Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ СПОСОБНОСТИ КЛЕТОК КОСТНОГО МОЗГА К ДЕЛЕНИЮ
Вид РИД
Изобретение
Изобретение относится к медицине, в частности клинической биохимии, цитологии, патоморфологии, и может быть использовано для определения способности клеток костного мозга (ККМ) к делению.
Известен способ определения колониеобразующей способности гемопоэтических стволовых клеток костного мозга для оценки их жизнеспособности, основанный на культивировании на различных полувязких и полутвердых питательных средах (метилцеллюлоза, коллаген, агар) с обязательным добавлением экзогенных ростовых факторов [С. Nissen-Druey, A. Tichelli, S. Meyer-Monard. Human Hematopoietic Colonies in Health and Disease. Acta Haemotologica (ISSN 0001-5792), V.113, №1, 2005]. Культуральные среды предназначены для поддержания оптимального режима жизнедеятельности изолированных клеток, фрагментов тканей и органов в искусственно создаваемых системах. Однако чаще всего используемые в качестве питательных сред агар и метилцеллюлоза влияют на пролиферацию и дифференцировку ККМ.
Известен модифицированный метод лимитирующих разведении (LDA) [Takaue Y., Reading C.L., Roome A.J., Dicke K.A., Tindle S., Chandran, M., Devaraj B. Limiting-Dilution Analysis of the Effects of Colony-Stimulating Factors, Phytohemagglutinin, and Hydrocortisone on Hematopoietic Progenitor Cell Growth. Blood, V.70, №5, 1987, P. 1611-1618], основанный на выращивании гемопоэтических клеток-предшественников в жидкой среде и позволяющий исключить влияние агара и метилцеллюлозы на колониеобразующую способность. Применение метода LDA позволило исследовать воздействие фитогемагглютенина, гидрокортизона и различных цитокинов на гемопоэтические клетки-предшественники.
Для изучения пролиферативной активности клеток используют метод с применением оксимочевины, которая подавляет синтез ДНК через действие на рибонуклеотидредуктазу. Клетки выделяют, отмывают и инкубируют с оксимочевиной, снова отмывают и переносят в питательную среду, инкубируют 7-9 дней (в контроле без оксимочевины) [Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. Томск, 1992, под ред. д.м.н. Новицкого, 272 с.].
Общими недостатками приведенных способов являются:
- влияние ростовой среды на деление и дифференцировку клеток;
- добавление экзогенных колониестимулирующих факторов маскирует эффект собственных ростовых факторов и не позволяет оценить спонтанную способность клеток к делению;
- методическая сложность и длительность (результаты получают через 7-14 дней).
Техническим результатом заявленного изобретения является определение спонтанной способности ККМ к делению, обусловленной эффектом собственных ростовых факторов, а также упрощение способа, сокращение времени получения результатов.
Указанный технический результат достигается в способе определения способности клеток костного мозга к делению, в котором клетки хранят в стандартном растворе стабилизатора при комнатной температуре, отбирают из суспензии первую исходную пробу и через 3-3,5 часа хранения суспензии отбирают вторую пробу, пробы обрабатывают флуоресцентным потенциалчувствительным витальным зондом иодид 2-(п-диметиламиностирил)-1-метилпиридиния (2-Di-1-ASP), измеряют интенсивность флуоресценции зонда в клетках, рассчитывают долю клеток с интенсивностью флуоресценции более 100 усл.ед. в каждой пробе, и при увеличении доли клеток с интенсивностью флуоресценции более 100 усл.ед. более чем в 1,5 раза во второй пробе по сравнению с первой, судят о способности клеток костного мозга к делению.
Популяция ККМ чрезвычайно гетерогенна и содержит большое количество форменных элементов крови и клеток-предшественников разной степени зрелости. [Воробьев А.И., Дризе Н.И., Чертков И.Л. Схема кроветворения. Пробл. Гематологии, 1995, т.1, №1, с.7-14]. Среди клеток-предшественников выделяют стволовые и прогениторные клетки, которые дают начало зрелым клеткам крови - колониеобразующие единицы (КОЭ). Стромальные клетки костного мозга вырабатывают фактор стволовых клеток (ФСК), который стимулирует пролиферацию и дифференцировку гемопоэтических клеток.
Ранее авторами было установлено, что флуоресцентный потенциалчувствительный витальный зонд катионного типа 2-Di-1-ASP проникает в живые ККМ и флуоресцирует в них, причем его флуоресценция чувствительна к изменению энергетического потенциала ККМ [RU №2488826, опубл. 27.07.2013, бюл. №21].
При разработке заявленного способа были исследованы образцы суспензии нативных ККМ в стандартном растворе стабилизатора 20 доноров, которые хранились при комнатной температуре (примерно 25°С). Исходно доля живых клеток в образцах составляла 80-92% (тест с трипановым синим [Phelan M.C. Basic techniques for mammalian cell tissue culture. Current Protocols in Cell Biology. 0:1.1.1-1.1.10. 1998]).
В качестве стандартного раствора стабилизатора был использован препарат фирмы «Terumo Corporation, Tokyo, Japan», содержащий в 100 мл:
|
Из образцов отбирали пробы клеток исходно (0 часов) и через 1 час, 2 часа, 3 часа, 5 часов, 24 часа, 48 часов, 72 часа хранения. Пробы инкубировали с 2-Di-1-ASP при 37°С, готовили препараты клеток, исследовали их на люминесцентном микроскопе и определяли среднюю интенсивность флуоресценции 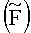 ККМ. В каждом препарате определяли флуоресценцию массива 80-100 клеток. Все исследованные клетки в каждом препарате разделяли на 4 группы по величине интенсивности флуоресценции: I - от 10 до 30 усл.ед.; II - от 30 до 70 усл.ед.; III - от 70 до 100 усл.ед.; IV - от 100 усл.ед. и рассчитывали долю клеток в каждой группе. Количество ядросодержащих клеток определяли по известному методу [Клиническая лабораторная аналитика, том 2. Частные аналитические технологии в клинической лаборатории. Под общей редакцией Меньшикова В.В., М., «Лабинформ», РАМЛД, 1999.], результаты выражали в процентах по отношению к количеству клеток в исходной пробе (NC=C/Cисх.×100).
ККМ. В каждом препарате определяли флуоресценцию массива 80-100 клеток. Все исследованные клетки в каждом препарате разделяли на 4 группы по величине интенсивности флуоресценции: I - от 10 до 30 усл.ед.; II - от 30 до 70 усл.ед.; III - от 70 до 100 усл.ед.; IV - от 100 усл.ед. и рассчитывали долю клеток в каждой группе. Количество ядросодержащих клеток определяли по известному методу [Клиническая лабораторная аналитика, том 2. Частные аналитические технологии в клинической лаборатории. Под общей редакцией Меньшикова В.В., М., «Лабинформ», РАМЛД, 1999.], результаты выражали в процентах по отношению к количеству клеток в исходной пробе (NC=C/Cисх.×100).
Статистическую обработку данных экспериментов проводили по t критерию Стьюдента [Бейли И.Н. Статистические методы в биологии. М., наука, 1963, 272 с.] и по коэффициенту корреляции рангов Спирмена [Гублер Е.В., Генкин А.А. Применение непараметрических критериев статистики в медико-биологических исследованиях. Л., Медицина, 1973, 142 с.].
В результате статистической обработки полученных данных было установлено, что через 3-3,5 часа хранения наблюдался рост  по сравнению с исходной, обусловленный увеличением доли клеток с интенсивностью флуоресценции более 100 усл.ед. (NF>100), причем степень этого нарастания коррелировала с увеличением NF>100. Через 5 часов хранения начиналось снижение
по сравнению с исходной, обусловленный увеличением доли клеток с интенсивностью флуоресценции более 100 усл.ед. (NF>100), причем степень этого нарастания коррелировала с увеличением NF>100. Через 5 часов хранения начиналось снижение  из-за отсутствия питательных веществ в среде хранения, что также коррелировало со снижением NF>100. Показано, что чем выше NF>100 через 3-3,5 часа хранения, тем больше прирост концентрации ядросодержащих клеток в суспензии, который начинался через 5 часов хранения, что свидетельствовало о способности клеток к делению. При возрастании NF>100 через 3-3,5 часа хранения ККМ менее чем в 1,5 раза по сравнению с исходной величиной, концентрация ядросодержащих клеток практически не изменялась, что свидетельствовало о неспособности клеток к делению в данных условиях.
из-за отсутствия питательных веществ в среде хранения, что также коррелировало со снижением NF>100. Показано, что чем выше NF>100 через 3-3,5 часа хранения, тем больше прирост концентрации ядросодержащих клеток в суспензии, который начинался через 5 часов хранения, что свидетельствовало о способности клеток к делению. При возрастании NF>100 через 3-3,5 часа хранения ККМ менее чем в 1,5 раза по сравнению с исходной величиной, концентрация ядросодержащих клеток практически не изменялась, что свидетельствовало о неспособности клеток к делению в данных условиях.
Способ может быть осуществлен, например, следующим образом.
Получение суспензии ККМ проводят по опубликованной методике [Фрегатова Л.М., Зубаровская Л.С., Эстрина М.А., Головачева А.А., Бабенко Е.В., Платонова Г.Г., Зуева Е.Е., Афанасьев Б.В. Методы получения стволовых клеток у больных и доноров для их последующей трансплантации. СПб, Изд. СПб ГМУ, кафедра гематологии, трансфузиологии, трансплантологии ФПО, 2004]. Полученные клетки помещают в стандартный раствор стабилизатора и хранят при комнатной температуре.
Суспензию клеток с концентрацией (~2-3)×107 объемом 0,9-1,0 мл хранят в пробирках типа Эппендорф емкостью 1,5 мл при комнатной температуре. Сразу после помещения клеток в пробирку суспензию перемешивают и отбирают из нее пробу объемом 30,0 мкл, помещают ее в пробирку типа Эппендорф емкостью 0,6 мл, добавляют раствор 2-Di-1-ASP в конечной концентрации 1·10-5-1·10-4 М и инкубируют в течение 45-90 мин при 37°С. После инкубации из суспензии окрашенных клеток берут каплю (3 мкл) суспензии, помещают на обезжиренное предметное стекло, накрывают покровным стеклом и исследуют препарат клеток на люминесцентном микроскопе Люмам-И2 (ЛОМО, Россия). Флуоресценцию зонда возбуждают ртутной лампой ДРШ-250-2 с длиной волны 405-436 нм. Для регистрации флуоресценции используют фотометрическую насадку ФМЭЛ-1 и интерференционный фильтр с максимумом пропускания 585 нм. Длина волны возбуждения 470 нм, интенсивность флуоресценции определяют при длине волны 560 нм. Регистрируют величину интенсивности флуоресценции каждой индивидуальной клетки. В каждом препарате определяют флуоресценцию массива 80-100 клеток, рассчитывают NF>100 в исходном образце (время хранения - 0 часов).
Через 3-3,5 часа хранения суспензии ККМ из пробирки емкостью 1,5 мл после перемешивания отбирают вторую пробу объемом 30,0 мкл, помещают ее в пробирку емкостью 0,6 мл, добавляют раствор 2-Di-1-ASP, инкубируют при 37°С и, после приготовления препарата окрашенных клеток, исследуют его на люминесцентном микроскопе, рассчитывают NF>100. При возрастании NF>100 через 3-3,5 часа хранения ККМ более чем в 1,5 раза по сравнению с исходной величиной судят о способности ККМ к делению.
Способ иллюстрируется следующими клиническими примерами.
Пример 1. Донор 1. ККМ хранили в среде стандартного стабилизатора при комнатной температуре. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-Di-1-ASP при 37°С, определяли  (средняя величина флуоресценции 80-100 индивидуальных клеток), рассчитывали NF>100. Для контроля способности к делению определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 1.
(средняя величина флуоресценции 80-100 индивидуальных клеток), рассчитывали NF>100. Для контроля способности к делению определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 1.
|
Полученные данные показывают, что в пробе, отобранной через 3 часа хранения, NF>100 возрастает по сравнению с исходной в 2,5 раза, что коррелирует с нарастанием  в 1,56 раза. Через 5 часов хранения при снижении доли клеток с F>100 наблюдается увеличение концентрации ядросодержащих клеток в 1,7 раза по сравнению с исходной, что свидетельствует об их интенсивном делении. Через 24 часа величина NF>100 практически возвращается к исходной, однако концентрация клеток продолжает нарастать (в 2 раза выше исходной). Через 72 часа NF>100 ниже исходного уровня, но концентрация клеток по-прежнему в 2 раза выше исходной.
в 1,56 раза. Через 5 часов хранения при снижении доли клеток с F>100 наблюдается увеличение концентрации ядросодержащих клеток в 1,7 раза по сравнению с исходной, что свидетельствует об их интенсивном делении. Через 24 часа величина NF>100 практически возвращается к исходной, однако концентрация клеток продолжает нарастать (в 2 раза выше исходной). Через 72 часа NF>100 ниже исходного уровня, но концентрация клеток по-прежнему в 2 раза выше исходной.
Таким образом, увеличение NF>100 через 3 часа хранения ККМ в 2,5 раза свидетельствует об их способности к делению.
Пример 2. Донор 2. ККМ хранили в среде стандартного стабилизатора при комнатной температуре. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-Di-1-ASP при 37°С, определяли  , рассчитывали NF>100, определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 2.
, рассчитывали NF>100, определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 2.
|
Из данных таблицы 2 видно, что через 3,5 часа хранения NF>100 возрастает по сравнению с исходной в 1,7 раза ( возрастает в 1,3 раза). Через 5 часов при снижении NF>100 наблюдается увеличение концентрации ядросодержащих клеток в 1,5 раза по сравнению с исходной, что свидетельствует об их делении. Через 24 часа NF>100 ниже исходной, но концентрация клеток продолжает нарастать (в 1,6 раза выше исходной). Далее, до 72 часов концентрация клеток сохраняется практически на одном уровне.
возрастает в 1,3 раза). Через 5 часов при снижении NF>100 наблюдается увеличение концентрации ядросодержащих клеток в 1,5 раза по сравнению с исходной, что свидетельствует об их делении. Через 24 часа NF>100 ниже исходной, но концентрация клеток продолжает нарастать (в 1,6 раза выше исходной). Далее, до 72 часов концентрация клеток сохраняется практически на одном уровне.
Из данного примера видно, что увеличение NF>100 через 3,5 часа хранения ККМ в 1,7 раза свидетельствует об их способности к делению.
Пример 3. Донор 3. ККМ хранили в среде стандартного стабилизатора при комнатной температуре. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-Di-1-ASP при 37°С, определяли  , рассчитывали NF>100 определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 3.
, рассчитывали NF>100 определяли количество ядросодержащих клеток. Результаты исследования представлены в таблице 3.
|
Из таблицы 3 видно, что через 3 часа хранения в данном препарате NF>100 возрастает в 1,2, а  - в 1,17 раза. Через 5 часов NF>100 снижена в 1,6 раза по сравнению с исходной, нарастания концентрации ядросодержащих клеток нет, что свидетельствует об отсутствии деления клеток. Через 24 часа NF>100 продолжает снижаться (в 3,5 раза по сравнению с исходной), общая концентрация клеток не изменяется. Через 72 часа в пробе отсутствуют клетки с интенсивностью флуоресценции более 100 усл.ед., деления клеток не происходит.
- в 1,17 раза. Через 5 часов NF>100 снижена в 1,6 раза по сравнению с исходной, нарастания концентрации ядросодержащих клеток нет, что свидетельствует об отсутствии деления клеток. Через 24 часа NF>100 продолжает снижаться (в 3,5 раза по сравнению с исходной), общая концентрация клеток не изменяется. Через 72 часа в пробе отсутствуют клетки с интенсивностью флуоресценции более 100 усл.ед., деления клеток не происходит.
Данный пример показывает, что отсутствие увеличения NF>100 через 3 часа хранения ККМ в 1,5 раза свидетельствует о неспособности клеток к делению.
Использование заявленного способа позволяет оценить спонтанную способность ККМ к делению, обусловленную эффектом собственных ростовых факторов, и исключает причины, влияющие на деление и дифференцировку клеток. Способ методически прост и позволяет получить результаты через 3-3,5 часа.
Способ определения способности клеток костного мозга к делению, отличающийся тем, что клетки хранят в стандартном растворе стабилизатора при комнатной температуре, отбирают из суспензии первую исходную пробу и через 3-3,5 часа хранения суспензии отбирают вторую пробу, пробы обрабатывают флуоресцентным потенциалчувствительным витальным зондом иодид 2-(п-диметиламиностирил)-1-метилпиридиния, измеряют интенсивность флуоресценции зонда в клетках, рассчитывают долю клеток с интенсивностью флуоресценции более 100 усл.ед. в каждой пробе, и при увеличении доли клеток с интенсивностью флуоресценции более 100 усл.ед. более чем в 1,5 раза во второй пробе по сравнению с первой, судят о способности клеток костного мозга к делению.
