Результат интеллектуальной деятельности: ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ
Вид РИД
Изобретение
Настоящее изобретение относится к медицине, а именно - к фотосенсибилизаторам (ФС) для фотодинамической терапии (ФДТ) злокачественных новообразований и ряда других патологических состояний.
Метод ФДТ основан на применении природных или синтетических ФС, которые обладают способностью к избирательному накоплению (тропностью) в опухолевой ткани. При облучении светом определенной длины волны ФС переходит в активированное состояние, которое инициирует образование цитотоксических агентов - синглетного кислорода и свободных радикалов, вызывающих разрушение структурных элементов опухолевой ткани.
Одними из наиболее эффективных ФС являются хлорины (дигидропорфирины), они характеризуются сильным возрастанием интенсивности длинноволновой полосы и ее смещением в красную область по сравнению с порфиринами. Среди них следует отметить водорастворимые моно-L-аспартилхлорин e6 и другие различные формы хлорина e6, в частности отечественные препараты «Фотодитазин», «Радахлорин» и белорусский препарат «Фотолон» (Чан Тхи Хай Иен, Г.В. Раменская, Н.А. Оборотова // Росс. Биотерапевт. Ж. 2009. Вып. 4. С.99-104), а также синтетические хлорины - 5,10,15,20-тетракис(м-гидроксифенил)хлорин (темопорфин, m-THPC, фоскан) и производные бензопорфирина (бензопорфирин монокислота, кольцо A) (Ali H., van Lier J.E. // Chem. Rev. 1999. Vol.99. P.2379-2450; Bonnett R. / Chemical Aspects of Photodynamic Therapy. 2000. Gordon and Breach Sci. Publ).
Моно-L-аспартилхлорин e6 (препарат NPe6, MACE, Nippon Petrochemical, Токио, Япония) поглощает при 664 нм с молярным коэффициентом поглощения около 25000 М-1 см-1, характеризуется отсутствием кожной токсичности.
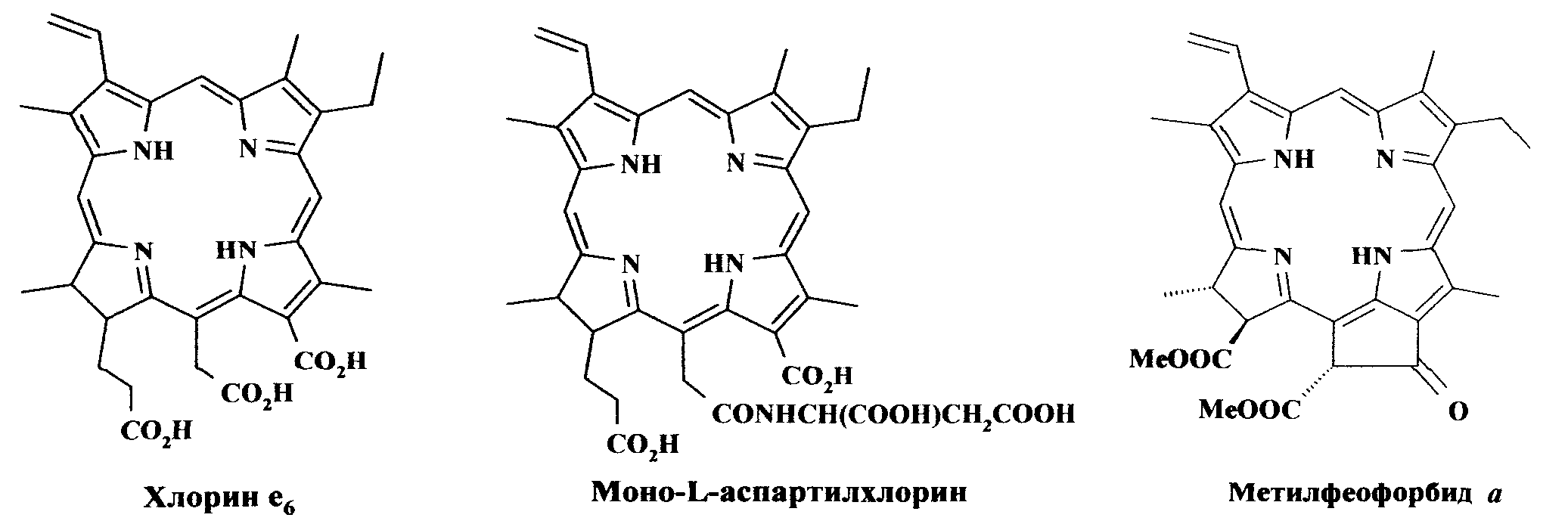
Преобладающее большинство фотосенсибилизаторов ряда хлорина относятся к анионному типу - их растворимость в воде достигается наличием в молекуле солеобразующих карбоксильных групп. Их недостатком является наличие в положении 13 молекулы, сопряженной с макрокольцом карбоксильной группы, которая может оказывать в анионном виде отрицательное влияние на их стабильность при хранении, понижая их окислительный потенциал.
Альтернативным способом придания растворимости в воде является введение в молекулу хлорина катионных заместителей, например остатков солей четвертичных аммониевых оснований. Положительно заряженные ФС представляют особенный интерес для антимикробной фотодинамической терапии (АФДТ) патогенных микроорганизмов.
Антимикробная ФДТ заключается в избирательной окислительной деструкции патогенных микроорганизмов при комбинированном воздействии ФС и оптического излучения соответствующего спектрального состава (Wainwright М. // J. Antimicrob. Chemother. 1998. Vol.42. P.13-28). Объектами антимикробной ФДТ являются вирусы, бактерии, грибы и простейшие микроорганизмы.
Среди микробных патогенов наиболее устойчивыми к фотодинамическим воздействиям являются грамотрицательные бактерии (Malik Z., Hanania J., Nitzan Y. // J. Photochem. Photobiol. B: Biol. 1990. Vol. 5. P.281-293), что связано с низкой проницаемостью их внешней мембраны для красителей.
Отрицательный заряд внешней поверхности жизнеспособных бактериальных клеток определяет активное связывание с ними и, соответственно, выраженную антибактериальную активность катионных красителей, например метиленового синего из класса фенотиазинов (Millson C.E., Wilson М., MacRobert A.J., Bown S.G. // J. Photochem. Photobiol. B: Biol. 1996. Vol. 2. 32. P.59-66).
|
Известно использование ФС «Фотосенс»® на основе сульфированного фталоцианина гидроксиалюминия для лечения инфицированных ран и трофических язв с устойчивой к антибиотикам микрофлорой (Stranadko Е.Р., Tolstykh М.Р., Riabov M.V., Krivikhin D.V. // IX World Congress of the International Photodynamic Association. Abstracts. Miyazaki. 2003. P.28). Однако анионный характер этого ФС является причиной его недостаточной эффективности по отношению к грамотрицательным бактериям.
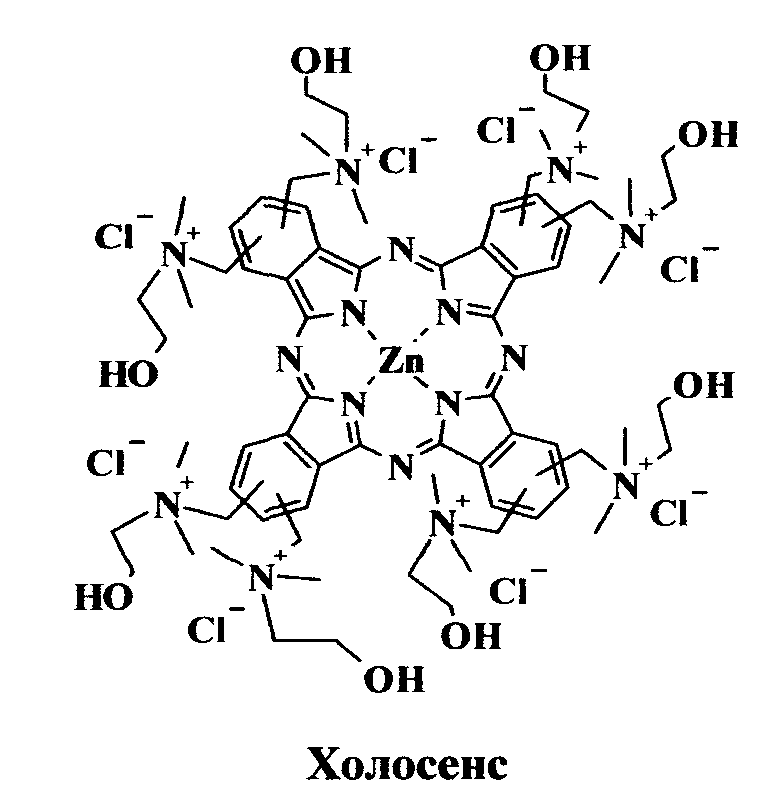
Известно также катионное производное фталоцианина - полихолиниозамещенный фталоцианин цинка (препарат «Холосенс»®), являющийся синтетическим ФС, который наряду с высокой фотоиндуцированной противоопухолевой активностью обладает выраженным противомикробным действием (Морозова Н.Б., Якубовская Р.И., Чиссов В.И. и др. // Российский онкологический журнал. 2012. Вып.1. С.23-28). Отмечается снижение множественности опытной бактериальной взвеси в 105 раз при использовании Холосенса в концентрации 2 мкг/мл и облучении светодиодным источником (685 нм). Холосенс может быть использован как для ФДТ и флуоресцентной диагностики злокачественных новообразований, так и для антимикробной ФДТ.
Однако перечисленные выше ФС, в том числе Холосенс, обладают недостаточно высокой эффективностью лечения при использовании как для ФДТ и флуоресцентной диагностики злокачественных новообразований, так и для антимикробной ФДТ. Так, величины торможения роста опухоли при их использовании и излеченность животных не достигают 100%-ных значений.
Задачей настоящего изобретения является поиск новых ФС на базе амидопроизводных хлорина ее, превосходящих по своей эффективности перечисленные выше ФС как для ФДТ и флуоресцентной диагностики, так и для антимикробной ФДТ.
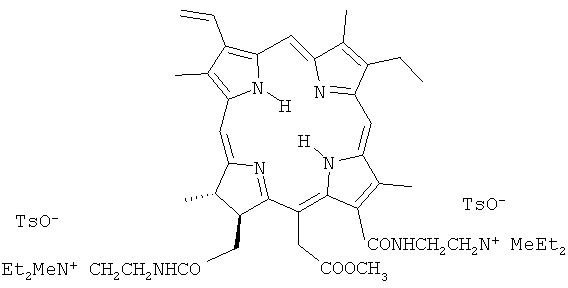
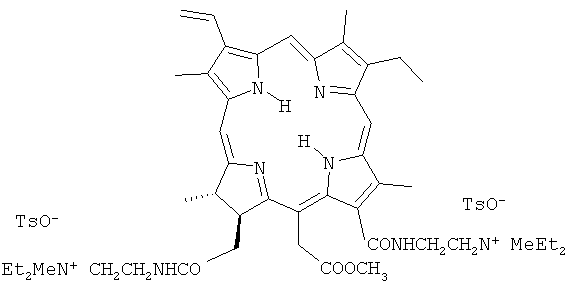
Для решения этой задачи предложено применять новое катионное кватернизованное производное хлорина e6, а именно метиловый эфир 13,17-бис(N-метил-N,N-диэтиламмониоэтиламид) хлорина e6 дитозилат (II).
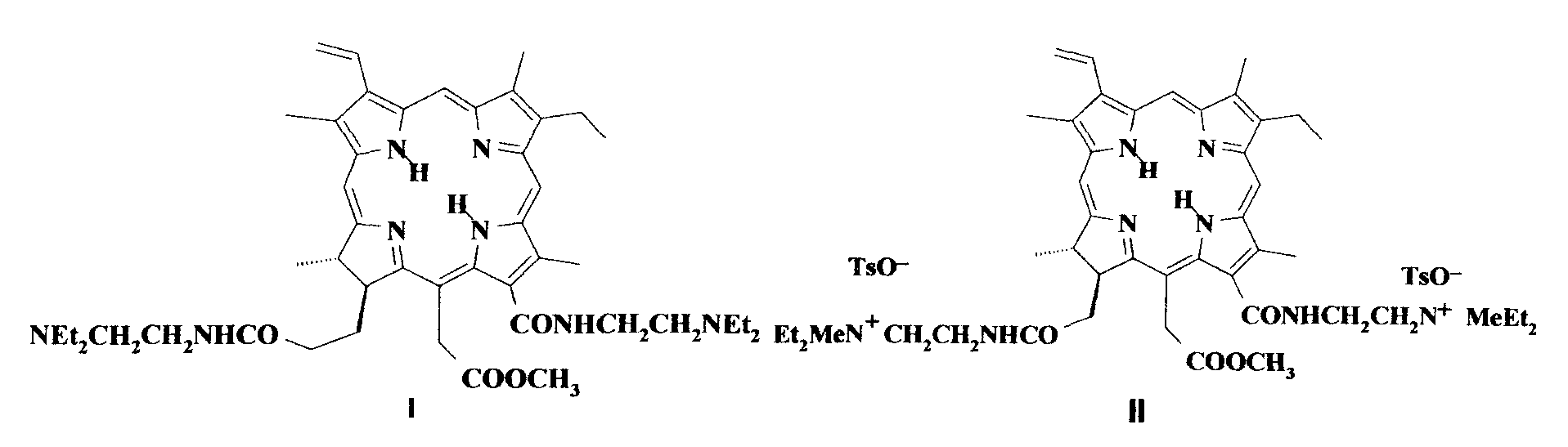
При нагревании метилфеофорбида с большим избытком N,N-диэтилэтилендиамина в течение 12-15 часов при 40 до 45°С образуется диамидное производное - метиловый эфир 13,17-бис(N,N-диэтиламиноэтиламид) хлорина e6 (I). Реакцией кватернизации диамида метиловым эфиром п-толуолсульфокислоты в ацетонитриле при комнатной температуре получена водорастворимая четвертичная соль - метиловый эфир 13,17-бис-(N-метил-N,N-диэтиламмониоэтиламид) хлорина e6 дитозилат (II).
Предлагаемое изобретение иллюстрируется следующими рисунками:
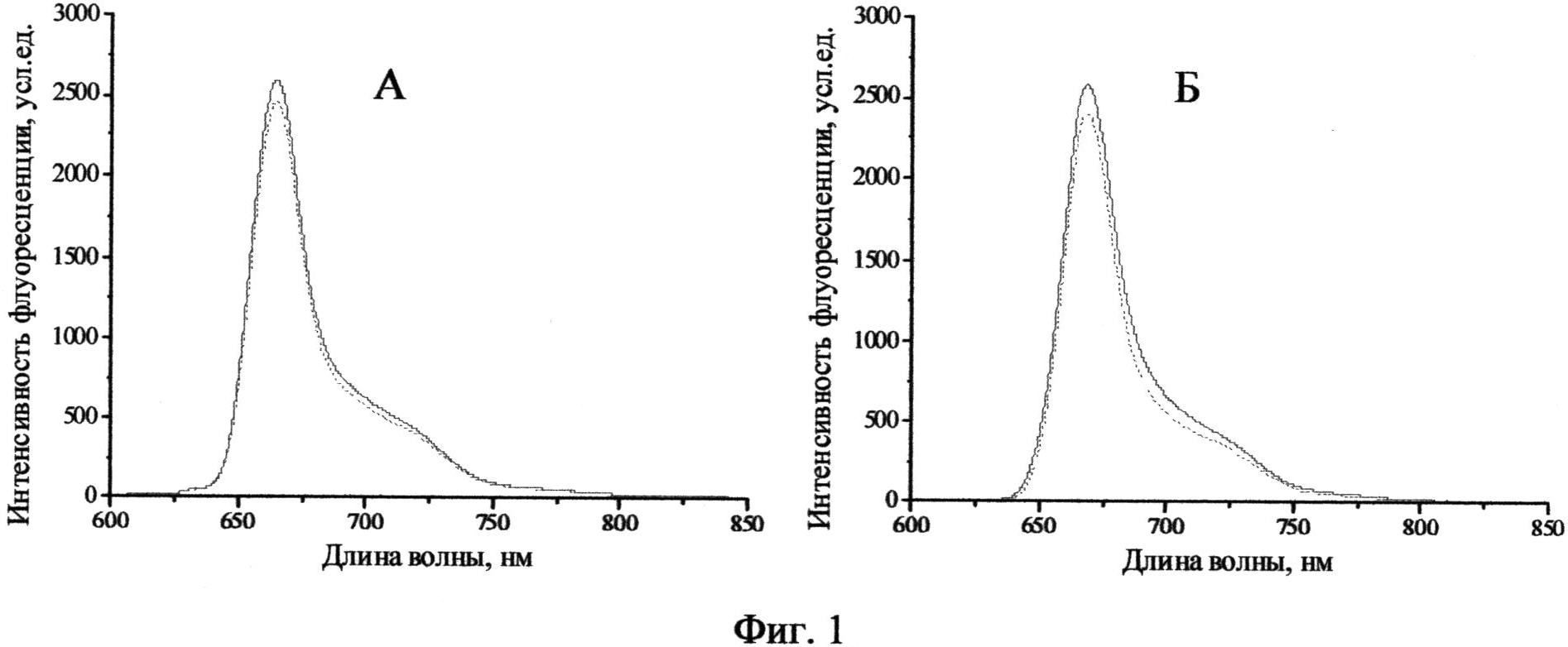
Фиг.1 - Спектр флуоресценции ФС в физрастворе (А) и в среде Игла MEM, содержащей 10% ЭТС (Б): сплошная линия - ex tempore, пунктирная линия - через 24 часа.
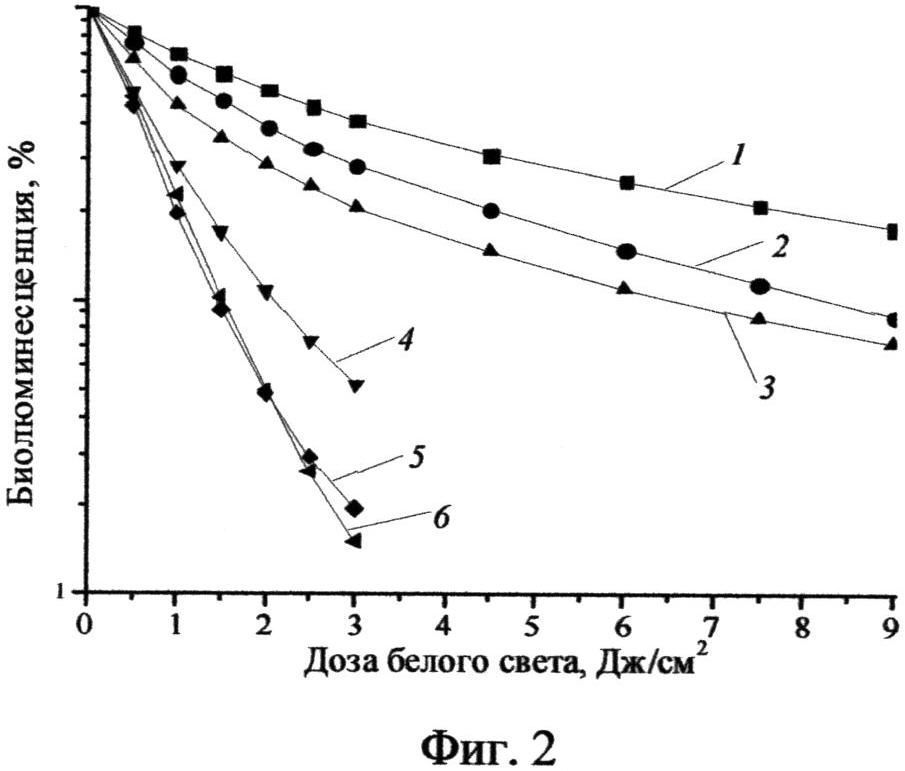
Фиг.2 - Дозовые зависимости инактивации бактерий Е.Coli K12 TG1 по тесту тушения биолюминесценции (1 - 0,2 мкМ, 2 - 0,5 мкМ, 3 - 1 мкМ, 4 - 2 мкМ, 5 - 5 мкМ, 6 - 10 мкМ).
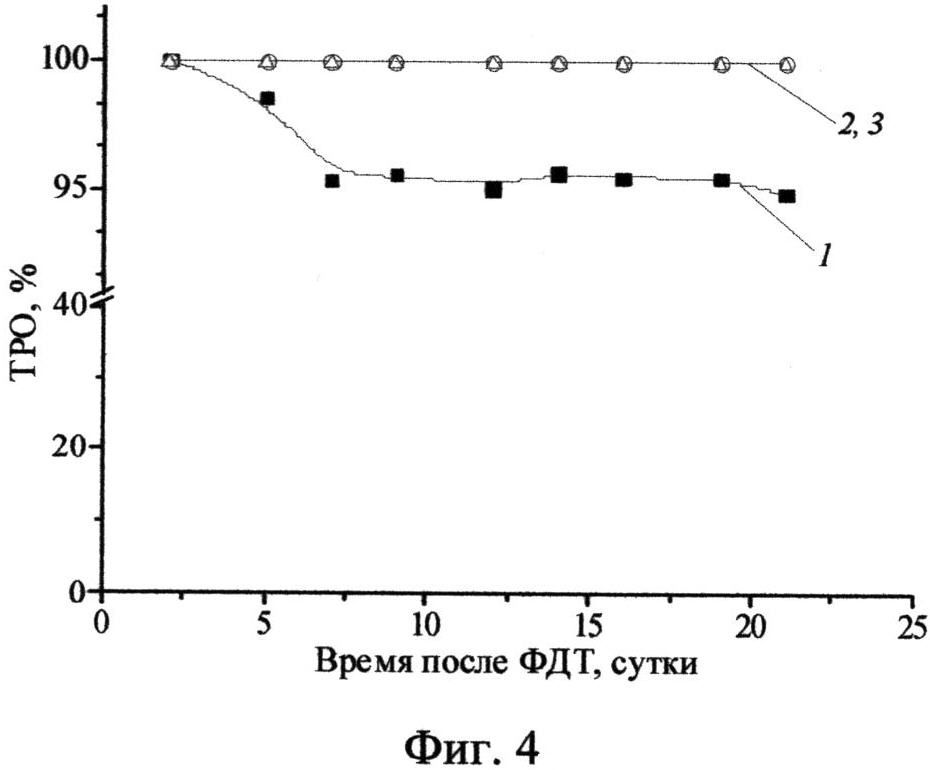
Фиг.3 - Зависимость ЛД90 от концентрации ФС: 1 - в дистиллированной воде, 2 - в физрастворе.
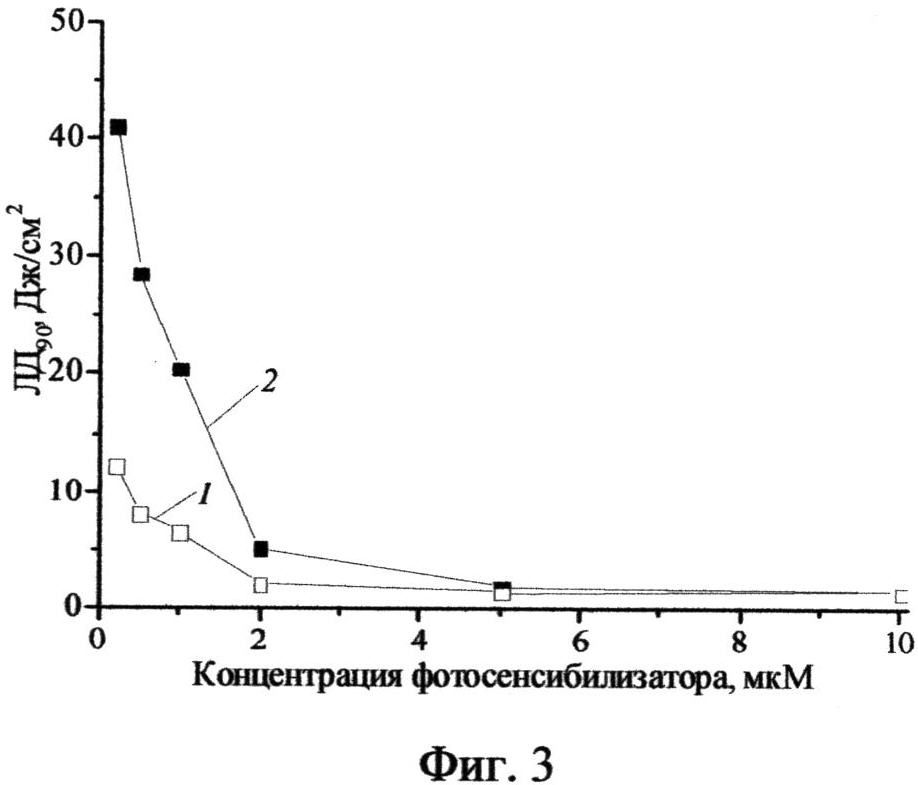
Фиг.4 - Фотоиндуцированная противоопухолевая активность ФС у мышей с саркомой S37: 1 - 1 мг/кг, 2 - 2,5 мг/кг, 3 - 5,0 мг/кг).
Предлагаемое изобретение также иллюстрируется нижеследующими примерами, но не ограничивается ими.
Пример 1. Получение 15-метилового эфира 13,17-бис(N,N-диэтиламиноэтиламида) хлорина e6 (I). Раствор 0.560 г метилфеофорбида а в 4,2 мл N,N-диэтилэтилендиамина нагревали (без доступа света) при температуре 32-37°С в течение 20 час. Раствор выливали в 400 мл гексана, выпавший осадок отфильтровывали и сушили на фильтре, затем подвергали хроматографической очистке на силикагеле. После элюирования примесей хлороформом и смесью хлороформ - метанол в объемных соотношениях 30:1, используя в качестве элюента смесь хлороформ - метанол - триэтиламин в объемных соотношениях 10:1:0.15, вымывали диамидное производное, растворитель отгоняли досуха в вакууме, остаток промывали гексаном, сушили в вакууме при комнатной температуре. Выход чистого продукта 0,52 г (69,3%). Полученное соединение растворимо в хлороформе, ароматических углеводородах, ацетоне, спирте, нерастворимо в воде. ИК-спектр обнаруживает интенсивную амидную полосу при 1651,3 см-1 и менее интенсивную полосу при 1734,2 см-1, принадлежащую эфирной группе. МАЛДИ масс-спектр, m/z 807,522 [М], вычислено М 807.11. Электронный спектр поглощения (хлороформ), λmax., нм (lg ε): 291 (3,94), 404 (5,17), 502 (4,13), 529 (3,57), 608 (3,66), 664 (4,66); 290 (3,98), 403 (5,11), 501 (4,07), 531 (3,62), 609 (3,63), 663 (4,60).
Получение метилового эфира 13,17-бис(N-метил-N,N-диэтиламмониоэтиламид) хлорина e6 дитозилата (II). Смесь 0.078 г соединения (I) и 0,20 г метилового эфира п-толуолсульфокислоты в 2,5 мл ацетонитрила выдерживали в темноте при комнатной температуре в течение трех суток, после чего растворитель отогнали в вакууме, остаток промывали серным эфиром и высушили в вакууме. Получено 0,106 г (выход около 93%) четвертичной соли (II). Соединение гигроскопично, легко растворимо в воде, растворимо в водном этаноле, в органических растворителях (бензол, хлороформ, ацетон, ДМСО). Электронный спектр поглощения, λmax., нм (lg ε) (вода): 286 (3,94), 401 (5,24), 500 (4,04), 529 (3,00), 608 (3,49), 658 (4,60). Найдено, %: С 63,20; Н 7,64, 7,59; N 8,91, 8,62; S 5,27; 5,03. C63H86N8O10S2. Вычислено, %: С 64,20; Н 7,28; N 9,51; S 5,44.
Пример 2. Стабильность ФС в динамике.
Оценку стабильности ФС проводили с помощью абсорбционного и флуоресцентного методов анализа. Хлорин II легко растворим в физрастворе (0,9% растворе NaCl) до концентрации 1 мг/мл. Растворы для проведения исследований готовили ex tempore, достигая выбранной концентрации путем последовательных разведений исходного раствора. Спектры поглощения регистрировали на спектрофотометре «Genesys 2» (США) в диапазоне длин волн от 600 до 900 нм. Регистрацию флуоресценции растворов проводили в динамике контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей «ЛЭСА-6» (ТОО «БиоСпек», Россия). Флуоресценцию возбуждали He-Ne лазером с длиной волны генерации 632,8 нм, спектральный диапазон измерения от 600 до 900 нм.
Раствор хлорина II стабилен в течение суток инкубации в физрастворе и в среде Игла MEM с содержанием 10% эмбриональной телячьей сыворотки (ЭТС) в концентрации 5 мкМ в темновых условиях. В выбранном временном диапазоне не выявлено ни сдвигов Q-полосы, ни уменьшения оптической плотности и интенсивности флуоресценции, сохранялась симметрия основной полосы (Фиг.1, Таблица 1).
|
Пример 3. Фотоиндуцированная активность хлорина (II) в отношении клеток культуры НЕр2.
Исследования проводили на опухолевых клетках человека - эпидермоидной карциноме гортаноглотки (НЕр2), полученных из Института вирусологии им. Д.И. Ивановского РАМН, которые культивировались при 37°С в увлажненной атмосфере, содержащей 5% СО2.
Клетки рассевали в лунки плоскодонного 96-луночного микропланшета в концентрации 65 тыс. кл./мл. Тестируемый краситель вносили в лунки через 24 часа после посева, варьируя концентрацию от 0,12 до 10 мкМ. Для оценки фототоксичности через 0,5, 2 и 6 часов инкубации с ФС клетки облучали галогеновой лампой через широкополосный фильтр КС-10 (λ≥640 нм). Плотность мощности составляла 36,0±1,0 мВт/см2, расчетная световая доза - 10 Дж/см2. После облучения клетки инкубировали в течение суток в стандартных условиях. Оценку выживаемости определяли визуально и колориметрическим методом с использованием МТТ-теста. Биологически значимым эффектом считали ингибирование роста клеток в культуре более чем на 50% (средняя величина по результатам трех независимых тестов).
Выявлено, что ФС проявил максимальную фотоиндуцированную активность относительно клеток культур НЕр2 при 2-часовой инкубации, ИК50 составляла 0,45±0,04 мкМ, с увеличением времени инкубации до 6 часов величина ИК50 практически не изменялась и составляла 0,52±0,05 мкМ.
Таким образом, результаты, полученные in vitro, показали, что хлорин II обладает высокой фотоиндуцированной активностью в отношении клеток культуры НЕр2.
Пример 4. Фотобактерицидную активность in vitro определяют на генно-инженерном биолюминесцентном штамме грам-отрицательных бактерий Е. coli K12 TG1. К суспензии бактерий (3×107 КОЕ/мл) в дистиллированной воде добавляют ФС в концентрации 0,2-10 мкМ, инкубируют 10 мин в отсутствие освещения и облучают белым светом источника ЭКОМП (50 мВт/см, доза света 1-9 Дж/см2). Оценку результатов инактивации колониеобразующих единиц (КОЕ) бактерий проводят по тесту тушению биолюминесценции. На Фиг.2 приведены дозовые зависимости инактивации бактерий Е. coli K12 TG1 по тесту тушению биолюминесценции. При концентрации ФС 5 мкМ и дозе белого света 3 Дж/см2 происходит уменьшение КОЕ в 50 раз.
Пример 5. Определение ЛД90 проводят по дозовым зависимостям инактивации бактериального биосенсора в физрастворе или дистиллированной воде для концентраций хлорина 0,2-10 мкМ. На Фиг.3 приведена зависимость ЛД90 от концентрации хлорина II в дистиллированной воде (1) и в физрастворе (2). Для каждой концентрации ФС определяют дозу белого света, вызывающую инактивацию колониеобразующих единиц (КОЕ) бактерий на 90%.
Проведено сравнение ЛД90 для хлоринового и фталоцианинового ФС (Холосенс, октакатионный октакис-холинилфталоцианин цинка) в дистиллированной воде и в физрастворе. В дистиллированной воде Холосенс в 2 раза более активен в фотодинамической инактивации бактерий (для концентрации 2 мкМ ЛД90 составляет 1 и 2 Дж/см2, соответственно). Однако в физрастворе активность Холосенса уменьшается в большей степени, чем у хлорина (II) - в физрастворе для концентрации 2 мкМ ЛД90 составляет 6 и 5 Дж/см2, соответственно. Это объясняется различным механизмом связывания в физрастворе с бактериальными клетками, что демонстрируется следующим примером.
Пример 6. Определение дзета потенциала клеток грам-отрицательных бактерий E. coli K12 TG1.
Измеряют поверхностный (дзета) потенциал бактериальных клеток в дистиллированной воде и в физрастворе с добавлением ФС или без него. Результаты представлены в таблице 2. Фотодинамическая активность Холосенса проявляется только в условиях электростатического связывания с бактериальными клетками, что следует из нейтрализации их дзета потенциала в присутствии ФС, и сильно зависит от этого параметра. Уменьшение дзета потенциала в физрастворе приводит к снижению способности Холосенса связываться с клетками бактерий и к уменьшению его фотодинамической активности (увеличению ЛД90). Действие дикатионного хлорина (II) в меньшей степени обусловлено нейтрализацией дзета потенциала клеток бактерий. Сдвиг дзета потенциала в физрастворе не вызывает столь резкого уменьшения фотодинамической активности этого ФС.
|
Пример 7. Распределение хлорина (II) в опухоли S37 и флуоресцентная контрастность относительно окружающей ткани.
Оценку распределения ФС в опухолевой и окружающих тканях проводили у мышей с саркомой S37 в интервале от 5 секунд до 48 часов методом локальной флуоресцентной спектроскопии (ЛФС). ФС вводили внутривенно в дозе 5,0 мг/кг. Флуоресценцию регистрировали контактным способом на лазерном спектральном анализаторе «ЛЭСА-06».
В опухолевой ткани нормированная флуоресценция ФС регистрировалась на максимальном уровне через 1-2 часа после введения и составляла 8,5±0,9 - 9,7±2,4 усл. ед., а затем к 48 часам снижалась на 45% от максимального значения. Наиболее высокий уровень нормированной флуоресценции в коже (4,8±1,4 усл. ед.) наблюдался через 2 часа после введения хлорина (II), в мышце (12,0±0,7 усл. ед.) - через 30 минут. Максимальная флуоресцентная контрастность относительно окружающих нормальных тканей кожи регистрировалась через 1 час после введения и составляла 2,8±0,4 усл. ед., а относительно мышцы - через 48 часов после введения и составляла 1,8±0,3 усл. ед.
Пример 8. Фотоиндуцированная противоопухолевая активность хлорина (II) у животных с саркомой S37.
Изучение фотоиндуцированной противоопухолевой активности проводили у животных с саркомой S37, привитой подкожно с внешней стороны правого бедра мышам-гибридам F1, в зависимости от дозы ФС на 7 сутки после инокуляции опухоли.
В опытных группах ФС животным вводили однократно внутривенно в хвостовую вену в дозах 1,0, 2,5 и 5,0 мг/кг, соответственно. Облучение проводили через 1 час после введения ФС. Для облучения использовали светодиодный источник (ФГУП «ГНЦ РФ НИОПИК») с длиной волны 662±14 нм и плотностью мощности 100 мВт/см2 (плотность энергии 90 Дж/см2). Контрольная группа животных - без воздействия.
Эффективность ФДТ оценивали, используя общепринятые в экспериментальной онкологии критерии:
- торможение роста опухоли ТРО=[(Vк-Vоп)/Vк]·100%, где Vоп и Vк - объем опухоли в опытной и контрольной группах, соответственно;
- критерий излеченности КИ=[Nи/No]·100%, где Nи и No - количество излеченных животных и общее количество животных в опытной группе, соответственно.
Объем опухоли рассчитывали по формуле: V=d1·d2·d3, где d1, d2 и d3 - три взаимно перпендикулярных диаметра опухоли.
Измерение объема опухоли проводили в течение 21 суток после проведенного облучения с помощью электронного цифрового кронциркуля STORMtm 3C301 «Central». За животными наблюдали 50 суток.
В опытных группах в течение суток после облучения у животных образовывался интенсивный отек в зоне воздействия, который сохранялся до 5-10 суток. При использовании хлорина (II) в дозе 1,0 мг/кг ТРО составило 94,9 - 100%, КИ - 75%. Для доз 2,5 и 5,0 мг/кг выявлена еще более высокая эффективность: 100% ТРО в течение всего срока наблюдения, 100% излеченность животных в течение 50 суток наблюдения (Фиг.4).
Пример 9. Фармакокинетика хлорина (II).
Фармакокинетику изучали методом ЛФС в органах и тканях интактных мышей в дозе 5,0 мг/кг. Максимум спектра флуоресценции хлорина (II) в тканях животных регистрировали при 669±2 нм. Флуоресцирующая форма его быстро (в течение 5-30 минут) поступала во внутренние органы и ткани организма, преимущественно в печень, почки и селезенку, затем снижалась с различной скоростью. Максимальная флуоресценция хлорина (II) в крови определялась сразу после внутривенного введения и в течение 24-х часов снижалась на 94% от максимального значения и через 7 суток уже не регистрировалась.
Во внутренних органах через 24 часа уровень нормированной флуоресценции снижался в печени на 33%, почках - на 45%, селезенке - на 47% от максимального значения. Флуоресцирующая форма хлорина (II) определялась во внутренних органах более 7 суток. Остаточное количество ФС на этот срок составляло в печени 47%, в почках 20% и селезенке 25% от максимального значения.
В коже максимальное значение флуоресценции регистрировалось через 2 часа после введения красителя, затем его нормированная флуоресценция снижалась и через 24 часа составляла 73% от максимального значения, а через 7 суток - 25%. Это свидетельствует о медленном элиминировании хлорина (II) из кожи. В мышце через 24 часа уровень нормированной флуоресценции также снижался на 81%, в жировой ткани - на 29%. Остаточное количество хлорина (II) в мышце (8%) и жировой ткани (24%) регистрировалось более 7 суток.
Полученные данные свидетельствуют о более медленной циркуляции хлорина (II) в организме млекопитающих по сравнению с хлоринами природного происхождения и его выведении преимущественно через печень с желчью и почки с мочой.
Таким образом, предложенный ФС достаточно стабилен в растворах в темновых условиях и при световом воздействии, обладает высокой фотобактерицидной активностью in vitro, высокой фотодинамической эффективностью, однако более медленной циркуляцией в организме млекопитающих по сравнению с хлоринами природного происхождения. Эта особенность предложенного ФС может представлять и клинический интерес для многокурсовой терапии с использованием одной дозы ФС, повышающей эффективность и надежность лечения.
Метиловый эфир 13,17-бис-(N-метил-N,N-диэтиламмониоэтиламид) хлорина e дитозилат как фотосенсибилизатор для фотодинамической терапии.