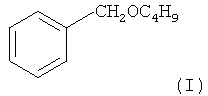
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БЕНЗИЛБУТИЛОВОГО ЭФИРА
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, в частности к способу получения бензилбутилового эфира.
Бензилалкиловые эфиры, обладающие приятным запахом, являются ценными душистыми веществами и используются в парфюмерной, косметической и пищевой промышленности ([1] Войткевич С.А. 865 Душистых веществ для парфюмерии и бытовой химии.- М.: Пищевая промышленность, 1994, 594).
Так, бензилбутиловый эфир обладает фруктовым запахом и разрешен во многих странах для применения в качестве ароматизатора пищевых продуктов (мороженого, льда, напитков, десертов, печеностей и т.д.).
Один из важных методов синтеза бензилбутилового эфира основан на реакции н-бутанола с бензилхлоридом (или бензилбромидом) в присутствии органических и неорганических оснований.
Бензиловые эфиры можно получить реакцией н-бутилата натрия с бензилбромидом в присутствии иодида тетрабутиламмония ([2] М.Ochiai, Т.Ito, Н.Takahashi, A.Nakanishi, М.Toyonari, Т.Sueda, S.Goto, М.Shiro // J. Am. Chem. Soc, 1996, 118(33), 7716).

Данный метод синтеза бензиловых эфиров имеет лишь препаративное значение, т.к. бутилат натрия, необходимый для синтеза эфиров, получают растворением металлического натрия в н-бутаноле.
В работе ([3] Н.Normant, Т.Cuvigny // Bull. Soc. Chim. France, 1965, 6, 1865) бензилбутиловый эфир получили по следующей методике: смесь 0.1 моль гидрида натрия NaH в гексаметаноле и 0.1 моль н-бутанола Н-С4Н9ОН выдерживают 2 часа при комнатной температуре. В результате образуется н-бутилат натрия н-С4H9ONa и выделяется водород. К раствору н-С4H9ONa в гексаметаноле добавляют 0.1 моль бензилхлорида и нагревают при 70-80°С в течение 5 часов. Выход бензилбутилового эфира по данному методу составляет 89%. В ТГФ выход эфира ниже в 3 раза (30%).
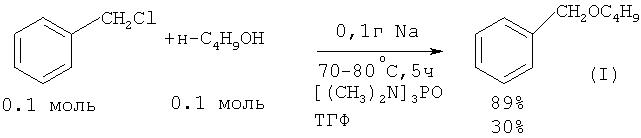
В работе ([4] Н.Normant, Т.Cuvigny, J.Normant, В.Angelo // Bull. Soc. Chim. France, 1965, 12, 3446) выход бензилбутилового эфира при 70°С за 4 ч составил 77%.
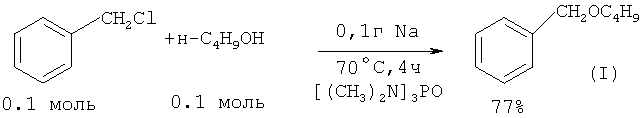
Недостатки методов:
1. Применение пожаро- и взрывоопасного натрия и гидрида натрия.
2. Использование в качестве исходных соединений лакриматора - бензилхлорида, получаемого хлорированием толуола, что осложняет работу.
В работе ([5] G.A.Sereda // Tetrahedron Lett., 2004, 45(39), 7265-7267) бензилбутиловый эфир получают из бензилхлорида и н-бутилового спирта в присутствии графита. Выход бензилбутилового эфира по этому методу очень низкий и составляет всего 27%.

Бензилбутиловый эфир с выходом 90% был получен из бутанола-1 и бензилбромида в присутствии основания - гидрида натрия, взятого в стехиометрическом количестве ([6] B.S.Bal, K.S.Kochhar, H.W.Pinnick // J. Org. Chem., 1981,46(7), 1492).
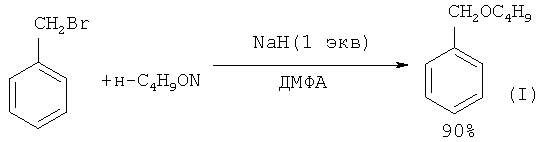
Важным методом синтеза бензилбутилового эфира является метод межфазного катализа, который предусматривает использование в качестве исходных соединений бензилхлорида (бензилбромида) и н-бутанола или бензилового спирта и н-бутилхлорида (н-бутилбромида).
Так, бензилбутиловый эфир получают из бензилхлорида (избыток) и 1-бутанола под действием 50% гидроксида натрия NaOH в присутствии межфазного катализатора n-Bu4NHSO4 ([7] Н.Н Freedman, R.A.Dubois. // Tetrahedron Lett., 1975, 38, 3251).
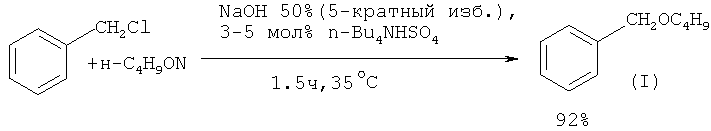
Представляет интерес способ получения бензилбутилового эфира в условиях трехфазного катализа. Необходимая для проведения реакции трехфазная система состоит из гидроксида калия (твердая фаза) (1.76×104 моль-КОН/м3-Н2O), додекана (неполярная фаза) и органического растворителя. Межфазный катализатор состоит из полиэтиленгликоля и тетрагексиламмонийбромида (ПЭГ + (Hex)4NBr). Указанная система отличается большей эффективностью для синтеза бензилбутилового эфира, чем двухфазная, так как позволяет получить бензилбутиловый эфир с 90% выходом ([8] G. Jin, Т. Ido, S. Goto // Catal. Today, 2001, 64(3-4), 279).

Синергетический эффект при синтезе бензилбутилового эфира наблюдался в условиях жидкого трехфазного катализа при использовании в качестве катализатора тетрабутиламмонийбромида (Bu)4NBr и ПЭГ ([9] G. Jin, С. Zhaang, Т. Ido, S. Goto // Catal. Lett., 2004, 98(2-3), 107).
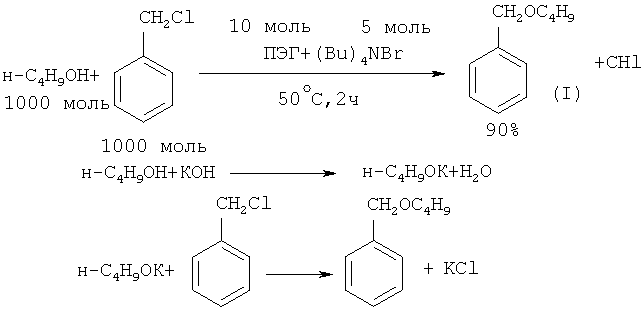
Недостатки методов:
1. Использование в качестве исходных соединений лакриматоров: бензилхлорида, получаемого хлорированием толуола, или бензилбромида, синтезируемого бромированием толуола жидким бромом, что осложняет работу.
2. Использование избытка агрессивных оснований: гидроксида калия или гидроксида натрия.
3. Образование большого количества сточных вод, содержащих КОН и КСl, NaOH и NaCl.
4. Значительные трудности при выделении целевого эфира из-за образования большого количества побочных продуктов.
5. Применение пожаро- и взрывоопасного гидрида натрия.
Разновидностью межфазного катализа является синтез бензиловых эфиров из спиртов и бензилхлорида в присутствии третичных аминов в сочетании с KI. Так, бензилбутиловый эфир был получен реакцией бензилхлорида с 1-бутанолом в присутствии KI и трибутиламина при 65°С. При этом трибутиламин выполняет две функции: реагирует с бензилхлоридом, давая трибутилбензиламмонийхлорид (межфазный катализатор) и служит акцептором НСl, который выделяется в ходе реакции ([10] D.-H. Hwu, С.Hwang, Y.-P. Shih, M.-Y. Yeh, C.-L. Chao. // Ind. Eng. Chem. Res., 1992, 31(1), 177).
В другом известном методе синтеза бензилбутилового эфира в качестве исходных соединений используются бензиловый спирт и н-бутилхлорид(бромид).
В работе ([11] J. Barluenga, L. Alonso-Cires, P.J. Campos, G. Asensio // Synthesis, 1983, 1, 53] синтез эфиров из бензилового спирта и алкилбромида проводят под действием бромфтористоводородной кислоты HBF4 в присутствии оксида ртути (II)
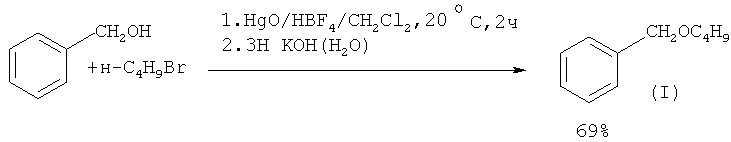
Недостатки метода:
1. Использование в качестве катализатора дорогостоящего и труднодоступного соединения - бромфтористоводородной кислоты (HBF4).
2. Использование в качестве вспомогательного реагента высокотоксичного оксида ртути.
Синтез бензилбутилового эфира может быть осуществлен в условиях межфазного катализа с использованием в качестве катализатора полимерной четвертичной аммонийной соли. Указанную соль получают обработкой хлорметилированного полимера с третичными аминами в течение 70 ч при 70°С в толуоле. Синтез бензилбутилового эфира проводили по следующей методике: 16.6 мг катализатора и 2 мл 50% КОН нагревают на водяной бане (40°С) в реакционной трубке с тефлоновой закручивающейся крышкой, затем в трубку дозируют предварительно нагретую смесь, содержащую бензиловый спирт, н-бутилбромид. Трубку герметично закрывают, реакционную смесь перемешивают на магнитной мешалке в течение 3-4 ч. Выход эфира (I) 80% ([12] Н. Takeuchi, Y. Miwa, S. Morita, J. Okada. // Chem. Pharm. Bull, 1985, 33(8), 3101).
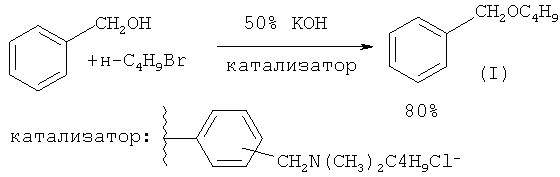
В работе ([13] G. Не, L. Guo, F. Li, Н. Zeng // Huaxue Yanjiu Yu Yingyong, 2009, 21(1), 135) китайских химиков показано, что синтез бензилбутилового эфира (I) можно осуществить в условиях межфазного катализа без использования органического растворителя. В начале реакции органическая фаза состоит из исходных реагентов: бензилового спирта и н-бутилбромида. Выход эфира (I) составляет 65%.
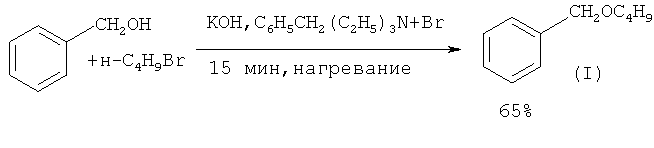
Недостатки методов:
1. Использование избытка гидроксида калия в виде 40% раствора.
2. Образование сточных вод, содержащих КОН и KBr.
3. Умеренный выход бензилбутилового эфира (65%).
В качестве межфазных катализаторов при получении (I) можно использовать полиоксетановые смолы с четвертичными аммонийными солями. ([14] М. Motoi, К. Shimamura, С.Shimamura, S. Muramoto, S. Kanoh, H. Suda. // Bull. Chem. Soc. Jpn., 1989, 62(8), 2553).
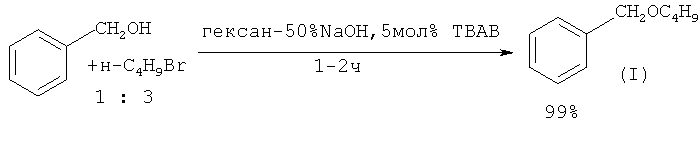
Недостатки метода:
1. Труднодоступность полимерного межфазного катализатора.
2. Использование NaOH в избытке (40% раствор)
3. Образование сточных вод, содержащих гидроксид натрия NaOH и бромид натрия NaBr.
Эффективным средством увеличения скорости реакции синтеза бензилбутилового эфира из бензилового спирта и н-бутилбромида в условиях межфазного катализа является микроволновое излучение. Так, реакция 4 ммолей бензилового спирта с 8 ммолями н-бутилбромида и н-бутилхлорида при действии микроволного излучения завершается за 10 мин с выходом бензилбутилового эфира 92 и 52% соответственно ([15] Y. Yuan, Y. Jiang, J. Pang, X. Zhang, С.Yang. // Gazzetta Chimica Italiana, 1993, 123(9), 519).
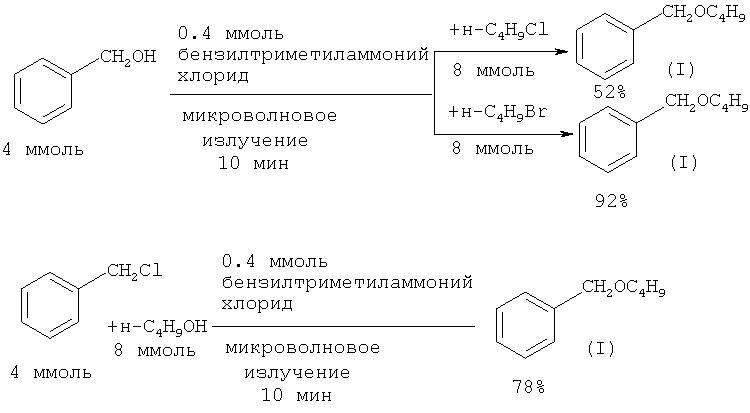
Недостатки методов:
1. Использование микроволнового излучения.
2. Использование в качестве исходных соединений лакриматоров: бензилхлорида, получаемого хлорированием толуола, или бензилбромида, синтезируемого бромированием толуола жидким бромом, что осложняет работу.
Как известно, классическим методом получения простых эфиров является метод межмолекулярной дегидратации из спиртов в присутствии катализаторов.
Этот метод использован в работе ([16] Н. Firouzabadi, N. Iranpoor, A.A. Jafari // J. Mol. Catal. A: Chem., 2005, 227(1-2), 97) для осуществления синтеза бензилбутилового и ряда симметричных и несимметричных простых эфиров из соответствующих спиртов под действием катализатора сложного состава AlPW12O40.
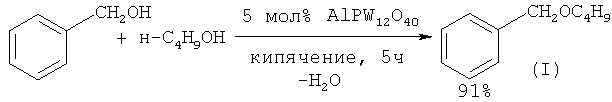
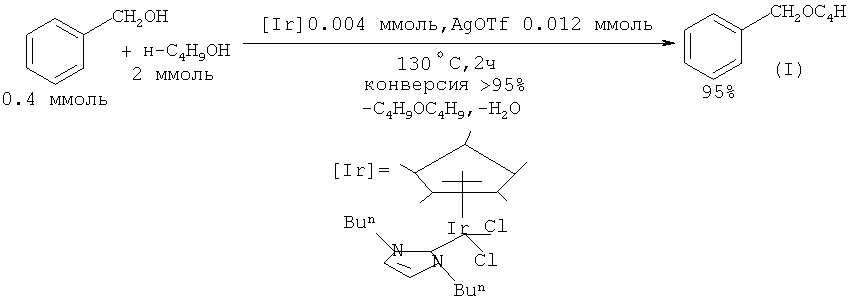
В работе ([17] A. Prades; R. Corberan; М. Poyatos; Е. Peris. // Chem. Eur. J. 2008, 14(36), 11474) в качестве катализатора при получении простых эфиров, в т.ч. бензилбутилового эфира (I) предложено использовать комплексы иридия. Синтез бензилбутилового эфира проводят по следующей методике: смесь бензилового спирта (0.4 ммоль), бутанола (2.0 ммоль), иридиевого катализатора (0.004 ммоль) и трифлата серебра AgOTf (0.012 ммоль) нагревают при 130°С в толстостенной стеклянной трубе, оснащенной тефлоновой пробкой, в течение 2 часов. Выход бензилбутилового эфира по данному способу составляет 95%.
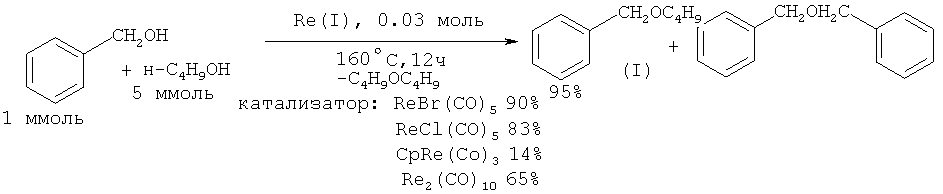
В работе ([18] Y. Liu, R. Hua, Н.-В. Sun, X. Qiu. // Organometallics, 2005, 24(11), 2819) описан синтез бензилбутилового эфира взаимодействием бензилового спирта и н-бутанола в присутствии ренийсодержащего катализатора. Реакция проходит при температуре 160°С и завершается через 12 ч. В лучшем опыте выход целевого эфира (I) достигает 90%.
Недостатки методов:
1. Использование труднодоступных и дорогостоящих иридий- и ренийсодержащих катализаторов.
Авторами предлагается способ получения бензилбутилового эфира, свободный от недостатков, присущих известным методам.
Задачей предлагаемого изобретения является удешевление себестоимости бензилбутилового эфира за счет использования в качестве катализатора доступного и дешевого дибромида меди CuBr2 вместо дорогостоящих иридий- или ренийсодержащих катализаторов, отказ от применения оснований (NaOH, КОН, NaH, n-BuONa, амины), уменьшение количества отходов и упрощение технологии в целом.
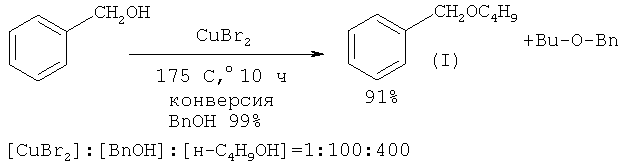
Сущность способа заключается во взаимодействии бензилового спирта с н-бутанолом под действием CuBr2 при температуре 140-175°С в течение 2-10 ч при мольном соотношении [CuBr2]: [ВпОН]: [н-С4Н9ОН] = 1-5:100:100-400. В оптимальных условиях (175°С, 10 ч, [CuBr2]: [ВnОН]: [н-С4Н9ОН] = 1:100:400) бензиловый спирт с конверсией 99% превращается в бензилбутиловый эфир. Общий выход бензилбутилового эфира по предложенному методу 91%. В отсутствие катализатора реакция не идет.В следовых количествах в реакционной массе был обнаружен бензальдегид (<0,2%). Дибутиловый эфир в условиях реакции не образуется.
Без катализатора реакция не идет.
Существенные отличия предлагаемого способа от прототипов.
Реакция межмолекулярной дегидратации между бензиловым спиртом и 1-бутанолом с образованием бензилбутилового эфира проводится в присутствии нового катализатора - бромида меди (II) CuBr2.
Преимущества предлагаемого метода.
1. Доступность и дешевизна катализатора CuBr2.
2. Отсутствие побочных продуктов.
3. Селективность процесса и высокий выход целевого продукта: при конверсии бензилового спирта 99% общий выход бензилбутилового эфира составляет 91%.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводили в стеклянной ампуле (V=12 мл), помещенной в микроавтоклав из нержавеющей стали (V=17 мл).
В ампулу под аргоном загрузили 1 ммоль CuBr2, 100 ммоль BnOH и 400 ммоль Н-С4Н9ОН. Запаянную ампулу поместили в автоклав, автоклав герметично закрыли и нагревали при 175°С в течение 10 часов с постоянным перемешиванием. После окончания реакции автоклав охлаждали до 20°С, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлороформом, реакционную массу фильтровали через слой силикагеля (2 грамма) (элюент - гексан). Бензилбутиловый эфир выделяли перегонкой в вакууме.
Общий выход бензилбутилового эфира при проведении реакции в условиях: 175°С, 10 ч при мольном соотношении [CuBr2]: [ВnОН]: [н-С4Н9ОН] = 1:100:400 составил 91%.
Выделенный бензилбутиловый эфир имел т.кип. 90-92°С/10 мм.рт.ст. (лит.220-221°/744 мм.рт.ст ([19] Словарь органических соединений. П/р Хейльборна И. и Бэнбери Г.М, т.I. М.: Изд-во: иностранной литературы, 1949) и 220-221°C ([20] Справочник химика. Основные свойства неорганических и органических соединений, п/р. Никольский Б.П, Зонис С.А.- Л., Химия, 1971. II, 1168).
Спектр ЯМР,13С, δ, м.д.: 138.74, 128.34, 127.63, 127.48, 70.22, 72.87, 31.89, 19.42, 13.94. Спектр ЯМР 1Н, δ, м.д.: 0.99 (3Н, т, 3JHH=7.6 Гц, СН3), 1.4-1.55 (м, 2Н, СН2СН3), 1.6-1.75 (м, 2Н, СН2СН2СН3), 3.52 (2Н, т, 3JHH=6.8 Гц, ОСН2СН2), 4.54 с (2Н, с, СH2О), 7.25-7.55 м (5Н, м, Ar, СН).
Другие примеры, подтверждающие способ, приведены в таблице 1.
|