Результат интеллектуальной деятельности: ЭКЗОГЕННО-ИНДУЦИРУЕМАЯ ЖИВОТНАЯ МОДЕЛЬ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Вид РИД
Изобретение
Область техники, к которой относится изобретение.
Изобретение относится к способу создания модели болезни Альцгеймера, отличающемуся тем, что церебральный амилоидоз у экспериментальных животных вызывается введением в их организм синтетических аналогов изомеризованного по аминокислотному остатку аспарагиновой кислоты в положении 7 человеческого бета-амилоида и/или его фрагментов, включающих остаток изомеризованной аспарагиновой кислоты в положении 7.
Уровень техники
Болезнь Альцгеймера (БА) является смертельной нейродегенеративной патологией, клиническое протекание которой сопровождается неуклонным упадком психомоторных функций пациента на протяжении длительного периода (1). В России число таких больных составляет около полутора миллионов человек (2). Лекарственных средств, способных остановить течение данной патологии, в настоящее время не существует нигде в мире, однако их поиску придается колоссальное значение во всех развитых странах, где с ростом числа лиц пожилого возраста увеличивается и число страдающих от болезни Альцгеймера.
Характерным молекулярным процессом болезни Альцгеймера является конформационное превращение небольшого (39-43 аминокислотных остатка) белка, бета-амилоида (3). Этот белок является нормальным компонентом крови, где присутствует в виде мономера, однако образует олигомеры и надмолекулярные агрегаты (амилоидные бляшки) у пациентов с клинически диагностированной болезнью Альцгеймера (4). Согласно широко принятой амилоидной гипотезе, именно полимеризация бета-амилоида, которая приводит к церебральному амилоидозу, является ключевым событием, запускающим весь патогенный каскад болезни Альцгеймера (5).
Церебральный амилоидоз представляет собой процесс образования плотных конгофильных амилоидных бляшек в специфических отделах головного мозга и является одним из важнейших нейроморфологических признаков болезни Альцгеймера (6). В настоящее время существует несколько животных моделей болезни Альцгеймера, основанных на использования трансгенных грызунов (мышей, крыс). В этих моделях церебральный амилоидоз обусловлен изменениями в геноме, которые приводят к повышенной экспрессии эндогенного человеческого бета-амилоида (Аβ) в крови (7-9). Мыши и крысы дикого типа в отличие от всех остальных млекопитающих имеют три замены в аминокислотной последовательности бета-амилоида и не подвержены болезни Альцгеймера. Введение синтетических аналогов Аβ в организм млекопитающих не вызывает у них развития церебрального амилоидоза и, соответственно, патогенеза БА. В то же время было показано, что интрацеребральные инъекции гомогенизированных амилоидных бляшек, выделенных из мозга пораженных болезнью Альцгеймера людей, приводили к развитию церебрального амилоидоза у подопытных животных (10-19). Эти данные дали основание считать, что главной движущей силой патогенеза БА является агрегирование эндогенного бета-амилоида под влиянием структурно и/или химически измененной изоформы бета-амилоида, которая содержится в экстрактах амилоидных бляшек (20-21). Тем не менее, несмотря на многочисленные исследования в течение более чем 20 лет ни одна научная группа в мире не смогла найти такую изоформу бета-амилоида. Соответственно, к моменту создания настоящего изобретения ничего не было известно о точной идентификации индуцирующего патологию болезни Альцгеймера агента и, тем более, никому не удавалось создать экзогенно-индуцированную животную модель болезни Альцгеймера
В 2008 году авторами данного изобретения было показано, что изомеризация остатка аспарагиновой кислоты в положении 7 ведет к цинк-зависимой олигомеризации металл-связывающего домена бета-амилоида (22). Так как амилоидные бляшки содержат до 75% изомеризованного таким образом бета-амилоида и избыток ионов цинка, то нами - первыми и единственными в мире - было предположено, что именно цинковые комплексы этой изоформы бета-амилоида могут являться молекулярным агентом, вызывающим олигомеризацию и последующую агрегацию растворимых форм бета-амилоида, то есть тех самых процессов, которые абсолютным большинством исследователей считаются пусковыми механизмами патогенеза болезни Альцгеймера. Важно отметить, что в работе М. Meyer-Luehmann et al (14) и во всех остальных известных работах нашего времени способность предлагаемого нами агента вызывать церебральный амилоидоз не была проверена. Таким образом, к моменту создания настоящего изобретения никто не был в состоянии обосновано указать, какая изоформа бета-амилоида является инициатором возникновения церебрального амилоидоза, что безусловно указывает на совершенную неочевидность настоящего изобретения.
Сущность изобретения.
Настоящее изобретение состоит в экзогенном инициировании церебрального амилоидоза у млекопитающих, которые экспрессируют эндогенный человеческий бета-амилоид в физиологически обусловленных или же искусственно завышенных количествах. В качестве индуцирующего патологию болезни Альцгеймера агента в настоящем изобретении впервые в мире используются инъекции препаратов, содержащих в своем составе синтетические аналоги изомеризованного по аминокислотному остатку аспарагиновой кислоты в положении 7 человеческого бета-амилоида (изоАсп7-бета-амилоида) и/или его фрагментов, включающих остаток изомеризованной аспарагиновой кислоты в положении 7. Преимуществом таких экзогенно-индуцируемых моделей болезни Альцгеймера по сравнению с существующими в настоящее время конституциональными трансгенными моделями является возможность произвольного изменения скорости развития патологических процессов у подопытных животных в зависимости от целей конкретного исследования. Дополнительным преимуществом данного изобретения является возможность использования в качестве модели болезни Альцгеймера нетрасгенных животных, так как для специалистов в данной области совершенно очевидно, что если молекулярный агент вызывает церебральный амилоидоз у трансгенных мышей, экспрессирующих человеческий бета-амилоид, то этот же агент, а именно - препараты, содержащие в своем составе синтетические аналоги изомеризованного по остатку аспарагиновой кислоты в положении 7 человеческого бета-амилоида и/или его фрагментов, включающих остаток изомеризованной аспарагиновой кислоты в положении 7, - будет с неизбежностью вызывать церебральный амилоидоз у всех остальных млекопитающих, у которых человеческий бета-амилоид присутствует конституционально.
Технический результат.
Технический результат, достигаемый при использовании патентуемого изобретения, заключается в создании экзогенно-индуцируемой животной модели болезни Альцгеймера. Никаких прототипов данного изобретения не существует нигде в мире, так как лишь в рамках настоящего изобретения впервые показана роль препаратов, содержащих в своем составе синтетические аналоги изомеризованного по аминокислотному остатку аспарагиновой кислоты в положении 7 человеческого бета-амилоида и/или его фрагментов, включающих остаток изомеризованной аспарагиновой кислоты в положении 7, в качестве индуцирующих патологию болезни Альцгеймера экзогенно-вводимых агентов.
Пример осуществления изобретения.
Для создания экзогенно-индуцируемой модели болезни Альцгеймера нами была использована линия трансгенных мышей B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J (JAX® GEMM® B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J) без специфицированной патогенной микрофлоры. У мышей данной линии имеются следующие изменения в геноме (21):
- Человеческий ген, кодирующий мутированную форму («Шведский вариант», APPswe, K670N/M671L) Белка-предшественника бета-амилоида; эта форма вызывает наследственную болезнь Альцгеймера.
- Человеческий ген, кодирующий мутированную форму (А246Е) Пресенелина 1; эта форма также вызывает наследственную болезнь Альцгеймера.
Оба гена находятся под управлением промотера мышиного прионного белка. Трансгенный продукт был введен в оплодотворенные яйцеклетки мышей линии C57BL/6JXC3HeJF2, успешная линия была выделена и размножена путем обратного скрещивания с мышами линии C57BL/6J на протяжении 14 поколений.
Мыши B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J характеризуются нейропатологическими повреждениями, которые имеют близкое сходство с выявленными у пациентов с болезнью Альцгеймера (амилоидные бляшки, нейрофибриллярные клубки, гибель нейронов, психомоторные нарушения…) и являются коммерчески доступными.
На период экспериментов трансгенные мыши содержались в стерильных условиях (Пущино, филиал ИБОрХ РАН), Все работы с животными проводились с использованием индивидуальных средств защиты (технологическая одежда). Весь использованный в экспериментах расходный материал (шприцы, ампулы, марля, вата), а также трупы павших и эвтаназированных животных подвергались специализированному накоплению и дальнейшей утилизации на станции огневого уничтожения отходов ФИБХ РАН. Для накопления использованных игл применялся контейнер Шарпа. При проведении эксперимента использовались стандартные условия содержания животных в соответствии с Программой по уходу и содержанию животных в ПЛЖ, рассмотренной и одобренной Институтской Комиссией по контролю за содержанием и использованием лабораторных животных в июле 2009 года.
В качестве препаратов для инъекций использовались;
- «А»: раствор бета-амилоида в воде (концентрация = 100 мкМ)
- «В»: Раствор изоАсп7-бега-амилоида в воде (концентрация = 100 мкМ)
«Аβ42» (активный компонент препарата «А»): синтетический 42-членный пептид DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA. Аминокислотная последовательность данного пептида соответствует бета-амилоиду человека (Beta-amyloid protein 42, или Аβ42), который является фрагментом 672-713 Амилоидного прекурсорного протеина (Amyloid beta A4 protein, UniProtKB/Swiss-Prot P05067, A4_HUMAN). Средняя молекулярная масса: 4514 г/моль. «[isoD7]-Aβ42» (активный компонент препарата «В»): синтетический 42-членный пептид DAEFRH[isoD]SGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA. Этот пептид является [isoD7]-аналогом вещества «Аβ42». Средняя молекулярная масса: 4514 г/моль.
Все используемые вещества и препараты относится к малоопасным химическим веществам (4-й класс опасности).
Учитывая, что средний объем крови у мыши равен 2 мл, а концентрация бета-амилоида в крови трансгенной альцгеймеровской мыши равна 200 нМ, то общее содержание циркулирующего бета-амилоида в этом животном составляет около 0.002·200·10-9=0.4 наномоль = 2000 нг (2 мкг). В соответствие с целью исследований количество вводимого препарата должна быть по меньшей мере в 25 раз выше количества нативного бета-амилоида и, соответственно, должно составлять 25*2000 нг = 50000 нг (50 мкг). Соответственно, концентрация изоформы бета-амилоида в 100 мкл вводимого раствора препарата может быть рассчитана из соотношения:
25·0.200 мкМ·2000 мкл = х мкМ·100 мкл,
и будет составлять 100 мкМ. При этом в 100 мкл вводимого препарата общее количество бета-амилоида составит 50 (пятьдесят) мкг, а в 200 мкл - 100 (сто) мкг.
Возраст животного к первой инъекции = 8-10 недель. Каждый препарат вводился раз в месяц внутривенно в ретроорбитальное венозное сплетение в объеме 200 мкл/гол, всего было проведено по 8 инъекций для каждого животного, последняя инъекция проводилась в возрасте 9 месяцев.
Внутривенная инъекция в ретроорбитальное венозное сплетение у мышей разрешена для проведения в отсутствие анестезии. Для проведения данной процедуры мышь захватывают за кожу шеи большим и указательным пальцами, другими пальцами надежно удерживают за кожу спины и прижимают к сетке для содержания. Иглой шприца прокалывают конъюнктиву внутреннего угла глаза и проводят ее на глубину 1-2 мм за глазное яблоко, где находиться венозное сплетение. При правильном введении в иглу из ретроорбитального сплетения самотеком поступает кровь (при сомнении можно в шприце создать небольшое отрицательное давление). Убедившись в правильности местонахождения, медленно вводится испытуемый препарат. После инъекции стерильной марлевой салфеткой слегка надавливается глазное яблоко с целью остановки кровотечения. Таким способом можно вводить препарат шприцем объемом 1 мл и иглой №27-29G½. Объем вводимого препарата 100-200 мкл/гол. В течение всего эксперимента мыши содержатся индивидуально в клетках Тип-2 с идентификационными табличками, на которых указывается количество животных, название линии, пол, вид и дата манипуляции. Для облегчения боли и стресса при внутривенной инъекции в ретроорбитальное венозное сплетение будет использоваться анестезия. Основные болевые ощущения и стресс связаны с фиксацией и внутривенной инъекцией. По окончании эксперимента в каждой группе эвтаназировались все животные и приготавливались препараты головного мозга. Эвтаназия проводилась в соответствии с Российским национальным санитарным законодательством и Американским законодательством по защите животных углекислым газом согласно утвержденному в комиссии IACUC Протоколу-заявке на манипуляции с животными №09/01.
Морфологический анализ тканей мозга трансгенных животных проводился с помощью гистохимических методов, описанных ниже.
Покрытие предметных стекол желатиной с алюмохромовыми квасцами - 2 г желатина растворялось в 400 мл дистиллированной воды, с нагреванием раствора до 55°C при постоянном помешивании. После растворения добавлялось 0,2 г алюмохромовых квасцов и раствор хорошо перемешивался. Раствор нагревался до 60°C для покрытия предметных стекол. Стекла высушивались в течение суток перед использованием.
Фиксация мозга - Мозг мыши вынимается из черепной коробки и помещается в свежеприготовленный раствор 4% параформальдегида в фосфатном буфере (pH 7,4) на шесть суток с трех разовый сменой раствора через двое суток. На седьмые сутки, непосредственно перед изготовлением срезов, мозг помещается на шестеро суток в 30% раствор сахарозы с трехразовой сменой раствора через двое суток.
Изготовление срезов - Мозг мыши извлекается из раствора сахарозы, промакивается фильтровальной бумагой и покрывается средой для заморозки (например Tissue-Tek® ОСТ Compound, компании Thermo). Далее мозг замораживался либо на элементе Пельтье, которым снабжен криотом фирмы Thermo, либо в жидком азоте. После заморозки мозг помещался в криотом и делались срезы толщиной в 30 микрон. Срезы помещались на предметное стекло, покрытое желатином, и подвергались гистологическому окрашиванию.
Гистологические окрашивания
(1) Окрашивание гематоксилиом по Майеру: Срезы последовательно по 2 минуты дегидратируют в 100%, 96% и 70% спирте и помещаит на 2 минуты в воду. Затем препараты помещают на 30 мин в раствор гематоксилина, примывают водой и проявляют в ТАР воде до появления синего окрашивания.
(2) Окрашивание амилоидных бляшек спиртовым раствором Конго-красным; Срезы, предварительно дегидратированные в спиртовых растворах и окрашенные гематоксилином по Майеру, инкубируются в насыщенном 80% спиртовом растворе NaCl, содержащим 1% одного процентного NaOH, в течение 20 минут. Затем Препарат помещается в раствор Конго-красного, содержащего 1% одного процентного NaOH, в течение 20 минут. Препараты два раза по 5 минут дегидратируют в 100% спирте, просветляют в ксилоле и заключают в бальзам. Визуализация амилоидных бляшек розового цвета проводится в проходящем свете и подтверждается в поляризационном. Для одновременного окрашивания амилоидных и клеточных структур был применен подход с окрашиванием клеток гематоксилином по Майеру и бляшек Конго-красным.
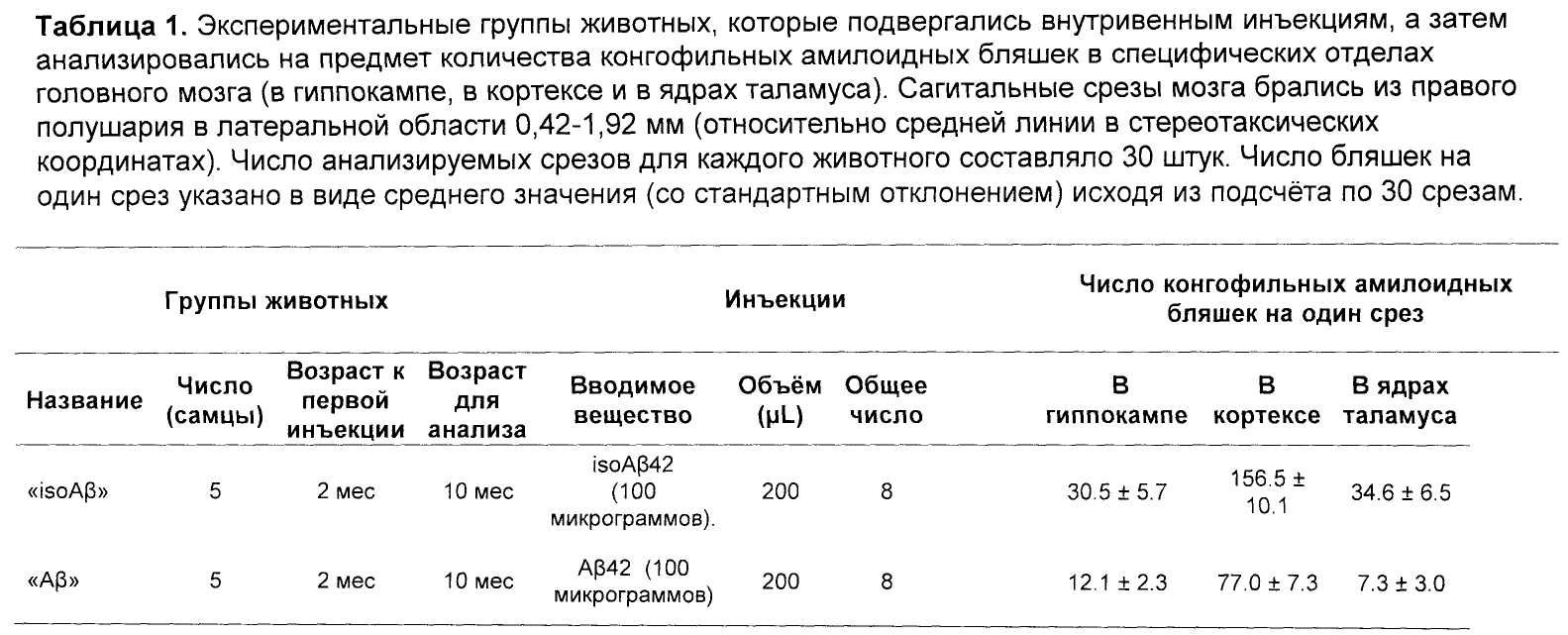
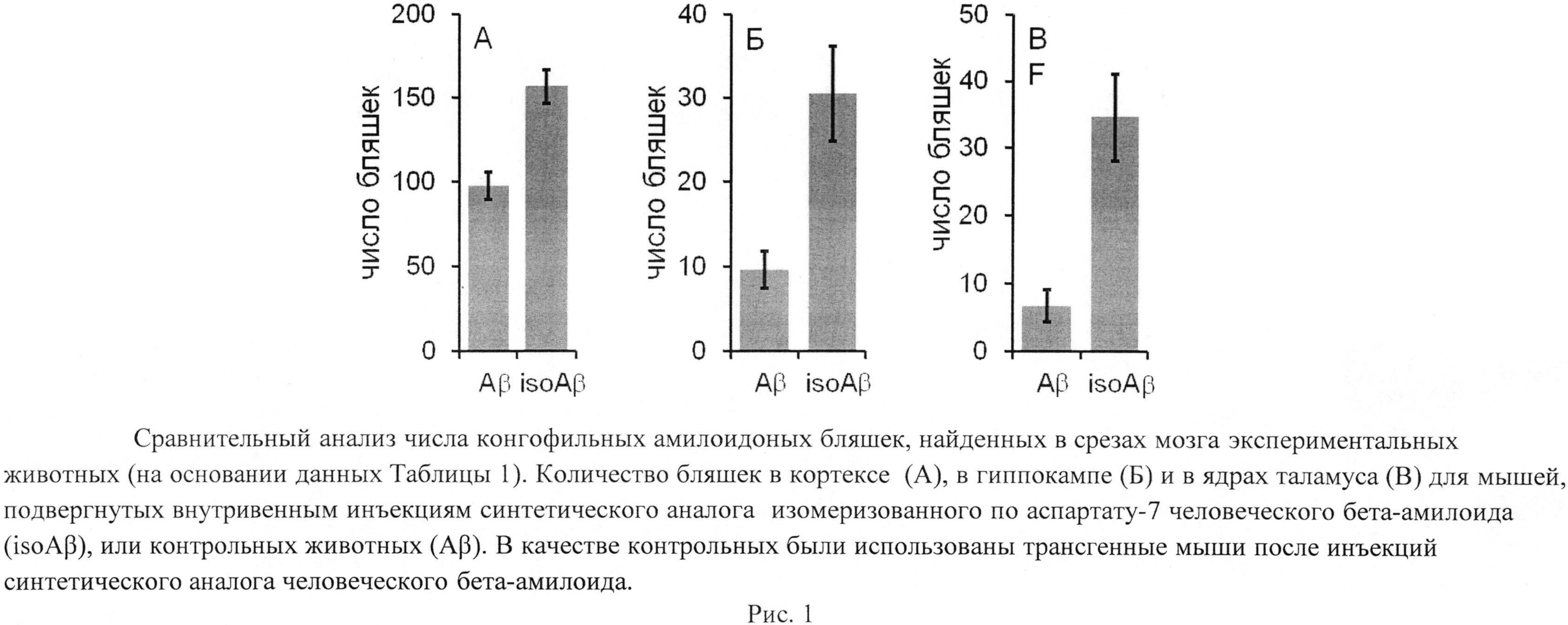
Число конгофильных амилоидных бляшек подсчитывалось вручную с помощью светового микроскопа в поляризованном свете. Результаты сравнительного анализа показали (Таблица 1, Рисунок 1), что число бляшек у мышей, инъецированных препаратом синтетического аналога изомеризованного по аспратату-7 человеческого бета-амилоида значительно превышает число бляшек у контрольных животных, которым вкалывался препарат, содержащий интактный бета-амилоид, что однозначно свидетельствует о способности изомеризованного по аспратату-7 человеческого бета-амилоида вызывать церебральный амилоидоз у соответствующим образом обработанных животных.