Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ МОДИФИЦИРОВАННЫХ НУКЛЕОТИДОВ РНК
Вид РИД
Изобретение
Изобретение относится к области органической и медицинской химии, молекулярной биологии и касается способа обнаружения модифицированных оснований в составе РНК, который может быть использован для быстрой идентификации РНК-модифицирующих ферментов в клетке.
Нуклеотиды природных РНК часто претерпевают различные химические превращения, и на сегодняшний день известно более сотни типов модифицированных нуклеотидов (Rozenski J., Grain P.F., McCloskey J.A. The RNA Modification Database: 1999 update. Nucleic Acids Res. 1999. 27(1): 196-7). Среди всех типов РНК наиболее распространенными модификациями являются метилирование, псевдоуридинилирование и дигидроуридинилирование. Известно, что некоторые такие модификации обеспечивают химическое и функциональное разнообразие РНК, улучшают их структурную стабильность или функциональную активность (Bjork, G.R., et al. Transfer RNA modification. Anna Rev Biochem. 1987. 56:263-87; Dunin-Horkawicz, S., et al. MODOMICS: a database of RNA modification pathways. Nucleic Acids Res. 2006. 34 (Database issue): D145-9) и даже участвуют в регуляции экспрессии генов (Clancy MJ, Shambaugh ME, Timpte CS, Bokar J A. Induction of sporulation in Saccharomyces cerevisiae leads to the formation of N6-methyladenosine in mRNA: a potential mechanism for the activity of the IME4 gene. Nucleic Acids Res. 2002. 30(20): 4509-18).
Несмотря на эти данные, остается обширный круг модифицированных нуклеотидов РНК, функция и причина возникновения которых до сих пор непонятны. Кроме того, реализация данного изобретения поможет выяснить и особенности регуляции процесса модифицирования нуклеотидов РНК. В течение более чем 50 лет в научном мире появляются все новые методы, которые позволяют более или менее успешно устанавливать наличие, количество и даже положение той или иной модификации в молекуле РНК. Одним из первых методов обнаружения метилированных нуклеотидов стал анализ продуктов гидролиза радиоактивно меченной РНК методом двумерного электрофореза (Sanger, F., G.G.Brownlee, and B.G.Barrell. A two-dimensional fractionation procedure for radioactive nucleotides. J Mol Biol. 1965. 13(2): 373-98). Однако метод оказался крайне трудоемким, а его результаты часто были неоднозначными. Сразу после того как Максам и Гилберт предложили анализировать последовательность ДНК путем химического и ферментативного гидролиза (Махат, A.M. and W.Gilbert. A new method for sequencing DNA. Proc Natl Acad Sci USA. 1977. 74(2): 560-4), появились методы, позволяющие выявить некоторые модифицированные нуклеотиды РНК (Peattie, D.A. Direct chemical method for sequencing RNA. Proc Natl Acad Sci USA 1979. 76(4): 1760-4; Donis-Keller, H., A.M.Maxam, and W.Gilbert. Mapping adenines, guanines, and pyrimidines in RNA. Nucleic Acids Res. 1977. 4(8): 2527-38). Эти методы требовали работы с радиоактивными изотопами, а анализируемая молекула РНК не должна была иметь большую длину. В начале 80-х годов данный метод адаптировали к длинным молекулам РНК, предложив использовать олигодезоксирибонуклеотиды, комплементарные исследуемым последовательностям РНК, с последующим гидролизом РНказойН (Connaughton, J.F., et al. Primary structure of rabbit 18S ribosomal RNA determined by direct RNA sequence analysis. Nucleic Acids Res. 1984. 12(11): 4731-45). Это позволило идентифицировать метилированные по 2'-гидроксильным группам рибозы нуклеотиды Cm, Am, Um, а также нуклеотиды m7G. К сожалению, усовершенствованный метод гидролиза с последующим секвенированием РНК, был не менее трудоемок и не был универсальным для нахождения любых модификаций РНК. В 1993 году группа Офенганда разработала новый, до сих пор не утерявший своей актуальности метод обнаружения модифицированных нуклеотидов с помощью реакции обратной транскрипции (Bakin, A. and J.Ofengand. Four newly located pseudouridylate residues in Escherichia coli 23S ribosomal RNA are all at the peptidyltransferase center: analysis by the application of a new sequencing technique. Biochemistry. 1993. 32(37): 9754-62). Он применим преимущественно к нахождению модификаций нуклеотидов, которые препятствуют образованию Уотсон-Криковских пар (m2 6А, m3U, m1G), а при особых условиях остановку реакции обратной транскрипции вызывает и наличие метальной группы на 2'-гидроксиле рибозы (Maden, В.Е., et al. Classical and novel approaches to the detection and localization of the numerous modified nucleotides in eukaryotic ribosomal RNA. Biochimie. 1995. 77(1-2): 22-9). При использовании уникальных химических свойств некоторых других нуклеотидов в сочетании с реакцией обратной транскрипции также можно обнаружить псевдоуридин Ψ (Bakin, A. and J.Ofengand. Four newly located pseudouridylate residues in Escherichia coli 23S ribosomal RNA are all at the peptidyltransferase center: analysis by the application of a new sequencing technique. Biochemistry. 1993. 32(37): 9754-62), m7G (Wintermeyer, W. and H.G.Zachau. A specific chemical chain scission of tRNA at 7-methylguanosine. FEBS Lett. 1970. 11(3): 160-164), m3C, m2G (Mortimer, SA., J.S.Johnson, and K.M.Weeks. Quantitative analysis of RNA solvent accessibility by N-silylation of guanosine. Biochemistry. 2009. 48(10): 2109-14.), m5C (Rhodes, D. Accessible and inaccessible bases in yeast phenylalanine transfer RNA as studied by chemical modification. J Mol Biol. 1975. 94(3): 449-60; Negishi, K., et al A rapid cytosine-specific modification of E. coli tRNA Leu 1 by semicarbazide-bisulfite, a probe for polynucleotide conformations. Nucleic Acids Res. 1977. 4(7): 2283-92. Munzel, M., et al. Chemical discrimination between dC and 5MedC via their hydroxylamine adducts. Nucleic Acids Res. 2010. 38(21): e192; Clark, S.J., et al. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 1994. 22(15): 2990-7; Gu, W., et al. Depletion of Saccharomyces cerevisiae tRNA(His) guanylyltransferase Thg1p leads to uncharged tRNAHis with additional m(5)C. Mol Cell Biol. 2005. 25(18): 8191-201; Schaefer, M., et al. RNA cytosine methylation analysis by bisulfite sequencing. Nucleic Acids Res. 2009. 37(2): e12.). Стоит отметить также, что 2'-O-метилированный нуклеотид более устойчив в условиях щелочного гидролиза, нежели неметилированный. Это свойство используют в сочетании с реакцией обратной транскрипции для обнаружения нуклеотидов РНК, содержащих метальную группу в рибозе (Maden, В.Е. Mapping 2'-O-methyl groups in ribosomal RNA. Methods. 2001. 25(3): 374-82). Дигидроуридин также не вызывает остановку реакции обратной транскрипции, поэтому перед дальнейшим анализом используют его уникальную способность превращаться в остаток β-уреидопропионовой кислоты в щелочной среде (Xing F, Hiley SL, Hughes TR, Phizicky EM. The specificities of four yeast dihydrouridine synthases for cytoplasmic tRNAs. J Biol Chem. 2004. 279:17850-60).
С появлением новых инструментов подходы к поиску модифицированных нуклеотидов РНК изменились. Так, метод масс-спектрометрии с электроспрей-ионизацией (ESI-MS) обеспечивает достаточно мягкие условия для анализа РНК (Kowalak, J.A., et al. А novel method for the determination of post-transcriptional modification in RNA by mass spectrometry. Nucleic Acids Res. 1993. 21(19): 4577-85), которые в результате образуют многозарядные ионы, и, следовательно, допустимый предел массы анализируемой РНК значительно увеличивается (Polo, L.M. and P.A.Limbach. Analysis of oligonucleotides by electrospray ionization mass spectrometry. Curr Protoc Nucleic Acid Chem. 2001. Chapter 10, Unit 10 2). При всех достоинствах метода ESI-MS, с его помощью зачастую нельзя установить положение модифицированного нуклеотида в молекуле РНК, и практически невозможно установить положение модификации внутри нуклеотида. В связи с этим метод масс-спектрометрии используют в качестве надежного дополняющего метода, позволяющего обнаружить различия в массах фрагментов РНК, не достигающих даже 1 дальтона.
На сегодняшний день широко применяют высокоэффективную жидкостную хроматографию (ВЭЖХ) для подтверждения присутствия модифицированного нуклеотида в составе РНК. Разделению подвергают продукты полностью гидролизованных РНК и по малейшим изменениям в подвижности различают всевозможные типы модифицированных нуклеотидов. Кроме того, в сочетании с методом масс-спектрометрии в точности устанавливают тип и молекулярную массу исследуемого фрагмента (Kowalak, J.A., et al. A novel method for the determination of post-transcriptional modification in RNA by mass spectrometry. Nucleic Acids Res. 1993. 21(19): 4577-85; Andersen, Т.Е., B.T.Porse, and F.Kirpekar. A novel partial modification at C2501 in Escherichia coli 23S ribosomal RNA. RNA. 2004.10(6): 907-13; Giessing, A.M., et al. Identification of 8-methyladenosine as the modification catalyzed by the radical SAM methyltransferase Cfr that confers antibiotic resistance in bacteria. RNA. 2009. 15(2): 327-36; Yan, F., et al. RlmN and Cfr are radical SAM enzymes involved in methylation of ribosomal RNA. J Am Chem Soc. 2010. 132(11): 3953-64; Benitez-Paez, A., et al. YibK is the 2'-O-methyltransferase TrmL that modifies the wobble nucleotide in Escherichia coli tRNA(Leu) isoacceptors. RNA. 2010.16(11): 2131-43; Havelund, JF, Giessing, A.M., Hansen, Т., Rasmussen, A., Scott, L.G., Kirpekar, F. Identification of 5-hydroxycytidine at position 2501 concludes characterization of modified nucleotides in E.coli 23S rRNA. J Mol Biol. 2011. 411(3):529-36). Однако установить точное положение модифицированного нуклеотида с использованием комбинации ВЭЖХ и ESI-MS не представляется возможным. Нельзя не упомянуть изящный и сложный метод обнаружения 2'-O-метилированных нуклеотидов, который представляет собой совмещение масс-спектрометрического анализа, метода переноса электронов (ЕТ) и метода диссоциации, активированной соударениями (CAD), инфракрасной мультифотонной диссоциации (IRMPD) или ультрафиолетовой фотодиссоциации (UVPD) (Smith, S.I. and J.S. Brodbelt. Hybrid activation methods for elucidating nucleic acid modifications. Anal Chem. 2011. 83(1): 303-10). С помощью данного метода получают различные типы ионов, образованных разрушением некоторых предпочтительных связей в нуклеиновых кислотах, причем продукты разрыва в результате применения IRMPD и UVPD различаются и дополняют друг друга. Наличие 2'-O-метильной группы предотвращает образование характерных для рибозы типов ионов, и в результате сравнительного анализа методом масс-спектрометрии полученного фрагмента РНК устанавливают искомое положение метилированного нуклеотида в нем.
Среди всех модифицированных нуклеозидов наибольшее затруднение в идентификации вызывают дигидроуридин (D), монометилированный по экзоциклическому атому азота аденозин (m6A) и в меньшей степени псевдоуридин (Ψ). Это связано с тем, что при формировании дуплексов между исследуемой РНК и комплементарными ей олигонуклеотидами они ведут себя в точности так же, как немодифицированные нуклеозиды. В то время как D и Ψ имеют уникальные химические свойства и могут быть обнаружены после химических превращений путем обратной транскрипции, то m6A до недавних пор могли детектировать только исчерпывающим гидролизом с дальнейшим анализом методами ВЭЖХ и MS (Kawamura, Y. and Mizuno, Y. Studies on transfer RNAs. II. Modification of Escherichia coli formylmethionine transfer RNA. Biochim. Biophys. Acta. 1972. 277: 323-334; Limbach, PA., Grain, P.F. and McCloskey, J.A. Characterization of oligonucleotides and nucleic acids by mass spectrometry. Curr. Opin. Biotechnol. 1995. 6: 96-102). Проблема обостряется еще и потому, что именно эти три модифицированных нуклеозида чаще всего встречаются в РНК клеток всех живых организмов. Был предложен довольно интересный метод обнаружения двух модифицированных нуклеозидов - Ψ и m6A (Dai, Q., Fong, R., Saikia, M., Stephenson, D., Yu, Y., Pan, T. and Piccirilli, J A. Identification of recognition residues for ligation-based detection and quantitation of pseudouridine and N6-methyladenosine. Nucleic Acids Research. 2007. 35(18): 6322-9). Принцип метода заключается в подборе пары комплементарных исследуемой РНК олигонуклеотидов, один из которых содержит на 5'-конце так называемый «узнающий остаток», а также несет радиоактивно меченный атом фосфора в α-положении. Второй олигонуклеотид гибридизуется в непосредственной близости с «узнающим». «Узнающий остаток» находится прямо напротив исследуемого нуклеотида и принимает разную геометрию, в зависимости от наличия или отсутствия модификации. Это сказывается на эффективности лигирования двух олигонуклеотидов, располагающихся напротив искомого нуклеотида, и, таким образом, указывает на наличие или отсутствие модификации в РНК. Авторы данного метода впервые показали, как без дополнительных химических превращений можно обнаружить модифицированные нуклеотиды Ψ и m6A. Недостатками метода является применение радиоактивных изотопов, а также неколичественный выход реакции, который заметно отличается для разных последовательностей изучаемых РНК.
Один из методов обнаружения модифицированного нуклеозида m6А использовала группа Рао, применив антитела, специфичные к участку ДНК, содержащему монометилированный по экзоциклическому атому азота аденозин (Banerjee, A., Rao, D.N. Functional analysis of an acid adaptive DNA adenine methyltransferase from Helicobacter pylori 26695. PLoS One. 2011. 6(2):e16810). Вскоре после этого был представлен усовершенствованный метод, адаптированный для анализа метилированных РНК и получивший название m6A-seq (Dominissini, D., Moshitch-Moshkovitz, S., Schwartz, S., Salmon-Divon, M., Ungar, L., Osenberg, S., Cesarkas, K., Jacob-Hirsch, J., Amariglio, N, Kupiec, M., Sorek, R., Rechavi, G. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature. 2012. 485(7397): 201-6). Авторы демонстрируют, что при помощи антител, специфичных по отношению к модифицированному нуклеозиду m6A в мРНК, с последующим исчерпывающим секвенированием ее фрагментов, появилась возможность определять весь набор искомых модификаций во всех клеточных РНК одновременно. Этот метод можно назвать прорывным благодаря его универсальности: с его помощью стало возможным обнаруживать модифицированные нуклеотиды вне зависимости от последовательности РНК, при этом не требуется дополнительной обработки РНК и работы с радиоактивными изотопами. Единственным существенным недостатком предложенного метода является необходимость в дорогостоящем оборудовании, приобретение которого могут позволить себе лишь единичные лаборатории мира.
Наиболее близким к заявляемому решению является способ определения метилирования в последовательностях нуклеиновых кислот (Заявка на изобретение США US 2010/0291565 Al). Данное изобретение относится к методу детекции метилирования ДНК предпочтительно природного происхождения путем контакта исследуемой нуклеиновой кислоты с каким-либо химическим агентом с образованием детектируемого сигнала при их контакте. Метод включает в себя стадию денатурации исследуемой ДНК и детекцию полученного от химического агента сигнала при их контакте. Уровень метилирования оценивают путем сравнения профилей кривых плавления, в частности, по их наклону. Кроме того, метод также допускает использование дополнительно химического агента, контактирующего с ДНК и способного тушить флуоресценцию, возникающую при применении метода.
Заявляемое изобретение имеет существенные отличия от известного технического решения. А именно, в основе настоящего изобретения лежит гибридизация двух олигонуклеотидов, один из которых содержит донор флуоресценции, а другой - тушитель флуоресценции, причем имеет большое значение соотношение длин применяемых олигонуклеотидов. Предложенный метод используется для точечных модификаций в определенных нуклеотидах, в отличие от прототипа. Метод нацелен на обнаружение различных типов модификаций, включая различные типы метилирования, дигидроуридинилирование и прочее. Стадии денатурации в настоящем исследовании предшествует стадия гибридизации олигонуклеотидов, что увеличивает специфичность метода детекции. Характер кривых в настоящем изобретении может указывать на различные типы модификаций и, таким образом, возможна детерминация различных типов модификаций на одном и том же нуклеотиде. Кроме того, объектом исследования является РНК, а не ДНК.
Все вышеперечисленные отличия выгодно характеризуют предложенное изобретение, при применении которого появляется возможность детектировать большой спектр модификаций на конкретных нуклеотидах в молекулах РНК.
Таким образом, в данной области остается необходимость в разработке универсального метода, который позволил бы однозначно, быстро и с минимальными материальными затратами детектировать различные модификации нуклеотидов в составе РНК.
Задачей настоящего изобретения является разработка нового простого и универсального способа обнаружения модифицированных нуклеотидов в составе РНК.
Технический результат заявляемой группы изобретений состоит в возможности выявить минимальные различия в структуре РНК, даже для модификаций, не препятствующих образованию Уотсон-Криковских пар. Кроме того, технический результат состоит в расширении спектра модификаций, которые могут быть обнаружены с помощью заявляемого метода.
Поставленная задача решается тем, что способ обнаружения модифицированного нуклеотида в составе исследуемой РНК включает получение контрольной РНК; дизайн двух олигонуклеотидных зондов разной длины, комплементарных исследуемой РНК, при этом один из зондов, имеющих меньшую длину, комплементарен РНК в области, содержащей исследуемый нуклеотид, и имеет температуру плавления меньшую, чем температура плавления второго зонда, один из зондов содержит молекулу донора флуоресценции, а другой - тушитель флуоресценции, при этом донор флуоресценции и тушитель подобраны с обеспечением перекрывания диапазона длин волн испускаемого донором флуоресценции излучения с диапазоном длин волн излучения, поглощаемого тушителем флуоресценции; смешение зондов с исследуемой и контрольной РНК, после чего полученные смеси подвергают нагреву до температуры, обеспечивающей полную денатурацию исследуемой РНК и зондов, медленному охлаждению до температуры, обеспечивающей образование стабильных дуплексов между РНК и зондами, и повторному медленному контролируемому нагреву с одновременным облучением и измерением интенсивности флуоресценции и получением кривых плавления для исследуемой и контрольной РНК, при этом выводы о наличии или отсутствии модификации в исследуемом нуклеотиде РНК делают по итогам сравнения кривых, и при совпадении характера кривых и/или температуры плавления делают вывод о наличии / отсутствии модификации в исследуемой РНК при наличии / отсутствии модификации в контрольной РНК в зоне гибридизации более короткого зонда. В качестве контрольной РНК используют РНК с известной структурой в исследуемой области, а исследуемая РНК аналогична контрольной или отличается от контрольной наличием или отсутствием модификации в исследуемом нуклеотиде. Исследуемая и контрольная РНК являются рибосомными или матричными или транспортными. Зонды подбирают из условия гибридизации их на РНК в непосредственной близости без перекрывания. Более длинный зонд подбирают с температурой плавления, превышающей температуру плавления второго зонда более чем на 5°С. Первый и второй зонды подбирают из условия гибридизации их на РНК на расстоянии друг от друга не далее чем на 10 нуклеотидов между их ближайшими концами. Первый и второй зонды подбирают из условия расположения молекул донора флуоресценции и тушителя флуоресценции на расстоянии не более чем на 10 нуклеотидов друг от друга при гибридизации зондов на РНК. Молекулы донора флуоресценции и тушителя флуоресценции к зондам присоединяют ковалентно. Зонды состоят из рибонуклеотидов, и/или дезоксирибонуклеотидов, и/или из их аналогов и могут содержать любые модификации, не препятствующие проведению исследования. Смешение зондов с РНК осуществляют с использованием буферного раствора. В качестве буферного раствора может быть использован любой состав, включающий вещество, поддерживающее рН раствора в диапазоне 6-8.5, и соль одновалентного или мультивалентного катиона. В одном из вариантов исполнения для смешения зондов с РНК может быть использовано 2-10 пмоль РНК, 2-10 пмоль олигонуклеотида зонда, содержащего донор флуоресценции, 2-10 пмоль зонда, содержащего тушитель флуоресценции, 2-10 мкл 5-кратного буфера для гибридизации, содержащего 200-300 мМ Tris-HCl рН 8.3, 150-250 мМ КСl и деионизированную воду для доведения объема образца до 10-50 мкл. Смесь может дополнительно содержать минеральное масло в количестве 3-10 мкл. Нагрев и охлаждение смесей осуществляют с контролируемой скоростью, при этом измерение интенсивности флуоресценции осуществляют в процессе нагревания. Возможен вариант использования, при котором первоначальный нагрев осуществляют до температуры смесей 70-95°С, медленное охлаждение происходит со скоростью 0.5-4°/ мин до достижения температуры смеси 30-10°С, повторный нагрев смесей производят со скоростью 0.5°/30 сек до достижения смесями 55-95°С. При этом охлаждение проводят до температуры, значение которой ниже температуры плавления короткого зонда не менее чем на 5°С. Повторный нагрев смесей осуществляют до температуры, значение которой превышает температуру плавления более короткого зонда, не менее чем на 5°С. Полученные для анализа кривые плавления преобразуют в кривые зависимости производных интенсивности флуоресценции по температуре от температуры (дифференциальные кривые).
Таким образом, техническая задача решается путем подбора подходящей для исследуемой области РНК пары олигонуклеотидных зондов, подбором пары донора и тушителя флуоресценции с подходящими оптическими свойствами. Длину зондов подбирают экспериментально, отдавая предпочтение тем, которые обеспечивают результаты плавления, интерпретируемые наилучшим образом. Проводится прямой химический синтез модифицированных зондов, оценивается их эффективность в ходе плавления с РНК, содержащей известные модификации. Оцениваются полученные параметры плавления для каждой конкретной системы.
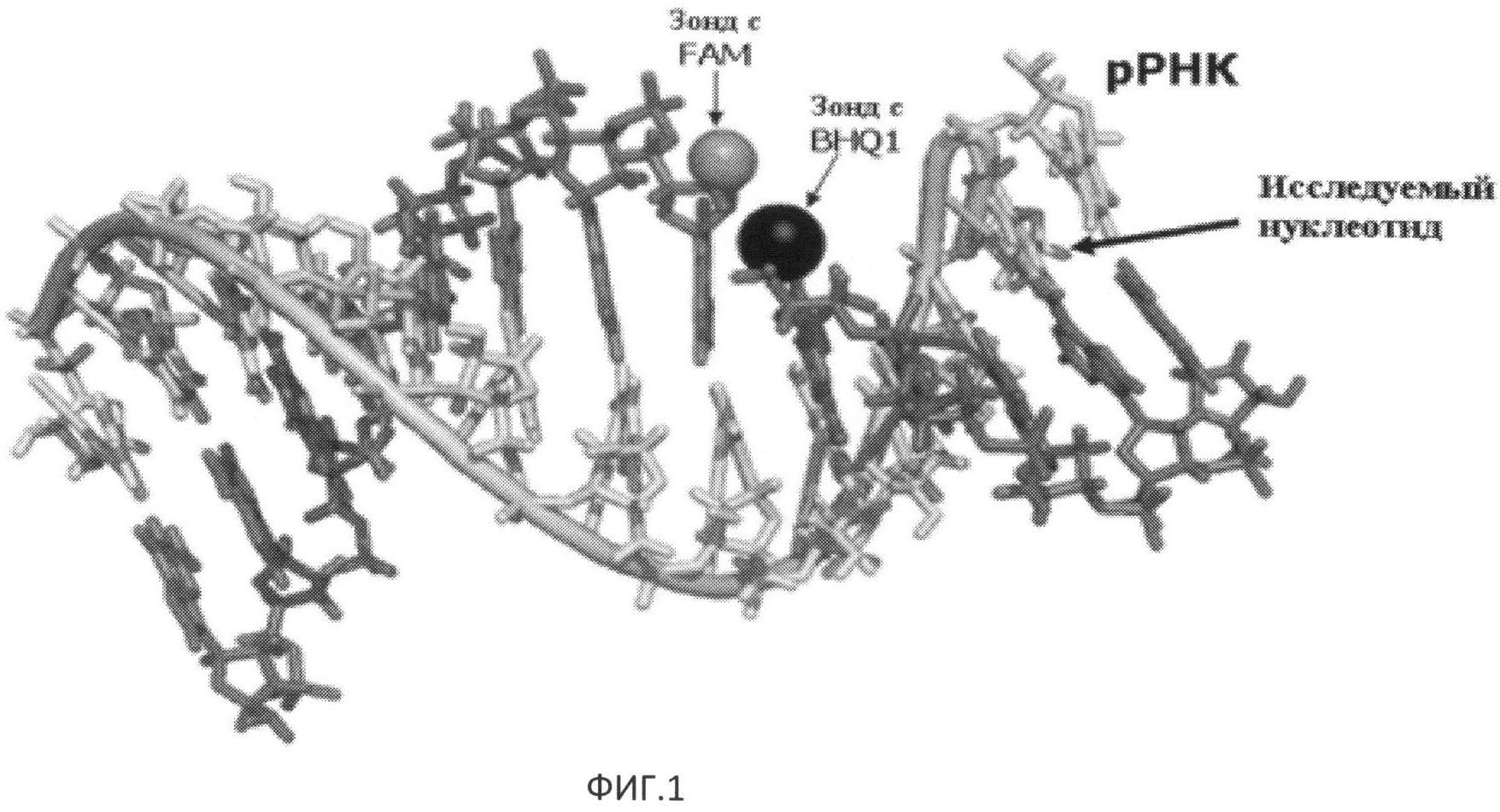
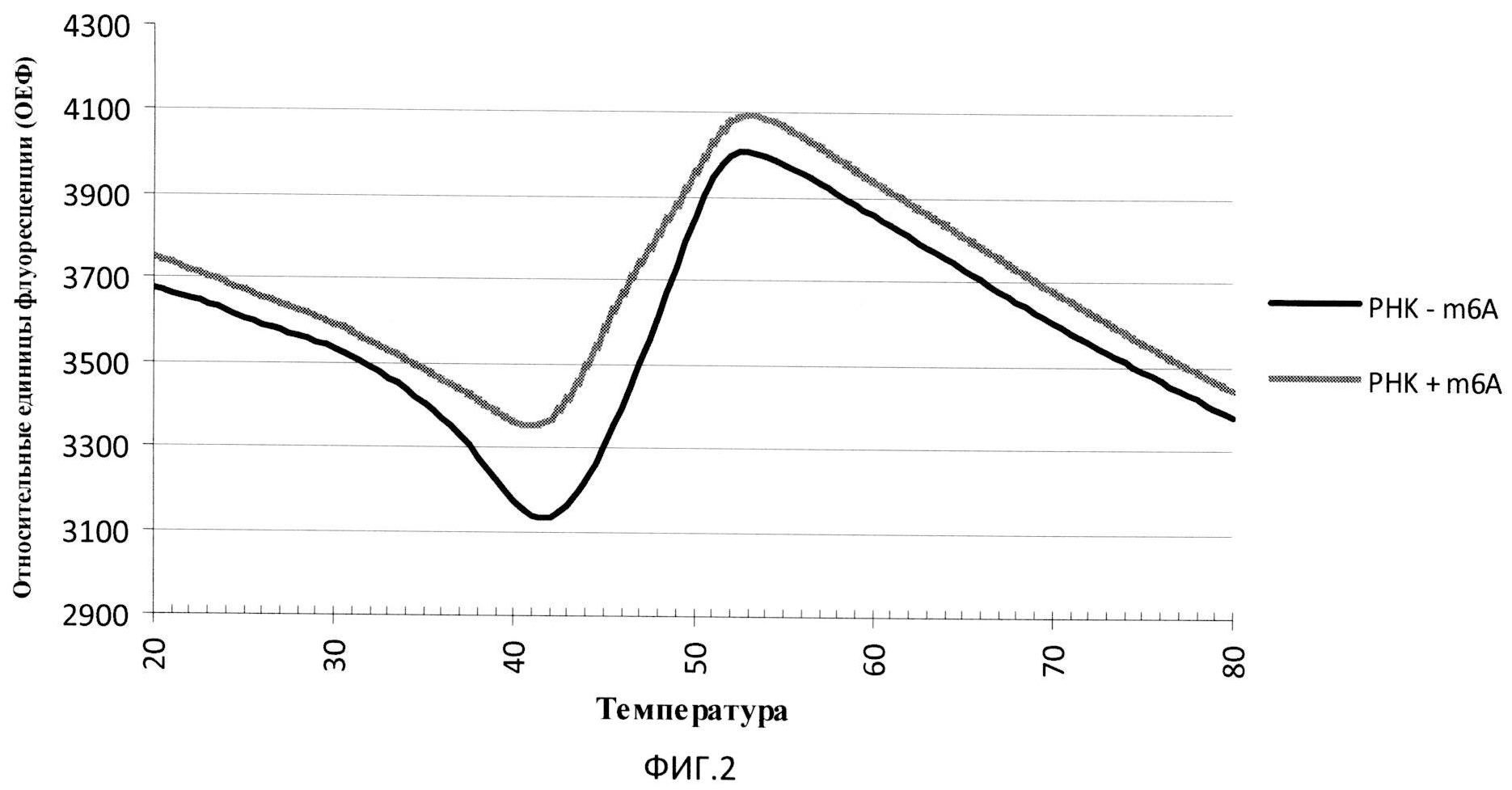
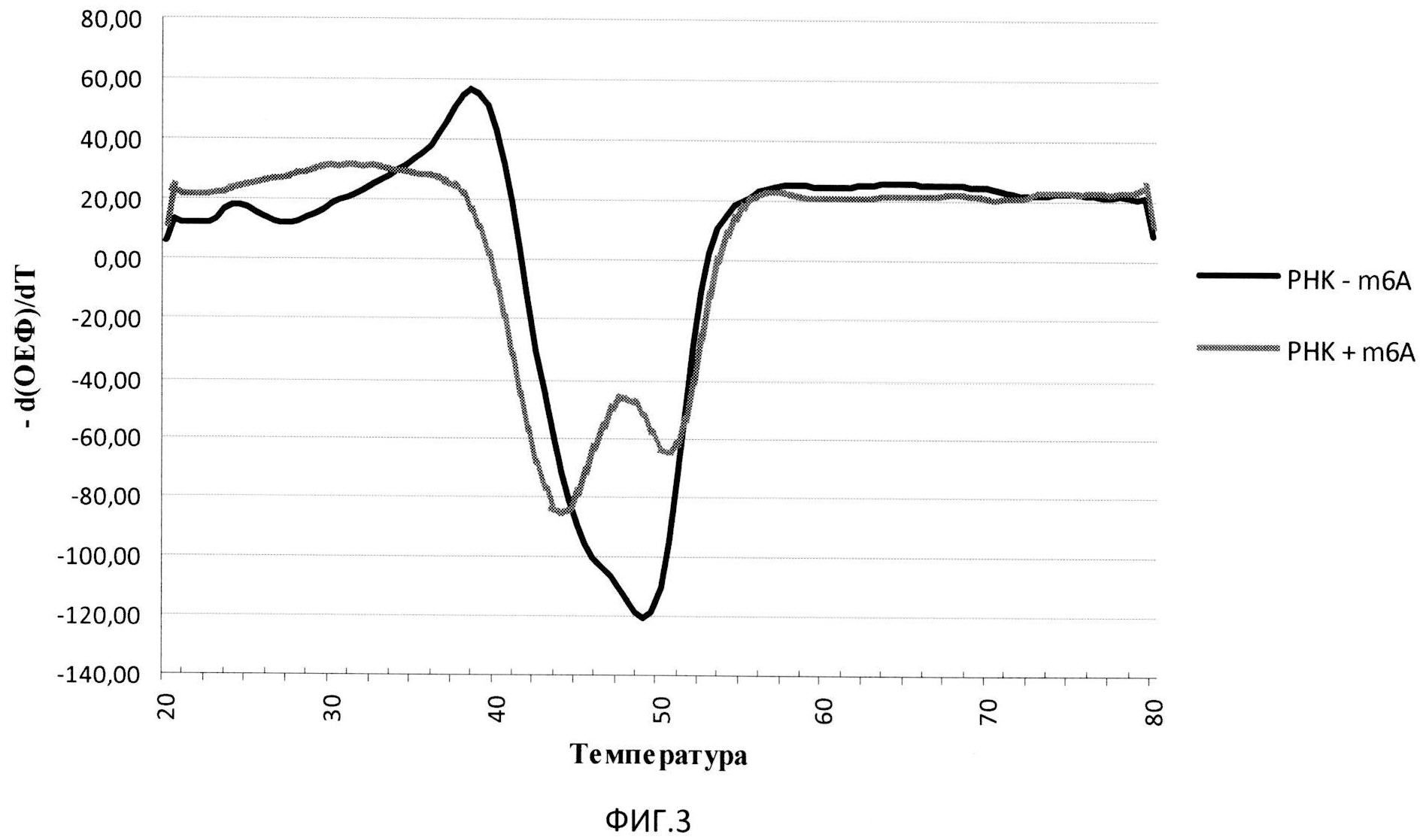
Изобретение поясняется чертежами, где на Фиг.1 представлена схема расположения олигонуклеотидов, содержащих флуорофор и тушитель флуоресценции, гибридизованных с местом модификации РНК; на Фиг.2 изображены кривые плавления РНК-ДНК дуплексов; на Фиг.3 представлены дифференциальные кривые плавления РНК-ДНК дуплексов.
Авторы настоящего изобретения установили, что после гибридизации в непосредственной близости друг от друга двух комплементарных исследуемой РНК олигонуклеотидных зондов, один из которых содержит флуоресцентную метку, а другой - тушитель флуоресценции (Фиг.1), по термодинамическим параметрам такой системы можно определить наличие или отсутствие модифицированного основания в том участке РНК, на котором гибридизован более короткий зонд. Термодинамические параметры оценивали качественно при медленном нагревании всей системы и постоянной детекции уровня флуоресценции. В тот момент, когда один из олигонуклеотидных зондов начинает первым диссоциировать, происходит увеличение расстояния между донором флуоресценции и тушителем, что приводит к скачкообразному росту интенсивности флуоресценции в системе. Такой скачок происходит для каждой пары зондов и РНК при конкретной температуре, которую считают температурой плавления дуплекса. В результате эксперимента получали графики зависимости уровня флуоресценции от температуры (кривые плавления), которые преобразовывали в кривые зависимости производных интенсивности флуоресценции по температуре от температуры (дифференциальные кривые). Те области кривых плавления, в которых рост флуоресценции происходит скачкообразно (т.е. наблюдается точка перегиба кривой), соответствуют пикам в дифференциальных кривых.
Согласно заявляемому изобретению олигонуклеотидный зонд, комплементарный исследуемой РНК в непосредственной области, содержащей анализируемый нуклеотид, должен иметь температуру плавления ниже температуры плавления второго зонда. При этом не имеет значения, какой из зондов модифицирован донором, а какой - тушителем флуоресценции. При сравнении параметров системы, содержащей модифицированную и немодифицированную РНК, в большинстве случаев наблюдается различие как в температуре плавления, так и в характере кривых плавления. Причем различия в температурах плавления могут быть и менее 1 градуса. Это обусловлено особенностями каждой отдельной системы, которая, в зависимости от наличия или отсутствия модификации, может стабилизироваться или дестабилизироваться за счет изменения в геометрии дуплекса и в характере связей между зондами и РНК в области исследуемого нуклеотида. Зонды могут представлять собой модифицированные олигорибонуклеотиды, олигодезоксирибонуклеотиды, могут также содержать в своем составе любые модификации, не влияющие на способность зондов к гибридизации.
Авторами были получены кривые плавления для систем с рибосомной РНК, которые содержали следующие модифицированные нуклеозиды: псевдоуридин Ψ, дигидроуридин D, метилированный по 6 положению аденозин m6А, метилированный по 7 положению гуанозин m7G, метилированные по 2'-O-гидроксилу рибозы нуклеозиды Bm. Из перечисленных модифицированных нуклеозидов с помощью предложенного метода были детектированы D, m6А и m7G, разница в температурах плавления с немодифицированными РНК составляла до 4 градусов, при этом характер кривых плавления при детекции m6А заметно изменялся, что упрощало анализ. Стоит отметить, что модифицированные нуклеозиды Ψ и Bm не вызывали заметного сдвига кривых плавления. По всей вероятности, псевдоуридин незначительно изменяет свое окружение по сравнению с уридином, и термодинамические параметры образуемых ими дуплексов в точности совпадают. Метилированные по рибозе нуклеозиды Вт, хоть и содержат дополнительную гидрофобную группу, что, несомненно, сказывается на структуре ДНК-РНК дуплекса, однако же не проявляют какие-либо особенности в ходе плавления предложенным методом.
Кроме того, оригинальным является и принцип подбора олигонуклеотидных зондов для реализации способа, которые комплементарны РНК в области предполагаемого модифицированного нуклеотида, и один из них содержит тушитель флуоресценции, а другой - донор флуоресценции.
Наилучший результат достигается при соблюдении совокупности следующих условий:
- для детекции модифицированного нуклеотида необходимо ровно два олигонуклеотидных зонда;
- один из используемых зондов должен быть комплементарен области исследуемой РНК так, чтобы в данной области находился изучаемый нуклеотид;
- зонд, комплементарный области РНК, содержащей изучаемый нуклеотид, должен иметь температуру плавления, заметно меньшую, чем температура плавления второго зонда (как минимум, на 5°С);
- второй из используемых зондов должен быть комплементарен исследуемой РНК в непосредственной близости к первому зонду так, чтобы не было перекрывания зондов, а также их ближайшие концы располагались на РНК не далее чем на 10 нуклеотидов;
- один из зондов должен быть модифицирован молекулой донора флуоресценции, а другой зонд должен быть модифицирован молекулой тушителя флуоресценции, причем при гибридизации зондов на РНК молекулы донора и тушителя флуоресценции должны располагаться на расстоянии не более чем на 10 нуклеотидов;
- пара донора и тушителя флуоресценции, используемая в настоящем изобретении, должна быть совместима, то есть диапазон волн испускаемого донором излучения должен как минимум частично перекрываться с диапазоном длин волн, поглощаемых тушителем;
- зонды могут состоять из рибонуклеотидов или дезоксирибонуклеотидов;
- зонды могут содержать любые модификации, не препятствующие проведению детекции.
Ниже представлено более подробное описание заявляемого способа.
Зонды по изобретению могут иметь длину от 8 до 35 нуклеотидов, причем зонд, комплементарный РНК в области исследуемого нуклеотида, должен иметь температуру плавления как минимум на 5°С ниже температуры плавления второго зонда. Один из зондов должен содержать ковалентно связанную с ним молекулу донора флуоресценции, а другой зонд из пары должен содержать ковалентно связанную с ним молекулу тушителя флуоресценции. В некоторых вариантах осуществления зонды могут содержать дополнительные, некомплементарные к последовательности РНК, нуклеотиды или их производные, а также могут содержать модифицированные межнуклеотидные связи.
Ниже представлена используемая в изобретении терминология.
Под термином «РНК» понимают рибонуклеиновую кислоту. В рамках настоящего изобретения объектом исследования является любая РНК природного происхождения.
Под термином «ДНК» понимают дезоксирибонуклеиновую кислоту. Олигонуклеотидные зонды чаще всего представляют собой именно ДНК.
Под термином «модифицированный нуклеотид» подразумевают нуклеотид, производный от одного из нуклеотидов, азотистое основание которых является урацилом, тимином, аденином, цитозином или гуанином, отличающийся от них наличием или отсутствием заместителей или характером образованных связей.
Под термином «штамм дикого типа» подразумевают фенотип присущий большинству особей природных популяций данного вида.
Под термином «РНК дикого типа» подразумевают РНК, выделенную из штамма дикого типа.
Под термином «мутантная РНК» подразумевают РНК, отличную от РНК дикого
типа.
Под термином «суммарная РНК» подразумевают набор из различных РНК, выделенных из клетки одновременно.
Под термином «рибосомная РНК» подразумевают рибонуклеиновую кислоту природного происхождения, которая входит в состав рибосом.
Под термином «матричная РНК» подразумевают рибонуклеиновую кислоту природного происхождения, содержащую информацию о первичной структуре (аминокислотной последовательности) белков.
Под термином «транспортная РНК» подразумевают рибонуклеиновую кислоту природного происхождения, функцией которой является транспортировка аминокислот к месту синтеза белка.
Под термином «олигонуклеотидные зонды» подразумевают олигорибонуклеотиды или олигодезоксирибонуклеотиды, которые специфически связываются с определенной последовательностью целевой РНК или ДНК. Олигонуклеотидные зонды часто содержат различные модификации, к примеру, молекулы донора флуоресценции, остаток фосфорной кислоты с изотопом 32Р, биотин и другие, в зависимости от дальнейших целей эксперимента. Соответствующие олигодезоксирибонуклеотиды были получены методом стандартного твердофазного синтеза.
Под термином «дуплекс» понимают структуру из двух цепей нуклеиновых кислот, образующую двухцепочечную спираль, удерживаемую, в основном, каноническими Уотсон-Криковскими взаимодействиями.
Под термином «гибридизация» понимают процесс избирательного связывания РНК и олигонуклеотидного зонда по принципу комплементарности. В экспериментальных условиях гибридизация происходит наиболее эффективно при сильном нагревании до 80°С с последующим медленным охлаждением до комнатной температуры.
В рамках настоящего изобретения под термином «плавление» подразумевают процесс нагревания гибридизованных нуклеиновых кислот до полной диссоциации с образованием индивидуальных молекул в растворе. Плавление нуклеиновых кислот, как и других полимеров, может происходить ступенчато, с образованием промежуточных устойчивых комплексов за счет перегруппировки нуклеотидных остатков и образования новых стабилизирующих связей, например водородных.
Под термином «температура плавления» подразумевают температуру, при которой структура кооперативно переходит в расплавленное состояние. У дуплексов, образованных нуклеиновыми кислотами, может наблюдаться несколько таких точек кооперативного перехода. В рамках настоящего изобретения при плавлении структуры наблюдается резкое разгорание флуоресценции, которое указывает на единовременный переход дуплекса, образованного более коротким олигонуклеотидом, в расплавленное состояние.
Под «последовательностью РНК» в настоящем описании понимают полимерную последовательность рибонуклеотидов и их производных. Нуклеотид - это сахар, к 5'-атому углерода которого присоединена фосфатная группа, а к 1' атому углерода присоединено азотистое основание. Сахаром является рибоза или дезоксирибоза (в РНК и ДНК соответственно). Основаниями могут быть аденин, гуанин, тимин, урацил и цитозин, а также их производные. В последовательность зондов могут быть включены ароматические группы, не являющиеся указанными основаниями.
Под термином «нуклеотид» в настоящем описании понимают нуклеотиды, которые могут быть природными нуклеотидами (например, АТР, ТТР, GTP, СТР, UTP) или модифицированными нуклеотидами. Модифицированные нуклеотиды относятся к нуклеотидам, содержащим основания, такие как, например, аденин, гуанин, цитозин, тимин и урацил, ксантин, инозин, и квеуозин, которые были модифицированы заменой или добавлением одного или нескольких атомов или групп. Некоторые примеры вариантов модификаций, которые могут содержать нуклеотиды, основные группы которых модифицированы, включают, но ими не ограничиваются, алкилированные, галогенированные, тиолированные, аминированные, амидированные или ацетилированные основания, в различных сочетаниях. Более конкретные примеры включают 5-пропинилуридин, 5-пропинилцитидин, 6-метиладенин, 6-метилгуанин, N6,N6-диметиладенин, 2-пропиладенин, 2-пропилгуанин, 2-аминоаденин, 1-метилинозин, 3-метилуридин, 5-метилцитидин, 5-метилуридин и другие нуклеотиды, имеющие модифицикации в 5 положении, 5-(2-амино)пропилуридин, 5-галогенцитидин, 5-галогенуридин, 4-ацетилцитидин, 1-метиладенозин, 2-метиладенозин, 3-метилцитидин, 6-метилуридин, 2-метилгуанозин, 7-метилгуанозин, 2,2-диметилгуанозин, 5-метиламиноэтилуридин, 5-метилоксиуридин, деазануклеотиды, такие как 7-деаза-аденозин, 6-азоуридин, 6-азоцитидин, 6-азотимидин, 5-метил-2-тиоуридин, другие тио-основания, такие как 2-тиоуридин и 4-тиоуридин и 2-тиоцитидин, а также дигидроуридин, псевдоуридин, квьюозин, нафтил и замещенные нафтиловые группы, любые О- и N-алкилирующие пурины и пиримидины, такие как N6-метиладенозин, 5-метилкарбонилметилуридин, уридин 5-оксиуксусная кислота, пиридин-4-он, пиридин-2-он, фенил и модифицированные фенильные группы, такие как аминофенол или 2, 4, 6-триметоксибензол, 8-замещенные аденины и гуанины, 5-замещенные урацилы и тимины, азапиримидины, карбоксигидроксиалкильные нуклеотиды, карбоксиалкиламиноалкильные нуклеотиды и алкилкарбонилалкилированные нуклеотиды. Модифицированные нуклеотиды также включают нуклеотиды, которые модифицированы по сахарной группе (например, 2'-фтор или 2'-O-метил нуклеотиды), а также нуклеотиды, имеющие сахара или их аналоги, которые не являются рибозилом. Например, сахарные группы могут быть, или могут быть основаны на маннозе, арабинозе, глюкопиранозе, галактопиранозе, 4'-тиорибозе и других сахарах, гетероциклах или карбоциклах. Термин «нуклеотид» также обозначает универсальное основание. В качестве примера, универсальные основания включают, но ими не ограничиваются, 3-нитропиррол, 5-нитроиндол или небуларин. Модифицированные нуклеотиды включают меченные нуклеотиды, такие как нуклеотиды, меченные радиоактивной меткой, флуоресцентной меткой, молекулой тушителя флуоресценции, ферментом или пигментом.
Под «модифицированными межнуклеотидными связями» понимают все модифицированные межнуклеотидные связи, известные в данной области и которые специалист в данной области сочтет возможными для использования в контексте настоящего изобретения. Модификации межнуклеотидных связей включают, но ими не ограничиваются, фосфоротиоаты, фосфородитиоаты, метилфосфонаты, 5'-алкиленфосфонаты, 5'-метилфосфонат, 3'-алкиленфосфонаты, эфираты трехфтористого бора, сложные эфиры бора и фосфорной кислоты и селенофосфаты 3'-5' связи или 2'-5' связи, фосфотриэфиры, тионоалкилалкилфосфотриэфиры, гидрофосфорные связи, алкилфосфонаты, алкилфосфонотиоаты, арилфосфонотиоаты, фосфороселеноата, фосфородиселеноаты, фосфинаты, фосфорамидаты, 3'-алкилфосфорамидаты, аминоалкилфосфорамидаты, тионофосфорамидаты, фосфоропиперазидаты, фосфороанилотиоаты, фосфороанилидаты, кетоны, сульфоны, сульфонамиды, карбонаты, карбаматы, метиленгидразо, метилендиметилгидразо, формацетали, тиоформацетали, оксимы, метиленимины, метиленметилимины, тиоамидаты, связи с рибоацетиловыми группами, аминоэфир глицина, силиловые или силоксановые связи, алкил или циклоалкильные связи с или без гетероатомов, например, от 1 до 10 углеродов, которые могут быть замещенными или незамещенными и/или замещенными и/или содержать гетероатомы, связи с морфолиноструктурами, амиды, полиамиды, где основания могут быть присоединены к аза-азоту основной цепи напрямую или не напрямую, и сочетания таких модифицированных межнуклеотидных связей.
В изобретении, согласно заявляемому решению, зонды могут быть связаны с конъюагатами, придающими им дополнительные свойства. Конъюгаты могут включать, но ими не ограничиваться, например, аминокислоты, пептиды, полипептиды, белки, антитела, антигены, токсины, гормоны, липиды, нуклеотиды, нуклеозиды, сахара, углеводороды, полимеры, такие как полиэтиленгликоль и полипропиленгликоль, а также аналоги или производные всех этих классов веществ, холестерин, фосфолипиды, ди- и триацилгицеролы, жирные кислоты, углеводороды, которые необязательно содержат заместители, ферменты, биотин, дигоксигенин и полисахариды.
Зонды должны содержать ковалентно присоединенную молекулу флуорофора или тушителя. Используемые флуорофоры могут включать, но ими не ограничиваться: FAM, ROX, Alexa Fluor, TAMRA, BODIPY, производные цианина, такие как Су3 или Су5 Dabsyl, или другие подходящие флуорофоры, известные из уровня техники. Используемые тушители могут включать, но ими не ограничиваться: все производные BHQ, Qxl, Iowa black FQ, Iowa black RQ, IRDye QC-1. Такие конъюгаты могут быть присоединены к любому концу олигонуклеотида, а также к любому промежуточному нуклеотиду, если расстояние между двумя конъюгатами гибиридизованных зондов не превышает 10 нуклеотидов.
Для выполнения настоящего метода зонды могут быть синтезированы любым способом, известным в данной области. В одном из вариантов осуществления, зонды могут быть получены химическим синтезом олигонуклеотидов и/или лигированием коротких олигонуклеотидов.
Изобретение может быть использовано для обнаружения РНК, принадлежащей некоторым патогенам, устойчивым, например, к макролидным антибиотикам. Такие способы возможно применять в клинических условиях для выявления в РНК патогенов модификаций, обеспечивающих устойчивость к антибиотикам, в частности, для обнаружения диметилирования нуклеотида А2058 23S рибосомной РНК бактерий, приводящего к их устойчивости к антибиотикам макролидного ряда, например эритромицин.
Изобретение поясняется конкретными вариантами осуществления, которые не предназначены для ограничения заявленного технического решения.
Этап 1. Синтез олигодезоксирибонуклеиновых зондов.
Синтез олигодезоксирибонуклеиновых зондов по изобретению осуществляли по стандартной методике на твердофазном носителе (Oligonucleotide Synthesis, M.J.Gait ed., 1984; Sambrook, Fntsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989).
Зонды, содержащие на 5'-конце флуорофор FAM, были получены методом автоматического твердофазного синтеза на синтезаторе MerMade 48 с использованием в качестве реагентов амидофосфитов нуклеозидов. В качестве носителя был использован полимер на основе SiO2 с контролируемым размером пор (CPG - Controlled Pore Glass, GlenResearch). Колонки с носителем содержали первый нуклеотид зонда, присоединенный к аминопропиловой группе на поверхности носителя с помощью сукцинильного линкера, связывающего аминогруппу и 3'-гидроксильную группу нуклеотида. На каждом цикле реакции детритилировали продукт, затем проводили наращивание цепи активированным амидофосфитом. Не вступившие в реакцию 5'-гидроксильные группы растущей цепи блокировали смесью уксусного ангидрида и 1-метилимидазола, а связанный на подложке продукт обрабатывали водным раствором йода и пиридина. На завершающей стадии с полученного олигонуклеотида снимали защитную группировку DMT 2% трихлоруксусной кислотой в дихлорметане и модифицировали полученный олигонуклеотид амидитом 6-FAM. Олигонуклеотиды снимали с полимерной подложки насыщенным раствором аммиака при 55°С в течение 3 часов, а также удаляли защитные группировки.
Для твердофазного синтеза зондов с молекулой тушителя на 3'-конце использовали стандартный полимер 3'-BHQ-1 CPG (стекло с контролируемым размером пор и с модификацией BHQ1, GlenResearch). Таким образом, на первом же цикле синтеза продукт уже содержал молекулу тушителя BHQ1. Синтез олигонуклеотидов, содержащих тушитель, производили стандартным описанным выше методом.
Полученные олигонуклеотиды очищали путем электрофоретического разделения продуктов реакции в полиакриламидном геле.
Этап 2. Выделение и очистка РНК
Для получения суммарной РНК по изобретению, пригодной для анализа методом плавления, проводили следующие процедуры:
Клетки исследуемых штаммов высевали со стоков штрихом до образования отдельных колоний на агаризованную среду, инкубировали ночь при 37°С, затем отдельные колонии переносили в 1 мл LB ночной культуры и снова инкубировали при интенсивном встряхивании в течение ночи при 37°С.
30 мкл ночной культуры инокулировали в 30 мл LB. Клеткам давали вырасти до достижения оптической плотности А600=0.6 и остужали во льду при 4°С в течение 20 мин. Клетки собирали центрифугированием при 6000 об/мин в роторе JA10 в течение 10 мин, промывали буфером А (20 мМ Hepes-KOH рН 7.5, 6 мМ Mg(OAc)2, 150 мМ NH4Cl, 4 мМ β-меркаптоэтанол, 0,05 мМ спермин, 2 мМ спермидин) и снова центрифугировали при 6000 об/мин.
Полученные влажные клетки можно замораживать в жидком азоте и хранить при Т=-80°С.
Осажденные клетки ресуспендировали в 1 мл холодного буфера А и разрушали ультразвуком (6 раз по 30 сек). Дебрис отделяли центрифугированием при 15000 об/мин в течение 40 мин в роторе JA-20. Супернатант декантировали, и к нему добавляли равный объем буфера для экстракции В (300 mM NaOAc, 25 mМ H3BO3 рН 7.0, 0.5 mM SDS, 5 мМ EDTA). К раствору добавляли 1 объем фенола, интенсивно взбалтывали в течение минимум 30 сек, центрифугировали в настольной центрифуге при 13000 об/мин в течение 10 минут. Верхнюю, водную, фазу отбирали и снова экстрагировали 1 объемом фенола, а затем - 1 объемом смеси фенола и хлороформа в соотношении 1:1. К водной фазе добавляли 3 объема этанола и осаждали при -20°С в течение часа. Осадки центрифугировали в настольной центрифуге при 13000 об/мин в течение 10 минут, а затем сушили в вакуумном испарителе или на воздухе. Полученные осадки суммарных РНК растворяли в смеси из 50 мкл деионизированной воды и 50 мкл буфера В, а затем экстрагировали смесь фенолом и снова осаждали РНК тремя объемами этанола при -20°С в течение 1 часа. Осадки растворяли в 50 мкл деионизированной воды и оценивали концентрацию рРНК спектрофотометрически при длине волны 260 нм.
Концентрацию суммарной рРНК рассчитывали, исходя из ее доли в смеси суммарной клеточной РНК (которая составляет 0,8), по формуле:
OD260[о.е./мл]∗0,0258[нмоль/ое]∗0,8=с(рРНК)[пмоль/мкл]
Полученные растворы суммарной рРНК в аликвотах по 10 мкл замораживали в жидком азоте и хранили при температуре -80°С.
Этап 3. Получение и анализ кривых плавления
Для проведения детекции модифицированных нуклеотидов путем плавления дуплексов, образованных РНК и двумя зондами с флурофором и тушителем флуоресценции, поводили следующие действия:
Смешивали в плашках с оптически прозрачными крышками: 4 пмоль суммарной РНК; 2 пмоль олигонуклеотида с донором флуоресценции FAM; 4 пмоль олигонуклеотида с тушителем флуоресценции BHQ1; 2 мкл 5хбуфера для гибридизации С (250 мМ Tris-НСl рН 8.3, 200 мМ КСl) и добавляли деионизированную воду до 10 мкл. После перемешивания на смесь сверху наслаивали по 5 мкл минерального масла. Плашку помещали в прибор для ПЦР реального времени CFX96 (Bio-Rad) и проводили гибридизацию/плавление в следующей последовательности: нагревали до 80°С в течение 3 мин, охлаждали до 20°С со скоростью 37 мин, а затем нагревали смесь до 80°С со скоростью 0.5°/30 сек с одновременной детекцией интенсивности флуоресценции на каждом шаге стадии нагревания.
Этап 4. Анализ данных, полученных в результате плавления. В результате эксперимента получали графики зависимости уровня флуоресценции от температуры (кривые плавления, Фиг.2), которые преобразовывали в кривые зависимости производных интенсивности флуоресценции по температуре от температуры (дифференциальные кривые, Фиг.3). Анализу подвергали дифференциальные кривые плавления исследуемых дуплексов, в которых отмечают температуры, соответствующие пикам на кривых.
Разгорание флуоресценции, которое соответствует денатурации более короткого олигонуклеотида, выражается в виде точки перегиба на кривой плавления, которая соответствует пику на дифференциальной кривой. Сравнение структуры РНК проводят путем сравнения температур, соответствующих пикам на дифференциальных кривых, а также путем сравнения характера кривых плавления. В случае, если характер кривых и/или температура плавления не совпадают для контрольной и исследуемой РНК, делают вывод о различной структуре РНК в области исследуемого нуклеотида.
Заявляемый способ имеет ряд преимуществ перед другими методами определения модификаций. Во-первых, он является универсальным, то есть подходит для обнаружения различных типов модификаций РНК. Во-вторых, способ позволяет детектировать наличие модификаций, которые не препятствуют образованию Уотсон-Криковских пар между нуклеотидами и не обладают специфическими химическими свойствами, что крайне выгодно отличает заявленных способ от большинства альтернативных способов. В-третьих, метод крайне простой и быстрый, так как предполагает лишь смешение компонентов и дальнейший анализ в течение не более 2 часов. В-четвертых, заявляемый способ не требует больших материальных затрат на выполнение анализа.
Таким образом, заявляемое изобретение может быть использовано для научно-исследовательских целей, таких, как поиск новых ферментов, отвечающих на формирование известных модификаций, для оценки уровня модифицирования природных РНК в различных условиях, а также при диагностике антибиотикоустойчивости патогенов, где способ предусматривает обнаружение РНК, принадлежащей некоторым бактериям, устойчивым, например, к макролидным антибиотикам.