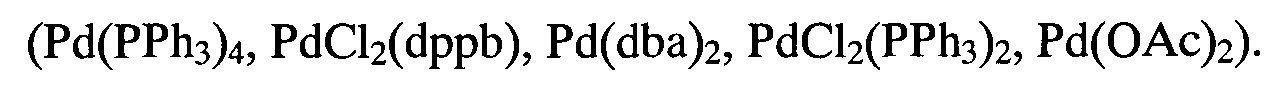Результат интеллектуальной деятельности: СИНТЕЗ НОВОГО КЛАССА ФТОРСОДЕРЖАЩИХ ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ С ИСПОЛЬЗОВАНИЕМ ХЛАДОНА 114В2 В КАЧЕСТВЕ ИСХОДНОГО СОЕДИНЕНИЯ
Вид РИД
Изобретение
В изобретении предлагаются новые вещества и способ их синтеза. Объекты являются термотропными жидкими кристаллами, содержащими четырехатомные «мостиковые» фрагменты -CH2CF2CF2S-, -CH=CFCF2S-, -C≡CCF2S-
Изобретение относится к области органической химии, в частности к неизвестному ранее типу жидкокристаллических соединений, и включает в себя как новые химические соединения, так и способы их получения. Полученный класс жидкокристаллических веществ содержит в своей химической структуре ранее не описанный (не использованный для получения жидкокристаллических соединений) в литературе четырехатомный «мостиковый» фрагмент -CH2CF2CF2S-, -CH=CFCF2S-, -C≡CCF2S-.
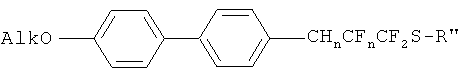
Изобретение включает соединения с общей формулой
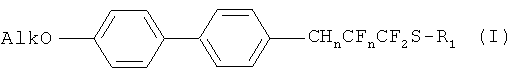
в которой
Alk представляет собой алкильный заместитель: C4H9, C6H13, C10H21, C15H31, C18H37;
R1 представляет собой арильный заместитель 4-CH3C6H4; n=0,1 или 2;
CHnCFn представляет из себя фрагмент: при n=2 CH2-CF2, при n=1 CH=CF, при n=0 C≡C.
Соединения, описанные формулой I, представляют собой:
4-Бутокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4-Гексокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4-Децокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4-Пентадецокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4-Октадецокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4-Бутокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
4-Гексокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
4-Децокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
4-Пентадецокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
4-Октадецокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
4-Бутокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил;
4-Гексокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил;
4-Децокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил;
4-Октадецокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил.
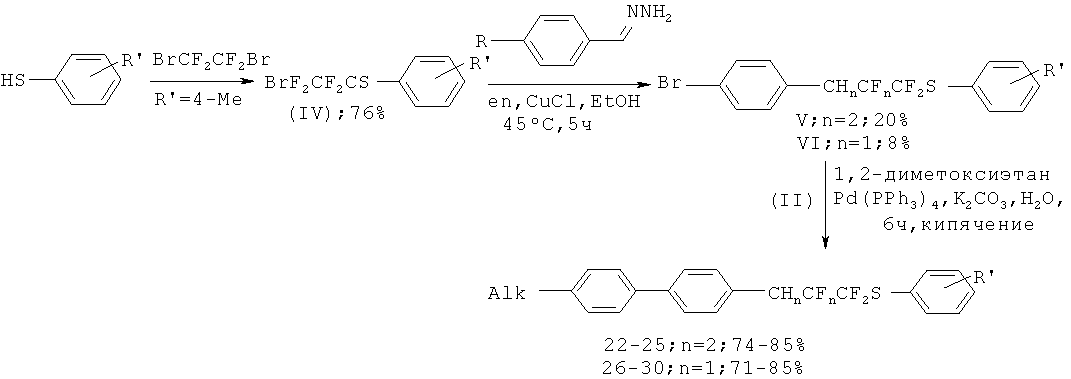
Способ получения соединений общей формулы (I) могут быть получены способом, где Alk представляет собой С4Н9, C6H13, C10H21, C15H31, C18H37, R1 представляет собой 4-CH3C6H4, при этом гидразон пара-бромбензальдегида вводят во взаимодействие с 2-бром-1,1,2,2-тетрафторэтил 4-метилфенил сульфидом в присутствии основания этилендиамина и катализатора хлорида меди (I) в этаноле при 30-45°С в течение 5 ч с образованием смеси 3-(4-Бромфенил)-1,1,2,2-тетрафторпропил 4-метилфенил сульфида и 3-(4-Бромфенил)-1,1,2-трифторпроп-2-ен-1-ил 4-метилфенил сульфида, затем каждое полученное вещество по отдельности вводится в реакцию кросс-сочетания с 4-алкилоксиборными кислотами в течение 6 ч, с использованием 1,2-диметоксиэтана в качестве растворителя, водного раствора неорганического основания, и палладиевый катализатор (Рd(РРh3)4, PdCl2(dppb), Pd(dba)2, PdCl2(PPh3)2, Pd(OAc)2).
Способ получения соединений общей формулы (I), где n=0, Alk представляет собой С4Н9, C6H13, C10H21, C18H37, R1 представляет собой 4-CH3C6H4 при этом гидразон иорд-бромбензальдегида вводят во взаимодействие с 2-бром-1,1,2,2-тетрафторэтил 4-метилфенил сульфидом в присутствии основания этилендиамина и катализатора хлорида меди (I) в этаноле при 30-45°С в течение 5 ч с образованием смеси 3-(4-Бромфенил)-1,1,2,2-тетрафторпропил 4-метилфенил сульфида и 3-(4-Бромфенил)-1,1,2-трифторпроп-2-ен-1-ил 4-метилфенил сульфида, после чего первое из двух полученных веществ (n=2) вводится в реакцию кросс-сочетания с 4-алкилоксиборными кислотами, в течение 6 ч, с использованием 1,2-диметоксиэтана в качестве растворителя, водного раствора неорганического основания, и палладиевый катализатор (Pd(PPh3)4, PdCl2(dppb), Pd(dba)2, PdCl2(PPh3)2, Pd(OAc)2), затем для каждого соединения осуществляют реакцию элиминирования фтороводорода 1.0 М раствором в ТГФ гексаметилдисилазида натрия при -80°С в течение 1-3 ч.
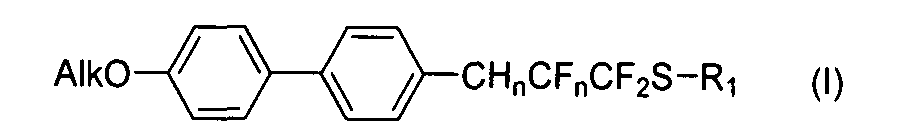
Все соединения данного типа ранее не были описаны в литературе. Их ближайшими аналогами являются молекулы линейного строения (каламитного типа), содержащие в своей структуре мостиковые фрагменты CF2-CF2 или O-CF2 и имеющие как минимум три циклических мезогенных фрагмента (циклогексильное или бензольное кольцо). Получение таких соединений подробно описано в следующих литературных источниках [Патент, Chisso Corporation, US 6319570, 2001; патент, Chisso Corporation, US 6001275, 1999; патент UBE INDUSTRIES, LTD., US 2010/99909, 2010; патент, MERCK PATENT GMBH, WO 2007/147516, 2007; P.Kirsch, M.Lenges, A.Ruhl, D.V.Sevenard, G.-V.Roeschenthaler, Journal of Fluorine Chemistry; 125, 6, 2004, 1025-1030]. Известно, что введение в молекулу «фторных мостиков» типа CF2-CF2 или О-СF2 сильно изменяет свойства веществ. Хотя температура перехода в ЖК фазу у таких соединений немного выше, чем у нефторированных аналогов, однако диапазон существования мезофаз становится значительно шире [Р.Kirsch, M.Bremer, F.Huber, H.Lannert, A.Ruhl, M.Lieb, T.Wallmichrath.J. Am. Chem. Soc., 2001, 123, 5414-5417; E.Bartmann, Adv. Mater., 1996, 8, 570-573; P.Kirsch, M.Bremer, A.Taugerbeck, T.Wallmichrath, Angew. Chem. Int. Ed., 2001, 40, 1480-1484], кроме того повышается диэлектрическая анизотропия Δε. Самыми близкими к полученным являются соединения представленные на рисунке.
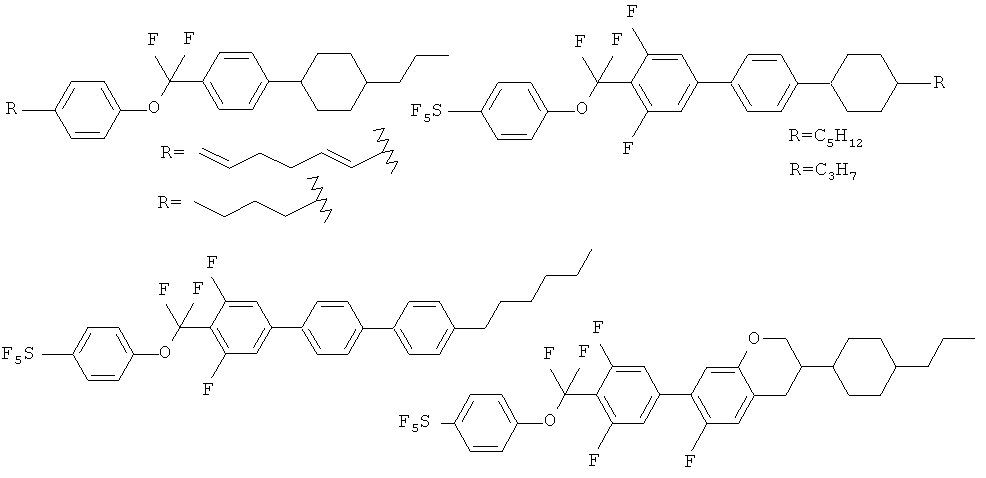
Соединения данного типа обладают широкими диапазонами существования ЖК-фазы, но основными недостатками являются: низкие выходы при получении таких веществ (не превышают 25-30%), применение фторирующих агентов, из-за сложных субстратов на стадии реакции кросс-сочетания выходы часто падают ниже 50%. С точки зрения жидкокристаллических свойств некоторые вещества имеют достаточно широкие диапазоны существования мезофаз, но температуры перехода в ЖК-фазу достаточно высокие (60-80°С). Тем не менее их применение в смесях (10-20 компонентов) целесообразно, так как образуются ЖК-материалы с нужной температурой просветления (попадают в желательный диапазон 70-120°С).
Хладон 114В2 (1,2-дибромтетрафторэтан) является дешевым соединением и благодаря наличию в своей химической структуре двух атомов брома достаточно реакционно-способен. Таким образом, за счет этого становится возможно внедрять фрагмент CF2-CF2 в структуру органических соединений.
Номера целевых соединений для ссылки на них и идентификации ниже в тексте будут обозначаться арабскими цифрами, при этом общая формула целевых соединений обозначается римской цифрой (I).
Соединения общей формулы (I) могут быть получены как применением или приспособлением известных способов (т.е. способов, используемых для этой цели или описанных в литературе), так и новыми методами, описанными в данном изобретении.
Согласно данному изобретению получение соединений происходит в несколько стадий и включает получение промежуточных продуктов. Нумерация промежуточных продуктов будет осуществляться римскими цифрами (от (II) и далее).
В качестве исходных соединений используются хладон 114В2 (1,2-дибромтетрафторэтан), различные алкилбромиды, пара-бромфенол, пара-бромбензальдегид. Рассматриваемый способ получения соединений включает в себя получение соответствующих борных кислот (II), описанных в литературе. На первой стадии проводится взаимодействие пара-бромфенола с алкилбромидом согласно [G.W.Gray, M.Hird, D.Lacey, К.J.Toyne, J. Chem. Soc., Perkin Trans. 2, 1989, 2041-2053;. Kwiatkowski, J. Chattopadhyaya, Acta Chem. Scand., 1984, B38, 657-671]. Получающиеся замещенный бром-бензол литиируется и обрабатывается триметилборатом с дальнейшим добавлением разбавленного раствора соляной кислоты согласно [С.M.Marson, L.D.Farrand, R.Brettle, D.A.Dunmur, Tetrahedron, 2003, 59, 4377-4381].
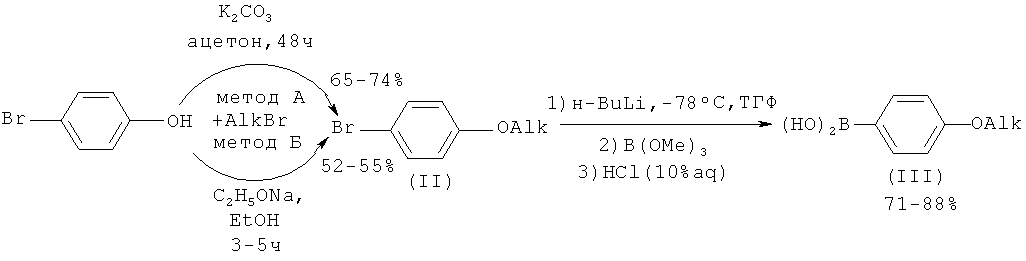
Получение целевых соединений можно осуществить следующим способом.
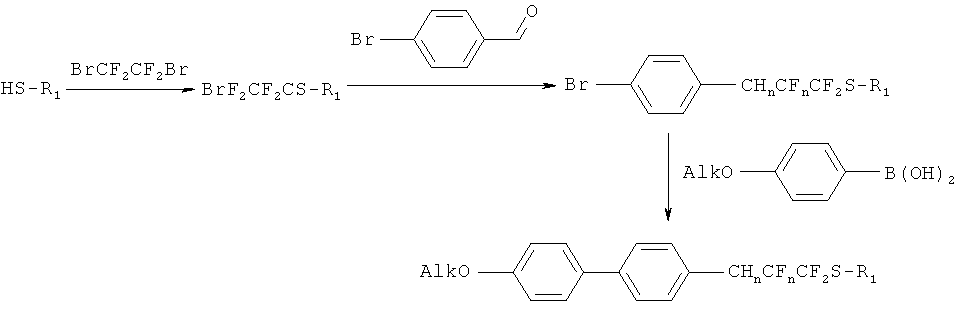
В данном изобретении также рассматривается способ элиминирования одной или двух молекул HF в соединениях типа (I), у которых n=1,2 (т.е. имеют фрагменты СН2-СF2 и CH=CF).
Исходным соединением для синтеза является (IV), которое может быть получено по методике [F.Toulgoat, В.R.Langlois. M.Medebielle, J.-Y. Sanchez, J. Org. Chem., 2007, 72, 9046-9052].
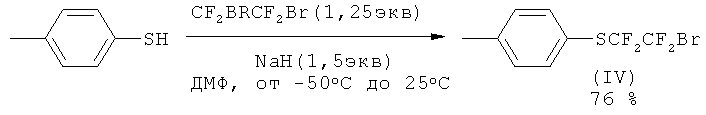
Далее соединение (IV) вводили в реакцию с in situ приготовленным гидразоном пара-бромбензальдегида (ТСХ контроль, элюент - CH2Cl2). Катализатором процесса выступает хлорид меди (I), основанием - этилендиамин. Растворитель - этанол. В результате реакции образуется смесь алкана (IX) и алкена (X).
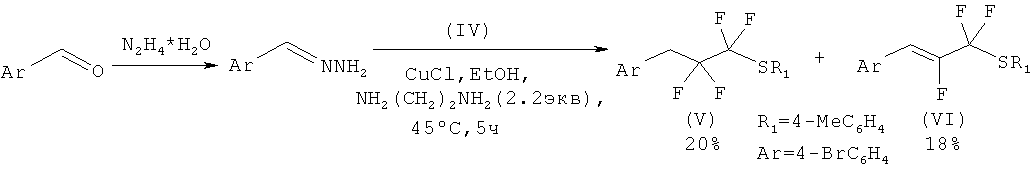
Полученный алкан (V) сравнительно легко отделяются от соответствующего алкена (VI) колоночной хроматографией (Rf последнего немного больше). Несмотря на невысокие выходы следует учесть, что данный подход является очень простым в экспериментальном исполнении, не требует использования инертной атмосферы, не вносит ограничения на функциональные группы, а исходные реагенты являются очень дешевыми.
Алкан (V) и алкен (VI) вводят в реакцию кросс-сочетания с арилборными кислотами (II) и тетракис-(трифенилфосфино)палладием Рd(РРh3)4 (5 мол %) в 1,2-диметоксиэтане с водным раствором карбоната калия. Реакционную смесь кипятили в атмосфере аргона в течение 6 ч и оставляли на ночь при комнатной температуре. В результате образуются целевые соединения 1-10.
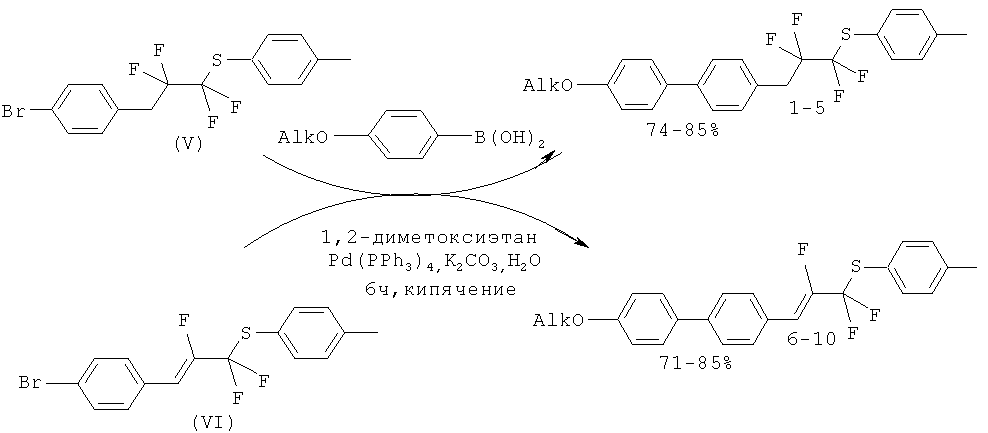
|
Общую схему получения целевых продуктов можно представить следующим образом.
Соединения с тройной связью 11-14 получают действием гексаметилдисилазидов натрия на соответствующие алканы. Гексаметилдисилазид натрия является универсальным реагентом и приводит к высоким выходам всегда, в отличие от гексаметилдисилазида лития. Под действием 3 эквивалентов NaNTMS2 при -80°С целевые алкины образуются с высокими выходами, при этом в реакционной смеси не остается промежуточного алкена и очистку продукта можно проводить флеш-хроматографией. Другие методы, такие как использование щелочей, тpeт-бутилата калия и литийдиизопропиламида не позволяют получить искомые соединения.
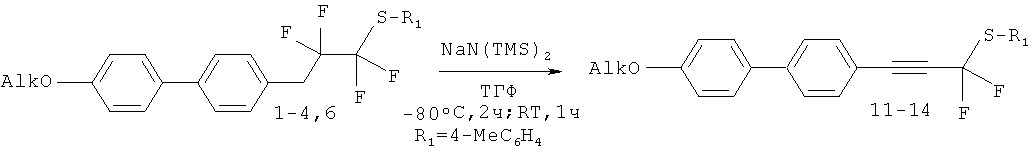
|
Смесь 3-(4-Бромфенил)-1,1,2,2-тетрафторпропил 4-метилфенил сульфида и 3-(4-Бромфенил)-1,1,2-трифторпроп-2-ен-1-ил 4-метилфенил сульфида.
К раствору пара-бромбензальдегида (20 ммоль) в EtOH (40 мл) добавляли по каплям при перемешивании раствор гидразин-гидрата (1,2 мл, 20 ммоль) в EtOH (20 мл) и оставляли при перемешивании до исчезновения исходного альдегида (контроль ТСХ). Далее в реакцию добавляли свежеприготовленный CuCl (200 мг, 2 ммоль) и 1,2-этилендиамин (3.0 мл, 44 ммоль) и через 10 мин прибавляли по каплям 2-бром-1,1,2,2-тетрафторэтил 4-метилфенил сульфид (IV) (22 ммоль) при комнатной температуре. Реакционную смесь перемешивали 3 ч при комнатной температуре, 3 ч при 45°С, разлагали водным раствором соляной кислоты (5%) (300 мл) и экстрагировали СН2Сl2 (100 мл×3). Экстракт сушили над сульфатом натрия, упаривали хлористый метилен в вакууме роторного испарителя и остаток очищали методом колоночной хроматографии (элюент гексан или гексан:СН2Сl2 - 2:1).
3-(4-Бромфенил)-1,1,2,2-тетрафторпропил 4-метилфенил сульфид (V)
Очистка колоночной хроматографией (элюент гексан). Белое кристаллическое вещество, выход 19%, т.пл. 89.2-91.2°С. Rf (гексан) 0.6. Спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 2.41 (с, 3Н, СН3), 3.34 (т, 2Н, CH 2-CF2, J=18.32 Гц), 7.19 (д, 2Н, Ar, J=8.34 Гц), 7.24 (д, 2Н, Ar, J=8.08 Гц), 7.50 (д, 2Н, Ar, J=8.34 Гц), 7.56 (д, 2Н, Ar, J=8.08 Гц). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.): -88.03 (т, J=3.4 Гц, CF 2-S), -110.65 (тт, JH-F=18.3 Гц, J=3.4 Гц, CF 2-CH2). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 21.28, 36.74 (т, CH2CF2, 2JCF=22.7 Гц), 117.34 (тт, СF2, 1JCF=253.2 Гц, 2JCF=32.9 Гц), 120.16, 122.03, 124.36 (тт, CF2, 1JCF=287.6 Гц, 2JCF=35.9 Гц), 129.27, 130.03, 131.56, 132.42, 137.09, 141.01. Найдено (%): С, 48.81; Н, 3.24. C16H13BrF4S. Вычислено (%): С, 48.87; Н, 3.33.
3-(4-Бромфенил)-1,1,2-трифторпроп-2-ен-1-ил 4-метилфенил сульфид (VI)
Получен в виде смеси Z/E изомеров 97:3. Очистка колоночной хроматографией (элюент гексан). Белое кристаллическое вещество, выход 18%, т.пл. 73.6-74.8°С. Rf (гексан) 0.7. ИК-спектр (ν, см-1): 1380,1470, 1600, 1700 (С=С) см-1.
Z-изомер: спектр 1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 2.38 (с, 3Н, СН3), 5.97 (д, 1Н, CH=CF, J=35.4 Гц), 7.19 (д, 2Н, Ar, J=7.83 Гц), 7.34 (д, 2Н, Ar, J=8.34 Гц), 7.48-7.55 (m, 4H, Ar). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.): -80.28 (д, J=19.4 Гц, СF 2-S), -123.13 (дт, JH-F=35.5 Гц, J=19.4 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 21.22, 109.30, 122.25, 122.76 (тд, CF2-CF, 1JCF=278.2 Гц, 2JCF=38.8 Гц), 123.07, 129.97, 130.75 (д, JCF=6.8 Гц), 131.82, 132.39, 136.70, 140.85, 149.36 (дт, CF-CF2, 1JCF=267.3 Гц, 2JCF=30.4 Гц).
Е-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 6.53 (д, 1Н, CH=CF, J=21.5 Гц), 7.24 (д, 2Н, Аr, J=7.83 Гц). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.): -76.00 (д, J=18.1 Гц, CF 2-S), -114.81 (т, J=18.3 Гц, CF=CH). Остальные спектральные данные совпадают с основным изомером.
Найдено (%): С, 52.09; Н, 3.54. C16H12BrF3S. Вычислено (%): С, 51.49; Н, 3.24.
Пример 1: 4-Бутокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
В колбу на 100 мл, заполненную аргоном, снабженную кран-пробкой и обратным холодильником помещали раствор пара-бутоксиборной кислоты (II) (1.5 ммоль) и 1 ммоль соединения VIII в 25 мл 1,2-диметоксиэтана, дегазирововали и в дальнейшем проводили реакцию в атмосфере аргона. К раствору прибавляли каталитическое количество палладиевого катализатора (Рd(РРh3)4, PdCl2(dppb), Pd(dba)2, PdCl2(PPh3)2 Pd(OAc)2) (0.05 ммоль) и раствор неорганического основания (NaOH, КОН, К2СО3, Nа2СО3, СsСО3) (6 ммоль) в воде (2.5 мл), полученную смесь кипятили с обратным холодильником 6 ч и оставляли на ночь при перемешивании (комнатная температура). Растворитель упаривали в вакууме роторного испарителя, остаток очищали методом колоночной хроматографии (элюент гексан:СН2Сl2 - 8:1). Белое кристаллическое вещество, выход 81%, т.пл. 110.7-112.2°С. Rf (гексан: CH2Cl2 - 8:1) 0.3. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 1.03 (т, 3Н, СН3, J=6.95 Гц), 1.55 (м, 2Н, СН2 CH 2СН2, J=7.07 Гц), 1.82 (м, 2Н, СН3 СН 2CH2, J=6.06 Гц), 2.42 (с, 3Н, СН3), 3.41 (т, 2Н, CH2-CF2, JHF=18.44 Гц), 4.04 (т, 2Н, СН2O, J=6.08 Гц), 7.00 (д, 2Н, Аr, J=7.83 Гц), 7.25 (д, 2Н, Аr, J=7.07 Гц), 7.37 (д, 2Н, Аr, J=7.07 Гц), 7.47-7.63 (м, 6Н, Аr). Спектр 19F ЯМР (377 МГц, СDCl3, δ, м.д.): -88.04 (т, J=3.4 Гц, СF 2-S), -110.64 (тт, JH-F=18.6 Гц, J=3.4 Гц, СF 2-CH2). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 13.82, 19.24, 21.22, 31.33, 36.91 (т, CH2CF2, 2JCF=22.7 Гц), 67.68 (с, СН2-O), 114.76, 117.69 (тт, CF2, 1JCF=253.2 Гц, 2JCF=32.9 Гц), 120.40, 124.54 (тт, CF2, 1JCF=252.5 Гц, 2JCF=36.6 Гц), 126.60, 127.98, 128.52, 129.99, 131.14, 132.82, 137.09, 140.32, 140.90, 158.84. ESI-MS (m/z): вычислено C26H26F4NaOS+ [M+Na+] 485.1533, найдено 485.1533.
Пример 2: 4-Гексокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
Методика получения аналогична примеру 1, исходное вещество - ди-(пара-толил)дисульфид. Белое кристаллическое вещество, выход 68%. Rf (гексан: СН2Сl2 - 8:1) 0.3. Спектр 1H ЯМР (400 МГц, CDCl3): 0.95 (т, 3Н, СН3, J=6.6 Гц), 1.35-1.43 (м, 4Н, СН2), 1.51 (м, 2Н, СН2 СН 2СН2, J=7.3 Гц), 1.84 (м, 2Н, СН3 CH 2СН2, J=7.2 Гц), 2.42 (с, 3Н, СН3), 3.41 (т, 2Н, CH2-CF2, JHF=18.6 Гц), 4.03 (т, 2Н, СН2O, J=6.6 Гц), 6.99 (д, 2Н, Аr, J=8.6 Гц), 7.24 (д, 2Н, Аr, J=8.1 Гц), 7.36 (д, 2Н, Аr, J=7.8 Гц), 7.52-7.60 (м, 6Н, Аr). Спектр 19F ЯМР (377 МГц, СDСl3, δ, м.д.): -88.11 (т, J=3.6 Гц, CF 2-S), -110.75 (тт, JH-F=18.6 Гц, J=3.6 Гц, СF 2-СН2). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 14.16, 21.39, 22.73, 25.86, 29.38, 31.72, 37.02 (т, СН2СF2, 2JCF=23.4 Гц), 68.14 (с, CH2-О), 114.88, 117.80 (тт, CF2, 1JCF=253.2 Гц, 2JCF=32.2 Гц), 120.51, 124.64 (тт, CF2, 1JCF=286.9 Гц, 2JCF=35.1 Гц), 126.74, 128.12, 128.65, 130.12, 131.27, 132.95, 137.23, 140.45, 141.04, 158.94. ESI-MS (m/z): вычислено для C28H30F4NaOS+ [M+Na+] 513.1846, найдено 513.1853.
Пример 3: 4-Децокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
Методика получения аналогична примеру 1, исходное вещество - пара-децоксиборная кислота. Белое кристаллическое вещество, выход 82%. Rf (гексан: СН2Сl2 - 8:1) 0.4. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.93 (т, 3Н, СН3, J=6.57 Гц), 1.27-1.43 (м, 12Н, СН2), 1.51 (м, 2Н, СН2 СН 2СН2, J=7.83 Гц), 1.83 (м, 2Н, СН3 СН 2СН2, J=6.57 Гц), 2.42 (с, 3Н, СН3), 3.41 (т, 2Н, CH2-CF2, JHF=18.70 Гц), 4.03 (т, 2Н, СН2O, J=6.57 Гц), 7.00 (д, 2Н, Аr, J=8.84 Гц), 7.25 (д, 2Н, Аr, J=7.83 Гц), 7.37 (д, 2Н, Аr, J=8.08 Гц), 7.52-7.62 (м, 6Н, Аr). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.): -88.11 (т, J=3.7 Гц, CF 2-S), -110.75 (тт, JH-F=18.7 Гц, J=3.6 Гц, СF 2-СН2). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 13.98, 21.11, 22.56, 25.95, 29.20, 25.30, 29.40-29.57 (м), 31.79, 36.79 (т, CH2CF2, 2JCF=22.8 Гц), 67.89 (с, СН2-O), 114.63, 117.56 (тт, CF2, 1JCF=252.9 Гц, 2JCF=32.9 Гц), 120.29, 124.41 (тт, CF2, 1JCF=287.5 Гц, 2JCF=37.1 Гц), 126.48, 127.85, 128.40, 129.86, 131.01, 132.70, 136.98, 140.20, 140.77, 158.94. ESI-MS (m/z): вычислено C32H38F4NaOS+ [M+Na+] 569.2472, найдено 569.2474.
Пример 4: 4-Пентадецокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
Методика получения аналогична примеру 1, исходное вещество - пара-пентадецоксиборная кислота. Белое кристаллическое вещество, выход 80%. Rf (гексан: СН2Сl2 - 8:1) 0.2. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.91 (т, 3Н, СН3, J=6.69 Гц), 1.26-1,43 (м, 22Н, СН2), 1.51 (м, 2Н, СН2 СН 2СН2, J=7.3 Гц), 1.83 (м, 2Н, СН3 СН 2CH2, J=7.2 Гц), 2.42 (с, 3Н, СН3), 3.41 (т, 2Н, CH2-CF2, JHF=18.7 Гц), 4.02 (т, 2Н, СН2O, J=6.57 Гц), 6.99 (д, 2Н, Аr, J=8.8 Гц), 7.24 (д, 2Н, Аr, J=7.83 Гц), 7.36 (д, 2Н, Аr, J=8.08 Гц), 7.52-7.59 (м, 6Н, Аr). Спектр 19F ЯМР (188 МГц, СDСl3, δ, м.д.): -88.60 (т, J=3.8 Гц, СF 2-S), -111.22 (тт, JH-F=18.8 Гц, J=4.3 Гц, СF 2-СН2). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 14.11, 21.24, 22.70, 26.07, 29.31, 25.38, 29.43, 29.63-29.73 (м), 31.94, 36.93 (т, CH2CF2, 2JCF=23.4 Гц), 68.02 (с, СН2-O), 114.76, 117.67 (тт, CF2, 1JCF=252.5 Гц, 2JCF=32.2 Гц), 120.45, 124.52 (тт, CF2, 1JCF=288.6 Гц, 2JCF=36.6 Гц), 126.61, 127.98, 128.53, 129.98, 131.13, 132.84, 137.10, 140.34, 140.87, 158.84. ESI-MS (m/z): вычислено C37H48F4NaOS+ [M+Na+] 639.3260, найдено 639.3256.
Пример 5: 4-Октадецокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
Методика получения аналогична примеру 1, исходное вещество - пара-октадецоксиборная кислота. Белое кристаллическое вещество, выход 74%, т.пл. 89.5-90.3°С. Rf (гексан: СН2Сl2 - 8:1) 0.2. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.91 (т, 3Н, СН3, J=6.7 Гц), 1.26-1.43 (м, 28Н, СН2), 1.50 (м, 2Н, СН2 СН 2СН2, J=7.3 Гц), 1.83 (м, 2Н, СН3 СН 2CH2, J=7.2 Гц), 2.41 (с, 3Н, СН3), 3.40 (т, 2Н, CH2-CF2, JHF=18.6 Гц), 4.02 (т, 2Н, СН2O, J=6.4 Гц), 6.99 (д, 2Н, Аr, J=8.8 Гц), 7.24 (д, 2Н, Ar, J=7.8 Гц), 7.36 (д, 2Н, Ar, J=8.1 Гц), 7.51-7.60 (м, 6Н, Аr). Спектр 19F ЯМР (188 МГц, СDСl3, δ, м.д.): -88.61 (т, J=3.7 Гц, CF 2-S), -111.22 (тт, JH-F=18.8 Гц, J=4.3 Гц, СF 2-СН2). Спектр 13С ЯМР 100 МГц, СDСl3, δ, м.д.): 14.24, 21.34, 22.83, 26.20, 29.45, 25.56, 29.71-29.99 (м), 32.08, 37.05 (т, CH2CF2, 2JCF=22.7 Гц), 68.13 (с, СН2-O), 114.87, 117.79 (тт, CF2, 1JCF=254.6 Гц, 2JCF=31.2 Гц), 120.56, 124.65 (тт, CF2, 1JCF=287.5 Гц, 2JCF=35.4 Гц), 126.71, 128.09, 128.65, 130.10, 131.25, 132.94, 137.22, 140.45, 140.98, 158.96. ESI-MS (m/z): вычислено C40H54F4NaOS+ [M+Na+] 681.3724, найдено 681.3721.
Пример 6: 4-Бутокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил
В колбу на 100 мл, заполненную аргоном, снабженную кран-пробкой и обратным холодильником помещали раствор пара-бутоксиборной кислоты (II) (1.5 ммоль) и 1 ммоль соединения (IX) в 25 мл 1,2-диметоксиэтана, дегазирововали и в дальнейшем проводили реакцию в атмосфере аргона. К раствору прибавляли каталитическое количество палладиевого катализатора (Рd(РРh3)4, PdCl2(dppb), Pd(dba)2, РdСl2(РРh3)2, Pd(OAc)2) (0.05 ммоль) и раствор неорганического основания (NaOH, КОН, К2СО3, Nа2СО3, СsСО3) (6 ммоль) в воде (2.5 мл), полученную смесь кипятили с обратным холодильником 6 ч и оставляли на ночь при перемешивании (комнатная температура). Растворитель упаривали в вакууме роторного испарителя, остаток очищали методом колоночной хроматографии (элюент гексан:СН2Сl2 - 8:1). Получен в виде смеси Z/E изомеров 96:4. Белое кристаллическое вещество, выход 84%, т.пл. 137.3-138.8°С. Rf (гексан: СН2Сl2 - 8:1) 0.4. ИК-спектр (ν, см-1): 1470, 1600 (Ar), 1680 (С=С) см-1.
Z-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 1.03 (т, 3Н, СН3, J=7.33 Гц), 1.55 (м, 2Н, СН3 СН 2СН2, J=7.58 Гц), 1.83 (м, 2Н, СН2 СН 2СН2, J=6.57 Гц), 2.39 (с, 3Н, СН3), 4.04 (т, 2Н, СН2O, J=6.57 Гц), 6.07 (д, 1Н, CH=CF, JHF=36.13 Гц), 7.01 (д, 2Н, Аr, J=8.59 Гц), 7.20 (д, 2Н, Ar, J=7.83 Гц), 7.51-7.60 (м, 8Н, Ar). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.); -79.81 (д, J=19.8 Гц, CF 2-S), -123.54 (дт, JH-F=36.2 Гц, J=19.8 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 13.82, 19.23, 21.24, 31.29, 67.72 (с, СН2-O), 110.11 (с), 114.84, 122.47, 122.80 (тд, CF2-CF, 1JCF=276.5 Гц, 2JCF=38.8 Гц), 126.85, 127.93, 128.91, 129.82 (д, 4JCF=6.8 Гц), 129.95, 132.35, 136.70, 140.75, 141.18. 148.81 (дт, CF-CF2, 1JCF=266.4 Гц, 2JCF=31.2 Гц), 159.07.
E-изомер: спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 6.65 (д, 1Н, CH=CF, J=23.0 Гц).
Остальные спектральные данные совпадают с основным изомером.
ESI-MS (m/z): вычислено C26H25F3NaOS+ [M+Na+] 465.1470, найдено 465.1470.
Пример 7: 4-Гексокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил
Методика получения аналогична примеру 6, исходное вещество - пара-гексоксиборная кислота. Получен в виде смеси Z/E изомеров 91:9. Белое кристаллическое вещество, выход 82%. Rf (гексан: CH2Cl2 - 8:1) 0.5. ИК-спектр (ν, см-1): 1470, 1610 (Ar), 1680 (C=C) см-1.
Z-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 0.96 (т, 3Н, СН3, J=6.19 Гц), 1.35-1.42 (м, 4Н, СН2), 1.52 (м, 2Н, СН 2, J=6.32 Гц, J), 1.85 (м, 2Н, CH2 CH 2CH2, J=6.57 Гц), 2.39 (с, 3Н, СН3), 4.03 (т, 2Н, CH2O), J=6.57 Гц), 6.08 (д, 1Н, CH=CF, JHF=36.38 Гц), 7.01 (д, 2Н, Ar, J=8.59 Гц), 7.21 (д, 2Н, Аr, J=7.58 Гц), 7.51-7.60 (м, 8Н, Ar). Спектр 19F ЯМР (377 МГц, СDСl3, δ, м.д.): -79.91 (д, 7=19.8 Гц, СF 2-S), -123.58 (дт, JH-F=36.2 Гц, J=19.8 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 14.02, 21.23, 22.59, 25.71, 29.22, 31.58, 68.01 (с, СН2-O), 110.11 (с), 114.81, 122.45, 122.91 (тд, CF2-CF, 1JCF=277.4 Гц, 2JCF=38.8 Гц), 126.63, 127.92, 128.87, 129.84 (д, 4JCF=7.3 Гц), 129.95, 132.29, 136.70, 140.74, 141.16,148.80 (дт, CF-CF2, 1JCF=267.1 Гц, 2JCF=31.5 Гц), 159.07.
E-изомер: спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 6.65 (д, 1Н, CH=CF, J=22.5 Гц).
Остальные спектральные данные совпадают с основным изомером. ESI-MS (m/z): вычислено C28H29F3NaOS+ [M+Na+] 493.1783, найдено 493.1783.
Пример 8: 4-Децокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил
Методика получения аналогична примеру 6, исходное вещество - пара-децоксиборная кислота. Получен в виде смеси Z/E изомеров 99:1. Белое кристаллическое вещество, выход 85%. Rf (гексан: СН2Сl2 - 8:1) 0.5. ИК-спектр (ν, см-1): 1470, 1600 (Ar), 1680 (C=C) см-1.
Z-изомер: спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.93 (т, 3Н, СН3, J=5.81 Гц), 1.25-1.56 (м, 14Н, СН2), 1.85 (м, 2Н, СН 2, J=6.82 Гц), 2.39 (с, 3Н, СН3), 4.03 (т, 2Н, СН2O, J=6.44 Гц), 6.08 (д, 1Н, CH=CF, JHF=36.38 Гц), 7.01 (д, 2Н, Ar, J=8.59 Гц), 7.21 (д, 2Н, Ar, J=7.83 Гц), 7.51-7.60 (м, 8Н, Ar). Спектр 19F ЯМР (377 МГц, CDCl3, δ, м.д.): -79.91 (д, J=19.9 Гц, CF 2-S), -123.58 (дт, JH-F=36.2 Гц, J=19.9 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 14.07, 21.22, 22.69, 26.07, 29.31, 29.36, 29.43, 29.61, 29.74, 31.91, 68.06 (с, СН2-O), 110.10 (с), 114.84, 122.57, 122.93 (тд, CF2-CF, 1JCF=279.1 Гц, 2JCF=37.9 Гц), 126.66, 127.93, 128.94, 129.82 (д, 4JCF=7.6 Гц), 129.93, 132.38, 136.73, 140.71, 141.22, 148.87 (дт, CF-CF2, 1JCF=267.3 Гц, 2JCF=32.0 Гц), 159.11.
E-изомер: спектр 1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 6.65 (д, 1Н, CH=CF, J=22.2 Гц).
Остальные спектральные данные совпадают с основным изомером.
ESI-MS (т/г): вычислено C32H37F3NaOS+ [M+Na+] 549.2409, найдено 549.2415.
Пример 9: 4-Пентадецокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил
Методика получения аналогична примеру 26, исходное вещество - пара-пентадецоксиборная кислота. Получено в виде смеси Z/E изомеров 97:3. Белое кристаллическое вещество, выход 76%, т.пл. 97.4-98.7°С. Rf (гексан:СН2Сl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1460, 1600 (Ar), 1680 (С=С) см-1;
Z-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 0.91 (т, 3Н, СН3, J=6.4 Гц), 1.24-1.43 (м, 22Н, СН2), 1.50 (м, 2Н, СН 2, J=7.3 Гц), 1.83 (м, 2Н, СH 2, J=6.8 Гц) 2.38 (с, 3Н, СН3), 4.03 (т, 2Н, CH2O, J=6.4 Гц), 6.07 (д, 1Н, CH=CF, JHF=36.1 Гц), 7.00 (д, 2Н, Ar, J=8.6 Гц), 7.20 (д, 2Н, Ar, J=7.8 Гц), 7.51-7.60 (м, 8Н, Ar). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -80.38 (д, J=18.8 Гц, CF 2-S), -124.11 (дт, JH-F=36.1 Гц, J=20.2 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 14.11, 21.24, 22.69, 26.05, 29.28, 29.41, 29.64-29.85 (м), 31.93, 68.04 (с, СН2-O), 110.11, 119.84, 122.52, 122.91 (тд, CF2-CF, 1JCF=277.4 Гц, 2JCF=38.8 Гц), 126.64, 127.92, 128.92, 129.80 (д, 4JCF=6.8 Гц), 129.94, 132.34, 136.71, 140.71, 141.18, 148.84 (дт, CF-CF2, 1JCF=266.4 Гц, 2JCF=29.5 Гц), 159.09.
E-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 6.64 (д, 1Н, CH=CF, J=22.0 Гц).
Остальные спектральные данные совпадают с основным изомером.
ESI-MS (m/z): вычислено C37H47F3NaOS+ [M+Na+] 619.3192, найдено 619.3193.
Пример 10: 4-Октадецокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил
Методика получения аналогична примеру 6, исходное вещество - пара-октадецоксиборная кислота. Получено в виде смеси Z/E изомеров 94:6. Белое кристаллическое вещество, выход 71%. Rf (гексан:СН2Сl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1460, 1600 (Ar), 1680 (C=C) см-1 .
Z-изомер: спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.91 (т, 3Н, СН3, J=6.7 Гц), 1.24-1.43 (м, 28Н, CH2), 1.50 (м, 2Н, CH 2, J=7.5 Гц), 1.83 (м, 2Н, CH 2, J=6.8 Гц), 2.38 (с, 3Н, СН3), 4.03 (т, 2Н, СН2O, J=6.6 Гц), 6.07 (д, 1Н, CH=CF, JHF=36.1 Гц), 7.00 (д, 2Н, Ar, J=8.6 Гц), 7.20 (д, 2Н, Ar, J=7.8 Гц), 7.52-7.59 (м, 8Н, Ar). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -80.38 (д, J=20.2 Гц, CF 2-S), -124.11 (дт, JH-F=36.1 Гц, J=20.2 Гц, CF=CH). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 14.11, 21.29, 22.70, 26.07, 29.30, 29.38, 29.42, 29.62, 29.66-29.83 (м), 31.95, 68.09 (с, СН2-O), 110.12, 114.87, 122.55, 122.92 (тд, CF2-CF, 1JCF=277.4 Гц, 2JCF=37.9 Гц), 126.69, 127.97, 128.98, 129.84 (д, 4JCF=7.6 Гц), 129.97, 132.41, 136.74, 140.75, 141.23, 148.86 (дт, CF-CF2, 1JCF=265.6 Гц, 2JCF=30.4 Гц), 159.11.
Е-изомер: спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 6.64 (д, 1Н, CH=CF, J=22.5 Гц).
Остальные спектральные данные совпадают с основным изомером.
ESI-MS (m/z): вычислено C40H53F3NaOS+ [M+Na+] 661.3661, найдено 661.3683.
Пример 11: 4-Бутокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил
В колбу, заполненную аргоном, снабженную кран-пробкой и низкотемпературным термометром помещали раствор соответствующего бифенила (1 ммоль) в 10 мл абсолютного ТГФ, охлаждали до -80°С и медленно добавляли 3 мл (3 ммоль, 3 экв.) раствора гексаметилдисилазида натрия (1.0 М в ТГФ) и выдерживали смесь при данной температуре 2 ч. Далее раствор нагревали до комнатной температуры в течение 1 ч, убирали ТГФ в вакууме роторного испарителя, смесь разлагали 1 М раствора соляной кислоты в воде. Водную фазу экстрагировали СН2Сl2 (3×40 мл), объединенные органические фракции промывали водой (3×40 мл) и сушили над сульфатом натрия. Далее хлористый метилен упаривали и твердый остаток очищали методом колоночной хроматографии на силикагеле (элюент гексан:СН2Сl2 - 8:1). Белое кристаллическое вещество, выход 85%, т.пл. 117.1-118.6°С. Rf (гексан:СН2Сl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1120, 1470, 1610 (Ar), 2250 (С≡С) см-1. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 1.03 (т, 3Н, СН3, J=7.2 Гц), 1.55 (м, 2Н, СН2 СН 2СН2, J=7.3 Гц), 1.82 (м, 2Н, СН3 CH 2СН2, J=6.8 Гц), 2.42 (с, 3Н, СН3), 4.04 (т, 2Н, СН2O, J=6.4 Гц), 7.00 (д, 2Н, Ar, J=8.6 Гц), 7.25 (д, 2Н, Ar, J=7.8 Гц), 7.48 (д, 2Н, Ar, J=8.1 Гц), 7.52-7.58 (м, 4Н, Ar), 7.61 (д, 2Н, Ar, J=7.8 Гц). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -59.12 (с, СF 2-S). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 13.81, 19.20, 21.24, 31.25, 67.67 (с, СН2-O), 80.62 (т, C≡C-CF2, 2JCF=40.5 Гц), 90.49, 114.84, 117.43, 117.97 (т, CF2, lJCF=264.7 Гц), 123.33, 126.39, 128.00, 129.89, 131.78, 132.45, 136.65, 140.76, 142.52, 159.31. Найдено (%): С, 73.50; Н, 5.85. С26Н24Р2OS. Вычислено (%): С, 73.91; Н, 5.73.
Пример 12: 4-Гексокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил
Методика получения аналогична примеру 10. Белое кристаллическое вещество, выход 83%, т.пл. 96.6-97.9°С. Rf (гексан:СН2Сl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1470, 1600 (Ar), 2250 (С≡С) см-1. Спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 0.94 (т, 3Н, СН3, J=7.0 Гц), 1.35-1.42 (м, 4Н, СН2),1.50 (м, 2Н, CH2 CH 2CH2, J=7.4 Гц), 1.83 (м, 2Н, СН3 СН 2СН2, J=7.2 Гц), 2.42 (с, 3Н, СН3), 4.02 (т, 2Н, СН2O, J=6.6 Гц), 7.00 (д, 2Н, Ar, J=8.8 Гц), 7.25 (д, 2Н, Ar, J=8.1 Гц), 7.48 (д, 2Н, Ar, J=7.8 Гц), 7.52-7.58 (м, 4Н, Ar), 7.61 (д, 2Н, Ar, J=8.1 Гц). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -59.19 (с, СF 2-S). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 14.00, 21.24, 22.57, 25.68, 29.18, 31.55, 68.01 (с, СН2-O), 80.63 (т, C≡C-CF2, 2JCF=40.0 Гц), 90.49, 114.85, 117.43, 117.97 (т, CF2, 1JCF=265.6 Гц), 123.35, 126.39, 128.01, 129.89, 131.80, 132.45, 136.65, 140.76, 142.53, 159.32. ESI-MS (m/z): вычислено C28H28F2NaOS+ [M+Na+] 473.1721, найдено 473.1735.
Пример 13: 4-Децокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил
Методика получения аналогична примеру 11. Белое кристаллическое вещество, выход 85%. Rf (гексан:СН2Cl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1470, 1600 (Ar), 2250 (C≡C) см-1. Спектр 1H ЯМР (400 МГц, CDCl3, δ, м.д.): 0.92 (т, 3Н, СН3, J=6.7 Гц), 1.30-1.42 (м, 8Н, СН2), 1.50 (м, 2Н, СН2 СН 2СН2, J=7.5 Гц), 1.83 (м, 2Н, СН3 СН 2СН2, J=7.2 Гц), 2.42 (с, 3Н, СН3), 4.02 (т, 2Н, СН2O, J=6.6 Гц), 7.00 (д, 2Н, Ar, J=8.8 Гц), 7.25 (д, 2Н, Ar, J=7.8 Гц), 7.48 (д, 2Н, Аr, J=8.3 Гц), 7.52-7.58 (м, 4Н, Ar), 7.61 (д, 2Н, Ar, J=7.8 Гц). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -59.20 (с, CF 2-S). Спектр 13С ЯМР (100 МГц, СDСl3, δ, м.д.): 14.09, 21.28, 22.67, 26.03, 29.23, 29.31, 29.39, 29.56-29.64 (м), 31.88, 68.06 (с, СН2-O), 80.65 (т, C≡C-CF2, 2JCF=40.0 Гц), 90.48 (т, C≡C-CF2, 3JCF=5.9 Гц), 114.88, 117.49, 117.97 (т, CF2, 1JCF=265.6 Гц), 123.39, 126.42, 128.04, 129.89, 131.86, 132.47, 136.66, 140.78, 142.56, 159.34. Найдено (%): С, 75.58; Н, 7.18. С32Н36F2OS. Вычислено (%): С, 75.85; Н, 7.16.
Пример 14: 4-Октадецокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил
Методика получения аналогична примеру 10. Белое кристаллическое вещество, выход 91%. Rf (гексан:СН2Сl2 - 8:1) 0.2. ИК-спектр (ν, см-1): 1470, 1600 (Аr), 2250 (С≡С) см-1. Спектр 1H ЯМР (400 МГц, СDСl3, δ, м.д.): 0.94 (т, 3Н, СН3, J=6.6 Гц), 1.28-1.42 (м, 16Н, СН2), 1.52 (м, 2Н, СН2 СН 2СН2, J=7.6 Гц), 1.85 (м, 2Н, СН3 СН 2СН2, J=6.6 Гц), 2.43 (с, 3Н, СН3), 4.04 (т, 2Н, СН2O, J=5.8 Гц), 7.01 (д, 2Н, Аr, J=8.1 Гц), 7.27 (д, 2Н, Ar, J=7.6 Гц), 7.49 (д, 2Н, Ar, J=7.8 Гц), 7.52-7.59 (м, 4Н, Ar), 7.64 (д, 2Н, Ar, J=7.3 Гц). Спектр 19F ЯМР (188 МГц, CDCl3, δ, м.д.): -59.21 (с, CF 2-S). Спектр 13С ЯМР (100 МГц, CDCl3, δ, м.д.): 14.09, 21.25, 22.67, 26.02, 29.23, 29.35, 29.49, 29.63-29.81 (м), 31.90, 68.02 (с, СН2-O), 80.65 (т, C≡C-CF2, 2JCF=40.3 Гц), 90.44 (т, C≡C-CF2, 3JCF=5.9 Гц), 114.86, 117.48, 117.96 (т, 2JCF=265.7 Гц), 123.43, 126.39, 127.99, 129.86, 131.83, 132.45, 136.64, 140.69, 142.53,159.33.
Для установления наличия ЖК-свойств полученных соединений использовались: метод поляризационной оптической микроскопии и метод дифференциально-сканирующей калориметрии (ДСК) - для определения теплот (энтальпий) фазовых переходов. Обнаружилось, что часть из полученных целевых продуктов обладает нужными свойствами. Таким образом в рамках данного изобретения получен новый класс термотропных жидкокристаллических соединений каламитного типа.
Конкретные соединения имеющие жидкокристаллические свойства, приведены ниже:
2. 4-Гексокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
3. 4-Децокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
4. 4-Пентадецокси-4'-{2,2,3,3-тетрафтор-3-[(4-метилфенил)тио]пропил}бифенил;
7. 4-Гексокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
8. 4-Децокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
10. 4-Октадецокси-4'-{2,3,3-трифтор-3-[(4-метилфенил)тио]проп-1-ен-1-ил}бифенил;
13. 4-Децокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил;
14. 4-Октадецокси-4'-{3,3-дифтор-3-[(4-метилфенил)тио]проп-1-ин-1-ил}бифенил;
Из вышеприведенных соединений особенно предпочтительны соединения 3, 10, 13, 14, так как они обладают достаточно широкими интервалами существования ЖК-фазы или/и низкими температурами плавления. Разработанные методы синтеза фторсодержащих ЖК соединений не уступают методикам, описанным в литературе по простоте проведения эксперимента, доступности исходных реагентов и суммарному выходу. Кроме того, данное изобретение предлагает использование полученных ЖК-соединений для дальнейшего применения в жидкокристаллических материалах.
|