Результат интеллектуальной деятельности: СПОСОБ ВЫЯВЛЕНИЯ УСТОЙЧИВЫХ К ПИРАЗИНАМИНУ ИЗОЛЯТОВ Mycobacterium tuberculosis
Вид РИД
Изобретение
Предлагаемое изобретение относится к молекулярной биологии и медицине и может быть использовано в лабораторной диагностике туберкулеза для быстрого выявления мутаций в гене pncA, ассоциированных с формированием устойчивости к пиразинамиду.
Антибиотикоустойчивость у микобактерий туберкулезного комплекса - достаточно хорошо изученное явление с точки зрения молекулярно-генетических механизмов. Описаны мутации, ассоциированные с устойчивостью к изониазиду, этамбутолу, пиразинамиду, рифампицину и другим противотуберкулезным препаратам [1]. Пиразинамид используется для лечения туберкулеза с 1952 года [2]. Попадая с помощью пассивной диффузии в микобактериальную клетку, пиразинамид гидролизуется ферментом пиразинамидазой до более активного деривата, пиразиновой килоты. Циклическое закачивание пиразнновой кислотой ионов водорода закисляет цитоплазму клетки и приводит к ее гибели [3]. Второй механизм действия пиразиновой кислоты на клетку заключается в том, что она конкурирует с сайтом связывания белка RpsA, тем самым данный белок не может связываться с тмРНК, что блокирует транс-трансляцию микобактерий [4]. У PZA - устойчивых изолятов в 72%-97% случаях делеции, инсерции или миссенс - мутации находят в самом гене pncA, а также в промоторной его части. Широкое разнообразие нуклеотидных замен в данном гене, ведущее к образованию устойчивости к PZA, можно объяснить небольшим размером белка PncA, состоящего всего из 186 аминокислотных остатков, поэтому любая аминокислотная замена может пагубно отразиться на функции данного белка. Исследование кристаллической структуры белка PncA показало, что мутации в гене pncA в основном влияют на каталитический сайт связывания и рядом расположенные аминокислоты [5]. При нахождении корреляции между мутацией и минимально ингибирующей концентрацией был показан высокий уровень устойчивости к пиразинамиду в случае нахождения мутаций в 63-м, 138-м и 14-м кодонах гена pncA и также в случае делеции нуклеотида в позиции 162 (MIC>500 µg/ml). Отсутствие мутаций в гене pncA у 28% PZA - устойчивых изолятов говорит о существовании дополнительных генов, ассоциированных с устойчивостью к PZA [6].
Определение устойчивости микобактерий классическими бактериологическими методами занимает 1-2 мес, которые можно считать «потерянными» для больного. Более того, тестирование чувствительности к пиразинамиду требует некоторых изменений общих методов, поскольку препарат активен только in vitro при низких значениях pH. Модификация метода пропорции заключается в использовании агара 7Н10 с pH 5,5 и концентрацией лекарственного препарата 25-50 мкг/мл [7]. Ограничение метода состоит в том, что при pH 5,5 для многих изолятов М. tuberculosis наблюдается отсутствие роста или недостаточный рост. Методы на основе агара, такие как метод пропорции на агаре, оказались неудовлетворительными для тестирования чувствительности к пиразинамиду (PZA), поскольку для многих изолятов рост не наблюдается при подкислении агара для теста на чувствительность к PZA. Метод радиометрического определения чувствительности ВАСТЕС 460ТВ PZA более эффективен и быстр. Основан на выделении радиоактивного диоксида углерода, меченного изотопом 14 С, растущими микобактериями, что обнаруживается за счет повышения показателя роста в системе на среде ВАСТЕС PZA Test Medium с пониженной кислотностью (pH 6,0) [8]. При таком значении pH активность PZA в отношении микобактерий может быть определена без ингибирования роста большинства изолятов М. tuberculosis. Тестирование чувствительности в системе ВАСТЕС 460ТВ System оказалось удовлетворительным, и в настоящее время эта методика рассматривается в качестве эталонного метода тестирования чувствительности к PZA. Таким образом, автоматизированные системы с использованием жидких сред, в основе которых лежит радиометрический метод, эффективны и позволяют получить результат в течение 14 дней, существенным недостатком данного метода является его высокая стоимость. Гибридизационные методы ПЦР-анализа лекарственной устойчивости дают результат в течение 4-5 часов, также затратны и требуют дополнительного оборудования. Так как резистентность к пиразинамиду связана с различными мутациями, разбросанными по всему гену pncA и его промоторной части, то наиболее подходящим молекулярно-генетическим методом будет секвенирование. Однако данный метод требует дорогого оборудования и классифицированных специалистов. В целом, методы выявления лекарственной резистентности, основанные на анализе ДНК микобактерий, выполняются в течение нескольких дней, показывают достаточную специфичность и чувствительность [9]. Однако у данных методов есть существенный недостаток, как-то высокая вероятность контаминации при большом потоке анализов. С появлением метода ПЦР в режиме «реального времени» указанный недостаток можно преодолеть, при этом существенно сократив время анализа. Помимо этого стоит отметить простоту метода для выполняемого персонала.
В 1997 г. предложен новый вид анализа продуктов ПЦР, основанный на использовании интеркалирующих флуоресцентных красителей ДНК и возможностей оборудования для проведения ПЦР в режиме «реального времени» [10]. После проведения стандартной ПЦР реакционная смесь, содержащая амплифицированный фрагмент ДНК, подвергается нагреванию, что приводит к переходу фрагмента ДНК из двухцепочечной формы в одноцепочечную, диссоциации красителя и снижению уровня флуоресценции. В результате получается характерная кривая плавления, специфичная для конкретного ПЦР-фрагмента. Попытки увеличения информативности флуоресцентного мониторинга плавления ДНК привели к появлению метода анализа кривых плавления с высоким разрешением (high resolution melting curve analysis - HRM, HRMA, HRMCA) [11]. Мутации в пределах анализируемого ПЦР-фрагмента ДНК приводят к небольшим изменениям температуры плавления, что сдвигает кривую по оси значения температуры или, в отдельных случаях, меняет ее форму. Ранее описано применение HRM-анализа для быстрой детекции мутаций, вызывающих лекарственную устойчивость к изониазиду и рифампицину у микобактерий туберкулеза [12] [13]. Однако описанные подходы не позволяют достичь высоко воспроизводимых результатов, что особенно важно в клинической практике.
Наиболее близким к заявленному способу-прототипу является способ типирования, предложенный K.G. Hoek и соавт. [11], где впервые применили HRM - анализ для выявления мутаций в rpoB гене. Известно, что при анализе однонуклеотидных замен (SNP) в геноме человека методом HRM наиболее надежно выявляются гетерозиготы. Это обусловлено тем, что после плавления ампликонов двух типов и их дальнейшей реассоциации образуются молекулы четырех типов - две исходных и две, несущие неспаренные основания (мис-матчи) в области SNP, обладающие значительно более низкой температурой плавления. Суперпозиция кривых плавления этих фрагментов ДНК дает характеристическую кривую, которая часто содержит два перегиба и значительно отличается от кривой плавления ампликона дикого типа. Этот факт использован в целом ряде исследований по скринингу высокопенетрантных мутаций для моногенных заболеваний человека [14]. В работе Хоек и соавт. амплифицировали участок rpoB гена дикого типа (штамм H37Rv) и анализируемый клинический образец, затем смешивали ампликоны, проводили еще 10 раундов ПЦР и уже после проводили анализ кривых плавления. Недостатком данного метода является снижение гомогенности и высокая вероятность кросс-контаминации ампликонами любых типов.
Предлагаемый способ выявления устойчивых к пиразинамиду изолятов М. tuberculosis, путем определения мутаций в гене pncA, ассоциированных с формированием устойчивости к пиразинамиду, заключается в проведении ПЦР в режиме «реального времени» с использованием HRM-анализа, отличающийся, тем, что в процессе амплификации формируются «искусственные» гетеродуплексы за счет одновременной коамплификации ДНК дикого типа и тестируемой ДНК, что может увеличить надежность анализа. В ПЦР используются праймеры следующей структуры: Pnc18U: 5'-TACGCTCCGGTGTAGGCAC-3', Pnc15R: 5'-GAAGCGGCGGACTACCATC-3'. При этом главный принцип ПЦР в режиме «реального времени», а именно, анализ продуктов ПЦР с закрытой крышкой, сохраняется, что нивелирует возможность контаминации ампликонами, полученными в процессе реакции.
Способ заключается в следующем:
Выделение ДНК их культуры М. tuberculosis проводят согласно описанной методике [15].
Реакции амплификации выполняют при помощи термоциклера с оптическим блоком для детекции флуоресценции CFX96 (Bio-Rad). Для регистрации флуоресценции в режиме реального времени в реакционную смесь добавляют интеркалирующий краситель SYT09. Качество реакции амплификации считают приемлемым при выполнении следующих условий:
- эффективность реакции амплификации больше 80% (Е>0,8);
- коэффициент корреляции между ожидаемым и эмпирическим уравнениями калибровочной кривой больше 0,99 (r2>99);
- разница между значениями Ct для повторяющихся точек калибровочной кривой не превышает 0,5 цикла;
- отсутствие неспецифичных продуктов амплификации.
Эффективность ПЦР рассчитывали при помощи уравнения (1)
log(R0)=log(RN)-log(1+E)×Nt.
где
- N - независимая переменная, соответствующая номеру амплифнкационного цикла, на котором проводятся измерения;
- RN - количество амплифицированных молекул после N-ного цикла амплификации (прямо пропорционально значению флуоресценции амплификационной смеси);
- R0 - исходное число амплифицируемых молекул;
- Е - эффективность амплификации.
Для этого с парой праймеров (Pnc18U/Pnc15R) амплифицируются образцы калибровочной кривой, (четыре последовательных 4-кратных разведения анализируемой и референтной (H37Rv) ДНК). Используя калибровочную прямую и регрессионное уравнение (1), проводят уравнивание концентраций анализируемых образцов ДНК до концентрации наименее концентрированной ДНК.
Непосредственно ПНР в режиме «реального времени» с последующим HRM-анализом проводят при смешивании равного количества тестируемой ДНК и ДНК H37Rv. ПЦР проводят в объеме 20 мкл, содержащем 67 мМ трис-HCl (pH 8,9), 16 мМ сульфат аммония, 1,5 мМ MgCl2, 0,01% Твин 20, 0,2 мМ дНТФ, 0,5 мкМ растворы олигонуклеотидных праймеров (Pnc18U: 5'-TACGCTCCGGTGTAGGCAC-3', Pnc15R: 5'-GAAGCGGCGGACTACCATC-3') и 1 ЕД/акт Taq-полимеразы. Реакцию проводят на амплификаторе CFX96 («Bio-Rad», США) с начальной денатурацией при 96°C в течение 2 мин, далее 35 циклов с денатурацией при 95°C в течение 5 с, отжигом праймеров при 63°C в течение 5 с и синтезом при 72°C в течение 5 с.
Для анализа кривой плавления ПЦР смесь нагревают до 96°C 5 мин, далее инкубируют минуту при температуре 63°C и проводят плавление со скоростью 0,2°C на один шаг снятия флуоресцентного сигнала, вплоть до 94°C. Для оценки качества ПЦР-аликвоты реакции фракционируют в 6% полиакриламидпом геле. Для HRM-анализа используют «Precision Melt AnalysisTM Software» («Bio-Rad», США). Специфичность реакции амплификации подтверждают по отсутствию дополнительных пиков на кривой плавления и дополнительных бэндов на электрофореграмме.
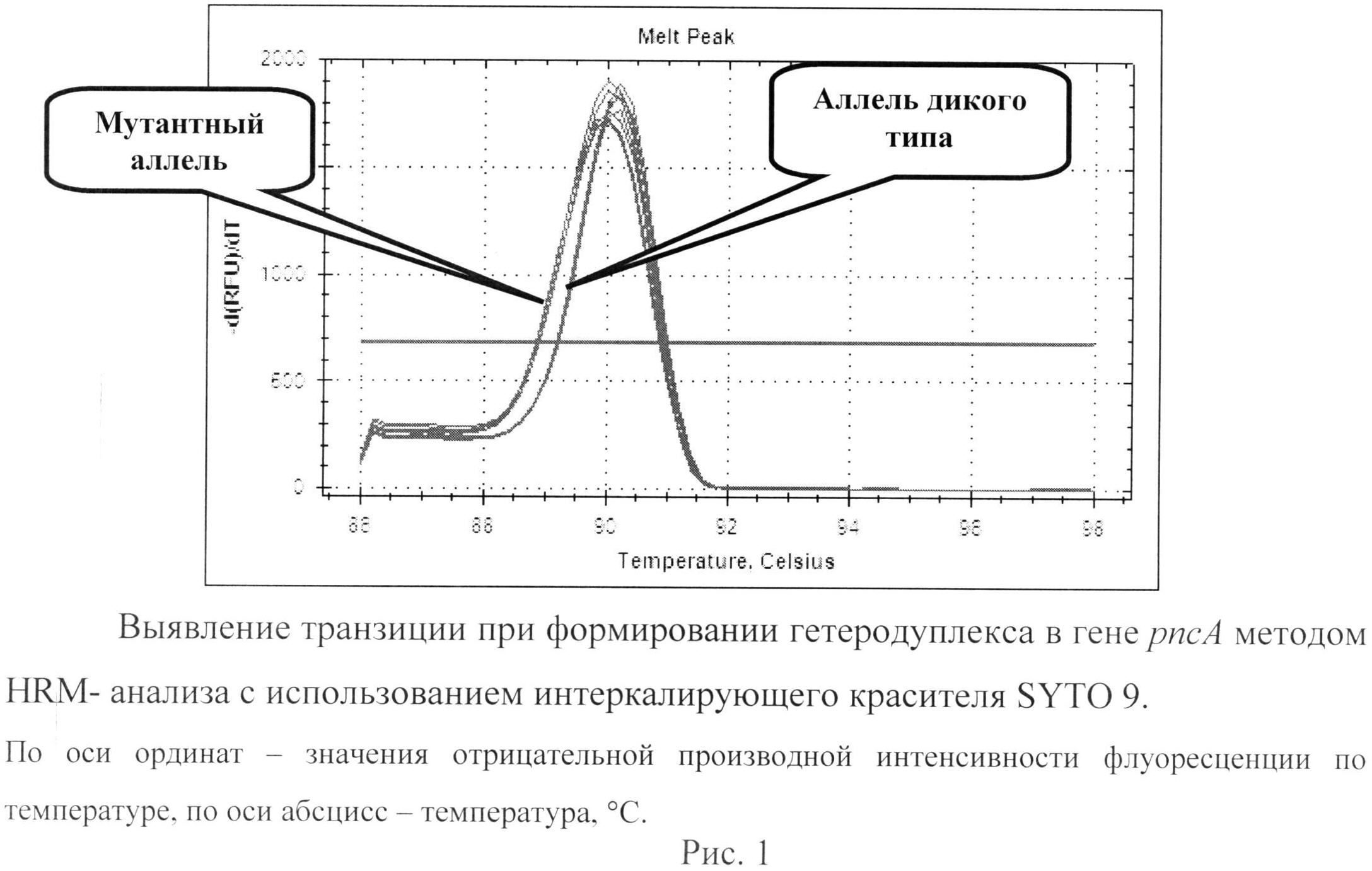
Характерные кривые плавления представлены на рис.1. Представлено графическое представление кривых плавления продуктов амплификации участка гена pncA. Любая замена в гене pncA горизонтально сдвигает пики кривых плавления влево из-за уменьшения температуры плавления (см. рис.1), в связи с формированием гетеродуплекса. Использование интеркаллирующего красителя SYTO 9 надежно выявляло мутации. При необходимости, в дальнейшем можно более детально изучить характер мутации с помощью секвенирования.
Таким образом, предложенный подход обладает высокой специфичностью и чувствительностью при прямом анализе ДНК, выделенных из мокроты. Скрининг устойчивости к пиразинамиду с использованием предложенного нами подхода, учитывая его быстроту и низкую себестоимость, может быть эффективен для установления MDR-туберкулеза. Данное утверждение делается на предположении, что модификации в гене pncA могут возникать после возникновения мутаций в генах katG и rpoB, ответственных за формирование устойчивости к изониазиду и рифампицину.
Разработанный способ выявления мутаций в гене pncA Mycobacterium tuberculosis обладает высокой чувствительностью и специфичностью (100%), а также наиболее низкой стоимостью среди описанных к настоящему времени альтернативных подходов, имеет высокий уровень надежности и воспроизводимости. Способ апробирован на представительной выборке из 200 образцов ДНК M.tiiberciilosis. Суммарное время проведения анализа, начиная с биологического образца (бактериальные клетки или мокрота), не превышал 5,5 ч. Стоит отметить, что разработанный подход к анализу точковых мутаций может подходить и для анализа других нуклеотидных замен, представляющих научный и практический интерес. Разработанный метод хорошо адаптируем к инструментальным возможностям современных клинико-диагностических лабораторий и, таким образом, уже в настоящее время может быть использован во фтизиатрической практике.
Источники информации
[1] D. Laurenzo and S.A. Mousa, "Mechanisms of drug resistance in Mycobacterium tuberculosis and current status of rapid molecular diagnostic testing" Acta tropica, vol. 119, no. 1, pp.5-10, Jul. 2011.
[2] A.P. Davies, O.J. Billington, T.D. McHugh, D.A. Mitchison, and S.H. Gillespie, "Comparison ofphenotypic and genotypic methods for pyrazinamide susceptibility testing with Mycobacterium tuberculosis.," Journal of clinical microbiology, vol. 38, no. 10, pp.3686-8, Oct. 2000.
[3] Y. Zhang and D. Mitchison, "The curious characteristics of pyrazinamide: a review" The international journal of tuberculosis and lung disease: the official journal of the International Union against Tuberculosis and Lung Disease, vol. 7, no. 1, pp.6-21, Jan. 2003.
[4] A.S. Kalinda and С.С. Aldrich, "Pyrazinamide: a frontline drug used for tuberculosis. Molecular mechanism of action resolved after 50 years?" ChemMedChem, vol.7, no. 4, pp.558-60, Apr. 2012.
[5] S. Petrella, N. Gelus-Ziental, A. Maudry, С. Laurans, R. Boudjelloul, and W. Sougakoff, "Crystal structure of the pyrazinamidase of Mycobacterium tuberculosis: insights into natural and acquired resistance to pyrazinamide" PloS one, vol.6, no. 1, p.e15785, Jan. 2011.
[6] G.P. Morlock, J.T. Crawford, W.R. Butler, S.E. Brim, D. Sikes, G.H. Mazurek, С.L. Woodley, and R.С. Cooksey, "Phenotypic characterization of pncA mutants of Mycobacterium tuberculosis" Antimicrobial agents and chemotherapy, vol.44, no. 9, pp.2291-5, Sep. 2000.
[7] L. Heifets and P. Lindholm-Levy, "Pyrazinamide sterilizing activity in vitro against semidormant Mycobacterium tuberculosis bacterial populations" The American review of respiratory disease, vol.145, no. 5, pp.1223-5, May 1992.
[8] M. Salfmger, L.В. Reller, В. Demchuk, and Z.T. Johnson, "Rapid radiometric method for pyrazinamide susceptibility testing of Mycobacterium tuberculosis" Research in microbiology, vol.140, no. 4-5, pp.301-9.
[9] L.E. Espinosa de los Monteros, J.С. Galan, M. Gutierrez, S. Samper, J.F. Garcia Marin, С. Martin, L. Dominguez, L. de Rafael, F. Baquero, E. Gomez-Mampaso, and J. Blazquez, "Allele-specific PCR method based on pncA and oxyR sequences for distinguishing Mycobacterium bovis from Mycobacterium tuberculosis: intraspecific M. bovis pncA sequence polymorphism" J din Microbiol, vol. 36, no. 1, pp.239-242, 1998.
[10] K.M. Ririe, R.P. Rasmussen, and С.Т. Wittwer, "Product differentiation by analysis ofDNA melting curves during the polymerase chain reaction" Analytical biochemistry, vol. 245, no. 2, pp.154-60, Feb. 1997.
[11] K.G.P. Hoek, N.C. Gey van Pittius, H. Moolman-Smook, K. Carelse-Tofa, A. Jordaan, G.D. van der Spuy, E. Streicher, Т.C. Victor, P.D. van Helden, and R.M. Warren, "Fluorometric assay for testing rifampin susceptibility of Mycobacterium tuberculosis complex" Journal of clinical microbiology, vol.46, no. 4, pp.1369-73, Apr. 2008.
[12] А.Т. Pietzka, A. Indra, A. Stoger, J. Zeinzinger, M. Konrad, P. Hasenberger, F. Allerberger, and W. Ruppitsch, "Rapid identification of multidrug-resistant Mycobacterium tuberculosis isolates by rpoB gene scanning using high-resolution melting curve PCR analysis" The Journal of antimicrobial chemotherapy, vol. 63, no. 6, pp.1121-7, Jun. 2009.
[13] G.E. Choi, S.M. Lee, J.Yi, S.H. Hwang, H.H. Kim, E.Y. Lee, E.H. Cho, J.H. Kim, H.-J. Kim, and C.L. Chang, "High-resolution melting curve analysis for rapid detection of rifampin and isoniazid resistance in Mycobacterium tuberculosis clinical isolates" Journal of clinical microbiology, vol.48, no. 11, pp.3893-8, Nov. 2010.
[14] R.H.A.M. Vossen, E. Aten, A. Roos, and J.Т. den Dunnen, "High-resolution melting analysis (HRMA): more than just sequence variant screening" Human mutation, vol.30, no. 6, pp.860-6, Jun. 2009.
[15] D. van Soolingen, M.W. Borgdorff, P.E. de Haas, M.M. Sebek, J. Veen, M. Dessens, K. Kremer, and J.D. van Embden, "Molecular epidemiology of tuberculosis in the Netherlands: a nationwide study from 1993 through 1997” J Infect Dis, vol.180, no. 3, pp.726-736, 1999.
Способ выявления устойчивых к пиразииамиду изолятов Mycobacterium tuberculosis, путем определения наличия мутаций в гене pncA, ассоциированных с формированием устойчивости к пиразинамиду, посредством проведения ПЦР в режиме «реального времени» с использованием HRM-анализа, отличающийся тем, что проводят амплификацию на смеси равного количества тестируемой ДНК и ДНК дикого типа с использованием праймеров:Pnc18U: 5'-TACGCTCCGGTGTAGGCAC-3'Pnc15R: 5'-GAAGCGGCGGACTACCATC-3',формируют гетеродуплексы за счет одновременной коамплификации ДНК дикого типа и тестируемой ДНК, при этом на первом этапе ПЦР проводят уравнивание концентрации с помощью количественной ПЦР с использованием той же пары праймеров (Pnc18U/Pnc15R) с построением калибровочной кривой и использованием регрессионного уравнения.