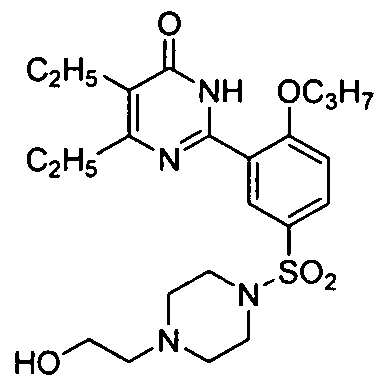
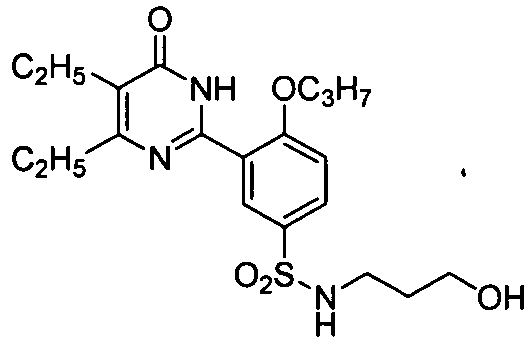
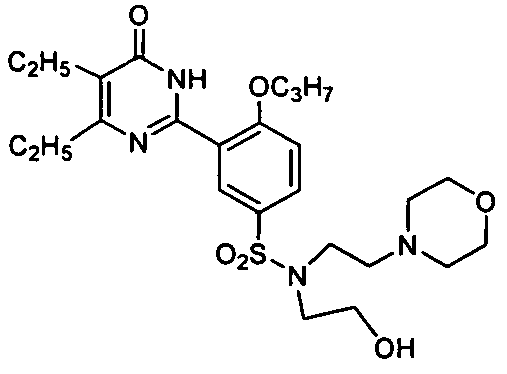
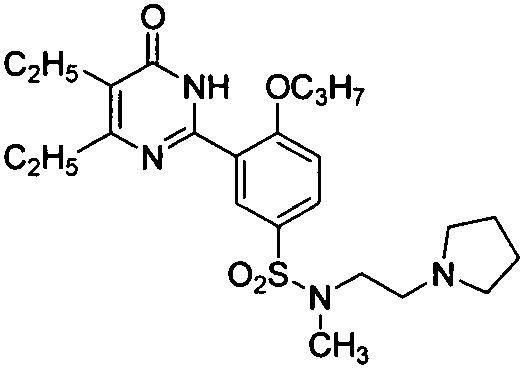
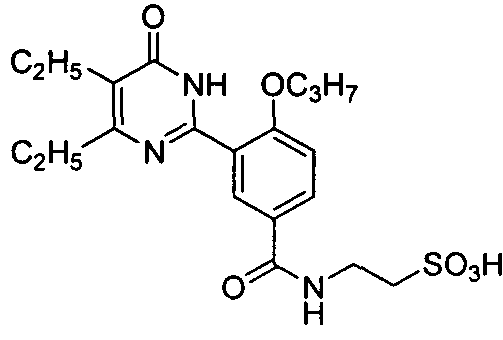
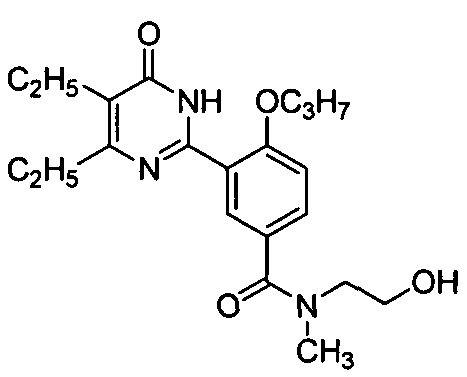
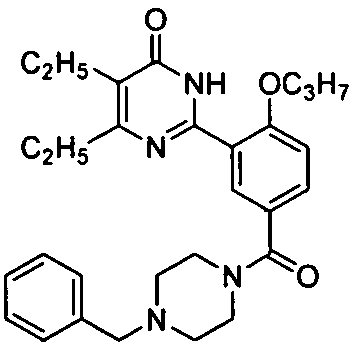
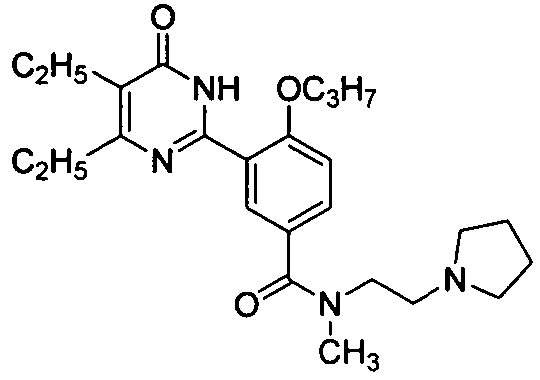
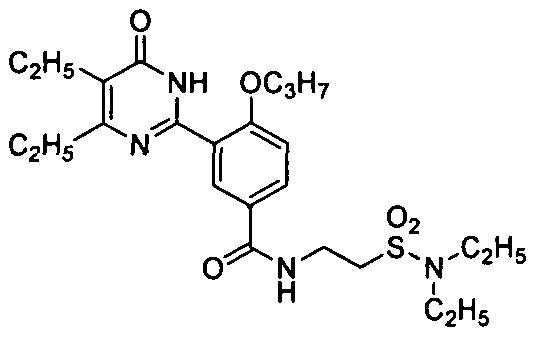
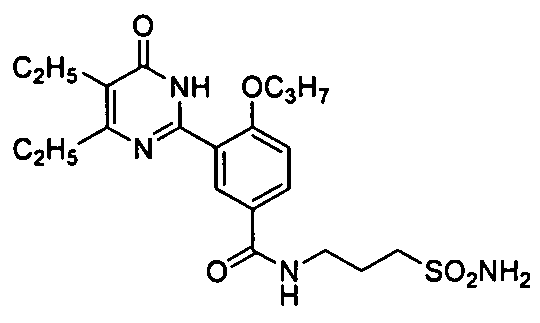
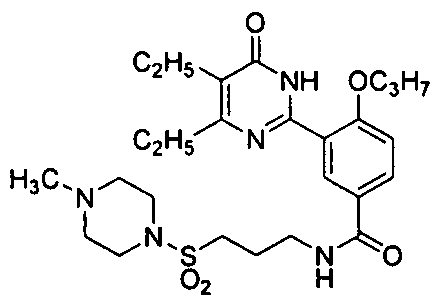
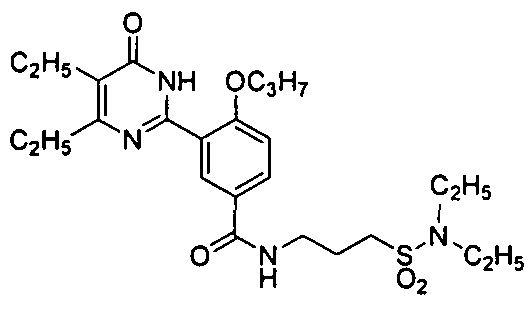
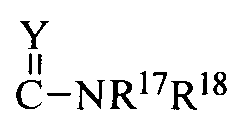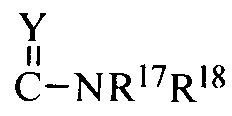Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ФЕНИЛПИРИМИДОНА, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к классу производных фенилпиримидона и их фармацевтически приемлемым солям. Настоящее изобретение также относится к фармацевтическим композициям, включающим производные фенилпиримидона, и способу получения производных фенилпиримидона. Производные фенилпиримидона согласно настоящему изобретению могут эффективно ингибировать фосфодиэстеразу типа V (PDE5) и, таким образом, могут использоваться для лечения различных сосудистых нарушений, таких как нарушения эректильной функции, легочная артериальная гипертензия и т.п.
Уровень техники изобретения
Сильденафил (Sildenafil) (WO 94/28902), разработанный Pfizer Inc., является пероральным ингибитором PED5 для лечения нарушений эрекции. Он увеличивает уровень циклического гуанозинмонофосфата (cGMP), ферментного субстрата фосфодиэстеразы типа V (PDE5), в гдадкомышечных клетках для расслабления гладких мышц и вызывания вазодилятации посредством ингибирования фосфодиэстеразы типа V с целью увеличения скорости потока крови в гладкой мышце для вызывания эрекции.
К данному времени многими крупными фармацевтическими компаниями и исследовательскими центрами разработано множество ингибиторов PED5 с различными другими химическими структурами. WO 98/49166, WO 99/54333 и WO 01/87888 раскрывают ряд производных пиразоло[4,3-d]пиримидин-7-она; WO 2004/096810 раскрывает ряд производных 5,7-диаминопиразоло[4,3-d]пиримидина; WO 2004/108726 раскрывает ряд производных дигидропирроло[2,3-d]пиримидин-4-она; WO 2004/101567 раскрывает ряд производных имидазо[1,5-a]-1,3,5-триазин-4(3H)-она; WO 2006/126081, WO 2006/126083, WO 2007/020521 и CA 02339677 раскрывают ряд производных пиридинопиразинона; WO 2005/089752 раскрывает ряд производных тетрациклического карболина; WO 2005/012303 и WO 2007/002125 раскрывают ряд производных ксантина; и WO 03/020724 раскрывает ряд производных полициклических гуанидин-ксантина. Все эти производные также показывают сильную ингибирующую активность в отношении PDE5.
Усовершенствованные ингибиторы PDE5 также используются для легочной артериальной гипертензии, диабетических желудочно-кишечных нарушений, резистентности к инсулину, гиперлипемии и т.п.
Хотя применение сильденафила оказывает хорошее клиническое действие, он все же показывает и некоторые побочные эффекты, такие как головная боль, лицевые приливы, расстройство желудка, заложенность носа, нарушение четкости зрения, усиленное восприятие света, нарушение различения цвета (синего/зеленого) и т.п. в клинике, так как он также ингибирует другие изоферменты PDE в различной степени. С одной стороны, поскольку побочные эффекты зависят от дозы, существует потребность в ингибиторе PDE5, имеющем более сильную активность, для уменьшения дозы и смягчения побочных эффектов; с другой стороны, с тех пор как обнаружено, что нарушения зрительных восприятий вызываются ингибированием фосфодиэстеразы типа VI (PDE6), находящейся в сетчатке, появилась потребность в новом ингибиторе PDE5 для увеличения селективности воздействия, особенно в отношении PDE6.
Сущность изобретения
Таким образом, одним объектом изобретения являются производные фенилпиримидона формулы I или их фармацевтически приемлемые соли.
Другим объектом изобретения является фармацевтическая композиция, содержащая упомянутые производные фенилпиримидона формулы I или их фармацевтически приемлемые соли.
Следующим объектом изобретения является способ получения упомянутых производных фенилпиримидона формулы I или их фармацевтически приемлемых солей.
Еще одним объектом изобретения является применение упомянутых производных фенилпиримидона формулы I или их фармацевтически приемлемых солей в изготовлении лекарственных средств для лечения различных сосудистых нарушений, таких как нарушения эректильной дисфункции, легочной артериальной гипертензии и т.д.
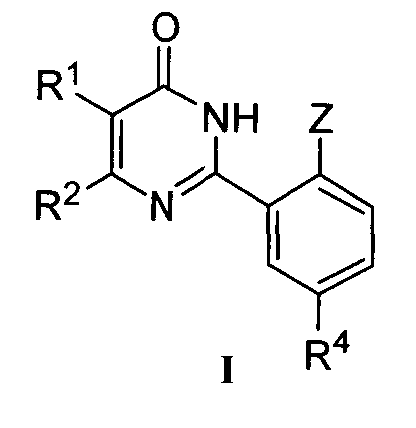
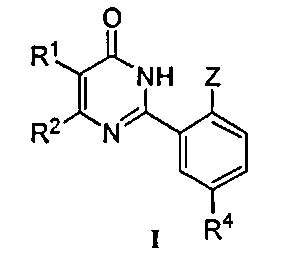
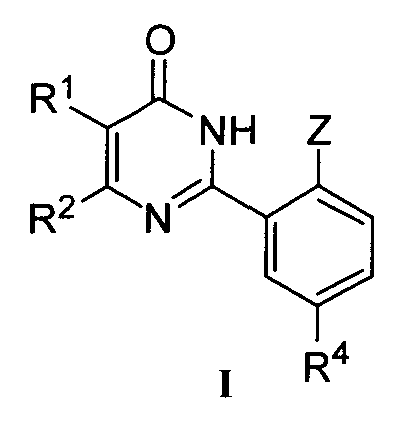
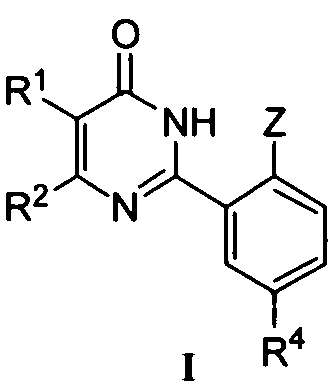
Настоящее изобретение относится к разработанным и синтезированным новым производным фенилпиримидона формулы I или их фармацевтически приемлемым солям:
 ,
,
в которой
R1 и R2 означают каждый независимо H; C1-C10 алкил; галоген; CF3; CN; OR5; NR6R7; NHCOR8; арил; или C1-C4 алкил, необязательно замещенный OR5;
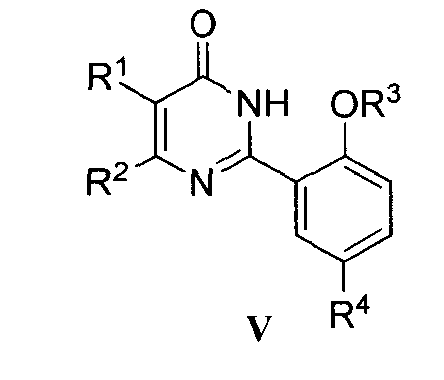
Z означает OR3;
R3 означает C1-C6 алкил или C1-C3 алкил, замещенный C1-C3 алкокси-группой;
R4 означает SO2NR6R7; NR9R10, при условии что NR9R10 не является NH2, COR11; OR12; или
R4 означает 5-6-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей OH и C1-C6 алкил; или
R4 означает 5- или 6-членную циклическую моносахаридную группу;
R5 означает C1-C6 алкил; C1-C4 алкил, необязательно замещенный C1-C4 алкокси-группой;
R6 и R7 означают каждый независимо H, OH, C1-C6 алкил, C1-C6 алкокси-группу, C3-C6 алкенил, C3-C6 циклоалкил, адамантил, C3-C8 лактамил, арил, Het или (CH2CH2O)jH, где j равно 1-3; или
R6 и R7 означают каждый независимо C1-C6 алкил, необязательно замещенный ОН, C1-C4 алкокси-группой, SO3H, SO2NR13R14, SO2R16, NR13R14, арилом, Het или 5-6-членным гетероциклилом; или
R6 и R7 означают каждый независимо 5-6-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей C1-C6 алкил и C1-C6 алкил, замещенный гидроксилом; или
R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 5-7-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей OH, COOR8, (CH2CH2O)jH, где j равно 1-3, C1-C4алкокси-группу, Het и C1-С6алкил, замещенный арилом; или
R6 и R7 вместе с атомом азота, к которому они присоединены, образуют глюкозиламино-группу, аминокислотный остаток, остаток эфира аминокислоты или аминоамидный остаток, которые необязательно замещены одним или более заместителями, выбранными из группы, включающей C1-C6 алкил, COR16, бензил и трет-бутилоксикарбонил;
R8 означает H или C1-C6 алкил;
R9 означает H, C1-C6 алкил или SO2R16;
R10 означает H; C1-C6 алкил; COR15; SO2R16; 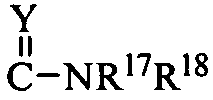 ;
; 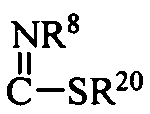 ; 5- или 6-членную циклическую моносахаридную группу, необязательно замещенную одним или более заместителями, выбранными из C1-C6алкила; или
; 5- или 6-членную циклическую моносахаридную группу, необязательно замещенную одним или более заместителями, выбранными из C1-C6алкила; или
R10 означает 5-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из OH, где гетероциклил означает дигидроимидазолил, замещенный гидроксиалкилом, или 1,2,4-триазолил, необязательно замещенный C1-C6 алкилом, арилом или амино-группой; или когда R9 означает Н, R10 означает аминокислотный остаток, необязательно замещенный одним или более заместителями, выбранными из группы, включающей C1-C6 алкил, COR16, бензил и трет-бутилоксикарбонил;
R11 означает H; Het; NH(CH2)kNH2, NH(CH2)kNHSO2R16 или NH(CH2)kNHCOR16, где k равно 0-4; C1-C3 алкил, замещенный галогеном, ОН или C1-C6 алкокси-группой; или (CH2)mNR6R7, где m равно 0-2; или
R11 означает аминокислотный остаток или аминоамидный остаток, которые необязательно замещены одним или более заместителями, выбранными из группы, включающей C1-C6 алкил, COR16, бензил и трет-бутилоксикарбонил;
R12 означает Н, COR19, SO2R16 или 5- или 6-членную моносахаридную группу;
R13 и R14 означают каждый независимо H или C1-C6 алкил; или
R13 и R14 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей OH, C1-C6алкил и Het;
R15 означает H; CF3; C1-C6 алкил, необязательно замещенный галогеном, OH, C1-C6 алкоксикарбониламино-группой, NR13R14, NHCOR16, PO(OR16)2, арилом или Het; (CH2)nCOOR8 или (CH2)nCONHR8, где n равно 0-6; C2-C4 алкенил; C3-C6 циклоалкил;
арил; или Het;
R16 означает C1-C6алкил;
R17 и R18 означают каждый независимо H; C1-C6 алкил, необязательно замещенный NR13R14 или арилом; C5-C6 циклоалкил; или
R17 и R18 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный гетероциклил, необязательно замещенный одним или более заместителями, выбранными из C1-C6 алкила; или когда Y означает NH, R17 и C(Y)N образуют дигидроимидазолил;
R19 означает C1-C6алкил, арил или NHR8;
R20 означает C1-C3алкил;
галоген означает F, Cl, Br или I;
Y означает О, S или NR8;
упомянутый "арил" означает фенил, незамещенный или замещенный одним или более заместителями, выбранными из группы, включающей галоген, C1-C3 алкил и C1-C3 алкокси-группу;
упомянутые "5-7-членный гетероциклил", "5-6-членный гетероциклил", "5-членный гетероциклил" означают насыщенный или ненасыщенный гетероциклил, включающий один или более гетероатомов, выбранных из N, S и O;
упомянутый "Het" означает 5-6-членный ароматический гетероциклил, содержащий 1-3 гетероатома, выбранных из N, S и O, упомянутый 5-6-членный ароматический гетероциклил является необязательно замещенным одним или более заместителями, выбранными из группы, включающей C1-C3 алкил, C1-C3 алкокси-группу, CF3, CN и NO2;
упомянутая "аминокислота" означает глицин, аланин, фенилаланин, серин, триптофан, валин, лейцин, изолейцин, трет-лейцин, тирозин, лизин, гистидин, метионин, аргинин, треонин, аспартат, цистеин, пролин, глутаминовую кислоту, аспарагин, глютамин, орнитин или цитруллин;
упомянутый "5- или 6-членный моносахарид" означает рибозу, дезоксирибозу, ксилозу, арабинозу, глюкозу, маннозу, галактозу или фруктозу.
В предпочтительном варианте настоящего изобретения в формуле I:
R1 означает H, F, Cl, Br, I, NH2, OH, CN, метил, этил, пропил, изопропил или ацетамидо-группу;
R2 означает NH2, Br, CF3, OR5, этил, пропил, изопропил, бензиламино-группу, фенил, бензил, изобутил, н-октил или ацетамидо-группу;
Z означает OR3;
R3 означает этил, пропил, н-бутил, н-гексил или 3-метоксилпропил;
R4 означает SO2NR6R7, NR9R10, при условии что NR9R10 не является NH2, COR11, OR12; или R4 означает 5- или 6-членный гетероциклил, где упомянутый 5- или 6-членный гетероциклил означает тиенил, тиазолил, 1,2,4-триазолил, имидазолил, пирролил, оксадиазолил, пиримидинил, морфолинил, тиоморфолинил, пиперидил, пирролидинил или пиперазинил, и упомянутый 5- или 6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей ОН, COOH, CONH2, C1-C6 алкил, C1-C4 алкокси-группу, C3-C6 циклоалкил, арил, Het и C1-C6 алкил, замещенный ОН;
R5 означает C1-C4 алкил, необязательно замещенный C1-C4алкокси-группой;
R6 и R7 означают каждый независимо H, метил, метоксил, циклопропил, пропенил, изобутил, трет-бутил, адамантил, циклогексил, капролактамил, 2-(1-метилпиррол-2-ил)этиламино, пиридилметил, тиенилметил, 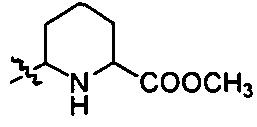 ; или C2-C3 алкил, необязательно замещенный ОН, NR13R14, SO3H, SO2NR13R14 или 5-6-членным гетероциклилом, где упомянутый 5-6-членный гетероциклил является морфолинилом, тиоморфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 5-6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей OH, COOR8, CONH2, COR16, SO2R16, C1-C6 алкил и арил; или R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный гетероциклил, где упомянутый 5-6-членный гетероциклил является морфолинилом, тиоморфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 5-6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей ОН, COOR8, CONH2, COR16, SO2R16, C1-C6 алкил, (CH2CH2O)jH, где j равно 1-2, дихлорфенил, бензил, пиридил и арил; или NR6R7 означает глюкозиламино-группу, аминокислотный остаток, остаток эфира аминокислоты или аминоамидный остаток, которые необязательно замещены одним или более заместителями, выбранными из группы, включающей NR13R14 и ацетил;
; или C2-C3 алкил, необязательно замещенный ОН, NR13R14, SO3H, SO2NR13R14 или 5-6-членным гетероциклилом, где упомянутый 5-6-членный гетероциклил является морфолинилом, тиоморфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 5-6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей OH, COOR8, CONH2, COR16, SO2R16, C1-C6 алкил и арил; или R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный гетероциклил, где упомянутый 5-6-членный гетероциклил является морфолинилом, тиоморфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 5-6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей ОН, COOR8, CONH2, COR16, SO2R16, C1-C6 алкил, (CH2CH2O)jH, где j равно 1-2, дихлорфенил, бензил, пиридил и арил; или NR6R7 означает глюкозиламино-группу, аминокислотный остаток, остаток эфира аминокислоты или аминоамидный остаток, которые необязательно замещены одним или более заместителями, выбранными из группы, включающей NR13R14 и ацетил;
R8 означает H, метил или этил;
R9 означает H, или метил или SO2R16;
R10 означает H, метил, COR15, SO2R16, 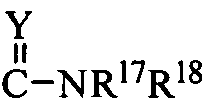 ,
, 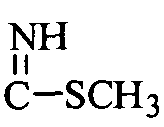 ,
, 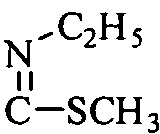 , глюкозил или маннозил; дигидроимидазолил, замещенный гидроксиэтилом; или когда R9 означает H, R10 означает аминокислотный остаток, необязательно замещенный одним или более заместителями, выбранными из группы, включающей OH, трет-бутилоксикарбонил и ацетил;
, глюкозил или маннозил; дигидроимидазолил, замещенный гидроксиэтилом; или когда R9 означает H, R10 означает аминокислотный остаток, необязательно замещенный одним или более заместителями, выбранными из группы, включающей OH, трет-бутилоксикарбонил и ацетил;
R11 означает пиразолил, замещенный изопропилом; аминоамидный остаток; аминоэфирный остаток; NR6R7; CH2Br или CH2NR6R7;
R12 означает H, COR19, SO2R16, маннозил или глюкозил;
R13 и R14 означают каждый независимо Н или этил; или R13 и R14 вместе с атомом азота, к которому они присоединены, образуют 5-6-членный гетероциклил, где упомянутый 5- или 6-членный гетероциклил является морфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 5-6-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей OH, C1-C6алкил и Het;
R15 означает Н; метил; этил; циклогексил; CF3; (CH2)nCOOR8 или (CH2)nCONH2, где n равно 0 или 1; винил; пропенил; пиридил; фенил, замещенный этокси-группой; или тиазолил, замещенный изопропилом;
R16 означает метил;
R17 и R18 означают каждый независимо Н, этил или фенил; или R17 и R18 вместе с атомом азота, к которому они присоединены, образуют 4-8-членный гетероциклил, где упомянутый 4-8-членный гетероциклил является морфолинилом, пиперидилом, пирролидинилом или пиперазинилом, и упомянутый 4-8-членный гетероциклил необязательно замещен одним или более заместителями, выбранными из группы, включающей OH и C1-C6 алкил; или когда Y означает NH, R17 и C(Y)N образуют дигидроимидазолил;
R19 означает метил или NHC2H5;
R20 означает метил;
галоген означает F, Cl, Br или I;
Y означает O, S, NH или NC2H5;
упомянутый "арил" означает фенил, незамещенный или замещенный одним или более заместителями, выбранными из группы, включающей галоген, C1-С3 алкил и C1-С3 алкокси-группу;
упомянутый "Het" означает 5-6-членный ароматический гетероциклил, включающий 1-3 гетероатома, выбранных из N, S и O, упомянутый 5-6-членный ароматический гетероциклил является необязательно замещенным одним или более заместителями, выбранными из группы, включающей C1-C3алкил, C1-C3алкокси-группу, CF3, CN и NO2;
упомянутая "аминокислота" означает глицин, аланин, фенилаланин, серин, триптофан, валин, лейцин, изолейцин, трет-лейцин, тирозин, лизин, гистидин, метионин, аргинин, треонин, аспартат, цистеин, пролин, глутаминовую кислоту, аспарагин, глютамин, орнитин или цитруллин;
упомянутый "5- или 6-членный моносахарид" означает глюкозу или маннозу.
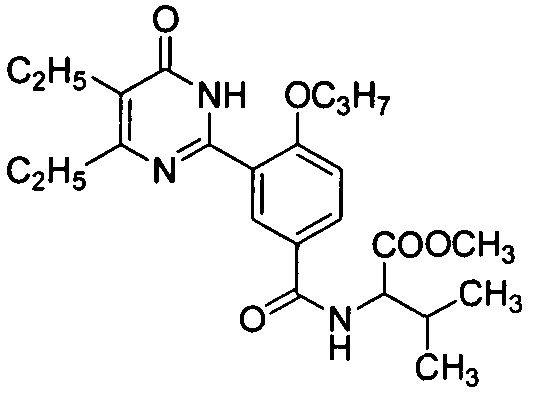
В другом предпочтительном варианте настоящего изобретения производное фенилпиримидона формулы I или его фармацевтически приемлемые соли выбраны из группы, включающей следующие соединения:
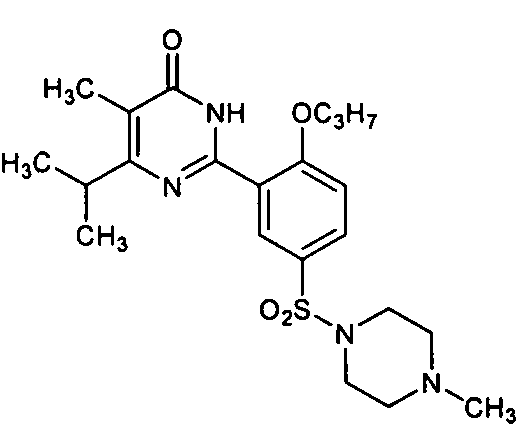
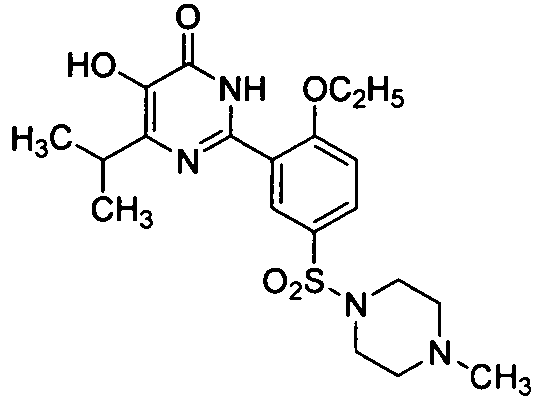
6-изопропил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
6-амино-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
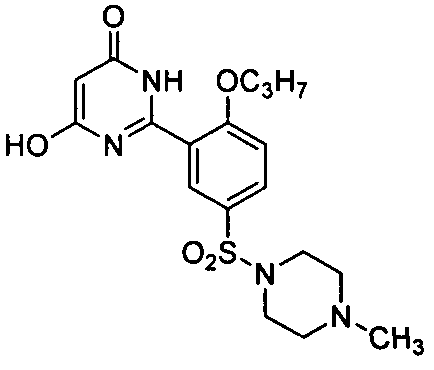
6-гидрокси-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
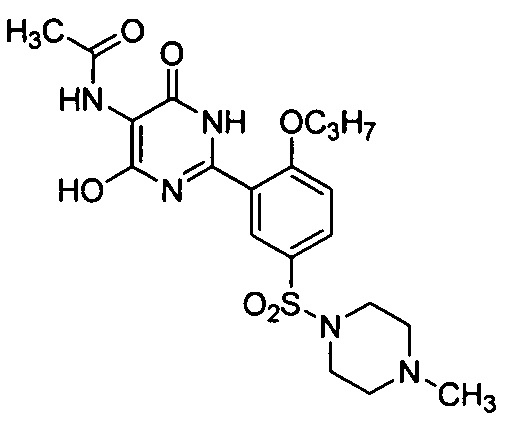
5-ацетамидо-6-гидрокси-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)-фенил]пиримид-4(3H)-он,
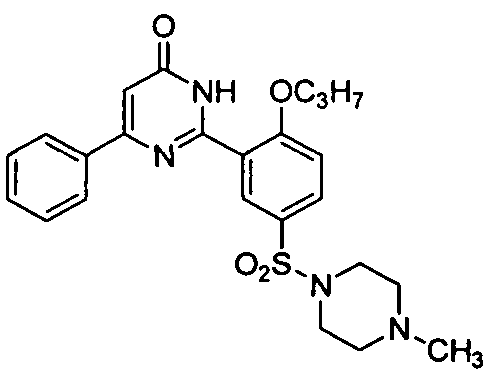
6-фенил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
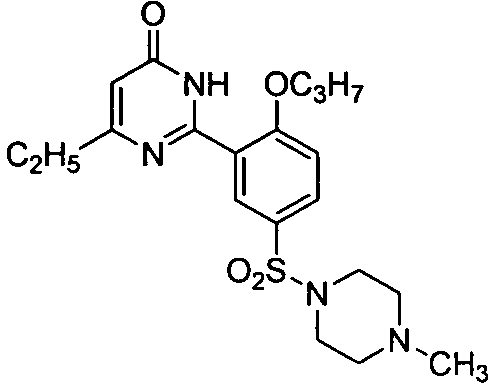
6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
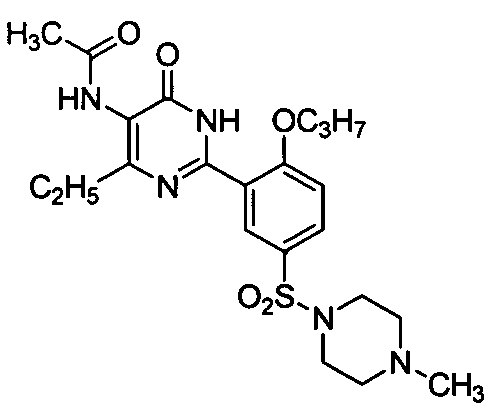
5-ацетамидо-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
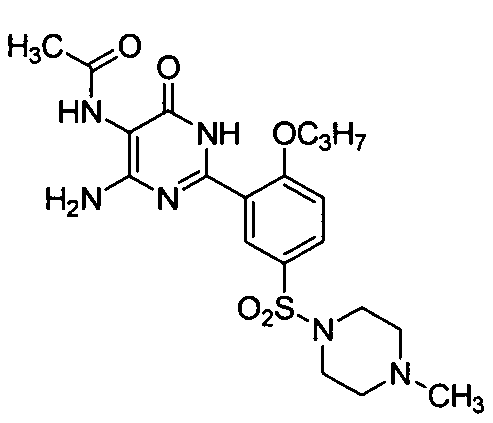
5-ацетамидо-6-амино-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
6-ацетамидо-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
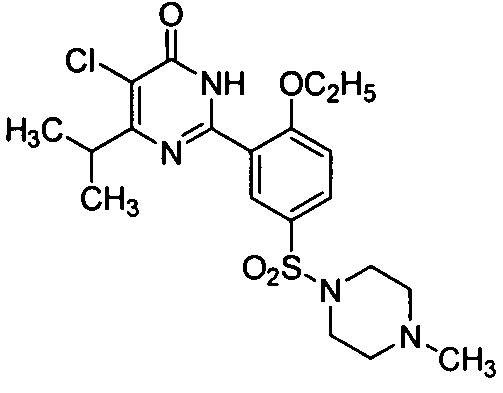
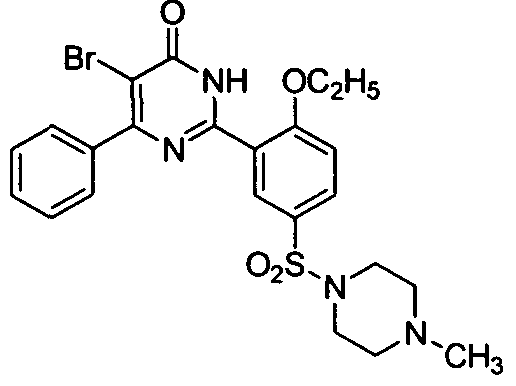
5-бром-6-изопропил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
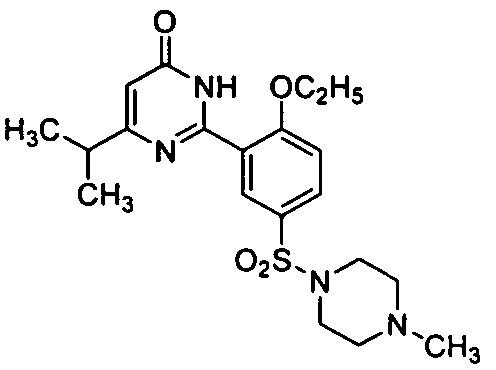
6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
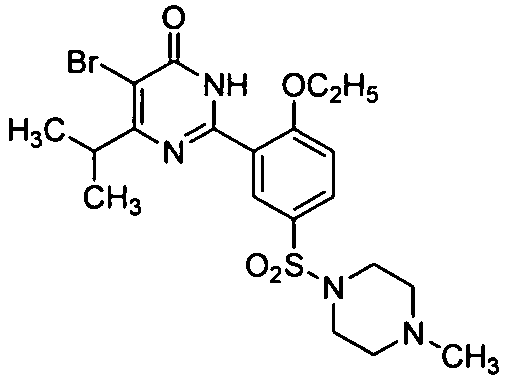
5-бром-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-хлор-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
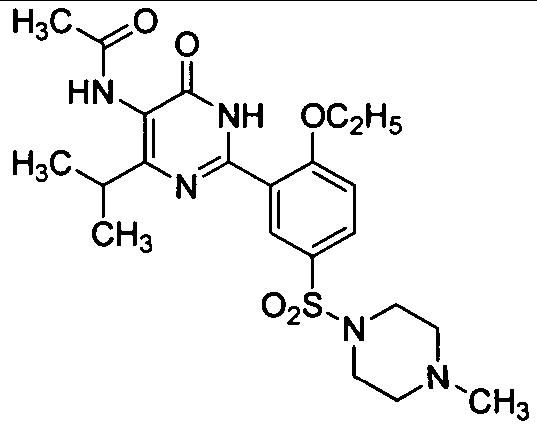
5-ацетамидо-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
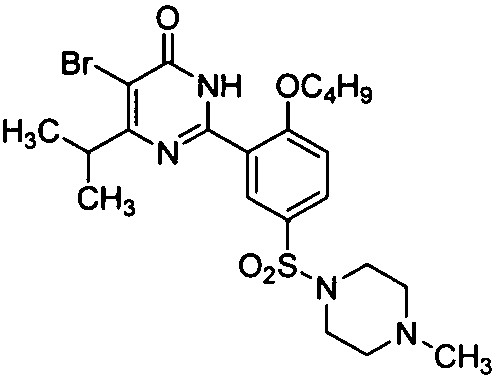
5-бром-6-изопропил-2-[2-н-бутокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
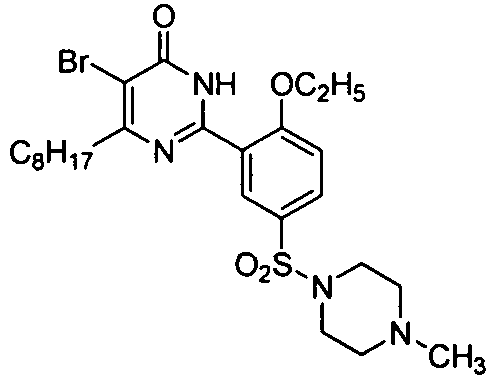
5-бром-6-н-октил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
5-бром-6-фенил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
5-метил-6-изопропил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
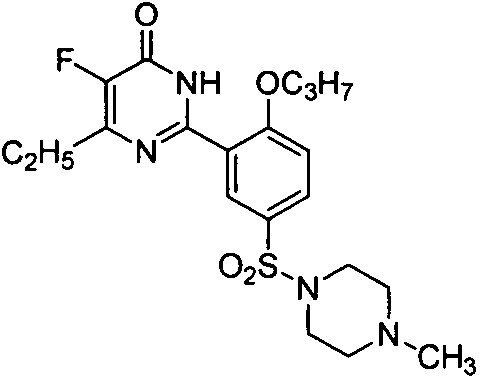
5-фтор-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-метил-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-гидрокси-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-амино-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-бром-6-изопропил-2-[2-н-гексилокси-5-(4-метил-1-пиперазинилсульфонил)-фенил]пиримид-4(3H)-он,
5-бром-6-изопропил-2-[2-этоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
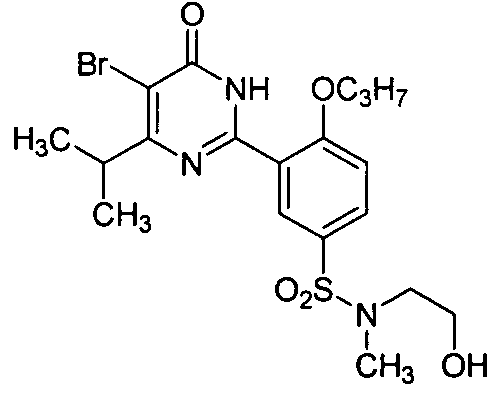
5-бром-6-изопропил-2-{2-н-пропоксил-5-[N-метил-N-(2-гидроксиэтил)амино-сульфонил]фенил} пиримид-4(3H)-он,
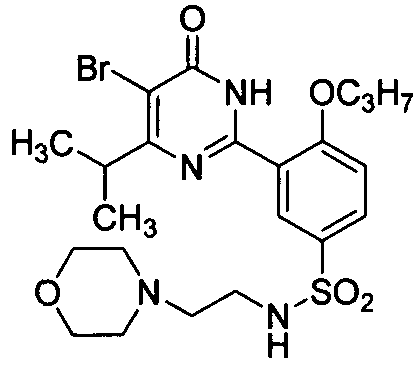
5-бром-6-изопропил-2-{2-н-пропоксил-5-[N-(2-морфолиноэтил)аминосульфонил]-фенил}пиримид-4(3H)-он,
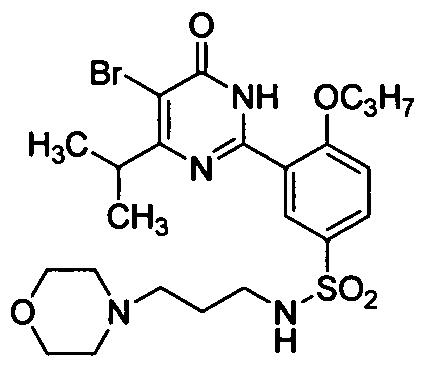
5-бром-6-изопропил-2-{2-н-пропоксил-5-[N-(3-морфолинопропил)аминосульфонил]-фенил}пиримид-4(3H)-он,
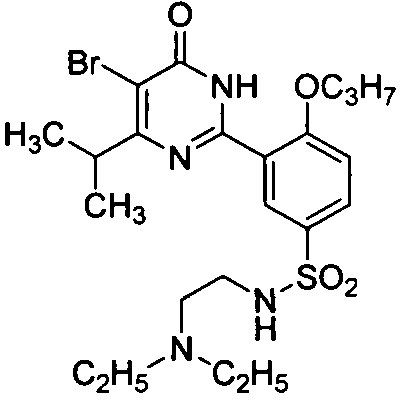
5-бром-6-изопропил-2-{2-н-пропоксил-5-[N-(N′,N′-диэтиламино)этиламино-сульфонил]фенил}пиримид-4(3H)-он,
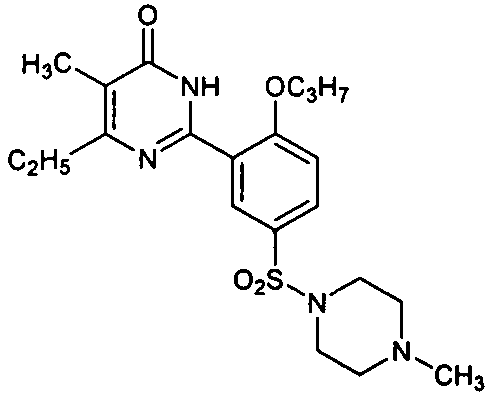
5,6-диэтил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
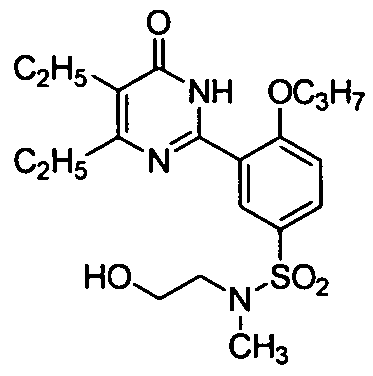
5,6-диэтил-2-{2-н-пропоксил-5-[N-метил-N-(гидроксиэтил)аминосульфонил]фенил}-пиримид-4(3H)-он,
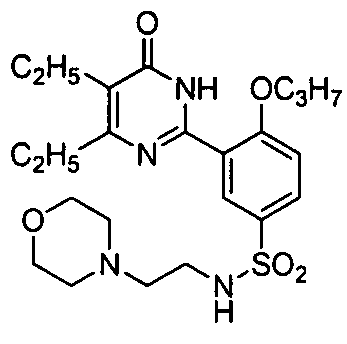
5,6-диэтил-2-{2-н-пропоксил-5-[N-(2-этиламиноэтил)аминосульфонил]фенил}-пиримид-4(3H)-он,
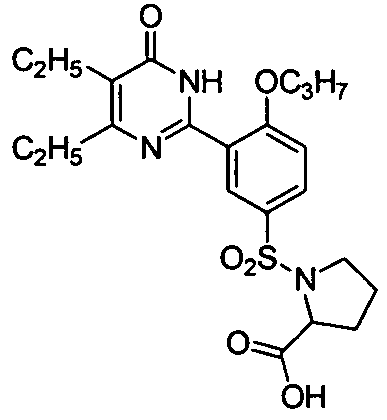
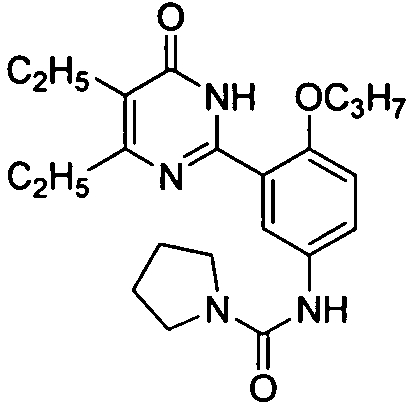
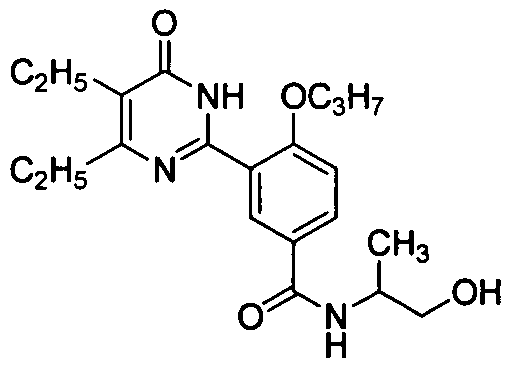
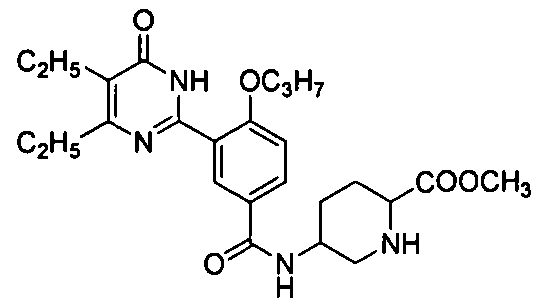
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенилсульфонил)-пролин,
2-(5-нитро-2-н-пропоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он,
2-(5-амино-2-н-пропоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он,
1-(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этилтиомочевину,
1-[3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-3-этил-2-метилизотиомочевину,
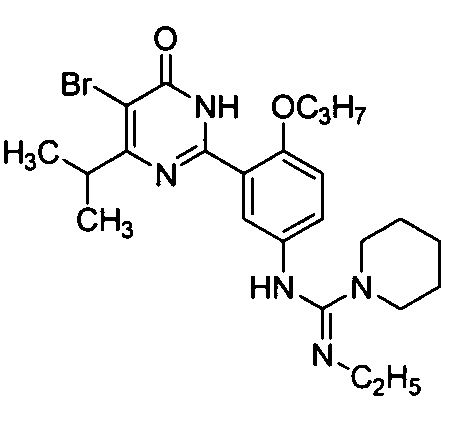
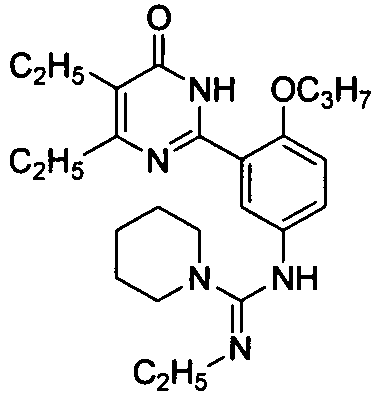
N-[3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′N″-триэтилгуанидин,
N-[3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′-этил-пиперидил-1-формамидин,
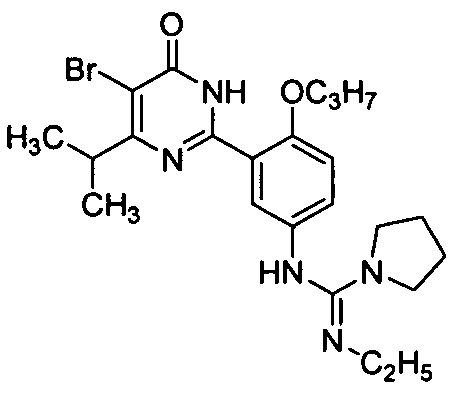
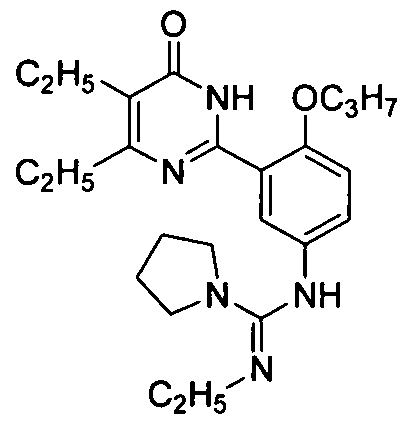
N-[3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′-этилпирролил-1-формамидин,
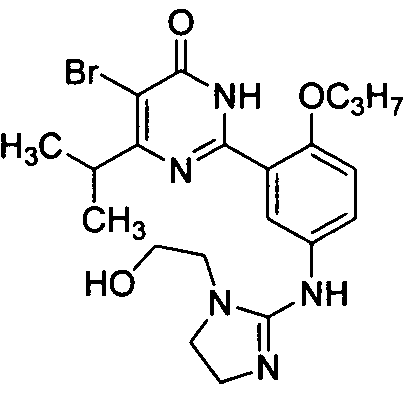
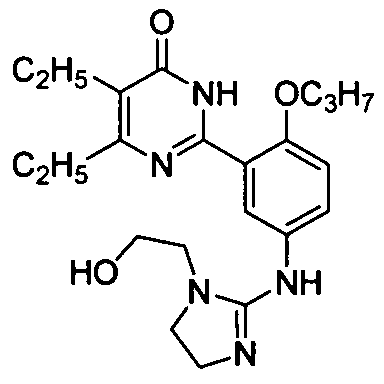
2-{2-[3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]амино-4,5-дигидро-имидазол-1-ил}этанол,
2-(5-нитро-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
2-(5-амино-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этилтиомочевину,
1-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-3-этил-2-метилизотиомочевину,
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′-этил-пиперидил-1-формамидин,
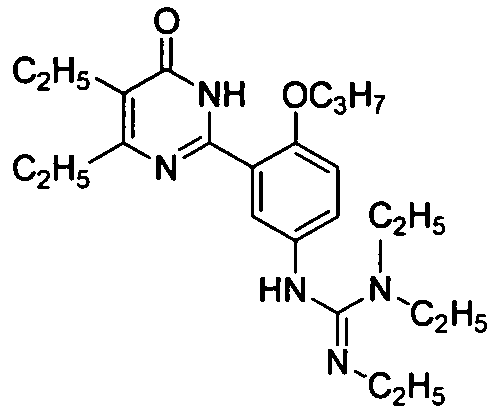
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′,N″-триэтилгуанидин,
2-{2-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-амино-4,5-дигидроимидазол-1-ил}этанол,
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′-этил-пирролил-1-формамид,
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-пирролил-1-формамидин,
5-бром-6-изопропил-2-(2-н-пропоксил-5-мезиламидофенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-мезиламидофенил)пиримид-4(3H)-он,
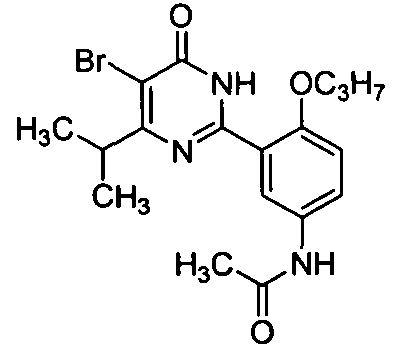
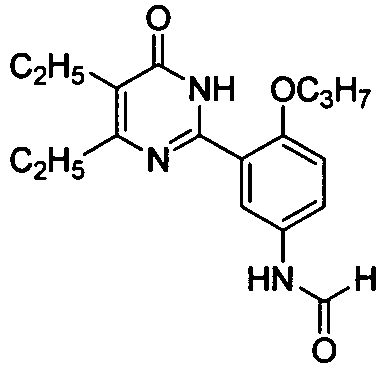
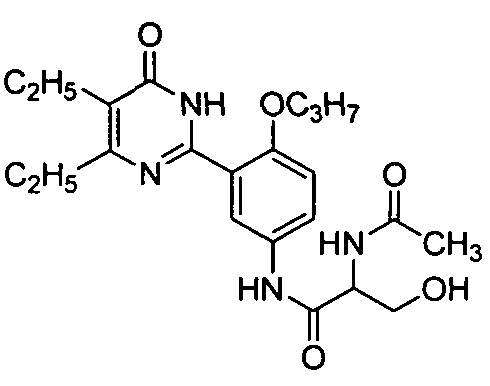
N-(3-(1,6-дигидро-4-изопропил-5-бром-6-оксопиримидин-2-ил)-4-пропоксифенил)-ацетамид,
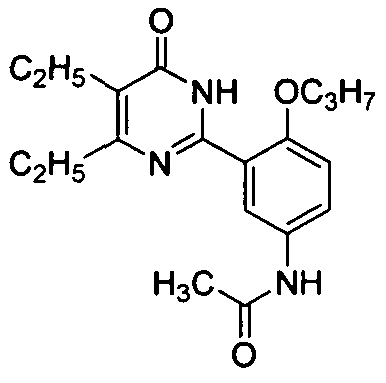
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)ацетамид,
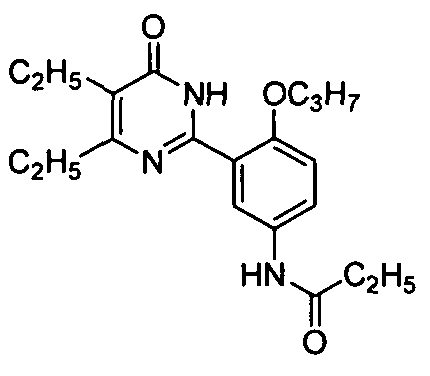
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)пропионамид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)циклогекс-амид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)формамид,
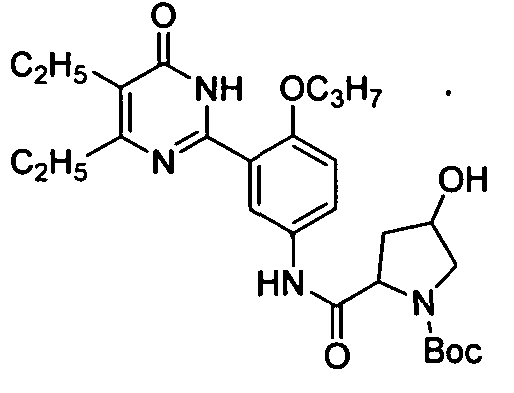
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)-1-трет-бутилоксикарбонил-4-гидроксипролиламид,
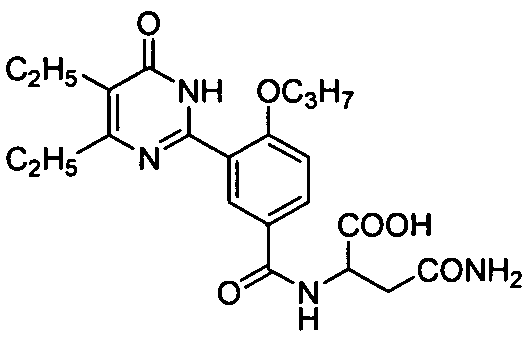
4-н-пропоксил-3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)бензойная кислота,
(морфолин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)-бензофенон,
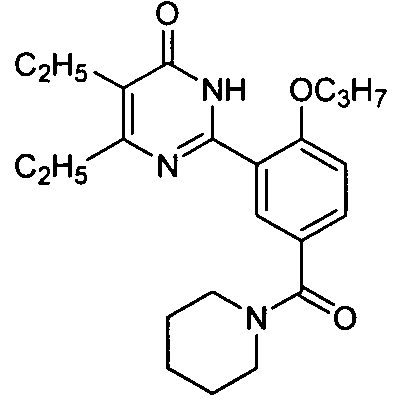
(пиперид-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)-бензофенон,
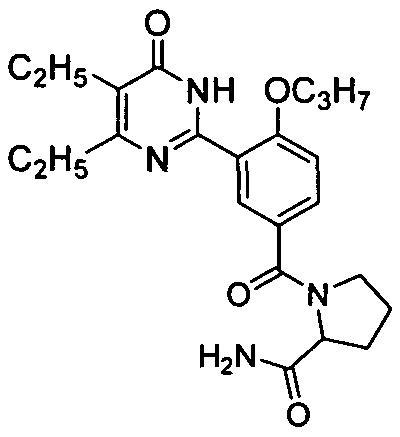
(2-аминоформилпиррол-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
4-н-пропоксил-3-(1,6-дигидро-4-изопропил-6-оксопиримидин-2-ил)бензойная кислота,
(морфолин-1-ил)(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
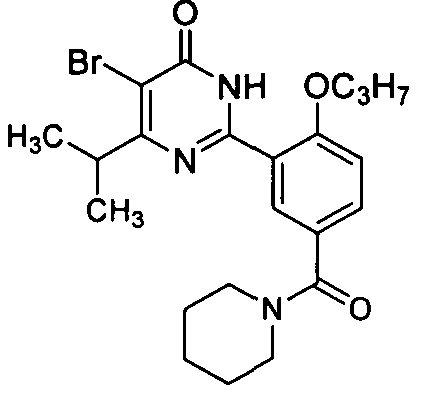
(пиперид-1-ил)(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
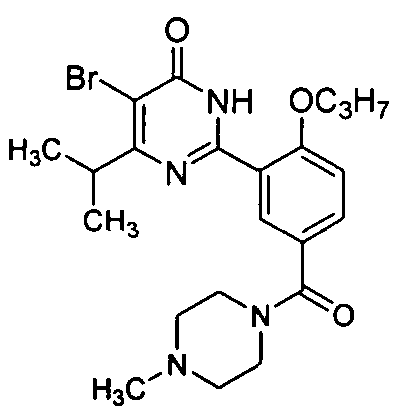
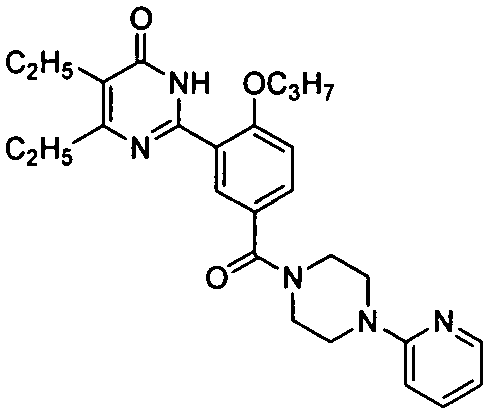
(4-метил-пиперазин-1-ил)(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
2-(5-(N,N-диметиламино-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
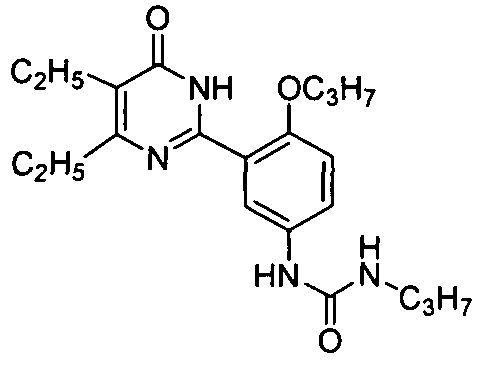
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевину,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этил-мочевину,
1-(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-фенилтиомочевину,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)гуанидин,
5-бром-6-изопропил-2-(5-(2-бромацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
5-бром-6-изопропил-2-(5-(2-морфолинилацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
5-бром-6-изопропил-2-(5-(2-(4-метил-пиперазин-1-ил)ацетил)-2-н-пропоксифенил)-пиримид-4(3H)-он,
5,6-диэтил-2-(5-(2-бромацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
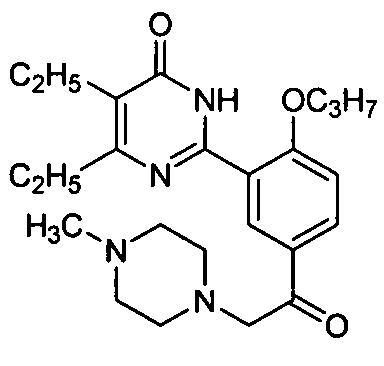
5,6-диэтил-2-(5-(2-(4-метил-пиперазин-1-ил)ацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
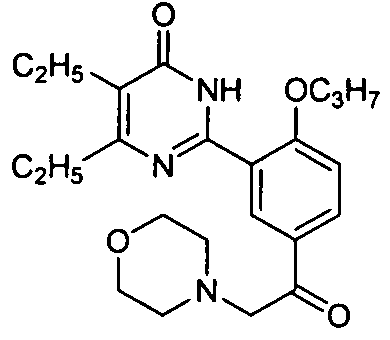
5,6-диэтил-2-(5-(2-морфолинилацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
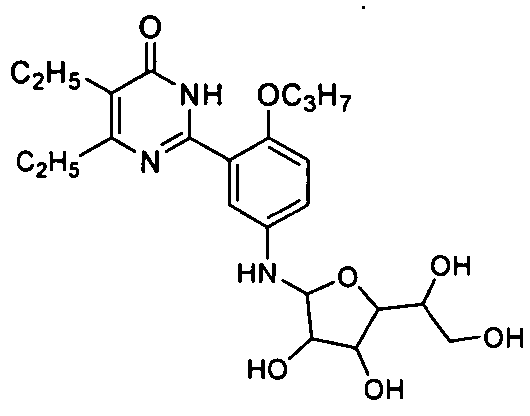
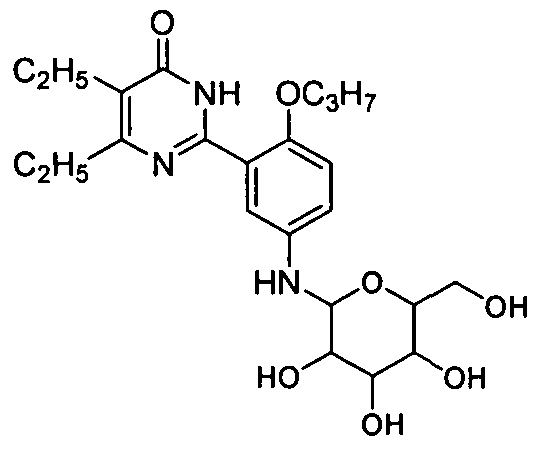
5-бром-6-изопропил-2-(2-н-пропоксил-5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-иламино)фенил)пиримид-4(3H)-он,
5-бром-6-изопропил-2-(2-н-пропоксил-5-(тетрагидро-3,4-дигидрокси-5-(1,2-ди-гидроксиэтил)фур-2-иламино)фенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(тетрагидро-3,4-дигидрокси-5-(1,2-дигидроксиэтил)-фур-2-иламино)фенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-иламино)фенил)пиримид-4(3H)-он,
2-(5-гидрокси-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)ацетат,
(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)этиламиноформат,
5,6-диэтил-2-(2-н-пропоксил-5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-илокси)фенил)пиримид-4(3H)-он,
(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мезилат,
2-(5-(2,5-диметил-1Н-пиррол-1-ил)-2-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
2,2′-(4-н-пропоксил-1,3-фенилен)бис(5,6-диэтилпиримид-4(3H)-он),
2-(5-(1,3,4-оксадиазол-2-ил)-2-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он,
этил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-ацетат,
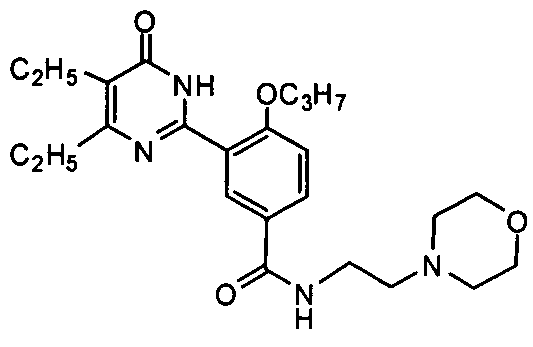
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-морфолинилэтил)-4-н-пропоксибензамид,
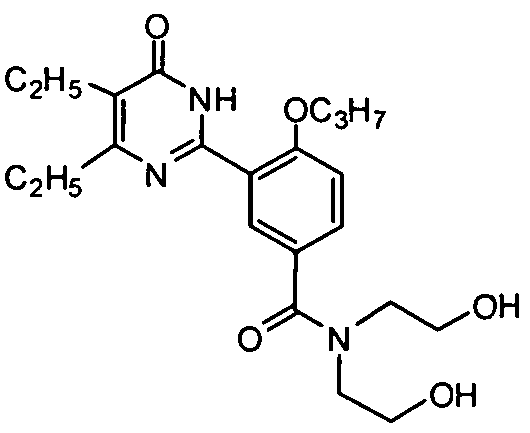
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N,N-ди(2-гидроксиэтил)-4-н-пропоксибензамид,
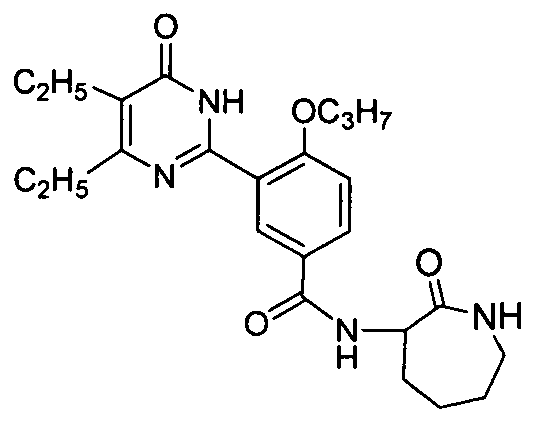
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-капролактам-3-ил)-4-н-пропоксибензамид,
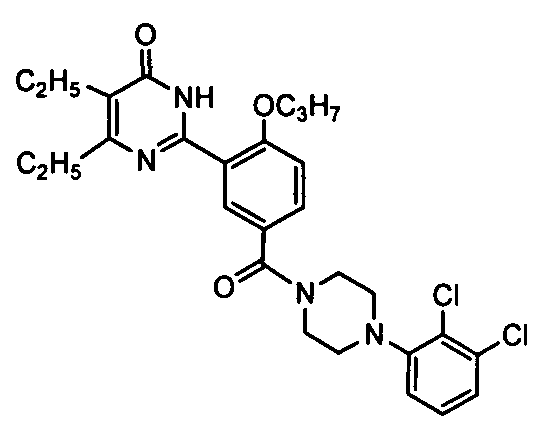
(4-(2,3-дихлорфенил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
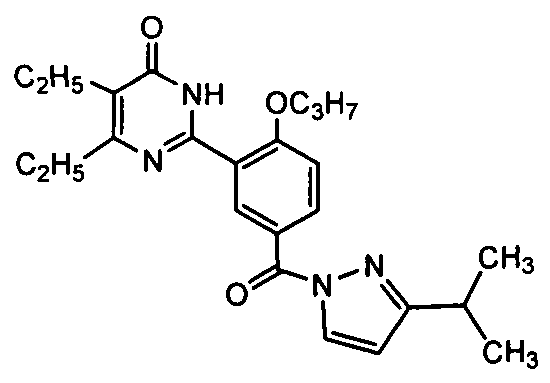
(3-изопропилпиразол-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
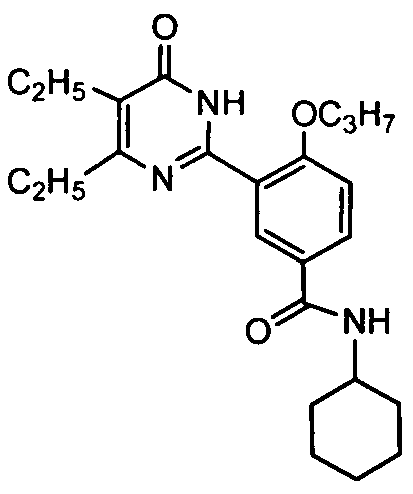
N-циклогексил-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамид,
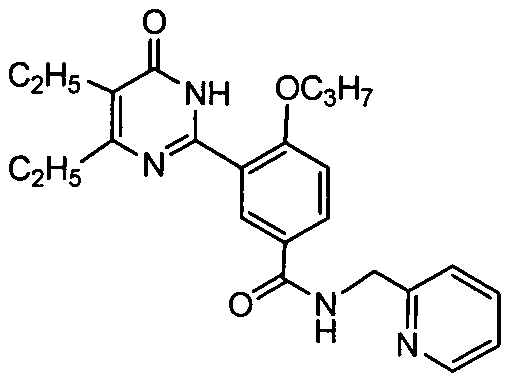
N-((пирид-2-ил)метил)-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамид,
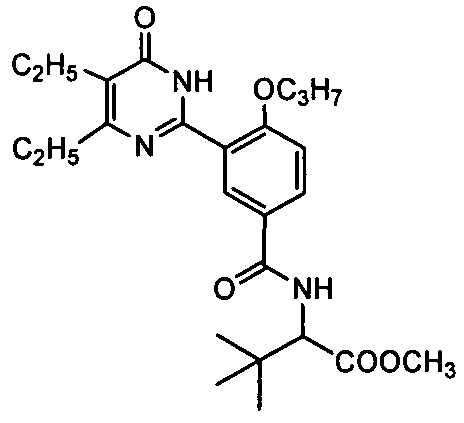
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибенз-амидо)-3,3-диметилбутират,
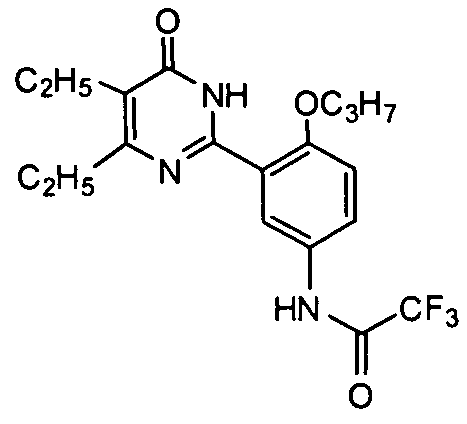
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2,2,2-трифторацетамид,
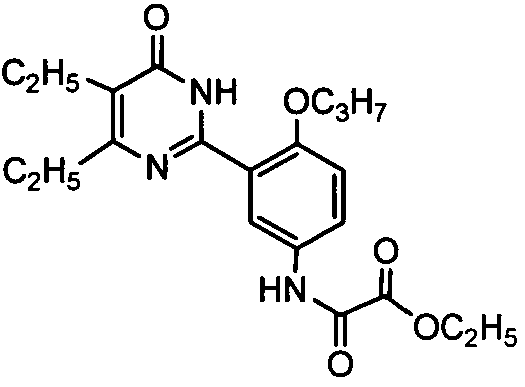
этил N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-аминоформилформат,
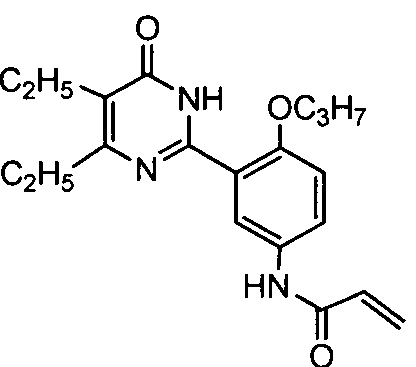
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)акриламид,
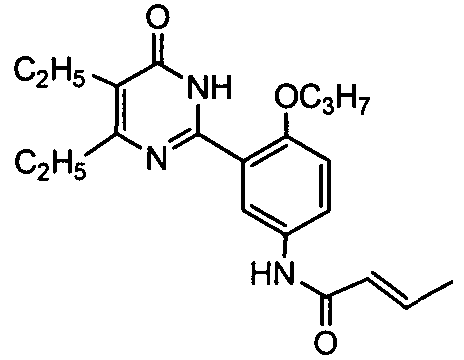
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-кротон-амид,
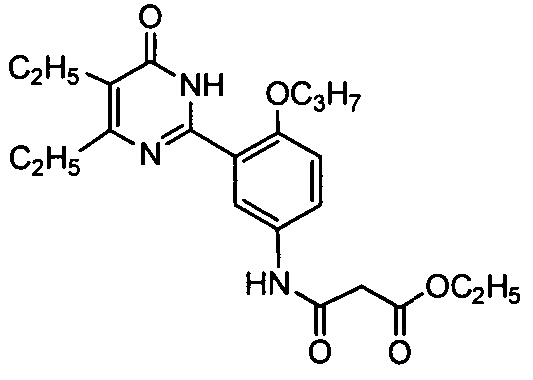
этил N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-аминоформилацетат,
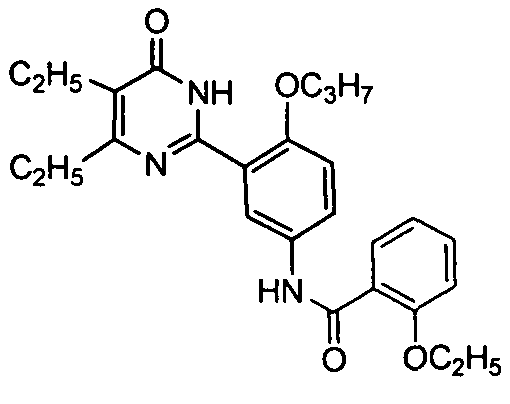
2-этоксил-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-бензамид,
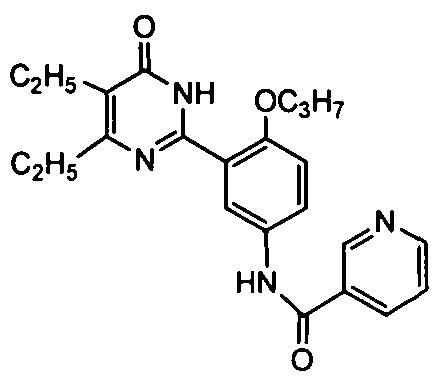
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)никотинамид,
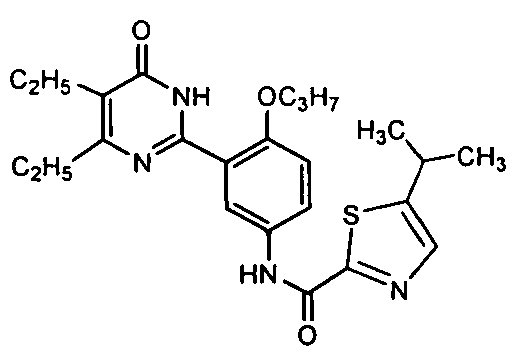
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-5-изо-пропилтиазолил-2-формамид,
трет-бутил 3-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)аминоформил)пропиламиноформат,
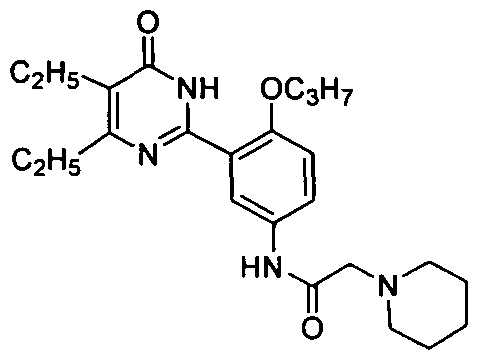
4-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)бутирамид,
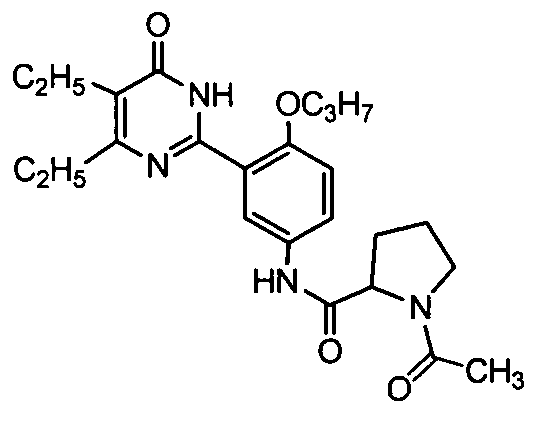
1-ацетил-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-пирролидинил-2-формамид,
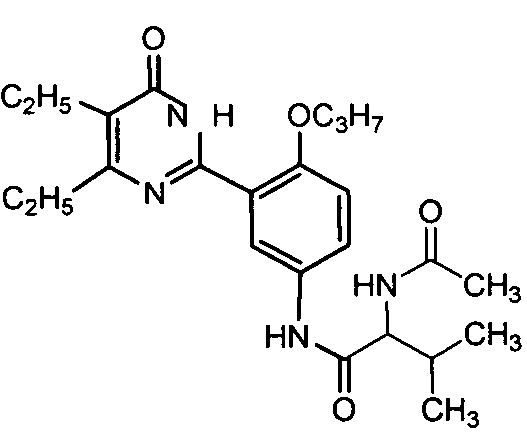
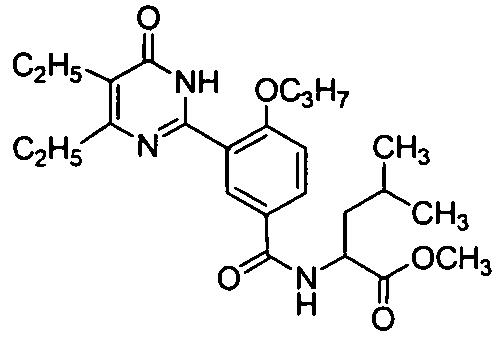
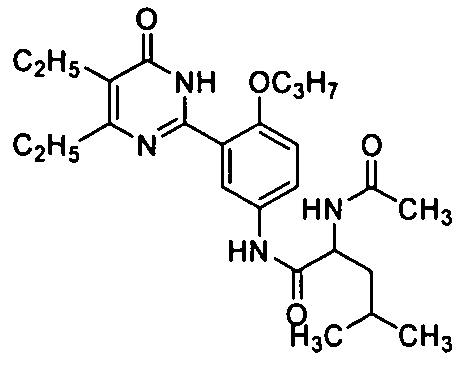
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-метилбутирамид,
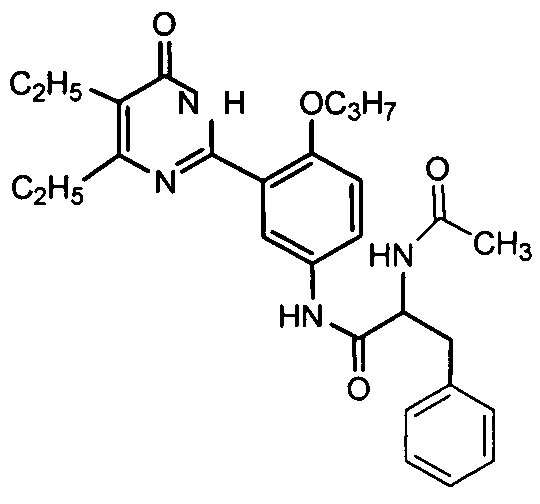
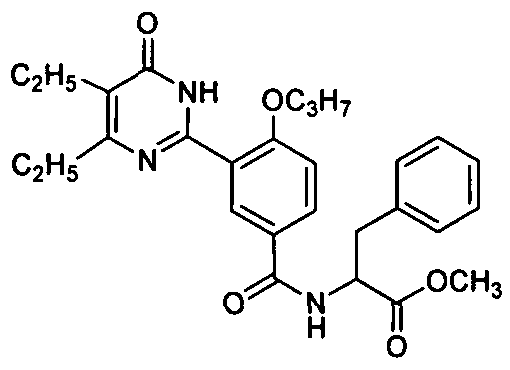
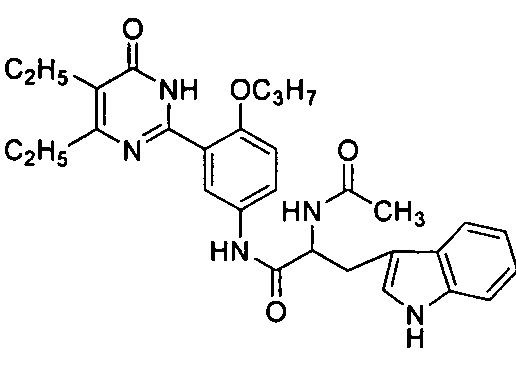
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)-3-фенилпропионамид,
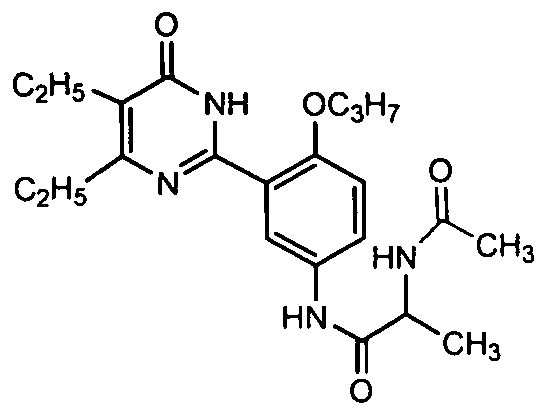
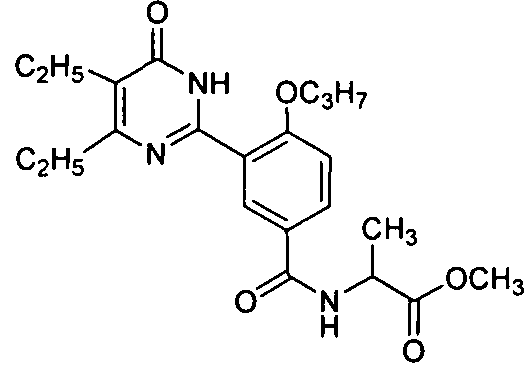
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)пропионамид,
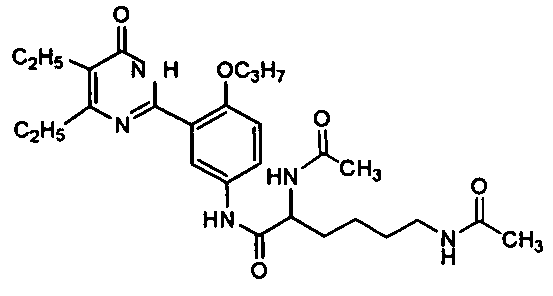
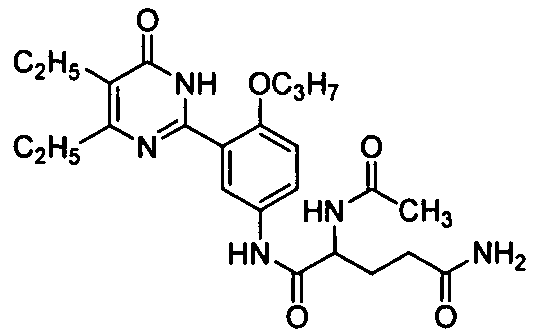
2,6-диацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)гексанамид,
N1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)пропан-диамид,
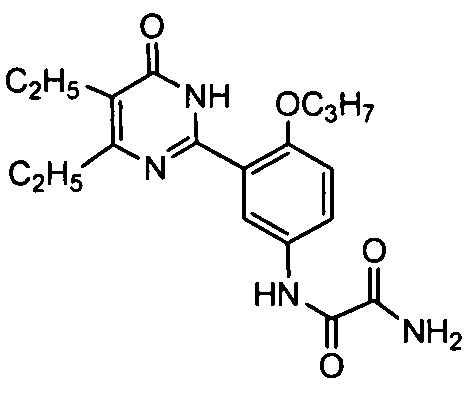
N1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)оксаламид,
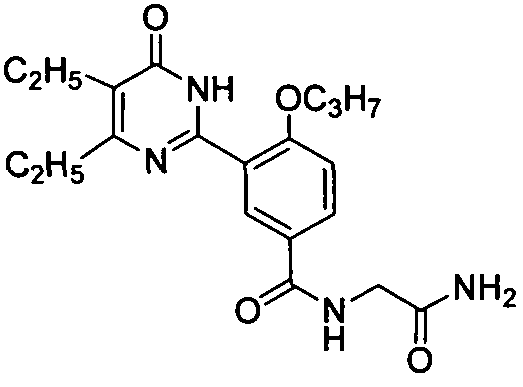
N-(аминоформилметил)-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-проп-оксибензамид,
5,6-диэтил-2-{2-н-пропоксил-5-[(2-(1-метилпиррол-2-ил)этил)аминосульфонил]-фенил}пиримид-4(3H)-он,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-(1-метилпиррол-2-ил)-этил)-4-н-пропоксилбензамид,
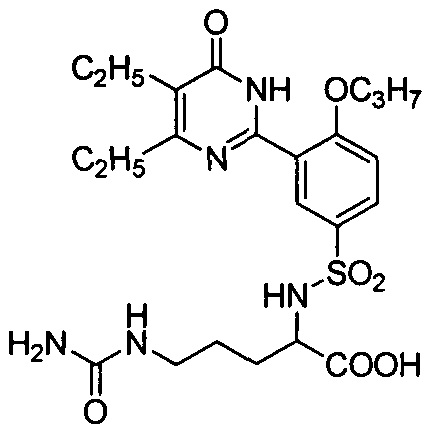
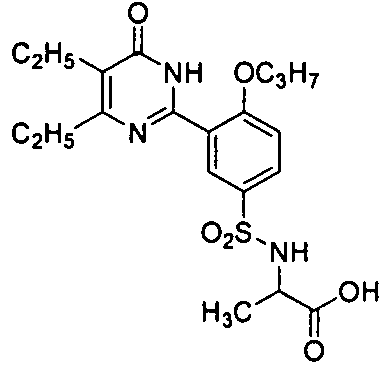
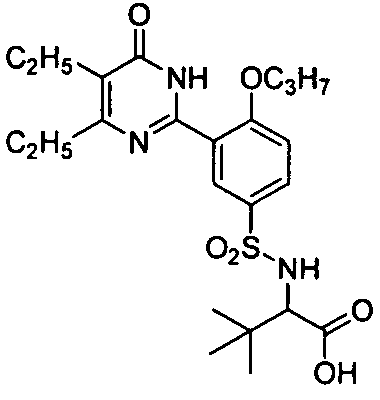
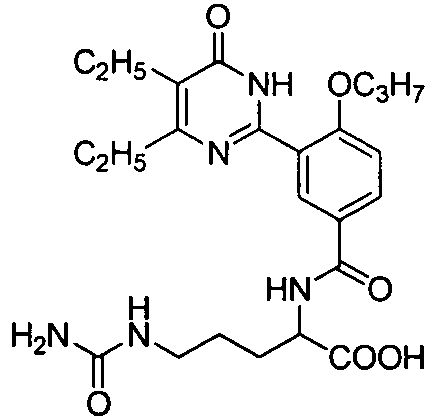
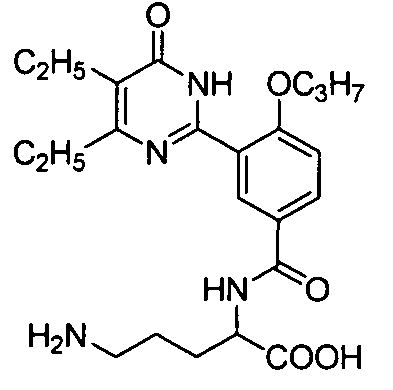
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-5-мочевинопентановую кислоту,
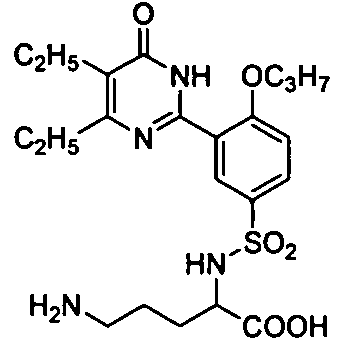
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-5-аминопентановую кислоту,
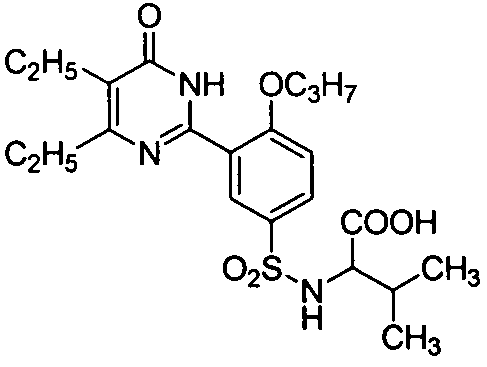
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-метилмасляную кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминопропановую кислоту,
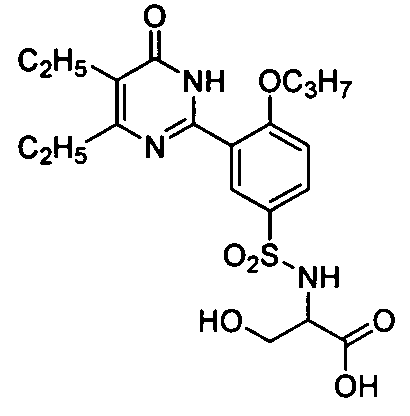
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-гидроксипропановую кислоту,
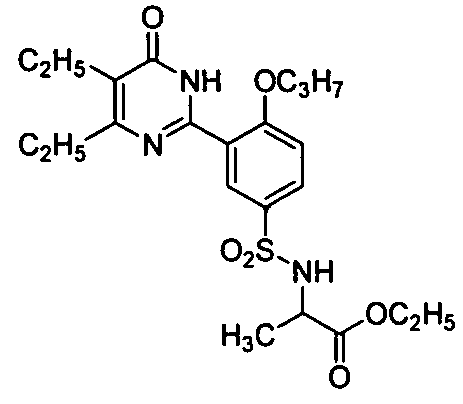
этил 2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминопропионат,
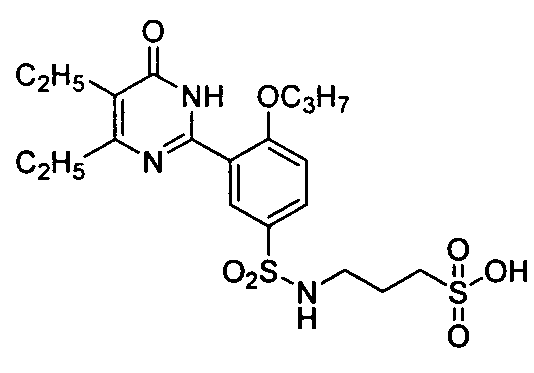
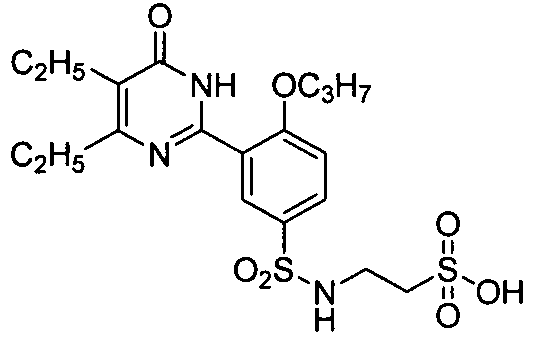
3-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминопропилсульфоновую кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминоэтилсульфоновую кислоту,
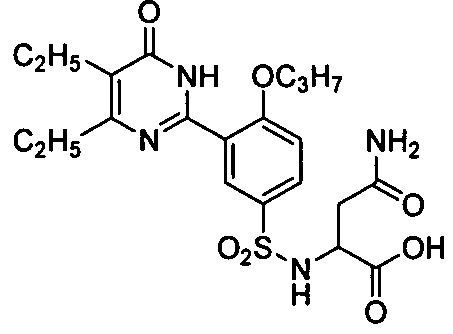
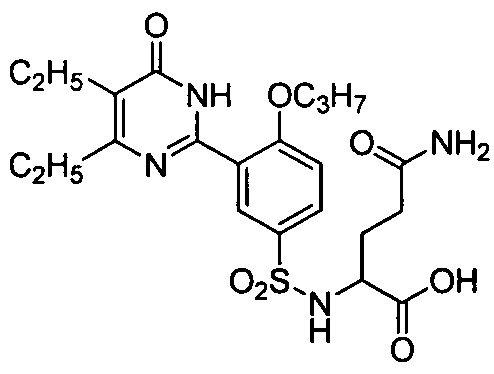
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-аминоформилпропановую кислоту,
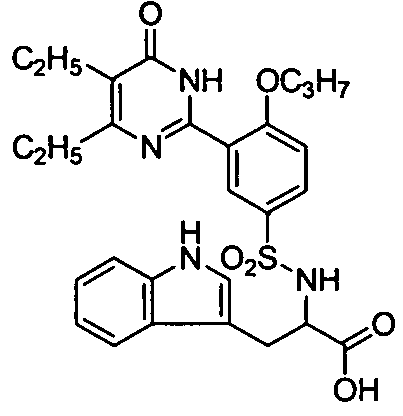
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-индолпропионовую кислоту,
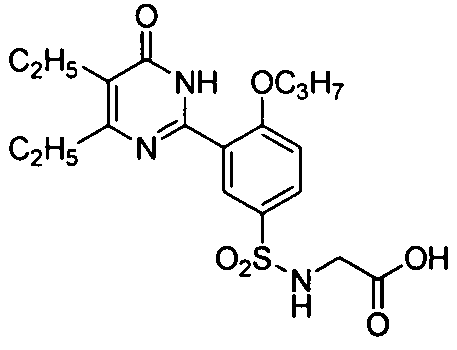
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминоуксусную кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3,3-диметилмасляную кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-4-аминоформилмасляную кислоту,
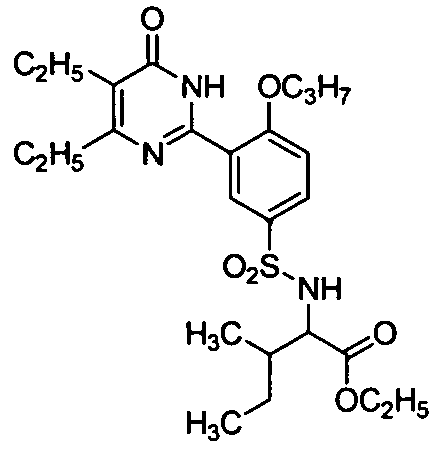
этил 2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-метилвалерат,
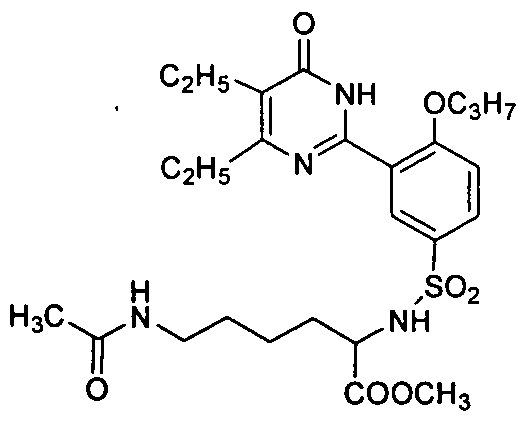
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенилсульфонамидо)-6-ацетамидокапроат,
5,6-диэтил-2-(2-н-пропоксил-5-(4-гидроксиэтил-1-пиперазинилсульфонил)фенил] -пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(3-гидроксипропиламиносульфонил)фенил]пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(N-(2-морфолинилэтил)-N-(2-гидроксиэтил)аминосульфонил)фенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(N-метил-N-(2-(пирролидин-1-ил)этил)аминосульфонил)фенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(2-(N,N-диэтил)аминоэтиламиносульфонил)фенил]-пиримид-4(3H)-он малеат,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-фенилпропановую кислоту,
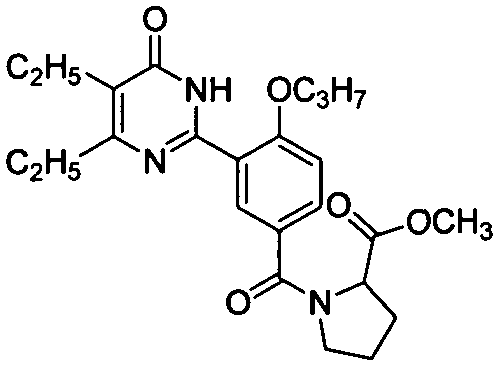
метил N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензоил-пролинат,
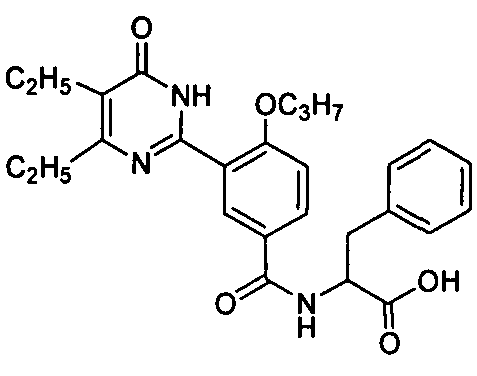
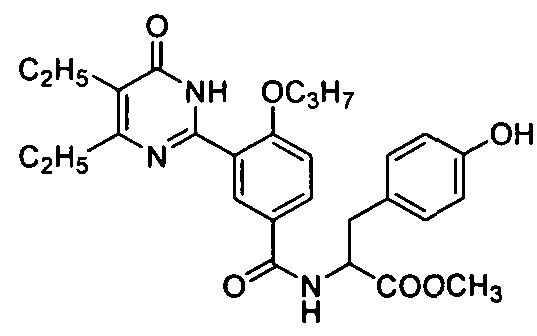
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-3-(4-гидроксифенил)пропионат,
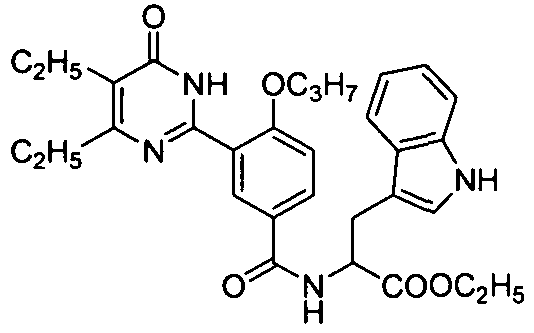
этил 2-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-(1H-индол-3-ил)пропионат,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-3-метилбутират,
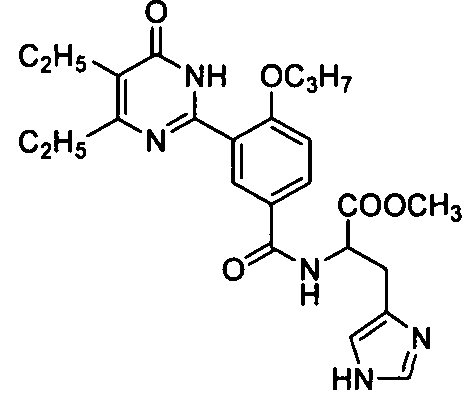
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-3(1H-имидазол-4-ил)пропионат,
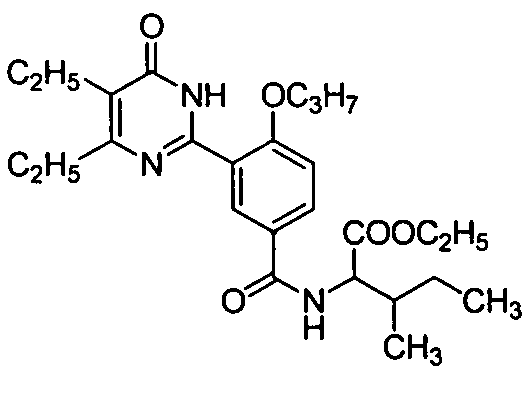
этил 2-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-метилвалерат,
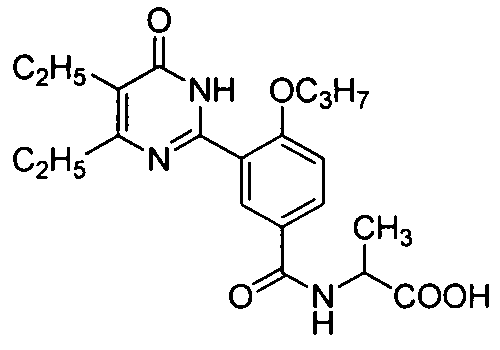
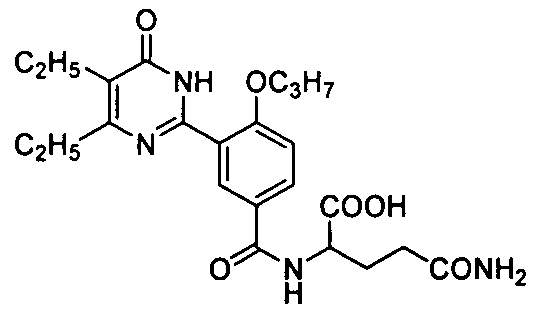
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-пропионовую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-аминоформилпропионовую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-4-аминоформилмасляную кислоту,
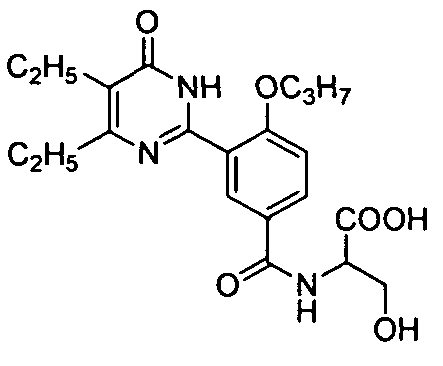
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-гидроксипропионовую кислоту,
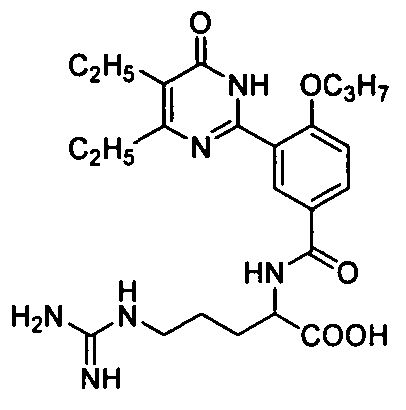
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-гуанидинопентановую кислоту,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-фенилпропионат,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-пропионат,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-4-метилвалерат,
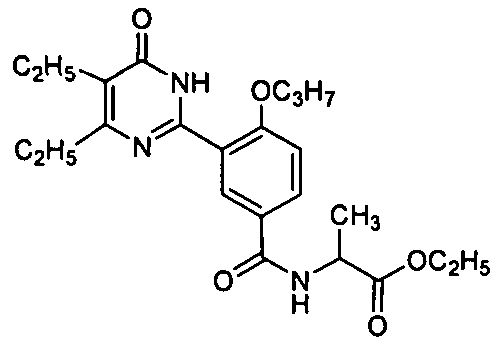
этил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-пропионат,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(1-(4-метилпиперазин-1-ил)-1-оксопропан-2-ил)-4-н-пропоксибензамид,
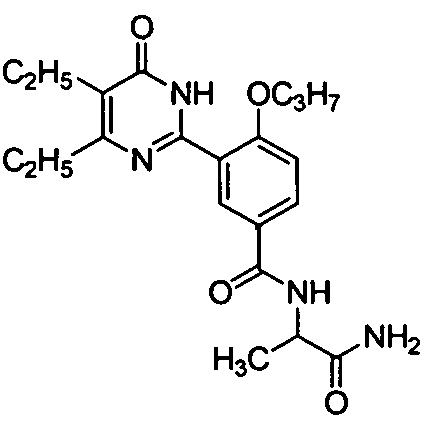
N-(1-аминоформилэтил)-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамид,
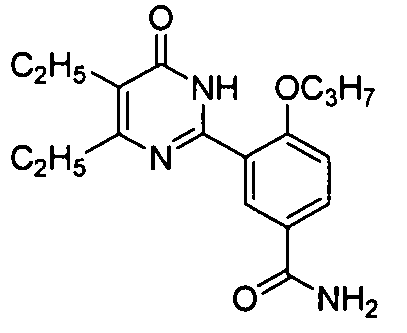
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамид,
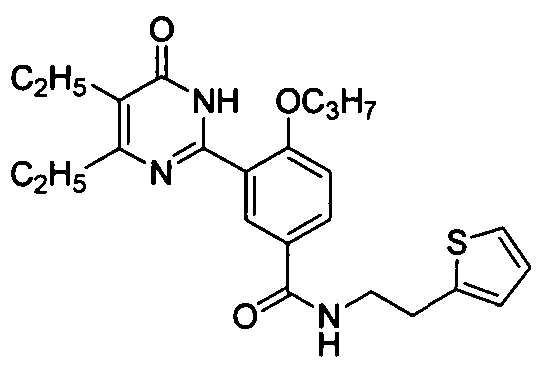
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил-N-(2-(тиен-2-ил)-этил)бензамид,
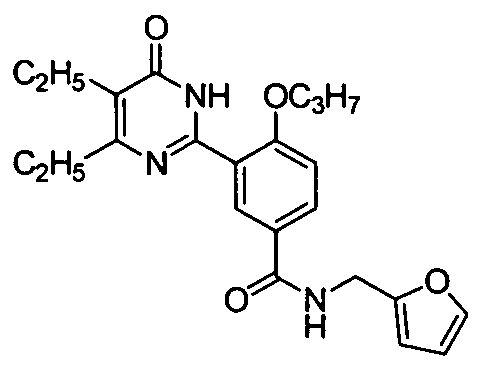
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил-N-((фур-2-ил)-метил)бензамид,
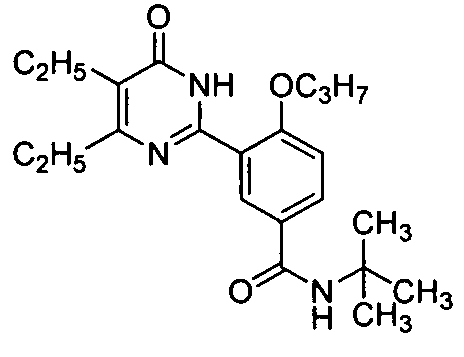
N-трет-бутил-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибенз-амид,
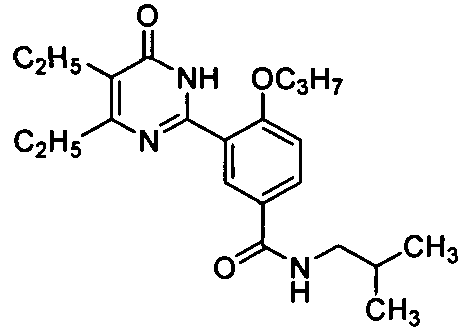
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-изобутил-4-н-пропоксилбенз-амид,
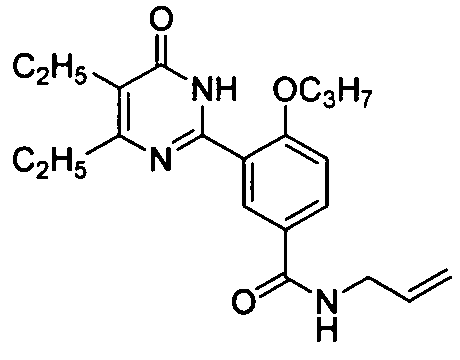
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-аллил-4-н-пропоксилбензамид,
(4-(пирид-2-ил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
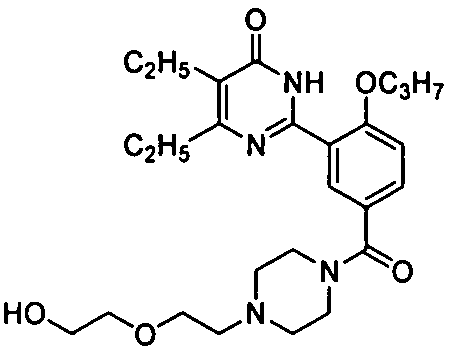
(4-(гидроксиэтилоксилэтил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
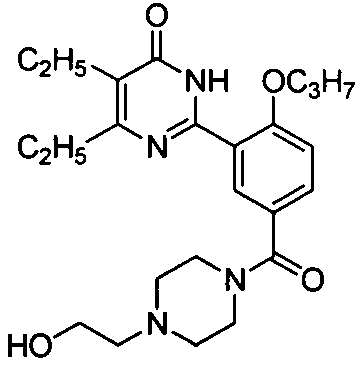
(4-(гидроксиэтил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
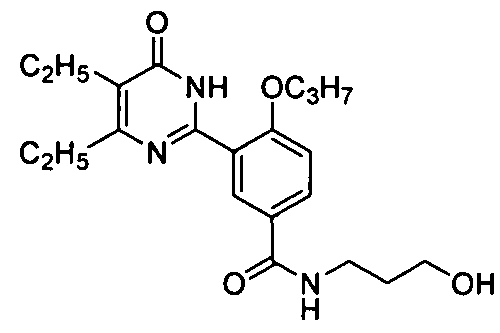
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(3-гидроксипропил)-4-н-проп-оксилбензамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(1-гидрокси-2-пропил)-4-н-пропоксибензамид,
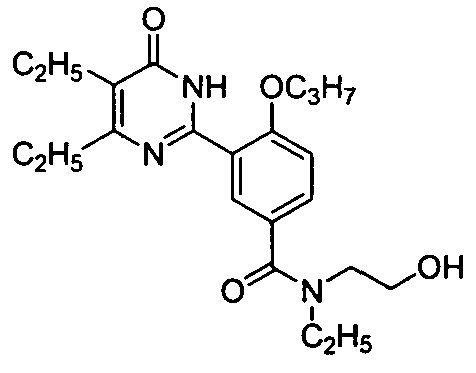
N-этил-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-гидроксиэтил)-4-н-пропоксилбензамид,
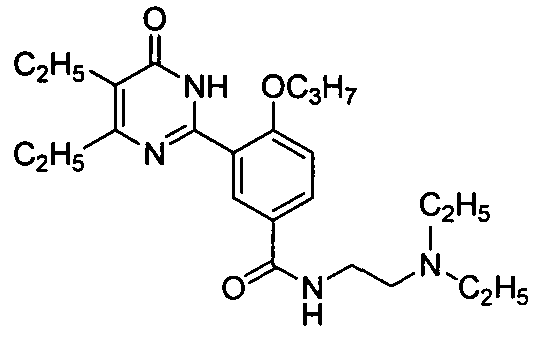
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-диэтиламиноэтил)-4-н-пропоксилбензамид,
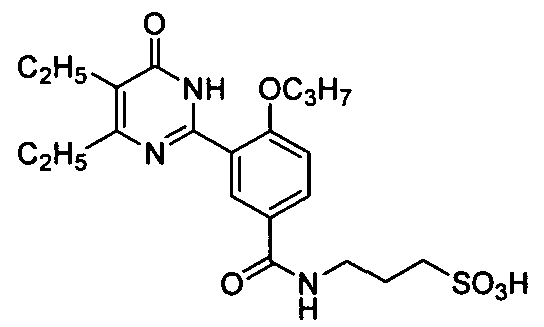
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)пропил-1-сульфоновую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)этилсульфоновую кислоту,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-гидроксиэтил)-N-метил-4-н-пропоксилбензамид,
(4-бензилпиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-метил-N-(2-(пирролидин-1-ил)-этил)-4-н-пропоксибензамид,
метил 5-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)пиперидил-2-формат,
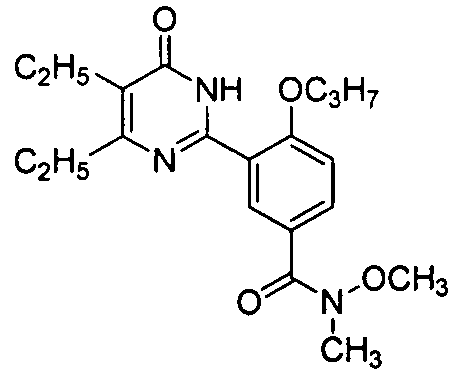
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-метоксил-N-метил-4-н-пропоксибензамид,
5,6-диэтил-2-[2-(3-метоксилн-пропоксил)-5-(4-метил-1-пиперазинилсульфонил)-фенил]пиримид-4(3H)-он,
2-хлор-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-ацетамид,
2-(диметиламино)-N-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-проп-оксифенил)ацетамид,
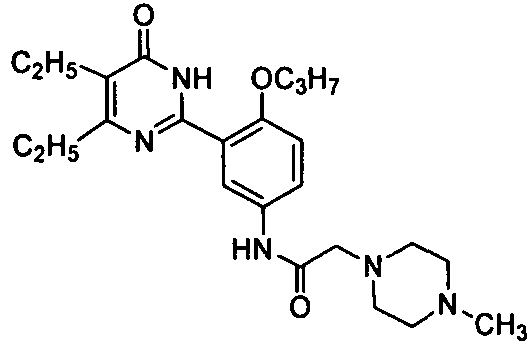
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-(4-метилпиперазин-1-ил)ацетамид,
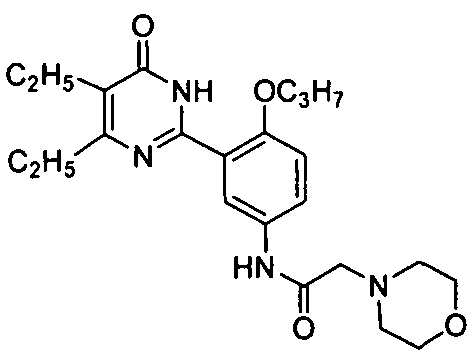
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-морфолинил)ацетамид,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-(пиперид-1-ил)ацетамид,
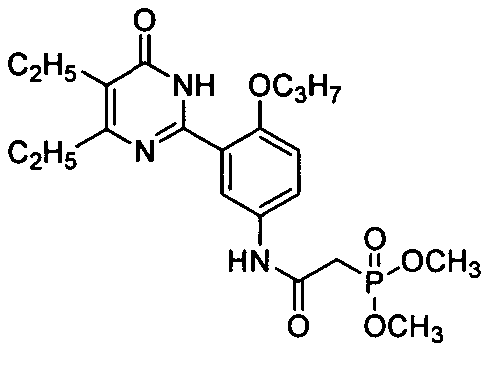
диметил (3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифениламиноформил)метилфосфат,
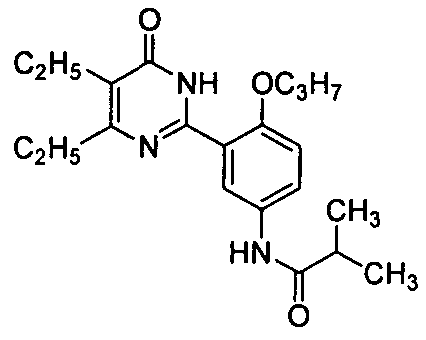
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)изобутирамид,
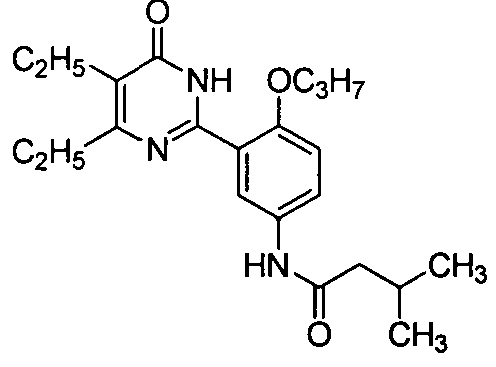
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-метилбутирамид,
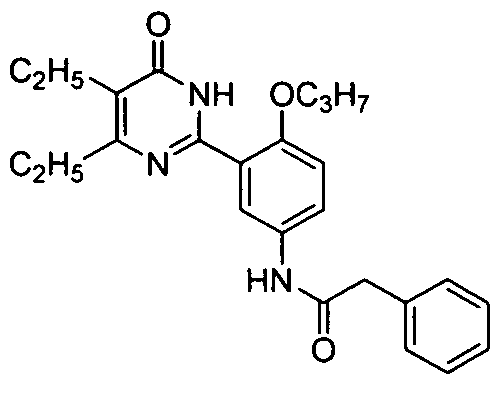
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-фенилацетамид,
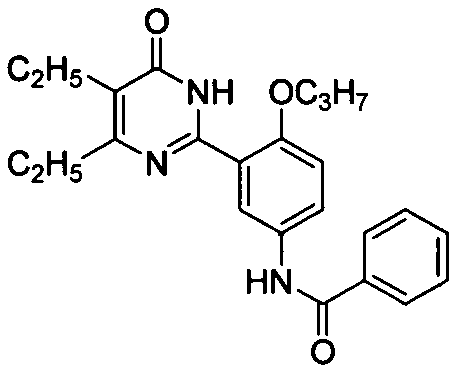
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)бензамид,
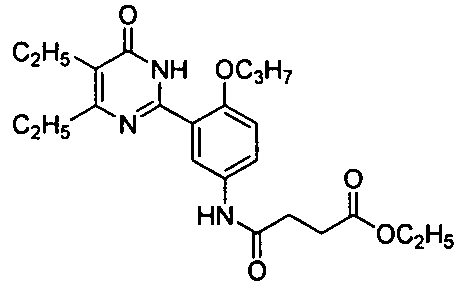
этил 3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифениламиноформил)пропионат,
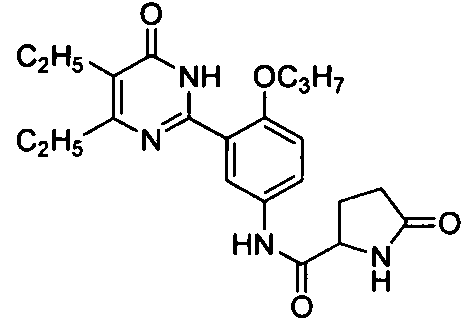
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-5-оксопирролидинил-2-формамид,
2-ацетамидо-N-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-4-метилпентанамид,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-ацет-амидо-3-(1H-индол-3-ил)пропионамид,
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)глютарамид,
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-гидроксибутирамид,
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-гидроксипропионамид,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифениламиноформил)-2-ацетамидоэтилацетат,
5,6-диэтил-2-(5-(этиламино)-2-н-пропоксифенил)пиримид-4(3H)-он,
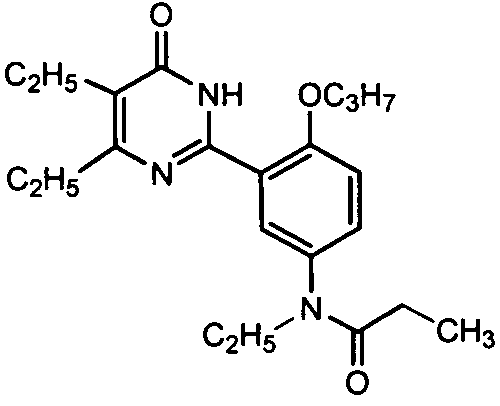
N-этил-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-пропионамид,
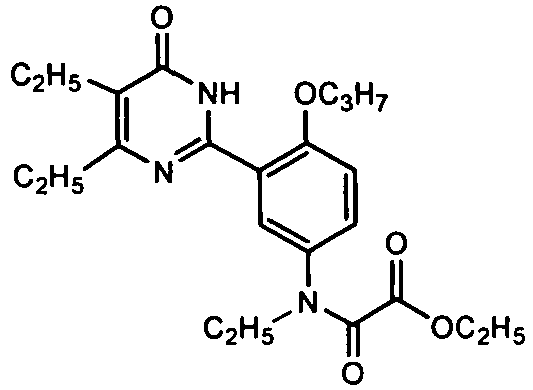
этил (N-этил-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)аминоформилформат,
1,3-диэтил-1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-мочевина,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)пиперидил-1-формамид,
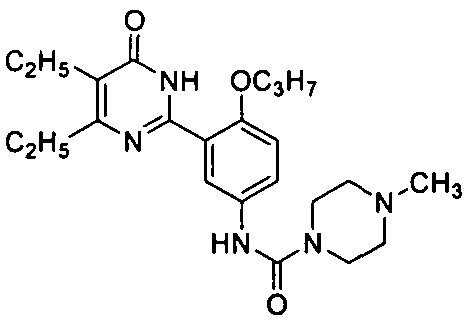
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-4-метилпиперазинил-1-формамид,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-пропилмочевину,
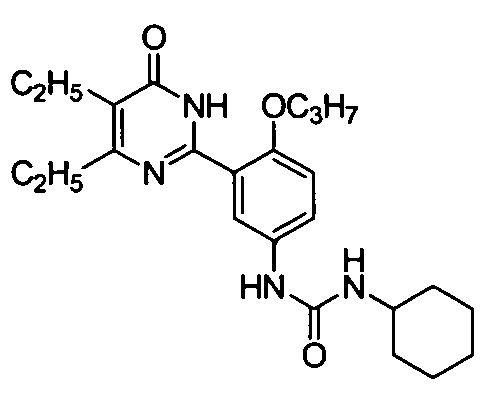
1-циклогексил-3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевину,
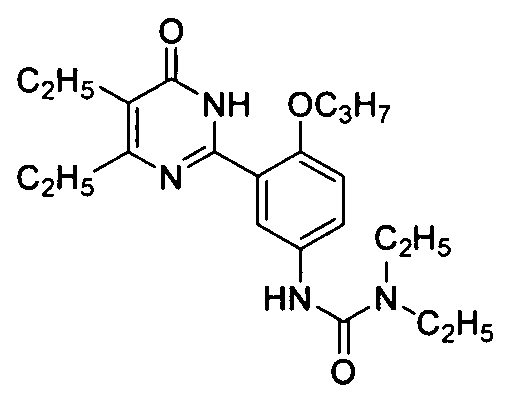
1,1-диэтил-3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-мочевина,
1-(2-(диэтиламино)этил)-3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевина малеат,
(4-метилпиперазин-1-ил)(3-(4,5-диэтил-1,б-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
5-иод-6-изопропил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5-хлор-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-((тетрагидро-2,4,5-тригидрокси-6-(гидроксиметил)-2Н-пиран-3-иламино)сульфонил)фенил]пиримид-4(3H)-он,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-мочевинопентановую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-аминопентановую кислоту,
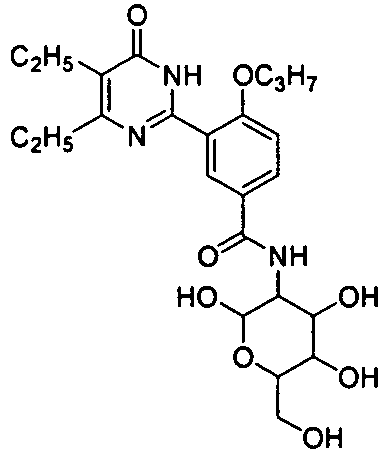
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(тетрагидро-2,4,5-три-гидрокси-6-(гидроксиметил)-2H-пиран-3-ил)-4-н-пропоксибензамид,
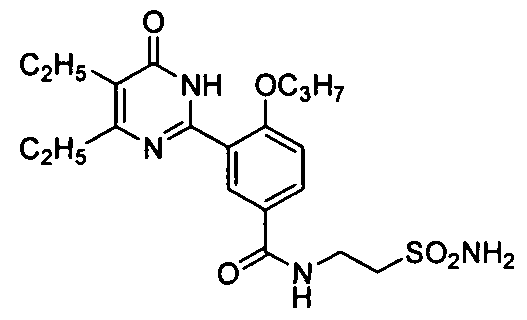
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)этил-сульфамид,
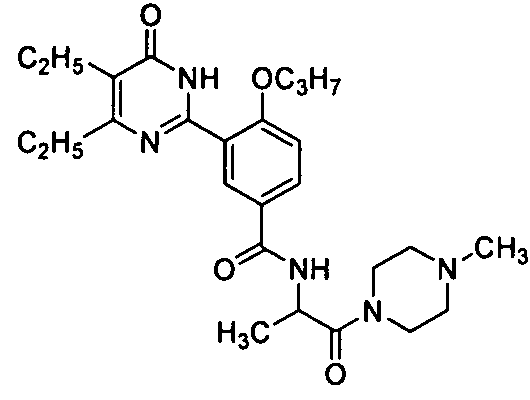
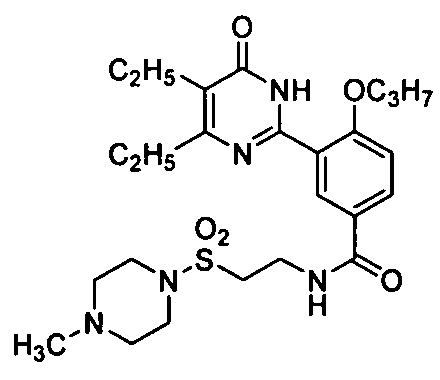
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(4-метилпиперазин-1-ил-сульфонилэтил)-4-н-пропоксибензамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(N,N-диэтиламиносульфонилэтил)-4-н-пропоксибензамид,
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)пропилсульфамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(4-метилпиперазин-1-ил-сульфонилпропил)-4-н-пропоксибензамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(N,N-диэтиламиносульфонилпропил)-4-н-пропоксибензамид,
5,6-диэтил-2-(5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-ил)-2-н-пропоксифенил)пиримид-4(3H)-он,
5-иод-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
5-бром-6-этил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он, и
5-хлор-6-изопропил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он.
В более предпочтительном варианте настоящего изобретения упомянутое производное фенилпиримидона формулы I или его фармацевтически приемлемые соли выбраны из группы, включающей следующие соединения:
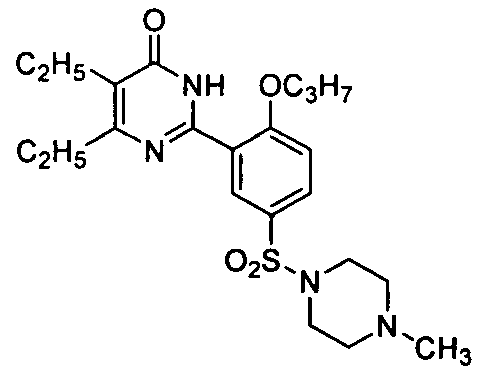
5,6-диэтил-2-[2-н-пропоксил-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он,
5,6-диэтил-2-{2-н-пропоксил-5-[N-(2-морфолинилэтил)аминосульфонил)фенил}-пиримид-4(3H)-он,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенилсульфонилпролин,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этилтио-мочевину,
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′,N″-триэтилгуанидин,
N-[3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]пирролил-1-формамид,
5-бром-6-изопропил-2-(2-н-пропоксил-5-мезиламидофенил)пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-мезиламидофенил)пиримид-4(3H)-он,
N-(3-(1,6-дигидро-4-изопропил-5-бром-6-оксопиримидин-2-ил)-4-пропоксифенил)-ацетамид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)ацетамид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)пропионамид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)циклогекс-амид,
N-(3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)-1-трет-бутил-оксикарбонил-4-гидроксипролиламид,
(морфолин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-проп-оксил)-бензофенон,
(пиперид-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)-бензофенон,
(2-аминоформилпиррол-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
(морфолин-1-ил)(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксил)бензофенон,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевину,
1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этилмочевину,
5,6-диэтил-2-(5-(2-морфолинилацетил)-2-н-пропоксифенил)пиримид-4(3H)-он,
2,2′-(4-н-пропоксил-1,3-фениленил)бис(5,6-диэтилпиримид-4(3H)-он),
этил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-ацетат,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2,2,2-трифторацетамид,
этил N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)аминоформилацетат,
4-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)бутирамид,
1-ацетил-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-пирролидинил-2-формамид,
2-ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)-3-фенилпропионамид,
N1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)оксаламид,
5,6-диэтил-2-{2-н-пропоксил-5-[(2-(1-метилпиррол-2-ил)этил)аминосульфонил]-фенил}пиримид-4(3H)-он,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-(1-метилпиррол-2-ил)этил)-4-н-пропоксилбензамид,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-5-мочевинопентановую кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-5-аминопентановую кислоту,
этил 2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминопропионат,
3-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминопропилсульфоновую кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)аминоэтилсульфоновую кислоту,
2-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-сульфонил)амино-3-аминоформилпропановую кислоту,
5,6-диэтил-2-(2-н-пропоксил-5-(4-гидроксиэтил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он,
5,6-диэтил-2-(2-н-пропоксил-5-(N--(2-морфолинилэтил)-N-(2-гидроксиэтил)аминосульфонил)фенил)пиримид-4(3H)-он,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-фенилпропановую кислоту,
метил N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензоилпролинат,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-3-(4-гидроксифенил)пропионат,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензамидо)-пропановую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-аминоформилпропановую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-гуанидинопентановую кислоту,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-3-фенилпропановую кислоту,
метил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-пропановую кислоту,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(1-(4-метилпиперазин-1-ил)-1-оксопропан-2-ил)-4-н-пропоксибензамид,
N-(1-аминоформилэтил)-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамид,
(4-(гидроксиэтилоксилэтил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксо-пиримидин-2-ил)-4-н-пропоксилбензофенон,
(4-(гидроксиэтил)пиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(1-гидрокси-2-пропил)-4-н-пропоксибензамид,
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)пропил-1-сульфоновую кислоту,
метил 5-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-пиперидинил-2-формат,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-2-(4-метилпиперазин-1-ил)ацетамид,
N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)бензамид,
1-(2-(диэтиламино)этил)-3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевина малеат,
(4-метилпиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксилбензофенон,
5,6-диэтил-2-(2-н-пропоксил-5-((тетрагидро-2,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-3-иламино)сульфонил)фенил]пиримид-4(3H)-он,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-мочевинопентановую кислоту,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-5-аминопентановую кислоту,
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(тетрагидро-2,4,5-три-гидрокси-6-(гидроксиметил)-2H-пиран-3-ил)-4-н-пропоксибензамид,
2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)этилсульфамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(4-метилпиперазин-1-ил-сульфонилэтил)-4-н-пропоксибензамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(N,N-диэтиламиносульфонилэтил)-4-н-пропоксибензамид,
3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)-пропилсульфамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(4-метилпиперазин-1-ил-сульфонилпропил)-4-н-пропоксибензамид,
3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(N,N-диэтиламиносульфонилпропил)-4-н-пропоксибензамид, и
5,6-диэтил-2-(5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-ил)-2-н-пропоксифенил)пиримид-4(3H)-он.
В вышеуказанных определениях, если особо не оговорено, алкил или алкоксигруппа с 3 или более атомами углерода могут иметь прямую или разветвленную структуру.
Соединения формулы I могут иметь один или более хиральных участка, таким образом, они могут иметь стереоизомеры, то есть энантиомеры, диастереоизомеры или их смесь. Если соединение формулы I содержит алкенил или алкенилен, оно может также существовать в виде цис(E)-транс(Z) изомеров. Соответственно, соединение формулы I согласно настоящему изобретению может быть единственным изомером или смесью различных изомеров.
Разделение диастереоизомеров или цис- и транс-изомеров может быть осуществлено общеизвестными методами, например, фракционной кристаллизацией, хроматографией или жидкостной хроматографией высокого разрешения (HPLC) стереоизомерной смеси соединения формулы I, его приемлемых солей или производных. Соединение формулы I также может быть получено из соответствующих оптически чистых промежуточных соединений или растворением соответствующих рацематов, используя подходящий хиральный вектор, например разделением диастереоизомерных солей, полученных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием при помощи HPLC или фракционной кристаллизации.
Соединения формулы I могут иметь таутомеры, и настоящее изобретение также включает таутомер как таковой или их смесь.
Настоящее изобретение включает меченные изотопом производные соединения формулы I, которые являются приемлемыми для биологических исследований.
Настоящее изобретение относится к фармацевтически приемлемым солям соединения формулы I, имеющим щелочной центр, например солям, полученным добавлением нетоксичных кислот, например неорганических кислот, таких как соляная, бромистоводородная, йодистоводородная, серная и фосфорная кислота, или органических карбоновых кислот или органических сульфокислот.
Соединения формулы I могут также взаимодействовать с основаниями с получением фармацевтически приемлемых солей металлов, в частности нетоксичных солей щелочных металлов, таких как соли натрия и калия. Предпочтенными являются метансульфонат и гидрохлорат.
Настоящее изобретение включает любое пролекарство соединения формулы I.
Настоящее изобретение кроме этого включает фармацевтически приемлемые оксиды соединения формулы I и его фармацевтически приемлемые соли (указаны как соли фармацевтически приемлемого оксида).
Настоящее изобретение дополнительно включает различные кристаллические формы соединения формулы I и его солей.
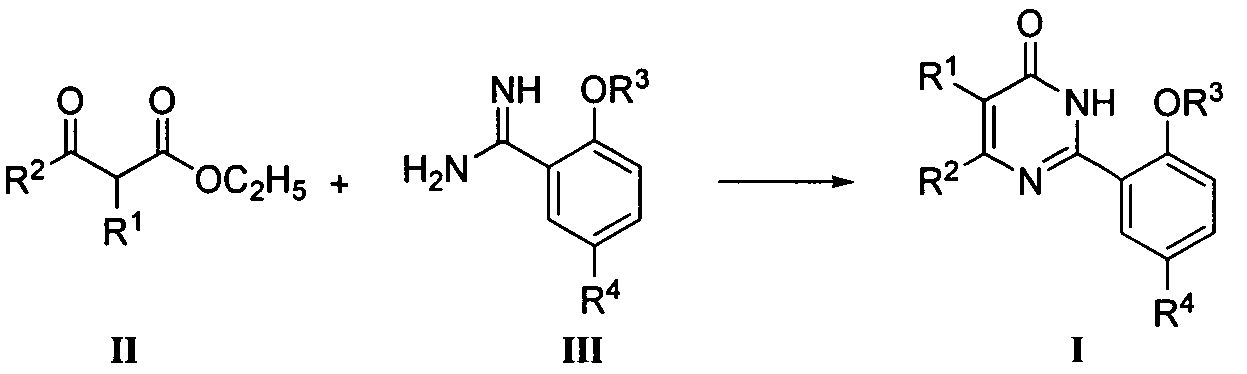
Настоящее изобретение также относится к способу получения производных фенилпиримидона формулы I или его фармацевтически приемлемых солей, где способ включает:
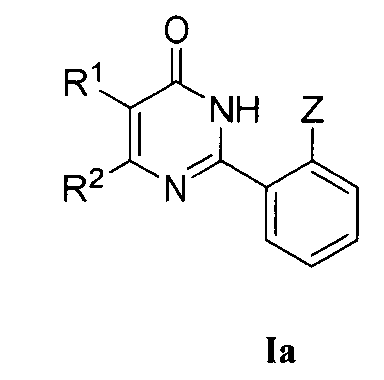
(А) когда Z означает OR3, соединение формулы I может быть получено по следующим методикам:
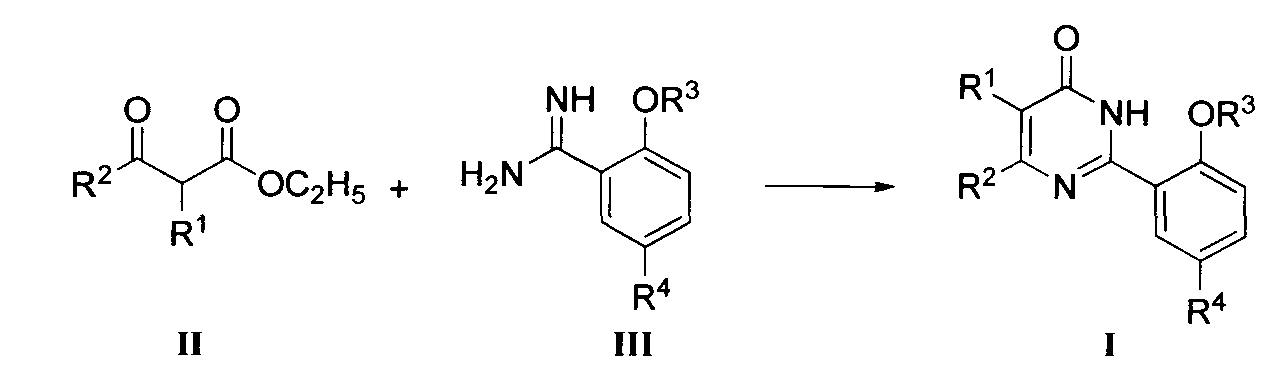
(1) когда R4 означает ОН, SO2NR6R7, COR11, незамещенный или замещенный C2-C4 алкил, незамещенный или замещенный C2-C4 алкенил или незамещенный или замещенный 5-7-членный гетероциклил, соединение формулы I может быть получено циклизацией соединения формулы II с соединением формулы III в присутствии основания, где R1, R2, R3, R6, R7, R11 и упомянутый 5-7-членный гетероциклил являются такими, как определено выше. Реакция обычно осуществляется при температуре в пределах от 50°C до 120°C. Растворитель предпочтительно выбирают из группы, включающей хлороформ, метанол, этанол, монометиловый эфир этиленгликоля, N,N-диметилформамид и диоксан. Время реакции составляет от 0,5 до 10 часов, и упомянутым основанием является предпочтительно K2CO3 или NaOC2H5;
или
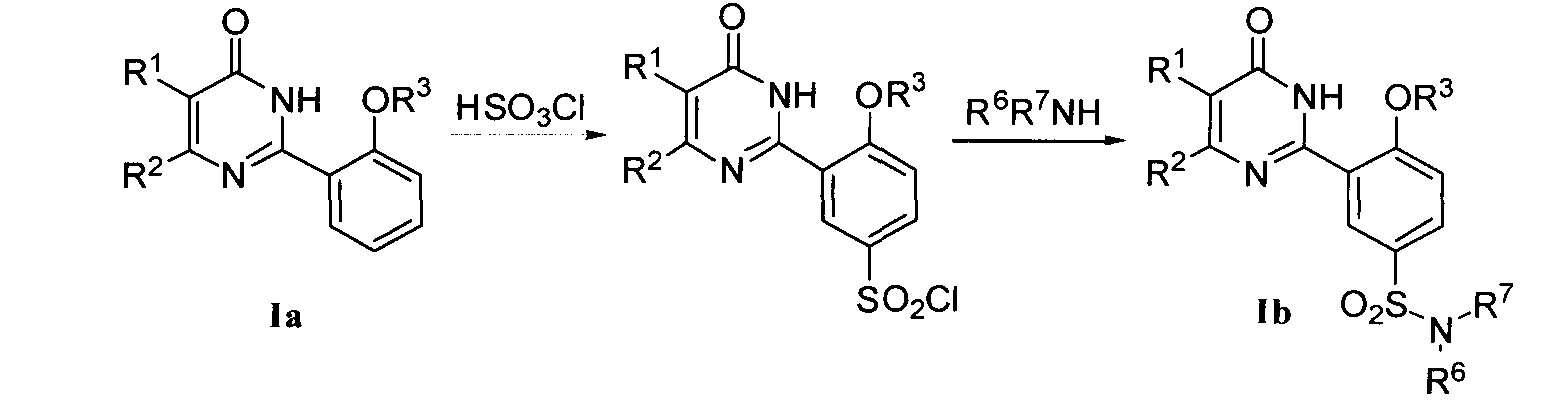
(2) соединение формулы I может быть получено преобразованием соединения формулы Ia, соединения формулы Ie или других соединений формулы I, где R1, R2, R3, R5, R6, R7, R8, R9, R10, R12, R15, R16, R17, R18, R19 и R20 являются такими, как определено выше, где способ получения соединения формулы Ia выполняется по вышеуказанной методике (1) и соединение формулы Ie (которое является известным соединением) может быть получено бромированием соединения формулы Ia, в котором,
1) когда R4 означает SO2NR6R7, соединение формулы Ib может быть получено из соединения формулы Ia путем хлорсульфирования с последующим взаимодействием с R6R7NH в присутствии органического основания, такого как пиридин или триэтиламин, в подходящем органическом растворителе, таком как тетрагидрофуран, дихлорметан или т.п.;
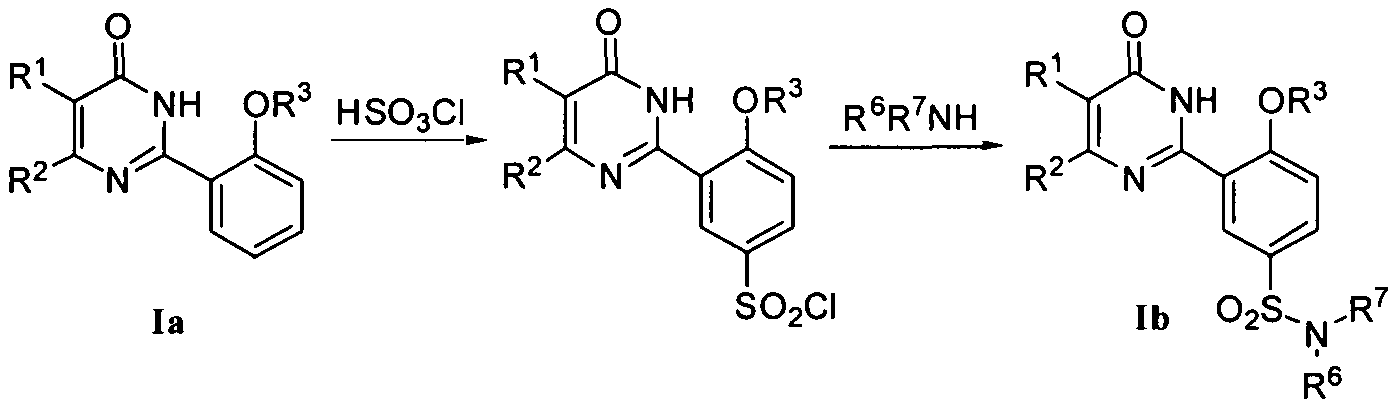
или
2) когда R4 означает NO2, соединение Ic может быть получено нитрованием соединения формулы Ia, где нитрующий реагент может быть смесью концентрированной азотной кислоты и концентрированной серной кислоты;
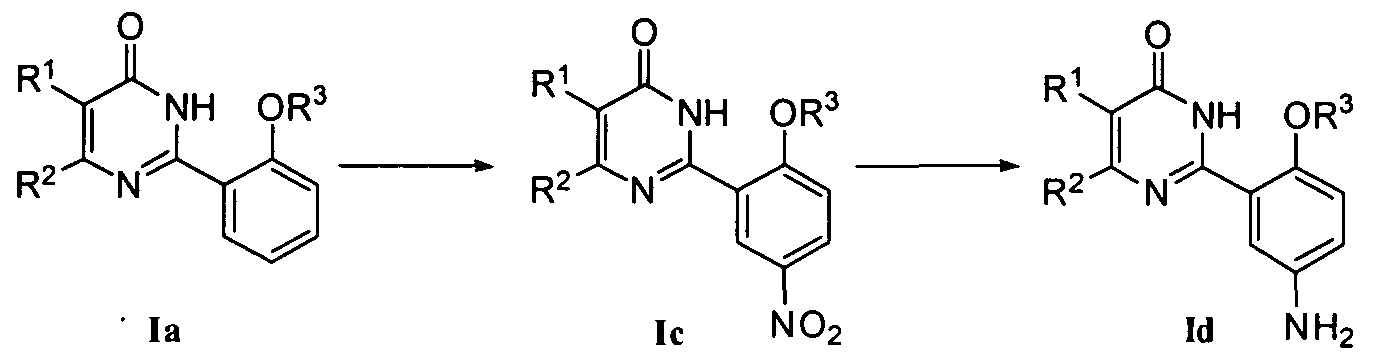
или
3) когда R4 означает NH2, соединение формулы Id может быть получено восстановлением соединения формулы Ic, например, при помощи традиционного каталитического восстановления водородом, при котором используется катализатор Ni-Ренея или Pd/C, или при помощи порошка восстановленного железа в кислой среде (например, в качестве растворителя может быть использована концентрированная соляная кислота) при приемлемой температуре (20-100°C);
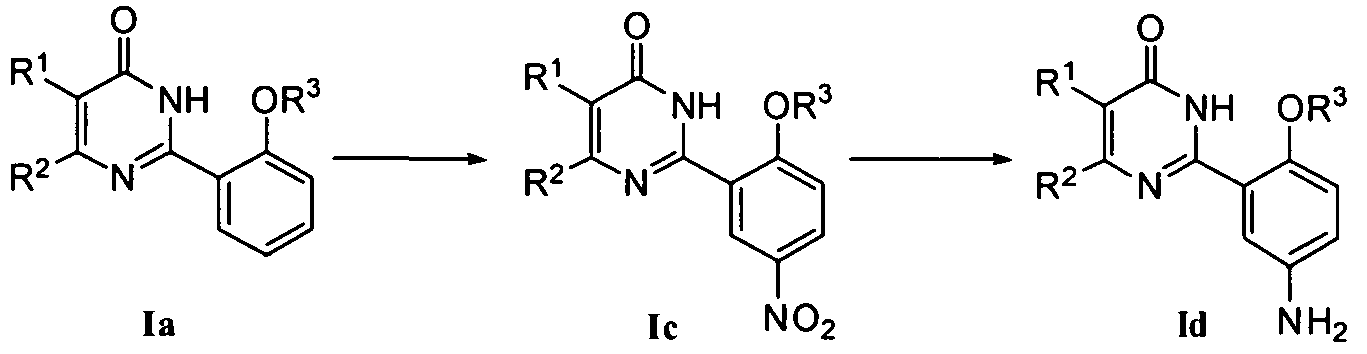
или
4) когда R4 означает CN, соединение формулы If может быть получено из соединения формулы Ie нуклеофильным замещением цианидом, таким как CuCN, в подходящем растворителе (например, N,N-диметилформамиде) при приемлемой температуре (например 70-160°C);
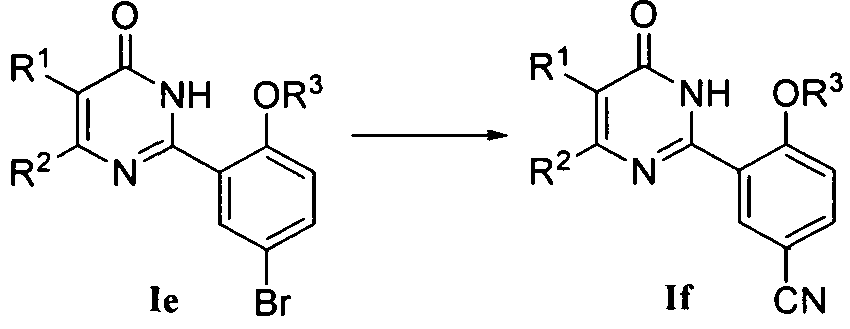
или
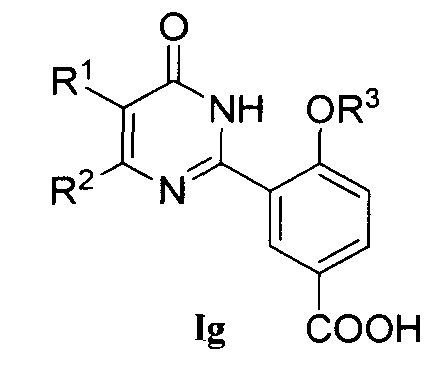
5) когда R4 означает COOH, соединение формулы Ig может быть получено из соединения формулы If гидролизом в присутствии основания (например, 2H раствором NaOH в воде);
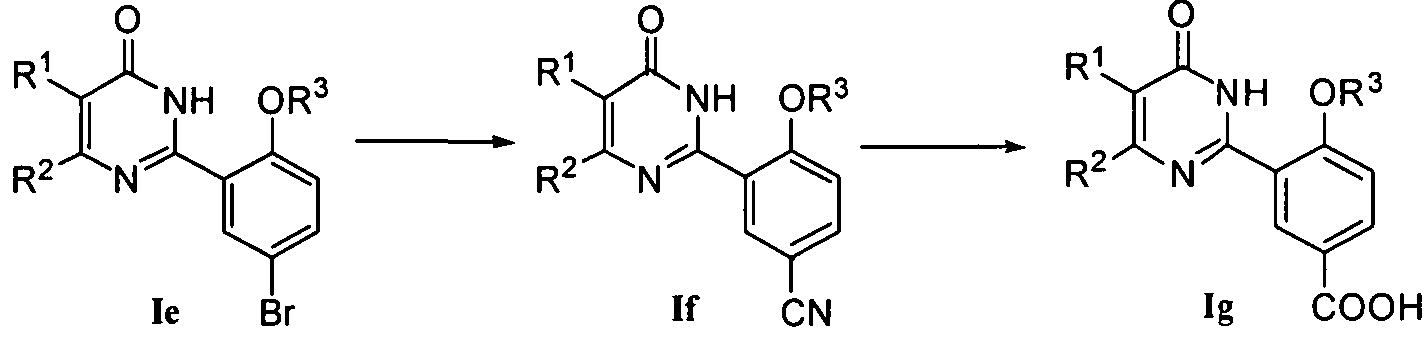
или
6) когда R4 означает NR9R10, соединение формулы I может быть получено из соединения формулы Id, в которой R4 означает NH2, в котором
1> когда R9 и R10 означают, каждый, метил, соединение формулы I может быть получено N-метилированием при помощи пара-формальдегида в качестве метилирующего реагент с муравьиной кислотой в качестве растворителя при приемлемой температуре (например, 80°C);
2> когда R9 означает H и R10 означает SO2R16, соединение формулы I может быть получено из соединения формулы Id сульфонилированием в присутствии органического основания (например, пиридина или триэтиламина) в подходящем органическом растворителе (например, тетрагидрофуране, дихлорметане и т.д.), где сульфонилирующим агентом является предпочтительно сульфонил-галоидное соединение (например, метилсульфонилхлорид).
3> когда R9 означает H и R10 означает COR15, соединение формулы I может быть получено, во-первых, реакцией органической кислоты с оксалилхлоридом или тионилхлоридом для получения ацилхлорида в подходящем органическом растворителе (например, тетрагидрофуране, дихлорметане и т.д.) с последующим взаимодействием полученного ацилхлорида с соединением формулы Id; или конденсацией соединения формулы Id с органической кислотой (например, муравьиной кислотой, циклогексанкарбоновой кислотой и т.д.) в присутствии связующего агента (например, 1,3-дициклогексилкарбодиимида (DCC) или 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI)) и активирующей добавки (например, 1-гидроксибензотриазола (НОВТ));
4> когда R9 означает Н, R10 означает C(Y)NR17R18 и Y означает О или S, соединение формулы I может быть получено реакцией присоединения соединения формулы Id и соединения формулы Y=C=NR17R18 в подходящем растворителе (например, этаноле) при приемлемой температуре (например, 50-80°C);
5> когда R9 означает Н, R10 означает 5- или 6-членную моносахаридную группу, соединение формулы I может быть получено реакцией соединения формулы Id с незащищенным 5- или 6-членным моносахаридом в присутствии следов органической кислоты (например, ледяной уксусной кислоты) в качестве катализатора в подходящем растворителе (например, этаноле, монометиловом эфире этиленгликоля, N,N-диметилформамиде, н-бутиловом спирте и т.д.) при приемлемой температуре (например, 50-150°C);
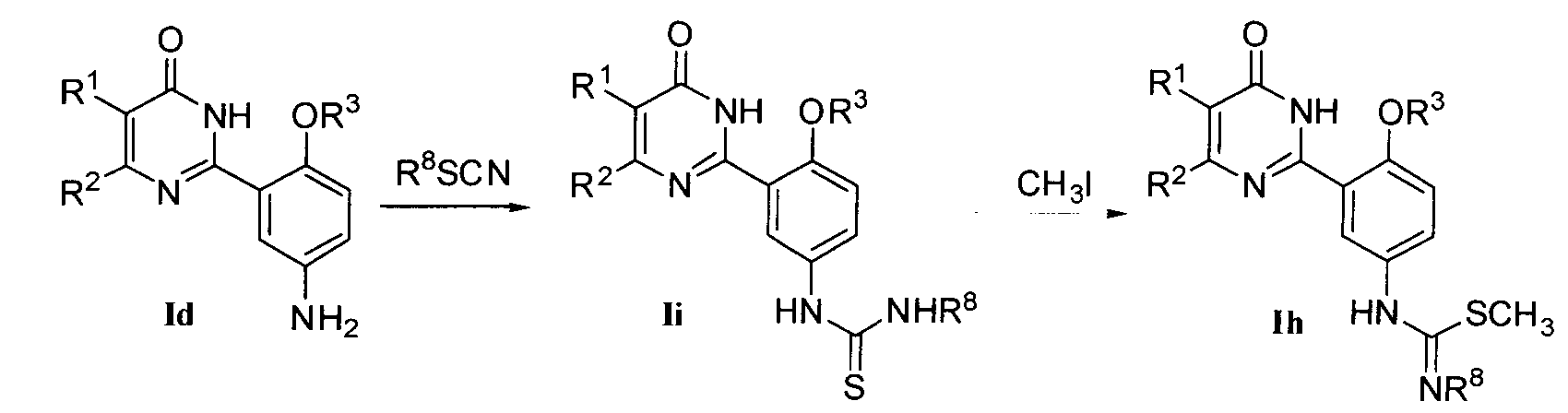
6> когда R9 означает H, R10 означает  и Y означает NR8, соединение формулы I может быть получено нуклеофильным замещением соединения формулы Ih соединением формулы R17NHR18 в подходящем растворителе (например, этаноле, монометиловом эфире этиленгликоля, N,N-диметилформамиде, н-бутиловом спирте и т.д.) при приемлемой температуре (например, 50-150°C), где соединение формулы Ih может быть получено реакцией присоединения соединения формулы Ii и иодметана в подходящем растворителе (например, метаноле, этаноле, тетрагидрофуране и т.д.) при приемлемой температуре (например, 40-80°C) и соединение формулы Ii может быть получено реакцией присоединения соединения формулы Id и R8SCN в подходящем растворителе (например, метаноле, этаноле, тетрагидрофуране, уксусной кислоте и воде и т.д.) при приемлемой температуре (например, 40-80°C);
и Y означает NR8, соединение формулы I может быть получено нуклеофильным замещением соединения формулы Ih соединением формулы R17NHR18 в подходящем растворителе (например, этаноле, монометиловом эфире этиленгликоля, N,N-диметилформамиде, н-бутиловом спирте и т.д.) при приемлемой температуре (например, 50-150°C), где соединение формулы Ih может быть получено реакцией присоединения соединения формулы Ii и иодметана в подходящем растворителе (например, метаноле, этаноле, тетрагидрофуране и т.д.) при приемлемой температуре (например, 40-80°C) и соединение формулы Ii может быть получено реакцией присоединения соединения формулы Id и R8SCN в подходящем растворителе (например, метаноле, этаноле, тетрагидрофуране, уксусной кислоте и воде и т.д.) при приемлемой температуре (например, 40-80°C);

7> когда R9 означает H и R10 означает остаток аминокислоты, замещенный ацетилом, соединение формулы I может быть получено вначале конденсацией соединения формулы Id с N-Boc-защищенной аминокислотой в органическом растворителе, включающем тетрагидрофуран или дихлорметан в присутствии связующего агента, включающего 1,3-дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид, и активирующей добавки, такой как 1-гидроксибензотриазол, для получения промежуточного соединения; затем удалением защитной Boc-группы в трифторуксусной кислоте; и в конце реакцией с уксусным ангидридом в пиридине;
или
7) когда R4 означает COR11 и R11 означает NR6R7, соединение формулы I может быть получено конденсацией соединения формулы Ig с R6R7NH в присутствии связующего агента, являющегося предпочтительно 1,3-дициклогексилкарбодиимидом (DCC) или 1-(3-диметиламинопропил)-3-этилкарбодиимидом (EDCI); или превращением соединения формулы Ig в соответствующее производное ацилхлорида с последующей реакцией с R6R7NH;
или
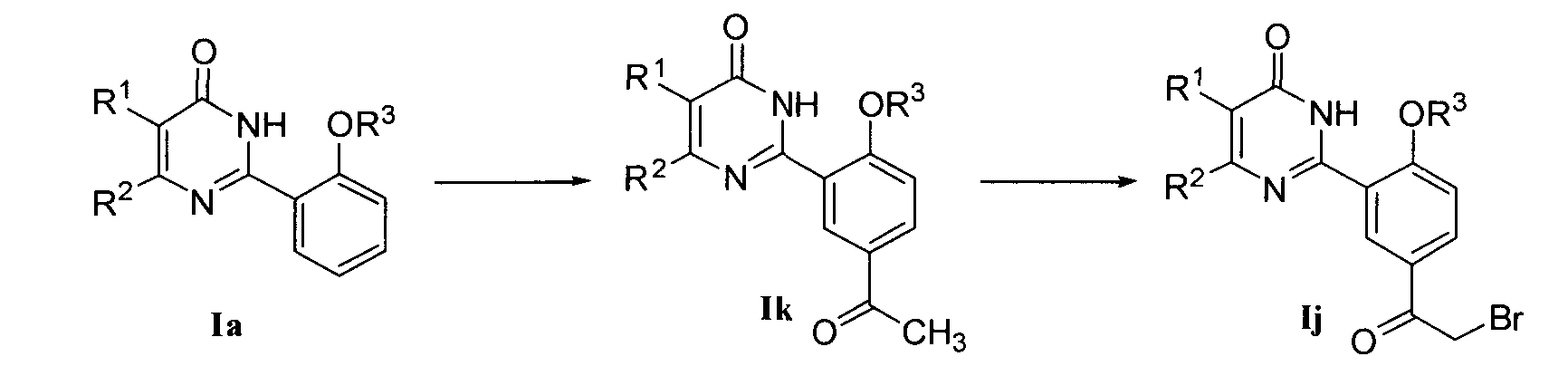
8) когда R4 означает COR11 и R11 означает CH2NR6R7, соединение формулы I может быть получено конденсацией соединения формулы Ij с R6R7NH в присутствии органического основания, где упомянутое органическое основание является предпочтительно пиридином или триэтиламином; соединение формулы Ij может быть получено бромированием соединения формулы Ik, где бромирующим реагентом является предпочтительно бром или N-бромсукцинимид (NBS); соединение формулы Ik может быть получено реакцией соединения формулы Ia с винил-н-бутиловым эфиром в присутствии металлического катализатора (например, ацетата палладия) с последующим гидролизом в разбавленной соляной кислоте; или соединение формулы Ij может также быть получено реакцией Фриделя-Крафта соединения формулы Ia с бромацетилбромидом, используя излишек AlCl3, в качестве кислоты Льюиса, где растворителем реакции является предпочтительно дихлорметан;
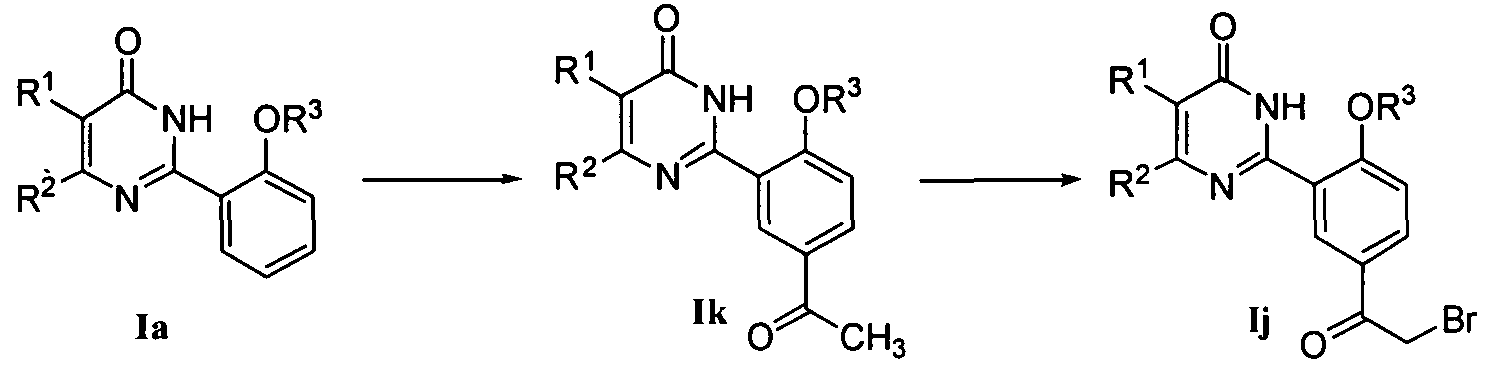
или
9) когда R4 означает OR12, соединение формулы I может быть получено из соединения формулы II традиционным методом хемосинтеза, в котором
1> когда R12 означает COR19 и R19 означает C1-C6 алкил или арил, соединение формулы I может быть получено этерификацией соединения формулы II, в которой R4 означает ОН, в подходящем растворителе (например, тетрагидрофуране, дихлорметане и т.д.) в присутствии органического основания (например, пиридина или триэтиламина);
2> когда R12 означает COR19 и R19 означает NHR8, соединение формулы I может быть получено реакцией присоединения R8NCO и соединения формулы II, в которой R4 означает ОН;
3> когда R12 означает SO2R16, соединение формулы I может быть получено сульфонилированием соединения формулы II, в которой R4 означает ОН, в присутствии органического основания (например, пиридина или триэтиламина) в подходящем растворителе (например, тетрагидрофуране, дихлорметане и т.д.), и где сульфонилирующим агентом является предпочтительно сульфонилгалоидное соединение (например, мезилхлорид);
4> когда R12 означает 5- или 6-членную моносахаридную группу, соединение формулы I может быть получено вначале конденсацией соединения формулы II с 5- или 6-членным моносахаридом активизированным трихлорацетонитрилом, и защищенного в гидроксил-положении защитной группой, такой как тетраацетил и т.д. над катализатором - кислотой Льюиса (например, бортрифториддиэтиловый эфир) согласно методу Шмидта и др. (Angew. Chem., 1980, 92, 763-764) для получения соединения формулы Im с последующим гидролизом в щелочной среде для удаления ацетильной защитной группы;
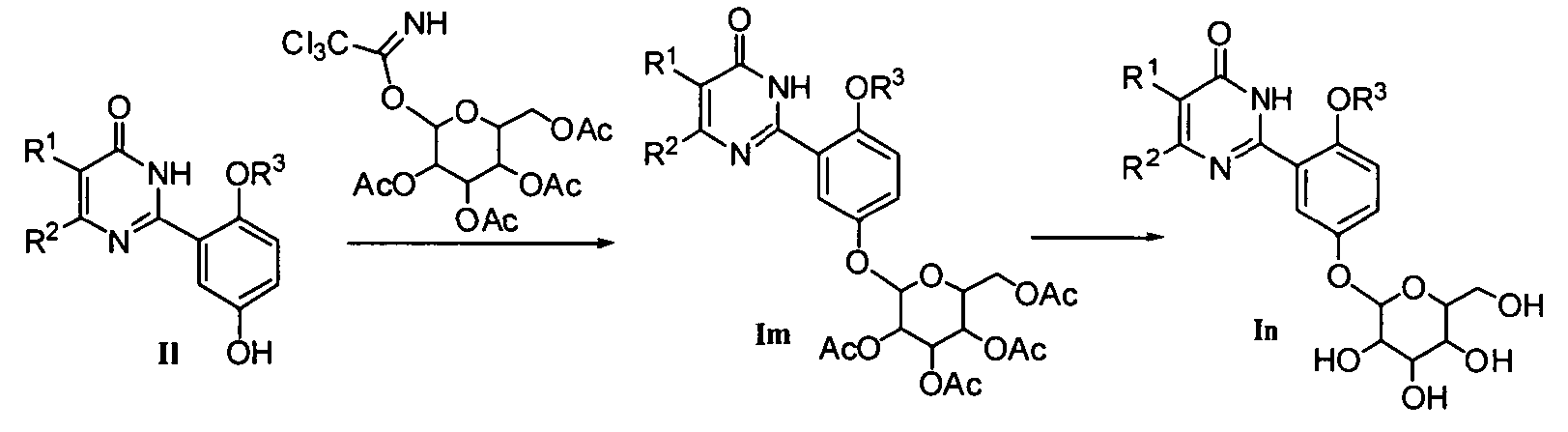
или
10) когда R4 означает пирролил, соединение формулы Io может быть получено конденсацией 2,5-гександиона с соединением формулы Id, где R4 означает NH2, в присутствии органической кислоты, где упомянутая органическая кислота является предпочтительно уксусной кислотой и обычно растворителем реакции является предпочтительно этанол;
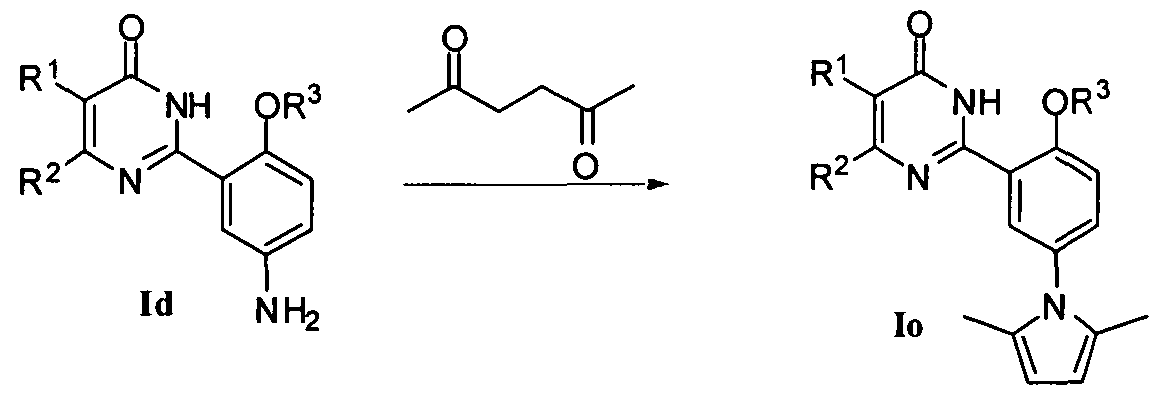
или
11) когда R4 означает гликозид, соединение формулы I может быть получено вначале реакцией соединения формулы Ie, где R4 означает Br, с н-BuLi, затем реакцией с глюколактоном, защищенным защитной группой (например, триметилсиликаном), с последующим восстановлением при помощи восстановителя (например, триэтилсиликана).
или
(3) соединение формулы I может быть получено превращением других соединений формулы I, где R1 означает любой заместитель, R2, R3 и R4, такие как определено выше, в котором
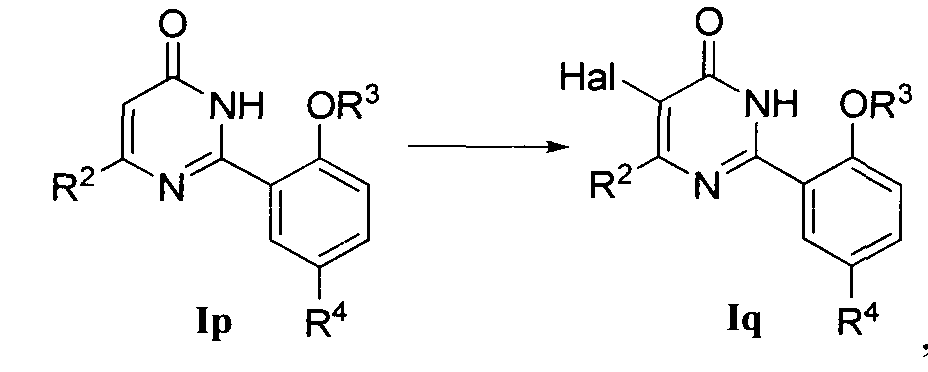
1) когда R1 означает галоген, соединение формулы Iq может быть получено галогенированием соединения формулы Ip, где R1 означает Н, в присутствии органического основания, где упомянутое органическое основание является предпочтительно пиридином, галоидирующим реагентом является предпочтительно элементарный галоген, например газообразный хлор, жидкий бром и т.д., и растворителем реакции является предпочтительно дихлорметан;
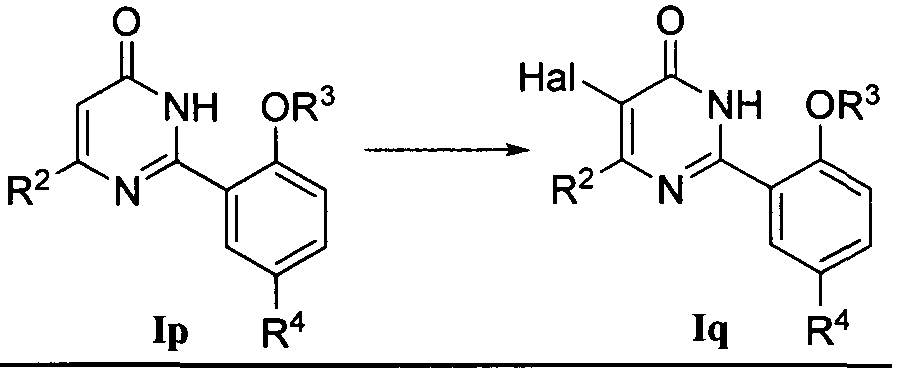
или
2) когда R1 означает NH2, соединение формулы Is может быть получено гидролизом соединения формулы Ir, где R1 означает ацетамидо-группу, при сильно кислых условиях, где растворителем реакции является предпочтительно концентрированная соляная кислота и температура реакции обычно составляет 90-110°C.
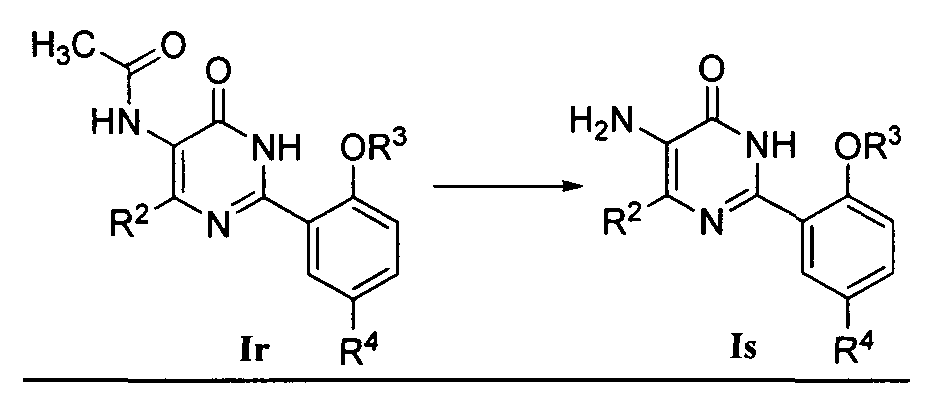
или
(B) когда Z означает NR3R10, соединение формулы I может быть получено нитрованием, восстановление и N-замещением аналогично способу получения вышеупомянутого соединения формулы I, где R4 означает NR9R10;
или
(C) когда Z означает COR11, NHCOR15 или OCOR15, соединение формулы I может быть аналогично способу получения вышеупомянутого соединения формулы I, где R4 означает COR11, NHCOR15 или OCOR15.
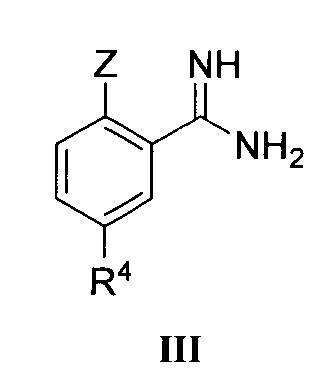
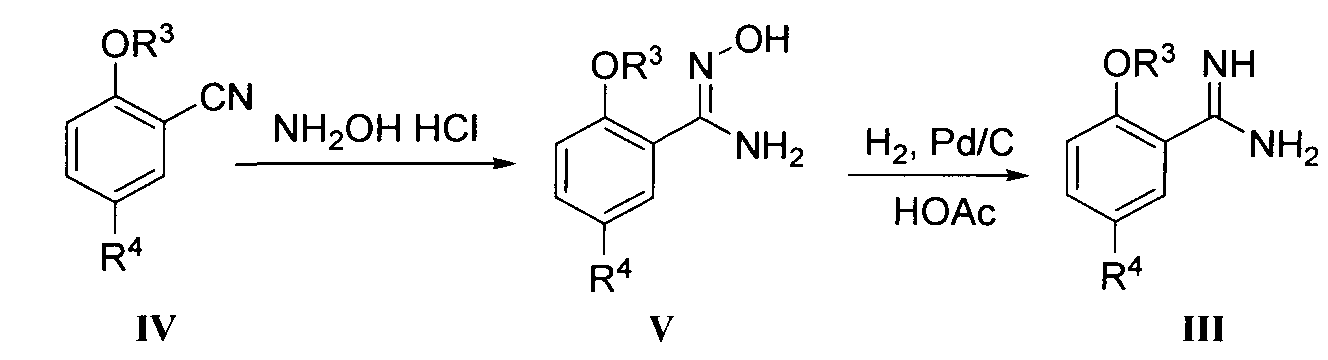
Настоящее изобретение также включает новые промежуточные соединения в процессе получения соединения формулы I и способы их получения, например соединения формулы III, V и Ia и способы их получения.
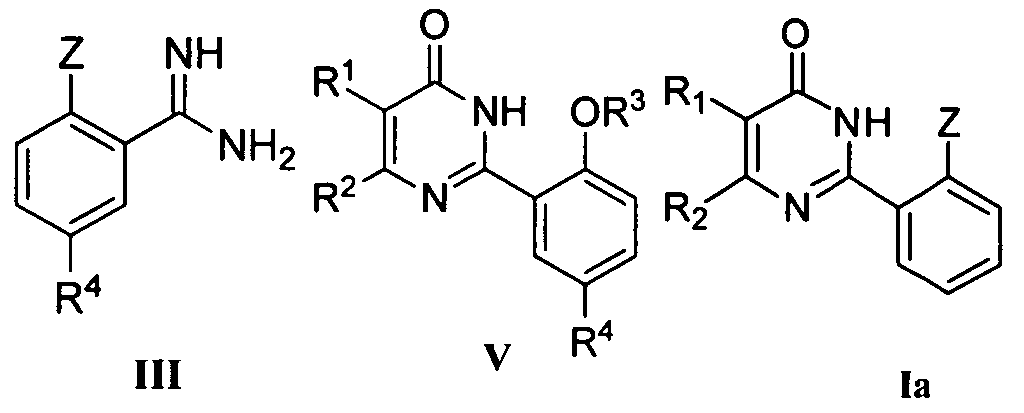
Когда Z означает OR3, соединение формулы III может быть получено следующим путем.
Соединение формулы III может быть получено из соединения формулы IV и литий бис(триметилсилил)амида (LiN(Si(CH3)3)2) в тетрагидрофуране (ТГФ) согласно способу Шмидта и др. (Angew. Chem., 1980, 92, 763-764).
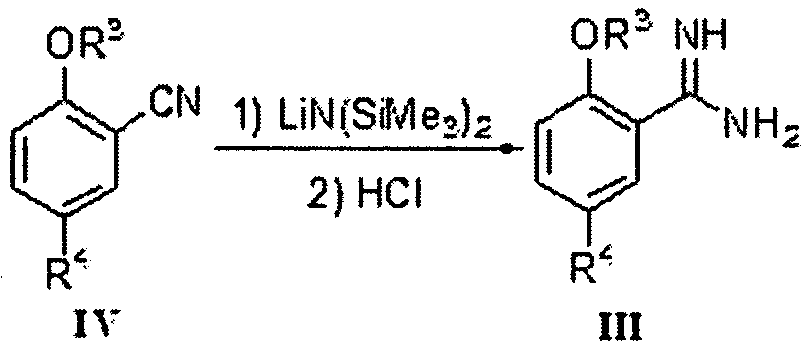
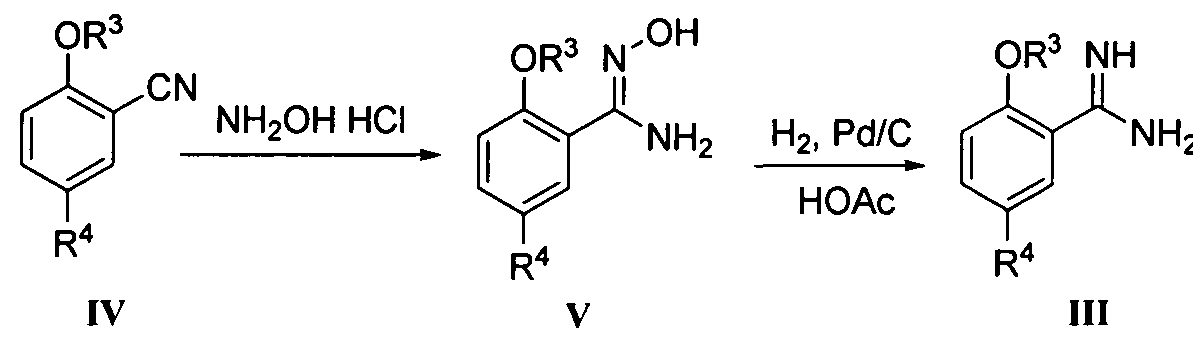
Соединение формулы III может быть получено вначале реакцией соединения формулы IV с гидроксиламингидрохлоридом в подходящем растворителе (например, смеси воды и метанола) при подходящей температуре (например, 40-80°C) согласно способу Джуби (Juby) и др. (US 4031093) для получения соединения формулы V; с последующей гидрогенизацией в растворе уксусной кислоты при подходящей температуре (например, 60°C) под подходящим давлением водорода (1-5 МПа), где в качестве катализатора восстановления используется Pd/C.
Соединения формулы II и IV коммерчески доступны (производятся фирмой Sinopharm Chemical Reagent Co. Ltd) и в случае отсутствия могут быть получены согласно способам, описанным в литературе.
Кроме того, настоящее изобретение также относится к фармацевтической композиции с ингибирующей активностью в отношении PDE5, содержащей терапевтически эффективную дозу соединения формулы I или его фармацевтически приемлемых солей.
Упомянутая фармацевтическая композиция включает терапевтически эффективную дозу одного или более соединений формулы I (или его фармацевтически приемлемых солей) и, по крайней мере, одно фармацевтически приемлемое вспомогательное средство. Упомянутое фармацевтически приемлемое вспомогательное средство может быть выбрано соответственно способу введения и механизму действия и обычно выбирается из наполнителя, разбавителя, связующего, смачивающего средства, дезинтегратора, смазывающего средства, эмульгатора, суспендирующего средства и т.д.
Фармацевтическая композиция настоящего изобретения может быть введена перорально, инъекцией (внутривенно, внутримышечно, подкожно и интракоронарно), подъязычно, трансбуккально, ректально, уретрально, вагинально, интраназально, ингаляцией или локально. Предпочтенным является пероральный путь введения.
Вышеупомянутая композиция включает 0,1%-99,9% по массе, предпочтительно 1%-99% по массе соединения формулы I или его фармацевтически приемлемых солей, от общей массы композиции.
Настоящее изобретение также относится к способу получения фармацевтической композиции, включающей соединение формулы I или его фармацевтически приемлемые соли. Как правило, соединение формулы I или его фармацевтически приемлемые соли смешивают с фармацевтически приемлемыми вспомогательными средствами и формулируют общеизвестными способами в дозированные формы (препараты), подходящие для определенного способа введения. Упомянутые препараты включают таблетки, капсулы, гранулы, пилюли, растворы, суспензии, эмульсии, пасты, пленки, кремы, аэрозоли, инъекции, свечи и т.д., предпочтительно таблетки и капсулы.
В состав таблетки и капсулы может входить терапевтически эффективная доза одного или более соединений формулы I или его фармацевтически приемлемых солей и один или более обычно используемых вспомогательных средств, например наполнитель, такой как крахмал, сахароза, лактоза, глюкоза, микрокристаллическая целлюлоза, манноза и т.д.; связующее, такое как карбоксиметилцеллюлоза, желатин, альгинат и поливинилпирролидон и т.д.; смачивающее средство, такое как глицерин и т.д.; дезинтегрирующее средство, такое как агар, этилцеллюлоза, натрийкарбоксиметилкрахмал, карбонат кальция и т.д.; смазывающее средство, такое как стеарат магния, тальк, полигликоль и т.д.
Соединения согласно настоящему изобретению обычно вводят в количестве 1-500 мг, предпочтительно 10-100 мг в сутки, одно- или многократно. Однако в случае необходимости вышеупомянутая доза может быть соответственно изменена. Специалист в данной области может определить оптимальную дозу согласно профессиональным знаниям и определенным ситуациям, включая тяжесть заболевания, индивидуальную переносимость пациентом, характеристики препарата и способа введения и т.д.
Кроме того, настоящее изобретение далее относится к применению соединения формулы I или его фармацевтически приемлемых солей, или композиций на его основе в качестве лекарственных средств.
Настоящее изобретение далее относится к применению соединения формулы I или его фармацевтически приемлемых солей для изготовления лекарственных средств в качестве ингибиторов PDE5.
Настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемых солей или композиций на его основе для изготовления лекарственных средств для лечения или профилактики эректильной дисфункции, доброкачественной гиперплазии предстательной железы, женской сексуальной дисфункции, преждевременного родоразрешения, дисменореи, обструкции мочевыводящих путей, недержания, неустойчивой и различной стенокардии Prinzmetal, артериальной гипертензии, легочной артериальной гипертензии, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, апоплексии, периферических сосудистых заболеваний, заболеваний Рейно, воспалительных заболеваний, бронхита, хронической астмы, аллергической астмы, аллергического насморка, глаукомы или заболеваний, связанных с нарушением пищеварения (энтерокинез) (например, синдром раздражения кишечника).
Настоящее изобретение далее относится к применению соединения формулы I или его фармацевтически приемлемых солей или композиций на его основе в комбинации с другими препаратами при лечении или профилактике заболеваний, таких как эректильная дисфункция, доброкачественная гиперплазия предстательной железы и т.д., например, в комбинации с селективными 5-гидрокситриптаминными (5-НТА) ингибиторами перепоглощения для лечения ускоренной эякуляции; в комбинации с α-акцепторным ингибитором для лечения эректильной дисфункции (ED) совместно с доброкачественной гиперплазией предстательной железы (ВРН); в комбинации с гипотензивным лекарственным средством для лечения ED совместно с артериальной гипертензией; в комбинации с пропионил-L-карнитином (Левокарнитин (Levocarnitin), PLC) для лечения диабетической ED; в комбинации с ундеканоат тестостероном для лечения эректильной дисфункции у пациентов, страдающих от ED совместно с диабетом; в комбинации с тианептином для эффективного лечения депрессии совместно с половой дисфункцией и т.д.
Соединение формулы I и ли его фармацевтически приемлемые соли обладают ингибирующей активностью в отношении PDE5. Более важно, что большинство этих соединений имеет более сильную ингибирующую активность в отношении PDE5 по сравнению с сильденафилом и имеет более высокую селективность в отношении PDE6, распространенному в сетчатке. Соответственно, соединения, согласно настоящему изобретению, как ожидается, будут показывать более высокую клиническую безопасность и эффективность и, таким образом, иметь широкую область клинического применения.
Предпочтительный способ выполнения изобретения
Примеры приготовления и примеры
Следующие ниже примеры иллюстрируют способ получения соединений настоящего изобретения и их промежуточных соединений, но не должны рассматриваться как ограничивающие настоящее изобретение. Спектры 1H ЯМР сняты на Mercury-400 или Mercury-300 NMR спектрометре (Компания Varian). Общие сокращения обозначают следующее: s - синглет; d - дуплет; t - триплет; q - квартет; м - мультиплет; br - размытый максимум.
Пример приготовления 1
2-н-Пропокси-5-(4-метилпиперазин-1-ил)сульфонилбензонитрил
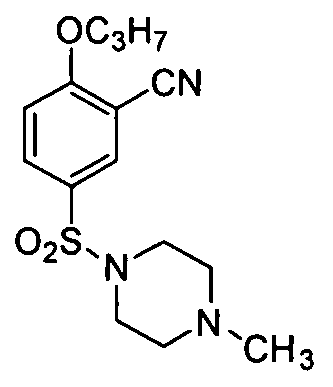
2-н-Пропоксибензонитрил (32,2 г, 0,2 моль) медленно добавляют в хлорсульфоновую кислоту (120 мл) в ванне со льдом. Ванну со льдом удаляют и после перемешивания в течение 2 ч при комнатной температуре реакционную смесь добавляют осторожно по каплям в раздробленный лед для получения большого количества преципитата (осадка). После фильтрования преципитат промывают ледяной водой, растворяют в CH2Cl2 (300 мл) и добавляют по каплям в метилпиперазидин (19,8 г, 0,2 моль), растворенный в CH2Cl2 (250 мл), в ванне со льдом. После добавления перемешивание продолжают в течение 30 мин. Конечную органическую фазу промывают водой (3×200 мл) и насыщенным солевым раствором (100 мл). После испарения растворителя досуха остаток перекристаллизовывают в этилацетате/петролейном эфире с получением целевого соединения (соединения, указанного в названии примера) (48,5 г, полный выход двух стадий: 75%). 1H ЯМР (диметилсульфоксид (DMSO)-d6) δ: 8,05 (1Н, dd), 7,77 (1H, t), 7,36 (1H, d), 4,15 (2H, t), 2,87 (4H, t), 2,36 (4H, t), 2,13 (3H, s), 1,79 (2H, m), 0,99 (3H, t).
Пример приготовления 2
5-Гидрокси-2-н-пропоксибензонитрил
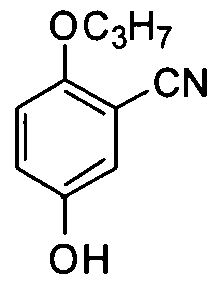
5-Ацетил-2-н-пропоксибензонитрил (20,3 г, 0,10 моль) растворяют в ледяной уксусной кислоте (100 мл) с последующим добавлением персульфата аммония (60 г, 0,26 моль). После добавления медленно по каплям раствора серной кислы (H2SO4 10 мл/H2O 14 мл) в водяной ванне со льдом, температуру реакции поднимают до 45°C в течение 3 часов. Реакционную смесь выливают в ледяную воду для выпадения преципитата, перемешивают в течение 0,5 часа, фильтруют и сушат с получением целевого соединения (13,0 г, выход: 73%). 1H ЯМР (CDCl3) δ: 8,00 (1H, d), 7,04 (1H, dd), 6,90 (1H, d), 4,05 (2H, t), 1,78 (2H, m), 1,01 (3H, t).
Пример приготовления 3
3-Циано-4-н-пропоксибензойная кислота
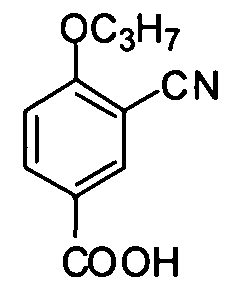
NaOH (5,52 г, 0,138 моль) растворяют в воде (35 мл) в ванне со льдом с последующим добавлением медленно жидкого брома (3,5 мл, 0,068 моль) при охлаждении. После добавления медленно по каплям раствора 5-ацетил-2-н-пропоксибензонитрила (7 г, 0,034 моль) в диоксане (35 мл) реакцию продолжают в течение 2 ч. Реакционную смесь медленно доводят до pH приблизительно 2 разбавленной соляной кислотой для получения большого количества светло-желтого твердого вещества. После фильтрования полученное твердое вещество промывают этилацетатом и фильтруют для получения целевого соединения (6,5 г, выход: 92%). 1H ЯМР (CDCl3) δ: 13,21 (1H, br), 8,18 (1H, d), 8,15 (1H, dd), 7,34 (1H, d), 4,18 (2H, t), 1,79 (2H, m), 1,00 (3H, t).
Пример приготовления 4
4-н-Пропокси-м-бензол динитрил
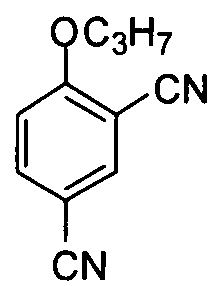
Соединение (3 г, 14,6 ммоль) примера приготовления 3 суспендируют в дихлорметане (30 мл) с последующим добавлением тионилхлорида (2,12 мл, 29,2 ммоль). После нагревания с обратным холодильником (дефлегмации) в течение 2 часов реакционную смесь концентрируют досуха с получением масла. Масло растворяют в сухом бензоле (10 мл) и концентрируют из растворителя. После повторения три раза концентрирования-растворения масло растворяют в сухом дихлорметане (10 мл) и затем медленно по каплям добавляют в раствор аммиака в метаноле (15 мл), охлажденный в ванне со льдом, с последующей реакцией в течение 0,5 часа. Реакционную смесь концентрируют досуха и затем растворяют в дихлорметане (20 мл). Органический слой промывают водой (30 мл × 2) и насыщенным солевым раствором (40 мл) соответственно. Полученную органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении. Полученное твердое вещество перекристаллизовывают из петролейного эфира/этилацетата и подвергают дефлегмации в оксихлориде фосфора (10 мл) в течение 1 ч. Охлажденную реакционную смесь выливают в ледяную воду для осаждения, перемешивают в течение 0,5 часа, фильтруют, промывают чистой водой и сушат для получения целевого соединения (2,3 г, общий выход двух стадий: 83%). 1H ЯМР (CDCl3) δ: 7,85 (1H, d), 7,80 (1H, dd), 7,05 (1H, d), 4,12 (2H, t), 1,91 (2H, m), 1,09 (3H, t).
Пример приготовления 5
3-Циано-4-н-пропоксибензоилгидразин
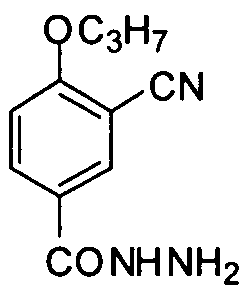
Соединение (3 г, 14,6 ммоль) примера приготовления 3 суспендируют в дихлорметане (30 мл) с последующим добавлением тионилхлорида (2,12 мл, 29,2 ммоль). Реакционную смесь подвергают дефлегмации в течение 2 ч и затем концентрируют досуха для получения масла. Масло растворяют в сухом бензоле (10 мл) и концентрируют из растворителя. После повторения три раза концентрирования-растворения полученное масло растворяют в сухом дихлорметане (10 мл) и затем медленно добавляют по каплям в раствор смеси гидрата гидразина (85%) (15 мл) и метанола (15 мл), охлажденный в ванне со льдом, с последующей реакцией в течение 0,5 часа. Реакционную смесь концентрируют досуха и затем растворяют в дихлорметане (20 мл). Полученный органический слой промывают водой (30 мл × 2) и насыщенным солевым раствором (40 мл) соответственно. Полученную органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении. Полученное твердое вещество перекристаллизовывают из петролейного эфира/этилацетата для получения целевого соединения (2,3 г, выход: 72%). 1H ЯМР (CDCl3) δ: 7,98 (1H, d), 7,94 (1H, dd), 7,59 (1H, br), 7,00 (1H, d), 4,09 (2H, t), 1,90 (2H, m), 1,09 (3H, t).
Пример приготовления 6
5-(1,3,4-Оксадиазол-2-ил)-2-н-пропоксибензонитрил
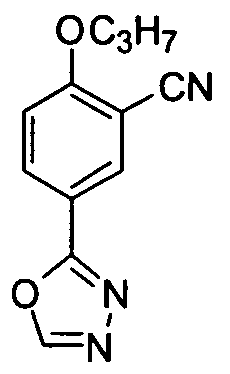
Соединение (1,5 г, 6,8 ммоль) примера приготовления 5 добавляют в триэтоксиметан (10 мл) и нагревают с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют досуха и полученное твердое вещество перекристаллизовывают из этилацетата/петролейного эфира для получения целевого соединения (1,2 г, выход: 76%). 1H ЯМР (CDCl3) δ: 8,47 (1Н, d), 8,27 (1H, dd), 8,25 (1H, s), 7,11 (1H, d), 4,13 (2H, t), 1,91 (2H, m), 1,10 (3H, t).
Пример приготовления 7
2-н-Пропокси-5-(4-метилпиперазин-1-ил)сульфонилбензамидин
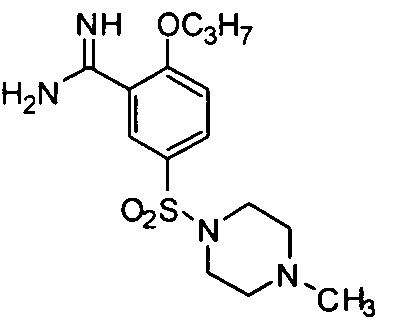
В ванне со льдом соединение (10 г, 31 ммоль) примера приготовления 1 добавляют в раствор ТГФ (150 мл), содержащий 20% LiN(Si(CH3)3)2 и перемешивают в течение 18 часов при комнатной температуре. Затем добавляют 4H раствор HCl для приведения значения рН до 2-3, ТГФ и большую часть воды отгоняют и оставшуюся водную фазу промывают EtOAc, доводят значение pH до 12-13 4H раствором NaOH и экстрагируют CH2Cl2. Органическую фазу промывают насыщенным солевым раствором и концентрируют досуха для получения целевого соединения в виде красно-коричневого масла, которое непосредственно используют на следующей стадии без очистки.
Пример приготовления 8
5-(1,3,4-Оксадиазол-2-ил)-2-н-пропоксибензамидин
Целевое соединение получают из соединения (0,5 г, 2,2 ммоль) примера приготовления 6 в качестве исходного материала способом, описанным в примере приготовления 7, в виде красно-коричневого масла, которое непосредственно используют на следующей стадии без очистки.
Пример приготовления 9
N1′,N3′-дигидрокси-4-н-пропокси-изофталамидин
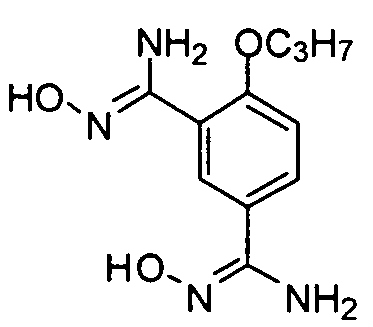
Соединение (3,0 г, 16,0 ммоль) примера приготовления 4 растворяют в растворе смеси метанола (50 мл) и воды (50 мл) и добавляют карбонат калия (8,9 г, 65,2 ммоль) и гидрохлорид гидроксиламина (4,5 г, 65,2 ммоль) соответственно. Реакционную смесь подвергают дефлегмации в течение ночи, затем концентрируют из метанола и медленно охлаждают для отделения белого твердого вещества. После фильтрации твердое вещество промывают водой (30 мл × 3) и сушат для получения целевого соединения (2,0 г, выход: 49%). 1H ЯМР (CDCl3) δ: 9,45 (2H, br), 7,75 (1H, d), 7,63 (1H, dd), 7,05 (1H, d), 5,73 (2Н, s), 5,60 (2H, s), 4,01 (2Н, t), 1,75 (2H, m), 0,99 (3H, t).
Пример приготовления 10
4-н-Пропокси-1,3-диамидинобензол
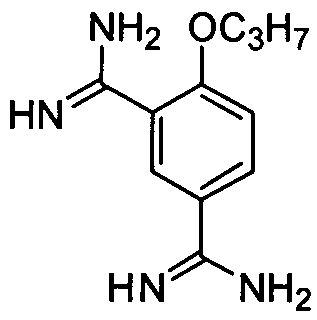
Соединение (2,0 г, 7,8 ммоль) примера приготовления 9 растворяют в ледяной уксусной кислоте (100 мл), добавляют 10% Pd/C (100 мг) и гидрируют при 65°C под давлением 3 МПа в течение 8 ч. Реакционную смесь концентрируют досуха для получения 1 г целевого соединения в виде красно-коричневого твердого вещества, которое непосредственно используют на следующей стадии без очистки.
Пример приготовления 11
5-Гидрокси-2-н-пропоксибензамидин
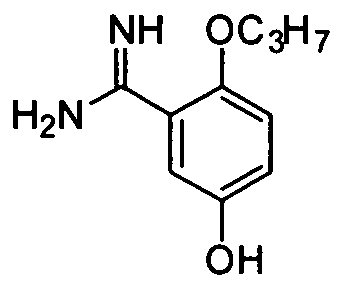
Целевое соединение получают из соединения (2,0 г, 7,8 ммоль) примера приготовления 2 способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 12
3-Гуанил-4-н-пропоксибензойная кислота
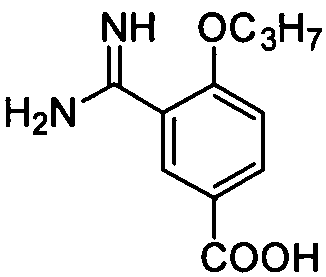
Целевое соединение получают из соединения (6,1 г, 29,8 ммоль) примера приготовления 3 способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 13
2-Этоксибензамидин
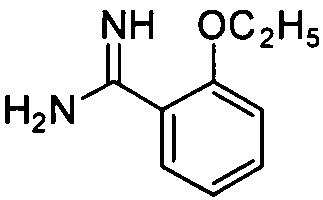
Целевое соединение получают из 2-этоксибензонитрила (20,5 г, 127,3 ммоль) способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 14
2-н-Пропоксибензамидин
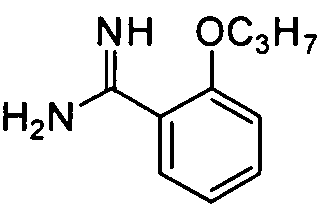
Целевое соединение получают из 2-н-пропоксибензонитрила (20,5 г, 127,3 ммоль) способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 15
2-н-Бутоксибензамидин
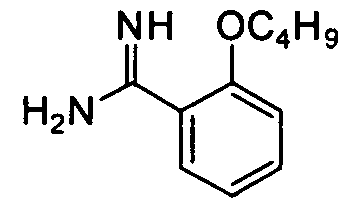
Целевое соединение получают из 2-бутоксибензонитрила (2,0 г, 11,4 ммоль) способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 16
2-н-Гексоксибензамидин
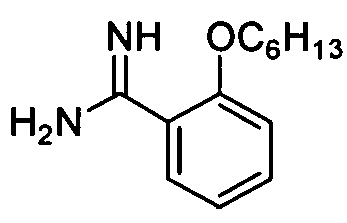
Целевое соединение получают из 2-н-гексоксибензонитрила (2,0 г, 9,8 ммоль) способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 17
5-Бром-2-н-пропоксибензамидин
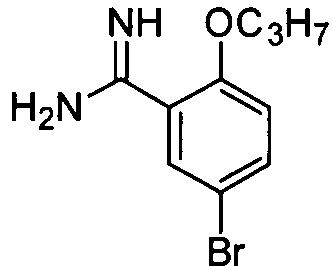
Целевое соединение получают из 5-бром-2-н-пропоксибензонитрила (5,0 г, 22,1 ммоль) способом, описанным в примере приготовления 9 и 10, и непосредственно используют на следующей стадии без очистки.
Пример приготовления 18
2-(2-н-Бутоксипропоксифенил)-6-изопропилпиримид-4(3H)-он
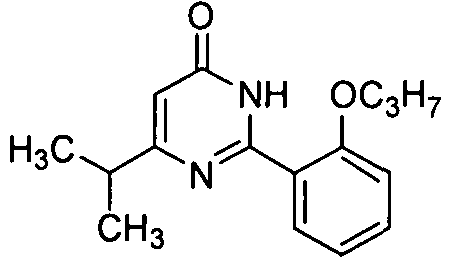
Соединение (10,0 г, 42 ммоль) примера приготовления 14 и K2CO3 (11,6 г, 84 ммоль) смешивают, суспендируют в N,N-ДМФ (DMF) (80 мл) и добавляют одну часть этилизобутирилацетата (7,3 г, 46 ммоль). Реакционную смесь перемешивают в течение 4 ч при 100°C под защитой в среде азота и затем охлаждают и выливают в ледяную воду. Полученное твердое вещество промывают водой (1,5 л) и сушат при 60°C для получения светло-желтого твердого неочищенного продукта, который перекристаллизовывают из этилацетата для получения белого целевого продукта (8,4 г, выход: 73%). 1H ЯМР (CDCl3) δ: 11,23 (1H, br), 8,51 (1H, dd), 7,48 (1H, t), 7,19 (1H, t), 7,03 (1H, d), 6,20 (1H, s), 4,18 (2H, t), 2,82 (1H, m), 1,99 (2H, m), 1,27 (6H, d), 1,13 (3H, t).
Пример приготовления 19
2-(2-н-Пропоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он
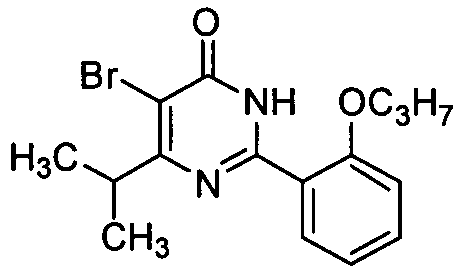
Соединение (3,2 г, 12 ммоль) примера приготовления 18 растворяют в CH2Cl2 (150 мл) и добавляют пиридин (1 мл) с последующим добавлением по каплям жидкого брома (1,9 г, 12 ммоль) в ванне со льдом. После реакции в течение 10 минут реакционную смесь промывают 1М раствором Na2S2O3 (50 мл), 1M раствором HCl (40 мл) и насыщенным солевым раствором (50 мл) соответственно. Органическую фазу сушат безводным сульфатом натрия и концентрируют досуха при пониженном давлении. Остаток перекристаллизовывают из ацетонитрил-этилового эфира для получения целевого соединения (3,9 г, выход: 95%). 1H ЯМР (CDCl3) δ: 11,41 (1H, br), 8,53 (1H, d). 7,51 (1H, t), 7,13 (1H, t), 7,04 (1H, d), 4,20 (2H, t), 3,51 (1H, m), 2,00 (2H, m), 1,28 (6H, d), 1,14 (3H, t).
Пример приготовления 20
2-(2-Этоксифенил)-6-изопропилпиримид-4(3H)-он
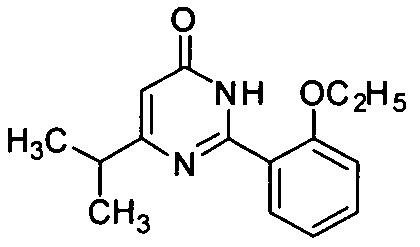
Целевой продукт получают из соединения (4,0 г, 20 ммоль, рассчитано на основе ацетата) примера приготовления 13 и этилизобутирилацетата (3,3 г, 21 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18. Выход: 85%. 1H ЯМР (CDCl3) δ: 11,22 (1H, br), 8,52 (1H, dd), 7,48 (1H, t), 7,12 (1H, t), 7,03 (1H, d), 6,20 (1H, s), 4,29 (2H,t), 2,82 (1H, m), 1,59 (3H, t), 1,27 (6H, d).
Пример приготовления 21
2-(2-Этоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он
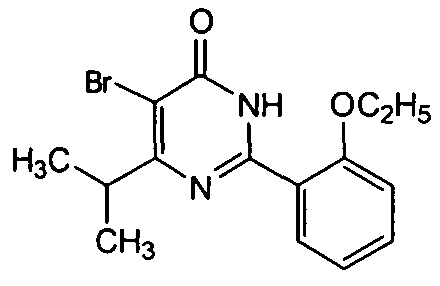
Целевой продукт получают из соединения примера приготовления 20 в качестве исходного материала способом, описанным в примере приготовления 19. Выход: 95%. 1H ЯМР (CDCl3) δ: 8,53 (1H, d), 7,51 (1H, t), 7,13 (1H, t), 7,04 (1H, d), 4,32 (2H, q), 3,51 (1H, m), l,59 (3H, t), 1,27 (6H, d).
Пример приготовления 22
2-(2-Этоксифенил)-5-хлор-6-изопропилпиримид-4(3H)-он
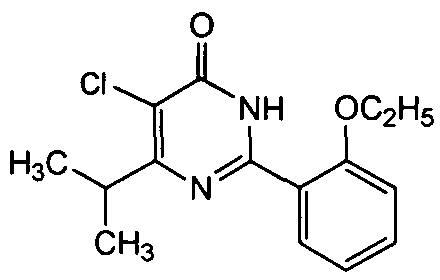
Соединение (0,52 г, 2 ммоль) примера приготовления 20 растворяют в CH2Cl2 (50 мл) и добавляют пиридин (0,5 мл) с последующим добавлением медленно газообразного хлора (1,9 г, 12 ммоль) в течение 3 мин в ванне со льдом. Реакционную смесь промывают 1M раствором Na2S2O3 (20 мл), 1M раствором HCl (20 мл) и насыщенным солевым раствором (40 мл) соответственно. Органическую фазу сушат безводным сульфатом натрия и концентрируют досуха при пониженном давлении. Остаток перекристаллизовывают из ацетонитрил-этиленового эфира для получения целевого соединения (0,57, выход: 98%). 1H ЯМР (CDCl3) δ: 8,52 (1H, d), 7,50 (1H, t), 7,13 (1H, t), 7,04 (1H, d), 4,31 (2H, q), 3,49 (1H, m), 1,59 (3H. t), 1,27 (6H, d).
Пример приготовления 23
2-(2-Этоксифенил)-5-ацетамидо-6-изопропилпиримид-4(3H)-он
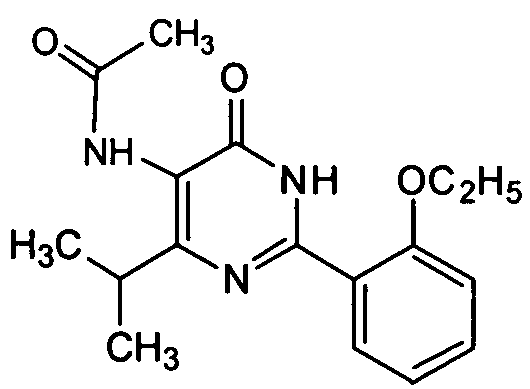
Целевой продукт получают из соединения (1,2 г, 5,0 ммоль) примера приготовления 13 и этил 2-ацетамидоизобутирилацетата (1,1 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18. Выход: 65%. 1H ЯМР (CDCl3) δ: 8,52 (1H, d), 7,50 (1H, t), 7,13 (1H, t), 7,04 (1H; d), 4,21 (2H, q), 3,00 (1H, m), 2,01 (3H, s), 1,10 (6H, d), 0,96 (3H, t).
Пример приготовления 24
2-(2-н-Бутоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он
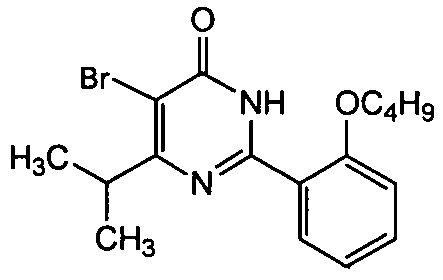
2-(2-н-Бутоксифенил)-6-изопропилпиримид-4(3H)-он получают из соединения (1,3 г, 5,0 ммоль) примера приготовления 15 и этилизобутирилацетата (0,8 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18, и затем бромируют способом, описанным в примере приготовления 19, для получения целевого соединения (общий выход двух стадий: 69%). 1H ЯМР (диметилсульфоксид-d6,) δ: 7,89 (1H, d), 7,85 (1H, dd), 7,39 (1H, d), 4,14 (2H, t), 3,37 (1H, m), 1,71 (2H, m), 1,35 (2H, m), 1,23 (3H, t), 1,15 (6H, d), 0,81 (3H, t).
Пример приготовления 25
2-(2-Этоксифенил)-5-бром-6-н-октилпиримид-4(3H)-он
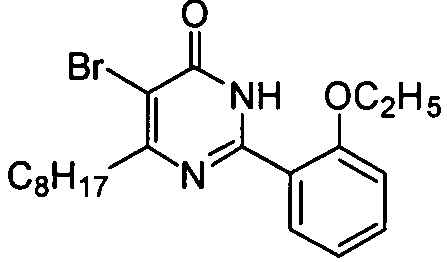
2-(2-Этоксифенил)-6-н-октилпиримид-4(3H)-он получают из гидрохлората (1,0 г, 5,0 ммоль) соединения, полученного в примере приготовления 13, и этилнонаноилацетата (1,2 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18, и затем бромируют способом, описанным в примере приготовления 19, для получения целевого соединения (общий выход двух стадий: 78%). 1H ЯМР (CDCl3) δ: 11,40 (1H, br), 8,47 (1H, d), 7,50 (1H, t), 7,12 (1H, t), 7,03 (1H, d), 4,31 (2H, q), 2,84 (2H, t), 1,76 (2H, m), 1,58 (3H, t), 1,51-1,19 (12H, m), 0,88 (3H,t).
Пример приготовления 26
2-(2-Этоксифенил)-5-бром-6-фенилпиримид-4(3H)-он
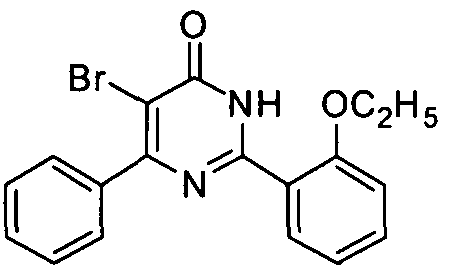
2-(2-Этоксифенил)-6-фенилпиримид-4(3H)-он получают из гидрохлората (1,0 г, 5,0 ммоль) 2-этоксибензамидина (соединения примера приготовления 13) и этилбензоилацетата (1,0 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18, и затем бромируют способом, описанным в примере приготовления 19, для получения целевого соединения (общий выход двух стадий: 80%). 1H ЯМР (CDCl3) δ: 8,52 (1H, d), 7,84 (2H, m), 7,49 (4H, m), 7,08 (2H, m), 4,35 (2H, q), 1,62 (3H, t).
Пример приготовления 27
2-(2-н-Пропоксифенил)-5-метил-6-изопропилпиримид-4(3H)-он
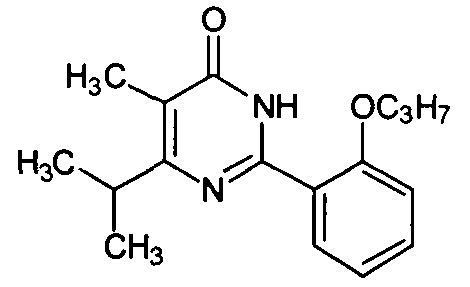
Целевой продукт получают из соединения (1,2 г, 5,0 ммоль) примера приготовления 14 и этил 2-метилизобутирилацетата (0,9 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 69%). 1H ЯМР (CDCl3) δ: 8,52 (1H, d), 7,45 (1H, t), 7,11 (1H, t), 7,02 (1H, d), 4,17 (2H, t), 3,17 (1H, m), 2,12 (3H, s), 1,99 (2H, m), 1,25 (6H, d), 1,14 (3H, t).
Пример приготовления 28
2-(2-н-Пропоксифенил)-5-фтор-6-этилпиримид-4(3H)-он
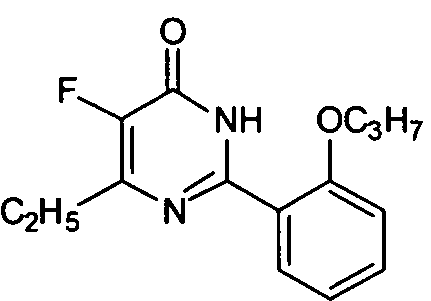
Целевой продукт получают из соединения (1,2 г, 5,0 ммоль) примера приготовления 14 и этил 2-фторпропионилацетата (0,8 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 62%). 1H ЯМР (CDCl3) δ: 11,16 (1H, br), 8,45 (1H, d), 7,48 (1H, t), 7,12 (1H, t), 7,04 (1H, d), 4,19 (2H, t), 2,73 (2H, q), 2,00 (2H, m), 1,30 (3H, t), 1,13 (3H, t).
Пример приготовления 29
2-(2-н-Пропоксифенил)-5-метил-6-этилпиримид-4(3H)-он
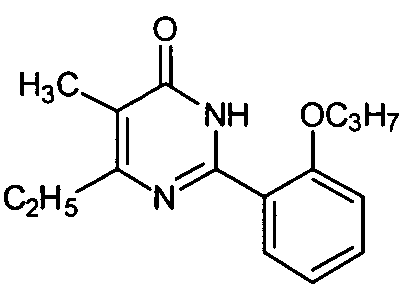
Целевой продукт получают из соединения (1,2 г, 5,0 ммоль) примера приготовления 14 и этил 2-метилпропионилацетата (0,8 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 65%). 1H ЯМР (CDCl3) δ: 11,16 (1H, br), 8,46 (1H, d), 7,46 (1H, t), 7,11 (1H, t), 7,02 (1H, d), 4,16 (2H, t). 2,68 (2H, q), 2,11 (3H, s), 1,98 (2H, m), 1,27 (3H, t), 1,13 (3H, t).
Пример приготовления 30
2-(2-Этоксифенил)-5-гидрокси-6-изопропилпиримид-4(3H)-он
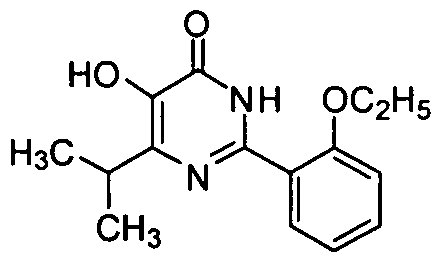
Соединение (1,6 г, 5 ммоль) примера приготовления 23 суспендируют в концентрированной соляной кислоте (15 мл) и подвергают дефлегмации в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении до небольшого объема и доводят значение pH до 8-9 концентрированным аммиаком для осаждения. Осадок промывают дистиллированной водой (30 мл×2) и сушат для получения 1,3 г дезацетилированного соединения, 2-(2-этоксифенил)-5-амино-6-изопропилпиримид-4(3H)-она. Вышеупомянутое полученное соединение растворяют, подвергают дефлегмации в этаноле (15 мл) и охлаждают в ванне со льдом с последующим добавлением 38% HBF4 (5 мл). В раствор медленно по каплям добавляют изоамилнитрит (0,6 г, 6 ммоль) и выдерживают в течение 2 ч. Затем добавляют этиловый эфир для высаживания осадка. Отфильтрованный осадок добавляют в баню при дефлегмации 1H раствором H2SO4, подвергают взаимодействию в течение получаса и извлекают этилацетатом (20 мл×2). Органическую фазу промывают водой (30 мл×2), 10% NaHCO3 (20 мл) и насыщенным солевым раствором (40 мл) соответственно, сушат безводным Na2SO4, и концентрируют при пониженном давлении и остаток разделяют колоночной хроматографией для получения 150 мг целевого соединения (выход: 11%). 1H ЯМР (CDCl3) δ: 11,36 (1H, br), 8,46 (1H, d),7,52 (1Н, t), 7,14 (1Н, t), 7,06 (1Н, d), 6,42 (1H, s), 4,32 (2H, q), 3,75 (1H, s), 1,61 (3H, t), 1,54 (6H, s).
Пример приготовления 31
2-(2-н-Гексоксилфенил)-6-изопропилпиримид-4(3H)-он
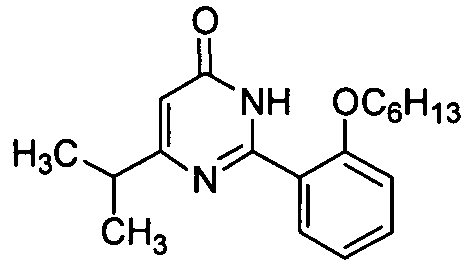
Целевой продукт получают из соединения (1,4 г, 5,0 ммоль) примера приготовления 16 и этилизобутирилацетата (0,8 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 54%). 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 8,52 (1H, d), 7,48 (1H, t), 7,12 (1H, t), 7,04 (1H, d), 6,29 (1H, s), 4,20 (2H, t), 2,81 (1H, m), 1,98 (2H, m), 1,58-1,30 (6H, m), 1,27 (6H, d), 0,90 (3H, t).
Пример приготовления 32
2-(2-Этоксифенил)-6-изопропилпиримид-4(3H)-он
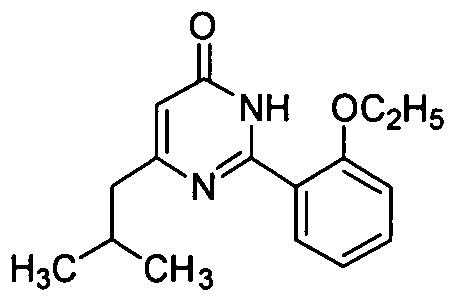
Целевой продукт получают из гидрохлората (1,0 г, 5,0 ммоль) 2-этоксибензамидина (соединения примера приготовления 13) и этилизовалерилацетата (0,9 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 82%). 1H ЯМР (CDCl3) δ: 11,24 (1H, br), 8,48 (1H, d), 7,49 (1H, t), 7,12 (1H, t), 7,03 (1H, d), 6,16 (1H, s), 4,29 (2H, q), 2,45 (2H, d), 2,18 (1H, m), 1,59 (3H, t), 0,96 (6H, d).
Пример приготовления 33
2-(2-н-Пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
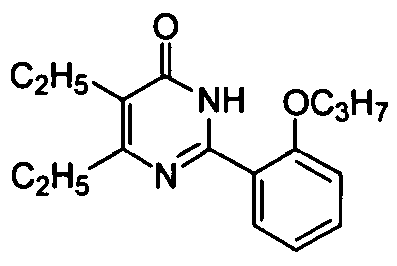
Целевой продукт получают из соединения (4,0 г, 20 ммоль) примера приготовления 14 и метил 2-этил-3-оксопентаноата (3,6 г, 21 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 78%). 1H ЯМР (CDCl3) δ: 11,18 (1H, br), 8,46 (1H, dd), 7,44 (1H, t), 7,09 (1H, t), 7,01 (1H, d), 4,15 (2H, t), 2,66 (2H, q), 2,58 (2H, q), 1,98 (2H, m), 1,29 (3H, t), 1,14 (3H, t).
Пример приготовления 34
2-(5-Бром-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
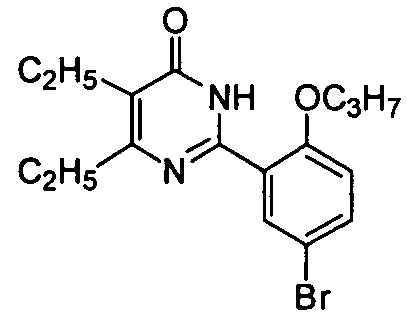
Целевой продукт получают из соединения (5,9 г, 20 ммоль) примера приготовления 17 и метил 2-этил-3-оксопентаноата (3,6 г, 21 ммоль), в качестве исходных материалов, способом, описанным в примере приготовления 18 (выход: 63%).1H NMR (CDCl3) δ: 7,96 (1H, d), 7,89 (1H, dd), 7,44 (1H, d), 4,13 (2H, t), 2,58 (2H, q), 2,46 (2H, q), 1,76 (2H, m), 1,18 (3H, t), 1,05 (3H, t), 0,96 (3H, t).
Пример приготовления 35
2-(5-Бром-2-н-пропоксифенил)-6-изопропилпиримид-4(3H)-он
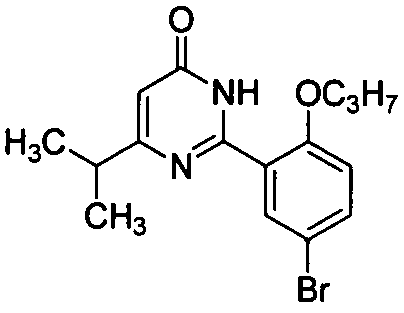
Целевой продукт получают из соединения (4,0 г, 20 ммоль) примера приготовления 17 и этилизобутирилацетата (3,3 г, 21 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 93%). 1H NMR (CDCl3) δ: 11,12 (1H, br), 8,60 (1H, d), 7,54 (1H, dd), 6.93 (1H, d), 6,22 (1H, s), 4,15 (2H, t), 2,82 (1H, m), 1,98 (2H, m), 1,27 (6H, d), 1,12 (3H, t).
Пример приготовления 36
2-(2-(3-Метоксипропокси)фенил)-5,6-диэтилпиримид-4(3H)-он
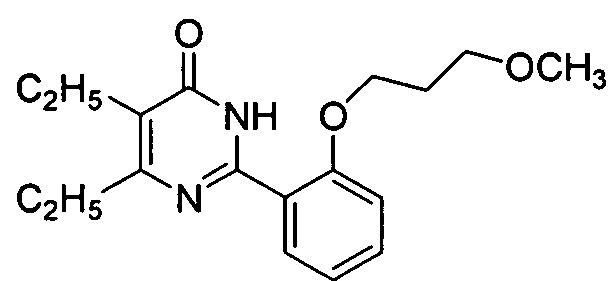
Целевой продукт получают из гидрохлората (1,22 г, 5,0 ммоль) 2-(3-метокси-н-пропокси)бензамидина и этил 2-этилпропионилацетата (0,8 г, 5,1 ммоль) в качестве исходных материалов способом, описанным в примере приготовления 18 (выход: 73%). 1Н NMR (CDCl3) δ: 11,08 (1H, br), 8,46 (1H, dd), 7,44 (1H, t), 7,09 (1H, t), 7,01 (1H, d), 4,25 (2H, t), 3,65 (2H, t), 3,42 (3H, s), 2,66 (2H, q), 2,59 (2H, q), 2,22 (2H, m), 1,27 (3H, t), 1,15(3H, t).
Пример 1
6-Изопропил-2-[2-н-пропокси-5-(4-метилпиперазин-1-ил-сульфонил)фенил]пиримид-4(3H)-он
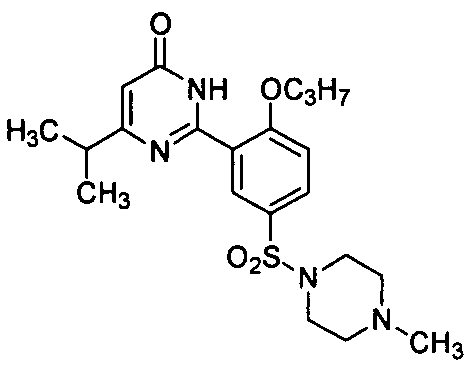
Этил изобутирилацетат (0,5 г, 3,2 ммоль) и соединение (1,2 г, 3,2 ммоль) примера приготовления 7 добавляют в DMF (10 мл) с последующим добавлением K2CO3 (0,9 г, 6,4 ммоль). Реакционную смесь нагревают до 90°C в течение 3 ч. Охлажденную реакционную смесь выливают в ледяную воду и экстрагируют CH2Cl2 (3×20 мл). Органическую фазу промывают насыщенным солевым раствором, сушат безводным Na2SO4 и концентрируют. Остаток пропускают через колонку нейтрального оксида алюминия для получения 0,7 г целевого соединения (выход: 50%). 1H ЯМР (диметилсульфоксид-d6) δ: 7,89 (1H, d), 7,84 (1H, dd), 7,38 (1H, d), 6,15 (1H, s), 4,12 (2H, t), 2,90 (4H, t), 2,75 (1H, m), 2,36 (4H, t), 2,14 (3H, s), 1,74 (2G, m), 1,35 (3H, t), 1,18 (6H, d).
Примеры 2-8
Соединения примеров 2-8 получают реакцией соединения примера приготовления 7 с этилцианоацетатом, диэтилмалонатом, диэтилацетамидомалонатом, этилбензоилацетатом, этилпропионилацетатом, этилацетамидопропионилацетатом, этилацетамидоцианоацетатом соответственно способом, описанным в примере приготовления 1:
|
|
Пример 9
6-Ацетамидо-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он
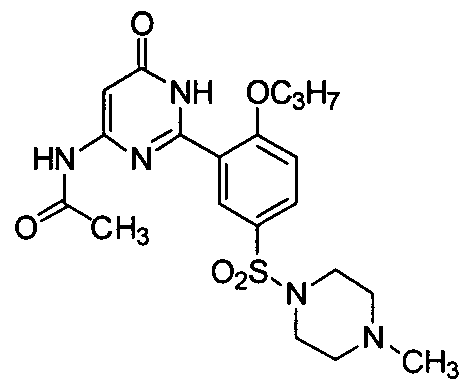
Соединение (0,20 г, 0,5 ммоль) примера 2 суспендируют в уксусном ангидриде (5 мл) и перемешивают при 100°C в течение 1 ч. Охлажденную реакционную смесь выливают в ледяную воду для получения белого твердого вещества. После фильтрования твердое вещество промывают чистой водой (3×10 мл) и сушат при 60°C для получения 0,12 г целевого соединения (выход: 53%). 1H ЯМР (DMSO-d6) δ: 12,16 (1H, br), 10,54 (1H, br), 7,92 (1H, d), 7,84 (1H, dd), 7,40 (1H, d), 6,89 (1H, s), 4,12 (2H, t), 2,88 (4H, t), 2,36 (4H, t), 2,14 (3H, s), 2,08 (3H, s), 1,74 (2H, m), 0,95 (3H, t).
Пример 10
5-Бром-6-изопропил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он
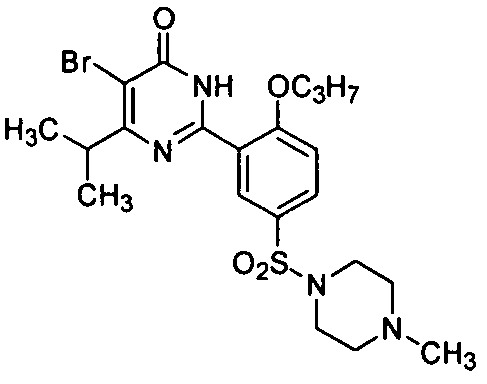
Соединение (0,35 г, 1,0 ммоль) примера приготовления 19 медленно добавляют в хлорсульфоновую кислоту (5 мл) в ванне со льдом и затем ванну со льдом удаляют. После перемешивания при комнатной температуре в течение 2 ч реакционную смесь осторожно по каплям добавляют в раздробленный лед для получения бледно-желтого осадка. После фильтрации твердое вещество промывают ледяной водой, растворяют в CH2Cl2 (50 мл) и добавляют по каплям в CH2Cl2 (30 мл), содержащий N-метилпиперазин (0,11 г, 1,1 ммоль) и триэтиламин (1 мл) в ванне со льдом, с последующим перемешиванием в течение 30 мин. Органическую фазу промывают водой (3×20 мл) и насыщенным солевым раствором (20 мл) и выпаривают растворитель досуха. Остаток повторно кристаллизуют из этилацетата/петролейного эфира для получения целевого соединения (0,41 г, общий выход двух стадий: 80%). 1H ЯМР (DMSO-d6) δ: 7,91 (1H, d), 7,85 (1H, dd), 7,39 (1H, d), 4,13 (2H, t), 2,90 (4H, t), 2,75 (1H, m), 2,36 (4H, t), 2,14 (3H, s), 1,74 (2H, m), 1,35 (3H, t), 1,18 (6H, d).
Примеры 11-21
Соединения примеров приготовления 20-30 реагируют последовательно с хлорсульфоновой кислотой и N-метилпиперазином способом, описанным в примере приготовления 10, для получения соединений примеров 11-21:
|
|
|
Пример 22
5-Амино-6-изопропил-2-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-
пиримид-4(3H)-он
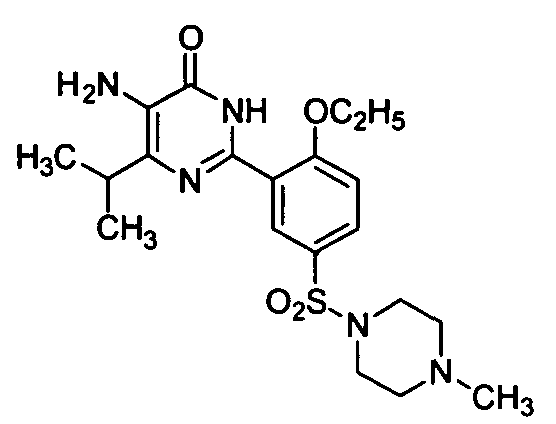
Соединение (60 мг, 0,13 ммоль) примера 14 суспендируют в концентрированной соляной кислоте (3 мл) и подвергают дефлегмации в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении до небольшого объема и доводят значение pH до 8-9 концентрированным аммиаком для осаждения. Полученный осадок промывают дистиллированной водой (3 мл) и сушат для получения целевого соединения (50 мг, выход: 91%). 1H ЯМР (DMSO-d6) δ: 7,90 (1H, d), 7,75 (1H, dd), 7,33 (1H, d), 4,91 (2H, s), 4,21 (2H, q), 3,09 (1H, m), 2,89 (4H, t), 2,36 (4H, t), 2,13 (3H, s), 1,37 (3H, t), 1,13 (6H, d).
Пример 23
5-Бром-6-изопропил-2-[2-н-гексилокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он
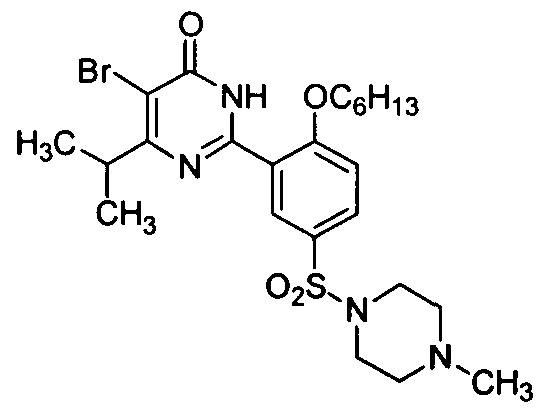
2-(2-н-гексоксилфенил)-5-бром-6-изопропилпиримид-4(3H)-он получают из соединения примера приготовления 31 в качестве исходного материала бромированием способом, описанным в примере приготовления 19, и затем хлорсульфируют и подвергают взаимодействию с N-метилпиперазином способом, описанным в примере 10, для получения целевого соединения (общий выход двух стадий: 85%). 1H ЯМР (DMSO-d6) δ: 7,90 (1H, d), 7,85 (1H, dd), 7,39 (1H, d), 4,14 (2H, t), 3,37 (1H, m), 2,90 (4H. t), 2,37 (4H, t), 2,14 (3H, s), 1,70 (2H, m), 1,18-1,40 (8H, m), 1,15 (6H.d), 0,81 (3H, t).
Пример 24
5-Бром-6-изобутил-2-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он
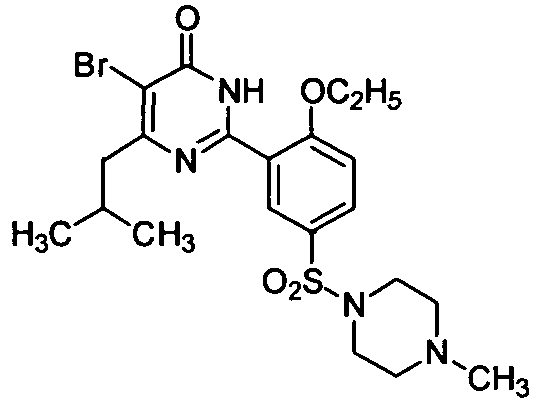
Целевое соединение получают из соединения примера приготовления 32 в качестве исходного материала способом, описанным в примере 23 (полный выход: 88%). 1H ЯМР (DMSO-d6) δ: 7,87 (1H, d), 7,83 (1H, dd), 7,38 (1H, d), 4,21 (2H, q), 2,91 (4H, t), 2,65 (2H, d), 2,44 (4H, t), 2,20 (3H, s), 2,17 (1H, m), 1,33 (3H, t), 0,95 (6H, d).
Примеры 25-28
Способом, описанным в примере 10, соединение примера приготовления 19 вначале хлорсульфируют и затем подвергают взаимодействию с N-метилэтаноламином, 2-(морфолин-1-ил)этиламином, 3-(морфолин-1-ил)пропиламином и N,N-диэтилэтилендиамином соответственно для получения соединений примеров 25-28:
|
|
Примеры 29-32
Способом, описанным в примере 10, соединение примера приготовления 33 вначале хлорсульфируют и затем подвергают взаимодействию с N-метилпиперазином, N-метилэтаноламином, 2-морфолинилэтиламином и L-пролином соответственно для получения соединений примеров 29-32:
|
|
Пример 33
2-(5-Нитро-2-н-пропоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он
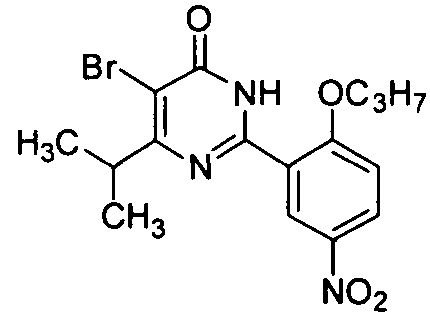
Соединение (14,0 г, 40 ммоль) примера приготовления 19 растворяют в концентрированной серной кислоте (100 мл) в ванне со льдом и медленно добавляют 65-68% концентрированную азотную кислоту (100 мл). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь медленно добавляют по каплям в ледяную воду для получения светло-желтого осадка. После фильтрации твердое вещество промывают чистой водой (3 × 200 мл) и сушат при 60°C для получения целевого соединения (14,2 г, выход: 90%). 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 9,36 (1H, d), 8,39 (1H, dd), 7,04 (1H, d), 4,32 (2H, t), 3,56 (1H, m), 2,04 (2H, m), 1,30 (6H, d), 1,16 (3H, t).
Пример 34
2-(5-Амино-2-н-пропоксифенил)-5-бром-6-изопропилпиримид-4(3H)-он
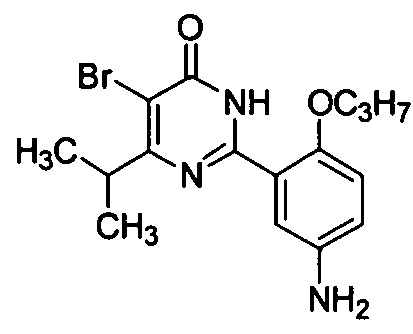
Соединение (4,0 г, 10 ммоль) примера 33 суспендируют в концентрированной соляной кислоте и подвергают дефлегмации. Порошок восстановленного железа (1,7 г, 30 ммоль) добавляют в реакционную смесь в бане и перемешивают в течение 1 ч. Горячую реакционную смесь фильтруют и охлаждают при комнатной температуре для получения желтоватого осадка. После фильтрации твердое вещество сушат при 60°C для получения гидрохлората целевого соединения (3,0 г, выход: 82%). 1H ЯМР (DMSO-d6) δ: 12,55 (1H, br), 10,18 (2H, br), 7,72 (1H, d), 7,50 (1H, dd), 7,27 (1H, d), 4,04 (2H, t), 3,39 (1H, m), 1,73 (2H, m), 1,17 (6H, d), 0,95 (3H, t).
Пример 35
1-(3-(4-Изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)- 3-этилтиомочевина
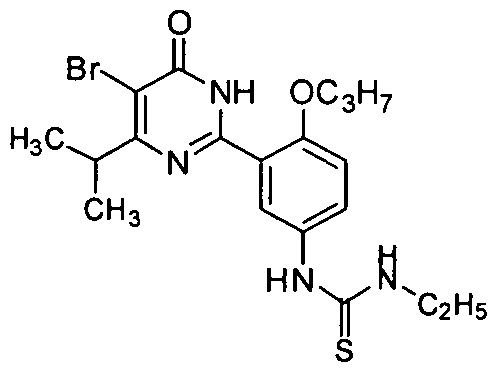
Соединение (4,0 г, 10 ммоль) примера 34 суспендируют в этаноле (10 мл) и добавляют этил изотиоцианат (0,9 г, 1,1 ммоль) и триэтиламин (1 мл), затем подвергают дефлегмации в течение 3 ч, реакционную смесь концентрируют досуха. Полученное твердое вещество промывают дистиллированной водой и перекристаллизовывают из этилацетата-петролейного эфира для получения целевого соединения (3,4 г, выход: 74%). 1H ЯМР (DMSO-d6) δ: 12,38 (1H, br), 9,41 (1H, br), 7,74 (1H, d), 7,54 (1H, dd), 7,15 (1H, d), 4,04 (2H, t), 3,46 (2H, m), 3,37 (1H, m), 1,75 (2H, m), 1,18 (6H, d), 1,11 (3H, t), 0,97 (3H, t).
Пример 36
1-[3-(4-Изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-3-этил-2-метилизотиомочевина
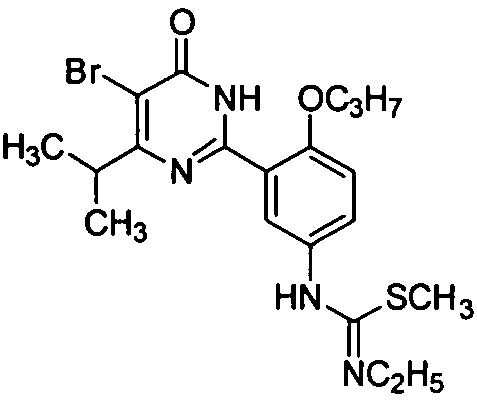
Соединение (2,7 г, 6 ммоль) примера 35 суспендируют в метаноле (20 мл) и добавляют иодметан (1,0 г, 7 ммоль). После дефлегмации в течение 3 ч реакционную смесь концентрируют досуха. Полученное твердое вещество перекристаллизовывают из этилового эфира для получения целевого соединения (2,4 г, выход: 85%). 1H ЯМР (DMSO-d6) δ: 7,16 (1H, d), 6,99 (1H, dd), 6,87 (1H, d), 4,00 (2H, t), 3,37 (1H, m), 2,94 (2H, q), 2,56 (3H, s), 1,74 (2H, m), 1,18 (6H, d), 1,11 (3H, t), 0,98 (3H, t).
Пример 37
N-[3-(4-Изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-N′, N″-триэтилгуанидин
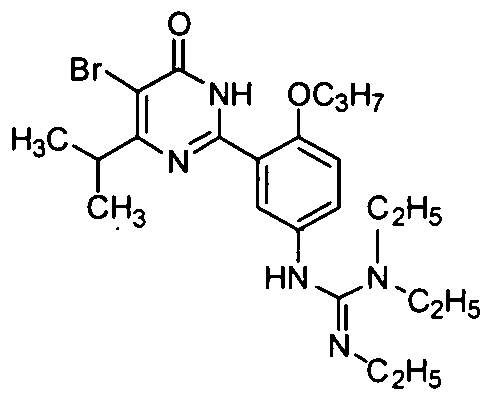
Соединение (150 мг, 0,28 ммоль) примера 36 добавляют в 20 мл этанола, добавляют диэтиламин (84 мг, 0,8 ммоль) и перемешивают при 70°C в течение 15 ч. Охлажденную реакционную смесь концентрируют при пониженном давлении. Полученное пастообразное твердое вещество промывают 4 мл этилацетата и растворяют в CH2Cl2 (100 мл) и затем промывают водой (30 мл×2), 10% NaOH (20 мл) и насыщенным солевым раствором (40 мл) соответственно. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении. Остаток перекристаллизовывают из этилацетата-метанола для получения белого твердого вещества (75 мг, выход: 56%). 1H ЯМР (DMSO-d6) δ: 7,14 (1H, d), 6,98 (1H, dd), 6,85 (1H, d), 3,94 (2H, t), 3,37 (1H, m), 3,21 (4H, q), 2,93 (2H, q), 1,69 (2H, m), 1,14 (6H, d), 1,05 (6H, t), 1,00 (3H, t), 0,94 (3H, t).
Примеры 38-40
Соединения примеров 38-40 получают реакцией соединения примера 36 с пиперидином, пирролидином и диэтаноламином соответственно способом, описанным в примере 37:
|
Пример 41
2-(5-Нитро-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
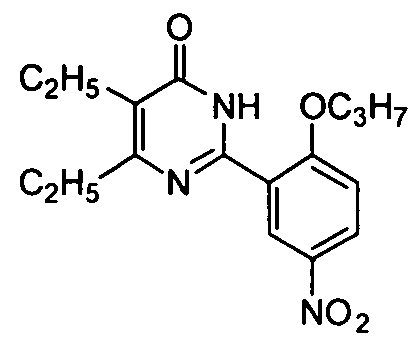
Целевое соединение получают из соединения примера приготовления 33 в качестве исходного материала способом, описанным в примере 33. Выход: 89%. 1H ЯМР (CDCl3) δ: 9,29 (1H, d), 8,35 (1H, dd), 7,14 (1H, d), 4,30 (2H, t), 2,73 (2H, q), 2,60 (2H, q), 2,02 (2H, m), 1,32 (3H, t), 1,15 (6H, t).
Пример 42
2-(5-Амино-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
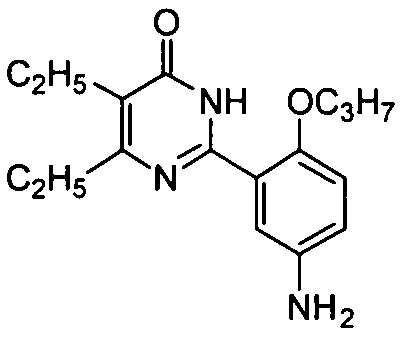
Соединение (16,5 г, 50 ммоль) примера 41 растворяют в метаноле, добавляют 0,4 г 10% Pd/C и гидрируют при обычной температуре и давлении. Когда водород более не поглощается реакционной смесью, реакция подавляется и Pd/C отфильтровывают. Фильтрат концентрируют до небольшого объема и подают газообразный HCl для получения белого твердого вещества. Полученное твердое вещество отфильтровывают и сушат для получения гидрохлората целевого соединения (16,4 г, выход: 97%). 1H ЯМР (CDCl3) δ: 7,68 (1H, d), 7,43 (1H, dd), 7,24 (1H, d), 4,04 (2H, t), 2,57 (2H, q), 2,46 (2H, q), 1,75 (2H, m), 1,19 (3H, t), 1,04 (3H, t), 0,96 (3H, t).
Пример 43
1-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этилтио-мочевина
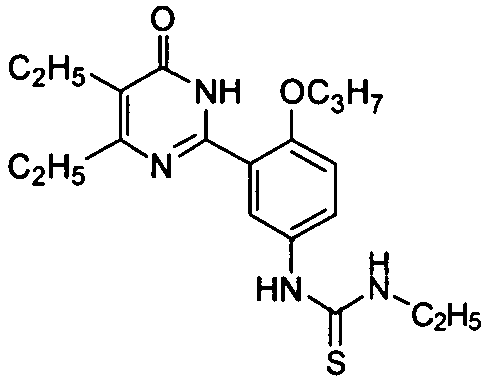
Целевое соединение получают из соединения примера 42 способом, описанным в примере 35. Выход: 83%. 1H ЯМР (DMSO-d6) δ: 11,79 (1H, br), 9,40 (1H, br), 7,73 (1H, d), 7,52 (1H, dd), 7,13 (1H, d), 4,05 (2H, t), 3,46 (2H, q), 2,56 (2H, q), 2,45 (2H, q), 1,76 (2H, m), 1,18 (3H, t), 1,10 (3H, t), 1,04 (3H, t), 0,98 (3H, t).
Пример 44
1-[3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил]-3-этил-2-метилизотиомочевина
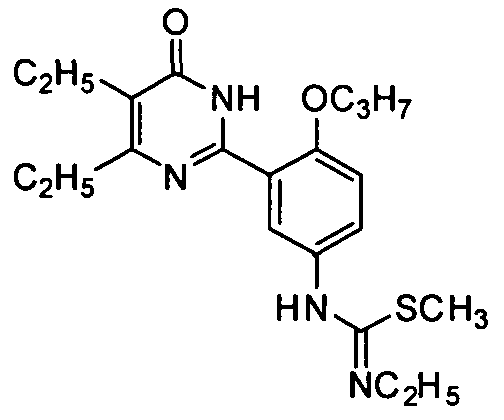
Целевое соединение получают из соединения примера 43 способом, описанным в примере 36. Выход: 87%. 1H ЯМР (DMSO-d6) δ: 7,78 (1H, d), 7,56 (1H, dd), 7,13 (1H, d), 4,07 (2H, t), 3,46 (2H, q), 2,67 (3H, s), 2,56 (2H, q), 2,45 (2H, q), 1,76 (2H, m), 1,18 (3H, t), 1,11 (3H, t), 1,04 (3H, t), 0,97 (3H, t).
Примеры 45-47
Соединения примера 45-47 получают реакцией соединения примера 44 с пиперидином, диэтиламином и диэтаноламином, соответственно, способом, описанным в примере 37:
|
|
Примеры 48 и 49
Соединение (0,40 г, 1,0 ммоль) примера 44 помещают в 20 мл этанола, добавляют пирролидин (0,28 г, 4 ммоль) и перемешивают при 70°C в течение 15 ч. Охлажденную реакционную смесь концентрируют при пониженном давлении, растворяют в CH2Cl2 (100 мл), промывают водой (30 мл×2), 10% NaOH (20 мл) и насыщенным солевым раствором (40 мл) соответственно. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении. Остаток пропускают через колонку силикагеля, используя этилацетат-метанол в качестве растворителя, получают 150 мг соединения примера 48 и 85 мг соединения примера 49:
|
|
Пример 50
5-Бром-6-изопропил-2-(2-н-пропокси-5-мезиламидофенил)пиримид-4(3H)-он
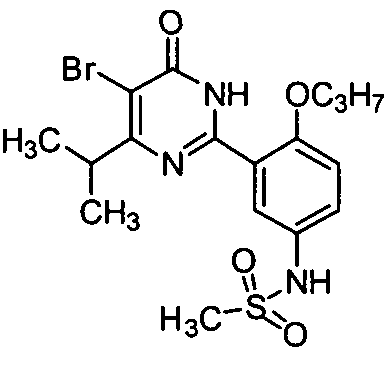
Соединение (0,37 г, 1 ммоль) примера 34 растворяют в дихлорметане (20 мл) и добавляют триэтиламин (1 мл) с последующим медленным добавлением мезилхлорида (81 мкл, 1 ммоль) на ледяной водяной бане. После перемешивания в течение 0,5 ч реакционную смесь промывают водой (10 мл), 1H раствором HCl (5 мл), насыщенным раствором бикарбоната натрия (10 мл), насыщенным солевым раствором соответственно. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое пропускают через колонку с силикагелем, используя этилацетат-петролейный эфир в качестве растворителя, для получения целевого продукта (160 мг, выход: 36%). 1H ЯМР (DMSO-d6) δ: 7,63 (1H, d), 7,37 (1H, dd), 7,18 (1H, d), 6,15 (1H, s), 4,02 (2H, t), 3,38 (1H, m), 2,95 (3H, s), 1,74 (2H, m), 1,18 (6H, d),0,95 (3H, t).
Пример 51
5,6-Диэтил-2-(2-н-пропокси-5-мезиламидофенил)пиримид-4(3H)-он
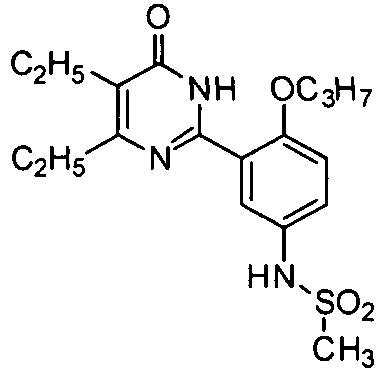
Целевой продукт получают реакцией соединения примера 42 с мезилхлоридом способом, описанным в примере 50. 1H ЯМР (CDCl3) δ: 8,28 (1H, d), 7,50 (1H, dd), 7,11 (1H, br), 7,02 (1H, d), 4,15 (2H, t), 3,00 (3H, s), 2,66 (2H, q), 2,58 (2H, q), 1,97 (2H, m), 1,28 (3H, t), 1,14 (3H, t), 1,12 (3H, t).
Примеры 52-54
Соединение примера 52 получают реакцией соединения примера 34 с ацетилхлоридом и соединения примеров 53 и 54 получают реакцией соединения примера 42 с ацетилхлоридом и пропионилхлоридом способом, описанным в примере 50:
|
Пример 55
N-(3-(1,6-Дигидро-4,5-диэтил-6-оксопиримидин-2-ил)-4-пропоксифенил)циклогексамид
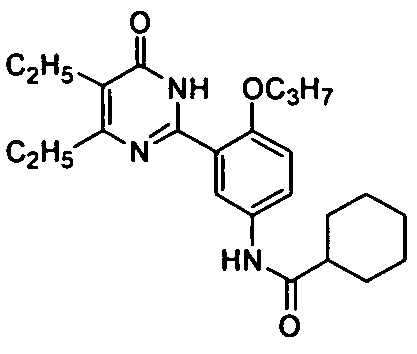
Циклогексилмуравьиную кислоту (100 мг, 0,78 ммоль) растворяют в дихлорметане (20 мл), добавляют дихлорэтан (EDCl) (130 мг, 0,78 ммоль) и перемешивают в течение 0,5 ч. Затем добавляют 1-гидроксибензотриазол (НОВТ) (100 мг, 0,78 ммоль) и перемешивают в течение 12 ч с последующим добавлением соединения (235 мг, 0,78 ммоль) примера 42. После перемешивания при комнатной температуре в течение 2 ч реакционную смесь промывают водой (10 мл) и насыщенным солевым раствором. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое затем пропускают через колонку с силикагелем для получения целевого соединения (250 мг, выход: 78%). 1H ЯМР (CDCl3) δ: 8,21 (1H, d), 8,08 (1H, dd), 7,55 (1H, br), 6,98 (1H, d), 4,13 (2H, t), 2,66 (2H, q), 2,58 (2H, q), 2,50-1,60 (13H, m), 1,28 (3H, t), 1,14 (3H, t), 1,12 (3H, t).
Примеры 56 и 57
Соединения примеров 56 и 57 получают конденсированием соединения примера 42 с муравьиной кислотой и N-Boc-4-гидроксипралином соответственно способом, описанным в примере 55:
|
|
Пример 58
4-н-Пропокси-3-(1,6-дигидро-4,5-диэтил-6-оксопиримидин-2-ил)бензойная кислота
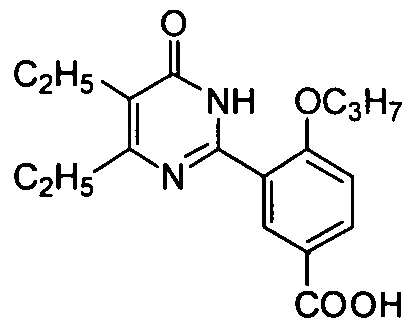
Соединение (1,0 г, 2,74 ммоль) примера приготовления 34 растворяют в DMF (12 мл), добавляют CuCN (0,28 г, 3,1 ммоль) и пиридин (1,2 мл) и подвергают дефлегмации в течение 24 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют насыщенный водный раствор Na2S2O3 (20 мл) и экстрагируют этилацетатом (15 мл×3). Органическую фазу концентрируют досуха. Полученное твердое вещество растворяют в растворе смеси 2H водного раствора NaOH (10 мл) и метанола (10 мл) и подвергают дефлегмации в течение 4 ч. После того как реакция закончилась, большую часть метанола и воды выпаривают. Остаток экстрагируют CH2Cl2 (15 мл×3) и водный слой доводят до pH 6-7 концентрированной соляной кислотой. Полученное белое твердое вещество отфильтровывают и сушат для получения целевого соединения (0,25 г, выход: 28%).
Пример 59
(Морфолин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси)-бензофенон
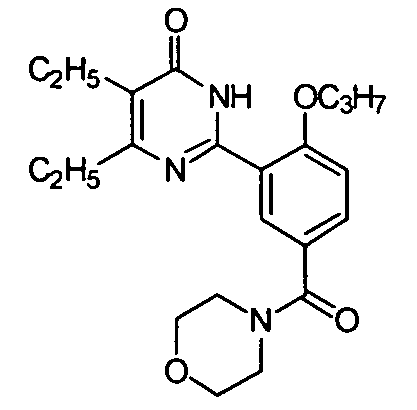
Соединение (100 мг, 0,3 ммоль) примера 58 растворяют в дихлорметане (20 мл), добавляют EDCl (50 мг, 0,3 ммоль) и перемешивают в течение 0,5 ч. Затем добавляют НОВТ (41 мг, 0,3 ммоль) и перемешивают в течение 12 ч. После чего добавляют морфолин (27 мг, 0,3 ммоль) и продолжают перемешивание при комнатной температуре в течение 2 ч. Реакционную смесь промывают водой (10 мл), насыщенным раствором бикарбоната натрия (10 мл) и насыщенным солевым раствором соответственно. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое пропускают через колонку с силикагелем для получения целевого соединения (60 мг, выход: 50%). 1H ЯМР (CDCl3) δ: 8,57 (1H, d), 7,59 (1H, dd), 7,08 (1H, d), 4,20 (2H, t), 3,74 (8H, br), 2,67 (2H, q), 2,59 (2H, q), 2,00 (2H, m), 1,29 (3H,t), 1,14 (6H,t).
Примеры 60 и 61
Соединения примеров 60 и 61 получают конденсированием соединения примера 58 с пиперидином и L-пролиламидом соответственно способом, описанным в примере 59:
|
|
Пример 62
4-н-Пропокси-3-(1,6-дигидро-4-изопропил-6-оксопиримидин-2-ил)бензойная кислота
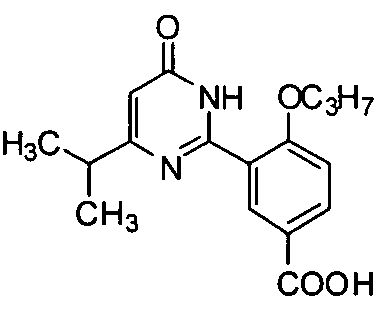
Соединение (4,0 г, 14 ммоль) примера приготовления 12 и K2CO3 (7,7 г, 56 ммоль) смешивают и суспендируют в DMF (30 мл) и затем добавляют этилизобутирилацетат (2,7 г, 17 ммоль) в один прием. Реакционную смесь перемешивают в течение ночи при 100°C под защитой среды азота, охлаждают, вливают в ледяную воду и доводят значение pH до 4-5 добавлением ледяной уксусной кислоты для получения желтоватого твердого сырья. После фильтрации твердое вещество промывают водой (250 мл) и сушат при 60°C. Сырье перекристаллизовывают из этилацетата для получения белого целевого продукта (3,4 г, выход: 77%). 1H ЯМР (CD3OD) δ: 8,57 (1H, d), 8,19 (1H, dd), 7.26 (1H, d), 6,25 (1H, s), 4,20 (2H, t), 2,86 (1H, m), 1,89 (2H, m), 1,29 (6H, d), 1,06 (3H, t).
Пример 63
(Морфолин-1-ил)(3-(4-изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси)бензофенон
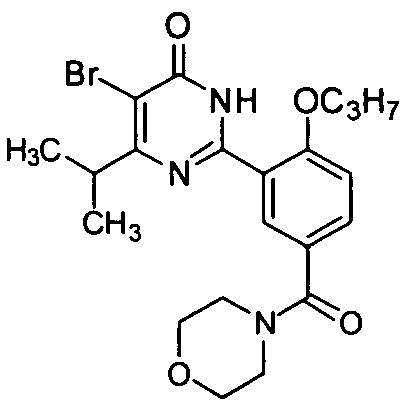
(Морфолин-1-ил)(3-(4-изопропил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси)-бензофенон сначала получают из соединения примера 62 в качестве исходного материала способом, описанным в примере 59, и затем бромируют способом, описанным в примере приготовления 19, для получения целевого продукта (выход: 30%). 1H ЯМР (CDCl3) δ: 8,60 (1H, d), 7,65 (1H, dd), 7,11 (1H, d), 4,24 (2H, t), 3,75 (8H, br), 3,51 (1H, m), 2,01 (2H, m), 1,26 (6H, d), 1,14 (3H, t).
Примеры 64 и 65
Соединения примеров 64 и 65 получают конденсированием соединения примера 62 с пиперидином и N-метилпиперазином соответственно и затем бромируют способом, описанным в примере 63:
|
Пример 66
2-(5-(N,N-Диметиламино-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
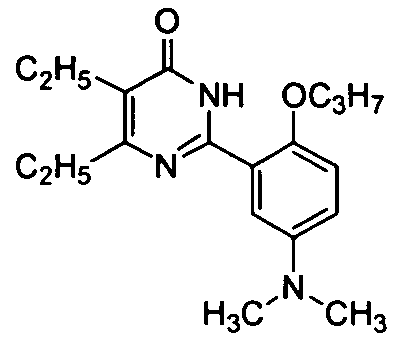
Соединение (100 мг, 0,3 ммоль) примера 42 суспендируют в воде (10 мл), осторожно добавляют параформальдегид (20 мг, 0,66 ммоль) и муравьиную кислоту (0,1 мл), подвергают дефлегмации и перемешивают в течение 2 ч. Реакционную смесь концентрируют досуха, растворяют в дихлорметане (20 мл) и промывают осторожно водой (10 мл), 1H раствором HCl (5 мл), насыщенным раствором бикарбоната натрия (10 мл), насыщенным солевым раствором. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое пропускают через колонку с силикагелем, используя этилацетат-петролейный эфир в качестве растворителя, для получения целевого продукта (100 мг, выход: 91%). 1H ЯМР (CDCl3) δ: 11,33 (1H, br), 7,92 (1H, d), 7,57 (1H, dd), 6,93 (1H, d), 4,08 (2H, t), 2,95 (6H, s), 2,67 (2H, q), 2,58 (2H, q), 1,94 (2H, m), 1,29 (3H,t), 1,14 (3H, t), 1,11 (3H, t).
Пример 67
1-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)мочевина
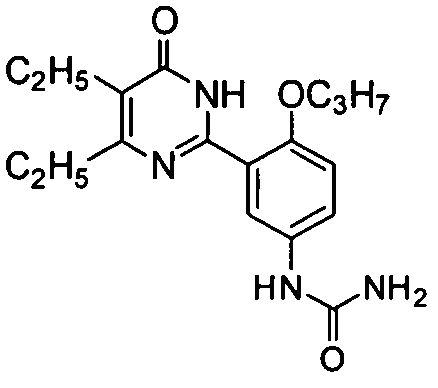
Соединение (200 мг, 0,6 ммоль) примера 42 суспендируют в растворе смеси воды (5 мл) и уксусной кислоты (5 мл), добавляют цианат калия (81 мг, 1 ммоль), подвергают дефлегмации и перемешивают в течение 2 ч. Охлажденную реакционную смесь выливают в воду для получения белого твердого вещества, которое промывают водой (10 мл×3) и сушат для получения целевого соединения (210 мг, выход: 91%). 1H ЯМР (DMSO-d6) δ: 11,76 (1H, br), 8,56 (1H, br), 7,76 (1H, d), 7,59 (1H, dd), 7,06 (1H, d), 5,78 (1H, br), 4,00 (2H, t), 2,56 (2H, q), 2,46 (2H, q), 1,74 (2H, m), 1,19 (3H, t), 1,04 (3H, t), 0,97 (3H, t).
Пример 68
1-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-этил-мочевина
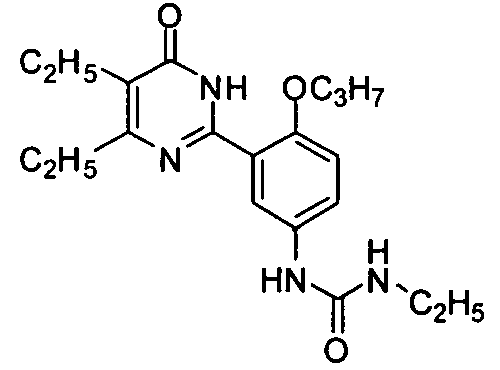
Целевой продукт получают реакцией соединения примера 42 с этилизоцианатом способом, описанным в примере 35. Выход: 90%. 1H ЯМР (DMSO-d6) δ: 11,76 (1H, br), 8,46 (1H, br), 7,77 (1H, d), 7,57 (1H, dd), 7,06 (1H, d), 6,01 (1H, t), 4,00 (2H, t), 3,09 (2H, m), 2,56 (2H, q), 2,45 (2H, q), 1,73 (2H, m), 1,19 (3H, t), 1,03 (6H, t), 0,97 (3H, t).
Пример 69
1-(3-(4-Изопропил-5-бром-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-3-фенилтиомочевина
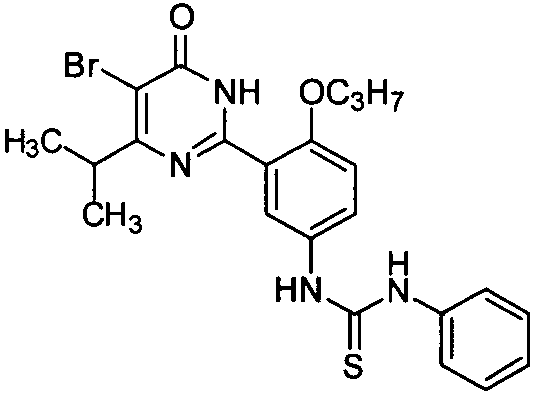
Целевой продукт получают реакцией соединения примера 34 с фенилизосульфоцианатом способом, описанным в примере 35. Выход: 89%. 1H ЯМР (DMSO-d6) δ: 12,38 (1H, br), 9,79 (1H, br), 7,84 (1H, d), 7,65 (1H, dd), 7,53-7,07 (6H, m), 4,06 (2H, t), 3,37 (1H, m), 1,75 (2H, m), 1,17 (6H, d), 0,97 (3H, t).
Пример 70
1-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)гуанидин
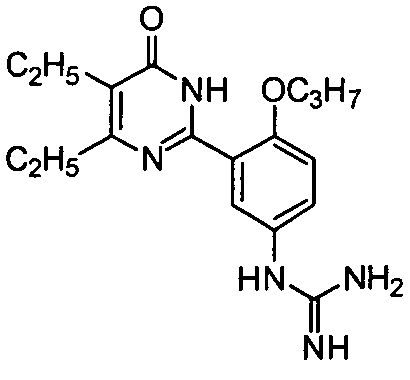
Соединение (140 мг, 0,41 ммоль) примера 42 суспендируют в растворе смеси воды (2,5 мл) и уксусной кислоты (2,5 мл), добавляют S-метилизотиомочевину (64 мг, 0,45 ммоль) и подвергают дефлегмации при перемешивании в течение 10 ч. Реакционную смесь концентрируют досуха, растворяют в дихлорметане (20 мл) и осторожно промывают 1H раствором NaOH (5 мл), водой (10 мл) и насыщенным солевым раствором. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое пропускают через колонку с силикагелем, используя этилацетат-петролейный эфир в качестве растворителя, для получения целевого соединения (35 мг, выход: 25%). 1H ЯМР (CDCl3) δ: 8,26 (1H, d), 8,00 (1H, dd), 7,50 (1H, br), 6,99 (1H, d), 4,14 (2H, t), 2,67 (2H, q), 2,59 (2H, q), 1,97 (2H, m), 1,29 (3H, t), 1,15 (3H, t), 1,13 (3H, t).
Пример 71
5-Бром-6-изопропил-2-(5-(2-бромацетил)-2-н-пропоксифенил)пиримид-4(3H)-он
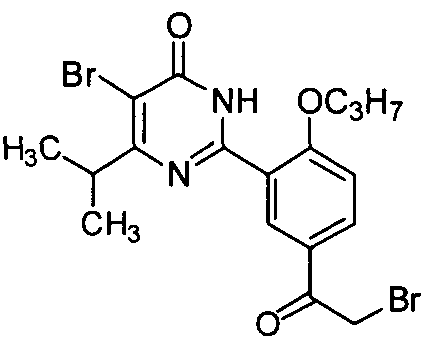
Соединение (2,5 г, 7,1 ммоль) примера приготовления 35 растворяют в DMF (50 мл), добавляют винил-н-бутиловый эфир (4,7 мл), 1,4-бис(дифенилфосфин)бутан (0,47 г, 1,1 ммоль), Pd(OAc)2 (0,14 г, 0,62 ммоль) и триэтиламин (1,2 мл) с последующим перемешиванием при 100°C в течение 36 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют воду (40 мл) и экстрагируют CH2Cl2 (30 мл×3). Органическую фазу концентрируют досуха, добавляют раствор смеси 10% соляной кислоты (30 мл) и ТГФ (30 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. ТГФ выпаривают и реакционную смесь охлаждают до комнатной температуры, доводят значение pH до 6-7 2H раствором NaOH и экстрагируют CH2Cl2 (20 мл×3). Органическую фазу промывают насыщенным солевым раствором (20 мл×3), сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла. Масло растворяют в 25 мл ледяной уксусной кислоты, добавляют по каплям жидкий бром (0,5 мл) при комнатной температуре, перемешивают при 30°C в течение 3 ч и добавляют 30 мл воды с последующей экстракцией этилацетатом (30 мл×3). Органический слой промывают насыщенным солевым раствором (20 мл×3), сушат безводным Na2SO4, концентрируют при пониженном давлении и остаток пропускают через колонку с силикагелем, используя этилацетат-петролейный эфир в качестве растворителя, для получения целевого соединения (0,61 г, общий выход: 18%). 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 9,21 (1H, d), 8,17 (1H, dd), 7,15 (1H, d), 4,45 (2H, s), 4,30 (2H, t), 3,52 (1H, m), 2,03 (2H, m), 1,30 (6H, d), 1,16 (3H, t).
Пример 72
5-Бром-6-изопропил-2-(5-(2-морфолинилацетил)-2-н-пропоксифенил)пиримид-4(3H)-он
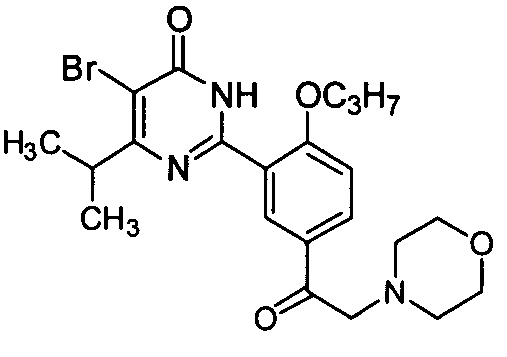
Соединение (150 мг, 0,32 ммоль) примера 71 растворяют в дихлорметане (20 мл), добавляют триэтиламин (0,5 мл) и тетрагидрооксазин (40 мг, 0,46 ммоль) с последующим перемешиванием в течение 12 ч. Реакционную смесь промывают осторожно водой (10 мл) и насыщенным солевым раствором. Органическую фазу сушат безводным Na2SO4 и концентрируют при пониженном давлении для получения масла, которое пропускают через колонку с силикагелем для получения целевого соединения (60 мг, выход: 39%). 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 9,21 (1H, d), 8,17 (1H, dd), 7,15 (1H, d), 4,30 (2H, t), 3,75-3,64 (10H, br), 3,52 (1H, m), 2,03 (2H, m), 1,30 (6H, d), 1,16 (3H, t).
Пример 73
5-Бром-6-изопропил-2-(5-(2-(4-метилпиперазин-1-ил)ацетил)-2-н-пропоксифенил)-пиримид-4(3H)-он
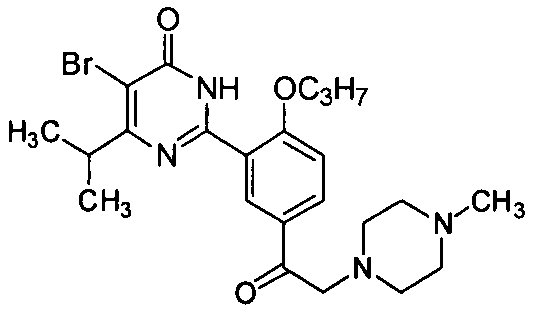
Целевой продукт получают реакцией соединения примера 71 с N-метилпиперазином способом, описанным в примере 72. 1H ЯМР (CDCl3) δ: 9,23 (1H, d), 8,19 (1H, dd), 7,10 (1H, d), 4,28 (2H, t), 3,77 (2H, s), 3,53 (1H, m), 2,66 (4H, t), 2,52 (4H, t), 2,31 (3H, s), 2,02 (2H, m), 1,29 (6H, d), 1,15 (3H, t).
Пример 74
5,6-Диэтил-2-(5-(2-бромацетил)-2-н-пропоксифенил)пиримид-4(3H)-он
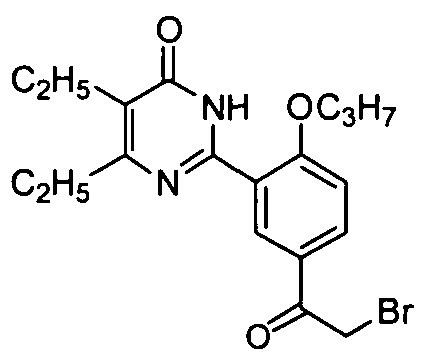
Целевое соединение получают из соединения примера приготовления 34 способом, описанным в примере 71. 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 8,60 (1H, d), 7,59 (1H, dd), 7,10 (1H, d), 4,45 (2H, s), 4,20 (2H, t), 2,65 (2H, q), 2,58 (2H, q), 2,03 (2H, m), 1,28 (3H, t), 1,14 (6H, t).
Примеры 75 и 76
Соединения примеров 75 и 76 получают реакцией соединения примера 74 с N-метилпиперазином и морфолином соответственно способом, описанным в примере 72:
|
Пример 77
5-Бром-6-изопропил-2-(2-н-пропокси-5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-иламино)фенил)пиримид-4(3H)-он
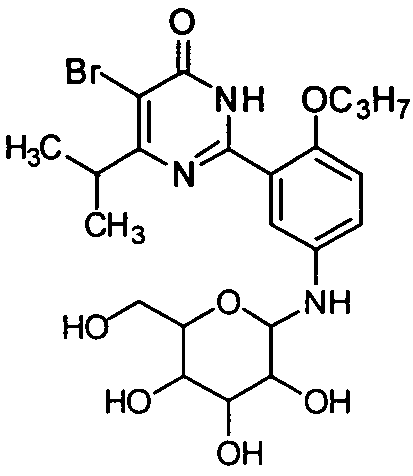
Соединение примера 34 (200 мг, 0,55 ммоль) растворяют в н-бутаноле (10 мл), и добавляют глюкозу (200 мг, 1 ммоль) и одну каплю ледяной уксусной кислоты. Реакционную смесь подвергают дефлегмации под защитой среды азота в течение 12 ч. Охлажденную реакционную смесь концентрируют досуха и добавляют дихлорметан. Органический слой промывают насыщенным солевым раствором (20 мл×3), сушат безводным Na2SO4 и концентрируют при пониженном давлении. Остаток пропускают через колонку с силикагелем для получения целевого соединения (60 мг, выход: 21%). 1H ЯМР (DMSO-d6) δ: 7,47 (1H, d), 7,21 (1H, dd), 7,09 (1H, d), 4,31 (1H, d), 4,01 (3H, t), 3,63 (1H, d), 3,46 (1H, d), 3,09-3,29 (4H, m), 2,57 (2H, q), 2,46 (2H, q), 1,72 (2H, m), 1,18 (6H, d), 0,95 (3H, t).
Пример 78
5-Бром-6-изопропил-2-(2-н-пропокси-5-(тетрагидро-3,4-дигидрокси-5-(1,2-дигидроксиэтил)фур-2-иламино)фенил)пиримид-4(3H)-он
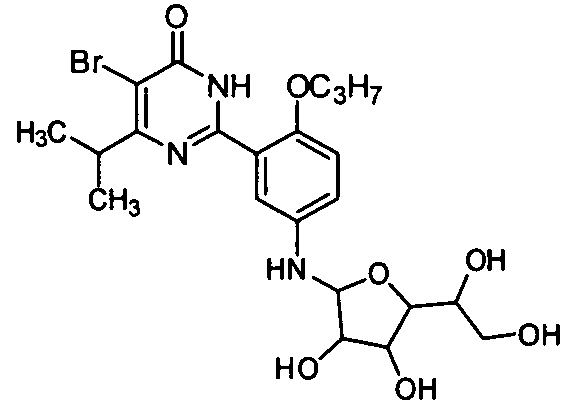
Целевой продукт получают реакцией соединения примера 34 с маннозой способом, описанным в примере 77. 1H ЯМР (DMSO-d6) δ: 7,47 (1H, d), 7,21 (1H, dd), 7,09 (1H, d), 4,75 (1H, d), 4,01 (2H, t), 3,78-3,37 (7H, m), 2,57 (2H, q), 2,46 (2H, q), 1,72 (2H, m), 1,18 (6H, d), 0,95 (3H, t).
Примеры 79 и 80
Соединения примеров 79 и 80 получают реакцией соединения примера 42 с маннозой и глюкозой способом, описанным в примере 77:
|
Пример 81
2-(5-Гидрокси-2-н-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
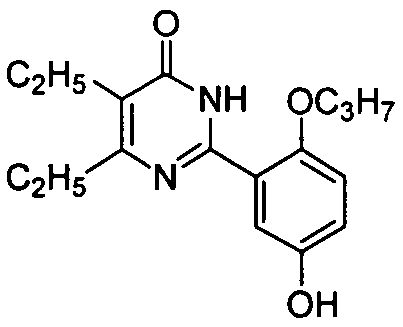
Целевой продукт получают реакцией метил 2-этил-3-оксовалерата с соединением примера приготовления 11 способом, описанным в примере 1. 1H ЯМР (CDCl3) δ: 7,98 (1H, d), 7,00 (1H, dd), 6,88 (1H, d), 4,06 (2H, t), 2,65 (2H, q), 2,59 (2H, q), 1,92 (2H, m), 1,26 (3H, t), 1,15 (3H, t), 4,08 (3H, t).
Пример 82
(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)ацетат
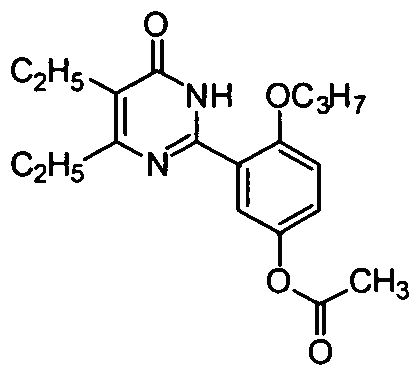
Соединение примера 82 получают реакцией соединения примера 81 с ацетилхлоридом способом, описанным в примере 50. 1H ЯМР (CDCl3) δ: 8,20 (1H, d), 7,20 (1H, dd), 7,02 (1H, d), 4,17 (2H, t), 2,67 (2H, q), 2,59 (2H, q), 2,33 (3H, s), 1,99 (2H, m), 1,29 (3H, t), 1,15 (6H, t).
Пример 83
3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенилэтиламино-формат
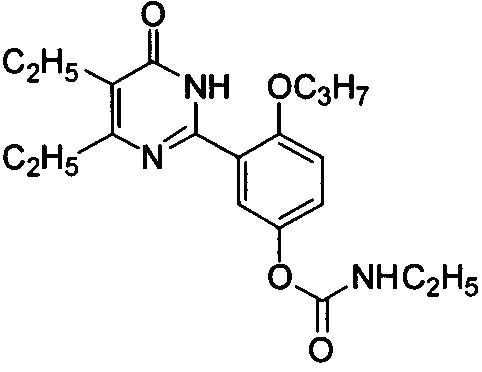
Целевой продукт получают реакцией соединения примера 81 с этилизоцианатом способом, описанным в примере 35. 1H ЯМР (CDCl3) δ: 8,20 (1H, d), 7,25 (1H, dd), 6,99 (1H, d), 5,06 (1H, br), 4,14 (2H, t), 3,32 (2H, m), 2,66 (2H, q), 2,58 (2H, q), 1,98 (2H, m), 1,28 (3H, t), 1,22 (3H, t), 1,14 (3H, t), 1,13 (3H, t).
Пример 84
5,6-Диэтил-2-(2-н-пропокси-5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-2-илокси)фенил)пиримид-4(3H)-он
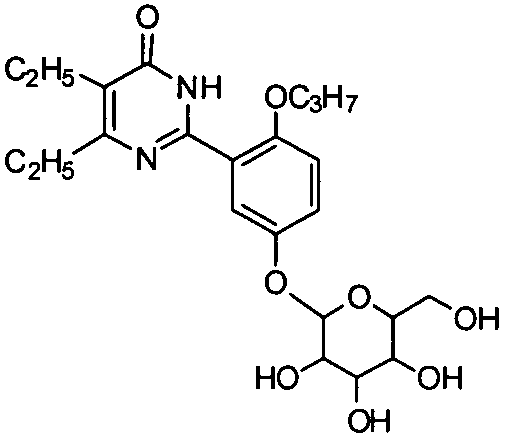
Соединение (500 мг, 1,6 ммоль) примера 81 растворяют в дихлорметане (20 мл) и добавляют боронтрифторидэтерат (2 мл) и сложный эфир 2,3,4,6-тетра-о-ацетил-α-d-глюкопиранозы и трихлорацетилимида (800 мг, 1,6 ммоль) (описание методики можно найти в Upreti, M. et al. Tetrahedron, 2000, 56, 6577) с последующим перемешиванием при комнатной температуре в течение 12 ч. Реакционную смесь концентрируют досуха для получения масла. Масло растворяют в растворе смеси метанола (10 мл) и воды (10 мл) и добавляют карбонат калия (900 мг, 6,5 ммоль) с последующей дефлегмацией в течение 2 ч. Реакционную смесь концентрируют досуха и остаток пропускают через колонку с силикагелем для получения целевого соединения (155 мг, общий выход двух стадий: 20%. 1H ЯМР (DMSO-d6) δ: 7,48 (1H, d), 7,20 (1H, dd), 7,10 (1H, d), 4,75 (1H, d), 4,01 (2H, t), 3,69-3,48 (2H, m), 3,33-3,14 (4H, m), 2,57 (2H, q), 2,46 (2H, q), 1,72 (2H, m), 1,18 (3H, t), 1,03 (3H, t), 0,96 (3H, t).
Пример 85
3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенилмезилат
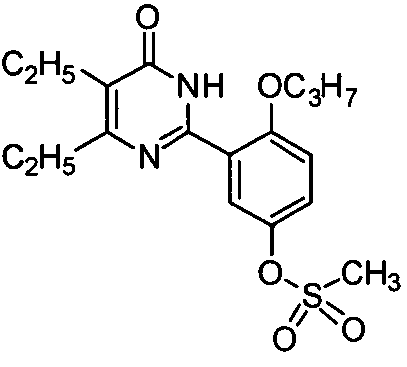
Целевой продукт получают реакцией соединения примера 81 с мезилхлоридом способом, описанным в примере 50. 1H ЯМР (CDCl3) δ: 8,39 (1H, d), 7,43 (1H, dd), 7,06 (1H, d), 4,18 (2H, t), 3,20 (3H, s), 2,68 (2H, q), 2,58 (2H, q), 2,00 (2H, m), 1,28 (3H, t), 1,14 (6H, t).
Пример 86
2-(5-(2,5-Диметил-1H-пиррол-1-ил)-2-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
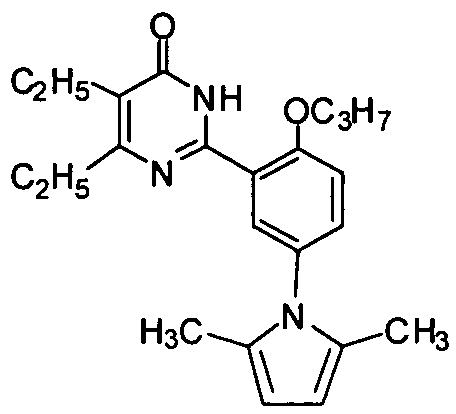
Соединение (200 мг, 0,66 ммоль) примера 42 и 2,5-гександион (76 мг, 0,66 ммоль) растворяют в этаноле (10 мл) и добавляют ледяную уксусную кислоту (0,1 мл) с последующей дефлегмацией в течение 12 ч. Реакционную смесь концентрируют досуха, растворяют в CH2Cl2 (10 мл) и промывают насыщенным NaHCO3 (10 мл) и насыщенным солевым раствором (10 мл), сушат и концентрируют. Остаток пропускают через колонку с силикагелем для получения целевого соединения (110 мг, выход: 44%). 1H ЯМР (CDCl3) δ: 11,20 (1H, br), 8,42 (1H, d), 7,30 (1H, dd), 7,10 (1H, d), 5,93 (2H, s), 4,23 (2H, t), 2,63 (2H, q), 2,59 (2H, q), 2,06 (6H, s), 2,04 (2H, m), 1,24 (3H, t), 1,18 (3H, t), 1,15 (3H, t).
Пример 87
2,2′-(4-н-Пропокси-1,3-фенилен)бис(5,6-диэтилпиримид-4(3H)-он)
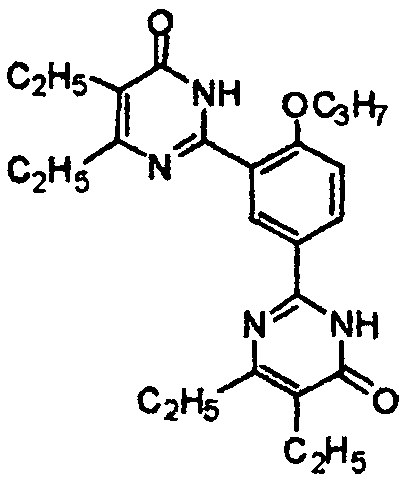
Целевой продукт получают реакцией соединения примера приготовления 10 с метил 2-этил-3-оксовалератом способом, описанным в примере 1. 1H ЯМР (CDCl3) δ: 9,08 (1H, d), 8,34 (1H, dd), 7,08 (1H, d), 4,19 (2H, t), 2,74-2,48 (8H, m), 1,97 (2H, m), 1,30 (3H, t), 1,27 (3H, t), 1,15 (3H, t), 1,13 (3H, t), 1,07 (3H, t).
Пример 88
2-(5-(1,3,4-Оксадиазол-2-ил)-2-пропоксифенил)-5,6-диэтилпиримид-4(3H)-он
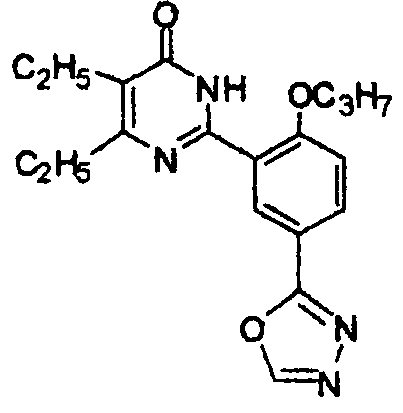
Целевой продукт получают реакцией соединения примера приготовления 8 с метил 2-этил-3-оксовалератом способом, описанным в примере 1. 1H ЯМР (CDCl3) δ: 8,69 (1H, d), 8,51 (1H, dd), 7,05 (1H, d), 4,14 (2H, t), 2,69 (4H, m), 1,92 (2H, m), 1,31 (3H, t), 1,21 (3H, t), 1,12 (3H, t).
Пример 89
Этил 2-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензамидо)ацетат
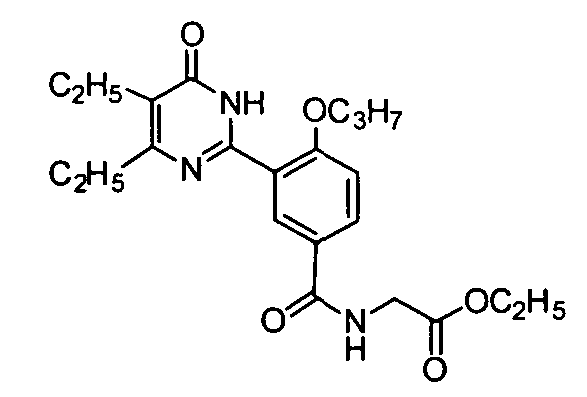
Соединение (250 мг, 0,76 ммоль) примера 58 суспендируют в дихлорметане (20 мл) и добавляют тионилхлорид (2 мл) с последующей дефлегмацией в течение 2 ч для очистки реакционной смеси. Реакционную смесь концентрируют из тионилхлорида и добавляют дихлорметан. В ванне со льдом реакционную смесь добавляют по каплям в раствор дихлорметана (20 мл), содержащий этил 2-аминоацетат (80 мг, 0,727 ммоль) и триэтиламин (0,2 мл, 1,454 ммоль), с последующим перемешивании в течение 0,5 ч. Затем реакционную смесь промывают водой (20 мл) и насыщенным солевым раствором (20 мл) соответственно. Органический слой сушат безводным сульфатом натрия и концентрируют. Остаток пропускают через колонку с силикагелем для получения белого целевого продукта (100 мг, выход: 33%). 1H ЯМР (CDCl3) δ: 11,01 (1H, br), 8,87 (1H, d), 8,00 (1H, dd), 7,08 (1H, d), 6,87 (1H, br), 4,27 (2H, q), 4,25 (2H, t), 4,21 (2H, t), 2,69 (2H, q), 2,59 (2H, q), 2,00 (2H, m), 1,32 (3H, t), 1,30 (3H, t), 1,15 (6H, t).
Примеры 90-97
Способом, описанным в примере 89, соединение примера 58 сначала подвергают реакции с тионилхлоридом для получения продукта, который затем подвергают реакции с N-аминоэтилморфолином, диэтаноламином, 3-аминоциклокапролактамом, 1-(2,3-дихлорфенил)-пиперазином, 3-изопропилпиразолом, циклогексиламином, 2-аминометилпиридином и метил 3,3-диметилбутиратом соответственно для получения целевых соединений примеров 90-97:
|
|
|
Примеры 98-105
Соединение примера 42 подвергают реакции с трифторацетилхлоридом, этилоксалилмонохлоридом, акролилхлоридом, кротонилхлоридом, этилмалонилхлоридом, 2-этоксибензоилхлоридом, никотиноилхлоридом, 5-изопропилтиазолформилхлоридом соответственно для получения целевых соединений примеров 98-105 способом, описанным в примере 50:
|
|
Пример 106
Трет-бутил-3-(N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)аминоформил)пропиламиноформат
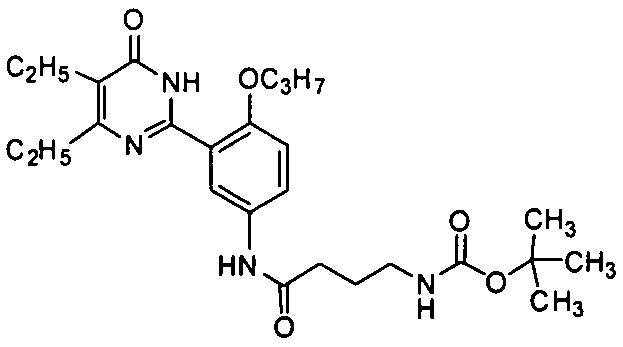
N-Boc-4-аминомасляную кислоту (203 мг, 1 ммоль) растворяют в дихлорметане (50 мл) и добавляют EDCl (180 мг, 1 ммоль) и НОВТ (135 мг, 1 ммоль) с последующим перемешиванием при комнатной температуре в течение 12 ч. Затем добавляют соединение примера 42 (300 мг, 1 ммоль) и перемешивание продолжают при комнатной температуре в течение 6 ч. Реакционную смесь промывают водой (50 мл) и насыщенным солевым раствором (50 мл) соответственно. Органический слой сушат безводным сульфатом натрия и концентрируют и остаток пропускают через колонку с силикагелем для получения белого целевого продукта (200 мг, выход: 41%). 1H ЯМР (CDCl3) δ: 9,00 (1H, br), 8,39 (1H, d), 8,09 (1H, dd), 6,99 (1H, d), 4,83 (1H, t), 4,14 (2H, t), 3,27 (2H, m), 2,65 (2H, q), 2,59 (2H, q), 2,41 (2H, t), 1,97 (2H, m), 1,89 (2H, m), 1,48 (9H, s), 1,29 (3H, t), 1,14 (3H, t), 1,13 (3H, t).
Пример 107
4-Ацетамидо-N-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)бутирамид
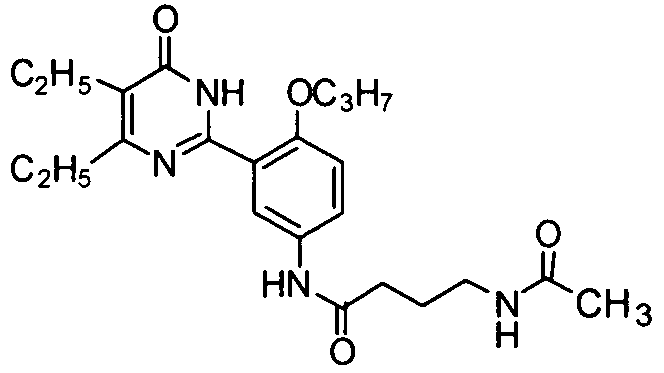
Соединение (200 мг, 0,412 ммоль) примера 106 растворяют в дихлорметане (30 мл) и добавляют трифторуксусную кислоту (2 мл) с последующим перемешиванием при комнатной температуре в течение 0,5 ч. Реакционную смесь непосредственно концентрируют досуха. Полученное масло растворяют в дихлорметане (30 мл) и добавляют триэтиламин (1 мл). Затем под ледяной водой добавляют по каплям вначале ацетилхлорид (33 мг, 0,42 ммоль) в течение 0,5 ч, позже тонкослойная хроматография (TLC) показывает, что реакция завершена. Реакционную смесь промывают водой (50 мл) и насыщенным солевым раствором (50 мл). Органический слой сушат безводным сульфатом натрия и концентрируют и остаток пропускают через колонку с силикагелем для получения белого целевого продукта (50 мг, выход: 28%). 1H ЯМР (CDCl3) δ: 8,79 (1H, br), 8,51 (1H, d), 7,93 (1H, dd), 6,99 (1H, d), 6,05 (1H, br), 4,15 (2H, t), 3,40 (2H, t), 2,68 (2H, q), 2,60 (2H, q), 2,44 (2H, t), 2,03 (3H, s), 1,97 (2H, m), 1,94 (2H, m), 1,32 (3H, t), 1,16 (3H, t), 1,14 (3H, t).
Примеры 108-112
Согласно способу, описанному в примере 106 и примере 107, соединение примера 42 подвергают реакции с N-Boc-пролином, N-Boc-валином, N-Boc-фенилаланином, N-Boc-лактамином и N-Boc-лизином соответственно и затем удаляют Вос-защитную группу и ацетилируют для получения соединений примеров 108-112:
|
|
Пример 113
N1-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)пропан-диамид
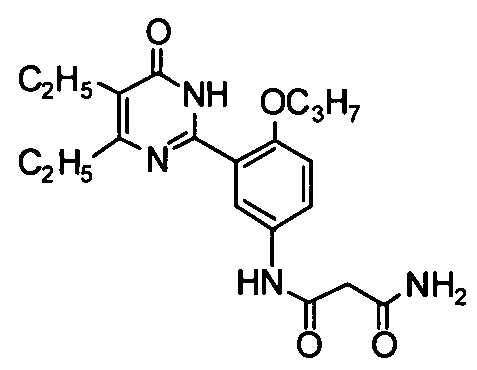
Соединение примера 102 (100 мг) герметизируют в трубе на 25 мл, добавляют насыщенный раствор (15 мл) аммиака в этаноле (15 мл) и нагревают до 120°C для взаимодействия в течение 12 ч. Реакционную смесь концентрируют досуха и остаток перекристаллизовывают из этилацетата для получения белого целевого продукта (60 мг, выход: 64%). 1H ЯМР (CDCl3) δ: 9,57 (1H, br), 8,38 (1H, d), 7,87 (1H, dd), 7,02 (1H, br), 6,96 (1H, d), 5,93 (1H, br), 4,12 (2H, t), 3,44 (2H, s), 2,64 (2H, q), 2,57 (2H, q), 1,95 (2H, m), 1,27 (3H, t), 1,14 (3H, t), 1,11 (3H, t).
Примеры 114-115
Соединения примеров 114-115 получают соответственно реакции соединения примеров 99 и 89 с насыщенным раствором аммиака в этаноле способом, описанным в примере 113:
|
Пример 116
5,6-диэтил-2-{2-н-пропокси-5-[(2-(1-метилпиррол-2-ил)этил)аминосульфонил]фенил}-пиримид-4(3H)-он
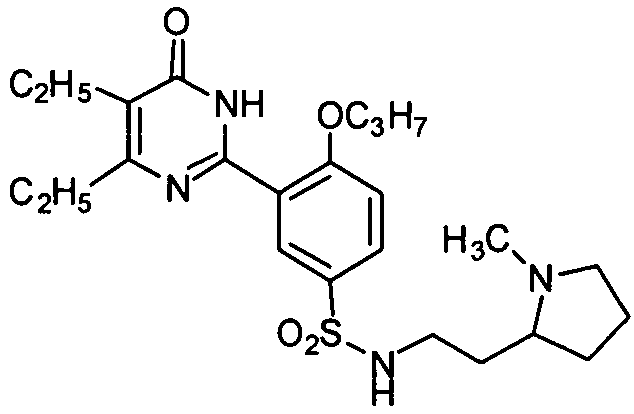
Согласно способу, описанному в примере 10, соединение примера приготовления 33 вначале хлорсульфируют и затем подвергают реакции с 2-(1-метилпиррол-2-ил)этиламином для получения соединения примера 116. 1H ЯМР (DMSO-d6) δ: 12,04 (1H, br), 8,02 (1H, d), 7,87 (1H, dd), 7,60 (1H, br), 7,35 (1H, d), 4,11 (2H, t), 2,88 (1H, m), 2,75 (2H, m), 2,57 (2H, q), 2,47 (2H, q), 2,12 (3H, s), 2,00 (2H, m), 1,85-1,62 (4H, m), 1,55 (2H, m), 1,29 (2H, m), 1,19 (3H, t), 1,04 (3H, t), 0,96 (3H, t).
Пример 117
3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-N-(2-(1-метилпиррол-2-ил)этил)-4-н-пропоксибензамид
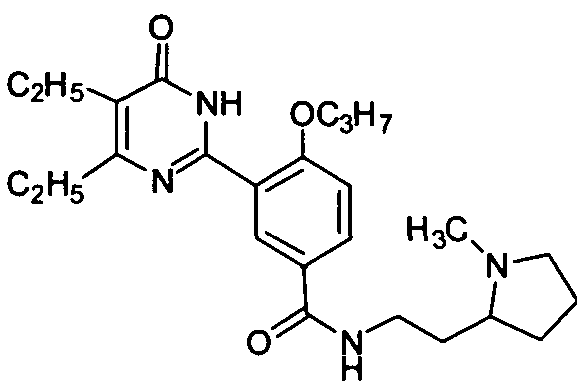
Согласно способу, описанному в примере 89, соединение примера 58 подвергают реакции с 2-(1-метилпиррол-2-ил)этиламином для получения соединения примера 117. 1H ЯМР (DMSO-d6) δ: 12,01 (1H, br), 8,50 (1H, t), 8,12 (1H, d), 7,96 (1H, dd), 7,22 (1H, d), 4,08 (2H, t), 3,28 (2H, m), 2,98 (1H, m), 2,58 (2H, q), 2,47 (2H, q), 2,25 (3H, s), 2,13 (2H, m), 1,90 (2H, m), 1,75 (2H, m), 1,64 (2H, m), 1,45 (2H, m), 1,19 (3H, t), 1,04 (3H, t), 0,96 (3H, t).
Примеры 118-136
Согласно способу, описанному в примере 10, соединение примера приготовления 33 вначале хлорсульфируют и затем подвергают реакции с цитруллином, орнитином, валином, лактимином, серином, этиллактаматом, гомотаурином, таурином, аспарамидом, триптофаном, гликоцином, трет-лейцином, глютамином, этилизолейцинатом, метил 6-ацетиллизинатом, гидроксиэтилпиперазином, 1-пропаноламином, N-гидроксиэтил-2-(морфолин-1-ил)этиламином, N-метил-2-(пирролидин-1-ил)этиламином соответственно для получения соединений примеров 118-136:
|
|
|
|
|
|
Пример 137
5,6-Диэтил-2-(2-н-пропокси-5-(2-(N,N-диэтил)аминоэтиламиносульфонил)фенил)-пиримид-4(3H)-он малеат
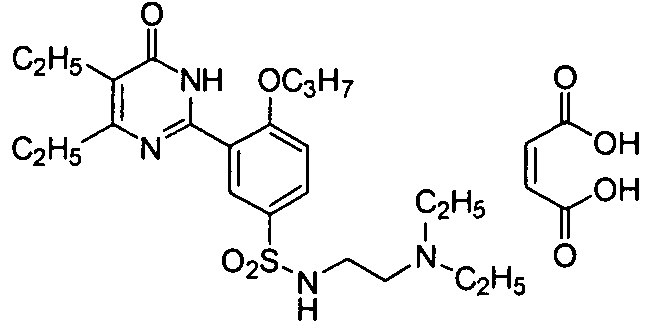
Соединение (0,35 г, 1,0 ммоль) примера приготовления 33 медленно добавляют в хлоросульфоновую кислоту (5 мл) в ванне со льдом. Ванну со льдом удаляют и реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем осторожно добавляют по каплям в раздробленный лед для получения желтоватого осадка и отфильтровывают. Полученное твердое вещество промывают ледяной водой, растворяют в CH2Cl2 (50 мл) и добавляют по каплям в раствор CH2Cl2 (30 мл), содержащий N,N-диэтилэтилендиамин (0,13 г, 1,1 ммоль) и триэтиламин (1 мл), в ванне со льдом. После добавления перемешивание продолжают в течение 30 мин. Органическую фазу промывают водой (3×20 мл) и насыщенным солевым раствором (20 мл) и отгоняют растворитель для получения масла. Масло растворяют в безводном этаноле (5 мл), добавляют малеиновую кислоту (0,13 г, 1,1 ммоль) и нагревают до 50°C с перемешиванием в течение 15 мин. Реакционную смесь перемешивают в течение 2 ч в ванне со льдом, фильтруют и сушат для получения целевого соединения (0,45 г, общий выход двух стадий: 77,6%). 1H ЯМР (DMSO-d6) δ: 8,05 (1H, d), 7,92 (1H, dd), 7,38 (1H, d), 6,04 (2H, s), 4,12 (2H, t), 3,18-3,02 (8H, m), 2,57 (2H, q), 2,46 (2H, q), 1,76 (2H, m), 1,18 (3H, t), 1,16 (3H, t), 1,04 (3H, t), 0,96 (3H, t).
Примеры 138-153
Согласно способу, описанному в примере 89, соединение примера 58 сначала подвергают реакции с тионилхлоридом и полученные продукты подвергают реакции с фенилаланином, метилпролинатом, метилтирозинатом, этилтриптофанатом, метилвалинатом, метилгистидинатом, этилизолейцинатом, лактамином, аспарамидом, глютамином, серином, аргинином, метилфенилаланинатом, метиллактаминатом, метиллейцинатом, этиллактаминатом соответственно для получения соединений примеров 138-153:
|
|
|
|
|
Примеры 154-155
Соединения примеров 154-155 получают реакцией соединения примера 151 с N-метилпиперазином и насыщенным раствором аммиака в этаноле соответственно способом, описанным в примере 113:
|
|
Примеры 156-175
Согласно способу, описанному в примере 89, соединение примера 58 сначала подвергают реакции с тионилхлоридом и полученные продукты подвергают реакции с аммиачной водой, 2-тиенилэтиламином, фурфуриламином, трет-бутиламином, изобутиламином, аллиламином, 1-(2-пиридил)пиперазином, гидроксилэтоксиэтил-пиперазином, гидроксиэтилпиперазином, 1-пропаноламином, 2-пропаноламином, N-этилэтаноламином, N,N-диэтилэтилендиамином, гомотаурином, таурином, N-метилэтаноламином, N-бензилпиперазином, N-метил-2-(пирролидин-1 -ил)-этиламином, метил 5-аминопиперидин-2-карбоксилатом и N,O-диметилгидроксиламином соответственно для получения соединений примеров 156-175:
|
|
|
|
|
Пример 176
5,6-Диэтил-2-[2-(3-метокси-н-пропокси)-5-(4-метил-1-пиперазинилсульфонил)-фенил]пиримид-4(3H)-он
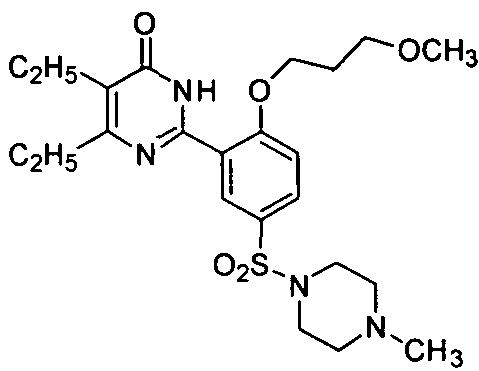
Согласно способу, описанному в примере 10, соединение примера приготовления 36 вначале хлорсульфируют и затем подвергают реакции с N-метилпиперазином для получения целевого соединения. 1H ЯМР (CDCl3) δ: 11,08 (1H, br), 8,78 (1H, d), 7,83 (1H, dd), 7,14 (1H, d), 4,38 (2H, t), 3,65 (2H, t), 3,40 (3H, s), 3,10 (4H, t), 2,66 (2H, q), 2,59 (2H, q), 2,53 (4H, t), 2,30 (3H, s), 2,22 (2H, m), 1,27 (3H, t), 1,15 (3H, t).
Пример 177
2-Хлор-N-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-ацетамид
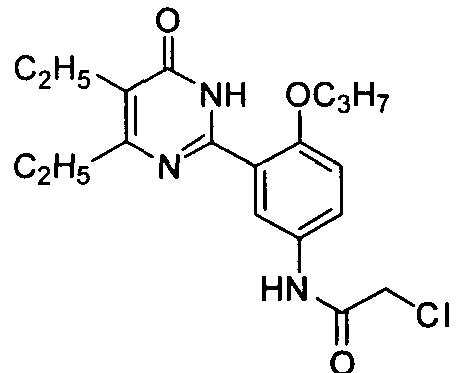
Соединение (0,74 г, 2 ммоль) примера 34 растворяют в дихлорметане (20 мл), добавляют триэтиламин (2 мл) с последующим медленным добавлением хлорацетилхлорида (0,23 г, 2,05 ммоль) в ледяной водяной бане. После перемешивания в течение 0,5 ч реакционную смесь промывают водой (10 мл), 1H раствором HCl (5 мл), насыщенным раствором бикарбоната натрия (10 мл) и насыщенным солевым раствором соответственно. Органическую фазу сушат безводным Na2SO4 и концентрируют. Полученное масло перекристаллизовывают из этилацетат-петролейного эфира для получения целевого соединения (0,71 г, выход: 94%). 1H ЯМР (CDCl3) δ: 11,16 (1H, br), 9,09 (1H, br), 8,27 (1H, d), 8,00 (1H, dd), 7,01 (1H, d), 4,15 (2H, t), 3,18 (2H, s), 2,68 (2H, q), 2,58 (2H, q), 1,97 (2H, m), 1,31 (3H, t), 1,15 (3H, t), 1,13 (3H, t).
Пример 178
2-(Диметиламино)-N-3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропокси-фенил)ацетамид
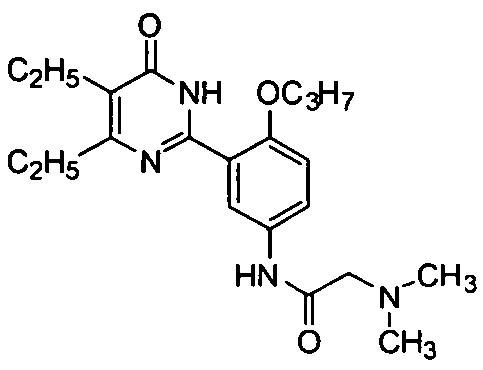
Соединение (0,38 г, 1 ммоль) примера 177 суспендируют в 33% растворе диметиламина (20 мл), герметизируют в трубке и нагревают до 60°C для перемешивания в течение 10 ч. Реакционную смесь концентрируют досуха, промывают водой и сушат. Полученное твердое вещество перекристаллизовывают из этилацетата для получения целевого соединения (0,36 г, выход: 93,2%). 1H ЯМР (DMSO-d6) δ: 11,81 (1H, br), 9,82 (1H, br), 8,03 (1H, d), 7,78 (1H, dd), 7,12 (1H, d), 4,02 (2H, t), 3,09 (2H, s), 2,57 (2H, q), 2,46 (2H, q), 2,29 (6H, s), 1,74 (2H, m), 1,20 (3H, t), 1,04 (3H, t), 0,97 (3H, t).
Примеры 179-182
Целевые соединения получают реакцией соединения примера 77 с N-метилпиперазином, морфолином, пиперидином и триметилфосфитом соответственно способом, описанным в примере 178:
|
|
Примеры 183-188
Соединения примеров 183-188 получают реакцией соединения примера 42 с изобутирилхлоридом, изовалерилхлоридом, фенилацетилхлоридом, бензоилхлоридом, этилсукцинилхлоридом и пироглютамилхлоридом соответственно способом, описанным в примере 50:
|
|
Примеры 189-193
Согласно способам, описанным в примере 106 и примере 107, соединение примера 42 подвергают реакции с N-Boc-лейцином, N-Boc-триптофаном, N-Boc-глютамином, N-Boc-треонином и N-Boc-серином соответственно и затем удаляют Вос-защитную группу и ацетилируют для получения соединений примеров 189-193:
|
|
Пример 194
2-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифениламино-формил)-2-ацетамидоэтилацетат
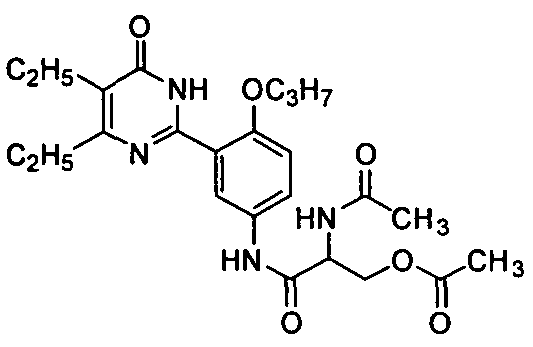
При комнатной температуре соединение (0,21 г, 0,5 ммоль) примера 193 растворяют в дихлорметане (10 мл) и добавляют пиридин (40 мг, 0,5 ммоль) и через 0,5 ч уксусный ангидрид (51 мг, 0,5 ммоль). TLC показывает, что реакция завершена. Реакционную смесь промывают 1H раствором соляной кислоты (2 мл), водой (10 мл) и насыщенным солевым раствором (10 мл) соответственно. Органический слой сушат безводным сульфатом натрия и концентрируют. Остаток пропускают через колонку с силикагелем для получения белого целевого продукта (175 мг, выход: 74%). 1H ЯМР (CDCl3) δ: 9,49 (1H, br), 8,33 (1H, d), 7,89 (1H, dd), 6,97 (1H, d), 6,92 (1H, d), 5,11 (1H, m), 4,51 (1H, dd), 4,39 (1H, dd), 4,08 (2H, t), 2,60 (2H, q), 2,55 (2H, q), 2,12 (3H, s), 2,06 (3H, s), 1,92 (2H, m), 1,23 (3H, t), 1,12 (3H, t), 1,09 (3H, t)
Пример 195
5,6-Диэтил-2-(5-(этиламино)-2-н-пропоксифенил)пиримид-4(3H)-он
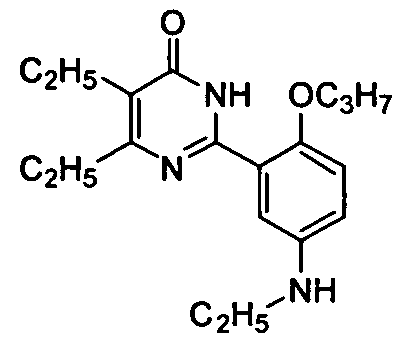
Соединение (2,2 г, 7,3 ммоль) примера 42 растворяют в 50 мл 80% водного раствора ацетонитрила и добавляют 0,14 г 5% Pd/C и 5 г формиата аммония с последующим перемешиванием при комнатной температуре в течение 20 ч под атмосферой азота. Реакционную смесь отфильтровывают от Pd/C и отгоняют растворитель. Остаток растворяют в CH2Cl2 (50 мл), промывают водой (50 мл) и насыщенным солевым раствором (50 мл), сушат безводным Na2SO4 и концентрируют досуха для получения белого твердого сырья, которое пропускают через колонку с силикагелем (элюент: 10% этилацетат-петролейный эфир) для получения целевого продукта (1,9 г, выход: 79%). 1H ЯМР (CDCl3) δ: 8,38 (1H, d), 7,33 (1H, dd), 7,04 (1H, d), 4,19 (2H, t), 4,04 (2H, q), 2,66 (2H, q), 2,59 (2H, q), 2,01 (2H, m), 1,28 (3H, t), 1,19 (3H, t), 1,15 (3H, t), 1,06 (3H, t).
Примеры 196-197
Соединения примеров 196 и 197 получают реакцией соединения примера 195 с пропионилхлоридом и этилоксалилмонохлоридом соответственно способом, описанным в примере 50:
|
|
Примеры 198
1,3-Диэтил-1-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)-мочевина
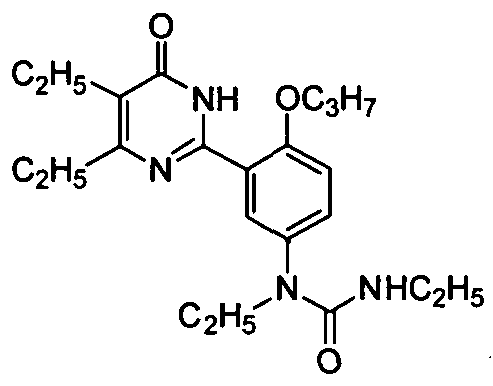
Соединение (0,33 г, 1 ммоль) примера 195 растворяют в этаноле (10 мл) и добавляют этилизоцианат (0,8 г, 1,1 ммоль). После дефлегмации в течение 1 ч реакционную смесь концентрируют досуха. Полученное твердое вещество перекристаллизовывают из этилацетата-петролейного эфира для получения целевого соединения (0,32 г, выход: 80%). 1H ЯМР (DMSO-d6) δ: 11,81 (1H, br), 7,58 (1H, d), 7,30 (1H, dd), 7,19 (1H, d), 5,65 (1H, t), 4,07 (2H, t), 3,55 (2H, q), 3,00 (2H, m), 2,56 (2H, q), 2,46 (2H, q), 1,77 (2H, m), 1,18 (3H, t), 1,04 (3H, t), 0,99 (3H, t), 0,98 (3H, t), 0,95 (3H, t).
Пример 199
N-(3-(4,5-Диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)пиперидин-1-формамид
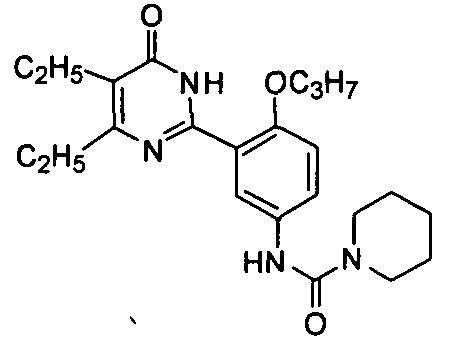
Соединение (1 г, 3,3 ммоль) примера 42 растворяют в дихлорметане (10 мл) и добавляют N,N′-карбонилдиимидазол (589 мг, 3,63 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч. Получают осадок, и TLC показывает, что реакция завершена. Реакционную смесь фильтруют и полученное белое твердое вещество (1 г) добавляют в пиперидин (10 мл) и нагревают при 80°C для перемешивания в течение 5 ч. TLC показывает, что реакция завершена. Реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан. Органический слой промывают водой и насыщенным солевым раствором, сушат безводным сульфатом натрия и концентрируют для получения масляного сырья, которое пропускают через колонку для получения целевого соединения (300 мг, выход: 22%). 1H ЯМР (CDCl3) δ: 8,08 (1H, d), 7,80 (1H, dd), 6,98 (1H, d), 6,49 (1H, br), 4,12 (2H, t), 3,46 (4H, t), 2,66 (2H, q), 2,58 (2H, q), 1,96 (2H, m), 1,64 (6H, m), 1,29 (3H, t), 1,14 (3H, t), 1,12 (3H, t).
Примеры 200-203
Согласно способу, описанному в примере 199, соединение примера 42 сначала подвергают реакции с N,N′-карбонилдиимидазолом для получения промежуточного соединения, которое затем подвергают реакции с N-метилпиперазином, н-пропиламином, циклогексиламином и диэтиламином соответственно для получения соединений примеров 200-203:
|
|
Пример 204
1-(2-Этил(диэтиламино))-3-(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксифенил)малеатмочевина
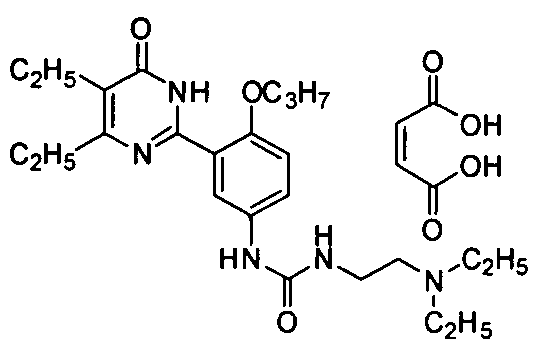
Соединение (1 г, 3,3 ммоль) примера 42 растворяют в дихлорметане (10 мл) и добавляют N,N′-карбонилдиимидазол (589 мг, 3,63 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч для получения твердого вещества. TLC показывает, что реакция завершена. Реакционную смесь фильтруют, полученное белое твердое вещество (1 г) добавляют в N,N′-диэтилэтилендиамин (10 мл) и нагревают до 80°C для перемешивания в течение 5 ч. TLC показывает, что реакция завершена. Реакционную смесь охлаждают до комнатной температуры и добавляют дихлорметан. Органический слой промывают водой и насыщенным солевым раствором, сушат безводным сульфатом натрия и концентрируют для получения масляного сырья, которое пропускают через колонку для получения целевого соединения (300 мг) в щелочной форме. Соединение растворяют в ацетоне (3 мл), добавляют малеиновую кислоту (79 мг, 0,677 ммоль) и перемешивают в течение 10 ч для получения твердого вещества, которое фильтруют и сушат для получения целевого соединения (300 мг, выход: 16%). 1H ЯМР (DMSO-d6) δ: 7,84 (1H, d), 7,56 (1H, dd), 7,09 (1H, d), 6,04 (2H, s), 4,01 (2H, t), 3,42 (2H, t), 3,17 (6H, m), 2,56 (2H, q), 2,45 (2H, q), 1,74 (2H, m), 1,20 (6H, t), 1,18 (3H, t), 1,03 (3H, t), 0,97 (3H, t).
Пример 205
(4-Метилпиперазин-1-ил)(3-(4,5-диэтил-1,6-дигидро-6-оксопиримидин-2-ил)-4-н-пропоксибензофенон
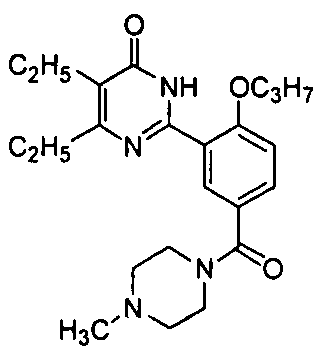
Согласно способу, описанному в примере 89, соединение примера 58 сначала подвергают реакции с тионилхлоридом и полученный продукт подвергают реакции с N-метилпиперазином для получения целевого соединения. 1H ЯМР (CDCl3) δ: 11,08 (1H, br), 8,58 (1H, d), 7,57 (1H, dd), 7,06 (1H, d), 4,19 (2H, t), 3,68 (4H, br), 2,65 (2H, q), 2,58 (2H, q), 2,45 (4H, br), 2,33 (3H, s), 2,00 (2H, m), 1,28 (3H, t), 1,14 (6H, t).
Пример 206
5-Иод-6-изопропил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он
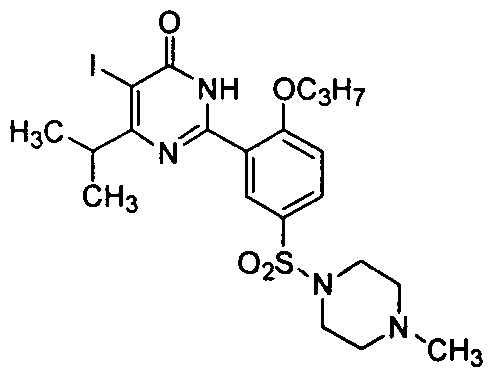
Соединение (1,69 г, 3,9 ммоль) примера 1 добавляют в метанол (15 мл) и добавляют нитрат серебра (0,66 г, 3,9 моль) и затем кристаллический I2 (0,98 г, 3,9 ммоль) при перемешивании. Реакционную смесь перемешивают при комнатной температуре в течение 0,5 ч и TLC показывает, что реакция завершена. Реакционную смесь фильтруют и фильтрат концентрируют. Концентрат промывают водой, экстрагируют дихлорметаном. Органический слой промывают насыщенным солевым раствором, сушат безводным сульфатом натрия и концентрируют. Остаток перекристаллизовывают из этилацетата для получения желтоватого твердого вещества (1,52 г, выход: 70%). 1H ЯМР (CDCl3) δ: 8,90 (1H, d), 7,89 (1H, dd), 7,16 (1H, d), 4,27 (2H, t), 3,46 (1H, m), 3,08 (4H, t), 2,49 (4H, t), 2,27 (3H, s), 2,03 (2H, m), 1,25 (6H, d), 1,16 (3H, t).
Пример 207
5-Хлор-6-этил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он
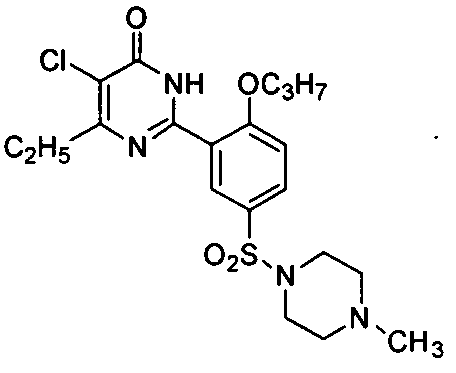
Соединение (0,42 г, 1 ммоль) примера 6 растворяют в CH2Cl2 (20 мл), добавляют пиридин (0,3 мл) и подают газообразный хлор в течение приблизительно 2 минут в ванне со льдом. Реакционную смесь промывают 1M раствором Na2S2O3 (20 мл), 1M раствором HCl (20 мл) и насыщенным солевым раствором (40 мл), соответственно. Органическую фазу сушат безводным сульфатом натрия и концентрируют досуха при пониженном давлении. Остаток перекристаллизовывают из ацетонитрила-этилового эфира для получения целевого соединения (0,41 г, выход: 90%). 1H ЯМР (CDCl3) δ: 11,25 (1H, br), 8,85 (1H, d), 7,87 (1H, dd), 7,16 (1H, d), 4,27 (2H, t), 3,08 (4H, t), 2,85 (2H, q), 2,49 (4H, t), 2,27 (3H, s), 2,03 (2H, m), 1,29 (3H, t), 1,15 (3H, t).
Пример 208
5,6-Диэтил-2-(2-н-пропокси-5-((тетрагидро-2,4,5-тригидрокси-6-(гидроксиметил)-2H-пиран-3-иламино)сульфонил)фенил)пиримид-4(3H)-он
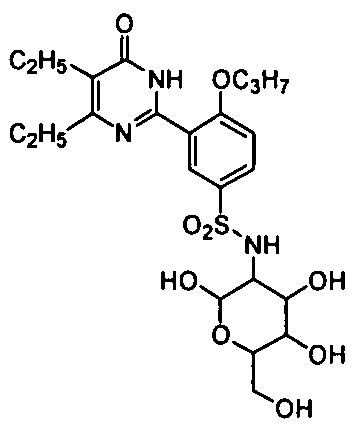
Согласно способу, описанному в примере 10, соединение примера приготовления 33 вначале хлорсульфируют и затем подвергают реакции с аминоглюкозой для получения соединения примера 208. 1H ЯМР (CDCl3) 11,02 (1H, s), 8,52 (1H, s), 7,96 (1H, d), 7,12 (1H, d), 4,06 (2H, t), 3,52-3,84 (5H, m), 3,35 (1H, m), 3,15 (1H, m), 2,52 (2H, q), 2,49 (2H, q), 1,80 (2H, m), 1,24 (3H, t), 1,06 (3H, t), 0,84 (3H, t).
Пример 209
Согласно способу, описанному в примере 89, соединение примера 58 сначала подвергают реакции с тионилхлоридом и полученный продукт подвергают реакции с цитруллином, орнитином и аминосахаром соответственно для получения соединений примеров 209-211:
|
Пример 212-214
Согласно способу, описанному в примере 89, соединение примера 170 сначала подвергают реакции с тионилхлоридом и полученный продукт подвергают реакции с аммиаком, N-метилпиперазином и диэтиламином соответственно для получения соединений примеров 212-214:
|
Пример 215-217
Согласно способу, описанному в примере 89, соединение примера 169 сначала подвергают реакции с тионилхлоридом и полученный продукт подвергают реакции с аммиаком, N-метилпиперазином и диэтиламином соответственно для получения соединений примеров 215-217:
|
Пример 218
5,6-Диэтил-2-(5-(тетрагидро-3,4,5-тригидрокси-6-(гидроксиметил)-2Н-пиран-2-ил)-2-н-пропоксифенил)пиримид-4(3H)-он
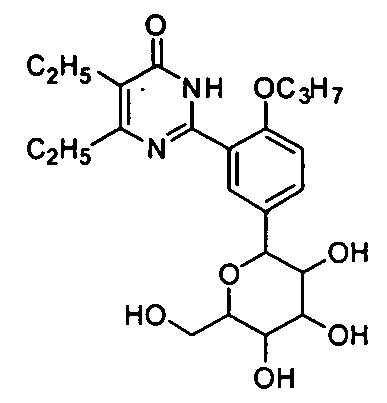
Соединение (728 мг, 2 ммоль) примера приготовления 34 растворяют в тетрагидрофуране (4 мл) и добавляют медленно 1,6 моль/л раствора н-BuLi (2,8 мл, 4,4 ммоль) в н-гексане при -78°C, контролируя снижение скорости для поддержания температуры ниже -70°C. По истечении 40 мин медленно по каплям в реакционную систему добавляют глюконолактон, защищенный триметилсиланом и растворенный в 4 мл толуола. Температуру реакции поддерживают ниже -70°C в течение 1 ч и затем поднимают до -40°C, чтобы перемешать в течение 30 мин. Затем в реакционную систему медленно по каплям добавляют метанольный раствор (4 мл) метансульфоновой кислоты (0,38 мл, 6,0 ммоль). После добавления температуру реакционной смеси также медленно поднимают до комнатной температуры и перемешивают в течение 8 ч, добавляют насыщенный бикарбонат натрия для доведения значения pH до 8 и экстрагируют этилацетатом. Органическую фазу промывают насыщенным солевым раствором, сушат безводным сульфатом натрия и концентрируют досуха для получения желтого масла, которое пропускают через колонку с силикагелем (петролейный эфир : этилацетат = 1:4) для получения промежуточного соединения (380 мг). Промежуточное соединение (380 мг, 0,8 ммоль) растворяют в 5 мл ацетонитрила и добавляют триэтилсилан (0,4 мл, 2,3 ммоль) и борон трифтордиэтиловый эфир (0,1 мл, 1,6 ммоль) в ванне со льдом с последующим перемешиванием в ванне со льдом в течение 40 мин. Перемешивание продолжают при комнатной температуре в течение следующих 3 ч, и TLC показывает, что реакция завершена. Реакционную смесь доводят до pН 7 насыщенным раствор бикарбоната натрия и экстрагируют этилацетатом. Органическую фаза промывают насыщенным солевым раствором, сушат безводным сульфатом натрия и концентрируют досуха. Остаток перекристаллизовывают из этилацетата-этанола для получения целевого соединения (300 мг, выход: 34%). 1H ЯМР (CDCl3) 8,60 (1H, s), 7,72 (1H, s), 7,53 (1H, d), 7,02 (1H, d), 4,03 (2H, t), 3,85 (3H, m), 3,66 (2H, m), 3,55 (1H, m), 3,23 (1H, d), 2,74 (2H, q), 2,58 (2H, q), 1,54 (2H, m), 1,24 (3H, t), 1,10 (3H, t), 1,05 (3H, t).
Пример 219
5-Иод-6-этил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он
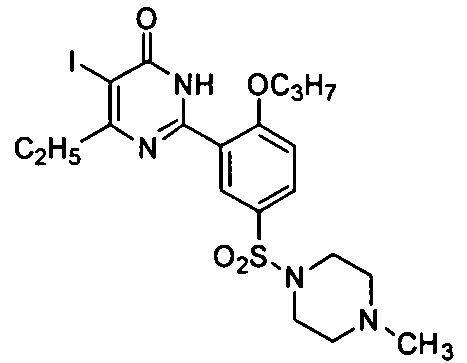
Соединение примера 219 получают реакцией соединения примера 6 с I2 способом, описанным в примере 206. 1H ЯМР (CDCl3) 11,12 (1H, br), 8,88 (1H, d), 7,88 (1H, dd), 7,16 (1H, d), 4,27 (2H, t), 3,10 (4H, t), 2,92 (2H, q), 2,52 (4H, t), 2,30 (3H, s), 2,03 (2H, m), 1,28 (3H, t), 1,16 (3H, t).
Пример 220
5-Бром-6-этил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]пиримид-4(3H)-он
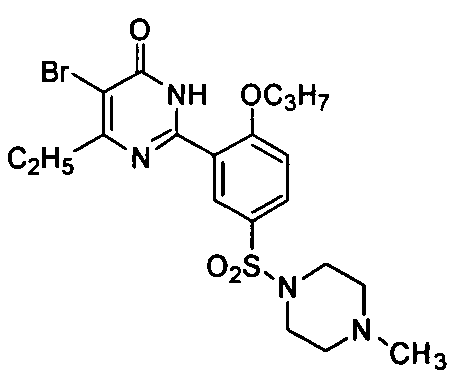
Соединение примера 220 получают реакцией соединения примера 6 с жидким бромом способом, описанным в примере приготовления 19. 1H ЯМР (CDCl3) 11,20 (1H, br), 8,86 (1H, d), 7,88 (1H, dd), 7,16 (1H, d), 4,27 (2H, t), 3,09 (4H, t), 2,88 (2H, q), 2,50 (4H, t), 2,28 (3H, s), 2,03 (2H, m), 1,29 (3H, t), 1,15 (3H, t).
Пример 221
5-Хлор-6-изопропил-2-[2-н-пропокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-пиримид-4(3H)-он
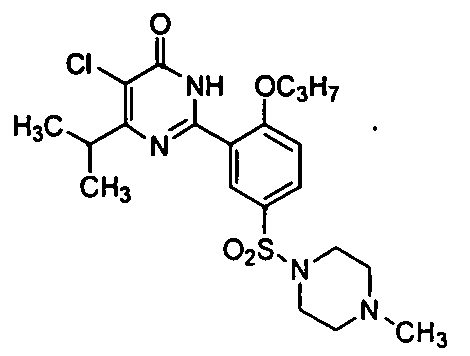
Соединение примера 221 получают реакцией соединения примера 1 с газообразным хлором способом, описанным в примере 207. 1H ЯМР (CDCl3) 8,86 (1H, d), 7,88 (1H, dd), 7,16 (1H, d), 4,27 (2H, t), 3,49 (1H, m), 3,09 (4H, t), 2,50 (4H, t), 2,27 (3H, s), 2,03 (2H, m), 1,26 (6H, d), 1,16 (3H, t).
Пример 222 Капсулы
|
Упомянутое соединение фенилпиримидона и вспомогательные средства, т.е. крахмал, лактозу и микрокристаллическую целлюлозу, отбирают на ситах с размером отверстий 80 меш, взвешивают согласно указанному составу, гранулируют в подходящие гранулы по размеру отверстий сит 16 меш при помощи 10% этанольного раствора поливинилпирролидона в качестве склеивающего вещества, сушат при 65°C, отбирают с сит с размером отверстий 14 меш и добавляют стеарат магния для однородного смешивания. Затем содержание гранул измеряют и рассчитывают количество загрузки. Требуемое количество гранул помещают в капсулы, таким образом получая конечный продукт.
Пример 223 Таблетки (мокрая грануляция)
|
Упомянутое соединение фенилпиримидона, микрокристаллическую целлюлозу, лактозу и натрий карбоксиметил крахмал отбирают на ситах с размером отверстий 80 меш, смешивают однородно, готовят влажную массу с 8% крахмальным клейстером, гранулируют по размеру отверстий сит 16 меш, сушат, измеряют на ситах с размером отверстий 14 меш и добавляют стеарат магния для однородного смешивания. Затем содержание гранул измеряют, и вес таблетки рассчитывают. Выполняют изготовление таблеток для получения конечного продукта.
Пример 224 Таблетки (прессованный порошок)
|
Упомянутое соединение фенилпиримидона, микрокристаллическую целлюлозу, безводную лактозу, поливинилпирролидон и силикагель смешивают однородно в смесителе и затем добавляют стеарат магния для однородного смешивания. Выполняют изготовление таблеток для получения конечного продукта.
Измерение активности соединений
Результаты теста на ингибирование активности ферментов
Фермент, используемый для теста на ингибирование активности ферментов, получают подходящей обработкой различных тканей и отделением ферментом при помощи интенсивной протеиновой жидкостной хроматографии (FPLC) согласно методике, описанной в литературе (Thrombosis Res. 1991, 62, 31 and J. Biol. Chem. 1997, 272, 2714). В частности, PDE5 и PDE3 получают из человеческих тромбоцитов, a PDE6 выделяют из бычьей сетчатки. Тест на ингибирование активности ферментов выполняют сразу после выделения ферментом. Упомянутый тест на ингибирование активности ферментов выполняют обнаружением сцинтилляционным счетчиком непосредственно сходства AMP/GMP, используя набор TRKQ7100 и TRKQ7090, которое выполняется следующим образом. В присутствии различных концентраций ингибитора и небольших количеств субстрата добавляют 10 мкл буфера (50 мМ Tris/HCl pH 7,5, 8,3 мМ MgCl2, 1,7 мМ EGTA) и затем добавляют воду до конечного объема 100 мкл. Реакция инициируется фиксированным количеством фермента, выращенного при 30°C в течение 30 минут, и затем блокируют 50 мкл гранулами силиката иттрия, включающего сульфат цинка. После взбалтывания в течение 20 минут реакционную смесь ставят в темное место и оставляют на 30 минут и затем считывают на универсальном сцинтилляционном счетчике BECKMAN LS6500. В конце на основе результатов считывания рассчитывают степень ингибирования 50% (IC50) фермента соединения согласно настоящему изобретению.
Результаты теста по ингибированию активности PDE5
Согласно вышеупомянутой методике измеряют ингибирование активности для человеческого тромбоцита PDE5 некоторых соединений формулы I согласно настоящему изобретению, результаты измерений приведены в следующей таблице:
|
|
По данным ингибирования активности (IC50) PDE5 соединениями в вышеупомянутой таблице, можно заметить, что соединения формулы I согласно настоящему изобретению обладают свойством ингибирования активности PDE5. Более важно, что большинство соединений в вышеупомянутой таблице показывает более сильное ингибирование активности PDE5 по сравнению с сильденафилом и поэтому имеют меньшую перроральную дозу по сравнению с сильденафилом и сниженную вероятность возникновения побочных эффектов.
Результаты теста ингибирования активности PDE6
Принимая во внимание, что соединения согласно настоящему изобретению могут обладать свойством ингибирования активности PDE6, распределенного в сетчатке, что вызывает зрительные нарушения, измеряют активность ингибирования в отношении PDE6 в бычьей сетчатке некоторых соединений формулы I согласно настоящему изобретению, результаты измерений показаны в следующей таблице:
|
Селективность в отношении PDE6 и PDE5 соединений согласно настоящему изобретению определяется как отношение IC50 PDE6/IC50 PDE5. Можно заметить по вышеупомянутым результатам, что соединения формулы I согласно настоящему изобретению обладают превосходной селективностью в отношении PDE5, в частности большинство соединений, полученных в примерах, имеют более высокую селективность по сравнению с сильденафилом. Соответственно, соединения согласно настоящему применению обладают низкой вероятностью порождения зрительных нарушений по сравнению с сильденафилом.