Результат интеллектуальной деятельности: ФТОРЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИНОСОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к области медицинской химии и фармакотерапевтическим средствам, в частности к классу фторзамещенных циклических аминосоединений, их получению, фармацевтическим композициям, содержащим такие соединения, и их применению в качестве ингибитора ацетилхолинэстеразы, в частности для приготовления лекарственных средств для лечения болезни Альцгеймера, болезни Паркинсона, эпилепсии или шизофрении.
Предшествующий уровень техники
С быстрым старением общества состоянию здоровья пожилых людей уделяется все больше внимания. Среди многочисленных заболеваний, которые угрожают здоровью пожилых людей, болезнь Альцгеймера (AD), также известная как старческая деменция, представляет собой наиболее частую причину слабоумия в пожилом возрасте. AD представляет собой прогрессирующее смертельное нейродегенеративное заболевание, клинические проявления которого представляют собой ухудшение познавательных функций и функций памяти, прогрессирующее снижение активности в повседневной жизни и множество психоневрологических симптомов и поведенческих расстройств. Частота AD в пожилом возрасте является очень высокой: почти 50% людей, страдающих от деменции, страдают от болезни Альцгеймера. У пациентов в возрасте свыше 85 лет доля увеличивается до 70%. Среди причин смерти у пожилых людей AD занимает 4-е место и уступает сердечно-сосудистым заболеваниям, раку и кровоизлиянию в мозг. Таким образом, исследование лекарственных средств для лечения AD стало одной из горячих точек для разработки новых лекарств.
В отчетах компании IMS Health (ims health) продемонстрировано, что, среди 500 лучших наиболее продаваемых лекарств на семи крупнейших фармацевтических рынках в мире, рынок лекарств против старческой деменции достиг 6,41 миллиардов $ в 2007 году, превышая на 24,18% значение для предыдущего года. В 2008 году рынок лекарств против старческой деменции продемонстрировал увеличение на 12,49% по сравнению с предыдущим годом и размер рынка достиг 7,211 миллиардов $. Средний ежегодный темп роста за последние три года составил приблизительно 23% и намного превысил средний ежегодный рост глобального фармацевтического рынка, составляющий 5%-6%. "World Alzheimer Report 2010" ("Мировой отчет по болезни Альцгеймера 2010 года") продемонстрировал, что общая стоимость для лечения деменции достигла 604 миллиардов $.
Таким образом, рынок лекарств против старческой деменции обладает значительным потенциалом. Тем не менее, "World Alzheimer Report 2011", опубликованный в 2012 году, продемонстрировал, что приблизительно 36 миллионов человек страдают от деменции, при этом у трех четвертей пациентов диагноз не был установлен и они не смогли получить соответствующее лечение и уход. В странах с высоким уровнем доходов только 20-50% случаев деменции получают первую помощь, в то время как в странах со средним уровнем дохода, только 10%.
В настоящее время лекарственные средства для лечения старческой деменции представляют собой следующие: (1) ингибиторы холинэстеразы: такие как такрин, донепезил, гуперзин A, галантамин и т.д., основная причина болезни Альцгеймера представляет собой недостаток холина, таким образом, приводя в результате у пациентов к гипомнезии, дезориентации, поведенческим изменениям и изменениям индивидуальности и т.п. Таким образом, лекарственные средства, усиливающие холинергический эффект, играют важную роль в лечении старческой деменции. (2) кальциевые антагонисты: такие как нимодипин, флунаризин хлоргидрат и т.п. (3) мозговые регуляторы метаболизма: такие как ницерголин, алмитрин, пирацетам и т.п. (4) нейропротективные агенты: такие как церебролизин. Среди клинических лекарств, для лечения старческой деменции ингибиторы ацетилхолинэстеразы (AChEI) с точной эффективностью широко используются в клиническом лечении.
Холинэстераза представляет собой ключевой фермент в биологической нервной проводимости. В соответствии со специфичностью к катализируемым субстратам холинэстеразу разделяют на ацетилхолинэстеразу (AChE) и бутирилхолинэстеразу. Ацетилхолинэстераза может катализировать реакцию декомпозиции ацетилхолина, таким образом, приводя в результате к утрате ацетилхолина и невозможности нервной проводимости сигнала и далее приводя к снижению когнитивной функции у пациентов и потере памяти, и клиническим проявлениям симптомов старческой деменции. Ингибиторы ацетилхолинэстераз могут ингибировать активность AChE, замедлить скорость гидролиза ацетилхолина, улучшить уровень ацетилхолина в синаптической щели и обеспечить нормальную проводимость нервных сигналов, таким образом, выполняя терапевтическое действие в отношении старческой деменции.
Донепезил хлоргидрат (Е2020), раскрытый в EP 0296560 A2, представляет собой второе поколение ингибитора ацетилхолинэстеразы, эффект лечения которым заключается в обратимом ингибировании гидролиза ацетилхолина, вызванного ацетилхолинэстеразой (AChE), таким образом увеличивая содержание ацетилхолина в области рецептора. Е2020, который был вторым лекарством, одобренным американским FDA (Управление по контролю за продуктами питания и лекарственными средствами США) для лечения слабой или умеренной деменции, был разработан Eisai и Pfizer Limited и поступил на рынок Соединенных Штатов Америки в 1997 году. Е2020, который был одобрен для продажи на рынке более чем 50 стран и областей, включающих Китай, представляет собой относительно безопасное и эффективное лекарство для лечения старческой деменции и предпочтительное лекарство для лечения слабой и умеренной старческой деменции. Избирательная аффинность донепезил хлоргидрата в отношении ацетилхолинэстеразы в 1250 раз сильнее, чем в отношении бутирилхолинэстеразы. Донепезил хлоргидрат может очевидно ингибировать холинэстеразу в головном мозге, в то время как бутирилхолинэстераза, главным образом, существует за пределами центральной нервной системы. Таким образом, E2020 не оказывает никакого действия на периферийное сердце (миокард) или тонкий кишечник (гладкая мускулатура) и обладает незначительными побочными действиями. По сравнению с такрином Е2020 обладает более хорошими действиями, более высокой избирательностью и меньшей токсичностью для центральной нервной системы. Таким образом, Е2020 стал лекарством первого выбора для лечения старческой деменции в клинической практике, и глобальные продажи в 2010 году достигли 3,4 миллиарда $.
Тем не менее, все еще существует большой разрыв между общей скоростью разработки и исследований лекарств против AD, и рыночным спросом, и существует несколько лекарственных средств с подтвержденной эффективностью. Лекарства на рынке могут не удовлетворять потребностям пациентов. Таким образом, необходимо, чтобы больше ингибиторов ацетилхолинэстераз удовлетворяли рыночному спросу.
Краткое изложение сущности изобретения
Одна из задач изобретения заключается в том, чтобы предложить фторзамещенное циклическое аминосоединение общей формулы I, его фармацевтически приемлемую соль, рацемат, R-изомер, S-изомер или их смесь.
Еще одна задача изобретения заключается в том, чтобы предложить способ получения вышеуказанного фторзамещенного циклического аминосоединения общей формулы I.
Еще одна задача изобретения заключается в том, чтобы предложить фармацевтическую композицию, включающую терапевтически эффективное количество одного или более чем одного соединения, выбранного из вышеуказанных фторзамещенных циклических аминосоединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей.
Еще одна задача изобретения заключается в том, чтобы предложить ингибитор ацетилхолинэстеразы, включающий одно или более чем одно соединение, выбранное из вышеуказанных фторзамещенных циклических аминосоединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей.
Еще одна задача изобретения заключается в том, чтобы предложить применение вышеуказанных фторзамещенных циклических аминосоединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей для приготовления лекарственных средств для лечения связанных с ацетилхолинэстеразой заболеваний нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, шизофрения и т.п.
Еще одна задача изобретения заключается в том, чтобы предложить способ лечения связанных с ацетилхолинэстеразой заболеваний нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, шизофрения и т.п., при которых осуществляют введение одного или более чем одного соединения, выбранного из вышеуказанных фторзамещенных циклических аминосоединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей пациенту, нуждающемуся в таком введении.
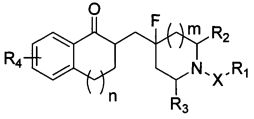
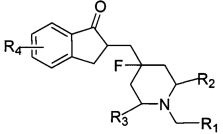
На основе вышеприведенных задач в настоящем изобретении предложено фторзамещенное циклическое аминосоединение общей формулы I, его рацемат, R-изомер, S-изомер и фармацевтически приемлемая соль или их смесь:
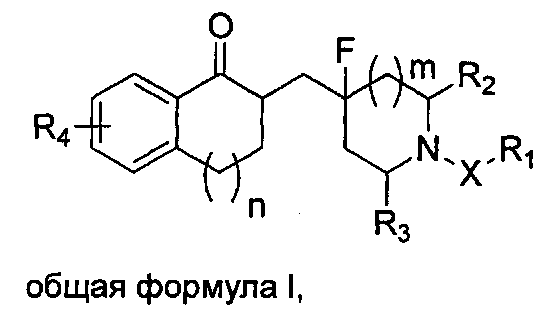
где
m представляет собой целое число от 0 до 3; где m предпочтительно равен 0, 1 или 2.
n представляет собой целое число от 0 до 3; где n предпочтительно равен 0, 1 или 2.
X представляет собой (CH2)p, CO или SO2, где p представляет собой целое число от 0 до 3; X предпочтительно представляет собой (CH2)p или CO, p предпочтительно равен 1 или 2.
R1 представляет собой замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенную или незамещенную 3-12-членную гетероциклическую группу, замещенный или незамещенный С6-С12 арил; заместитель(и) R1 представляет(ют) собой 1, 2, 3, 4 или 5 одинаковых или отличающихся заместителей, независимо выбранных из группы, состоящей из галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, C1-C6 алкоксикарбонила, галогенозамещенной C1-C6 алкокси, C2-C6 алкенила, С2-С6 алкинила, C3-C8 циклоалкила, циано, нитро, амино, гидроксила, гидроксиметила, карбоксила, меркапто, сульфонила, C6-C10 арила и 3-12-членного гетероциклического радикала; или два соседних заместителя С6-С12 арила и атом(ы) углерода соседнего ароматического кольца вместе образуют С3-С7 циклоалкил, С3-С7 циклоалкенил или 3-7-членный гетероциклический радикал; и каждый гетероциклический радикал независимо содержит 1-4 гетероатома, выбранные из O, S или N;
предпочтительно R1 представляет собой замещенный или незамещенный С3-С8 циклоалкил, или замещенный или незамещенный С6-С12 арил; заместитель(и) R1 представляют собой от 1 до 5 одинаковых или отличающихся заместителей, независимо выбранных из группы, состоящей из галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, C1-C6 алкоксикарбонила, галогенозамещенного C1-C6 алкокси, C2-C6 алкенила, C2-C6 алкинила, C3-C8 циклоалкила, циано, нитро, амино, гидроксила, гидроксиметила, карбоксила, меркапто, сульфонила, фенила, нафтила и 3-12-членного гетероциклического радикала; или два соседних заместителя С6-С12 арила и атом(ы) углерода соседнего ароматического кольца вместе образуют С3-С7 циклоалкил, С3-С7 циклоалкенил или 3-7-членный гетероциклический радикал; и гетероциклический радикал содержит от 1 до 3 гетероатомов, выбранные из O, S или N;
более предпочтительно R1 представляет собой C3-C8 циклоалкил, замещенный или незамещенный фенил или замещенный или незамещенный нафтил; заместитель(и) R1 представляют собой от 1 до 5 одинаковых или отличающихся заместителей, независимо выбранных из группы, состоящей из галогена, C1-C6 алкила, C1-C6 алкокси, галогеназамещенного C1-C6 алкокси, C1-C6 алкоксикарбонила, C2-C6 алкенила, C2-C6 алкинила, циано, нитро, амино, гидроксила, гидроксиметила, трифторметила, трифторметокси, карбоксила, меркапто, сульфонила и фенила, или два соседних заместителя фенила и атомы углерода соседнего бензольного кольца вместе образуют 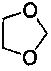 ;
;
наиболее предпочтительно R1 представляет собой циклобутил, циклопентил, циклогексил, циклогептил или замещенный или незамещенный фенил, заместитель(и) замещенного фенила представляют собой от 1 до 5 одинаковых или отличающихся заместителей, независимо выбранных из группы, состоящей из галогена, нитро, циано, трифторметила, трифторэтила, трифторпропила, трифторметокси, метила, этила, пропила, изопропила, бутила, трет-бутила, 2-метилпропила, фенила, метоксикарбонила, этоксикарбонила и пропоксикарбонила, или два соседних заместителя фенила и атомы углерода соседнего бензольного кольца вместе образуют 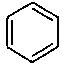 или
или 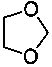 ;
;
каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, карбоксила, С1-С4 алкоксикарбонила и С1-С4 алкила; или R2 и R3 вместе образуют С1-С4 алкилиден;
предпочтительно каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, карбоксила, метоксикарбонила, этоксикарбонила, пропоксикарбонила, метила, этила, пропила, изопропила, бутила и 2-метилпропила; или R2 и R3 вместе образуют метилен, этилен или пропилен;
R4 представляет собой от 1 до 4 одинаковых или отличающихся заместителей, выбранных из группы, состоящей из водорода, галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, C2-C6 алкенила, C2-C6 алкинила, циано, нитро, амино, гидроксила, гидроксиметила, карбоксила, меркапто, сульфонила, -O[(CH2)qO]rR5, фенила и 3-12-членного гетероциклического радикала; где гетероциклический радикал содержит от 1 до 3 гетероатомов, выбранных из O, S или N; R5 выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила и гидроксиметила; причем q равен 1, 2, 3 или 4; r равен 1, 2, 3 или 4;
предпочтительно R4 представляет собой от 1 до 3 одинаковых или отличающихся заместителей, выбранных из группы, состоящей из водорода, галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, C2-C6 алкенила, C2-C6 алкинила, циано, нитро, амино, гидроксила, карбоксила и -O[(CH2)qO]rR5; R5 выбран из группы, состоящей из водорода, галогена, C1-C6 алкила и галогенозамещенного C1-C6 алкила; q равен 1, 2 или 3; и r равен 1, 2 или 3;
более предпочтительно R4 представляет собой от 1 до 2 одинаковых или отличающихся заместителей, выбранных из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, гидроксила и -O[(CH2)qO]rR5; R5 выбран из C1-C6 алкила или галогенозамещенного C1-C6 алкила; q равен 1, 2 или 3; и r равен 1, 2 или 3.
В настоящем изобретении указанный галоген представляет собой F, Cl, Br или I.
Термины, использованные в настоящем изобретении, если не указано иное, имеют общие значения, известные специалистам в данной области техники.
В настоящем изобретении термин "C1-C6 алкил" обозначает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода, включающий без ограничения метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил и т.п., предпочтительно этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил.
В настоящем изобретении термин "C1-C6 алкокси" обозначает линейный или разветвленный алкокси, имеющий от 1 до 6 атомов углерода, включающий без ограничения метокси, этокси, пропокси, изопропокси, бутокси и т.п.
В настоящем изобретении термин "C2-C6 алкенил" обозначает линейный или разветвленный алкенил, имеющий от 2 до 6 атомов углерода, содержащий одну двойную связь, включающий без ограничения этенил, пропенил, бутенил, изобутенил, пентенил, гексенил и т.п.
В настоящем изобретении термин "C2-C6 алкинил" обозначает линейный или разветвленный алкинил, имеющий от 2 до 6 атомов углерода, содержащий одну тройную связь, включающий без ограничения этинил, пропинил, бутинил, изобутинил, пентинил, гексинил и т.п.
В настоящем изобретении термин "C3-C10 циклоалкил" обозначает циклоалкил, имеющий от 3 до 10 атомов углерода в кольце, включающий без ограничения циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил и т.п. Термины "С3-С8 циклоалкил", "С3-С7 циклоалкил" и "C3-C6 циклоалкил" имеют похожие значения.
В настоящем изобретении термин "C3-C10 циклоалкенил" обозначает циклоалкенил, имеющий от 3 до 10 атомов углерода в кольце, включающий без ограничения циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и циклодеценил и т.п. Термин "С3-С7 циклоалкенил" имеет похожее значение.
В настоящем изобретении термин "C6-C12 арил" обозначает ароматическую циклическую группу, имеющую от 6 до 12 атомов углерода без гетероатома в кольце, такую как фенил, нафтил и т.п. Термин "C6-C10 арил" имеет похожее значение.
В настоящем изобретении термин "3-12-членный гетероциклический радикал" обозначает насыщенную или ненасыщенную 3-12-членную циклическую группу, имеющую в кольце от 1 до 3 гетероатомов, выбранных из O, S или N, такую как диоксоциклопентил и т.п. Термин "3-7-членный гетероциклический радикал" имеет похожее значение.
В одном из предпочтительных воплощений вышеприведенные фторзамещенные циклические аминосоединения общей формулы I представляют собой фторзамещенные циклические аминосоединения общей формулы II:
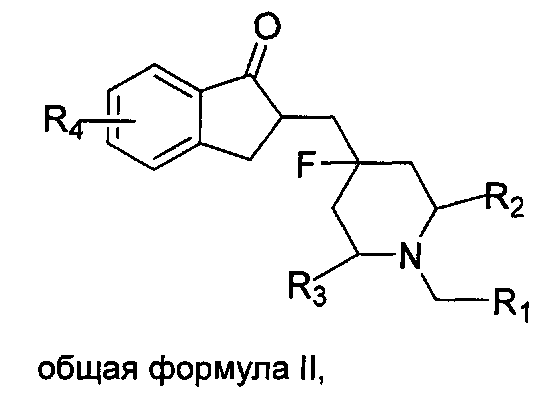
где R1 представляет собой 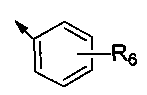 или C3-C10 циклоалкил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из H, галогена, нитро, циано, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, фенила и C1-C6 алкоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют
или C3-C10 циклоалкил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из H, галогена, нитро, циано, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, фенила и C1-C6 алкоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют  или
или  ;
;
предпочтительно R1 представляет собой 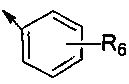 или С3-С7 циклоалкил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из Н, галогена, нитро, циано, C1-C4 алкила, галогенозамещенного C1-C4 алкила, C1-C4 алкокси, галогенозамещенного C1-C4 алкокси, фенила и C1-C4 алкоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют
или С3-С7 циклоалкил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из Н, галогена, нитро, циано, C1-C4 алкила, галогенозамещенного C1-C4 алкила, C1-C4 алкокси, галогенозамещенного C1-C4 алкокси, фенила и C1-C4 алкоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют  или
или  ;
;
более предпочтительно R1 представляет собой 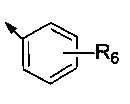 , циклобутил, циклопентил, циклогексил или циклогептил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из Н, галогена, нитро, циано, -F, -Br, трифторметила, трифторэтила, трифторпропила, метила, этила, пропила, изопропила, бутила, 2-метилпропила, фенила, метоксикарбонила, этоксикарбонила и пропоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют
, циклобутил, циклопентил, циклогексил или циклогептил, R6 представляет собой от 1 до 5 заместителей, и заместитель независимо выбран из группы, состоящей из Н, галогена, нитро, циано, -F, -Br, трифторметила, трифторэтила, трифторпропила, метила, этила, пропила, изопропила, бутила, 2-метилпропила, фенила, метоксикарбонила, этоксикарбонила и пропоксикарбонила, или два соседних R6 и атомы углерода соседнего бензольного кольца вместе образуют  или
или  ;
;
каждый из R2 и R3 независимо выбраны из группы, состоящей из водорода, карбоксила, C1-C4 алкоксикарбонила и C1-C4 алкила; или R2 и R3 вместе образуют C1-C4 алкилиден;
предпочтительно каждый из R2 и R3 независимо выбран из группы, состоящей из водорода, карбоксила, метоксикарбонила, этоксикарбонила, пропоксикарбонила, метила, этила, пропила, изопропила, бутила и 2-метилпропила; или R2 и R3 вместе образуют метилен, этилен или пропилен.
R4 представляет собой от 1 до 4 заместителей, и заместитель независимо выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, галогенозамещенного C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, C2-C6 алкенила, C2-C6 алкинила, циано, нитро, амино, гидрокси, карбоксила и -O[(CH2)qO]rR5; где R5 выбран из группы, состоящей из водорода, галогена, C1-C6 алкила и галогенозамещенного C1-C6 алкила; q равен 1, 2 или 3; и r равен 1, 2 или 3;
предпочтительно, R4 представляет собой от 1 до 2 заместителей, и заместитель независимо выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C6 алкокси, галогенозамещенного C1-C6 алкокси, гидроксила и -O[(CH2)qO]rR5; где R5 выбран из C1-C6 алкила или галогенозамещенного C1-C6 алкила; q равен 1, 2 или 3; и r равен 1, 2 или 3.
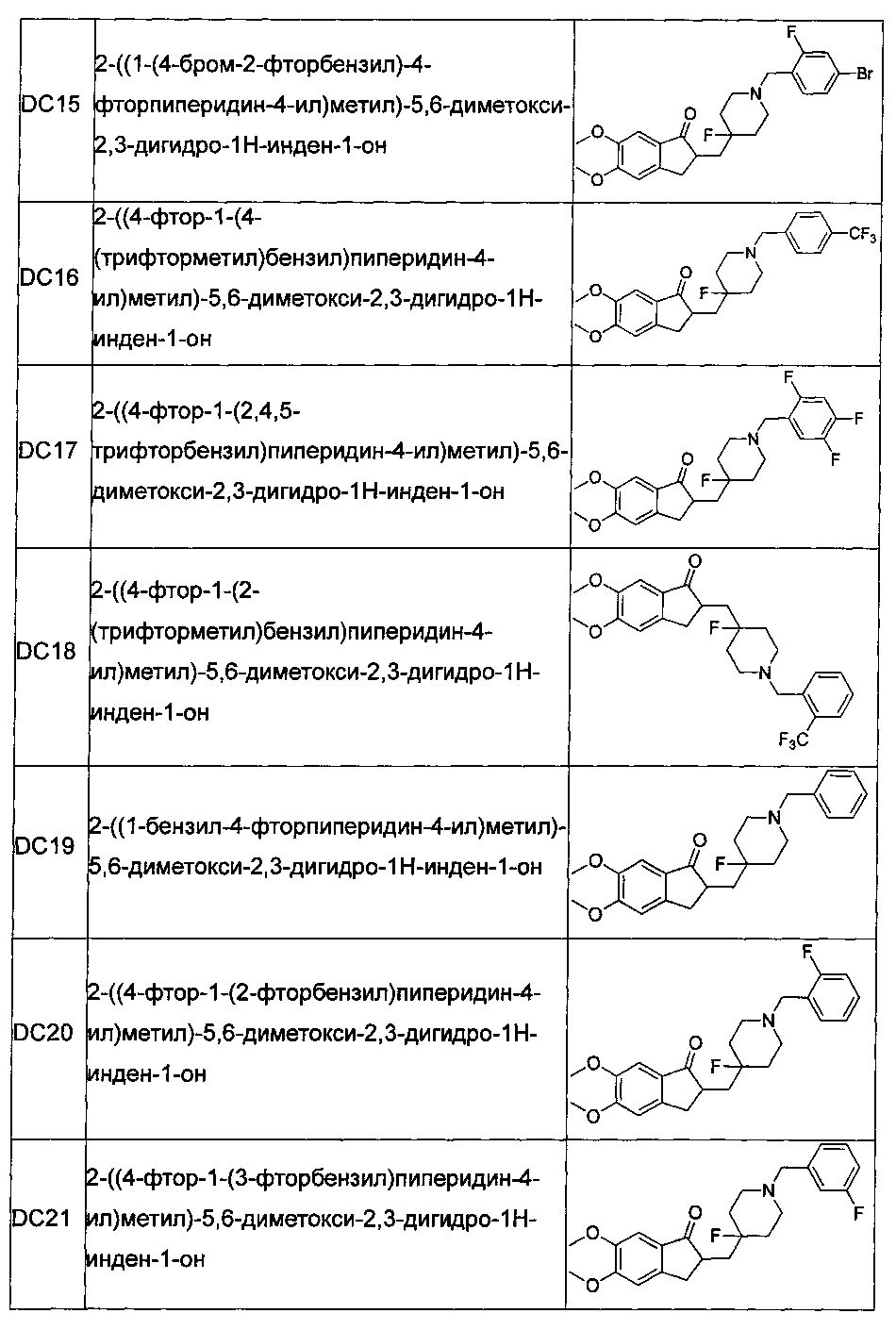
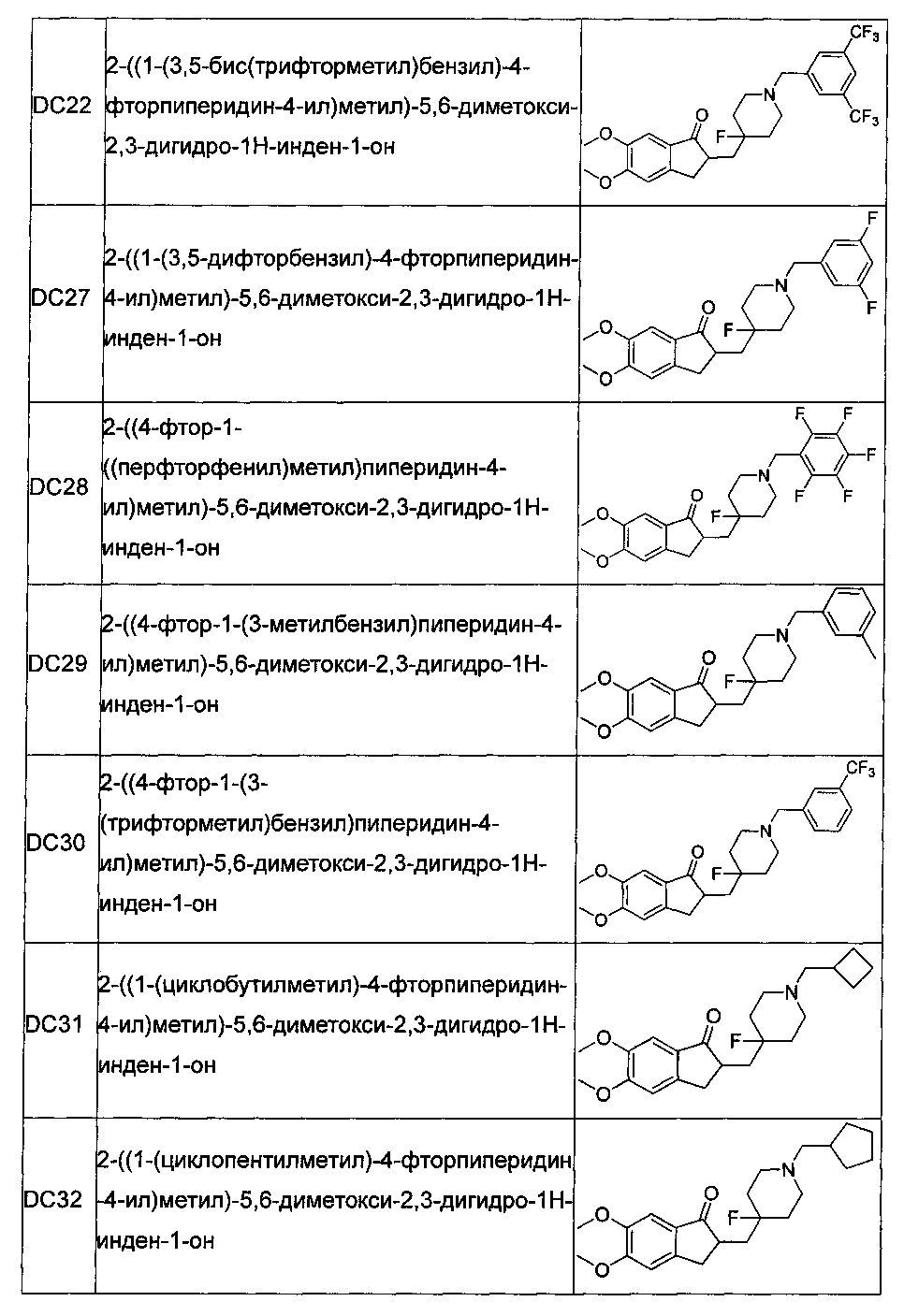
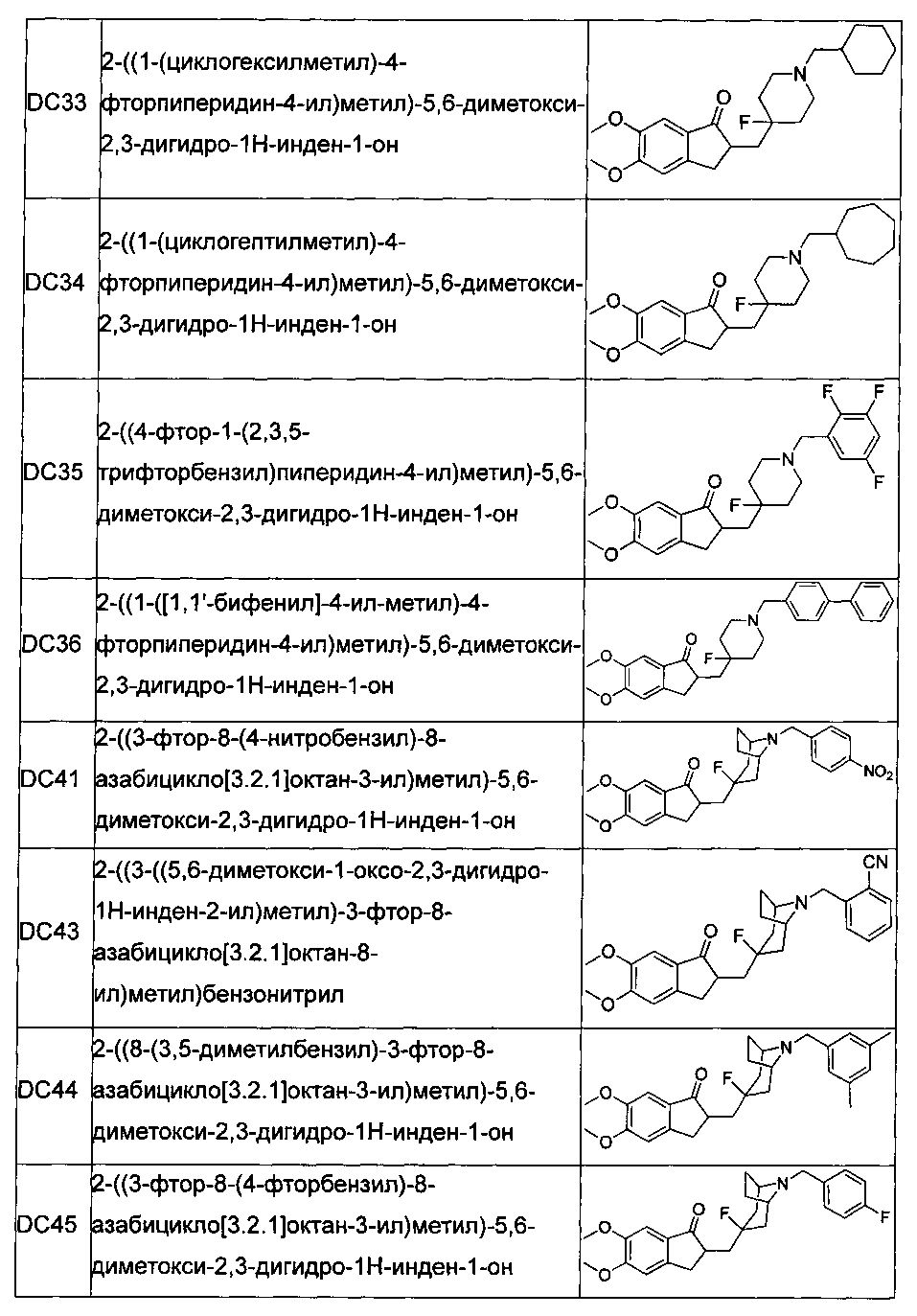
В более предпочтительных воплощениях настоящего изобретения соединения общей формулы I в настоящем изобретении представляют собой следующие конкретные соединения:
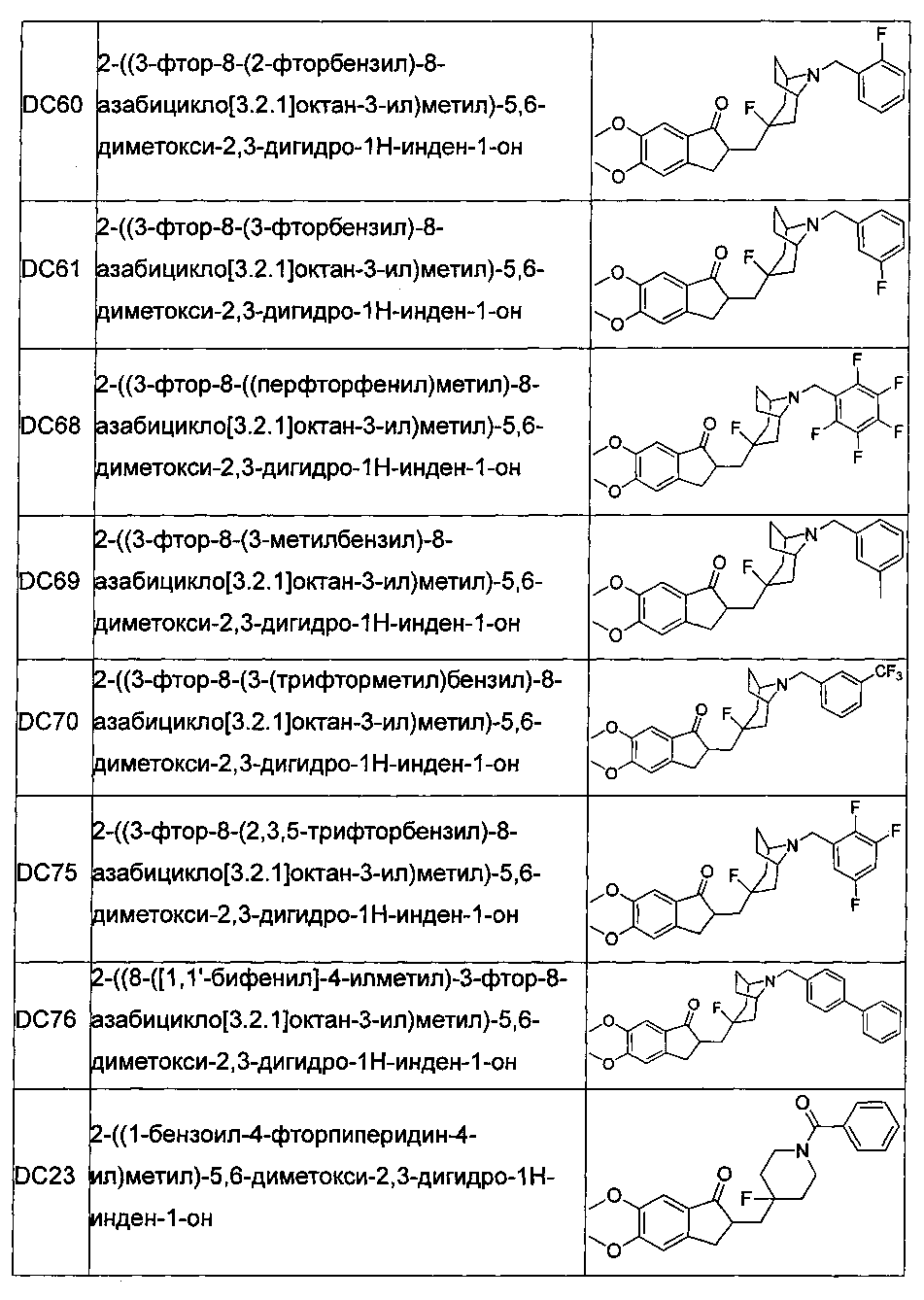
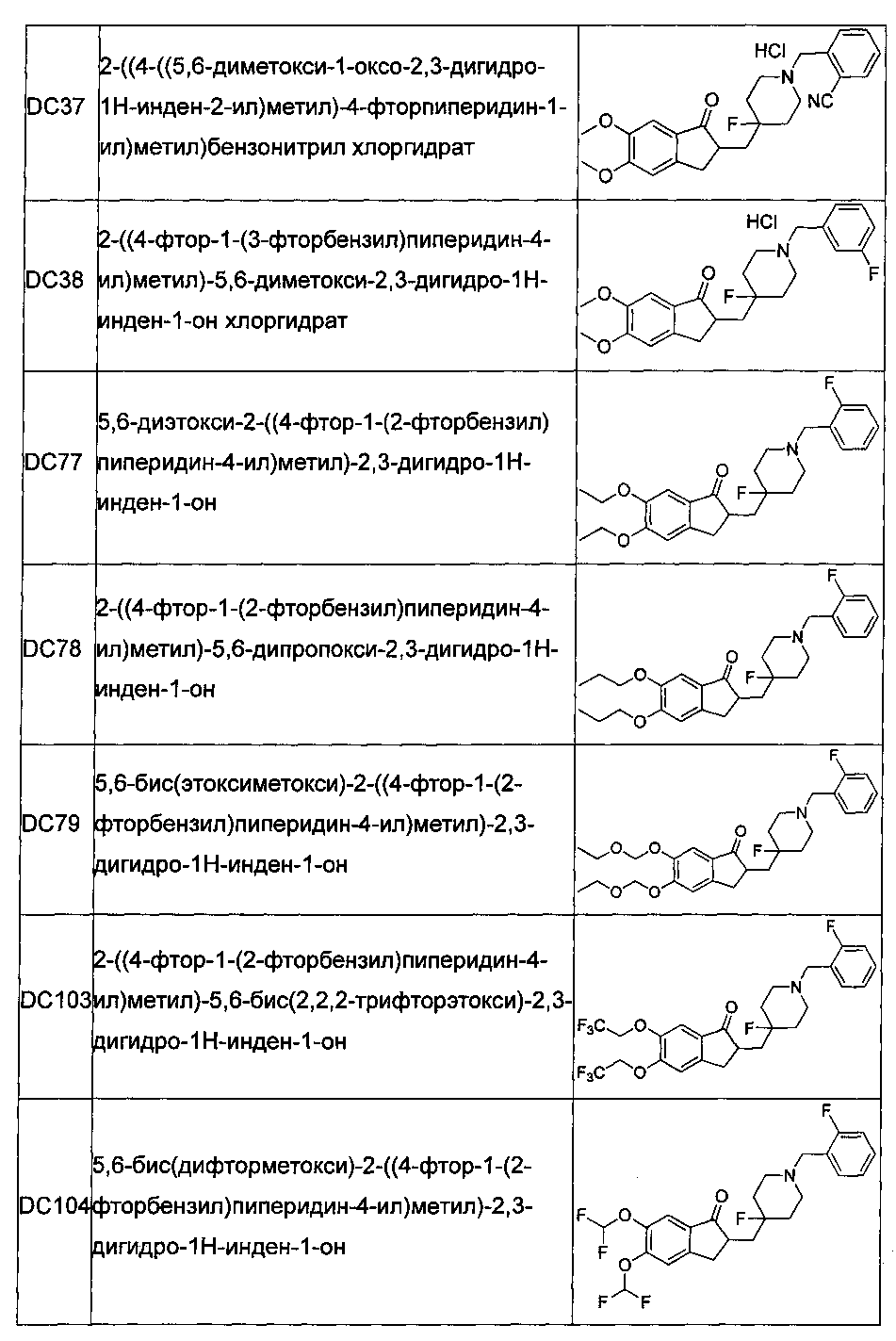
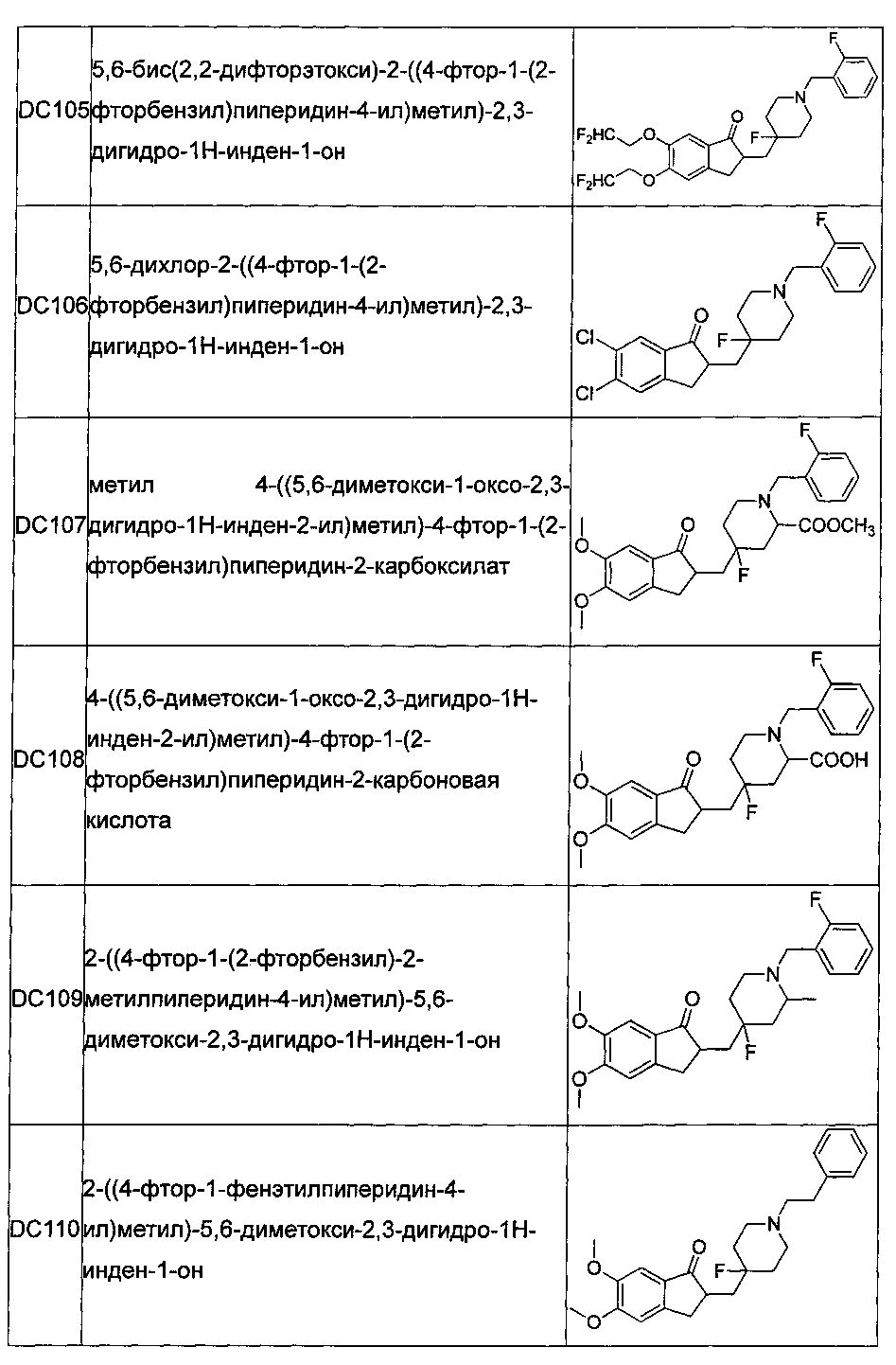
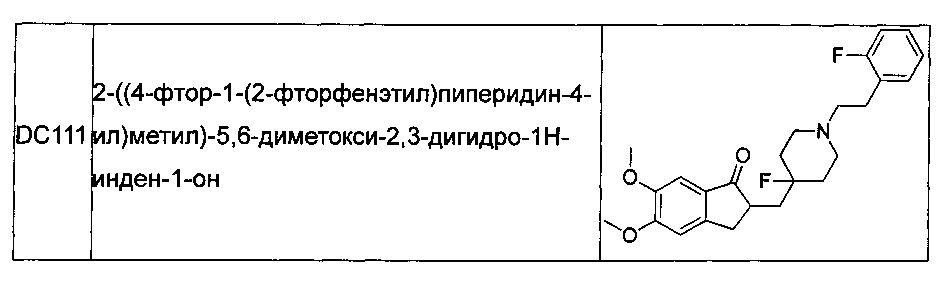
Соединения по настоящему изобретению имеют асимметрический центр, хиральную ось и хиральную плоскость и могут быть представлены в форме рацематов, R-изомеров или S-изомеров. Для специалиста в данной области техники, R-изомер и/или S-изомер могут быть получены из рацемата с использованием обычных технических средств путем расщепления.
В настоящем изобретении предложены фармацевтически приемлемые соли соединений общей формулы I, в частности обычные фармацевтически приемлемые соли получены в результате взаимодействия соединений общей формулы I с неорганической кислотой или органической кислотой. Например, обычные фармацевтически приемлемые соли могут быть получены в результате взаимодействия соединений общей формулы I с неорганической кислотой или органической кислотой, где неорганическая кислота включает соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, аминосульфокислоту, ортофосфорную кислоту и т.п., а органическая кислота включает лимонную кислоту, винную кислоту, молочную кислоту, пировиноградную кислоту, уксусную кислоту, бензолсульфоновую кислоту, пара-толуолсульфоновую кислоту, метансульфоновую кислоту, нафталинсульфоновую кислоту, этансульфоновую кислоту, нафталиндисульфоновую кислоту, малеиновую кислоту, яблочную кислоту, малоновую кислоту, фумаровую кислоту, янтарную кислоту, пропионовую кислоту, щавелевую кислоту, трифторуксусную кислоту, стеариновую кислоту, памовую кислоту, гидроксималеиновую кислоту, фенилуксусную кислоту, бензойную кислоту, салициловую кислоту, глутаминовую кислоту, аскорбиновую кислоту, пара-аминобензолсульфоновую кислоту, 2-ацетоксибензойную кислоту, изетионовую кислоту и т.п.; или натриевые соли, калиевые соли, кальциевые соли, соли алюминия или аммониевые соли в результате взаимодействия соединений общей формулы I с неорганическим основанием; или соли метиламина, соли этиламина или соли этаноламина в результате взаимодействия соединений общей формулы I с органическим основанием.
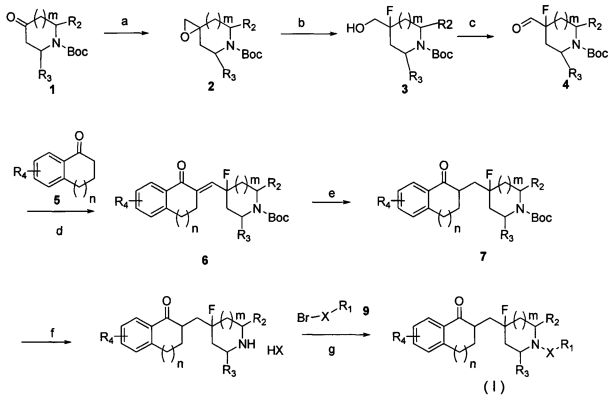
В еще одном аспекте настоящего изобретения предложен способ получения соединений общей формулы I, который осуществляют в соответствии со следующей схемой 1 или схемой 2.
Схема 1:
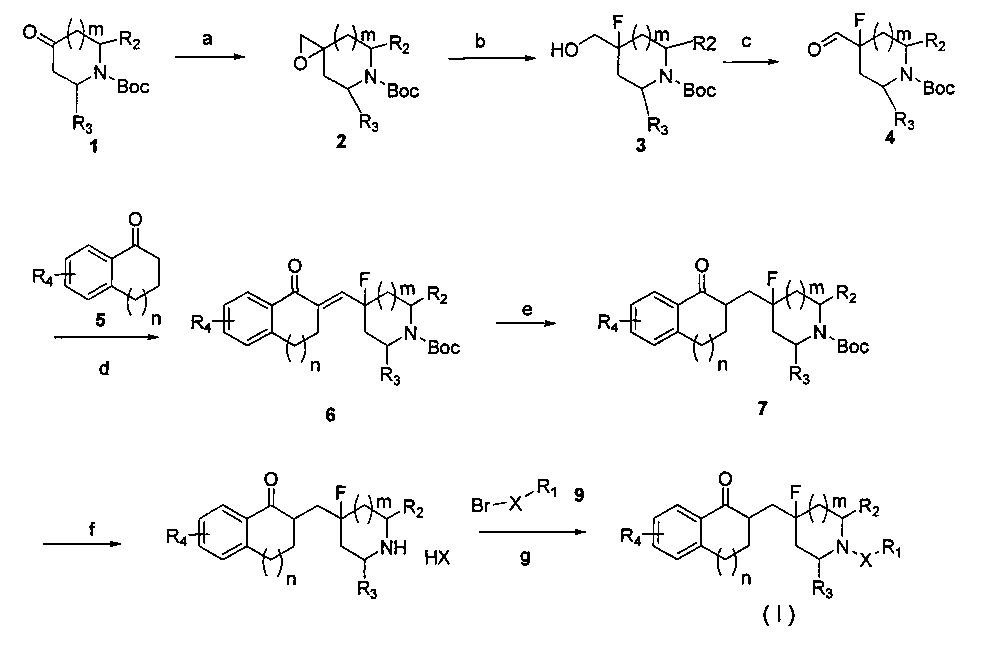
где значения R1, R2, R3, R4, X, m и n являются такими же, как определены в общей формуле I.
Стадия а: диметилсульфоксид добавляют и нагревают при перемешивании; добавляют NaH и перемешивают. После охлаждения добавляют триметилсульфоксоний йодид, и затем соединение 1 добавляют с получением эпоксида 2; температура нагревания составляет от 60 до 100°C.
Стадия b: промежуточное соединение 2 растворяют в органическом растворителе и охлаждают до температуры от -10°C до -40°C. Добавляют от 1 до 10 эквивалентов раствора фторида водорода в пиридине и продолжают взаимодействие до исчезновения сырья. Промежуточное соединение 3 получают путем выделения и очистки; органический растворитель представляет собой тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан или их смесь.
Стадия c: промежуточное соединение 3 растворяют в органическом растворителе, и добавляют окислитель для окисления спиртового гидроксила до альдегидной группы с получением промежуточного соединения 4; органический растворитель представляет собой тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан или их смесь; и указанный окислитель может быть выбран из группы, состоящей из РСС (pyridinium chlorochromate - хлорхромат пиридиния), PDC (pyridinium dichromate - дихромат пиридиния), периодинана Десса-Мартина, окислителя Сверна, H2O2, перманганата калия и диоксида марганца.
Стадия d: промежуточное соединение 4 растворяют в органическом растворителе и добавляют соединение 5. Затем добавляют сильное основание до исчезновения сырья. Промежуточное соединение 6 получают путем выделения и очистки; органический растворитель представляет собой тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан или их смесь; и сильное основание представляет собой NaOH, KOH, этоксид натрия или метоксид натрия.
Стадия e: промежуточное соединение 6 растворяют в органическом растворителе и добавляют палладий на углероде. Затем газообразный водород загружают для восстановления с получением промежуточного соединения 7; органический растворитель содержит тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан.
Стадия f: промежуточное соединение 7 растворяют в органическом растворителе, и добавляют трифторуксусную кислоту (TFA) или соляную кислоту (HCl) в органическом растворителе для удаления защитной группы BOC (tert-butyloxycarbonyl - трет-бутилоксикарбонил) с получением промежуточного соединения 8; органический растворитель может представлять собой тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан или их смесь.
Стадия g: промежуточное соединение 8 растворяют в органическом растворителе и добавляют соединение 9. Затем добавляют некоторое количество основания, и перемешивают до исчезновения сырья с получением конечного продукта; органический растворитель представляет собой тетрагидрофуран, диэтиловый эфир, диметилформамид, гликольдиметиловый эфир, гликольдиэтиловый эфир, диоксан, этанол, метанол, этилацетат, дихлорметан или их смесь; и основание может представлять собой ацетат натрия, NaOH, KOH, этоксид натрия, метоксид натрия, карбонат натрия, карбонат калия, триэтиламин или диизопропиламин.
Схема 2:
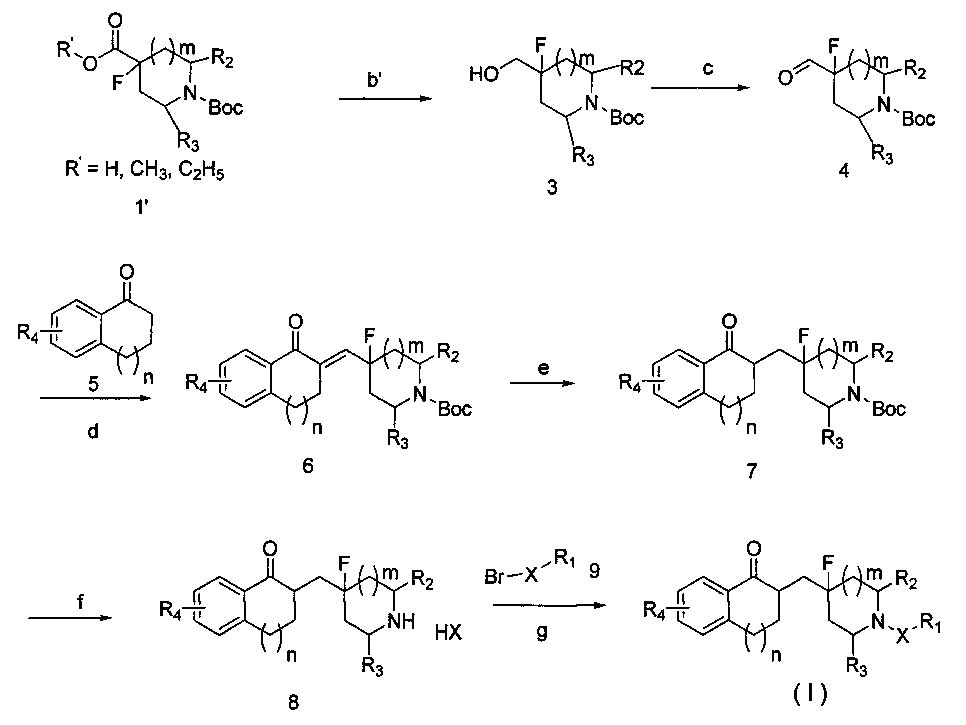
где значения R1, R2, R3, R4, X, m и n являются такими же, как определены в вышеприведенной общей формуле I.
Стадия b′: соединение 1′ восстанавливают восстановителем для получения промежуточного соединения 2; восстановитель выбирают из боргидрида натрия, боргидрида калия, боргидрида лития, алюмогидрида лития (LiAlH4).
Стадии c-g: специфические операции идентичны операциям, приведенным на схеме 1.
В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество одного или более чем одного из вышеприведенных соединений общей формулы I, фармацевтически приемлемые соли, энантиомеры, диастереоизомер и рацематы, и возможно один или более чем один фармацевтически приемлемый носитель, эксципиент, адъювант, вспомогательные материалы и/или разбавители. Вспомогательный материал представляет собой, например ароматизирующий агент, вкусовую добавку, подсластитель и т.п.
Фармацевтическая композиция, предложенная в настоящем изобретении, предпочтительно содержит от 1 до 99 масс. % активных ингредиентов, и предпочтительная пропорция является такой, при которой содержание соединения общей формулы I в качестве действующего начала составляет от 65 масс. % до 99 масс. % на основе общей массы, и оставшаяся часть представляет собой фармацевтически приемлемые носители, разбавитель или раствор, или солевой раствор.
Соединения и фармацевтические композиции по настоящему изобретению могут быть предложены в различных формах, таких как таблетки, капсулы, порошки, сиропы, растворы, суспензии, аэрозоли и т.п., и могут быть представлены в подходящем твердом или жидком носителе или разбавителе, и подходящем дезинфицирующем агенте для инъекции или инфузии.
Различные стандартные лекарственные формы фармацевтических композиций по настоящему изобретению могут быть приготовлены в соответствии с обычными способами получения в фармацевтической области. Стандартная доза композиции содержит от 0,05 до 200 мг соединения общей формулы I, предпочтительно стандартная доза композиции содержит от 0,1 мг до 100 мг соединения общей формулы I.
Соединения и фармацевтические композиции по настоящему изобретению могут быть применены клинически в отношении млекопитающих, включая людей и животных, путем введения через рот, нос, кожу, легкое или желудочно-кишечный тракт и т.п., наиболее предпочтительно через рот. Наиболее предпочтительно, суточная доза составляет от 0,01 до 200 мг/кг массы организма, разовое применение, или от 0,01 до 100 мг/кг массы организма в виде дробных доз. Независимо от пути введения оптимальная доза для субъекта должна быть определена в соответствии со специфическим лечением. Как правило, исходная доза представляет собой небольшую дозу, и дозу постепенно увеличивают до достижения наиболее подходящей дозы.
Еще один аспект настоящего изобретения заключается в том, чтобы предложить ингибитор ацетилхолинэстеразы, содержащий одно или более чем одно из вышеприведенных соединений общей формулы I, их фармацевтически приемлемые соли, рацематы, R-изомеры, S-изомеры или их смесь, и возможно один или более чем один фармацевтически приемлемый носитель, эксципиенты, адъюванты, вспомогательные материалы и/или разбавители.
Соединения и фармацевтические композиции по настоящему изобретению могут быть применены для лечения или предупреждения заболеваний нервной системы, связанных с ацетилхолинэстеразой, включающих без ограничения старческую деменцию, болезнь Паркинсона, эпилепсию или шизофрению и т.п.
Таким образом, еще один аспект настоящего изобретения заключается в том, чтобы предложить применение вышеприведенных соединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей для получения лекарственных средств для лечения заболеваний нервной системы, связанных с ацетилхолинэстеразой, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, шизофрения и т.п.
Еще один аспект настоящего изобретения заключается в том, чтобы предложить способ лечения заболеваний нервной системы, связанных с ацетилхолинэстеразой, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, шизофрения и т.п., при которых осуществляют введение одного или более чем одного из вышеприведенных соединений общей формулы I, их фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров или их смесей пациенту, нуждающемуся в таком введении.
Примеры осуществления изобретения
Настоящее изобретение далее будет проиллюстрировано в следующих примерах. Предполагается, что эти примеры иллюстрируют изобретение, но никоим образом не ограничивают его. Если не указано иное, то исходные вещества, использованные в настоящем изобретении, приобретены в продаже.
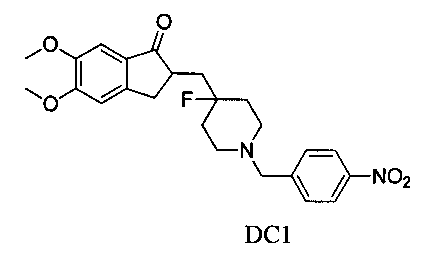
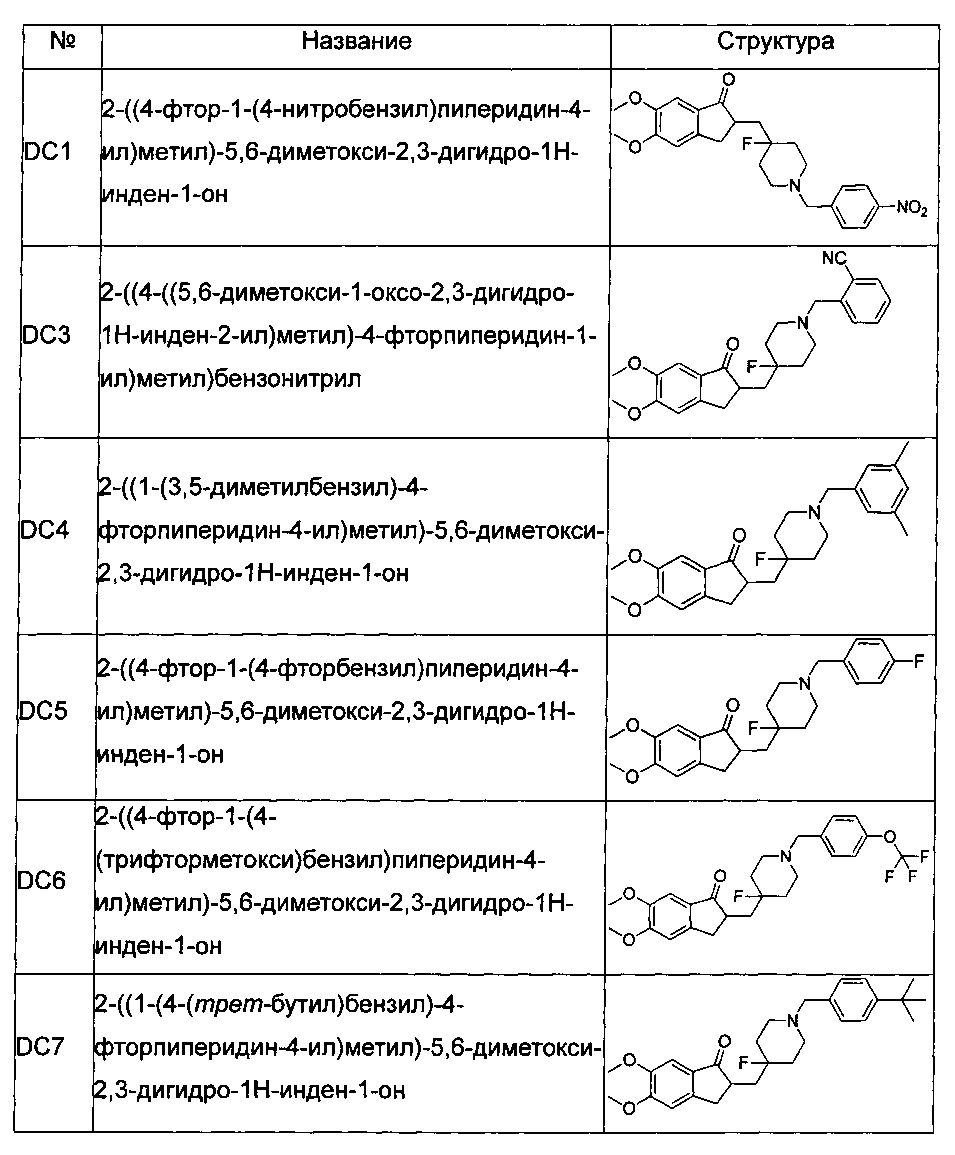
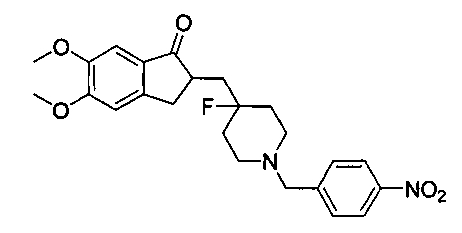
Пример 1. Получение 2-((4-фтор-1-(4-нитробензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC1)
1.1 синтез трет-бутил 1-окса-6-азаспиро[2.5]октан-6-карбоксилата

130 мл диметилсульфоксида (DMSO) добавляли в колбу объемом 250 мл в форме баклажана и нагревали при перемешивании. Взвешивали 5 г твердого NaH и добавляли в раствор DMSO и затем перемешивали в течение еще 12 часов. Нагревание прекращали, и реакционную смесь охлаждали до комнатной температуры. Добавляли 25 г триметилсульфоксоний йодида и перемешивали при комнатной температуре в течение 24 часов. 25 г N-трет-бутоксикарбонил-пиперидона, предварительно растворенного в DMSO, добавляли к реакционной смеси и перемешивали в течение еще 12 часов. Реакцию контролировали путем тонкослойной хроматографии (TLC). После завершения реакции добавляли от 100 до 200 мл воды, и реакционную смесь трижды экстрагировали 100 мл этилацетата (EA). Органический слой трижды промывали 30 мл насыщенного рассола, и затем сушили при помощи роторного испарителя с получением 28 г 1-окса-6-азаспиро[2.5]октан-6-карбоксилата в виде бесцветной жидкости.
1.2 синтез трет-бутил 4-фтор-4-(гидроксиметил)пиперидин-1-карбоксилата
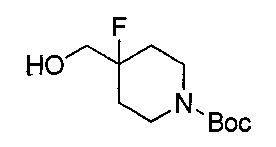
28 г 1-окса-6-азаспиро[2.5]октан-6-карбоксилата растворяли в 100 мл дихлорметана (DCM) и охлаждали. Добавляли 120 мл 70% раствора фторида водорода в пиридине, и реакция протекала в течение еще 12 часов. После завершения реакции добавляли 100 мл воды. Реакционную смесь трижды экстрагировали 100 мл DCM и очищали при помощи хроматографии на силикагеле (петролейный эфир (PE): этилацетат (EA) = 4:1) и сушили при помощи роторного испарителя с получением 21 г 4-фтор-4-(гидроксиметил)пиперидин-1-карбоксилата в виде в основном бесцветного жидкого продукта.
1.3 синтез трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилата
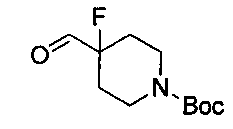
3,5 г 4-фтор-4-(гидроксиметил)пиперидин-1-карбоксилата растворяли в 20 мл органического растворителя, и добавляли 16 г периодинана Десса-Мартина и перемешивали при комнатной температуре в течение 14 часов. Взаимодействие завершалось. Добавляли 50 мл дихлорметана, и для экстракции добавляли воду. Экстрагированную фазу промывали насыщенным раствором бикарбоната натрия и затем сушили при помощи роторного испарителя с получением трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилата в виде белой жидкости.
1.4 синтез трет-бутил 4-((5,6-диметокси-1-оксо-1Н-инден-2(3H)-илиден)метил)-4-фторпиперидин-1-карбоксилата
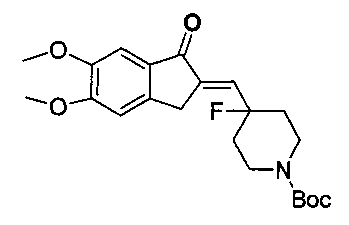
трет-Бутил 4-фтор-4-формилпиперидин-1-карбоксилат растворяли в 25 мл тетрагидрофурана и добавляли 1,4 г 5,6-диметоксиинданона и 1,8 г гидроксида натрия. Цвет реакционной жидкости менялся с желтого на коричневый. Через 12 часов взаимодействие завершалось. Реакционную смесь очищали путем колоночной хроматографии (PE: EA = 4:1) с получением 1,4 г трет-бутил 4-((5,6-диметокси-1-оксо-1Н-инден-2(3H)-илиден)метил)-4-фторпиперидин-1-карбоксилата в виде белых твердых частиц.
1.5 синтез трет-бутил 4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фторпиперидин-1-карбоксилата
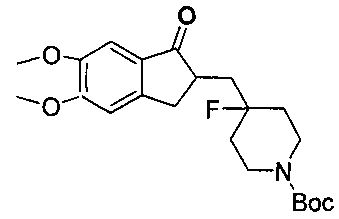
(E)-трет-бутил 4-((5,6-диметокси-1-оксо-1H-инден-2(3H)-илиден)метил)-4-фторпиперидин-1-карбоксилат добавляли к 50 мл метанола, и добавляли 300 мг 5% палладия на углероде. Устанавливали водородный баллон для тройной смены воздуха. Реакционную смесь перемешивали при 30°C в течение от 24 до 36 часов и фильтровали через диоксид кремния. Фильтрат сушили при помощи роторного испарителя с получением 1,3 г трет-бутил 4-((5,6-диметокси-1-оксо-2,3-дигидро-1H-инден-2-ил)метил)-4-фторпиперидин-1-карбоксилата в виде бесцветного жидкого продукта.
1.6 синтез 2-((4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она
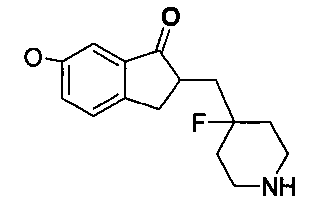
50 мл раствора диоксана добавляли к трет-бутил 4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фторпиперидин-1-карбоксилату, и добавляли 20 мл насыщенного соляной кислотой раствора диоксана и перемешивали при комнатной температуре с осаждением белых твердых частиц. Реакцию контролировали при помощи тонкослойной хроматографии (TLC). После фильтрования и сушки при помощи масляного насоса, получали 1 г 2-((4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она в виде белых твердых частиц.
1.7 синтез конечного продукта DC1
1 экв. (эквивалент) 4-нитробензилбромида, 150 мг безводного карбоната натрия и 5 мл безводного этанола добавляли к 50 мг 2-((4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она, и перемешивали при комнатной температуре в течение от 12 до 24 часов. Взаимодействие завершалось. Реакционную смесь сушили при помощи роторного испарителя, и добавляли 5 мл воды. Смесь экстрагировали при помощи EA, затем сушили при помощи роторного испарителя и очищали с получением приблизительно от 20 до 40 мг DC1 в виде бесцветных и прозрачных твердых частиц. 1H ЯМР (ядерный магнитный резонанс) (CDCl3, 400 МГц) δ 8,18 (d, J=8,4, 2Н), 7,52 (d, J=8,4, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,63 (s, 2Н), 3,30-3,36 (m, 1Н), 2,86-2,91 (m, 4Н), 2,37-2,44 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,64-1,67 (m, 2Н); LRMS (масс-спектр низкого разрешения) (ИЭ (ионизация путем распыления электронов)) m/z 442 (M+).
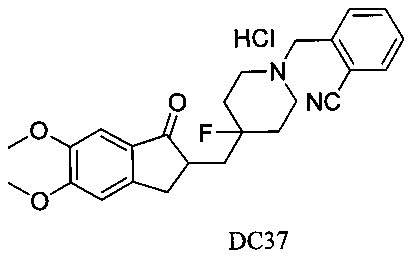
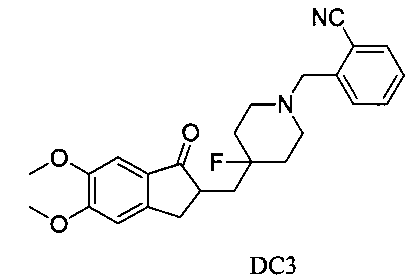
Пример 2. Получение 2-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фторпиперидин-1-ил)метил)бензонитрила (DC3)
4-Нитробензилбромид заменяли на 2-цианобензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC3 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,65 (m, 1Н), 7,55 (m, 2Н), 7,36 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,98 (s, 3H), 3,89 (s, 3H), 3,65 (s, 2Н), 3,28-3,34 (m, 1Н), 2,67-2,91 (m, 4Н), 2,39-2,51 (m, 3H), 1,91-2,02 (m, 1Н), 1,62-2,03 (m, 4Н); LRMS (ИЭ) m/z 422 (M+).
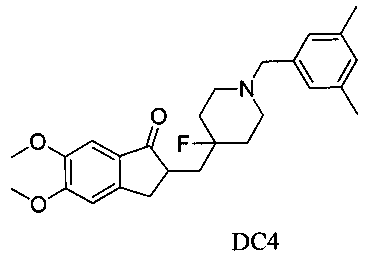
Пример 3. Получение 2-((1-(3,5-диметилбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC4)
4-Нитробензилбромид заменяли на 3,5-диметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC4 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 6,95 (s, 2Н),6,90 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,48 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,91 (m, 4Н), 2,39-2,45 (m, 3H), 3,33 (s, 6Н), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 3H), 1,62-1,65 (m, 1Н); LRMS (ИЭ) m/z 425 (M+).
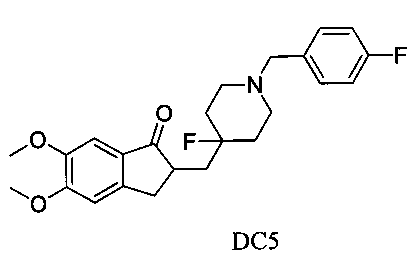
Пример 4. Получение 2-((4-фтор-1-(4-фторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC5)
4-Нитробензилбромид заменяли на 4-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC5 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,29 (t, 2Н), 7,17 (s, 1Н), 7,00 (t, 2H), 6,86 (s, 1H), 3,96 (s, 3H), 3,90 (s, 3H), 3,50 (s, 2H), 3,30-3,36 (m, 1H), 2,80-2,91 (m, 4H), 2,30-2,39 (m, 3H), 1,82-1,84 (m, 1H), 1,62-1,80 (m, 4H); LRMS (ИЭ) m/z 415 (M+).
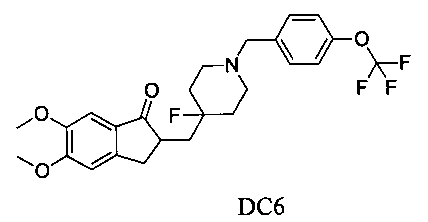
Пример 5. Получение 2-((4-фтор-1-(4-(трифторметокси)бензил) пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC6)
4-Нитробензилбромид заменяли на 4-трифторметоксибензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC6 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,36 (d, J=8,4, 2Н), 7,25 (d, J=8,40, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,53 (s, 2Н), 3,28-3,34 (m, 1Н), 2,80-2,92 (m, 4Н), 2,32-2,40 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,63-1,65 (m, 2Н); LRMS (ИЭ) m/z 481 (M+).
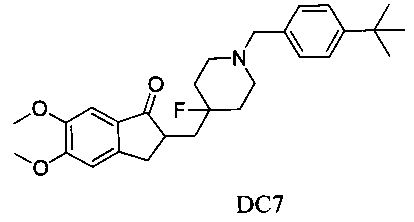
Пример 6. Получение 2-((1-(4-(трет-бутил)бензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC7)
4-Нитробензилбромид заменяли на 4-трет-бутилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC7 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,35 (d, J=8,0, 2Н), 7,25 (d, J=8,40, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,55 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,92 (m, 4Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 453 (M+).
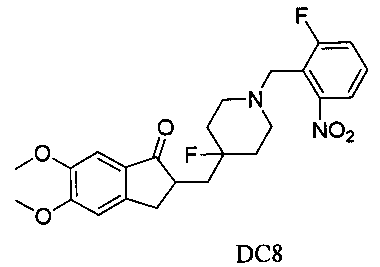
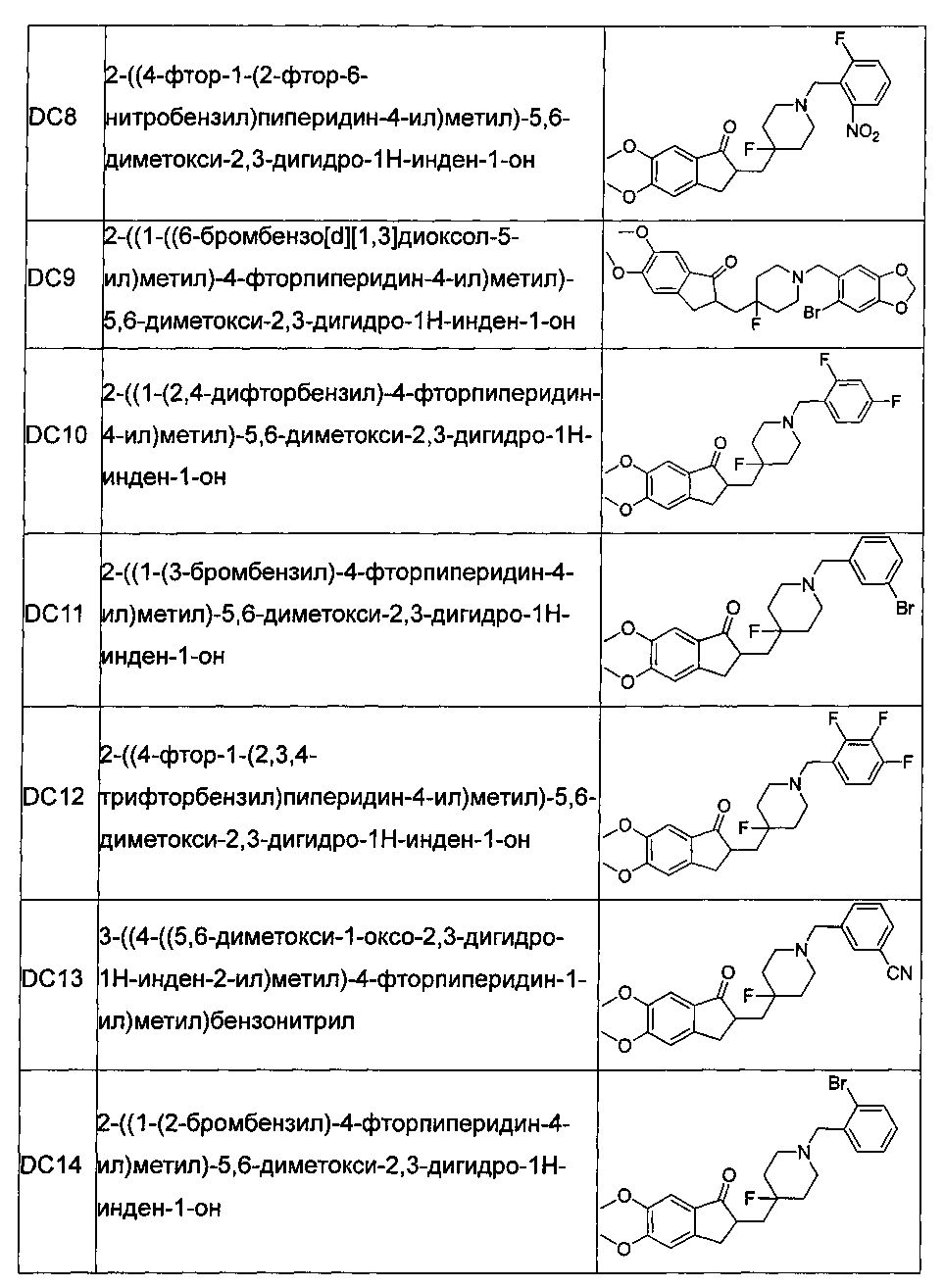
Пример 7. Получение 2-((4-фтор-1-(2-фтор-6-нитробензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC8)
4-Нитробензилбромид заменяли на 2-фтор-6-нитробензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC8 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,51 (m, 1Н), 7,38 (m, 1Н), 7,29 (m, 1Н); 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,89 (s, 3H), 3,85 (s, 2Н), 3,27-3,36 (m, 1Н), 2,75-2,87 (m, 4Н), 2,39-2,41 (m, 3H), 1,91-2,02 (m, 1Н), 1,55-1,63 (m, 4Н); LRMS (ИЭ) m/z 460 (M+).
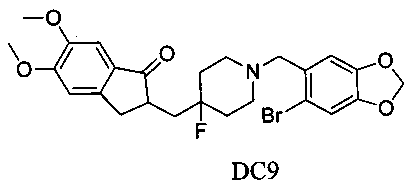
Пример 8. Получение 2-((1-((6-бромбензо[d][1,3]диоксол-5-ил)метил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC9)
4-Нитробензилбромид заменяли на 6-бром-3,4-метилдиоксобензилбромид, а остальное сырье, реагенты и получение были идентичными приведенным в примере 1. DC9 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 7,00 (m, 1Н), 6,98 (s, 1Н), 6,86 (s, 1Н), 5,97 (s, 2Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,57 (s, 2H), 3,28-3,34 (m, 1H), 2,82-2,91 (m, 4H), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1H), 1,75-1,90 (m, 2H), 1,62-1,65 (m, 2H); LRMS (ИЭ) m/z 520 (M+).
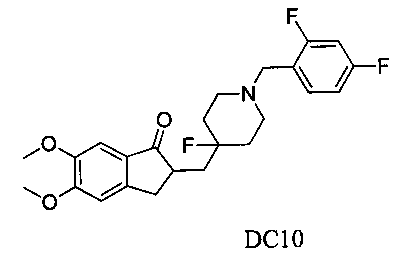
Пример 9. Получение 2-((1-(2,4-дифторбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC10)
4-Нитробензилбромид заменяли на 6-бром-3,4-метилдиоксобензилбромид, а остальное сырье, реагенты и получение были идентичными приведенным в примере 1. DC10 получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,28 (s, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 6,79 (m, 2Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,65 (s, 2Н), 3,29-3,36 (m, 1Н), 2,74-2,90 (m, 4Н), 2,39-2,42 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,61-1,65 (m, 2Н); LRMS (ИЭ) m/z 433 (M+).
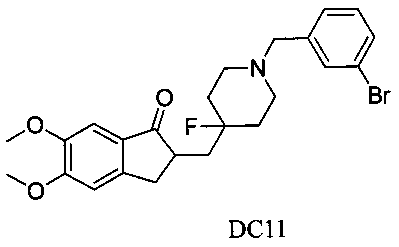
Пример 10. Получение 2-((1-(3-бромбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC11)
4-Нитробензилбромид заменяли на 3-бромбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC11 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,50 (s, 1Н), 7,39 (d, 1Н), 7,28 (m, 1Н); 7,17 (m, 2Н), 6,86 (s, 1Н), 3,97 (s, 3H), 3,90 (s, 3H), 3,52 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 4Н), 2,33-2,40 (m, 3H), 1,90-2,00 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 476 (M+).
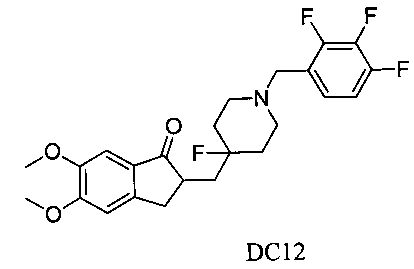
Пример 11. Получение 2-((4-фтор-1-(2,3,4-трифторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC12)
4-Нитробензилбромид заменяли на 2,3,4-трифторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC12 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 7,15 (m, 1Н), 6,95 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,60 (s, 2Н), 3,29-3,35 (m, 1Н), 2,80-2,92 (m, 4Н), 2,39-2,42 (m, 3H), 1,89-2,01 (m, 2Н), 1,62-1,85 (m, 3H); LRMS (ИЭ) m/z 451 (M+).
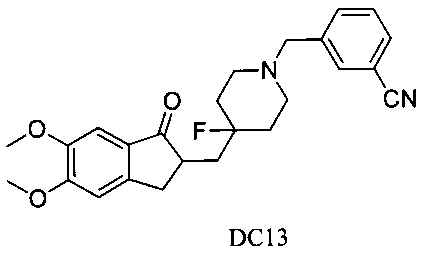
Пример 12. Получение 3-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фторпиперидин-1-ил)метил)бензонитрила (DC13)
4-Нитробензилбромид заменяли на 3-цианобензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC13 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,66 (s, 1Н), 7,56 (m, 2H),7,44 (m, 1H), 7,17 (s, 1H), 6,86 (s, 1H), 3,98 (s, 3H), 3,96 (s, 3H), 3,58 (s, 2H), 3,29-3,38 (m, 1H), 2,83-2,90 (m, 4H), 2,39-2,45 (m, 3H), 1,65-1,99 (m, 2H), 1,59-1,65 (m, 3H); LRMS (ИЭ) m/z 422 (M+).
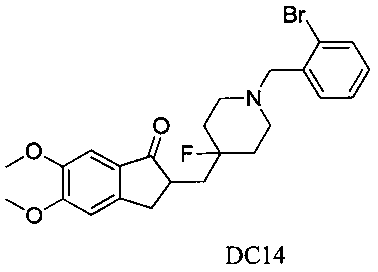
Пример 13. Получение 2-((1-(2-бромбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC14)
4-Нитробензилбромид заменяли на 2-бромбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC14 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,56 (m, 2Н), 7,28 (m, 1Н), 7,17 (s, 1Н), 7,12 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,65 (s, 2Н), 3,31-3,37 (m, 1Н), 2,79-2,92 (m, 4Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,60-1,67 (m, 2Н); LRMS (ИЭ) m/z 476 (M+).
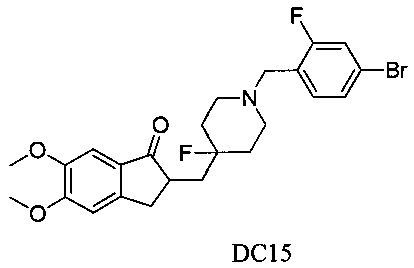
Пример 14. Получение 2-((1-(4-бром-2-фторбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC15)
4-Нитробензилбромид заменяли на 2-фтор-4-бромбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC15 получали в качестве желаемого продукта с выходом 80%. 1H ЯМР (CDCl3, 300 МГц) δ 7,27 (m, 2Н), 7,25 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,56 (s, 2Н), 3,28-3,37 (m, 1Н), 2,79-2,92 (m, 4Н), 2,30-2,41 (m, 3H), 1,91-2,02 (m, 1Н), 1,76-1,90 (m, 2Н), 1,61-1,67 (m, 2Н); LRMS (ИЭ) m/z 494 (M+).
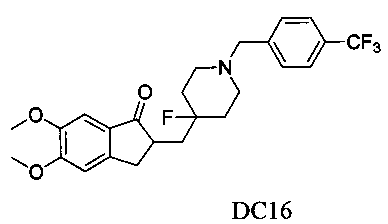
Пример 15. Получение 2-((4-фтор-1-(4-(трифторметил)бензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC16)
4-Нитробензилбромид заменяли на 4-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC16 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 300 МГц) δ 7,57(d, J=8,1, 2Н), 7,45 (d, J=8,1, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,59 (s, 2Н), 3,29-3,37 (m, 1Н), 2,69-2,92 (m, 4Н), 2,31-2,41 (m, 3H), 1,91-2,01 (m, 1Н), 1,76-1,90 (m, 2Н), 1,61-1,67 (m, 2Н); LRMS (ИЭ) m/z 465 (M+).
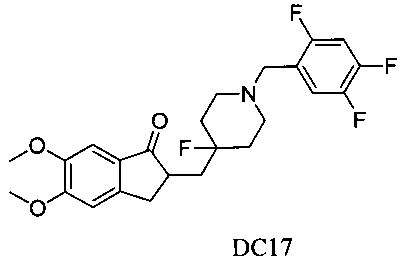
Пример 16. Получение 2-((4-фтор-1-(2,4,5-трифторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC17)
4-Нитробензилбромид заменяли на 2,4,5-трифторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC17 получали в качестве желаемого продукта с выходом 80%. 1H ЯМР (CDCl3, 300 МГц) δ 7,27 (m, 1Н), 7,17 (s, 1Н), 6,91 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,54 (s, 2Н), 3,29-3,54 (m, 1Н), 2,66-2,92 (m, 4Н), 2,40-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,76-1,90 (m, 2Н), 1,62-1,67 (m, 2Н); LRMS (ИЭ) m/z 451 (M+).
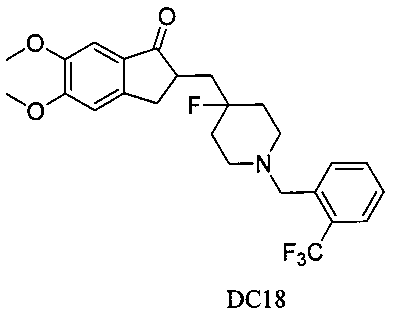
Пример 17. Получение 2-((4-фтор-1-(2-(трифторметил)бензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC18)
4-Нитробензилбромид заменяли на 2-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC18 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,79 (d, 2Н), 7,62 (d, 2Н), 7,51 (t, 1Н), 7,32 (t, 1H),7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,69 (s, 2Н), 3,31-3,37 (m, 1Н), 2,82-2,92 (m, 4Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,76-1,90 (m, 2Н), 1,60-1,67 (m, 2Н); LRMS (ИЭ) m/z 465 (M+).
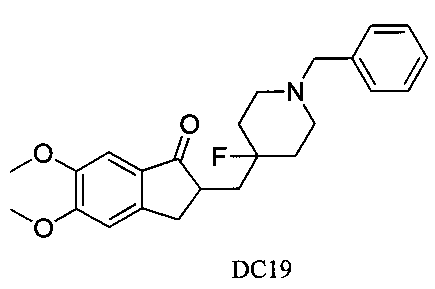
Пример 18. Получение 2-((1-бензил-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC19)
4-Нитробензилбромид заменяли на 1-бензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC19 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,31-7,33 (m, 5Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,59 (s, 2Н), 3,29-3,37 (m, 1Н), 2,79-2,92 (m, 4Н), 2,30-2,41 (m, 3H), 1,91-2,02 (m, 1Н), 1,66-2,02 (m, 4Н); LRMS (ИЭ) m/z 397 (M+).
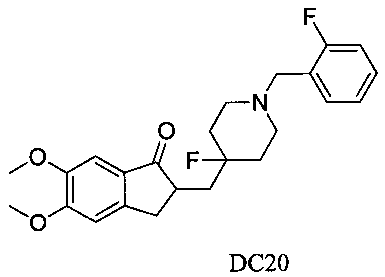
Пример 19. Получение 2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC20)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC20 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,41 (t, 1Н), 7,24-7,26 (m, 1Н), 7,17 (s, 1Н), 7,12 (t, 1Н), 7,06 (t, 1Н), 6,86 (s, 1Н), 3,98 (s, 3H), 3,90 (s, 3H), 3,65 (s, 2Н), 3,29-3,34 (m, 1Н), 2,80-2,90 (m, 4Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 415 (M+).
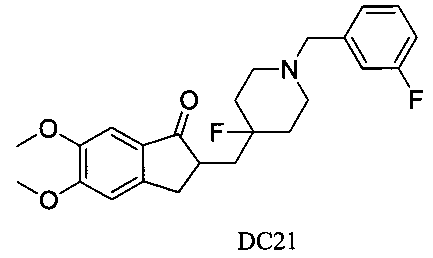
Пример 20. Получение 2-((4-фтор-1-(3-фторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC21)
4-Нитробензилбромид заменяли на 3-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC21 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3) 400 МГц) δ 7,26-7,28 (m, 1Н), 7,17 (s, 1Н), 7,07 (t, 2Н), 6,63 (t, 1Н), 6,86 (s, 1Н), 3,98 (s, 3H), 3,90 (s, 3H), 3,54 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 2Н), 2,70 (t, 2Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 415 (M+).
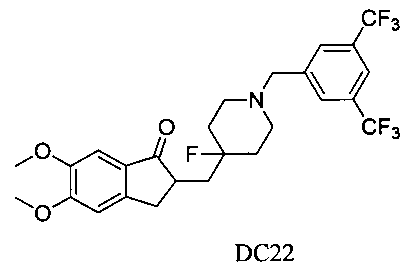
Пример 21. Получение 2-((1-(3,5-бис(трифторметил)бензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC22)
4-Нитробензилбромид заменяли на 3,5-бис-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC22 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,79 (m, 3H), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,64 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 2Н), 2,68 (t, 2Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 533 (M+).
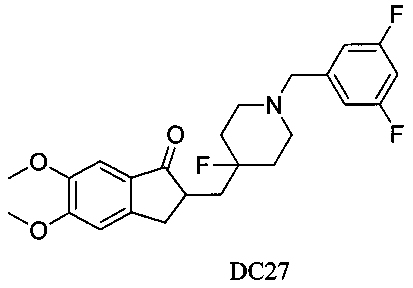
Пример 22. Получение 2-((1-(3,5-дифторбензил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC27)
4-Нитробензилбромид заменяли на 3,5-дифторбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC27 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 6,91 (s, 2Н), 6,86 (s, 1Н), 6,70 (t, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,64 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 2Н), 2,68 (t, 2Н), 2,40-2,45 (m, 3H), 1,90-2,01 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 433 (M+).
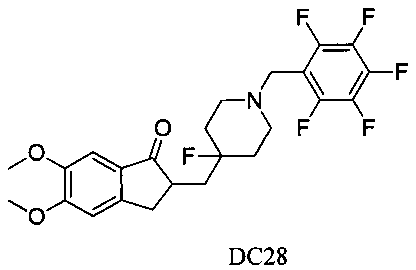
Пример 23. Получение 2-((4-фтор-1-((перфторфенил)метил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC28)
4-Нитробензилбромид заменяли на 2,3,4,5,6-пентафторбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC28 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,16 (s, 1Н), 6,85 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,76 (s, 2Н), 3,30-3,38 (m, 1Н), 2,64-2,88 (m, 4Н), 2,39-2,44 (m, 3H), 1,93-2,04 (m, 1Н), 1,75-1,84 (m, 2Н), 1,60-1,64 (m, 2Н); LRMS (ИЭ) m/z 487 (M+).
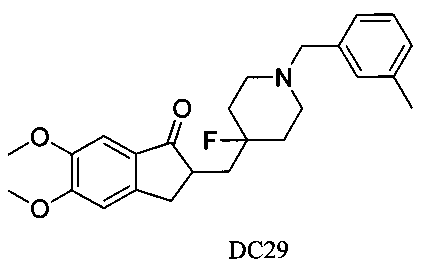
Пример 24. Получение 2-((4-фтор-1-(3-метилбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC29)
4-Нитробензилбромид заменяли на 3-метилбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC29 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,19-7,24 (m, 3H), 7,17 (s, 1Н), 7,12 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,66 (s, 2Н), 3,31-3,37 (m, 1Н), 2,78-2,88 (m, 4Н), 2,35-2,51 (m, 3H), 2,36 (s, 3H), 1,85-2,01 (m, 3H), 1,53-1,74 (m, 2Н); LRMS (ИЭ) m/z 411 (M+).
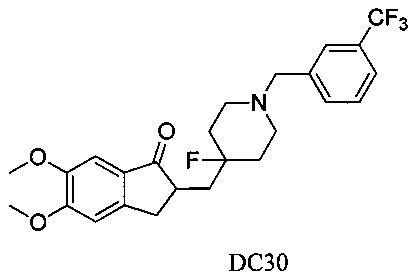
Пример 25. Получение 2-((4-фтор-1-(3-(трифторметил)бензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC30)
4-Нитробензилбромид заменяли на 3-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC30 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,61 (s, 1Н), 7,52 (m, 2Н), 7,49 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,60 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,91 (m, 4Н) 2,38-2,41 (m, 3H), 1,90-2,01 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 465 (M+).
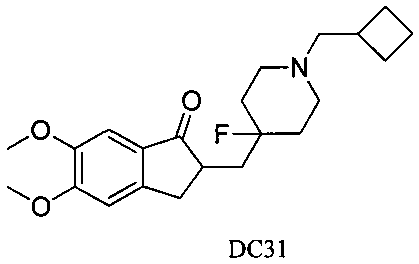
Пример 26. Получение 2-((1-(циклобутилметил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC31)
4-Нитробензилбромид заменяли на циклобутилметил бромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC31 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,36-3,43 (m, 4Н), 2,76-2,86 (m, 4Н), 2,48-2,53 (m, 3H), 2,42-2,48 (m, 1Н), 2,28-2,31 (m, 3H), 1,93-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (s, 2Н); LRMS (ИЭ) m/z 375 (M+).
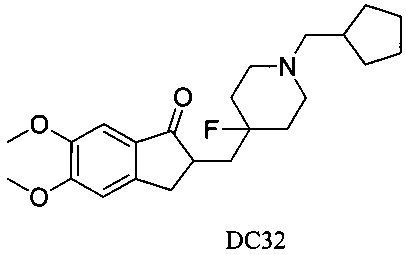
Пример 27. Получение 2-((1-(циклопентилметил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC32)
4-Нитробензилбромид заменяли на циклопентилметил бромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC32 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,16 (s, 1Н), 6,87 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,36-3,46 (m, 3H), 2,16-2,26 (m, 1Н), 3,03 (t, 2Н), 2,76-2,85 (m, 2Н), 2,52-2,61 (m, 1Н), 2,21-2,47 (m, 2Н), 1,02-2,18 (m, 5Н), 1,89 (s, 5Н), 1,65-1,71 (s, 3H); LRMS (ИЭ) m/z 389 (M+).
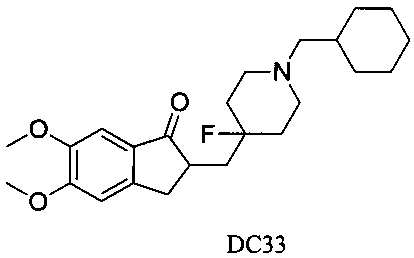
Пример 28. Получение 2-((1-(циклогексилметил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC33)
4-Нитробензилбромид заменяли на циклогексилметил бромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 1. DC33 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 6,87 (s, 1Н), 3,97 (s, 3H), 3,91 (s, 3H), 3,36-3,66 (m, 4Н), 2,70-2,96 (m, 2Н), 2,46-2,55 (m, 1Н), 2,02-2,21 (m, 4Н), 1,61-1,97 (m, 11Н), 1,22-1,28 (m, 3H); LRMS (ИЭ) m/z 403 (M+).
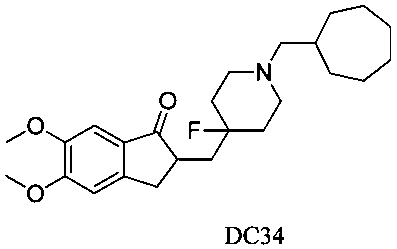
Пример 29. Получение 2-((1-(циклогептилметил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC34)
4-Нитробензилбромид заменяли на циклогептилметил бромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC34 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,16 (s, 1Н), 6,88 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,36-3,40 (m, 1Н), 3,16-2,28 (m, 5Н), 2,76-2,85 (m, 2Н), 2,49-2,56 (m, 4Н), 2,12-2,17 (m, 4Н), 1,80-2,82 (m, 2Н), 1,53-1,71 (m, 10H); LRMS (ИЭ) m/z 417 (M+).
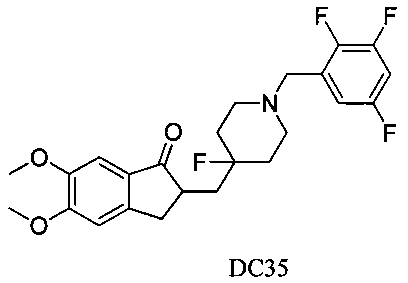
Пример 30. Получение 2-((4-фтор-1-(2,3,5-трифторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC35)
4-Нитробензилбромид заменяли на 2,3,5-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC35 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 7,02 (s, 1Н), 6,87 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,64 (s, 2Н), 3,30-3,37 (m, 1Н), 2,79-2,91 (m, 4Н) 2,38-2,41 (m, 3H), 1,90-2,01 (m, 1Н), 1,75-1,90 (m, 2Н), 1,60-1,65 (m, 2Н); LRMS (ИЭ) m/z 451 (M+).
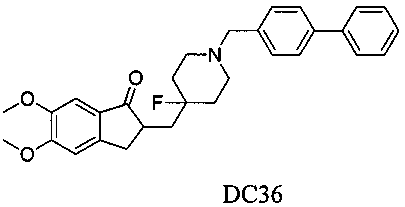
Пример 31. Получение 2-((1-([1,1′-бифенил]-4-илметил)-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC36)
4-Нитробензилбромид заменяли на бифенил-4-метил бромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC36 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,55-7,60 (m, 4Н), 7,42-7,46 (m, 4Н), 7,34-7,36 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,64 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 4Н), 2,39-2,45 (m, 3H), 1,93-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2H); LRMS (ИЭ) m/z 473 (M+).
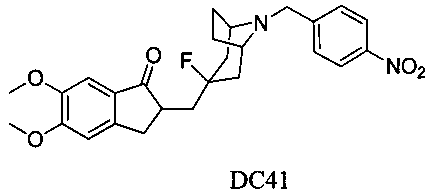
Пример 32. Получение 2-((3-фтор-8-(4-нитробензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC41)
4-Boc-пиперидон заменяли на 4-Вос-тропинон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1. DC41 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 8,18 (d, J=8,4, 2Н), 7,60 (d, J=8,4, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,76 (s, 2Н), 3,31-3,36 (m, 1Н), 3,22 (s, 2Н), 2,85-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,82 (m, 4Н); LRMS (ИЭ) m/z 468 (M+).
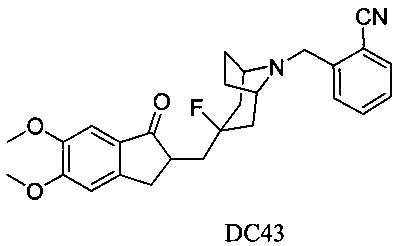
Пример 33. Получение 2-((3-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-3-фтор-8-азабицикло[3.2.1]октан-8-ил)метил)бензонитрила (DC43)
4-Нитробензилбромид заменяли на 2-цианобензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC43 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,73 (s, 1Н), 7,58-7,65 (m, 2Н), 7,35 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,83 (s, 2Н), 3,26-3,34 (m, 3H), 2,85-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,82 (m, 4Н); LRMS (ИЭ) m/z 448 (M+).
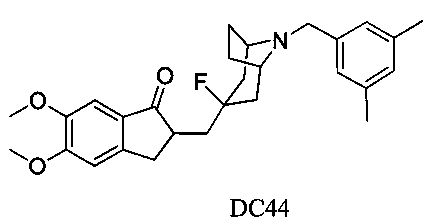
Пример 34. Получение 2-((8-(3,5-диметилбензил)-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC44)
4-Нитробензилбромид заменяли на 3,5-диметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC44 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 7,05 (s, 2H), 6,91 (t, 2Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,64 (s, 2Н), 3,29-3,36 (m, 3H), 2,86-2,93 (m, 2Н), 2,50-2,71 (m, 1Н), 2,32 (s, 6Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,05-2,13 (m, 3H), 1,72-1,82 (m, 4Н); LRMS (ИЭ) m/z 451 (M+).
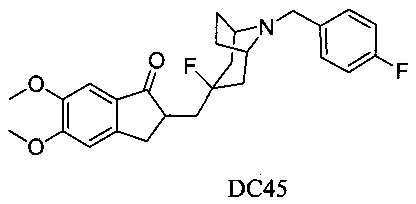
Пример 35. Получение 2-((3-фтор-8-(4-фторбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC45)
4-Нитробензилбромид заменяли на 4-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC45 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,39 (m, 2Н), 7,17 (s, 1Н), 7,01 (t, 2Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,65 (s, 2Н), 3,31-3,36 (m, 1Н), 3,26 (s, 2Н), 2,85-2,93 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,05-2,13 (m, 3H), 1,72-1,82 (m, 4Н); LRMS (ИЭ) m/z 441 (M+).
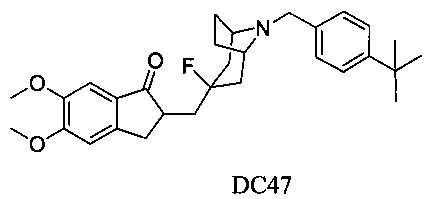
Пример 36. Получение 2-((8-(4-(трет-бутил)бензил)-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC47)
4-Нитробензилбромид заменяли на 4-трет-бутилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC47 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,36 (s, 4Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,68 (s, 2Н), 3,30-3,36 (m, 3H), 2,86-2,93 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,82 (m, 4Н), 1,31 (s, 9Н); LRMS (ИЭ) m/z 479 (M+).
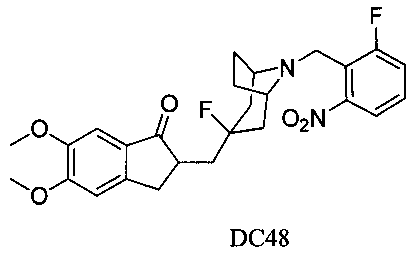
Пример 37. Получение 2-((3-фтор-8-(2-фтор-6-нитробензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC48)
4-Нитробензилбромид заменяли на 2-фтор-6-нитробензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC48 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,53 (m, 1Н), 7,38 (m, 1Н), 7,25 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 5Н), 3,12-3,14 (m, 1Н), 3,11 (s, 2Н), 2,86-2,93 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 1,96-2,13 (m, 4Н), 1,71-1,82 (m, 4Н); LRMS (ИЭ) m/z 486 (M+).
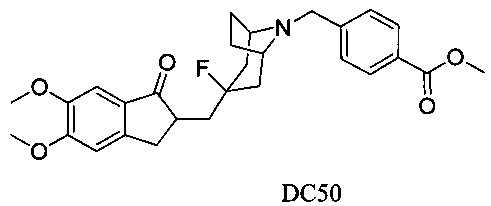
Пример 38. Получение метил 4-((3-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-3-фтор-8-азабицикло[3.2.1]октан-8-ил)метил)бензоата (DC50)
4-Нитробензилбромид заменяли на 4-метоксикарбонилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC50 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 8,00 (d, J=8,0, 2Н), 7,53 (d, J=8,4, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 6Н), 3,74 (s, 2Н), 3,32-3,41 (m, 3H), 2,85-2,92 (m, 2Н), 2,52-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,14 (m, 3H), 1,70-1,82 (m, 4Н); LRMS (ИЭ) m/z 481 (M+).
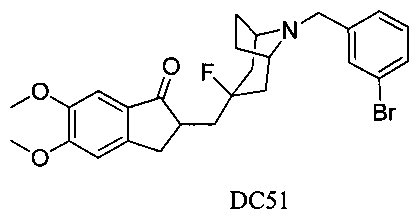
Пример 39. Получение 2-((8-(3-бромбензил)-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC51)
4-Нитробензилбромид заменяли на 3-бромбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC51 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,59 (s, 1Н), 7,37 (m, 2Н), 7,21 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 3H), 3,65 (s, 2Н), 3,30-3,36 (m, 1Н), 3,20 (s, 2Н), 2,83-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,72-1,82 (m, 4Н); LRMS (ИЭ) m/z 476 (M+).
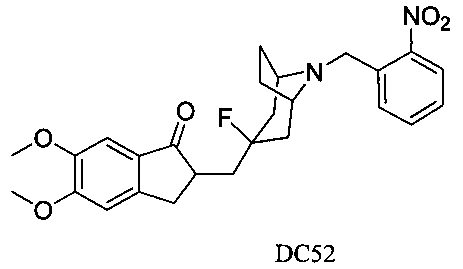
Пример 40. Получение 2-((3-фтор-8-(2-нитробензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC52)
4-Нитробензилбромид заменяли на 2-нитробензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC52 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,80-7,86 (m, 2Н), 7,57 (t, 1Н), 7,39 (t, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,90 (s, 5Н), 3,30-3,36 (m, 1Н), 3,20 (s, 2Н), 2,82-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,68-1,82 (m, 4Н); LRMS (ИЭ) m/z 468 (M+).
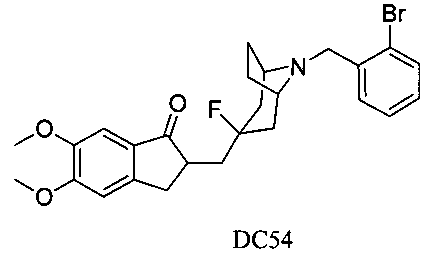
Пример 41. Получение 2-((8-(2-бромбензил)-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC54)
4-Нитробензилбромид заменяли на 2-бромбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC54 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,73 (s, 1Н), 7,53 (d, 1Н), 7,32 (t, 1Н), 7,17 (s, 1Н), 7,11 (t, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 5Н), 3,70 (s, 2Н), 3,28-3,37 (m, 3H), 2,86-2,94 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,68-1,82 (m, 4Н); LRMS (ИЭ) m/z 476 (M+).
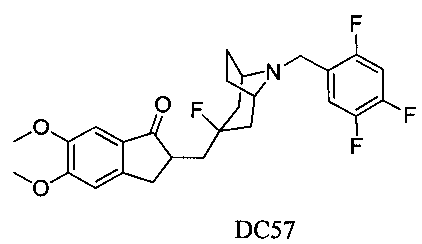
Пример 42. Получение 2-((3-фтор-8-(2,4,5-трифторбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC57)
4-Нитробензилбромид заменяли на 2,4,5-трифторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC57 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,51 (s, 1Н), 7,17 (s, 1Н), 6,88 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,63 (s, 2Н), 3,30-3,36 (m, 1Н), 3,20 (s, 2Н), 2,82-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,26-2,45 (m, 1Н), 2,15-2,27 (m, 1Н), 2,07-2,13 (m, 3H), 1,68-1,82 (m, 4Н); LRMS (ИЭ) m/z 451 (M+).
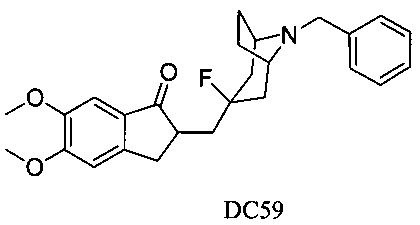
Пример 43. Получение 2-((8-бензил-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC59)
4-Нитробензилбромид заменяли на бензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC59 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,44 (s, 2Н), 7,33 (t, 2Н), 7,25 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,70 (s, 2Н), 3,28-3,33 (m, 3H), 2,87-2,92 (m, 2Н), 2,50-2,71 (m, 1Н), 2,15-2,47 (m, 2Н), 2,03-2,13 (m, 3H), 1,68-1,82 (m, 4Н); LRMS (ИЭ) m/z 423 (M+).
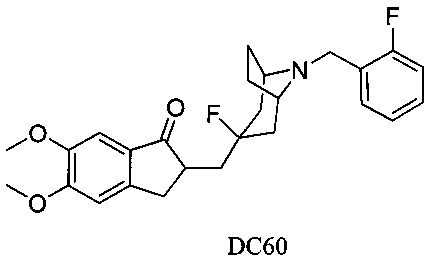
Пример 44. Получение 2-((3-фтор-8-(2-фторбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC60)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC60 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,64 (s, 1Н), 7,23 (m, 1Н), 7,15-7,18 (m, 2Н), 6,99 (t, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,71 (s, 2Н), 3,31-3,35 (m, 3H), 2,85-2,93 (m, 2Н), 2,52-2,71 (m, 1Н), 2,15-2,47 (m, 2Н), 2,03-2,13 (m, 3H), 1,72-1,88 (m, 4Н); LRMS (ИЭ) m/z 441 (M+).
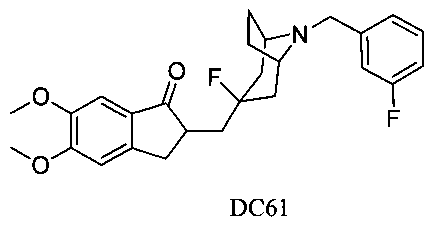
Пример 45. Получение 2-((3-фтор-8-(3-фторбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1Н-инден-1-она (DC61)
4-Нитробензилбромид заменяли на 3-фторбензилбромид, а остальное сырье, реагенты и получение были идентичными с приведенными в примере 32. DC61 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,28 (m, 1Н), 7,17-7,24 (m, 3H), 6,96 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,67 (s, 2Н), 3,25-3,37 (m, 3H), 2,83-2,93 (m, 2Н), 2,53-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,10-2,26 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,86 (m, 4Н); LRMS (ИЭ) m/z 441 (M+).
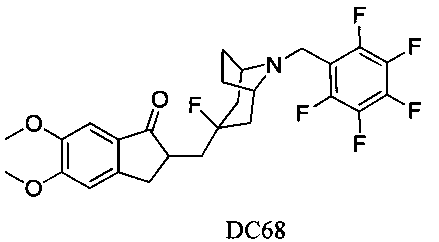
Пример 46. Получение 2-((3-фтор-8-((перфторфенил)метил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC68)
4-Нитробензилбромид заменяли на 2,3,4,5,6-пентафторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC68 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,71 (s, 2Н), 3,32-3,36 (m, 3H), 2,84-2,91 (m, 2Н), 2,54-2,71 (m, 1Н), 2,09-2,26 (m, 4Н), 1,71-1,86 (m, 4Н); LRMS (ИЭ) m/z 513 (M+).
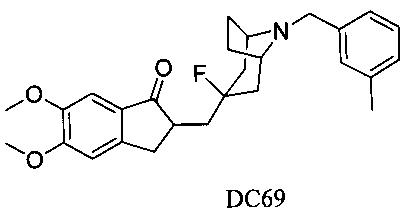
Пример 47. Получение 2-((3-фтор-8-(3-метилбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC69)
4-Нитробензилбромид заменяли на 3-метилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC69 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,17-7,26 (m, 3H), 7,17 (s, 1Н), 7,10 (m, 1Н), 6,87 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,67 (s, 2Н), 3,28-3,33 (m, 3H), 2,88-2,94 (m, 2Н), 2,52-2,71 (m, 1Н), 2,18-2,48 (m, 1Н), 2,36 (s, 3H), 2,18-2,35 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,79 (m, 4Н); LRMS (ИЭ) m/z 437 (M+).
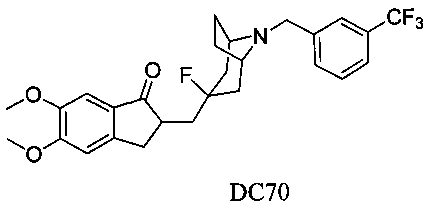
Пример 48. Получение 2-((3-фтор-8-(3-(трифторметил)бензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC70)
4-Нитробензилбромид заменяли на 3-трифторметилбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC70 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,68 (s, 1Н), 7,61 (m, 1Н), 7,49 (m, 1Н), 7,44 (m, 1Н), 7,17 (s, 1Н), 6,87 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,73 (s, 2Н), 3,31-3,33 (m, 1Н), 3,25 (s, 2Н), 2,86-2,93 (m, 2Н), 2,52-2,71 (m, 1Н), 2,18-2,48 (m, 1Н), 2,18-2,35 (m, 1H), 2,07-2,13 (m, 3H), 1,71-1,79 (m, 4Н); LRMS (ИЭ) m/z 491 (M+).
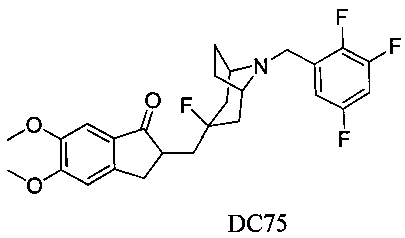
Пример 49. Получение 2-((3-фтор-8-(2,3,5-трифторбензил)-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC75)
4-Нитробензилбромид заменяли на 2,3,5-трифторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC75 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,28 (s, 1Н), 7,17 (s, 1Н), 6,95 (m, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,66 (s, 2Н), 3,25-3,37 (m, 1Н), 3,25 (s, 2Н), 2,53-2,68 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,86 (m, 4Н); LRMS (ИЭ) m/z 477 (M+).
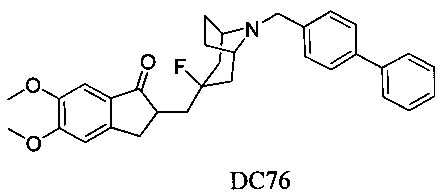
Пример 50. Получение 2-((8-([1,1′-бифенил]-4-илметил)-3-фтор-8-азабицикло[3.2.1]октан-3-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC76)
4-Нитробензилбромид заменяли на бифенил-4-метил бромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 32. DC76 в качестве желаемого продукта получали с выходом 80%. 1H ЯМР (CDCl3, 400 МГц) δ 7,52-7,61 (m, 4Н), 7,52-7,56 (m, 2Н), 7,44 (t, 2Н), 7,34 (t, 2Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,96 (s, 3H), 3,91 (s, 3H), 3,76 (s, 2Н), 3,32-3,37 (m, 3H), 2,88-2,98 (m, 2Н), 2,50-2,71 (m, 1Н), 2,28-2,48 (m, 1Н), 2,19-2,30 (m, 1Н), 2,07-2,13 (m, 3H), 1,71-1,86 (m, 4Н); LRMS (ИЭ) m/z 411 (M+).
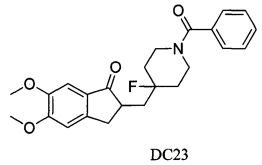
Пример 51. Получение 2-((1-бензоил-4-фторпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC23)
4-Нитробензилбромид заменяли на бензоилхлорид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC23 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 8,03 (m, 2Н), 7,63-7,70 (m, 3H), 7,54 (s, 1Н), 7,04 (s, 1Н), 3,83 (s, 6Н), 3,34-3,67 (m, 5Н), 2,58-2,83 (m, 2Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 499 (M+).
Пример 52. Получение 2-((4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фторпиперидин-1-ил)метил)бензонитрил хлоргидрата (DC37)
Соединение DC3 растворяли в небольшом количество диоксана, м добавляли раствор диоксана и соляной кислоты, и перемешивали для осаждения белых твердых частиц. После фильтрования путем отсасывания и сушки получали продукт DC37. 1H ЯМР (CDCl3, 400 МГц) δ 7,65 (m, 1Н), 7,55 (m, 2Н), 7,36 (m, 1Н), 7,17 (s, 1Н), 6,86 (s, 1Н), 3,98 (s, 3H), 3,89 (s, 3H), 3,65 (s, 2Н), 3,28-3,34 (m, 1Н), 2,67-2,91 (m, 4Н), 2,39-2,51 (m, 3H), 1,91-2,02 (m, 1Н), 1,62-2,03 (m, 4Н); LRMS (ИЭ) m/z 422 (M+).
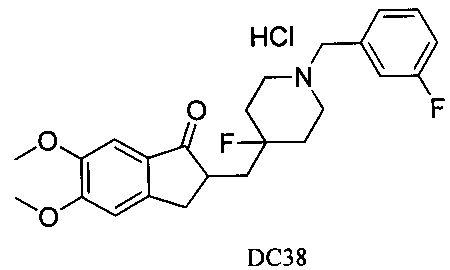
Пример 53. Получение 2-((4-фтор-1-(3-фторбензил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-он хлоргидрата (DC38)
Соединение DC21 растворяли в небольшом количестве диоксана, и добавляли раствор диоксана и соляной кислоты, и перемешивали для осаждения белых твердых частиц. После фильтрования путем отсасывания и сушки получали продукт DC38. 1H ЯМР (CDCl3, 400 МГц) δ 7,26-7,28 (m, 1Н), 7,17 (s, 1Н), 7,07 (t, 2Н), 6,63 (t, 1Н), 6,86 (s, 1Н), 3,98 (s, 3H), 3,90 (s, 3H), 3,54 (s, 2Н), 3,30-3,36 (m, 1Н), 2,80-2,90 (m, 2Н), 2,70 (t, 2Н), 2,39-2,45 (m, 3H), 1,91-2,02 (m, 1Н), 1,75-1,90 (m, 2Н), 1,62-1,65 (m, 2Н); LRMS (ИЭ) m/z 415 (M+).
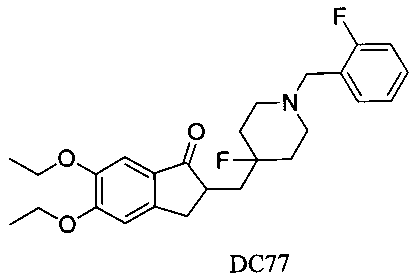
Пример 54. Получение 5,6-диэтокси-2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-2,3-дигидро-1H-инден-1-она (DC77)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-диэтоксиинданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC77 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,28 (m, 3H), 4,09 (m, 4Н), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58 (m, 2Н), 1,72-2,14 (m, 4Н), 1,52-1,64 (m, 6Н), 1,32 (m, 6Н); LRMS (ИЭ) m/z 443 (M+).
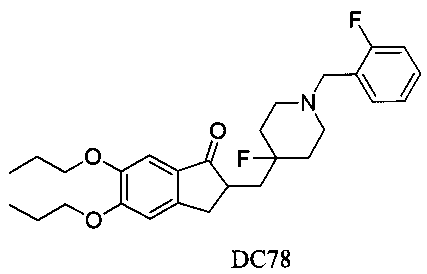
Пример 55. Получение 2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-5,6-дипропокси-2,3-дигидро-1H-инден-1-она (DC78)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-дипропоксиинданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC78 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,25 (m, 3H), 4,03 (m, 4Н), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58 (m, 2Н), 1,82-2,14 (m, 4Н), 1,62-1,74 (m, 10H), 0,90 (m, 6Н); LRMS (ИЭ) m/z 471 (M+).
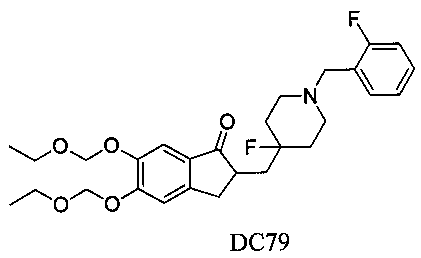
Пример 56. Получение 5,6-бис(этоксиметокси)-2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-2,3-дигидро-1H-инден-1-она (DC79),
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-ди(этоксиметокси)инданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC79 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,21 (m, 3H), 6,03 (s, 4Н), 3,66 (s, 2Н), 3,37-3,50 (m, 5Н), 2,58 (m, 2Н), 1,62-2,14 (m, 4Н), 1,62-1,74 (m, 4Н), 1,10 (m, 6Н); LRMS (ИЭ) m/z 503 (M+).
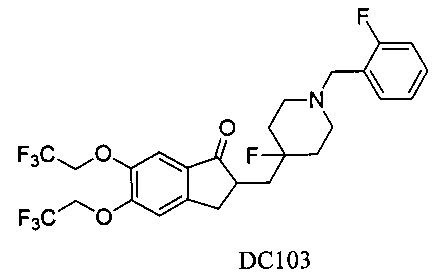
Пример 80. Получение 2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-5,6-бис(2,2,2-трифторэтокси)-2,3-дигидро-1Н-инден-1-она (DC103)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-ди(трифторэтокси)инданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC103 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,21 (m, 3H), 4,46 (m, 4Н), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58-2,83 (m, 2Н), 1,62-2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 551 (M+).
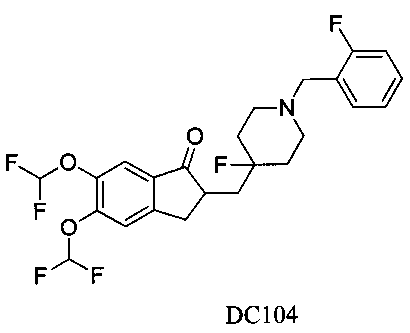
Пример 81. Получение 5,6-бис(дифторметокси)-2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-2,3-дигидро-1Н-инден-1-она (DC104)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-ди(трифторметокси)инданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC104 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,36 (m, 2Н), 7,04-7,21 (m, 3H), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58-2,83 (m, 2Н), 1,62-2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 487 (M+).
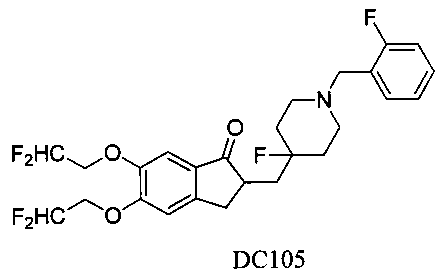
Пример 82. Получение 5,6-бис(2,2-дифторэтокси)-2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-2,3-дигидро-1H-инден-1-она (DC105)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-ди(2,2-дифторэтокси)инданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC105 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,21 (m, 3H), 5,56 (m, 2Н), 4,46 (m, 4Н), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58-2,83 (m, 2Н), 1,62-2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 515 (M+).
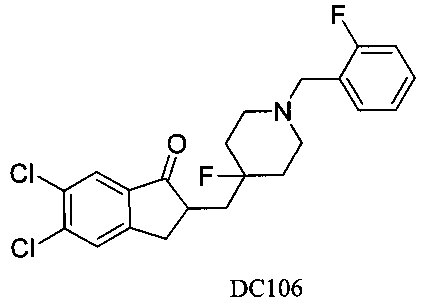
Пример 83. Получение 5,6-дихлор-2-((4-фтор-1-(2-фторбензил)пиперидин-4-ил)метил)-2,3-дигидро-1H-инден-1-она (DC106)
4-Нитробензилбромид заменяли на 2-фторбензилбромид, 5,6-диметоксиинданон заменяли на 5,6-дихлоринданон, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC106 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,78 (s, 1Н), 7,48-7,56 (m, 3H), 7,10-7,21 (m, 2Н), 3,66 (s, 2Н), 3,37 (m, 1Н), 2,58-2,83 (m, 2Н), 2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 423 (M+).
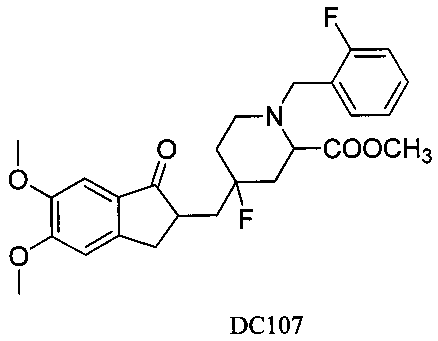
Пример 84. Получение 4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фтор-1-(2-фторбензил)пиперидин-2-карбоксилата (DC107)
Boc-пиперидон заменяли на 2-метоксикарбонил-Вос-пиперидон, 4-нитробензилбромид заменяли на 2-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC107 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,21 (m, 3H), 3,83 (s, 6Н), 3,68 (s, 3H), 3,62 (s, 2Н), 3,37 (m, 1Н), 3,07 (m, 1Н), 2,41-2,83 (m, 4Н), 1,56-1,85 (m, 6Н); LRMS (ИЭ) m/z 473 (M+).
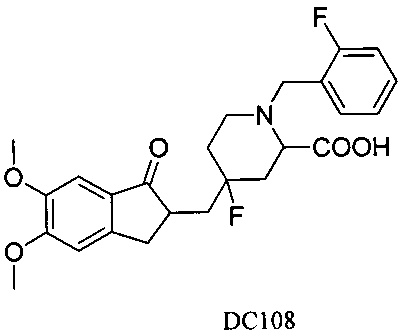
Пример 85. Получение 4-((5,6-диметокси-1-оксо-2,3-дигидро-1Н-инден-2-ил)метил)-4-фтор-1-(2-фторбензил)пиперидин-2-карбоновой кислоты (DC108)
Соединение DC107 растворяли в тетрагидрофуране и воде (1:1, об./об.) и добавляли 2 экв. водного раствора NaOH, и кипятили с обратным холодильником в течение ночи. После подкисления, экстракции этилацетатом, сушки и очистки получали желаемый продукт DC108. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,04-7,21 (m, 3H), 3,83 (s, 6Н), 3,62 (s, 2Н), 3,37 (m, 1Н), 3,07 (m, 1Н), 2,41-2,83 (m, 4Н), 1,56-1,85 (m, 6Н); LRMS (ИЭ) m/z 459 (M+).
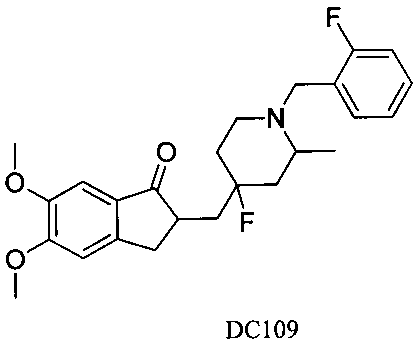
Пример 86. Получение 2-((4-фтор-1-(2-фторбензил)-2-метилпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC109)
Boc-пиперидон заменяли на 2-метил-Вос-пиперидон, 4-нитробензилбромид заменяли на 2-фторбензилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC109 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,48-7,56 (m, 3H), 7,10-7,12 (m, 3H), 3,83 (s, 6Н), 3,62 (s, 2Н), 3,37 (m, 1Н), 2,41-2,83 (m, 5Н), 1,46-1,56 (m, 6Н), 1,12 (m, 3H); LRMS (ИЭ) m/z 473 (M+).
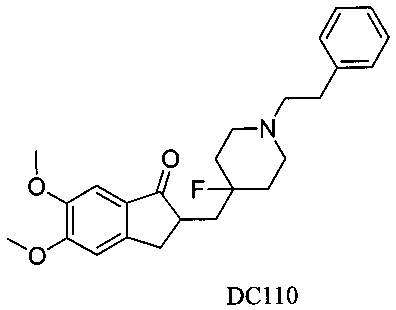
Пример 87. Получение 2-((4-фтор-1-фенэтилпиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC110)
4-Нитробензилбромид заменяли на 2-фторфенэтилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC110 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,54-7,57 (m, 3H), 7,04-7,27 (m, 3H), 3,83 (s, 6Н), 3,37 (m, 1Н), 2,58-2,69 (m, 6Н), 2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 429 (M+).
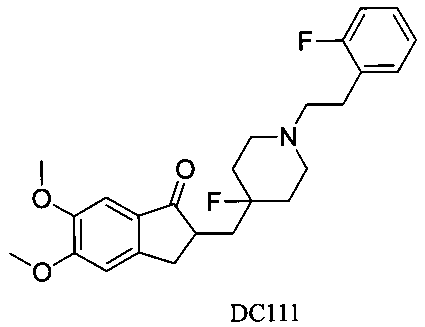
Пример 88. Получение 2-((4-фтор-1-(2-фторфенэтил)пиперидин-4-ил)метил)-5,6-диметокси-2,3-дигидро-1H-инден-1-она (DC111)
4-Нитробензилбромид заменяли на фенэтилбромид, а остальное сырье, реагенты и получение были идентичны приведенным в примере 1, с получением DC111 в качестве желаемого продукта. 1H ЯМР (CDCl3, 400 МГц) δ 7,54 (s, 1Н), 7,27-7,40 (m, 5Н), 7,04 (s, 1Н), 3,83 (s, 6Н), 3,37 (m, 1Н), 2,58-2,69 (m, 6Н), 2,24 (m, 4Н), 1,56-1,62 (m, 6Н); LRMS (ИЭ) m/z 411 (M+).
Пример анализа фармакологической активности
Экспериментальный пример 1
Ингибирующие действия соединений общей формулы I в отношении ацетилхолинэстеразы и бутирилхолинэстеразы определяли при помощи тестов, в соответствии с Biochem. Pharmacol. 1961, 7, 88-95 и Acta pharmacologica Sinica 1999, 20, 141-5. Экспериментальные данные представлены в Таблице 1.
Приготовление образца: все образцы готовили в виде раствора с концентрацией 10-2 моль/л с использованием 100% DMSO. Раствор с концентрацией 10-2 моль/л использовали для микроопределений. 1 мкл отбирали для использования в эксперименте с единичной пробиркой. Конечная концентрация в реакционной смеси составила 4×10-5 моль/л.
Растворитель в качестве контроля: 0,4% DMSO использовали для микроопределений. Получали долю ингибирования в образце, из которой вычитали действие растворителя.
Положительный контроль: гуперзин A, конечная концентрация в реакционной смеси составила 1,65×10-6 моль/л.
Ацетилхолинэстераза: кора головного мозга крысы
Бутирилхолинэстераза: сыворотка крови крысы

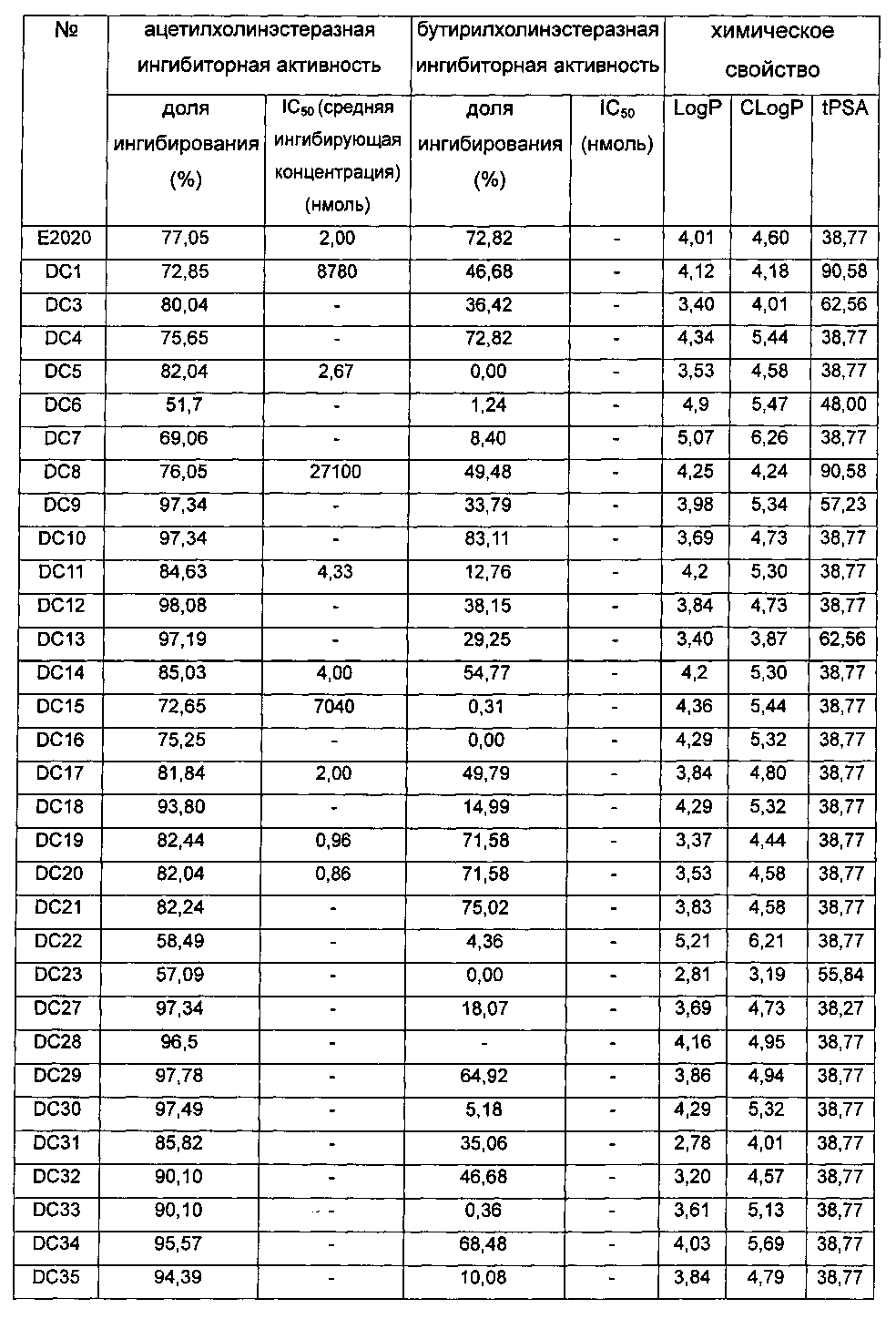
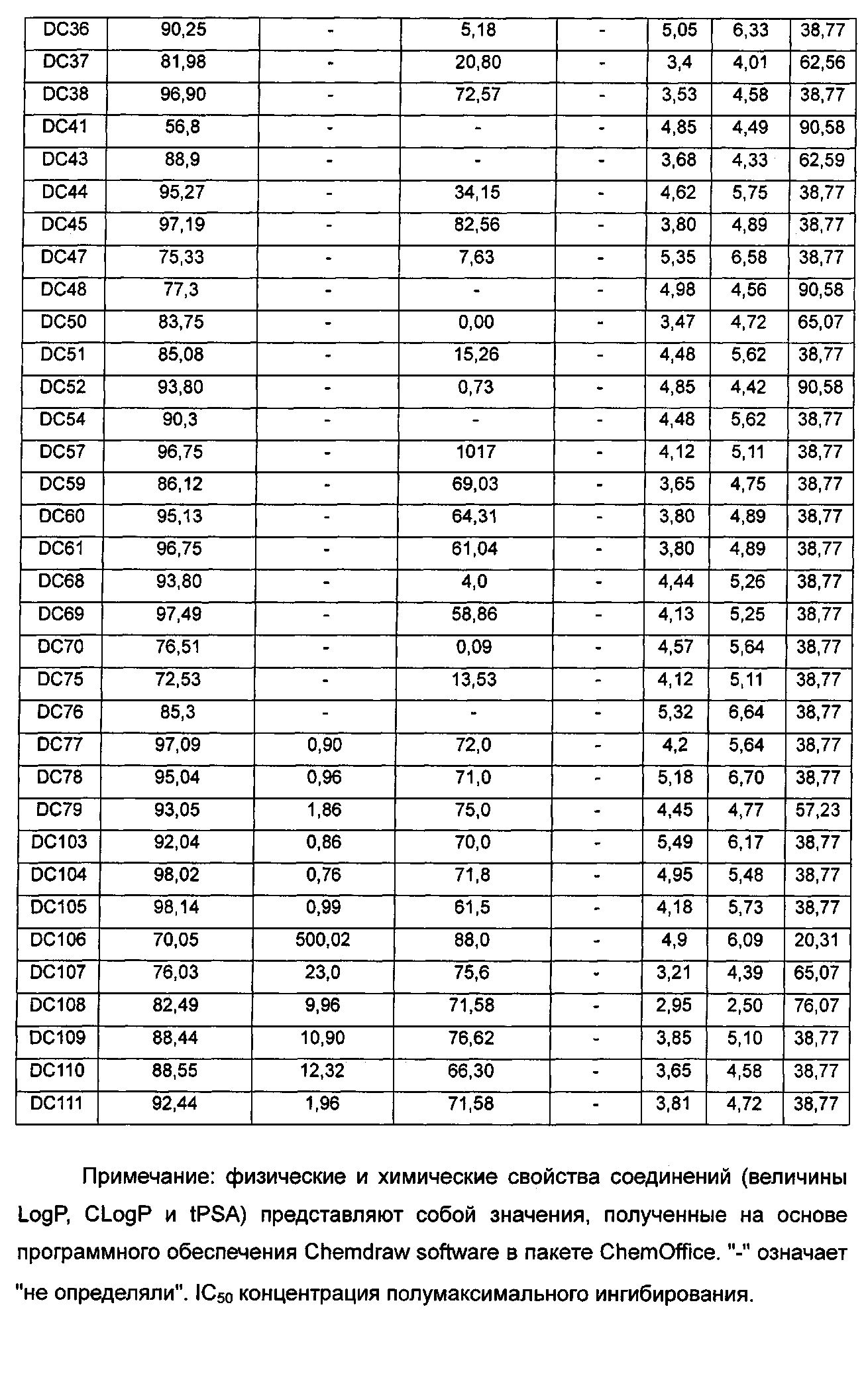
Заключение: лекарственное средство Е2020, имеющееся в продаже, использовали в качестве положительного контроля в оценке биологической активности. Доля ингибирования ацетилхолинэстеразы составила 77% и значение IC50 составило 2,0 нМ. На основе данных, полученных из вышеуказанной таблицы, можно видеть, что процентные доли ингибирования большинства вновь синтезированных соединений превосходили доли ингибирования для используемого в качестве положительного контроля соединения Е2020, где почти 30 соединений могут достигать доли ингибирования более чем 90%, которая гораздо превышает долю для Е2020. Значения IC50 для множества соединений в отношении ацетилхолинэстеразы составляли меньше чем 1 нМ и были значительно лучше, чем для используемого в качестве положительного контроля лекарства Е2020 (IC50 2 нМ). Кроме того, физические и химические свойства (LogP, CLogP и tPSA и т.п.) этих соединений сравнимы со свойствами используемого в качестве положительного контроля лекарственного средства и также могут быть использованы в качестве лекарственного средства.
Экспериментальный пример 2
Острые токсичности некоторых соединений общей формулы I определяли в отношении мышей, и данные представлены в таблице 2.
Приготовление образца: при получении образцы не растворяли. Добавляли 5% DMSO и встряхивали достаточным образом для растворения образцов. Затем добавляли 1% EL (полиоксиэтилированное касторовое масло) в качестве сорастворителя, и воду использовали для доведения оставшегося объема с получением образца с концентрацией 10 мг/мл. Образцы представляли собой суспензии.
Экспериментальные животные: мыши КМ (линии Крушинского-Молодкиной), 22-29 г, половина самцов и половина самок.
Экспериментальный способ: мышей произвольным образом распределяли на группы. 100 мг/кг тестируемых соединений DC19 и DC20 соответственно вводили перорально. Равное количество 5% раствора DMSO и 1% раствора EL вводили в группу с растворителем в качестве контроля. После введения, за мышами наблюдали в отношении присутствия или отсутствия значительных побочных действий или смерти.
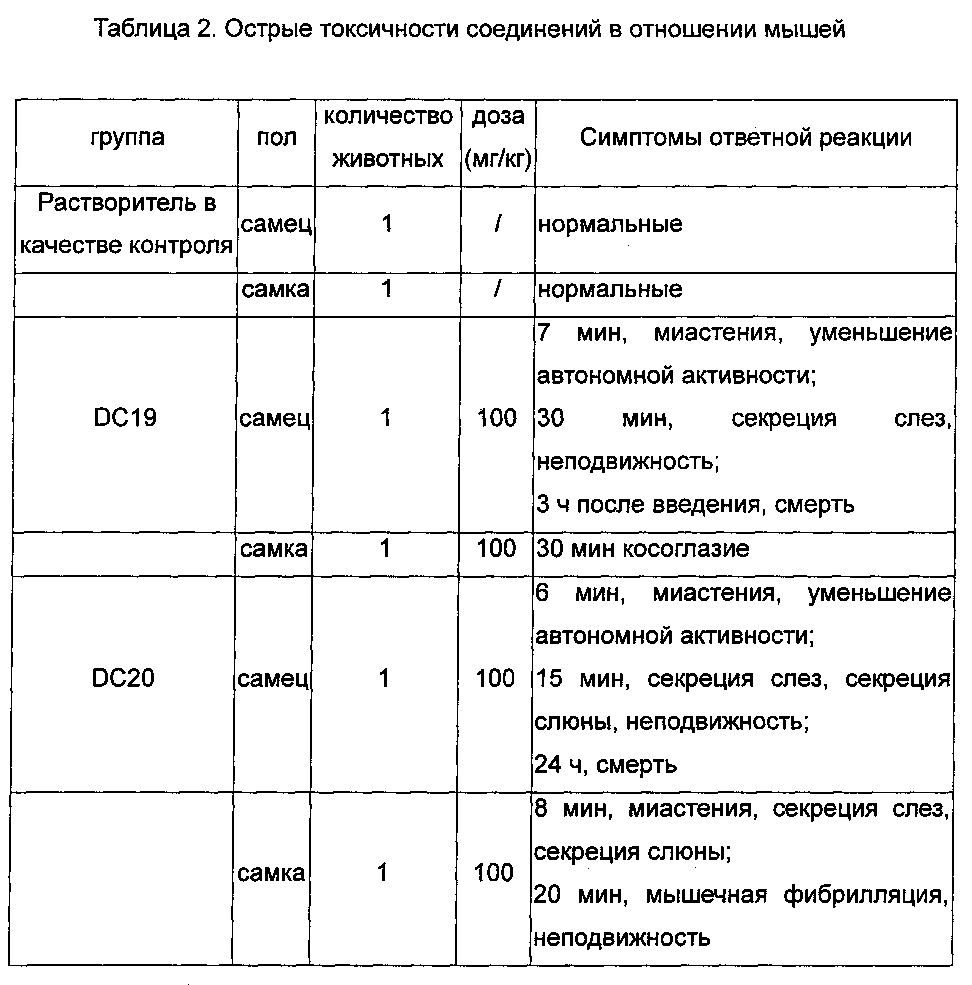
Заключение об эксперименте: После введения высоких доз образцов проявлялись некоторые явления, такие как миастения, секреция слез и секреция слюны и т.д., вызванные ингибитором ацетилхолинэстеразы у мышей в каждой группе. Результаты продемонстрировали, что соединения по настоящему изобретению могут проникать через гематоэнцефалический барьер и действовать на ацетилхолинэстеразу в головном мозге, таким образом, играя роль в лечении старческой деменции.
Экспериментальный пример 3
Определяли ингибирующие действия in vivo некоторых соединений общей формулы I и донепезила (донепезил, положительный контроль, приобретенный в компании sigma) в отношении ацетилхолинэстеразы коры головного мозга и гиппокампа мышей.
Приготовление образца: при получении образцы не растворяли. Добавляли 5% DMSO и встряхивали достаточным образом для растворения образцов. Затем добавляли 1% EL (полиоксиэтилированное касторовое масло) в качестве сорастворителя, и воду использовали для доведения оставшегося объема с получением образца с концентрацией 10 мг/мл. Образцы разбавляли постепенно до 0,3 мг/мл, 1 мг/мл и 3 мг/мл. Образцы представляли собой суспензии. Образцы вводили перорально в соответствии с отношением объема к массе 0,1 мл/10 г. Равное количество 5% раствора DMSO и 1% раствора EL перорально вводили в группу с растворителем в качестве контроля.
Экспериментальные способы и материалы
(1) Ацетилхолинэстераза: кора головного мозга и гиппокамп мышей. Через 1 ч после перорального введения мышей декапитировали. После извлечения головного мозга гиппокамп и кору головного мозга быстро нарезали на льду. К коре головного мозга добавляли охлажденный на льду 75 мМ PBS (физиологический раствор, забуференный фосфатом), и гомогенизировали с получением 30× тканевого гомогената, и к гиппокампу добавляли охлажденный на льду 75 мМ PBS, и гомогенизировали с образованием 40× тканевого гомогената. И, наконец, добавляли 1/10 по объему ОМРА и помещали на лед для тестирования.
(2) Методика теста: к образцам добавляли реакционную систему, содержащую PBS, H2O, S-Ach и DTNB (5,5′-дитиобис-(2-нитробензойную кислоту)). За исключением пробирки в качестве отрицательного контроля в остальные пробирки добавляли подходящее количество фермента. Реакцию осуществляли при комнатной температуре в течение 20 минут. SDS (додецилсульфат натрия) добавляли в каждую пробирку для гашения реакции. Подходящее количество фермента добавляли, в пробирку в качестве отрицательного контроля. Поглощение в каждой пробирке определяли при помощи спектрофотометра, работающего в УФ/видимом спектре (оптическая плотность (OD) 440 нм).
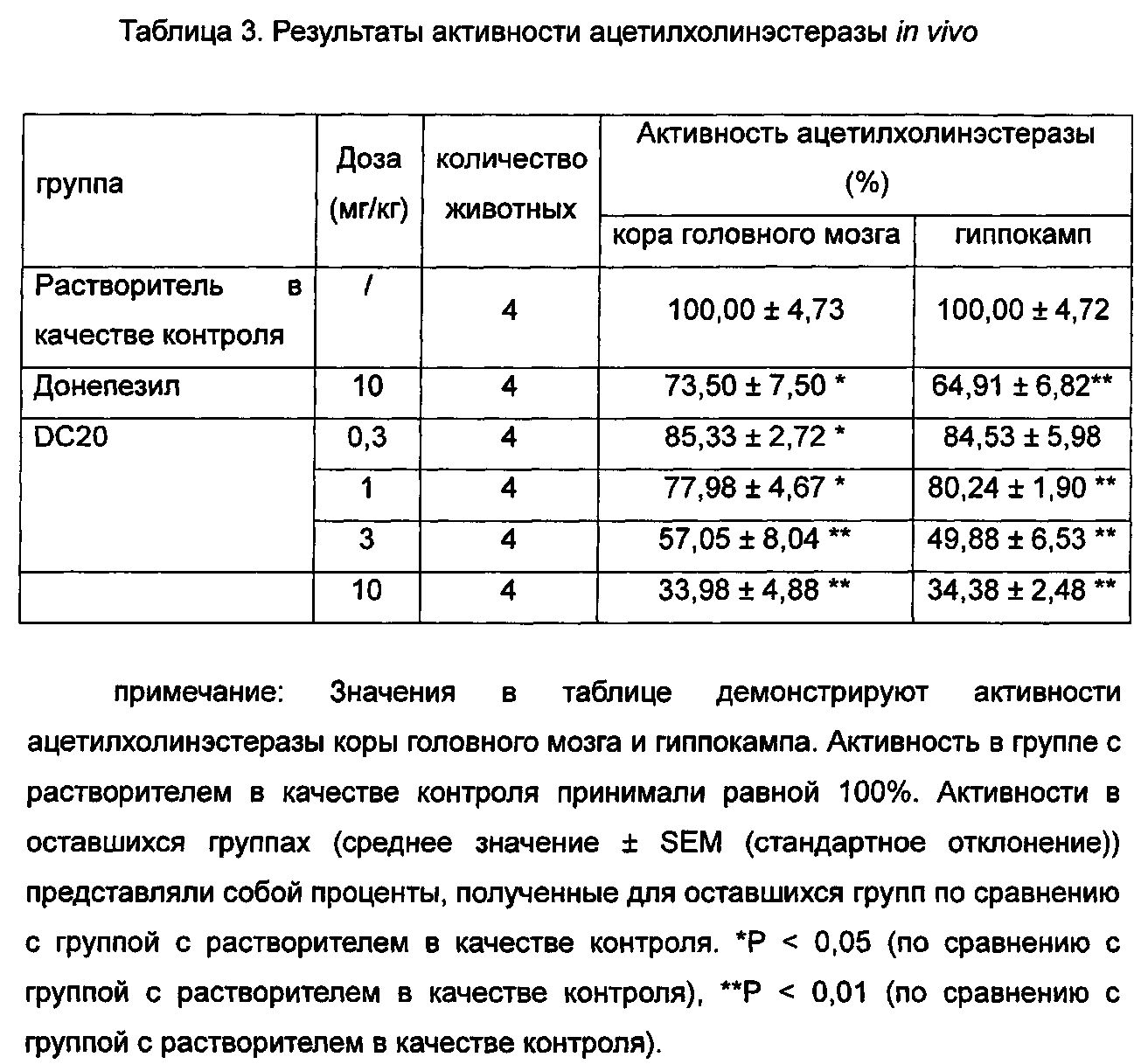
Экспериментальное заключение:
Активности 0,3 мг/кг, 1 мг/кг, 3 мг/кг и 10 мг/кг соединения DC20 в отношении ацетилхолинэстеразы коры головного мозга составляли 85,33%, 77,98%, 57,05% и 33,98%, соответственно, и соединение DC20 позволяло достичь ингибирования на 14,67%, 22,02%, 42,95% и 66,02% по сравнению с группой с растворителем в качестве контроля. Активности 0,3 мг/кг, 1 мг/кг, 3 мг/кг и 10 мг/кг соединения DC20 в отношении ацетилхолинэстеразы гиппокампа составляли 84,53%, 80,24%, 49,88% и 34,38%, соответственно, и соединение DC20 позволяло достичь ингибирования на 15,47%, 19,76%, 50,12% и 65,62% по сравнению с группой с растворителем в качестве контроля.
1 мг/кг, 3 мг/кг и 10 мг/кг DC20 демонстрировали значимые ингибирующие действия в отношении как ацетилхолинэстеразы коры головного мозга мышей, так и ацетилхолинэстеразы гиппокампа мышей.
Ингибирующие действия 1 мг/кг DC20 в отношении AChE коры головного мозга и гиппокампа мышей были сравнимы с действиями 10 мг/кг лекарства донепезила в качестве положительного контроля. Таким образом, общая активность соединения DC20 была лучше, чем активность донепезила.
Экспериментальный пример 4
Определяли ингибирующие действия мономеров некоторых соединений общей формулы I (R-изомер, S-изомер) и донепезила (положительный контроль) в отношении ацетилхолинэстеразы коры головного мозга и гиппокампа мышей.
Приготовление образца: добавляли 5% DMSO и встряхивали достаточным образом для растворения образцов. Затем добавляли 1% EL (полиоксиэтилированное касторовое масло) в качестве сорастворителя, и воду использовали для доведения оставшегося объема с получением образца с концентрацией 10 мг/мл. Образцы разбавляли постепенно до 1 мг/мл и 0,1 мг/мл. Образцы вводили перорально в соответствии с отношением объема к массе 0,1 мл/10 г. Равное количество 5% раствора DMSO и 1% раствора EL перорально вводили в группу с растворителем в качестве контроля.
Экспериментальные способы и материалы
(1) Ацетилхолинэстераза: кора головного мозга и гиппокамп мышей. Через 1 ч после перорального введения мышей декапитировали. После извлечения головного мозга гиппокамп и кору головного мозга быстро нарезали на льду. К коре головного мозга добавляли охлажденный на льду 75 мМ PBS, и гомогенизировали с получением 30× тканевого гомогената, и к гиппокампу добавляли охлажденный на льду 75 мМ PBS, и гомогенизировали с образованием 40× тканевого гомогената. И, наконец, добавляли 1/10 по объему ОМРА и помещали на лед для тестирования.
(2) Методика теста: К образцам добавляли реакционную систему, содержащую PBS, Н2O, S-Ach и DTNB. За исключением пробирки в качестве отрицательного контроля в остальные пробирки добавляли подходящее количество фермента. Реакцию осуществляли при комнатной температуре в течение 20 минут. SDS добавляли в каждую пробирку для гашения реакции. Подходящее количество фермента добавляли в пробирку в качестве отрицательного контроля. Поглощение в каждой пробирке определяли при помощи спектрофотометра, работающего в УФ/видимом спектре (ОП 440 нм).
Получены следующие экспериментальные результаты.
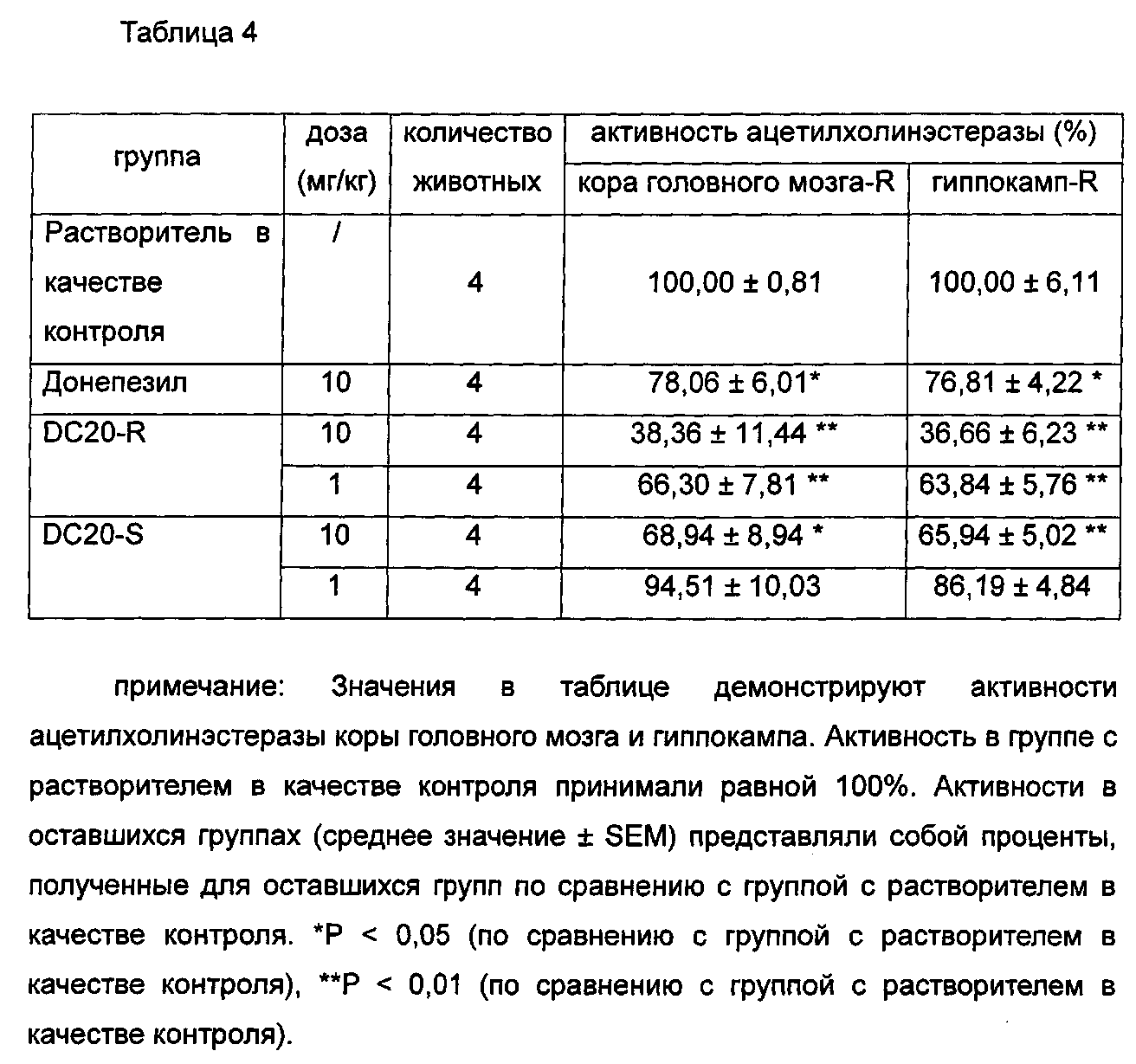
Экспериментальное заключение:
Активности 10 мг/кг и 1 мг/кг соединения DC20-R в отношении ацетилхолинэстеразы коры головного мозга составляли 38,36% и 66,30%, соответственно, и соединение DC20-R позволяло достичь ингибирования на 61,64% и 33,70% по сравнению с группой с растворителем в качестве контроля. Активности 10 мг/кг и 1 мг/кг соединения DC20-R в отношении ацетилхолинэстеразы гиппокампа составляли 36,66% и 63,84%, соответственно, и соединение позволяло достичь ингибирования на 63,34% и 36,16% по сравнению с группой с растворителем в качестве контроля. 10 мг/кг и 1 мг/кг DC20-R демонстрировали значимые ингибирующие действия в отношении как ацетилхолинэстеразы коры головного мозга мышей, так и ацетилхолинэстеразы гиппокампа мышей.
Активности 10 мг/кг и 1 мг/кг соединения DC20-S в отношении ацетилхолинэстеразы коры головного мозга составляли 68,94% и 94,51%, соответственно, и соединение DC20-S позволяло достичь ингибирования на 31,06% и 5,49% по сравнению с группой с растворителем в качестве контроля. Активности 10 мг/кг и 1 мг/кг соединения DC20-S в отношении ацетилхолинэстеразы гиппокампа составляли 65,94% и 86,19%, соответственно, и соединение позволяло достичь ингибирования на 34,06% и 13,81% по сравнению с группой с растворителем в качестве контроля. 10 мг/кг DC20-S демонстрировали значимые ингибирующие действия в отношении как ацетилхолинэстеразы коры головного мозга мышей, так и ацетилхолинэстеразы гиппокампа мышей.