Результат интеллектуальной деятельности: СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ ПЕНТА-N-АЦЕТИЛХИТОПЕНТАОЗЫ И ГЕКСА-N-АЦЕТИЛХИТОГЕКСАОЗЫ
Вид РИД
Изобретение
Изобретение относится к области биохимического синтеза, а непосредственно к способу получения хитоолигосахаридов. Известен способ получения хитоолигосахаридов путем фрагментации биополимера хитина, выделенного из природных источников (панцири ракообразных, кутикула насекомых, клеточные стенки грибов) (Cabrera J.C., Van Cutsem P. Preparation of chitooligosaccharides with degree of polymerization higher than 6 by acid or enzymatic degradation of chitosan // Biochemical engineering Journal. 2005. V.25. P.165-172). Недостатками известного способа являются его высокая стоимость и трудоемкость, поскольку он предполагает очистку, фракционирование и последующее определение структуры полученных продуктов. Известен способ получения хитоолигосахаридов посредством химического синтеза (Boons G.J. Strategies in oligosaccharide synthesis // Tetrahedron. 1996. V.52. P.1095-1121). Недостатками известного способа являются многоэтапность процесса синтеза, а также необходимость стабилизировать полученные промежуточные продукты синтеза, что делает нецелесообразным получение хитоолигосахаридов со степенью полимеризации более трех остатков N-ацетилглюкозамина. Наиболее близким предлагаемому изобретению является способ получения хитоолигосахаридов, заключающийся в биосинтезе с помощью генетически модифицированных бактерий Escherichia coli, несущих плазмиду с клонированным геном NodC, который кодирует рекомбинантный фермент N-ацетилглюкозаминилтрансферазу бактерий Azorhizobium caulidans, Rhizobium leguminosarum, Rhizobium meliloti, который принимается за прототип (US №20090082307, М.кл. A61K 31/715, C12P 19/18, A01N 43/04, A61P 3/10, A61P 9/00, A61P 31/04, A61P 31/12, A61P 25/00, A61P 35/00, A01P 21/00, C07H 1/00, 2009). Недостатком известного способа является невозможность получения олигомеров хитина, состоящих более чем из четырех остатков N-ацетилглюкозамина.
Решаемая изобретением задача - биологический синтез более длинных олигомеров хитина с помощью фермента N-ацетилглюкозаминилтрансферазы, кодируемого геном NodC почвенной бактерии Rhizobium sp. GRH2. Заявленный способ позволяет осуществить биосинтез олигомеров хитина с определенной химической структурой - пента-N-ацетилхитопентаозы и гекса-N-ацетилхитогексаозы - in vivo из предшественника N-ацетилглюкозамина в клетках Escherichia coli DH5α с помощью рекомбинантного фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2.
Поставленная задача решается тем, что способ ферментативного получения пента-N-ацетилхитопентаозы и гекса-N-ацетилхитогексаозы из предшественника N-ацетилглюкозамина в культуре бактерий Escherichia coli DH5α с помощью экспрессируемого в клетках этих бактерий рекомбинантного фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2 отличается тем, что при биосинтезе in vivo получают олигомеры хитина, состоящие из пяти и шести остатков N-ацетилглюкозамина, для осуществления биосинтеза in vivo олигомеров хитина проводят выделение, клонирование и экспрессию в Escherichia coli DH5α гена NodC Rhizobium sp. GRH2, кодирующего N-ацетилглюкозаминилтрансферазу, амплификацию гена NodC осуществляют с помощью специфичных (подходящих для последовательности гена NodC Rhizobium sp. GRH2) праймеров и Pfu-полимеразы, в качестве матрицы для амплификации гена NodC используют ДНК, выделенную из штамма Rhizobium sp. GRH2, в результате получают продукт амплификации размером 1300 п.о., амплифицированный ген NodC Rhizobium sp. GRH2 клонируют в векторе pUC19 с сохранением рамки считывания, таким образом, получают плазмиду pUC19-NodC, содержащую полноразмерный ген NodC, кодирующий N-ацетилглюкозаминилтрансферазу, и используют полученную плазмиду для экспрессии гена NodC в бактериях Escherichia coli DH5α, экспрессию N-ацетилглюкозаминилтрансферазы (NodC) осуществляют в штамме Escherichia coli DH5α после индукции изопропил-β-D-тиогалактозидом, при культивировании бактерий Escherichia coli DH5α, несущих плазмиду pUC19-NodC со встроенным геном NodC Rhizobium sp. GRH2, в присутствии предшественника N-ацетилглюкозамина синтезируют пента-N-ацетилхитопентаозу и гекса-Н-ацетилхитогексаозу, с помощью метода масс-спектрометрии осуществляют анализ синтезированных веществ, который подтверждает, что синтезированные вещества являются пента-N-ацетилхитопентаозой и гекса-N-ацетилхитогексаозой.
Заявителем не выявлены источники информации, содержащие сведения о технических решениях, идентичных заявленному изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Предлагаемый способ ферментативного получения олигомеров хитина обеспечивает биологический синтез более длинных олигомеров хитина с помощью фермента N-ацетилглюкозаминилтрансферазы ризобий Rhizobium sp. GRH2. Заявленный способ позволяет осуществить биосинтез олигомеров хитина с определенной химической структурой - пента-N-ацетилхитопентаозы и гекса-N-ацетилхитогексаозы - in vivo из предшественника N-ацетилглюкозамина в клетках Escherichia coli DH5α. Поставленная задача решается тем, что ферментативный синтез пента-N-ацетилхитопентаозы и гекса-N-ацетилхитогексаозы осуществляют из предшественника N-ацетилглюкозамина в культуре бактерий Escherichia coli с помощью рекомбинантного фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2, контролирующего синтез этих соединений. Сущность заявленного способа поясняется с помощью рисунков:
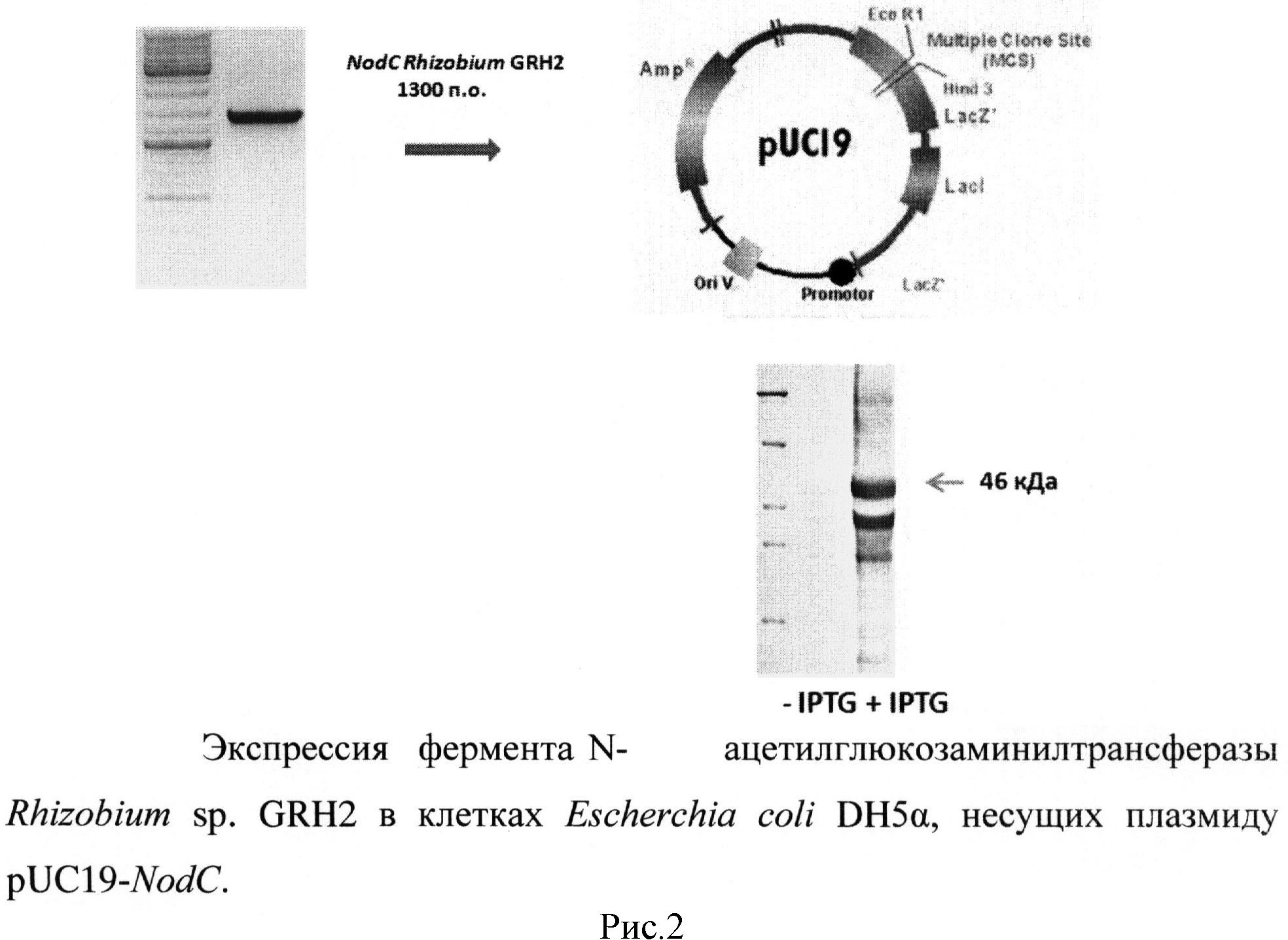
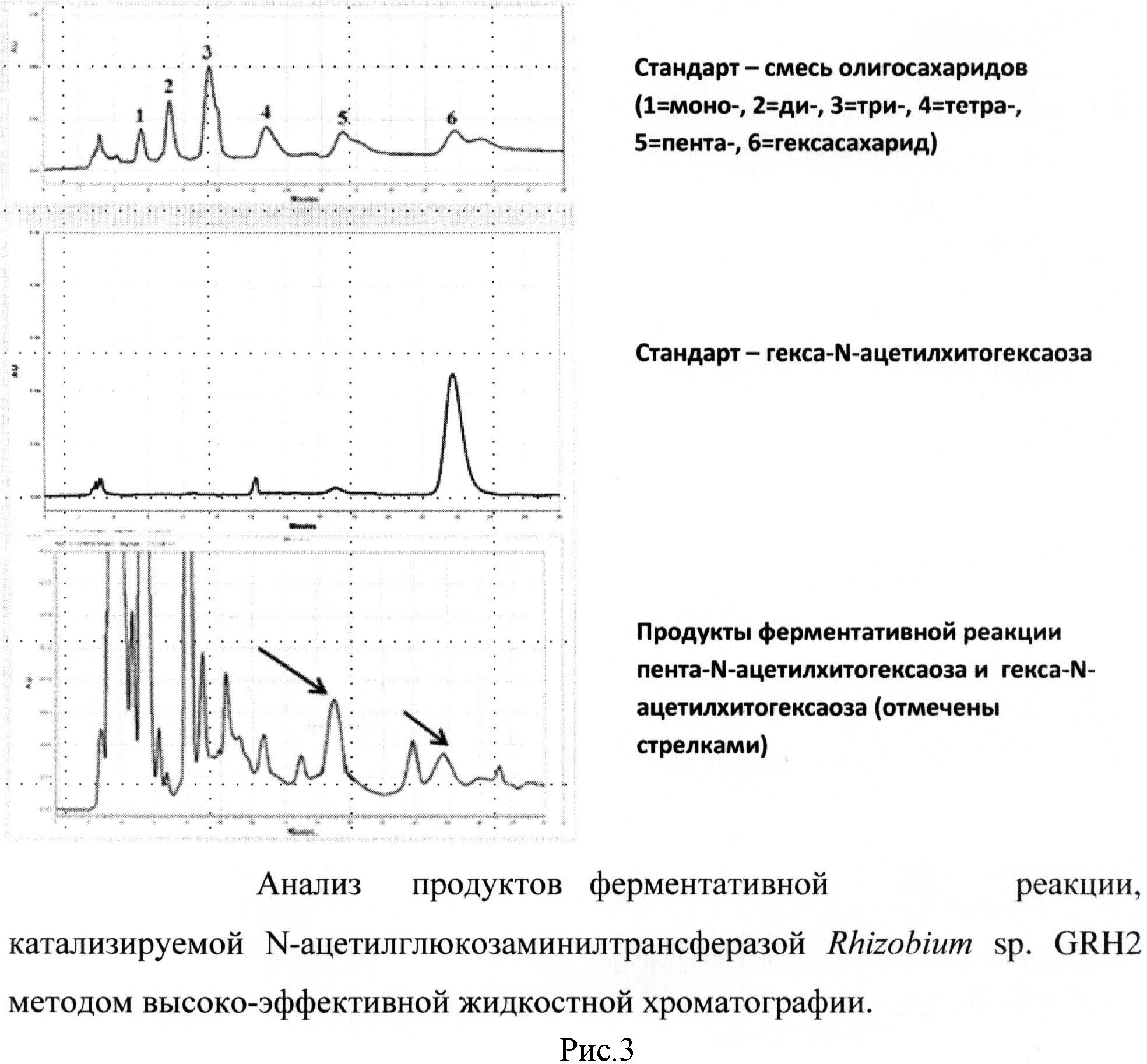
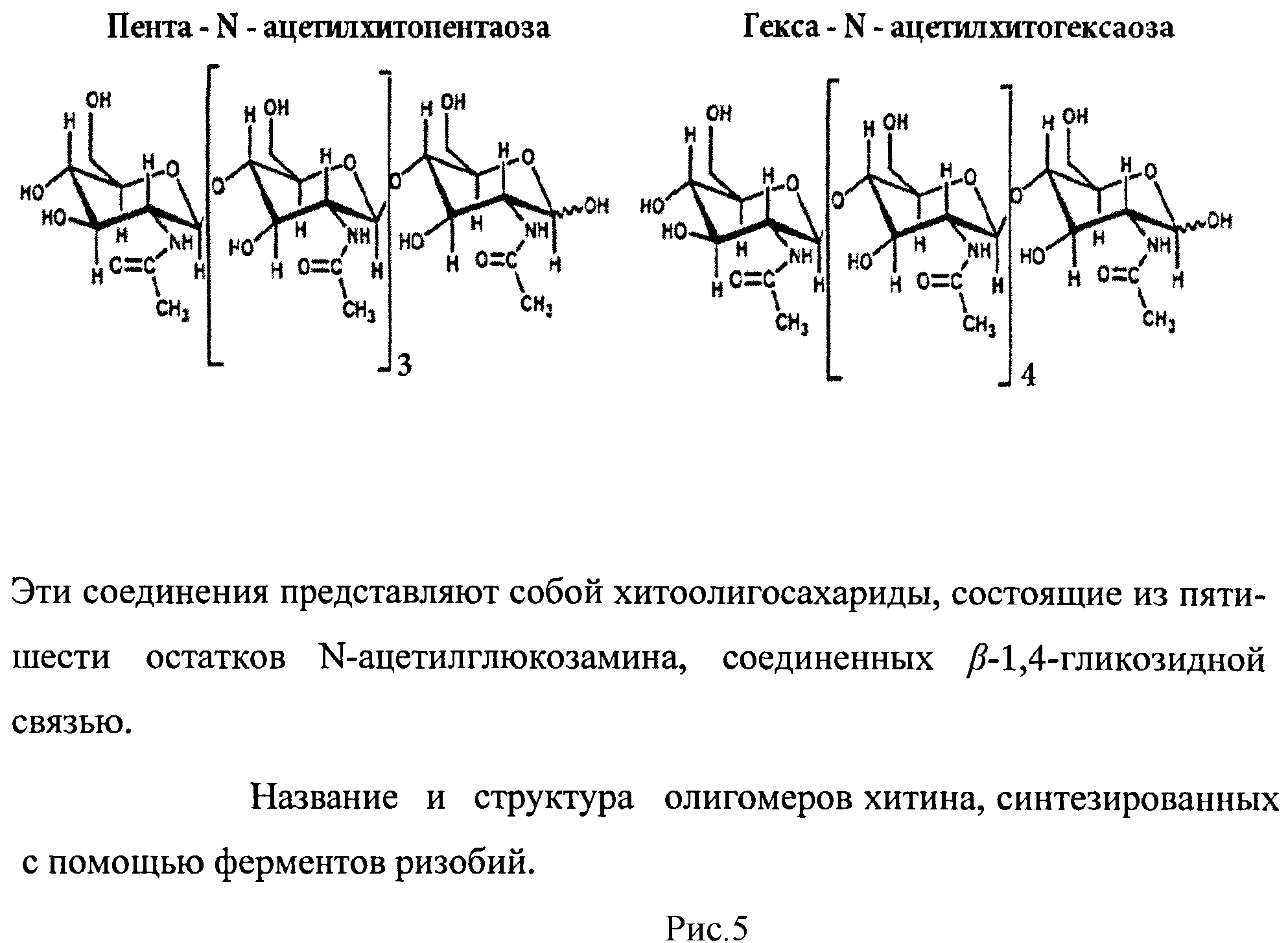
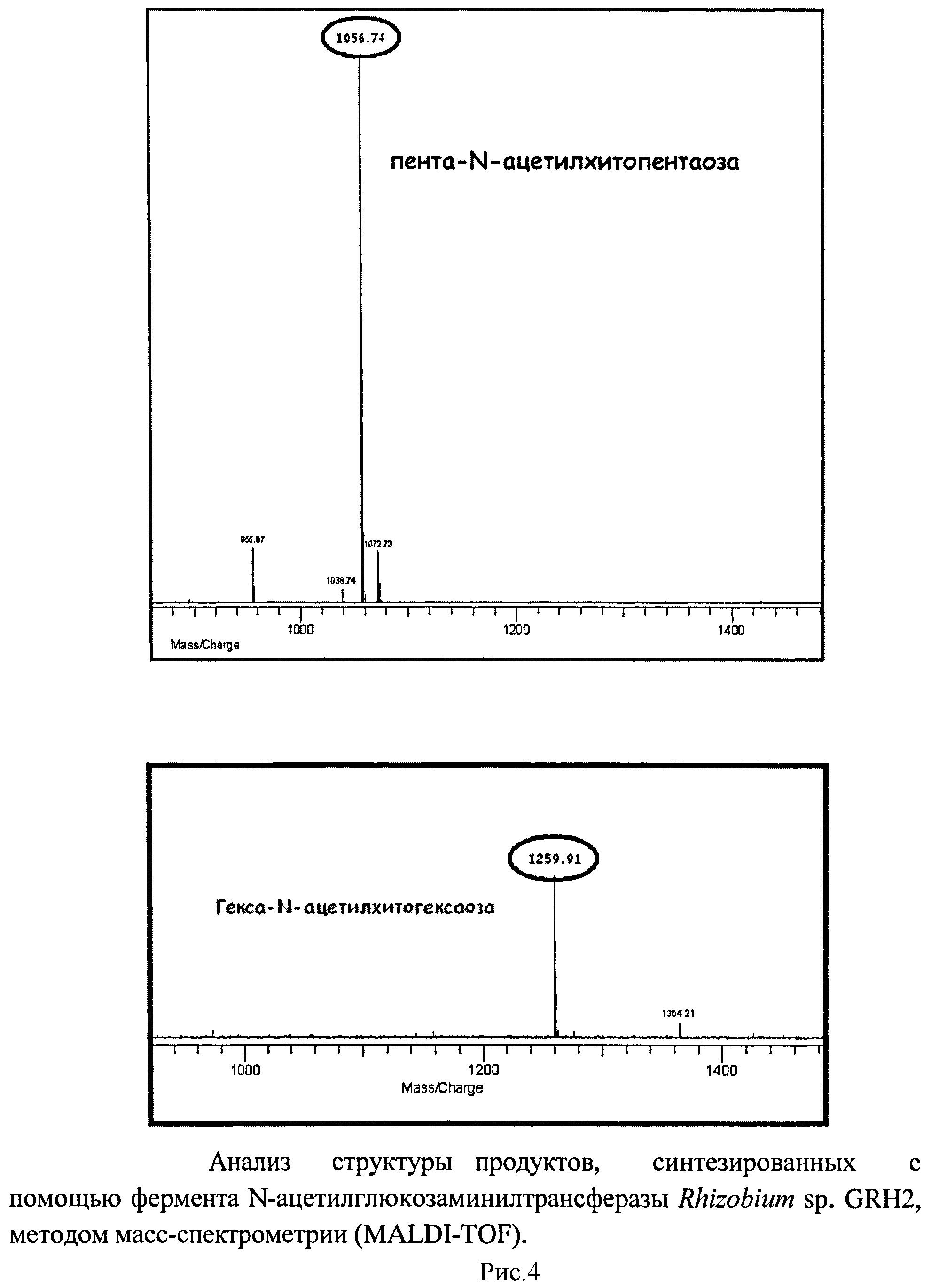
рисунок 1. Амплификация гена NodC Rhizobium sp. GRH2, кодирующего N-ацетилглюкозаминилтрансферазу, рисунок 2. Экспрессия фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2 в клетках Escherchia coli DH5α, несущих плазмиду pUC19-NodC, рисунок 3. Анализ продуктов ферментативной реакции, катализируемой N-ацетилглюкозаминилтрансферазой Rhizobium sp. GRH2 методом высокоэффективной жидкостной хроматографии, рисунок 4. Анализ структуры продукта, синтезированного с помощью фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2, методом масс-спектрометрии (MALDI-TOF), рисунок 5. Название и структура олигомеров хитина, синтезированных с помощью ферментов ризобий.
Предлагаемый способ включает биосинтез in vivo из предшественника N-ацетилглюкозамина в культуре бактерий Escherichia coli DH5α с помощью рекомбинантного фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2, контролирующего синтез этих соединений, отличается тем, что при биосинтезе используют фермент, контролирующий синтез олигомеров, состоящих из пяти и шести остатков N-ацетилглюкозамина. Для осуществления биосинтеза олигомеров хитина проводят выделение, клонирование и экспрессию в Escherichia coli DH5α гена NodC Rhizobium sp. GRH2, кодирующего N-ацетилглюкозаминилтрансферазу, амплификацию гена NodC осуществляют с помощью специфичных (подходящих для последовательности гена NodC Rhizobium sp. GRH2) праймеров и Pfu-полимеразы, в качестве матрицы для амплификации гена NodC используют ДНК, выделенную из штамма Rhizobium sp. GRH2, в результате получают продукт амплификации размером 1300 п.о. (рисунок 1), амплифицированный ген NodC Rhizobium sp. GRH2 (NodC) клонируют в векторе pUC19 по сайтам BamH и EcoR1 с сохранением рамки считывания, таким образом, получают плазмиду pUC 19-NodC, содержащую полноразмерный ген NodC, кодирующий N-ацетилглюкозаминилтрансферазу, и используют полученную плазмиду для экспрессии гена NodC в бактериях Escherichia coli DH5α, экспрессию N-ацетилглюкозаминилтрансферазы (NodC) осуществляют в штамме Escherichia coli DH5α после индукции изопропил-β-D-тиогалактозидом (рисунок 2), при культивировании бактерий Escherichia coli DH5α, несущих плазмиду pUC19-AWC со встроенным геном NodC Rhizobium sp. GRH2, в присутствии предшественника N-ацетилглюкозамина синтезируют пента-N-ацетилхитопентаозу и гекса-N-ацетилхитогексаозу (рисунок 3), с помощью метода масс-спектрометрии осуществляют анализ синтезированных веществ (рисунок 4), который подтверждает, что синтезированные вещества являются пента-N-ацетилхитопентаозой и гекса-N-ацетилхитогексаозой (рисунок 5).
Указанные обстоятельства, по мнению заявителя, подтверждают соответствие заявленного технического решения критерию «изобретательский уровень».
Возможность реализации предлагаемого изобретения подтверждается проведенными экспериментами и иллюстрируется следующими примерами.
Пример 1
1.1. Конструирование экспрессионной плазмиды
Для конструирования экспрессионной плазмиды pUC19-AWC последовательность гена NodC Rhizobium sp. GRH2, кодирующую N-ацетилглюкозаминилтрансферазу, амплифицировали методом полимеразной цепной реакции с использованием специфичных праймеров 5′-GG GGATCC GATGGACCTGCTCAACACAATCG-3′ и 5′-GG GAATTC TCAGTCGTCGCTGTAGACACCG-3′, в состав которых вводили сайты узнавания эндонуклеаз рестрикции BamHI и EcoRI. Для амплификации использовали ризобиальную ДНК штамма ризобий Rhizobium sp. GRH2. Продукт амплификации очищали с помощью набора GIAEX II Gel Extraction Kit и клонировали в плазмиду pUC19 с использованием соответствующих эндонуклеаз рестрикции и Т4 ДНК-лигазы.
1.2. Условия для экспрессии ферментов в клетках Escherichia coli DH5α
Экспрессию рекомбинантного фермента N-ацетилглюкозаминилтрансферазы ризобий Rhizobium sp. GRH2 осуществляли в клетках Escherichia coli DH5α. Клетки штамма Escherichia coli DH5α трансформировали плазмидой pUC19-NodC. Несколькими свежими рекомбинантными колониями инокулировали 100-500 мл среды LB - 10 г/л триптона, 5 г/л дрожжевого экстракта, 5 г/л NaCl (pH 7.0), содержащей ампициллин (100 мкг/мл) и растили при температуре 37°C, 220 об/мин на орбитальном шейкере до достижения культурой оптической плотности OD600=0,6. Экспрессию гена рекомбинантного белка индуцировали добавлением изопропил-β-D-тиогалактозида до конечной концентрации 1 мМ.
Пример 2
2.1. Синтез хитоолигосахаридов
Для синтеза хитоолигосахаридов бактериальную культуру выращивали в среде LB при температуре 37°C с добавлением ампициллина в концентрации 100 мг/л до достижения оптической плотности ОП600=0,6, затем производили индукцию экспрессии белка посредством добавления изопропил-β-D-тиогалактозида. Далее в качестве источника углерода добавляли глицерол в концентрации 160 г/л и N-ацетилглюкозамин в концентрации 1 г/л в качестве субстрата для синтеза хитоолигосахаридов. Синтез хитоолигосахаридов осуществляли в клетках Escherichia coli DH5α. Выделение и очистку хитоолигосахаридов проводили из 100 мл 24- или 48-часовой бактериальной культуры. Клетки были осаждены в течение 20 минут при 3000 g, затем ресуспендированы в маленьком объеме (2 мл) и подвергнуты кипячению в течение 30 минут. При этом происходил выход синтезированных хитоолигосахаридов в культуральную среду. Хитоолигосахариды были адсорбированы на активированном угле в течение 20 минут. Смыв хитоолигосахаридов с угля проводили этиловым спиртом 50% и 70%.
2.2. Разделение и идентификация хитоолигосахаридов методом высокоэффективной жидкостной хроматографии и масс-спектрометрии
Идентификацию и разделение хитоолигосахаридов проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке с аминофазой SUPELCOSIL™ LC-NH2 с использованием в качестве жидкой фазы системы ацетонитрил : вода (70%:30%). Нами была показана возможность разделения хитоолигосахаридов с различной степенью полимеризации (пентамеров и гескамеров), а также разной степени ацетилирования. Структуру полученных соединений проверяли с помощью метода масс-спектрометрии.
Способ ферментативного получения пента-N-ацетилхитопентаозы и гекса-N-ацетилхитогексаозы из предшественника N-ацетилглюкозамина в культуре бактерий Escherichia coli DH5α с помощью экспрессируемого в клетках этих бактерий рекомбинантного фермента N-ацетилглюкозаминилтрансферазы Rhizobium sp. GRH2, отличается тем, что при биосинтезе in vivo получают олигомеры хитина, состоящие из пяти и шести остатков N-ацетилглюкозамина, для осуществления биосинтеза in vivo олигомеров хитина проводят выделение, клонирование и экспрессию в Escherichia coli DH5α гена NodC ризобий Rhizobium sp. GRH2, кодирующего N-ацетилглюкозаминилтрансферазу, амплификацию гена NodC осуществляют с помощью специфичных (подходящих для последовательностей генов NodC Rhizobium sp. GRH2) праймеров и Pfu-полимеразы, в качестве матрицы для амплификации гена NodC используют ДНК, выделенную из штамма Rhizobium sp. GRH2, амплифицированный ген NodC Rhizobium sp. GRH2 (NodC) клонируют в векторе pUC19 с сохранением рамки считывания, таким образом, получают плазмиду pUC19-NodC, содержащую полноразмерный ген NodC, кодирующий N-ацетилглюкозаминилтрансферазу, и используют полученную плазмиду для экспрессии гена NodC в бактериях Escherichia coli DH5α, при культивировании бактерий Escherichia coli DH5α, несущих плазмиду pUC19-NodC со встроенным геном NodC Rhizobium sp. GRH2, в присутствии предшественника N-ацетилглюкозамина синтезируют пента-N-ацетилхитопентаозу и гекса-N-ацетилхитогексаозу.