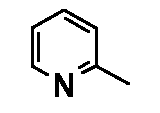
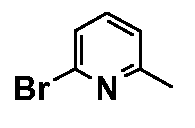
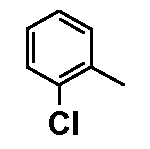
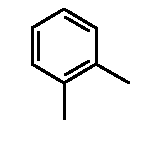
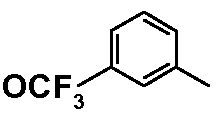
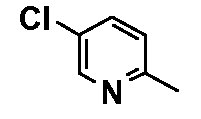
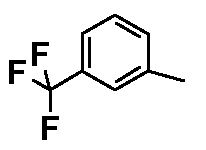
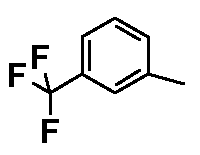
Результат интеллектуальной деятельности: ФЕНИЛАЛКИЛПИПЕРАЗИНЫ, МОДУЛИРУЮЩИЕ АКТИВНОСТЬ TNF
Вид РИД
Изобретение
Настоящее изобретение относится к новым фенилалкилпиперазинам, модулирующим активность TNF, к содержащим их фармацевтическим композициям и к способу их получения.
TNF-альфа является цитокином, который идентифицирован как медиатор иммунной системы, медиатор воспаления, медиатор клеточной пролиферации, фиброза и т.д. Этот медиатор в большом количестве находится в синовиальной ткани при воспалительном процессе и выполняет главную роль в патогенезе аутоиммунной системы (Annu. Rep. Med. Chem., 1997, 32:241-250).
В настоящее время обнаружено, что фенилалкилпиперазины обладают превосходной активностью в отношении модуляции активности TNF-альфа, более конкретно ингибирующей активностью.
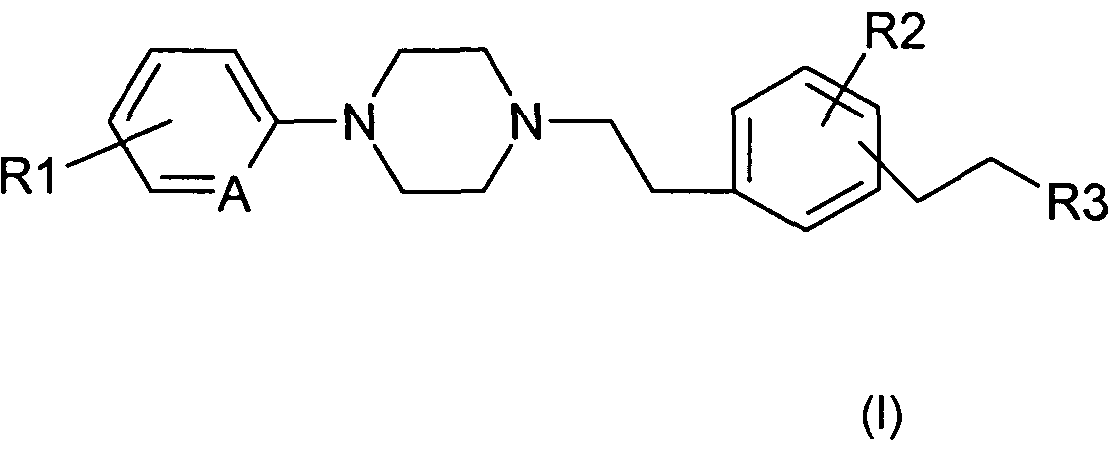
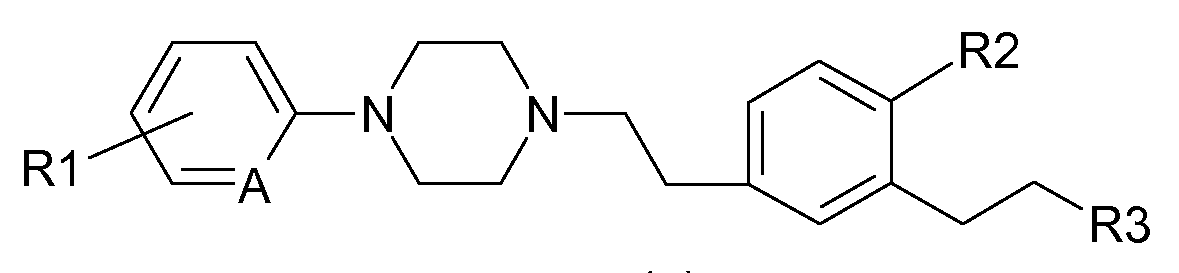
Таким образом, в соответствии с одним из своих аспектов, настоящее изобретение относится к фенилалкилпиперазинам формулы (I):
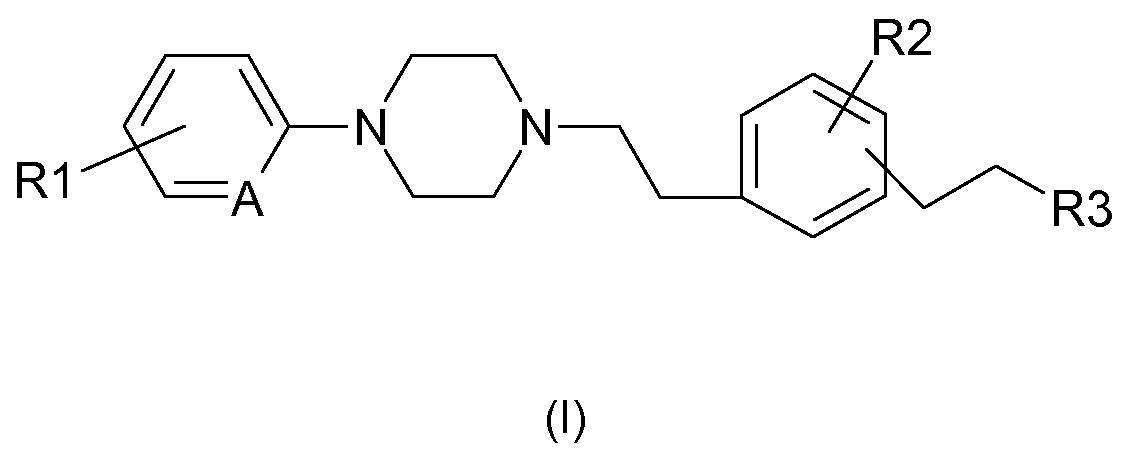
в которой:
и R1 и R2 обозначают независимо друг от друга атом водорода, атом галогена, (С1-С5) алкильную группу, (С1-С5)галогеналкильную группу, (С1-С2)перфторалкильную группу, (С1-С5)алкоксильную группу или (С1-С2)перфторалкоксильную группу;
- R3 обозначает (С1-С5)алкильную группу;
- А обозначает =СН- или =N-.
Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси, включая рацемические, составляют часть изобретения.
Соединения формулы (I) могут существовать в форме оснований или аддитивных солей с кислотами. Такие аддитивные соли составляют часть изобретения.
Эти соли могут быть получены с фармацевтически приемлемыми кислотами, но соли с другими кислотами, пригодными, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения.
Соединения формулы (I) могут существовать в форме N-оксидных производных. Так, соединения формулы (I) могут, в частности, нести одну или две N-оксидные группы на пиперазине. Несмотря на то, что в принципе оба указанных выше атома азота могут быть окислены, предпочтительны соединения, которые несут только одну N-оксидную группу.
В качестве другого объекта изобретения можно назвать соединения формулы (I), в которой:
- R1 обозначает (С1-С5)галогеналкильную группу, более конкретно (С1-С5)фторалкильную группу, (С1-С2)перфторалкильную группу; и/или
- R2 обозначает атом водорода или (С1-С5)алкильную группу;
в форме основания или аддитивной соли с кислотой.
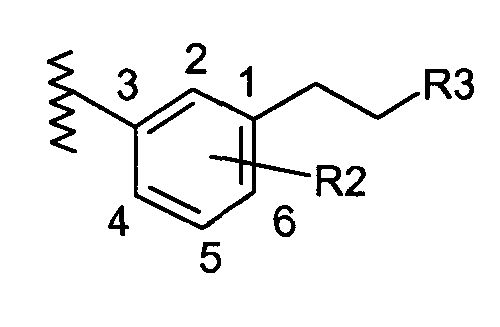
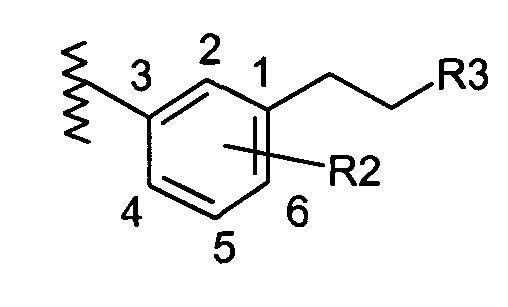
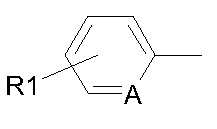
В соответствии с другим объектом изобретения пиперазин соединяется с фенильной группой с помощью этильной группы в положении 3:
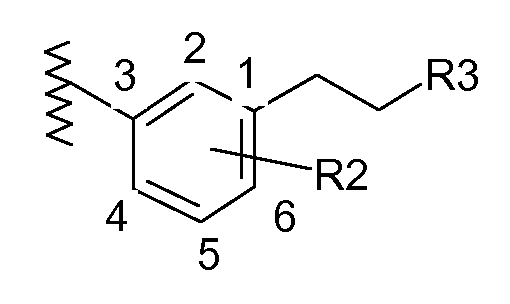 и/или
и/или
- R1 обозначает (С1-С2)перфторалкильную группу; и/или
- R2 обозначает атом водорода или (С1-С3)алкильную группу.
В качестве другого объекта изобретения можно назвать соединения формулы (I):
1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазин;
в форме основания или аддитивной соли с кислотой.
В качестве другого объекта изобретения можно назвать соединение формулы (I), выбранное из:
- соединения n°1: гемипамоат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°1 бис: гемипамоат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa в смеси с 0,5 молями свободной памоиновой кислоты;
- соединения n°2: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метокси-3-пентилфенил)-этил]пиперазинa;
- соединения n°3: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пропилфенил)-этил]пиперазинa;
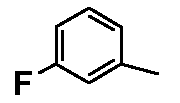
- соединения n°4: гидрохлорид 1-(3-фторфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°5: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метил-3-гептилфенил)-этил]пиперазинa;
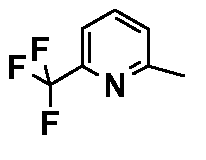
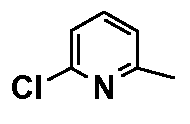
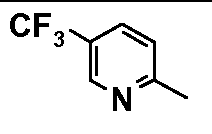
- соединения n°6: гидрохлорид 1-(6-трифторметилпирид-2-ил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°7: гидрохлорид 1-(3-фторфенил)-4-[2-(4-метокси-3-пентилфенил)-этил]пиперазинa;
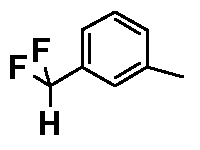
- соединения n°8: гидрохлорид 1-(3-дифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°9: гидрохлорид 1-(фенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°10: гидрохлорид 1-(3-метоксифенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
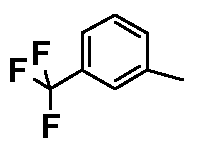
- соединения n°11: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метил-3-(2-метилбутил)фенил)-этил]пиперазинa;
- соединения n°12: гидрохлорид 1-(3-дифторметилфенил)-4-[2-(4-метокси-3-пентилфенил)-этил]пиперазинa;
- соединения n°13: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метокси-3-гептилфенил)-этил]пиперазинa;
- соединения n°14: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метил-3-гексилфенил)-этил]пиперазинa;
- соединения n°15: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метокси-3-пропилфенил)-этил]пиперазинa;
- соединения n°16: гидрохлорид 1-(фенил)-4-[2-(4-метокси-3-пентилфенил)-этил]пиперазинa;
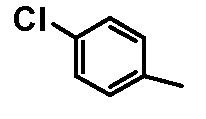
- соединения n°17: гидрохлорид 1-(4-хлорфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения nº18: гидрохлорид 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
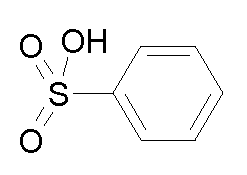
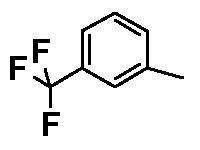
- соединения n°19: бензолсульфонат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
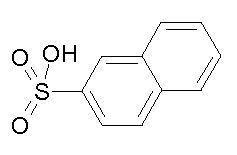
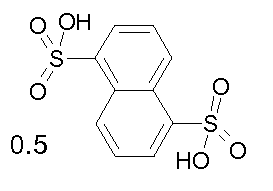
- соединения n°20: 2-нафталинсульфонат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
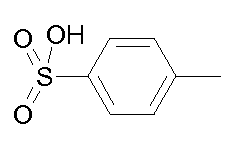
- соединения n°21: п-толилсульфонат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°22: геми-2,5-нафталиндисульфонат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
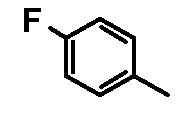
- соединения n°23: дигидрохлорид 1-(4-фторфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
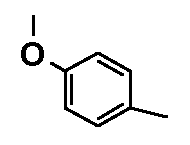
- соединения n°24: 1-(4-метоксифенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa, основание;
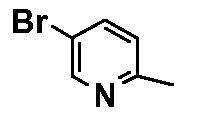
- соединения n°25: дигидрохлорид 1-(5-бромпиридин-2-ил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°26: дигидрохлорид 1-[2-(4-метил-3-пентилфенил)-этил]-4-(5-трифторметилпиридин-2-ил)-пиперазина;
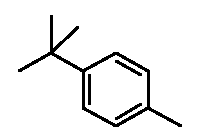
- соединения n°27: гидрохлорид 1-(4-трет.бутилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
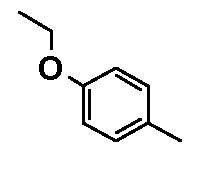
- соединения n°28: дигидрохлорид 1-(4-этоксифенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
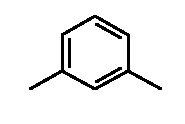
- соединения n°29: дигидрохлорид 1-[2-(4-метил-3-пентилфенил)-этил]-4-м-толилпиперазинa;
- соединения n°30: дигидрохлорид 1-[2-(4-метил-3-пентилфенил)-этил]-4-пиридин-2-илпиперазинa;
- соединения n°31: гидрохлорид 1-(6-бромпиридин-2-ил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°32: гидрохлорид 1-(2-хлорфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°33: гидрохлорид 1-(2-метилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°34: гидрохлорид 1-(3-трифторметоксилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°35: гидрохлорид 1-(5-хлорпиридин-2-ил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°36: оксалат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°37: фумарат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°38: сукцинат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa;
- соединения n°39: дигиппурат 1-(3-трифторметилфенил)-4-[2-(4-метил-3-пентилфенил)-этил]пиперазинa.
В объеме данного изобретения подразумевают под:
- атомом галогена: фтор, хлор, бром или иод;
- алкильной группой: насыщенную алифатическую группу, линейную или разветвленную. Например, (С1-С5)алкильную группу, содержащую 1-5 атомов углерода. В качестве примера можно назвать, более конкретно, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет.бутильную, пентильную, изопентильную, … группы;
- галогеналкильной группой: алкильную группу, которая определена выше, в которой один или несколько атомов водорода замещены атомом галогена, например фторалкильную группу, которая может содержать один или несколько атомов фтора;
- перфторалкильной группой: алкильную группу, которая определена выше, у которой все атомы водорода замещены атомом фтора;
- алкоксильной группой: -O-алкилную группу, в которой алкильная группа определена выше;
- перфторалкоксильной группой: алкоксигруппу, в которой все атомы водорода замещены атомом фтора.
Под «уходящей группой» в дальнейшем описании подразумевают группу, которая может быть легко отщеплена от молекулы гетеролитическим расщеплением связи с уходом электронной пары. Таким образом, эта группа может быть легко заменена на другую группу, например, в процессе реакции замещения. Такими уходящими группами, являются, например, галогены или активированная гидроксигруппа, такая как метансульфонатная, бензолсульфонатная, пара-толуолсульфонатная, трифлатная, ацетатная и т.д. группы. Примеры уходящих групп, а также способы их получения описаны в Advances in Organic Chemistry, J. March, 3rd Edition, Wiley Interscience, c.310-316.
Соединения формулы (I) могут быть получены согласно схеме 1:
Схема 1
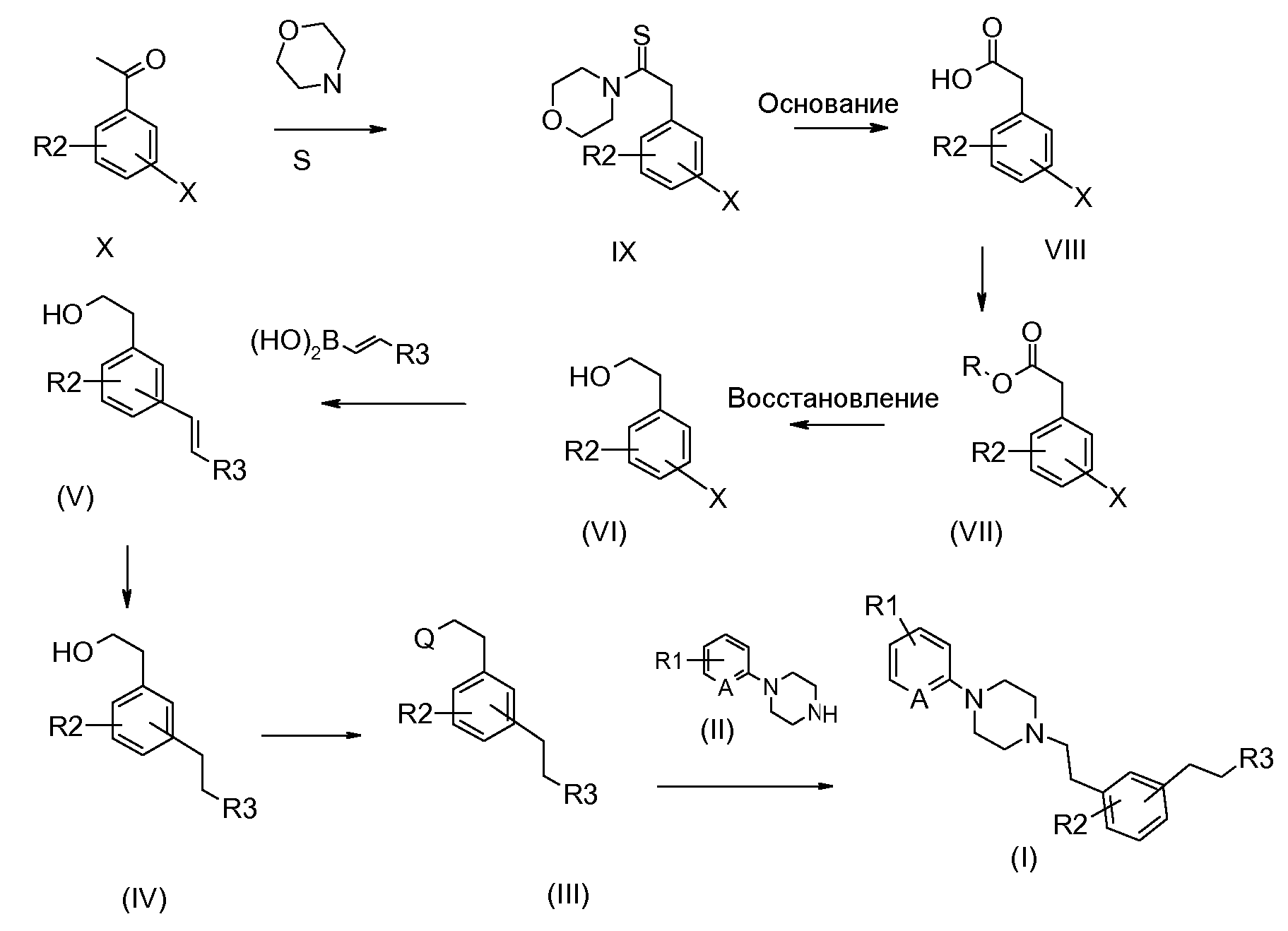
Следуя этой схеме соединения формулы (I) могут быть синтезированы путем конденсации соединения формулы (II):
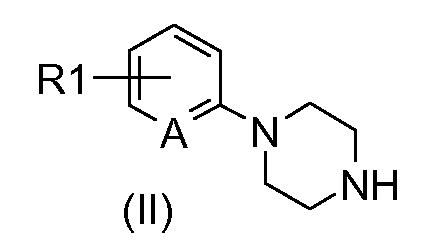
в которой R1 и А определены выше, с соединением формулы (III):
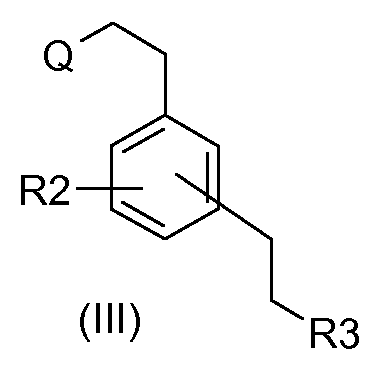
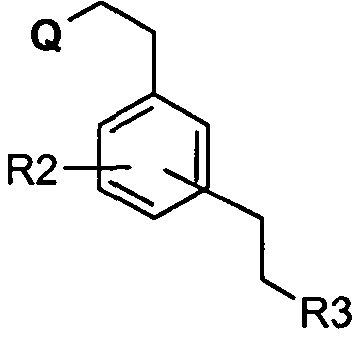
в которой R2 и R3 определены выше и Q является уходящей группой.
В качестве уходящей группы Q можно использовать, например, атом галогена или любую группу, способную конденсироваться с амином. Реакцию конденсации осуществляют традиционным способом смешивания исходных соединений (II) и (III) в органическом растворителе, таком как спирт, например метанол или бутанол, необязательно в присутствии основания, такого как карбонат щелочного металла, 4-диметиламинопиридин или триэтиламин, при температуре в интервале между комнатной температурой и температурой рефлюкса выбранного растворителя. Под комнатной температурой подразумевают температуру между 5 и 25°С.
Соединение формулы (III) получают превращением гидроксигруппы соединения формулы (IV) в уходящую группу Q согласно классическим способам, известным специалисту. Например, гидроксигруппу можно превратить в галоген, такой как бром, в присутствии бромистоводородной кислоты, тетрабромида углерода или тионилбромида; или же такой, как хлор в присутствии тионилхлорида. Так, можно получить группу мезилокси (CH3-SO2-O-) или тозилокси (толил-SO2-O) в качестве уходящей группы путем взаимодействия продуктов формулы (IV) с метансульфонилхлоридом или пара-толилсульфонилхлоридом.
Соединение (IV) получают восстановлением двойной связи соединения формулы (V). Восстановление можно осуществить в соответствии с классическими способами, известными специалисту, например, в присутствии водорода, на катализаторе палладий/уголь в органическом растворителе, таком как этанол, при температуре между 20 и 40°С.
Соединение формулы (V) может быть получено согласно реакции Сузуки (J. Org. Chem., 55 6184-1990). В соответствии с этим способом подвергают взаимодействию соединение формулы (VI), в которой Х обозначает галоген, более конкретно бром или иод; или трифторметилсульфонат, с винилбороновой кислотой или винилборонатом, в присутствии катализатора, такого как ацетат палладия или тетракис(трифенилфосфин)палладий, в растворителе, таком как тетрагидрофуран, диоксан или диметоксиэтан.
Соединение формулы (VI) может быть получено исходя из соединения формулы (Х) в соответствии с этапами, описанными на схеме 1, в условиях, хорошо известных специалисту, или в аналогичных условиях или в условиях, подробно описанных в примерах.
Соединения формулы (II) могут быть коммерческими продуктами или же они могут быть получены методами, хорошо известными специалисту.
В указанной схеме исходные соединения и реактивы, если способ их получения не описан, находятся в продаже, или описаны в литературе, или же могут быть получены способами, которые в ней описаны или которые известны специалисту.
Способ согласно изобретению может также включать стадию выделения и/или очистки полученного таким способом соединения формулы (I) и/или его возможного превращения в одну из его солей и/или его N-оксид.
Желаемое соединение выделяют согласно традиционным методам в форме основания или его солей. Свободное основание может быть превращено в одну из его солей обычным солеобразованием в органическом растворителе, таком как спирт, предпочтительно этанол или изопропанол, простой эфир, такой как 1,2-диметоксиэтан, этилацетат, ацетон или углеводород, такой как гексан.
Соединения формулы (I), несущие N-оксидную группу на атомах азота, могут быть получены окислением соответствующих соединений формулы (I). В этом случае соединение формулы (I), полученное описанным выше синтезом, подвергают реакции окисления в соответствии с традиционными способами, например реакцией с м-хлорпербензойной кислотой в подходящем растворителе, и выделяют в соответствии с обычными методиками, хорошо известными специалисту.
Следующие примеры описывают получение соединений согласно изобретению. Эти примеры не ограничивают изобретение, а лишь иллюстрируют его. Номер соединения согласно примеру соответствует номеру, указанному в находящейся ниже таблице, которая характеризует химическую структуру и физические свойства соединения согласно изобретению.
Физико-химические измерения были осуществлены следующим образом.
Температуры плавления измеряли на аппарате Buchi В540.
Спектры ядерно-магнитного резонанса протона (ЯМР-1Н) были сняты на частоте 500 МГц на спектрометре Bruker, снабженном консолью Avance. Химические сдвиги представлены в м.д. по отношению к частоте ТМС.
Все спектры регистрировались при температуре 40°С.
Аббревиатура, используемая при характеристике сигналов, следующая: с=синглет, с шир.=синглет широкий, м=мультиплет, м шир.=мультиплет широкий, д=дублет, т=триплет, к=квадруплет.
• =не интегрируется из-за интерференции с широким пиком, обусловленным присутствием воды.
Для метода LC/MS:
Система ThermoElectron LCQ Deca XР Max, снабженная масс-спектрометрическим детектором с ионной ловушкой, а также детектором с диодной матрицей.
Используемые хроматографические системы следующие:
Метод А)
- Колонка Kromasil C18 (2,1 × 50 мм), 3,5 мкм
- Элюент А=Н2О ацетат аммония рН 6,5; 5 мМ
- Элюент В=CH3CN.
- Градиент от 98% А до 95% В в течение 12 минут, затем элюирование 95% В в течение 3 минут
- Расход 0,5 мл/минуту
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод В)
- Колонка Kromasil C18 (2,1 × 50 мм), 3,5 мкм
- Элюент А=Н2О+0,01% ТФУ
- Элюент В=CH3CN
- Градиент от 98% А до 95% В в течение 15 минут, затем элюирование 95% В в течение 5 минут
- Расход 0,5 мл/минуту
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод С)
- Колонка Varian Sunfire C18 (2,0 × 100 мм), 3,5 мкм
- Элюент А=Н2О+0,01% ТФУ
- Элюент В=CH3CN
- Градиент от 98% А до 95% В в течение 15 минут, затем элюирование 95% В в течение 5 минут
- Расход 0,5 мл/минуту
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод D)
- Колонка Waters Atlantis DB C18 (2,0 × 50 мм), 3,0 мкм
- Элюент А=Н2О+0,01% ТФУ
- Элюент В=CH3CN
- Градиент от 98% А до 95% В в течение 15 минут, затем элюирование 95% В в течение 5 минут
- Расход 0,5 мл/минуту
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод Е)
- Колонка XTerra C18 (2,1 × 50 мм), 3,5 мкм n°186000400
- Элюент А=Н2О+0,01% ТФУ
- Элюент В=CH3CN.
- Градиент от 98% А до 95% В в течение 15 минут, затем элюирование 98% В в течение 5 минут
- Расход 0,5 мл/минуту
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод F)
- Колонка Ascentis C18 (2 × 50 мм), 3 мкм
- Элюент А=Н2О+0,01% ТФУ
- Элюент В=CH3CN
- Градиент от 98% А до 95% В в течение 10 минут, затем элюирование 95% В в течение 5 минут
- Расход 0,5 мл/минуту; температура 40°С
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Метод G)
- Колонка Ascentis C18 (2 × 50 мм), 3 мкм
- Элюент А=Н2О+0,05% ТФУ
- Элюент В=CH3CN+0,035% ТФУ
- Градиент от 98% А до 95% В в течение 12 минут, затем элюирование 95% В в течение 3 минут
- Расход 0,7 мл/минуту, температура 40ºС
- Инъекция 2 мкл раствора с концентрацией 0,1 мг/мл в смеси CH3CN:Н2О=9:1
Продукты детектировались при УФ излучении на длине волны 220 нм.
Для масс-спектрометрического анализа:
- Способ ионизации: положительный электроспрей (ESI+полярность+)
- Сканирование: 100-1200 а.е.м.
Cиликагель для флеш-хроматографической колонки выпускается фирмой Biotage.
СИНТЕЗ 1 4-(2-бромэтил)-1-метил-2-пентилбензол
1а) (3-бром-4-метилфенил)-уксусная кислота
Смешивают 13 г (0,061 мол) 3-бром-4-метилацетофенона, 2,1 г (0,065 мол) серы, 14 мл морфолина и каталитическое количество моногидрата п-толуолсульфоновой кислоты. В токе азота нагревают до 130°С. Спустя 7 часов охлаждают, прибавляют 35 мл абсолютного этанола и перемешивают в течение ночи при комнатной температуре. Растворяют 13,9 г полученного тиоамида в растворе 110 мл этанола, 70 мл воды и 6 г NaOH и нагревают с обратным холодильником в течение 4 часов. Растворители испаряют и затем подкисляют разбавленным раствором соляной кислоты. Выпадает осадок белого твердого вещества. Фильтруют и получают 9,16 г соединения, указанного в заголовке.
1b) 2-(3-бром-4-метилфенил)-этанол
Растворяют соединение, полученное на стадии 1а), в 170 мл этанола. Барботируют газообразную соляную кислоту в течение 30 минут. Нагревают с обратным холодильником в течение 3 часов. Испаряют этанол и обрабатывают диэтиловым эфиром. Промывают насыщенным раствором бикарбоната натрия и упаривают в вакууме. Получают 7,1 г сложного эфира, который растворяют в 70 мл ТГФ. Прибавляют по каплям раствор 7,6 мл борандиметилсульфида в 110 мл ТГФ в атмосфере азота и нагревают с обратным холодильником в течение 3 часов. Охлаждают до 0°С и прибавляют осторожно 120 мл метанола. Нагревают с обратным холодильником в течение 30 минут. Упаривают в вакууме. Остаток растворяют в этилацетате. Промывают разбавленным аммиачным раствором, сушат и упаривают в вакууме.
Получают 5,4 г продукта в виде масла, соответствующего соединению в заголовке.
1с) 2[4-метил-3-(пент-1-енил)-фенил]-этанол
Смешивают 2,0 г (0,0093 мол) продукта, полученного на предыдущей стадии, 1,12 г (0,01 мол) пентенилбороновой кислоты, 2,1 г (0,037 мол) КОН, 1,5 г (0,0046 мол) тетрабутиламмонийбромида и 50 мг Pd-тетракис(трифенилфосфина) в 50 мл ТГФ. Нагревают с обратным холодильником в токе азота в течение 4 часов. Вливают смесь в воду, экстрагируют этилацетатом, сушат органический слой и упаривают растворитель. Очищают остаток колоночной хроматографией на силикагеле, элюируя смесью гексан/этилацетат 9/1. Получают 740 мг продукта, указанного в заголовке, в виде масла.
1d) 2-(4-метил-3-пентилфенил)-этанол
Продукт, полученный на предыдущей стадии, в количестве 0,74 г (0,0036 мол) солюбилизируют в 46 мл этанола, прибавляют 0,12 г 10% Pd/C и оставляют реакцию протекать в потоке водорода в течение 5 часов при температуре 40ºС. Фильтруют и упаривают в вакууме. Получают 0,65 г соединения, указанного в заголовке, в виде масла.
1е) 4-(2-бромэтил)-1-метил-2-пентилбензол
Продукт, полученный на предыдущей стадии, в количестве 0,65 г (0,0032 мол), загружают в колбу, содержащую 8 мл 48% водного раствора бромистоводородной кислоты. Нагревают при 130°С в течение 6 часов. Охлаждают и вливают в насыщенный раствор бикарбоната натрия. Экстрагируют этилацетатом, сушат и упаривают в вакууме. Получают 0,65 г соединения, указанного в заголовке, в виде масла.
СИНТЕЗ 2 4-(2-метансульфонилоксиэтил)-1-метокси-2-пентилбензол
2а) (3-бром-4-метоксифенил)-уксусная кислота
Работают согласно процедуре, описанной в синтезе 1а), но используют 3-бром-4-метоксиацетофенон вместо 3-бром-4-метилацетофенона и получают соединение, указанное в заголовке.
2b) 2-(3-бром-4-метоксифенил)этанол
Работают согласно процедуре, описанной в синтезе 1b), но используют соединение 2а), полученное на предыдущей стадии, вместо соединения 1а) и получают соединение, указанное в заголовке.
2с) 2-[4-метокси-3-(пент-1-енил)-фенил]этанол
Работают согласно процедуре, описанной в синтезе 1с), но используют соединение 2b), полученное на предыдущей стадии, вместо соединения 1b) и получают соединение, указанное в заголовке.
2d) 2-(4-метокси-3-пентилфенил)этанол
Работают согласно процедуре, описанной в синтезе 1d), но используют соединение 2c), полученное на предыдущей стадии, вместо соединения 1c) и получают соединение, указанное в заголовке.
2e) 4-(2-метансульфонилоксиэтил)-1-метокси-2-пентилбензол
Загружают в колбу 1,2 г (0,0054 мол) соединения 2d), полученного на предыдущей стадии, 20 мл дихлорметана, 0,75 мл (0,0054 мол) триэтиламина и при 0-5°С вводят 0,42 мл (0,0054 мол) метансульфонилхлорида.
Перемешивают в течение 2 часов при комнатной температуре. Промывают водой, сушат и упаривают в вакууме органический слой. Получают продукт, указанный в заголовке, в виде желтого масла.
Пример 1: соединение n°1: 1-[2-(4-метил-3-пентилфенил)-этил]-4-(3-трифторметилфенил)-пиперазин и его гемипамоат
Загружают в колбу 1,98 г (0,00777 мол) соединения, полученного в синтезе 1, 1,5 г (0,0065 мол) (3-трифторметилфенил)-1-пиперазина, 1,35 г (0,00975 мол) карбоната калия и 40 мл н-бутанола. Кипятят с обратным холодильником в течение 6 часов. Испаряют н-бутанол, обрабатывают этилацетатом, промывают водой, сушат органический слой и испаряют растворитель. Очищают остаток колоночной хроматографией на силикагеле, элюируя смесью гексан/этилацетат 95/5.
Смешивают раствор 300 мг полученного свободного основания в ТГФ с раствором 180 мг памоиновой кислоты в ТГФ/вода 8:2.
Концентрируют в вакууме. Прибавляют 6 мл этанола и получают осадок, который отфильтровывают. Кристаллизуют при нагревании в этаноле и получают гемипамоат беловатого цвета: 450 мг с т.пл.=156-157. Последующая кристаллизация в этаноле позволяет получить продукт с т.пл.=157-158.
Температура плавления=157-158ºC;
М+Н+ (Метод А)=время удерживания: 10,9 мин.; m/z=419 (MH+).
ЯМР 1Н: δ (м.д., ДМСО-d6): 0,88 (м, 3Н); 1,27-1,39 (м, 4Н); 1,45-1,59 (м, 2Н); 2,23 (с, 3Н); 2,50-2,58 (м, 2Н**); 2,75-2,89 (м, 2Н); 2,89-3,50 (м, 10Н*); 4,74 (с, 1Н); 6,97 (дд, Jа=7,7 Гц; Jb=1,4 Гц, 1Н); 7,02 (д, J=1,4 Гц, 1Н); 7,07 (д, J=7,7 Гц, 1Н); 7,08-7,15 (м, 2Н); 7,16-7,32 (м, 3Н); 7,45 (дд→т, J=8 Гц, 1Н); 7,74 (д, J=8 Гц, 1Н); 8,17 (д, J=8 Гц, 1Н); 8,30 (с, 1Н).
В соответствии с одним из вариантов настоящего изобретения получают соединение 1бис, т.е. смесь гемипамоата 1-[2-(4-метил-3-пентилфенил)-этил]-4-(3-трифторметилфенил)-пиперазина и свободной памоиновой кислоты (молярное отношение 1:0,5) в соответствии со следующей методикой.
Смешивают 600 мг свободного основания, полученного в примере 1, растворенного в ТГФ, с 540 мг памоиновой кислоты, растворенной в ТГФ/вода 8:2. Упаривают в вакууме, затем обрабатывают остаток смесью ТГФ и простого изопропилового эфира. Нагревают и фильтруют. Получают 1 г твердого вещества желтого цвета.
Температура плавления=158-159°С;
М+Н+ (метод В)=время удерживания: 10,1 мин; m/z 419 (MH+).
Пример 2: соединение n°2: 1-[2-(4-метокси-3-пентилфенил)-этил]-4-(3-трифторметилфенил)-пиперазин и его гидрохлорид
Загружают в колбу 0,336 г (0,00112 мол) соединения, полученного в синтезе 2, 20 мл изопропанола, 0,47 мл триэтиламина (0,0036 мол) и 0,21 мл (0,00112 мол) 4-(3-трифторметилфенил)-пиперазина. Кипятят с обратным холодильником в течение ночи. Упаривают растворитель в вакууме и получают масло, которое очищают хроматографией, элюируя смесью гексан/этилацетат 8:2. Получают 300 мг свободного основания, из которого получают гидрохлорид в изопропаноле с помощью насыщенного раствора HCl в изопропаноле.
Фильтруют и получают 100 мг твердого белого вещества.
Температура плавления=146-149°С;
М+Н+ (метод В)=время удерживания: 7,0 мин; m/z=435 (MH+).
ЯМР 1Н: δ (м.д., ДМСО-d6): 0,88 (м, 3Н); 1,23-1,38 (м, 4Н); 1,53 (м, 2Н); 2,51-2,57 (м, 2Н**); 2,95-3,05 (м, 2Н); 3,11-3,28 (м, 4Н); 3,30-3,41 (м, 2Н); 3,60-3,70 (м, 2Н*); 3,77 (с, 3Н); 3,93-4,04 (м, 2Н); 6,92 (д, J=8 Гц, 1Н); 7,05 (д, J=2 Гц, 1Н); 7,07 (дд, Ja=8 Гц, Jb=2 Гц, 1Н); 7,17 (д шир., J=7 Гц, 1Н); 7,29 (с шир, 1Н); 7,31 (д шир., J=8 Гц, 1Н); 7,49 (дд→т, J=8 Гц, 1Н); 10,59 (с шир., 1Н).
Пример 3: соединение n°38: 1-[2-(4-метил-3-пентилфенил)-этил]-4-(3-трифторметилфенил)-пиперазин и его оксалат
Загружают в колбу 0,24 г (0,89 мол) соединения, полученного в синтезе 1, 0,24 г (0,1 ммол) (3-трифторметилфенил)-1-пиперазина, 0,22 г (1,6 ммол) карбоната калия и 10 мл н-бутанола. Кипятят с обратным холодильником в течение 6 часов. Испаряют н-бутанол, обрабатывают этилацетатом, промывают водой, сушат органический слой и испаряют растворитель. Очищают остаток колоночной хроматографией на силикагеле, элюируя смесью гексан/этилацетат 95/5. Получают 130 мг продукта, указанного в заголовке, в виде масла. Продукт растворяют в 2 мл изопропанола. Прибавляют раствор щавелевой кислоты в изопропаноле и получают осадок оксалата, который отделяют фильтрацией в виде твердого белого вещества (0,12 г).
Температура плавления=193-194°С;
М+Н+=время удерживания: 6,7 мин; m/z=419 (MH+).
ЯМР 1Н: δ (м.д., ДМСО-d6): 0,89 (м, 3Н); 1,28-1,40 (м, 4Н); 1,46-1,59 (м, 2Н); 2,23 (с, 3Н); 2,50-2,57 (м, **); 2,78-2,89 (м, 2Н); 2,91-3,08 (м, *); 3,39 (с шир., 4Н); 6,97 (дд, Ja=7,7 Гц, Jb=1,6 Гц, 1Н); 7,02 (с шир., 1Н); 7,07 (д, J=7,7 Гц, 1Н); 7,12 (д, J=7,4 Гц, 1Н); 7,22 (с шир, 1Н); 7,27 (д шир., J=8,4 Гц, 1Н); 7,45 (м, 1Н).
|
|
|
|
|
|
Соединения согласно изобретению обладают интересными свойствами ингибирования TNF-α.
Эти свойства проявили себя в тесте, в котором изучалось воздействие молекул на синтез TNF-α, индуцированный у мыши Balb/c с использованием липополисахарида (ЛПС) Escherichia Coli (055:B5, Sigma, St Luois, Mo).
Исследуемые соединения вводили перорально группам из пяти мышей-самок Balb/c (Charls River, France) в возрасте 7-8 недель. Спустя один час вводили ЛПС внутривенным путем (10 мкг/мышь). Кровь отбирали у каждого животного спустя 1,5 часа после внутривенного введения ЛПС. Образцы крови центрифугировали, плазму выделяли и замораживали при -80°С. Содержание TNF-α измеряли с помощью коммерческих наборов (R и D, Abingdon, UK).
В этом тесте соединение 38 показало высокую активность, так как ингибировало синтез TNF-α даже при очень низких дозах, IC50=0,1 мг/кг.
Эти же свойства были продемонстрированы также в тесте, изучавшем воздействие соединений на синтез TNF-α, индуцированный у крысы Sprague-Dawlay с использованием липополисахарида (ЛПС) Escherichia Coli (055:B5, Sigma, St Luois, Mo).
Исследуемые соединения вводили перорально группам из десяти крыс-самцов Sprague-Dawlay весом около 200 грамм. Спустя 2 часа вводили внутривенно ЛПС (0,1 мг/кг). Кровь отбирали у каждого животного спустя 1,5 часа после введения ЛПС. Образцы крови центрифугировали, сыворотку отделяли и замораживали при -80ºС. Содержание TNF-α измеряли с помощью коммерческих наборов (RPN 2744 Amersham, UK).
В этом тесте соединения показали высокую активность, так как ингибировали синтез TNF-α даже при очень низких дозах: IC50=0,3-1 мг/кг, в частности, IC50=0,3 мг/кг показало соединение 1 и IC50=1 мг/кг показали соединения 4 и 8.
Соединения согласно изобретению были протестированы на модели воспаления сустава.
Соединение (1 нг/сустав в виде суспензии в 10 мкл раствора, содержащего 2% ПВП (Поливинилпироллидон)/1% лутрола F68/0,9% NaCl) согласно изобретению вводили в сустав хомяка путем инъекции за 1 час перед первой инъекцией зимозана® (см. ниже).
Индуцирование суставного воспаления в колене: после легкой анестезии с помощью изофурана суспензию зимозана® в дозе 100 мкг на 10 мкл солевого раствора вводили в коленный сустав хомяка самца. Зимозан® является экстрактом дрожжей, который продуцирует сильное дозозависимое воспаление при подкожном инъецировании. В условиях описываемого здесь эксперимента (инъекция в коленный сустав) была вызвана гиперальгезия продолжительностью в одну неделю. Для продления этого срока были проведены 3 последовательные инъекции зимозана®. Латентный период отдергивания лапы вслед за воздействием на кожу стопы определенным термическим стимулом измеряли с использованием прибора (Plantar Test Ugo Basile Biological Research Apparatus, Comerio, Италия), включающего мини-камеру для обеспечения точного положения инфракрасного луча под задней изучаемой лапой.
Измерение вторичной гиперальгезии
Таймер, который измерял продолжительность воздействия инфракрасного света, отражаемого задней лапой, включался исследователем, а выключался автоматически, как только животное встряхивало лапой или отдергивало ее. Инфракрасный свет отключался исследователем спустя 16 секунд, начиная с момента, когда животное не отдергивало лапу для того, чтобы избежать ожога. Латентный период отдергивания лапы использовался в качестве показателя для измерения боли. Измерение осуществляли спустя 4 часа после первой инъекции зимозана® и замеряли в течение следующих 3 недель. В этом тесте показательные соединения согласно изобретению, в частности соединение 1, демонстрировали эффективное снижение боли на период 3 недель.
Соединения согласно изобретению были исследованы также на модели невропатической боли: измерение противоаллодиниевого эффекта при поражении интактного нерва (SNI).
На этой модели in vivo у мыши, страдающей хронической невропатической болью, на задней лапе с помощью хирургической перевязки большого седалищного нерва был вызван эффект тактильной аллодинии, т.е. болевого ощущения, вызванного обычно неболевым механическим стимулом. Затем измеряли порог отдергивания лапы (PWT), т.е. количество силы (в граммах), требующееся для того, чтобы мышь отдернула заднюю лапу.
Тактильную аллодинию замеряли на двух задних лапах, т.е. гомолатеральной и контрлатеральной по отношению к поражению, вызванному хирургической операцией, с помощью автоматического опыта Фрея, согласно которому кожу стопы задних лап подвергали прессорному стимулу с интенсивностью, возрастающей до 5 грамм, и с использованием стержня со сменными иглами. Сила в граммах, на которую отвечает животное отдергиванием задней лапы (порог отдергивания лапы PWT), использовался в качестве показателя тактильной аллодинии.
Использовались животные в опытных группах, которым были введены соединения согласно изобретению, и животные в контрольной группе, каждая из групп состояла из четырех мышей-самцов С57В6. Во всех группах базовую линию значений PWT (БЛ) определяли перед хирургической операцией. Для возбуждения невропатической боли две главные ветви большого седалищного нерва под общей анестезией были перевязаны лигатурой и поперечно рассечены у животных во всех группах вместе с подкожным наружным нервом, оставшимся интактным (повреждение интактного нерва, SNI). В этой модели невропатическая боль, т.е. тактильная аллодиния, полностью развилась в течение двух дней, следующих после поперечного рассечения нерва в задней гомолатеральной лапе, т.е на стороне, подвергнутой поражению, а в контрольной группе оставалась стабильной в течение всего времени проведения эксперимента.
Спустя 7 дней после хирургической операции непосредственно перед введением соединения, т.е. во время 0 час, у животных во всех группах определяли значения PWT на задней гомолатеральной лапе (пораженной) и на контрлатеральной лапе (не пораженной). Соединения согласно изобретению или носитель вводили животным путем инъекции в хвостовую вену (i.v.). В опытных группах животные получали 0,1 мл/10 г раствора исследуемых соединений в носителе (этанол/кремофор/фосфатно-солевой буфер 1:1:18) в дозе 1 мг/кг. В контрольной группе мыши получали 0,1 мл/10 г носителя. Спустя 1 час, 2 часа, 4 часа и 6 часов после введения определяли значения PWT.
Для проведения статистического анализа все полученные данные PWT были проанализированы методом однофакторного анализа ANOVA и множественного сравнения Бонферрони. При использованной дозе (1 мг/кг i.v.) статистически значимое снижение боли (путем измерения противоаллодиниевого эффекта) наблюдалось с соединением примера 1 в течение 1-6 часов.
Благодаря этой активности соединения формулы (I) и их соли могут быть использованы для лечения заболеваний, связанных с иммунными нарушениями и с нарушениями воспалительного характера или в качестве анальгетического средства для лечения боли.
В частности, соединения формулы (I) могут быть использованы для лечения атеросклероза, аутоиммунных заболеваний, заболеваний, приводящих к демиелинизации нейронов (таких как рассеянный склероз), астмы, болей или воспалений в суставах, более конкретно, болей в плече, в колене, пальцах, …, ревматоидного артрита и сопутствующих ему суставных болей, остеоартрита и сопутствующих ему суставных болей, а также других воспалительных болей в суставах, или же других воспалительных болей (например, гигрома, тендинит, …), фиброзных болезней, идиопатического легочного фиброза, цистического фиброза, глумерулонефрита, ревматоидного спондилита, подагры, костной резорбции, резорбции хрящевой ткани, остеопороза, болезни Пагета, множественной миеломы, увеоритинита, септических шоков, септицемии, эндотоксиновых шоков, реакции трансплантат против хозяина, отторжения трансплантата, респираторного дистресс-синдрома у взрослых, силикоза, асбестоза, саркоидоза легких, болезни Крона, язвенного колита, бокового амиотрофического склероза, болезни Альцгеймера, болезни Паркинсона, красной системной волчанки, гемодинамических шоков, ишемических патологий (инфаркт миокарда, ишемия миокарда, коронарный вазоспазм, грудная жаба, сердечная недостаточность, сердечный приступ), поражений, вызванных пост-ишемической реперфузией, малярии, микобактерийных инфекций, менингита, проказы, вирусных инфекций (ВИЧ, цитомегаловирусы, вирусы герпеса), оппортунистичесих инфекций, связанных со СПИДом, туберкулеза, псориаза, атопического и контактного дерматоза, диабета, кахексии, рака, повреждений, вызванных радиацией.
В соответствии с одним из своих аспектов, настоящее изобретение относится к соединению согласно изобретению или фармацевтически приемлемой соли указанного соединения для лечения перечисленных выше заболеваний.
В соответствии с другим из своих аспектов, настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу, по меньшей мере, одного соединения согласно изобретению или одной фармацевтически приемлемой соли этого соединения, а также по меньшей мере одно вспомогательное фармацевтически приемлемое вещество.
Указанные вспомогательные вещества выбирают, в зависимости от фармацевтической формы и желаемого способа введения, из числа обычных вспомогательных веществ, которые известны специалисту.
В фармацевтических композициях согласно настоящему изобретению, предназначенных для перорального, сублингвального, подкожного, внутримышечного, внутривенного, внутрисуставного, топического, локального, интратрахеального, назального, трансдермального или ректального пути введения, активное начало формулы (I), описанной выше, или его соль можно вводить в единичной форме введения в смеси с классическими фармацевтическими вспомогательными веществами животным и людям с целью профилактики или лечения нарушений или заболеваний, указанных выше.
Подходящие единичные формы введения включают формы для перорального введения, такие как таблетки, твердые или мягкие желатиновые капсулы, порошки, гранулы и растворы или суспензии для приема внутрь, формы для сублингвального, защечного, внутрисуставного, интратрахеального, внутриглазного, назального пути введения, формы для ингаляций, формы для топического, трансдермального, подкожного, внутримышечного или внутривенного введения, формы для ректального пути введения или имплантаты. Для топического нанесения соединения согласно изобретению можно использовать в составе кремов, гелей, помад и лосьонов.
Например, единичная форма введения соединения согласно изобретению в форме таблетки может содержать следующие компоненты:
|
При пероральном приеме вводимая доза активного начала в день может составлять от 0,01 до 100 мг/кг за один или несколько приемов, предпочтительно от 0,02 до 50 мг/кг.
Например, единичная форма введения соединения согласно изобретению в форме внутрисуставного раствора или суспензии может содержать следующие компоненты:
|
При внутрисуставной инъекции вводимая доза активного начала может составлять от 0,01 до 40 мг/кг на сустав, предпочтительно инъекции вводят с частотой, составляющей по меньшей мере один месяц между инъекциями.
В качестве дополнительного примера, единичная форма введения соединения согласно изобретению в форме внутрисуставного раствора или суспензии может содержать следующие компоненты:
|
При внутрисуставной инъекции вводимая доза активного начала может составлять от 4 нг до 96 мг на сустав, предпочтительно частота инъекций составляет интервал не менее одного месяца между инъекциями.
Могут возникнуть особые случаи, когда потребуются более высокие или более низкие дозы; такие дозы не выходят за рамки изобретения. В соответствии с имеющейся практикой подходящую дозу для каждого пациента определяет врач в зависимости от способа введения препарата, веса и ответа данного пациента.
В соответствии с другим из своих аспектов настоящее изобретение относится также к способу лечения указанных выше патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей.
В соответствии с другим из своих аспектов настоящее изобретение относится к способу лечения болезней, связанных с иммунными или воспалительными нарушениями, а также для лечения боли, в частности атеросклероза, аутоиммунных заболеваний, заболеваний, приводящих к демиелинизации нейронов (таких как рассеянный склероз), астмы, ревматоидного артрита и сопутствующих ему суставных болей, остеоартрита и сопутствующих ему суставных болей, а также других воспалительных болей в суставах, или же других воспалительных болей (например, гигрома, тендинит, …), фиброзных болезней, идиопатического легочного фиброза, цистического фиброза, глумерулонефрита, ревматоидного спондилита, подагры, костной резорбции, резорбции хрящевой ткани, остеопороза, болезни Пагета, множественной миеломы, увеоритинита, септических шоков, септицемии, эндотоксиновых шоков, реакции трансплантат против хозяина, отторжения трансплантата, респираторного дистресс-синдрома у взрослых, силикоза, асбестоза, саркоидоза легких, болезни Крона, язвенного колита, бокового амиотрофического склероза, болезни Альцгеймера, болезни Паркинсона, красной системной волчанки, гемодинамических шоков, ишемических патологий (инфаркт миокарда, ишемия миокарда, коронарный вазоспазм, грудная жаба, сердечная недостаточность, сердечный приступ), поражений, вызванных пост-ишемической реперфузией, малярии, микобактерийных инфекций, менингита, проказы, вирусных инфекций (ВИЧ, цитомегаловирусы, вирусы герпеса), оппортунистических инфекций, связанных со СПИДом, туберкулеза, псориаза, атопического и контактного дерматоза, диабета, кахексии, рака, повреждений, вызванных радиацией, включающему введение соединения формулы (I) или одной из его фармацевтически приемлемых солей, в индивидуальном виде или в сочетании с другими активными началами.
В соответствии с другим из своих аспектов настоящее изобретение относится к способу лечения болей или воспалений в суставах, в частности болей в плече, колене или в пальцах, включающему введение соединения формулы (I) или одной из его фармацевтически приемлемых солей, в индивидуальном виде или в сочетании с другими активными началами. Изобретение относится также к способу лечения, указанному выше, согласно которому введение соединения формулы (I) или одной из его фармацевтически приемлемых солей в индивидуальном виде или в сочетании с другими активными началами осуществляют путем внутрисуставной инъекции.
В соответствии с другим из своих аспектов настоящее изобретение относится к применению соединения формулы (I) или одной из его фармацевтически приемлемых солей для получения лекарственного средства, предназначенного для лечения болей или воспалений в суставах, более конкретно к применению соединения формулы (I) или одной из его фармацевтически приемлемых солей, отличающемуся тем, что лекарственное средство вводится в сустав.
Согласно другому из своих аспектов изобретение относится к соединению формулы (I) или одной из его фармацевтически приемлемых солей для лечения болей или воспалений в суставах, более конкретно лечению, отличающемуся тем, что лекарственное средство вводится в сустав.
 0,5
0,5
 0,5
0,5