Результат интеллектуальной деятельности: СОЛИ ТРИАЗОЛИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PAR1, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА
Вид РИД
Изобретение
Изобретение относится к новым соединениям формулы I:

где X, A-, Q1, Q2, Q3, R2, R3, R4, R5, R6, R7, R8 и R9 имеют приведенные далее значения. Соединения формулы I обладают противотромбической активностью и, в частности, ингибируют активируемый протеазой рецептор 1 (PAR1). Кроме того, изобретение относится к способу получения соединения формулы I и его применению в качестве лекарственного средства.
Активируемый протеазой рецептор 1 (PAR1) представляет собой тромбиновый рецептор, принадлежащий к классу G протеин-связанных рецепторов (GPCR). Ген, кодирующий PAR1, находится в хромосоме 5q13, состоит из двух экзонов и занимает область приблизительно в 27 тысяч пар нуклеотидов.
В частности, PAR1 экспрессируется в эндотелиальных клетках, гладких мышечных клетках, фибробластах, нейронах и человеческих тромбоцитах. В отношении тромбоцитов PAR1 представляет собой важный рецептор передачи сигнала, причастного к инициированию агрегации тромбоцитов.
Активация рецепторов PAR осуществляется посредством протеолитического отщепления части N-концевого участка рецепторов PAR, вследствие чего высвобождается новая N-концевая последовательность, которая затем активирует рецептор (Pharmacol. Rev. 54:203-217, 2002).
Свертывание крови представляет собой существенный для выживания млекопитающих процесс контроля кровотока. Процесс свертывания и последующее растворение сгустка после заживления раны происходит после повреждения сосуда и может быть разделен на четыре стадии.
1. Стадия вазоконстрикции: благодаря ей уменьшается потеря крови в поврежденной зоне.
2. Следующая стадия представляет собой адгезию тромбоцитов на обнажившемся коллагене в субэндотелии. Такая первичная адгезия на матрице активирует тромбоциты, которые затем секретируют различные активаторы, ведущие к усилению активации. К тому же, данные активаторы стимулируют дальнейшее поступление новых тромбоцитов к месту повреждения сосуда и способствуют агрегации тромбоцитов. Тромбоциты агрегируются по месту повреждения стенки сосуда и образуют первоначально рыхлый сгусток тромбоцитов. Далее активация тромбоцитов ведет к появлению фосфатидилсерина и фосфатидилинозитола на поверхности клеточных мембран. Появление данных фосфолипидов является существенным для связывания и активации мультиферментных комплексов каскада свертывания крови.
3. Первоначально рыхлый агрегат тромбоцитов сшивается фибрином. Если тромб содержит только тромбоциты и фибрин, то он представляет собой белый тромб. Если дополнительно присутствуют красные кровяные клетки, то речь идет о красном тромбе.
4. После заживления раны тромб растворяется под действием протеина плазмина.
Образование фибринового сгустка идет по двум альтернативным путям: эндогенному и экзогенному. Данные пути начинаются по разным механизмам, но в более поздней стадии сходятся к одному общему участку каскада свертывания. Образование красного тромба или сгустка вследствие аномалии стенки сосуда при отсутствии раны представляет собой результат эндогенного пути. Образование фибриновых сгустков как ответ на повреждение ткани или ранение представляет собой результат экзогенного пути. В обоих путях участвует значительное число протеинов, известных как факторы свертывания.
В эндогенный путь вовлекаются факторы свертывания VIII, IX, X, XI и XII, а также прекалликреин, высокомолекулярный кининоген, ионы кальция и фосфолипиды тромбоцитов. Каждый из данных протеинов ведет к активации фактора X.
Эндогенный путь начинается тогда, когда прекалликреин и высокомолекулярный кининоген связывают факторы XI и XII на отрицательно заряженной поверхности. Данный этап обозначают как стадию контакта. Взаимодействие с коллагеном стенки сосуда представляет собой первичный стимул стадии контакта. Результатом процессов стадии контакта является превращение прекалликреина в калликреин, который в свою очередь активирует фактор XII. Фактор XIIa гидролизует следующие молекулы прекалликреина до калликреина, вследствие чего происходит активация. Увеличивающаяся активация фактора XII приводит к активации фактора XI, который ведет к выделению брадикинина, представляющего собой вазодилататор. Вследствие этого заканчивается начальная стадия вазоконстрикции. Брадикинин образуется из высокомолекулярного кининогена. В присутствии ионов Ca2+ фактор XIa активирует фактор IX. Фактор IX представляет собой профермент, содержащий GLA-радикалы c-карбоксиглутамата, зависящего от витамина K. Активность сериновой протеазы проявляется после связывания ионов Ca2+ с данными GLA-радикалами. Многие из сериновых протеаз каскада свертывания крови (факторы II, VII, IX и X) содержат такого типа GLA-радикалы, зависящие от витамина K. Фактор IXa расщепляет фактор X и ведет к активации фактора Xa. Предпосылкой для образования фактора IXa является образование протеазного комплекса из ионов Ca2+ и тромбоцитов, активированных на поверхности факторами VIIIa, IXa и X. Одной из реакций активированных тромбоцитов является появление на поверхности фосфатидилсерина и фосфатидилинозитола. Только наличие данных фосфолипидов делает возможным образование комплекса протеазы. В данном процессе фактор VIII исполняет функцию рецептора факторов IXa и X. Поэтому фактор VIII представляет собой кофактор в каскаде свертывания. Активация фактора VIII с образованием фактора VIIIa, который является собственно рецептором, требует только минимального количества тромбина. С увеличением концентрации тромбина фактор VIIIa благодаря тромбину в итоге подвергается дальнейшему расщеплению и инактивации. Такая бифункциональная активность тромбина в отношении фактора VIII ведет к самоограничению образования комплексов протеазы и вместе с этим к ограничению свертывания крови.
При активации человеческих тромбоцитов тромбином центральную роль играют рецепторы PAR1 и PAR4; активация данных рецепторов ведет к морфологическим изменениям в тромбоцитах, выделению АДФ и агрегации тромбоцитов (Nature, 413:26-27, 2001).
Ингибиторы рецептора PAR1 описаны, например, в европейских заявках EP 1391451 или EP 1391452, в американских заявках US 6063847 и US 2004/0152736, а также в международной заявке WO 03/089428.
Соединения формулы I оказывают значительное специфическое ингибирующее действие на активируемый протеазой рецептор 1 и отличаются по сравнению с соединениями из EP 1391451 повышенной растворимостью в воде.
Поэтому соединения формулы I являются приемлемыми как для профилактического, так и для терапевтического применения в случае заболеваний человека, сопровождаемых тромбозами, эмболией, повышенной свертываемостью или фиброзными изменениями. Примерами таких заболеваний являются тромбоз, тромбоз глубоких вен, эмболия легочной артерии, инфаркт головного мозга, инфаркт миокарда, артериальная гипертония, воспалительные заболевания, ревматические заболевания, астма, гломерулонефрит или остеопороз. Соединения формулы I могут быть использованы для профилактики рецидивов заболеваний и являются приемлемыми как для неотложного, так и для длительного лечения. Соединения формулы I могут быть применены также в комбинации с активными веществами, принцип противотромбического действия которых отличается от действия на PAR1.
1) Настоящее изобретение относится к соединению формулы I
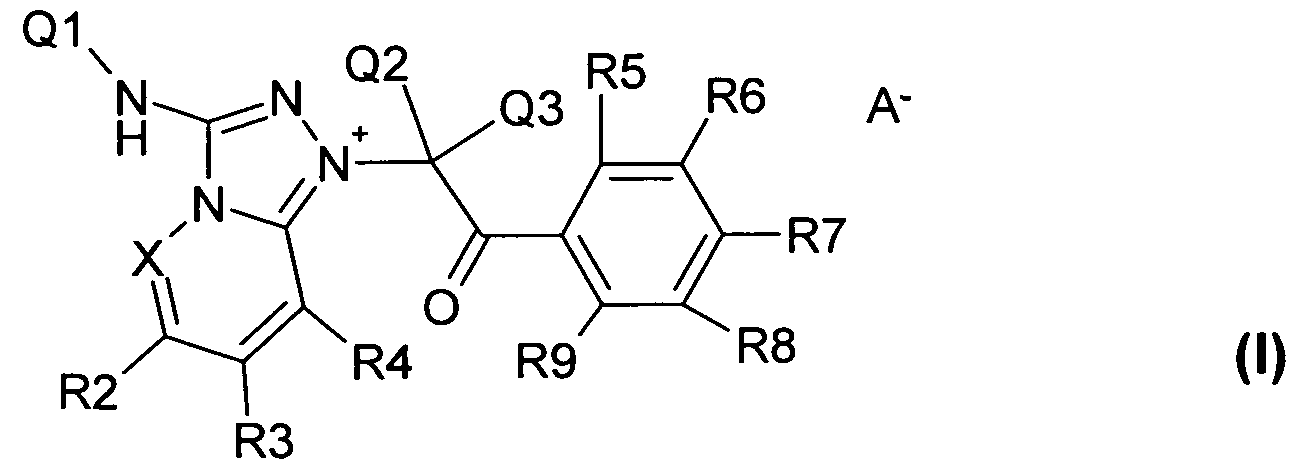
и/или любым стереоизомерным или таутомерным формам соединения формулы I, и/или смесям данных форм в любом соотношении, и/или физиологически приемлемым солям соединения формулы I, причем:
X означает C-R1 или N;
A- означает анион органической или неорганической кислоты;
Q1 означает атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-R11, -OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем алкилы и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
Q2 и Q3 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил или -(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R1, R2, R3 и R4 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-N(R11)-C(O)-O-R12, -(C0-C4)-алкилен-C(O)-R11, -(C0-C4)-алкилен-N(R11)-R12, -(C0-C4)-алкилен-N(R11)-C(O)-R12, галоген, OH, -CN, -NO2, -SO2CH3, -SO2CF3, -SF5, -Si[-(C1-C4)-алкил]3, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C0-C4)-алкилен-(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два или три заместителя, таких как -O-(C1-C6)-алкил, -(C1-C4)-алкил, OH, -(C3-C6)-циклоалкил, или -O-(C3-C6)-циклоалкил), -O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C1-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил;
причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил, -(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил), -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C3-C6)-циклоалкил, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R1 и R2, R2 и R3 или R3 и R4 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S, причем цикл является незамещенным или имеет независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R11 и R12 (относится также к Q1) независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R11 и R12 во фрагментах N(R11)-R12 и N(R11)-C(O)-R12 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-C(O), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R5, R6, R7, R8 и R9 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, OH, -CN, -NO2, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(CO)-N(R21)-R22, -SO2CH3, -SO2CF3, -(C0-C4)-алкилен-C(O)-O-R21, галоген, -SF5, -(C0-C4)-алкилен-C(O)-R21, -(C0-C4)-алкилен-N(R21)-R22, -(C0-C4)-алкилен-N(R21)-C(O)-R22, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -(C0-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -Si[-(C1-C4)-алкил]3, -(C0-C6)-алкилен-O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C0-C6)-алкилен-O-(C0-C6)-алкилен-(C6-C14)-арил или -(C4-C15)-Het, причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил, -(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил), -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C3-C6)-циклоалкил, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R5 и R6, R6 и R7, R7 и R8 или R8 и R9 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S, причем цикл является незамещенным или имеет независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R21 и R22 независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R21 и R22 во фрагментах N(R21)-R22 и N(R21)-C(O)-R22 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-C(O), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора.
2) Предпочтительным является соединение формулы I, где:
X означает C-R1 или N;
A- означает анион органической или неорганической кислоты;
Q1 означает атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-R11, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем алкилы и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, -OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
Q2 и Q3 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил или -(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R1, R2, R3 и R4 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-N(R11)-C(O)-O-R12-(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-C(O)-R11, -(C0-C4)-алкилен-N(R11)-R12, -(C0-C4)-алкилен-N(R11)-C(O)-R12, галоген, OH, -CN, -NO2, -SO2CH3, -SO2CF3, -SF5, -Si[-(C1-C4)-алкил]3, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C0-C4)-алкилен-(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два или три заместителя, таких как -O-(C1-C6)-алкил, -(C1-C4)-алкил, OH, -(C3-C6)-циклоалкил, или -O-(C3-C6)-циклоалкил), -O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C1-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил;
причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил, -(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил), -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C3-C6)-циклоалкил;
причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
при условии, что по меньшей мере один из радикалов R1, R2, R3 или R4 не представляет собой атом водорода;
или R1 и R2, R2 и R3 или R3 и R4 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S, причем цикл является незамещенным или имеет независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R11 и R12 независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R11 и R12 во фрагментах N(R11)-R12 и N(R11)-C(O)-R12 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-(CO), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R4, R5, R6, R7, R8 и R9 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, OH, -CN, -NO2, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(CO)-N(R21)-R22, -SO2CH3, -SO2CF3, -(C0-C4)-алкилен-C(O)-O-R21, галоген, -SF5, -(C0-C4)-алкилен-C(O)-R21, -(C0-C4)-алкилен-N(R21)-R22, -(C0-C4)-алкилен-N(R21)-C(O)-R22, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -(C0-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -Si[-(C1-C4)-алкил]3, -(C0-C6)-алкилен-O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C0-C6)-алкилен-O-(C0-C6)-алкилен-(C6-C14)-арил или -(C4-C15)-Het, причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил, -(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил), -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C3-C6)-циклоалкил, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора, при условии, что по меньшей мере один из радикалов R5, R6, R7, R8 или R9 не представляет собой атом водорода;
или R5 и R6, R6 и R7, R7 и R8 или R8 и R9 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S, причем цикл является незамещенным или имеет независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R21 и R22 независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R21 и R22 во фрагментах N(R21)-R22 и N(R21)-C(O)-R22 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-C(O), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора.
3) Более предпочтительным является соединение формулы I, где:
X означает C-R1 или N;
A- означает анион органической или неорганической кислоты;
Q1 означает атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-R11, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем алкилы и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
Q2 и Q3 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил или -(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R1, R2, R3 и R4 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-N(R11)-C(O)-O-R12, -(C0-C4)-алкилен-C(O)-R11, -(C0-C4)-алкилен-N(R11)-R12, -(C0-C4)-алкилен-N(R11)-C(O)-R12, галоген, OH, -CN, -NO2, -SO2CH3, -Si[-(C1-C4)-алкил]3, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C0-C4)-алкилен-(C6-C14)-арил, -O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C4-C15)-Het или -O-(C1-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил, причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора, при условии, что по меньшей мере один из радикалов R1, R2, R3 или R4 не представляет собой атом водорода;
или R1 и R2, R2 и R3 или R3 и R4 совместно с атомами кольца, с которыми они соответственно связаны, образуют цикл, выбранный из группы, в которую входят 2,3,5,6,7,8-гексагидро-1,2,3a,4,5,8-гексаазациклопента[b]нафталин, 2,6,7,8-тетрагидро-3H-5-окса-1,2,3a,4,8-пентаазациклопента[b]нафталин, 2,3,6,7-тетрагидро-5,8-диокса-1,2,3a,4-тетраазациклопента[b]нафталин, 2,3,6,7-тетрагидро-5H-8-окса-1,2,3a,4,5-пентаазациклопента[b]нафталин, 2,6,7,8-тетрагидро-3H-5-тиа-1,2,3a,4,8-пентаазациклопента[b]нафталин, 2,3,6,7,8,9-гексагидро-1,2,3a,4,6,9-гексаазациклопента[a]нафталин, 2,3-дигидро-5,7-диокса-1,2,3a,4-тетрааза-s-индацин, 2,6,7,8-тетрагидро-3H-циклопента[e][1,2,4]триазоло[4,3-b]пиридазин, 2,7,8,9-тетрагидро-3H-циклопента[d][1,2,4]триазоло[4,3-b]пиридазин и 2,3,6a,9a-тетрагидро-[1,3]диоксоло[4,5-d][1,2,4]триазоло[4,3-b]пиридазин, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R11 и R12 независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R11 и R12 во фрагментах N(R11)-R12 и N(R11)-C(O)-R12 означают 5-8-членный цикл, выбранный из группы, в которую входят азетидинил, пирролидинил, пиперидинил, пиперазинил, азепинил, морфолинил, тиоморфолинил, пирролидин-2,5-дионил, пиперидин-2,6-дионил, пиперазин-2,6-дионил, морфолин-3,5-дионил, пирролидин-2-онил, пиперидин-2-онил, пиперазин-2-онил и морфолин-3-онил, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R4, R5, R6, R7, R8 и R9 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, OH, -CN, -NO2, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -SO2CH3, -SO2CF3, -(C0-C4)-алкилен-(CO)-N(R21)-R22, -(C0-C4)-алкилен-C(O)-O-R21, галоген, -SF5, -(C0-C4)-алкилен-C(O)-R21, -(C0-C4)-алкилен-N(R21)-R22, -(C0-C4)-алкилен-N(R21)-C(O)-R22, -(C1-C6)-алкилен-O-(C1-C6)-алкил, -(C0-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -Si[-(C1-C4)-алкил]3, -(C0-C6)-алкилен-O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -(C0-C6)-алкилен-O-(C0-C6)-алкилен-(C6-C14)-арил или -(C4-C15)-Het, причем алкилы, алкилены и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил, -(C6-C14)-арил (причем арил является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил), -(C4-C15)-Het (причем Het является незамещенным или содержит независимо друг от друга один, два, три, четыре или пять заместителей, таких как галоген, -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил) или -O-(C3-C6)-циклоалкил, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора, при условии, что по меньшей мере один из радикалов R5, R6, R7, R8 или R9 не представляет собой атом водорода;
или R5 и R6, R6 и R7, R7 и R8 или R8 и R9 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, выбранный из группы, в которую входят 2,3-дигидробензо[1,4]диоксин, 3,4-дигидро-2H-бензо[1,4]оксазин, 1,2,3,4-тетрагидрохиноксалин; бензо[1,3]диоксол, 3,4-дигидро-2H-бензо[1,4]тиазин и 2,3,4,5-тетрагидро-1H-бензо[b][1,4]диазепин, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R21 и R22 независимо друг от друга означают атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-(C6-C14)-арил, -(C0-C4)-алкилен-(C4-C15)-Het, -SO2CH3 или -SO2CF3, причем в алкилах, алкиленах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
или R21 и R22 во фрагментах N(R21)-R22 и N(R21)-C(O)-R22 означают 5-8-членный цикл, выбранный из группы, в которую входят азетидинил, пирролидинил, пиперидинил, пиперазинил, азепинил, морфолинил, тиоморфолинил, пирролидин-2,5-дионил, пиперидин-2,6-дионил, пиперазин-2,6-дионил, морфолин-3,5-дионил, пирролидин-2-онил, пиперидин-2-онил, пиперазин-2-онил и морфолин-3-онил, причем циклы являются незамещенными или имеют независимо друг от друга один или два заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в образованных 5-8-членных циклах, алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора.
4) Настоящее изобретение относится также к соединению формулы I, где:
X означает C-R1 или N;
A- означает анион органической или неорганической кислоты;
Q1 означает атом водорода, -(C1-C6)-алкил, -(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-O-R11, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-R11, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем алкилы и циклоалкилы при необходимости являются незамещенными или содержат независимо друг от друга один, два или три заместителя, таких как -(C1-C4)-алкил, -(C3-C6)-циклоалкил, OH, -O-(C1-C6)-алкил или -O-(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
Q2 и Q3 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил или -(C3-C6)-циклоалкил, причем в алкилах или циклоалкилах атомы водорода могут быть полностью или частично замещены атомами фтора;
R1, R2, R3 и R4 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C4)-алкил, -O-(C1-C8)-алкил, -O-(C3-C6)-циклоалкил, -(C0-C4)-алкилен-C(O)-N(R11)-R12, -(C0-C4)-алкилен-C(O)-O-R11, -CF3, -(C0-C4)-алкилен-N(R11)-C(O)-O-R12, -(C0-C4)-алкилен-N(R11)-R12, хлор, -O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -O-(C0-C4)-алкилен-(C6-C14)-арил или -(C4-C15)-Het, причем Het выбран из группы, в которую входят акридинил, азепинил, азетидинил, бензимидазолил, бензофурил, бензотиофурил, бензотиофенил, бензоксазолил, бензотиазолил, бензотриазолил, бензизоксазолил, бензизотиазолил, карбазолил, 4aH-карбазолил, карболинил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, хроманил, хроменил, циннолинил, декагидрохинолинил, дибензофурил, дибензотиофенил, дигидрофуран[2,3-b]тетрагидрофурил, дигидрофурил, диоксолил, диоксанил, 2H,6H-1,5,2-дитиазинил, фурил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индолинил, индолизинил, индолил, 3H-индолил, изобензофурил, изохинолинил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изотиазолидинил, 2-изотиазолинил, изотиазолил, изоксазолил, изоксазолидинил, 2-изоксазолинил, морфолинил, нафтиридинил, октагидроизохинолинил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксотиоланил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пироазолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазолил, пиридоимидазолил, пиридотиазолил, пиридотиофенил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тетрагидропиридинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолидинил, тиазолинил, тиазолил, тиенил, тиеноимидазолил, тиенооксазолил, тиенопиррол, тиенопиридин, тиенотиазолил, тиенотиофенил, тиоморфолинил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил, причем алкилены являются незамещенными или имеют один заместитель -(C1-C4)-алкил или -(C3-C6)-циклоалкил или в алкиленах атомы водорода полностью или частично замещены атомами фтора;
R11 и R12 независимо друг от друга означают атом водорода или -(C1-C6)-алкил;
R5, R6, R7, R8 и R9 являются одинаковыми или различающимися и независимо друг от друга означают атом водорода, -(C1-C6)-алкил, OH, -O-(C1-C8)-алкил, хлор, бром, -SF5, -(C0-C4)-алкилен-N(R21)-R22, -(C0-C4)-алкилен-N(R21)-C(O)-R22, -(C0-C6)-алкилен-O-(C1-C6)-алкилен-O-(C1-C6)-алкил, -(C4-C15)-Het, -(C0-C6)-алкилен-O-(C1-C4)-алкилен-(C3-C6)-циклоалкил, -CF3 или -(C0-C6)-алкилен-O-(C0-C6)-алкилен-(C6-C14)-арил, причем алкилены являются незамещенными или имеют один заместитель -(C1-C6)-алкил, при условии, что по меньшей мере один из радикалов R5, R6, R7, R8 или R9 не представляет собой атом водорода;
R5 и R6, R6 и R7, R7 и R8 или R8 и R9 совместно с атомами кольца, с которыми они соответственно связаны, образуют цикл морфолина, причем цикл является незамещенным или имеет один заместитель -(C1-C4)-алкил;
R21 и R22 независимо друг от друга означают атом водорода или -(C1-C6)-алкил.
5) Наиболее предпочтительными являются соединения формулы I, причем к ним относятся следующие соединения: 1-{2-[3-ацетиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий в виде трифторуксуснокислой соли, 3-амино-1-[2-(3,5-ди-трет-бутил-4-гидроксифенил)-2-оксоэтил]-6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3,5-ди-трет-бутил-4-гидроксифенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-5-метил-7-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-5-хлор-1-{2-[3-метиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-7-этокси-6-этоксикарбонил-1-{2-[3-метиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-7-этокси-6-этоксикарбонил-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-7-этокси-6-метилкарбамоил-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-6-хлор-1-[2-(3,5-ди-трет-бутил-4-гидроксифенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-изопропокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-метокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-этокси-1-[2-(4-метокси-3-морфолин-4-ил-5-трифторметилфенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 1-{2-[3-ацетиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-циклопентилокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-циклобутокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-фенокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-бензилокси-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-циклогексилокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-(2,2,2-трифторэтокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-циклопропилметокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-(1-этилпропокси)-1-{2-[3-метиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-(1-этилпропокси)-1-{2-[3-метокси-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-этоксиметилфенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-циклопропилметоксиметилфенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4,5-диэтоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4,5-бис-циклопропилметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-пропоксиметилфенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-этоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-(1-этилпропокси)-1-[2-(3-метокси-5-трифторметилфенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-метоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-циклопропилметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-циклобутилметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-бензилоксиметил-5-трет-бутилфенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-циклогексилметокси-4,5-диметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-бутокси-1-[2-(3-трет-бутил-5-метоксиметилфенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-хлор-5-метоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(8-трет-бутил-4-метил-3,4-дигидро-2H-бензо[1,4]оксазин-6-ил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-диэтиламино-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-пиперидин-1-ил-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-этокси-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-1-[2-(3-циклогексилметокси-5-этоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-бром-5-метоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-(1-этилпропокси)-1-[2-(3-изопропил-5-метоксифенил)-2-оксоэтил]-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-циклогексилметокси-5-метоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-{2-[3-(3,3-диметилбутокси)-5-этоксифенил]-2-оксоэтил}-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(8-трет-бутил-4-метил-3,4-дигидро-2H-бензо[1,4]оксазин-6-ил)-2-оксоэтил]-6-этокси-[1,2,4]триазоло[4,3-a]пиридин-1-ий, 3-амино-6-диэтиламино-1-{2-[3-метокси-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-морфолин-4-ил-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(5-бром-2,3-диметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-хлор-4,5-диметоксифенил)-2-оксоэтил]-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-{2-[3-трет-бутил-5-(2-метоксиэтокси)фенил]-2-оксоэтил}-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-метоксифенил)-2-оксоэтил]-6-(2-метоксиэтокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-5-метоксиметилфенил)-2-оксоэтил]-6-(2-метоксиэтокси)-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-(1-этилпропокси)-1-{2-[3-морфолин-4-ил-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-этил-1-{2-[3-метокси-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-этил-[1,2,4]триазоло[4,3-b]пиридазин-1-ий, 3-амино-6-хлор-7-диэтилкарбамоил-1-{2-[3-метокси-5-(пентафторсульфанил)фенил]-2-оксоэтил}-[1,2,4]триазоло[4,3-b]пиридазин-1-ий или 3-амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-хлор-7-диэтилкарбамоил-[1,2,4]триазоло[4,3-b]пиридазин-1-ий.
Под термином "анион" понимают анионы органических и неорганических кислот, причем хлорид-ион является более предпочтительным. Примерами неорганических или органических кислот являются хлористоводородная, бромистоводородная, серная, разбавленная серная, фосфорная, метансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 4-бромбензолсульфоновая, циклогексиламидосульфоновая, трифторметилсульфоновая, 2-гидроксиэтансульфоновая, уксусная, щавелевая, винная, янтарная, глицеринфосфорная, молочная, яблочная, адипиновая, лимонная, фумаровая, малеиновая, глюконовая, глюкуроновая, пальмитиновая или трифторуксусная кислота.
Под термином "(C1-C4)-алкил" или "(C1-C6)-алкил" понимают углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 или от 1 до 6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, 2,3-диметилбутил или неогексил.
Под термином "-(C0-C4)-алкилен" или "-(C1-C6)-алкилен" понимают углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 или от 1 до 6 атомов углерода, например метилен, этилен, 1-метилметилен, пропилен, 1-метилэтилен, бутилен, 1-пропилметилен, 1-этил-1-метилметилен, 1,2-диметилэтилен, 1,1-диметилметилен, 1-этилэтилен, 1-метилпропилен, 2-метилпропилен, пентилен, 1-метилбутилен, гексилен, 1-метилпентилен. "-C0-алкилен" означает ковалентную связь.
Под термином "-O-(C1-C6)-алкил" или "-O-(C1-C8)-алкил" понимают алкоксигруппы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 6 или от 1 до 8 атомов углерода, например метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, трет-бутокси-, 1-пентокси-, 2-пентокси-, 3-пентокси-, 1-гексокси-, 2-гексокси-, 3-гексокси-, 1-гептокси-, 2-гептокси-, 3-гептокси-, 4-гептокси-, 2,4-диметилпентан-3-окси-, 1-октокси-, 2-октокси-, 3-октокси-, 2,2,4-триметилпентан-3-окси-, 2,3,4-триметилпентан-3-окси- или 4-октоксигруппа.
Под термином "(C3-C6)-циклоалкил" понимают радикалы, происходящие от соединений с 3-6-членными моноциклами, таких как циклопропан, циклобутан, циклопентан или циклогексан.
Под термином "-O-(C3-C6)-циклоалкил" понимают циклоалкоксигруппы, происходящие от соединений с 3-6-членными моноциклами, такие как циклопропокси-, циклобутокси-, циклопентокси- или циклогексоксигруппа.
Под термином "-(C6-C14)-арил" понимают ароматические углеводородные радикалы, содержащие в кольце от 6 до 14 атомов углерода. Примерами (C6-C14)-арилов являются фенил, нафтил, 1-нафтил, 2-нафтил, антрил или флуоренил. Нафтил и в особенности фенил являются предпочтительными арилами.
Под термином "Het" понимают циклические системы, которые содержат от 4 до 15 атомов углерода, входящих в один, два или три связанных друг с другом цикла, и которые в зависимости от размера циклов содержат один, два, три или четыре одинаковых или различающихся гетероатомов, выбранных из атомов кислорода, азота или серы. Примеры таких циклических систем представляют собой акридинил, азепинил, азетидинил, бензимидазолил, бензофурил, бензотиофурил, бензотиофенил, бензоксазолил, бензотиазолил, бензотриазолил, бензизоксазолил, бензизотиазолил, карбазолил, 4aH-карбазолил, карболинил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, хроманил, хроменил, циннолинил, декагидрохинолинил, дибензофурил, дибензотиофенил, дигидрофуран[2,3-b]тетрагидрофурил, дигидрофурил, диоксолил, диоксанил, 2H,6H-1,5,2-дитиазинил, фурил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индолинил, индолизинил, индолил, 3H-индолил, изобензофурил, изохинолинил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изотиазолидинил, 2-изотиазолинил, изотиазолил, изоксазолил, изоксазолидинил, 2-изоксазолинил, морфолинил, нафтиридинил, октагидроизохинолинил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксотиоланил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пироазолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазолил, пиридоимидазолил, пиридотиазолил, пиридотиофенил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тетрагидропиридинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолидинил, тиазолинил, тиазолил, тиенил, тиеноимидазолил, тиенооксазолил, тиенопиррол, тиенопиридин, тиенотиазолил, тиенотиофенил, тиоморфолинил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил или ксантенил.
В случае, когда X представляет собой C-R1, Y представляет собой C-R2, а R1 и R2 соответственно означают атомы водорода, подразумеваются бициклические системы, которые совместно с 4H-[1,2,4]триазол-3-иламином в формуле I образуют, например, цикл [1,2,4]триазол[4,3-a]пирин-3-иламина, имеющего следующую структуру:

В случае, когда X представляет собой N, Y представляет собой C-R2, а R1 и R2 соответственно означают атомы водорода, подразумеваются бициклические системы, которые совместно с 4H-[1,2,4]триазол-3-иламином в формуле I образуют, например, цикл [1,2,4]триазол[4,3-b]пиридазин-3-иламина, имеющего следующую структуру:

Под определением "R1 и R2, R2 и R3 или R3 и R4 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S" понимают циклическую систему, например, такую как 2,3,5,6,7,8-гексагидро-1,2,3a,4,5,8-гексаазациклопента[b]нафталин, 2,6,7,8-тетрагидро-3H-5-окса-1,2,3a,4,8-пентаазациклопента[b]нафталин, 2,3,6,7-тетрагидро-5,8-диокса-1,2,3a,4-тетраазациклопента[b]нафталин, 2,3,6,7-тетрагидро-5H-8-окса-1,2,3a,4,5-пентаазациклопента[b]нафталин, 2,6,7,8-тетрагидро-3H-5-тиа-1,2,3a,4,8-пентаазациклопента[b]нафталин, 2,3,6,7,8,9-гексагидро-1,2,3a,4,6,9-гексаазациклопента[a]нафталин, 2,3-дигидро-5,7-диокса-1,2,3a,4-тетрааза-s-индацин, 2,6,7,8-тетрагидро-3H-циклопента[e][1,2,4]триазоло[4,3-b]пиридазин, 2,7,8,9-тетрагидро-3H-циклопента[d][1,2,4]триазоло[4,3-b]пиридазин или 2,3,6a,9a-тетрагидро-[1,3]диоксоло[4,5-d][1,2,4]триазоло[4,3-b]пиридазин.
Под определением "R5 и R6, R6 и R7, R7 и R8 или R8 и R9 совместно с атомами кольца, с которыми они соответственно связаны, образуют 5-8-членный цикл, причем цикл состоит только из атомов углерода или 1, 2 или 3 атома из данных атомов замещены атомами N, O или S" понимают, например, циклическую систему, такую, как, 2,3-дигидробензо[1,4]диоксин, 3,4-дигидро-2H-бензо[1,4]оксазин, 1,2,3,4-тетрагидрохиноксалин, бензо[1,3]диоксол, 3,4-дигидро-2H-бензо[1,4]тиазин или 2,3,4,5-тетрагидро-1H-бензо[b][1,4]диазепин.
Под определениями "R11 и R12 во фрагментах N(R11)-R12 и N(RH)C(O)-R12 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-C(O), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S" или "R11 и R12 во фрагментах N(R21)-R22 и N(R21)-C(O)-R22 означают 5-8-членные циклы, образованные совместно с атомом азота N или группой N-C(O), причем таким образом образуются циклические амины, имиды или лактамы, содержащие до 2 других гетероатомов, выбранных из N, O или S" понимают, например, циклические системы, такие как радикалы циклических аминов, такие как азетидинил, пирролидинил, пиперидинил, пиперазинил, азепинил, морфолинил или тиоморфолинил, радикалы имидов, такие как пирролидин-2,5-дионил, пиперидин-2,6-дионил, пиперазин-2,6-дионил, морфолин-3,5-дионил, и радикалы лактамов, такие, как пирролидин-2-онил, пиперидин-2-онил, пиперазин-2-онил, морфолин-3-онил.
Под определением "алкил, алкилен или циклоалкил, в которых атомы водорода полностью или частично замещены атомами фтора" понимают частично или полностью фторированные алкилы, алкилены или циклоалкилы, которые в случае алкилов представляют собой, например, радикалы -CF3, -CHF2, -CH2F, -CHF-CF3, -CHF-CHF2, -CHF-CH2F, -CH2-CF3, -CH2-CHF2, -CH2-CH2F, -CF2-CF3, -CF2-CHF2, -CF2-CH2F, -CH2-CHF-CF3, -CH2-CHF-CHF2, -CH2-CHF-CH2F, -CH2-CH2-CF3, -CH2-CH2-CHF2, -CH2-CH2-CH2F, -CH2-CF2-CF3, -CH2-CF2-CHF2, -CH2-CF2-CH2F, -CHF-CHF-CF3, -CHF-CHF-CHF2, -CHF-CHF-CH2F, -CHF-CH2-CF3, -CHF-CH2-CHF2, -CHF-CH2-CH2F, -CHF-CF2-CF3, -CHF-CF2-CHF2, -CHF-CF2-CH2F, -CF2-CHF-CF3, -CF2-CHF-CHF2, -CF2-CHF-CH2F, -CF2-CH2-CF3, -CF2-CH2-CHF2, -CF2-CH2-CH2F, -CF2-CF2-CF3, -CF2-CF2-CHF2, -CF2-CF2-CH2F, -CH(CF3)2, -CH(CHF2)2, -CH(CFH2)2, -CH(CFH2)(CHF2), -CH(CFH2)(CF3), -CH(CFH2)(CH3), -CH(CHF2)(CH3), -CH(CF3)(CH3), -CF(CF3)2, -CF(CHF2)2, -CF(CFH2)2, -CF(CFH2)(CHF2), -CF(CFH2)(CF3), -CF(CFH2)(CH3), -CF(CHF2)(CH3) или -CF(CF3)(CH3), а также другие возможные комбинации в случае бутила, пентила и гексила, которые, как и пропил, также могут быть разветвленными, в случае алкиленов представляют собой, например, радикалы -CF2-, -CHF-, -CHF-CF2-, -CHF-CHF-, -CHF-CH2-, -CF2-CF2- или -CF2-CH2F, а также другие возможные комбинации в случае пропилена, бутилена, пентилена и гексилена, которые также могут быть разветвленными, и в случае циклоалкилов представляют собой, например, радикалы:

а также являются производными аналогичных более крупных колец циклопентила и циклогексила.
Под термином "галоген" понимают фтор, хлор, бром или иод, предпочтительными являются фтор, хлор или бром, в частности фтор или хлор.
Рассмотренные термины и определения применимы также в случае любой комбинации, например, как в радикале -(C0-C6)-алкилен-O-(C0-C6)-алкилен-(C6-C14)-арил.
При этом функциональные группы применяемых промежуточных соединений, например, аминогруппы или карбоксильные группы в соединениях формулы I, могут быть замаскированы приемлемыми защитными группами. Приемлемыми защитными группами для аминогрупп являются, например, трет-бутоксикарбонильная, бензилоксикарбонильная или фталоильная группа, а также тритильная или тозильная защитная группа. Приемлемыми защитными группами для карбоксильных групп являются например, алкиловые, ариловые или арилалкиловые сложные эфиры. Защитные группы могут вводиться и удаляться хорошо известными или приведенными в данном описании способами (см. Greene, T.W., Wuts, P.G.M., Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley-Interscience, или Kocienski, P.J., Protecting Groups (2004), 3rd Ed., Thieme). Термин "защитная группа" может относиться также к соответствующим полимерносвязанным защитным группам.
Соединения по настоящему изобретению могут быть получены хорошо известными или приведенными в данном описании способами.
Настоящее изобретение относится также к способу получения соединения формулы I и/или стереоизомерной формы соединения формулы I, и/или физиологически приемлемой соли соединения формулы I, отличающемуся тем, что:
а) соединение формулы II:

где R5, R6, R7, R8, R9, Q2 и Q3 имеют значения, определенные для формулы I, а W означает хлор, бром, мезильную или тозильную группу, и соединение формулы III:

где X, R2, R3 и R4 имеют значения, определенные для формулы I, с прибавлением или без прибавления основания в растворителе превращают в соединение формулы I, или
b) способом a) полученное соединение формулы I выделяют в свободной форме или выделяют из физиологически неприемлемых солей или в случае наличия кислотных или основных групп превращают в физиологически приемлемые соли, или
c) полученное способом a) соединение формулы I или приемлемый предшественник формулы I, которые вследствие своей химической структуры образуются в энантиомерных или диастереоизомерных формах, разделяют на чистые энантиомеры или диастереоизомеры солеобразованием с энантиомерно чистыми кислотами или основаниями, хроматографией на хиральной неподвижной фазе или дериватизацией с помощью хиральных энантиомерно чистых соединений, таких как аминокислоты, разделением полученных таким образом диастереоизомеров и отщеплением хиральных вспомогательных групп.
Настоящее изобретение относится также к способу получения соединения формулы I согласно схеме 1.
Схема 1

При этом исходные соединения II и III, причем соединение III при необходимости представляет собой соль, при комнатной температуре или при несколько повышенной температуре, преимущественно в интервале от 40 до 60°C, если соединение III представляет собой соль, в присутствии основания, предпочтительно в присутствии основания Хюнига, в растворителе, предпочтительно в диметилформамиде (ДМФА) или диоксане, превращают в соединение формулы I. Радикалы X, A-, Q1, Q2, Q3, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, определенные для формулы I, а W представляет собой предпочтительную уходящую группу, такую как хлор, бром, мезильная или тозильная группа, предпочтительно бром или мезильная группа.
2-Замещенные триазолопиридазины (A), также образующиеся при таких условиях реакции в зависимости от вида заместителя в различных частях, можно разделять хроматографически или перекристаллизацией. Предпочтительным является разделение на силикагеле с использованием в качестве элюента смеси "дихлорметан-метанол".

Гидразины формулы V могут быть циклизованы с цианосодержащими реагентами типа Z-CN, причем селективно образуются 1-замещенные катионные соединения формулы I, в которой Q1 означает водород. Альтернативно гидразины формулы V могут быть селективно циклизованы с изотиоцианатами SCN-Q1' формулы XXV с получением 1-замещенных катионных соединений формулы I, причем образующаяся промежуточная тиомочевина может быть циклизована с "активатором серы", таким как тозилхлорид, дарбодиимид, этиловый эфир бромуксусной кислоты или оксид ртути, с получением соединения формулы I. При этом радикалы X, A-, Q1, Q2, Q3, R2, R3, R4, R5, R6, R7, R8 и R9 имеют приведенные ранее значения, а Q' соответствует Q1 или защитной группе, такой, как FMOC (флуорен-9-илметилоксикарбонил), которая после циклизации может быть отщеплена, так что образуются соединения, в которых Q1 представляет собой водород.
Схема 2

Соединения формулы II имеются в продаже или могут быть получены известными из литературы способами, например, исходя из соответствующих ацетофенонов X или X' (см., например, Phosphorus and Sulfur and the Related Elements (1985), 25(3), 357 или Tetrahedron Letters (1984), 25(34), 3715). Соединения формулы X, которые являются хорошо известными и имеются в продаже в многочисленных структурных вариантах или могут быть синтезированы, могут быть, например, функционализированы по ацетильной группе, в частности, действием элементарного хлора, брома, трибромидпроизводных, таких как фенилтриметиламмонийтрибромид, 1,3-дихлордиметилгидантоина, N-хлор- или N-бромсукцинимида. Соединения формулы X' действием, например, мезил- или тозилхлорида могут быть превращены в соединения типа II.
Схема 3

Для некоторых радикалов R5-R9 может быть благоприятным превращение кетонов типа X сначала в кетали типа XI или XI', которые затем могут быть с высокой селективностью функционализированы по метильной группе с получением соединений типа XII, предпочтительно бромированы, и после декетализации с приемлемыми кислотами также превращены в соединения типа II.
При этом заместители, указанные на схемах 3 и 4, имеют определенные ранее значения, T представляет собой -(C1-C4)-алкил, T' означает этилен, пропилен или бутилен, W' представляет собой реакционноспособное соединение, такое как фенилтриметиламмонийтрибромид, N-бром- или N-хлорсукцинимид.
Схема 4

Соединения формулы III имеются в продаже или могут быть получены известными из литературы способами. При этом приемлемыми предшественниками являются соединения типа XX, которые в присутствии бромциана, хлорциана или тозилцианида могут быть циклизованы с получением соединений типа III и которые могут существовать также в таутомерной форме типа XXa.

Соединение формулы XX, такое, как пиридазин-3-илгидразин, и соединение формулы XXa, такое, как [2H-пиридазин-(3E)-илиден]гидразин, являются таутомерными формами. Когда в дальнейшем используется только одна форма записи, то это означает, что подразумевается также и другая таутомерная форма.
Соединение формулы I также может быть представлено в виде мезомерных форм, которые следуют из приведенных далее частных вариантов формулы I.

Соединение формулы I также может быть представлено в виде других мезомерных форм, которые следуют из приведенных далее частных вариантов формулы I, когда, например, X означает CH, а R2 означает OH.

Также возможно образование соединением формулы I внутренней соли, поскольку, например, радикал Q1, если он представляет собой -C(O)-O-CH3 или -C(O)CH3, вследствие своего подкисляющего действия делает возможным образование внутренней соли. Поэтому в таком случае получается внешне нейтральное соединение, которое не нуждается в противоионе "A-". То же самое происходит в случае с азотом, в данном случае внутренняя соль в отличие от уже описанной формы может перегруппировываться с образованием нейтральной формы. Acc означает акцептор, такой, как карбонил или также -CH2CF3.

Другие мезомерные формы образуются в случае, когда азот не может быть стабилизирован депротонированием.

Когда в данном описании используется только одна форма записи, то это означает, что подразумеваются также и другие мезомерные формы.
Альтернативно соединения типа XX взаимодействием с изотиоцианатами типа XXV также могут быть превращены в тиомочевины типа XXVI. Последние соединения после активации серы, например, этиловым эфиром бромуксусной кислоты, карбодиимидом, тозилхлоридом или оксидом ртути могут быть превращены в соединения формулы III. При этом радикалы X, R2, R3 и R4 имеют приведенные ранее значения, а Q1' соответствует Q1 или защитной группе, такой, как FMOC (флуорен-9-илметилоксикарбонил), которая после циклизации может быть отщеплена, так что образуются соединения, в которых Q1 представляет собой водород.
Схема 5

Соединения типа XX могут быть получены путем встраивания гидразина в соединения типа XXI, которые имеются в продаже с самыми разнообразными видами заместителей. При этом радикалы X, R2, R3 и R4 имеют приведенные ранее значения, а LG представляет собой предпочтительную уходящую группу, такую как фтор, хлор, бром, иод, мезилат, тозилат, трифлат или нонафлат.

Получение хлорсодержащих соединений типа XXI', в которых X представляет собой азот, а R2 представляет собой хлор, обеспечивается, например, взаимодействием ангидридов малеиновой кислоты типа XXIII с гидрохлоридом гидразина с получением соединений типа XXII и последующим взаимодействием с оксихлоридом фосфора с получением дихлорида XXI' и с гидразином с получением соединений типа XX', в которых R2 представляет собой хлор.

Полученное согласно схеме 1 соединение формулы I или приемлемый предшественник формулы I, которые вследствие своей химической структуры образуются в энантиомерных формах, могут быть разделены на чистые энантиомеры солеобразованием с энантиомерно чистыми кислотами или основаниями, хроматографией на хиральной неподвижной фазе или дериватизацией с помощью хиральных энантиомерно чистых соединений, таких как аминокислоты, разделением полученных таким образом диастереоизомеров и отщеплением хиральных вспомогательных групп (способ c) или полученное согласно схеме 1 соединение формулы I может быть выделено в свободной форме или в случае наличия кислотных или основных групп превращено в физиологически приемлемые соли (способ b).
Кислотные или основные формы соединения формулы I могут существовать в виде солей или в свободной форме. Предпочтительными являются фармакологически приемлемые соли, например, соли щелочных или щелочно-земельных металлов или гидрохлориды, сульфаты, гемисульфаты, метилсульфонаты, п-толуолсульфонаты, любые возможные фосфаты, а также соли аминокислот, природных оснований или карбоновых кислот, такие как лактаты, цитраты, тартраты, ацетаты, адипинаты, фумараты, глюконаты, глутаматы, малеинаты или памоаты.
Получение физиологически приемлемых солей из способных к солеобразованию соединений формулы I, включая их стереоизомерные формы, по способу b) осуществляют известным по существу способом. Если соединения формулы I содержат кислотные функциональные группы, то с реагентами с основным характером, такими, как гидроксиды, карбонаты, гидрокарбонаты, алкоголяты, а также аммиак или органические основания, например, триметил- или триэтиламин, этаноламин, диэтаноламин или триэтаноламин, трометамол, или также с аминокислотами, обладающими основным характером, такими как лизин, орнитин или аргинин, можно получать стабильные соли щелочных, щелочно-земельных металлов или при необходимости замещенные соли аммония. Основные группы соединений формулы I образуют с кислотами кислотно-аддитивные соли. В данном случае во внимание могут быть приняты как неорганические, так и органические кислоты, такие как хлористоводородная, бромистоводородная, серная, разбавленная серная, фосфорная, метансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 4-бромбензолсульфоновая, циклогексиламидосульфоновая, трифторметилсульфоновая, 2-гидроксиэтансульфоновая, уксусная, щавелевая, винная, янтарная, глицеринфосфорная, молочная, яблочная, адипиновая, лимонная, фумаровая, малеиновая, глюконовая, глюкуроновая, пальмитиновая или трифторуксусная кислота.
По способу c) соединение формулы I, если оно представляет собой смесь диастереоизомеров или энантиомеров или при выбранном варианте синтеза образуется в виде их смеси, разделяют на чистые стереоизомеры хроматографией при необходимости на хиральной неподвижной фазе, или, если рацемическое соединение формулы I способно к солеобразованию, может быть осуществлена также фракционная перекристаллизация диастереоизомерных солей, образованных с оптически активным основанием или кислотой в качестве вспомогательного вещества. В качестве хиральной неподвижной фазы для разделения энантиомеров тонкослойной или колоночной хроматографией приемлемыми являются, например, модифицированный силикагель (так называемые фазы Пиркле), а также высокомолекулярные кислородсодержащие углеводороды, такие как триацетилцеллюлоза. Для аналитических целей приемлемыми являются также газохроматографические способы разделения на хиральных неподвижных фазах после соответствующей дериватизации, известной специалистам в данной области техники. Для разделения энантиомеров рацемических карбоновых кислот с оптически активным, как правило, имеющимся в продаже основанием, таким как (-)-никотин, (+)- и (-)-фенилэтиламин, хининовые основания, L-лизин или L- и D-аргинин, которое образует диастереоизомерные соли с разной растворимостью, выделяют более трудно растворимый компонент в виде твердого вещества, а более хорошо растворимый диастереоизомер удаляют с маточным раствором и таким образом из полученных диастереоизомерных солей получают чистые энантиомеры. Принципиально подобным способом рацемические соединения формулы I, содержащие основную группу, такую как аминогруппа, можно перевести в чистые энантиомеры, используя оптически активную кислоту, такую, как (+)-камфор-10-сульфоновая кислота, D- и L-винная кислота, D- и L-молочная кислота, а также (+)- и (-)-миндальная кислота. Хиральные соединения, содержащие спиртовые гидроксигруппы или аминогруппы, также можно превращать в соответствующие сложные эфиры или амиды, используя соответственно активированные или при необходимости N-защищенные энантиомерно чистые аминокислоты, или, наоборот, хиральные карбоновые кислоты можно превращать в амиды, используя карбоксизащищенные энантиомерно чистые аминокислоты, или в соответствующие хиральные сложные эфиры, используя энантиомерно чистые гидроксикарбоновые кислоты, такие как молочная кислота. Затем хиральность аминокислотного или спиртового остатка, переведенного в энантиомерно чистую форму, может быть использована для разделения изомеров благодаря тому‚ что осуществляют разделение полученных таким образом диастереоизомеров перекристаллизацией или хроматографией на приемлемой неподвижной фазе и после этого совместно подаваемые хиральные молекулы вновь разделяют приемлемым способом.
При этом в случае некоторых соединений по настоящему изобретению имеется возможность для получения скелетных структур применять диастереоизомерно или энантиомерно чистые исходные вещества. Благодаря этому могут быть использованы также другие или более простые способы очистки конечного соединения. Такие исходные вещества были ранее получены известными из литературы способами в энантиомерно или диастереоизомерно чистой форме. Данное обстоятельство может, в частности, означать, что в синтезе скелетов молекул применяют энантиомерно селективные способы или осуществляют разделение энантиомеров (или диастереоизомеров) на более ранних стадиях синтеза, а не только на стадии получения конечных соединений. Упрощение разделения также может быть достигнуто благодаря тому, что осуществляют двух- или многостадийные процедуры.
Настоящее изобретение относится также к лекарственному средству, отличающемуся тем, что оно содержит эффективное количество по меньшей мере одного соединения формулы I и/или физиологически приемлемой соли соединения формулы I, и/или возможной стереоизомерной формы соединения формулы I совместно с фармацевтически и физиологически приемлемым эксципиентом, добавкой и/или другими активными и вспомогательными веществами.
На основе фармакологических свойств соединения по настоящему изобретению являются приемлемыми, например, для профилактики, предупреждения рецидивов и лечения любых заболеваний, излечение которых возможно путем ингибирования активируемого протеазой рецептора 1 (PAR1). Таким образом, соединения по настоящему изобретению являются приемлемыми как для профилактического, так и для терапевтического применения в отношении человека. Они являются приемлемыми как для неотложного, так и для длительного лечения. Соединения формулы I могут быть использованы в отношении пациентов, страдающих расстройствами здоровья или заболеваниями, сопровождаемыми тромбозами, эмболией, повышенной свертываемостью, фиброзными изменениями или воспалительными заболеваниями.
К таким заболеваниям относятся инфаркт миокарда, стенокардия и любые другие формы острой коронарной недостаточности, инсульт, периферические сосудистые заболевания, тромбоз глубоких вен, эмболия легочной артерии, эмболические или тромботические явления, обусловленные аритмией сердца, сердечно-сосудистые явления, такие как рестеноз после реваскуляризации, ангиопластики и аналогичных вмешательств, таких как имплантация стентов и операции шунтирования. Соединения формулы I могут быть использованы также в случае любых вмешательств, которые обуславливают контакт крови с чужеродными поверхностями, например, в случае пациентов, получающих диализ, и больных с постоянными катетерами.
Соединения формулы I могут быть использованы для уменьшения опасности тромбозов после хирургического вмешательства, например, после операций на коленном или тазобедренном суставе. Соединения формулы I являются приемлемыми для лечения больных в случае диссеминированного внутрисосудистого свертывания, сепсиса и других внутрисосудистых явлений, сопровождаемых воспалением. Соединения формулы I являются приемлемыми также для профилактики и лечения больных в случае атеросклероза, диабета, метаболического синдрома и их последствий. Расстройства гемостатической системы (например, отложения фибрина) причастны к механизмам, которые ведут к росту опухолей и опухолевому метастазированию, а также к воспалительным и дегенеративным заболеваниям суставов, таким как ревматоидный артрит и артроз. Соединения формулы I являются приемлемыми для замедления или предотвращения таких процессов.
Другими показаниями для применения соединений формулы I являются фиброзные изменения легких, такие, как хроническое обструктивное заболевание легких, респираторный дистресс-синдром у взрослых (ARDS), и заболевания глаз, такие, как отложения фибрина после операции на глазах. Соединения формулы I являются приемлемыми также для предотвращения и/или лечения рубцовых образований.
Введение лекарственного средства по настоящему изобретению может быть осуществлено перорально, путем ингаляции, ректально или чрескожно или путем подкожной, внутрисуставной, внутрибрюшинной или внутривенной инъекции. Предпочтительным является введение перорально. Соединениями формулы I можно покрывать стенты и другие поверхности, которые в теле входят в контакт с кровью.
Настоящее изобретение относится также к способу получения лекарственного средства, отличающемуся тем, что по меньшей мере одно соединение формулы I с фармацевтически и физиологически приемлемым эксципиентом и при необходимости с другими приемлемыми активными, дополнительными или вспомогательными веществами переводят в приемлемую для применения форму.
Приемлемые твердые или галеновы формы композиций представляют собой, например, гранулы, порошки, драже, таблетки, (микро)капсулы, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекций, а также препараты с пролонгированным высвобождением активного вещества, при производстве которых применяют традиционные вспомогательные вещества, такие как эксципиенты, дезинтеграторы, связующие, вещества, образующие покрытие, агенты набухания, скользящие вещества или смазывающие агенты, вкусовые добавки, подсластители и солюбилизаторы. В качестве часто применяемых вспомогательных веществ следует упомянуть такие вещества, как карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, целлюлоза и ее производные, животный жир и растительное масло, такие как, рыбий жир, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль, и растворители, такие как стерильная вода и одно- или многоатомные спирты, такие как глицерин.
Фармацевтические препараты предпочтительно производят и применяют в дозированной лекарственной форме, причем любая единица лекарственной формы содержит в качестве активного ингредиента определенную дозу соединения формулы I по настоящему изобретению. В случае твердых дозированных лекарственных форм, таких как таблетки, капсулы, драже или суппозитории, такая доза может составлять приблизительно 1000 мг и предпочтительно находится в интервале приблизительно от 50 до 300 мг, а в случае растворов для инъекций в форме ампул доза составляет приблизительно 300 мг и предпочтительно находится в интервале приблизительно от 10 до 100 мг.
Для лечения взрослого больного массой приблизительно 70 кг в зависимости от эффективности соединения формулы I суточные дозы назначают приблизительно от 2 до 1000 мг и предпочтительно приблизительно от 50 до 500 мг активного вещества. Однако при известных обстоятельствах могут быть установлены также более высокие или более низкие суточные дозы. Введение суточной дозы может быть осуществлено как путем однократного введения в виде одной единицы дозированной лекарственной формы или в виде нескольких меньших единиц дозированной лекарственной формы, так и путем многократного введения дробных доз через определенные интервалы.
Соединения формулы I могут быть применены как при монотерапии, так и в комбинации или совместно с любыми противотромбическими средствами (антикоагулянты и ингибиторы агрегации тромбоцитов), тромболитическими средствами (активаторы плазминогена любого типа), другими профибринолитическими активными веществами, противогипертоническими средствами, регуляторами содержания сахара в крови, антилипидными средствами и противоаритмическими средствами. При этом в качестве ингибитора агрегации тромбоцитов могут быть выбраны ингибиторы циклооксигеназы-1, такие как аспирин, нереверсивные антагонисты P2Y12, такие как клопидогрел или прасугрел, реверсивные антагонисты P2Y12, такие, как кангрелор или AZD6140 и H2-антагонисты тромбоксана A2/простагландина, такие как терутробан. Например, уже удалось доказать синергические эффекты блокады PAR1 в комбинации с блокадой P2Y12 (Eur. Heart J. 2007, 28, Abstract Supplement, 188).
Примеры
Характеристики конечных соединений, как правило, определяют способом хроматографии с детектированием ультрафиолетовым и масс-спектроскопическим детектором (сочетание ЖХ-УФ/ИЭР-МС (LCUV/ESI-MS)), а также способом ЯМР 1H. Для описания соединений приведены данные касательно соответствующего времени удерживания по ионному току (tуд при ЖХ-МС (LCMS-rt)) и соответствующего сигнала иона [M+H]+ при положительной ионизации в соответствующем масс-спектре. При невозможности получения массового сигнала иона [M+H]+ альтернативно приведены данные ЯМР 1H. Применяемые сокращения пояснены или соответствуют традиционным сокращениям.
Разделение на силикагеле осуществляли вручную (флеш-хроматография) или с поддержкой полуавтоматической системы с картриджами, такой как Companion (CombiFlash) или Flashmaster II (Jones Chromatography). Если не было указано иное, хроматографическое разделение на силикагеле осуществляли смесями "этилацетат/гептан", "дихлорметан/этанол" или "дихлорметан/метанол" в качестве элюента.
Выпаривание растворителей осуществляли, как правило, при пониженном давлении в интервале от 35 до 45°C на роторном испарителе и описывали выражениями "сгущали", "выпаривали на роторном испарителе" "упаривали досуха", "освобождали от растворителя", "удаляли или отделяли растворитель" или похожими выражениями.
Анализ ЖХ-УФ/МС осуществляли в следующих условиях.
Способ A (=Met-a)
|
Способ B (=Met-b):
|
Способ C (=Met-c):
|
Способ D (=Met-d):
|
Способ E (=Met-e):
|
Способ F (=Met-f):
|
Препаративную ВЭЖХ с обращенной фазой (ОФ) на силикагеле осуществляли приведенными далее способами.
Способ A представляет собой стандартный способ, если в описании не указано иное.
|
Способ B
|
Способ C
|
Реакции осуществляли в стандартной аппаратуре для проведения реакций, такой, как одно- или многогорлые колбы, вместимость которых, если не было указано иное, при необходимости составляла от 5 до 2000 мл и которые в зависимости от других требований были снабжены септами, пробками, холодильниками, перемешивающим устройством или иной оснасткой. Если не было указано иное, все реакции осуществляли в атмосфере аргона в качестве защитного газа и перемешивание осуществляли магнитной мешалкой. Реакции при нагревании микроволнами осуществляли в устройстве Emrys Optimizer производства компании Personal Chemistry в адаптированных по потребности сосудах вместимостью от 0,5 до 10 мл.
Растворители, такие, как дихлорметан, этанол, диметилформамид, метанол, изопропанол и другие, приобретали в торговой сети квалификации "сухой" и в таком виде использовали для проведения реакций, если однозначно не было указано иное.
Используемые сокращения:
|
|
Синтез основных исходных реагентов
W1.001
6-Этокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

6-Хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (W2.001a, 616 мг) растворяли в абсолютном этаноле (40 мл) и порциями прибавляли метилат натрия в твердом состоянии (990 мг). После перемешивания в течение 2 ч при 55°C прибавляли воду и водный слой три раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и сгущали. Было получено 709 мг неочищенного вещества требуемого соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,51 мин, [M+H]+: 180,1 (Met-a)
Аналогично были синтезированы:

|
|
W1.004
6-Циклобутокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Циклобутанол (2,43 мл) вносили при tкомн при перемешивании и охлаждали на бане со льдом приблизительно до 0°C. Затем порциями прибавляли гидрид натрия (146 мг). Образовавшуюся при этом суспензию в течение 30 мин нагревали при 55°C и порциями прибавляли гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001, 200 мг), суспендированный в циклобутаноле (5 мл). После перемешивания в течение 1,5 ч при 55°C смесь оставляли стоять в течение ночи при tкомн и затем прибавляли воду и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 136 мг соединения, указанного в заголовке, в виде твердого вещества.
tуд при ЖХ-МС: 0,82 мин, [M+H]+: 206,2 (Met-a)
Аналогично были получены исходные реагенты, приведенные далее:

|
|
W1.009
6-Циклопропилметокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Циклопропилметанол (2,64 мл) вносили в ДМФА (35 мл), в атмосфере аргона прибавляли гидрид натрия (795 мг) и перемешивали в течение 1 ч при 40°C. Затем прибавляли по каплям гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001; 1,66 г), растворенный в ДМФА (35 мл). Через 1 ч прибавляли воду и четыре раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом магния и упаривали на роторном испарителе. Остаток растирали с эфиром MtB, отделяли фильтрованием под вакуумом и сушили. Было получено 720 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,80 мин, [M+H]+: 206,1 (Met-f)
Аналогично были получены исходные реагенты, приведенные далее:

|
W1.013
6-Фенокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001; 200 мг) растворяли в NMP (4 мл). Затем при tкомн прибавляли фенолят натрия (185 мг). После перемешивания в течение часа при tкомн для завершения реакции смесь нагревали в течение 2 ч при 55°C. Затем прибавляли воду и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Неочищенное вещество очищали на силикагеле градиентным элюированием смесью "дихлорметан/метанол". Было получено 38 мг соединения, указанного в заголовке, в виде твердого вещества.
tуд при ЖХ-МС: 0,80 мин, [M+H]+: 228,1 (Met-a)
W1.014
6-(2,2,2-Трифторэтокси)-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Взаимодействие 2,2,2-трифторэтанола (1 мл), гидрида натрия (86 мг) и гидробромида 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001, 100 мг) осуществляли соответственно методике W1.004. Было получено 87 мг соединения, указанного в заголовке, в виде твердого вещества.
tуд при ЖХ-МС: 0,68 мин, [M+H]+: 234,1 (Met-a)
W1.020
6-Пиперидин-1-ил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001; 100 мг) вносили в воду (1 мл) и при перемешивании прибавляли пиперидин (260 мкл). Далее в течение 1 ч нагревали с обратным холодильником и после охлаждения удаляли растворитель. Затем прибавляли воду и образовавшееся при этом твердое вещество отделяли фильтрованием под вакуумом и сушили. Маточный раствор упаривали досуха и прибавляли небольшое количество воды. Полученное при этом твердое вещество отделяли фильтрованием под вакуумом и сушили. Затем фильтрат три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Три полученные фракции твердого вещества объединили, что составило 56 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,77 мин, [M+H]+: 219,1 (Met-a)
Аналогично было получено:
|
W1.022
N*6*,N*6*-Диэтил-[1,2,4]триазоло[4,3-b]пиридазин-3,6-диамин

Гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001; 150 мг) вносили в воду (5 мл) и при перемешивании прибавляли диэтиламин (814 мкл). Далее в течение 16 ч нагревали с обратным холодильником и затем прибавляли следующую порцию диэтиламина (407 мкл). После нагревания с обратным холодильником еще в течение 12 ч удаляли растворитель, прибавляли воду и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 67 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,72 мин, [M+H]+: 207,1 (Met-a)
W1.025
6-Этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Гидрохлорид (6-этилпиридазин-3-ил)гидразина (2 г) вносили в смесь этанола (30 мл) и воды (6 мл) при перемешивании при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 2,4 г в 7,5 мл этанола и 1,5 мл воды). После перемешивания в течение часа при tкомн смесь оставляли стоять в течение ночи и на следующий день перемешивали еще в течение 4 часов. Затем удаляли растворитель и остаток очищали препаративной ВЭЖХ (Met-C). Фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, подщелачивали насыщенным раствором карбоната калия и несколько раз экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Было получено 830 мг соединения, указанного в заголовке.
Водную фракцию с карбонатом калия также сушили вымораживанием, затем прибавляли небольшое количество воды и пять раз экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Было получено еще 180 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,32 мин, [M+H]+: 164,1 (Met-a)
W1.035
8-Метил-6-(3-метилоксетан-3-илметокси)-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

(3-Метилоксетан-3-ил)метанол (1,74 г) вносили в ДМФА (30 мл), в атмосфере аргона прибавляли гидрид натрия (408 мг) и перемешивали в течение 0,5 ч при 45°C. Затем гидробромид 6-хлор-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.002; 1,5 г) растворяли в ДМФА (30 мл) и прибавляли 1 экв раствора алкоголята (10 мл). После перемешивания в течение 30 мин при 45°C прибавляли еще 0,5 экв раствора алкоголята с последующим прибавлением по 0,5 экв через 30 и 60 мин. Затем прибавляли воду, реакционную смесь упаривали досуха и очищали на силикагеле (картридж массой 80 г, элюент "дихлорметан/метанол" с градиентом 0-20% в интервале 60 мин). Было получено 758 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,49 мин, [M+H]+: 250,1 (Met-b)
Аналогично было получено:
|
W1.040
N*6*,N*6*-Диэтил-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3,6-диамин

Гидробромид 6-хлор-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.002; 250 мг) растворяли в абсолютном ДМФА (2 мл) и прибавляли диэтиламин (7 мл). Далее реакционную смесь перемешивали при 80°C в течение 11 дней в нагревательном блоке. Затем удаляли растворитель, к остатку прибавляли небольшое количество воды и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Остаток очищали препаративной ВЭЖХ (Met-A), фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, подщелачивали насыщенным раствором карбоната калия и несколько раз экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Было получено 100 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,70 мин, [M+H]+: 221,2 (Met-b)
W1.071
7-Этил-6-(1-этилпропокси)-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

3-Пентанол (2,5 мл) вносили при tкомн при перемешивании. Затем при охлаждении льдом прибавляли гидрид натрия (91 мг). После перемешивания в течение 2,5 ч при 55°C прибавляли по каплям 6-хлор-7-этил-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (W2.007; 120 мг), растворенный в 3-пентаноле (2 мл) и ДМФА (4 мл). После перемешивания в течение 1 ч реакционную смесь оставляли стоять в течение ночи при tкомн, затем прибавляли воду и дихлорметан и далее экстрагировали три раза дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 126 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,90 мин, [M+H]+: 264,2 (Met-b)
W1.075
6-Этокси-8-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

6-Хлор-8-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (W2.003; 700 мг) растворяли при перемешивании в этаноле (100 мл). Затем к реакционной смеси прибавляли метилат натрия (724 мг) и перемешивали в течение 2 ч при tкомн. Затем нагревали в течение 3 ч при 45°C. После удаления растворителя к остатку прибавляли воду и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 670 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,64 мин, [M+H]+: 208,2 (Met-b)
W1.085
6-Этокси-7-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с трифторуксусной солью 6-хлор-7-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.011, 82 мг) и обработку осуществляли аналогично методике W1.075. Было получено 77 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,69 мин, [M+H]+: 208,2 (Met-b)
W1.100
Диэтиламид 3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-7-карбоновой кислоты

Диэтиламид 3-амино-6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-7-карбоновой кислоты (W2.019, 50 мг) вносили в этанол (5 мл) и при перемешивании прибавляли метилат натрия (28 мг). После перемешивания в течение 7 ч при tкомн и стояния в течение ночи удаляли растворитель и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 51 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,00 мин, [M+H]+: 279,2 (Met-b)
W1.101
Диэтиламид 3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-8-карбоновой кислоты

Синтез с диэтиламидом 3-амино-6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-8-карбоновой кислоты (W2.020, 50 мг) осуществляли аналогично методике W1.100. Было получено 51 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,04 мин, [M+H]+: 279,2 (Met-b)
W1.102
6-Этокси-N*7*,N*7*-диэтил-[1,2,4]триазоло[4,3-b]пиридазин-3,7-диамин

6-Хлор-N*7*,N*7*-диэтил-[1,2,4]триазоло[4,3-b]пиридазин-3,7-диамин (W2.021, 38 мг) вносили в этанол (7 мл) и прибавляли метилат натрия (24 мг). Реакционную смесь перемешивали в течение 4 ч при tкомн. Далее смесь перемешивали еще в течение 2 ч при 45°C. Затем смесь упаривали досуха и к остатку прибавляли воду, три раза экстрагировали ЭА и объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Было получено 30 мг соединения, указанного в заголовке, в виде неочищенного вещества, чистота которого была достаточна для осуществления дальнейшего взаимодействия.
tуд при ЖХ-МС: 1,13 мин, [M+H]+: 251,2 (Met-a)
W1.107
6-(1-Этилпропокси)-8-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с 6-хлор-8-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламином (W2.009, 80 мг) и обработку осуществляли аналогично методике W1.071. Затем неочищенное вещество очищали препаративной ВЭЖХ (Met-A), фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, подщелачивали насыщенным раствором карбоната калия и несколько раз экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Было получено 51 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,91 мин, [M+H]+: 264,2 (Met-b)
W1.112
7-Этил-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с 6-хлор-7-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламином (W2.011, 150 мг), обработку и очистку осуществляли аналогично методике W1.107. Было получено 103 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,87 мин, [M+H]+: 250,2 (Met-b)
W1.113
6-(1-Этилпропокси)-7-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с 6-хлор-7-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламином (W2.013, 100 мг) и обработку осуществляли аналогично методике W1.071. Было получено 132 мг указанного в заголовке соединения, в небольшой степени загрязненного ДМФА.
tуд при ЖХ-МС: 0,90 мин, [M+H]+: 264,2 (Met-b)
W1.114
7-Циклопропил-6-(1-этилпропокси)-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с 6-хлор-7-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламином (W2.012, 100 мг) и обработку осуществляли аналогично методике W1.071. Было получено 116 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,87 мин, [M+H]+: 262,2 (Met-b)
W1.125
6,7-Диэтокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

(5,6-Диэтоксипиридазин-3-ил)гидразин (W3.120; 50 мг) вносили при перемешивании в смесь этанола (3,5 мл) и воды (0,75 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 55 мг в 0,75 мл этанола и 0,15 мл воды). После перемешивания в течение 7 ч смесь оставляли стоять в течение ночи. Затем прибавляли еще 2 экв бромциана, растворенного в 0,75 мл этанола и 0,15 мл воды, и далее смесь перемешивали еще в течение 2 ч при tкомн и затем в течение 8 ч при 55°C. После охлаждения удаляли растворитель и к остатку прибавляли воду. После подщелачивания насыщенным раствором карбоната калия четыре раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Остаток очищали препаративной ВЭЖХ (Met-A). Фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, подщелачивали насыщенным раствором карбоната калия и четыре раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 36 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,54 мин, [M+H]+: 224,2 (Met-b)
W1.130
6-Метансульфонил-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Гидробромид 6-хлор-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.006; 1,0 г) и сульфинат натрия (916 мг) растворяли в ДМФА (6 мл) и перемешивали при 150°C в течение 45 мин при нагревании микроволнами. После удаления растворителя остаток очищали на силикагеле (картридж массой 40 г, элюент "дихлорметан/метанол" с градиентом 0-20% в интервале 60 мин). Было получено 1,02 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,33 мин, [M+H]+: 242,1 (Met-b)
W1.135
3-Амино-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-6-карбонитрил

6-Метансульфонил-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (W1.130; 1,0 г) растворяли в ДМФА (30 мл) и прибавляли цианид калия (405 мг). После перемешивания в течение 1 ч при 100°C смесь упаривали досуха. Остаток смешивали с ЭА и хроматографировали на короткой колонке с силакагелем, элюируя ЭА. Фракции упаривали на роторном испарителе. Было получено 560 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,27 мин, [M+H]+: 189,1 (Met-b)
W1.140
Гидрохлорид 3-амино-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-6-карбоновой кислоты

К 3-амино-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-6-карбонитрилу (W1.135; 600 мг) прибавляли концентрированную соляную кислоту (20 мл) и в течение 5 ч нагревали с обратным холодильником. Затем удаляли соляную кислоту, остаток обрабатывали водой и сушили вымораживанием. Было получено 790 мг указанного в заголовке соединения, чистота которого была достаточна для осуществления дальнейшего взаимодействия.
tуд при ЖХ-МС: 0,19 мин, [M+H]+: 189,1 (Met-c)
W1.145
Гидрохлорид метилового эфира 3-амино-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-6-карбоновой кислоты

Гидрохлорид 3-амино-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-6-карбоновой кислоты (W1.140; 780 мг) растворяли в метаноле (40 мл), по каплям медленно прибавляли тионилхлорид (1,9 мл) и затем перемешивали при 65°C. Через 2,5 ч смесь упаривали досуха и остаток очищали на силикагеле (картридж массой 24 г, элюент "дихлорметан/метанол" с градиентом 0-20% в интервале 60 мин). Было получено 602 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,37 мин, [M+H]+: 222,1 (Met-b)
W1.165
(6-Этокси-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)-(2,2,2-трифторэтил)амин

(6-Хлор-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)-(2,2,2-трифторэтил)амин (W2.150; 330 мг) вносили в этанол (25 мл) и прибавляли метилат натрия (90 мг). Реакционную смесь перемешивали в течение 4 ч при 50°C, затем прибавляли следующую порцию метилата натрия (10 мг) и перемешивали еще в течение 3 ч при 50°C. После стояния смеси в течение ночи прибавляли воду и упаривали досуха. Остаток растворяли в ЭА и три раза промывали водой. Фракцию ЭА сушили над сульфатом натрия, фильтровали и сгущали. Было получено 340 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,82 мин, [M+H]+: 290,2 (Met-b)
Аналогично были получены:
|
W1.175
[6-(1-Этилпропокси)-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил]метиламин

3-Пентанол (1,2 мл) вносили при перемешивании при tкомн. Затем при охлаждении льдом прибавляли гидрид натрия (77 мг). После перемешивания в течение 3 ч при 55°C прибавляли по каплям (6-хлор-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиламин (W2.169; 50 мг), растворенный в 3-пентаноле (1 мл) и ДМФА (2 мл). После перемешивания в течение 2 ч реакционную смесь оставляли стоять в течение ночи при tкомн, затем прибавляли воду и дихлорметан и далее экстрагировали три раза дихлорметаном. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 44 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,86 мин, [M+H]+: 264,2 (Met-b)
Аналогично методике W1.130 было получено:
|
Аналогично методике W1.135 было получено:
|
Аналогично методике W1.140 было получено:
|
Аналогично методике W1.145 было получено:
|
W1.250
Этиламид 7,8-диметил-3-метиламино-[1,2,4]триазоло[4,3-b]пиридазин-6-карбоновой кислоты

Гидрохлорид метилового эфира 7,8-диметил-3-метиламино-[1,2,4]триазоло[4,3-b]пиридазин-6-карбоновой кислоты (W1.220; 1,3 г) растворяли в метаноле (30 мл), охлаждали до 0°C, по каплям медленно прибавляли этиламин (11,44 мл; 2 M раствор в ТГФ) и в течение 6 ч перемешивали при 0°C. Далее прибавляли еще четыре эквивалента этиламина и смесь оставляли стоять при tкомн в течение примерно 60 часов. Затем реакционную смесь сгущали и очищали на силикагеле (картридж массой 40 г, элюент "дихлорметан/метанол" с градиентом 0-20% в интервале 60 мин). Было получено 1,12 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,81 мин, [M+H]+: 249,1 (Met-b)
Аналогично было получено:
|
W1.300
Гидробромид [1,2,4]триазоло[4,3-a]пиридин-3-иламина

2-Гидразинпиридин (654 мг) растворяли при перемешивании в смеси EtOH и воды (7,5/1,5 мл) при tкомн. Затем при перемешивании по каплям прибавляли раствор бромциана (раствор 666 мг в смеси "EtOH/вода", 1,5/0,3 мл). После перемешивания в течение 6 ч при tкомн удаляли растворитель, остаток обрабатывали водой и сушили вымораживанием. Было получено 1,3 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,15 мин, [M+H]+: 135,3 (Met-a)
W1.301
Гидробромид 6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-3-иламина и 6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-3-иламин

5-(Трифторметил)пирид-2-илгидразин (500 мг) растворяли при перемешивании при tкомн в смеси "EtOH/вода" (7,5/1,5 мл). Затем медленно и осторожно прибавляли по каплям раствор бромциана (раствор 314 мг в смеси "EtOH/вода", 0,75/0,15 мл) в течение 30 мин. После перемешивания в течение 3 ч при tкомн осадок отделяли фильтрованием под вакуумом и сушили в глубоком вакууме (создаваемом масляным насосом). Было получено 329 мг гидробромида 6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-3-иламина.
Маточный раствор упаривали досуха и остаток очищали препаративной ВЭЖХ. Фракции, содержавшие чистое вещество, объединяли, освобождали от ACN и водный остаток подщелачивали насыщенным раствором гидрокарбоната натрия. Затем три раза экстрагировали ЭА, а объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Было получено 110 мг трифторметил-[1,2,4]триазоло[4,3-a]пиридин-3-иламина.
tуд при ЖХ-МС: 0,54 мин, [M+H]+: 203,1 (Met-a)
W2.
W2.001
Гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина

3-Хлорпиридазин-6-ил)гидразин (5 г) растворяли при перемешивании в смеси EtOH (90 мл) и воды (36 мл) при tкомн. Затем по каплям осторожно прибавляли 5 M раствор бромциана (13 мл в ацетонитриле). После перемешивания в течение 4,5 ч смесь оставляли стоять в течение ночи и на следующий день при перемешивании прибавляли еще 5 M раствор бромциана (3 мл в ацетонитриле). Осадок, образовавшийся после перемешивания в течение дальнейших 4 ч, отделяли фильтрованием под вакуумом и сушили. Было получено 6,1 г соединения, указанного в заголовке. К маточному раствору прибавляли эфир MtB, образовавшийся при этом осадок отделяли фильтрованием под вакуумом и сушили, таким образом было получено еще 1,5 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,24 мин, [M+H]+: 170,1 (Met-a)
W2.001a
6-Хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Гидробромид 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина (W2.001; 1,1 г) растворяли в большом количестве воды и подщелачивали насыщенным раствором карбоната калия. Выпавший при этом осадок отделяли фильтрованием под вакуумом и сушили (388 мг).
После многократной экстракции маточного раствора дихлорметаном, высушивания объединенных органических фракций над сульфатом натрия, фильтрования и сгущения в целом получено еще 228 мг конечного соединения.
tуд при ЖХ-МС: 0,24 мин, [M+H]+: 170,1 (Met-a)
W2.002
Гидробромид 6-хлор-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина

(6-Хлор-4-метилпиридазин-3-ил)гидразин (W3.002; 4,6 г) вносили при перемешивании в смесь EtOH (330 мл) и воды (70 мл) при tкомн. Затем по каплям медленно прибавляли при tкомн раствор бромциана в смеси EtOH (170 мл) и воды (30 мл). После перемешивания в течение 6 ч при tкомн смесь оставляли стоять в течение ночи. Затем смесь упаривали досуха и остаток очищали на силикагеле (картридж массой 40 г, элюент "ДХМ/метанол" с градиентом 0-10% в интервале 30 мин). Было получено 7,3 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,17 мин, [M+H]+: 184,1 (Met-b)
W2.002b
Трифторуксуснокислая соль 6-хлор-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламина

(6-Хлор-4-метилпиридазин-3-ил)гидразин (W3.002; 432 мг) вносили при перемешивании в смесь этанола (15 мл) и воды (3 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 581 мг в 7 мл этанола и 1,5 мл воды). После перемешивания в течение 2 ч смесь оставляли стоять в течение ночи. Затем смесь перемешивали еще в течение 4 ч при tкомн и далее в течение 2 ч при 50°C. После охлаждения в течение ночи удаляли растворитель и остаток очищали препаративной ВЭЖХ (Met-A). Фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила и сушили вымораживанием. Было получено 158 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,44 мин, [M+H]+: 184,1 (Met-a)
W2.007
6-Хлор-7-этил-8-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

(6-Хлор-5-этил-4-метилпиридазин-3-ил)гидразин (W3.007; 340 мг) растворяли при перемешивании в смеси "этанол/вода" (10/2 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 386 мг в 5 мл этанола и 1 мл воды). После перемешивания в течение 5 ч при tкомн смесь оставляли стоять в течение ночи и затем удаляли растворитель и к остатку прибавляли воду. После подщелачивания насыщенным раствором карбоната калия три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 385 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,62 мин, [M+H]+: 212,1 (Met-b)
W2.008
6-Хлор-8-этил-7-метил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Трифторуксуснокислую соль (6-хлор-4-этил-5-метилпиридазин-3-ил)гидразина (W3.008; 340 мг) вносили при перемешивании в смесь EtOH (12 мл) и воды (2 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (240 мг), растворенный в 3 мл EtOH и 1 мл воды, и перемешивали в течение 8 ч. После стояния смеси в течение ночи прибавляли 0,5 экв раствора бромциана и перемешивали еще в течение 4,5 ч при tкомн и затем в течение 2 ч при 55°C. После стояния смеси в течение ночи удаляли растворитель и к остатку прибавляли воду. После подщелачивания насыщенным раствором карбоната калия три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 270 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,54 мин, [M+H]+: 212,1 (Met-b)
W2.009
6-Хлор-8-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Трифторуксуснокислую соль (6-хлор-4-изопропилпиридазин-3-ил)гидразина (W3.009; 258 мг) вносили при перемешивании в смесь "этанол/вода" (6/1 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 182 мг в смеси 1,5 мл EtOH и 0,5 мл воды). После перемешивания в течение 5 часов смесь оставляли стоять в течение ночи, затем прибавляли еще 1 экв раствора бромциана и перемешивали в течение дня. После стояния смеси в течение ночи удаляли растворитель и к остатку прибавляли воду. После подщелачивания насыщенным раствором карбоната калия три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 180 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,65 мин, [M+H]+: 212,1 (Met-b)
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 6,98 (1 H), 6,63 (2 H), 3,37 (1 H), 1,35 (6 H).
W2.011
6-Хлор-7-этил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с трифторуксуснокислой солью (6-хлор-5-этилпиридазин-3-ил)гидразина (W3.011; 169 мг) и обработку осуществляли аналогично методике W2.009. Было получено 130 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,33 мин, [M+H]+: 198,1 (Met-b)
W2.012
6-Хлор-7-циклопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Синтез с трифторуксуснокислой солью (6-хлор-5-циклопропилпиридазин-3-ил)гидразина (W3.012; 400 мг) и обработку осуществляли аналогично методике W2.008, причем вместо 0,5 экв дополнительно прибавляли один эквивалент раствора бромциана. Было получено 260 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,45 мин, [M+H]+: 210,1 (Met-b)
W2.013
6-Хлор-7-изопропил-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

Трифторуксуснокислую соль (6-хлор-5-изопропилпиридазин-3-ил)гидразина (W3.013; 400 мг) вносили при перемешивании в смесь "этанол/вода" (6/1 мл) при tкомн. Затем по каплям осторожно прибавляли бромциан (раствор 353 мг в смеси 1 мл EtOH и 0,5 мл воды). После перемешивания в течение 5 часов смесь оставляли стоять в течение ночи и затем перемешивали в течение следующего дня. После последующего стояния смеси в течение ночи удаляли растворитель и к остатку прибавляли воду. После подщелачивания насыщенным раствором карбоната калия три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 400 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,65 мин, [M+H]+: 212,1 (Met-b)
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,97 (1 H), 6,61 (2 H), 3,11 (1 H), 1,25 (6 H).
W2.019
Диэтиламид 3-амино-6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-7-карбоновой кислоты

Синтез с трифторуксуснокислой солью диэтиламида 3-хлор-6-гидразинпиридазин-4-карбоновой кислоты (W3.019; 390 мг) и обработку осуществляли аналогично методике W2.007. Было получено 285 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,94 мин, [M+H]+: 269,1 (Met-a)
W2.020
Диэтиламид 3-амино-6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-8-карбоновой кислоты

Синтез с трифторуксуснокислой солью диэтиламида 6-хлор-3-гидразинпиридазин-4-карбоновой кислоты (W3.020; 320 мг) и обработку осуществляли аналогично методике W2.007. Было получено 222 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 0,93 мин, [M+H]+: 269,1 (Met-a)
W2.021
6-Хлор-N*7*,N*7*-диэтил-[1,2,4]триазоло[4,3-b]пиридазин-3,7-диамин

Синтез с (3-хлор-6-гидразинпиридазин-4-ил)диэтиламином (W3.021; 215 мг) осуществляли аналогично методике W2.007, после чего удаляли смесь растворителей. Остаток очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, гидрокарбонатом натрия доводили значение pH до 9 и пять раз экстрагировали ДХМ. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 94 мг указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 1,04 мин, [M+H]+: 241,1 (Met-a)
W2.150
(6-Хлор-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)-(2,2,2-трифторэтил)амин

N*-(6-Хлор-4,5-диметилпиридазин-3-ил)амино-N-(2,2,2-трифторэтил)мочевину (W3.150; 400 мг) растворяли в оксихлориде фосфора (10 мл) и при перемешивании нагревали до 80°C. После перемешивания в течение 7 ч при 80°C смесь оставляли стоять в течение ночи и затем удаляли оксихлорид фосфора. Остаток растворяли в смеси "вода/ДХМ", гидрокарбонатом натрия доводили значение pH до 9 и разделяли слои. Водный слой три раза экстрагировали ДХМ, объединенные экстракты промывали насыщенным раствором хлорида натрия, сушили над карбонатом натрия, фильтровали и сгущали. Было получено 330 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,83 мин, [M+H]+: 280,1 (Met-b)
Аналогично методике W2.169 были получены:
|
W2.169
Гидробромид (6-хлор-7,8-диметил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиламина

N'-(6-Хлор-4,5-диметилпиридазин-3-ил)амино-N-метилтиомочевину (W3.169; 11,25 г) растворяли в этаноле (400 мл), прибавляли этиловый эфир бромуксусной кислоты (5,57 мл) и нагревали с обратным холодильником без доступа влаги. Через 2 ч удаляли растворитель и остаток очищали на силикагеле (картридж массой 120 г, элюент "ДХМ/метанол" с градиентом 0-10% в интервале 60 мин). Было получено 10,9 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,35 мин, [M+H]+: 212,1 (Met-b)
Аналогично методике W2.169 было получено:
|
W3
W3.002
(6-Хлор-4-метилпиридазин-3-ил)гидразин

Соединение синтезировано аналогично US 4578464.
tуд при ЖХ-МС: 0,21 мин, [M+H]+: 159,1 (Met-a)
W3.003 и W3.011
Трифторацетат (6-хлор-4-этилпиридазин-3-ил)гидразина и трифторацетат (6-хлор-5-этилпиридазин-3-ил)гидразина

3,6-Дихлор-4-этилпиридазин (W4.003, 2 порции по 2,4 г) помещали в 2 сосуда для нагревания микроволнами и в каждый сосуд прибавляли смесь моногидрата гидразина (6 мл) и диоксана (7 мл). Реакционную смесь нагревали микроволнами в течение 1 ч при 130°C. Затем содержимое обоих сосудов объединяли в круглодонной колбе и упаривали досуха. К остатку прибавляли воду и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Процесс обработки повторяли еще два раза. Полученный таким образом остаток разделяли препаративной ВЭЖХ (способ A с градиентом элюента, содержащего от 100% воды + 0,05% ТФК до 15% ацетонитрила/85% воды + 0,05% ТФК, в интервале 25 мин). Соответствующие фракции чистых веществ объединяли, в вакууме освобождали от ацетонитрила и сушили вымораживанием. Было получено 1,35 г (6-хлор-4-этилпиридазин-3-ил)гидразина в виде трифторацетата и 3,96 г (6-хлор-5-этилпиридазин-3-ил)гидразина в виде трифторацетата.
Трифторацетат (6-хлор-4-этилпиридазин-3-ил)гидразина, W3.003
tуд при ЖХ-МС: 0,20 мин, [M+H]+: 173,1 (Met-c)
Трифторацетат (6-хлор-5-этилпиридазин-3-ил)гидразина, W3.011
tуд при ЖХ-МС: 0,13 мин, [M+H]+: 173,1 (Met-b)
W3.005
(6-Хлор-5-метилпиридазин-3-ил)гидразин

Соединение синтезировано аналогично US 4578464.
tуд при ЖХ-МС: 0,26 мин, [M+H]+: 159,1 (Met-a)
W3.006
(6-Хлор-4,5-диметилпиридазин-3-ил)гидразин

К 3,6-дихлор-4,5-диметилпиридазину (W4.006; 29,0 г) прибавляли 160 мл раствора моногидрата гидразина (160 мл) и при перемешивании нагревали в течение 4 ч при 90°C. К реакционной смеси прибавляли воду, осадок отделяли фильтрованием под вакуумом, промывали водой и сушили над пентаоксидом фосфора. Было получено 27,2 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,15 мин, [M+H]+: 173,1 (Met-b)
W3.007 и W3.008
(6-Хлор-5-этил-4-метилпиридазин-3-ил)гидразин (также в виде соли ТФК) и трифторуксуснокислая соль (6-хлор-4-этил-5-метилпиридазин-3-ил)гидразина

Раствор 3,6-дихлор-4-этил-5-метилпиридазина (W4.007; 1 г) в диоксане (8 мл) с добавкой моногидрата гидразина (2 мл) помещали при tкомн в сосуд для нагревания микроволнами. Затем реакционную смесь нагревали микроволнами в течение 1 ч при 140°C. При стоянии в течение ночи выпадал осадок, который отделяли фильтрованием под вакуумом, промывали и сушили. Было получено 345 мг (6-хлор-5-этил-4-метилпиридазин-3-ил)гидразина в виде свободного основания.
Маточный раствор сгущали досуха и остаток очищали препаративной ВЭЖХ (Met-F). Соответствующие фракции чистых веществ объединяли, в вакууме освобождали от ацетонитрила и сушили вымораживанием. Было получено 340 мг трифторуксуснокислой соли (6-хлор-4-этил-5-метилпиридазин-3-ил)гидразина и 239 мг (6-хлор-5-этил-4-метилпиридазин-3-ил)гидразина в виде трифторацетата.
Трифторуксуснокислая соль (6-хлор-5-этил-4-метилпиридазин-3-ил)гидразина, W3.007
tуд при ЖХ-МС: 0,25 мин, [M+H]+: 187,1 (Met-b)
Трифторуксуснокислая соль (6-хлор-4-этил-5-метилпиридазин-3-ил)гидразина, W3.008
tуд при ЖХ-МС: 0,22 мин, [M+H]+: 187,1 (Met-b)
W3.009 и W3.013
Трифторуксуснокислая соль (6-хлор-4-изопропилпиридазин-3-ил)гидразина и трифторуксуснокислая соль (6-хлор-5-изопропилпиридазин-3-ил)гидразина

Синтез с 3,6-дихлор-4-изопропилпиридазином (W4.009; 2,3 г) осуществляли аналогично методике W3.007, после чего смесь упаривали досуха. Препаративной хроматографией (Met-F) было получено 260 мг трифторуксуснокислой соли (6-хлор-4-изопропилпиридазин-3-ил)гидразина и 2,16 г трифторуксуснокислой соли (6-хлор-5-изопропилпиридазин-3-ил)гидразина.
Трифторуксуснокислая соль (6-хлор-4-изопропилпиридазин-3-ил)гидразина, W3.009
tуд при ЖХ-МС: 0,20 мин, [M+H]+: 187,1 (Met-b)
Трифторуксуснокислая соль (6-хлор-5-изопропилпиридазин-3-ил)гидразина, W3.012
tуд при ЖХ-МС: 0,34 мин, [M+H]+: 187,1 (Met-b)
W3.010 и W3.012
Трифторуксуснокислая соль (6-хлор-4-циклопропилпиридазин-3-ил)гидразина и трифторуксуснокислая соль (6-хлор-5-циклопропилпиридазин-3-ил)гидразина

Синтез с 3,6-дихлор-4-циклопропилпиридазином (W4.010; 1,4 г) осуществляли аналогично методике W3.007, после чего смесь упаривали досуха. Препаративной хроматографией (Met-F) было получено 805 мг трифторуксуснокислой соли (6-хлор-4-циклопропилпиридазин-3-ил)гидразина и 708 г трифторуксуснокислой соли (6-хлор-5-циклопропилпиридазин-3-ил)гидразина.
Трифторуксуснокислая соль (6-хлор-4-циклопропилпиридазин-3-ил)гидразина, W3.010
tуд при ЖХ-МС: 0,15 мин, [M+H]+: 185,1 (Met-b)
Трифторуксуснокислая соль (6-хлор-5-циклопропилпиридазин-3-ил)гидразина, W3.012
tуд при ЖХ-МС: 0,22 мин, [M+H]+: 185,1 (Met-b)
W3.019 и W3.020
Трифторуксуснокислая соль диэтиламида 3-хлор-6-гидразинопиридазин-4-карбоновой кислоты и трифторуксуснокислая соль диэтиламида 6-хлор-3-гидразинопиридазин-4-карбоновой кислоты

Диэтиламид 3,6-дихлорпиридазин-4-карбоновой кислоты (W4.019; 18 г) суспендировали в воде (60 мл) и прибавляли моногидрат гидразина (2,8 мл). После перемешивания в течение 1 ч при 60°C смесь нагревали в течение 2 ч при 100°C. После охлаждения до tкомн прибавляли ДХМ и четыре раза экстрагировали ДХМ. Объединенные экстракты сушили над сульфатом натрия, фильтровали и сгущали. Остаток очищали препаративной ВЭЖХ (Met-C). Соответствующие фракции, содержавшие чистые вещества, объединяли, освобождали от ACN и сушили вымораживанием. Было получено 910 мг трифторуксуснокислой соли диэтиламида 3-хлор-6-гидразинопиридазин-4-карбоновой кислоты и 560 мг трифторуксуснокислой соли диэтиламида 6-хлор-3-гидразинопиридазин-4-карбоновой кислоты.
Трифторуксуснокислая соль диэтиламида 3-хлор-6-гидразинопиридазин-4-карбоновой кислоты
tуд при ЖХ-МС: 0,79 мин, [M+H]+: 244,1 (Met-a)
Трифторуксуснокислая соль диэтиламида 6-хлор-3-гидразинопиридазин-4-карбоновой кислоты
tуд при ЖХ-МС: 0,68 мин, [M+H]+: 244,1 (Met-a)
W3.021
Трифторуксуснокислая соль (3-хлор-6-гидразинопиридазин-4-ил)диэтиламина

(3,6-Дихлорпиридазин-4-ил)диэтиламин (W4.021; 500 мг) вносили при перемешивании в диоксан (20 мл) и прибавляли гидразингидрат (0,65 мл). Затем нагревали сначала в течение 2 ч при 80°C и далее в течение 3 ч с обратным холодильником. После стояния в течение примерно 60 часов смесь нагревали в течение еще 48 ч с обратным холодильником и после охлаждения удаляли растворитель. Остаток очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции, содержавшие чистые вещества, объединяли, освобождали от ACN, подщелачивали насыщенным раствором гидрокарбоната натрия и затем экстрагировали пять раз ЭА и пять раз ДХМ. Объединенные органические фракции сушили над сульфатом магния, фильтровали и сгущали. Было выделено 118 мг исходного соединения и 220 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,24 мин, [M+H]+: 220,1 (Met-a)
W3.120
(5,6-Диэтоксипиридазин-3-ил)гидразин

N-(5,6-Диэтоксипиридазин-3-ил)-N-нитроамин (W4.120; 114 мг) растворяли в уксусной кислоте (5 мл) и при перемешивании и охлаждении льдом в интервале от 10 до 20°C прибавляли по каплям к смеси цинка (130 мг) в воде (3 мл). После этого баню со льдом убирали и смесь перемешивали в течение 1 ч при tкомн. Затем подщелачивали 10 н. раствором гидроксида натрия, водный слой три раза экстрагировали ДХМ, объединенные фракции ДХМ сушили над сульфатом натрия, фильтровали и сгущали. Остаток очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции, содержавшие чистое вещество, объединяли, освобождали от ACN, подщелачивали насыщенным раствором карбоната калия и затем три раза экстрагировали ДХМ. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Было получено 50 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,37 мин, [M+H]+: 199,2 (Met-b)
W3.150
N*-(6-Хлор-4,5-диметилпиридазин-3-ил)амино-N-(2,2,2-трифторэтил)мочевина и гидрохлорид N*-(6-хлор-4,5-диметилпиридазин-3-ил)амино-N-(2,2,2-трифторэтил)мочевины

4-Нитрофенилхлорформиат (750 мг) растворяли в ТГФ (55 мл), при перемешивании прибавляли 2,2,2-трифторэтиламин (0,3 мл) и перемешивали при tкомн в течение 3 ч. Затем прибавляли (6-хлор-4,5-диметилпиридазин-3-ил)гидразин (W3.006, 620 мг), растворенный в ТГФ (100 мл), с последующим прибавлением триэтиламина (0,7 мл) и перемешивали в течение 3 ч при tкомн. Выпавший после стояния смеси в течение ночи осадок отделяли фильтрованием под вакуумом и сушили. Было получено 840 мг свободного основания, содержавшего заметное количество гидрохлорида триэтиламина.
Маточный раствор упаривали досуха и остаток очищали препаративной ВЭЖХ (Met-D). Фракции, содержавшие чистое вещество, объединяли и упаривали досуха. Было получено еще 400 мг указанного в заголовке соединения в виде гидрохлорида.
tуд при ЖХ-МС: 0,40 мин, [M+H]+: 298,1 (Met-b)
W3.166
N*-(6-Хлор-4,5-диметилпиридазин-3-ил)-амино-N-(циклопропил)тиомочевина

6-Хлор-4,5-диметилпиридазин-3-ил)гидразин (W3.006, 540 мг) растворяли в метиленхлориде (50 мл) и при перемешивании прибавляли циклопропилизотиоцианат (290 мкл). Смесь перемешивали в течение 7 ч при tкомн и затем оставляли стоять в течение ночи. После этого прибавляли диэтиловый эфир (50 мл), перемешивали в течение 3 ч и образовавшийся осадок отделяли фильтрованием под вакуумом. Осадок промывали эфиром и сушили в вакууме. Было получено 830 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,62 мин, [M+H]+: 272,1 (Met-b)
W3.167
N*-(6-Хлор-4,5-диметилпиридазин-3-ил)амино-N-(изопропил)тиомочевина

6-Хлор-4,5-диметилпиридазин-3-ил)гидразин (W3.006, 380 мг) приводили во взаимодействие с изопропилизотиоцианатом (235 мкл) и обрабатывали аналогично методике W3.166. Было получено в виде осадка 428 мг. Маточный раствор упаривали досуха и очищали на силикагеле (картридж массой 70 г, элюент "ДХМ/метанол" с градиентом 0-30% в интервале 30 мин). Таким образом, было получено еще 119 мг конечного соединения.
tуд при ЖХ-МС: 0,78 мин, [M+H]+: 274,1 (Met-b)
W3.168
N*-(6-Хлор-5-метилпиридазин-3-ил)амино-N-(изопропил)тиомочевина

6-Хлор-5-диметилпиридазин-3-ил)гидразин в виде трифторуксуснокислой соли (W3.005, 660 мг) растворяли в ДХМ (55 мл) и при перемешивании прибавляли изопропилизотиоцианат (258 мкл) и триэтиламин (310 мл). Обработку и выделение осуществляли аналогично методике W3.167. При этом в виде осадка было выделено 140 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,81 мин, [M+H]+: 260,1 (Met-b)
W3.169
N'-(6-Хлор-4,5-диметилпиридазин-3-ил)амино-N-метилтиомочевина

(6-Хлор-4,5-диметилпиридазин-3-ил)гидразин растворяли (W3.006; 8,00 г) в ДХМ (400 мл) и прибавляли метилизотиоцианат (3,39 г). Далее смесь перемешивали в течение 24 ч при tкомн и затем оставляли стоять в течение примерно 60 часов. Осадок отделяли фильтрованием, промывали ДХМ и сушили в сушильном шкафу при 45°C. Было получено 11,25 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,29 мин, [M+H]+: 246,1 (Met-b)
W3.170
N'-(6-Хлор-4-метилпиридазин-3-ил)амино-N-метилтиомочевина

Синтез с (6-хлор-4-метилпиридазин-3-ил)гидразином (W3.002; 5,5 г) и обработку осуществляли аналогично методике W3.169. Однако вместо одного дня смесь перемешивали в течение трех дней. Было получено 7,75 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,20 мин, [M+H]+: 232,1 (Met-b)
W4
W4.003 и W4.014
3,6-Дихлор-4-этилпиридазин и 3,6-дихлор-4,5-диэтилпиридазин

Соединения получали аналогично Samaritoni, Org. Prep. Proc. Int. 117 (1988)
3,6-Дихлорпиридазин (10 г), нитрат серебра (5,7 г) и пропионовую кислоту (7,5 мл) вносили в воду (125 мл) и при 50°C по каплям прибавляли концентрированную серную кислоту (11 мл). По окончании прибавления реакционную смесь нагревали до 60°C и медленно прибавляли раствор персульфата аммония (46 г) в воде (125 мл) в течение 20 мин. По окончании прибавления смесь нагревали в течение 30 мин при 70°C. После стояния в течение ночи реакционную смесь выливали в смесь "лед/вода" и значение pH доводили 25%-м раствором гидроксида аммония до 7. Затем три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Остаток очищали препаративной ВЭЖХ (Met-C). Соответствующие фракции чистых веществ объединяли, в вакууме освобождали от ацетонитрила и три раза экстрагировали дихлорметаном. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 6,6 г 3,6-дихлор-4-этилпиридазина и 3,0 г 3,6-дихлор-4,5-диэтилпиридазина.
3,6-Дихлор-4-этилпиридазин, W4.003
tуд при ЖХ-МС: 0,83 мин, [M+H]+: 177,1 (Met-b)
3,6-Дихлор-4,5-диэтилпиридазин, W4.014
tуд при ЖХ-МС: 1,02 мин, [M+H]+: 205,1 (Met-b)
W4.006
3,6-Дихлор-4,5-диметилпиридазин

4,5-Диметил-1,2-дигидропиридазин-3,6-дион (W5.006; 69,7 г) суспендировали в оксихлориде фосфора (150 мл) и нагревали в течение 2 ч при 80°C. После охлаждения выливали в ледяную воду и значение pH осторожно доводили 10 M раствором NaOH при охлаждении льдом до 10. Осадок отделяли фильтрованием под вакуумом, промывали водой и сушили. Было получено 78,3 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,63 мин, [M+H]+: 177,1 (Met-b)
W4.009 и W4.015
3,6-Дихлор-4-изопропилпиридазин и 3,6-дихлор-4,5-диизопропилпиридазин

Данное соединение синтезировали аналогично методике W4.003. Из 2,5 г 3,6-дихлорпиридазина и изомасляной кислоты (2,34 мл) было получено 2,46 г 3,6-дихлор-4-изопропилпиридазина и 0,33 г 3,6-дихлор-4,5-диизопропилпиридазина.
3,6-Дихлор-4-изопропилпиридазин, W4.009
tуд при ЖХ-МС: 0,96 мин, [M+H]+: 191,1 (Met-b)
3,6-Дихлор-4,5-диизопропилпиридазин, W4.015
tуд при ЖХ-МС: 1,14 мин, [M+H]+: 233,1 (Met-b)
W4.010 и W4.016
3,6-Дихлор-4-циклопропилпиридазин и 3,6-дихлор-4,5-дициклопропилпиридазин

Данное соединение синтезировали аналогично методике W4.003. Из 3 г 3,6-дихлорпиридазина и циклопропанкарбоновой кислоты (2,41 мл) было получено 1,6 г 3,6-дихлор-4-циклопропилпиридазина и 0,96 г 3,6-дихлор-4,5-дициклопропилпиридазина.
3,6-Дихлор-4-циклопропилпиридазин, W4.010
tуд при ЖХ-МС: 0,87 мин, [M+H]+: 189,1 (Met-b)
3,6-Дихлор-4,5-дициклопропилпиридазин, W4.016
tуд при ЖХ-МС: 1,05 мин, [M+H]+: 229,1 (Met-b)
W4.019
Диэтиламид 3,6-дихлорпиридазин-4-карбоновой кислоты

3,6-Дихлорпиридазин-4-карбонилхлорид (2,5 г) вносили при tкомн в ДХМ (25 мл). Затем по каплям медленно прибавляли при перемешивании диэтиламин (1,5 мл), предварительно растворенный в ДХМ (5 мл). После перемешивания в течение 3 ч при tкомн прибавляли воду и три раза экстрагировали ДХМ. Объединенные фракции ДХМ сушили над сульфатом натрия, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 70 г, градиентный элюент "н-гептан/ЭА"). Было получено 1,8 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,97 мин, [M+H]+: 248,1 (Met-a)
W4.021
(3,6-Дихлорпиридазин-4-ил)диэтиламин

3,4,6-Трихлорпиридазин (2 г) и диэтиламин (2,4 мл) вносили в толуол (10 мл) и оставляли стоять в течение 3 дней при tкомн. Затем прибавляли воду и ЭА и отделяли слой ЭА. Фракцию ЭА три раза промывали водой, сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 70 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 60 мин). Было получено 1,1 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,24 мин, [M+H]+: 248,1 (Met-a)
W4.120
N-(5,6-Диэтоксипиридазин-3-ил)-N-нитроамин

5,6-Диэтоксипиридазин-3-иламин (аналогично T. Horie в Chemical & Pharmaceutical Bulletin (1963), 11(9), 1157-67; 160 мг) растворяли в концентрированной серной кислоте (4 мл) при tкомн. Затем охлаждали до 0°C и по каплям прибавляли 2 мл смеси концентрированной азотной кислоты и концентрированной серной кислоты с соотношением 1:1. После выдерживания в течение 20 мин при 0°C баню со льдом убирали и смесь перемешивали в течение 4 ч. Затем снова охлаждали до 0°C, прибавляли еще 0,5 мл смеси кислот и далее перемешивали в течение часа при 0°C. Затем при охлаждении льдом прибавляли лед. После прибавления ДХМ разделяли слои и три раза экстрагировали ДХМ. Объединенные фракции ДХМ сушили над сульфатом натрия, фильтровали и сгущали. Было получено 188 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,81 мин, [M+H]+: 236,2 (Met-b)
W5
W5.006
4,5-Диметил-1,2-дигидропиридазин-3,6-дион

Дигидрохлорид гидразина (83,6 г) растворяли в воде (20 мл), нагревали до 100°C и при перемешивании прибавляли 3,4-диметилфуран-2,5-дион (100,4 г). Затем в течение 3 ч нагревали с обратным холодильником. Образовавшийся осадок отделяли фильтрованием под вакуумом, промывали водой и сушили. Остаток суспендировали в ЭА (2 л), отделяли фильтрованием под вакуумом и сушили. Было получено 69,7 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,19 мин, [M+H]+: 141,1 (Met-b)
Синтез вариативных исходных реагентов
O1.001
N-[3-(2-Бромацетил)-5-(пентафторсульфанил)фенил]ацетамид

N-[3-Ацетил-5-(пентафторсульфанил)фенил]ацетамид (859 мг, см. синтез примера 1) растворяли в смеси метанола (10 мл) и ТГФ (10 мл) и при перемешивании порциями прибавляли фенилтриметиламмонийтрибромид (1,065 г). После перемешивания в течение 2 ч при tкомн далее смесь нагревали в течение 3 ч при 40°C. После охлаждения реакционную смесь прибавляли к 2 н. раствору серной кислоты и водный слой 3 раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и сгущали. Неочищенное вещество очищали на силикагеле, элюируя смесью "этилацетат/гептан". Было получено 480 мг требуемого соединения.
tуд при ЖХ-МС: 1,47 мин, [M+H]+: 382,0 (Met-a)
O1.002
2-Бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон (Apollo Scientific)

O1.003
2-Бром-1-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)этанон

Соединение получено соответственно WO 2004/078721.
O1.004
2-Бром-1-(4-метокси-3-морфолин-4-ил-5-трифторметилфенил)этанон

4-[5-(1,1-Диметоксиэтил)-2-метокси-3-трифторметилфенил]морфолин (O2.004; 460 мг) растворяли в смеси метанола (1,4 мл) и ТГФ (4 мл), охлаждали до 7°C и при перемешивании порциями прибавляли фенилтриметиламмонийтрибромид (530 мг). После перемешивания в течение 3 ч при tкомн смесь оставляли стоять в течение ночи. Затем прибавляли водный раствор тиосульфата (0,8 мл; w=5%) и воду (4 мл), далее прибавляли ЭА и три раза экстрагировали ЭА. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Остаток растворяли в смеси ацетонитрила (20 мл) и воды (0,5 мл) и при перемешивании прибавляли ТФК (0,5 мл). После перемешивания в течение 5 ч при tкомн удаляли растворитель, к остатку прибавляли воду, нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Неочищенное вещество очищали на силикагеле, элюируя смесью "этилацетат/гептан". Было получено 200 мг требуемого соединения.
tуд при ЖХ-МС: 1,67 мин, [M+H]+: 382,0 (Met-a)
O1.006
2-Бром-1-[3-метиламино-5-(пентафторсульфанил)фенил]этанон

К N-[3-(2-бромацетил)-5-(пентафторсульфанил)фенил]-2,2,2-трифтор-N-метилацетамиду (O1.075; 1,2 г) прибавляли воду (15 мл) и при перемешивании и охлаждении льдом прибавляли по каплям концентрированную серную кислоту (15 мл). Смесь нагревали до 80°C и перемешивали в течение 7 ч при данной температуре. После охлаждения реакционную смесь медленно прибавляли к смеси 10 н. раствора гидроксида натрия и ЭА и водный слой пять раз экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Остаток очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, нейтрализовали гидрокарбонатом натрия и три раза экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было выделено 420 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,64 мин, [M+H]+: 354,0 (Met-a)
O1.007
2-Бром-1-[3-метокси-5-(пентафторсульфанил)фенил]этанон

1-[3-Метокси-5-(пентафторсульфанил)фенил]этанон (O2.007; 1,63 г) растворяли в ТГФ (150 мл) и при перемешивании прибавляли при tкомн фенилтриметиламмонийтрибромид (2,2 г). После перемешивания в течение 2 ч при tкомн прибавляли воду, нейтрализовали раствором гидрокарбоната натрия и три раза экстрагировали ЭА. Щелочной водный слой 3 раза экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Остаток очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила, нейтрализовали гидрокарбонатом натрия и три раза экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было выделено 1,27 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,65 мин, [M+H]+: 354,9 (Met-b)
O1.008
2-Бром-1-(3-трет-бутил-5-этоксиметилфенил)этанон

1-(3-трет-бутил-5-этоксиметилфенил)этанон (O2.008; 550 мг) растворяли в смеси "метанол/ТГФ" (10 мл/10 мл), при перемешивании прибавляли фенилтриметиламмонийтрибромид (882 мг) и перемешивали в течение 2 ч при tкомн. Затем реакционную смесь выливали в ДХМ (200 мл) и по одному разу тщательно промывали 5%-м раствором тиосульфата натрия и водой. Затем фракцию ДХМ сушили и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 566 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,83 мин, [M+H]+: 313,2 (Met-a)
Аналогично были получены:
|
O1.014
2-Бром-1-(3-метокси-5-трифторметилфенил)этанон

1-(3-Метокси-5-трифторметилфенил)этанон (O2.014, 50 мг) растворяли в ДХМ (0,8 мл) и при tкомн прибавляли по каплям к смеси бромида меди (II) (102 мг) и ЭА (1,2 мл). После нагревания в течение 2 ч с обратным холодильником реакционную смесь оставляли стоять в течение ночи, затем фильтровали под вакуумом через целит, тщательно промывали ЭА и упаривали фильтрат досуха. Остаток обрабатывали ЭА и вдвое разбавленным насыщенным раствором гидрокарбоната натрия и затем два раза экстрагировали ЭА. Объединенные фракции ЭА промывали вдвое разбавленным насыщенным раствором гидрокарбоната натрия, сушили над сульфатом натрия, фильтровали и сгущали. Неочищенное вещество очищали препаративной ВЭЖХ (Met-A). Соответствующие фракции чистого вещества объединяли, в вакууме освобождали от ацетонитрила и три раза экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом натрия и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было выделено 39 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,64 мин, [M+H]+: 297,0 (Met-a)
Аналогично методике O1.008 были получены:
|
O1.022
2-Бром-1-(8-трет-бутил-4-метил-3,4-дигидро-2H-бензо[1,4]оксазин-6-ил)этанон

1-(8-трет-Бутил-4-метил-3,4-дигидро-2H-бензо[1,4]оксазин-6-ил)этанон (250 мг, приобретено у компании Chembiotek, Индия) нагревали в смеси уксусной кислоты (4 мл) и толуола (8 мл) в интервале от 50 до 55°C. При данной температуре по каплям осторожно прибавляли бром (раствор 200 мг в уксусной кислоте). Через 2,5 ч нагревание прекращали, при tкомн прибавляли ледяную воду и три раза экстрагировали толуолом. Объединенные органические фракции сушили над сульфатом натрия, фильтровали и сгущали. Неочищенное вещество очищали на силикагеле, при этом было получено 65 мг требуемого соединения, а также было получено еще 43 мг слегка загрязненного требуемого соединения и 37 мг исходного соединения.
tуд при ЖХ-МС: 1,81 мин, [M+H]+: 326,0 (Met-a)
O1.030
2-Бром-1-(3-изопропил-5-метоксифенил)этанон

1-(3-Изопропил-5-метоксифенил)этанон (O2.030; 425 мг) растворяли в смеси "метанол/ТГФ" (15 мл/15 мл) и при перемешивании прибавляли фенилтриметиламмонийтрибромид (831 мг). После перемешивания в течение 3 ч при tкомн реакционную смесь прибавляли к 50 мл 20%-го раствора лимонной кислоты и перемешивали в течение 1 ч. После прибавления воды и ЭА отделяли слой ЭА, сушили и сгущали. Остаток растворяли в ацетонитриле (50 мл) и прибавляли к 2 н. раствору серной кислоты (15 мл). После выдерживания в течение 2 ч при tкомн прибавляли воду и экстрагировали ЭА. Фракцию ЭА промывали насыщенным раствором гидрокарбоната натрия, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 520 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,65 мин, [M+H]+: 271,1 (Met-a)
O1.031
2-Бром-1-(3-циклогексилметокси-5-этоксифенил)этанон

Исходя из 1-(3-циклогексилметокси-5-этоксифенил)этанона (O2.031, 1,76 г) соединение, указанное в заголовке, было получено аналогично методике O1.008. Для дальнейшей очистки, но только после хроматографии на силикагеле, использовали очистку препаративной ВЭЖХ. Было получено 370 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 2,11 мин, [M+H]+: 355,1 (Met-a)
O1.032
2-Бром-1-(3-бром-5-метоксифенил)этанон

1-(3-Бром-5-метоксифенил)этанон (O2.032, 1,45 г) растворяли в смеси "метанол/ТГФ" (40 мл/40 мл) и при перемешивании прибавляли фенилтриметиламмонийтрибромид (2,38 г). После перемешивания в течение 24 ч при tкомн прибавляли воду и ЭА. Затем фракцию ЭА отделяли, сушили и сгущали. Остаток растворяли в ацетонитриле (50 мл) и прибавляли к 2 н. раствору серной кислоты (15 мл). После выдерживания в течение 1 ч при tкомн прибавляли воду и экстрагировали два раза ЭА. Фракции ЭА промывали насыщенным раствором гидрокарбоната натрия, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 1,39 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,71 (1 H), 7,48 (2 H), 4,97 (2 H), 3,84 (3 H)
O1.034
2-Бром-1-[3-(3,3-диметилбутокси)-5-этоксифенил]этанон

Исходя из 1-[3-(3,3-диметилбутокси)-5-этоксифенил]этанона (O2.034; 950 мг) соединение, указанное в заголовке, получали аналогично методике O1.031. Было получено 236 мг указанного в заголовке соединения, загрязненного в небольшой степени.
tуд при ЖХ-МС: 2,06 мин, [M+H]+: 343,2 (Met-a)
O1.035
2-Бром-1-(3-циклогексилметокси-5-метоксифенил)этанон

Синтез с 1-(3-циклогексилметокси-5-метоксифенил)этаноном (O2.035; 1,33 г) осуществляли аналогично методике O1.032. Однако при этом вместо 24 ч смесь перемешивали при tкомн только в течение 3 ч. Было получено 950 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 2,03 мин, [M+H]+: 341,2 (Met-a)
O1.041
2-Бром-1-(5-бром-2,3-диметоксифенил)этанон

Синтез с 1-(5-бром-2,3-диметоксифенил)этаноном (O2.041; 1,1 г) осуществляли аналогично методике O1.032. Было получено 1,21 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,62 мин, [M+H]+: 337,0 (Met-a)
O1.042
2-Бром-1-(3-хлор-4,5-диметоксифенил)этанон

Синтез с 1-(3-хлор-4,5-диметоксифенил)этаноном (O2.042; 490 мг) осуществляли аналогично методике O1.032. Было получено 577 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,54 мин, [M+H]+: 293,0 (Met-a)
O1.043
2-Бром-1-[3-трет-бутил-5-(2-метоксиэтокси)фенил]этанон

1-[3-Трет-бутил-5-(2-метоксиэтокси)фенил]этанон (O2.043; 1 г) растворяли в смеси "метанол/ТГФ" (25 мл/25 мл), при перемешивании прибавляли фенилтриметиламмонийтрибромид (882 мг) и перемешивали в течение ночи при tкомн. Затем прибавляли 50 мл 20%-го раствора лимонной кислоты и перемешивали в течение 1 ч. Далее прибавляли ДХМ (200 мл) и три раза экстрагировали ДХМ. Затем объединенные фракции ДХМ сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-30% в интервале 30 мин). Было получено 1,31 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,72 мин, [M+H]+: 329,2 (Met-a)
O1.044
2-Бром-1-[3-морфолин-4-ил-5-(пентафторсульфанил)фенил]этанон

1-[3-Морфолин-4-ил-5-(пентафторсульфанил)фенил]этанон (O2.044; 1,1 г) растворяли в смеси "метанол/ТГФ" (20/20 мл) и при перемешивании прибавляли фенилтриметиламмонийтрибромид (1,25 г). После перемешивания в течение 27 ч при tкомн прибавляли 50 мл 20%-го раствора лимонной кислоты и перемешивали в течение 1 ч. После прибавления ДХМ (100 мл) слой ДХМ отделяли, сушили и сгущали. Остаток растворяли в ацетонитриле (100 мл) и прибавляли к 2 н. раствору серной кислоты (20 мл). После перемешивания в течение 24 ч при tкомн прибавляли воду и экстрагировали ЭА. Фракцию ЭА промывали насыщенным раствором гидрокарбоната натрия, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 80 г, элюент "н-гептан/ЭА" с градиентом 0-60% в интервале 40 мин). Было получено 866 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,69 мин, [M+H]+: 410,0 (Met-a)
O1.061
2-Бром-1-[3-трет-бутил-5-(2-гидроксиэтокси)фенил]этанон

1-{3-трет-Бутил-5-[2-(тетрагидропиран-2-илокси)этокси]фенил}этанон (O2.061; 3,9 г) растворяли в смеси "метанол/ТГФ" (60 мл/60 мл) и при перемешивании прибавляли фенилтриметиламмонийтрибромид (5,03 г). После перемешивания в течение 3 ч при tкомн реакционную смесь прибавляли к 20%-му раствору лимонной кислоты и перемешивали в течение 1 ч. После прибавления ЭА отделяли слой ЭА, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 80 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 60 мин). Было получено 2,56 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,90 мин, [M+H]+: 315,0 (Met-b)
|
O1.071
2-Бром-1-[3-трет-бутил-5-(3-гидроксипропокси)-4-метоксифенил]этанон

1-{3-Трет-бутил-4-метокси-5-[3-(тетрагидропиран-2-илокси)пропокси]фенил}этанон (O2.071; 12,7 г) растворяли в смеси "метанол/ТГФ" (200/200 мл) и при перемешивании прибавляли фенилтриметиламмонийтрибромид (13,1 г). При tкомн смесь перемешивали в течение 1 ч, затем прибавляли ДХМ и один раз промывали 5%-м раствором тиосульфата натрия. Фракцию ДХМ сушили над сульфатом магния, фильтровали и сгущали. Остаток растворяли в ацетонитриле (100 мл) и прибавляли 48%-ю бромистоводородную кислоту (5,91 мл). Смесь оставляли стоять в течение 1 ч, затем прибавляли воду, экстрагировали ЭА, объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 120 г, элюент "н-гептан/эфир MtB" с градиентом 0-100% в интервале 60 мин). Было получено 3,29 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,01 мин, [M+H]+: 359,1 (Met-b)
O1.075
N-[3-(2-Бромацетил)-5-(пентафторсульфанил)фенил]-2,2,2-трифтор-N-метилацетамид

N-[3-Ацетил-5-(пентафторсульфанил)фенил]-2,2,2-трифтор-N-метилацетамид (O2.075; 1,03 г) растворяли в смеси метанол (20 мл) и ТГФ (20 мл). При перемешивании прибавляли фенилтриметиламмонийтрибромид (1,05 г). После перемешивания в течение 5 ч при tкомн смесь оставляли стоять в течение ночи, затем прибавляли следующую порцию фенилтриметиламмонийтрибромида (100 мг) и нагревали в течение 2 ч при 60°C. После охлаждения реакционную смесь прибавляли к 2 н. раствору серной кислоты и перемешивали в течение 10 мин. Затем водный слой три раза экстрагировали ЭА. Объединенные органические фракции сушили над сульфатом магния и после отделения фильтрованием осушителя упаривали в вакууме досуха. Было получено 1,2 г указанного в заголовке соединения, чистота которого была достаточна для осуществления дальнейшего взаимодействия.
tуд при ЖХ-МС: 1,72 мин, [M+H]+: 449,9 (Met-a)
O2.004
4-[5-(1,1-Диметоксиэтил)-2-метокси-3-трифторметилфенил]морфолин

1-Бром-5-(1,1-диметоксиэтил)-2-метокси-3-трифторметилбензол (O3.004; 700 мг) вносили в диоксан (7 мл) и последовательно прибавляли ацетат Pd (II) (46 мг), карбонат цезия (2 г), 9,9-диметил-4,5-бис-(дифенилфосфино)ксантен (118 мг), а также морфолин (0,27 мл). Затем реакционную смесь нагревали в течение 7 ч при 90°C и далее оставляли стоять в течение ночи. После этого смесь фильтровали, а фильтрат упаривали на роторном испарителе. Остаток очищали на силикагеле (картридж массой 50 г, градиентный элюент "н-гептан/ЭА"). Было получено 433 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,55 мин, [M+H]+: 304,0 (Met-a)
O2.007
1-[3-Метокси-5-(пентафторсульфанил)фенил]этанон

3,N-Диметокси-N-метил-5-(пентафторсульфанил)бензамид (O3.007; 2,0 г) растворяли в абсолютном ТГФ (60 мл) и при 0°C при перемешивании по каплям прибавляли метилмагнийбромид (5,2 мл, 3 M раствор в диэтиловом эфире). После прибавления баню со льдом убирали и смесь перемешивали в течение 2 ч при tкомн. Затем при охлаждении по каплям прибавляли 1 н. раствор соляной кислоты и далее прибавляли воду и этилацетат. Органический слой отделяли, а водный слой 2 раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали препаративной ВЭЖХ (Met-A). Фракции, содержавшие конечное вещество, объединяли, освобождали от ацетонитрила и три раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,63 г требуемого соединения.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.]: 7,87 (1 H), 7,75 (1 H), 7,67 (1 H), 3,91 (3 H), 2,64 (3 H).
O2.008
1-(3-Трет-бутил-5-этоксиметилфенил)этанон

Синтез с 3-трет-бутил-N-метокси-5-метоксиметил-N-метилбензамидом (O3.008; 854 мг) осуществляли аналогично методике O2.043. Было получено 550 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,70 мин, [M+H]+: 235,3 (Met-a)
O2.009
1-(3-Трет-бутил-5-циклопропилметоксиметилфенил)этанон

Исходя из метилового эфира 3-трет-бутил-5-гидроксиметилбензойной кислоты и циклопропилметилбромида указанное в заголовке соединение (600 мг) получали аналогично методикам O5.008-O2.008.
tуд при ЖХ-МС: 1,81 мин, [M+H]+: 261,2 (Met-a)
O2.010
1-(3-Трет-бутил-4,5-диэтоксифенил)этанон

1-(3-Трет-бутил-4-этокси-5-гидроксифенил)этанон (O3.010; 470 мг) и этилиодид (193 мкл) растворяли в ДМФА (6,2 мл) и прибавляли гидрид натрия (57 мг). После перемешивания в течение 0,5 ч при tкомн ДМФА удаляли, остаток растворяли в ЭА, промывали водой, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-30% в интервале 60 мин). Было получено 420 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,93 мин, [M+H]+: 265,2 (Met-a)
O2.011
1-(3-Трет-бутил-5-этоксифенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксибензойной кислоты (O6.043) с этилиодидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.043-O2.043 получали соединение, указанное в заголовке. Было получено 390 мг соединения.
tуд при ЖХ-МС: 1,72 мин, [M+H]+: 221,3 (Met-a)
O2.012
1-(3-Трет-бутил-5-пропоксиметилфенил)этанон

Исходя из метилового эфира 3-трет-бутил-5-гидроксиметилбензойной кислоты и пропилиодида указанное в заголовке соединение (333 мг) получали аналогично методикам O5.008-O2.008.
tуд при ЖХ-МС: 1,81 мин, [M+H]+: 261,2 (Met-a)
O2.013
1-(3-Трет-бутил-4,5-бис-циклопропилметоксифенил)этанон

Исходя из 2-бром-6-трет-бутил-4-(1,1-диметоксиэтил)фенола и циклопропилбромида указанное в заголовке соединение (547 мг) получали аналогично методикам O4.010-O2.010.
tуд при ЖХ-МС: 2,10 мин, [M+H]+: 317,4 (Met-a)
O2.014
1-(3-Метокси-5-трифторметилфенил)этанон

3,N-Диметокси-N-метил-5-трифторметилбензамид (O3.014, 460 мг) вносили и растворяли в ТГФ (15 мл) при tкомн в атмосфере Ar. Затем охлаждали до 0°C и по каплям прибавляли метилмагнийбромид (1,5 мл; 3 M раствор в диэтиловом эфире). После этого баню со льдом убирали и смесь перемешивали в течение 2 ч при tкомн. Затем при охлаждении льдом прибавляли 1 н. раствор соляной кислоты, разбавляли водой и три раза экстрагировали ЭА. Объединенные фракции ЭА сушили над сульфатом натрия, фильтровали и сгущали. Было выделено 349 мг соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,80 (1 H), 7,73 (1 H), 7,53 (1 H), 3,92 (3 H), 2,66 (3 H).
O2.015
1-(3-Трет-бутил-5-метоксифенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксибензойной кислоты (O6.043) с метилиодидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.043-O2.043 получали соединение, указанное в заголовке. Было получено 880 мг соединения.
tуд при ЖХ-МС: 1,65 мин, [M+H]+: 207,1 (Met-a)
O2.016
1-(3-Трет-бутил-5-циклопропилметоксифенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксибензойной кислоты (O6.043) с циклопропилметилбромидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.043-O2.043 получали соединение, указанное в заголовке. Было получено 1,02 г соединения.
tуд при ЖХ-МС: 1,86 мин, [M+H]+: 247,1 (Met-a)
O2.017
1-(3-Трет-бутил-5-циклобутилметоксифенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксибензойной кислоты (O6.043) с бромметилциклобутаном осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.043-O2.043 получали соединение, указанное в заголовке. Было получено 252 мг соединения.
tуд при ЖХ-МС: 2,07 мин, [M+H]+: 261,2 (Met-a)
O2.018
1-(3-Бензилоксиметил-5-трет-бутилфенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксиметилбензойной кислоты с бензилбромидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.008-O2.008 получали соединение, указанное в заголовке. Было получено 638 мг соединения.
tуд при ЖХ-МС: 1,93 мин, [M+H]+: 297,2 (Met-a)
O2.019
1-(3-Циклогексилметокси-4,5-диметоксифенил)этанон

Синтез с 3-циклогексилметокси-4,5,N-триметокси-N-метилбензамидом (420 мг) и обработку осуществляли аналогично методике O2.059. Очистку на силикагеле не осуществляли. Было получено 370 мг соединения.
tуд при ЖХ-МС: 1,82 мин, [M+H]+: 293,2 (Met-a)
O2.020
1-(3-Трет-бутил-5-метоксиметилфенил)этанон

Взаимодействие метилового эфира 3-трет-бутил-5-гидроксиметилбензойной кислоты с метилиодидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.008-O2.008 получали соединение, указанное в заголовке. Было получено 1,54 г соединения.
tуд при ЖХ-МС: 1,58 мин, [M+H]+: 221,1 (Met-a)
O2.021
1-(3-Хлор-5-метоксифенил)этанон

3-Хлор-5-метоксибензойную кислоту (3 г) приводили во взаимодействие с тионилхлоридом (23,3 мл), гидрохлоридом N,O-диметилгидроксиламина (1,57 г) и метилмагнийбромидом (8,91 мл) аналогично методикам O3.043/O2.043. Было получено 2,42 г соединения.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,54 (1 H), 7,40 (1 H), 7,30 (1 H), 3,84 (3 H), 2,58 (3 H).
O2.030
1-(3-Изопропил-5-метоксифенил)этанон

Взаимодействие метилового эфира 3-гидрокси-5-изопропилбензойной кислоты с метилиодидом осуществляли аналогично методике O5.043 и аналогично последовательности методик O4.043-O2.043 получали соединение, указанное в заголовке. Было получено 425 мг соединения.
tуд при ЖХ-МС: 1,54 мин, [M+H]+: 193,1 (Met-a)
O2.031
1-(3-Циклогексилметокси-5-этоксифенил)этанон

1-(3,5-Дигидроксифенил)этанон (1,0 г) и этилбромид (0,531 мл) растворяли при tкомн в ДМФА (20 мл) и прибавляли гидрид натрия (189 мг). После перемешивания в течение 2 ч при 50°C прибавляли циклогексилметилбромид (1,36 мл) и следующую порцию гидрида натрия (315 мг). После перемешивания в течение 2 ч при 50°C ДМФА удаляли, остаток растворяли в ЭА, промывали водой, сушили, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 80 г, элюент "н-гептан/ЭА" с градиентом 0-20% в интервале 60 мин). Было получено 378 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 2,07 мин, [M+H]+: 277,2 (Met-a)
O2.032
1-(3-Бром-5-метоксифенил)этанон

Метиловый эфир 3-бром-5-метоксибензойной кислоты (O5.032; 2,50 г) аналогично последовательности методик O4.043, O3.043 и O2.059 превращали в соединение, указанное в заголовке. Было получено 1,45 г соединения.
tуд при ЖХ-МС: 1,46 мин, [M+H]+: 229,0 (Met-a)
O2.034
1-[3-(3,3-Диметилбутокси)-5-этоксифенил]этанон

Синтез с 1-(3,5-дигидроксифенил)этаноном (3,0 г) осуществляли аналогично методике O2.031. Однако вместо циклогексилбромида использовали 1-бром-3,3-диметилбутан. После хроматографирования было получено 960 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,99 мин, [M+H]+: 265,2 (Met-a)
O2.035
1-(3-Циклогексилметокси-5-метоксифенил)этанон

1-(3-Гидрокси-5-метоксифенил)этанон (O3.033; 1,5 г) и бромметилциклогексан (1,76 г) растворяли в ДМФА (20 мл) и прибавляли гидрид натрия (260 мг). После перемешивания в течение 24 ч при 50°C удаляли ДМФА. Остаток растворяли в ЭА, промывали водой, сушили, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 1,33 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,93 мин, [M+H]+: 263,2 (Met-a)
O2.041
1-(5-Бром-2,3-диметоксифенил)этанон

5-Бром-2,3-диметоксибензойную кислоту (2 г) аналогично методике O3.043 превращали в производное бензамида, из которого аналогично методике O2.059 получали соединение, указанное в заголовке. Было получено 1,1 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 3,70 мин, [M+H]+: 259,0 (Met-d)
O2.042
1-(3-Хлор-4,5-диметоксифенил)этанон

3-Хлор-4,5-диметоксибензойную кислоту (1 г) аналогично методике O3.043 превращали в производное бензамида, из которого аналогично методике O2.059 получали соединение, указанное в заголовке. Было получено 495 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,55 мин, [M+H]+: 215,1 (Met-a)
O2.043
1-[3-Трет-бутил-5-(2-метоксиэтокси)фенил]этанон

3-Трет-бутил-N-метокси-5-(2-метоксиэтокси)-N-метилбензамид (O3.043; 1,35 г) растворяли в ТГФ (40 мл), при 0°C по каплям прибавляли метилмагнийбромид (3,05 мл, 3 M раствор в эфире) и затем перемешивали в течение 2 ч при tкомн. Далее прибавляли 1 н. раствор соляной кислоты (50 мл), разбавляли водой и три раза экстрагировали ЭА. Затем объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-30% в интервале 30 мин). Было получено 1,0 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,58 мин, [M+H]+: 251,3 (Met-a)
O2.044
1-[3-Морфолин-4-ил-5-(пентафторсульфанил)фенил]этанон

Синтез с N-метокси-N-метил-3-морфолин-4-ил-5-(пентафторсульфанил)бензамидом (O3.044; 2,38 г) и обработку осуществляли аналогично методике O2.043. Очистку осуществляли на силикагеле (картридж массой 80 г, элюент "н-гептан/ЭА" с градиентом 0-70% в интервале 40 мин). Было получено 1,1 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,57 мин, [M+H]+: 332,0 (Met-a)
O2.059
1-[3-Трет-бутил-5-(3-гидроксипропокси)фенил]этанон

3-Трет-бутил-N-метокси-N-метил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензамид (O3.059; 5,49 г) растворяли в ТГФ (100 мл), охлаждали до 0°C и прибавляли литий-бис-(триметилсилил)амид (14,47 мл, 1 M раствор в эфире MtB). После перемешивания в течение 30 мин при 0°C по каплям прибавляли метилмагнийбромид (9,65 мл, 3 M раствор в эфире). Затем охлаждающую баню убирали и после перемешивания в течение 2 ч при tкомн разбавляли водой и экстрагировали ЭА. Фракцию ЭА сушили над сульфатом магния, фильтровали и упаривали на роторном испарителе. Остаток очищали на силикагеле (200 г, н-гептан/ЭА, 4:1). Было получено 3,4 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,53 (1 H); 7,28 (1 H); 7,17 (1 H); 4,57 (1 H, -O-C(-C)H-O-); 4,11 (2 H); 2,57 (3 H).
O2.061
1-{3-Трет-бутил-5-[2-(тетрагидропиран-2-илокси)этокси]фенил}этанон

Исходя из метилового эфира 3-трет-бутил-5-гидроксибензойной кислоты (O6.043) и 2-(2-бромэтокси)тетрагидропирана осуществляли последовательность синтезов O5.059-O2.059. Было получено 3,9 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,53 (1 H), 7,31 (1 H), 7,20 (1 H), 4,66 (1 H, -O-C(-C)H-O-), 4,20 (2 H), 2,58 (3 H).
O2.070
1-{3-Трет-бутил-4-метокси-5-[2-(тетрагидропиран-2-илокси)этокси]фенил}этанон

1-(3-Трет-бутил-5-гидрокси-4-метоксифенил)этанон (O3.070; 5,0 г) приводили во взаимодействие с 2-(2-бромэтокси)тетрагидропираном (5,64 г) аналогично методике O2.071. При этом неочищенное вещество очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 60 мин). Было получено 6,68 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,50 (2 H, ароматический), 4,70 (1 H, -O-C(-C)H-O-), 3,90 (3 H, -OCH3), 2,54 (3 H, ацетил).
O2.071
1-{3-Трет-бутил-4-метокси-5-[3-(тетрагидропиран-2-илокси)пропокси]фенил}этанон

1-(3-Трет-бутил-5-гидрокси-4-метоксифенил)этанон (O3.070; 6,9 г) и 2-(3-бромпропокси)тетрагидропиран (8,31 г) растворяли в ДМФА (80 мл) и прибавляли гидрид натрия (894 мг). После перемешивания в течение 5 часов при tкомн удаляли растворитель и остаток растворяли в ЭА. Фракцию ЭА промывали водой, сушили и сгущали. Было получено 12,7 г указанного в заголовке соединения в виде неочищенного вещества удовлетворительной чистоты.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 4,57 (1 H, -O-C(-C)H-O-), 2,54 (3 H, ацетил).
O2.075
N-[3-Ацетил-5-(пентафторсульфанил)фенил]-2,2,2-трифтор-N-метилацетамид

В сосуде для нагревания микроволнами N-(3-ацетил-5-пентафторсульфанилфенил)-2,2,2-трифторацетамид (O3.075; 0,25 г) растворяли в абсолютном диметоксиэтане (7,5 мл) и прибавляли измельченный карбонат калия и метилиодид (80 мкл). Затем осуществляли нагревание микроволнами в течение 40 мин при 100°C. После осуществления синтеза с последующими порциями N-(3-ацетил-5-пентафторсульфанилфенил)-2,2,2-трифторацетамида (4 порции по 250 мг) по описанной методике пять фракций реакционной смеси обрабатывали совместно, причем карбонат калия при охлаждении льдом нейтрализовывали 1 н. раствором соляной кислоты. После многократного промывания карбонатнокалиевой фракции диметоксиэтаном водный слой пять раз экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Остаток очищали препаративной ВЭЖХ (Met-A). Фракции, содержавшие конечное вещество, объединяли, освобождали от ацетонитрила и пять раз экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,03 г требуемого соединения.
tуд при ЖХ-МС: 1,62 мин, [M+H]+: 372,0 (Met-a)
O3
O3.004
1-Бром-5-(1,1-диметоксиэтил)-2-метокси-3-трифторметилбензол

1-(3-Бром-4-гидрокси-5-трифторметилфенил)этанон (O4.004; 6,8 г) растворяли в метаноле (50 мл) и последовательно прибавляли DL-камфор-10-сульфоновую кислоту (111 мг) и триметилортоформиат (8 мл). После перемешивания в течение 2 ч при tкомн прибавляли ДМФА (75 мл) и карбонат калия (4,98 г) и затем при охлаждении льдом медленно прибавляли метилиодид (3 мл). После перемешивания в течение 4 ч при tкомн реакционную смесь оставляли стоять в течение ночи, затем прибавляли смесь "н-гептан/вода" и отделяли органический слой. Водный слой еще раз экстрагировали н-гептаном и затем объединенные органические фракции сушили над сульфатом магния, фильтровали и сгущали. Было получено 7 г указанного в заголовке соединения удовлетворительной чистоты.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,90 (1 H), 7,62 (1 H), 3,89 (3 H), 3,10 (6 H), 1,49 (3 H).
O3.007
3,N-Диметокси-N-метил-5-(пентафторсульфанил)бензамид

Метиловый эфир 3-метокси-5-(пентафторсульфанил)бензойной кислоты (O4.007; 2,5 г) растворяли в абсолютном ТГФ (65 мл) и прибавляли гидрохлорид N,O-диметилгидроксиламина (1,2 г). Затем смесь охлаждали до -15°C и по каплям прибавляли раствор изопропилмагнийбромида (13,59 мл, 2 M раствор в ТГФ). Через 20 мин охлаждающую баню убирали и смесь перемешивали в течение 1 ч при tкомн. Затем прибавляли раствор хлорида аммония и водный слой три раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Полученное таким образом неочищенное вещество содержало исходное соединение в заметном количестве, поэтому еще раз осуществляли описанное ранее взаимодействие и обработку. В полученном далее остатке исходное соединение отсутствовало. Очистку осуществляли препаративной ВЭЖХ (Met-A). Фракции, содержавшие конечное вещество, объединяли, освобождали от ацетонитрила и водную фракцию три раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,78 г требуемого соединения.
ЯМР 1H (400 МГц, CDCl3) [м.д.]: 7,70 (1 H), 7,37 (1 H), 7,24 (1 H + CDCl3), 3,88 (3 H), 3,56 (3 H).
O3.008
3-Трет-бутил-5-этоксиметил-N-метокси-N-метилбензамид

Аналогично методике O3.043 3-трет-бутил-5-этоксиметилбензойную кислоту (O4.008; 1,15 г) сначала превращали в хлорангидрид (1,24 г) и затем осуществляли синтез с полученным 3-трет-бутил-5-этоксиметилбензоилхлоридом. Было получено 854 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 3,32 мин, [M+H]+: 280,2 (Met-d)
O3.010
1-(3-Трет-бутил-4-этокси-5-гидроксифенил)этанон

Синтез с 1-бром-3-трет-бутил-5-(1,1-диметоксиэтил)-2-этоксибензолом (O4.010; 19,68 г) осуществляли аналогично методике O3.070. Было получено 5,15 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,972 мин, [M+H]+: 237,1 (Met-b)
O3.014
3,N-Диметокси-N-метил-5-трифторметилбензамид

Метиловый эфир 3-метокси-5-трифторметилбензойной кислоты (O4.014, 1 г) и N,O-диметилгидроксиламин (416 мг) вносили в ТГФ (30 мл). Затем смесь охлаждали до -15°C и прибавляли по каплям в течение 10 мин изопропилмагнийхлорид (3,2 мл; 2 M раствор в ТГФ). Далее смесь перемешивали еще в течение 20 мин при -15°C и убирали охлаждающую баню. Через 3 ч смесь снова охлаждали до -15°C и прибавляли следующую порцию изопропилмагнийхлорида (3,2 мл). После удаления охлаждающей бани смесь перемешивали еще в течение часа при tкомн, затем прибавляли 20%-й раствор хлорида аммония и три раза экстрагировали ЭА. Объединенные фракции ЭА сушили над сульфатом натрия, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 50 г, элюент - ДХМ). Было получено 465 мг соединения, указанного в заголовке, и 427 мг исходного соединения.
tуд при ЖХ-МС: 1,36 мин, [M+H]+: 264,0 (Met-a)
O3.033
1-(3-Гидрокси-5-метоксифенил)этанон

1-(3,5-Дигидроксифенил)этанон (3 г) и метилиодид (2,80 г) растворяли в ДМФА (40 мл) и прибавляли гидрид натрия (568 мг). После перемешивания в течение 2 ч при tкомн удаляли ДМФА. Остаток растворяли в ЭА, промывали водой, сушили, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 89 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 1,12 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 9,8 (1 H); 6,93 (2 H); 6,58 (1 H); 3,76 (3 H); 2,50 (3 H + ДМСО).
O3.043
3-Трет-бутил-N-метокси-5-(2-метоксиэтокси)-N-метилбензамид

3-Трет-бутил-5-(2-метоксиэтокси)бензойную кислоту (O4.043; 1,9 г) растворяли в тионилхлориде (10,9 мл), нагревали в течение 2 ч с обратным холодильником и затем сгущали. Полученный 3-трет-бутил-5-(2-метоксиэтокси)бензоилхлорид (2,04 г) растворяли в ДХМ (20 мл), прибавляли диметилгидроксиламин (734 мг), затем прибавляли основание Хюнига (1,37 мл) и перемешивали в течение 1 ч при tкомн. Далее смесь упаривали досуха, остаток растворяли в ЭА, четыре раза промывали водой, сушили над сульфатом магния, фильтровали и упаривали на роторном испарителе. Остаток очищали на силикагеле (картридж массой 40 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 40 мин). Было получено 1,36 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,43 мин, [M+H]+: 296,3 (Met-a)
O3.044
N-Метокси-N-метил-3-морфолин-4-ил-5-(пентафторсульфанил)бензамид

3-Амино-N-метокси-N-метил-5-(пентафторсульфанил)бензамид (O5.075; 6,3 г) растворяли в ДМФА (80 мл) и прибавляли карбонат цезия (10,1 г), иодид натрия (0,62 г) и бис-2-бромэтиловый эфир (19,37 г). Смесь распределяли по 10 сосудам для нагревания микроволнами и нагревали в течение 3 ч при 130°C. Затем фракции реакционной смеси объединяли и освобождали от растворителя. Остаток растворяли в ЭА и промывали водой. Фракцию ЭА сушили и сгущали. Остаток очищали на силикагеле (картридж массой 120 г, элюент "н-гептан/ЭА" с градиентом 0-100% в интервале 30 мин). Было получено 2,48 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,41 мин, [M+H]+: 377,0 (Met-a)
O3.059
3-Трет-бутил-N-метокси-N-метил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензамид

3-трет-Бутил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензойную кислоту (O4.059; 4,90 г) и гидрохлорид N,O-диметилгидроксиламина (1,42 г) растворяли в ДМФА (80 мл) и прибавляли основание Хюнига (4,81 мл) и TOTU (4,78 г). После перемешивания в течение 2 ч смесь оставляли стоять в течение ночи. Затем удаляли ДМФА, обрабатывали ЭА и насыщенным раствором гидрокарбоната натрия, отделяли слой ЭА, сушили над сульфатом магния, фильтровали и сгущали. Было получено 5,49 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,12 (1 H), 7,01 (1 H), 6,90 (1 H), 4,56 (1 H, -O-C(-C)H-O-), 4,06 (2 H), 3,57 (3 H), 3,22 (3 H).
O3.070
1-(3-Трет-бутил-5-гидрокси-4-метоксифенил)этанон)

1-Бром-3-трет-бутил-5-(1,1-диметоксиэтил)-2-метоксибензол (O4.070; 36,3 г) растворяли в ТГФ (1 л), в атмосфере аргона по каплям прибавляли при -75°C н-бутиллитий (52,6 мл; 2,5 M раствор в гексане) и далее перемешивали в течение 30 мин. Затем по каплям прибавляли триметилборат (37,3 мл) и смесь оставляли стоять в течение 2 ч при tкомн. Далее последовательно прибавляли раствор гидроксида натрия (4,4 г в 10 мл воды) и раствор пероксида водорода (62,3 мл; 35%-й раствор в воде). После перемешивания в течение 2 ч при tкомн смесь оставляли стоять в течение ночи. Затем прибавляли воду и ЭА и подкисляли соляной кислотой. После отделения фракцию ЭА сушили над сульфатом магния и сгущали. Остаток очищали на силикагеле (картридж массой 330 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 60 мин). Было получено 14 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 0,90 мин, [M+H]+: 223,1 (Met-b)
O3.075
N-(3-Ацетил-5-пентафторсульфанилфенил)-2,2,2-трифторацетамид

N-метокси-N-метил-3-(пентафторсульфанил)-5-(2,2,2-трифторацетиламино)бензамид (O4.075; 1,65 г) растворяли в ТГФ (25 мл). При 0°C прибавляли при перемешивании литий-бис(триметилсилил)амид (0,9 мл). Через 30 мин по каплям прибавляли метилмагнийбромид (3,5 мл, 3 M раствор в диэтиловом эфире). По окончании прибавления баню со льдом убирали и смесь перемешивали в течение 2 ч при tкомн. Затем при охлаждении прибавляли 1 н. раствор соляной кислоты, воду и ЭА. После отделения органического слоя водный слой еще два раза экстрагировали ЭА. Объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Неочищенное вещество представляло собой смесь N-(3-ацетил-5-пентафторсульфанилфенил)-2,2,2-трифторацетамид и 1-[3-амино-5-(пентафторсульфанил)фенил]этанон, поэтому неочищенное вещество (1,3 г) растворяли в метиленхлориде (60 мл) и прибавляли триэтиламин (155 мкл). Затем при перемешивании прибавляли ангидрид трифторуксусной кислоты (160 мкл). После перемешивания в течение 3 ч при tкомн прибавляли воду и насыщенный раствор гидрокарбоната натрия, разделяли слои и фракцию ДХМ еще три раза промывали водой. Фракцию ДХМ сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,3 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,61 мин, [M+H]+: 358,0 (Met-a)
O4
O4.004
1-(3-Бром-4-гидрокси-5-трифторметилфенил)этанон

1-(4-Гидрокси-3-трифторметилфенил)этанон (5 г) при перемешивании растворяли при tкомн в ацетонитриле (150 мл) и охлаждали до -10°C. При данной температуре по каплям прибавляли N-бромсукцинимид (раствор 4,5 г в 100 мл ацетонитрила). Затем охлаждающую баню убирали и смесь перемешивали еще в течение 5 ч. После стояния смеси в течение ночи удаляли 3/4 части растворителя и к остатку прибавляли смесь "н-гептан/вода". Органический слой отделяли и промывали один раз 5%-м раствором тиосульфата натрия и один раз водой. Образовавшийся садок отделяли фильтрованием под вакуумом, промывали и сушили. Было получено 6,9 г указанного в заголовке соединения удовлетворительной чистоты.
tуд при ЖХ-МС: 1,35 мин, [M+H]+: 283,0 (Met-a)
O4.007
Метиловый эфир 3-метокси-5-(пентафторсульфанил)бензойной кислоты

3-Гидрокси-5-(пентафторсульфанил)бензойную кислоту (O5.007; 3,0 г) растворяли в абсолютном ДМФА (75 мл). Затем при перемешивании прибавляли метилиодид (3,6 мл) с последующим прибавлением тонкоизмельченного карбоната калия (6,3 г). После перемешивания в течение 5 часов при 40°C смесь охлаждали и прибавляли воду (250 мл). Затем смесь четыре раза экстрагировали эфиром (100 мл). Объединенные экстракты промывали по одному разу 1 н. раствором гидроксида натрия (75 мл) и водой (100 мл), сушили над сульфатом магния, фильтровали и сгущали. Было получено 2,9 г требуемого соединения.
ЯМР 1H (400 МГц, CDCl3) [м.д.]: 8,00 (1 H), 7,70 (1 H), 7,47 (1 H), 3,96 (3 H), 3,90 (3 H).
O4.008
3-Трет-бутил-5-этоксиметилбензойная кислота

Синтез с метиловым эфиром 3-трет-бутил-5-этоксиметилбензойной кислоты (O5.008; 1,18 г) осуществляли аналогично методике O4.043. При этом полученное неочищенное вещество очищали на силикагеле (картридж массой 50 г, элюент "н-гептан/ЭА" с градиентом 0-50% в интервале 30 мин). Было получено 1,15 г соединения, указанного в заголовке.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.]: 12,90 (1 H), 7,86 (1 H), 7,73 (1 H), 7,57 (1 H), 4,50 (2 H), 3,50 (1 H), 1,30 (9 H), 1,16 (3 H).
O4.010
1-Бром-3-трет-бутил-5-(1,1-диметоксиэтил)-2-этоксибензол

2-Бром-6-трет-бутил-4-(1,1-диметоксиэтил)фенол (20 г; синтез см. CA02515715) алкилируют этилиодидом в условиях аналогично методике O4.070. Было получено 19,67 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,46 (1 H), 7,33 (1 H), 4,03 (2 H), 3,06 (6 H), 1,43 (3 H), 1,38 (3 H), 1,35 (9 H).
O4.014
Метиловый эфир 3-метокси-5-трифторметилбензойной кислоты

3-Гидрокси-5-трифторметилбензойную кислоту (2 г) при перемешивании вносили при tкомн в ДМФА (15 мл) и по каплям прибавляли метилиодид (3,0 мл). После прибавления карбоната калия (5,6 г) смесь перемешивали в течение 5 ч и оставляли стоять в течение ночи. Затем прибавляли воду и три раза экстрагировали эфиром MtB. Объединенные фракции эфира MtB сушили над сульфатом натрия, фильтровали и сгущали. Было получено 2,29 г соединения, указанного в заголовке.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,76 (1 H), 7,70 (1 H), 7,55 (1 H), 3,91 (3 H), 3,89 (3 H).
O4.043
3-Трет-бутил-5-(2-метоксиэтокси)бензойная кислота

Метиловый эфир 3-трет-бутил-5-(2-метоксиэтокси)бензойной кислоты (O5.043; 2,0 г) растворяли в метаноле (30 мл) и ТГФ (60 мл) и прибавляли раствор гидроксида лития (30 мл, 1 M раствор в воде). Смесь нагревали до 40°C и перемешивали в течение 3 ч. Затем органический растворитель удаляли и значение pH водного слоя доводили 1 н. раствором соляной кислоты до 3. Затем экстрагировали ЭА, сушили, фильтровали и сгущали. Было получено 1,9 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,40 мин, [M+H-H2O]+: 235,3 (Met-a)
O4.059
3-Трет-бутил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензойная кислота

Метиловый эфир 3-трет-бутил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензойной кислоты (O5.059; 5,37 г) растворяли в метаноле (80 мл) и ТГФ (160 мл) и прибавляли раствор гидроксида лития (61,28 мл, 1 M раствор в воде). После перемешивания в течение 2 ч при 40°C смесь упаривали досуха, остаток обрабатывали водой и сушили вымораживанием. Полученное вещество смешивали с ДХМ, фильтровали и упаривали досуха. Было получено 4,9 г соединения.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,52 (1 H), 7,26 (1 H), 6,80 (1 H), 4,57 (1 H, -O-C(-C)H-O-), 4,02 (2 H).
O4.070
1-Бром-3-трет-бутил-5-(1,1-диметоксиэтил)-2-метоксибензол

Синтез 1-бром-3-трет-бутил-5-(1,1-диметоксиэтил)-2-метоксибензола осуществляли аналогично CA 02515715.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.]: 7,47 (1 H), 7,33 (1 H), 3,85 (3 H), 3,07 (6 H), 1,43 (3 H), 1,35 (9 H).
O4.075
N-Метокси-N-метил-3-(пентафторсульфанил)-5-(2,2,2-трифторацетиламино)бензамид

3-Амино-N-метокси-N-метил-5-пентафторсульфанилбензамид (O5.075; 1,45 г) растворяли в метиленхлориде (15 мл) и при перемешивании прибавляли триэтиламин (0,8 мл) с последующим прибавлением ангидрида трифторуксусной кислоты (0,85 мл) без доступа влаги. После перемешивания в течение 3 ч при tкомн и стояния в течение ночи прибавляли воду и насыщенный раствор гидрокарбоната натрия, разделяли слои и фракцию метиленхлорида еще три раза промывали водой, сушили над сульфатом магния, фильтровали и сгущали. Полученное вещество (1,75 г) использовали на следующей стадии без дополнительной очистки.
tуд при ЖХ-МС: 1,53 мин, [M+H]+: 403,0 (Met-a)
O5
O5.007
3-Гидрокси-5-(пентафторсульфанил)бензойная кислота

3-Амино-5-пентафторсульфанилбензойную кислоту (O6.007; 3,9 г) растворяли в 35%-м растворе серной кислоты (120 мл), охлаждали до -5°C и в течение 10 мин по каплям прибавляли раствор нитрита натрия (1,1 г) в воде (100 мл). Через 40 мин прибавляли следующую порцию раствора нитрита (2 мл), затем с интервалом 20 мин прибавляли еще 2 мл и 1 мл. После этого охлаждающую баню убирали и смесь нагревали при 100°C. Через 5 ч смесь охлаждали и раствор декантировали. Прозрачный кислый раствор пять раз экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Неочищенное вещество перекристаллизовывали из смеси "этилацетат/гептан". Было получено 3,6 г требуемого соединения.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.]: 10,72 (1 H); 7,71 (1 H); 7,57 (1 H); 7,46 (1 H).
O5.008
Метиловый эфир 3-трет-бутил-5-этоксиметилбензойной кислоты

Метиловый эфир 3-трет-бутил-5-гидроксиметилбензойной кислоты (2,0 г) алкилировали этилиодидом в условиях аналогично методике O5.043. Было получено 1,18 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 3,81 мин, [M+H]+: 250,2 (Met-d)
O5.032
Метиловый эфир 3-бром-5-метоксибензойной кислоты

Метиловый эфир 3-бром-5-гидроксибензойной кислоты (O6.032; 2,52 г) алкилировали метилиодидом и обрабатывали в условиях аналогично методике O5.043. Было получено 2,5 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,58 мин, [M+H]+: 245,0 (Met-a)
O5.043
Метиловый эфир 3-трет-бутил-5-(2-метоксиэтокси)бензойной кислоты

Метиловый эфир 3-трет-бутил-5-гидроксибензойной кислоты (O6.043; 2,18 г) и 1-бром-2-метоксиэтан (1,18 мл) растворяли в ДМФА (30 мл) и при перемешивании прибавляли гидрид натрия (301 мг). После перемешивания в течение 2 ч при tкомн удаляли растворитель. Остаток растворяли в ЭА, смесь промывали водой, сушили и сгущали. Остаток очищали на силикагеле (картридж массой 80 г, элюент "н-гептан/эфир MtB" с градиентом 0-30% в интервале 60 мин). Было получено 2,0 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,69 мин, [M+H-HOCH3]+: 235,2 (Met-a)
O5.059
Метиловый эфир 3-трет-бутил-5-[3-(тетрагидропиран-2-илокси)пропокси]бензойной кислоты

Метиловый эфир 3-трет-бутил-5-гидроксибензойной кислоты (O6.043; 3,22 г) и 2-(3-бромпропокси)тетрагидропиран (4,14 г) растворяли в ДМФА (30 мл) и прибавляли гидрид натрия (445 мг). После перемешивания в течение 3 ч при tкомн смесь оставляли стоять в течение ночи. Затем удаляли ДМФА, остаток растворяли в ЭА, промывали водой, сушили, фильтровали и сгущали. Было получено 5,37 г соединения.
ЯМР 1H (500 МГц, ДМСО-d6) [м.д.] (репрезентативные сигналы): 7,56 (1 H), 7,28 (1 H), 7,19 (1 H), 4,57 (1 H, -O-C(-C)H-O-), 4,10 (2 H).
O5.075
3-Амино-N-метокси-N-метил-5-пентафторсульфанилбензамид

N-Метокси-N-метил-5-нитро-3-пентафторсульфанилбензамид (O6.075; 4,2 г) растворяли в метаноле (120 мл) и прибавляли никель Ренея (около 700 мг). Гидрирование осуществляли с использованием баллона с водородом и магнитной мешалки. Через 5 ч катализатор отделяли фильтрованием и промывали метанолом. Фильтрат сгущали в вакууме и остаток очищали препаративной хроматографией. Фракции, содержавшие конечное вещество, объединяли, освобождали от ацетонитрила, подщелачивали раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,73 г требуемого соединения.
tуд при ЖХ-МС: 1,27 мин, [M+H]+: 307,0 (Met-a)
O6
O6.007
3-Амино-5-пентафторсульфанилбензойная кислота

3-Пентафторсульфанилбензойную кислоту (15 г) растворяли в дымящей азотной кислоте (120 мл) и при tкомн перемешивали без доступа влаги. Затем прибавляли концентрированную серную кислоту (7,5 мл) и перемешивали при 75°C. После перемешивания в течение 8 ч при 75°C смесь оставляли стоять в течение ночи, затем прибавляли следующую порцию серной кислоты (1,5 мл) и при перемешивании нагревали при 75°C в течение 8 ч. После стояния в течение ночи смесь выливали в ледяную воду и перемешивали в течение 2 ч. Затем осадок отделяли фильтрованием под вакуумом и сушили в глубоком вакууме. Было получено 13,7 г 3-пентафторсульфанил-5-нитробензойной кислоты.
Затем 3-пентафторсульфанил-5-нитробензойную кислоту (5 г) растворяли в метаноле (300 мл), прибавляли никель Ренея (приблизительно 750 мг) и гидрировали в атмосфере водорода (с использованием баллона с водородом). Через 3 ч катализатор отделяли фильтрованием и остаток на фильтре тщательно промывали метанолом. Фильтрат сгущали и сушили. Остаток очищали на силикагеле (2 картриджа массой 50 г, элюент "н-гептан/ЭА" с градиентом 0-100% в интервале 60 мин). Было получено 3,9 г соединения, указанного в заголовке.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.]: 13,30 (1 H); 7,37 (2 H); 7,23 (1 H); 5,98 (2 H).
O6.043
Метиловый эфир 3-трет-бутил-5-гидроксибензойной кислоты

3-Трет-бутил-5-гидроксибензойную кислоту (O7.043; 1,93 г) растворяли в метаноле (20 мл) и при перемешивании по каплям медленно прибавляли тионилхлорид (0,937 мл). После перемешивания в течение 1 ч при 65°C смесь упаривали досуха, остаток растворяли в ДХМ, раствор промывали насыщенным раствором гидрокарбоната натрия, сушили над MgSO4, фильтровали и упаривали на роторном испарителе. Было получено 2,19 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,44 мин, [M+H]+: 209,2 (Met-a)
O6.075
N-Метокси-N-метил-5-нитро-3-пентафторсульфанилбензамид

3-Пентафторсульфанилбензойную кислоту (5 г) растворяли в дымящей азотной кислоте (20 мл) и при tкомн перемешивали без доступа влаги. Затем прибавляли концентрированную серную кислоту (3 мл) и перемешивали при 75°C. После перемешивания в течение 5 ч при 75°C прибавляли следующую порцию серной кислоты (2 мл) и перемешивали еще в течение 2 ч при 75°C. После стояния в течение ночи смесь выливали в ледяную воду и перемешивали в течение 2 ч. Затем осадок отделяли фильтрованием под вакуумом и сушили в глубоком вакууме. Было получено 4,2 г 3-пентафторсульфанил-5-нитробензойной кислоты. Еще 900 мг было получено из маточного раствора после трехкратной экстракции метиленхлоридом, высушивания объединенных фракций метиленхлорида над сульфатом магния и выпаривания растворителя. Затем 4,0 г 3-пентафторсульфанил-5-нитробензойной кислоты при перемешивании растворяли в тионилхлориде (25 мл) и в течение 10 ч нагревали с обратным холодильником без доступа влаги. После стояния смеси в течение ночи при tкомн избыточный тионилхлорид удаляли в вакууме, полученный остаток растворяли в дихлорметане (50 мл) и при перемешивании прибавляли гидрохлорид N,O-диметилгидроксиламина (1,25 г) и диэтилизопропиламин (1,66 г). После перемешивания в течение 1 ч при tкомн смесь сгущали в вакууме, остаток растворяли в этилацетате и пять раз промывали водой. Органическую фракцию сушили над сульфатом магния, фильтровали и сгущали. Полученное неочищенное вещество в количестве 4,2 г использовали в таком виде на следующей стадии.
tуд при ЖХ-МС: 1,50 мин, [M+H]+: 337,0 (Met-a)
O7
O7.043
3-Трет-бутил-5-гидроксибензойная кислота

3-Бром-5-трет-бутилбензойную кислоту (5 г) растворяли в ТГФ (180 мл) и в атмосфере аргона при -75°C по каплям прибавляли н-бутиллитий (18,7 мл, 2,5 M раствор в гексане) и далее перемешивали в течение 30 мин. Затем по каплям прибавляли триметилборат (6,63 мл) и смесь оставляли стоять в течение 1 ч при tкомн. После этого последовательно прибавляли гидроксид натрия (0,778 г), растворенный в 2 мл воды, и пероксид водорода (12,89 мл, 30%-й раствор). После перемешивания в течение 3 ч при tкомн смесь оставляли стоять в течение примерно 60 часов. Затем прибавляли воду и ЭА, значение pH доводили 1 н. раствором соляной кислоты до 3 и отделяли слой ЭА. Слой ЭА три раза промывали водой, сушили, фильтровали и сгущали. Остаток очищали на силикагеле (картридж массой 120 г, элюент "н-гептан/эфир MtB" с градиентом 0-50% в интервале 60 мин). Было получено 1,94 г соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,18 мин, [M+H]+: 195,1 (Met-a)
Пример 1
1-{2-[3-Ацетиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ийтрифторацетат

a) 3-Нитро-5-пентафторсульфанилбензойная кислота

3-Пентафторсульфанилбензойную кислоту (5 г) растворяли в дымящей азотной кислоте (20 мл) и при tкомн перемешивали без доступа влаги. Затем прибавляли концентрированную серную кислоту (3 мл) и перемешивали при 75°C. После перемешивания в течение 5 ч при 75°C прибавляли следующую порцию серной кислоты (1,5 мл) и после перемешивания в течение 2 ч при 75°C смесь оставляли стоять в течение ночи. Затем смесь выливали в ледяную воду и перемешивали в течение 2 ч. Образовавшийся осадок отделяли фильтрованием под вакуумом и сушили в глубоком вакууме. Было получено 4,2 г 3-пентафторсульфанил-5-нитробензойной кислоты. Еще 900 мг было получено из маточного раствора после трехкратной экстракции метиленхлоридом, высушивания объединенных фракций метиленхлорида над сульфатом магния и выпаривания растворителя. Осадок использовали на следующей стадии без дополнительной очистки.
ЯМР 1H (400 МГц, ДМСО-d6) [м.д.]: 8,82 (1 H); 8,80 (1 H); 8,62 (1 H).
b) N-Метокси-N-метил-5-нитро-3-пентафторсульфанилбензамид

3-Нитро-5-пентафторсульфанилбензойную кислоту (4,0 г) при перемешивании растворяли в тионилхлориде (25 мл) и в течение 10 ч нагревали с обратным холодильником без доступа влаги. После стояния смеси в течение ночи при tкомн избыточный тионилхлорид удаляли в вакууме, полученный остаток растворяли в дихлорметане (50 мл) и при перемешивании прибавляли гидрохлорид N,O-диметилгидроксиламина (1,25 г) и диэтилизопропиламин (1,66 г). После перемешивания в течение 1 ч при tкомн смесь сгущали в вакууме, остаток растворяли в этилацетате и 5 раз промывали водой. Органическую фракцию сушили над сульфатом магния, фильтровали и сгущали. Полученное неочищенное вещество (4,2 г) использовали в таком виде на следующей стадии.
tуд при ЖХ-МС: 1,50 мин, [M+H]+: 337,0
c) 3-Амино-N-метокси-N-метил-5-пентафторсульфанилбензамид

N-Метокси-N-метил-5-нитро-3-пентафторсульфанилбензамид (4,2 г) растворяли в метаноле (120 мл) и прибавляли никель Ренея (около 700 мг). Гидрирование осуществляли с использованием баллона с водородом и магнитной мешалки. Через 5 ч катализатор отделяли фильтрованием и промывали метанолом. Фильтрат сгущали в вакууме и остаток очищали препаративной ВЭЖХ. Фракции, содержавшие конечное вещество, объединяли, освобождали от ацетонитрила, подщелачивали раствором гидрокарбоната натрия и экстрагировали три раза этилацетатом. Объединенные экстракты сушили над сульфатом магния, фильтровали и сгущали. Было получено 1,73 г требуемого соединения.
tуд при ЖХ-МС: 1,27 мин, [M+H]+: 307,0
d) 3-Ацетиламино-N-метокси-N-метил-5-(пентафторсульфанил)бензамид

3-Амино-N-метокси-N-метил-5-пентафторсульфанилбензамид (1,2 г) растворяли в метиленхлориде (15 мл) и при перемешивании прибавляли триэтиламин (0,7 мл) с последующим прибавлением уксусного ангидрида (1,75 мл) без доступа влаги. После перемешивания в течение 3 ч при tкомн прибавляли воду и насыщенный раствор гидрокарбоната натрия, разделяли слои и фракцию метиленхлорида затем три раза промывали водой, сушили над сульфатом магния, фильтровали и сгущали. Полученное вещество (1,3 г) использовали на следующей стадии без дополнительной очистки.
tуд при ЖХ-МС: 1,26 мин, [M+H]+: 349,0
e) N-[3-Ацетил-5-(пентафторсульфанил)фенил]ацетамид

3-Ацетиламино-N-метокси-N-метил-5-(пентафторсульфанил)бензамид (1,2 г) растворяли в абсолютном ТГФ (30 мл) и при 0°C перемешивали с литийгексаметилдисилазаном (721 мкл; плотность 0,8 г/л; 23%-й раствор в трет-бутилметиловом эфире) в течение 30 мин. Затем при 0°C при перемешивании по каплям прибавляли метилмагнийбромид (2,87 мл, 3 M раствор в диэтиловом эфире). После перемешивания в течение 2,5 ч при tкомн прибавляли следующую порцию метилмагнийбромида (1 мл, 3 M раствор в диэтиловом эфире) и перемешивали еще в течение 2,5 ч. Для обработки при охлаждении льдом по каплям прибавляли 1 н. раствор соляной кислоты и далее прибавляли воду и этилацетат. Органический слой отделяли, а водный слой еще два раза экстрагировали этилацетатом. Объединенные фракции этилацетата сушили над сульфатом натрия, фильтровали и сгущали. Неочищенное вещество (1,03 г) объединяли с полученным таким же образом неочищенным веществом (75 мг) и очищали на силикагеле, элюируя смесью "дихлорметан-метанол". Было получено 860 мг требуемого соединения.
tуд при ЖХ-МС: 1,34 мин, [M+H]+: 304,0
f) N-[3-(2-Бромацетил)-5-(пентафторсульфанил)фенил]ацетамид

N-[3-Ацетил-5-(пентафторсульфанил)фенил]ацетамид (859 мг) растворяли в смеси метанола (10 мл) и ТГФ (10 мл) и при перемешивании порциями прибавляли фенилтриметиламмонийтрибромид (1,065 г). После перемешивания в течение 2 ч при tкомн далее смесь нагревали в течение 3 ч при 40°C. После охлаждения реакционную смесь прибавляли к 2 н. раствору серной кислоты и водный слой 3 раза экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия, фильтровали и сгущали. Неочищенное вещество очищали на силикагеле, элюируя смесью "этилацетат/гептан". Было получено 480 мг требуемого соединения.
tуд при ЖХ-МС: 1,47 мин, [M+H]+: 382,0
g) 6-Хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин в виде гидробромида и 6-хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

(6-Хлорпиридазин-3-ил)гидразин (1 г) растворяли при перемешивании в смеси этанола (22,5 мл) и воды (9 мл) при tкомн. Затем по каплям прибавляли бромциан (2,8 мл, 5 M раствор в ацетонитриле). Образовавшийся после перемешивания в течение 6 ч и стояния в течение ночи осадок отделяли фильтрованием под вакуумом и сушили. Таким образом было получено 1,14 г требуемого соединения.
tуд при ЖХ-МС: 0,24 мин, [M+H]+: 170,1
Другая часть конечного соединения была получена в виде свободного основания путем подщелачивания маточного раствора насыщенным раствором карбоната калия. Образовавшийся при этом осадок отделяли фильтрованием под вакуумом и сушили (326 мг).
tуд при ЖХ-МС: 0,24 мин, [M+H]+: 170,1
h) 6-Этокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин

6-Хлор-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (1,1 г) растворяли в большом количестве воды и подщелачивали насыщенным раствором карбоната калия. Выпавший при этом осадок отделяли фильтрованием под вакуумом и сушили (388 мг). После многократной экстракции маточного раствора дихлорметаном, высушивания объединенных органических фракций над сульфатом натрия, фильтрования и сгущения в целом получено еще 228 мг конечного соединения.
Полученное свободное основание (616 мг) растворяли в абсолютном этаноле (40 мл) и порциями прибавляли метилат натрия в твердом виде (990 мг). После перемешивания в течение 2 ч при 55°C прибавляли воду и водный слой три раза экстрагировали дихлорметаном. Объединенные экстракты сушили над сульфатом натрия, фильтровали и сгущали. Было получено 709 мг требуемого соединения.
tуд при ЖХ-МС: 0,51 мин, [M+H]+: 180,1
i) 1-{2-[3-Ацетиламино-5-(пентафторсульфанил)фенил]-2-оксоэтил}-3-амино-6-этокси-[1,2,4]триазоло[4,3-b]пиридазин-1-ийтрифторацетат
6-Этокси-[1,2,4]триазоло[4,3-b]пиридазин-3-иламин (40 мг) при перемешивании вносили в абсолютный ДМФА (3,5 мл) и по каплям прибавляли N-[3-(2-бромацетил)-5-(пентафторсульфанил)фенил]ацетамид, растворенный в абсолютном ДМФА (1,5 мл). После перемешивания в течение 5 ч при tкомн и стояния в течение ночи удаляли растворитель и остаток очищали препаративной ВЭЖХ, причем при элюировании требуемое 1-замещенное соединение выходило перед 2-замещенным соединением. Фракции, содержавшие чистое вещество, объединяли, освобождали от ацетонитрила и сушили вымораживанием. Было получено 13 мг требуемого соединения. Фракции, загрязненные 2-замещенным изомером, также объединяли, освобождали от ацетонитрила и сушили вымораживанием. Затем остаток очищали на силикагеле градиентным элюированием смесью "дихлорметан/метанол", причем при элюировании требуемое 1-замещенное соединение выходило после 2-замещенного соединения. Фракции, содержавшие чистое вещество, объединяли и упаривали досуха. Остаток обрабатывали ацетонитрилом и водой и сушили вымораживанием. Было получено еще 20 мг требуемого соединения.
tуд при ЖХ-МС: 1,10 мин, [M+H]+: 481,0
Пример 4
3-Амино-1-[2-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)-2-оксоэтил]-6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-1-ийтрифторацетат

Гидробромид 6-трифторметил-[1,2,4]триазоло[4,3-a]пиридин-3-иламина (W1.301; 309 мг) растворяли в небольшом количестве воды, подщелачивали насыщенным раствором карбоната калия и три раза экстрагировали ЭА. Объединенные фракции ЭА сушили над сульфатом магния, фильтровали и сгущали. Было получено 212 мг свободного основания, которое при перемешивании растворяли в ДМФА (5 мл) при tкомн. Затем в течение 15 мин медленно прибавляли 2-бром-1-(3-трет-бутил-4-метокси-5-морфолин-4-илфенил)этанон (O1.003; раствор 427 мг в 1 мл ДМФА). Смесь перемешивали в течение 7 ч при tкомн и затем оставляли стоять в течение ночи. Далее смесь перемешивали при 40°C в течение 2 ч и при 60°C в течение 3 ч. Затем удаляли растворитель и остаток очищали препаративной ВЭЖХ. Фракции, содержавшие требуемое соединение, объединяли, освобождали от ACN и сушили вымораживанием. Было получено 90 мг соединения, указанного в заголовке.
tуд при ЖХ-МС: 1,34 мин, [M+H]+: 492,1
Другие примеры соединений представлены в приведенной далее таблице. Соединения получали сочетанием, аналогичным сочетанию, приведенному в примере 1i) или 4, триазолопиридазинов или триазолопиридинов типа "W1." или "W2." с соответствующими производными ацетофенона типа "O1.". Отделение соединения, алкилированного в положении 2, образующегося в качестве примеси и имеющего в масс-спектре такую же массу, осуществляли препаративной ВЭЖХ, причем требуемое соединение, алкилированное в положении 1, при выбранных условиях, как правило, выходило в начале элюирования, в то время как соединение, алкилированное в положении 2, выходило при последующем элюировании. При осуществлении дальнейшего разделения на силикагеле (см. пример 1i) порядок элюирования при применении элюирующей смеси "ДХМ/метанол" изменялся. Соединение, алкилированное в положении 2, элюировалось первым, а соединение, алкилированное в положении 1, элюировалось вторым.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примеры фармакологических испытаний
Способ определения PAR1: ингибирование агрегации тромбоцитов, опосредуемой рецептором PAR1
Фармакологические испытания соединений осуществляли по агрегации тромбоцитов, индуцируемой рецептором TRAP (пептид, активирующий тромбиновый рецептор), в 96-луночном планшете. С этой целью кровь здоровых доноров отбирали шприцами вместимостью 20 мл, в которые предварительно вносили по 2 мл 3,13%-ного раствора цитрата натрия. После центрифугирования в течение 20 минут при 150 g отделяли обогащенную тромбоцитами плазму (PRP) и прибавляли раствор PGE1 (500 мкг/мл в этаноле) из расчета 1 мкл на 1 мл PRP. После инкубации в течение 5 минут при tкомн смесь центрифугировали в течение 15 минут при 120 g для удаления лейкоцитов. PRP, освобожденную от лейкоцитов, помещали порциями по 5 мл в полипропиленовые пробирки вместимостью 15 мл и центрифугировали в течение 15 минут при 360 g для формирования осадка тромбоцитов. Затем плазму декантировали и осадок тромбоцитов, полученный из 5 мл PRP, ресуспендировали в 1 мл раствора Тироде (120 мМ NaCl, 2,6 мМ KCl, 12 мМ NaHCO3, 0,39 мМ NaH2PO4·H2O, 10 мМ HEPES, 0,35% BSA, 5,5 мМ глюкозы, pH 7,4) и раствором Тироде число тромбоцитов доводили до 3·105 ед./мкл. Затем к 13 мл данной суспензии клеток прибавляли 866 мкл 10 мМ раствора CaCl2 и пипеткой вносили по 120 мкл в лунки 96-луночного планшета, в которые предварительно было внесено по 15 мкл раствора испытуемого соединения. После инкубации в течение 30 минут при tкомн в темноте прибавляли по 15 мкл раствора TRAP (70-100 мкМ) в качестве агониста и прибором SpectraMax 340 при 650 нм регистрировали кинетические изменения при встряхивании в течение 20 минут при 37°C. Рассчитывали площади под кривыми негативного контроля (раствор Тироде/ДМСО) и кривыми позитивного контроля (15 мкл агониста/ДМСО) и разность принимали за 100%. Для испытуемых соединений готовили серию разведений для определения в двух параллельных пробах, при этом для каждой концентрации соединения определяли AUC и рассчитывали степень ингибирования в % AUC относительно контрольной пробы. По степени ингибирования в % посредством нелинейного регрессионного анализа 4-параметрического уравнения рассчитывали IC50.
В таблице 1 приведены результаты испытаний.
|
Испытания на связывание рецептора PAR1
Синтезированные соединения были исследованы в испытаниях на связывание рецептора PAR1. При этом проверяли способность соединений ингибировать связывание радиоактивно меченых PAR1-агонистов, известных из литературы, с рецептором PAR1 (Ho-Sam Ahn, Mol. Pharm., 51:350-356, 1997).
Человеческий рецептор PAR1 транзиторно экспрессировали в клетках насекомых типа High Five. Из данных клеток через 48 часов стандартными способами получали мембранный препарат, готовили аликвоты в растворе, содержавшем 10 мМ Tris-HCl, 0,3 мМ ЭДТА, 1 мМ ЭГТА, 250 мМ сахарозы с pH 7,5, и хранили при -80°C.
Соединения предварительно инкубировали в течение 15 минут при tкомн с мембранным препаратом, затем прибавляли радиоактивно меченый лиганд (ALA-(para-F-Phe)-Arg-ChA-homoArg-(3,4-3H-Tyr)-NH2; с активностью около 40 Ки/ммоль). Конечная концентрация меченого лиганда в тестовом буферном растворе (50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ ЭГТА, 0,1% BSA, 2% ДМСО) составляла 20 нМ, а мембранного препарата - 1 мг/мл. После инкубации в течение 60 минут 25 мкл смеси переносили в лунки 96-луночного фильтрующего титрационного микропланшета MultiScreenHTS FB (производства компании Millipore), который за 5 часов до этого предварительно был обработан при tкомн 0,75%-ном водным раствором полиэтиленимина. Затем при отсасывании под вакуумом каждую лунку четыре раза промывали 300 мкл буферного раствора (50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ ЭГТА). Затем планшет в течение ночи сушили, прибавляли сцинтиллятор по 100 мкл на лунку и через 6 часов осуществляли измерения жидкостным сцинтилляционным счетчиком Wallac MicroBeta (производства компании PerkinElmer). Определяли неспецифическое связывание в присутствии 100 мкМ SCH79797 (PAR1-антагонист; производство компании Tocris, кат. № 1592) и вычитали из всех измеренных значений. За 100% принимали значение, полученное для контрольной пробы без ингибитора. По степени ингибирования в % для серии разведений соединения посредством нелинейного регрессионного анализа 4-параметрического уравнения рассчитывали IC50.
В таблице 2 приведены результаты испытаний.
|


























































































































