Результат интеллектуальной деятельности: СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА
Вид РИД
Изобретение
Предлагаемое изобретение относится к области ветеринарной биотехнологии, в частности к разработке способов диагностики бруцеллеза животных, и может быть использовано в ветеринарии.
Высокой чувствительностью и специфичностью при выявлении антител к возбудителям бруцеллеза обладают способы на основе принципа иммуноферментного анализа (ИФА).
Известен способ получения бруцеллезного антигена, используемый для диагностики бруцеллеза, который включает культивирование бруцелл, отмывание микробных клеток, обработку их фенолом [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988.].
Однако антиген, полученный известным способом, используется только для постановки реакции агглютинации, с помощью которой обнаруживают специфические антитела в сыворотке больных бруцеллезом животных и людей.
Известен способ получения бруцеллезного антигена, включающий выращивание бруцелл, отмывку микробных клеток, обработку их ацетоном, эфиром, высушивание в вакуум-эксикаторе, экстракцию трихлоруксусной кислотой (ТХУ), высушивание, обработку щелочью, осаждение ацетоном, высушивание. Антиген, полученный данным способом, используют для выявления гемагглютининов в сыворотках больных бруцеллезом людей и животных [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988].
Однако бруцеллезный антиген, полученный по данному способу, имеет недостатки при его получении: низкий выход антигена; сложная технология; использование большого количества токсических и взрывоопасных веществ (ацетона, эфира); время обработки биомассы составляет несколько суток.
Известен способ диагностики бруцеллеза методом непрямого иммуноферментного анализа характеризующийся высокой специфичностью и чувствительностью. Способ заключается в последовательной инкубации в лунках планшета компонентов тест-системы и анализируемого материала по следующей схеме: сенсибилизацию лунок планшетов для микротитрования очищенным ЛПС бруцеллезным антигеном; внесение и инкубацию контрольных и анализируемых образцов; внесение и инкубацию видоспецифических антител, меченных ферментом. После каждой стадии проведения анализа проводят отмывание лунок планшетов от несвязавшихся реагентов. т.е. происходит внесение субстрата ферментативной реакции. [Ж. J.Virol.Meth. - 1983 - v.6. - 19-29].
Учет результатов реакции проводят по величине оптической плотности анализируемых образцов.
При проведении сравнительных исследований 1000 сывороток крови крупного рогатого скота методами РДП и ИФА было выявлено: РДП+/ ИФА+540; РДП-/ИФА- 431; ИФА+/РДП- 29; ИФА-/РДП+0 (Ж. J.Virol. Meth. - 1983 - v.6. - 19-29).
Однако существуют ограничения, не позволяющие проведение достоверной диагностики, так возбудители, вызывающие заболевание, присутствуют в природе в S и R формах, которые отличаются между собой по строению и как следствие этого обладают разным антигенным составом. Это обстоятельство затрудняет диагностику, так как большинство существующих тест-систем способны выявлять антитела, образовавшиеся только при иммунном ответе на S формы возбудителя. Кроме того, для профилактики бруцеллеза в неблагополучных и угрожаемых районах широко применяется вакцинация. Вырабатываемые в организме поствакцинальные антитела, очень трудно дифференцировать от антител, вырабатываемых организмом в ответ на внедрение патогенного штамма возбудителя, что значительно усложняет работу по проведению оздоровительных мероприятий.
Задачей изобретения является разработка повышение чувствительности способа диагностики бруцеллеза животных, расширение его функциональных возможностей, т.е. возможность применения способа с целью выявлять и дифференцировать антитела к S и R формам бруцелл в сыворотках крови или молоке любых восприимчивых животных и человека.
На поверхности твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезный антиген в 2 этапа, первый из которых - неспецифическая адсорбция моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам и второй - специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам. Далее вносят и инкубируют испытуемый материал вместе с ферментно мечеными моноклональными антителами. После проведения этапа инкубации отмывают несвязавшиеся реагенты. Добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител по величине оптической плотности испытуемых образцов по сравнению с контролем.
Для осуществления способа используют тест-систему, в которую входят: сенсибилизированный S-ЛПС и R-ЛПС бруцеллезным антигеном планшет для микротитрования; меченные пероксидазой моноклональные антитела против S-ЛПС и R-ЛПС; контрольные положительные и отрицательные образцы сыворотки крови и молока.
Кроме того, используют субстратную смесь перекиси водорода и хромогена (донор протонов), разбавители компонентов реакции и раствор для промывки планшетов.
Получение компонентов тест-системы.
Для изготовления сенсибилизированного бруцеллезными антигенами твердофазного носителя используют моноклональные антитела 2Н2 и 2Н8 против S и R ЛПС бруцеллезных антигенов.
Моноклональные антитела к S-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н2.
Клетки штамма в дозе 2-10×106 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к S-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Моноклональные антитела к R-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н8.
Клетки штамма в дозе 2-10×106 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к R-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Бруцеллы вакцинного штамма В. abortus 19 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течении часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Бруцеллы вакцинного штамма В. abortus 17/100 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течение часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Контроль специфичности и активности антигена осуществляют в реакции диффузионной преципитации (РДП) после концентрирования в 10-100 раз. Антиген должен образовывать полосу преципитации с контрольной стандартной антисывороткой, идентичную полосе преципитации, образованной контрольным стандартным антигеном и контрольной стандартной антисывороткой. Активность S и R ЛПС бруцеллезных антигенов должна быть не ниже, чем 1:16-1:64.
Изготовление сенсибилизированного S и R-ЛПС бруцеллезными антигенами твердофазного носителя проводят в 2 этапа.
1 этап. Препараты моноклональных антител 2Н2 и 2Н8 к S и R-ЛПС бруцеллезным антигенам разбавляют фосфатно-солевым буферным раствором рН 7,2-7,4 до концентрации белка 5 мкг/мл и вносят порядно в 96-луночные планшеты для микротитрования по 100 мкл в каждую лунку. В нечетные ряды вносят антитела 2Н2, в четные ряды антитела 2Н8. Инкубируют в течение 16 часов при 2-8°С, отмывают от несвязавшихся антител промывочным раствором.
2 этап. В лунки панели вносят по 100 мкл S и R-ЛПС бруцеллезных антигенов. В нечетные ряды вносят S-ЛПС бруцеллезный антиген, в четные ряды вносят R-ЛПС бруцеллезный антиген. Инкубируют в течение 3 часов при температуре 37°С, отмывают от несвязавшихся антител промывочным раствором. Подсушивают планшет на воздухе при комнатной температуре (18-22°С) в течение 16 час. Упаковывают герметически в ламинированную фольгу или полиэтилен, удаляя излишки воздуха.
Изготовление контрольных сывороток.
Контрольными положительными сыворотками служат сыворотки крови кролика иммунизированных нативными бруцеллами из штаммов В. abortus 19 (S положительная сыворотка) и В. abortus KB 17/100 (R положительная сыворотка). Контрольные положительные сыворотки оттитрованы. Контрольными отрицательными сыворотками крови служат сборные сыворотки крови полученные не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Положительное контрольное молоко получают добавлением положительных кроличьих сывороток в молоко не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Изготовление меченных пероксидазой моноклональных антител (конъюгатов) против S и R-ЛПС бруцеллезных антигенов проводят с использованием штаммов гибридомных линий клеток 2Н2 и 2Н8. Клетки штаммов линии 2Н2 и 2Н8 в дозе 2-10×106 клеток на мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получали асцитическую жидкость с активностью моноклональных антител в ИФА 1:640-1:5120, из которой затем выделяют антитела трехкратным осаждением раствором сульфата аммония 50% от насыщения с последующим диализом против 0,01 М натрий-карбонатного буфера, рН 9,5. Содержание антител в препарате (по белку) составило 10-12 мг/мл. Связывание антител с пероксидазой из корней хрена проводят методом, разработанным Wilson, Nakane, после активации фермента перйодатом натрия (4). Полученный конъюгат титровали методом иммуноферментного анализа. Активность полученного конъюгата в иммуноферментном анализе для выявления S и R-ЛПС антигенов адсорбированных в лунках планшета 1:5000-1:30000.
Проведение иммуноферментного анализа для выявления антител к S и R-ЛПС бруцеллезным антигенам состоит в следующем.
В планшеты для микротитрования, сенсибилизированные ЛПС бруцеллезным антигеном, вносят по 0,1 мл конъюгатов анти-S-ЛПС и анти-R-ЛПС. Анти-S-ЛПС конъюгат вносят в нечетные ряды, анти-R-ЛПС конъюгат в четные ряды планшета, затем в лунки вносят по 0,01 мл контрольных и исследуемых образцов сыворотки крови, содержимое лунок тщательно перемешивают, планшет накрывают крышкой и инкубируют при 37°С в течение 1 часа. Затем содержимое лунок удаляют и четырежды промывают промывочным раствором. Далее вносят в каждую лунку по 0,1 мл субстратной смеси, содержащей хромоген и перекись водорода и оставляют при температуре 18-22°С на 5-10 мин в защищенном от прямых солнечных лучей месте. Измеряют оптическую плотность раствора в лунках. Тест считают достоверным, если:
- значение оптической плотности положительного контроля не превышает 0,3;
- отношение между величинами оптической плотности положительного и отрицательного контроля N/Р не менее 1,5.
Реакцию считают положительной, если оптическая плотность раствора в лунке испытуемой равно или меньше оптической плотности раствора в лунке отрицательного контроля.
Осуществление способа диагностики отражено в конкретных примерах.
Пример 1. Изготовление тест-системы и оценка достоверности теста для определения антител к бруцеллезным антигенам в сыворотках крови. Изготовление тест-системы и проведение анализа с контрольными сыворотками, как описано выше. Установку нуля фотометра осуществляют против пустого планшета той же серии, которая была использована для изготовления тест-системы.
Результаты проведения измерений приведены в таблице 1. Полученные в результате измерений значения оптической плотности составляют: для холостой пробы - менее 0,05 (0,02-0,04); для отрицательной контрольной сыворотки 1,750-2,200; для положительной контрольной сыворотки 0,3.
|
Для всех испытанных препаратов антигена тест характеризовался низкой фоновой оптической плотностью и был высоко достоверным (N/P>2). Положительные контрольные сыворотки взаимодействовали со своим антигеном с высокой специфичностью.
Пример 2. Сравнение чувствительности и специфичности серологических способов диагностики бруцеллеза - РА и ИФА. Тест-систему для выявления инфицированного крупного рогатого скота методом конкурентного иммуноферментного анализа готовили, как описано выше, с использованием S и R-ЛПС бруцеллезного антигена на основе штаммов В.abortus шт.19 (S-форма) и КВ-17/100(К-форма). Проводили параллельное исследование 347 сывороток крови крупного рогатого скота из неблагополучного по бруцеллезу хозяйства №1 (закрытого типа) в данной тест-системе и реакции диффузионной преципитации. Результаты исследования приведены в таблице 2.
Совпадение результатов (РА+/ИФА+и РА-/ИФА-) отмечено в 87,5% случаев, несовпадение (РА+/ИФА- и РА-/ИФА+) - в 14,5% случаев. В ИФА было выявлено 40 (13% от числа исследованных) положительных проб, отрицательных в РА. Пять проб (1,5% от числа исследованных), положительных в РА, дали отрицательный результат в ИФА. Все положительные в ИФА сыворотки реагировали с S-бруцеллезным антигеном, так как возбудитель бруцеллеза крупного рогатого скота присутствует в природе в S-форме. Как видно из таблицы, предложенный способ является более чувствительным, по сравнению с РА.

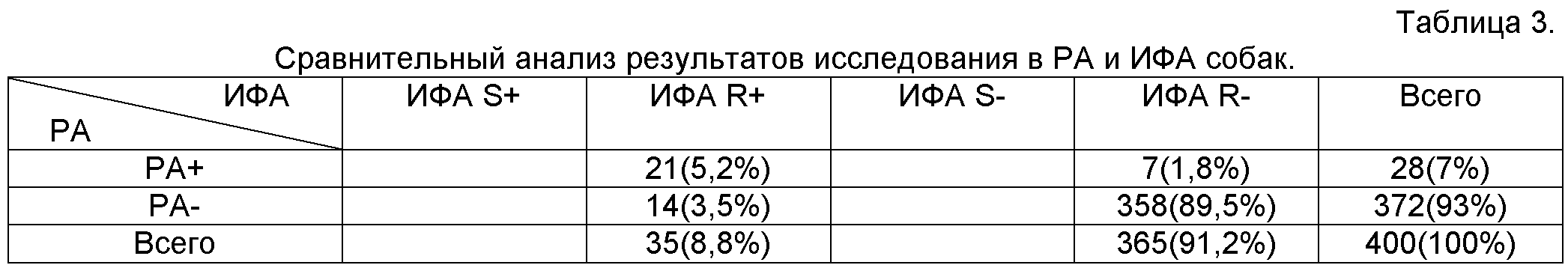
Пример 3. Чувствительность и специфичность иммуноферментного анализа с использованием моноклональных антител для исследования сывороток крови собак. Тест-систему для выявления бруцеллоносителей методом конкурентного иммуноферментного анализа готовили, как описано выше. В качестве антигена использовали препараты, на основе штаммов B.abortus шт.19 (S-форма) и КВ-17/100(R-форма). Проводили параллельное исследование 400 сывороток крови собак, доставленных из ветеринарных клиник.
Совпадение результатов (РА+/ИФА+; РА-/ИФА-) отмечали в 365 или 91,2%, несовпадение (РА+/ИФА-; РА-/ИФА+) - в 5,3% случаев. Семь положительных по результатам РА пробы прореагировали отрицательно в ИФА (1,8%). В ИФА было выявлено 21 (5,2%) положительная проба, тогда как в РА- 14 (3,5%). Все положительные в ИФА сыворотки реагировали с R-бруцеллезным антигеном, так как возбудитель бруцеллеза собак присутствует в природе в R-форме.
Из таблицы 3 видно, что по чувствительности метод иммуноферментного анализа превосходил РА и не уступал ей по специфичности.
Эти результаты свидетельствуют о том, что по чувствительности предложенный способ значительно превосходит РА и приближается к прямому диагностическому тесту - полимеразной цепной реакции (ПЦР).
Приведенные примеры свидетельствуют о высокой специфичности и чувствительности предложенного способа диагностики бруцеллеза путем выявления носителей возбудителя болезни методом конкурентного иммуно-ферментного анализа, независимо от способа получения антигена.
Предложенный способ диагностики бруцеллеза, методом конкурентного иммуноферментного анализа, характеризуется следующими полезными свойствами: обладает высокими чувствительностью и специфичностью вследствие использования при изготовлении тест-системы двух моноклональных антител к повторяющимся антигенным эпитопам; возможность исследования в одной тест-системе различных видов животных; дифференциация циркулирующей в организме формы (S или R) возбудителя заболевания; является методом экспресс-диагностики, позволяющим получить результаты анализа в течение 1,5 часов; включает объективную оценку результатов и поддается автоматизации; позволяет использовать в качестве материала для исследования не только сыворотку крови, но и молоко, что выгодно экономически и снижает риск распространения инфекции при взятии крови.
Способ диагностики бруцеллеза с одновременной дифференциацией возбудителя методом иммуноферментного анализа найдет применение в ветеринарии, что: позволит повысить эффективность оздоровительных мероприятий, сократить сроки оздоровления неблагополучных по бруцеллезу животноводческих хозяйств, выявлять инфицированных собак, находящихся в непосредственном контакте с людьми и в итоге - снизить заболеваемость человека бруцеллезом.
Способ дифференциальной диагностики бруцеллеза, предусматривающий использование антигенов S- и R-форм для выявления антител в испытуемом материале с последующим определением наличия антител, отличающийся тем, что на поверхность твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезные антигены в два этапа, где первый этап предусматривает неспецифическую адсорбцию моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам, и второй - специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам, далее вносят и инкубируют испытуемый материал вместе с меченными ферментом моноклональными антителами, после инкубации отмывают несвязавшиеся реагенты, добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител к бруцеллезным антигенам по величине оптической плотности испытуемых образцов по сравнению с контролем.
