Результат интеллектуальной деятельности: АЗАИНДОЛИЗИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет на основании предварительной заявки на патент США под номером 61/015942, поданной 21 декабря 2007 года, содержание которой во всей ее полноте включено в данное описание путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к азаиндолизинам с противораковой активностью и, более конкретно, к азаиндолизинам, которые ингибируют активность МЕК-киназы. Настоящее изобретение также относится к способам применения соединений для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающего или ассоциированных патологических состояний.
Предпосылки создания изобретения
В поисках понимания того, каким образом Ras передает внеклеточные сигналы к росту, путь МАР-(митоген-активируемый белок)-киназы (МАРК) предстает как очень важный путь между связанным с мембраной Ras и ядром. Путь МАРК охватывает каскад событий фосфорилирования, включающий три ключевых киназы, а именно Raf, MEK (киназа МАР-киназы) и ERK (МАР-киназа). Активный, GTP-связанный Ras приводит к активации и непрямому фосфорилированию Raf-киназы. Затем Raf фосфорилирует МЕК1 и МЕК2 по двум остаткам серина (S218 и S222 для МЕК1 и S222 и S226 для МЕК2) (Ahn et. al., Methods in Enzymology, 2001, 332, 417-431). Активированная МЕК затем фосфорилирует только свои известные субстраты, МАР-киназы, ERK1 и ERK2. ERK- фосфорилирование посредством МЕК происходит по Y204 и T202 в случае ERK1 и по Y185 и T183 в случае ERK2 (Ahn et. al., Methods in Enzymology, 2001, 332, 417-431). Фосфорилированная ERK димеризуется и затем транслоцируется в ядро, где она аккумулируется (Khokhlatchev et. al., Cell, 1998, 93, 605-615). В ядре, ERK вовлекается в некоторые важные клеточные функции, включая, но не ограничиваясь этим, ядерный транспорт, сигнальную трансдукцию, репарацию ДНК, сборку и транслокацию нуклеосомы и процессинг и трансляцию мРНК (Ahn et. al., Molecular Cell, 2000, 6, 1343-1354). Повсеместно, лечение клеток факторами роста приводит к активации ERK1 и ERK2, что в результате приводит к пролиферации и, в некоторых случаях, к дифференцировке (Lewis et. al., Adv. Cancer Res., 1998, 74, 49-139).
Было убедительно доказано, что генетические мутации и/или сверхэкспрессия протеинкиназ, вовлеченные в путь МАР-киназы, приводят к неконтролируемой клеточной пролиферации и, в конечном счете, к образованию опухоли при пролиферативных заболеваниях. Например, некоторые раковые заболевания включают мутации, которые в результате приводят к непрерывной активации этого пути вследствие непрерывного продуцирования факторов роста. Другие мутации могут приводить к дефектам в дезактивации активированного комплекса GTP-связанного Ras, вновь приводя к активации пути МАР-киназы. Мутированные онкогенные формы Ras найдены в случае 50% раковых заболеваний ободочной кишки и >90% раковых заболеваний поджелудочной железы, а также в случае многих других типов раковых заболеваний (Kohl et. al., Science, 1993, 260, 1834-1837). Недавно bRaf-мутации идентифицированы в случае более, чем 60%, злокачественной меланомы (Davies H., et. al., Nature, 2002, 417, 949-954). Эти мутации в bRaf приводят в результате к конститутивно активному каскаду МАР-киназы. Изучение образцов первичной опухоли и линий клеток также указывают на конститутивный или сверхактивный путь МАР-киназы при раке поджелудочной железы, ободочной кишки, легкого, яичника и почки (Hoshino R., et. al., Oncogene, 1999, 18, 813-822).
МЕК предстает в виде привлекательной терапевтической мишени в случае пути МАР-киназного каскада. МЕК, расположенная ниже Ras и Raf по ходу транскрипции, является очень специфичной в отношении фосфорилирования МАР-киназы; действительно, только известные субстраты для фосфорилирования МЕК являются МАР-киназами, ERK1 и ERK2. Показано, что ингибирование МЕК приносит потенциальную терапевтическую пользу при некоторых исследованиях. Например, показано, что малые молекулы ингибиторов МЕК ингибируют рост человеческой опухоли в ксенотрансплантатах "голой" мыши (Sebolt-Leopold et. al., Nature-Medicine, 1999, 5 (7), 810-816); Trachet et. al., AACR, 6-10 апреля, 2002, реферат №5426; Tecle H., IBC 2.sup.nd International Conference of Protein Kinases, 9-10 сентября, 2002), блокируют статическую аллодинию у животных (WO 01/05390, опубликованная 25 января 2001 года) и ингибируют рост клеток при острой миелоидной лейкемии (Milella et. al., J. Clin. Invest., 2001, 108 (6), 851-859).
Некоторые малые молекулы ингибиторов МЕК также обсуждались, например, в WO 02/06213, WO 03/077855 и WO 03/077914. Тем не менее, существует необходимость в новых ингибиторах МЕК в качестве эффективных и безопасных терапевтических средств для лечения множества статусов пролиферативного заболевания, таких как состояния, связанные с гиперактивностью МЕК, а также заболеваний, модулируемых каскадом МЕК.
Краткое изложение сущности изобретения
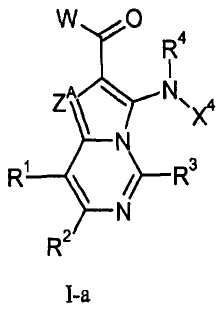
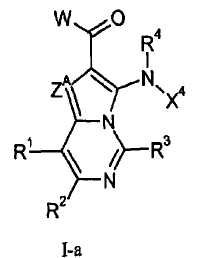
Данное изобретение, в целом, относится к азаиндолизинам формулы I-a или I-b (и/или их сольватам, гидратам и/или солям) с противораковой и/или противовоспалительной активностью и, более конкретно, с ингибирующей МЕК-киназу активностью. Некоторые гиперпролиферативные и воспалительные нарушения характеризуются модуляцией функции МЕК-киназы, например, путем мутаций или сверхэкспрессии белков. Поэтому соединения согласно данному изобретению и содержащие их композиции пригодны для лечения гиперпролиферативных нарушений, таких как раковые и/или воспалительные заболевания, такие как ревматоидный артрит.
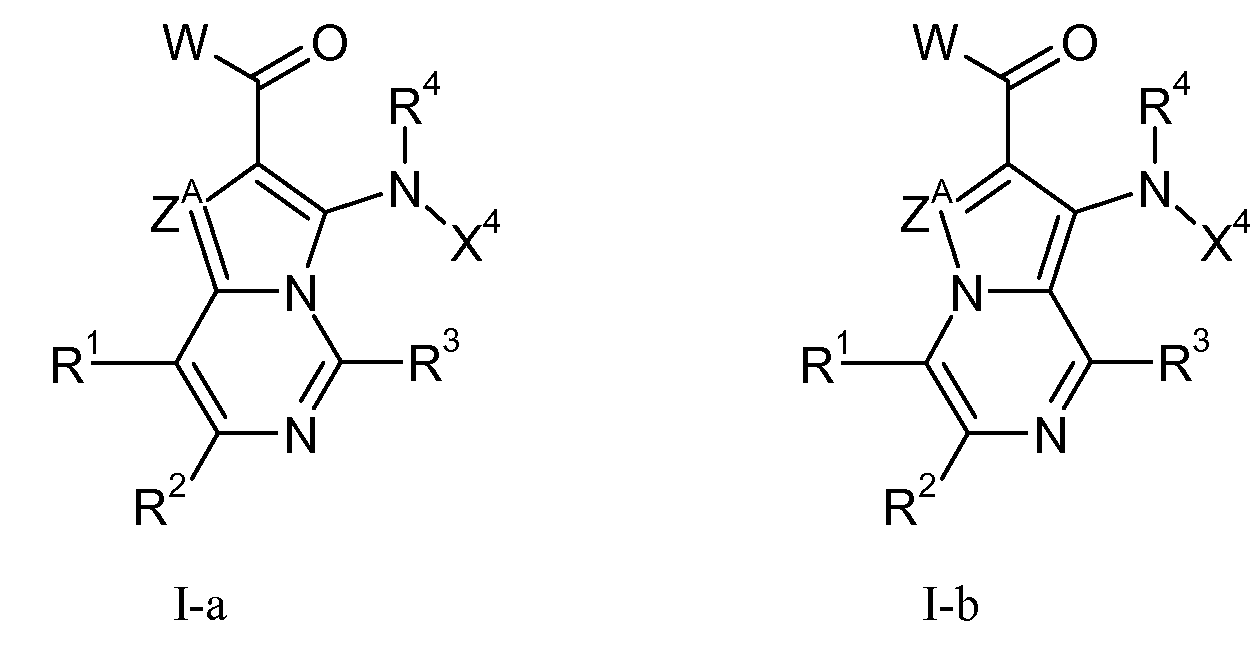
где
ZA означает CRA или N;
RA означает Н, CF3, галоген, С1-С6-алкил или CN;
каждый из R1, R2 и R3 независимо означает Н, С1-С6-алкил, галоген, CN, CF3, -(CR19R20)nNR16R17, -OR16, -SR16 или -С(=О)NR16R17;
W означает:
 или
или 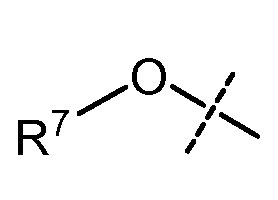
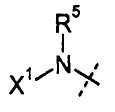
R4 и R5 независимо означают Н или С1-С12-алкил;
Х1 выбирают из R7 и -OR7; когда Х1 означает R7, то Х1 (т.е., R7), необязательно, вместе с R5 и атомом азота, с которым они связаны, образуют 4-7-членный насыщенный или ненасыщенный цикл, имеющий 0-2 дополнительных гетероатома, выбранных из О, S и N, где указанный цикл необязательно замещен одной или более группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16;
каждый R7 независимо означает Н, С1-С12-алкил, С2-С8-алкенил, С2-С8-алкинил, карбоциклил, гетероциклил, арил или гетероарил;
Х4 означает:
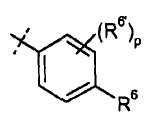
R6 означает Н, галоген, С1-С6-алкил, С2-С8-алкенил, С2-С8-алкинил, карбоциклил, гетероарил, гетероциклил, -OCF3, -NO2, -Si(С1-С6-алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16 или -(CR19R20)nSR16;
R6' означает Н, галоген, С1-С6-алкил, карбоциклил, CF3, -OCF3, -NO2, -Si(С1-С6-алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, С2-С8-алкенил, С2-С8-алкинил, гетероциклил, арил или гетероарил;
р означает 0, 1, 2 или 3;
каждый n независимо означает 0, 1, 2 или 3;
где каждый указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил R1, R2, R3, R4, R5, R6, R6', R7 и RA независимо необязательно замещен одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-С6-алкила), -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16;
каждый R16, R17 и R18 независимо означает Н, С1-С12-алкил, С2-С8-алкенил, С2-С8-алкинил, карбоциклил, гетероциклил, арил или гетероарил, где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил или гетероарил необязательно замещен одной или более группами, выбранными из галогена, CN, -OCF3, CF3, -NO2, С1-С6-алкила, -ОН, -SH, -О(С1-С6-алкила), -S(С1-С6-алкила), -NH2, -NH(С1-С6-алкила), -N(С1-С6-алкила)2, -SO2(С1-С6-алкила), -СО2Н, -СО2(С1-С6-алкила), -С(О)NH2, -С(О)NH(С1-С6-алкила), -С(О)N(С1-С6-алкила)2, -N(С1-С6-алкил)C(O)(С1-С6-алкила), -NHC(O)(С1-С6-алкила), -NHSO2(С1-С6-алкила), -N(С1-С6-алкил)SO2(С1-С6-алкила), -SO2NH2, -SO2NH(С1-С6-алкила), -SO2N(С1-С6-алкила)2, -OC(O)NH2, -OC(O)NH(С1-С6-алкила), -OC(O)N(С1-С6-алкила)2, -OC(O)О(С1-С6-алкила), -NHC(O)NH(С1-С6-алкила), -NHC(O)N(С1-С6-алкила)2, -N(С1-С6-алкил)C(O)NH(С1-С6-алкила), -N(С1-С6-алкил)C(O)N(С1-С6-алкила)2, -NHC(O)NH(С1-С6-алкила), -NHC(O)N(С1-С6-алкила)2, -NHC(O)O(С1-С6-алкила) и -N(С1-С6-алкил)С(О)О(С1-С6-алкила);
или R16 и R17, вместе с атомом азота, к которому они присоединены, образуют 3-8-членный насыщенный, ненасыщенный или ароматический цикл, имеющий 0-2 гетероатома, выбранных из О, S и N, где указанный цикл необязательно замещен одной или более группами, выбранными из галогена, CN, -OCF3, CF3, -NO2, С1-С6-алкила, -ОН, -SH, -О(С1-С6-алкила), -S(С1-С6-алкила), -NH2, -NH(С1-С6-алкила), -N(С1-С6-алкила)2, -SO2(С1-С6-алкила), -СО2Н, -СО2(С1-С6-алкила), -С(О)NH2, -С(О)NH(С1-С6-алкила), -С(О)N(С1-С6-алкила)2, -N(С1-С6-алкил)C(O)(С1-С6-алкила), -NHC(O)(С1-С6-алкила), -NHSO2(С1-С6-алкила), -N(С1-С6-алкил)SO2(С1-С6-алкила), -SO2NH2, -SO2NH(С1-С6-алкила), -SO2N(С1-С6-алкила)2, -OC(O)NH2, -OC(O)NH(С1-С6-алкила), -OC(O)N(С1-С6-алкила)2, -OC(O)О(С1-С6-алкила), -NHC(O)NH(С1-С6-алкила), -NHC(O)N(С1-С6-алкила)2, -N(С1-С6-алкил)C(O)NH(С1-С6-алкила), -N(С1-С6-алкил)C(O)N(С1-С6-алкила)2, -NHC(O)NH(С1-С6-алкила), -NHC(O)N(С1-С6-алкила)2, -NHC(O)O(С1-С6-алкила) и -N(С1-С6-алкил)С(О)О(С1-С6-алкила);
R19 и R20 независимо выбирают из Н, С1-С12-алкила, -(СН2)n-арила, -(СН2)n-карбоциклила, -(СН2)n-гетероциклила и -(СН2)n-гетероарила;
каждый Y' независимо означает О, NR21 или S; и
R21 означает Н или С1-С12-алкил.
Настоящее изобретение относится к композиции (например, фармацевтической композиции), содержащей соединение формулы I-a или I-b (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также относится к композиции (например, фармацевтическая композиция), содержащей соединение формулы I-a или I-b (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель), дополнительно содержащей второе химиотерапевтическое средство и/или второе противовоспалительное средство. Композиции согласно настоящему изобретению пригодны для ингибирования аномального роста клеток или для лечения гиперпролиферативного нарушения у млекопитающего (например, человека). Композиции согласно настоящему изобретению также пригодны для лечения воспалительных заболеваний у млекопитающего (например, человека).
Настоящее изобретение относится к способу ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов и солей) или содержащей его композиции, индивидуально или в комбинации со вторым химиотерапевтическим средством.
Настоящее изобретение относится к способу лечения воспалительного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов и солей) или содержащей его композиции, индивидуально или в комбинации со вторым противовоспалительным средством.
Настоящее изобретение относится к способу применения соединений согласно настоящему изобретению для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающего, организмов или ассоциированных патологических состояний.
Подробное описание типичных воплощений
Далее представлено подробное описание некоторых воплощений данного изобретения, примеры которых проиллюстрированы с помощью сопроводительных структур и формул. Несмотря на то, что данное изобретение будет описано совместно с перечисленными воплощениями, должно быть понятно, что данное изобретение не ограничено этими воплощениями. Наоборот, подразумевают, что данное изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в рамки настоящего изобретения, как указано в формуле изобретения. Квалифицированному специалисту в данной области известно много способов и материалов, подобных или эквивалентных таковым, описанным в данном описании, которые можно использовать при осуществлении настоящего изобретения. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами. В случае, когда одно или более из включенной литературы, патентов и подобных материалов отличается от данной заявки или противоречит данной заявке, включая, но не ограничиваясь этим, определенные термины, употребление терминов, описанные методики или т.п., это контролируется в настоящей заявке.
Определения
Термин "алкил", как используется в данном описании, относится к насыщенному одновалентному углеводородному радикалу с линейной или разветвленной цепью, с одним-двенадцатью атомами углерода,. Примеры алкильных групп включают, но не ограничиваясь этим, метил (Ме, -СН3), этил (Et, -СН2СН3), 1-пропил (n-Pr, н-пропил, -СН2СН2СН3), 2-пропил (i-Pr, изопропил, -СН(СН3)2), 1-бутил (n-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (i-Bu, изобутил, -СН2СН(СН3)2), 2-бутил (s-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (t-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3), 1-гептил, 1-октил и т.п.
Термин "алкенил" относится к одновалентному углеводородному радикалу с линейной или разветвленной цепью, с двумя-двенадцатью атомами углерода, по меньшей мере, с одним местом ненасыщенности, т.е., углерод-углеродной sp2-двойной связью, где алкенильный радикал включает радикалы, имеющие "цис" и "транс" ориентации, или, альтернативно, "Е" и "Z" ориентации. Примеры включают, но не ограничиваясь этим, этиленил или винил (-СН=СН2), аллил (-СН2СН=СН2) и т.п.
Термин "алкинил" относится к одновалентному углеводородному радикалу с линейной или разветвленной цепью, с двумя-двенадцатью атомами углерода, по меньшей мере, с одним местом ненасыщенности, т.е., углерод-углеродной sp-тройной связью. Примеры включают, но не ограничиваясь этим, этинил (-С≡СН), пропинил (пропаргил, -СН2С≡СН) и т.п.
Термины "карбоцикл", "карбоциклил", "карбоциклический цикл" и "циклоалкил" относятся к одновалентному неароматическому, насыщенному или частично ненасыщенному циклу, имеющему 3-12 атомов углерода, в виде моноцикла, или 7-12 атомов углерода, в виде бицикла. Бициклические карбоциклы, имеющие 7-12 атомов углерода, можно классифицировать, например, как бицикло[4,5]-, [5,5]-, [5,6]- или [6,6]-система, и бициклические карбоциклы, имеющие 9 или 10 атомов цикла, можно классифицировать как бицикло[5,6]- или [6,6]-система, или как системы с мостиковой связью, такие как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры моноциклических карбоциклов включают, но не ограничиваясь этим, циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.п.
Термин "арил" означает одновалентный ароматический углеводородный радикал с 6-18 атомами углерода, получаемый удалением одного атома водорода от одного атома углерода исходной ароматической циклической системы. Некоторые арильные группы представлены в виде типичных структур, как "Ar". Арил включает бициклические радикалы, содержащие ароматический цикл, конденсированный с насыщенным, частично ненасыщенным циклом или ароматическим карбоциклом или гетероциклом. Типичные арильные группы включают, но не ограничиваясь этим, радикалы, происходящие от бензола (фенил), замещенных бензолов, нафталина, антрацена, инденила, инданила, 1,2-дигидронафталина, 1,2,3,4-тетрагидронафтила и т.п.
Термины "гетероцикл", "гетероциклил" и "гетероциклический цикл" взаимозаменяемо используют в данном описании, и они относятся к насыщенному или частично ненасыщенному (т.е., имеющему одну или более двойных и/или тройных связей в цикле) карбоциклическому радикалу с 3-18 атомами цикла, в котором, по меньшей мере, один атом цикла является гетероатомом, выбранным из атома азота, кислорода и серы, причем остальные атомы цикла означают атомы углерода, где один или более атомов цикла независимо необязательно замещен одним или более заместителями, описанными ниже. Гетероцикл может быть моноциклом, имеющим 3-7 членов цикла (2-6 атомов углерода и 1-4 гетероатомов, выбранных из N, O, P и S), или бициклом, имеющим 7-10 членов цикла (4-9 атомов углерода и 1-6 гетероатомов, выбранных из N, O, P и S), например, бицикло[4,5]-, [5,5]-, [5,6]- или [6,6]-система. Гетероциклы описаны Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), особенно, главы 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 и до настоящего времени), в особенности, тома 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960), 82: 5566. Термин "гетероциклил" также включает радикалы, где радикалы гетероцикла конденсированы с насыщенным, частично ненасыщенным циклом или ароматическим карбоциклом или гетероциклом. Примеры гетероциклов включают, но не ограничиваясь этим, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидинил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Спиро-остатки также включены в рамки данного определения. Примерами гетероциклической группы, где атомы цикла замещены оксогруппами (=О), являются пиримидинонил и 1,1-диоксотиоморфолинил.
Термин "гетероарил" относится к одновалентному ароматическому радикалу с 5- или 6-членным циклом, и включает конденсированные циклические системы (по меньшей мере, одна из которых является ароматической) с 5-18 атомами, содержащие один или более гетероатомов, независимо выбранных из атома азота, кислорода и серы. Примерами гетероарильных групп являются пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
Гетероциклические или гетероарильные группы могут быть присоединены по углероду (углерод-связываемые) или по азоту (азот-связываемые), где такое возможно. В качестве примера, и без ограничения, углерод-связываемые гетероциклы или гетероарилы связаны в положении 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина, или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
В качестве примера и без ограничения, азот-связываемые гетероциклы или гетероарилы связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1Н-индазола, в положении 2 изоиндола или изоиндолина, в положении 4 морфолина, и в положении 9 карбазола или β-карболина.
Термин "галоген" относится к F, Cl, Br или I. Гетероатомы, присутствующие в гетероариле или гетероциклиле, включают окисленные формы, такие как N+ → O-, S(O) и S(O)2.
Термины "лечить" и "лечение" относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, где у объекта нужно предупреждать или замедлять (уменьшать) нежелательное физиологическое изменение или нарушение, такое как развитие или распространение ракового заболевания. Для целей данного изобретения, благоприятные или желательные клинические результаты включают, но не ограничиваясь этим, ослабление симптомов, уменьшение распространения заболевания, стабилизацию (т.е., не ухудшение) статуса заболевания, задержку или снижение развития заболевания, уменьшение интенсивности или временное облегчение статуса заболевания и ремиссию (или частичную или полную), или выявляемую или не выявляемую. Термин "лечение" также может означать пролонгируемое выживание, по сравнению с ожидаемым выживанием, если не получать лечения. Пациенты с необходимостью лечения включают таковые уже с состоянием или нарушением, а также таковые, склонные иметь состояние или нарушение, или таковые, у которых должно быть предотвращено состояние или нарушение.
Фраза "терапевтически эффективное количество" означает количество соединения согласно настоящему изобретению, которое (i) лечит или предотвращает определенное заболевание, состояние или нарушение, (ii) ослабляет, уменьшает интенсивность или устраняет один или более симптомов определенного заболевания, состояния или нарушения, или (iii) предотвращает или задерживает начало одного или более симптомов определенного заболевания, состояния или нарушения, описанного в данном описании. В случае ракового заболевания, терапевтически эффективное количество лекарственного средства может уменьшать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е., замедлять до некоторой степени и, предпочтительно, останавливать) инфильтрацию раковой клетки в периферические органы; ингибировать (т.е., замедлять до некоторой степени и, предпочтительно, останавливать) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или ослаблять до некоторой степени один или более симптомов, связанных с раковым заболеванием. До некоторой степени, лекарственное средство может предупреждать рост и/или уничтожать имеющиеся раковые клетки, причем это средство может быть цитостатическим и/или цитотоксическим. В случае раковой терапии эффективность может быть определена, например, путем оценки времени прогрессирования заболевания (ТТР) и/или определения скорости ответа (RR).
Термины "аномальный рост клетки" и "гиперпролиферативное нарушение" взаимозаменяемо используются в данной заявке. Термин "аномальный рост клетки", как используется в данном описании, за исключением иначе указанного, относится к росту клетки, который является независимым от обычного регуляторного механизма (например, потеря контактного ингибирования). Данный термин включает, например, аномальный рост: (1) опухолевых клеток (опухолей), которые пролиферируют за счет экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток в случае других пролиферативных заболеваний, при которых происходит активация аберрантной тирозинкиназы; (3) любых опухолей, которые пролиферируют за счет рецепторных тирозинкиназ; (4) любых опухолей, которые пролиферируют за счет аберрантной активации серин/треонинкиназы; и (5) доброкачественных и злокачественных клеток в случае других пролиферативных заболеваний, при которых происходит аберрантная активация серин/треонинкиназы.
Термины "раковое заболевание" и "раковый" относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. "Опухоль" включает одну или более раковых клеток. Примеры раковых заболеваний включают, но не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкемию или злокачественную лимфому. Более конкретные примеры таких раковых заболеваний включают рак сквамозной клетки (например, рак эпителиальной сквамозной клетки), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого ("NSCLC"), аденокарциному легкого и сквамозную карциному легкого, рак брюшины, гепатоцеллюлярный рак, рак области желудка или желудка, включая желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, ректальный рак, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, рак почки или почечный рак, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карциному полового члена, острую лейкемию, а также рак головы/головного мозга и шеи.
"Химиотерапевтическое средство" представляет собой соединение, пригодное для лечения ракового заболевания. Примеры химиотерапевтических средств включают эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), фулвестрант (FASLODEX®, AstraZeneca), сутент (SU11248, Pfizer), летрозол (FEMARA®, Novartis), иматинибмезилат (GLEEVEC®, Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Eloxatin®, Sanofi), 5-FU (5-фторурацил), леуковорин, рапамицин (Sirolimus, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs) и гефитиниб (IRESSA®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие средства, такие как тиотепа и CYTOXAN® циклосфосфамид; алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквион, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адоцелезин, карцелезин и бицелезин); криптофицины (особенно, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; хлорметины, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретаминоксидгидрохлорид, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урацилметин; нитросуреазы, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как антибиотики типа энедиина (например, калихеамицин, особенно, калихеамицин-гамма1I и калихеамицин-омегаI1 (Angew Chem. Intl. Ed. Engl. (1994), 33: 183-186); динемицин, включая динемицин А; бифосфонаты, такие как клодронат; эсперамицин; а также, неокарциностатин-хромофор и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин), морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, тиберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон-пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренальные средства, такие как аминоглютетимид, митотан, трилостан; наполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидглюкозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльфорнитин; эллиптиний-ацетат; эпотилон, этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®, полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно, Т-2-токсин, веррацирин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например TAXOL® (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE™ (не содержащий кремофора), лекарственные формы паклитаксела в виде связанных с альбумином наночастиц паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и TAXOTERE® (доксетаксел; Rhône-Poulenc Rorer, Antony, France); хлоранмбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®); ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любого из вышеперечисленных средств.
Также в определение "химиотерапевтический средство" включены: (i) антигормональные средства, которые регулируют или ингибируют гормональное воздействие на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERMs), включая, например, тамоксифен (включая NOLVADEX®; тамоксифенцитрат), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON® (торемифинцитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующий продуцирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® (мегестролацетат), AROMASIN® (экземестан; Pfizer), форместан, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARIMIDEX® (анастрозол; AstraZeneca); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин; а также троксацитабин (аналог 1,3-диоксолан-нуклеозид-цитозина); (iv) ингибиторы протеинкиназы; (v) ингибиторы липидкиназы; (vi) антисмысловые олигонуклеотиды, особенно такие, которые ингибируют экспрессию генов в сигнальных путях, вовлекаемых в аберрантную клеточную пролиферацию, такие как, например, РКС-альфа, Ralf и H-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®) и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины для генной терапии, например, ALLOVECTIN®, LEUVECTIN® и VAXID®; PROLEUKIN® rIL-2; ингибитор топоизомеразы 1, такой как LURTOTECAN®; ABARELIX® rmRH; (ix) антиангиогенные средства, такие как бевацизумаб (AVASTIN®, Genentech); и (х) фармацевтически приемлемые соли, кислоты и производные любого из вышеперечисленных средств. Другие антиангиогенные средства включают ингибиторы ММР-2 (матриксная металлопротеиназа 2), ингибиторы ММР-9 (матриксная металлопротеиназа 9), ингибиторы СОХ-II (циклооксигеназа II) и ингибиторы VEGF-рецепторной тирозинкиназы. Примеры таких пригодных ингибиторов матриксных металлопротеиназ, которые можно использовать в комбинации с соединениями согласно настоящему изобретению/композициями согласно настоящему изобретению (такими как любое одно из соединений, указанных в заголовках примеров 5-10), описаны в Международных заявках WO 96/33172, WO 96/27583, ЕР 818442, ЕР 1004578, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, ЕР 606046, ЕР 931788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99/07675, в EP 945864, в патенте США 5863949, в патенте США 5861510 и EP 780386, все из которых включены в данное описание во всей своей полноте путем ссылки. Примеры ингибиторов VEGF-рецепторной тирозинкиназы включают 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474; пример 2 из WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 из WO 00/47212), ваталаниб (РТК787; WO 98/35985) и SU11248 (сунитиниб; WO 01/60814), и соединения, такие как соединения, описанные в Международных публикациях РСТ под номерами WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354).
Другие примеры химиотерапевтических средств, которые можно использовать в комбинации с соединениями согласно настоящему изобретению (такими, как любое одно из указанных в заголовках соединений примеров 5-10) включают ингибиторы PI3K (фосфоиноситид-3-киназы), такие как описанные Yaguchi et. al., (2006), Jour. of the Nat. Cancer Inst., 98(8): 545-556; в патенте США 7173029; патенте США 7037915; патенте США 6608056; патенте США 6608053; патенте США 6838457; патенте США 6770641; патенте США 6653320; патенте США 6403588; патенте США 2008/0242665; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; патенте США 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; патенте США 2003/149074; WO 2003/035618; WO 2003/034997; патенте США 2003/158212; EP 1417976; патенте США 2004/053946; JP 2001247477; JP 08175990; JP 08176070; патенте США 6703414 и WO 97/15658, все из которых включены в данное описание во всей своей полноте путем ссылки. Конкретные примеры таких ингибиторов PI3K включают SF-1126 (ингибитор PI3K, Semafore Pharmaceuticals), BEZ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis, Inc.) и GDC-0941 (ингибитор PI3K, Genentech, Inc.).
Термин "воспалительные заболевания", как используется в данной заявке, включает, но не ограничиваясь этим, ревматоидный артрит, атеросклероз, застойную сердечную недостаточность, воспалительное кишечное заболевание (включая, но не ограничиваясь этим, болезнь Крона и язвенный колит), хроническое обструктивное заболевание легких, фиброзное заболевание печени и почек, болезнь Крона, волчанку, кожные заболевания, такие как псориаз, экзема и склеродерма, остеоартрит, рассеянный склероз, астму, заболевания и нарушения, связанные с диабетическими осложнениями, фиброзное повреждение органов, таких как легкое, печень, почка, и осложнения при воспалении сердечно-сосудистой системы, такие как острый коронарный синдром.
"Противовоспалительное средство" означает соединение, пригодное для лечения воспаления. Примеры противовоспалительных средств включают инъецируемые белковые терапевтические средства, такие как Enbrel®, Remicade®, Humira® и Kineret®. Другие примеры противовоспалительных средств включают нестероидные противовоспалительные средства (NSAIDs), такие как ибупрофен или аспирин (которые уменьшают опухоль и облегчают боль); противоревматические лекарственные средства, модифицирующие заболевание (DMARDs), такие как метотрексат; 5-аминосалицилаты (сульфасалазин и не содержащие серы средства); кортикостероиды; иммуномодуляторы, такие как 6-меркаптопутин ("6-MP"), азатиоприн ("AZA"), циклоспорины и модификаторы биологического ответа, такие как Remicade.RTM. (инфликсимаб) и Enbrel.RTM. (этанерцепт); факторы роста фибробластов; факторы роста тромбоцитов; блокаторы ферментов, такие как Arava.RTM. (лефлуномид); и/или хрящевой защитный агент, такой как гиалуроновая кислота, глюкозамин и хондроитин.
Термин "пролекарство", как используется в данной заявке, относится к предшественнику или производному соединения согласно данному изобретению, которое способно ферментативно или гидролитически активироваться или превращаться в более активную исходную форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy", Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et. al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et. al., (изд.), pp. 247-267, Humana Press (1985). Пролекарства согласно данному изобретению включают, но не ограничиваясь этим, содержащие сложный эфир пролекарства, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, модифицированные D-аминокислотой пролекарства, гликозилированные пролекарства, содержащие β-лактам пролекарства, необязательно замещенные пролекарства, содержащие феноксиацетамид, необязательно замещенные пролекарства, содержащие фенилацетамид, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут превращаться в более активное нецитотоксическое лекарственное средство. Примеры цитотоксических лекарственных средств, которые могут быть дериватизированы с образованием пролекарственной формы для применения согласно данному изобретению, включают, но не ограничиваясь этим, соединения согласно данному изобретению и химиотерапевтические средства, такие как описанные выше.
"Метаболит" представляет собой продукт, получаемый за счет метаболизма конкретного соединения или его соли в организме. Метаболиты соединения можно идентифицировать, используя стандартные методики, известные в данной области, и их активности определяют, используя тесты, такие как, например, описанные в данном описании. Такие продукты можно получать, например, в результате окисления, гидроксилирования, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п., вводимого соединения. Соответственно, данное изобретение относится к метаболитам соединений согласно данному изобретению, включая соединения, продуцируемые процессом, включающим контактирование соединения согласно данному изобретению с млекопитающим в течение периода времени, достаточного для образования его метаболического продукта.
"Липосома" представляет собой маленький мембранный пузырек (везикулу), включающий различные типы липидов, фосфолипидов и/или поверхностно-активных веществ, который пригоден для доставки лекарственного средства (такого как ингибиторы МЕК, описанные в данном описании, и, необязательно, химиотерапевтическое средство) млекопитающему. Компоненты липосомы, как правило, упорядочены в двуслойное образование, подобное липидному бислою биологических мембран.
Термин "инструкция по применению", как используется в данном описании, относится к инструкциям, обычно вкладываемым в промышленные упаковки терапевтических лекарственных средств, которые содержат информацию о показаниях, применении, дозах, введении, противопоказаниях и/или предупреждениях относительно применения таких терапевтических продуктов.
Термин "хиральный" относится к молекулам, которые обладают свойством несовместимости со своим зеркальным отражением, тогда как термин "ахиральный" относится к молекулам, которые совместимы со своим зеркальным отражением.
Термин "стереоизомер" относится к соединениям, которые обладают одинаковым химическим строением и соединением атомов, но различаются расположением этих атомов относительно друг друга в пространстве, причем не могут осуществлять взаимное превращение при вращении вокруг простых связей.
Термин "диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, и чьи молекулы не являются зеркальным отражением друг друга. Диастереомеры обладают различными физическими свойствами, например, температурами плавления, температурами кипения, спектральными свойствами и реакционной способностью. Смеси диастереомеров можно разделять с помощью аналитических методик с высокой степенью разделения, таких как кристаллизация, электрофорез и хроматография.
Термин "энантиомеры" относится к двум стереоизомерам соединения, у которых несовместимы зеркальные отражения друг друга.
Стереохимическими определениями и конвенциями, используемыми в данном описании, обычно руководствуются согласно S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984), McGraw-Hill Book Company, New York; и Eliel E. and Wilen S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения согласно данному изобретению могут включать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Подразумевают, что все стереоизомерные формы соединений согласно данному изобретению, включая, но не ограничиваясь этим, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью к ротации в плоскости плоскополяризованного света. При описании оптически активного соединения префиксы D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы относительно ее хирального(ых) центра(ов). Префиксы d и l, или (+) и (-), используют для указания на знак ротации соединения в плоскости плоскополяризованного света, где префикс (-) или 1 означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры, эти стереоизомеры идентичны, за исключением того, когда они являются зеркальными отражениями друг друга. Отдельный стереоизомер также можно рассматривать как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 рассматривают как рацемическую смесь или рацемат, которая(ый) может встречаться, когда нет стереоселективности или стереоспецифичности в химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух типов энантиомеров, не имеющей оптической активности.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различными энергиями, которые взаимопревращаемы за счет низкого энергетического барьера. Например, таутомеры с протонной изомерией (также известные как прототропные таутомеры) включают взаимопревращения за счет миграции протона, такие как кето-енольная и имино-енаминная изомеризации. Таутомеры с валентной изомерией (валентные таутомеры) включают взаимопревращения за счет перераспределения некоторых из электронов связи.
Фраза "фармацевтически приемлемая соль", как используется в данном контексте, относится к фармацевтически приемлемым органическим или неорганическим солям соединения согласно данному изобретению. Примеры солей включают, но не ограничиваясь этим, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат "мезилат", этансульфонат, бензолсульфонат, п-толуолсульфонат, памоат (т.е., 1,1'-метиленбис(2-гидрокси-3-нафтоат), соли щелочных металлов (например, натрия и калия), соли щелочноземельных металлов (например, магния) и аммониевые соли. К фармацевтически приемлемой соли можно добавлять другую молекулу, такую как ацетат-ион, сукцинат-ион или другой противоион. Противоион может быть любым органическим или неорганическим "фрагментом", который стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. В случаях, когда многозарядные атомы являются частью фармацевтически приемлемой соли, она может иметь множество противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов.
Если соединение согласно данному изобретению представляет собой основание, то желательную фармацевтически приемлемую соль можно получать при использовании любой подходящей методики, доступной в данной области, например, путем обработки свободного основания неорганической кислотой, такой как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пираносидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или т.п.
Если соединение согласно данному изобретению представляет собой кислоту, то желательную фармацевтически приемлемую соль можно получать с помощью любой подходящей методики, например, путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла, или т.п. Иллюстративные примеры подходящих солей включают, но не ограничиваясь этим, органические соли, получаемые при использовании аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, происходящие от натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Фраза "фармацевтически приемлемый" означает, что вещество или композиция должны быть химически и/или токсикологически совместимы с другими ингредиентами, включенными в готовую лекарственную форму, и/или млекопитающим, которое при этом подвергают лечению.
Термин "сольват" относится к ассоциации или комплексу одной или более молекул растворителя и соединения согласно данному изобретению. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваясь этим, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, где молекула растворителя представляет собой воду.
Термин "защитная группа" относится к заместителю, который, как правило, блокирует или защищает отдельную функциональность, в то время, как происходит взаимодействие других функциональных групп соединения. Например, "аминозащитная группа" представляет собой заместитель, присоединенный к аминогруппе, чтобы блокировать или защищать функциональную аминогруппу в соединении. Подходящие аминозащитные группы включают ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Подобным образом, "гидроксизащитная группа" относится к заместителю гидроксильной группы, который блокирует или защищает гидроксильную функциональность. Подходящие защитные группы включают ацетил и триалкилсилил. "Карбоксизащитная группа" относится к заместителю карбоксильной группы, который блокирует или защищает карбоксильную функциональность. Обычные карбоксизащитные группы включают фенилсульфонилэтил, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и т.п. В отношении общего описания защитных групп и их использования см. руководство T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Термины "соединение согласно данному изобретению", "соединения согласно настоящему изобретению", "соединения формулы I-a или I-b", "азаиндолизины" и "азаиндолизины формулы I-a или I-b", за исключением иначе указанного, включают соединения/азаиндолизины формулы I-a или I-b и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли) и пролекарства.
Настоящее изобретение относится к азаиндолизинам формулы I-a или I-b, как описано выше, пригодным в качестве ингибиторов киназы, особенно пригодных, в качестве ингибиторов МЕК-киназы. Настоящее изобретение относится к соединениям формулы II-a или II-b (т.е., ZA означает CRA) и все другие переменные имеют значения, как указано в случае формул I-a или I-b.
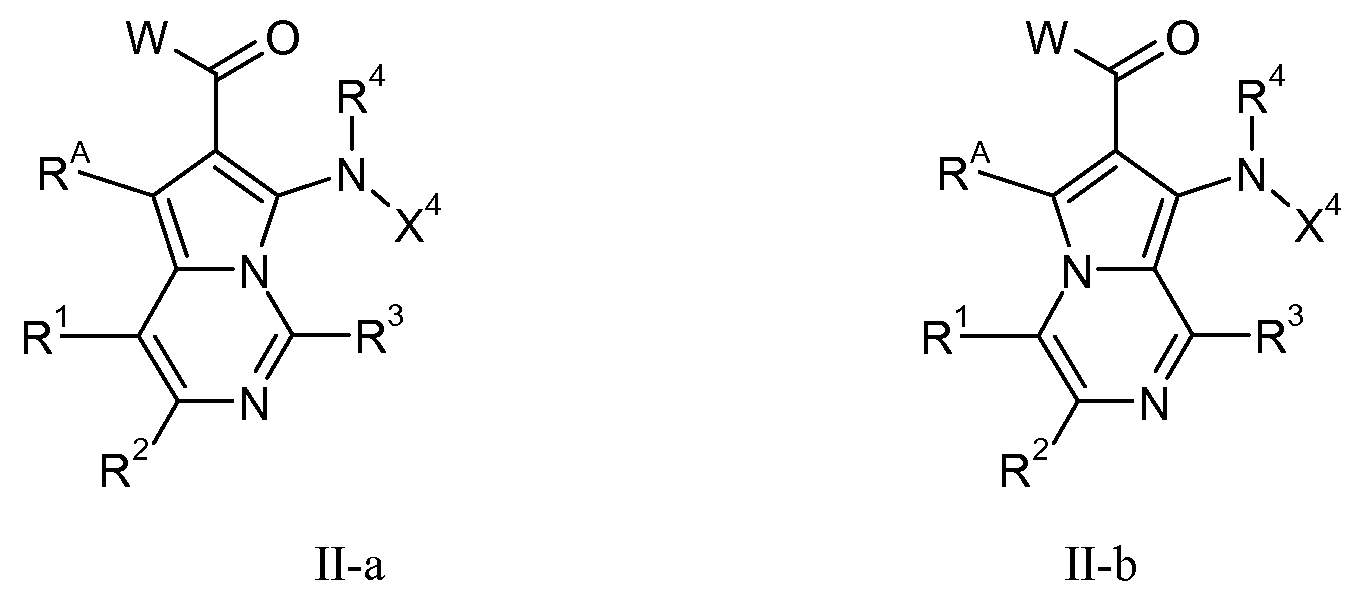
В одном воплощении настоящего изобретения, R1 означает Н, галоген, CN, CF3, С1-С6-алкил, -NR16R17, -OR16 или -SR16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b.
В другом воплощении настоящего изобретения, R1 означает Н, Cl, Br, F, CN, CF3, CHF2, метил, этил, -NH2, -NH(CH3), -N(CH3)2, -OH или -OCH3; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b.
В другом воплощении настоящего изобретения, R1 означает Н, Cl, F, CF3 или метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b.
В другом воплощении настоящего изобретения, R1 означает Н или F; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b.
В одном воплощении настоящего изобретения, R2 означает Н, галоген, CN, CF3, С1-С6-алкил, -NR16R17, -OR16 или -SR16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R2 означает Н, Cl, F, CN, CF3, CHF2, метил, этил, -NH2, -NH(CH3), -N(CH3)2, -OH или -OCH3; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R2 означает Н, Cl, F, CF3 или метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R2 означает Н; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, R3 означает Н, галоген, CN, CF3, С1-С6-алкил, -NR16R17, -OR16 или -SR16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R3 означает Н, Cl, F, CN, CF3, CHF2, метил, -NH2, -NH(CH3), -N(CH3)2, -OH или -OCH3; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R3 означает Н, Cl, F, CF3 или метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R3 означает Н; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, RA означает Н, галоген или CF3; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, RA означает Н, F или Cl; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, R4 означает Н или С1-С6-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R4 означает Н или метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R4 означает Н; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
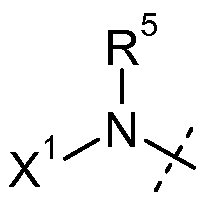
В одном воплощении настоящего изобретения, R5 означает Н или С1-С6-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает Н или метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает Н; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает метил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
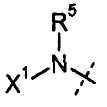
В одном воплощении настоящего изобретения, Х1 означает OR7; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает OR7, где R7 означает Н или С1-С12-алкил (например, С1-С6-алкил), замещенный одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает OR7, где R7 означает гетероциклил (например, 4-6-членный гетероциклил), необязательно замещенный одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает OR7, где R7 означает 4-6-членный гетероциклил, имеющий 1 атом азота в цикле, где указанный гетероциклил необязательно замещен одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает:
 ;
;
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает:
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, Х1 означает R7; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает R7, где R7 означает Н или С1-С12-алкил (например, С1-С6-алкил), замещенный одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6-алкила), -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает:
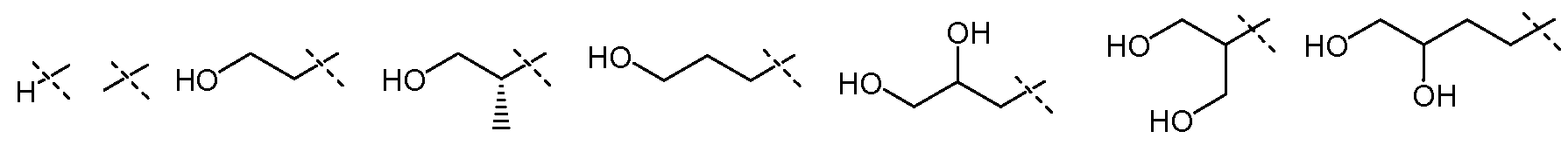
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает Н и Х1 означает:
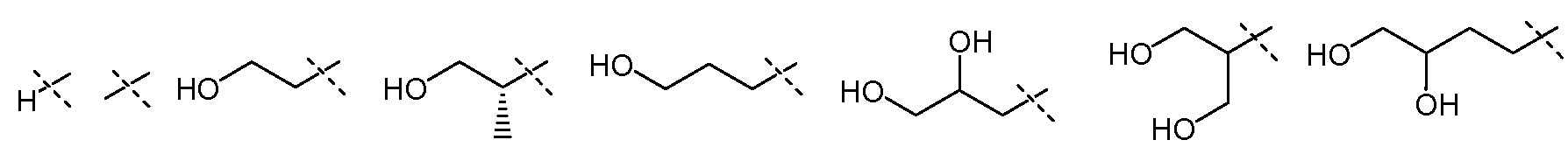
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает Н, RA означает Н, и Х1 означает:
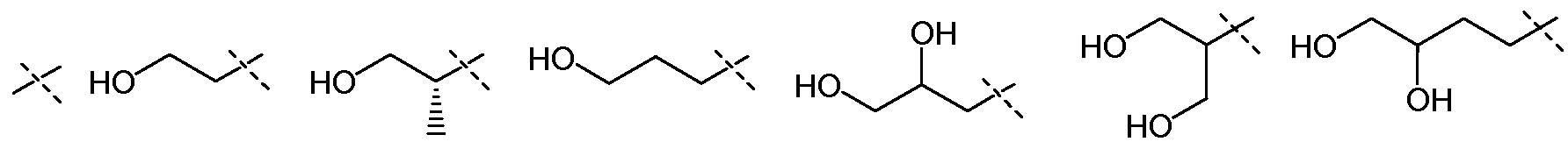
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х1 означает:
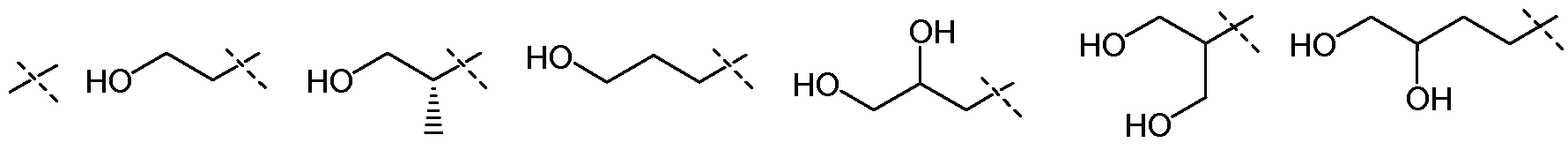
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R5 означает метил, и Х1 означает:
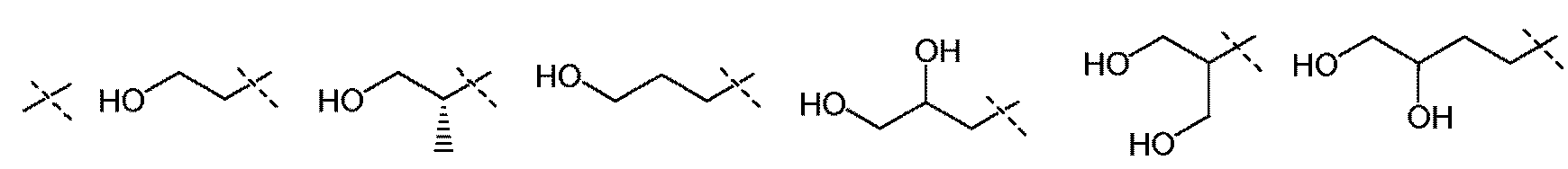
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, Х1 означает R7 и Х1 (т.е., R7) вместе с R5 и атомом азота, с которым они связаны, образуют 4-5-членный насыщенный цикл, имеющий 0-2 дополнительных гетероатома, выбранных из О, S и N, где указанный цикл необязательно замещен одной или более группами, выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)n-SR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, W означает:
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, W означает -OR7, где R7 означает Н или С1-С12-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, W означает -OR7, где R7 означает Н; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, W означает -OR7, где R7 означает С1-С6-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, R6 означает галоген, С2-С8-алкинил, карбоциклил или -SR16; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, R6 означает галоген, С2-С3-алкинил, С3-карбоциклил или -SR16, где R16 означает С1-С2-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, R6' означает Н, галоген или С1-С3-алкил; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В одном воплощении настоящего изобретения, р означает 1 или 2; и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
В другом воплощении настоящего изобретения, Х4 означает:
и все другие переменные имеют значения, как указано в случае формул I-a, I-b, II-a или II-b или как указано в любом одном из воплощений, описанных выше.
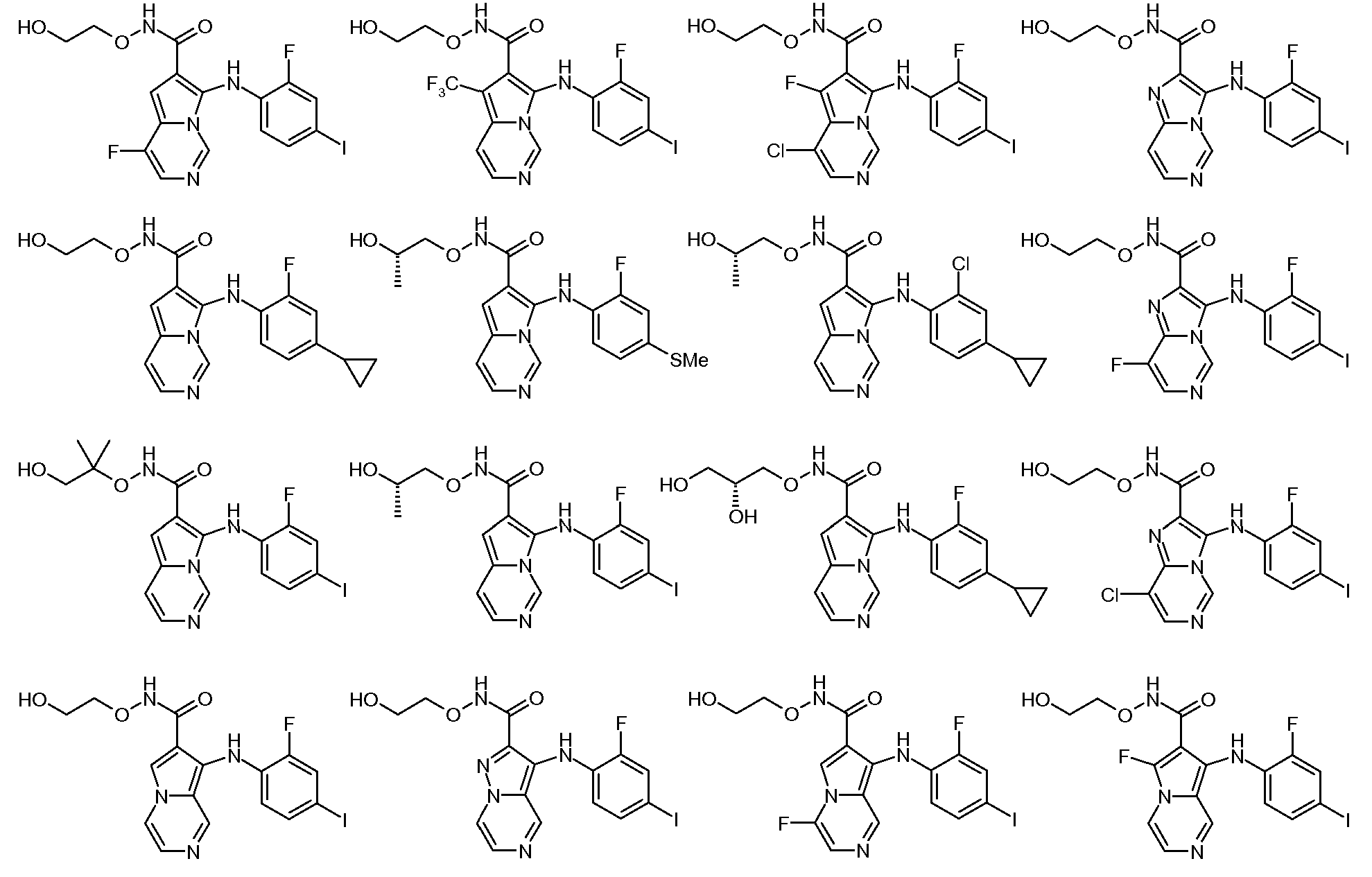
Другое воплощение настоящего изобретения относится к соединениям, описанным в примерах 5-10, и нижеуказанным соединениям:
Получение соединений формулы I-a или I-b
Азаиндолизины формулы I-a или I-b получают в соответствии с методиками, описанными ниже на схемах и в примерах, или с помощью методик, известных в данной области. Исходные вещества и различные промежуточные продукты могут быть получены из коммерческих источников, получены из коммерчески доступных соединений или получены, используя хорошо известные способы синтеза (например, описанные в WO 02/06213, WO 03/077855 и WO 03/077914).
Например, азаиндолизины формулы (II-a) можно получать, используя пути синтеза, показанные на схемах 1 и 2.
Схема 1
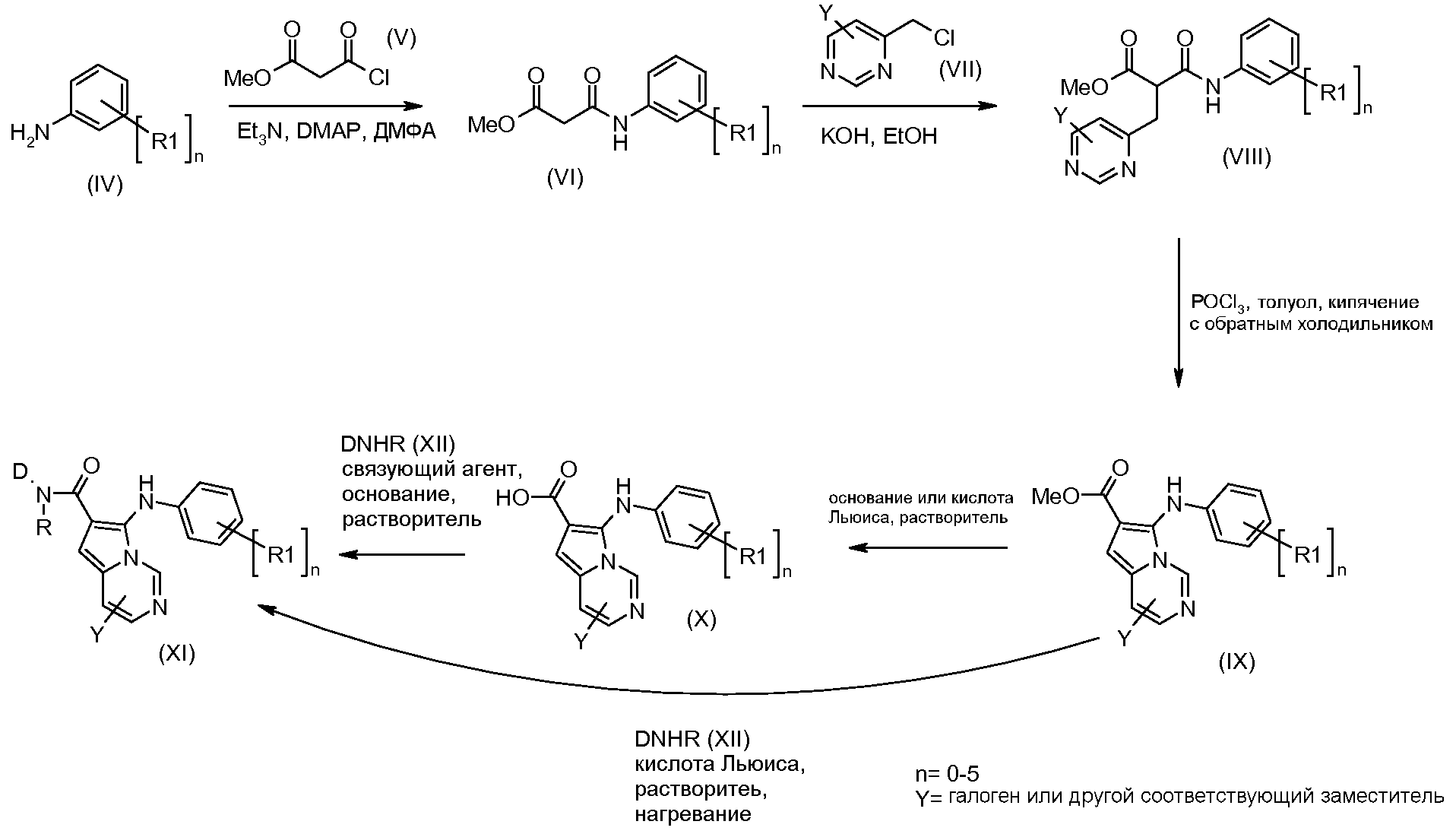
Анилины формулы (IV) (включая соответствующие заместители R1) можно получать коммерческим образом или получать в соответствии со способами, описанными в литературе. Соединения формулы (VI) можно получать из анилинов формулы (IV) путем введения во взаимодействие с хлорангидридами кислот формулы (V), в присутствии основания, такого как триэтиламин, и катализатора, такого как DMAP, в растворителе, таком как ДМФА. Соединения формулы (VI) можно превращать в соединения формулы (VIII) путем введения во взаимодействие с алкилгалогенидами формулы (VII), в присутствии основания, такого как гидроксид калия, в растворителе, таком как этанол. Соединения формулы (IX) можно получать из соединений формулы (VIII) путем обработки оксихлоридом фосфора, в растворителе, таком как толуол, при температуре от 50°С до температуры кипения с обратным холодильником.
Соединения формулы (Х) можно получать из соединений формулы (IX) путем введения во взаимодействие с основанием, таким как гидроксид натрия, в растворителе, таком как метанол, этанол или диоксан, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Альтернативно, соединения формулы (Х) можно получать из соединений формулы (IX) путем обработки кислотой Льюиса, такой как трибромид бора, в растворителе, таком как дихлорметан, при температуре от -78°С до температуры кипения с обратным холодильником.
Соединения формулы (Х) могут быть введены во взаимодействие с функционализированным гидроксиламином формулы (XII) (коммерчески доступный или получаемый в соответствии со схемой 3) или с амином, и подходящим связующим агентом, таким как О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний-гексафторфосфат, N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид или N,N'-дициклогексилкарбодиимид, в присутствии N-гидрокси-1,2,3-бензотриазола, в присутствии подходящего основания, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как тетрагидрофуран, N,N-диметилформамид или дихлорметан, примерно при комнатной температуре, с получением соединений формулы (XI). Альтернативно, соединения формулы (XI) можно непосредственно получать из соединений формулы (IX) путем введения их во взаимодействие с амином или гидроксиламином DNHR, в присутствии кислоты Льюиса, такой как триметилалюминий, в растворителе, таком как DCM, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Альтернативно, соединения формулы (IX) можно получать в соответствии со схемой 2.
Схема 2
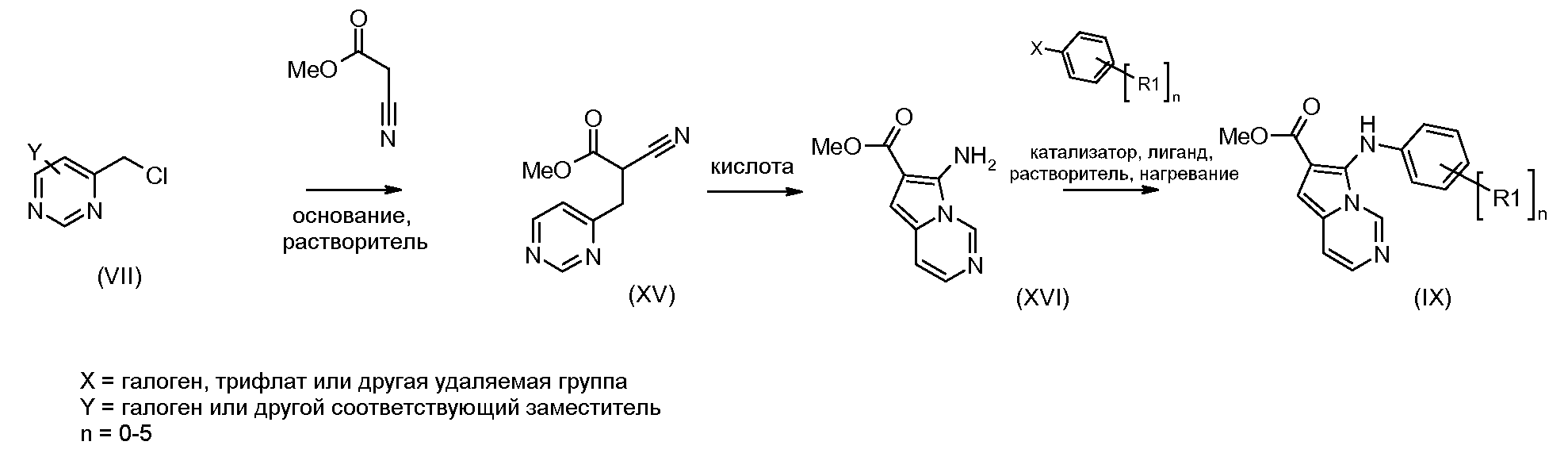
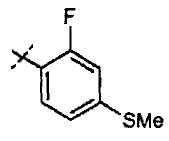
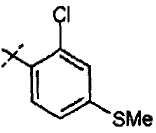
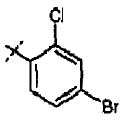
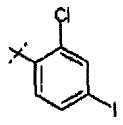
Хлорметилпиримидины формулы (VII) могут быть введены во взаимодействие с эфиром цианоуксусной кислоты, таким как метиловый эфир цианоуксусной кислоты, в присутствии основания, такого как гидрид натрия, в растворителе, таком как ТГФ, при температуре от 0°С до температуры кипения с обратным холодильником, с получением соединений формулы (XV). Соединения формулы (XVI) можно получать из соединений формулы (XV) путем обработки кислотой, такой как трифторуксусная кислота, неразбавленной или в растворителе, таком как диоксан, при температуре от 50°С до температуры кипения с обратным холодильником, или при использовании микроволнового излучения, при температуре от 90°С до 180°С. Соединения формулы (IX) можно получать из соединений формулы (XVI) путем введения их во взаимодействие с арилгалогенидом или арилтрифлатом (включая соответствующие заместители R1), в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия, основания, такого как фосфат калия, трет-бутоксид натрия, 1,8-диазабицикло[5.4.1]ундец-7-ен или карбонат цезия, лиганда, такого как 9,9'-диметил-4,5-бис(дифенилфосфино)ксантен, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 2-дициклогексилфосфино-2',6'-(диметокси)бифенил или трибутилфосфин, в подходящем растворителе, таком как толуол, 1,2-диметоксиэтан, тетрагидрофуран или диоксан, при температуре от комнатной температуры до температуры кипения растворителя, или при микроволновом излучении, при температуре от 70°С до 150°С. Соединения формулы (IX) можно превращать в соединения формулы (XI), используя методики, представленные на схеме 1.
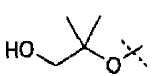
Гидроксиламины формулы (XII) можно получать, используя методики, описанные в литературе, или путь синтеза, представленный на схеме 3.
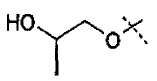
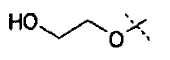
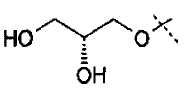
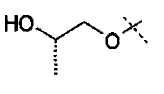
Схема 3
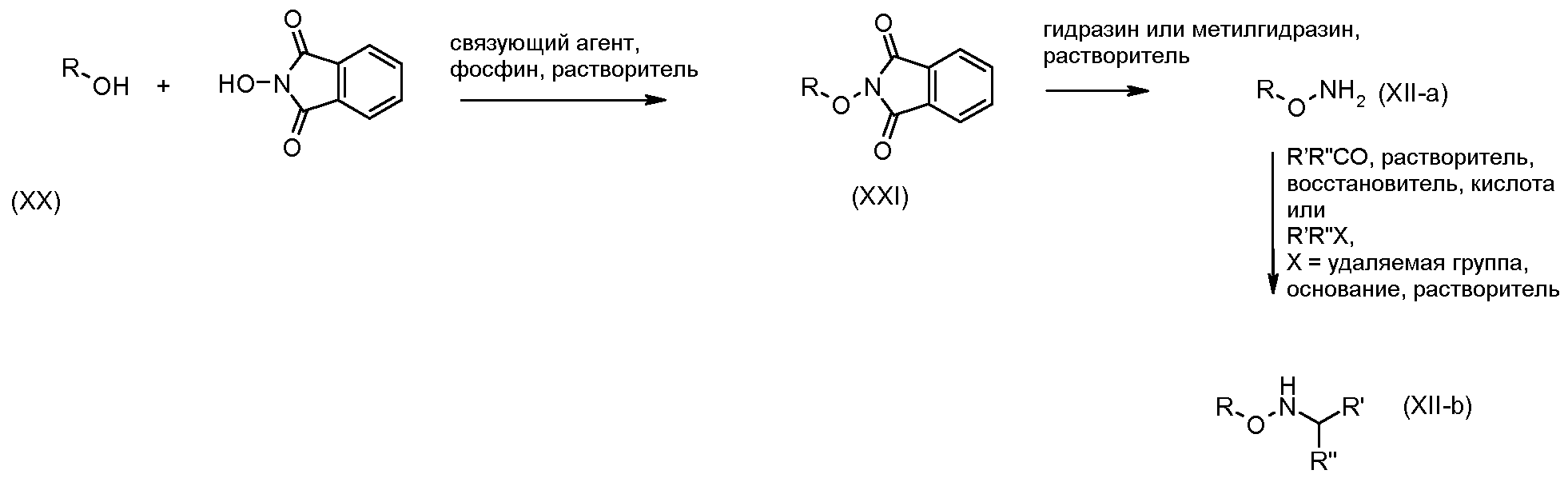
Первичные или вторичные спирты общей формулы (ХХ) можно получать, используя способы, описанные в литературе. Они могут быть введены во взаимодействие с N-гидроксифталимидом, при использовании фосфина и связующего реагента, такого как диэтилазодикарбоксилат, с получением соединений общей формулы (XXI). С соединений общей формулы (XXI) можно снимать защиту, используя гидразин или метилгидразин, с получением гидроксиламинов общей формулы (XII-a). Соединения формулы (XII-a) дополнительно можно модифицировать путем восстановительного аминирования с помощью альдегидов или кетонов, используя восстановитель, такой как триацетоксиборгидрид натрия, цианоборгидрид натрия или боран-пиридин, в растворителе, таком как дихлорэтан, при температуре от температуры окружающей среды до температуры кипения с обратным холодильником. В дополнение, соединения формулы (XII-a) дополнительно можно модифицировать путем алкилирования с помощью алкилгалогенида, в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, получая гидроксиламины общей формулы (XII-b).
Следует принимать во внимание, что, когда имеются соответствующие функциональные группы, соединения формулы (I) или любые промежуточные продукты, используемые для их получения, дополнительно можно дериватизировать с помощью одного или более стандартных способов синтеза, используя замещение, окисление, восстановление или реакции расщепления. Способы конкретного замещения включают стандартное алкилирование, арилирование, гетероарилирование, ацилирование, сульфонилирование, галогенирование, нитрование, формилирование и связывание.
Например, группы арилбромида или арилхлорида можно превращать в арилиодиды, используя реакцию Финкельштейна, используя источник иодида, такой как иодид натрия, катализатор, такой как иодид меди, и лиганд, такой как транс-N,N'-диметил-1,2-циклогександиамин, в растворителе, таком как 1,4-диоксан, и нагревание реакционной смеси до температуры кипения с обратным холодильником. Арилтриалкилсиланы можно превращать в арилиодиды путем обработки силана с помощью источника иодида, такого как монохлорид иода, в растворителе, таком как дихлорметан, с использованием или без использования кислоты Льюиса, такой как тетрафторборат серебра, при температуре от -40°С до температуры кипения с обратным холодильником.
В дополнительном примере, первичные аминогруппы (-NH2) можно алкилировать по способу восстановительного алкилирования, с использованием альдегида или кетона и боргидрида, например триацетоксиборгидрида натрия или цианоборгидрида натрия, в растворителе, таком как галогенированный углеводород, например 1,2-дихлорэтан, или спирт, такой как этанол, когда необходимо, в присутствии кислоты, такой как уксусная кислота, приблизительно, при температуре окружающей среды. Вторичные аминогруппы (-NH-) можно подобным образом алкилировать, используя альдегид.
В дополнительном примере, первичные или вторичные аминогруппы можно превращать в амидные группы (-NHCOR' или -NRCOR') путем ацилирования. Ацилирования можно достигать путем введения во взаимодействие с соответствующим хлорангидридом кислоты, в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, или путем введения во взаимодействие с соответствующей карбоновой кислотой, в присутствии подходящего связующего агента, такого как HATU (О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат), в подходящем растворителе, таком как дихлорметан. Подобным образом, аминогруппы можно превращать в сульфонамидные группы (-NHSO2R' или -NR"SO2R') путем введения во взаимодействие с соответствующим сульфонилхлоридом, в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан. Первичные или вторичные аминогруппы можно превращать в карбамидные группы (-NHCONR'R" или -NRCONR'R") путем введения во взаимодействие с соответствующим изоцианатом, в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан.
Амин (-NH2) можно получать восстановлением нитрогруппы (-NO2), например, путем каталитического гидрирования, используя, например, водород в присутствии катализатора на основе металла, как, например, палладий на носителе, таком как уголь, в растворителе, таком как этилацетат или спирт, например, метанол. Альтернативно, превращение можно осуществлять путем химического восстановления, используя, например, металл, например олово или железо, в присутствии кислоты, такой как соляная кислота.
В дополнительном примере, аминогруппы (-CH2NH2) можно получать путем восстановления нитрилов (-CN), например путем каталитического гидрирования, используя, например, водород в присутствии катализатора на основе металла, как, например, палладий на носителе, таком как уголь, или никеля Ренея, в растворителе, таком как простой эфир, например, циклический простой эфир, такой как тетрагидрофуран, при температуре от -78°С до температуры кипения растворителя.
В дополнительном примере, аминогруппы (-NH2) можно получать из групп карбоновой кислоты (-СО2Н) путем превращения в соответствующий ацилазид (-CON3), перегруппировки Курциуса и гидролиза полученного изоцианата (-N=C=O).
Альдегидные группы (-СНО) можно превращать в аминогруппы (-CH2NR'R") путем восстановительного аминирования, используя амин и боргидрид, например, триацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например дихлорметан, или спирт, такой как этанол, когда необходимо, в присутствии кислоты, такой как уксусная кислота, приблизительно, при температуре окружающей среды.
В дополнительном примере, альдегидные группы можно превращать в алкенильные группы (-СН=CHR') по реакции Виттига или Вадсворт-Эммонса, с использованием соответствующего фосфорана или фосфоната, при стандартных условиях, известных квалифицированному специалисту в данной области.
Альдегидные группы можно получать путем восстановления сложноэфирных групп (таких как -CO2Et) или нитрильных групп (-CN), используя диизобутилалюминийгидрид, в подходящем растворителе, таком как толуол. Альтернативно, альдегидные группы можно получать путем окисления спиртовых групп, используя любой подходящий окислитель, известный квалифицированному специалисту в данной области.
Сложноэфирные группы (-CO2R') можно превращать в соответствующую кислотную группу (-СО2Н) путем гидролиза, катализируемого кислотой или основанием, в зависимости от природы R. Если R означает трет-бутил, можно достичь гидролиза, катализируемого кислотой, например, путем обработки с помощью органической кислоты, такой как трифторуксусная кислота, в водном растворителе, или путем обработки с помощью неорганической кислоты, такой как соляная кислота, в водном растворителе.
Карбоксильные группы (-СО2Н) можно превращать в амиды (CONHR' или -CONR'R") путем введения во взаимодействие с соответствующим амином, в присутствии подходящего связующего агента, такого как HATU, в подходящем растворителе, таком как дихлорметан.
В дальнейшем примере, карбоновые кислоты можно гомологировать на один атом углерода (т.е., от -СО2Н к -СН2СО2Н) путем превращения в соответствующий хлорангидрид кислоты (-COCl), с последующим синтезом Арндта - Эйстерта.
В дальнейшем примере, группы -ОН можно получать из соответствующих сложных эфиров (например, -CO2R') или альдегидов (-СНО) путем восстановления, используя, например, комплекс гидрида металла, такой как литийалюминийгидрид, в диэтиловом эфире или тетрагидрофуране, или боргидрид натрия, в растворителе, таком как метанол. Альтернативно, спирт можно получать путем восстановления соответствующей кислоты (-СО2Н), используя, например, литийалюминийгидрид, в растворителе, таком как тетрагидрофуран, или путем использования борана, в растворителе, таком как тетрагидрофуран.
Спиртовые группы можно превращать в удаляемые группы, такие как атомы галогена или сульфонилоксигруппы, такие как алкилсульфонилокси, например трифторметилсульфонилокси, или арилсульфонилокси, например, п-толуолсульфонилоксигруппа, используя условия, известные квалифицированному специалисту в данной области. Например, спирт можно вводить во взаимодействие с тионилхлоридом в галогенированном углеводороде (например, дихлорметан) с получением соответствующего хлорида. Основание (например, триэтиламин) также можно использовать для взаимодействия.
В другом примере, спиртовые, фенольные или амидные группы могут быть алкилированы путем связывания фенола или амида со спиртом, в растворителе, таком как тетрагидрофуран, в присутствии фосфина, как, например, трифенилфосфин, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Альтернативно, алкилирования можно достичь путем депротонирования, используя подходящее основание, например, гидрид натрия, затем путем последующего добавления алкилирующего агента, такого как алкилгалогенид.
Галогенароматические заместители в соединениях можно подвергать обмену галоген-металл путем обработки основанием, как, например, литиевое основание, такое как н-бутиллитий или трет-бутиллитий, необязательно при низкой температуре, например, приблизительно -78°С, в растворителе, таком как тетрагидрофуран, и затем "гасить" с помощью электрофила для введения желательного заместителя. Таким образом, например, формильную группу можно вводить путем использования N,N-диметилформамида в качестве электрофила. Галогенароматические заместители можно, альтернативно, подвергать реакциям, катализируемым металлом (например, палладий или медь), для введения, например, кислотных, сложноэфирных, циано-, амидных, арильных, гетероарильных, алкенильных, алкинильных, тио- или аминозаместителей. Подходящие методики, которые можно использовать, включают описанные Heck, Suzuki, Stille, Buchwald или Hartwig. Галогенароматические заместители также можно подвергать нуклеофильному замещению с последующим введением во взаимодействие с соответствующим нуклеофилом, таким как амин или спирт. Преимущественно, такое взаимодействие можно осуществлять при повышенной температуре, в присутствии микроволнового излучения.
Соединения согласно настоящему изобретению тестировали в отношении их способности к ингибированию активности МЕК и активации (основной анализ) и в отношении их биологических воздействий на растущие клетки (второстепенный анализ), как описано ниже. Соединения согласно настоящему изобретению, имеющие IC50 менее чем 5 мкМ (более предпочтительно, менее чем 0,1 мкМ, наиболее предпочтительно, менее чем 0,01 мкМ) согласно анализу активности МЕК в соответствии с примером 1, IC50 менее чем 5 мкМ (более предпочтительно, менее чем 1 мкМ, еще более предпочтительно, менее чем 0,1 мкМ, наиболее предпочтительно, менее чем 0,01 мкМ) согласно анализу активации МЕК в соответствии с примером 2, EC50 менее чем 10 мкМ (более предпочтительно, менее чем 1 мкМ, еще более предпочтительно, менее чем 0,5 мкМ, наиболее предпочтительно, менее чем 0,1 мкМ) согласно анализу клеточной пролиферации в соответствии с примером 3, и/или EC50 менее чем 10 мкМ (более предпочтительно, менее чем 1 мкМ, еще более предпочтительно, менее чем 0,5 мкМ, наиболее предпочтительно, менее чем 0,1 мкМ) согласно анализу фосфорилирования ERK в соответствии с примером 4, пригодны в качестве ингибиторов МЕК.
Настоящее изобретение относится к композиции (например, фармацевтическая композиция), содержащей соединение формулы I-a или I-b (и/или его сольваты, и/или его соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также относится к композиции (например, фармацевтическая композиция), содержащей соединение формулы I-a или I-b (и/или его сольваты, и/или его соли) и носитель (фармацевтически приемлемый носитель), дополнительно включающей второе химиотерапевтическое средство и/или второе противовоспалительное средство, такие, как средства, описанные в данном описании. Композиции согласно настоящему изобретению пригодны для ингибирования аномального роста клеток или для лечения гиперпролиферативного нарушения у млекопитающего (например, человека). Композиции согласно настоящему изобретению также пригодны для лечения воспалительных заболеваний у млекопитающего (например, человека).
Соединения согласно настоящему изобретению (такие как любое одно из указанных в заголовках соединений примеров 5-10) и композиции также пригодны для лечения аутоиммунного заболевания, деструктивного костного нарушения, пролиферативных нарушений, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, человека). Примеры таких заболеваний/нарушений включают, но не ограничиваясь этим, диабеты и диабетические осложнения, диабетическую ретинопатию, ретролентальную фиброплазию, связанную с возрастом дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, почечное заболевание и почечную недостаточность, поликистоз почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантата органа, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантата органа, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита (В) (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV). Хроническая боль, для целей настоящего изобретения, включает, но не ограничиваясь этим, идиопатическую боль и боль, связанную с хроническим алкоголизмом, авитаминозом, уремией, гипотиреоидизмом, воспалением, артритом, и послеоперационную боль. Невропатическая боль связана с многочисленными состояниями, которые включают, но не ограничиваясь этим, воспаление, послеоперационную боль, боль "фантома конечности", боль от ожога, подагру, тригеминальную невралгию, острую герпетическую и постгерпетическую боль, каузалгию, диабетическую невропатию, авульсию нервных сплетений, неврому, васкулит, вирусную инфекцию, размозжение, констрикционное повреждение, повреждение ткани, ампутацию конечности, боль при артрите и повреждение нервов между периферической нервной системой и центральной нервной системой.
Соединения согласно настоящему изобретению (такие как любое одно из указанных в заголовках соединений примеров 5-10) и композиции также пригодны для лечения панкреатита или заболевания почек (включая пролиферативный гломерулонефрит и вызванное диабетом заболевание почек) у млекопитающего (например, человека).
Соединения согласно настоящему изобретению (такие как любое одно из указанных в заголовках соединений примеров 5-10) и композиции также пригодны для предотвращения имплантации бластоцитов у млекопитающего (например, человека).
Настоящее изобретение относится к способу ингибирования аномального роста клеток или способ лечения гиперпролиферативного нарушения у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов, и/или его солей) или содержащей его композиции. Также относящимся к настоящему изобретению является способ лечения воспалительного заболевания у млекопитающего (например, человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов и/или его солей) или содержащей его композиции.
Настоящее изобретение относится к способу ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов, и/или его солей) или содержащей его композиции, в комбинации со вторым химиотерапевтическим средством, таким как средства, описанные в данном описании. Настоящее изобретение также относится к способу лечения воспалительного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов, и/или его солей) или содержащей его композиции, в комбинации со вторым противовоспалительным средством, таким как средства, описанные в данном описании.
Настоящее изобретение относится к способу лечения аутоиммунного заболевания, деструктивного костного нарушения, пролиферативных нарушений, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов и/или его солей) или содержащей его композиции и дополнительно необязательно включающему введение второго терапевтического средства. Примеры таких заболеваний/нарушений включают, но не ограничиваясь этим, диабеты и диабетические осложнения, диабетическую ретинопатию, ретролентальную фиброплазию, связанную с возрастом дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, почечное заболевание и почечную недостаточность, поликистоз почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантата органа, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантата органа, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита (В) (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV).
Настоящее изобретение относится к способу лечения панкреатита или заболевания почек (включая пролиферативный гломерулонефрит и вызванное диабетом заболевание почек) у млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов, и/или его солей) или содержащей его композиции и дополнительно необязательно включающему введение второго терапевтического средства.
Настоящее изобретение относится к способу предотвращения имплантации бластоцитов в случае млекопитающего (например, человека), включающему введение указанному млекопитающему терапевтически эффективного количества соединения формулы I-a или I-b (и/или его сольватов, и/или его солей) или содержащей его композиции и дополнительно необязательно включающему введение второго терапевтического средства.
Настоящее изобретение относится к способу применения соединений согласно настоящему изобретению для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающего, организмов или ассоциированных патологических состояний.
Также полагают, что соединения согласно настоящему изобретению могут делать аномальные клетки более чувствительными к лечению облучением, для целей уничтожения таких клеток и/или ингибирования роста таких клеток. Соответственно, данное изобретение дополнительно относится к способу сенсибилизации аномальных клеток у млекопитающего (например, человека) в отношении лечения облучением, который включает введение указанному млекопитающему некоторого количества соединения формулы I-a или I-b (и/или его сольватов, и его солей) или содержащей его композиции, причем это количество является эффективным в отношении сенсибилизации аномальных клеток для лечения облучением.
Введение соединений согласно настоящему изобретению (в дальнейшем, "активное(ые) соединение(я)") может быть эффективным при любом способе, при котором возможна доставка соединений в место действия. Эти способы включают пероральные пути, интрадуоденальные пути, парентеральную инъекцию (включая внутривенное, подкожное, внутримышечное, внутрисосудистое введение или инфузию), местное введение, ингаляцию и ректальное введение.
Вводимое количество активного соединения зависит от субъекта, которого подвергают лечению, серьезности нарушения или состояния, скорости введения, характера соединения и усмотрения лечащего врача. Однако, эффективная доза находится в диапазоне от примерно 0,001 до примерно 100 мг на кг массы тела в сутки, предпочтительно, от примерно 1 до примерно 35 мг/кг/сутки, в одной или разделенных дозах. Для человека массой 70 кг, это количество составляет от примерно 0,05 до 7 г/сутки, предпочтительно, от примерно 0,05 до примерно 2,5 г/сутки. В некоторых случаях, уровни дозировки, находящиеся ниже низшего предела вышеуказанного диапазона, могут быть более чем достаточные, в то время как в других случаях могут быть использованы еще гораздо большие дозы, не вызывая какого-либо вредного побочного эффекта, при условии, что такие гораздо большие дозы сначала разделены на несколько малых доз для введения на протяжении суток.
Активное соединение можно применять в качестве монотерапии или в комбинации с одним или более химиотерапевтическими или противовоспалительными средствами, например, такими, как описанные в данном описании. Такое комбинированное лечение может быть осуществлено путем синхронной, последовательной или раздельной дозировки индивидуальных компонентов лечения.
Фармацевтическая композиция, например, может быть в форме, пригодной для перорального введения, в виде таблетки, капсулы, пилюли, порошка, готовых лекарственных составов с замедленным высвобождением, раствора, суспензии, для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии, для местного введения в виде мази или крема, или для ректального введения в виде суппозитория. Фармацевтическая композиция может быть в виде стандартных лекарственных форм, пригодных для однократного введения точных дозировок. Фармацевтическая композиция включает стандартный фармацевтический носитель или эксципиент и соединение согласно данному изобретению в качестве активного ингредиента. Кроме того, композиция может включать другие терапевтические или фармацевтические агенты, носители, адъюванты и т.д.
Примерные формы для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, как, например, водные растворы пропиленгликоля или декстрозы. Такие лекарственные формы могут быть подходящим образом забуферены, если желательно.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как ароматизаторы, связующие вещества, эксципиенты и т.п. Так, для перорального введения, таблетки, содержащие различные эксципиенты, такие как лимонная кислота, можно применять совместно с различными дезинтегрирующими агентами, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты, и со связующими агентами, такими как сахароза, желатин и гуммиарабик. Дополнительно, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто пригодны для целей таблетирования. Твердые композиции подобного типа также можно применять в мягких и твердых, заполненных лекарственным средством, желатиновых капсулах. Предпочтительные вещества, следовательно, включают лактозу или молочный сахар, и полиэтиленгликоли с высокой молекулярной массой. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в этом случае можно комбинировать с различными подсластителями или ароматизаторами, красителями или красящими веществами, и, если желательно, эмульгаторами или суспендирующими агентами, совместно с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Способы получения различных фармацевтических композиций с конкретным количеством активного соединения известны или очевидны для квалифицированного специалиста в данной области. Например, см., Remington's Pharmaceutical Sciences, Mack Publishing Company, Ester, Pa., 15.sup.th Edition (1975).
ПРИМЕРЫ
Аббревиатуры
|
Общие экспериментальные условия
1Н-ЯМР-спектры регистрируют при температуре окружающей среды, используя спектрометр Varian Unity Inova (400 МГц) с тройным резонансом, зонд 5 мм. Химические сдвиги выражают в м.д. (миллионные доли), относительно тетраметилсилана. Используют следующие аббревиатуры: ушир. = уширенный сигнал, с = синглет, д = дублет, дд = двойной дублет, т = триплет, кв = квартет, м = мультиплет.
Эксперименты при использовании высокоэффективной жидкостной хроматографии - масс-спектрометрии (LCMS) для определения времен удерживания (RT) и ассоциированных масс-ионов осуществляют, используя один из следующих способов.
Способ А: Эксперименты осуществляют при использовании квадрупольного масс-спектрометра Waters Micromass ZQ, соединенным с системой Hewlett Packard HP1100 LC с детектором с диодной матрицей. В случае этой системы используют колонку Higgins Clipeus, С18, 5 микрон, размером 100×3,0 мм, и объемную скорость потока 1 мл/мин. Исходная система растворителя включает 95% воды, содержащей 0,1% муравьиной кислоты, (растворитель А), и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты, (растворитель В), в первую минуту, затем градиент вплоть до 5% растворителя А и 95% растворителя В, в течение следующих 14 минут. Конечная система растворителя удерживается постоянной в течение следующих 5 минут.
Способ В: Эксперименты осущствляют при использовании квадрупольного масс-спектрометра Waters Platform LC, соединенным с системой Hewlett Packard HP1100 LC с детектором с диодной матрицей и 100-позиционным автосэмплером, используя колонку Phenomenex Luna, С18(2), размером 30×4,6 мм, и объемную скорость потока 2 мл/мин. Система растворителя включает 95% воды, содержащей 0,1% муравьиной кислоты, (растворитель А), и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты, (растворитель В), в первые 0,50 минуты, затем градиент вплоть до 5% растворителя А и 95% растворителя В, в течение следующих 4 минут. Конечная система растворителя удерживается постоянной в течение следующих 0,50 минут.
Эксперименты при использовании микроволнового излучения осуществляют, используя Personal Chemistry Emrys Iniatiator™ или Optimizer™, в котором применяют одномодовый резонатор и динамическую настройку поля (тюнинг), причем оба из них имеют функции воспроизводства и контроля. Можно достигать температуры 40-250оС и можно достигать давлений вплоть до 20 бар.
Пример 1
Анализ МЕК (анализ активности МЕК)
Конститутивно активированную человеческую мутантную МЕК1, экспрессированную в клетках насекомых, использовали в качестве источника ферментативной активности в конечной концентрации при анализе киназы 15 нМ.
Анализ осуществляли в течение 30 минут в присутствии 50 мкМ АТФ, используя рекомбинантную GST-ERK1, продуцированную в E.coli, в качестве субстрата. Фосфорилирование субстрата детектировали и количественно определяли, используя HTRF-реагенты, выпускаемые фирмой Cisbio. Они состоят из антитела против GST, конъюгированного с аллофикоцианином (XL665), и антитела против фосфо(Thr202/Tyr204)-ERK (анти-фосфо-антитело), конъюгированного с криптатом европия. Эти антитела использовали в конечной концентрации 4 мкг/мл и 0,84 мкг/мл, соответственно. Анти-фосфо-антитело распознает ERK1, двукратно фосфорилированную по Thr202 и Tyr204. Когда оба антитела связаны с ERK1 (то есть, когда субстрат фосфорилирован), происходит перенос энергии от криптата к аллофикоцианину после возбуждения при 340 нм, приводя к эмиттируемой флуоресценции, которая пропорциональна количеству продуцированного фосфорилированного субстрата. Флуоресценцию детектировали, используя многоканальный флуориметр.
Соединения разводили в ДМСО до добавления к буферу для анализа и конечная концентрация ДМСО при анализе составляет 1%.
IC50 определяли как концентрацию, при которой данное соединение вызывает ингибирование на 50% по отношению к контролю. Значения IC50 рассчитывали, используя XLfit-программное обеспечение (версия 2.0.5).
Указанные в заголовках соединения примеров 5-6 и 8-10 показали IC50 меньше, чем 0,5 мкМ, в случае анализа, описанного в примере 1.
Пример 2
Анализ bRaf (анализ активации МЕК)
Конститутивно активированный bRaf-мутант, экспрессированный в клетках насекомых, использовали в качестве источника ферментативной активности.
Анализ осуществляли в течение 30 минут в присутствии 200 мкМ АТФ, используя рекомбинантную GST-MEK1, продуцированную в E.coli, в качестве субстрата. Фосфорилирование субстрата детектировали и количественно определяли, используя HTRF-реагенты, выпускаемые фирмой Cisbio. Они состоят из антитела против GST, конъюгированного с аллофикоцианином (XL665), и антитела против фосфо(Ser217/Ser221)-MEK (анти-фосфо-антитело), конъюгированного с криптатом европия. Анти-фосфо-антитело распознает МЕК, двукратно фосфорилированную по Ser217 и Ser221 или однократно фосфорилированную по Ser217. Когда оба антитела связаны с МЕК (то есть, когда субстрат фосфорилирован), происходит перенос энергии от криптата к аллофикоцианину после возбуждения при 340 нм, приводя к эмиттируемой флуоресценции, которая пропорциональна количеству продуцированного фосфорилированного субстрата. Флуоресценцию детектировали, используя многоканальный флуориметр.
Соединения разводили в ДМСО до добавления к буферу для анализа, и конечная концентрация ДМСО при анализе составляет 1%.
IC50 определяли как концентрацию, при которой данное соединение вызывает ингибирование на 50% по отношению к контролю. Значения IC50 рассчитывали, используя XLfit-программное обеспечение (версия 2.0.5).
Пример 3
Анализ в отношении клеточной пролиферации
Соединения тестировали путем анализа в отношении клеточной пролиферации, используя следующие клеточные линии:
НСТ116 человеческая колоректальная карцинома (АТСС)
А375 человеческая злокачественная меланома (АТСС)
Обе клеточные линии выдерживали в среде DMEM/F12 (1:1) (Gibco), дополненной 10% фетальной телячьей сыворотки, при температуре 37°С в инкубаторе с влажной атмосферой с 5% СО2.
Клетки высевали на 96-луночные планшеты по 2000 клеток/лунка и спустя 24 часа их подвергали воздействию различных концентраций соединений с 0,83% ДМСО. Клетки культивировали в течение следующих 72 часов, и в каждую лунку добавляли одинаковый объем реагента CellTiter-Glo (Promega). Он лизирует клетки и генерирует люминесцентный сигнал, пропорциональный количеству высвободившегося АТФ (и, следовательно, пропорциональный количеству клеток в лунке), который может быть детектирован, используя многоканальный люминометр.
ЕС50 определяли как концентрацию, при которой данное соединение вызывает ингибирование на 50% по отношению к контролю. Значения IC50 рассчитывали, используя XLfit-программное обеспечение (версия 2.0.5).
В этом анализе, указанные в заголовках соединения примеров 5-6 и 8-9 показали ЕС50 меньше, чем 11,5 мкМ, в случае обеих клеточных линий.
Пример 4
Базирующийся на клетках анализ фосфо-ERK
Соединения тестировали путем базирующегося на клетках твердофазного иммуноферментного анализа (ELISA) фосфо-ERK, используя следующие клеточные линии:
НСТ116 человеческая колоректальная карцинома (АТСС)
А375 человеческая злокачественная меланома (АТСС)
Обе клеточные линии выдерживали в среде DMEM/F12 (1:1) (Gibco), дополненной 10% фетальной телячьей сыворотки, при температуре 37°С в инкубаторе с влажной атмосферой с 5% СО2.
Клетки высевали на 96-луночные планшеты по 2000 клеток/лунка и спустя 24 часа их подвергали воздействию различных концентраций соединений с 0,83% ДМСО. Клетки культивировали в течение следующих 2 часов или 24 часов, фиксировали с помощью формальдегида (конечное количество 2%) и "пропитывали" метанолом. После блокирования с помощью TBST-3% BSA, фиксированные клетки инкубировали с первичным антителом (кроличье против фосфо-ERK) в течение ночи при температуре 4°С. Клетки инкубировали с пропидиум иодидом (флуоресцентный краситель ДНК) и осуществляли детектирование клеточной р-ERK, используя анти-кроличье вторичное антитело, конъюгированное с флуоресцентным красителем Alexa Fluor 488 (Molecular probes). Флуоресценцию анализировали, используя Acumen Explorer (TTP Labtech), лазерный сканирующий цитометр для микропланшетов, и сигнал Alexa Fluor 488 нормировали к PI-сигналу (пропорциональный количеству клеток).
ЕС50 определяли как концентрацию, при которой данное соединение приводит к половинному сигнальному пути между базовой линией и максимальным ответом. Значения ЕС50 рассчитывали, используя XLfit-программное обеспечение (версия 2.0.5).
В этом анализе, указанные в заголовках соединения примеров 5-6 и 8-9 показали ЕС50 меньше, чем 1 мкМ, в случае обеих клеточных линий.
Этиловый эфир N-(2-фтор-4-иодфенил)малонамовой кислоты
К раствору 2-фтор-4-иоданилина (15,1 г, 63,7 ммоль), триэтиламина (8,9 мл, 63,7 ммоль) и DMAP (100 мг, 0,8 ммоль) в ДМФА (45 мл) добавляют этилмалонилхлорид (9,8 мл, 76,4 ммоль). Реакционную смесь нагревают при температуре 60°С в течение 2 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (30 мл), промывают водой (20 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 20-30% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества белого цвета (19,5 г, выход 87%).
LCMS (способ В): RT = 3,43 мин, М+Н+ = 352.
Этиловый эфир N-(2-фтор-4-иодфенил)-2-пиримидин-4-илметилмалонамовой кислоты
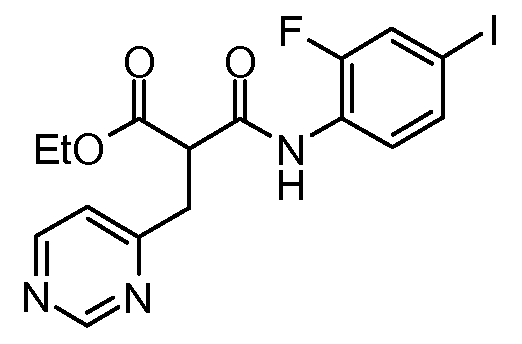
Этиловый эфир N-(2-фтор-4-иодфенил)малонамовой кислоты (20,5 г, 58,4 ммоль), 4-хлорметилпиримидин (5,0 г, 38,9 ммоль) и гидроксид калия (3,28 г, 58,4 ммоль) растворяют в IMS (200 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (30 мл), промывают водой (20 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 10-40% этилацетата в циклогексане), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (6,9 г, выход 39%).
LCMS (способ В): RT = 3,29 мин, М+Н+ = 444.
Этиловый эфир 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
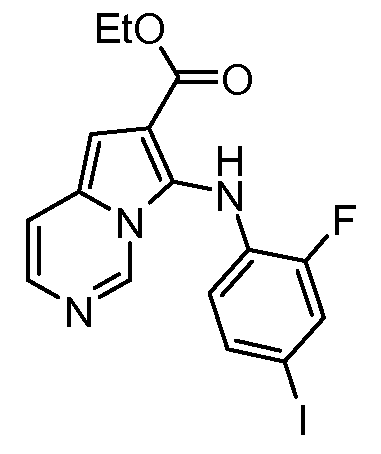
К раствору этилового эфира N-(2-фтор-4-иодфенил)-2-пиримидин-4-илметилмалонамовой кислоты (4 г, 9,02 ммоль) в толуоле (120 мл) добавляют оксихлорид фосфора (V) (4,2 мл, 45,1 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 16 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (30 мл), промывают с помощью насыщенного водного раствора бикарбоната натрия (20 мл), и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-40% этилацетата в циклогексане), получая твердое вещество темно-коричневого цвета. Это твердое вещество растирают в диэтиловом эфире (10 мл), получая указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета (0,63 г, выход 16%).
LCMS (способ В): RT = 3,95 мин, М+Н+ = 426.
7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновая кислота
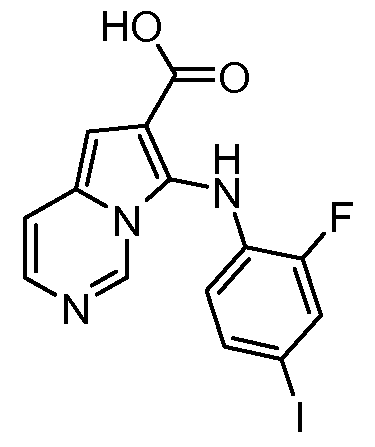
К раствору этилового эфира 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (230 мг, 0,54 ммоль) в смеси диоксана (2 мл) и воды (1 мл) добавляют моногидрат гидроксида лития (45 мг, 1,08 ммоль). Реакционную смесь нагревают при температуре 60°С в течение 1 часа. По каплям добавляют водный раствор соляной кислоты (1 М раствор) до достижения рН ~5, что вызывает образование осадка. Реакционную смесь отфильтровывают и твердый остаток промывают с помощью этилацетата (5 мл), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (67 мг, выход 31%).
LCMS (способ В): RT = 3,22 мин, М+Н+ = 398.
Метиловый эфир N-(2-фтор-4-метилсульфанилфенил)малонамовой кислоты
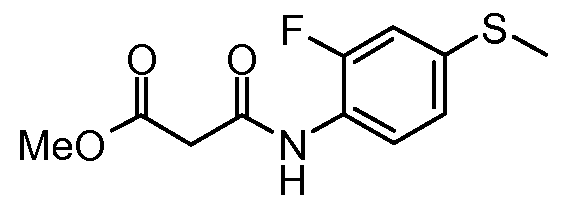
К раствору 2-фтор-4-метилсульфанилфениламина (13 г, 82,7 ммоль), триэтиламина (9,3 мл, 86,8 ммоль) и DMAP (100 мг, 0,8 ммоль) в ДМФА (50 мл) добавляют метилмалонилхлорид (11,5 мл, 82,7 ммоль). Реакционную смесь нагревают при температуре 60°С в течение 2 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (30 мл), промывают водой (20 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 10-30% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества белого цвета (15,4 г, выход 72%).
LCMS (способ В): RT = 2,94 мин, М+Н+ = 258.
Метиловый эфир N-(2-фтор-4-метилсульфанилфенил)-2-пиримидин-4-илметилмалонамовой кислоты
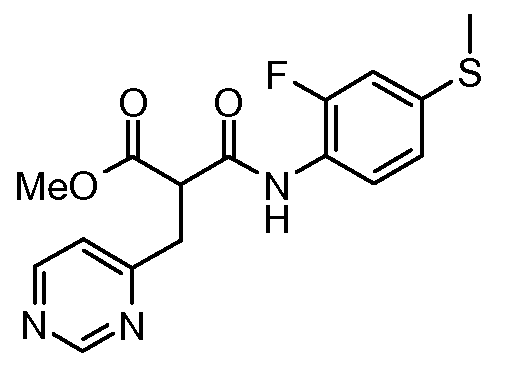
Метиловый эфир N-(2-фтор-4-метилсульфанилфенил)-малонамовой кислоты (15,4 г, 59,9 ммоль), 4-хлорметилпиримидин (5,13 г, 39,9 ммоль) и гидроксид калия (3,36 г, 59,9 ммоль) растворяют в IMS (150 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (30 мл), промывают водой (20 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (4,9 г, выход 23%).
LCMS (способ В): RT = 3,02 мин, М+Н+ = 350.
Метиловый эфир 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
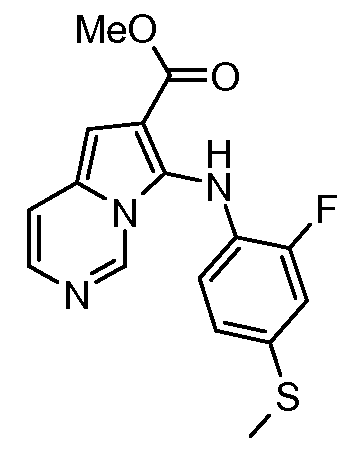
К раствору метилового эфира N-(2-фтор-4-метилсульфанилфенил)-2-пиримидин-4-илметилмалонамовой кислоты (2 г, 5,72 ммоль) и диизопропилэтиламина (2,9 мл, 17,2 ммоль) в диоксане (30 мл) добавляют оксихлорид фосфора (V) (2,7 мл, 28,6 ммоль) и реакционную смесь кипятят с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до температуры 0°С и гасят водой (10 мл). Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (20 мл) и экстрагируют с помощью этилацетата (3 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 10-20% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета (0,80 г, выход 42%).
LCMS (способ В): RT = 3,70 мин, М+Н+ = 332.
7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновая кислота
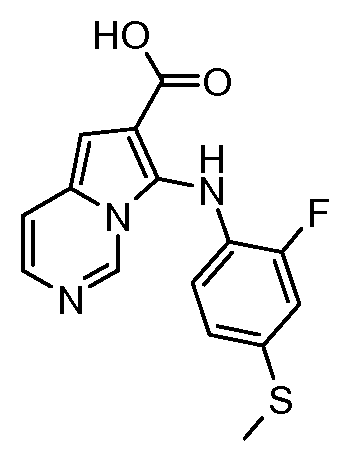
К раствору метилового эфира 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (635 мг, 1,9 ммоль) в диоксане (8 мл) и воде (2,5 мл) добавляют моногидрат гидроксида лития (161 мг, 3,8 ммоль). Реакционную смесь перемешивают при температуре 55°С в течение 2 часов, затем охлаждают до комнатной температуры. По каплям добавляют водный раствор соляной кислоты (1 М раствор) до достижения рН ~3. Реакционную смесь дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества темно-коричневого цвета (600 мг, выход 99%).
LCMS (способ В): RT = 3,20 мин, М+Н+ = 318.
Метиловый эфир 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
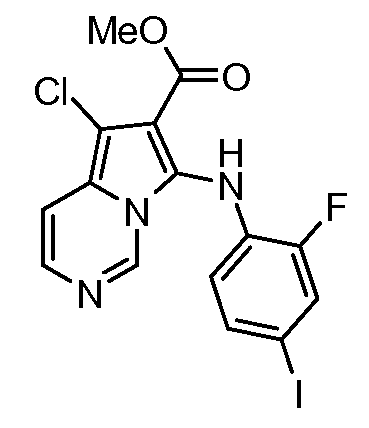
К раствору метилового эфира 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (576 мг, 1,40 ммоль) в DCM (10 мл) добавляют NCS (206 мг, 1,54 ммоль), и реакционную смесь кипятят с обратным холодильником в течение 3 часов. Добавляют еще NCS (37 мг, 0,28 ммоль) и реакционную смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь разбавляют водой, и продукт экстрагируют с помощью DCM (3 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-40% этилацетата в циклогексане), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (300 мг, выход 48%).
LCMS (способ В): RT = 4,11 мин, М+Н+ = 446.
5-Хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновая кислота
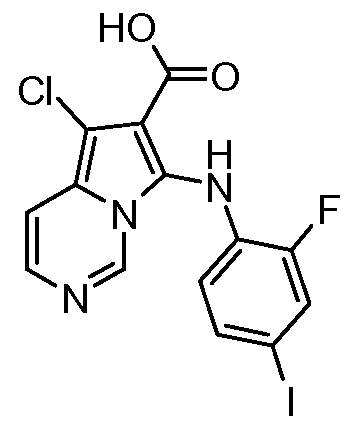
К раствору метилового эфира 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (300 мг, 0,67 ммоль) в DCM (6 мл) добавляют трибромид бора (0,65 мл, 6,7 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до температуры 0°С и осторожно гасят путем добавления воды (5 мл). Реакционную смесь разбавляют водным раствором соляной кислоты (2 мл, 1 М раствор) и экстрагируют с помощью этилацетата (3 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме, получая продукт в виде твердого вещества темно-коричневого цвета (335 мг, выход 115%).
LCMS (способ В): RT = 3,58 мин, М+Н+ = 432.
Пример 5
(2-Гидроксиэтокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
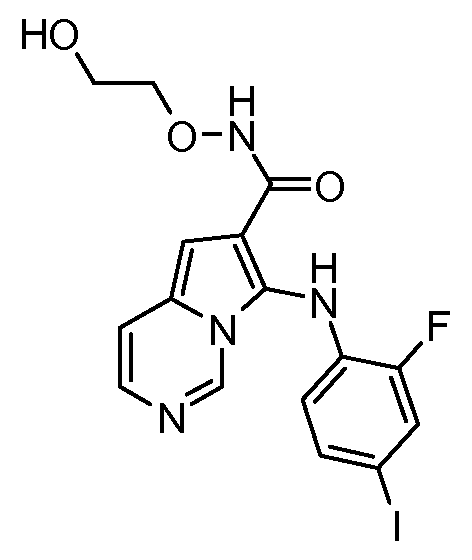
Стадия 1: (2-Винилоксиэтокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
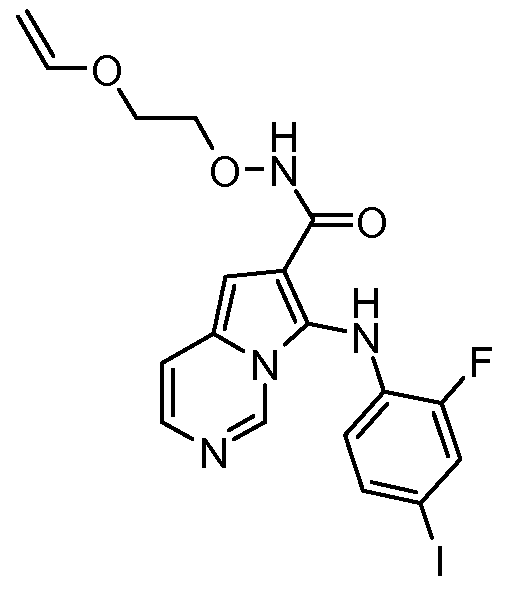
7-(2-Фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (67 мг, 0,18 ммоль), О-(2-винилоксиэтил)гидроксиламин (18 мг, 0,18 ммоль), HOBt (26 мг, 0,19 ммоль), гидрохлорид EDCI (37 мг, 0,19 ммоль) и DIPEA (31 мкл, 0,18 ммоль) суспендируют в ДМФА (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, на протяжении которых реагенты растворяются. Реакционную смесь концентрируют в вакууме, полученный остаток растворяют в этилацетате (10 мл), промывают водным насыщенным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (54 мг, выход 65%).
LCMS (способ В): RT = 3,38 мин, М+Н+ = 483.
Стадия 2: (2-Гидроксиэтокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
К раствору (2-винилоксиэтокси)амида 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (54 мг, 0,11 ммоль) в IMS (3 мл) добавляют водный раствор соляной кислоты (0,5 мл, 1 М раствор, 0,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Продукт растирают в смеси МеОН/диэтиловый эфир, получая указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета (20 мг, выход 39%).
1H-ЯМР (d6-ДМСО, 400 МГц) 11,32 (1H, с), 8,69 (1H, с), 7,98 (1H, с), 7,49 (1H, дд, J=11,0, 2,0 Гц), 7,40 (2H, с), 7,18-7,14 (1H, м), 6,74 (1H, с), 5,92 (1H, т, J=8,8 Гц), 4,65 (1H, т, J=5,6 Гц), 3,75 (2H, т, J=5,0 Гц), 3,46 (2H, кв, J=5,0 Гц).
LCMS (способ А): RT = 8,14 мин, М+Н+ = 457.
Пример 6
((R)-2,3-Дигидроксипропокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
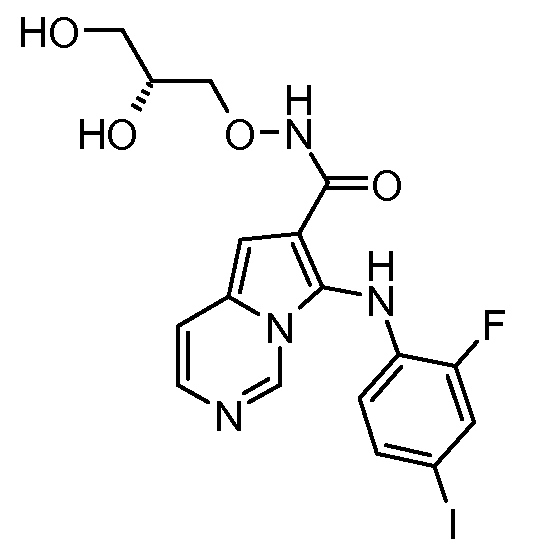
7-(2-Фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (90 мг, 0,23 ммоль), О-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)гидроксиламин (35 мг, 0,23 ммоль), HOBt (35 мг, 0,26 ммоль), гидрохлорид EDCI (50 мг, 0,26 ммоль) и DIPEA (40 мкл, 0,23 ммоль) растворяют в ДМФА (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл), и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток растворяют в растворе хлороводорода в диоксане (2 мл, 4 М раствор) и перемешивают при комнатной температуре в течение 10 минут. Реакционную смесь концентрируют в вакууме, и полученный остаток подвергают обращенно-фазовой ВЭЖХ (градиент: 20-80% ацетонитрил/вода с 0,1% муравьиной кислоты, колонка Phenominex gemini PhC6, 5 микрон, размер 250×20 мм). Продукт растворяют в этилацетате (5 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества желтого цвета (22 мг, выход 20%).
ЯМР (d6-ДМСО, 400 МГц) 11,39 (1H, с), 8,68 (1H, с), 7,99 (1H, с), 7,49 (1H, дд, J=10,9, 1,8 Гц), 7,41 (2H, с), 7,14-7,17 (1H, м), 6,74 (1H, с), 5,92 (1H, т, J=8,9 Гц), 4,80-4.81 (1H, м), 4,53 (1H, с), 3,80 (1H, дд, J=9,6, 3,6 Гц), 3,56-3,66 (2H, м).
LCMS (способ А): RT = 7,57 мин, М+Н+ = 487.
Пример 7
(Пиперидин-4-илокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
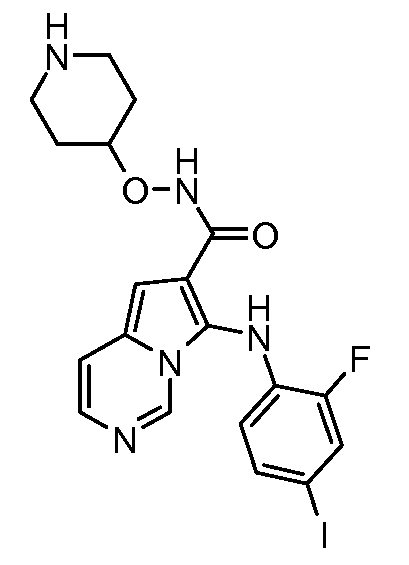
Стадия 1: трет-Бутиловый эфир 4-{[7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбонил]аминоокси}-пиперидин-1-карбоновой кислоты
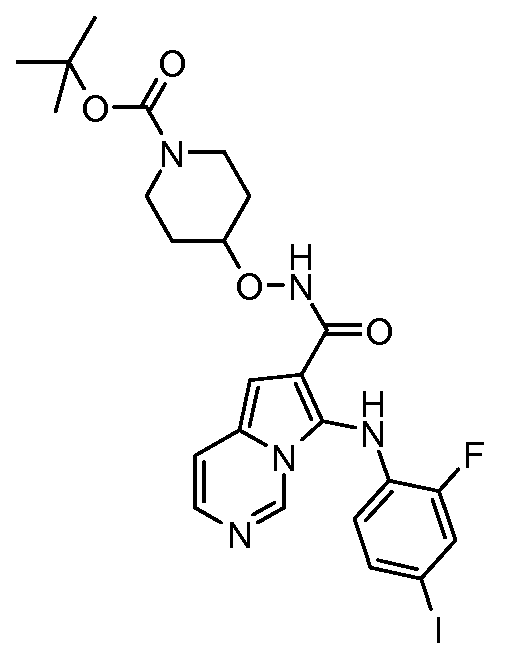
7-(2-Фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (190 мг, 0,48 ммоль), трет-бутиловый эфир 4-аминооксипиперидин-1-карбоновой кислоты (154 мг, 0,72 ммоль), HOBt (106 мг, 0,79 ммоль), гидрохлорид EDCI (150 мг, 0,79 ммоль) и DIPEA (120 мкл, 0,72 ммоль) суспендируют в ДМФА (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, на протяжении которого реагенты растворяются. Реакционную смесь концентрируют в вакууме, полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества коричневого цвета (180 мг, выход 65%).
LCMS (способ В): RT = 3,69 мин, М+Н+ -tBu = 540 (100%), М+Н+ -Boc = 496 (95%).
Стадия 2: (Пиперидин-4-илокси)амид 7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
трет-Бутиловый эфир 4-{[7-(2-фтор-4-иодфениламино)-пирроло[1,2-с]пиримидин-6-карбонил]аминоокси}пиперидин-1-карбоновой кислоты (180 мг, 0,30 ммоль) растворяют в растворе хлороводорода в диоксане (1 мл, 4 М раствор). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, затем концентрируют в вакууме. Полученный остаток подвергают обращенно-фазовой ВЭЖХ (градиент: 10-60% ацетонитрил/вода с 0,1% муравьиной кислоты, колонка Phenominex gemini PhC6, 5 микрон, размер 250×20 мм). Продукт растворяют в этилацетате (5 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества желтого цвета (37 мг, выход 25%).
1H-ЯМР (ДМСО-d6): 8,73 (1H, с), 7,92 (1H, с), 7,49 (1H, дд, J=10,98, 1,92 Гц), 7,41-7,38 (2H, м), 7,16-7,13 (1H, м), 6,72 (1H, д, J=0,92 Гц), 5,93 (1H, т, J=8,84 Гц), 3,72-3,62 (1H, м), 2,87 (2H, дт, J=12,72, 4,49 Гц), 2,41-2,31 (2H, м), 1,67 (2H, дт, J=12,84, 4,01 Гц), 1,32-1,21 (2H, м).
LCMS (способ А): RT = 6,17 мин, М+Н+ = 496.
Пример 8
((R)-2,3-Дигидроксипропокси)амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
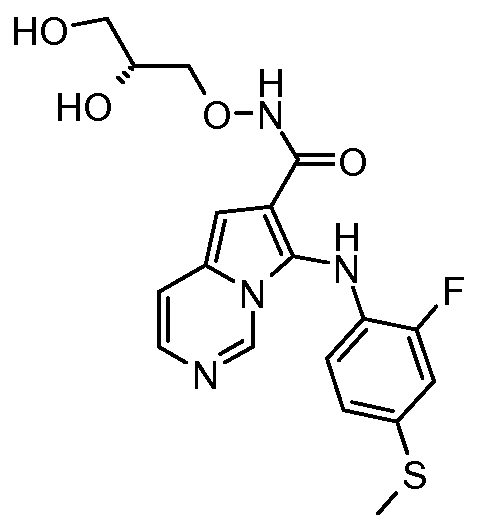
Стадия 1: ((R)-2,2-Диметил-[1,3]диоксолан-4-илметокси)-амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]-пиримидин-6-карбоновой кислоты
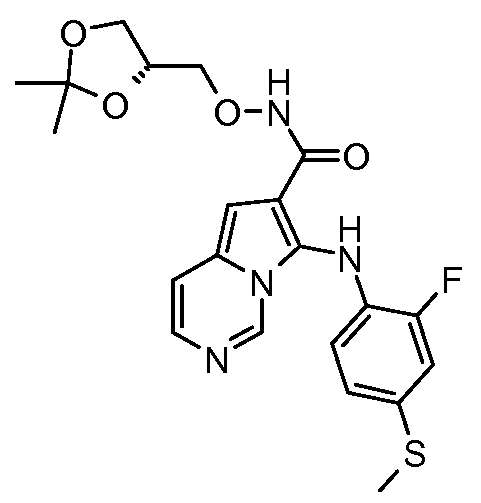
7-(2-Фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (287 мг, 0,90 ммоль), О-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)гидроксиламин (133 мг, 0,90 ммоль), HOBt (135 мг, 0,99 ммоль), гидрохлорид EDCI (191 мг, 0,99 ммоль) и DIPEA (169 мкл, 0,99 ммоль) растворяют в ДМФА (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 30-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества коричневого цвета (246 мг, выход 61%).
LCMS (способ В): RT = 3,28 мин, М+Н+ = 447.
Стадия 2: ((R)-2,3-Дигидроксипропокси)амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
К раствору ((R)-2,2-диметил-[1,3]диоксолан-4-илметокси)-амида 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (246 мг, 0,56 ммоль) в метаноле (1 мл) добавляют раствор хлороводорода в диоксане (1 мл, 4 М раствор, 4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем разбавляют этилацетатом (5 мл), промывают с помощью насыщенного водного раствора бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-10% DCM в метаноле), получая твердое вещество светло-коричневого цвета. Это твердое вещество растирают в ацетонитриле (3 мл), получая указанное в заголовке соединение в виде твердого вещества бежевого цвета (100 мг, выход 45%).
1H-ЯМР (ДМСО-d6): 11,38 (1H, с), 8,64 (1H, т, J=1,0 Гц), 7,86 (1H, с), 7,41-7,39 (2H, м), 7,15 (1H, дд, J=12,09, 2,09 Гц), 6,82-6,79 (1H, м), 6,73 (1H, с), 6,06 (1H, т, J=8,82 Гц), 4,82 (1H, с), 4,53 (1H, с), 3,80 (1H, дд, J=9,68, 3,51 Гц), 3,67-3,57 (2H, м), 3,31-3,24 (2H, м).
(SMe совпадает с растворителем).
LCMS (способ А): RT = 7,14 мин, М+Н+ = 407.
Пример 9
(2-Гидроксиэтокси)амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
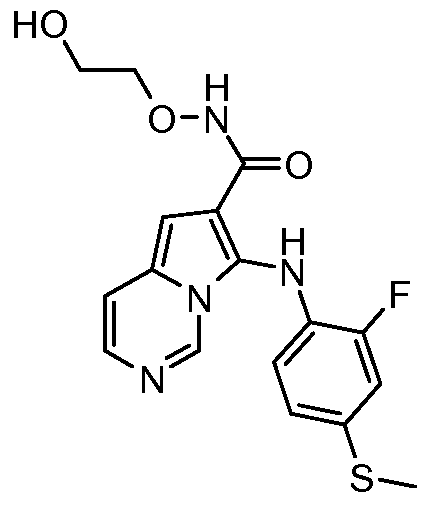
Стадия 1: (2-Винилоксиэтокси)амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
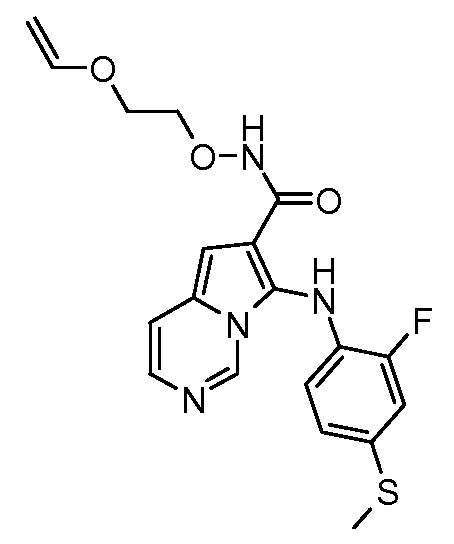
7-(2-Фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (200 мг, 0,63 ммоль), О-(2-винилоксиэтил)гидроксиламин (106 мг, 0,69 ммоль), HOBt (94 мг, 0,69 ммоль), гидрохлорид EDCI (132 мг, 0,69 ммоль) и DIPEA (118 мкл, 0,69 ммоль) растворяют в ДМФА (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества коричневого цвета (139 мг, выход 55%).
LCMS (способ В): RT = 3,35 мин, М+Н+ = 403.
Стадия 2: (2-Гидроксиэтокси)амид 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
К раствору (2-винилоксиэтокси)амида 7-(2-фтор-4-метилсульфанилфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты в IMS добавляют водный раствор соляной кислоты (4 н раствор, 0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (5 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 5 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-10% DCM в метаноле), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (73 мг, выход 56%).
1H-ЯМР (ДМСО-d6): 11,31 (1H, с), 8,65 (1H, с), 7,85 (1H, с), 7,42-7,37 (2H, м), 7,15 (1H, дд, J=12,10, 2,09 Гц), 6,82-6,79 (1H, м), 6,73 (1H, с), 6,06 (1H, т, J=8,82 Гц), 4,66 (1H, с), 3,75 (2H, дд, J=5,34, 4,47 Гц), 3,46 (2H, т, J=4,82 Гц), 2,36 (3H, с).
LCMS (способ А): RT = 7,35 мин, М+Н+ = 377.
Пример 10
((R)-2,3-Дигидроксипропокси)амид 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
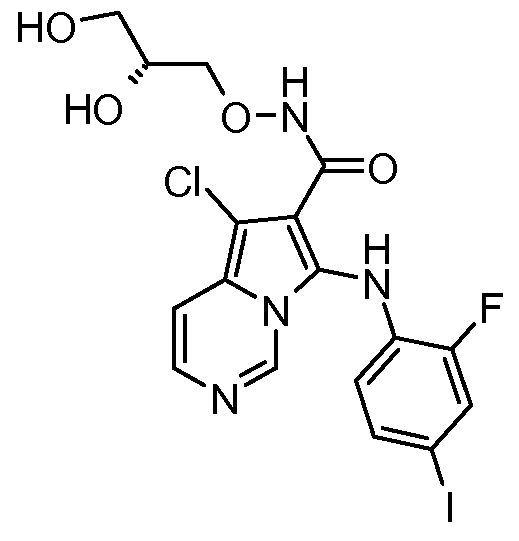
Стадия 1: ((R)-2,2-диметил-[1,3]диоксолан-4-илметокси)амид 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
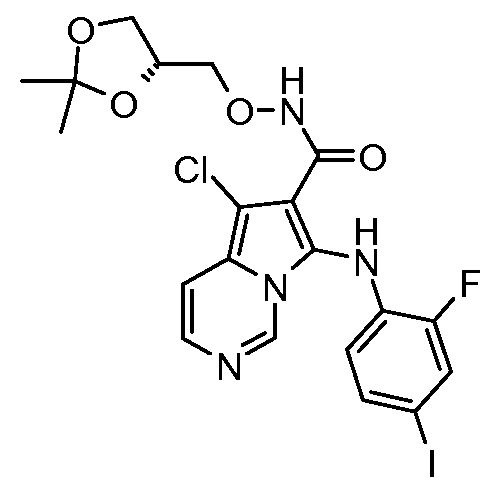
5-Хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновую кислоту (145 мг, 0,34 ммоль), О-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)гидроксиламин (50 мг, 0,34 ммоль), HOBt (50 мг, 0,37 ммоль), гидрохлорид EDCI (71 мг, 0,37 ммоль) и DIPEA (63 мкл, 0,37 ммоль) растворяют в ДМФА (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем концентрируют в вакууме. Полученный остаток растворяют в этилацетате (10 мл), промывают насыщенным водным раствором бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 25-100% этилацетата в циклогексане), получая указанное в заголовке соединение в виде твердого вещества коричневого цвета (57 мг, выход 25%).
LCMS (способ В): RT = 3,63 мин, М+Н+ = 561.
Стадия 2: ((R)-2,3-Дигидроксипропокси)амид 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты
К раствору ((R)-2,2-диметил[1,3]диоксолан-4-илметокси)амида 5-хлор-7-(2-фтор-4-иодфениламино)пирроло[1,2-с]пиримидин-6-карбоновой кислоты (57 мг, 0,1 ммоль) в метаноле (1 мл) добавляют раствор хлороводорода в диоксане (1 мл, 4 М раствор, 4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем разбавляют этилацетатом (5 мл), промывают с помощью насыщенного водного раствора бикарбоната натрия (10 мл) и водную фракцию дважды экстрагируют с помощью этилацетата (2 раза по 10 мл). Объединенные органические фракции промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии (SiO2, градиент 0-10% метанола в DCM), получая твердое вещество светло-коричневого цвета. Это твердое вещество растирают в ацетонитриле (3 мл), получая указанное в заголовке соединение в виде не совсем белого твердого вещества (13 мг, выход 45%).
1H-ЯМР (CH3 OH-d4): 8,74 (1H, д, J=l,57 Гц), 7,49 (1H, д, J=6,61 Гц), 7,42 (1H, дд, J=10,78, 1,91 Гц), 7,38 (1H, дд, J=6,61, 1,58 Гц), 7,21 (1H, ддд, J=8,48, 1,90, 1,11 Гц), 6,14 (1H, т, J=8,76 Гц), 3,89-3,80 (1H, м), 3,79-3,71 (2H, м), 3,56-3,42 (2H, м).
LCMS (способ А): RT = 7,70 мин, М+Н+ = 521.