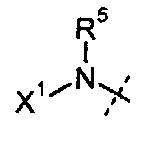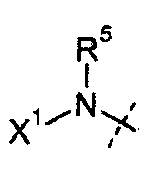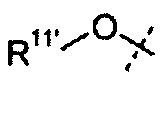Результат интеллектуальной деятельности: 8-АНИЛИНОИМИДАЗОПИРИДИНЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Рассматриваемая заявка испрашивает приоритет относительно предварительной заявки США номер 61/015155, поданной 19 декабря 2007, и предварительной заявки США номер 61/054024, поданной 16 мая 2008, раскрытия которых включены в настоящее описание путем ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к имидазопиридинам, обладающим противораковой активностью, и, более конкретно, к имидазопиридинам, которые ингибируют активность MEK киназы. Настоящее изобретение также относится к способам применения указанных соединений для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающих, или соответствующих патологических состояний.
ПРЕДПОСЫЛКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В поисках понимания того, как Ras передают сигналы внеклеточного роста, выяснилось, что схема функционирования MAP (митоген-активированный белок) киназы (MAPK) выявилась как критический путь между связанными с мембранами Ras и ядрами. Схема функционирования MAPK включает каскад актов фосфорилирования, в которых участвуют три ключевые киназы, а именно Raf, MEK (MAP kinase kinase) и ERK (MAP киназа). Активные GTP-связанные Ras приводят к активации и непрямому фосфорилированию Raf киназы. Затем Raf фосфорилирует MEK1 и MEK2 на двух сериновых остатках (S218 и S222 для MEK1 и S222 и S226 для MEK2) (Ahn et al., Methods in Enzymology 2001, 332, 417-431). Затем активированная MEK фосфорилирует свои единственно известные субстраты, киназы ERK1 и ERK2. ERK фосфорилирование за счет MEK происходит по Y204 и T202 для ERK1 и по Y185 и T183 для ERK2 (Ahn et al., Methods in Enzymology 2001, 332, 417-431). Фосфорилированная ERK димеризуется и затем перемещается в ядра, где накапливается (Khokhlatchev et al., Cell 1998, 93, 605-615). Находящаяся в ядрах ERK участвует в ряде важных клеточных функций, включая, но ими не ограничиваясь, ядерный транспорт, трансдукцию сигналов, репарацию ДНК, сборку и транслокацию нуклеосом, и процессинг и транслокацию мРНК (Ahn et al., Molecular Cell 2000, 6, 1343-1354). Вообще, обработка клеток факторами роста приводит к активации ERK1 и ERK2, результатом чего является пролиферация и, в некоторых случаях, дифференциация (Lewis et al., Adv. Cancer Res. 1998, 74, 49-139).
Существуют серьезные доказательства того, что генетические мутации в протеинкиназах и/или сверхэкспрессия протеинкиназ участвуют в каскаде реакций MAP киназы, приводящих к бесконтрольной клеточной пролиферации и, в конечном счете, к образованию опухоли, к пролиферативным заболеваниям. Например, некоторые раки содержат мутации, которые приводят к непрерывной активации указанного каскада реакций, связанного с постоянным продуцированием факторов роста. Другие мутации могут привести к дефектам в дезактивации активированного GTP-связанного Ras комплекса, что вновь приводит к активации каскада реакций MAP киназы. Мутированные, онкогенные формы Ras обнаруживаются в 50% случаев рака толстой кишки и более чем в 90% случаев рака поджелудочной железы, также как при многих других типах раковых заболеваний (Kohl et al., Science 1993, 260, 1834-1837). В последнее время мутации bRaf были идентифицированы более чем в 60% случаев злокачественных меланом (Davies, H. et al., Nature 2002, 417, 949-954). Указанные мутации в bRaf приводят к конститутивно активному каскаду реакций MAP киназы. Исследования образцов первичных опухолей и клеточных линий также демонстрируют конститутивный или сверхактивный каскад реакций MAP киназы при раковых заболеваниях поджелудочной железы, толстой кишки, легких, яичников и почек (Hoshino, R. et al., Oncogene 1999, 18, 813-822).
MEK возникли как привлекательная терапевтическая мишень в каскаде реакций MAP киназы. MEK, в прямом направлении от Ras и Raf, является высоко специфичной при фосфорилировании MAP киназы; действительно, единственными известными субстратами для фосфорилирования MEK являются MAP киназы, ERK1 и ERK2. В некоторых исследованиях было показано, что ингибирование MEK предоставляет потенциальные терапевтические преимущества. Например, было показано, что мелкие молекулы ингибиторов MEK ингибируют рост человеческих опухолей у голых мышей с ксенотрансплантатами (Sebolt-Leopold et al., Nature-Medicine 1999, 5 (7), 810-816); Trachet et al., AACR Apr. 6-10, 2002, Poster #5426; Tecle, H. IBC 2.sup.nd International Conference of Protein Kinases, Sep. 9-10, 2002), блокируют статическую аллодинию у животных (WO 01/05390 published Jan. 25, 2001) и ингибируют рост клеток при острой миелоидной лейкемии (Milella et al., J Clin Invest 2001, 108 (6), 851-859).
Обсуждались также некоторые мелкие молекулы MEK ингибиторов, например, в WO02/06213, WO 03/077855 и WO03/077914. Поэтому все еще существует необходимость в создании ингибиторов MEK в качестве эффективных и безопасных терапевтических средств для лечения различных пролиферативных болезненных состояний, таких как состояния, связанные с гиперактивностью MEK, также как заболеваний, модулируемых каскадом реакций MEK.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
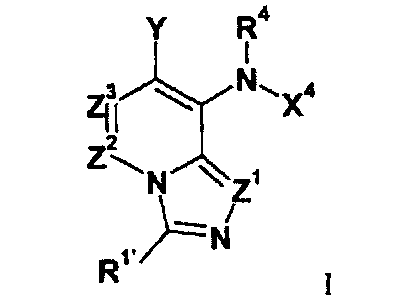
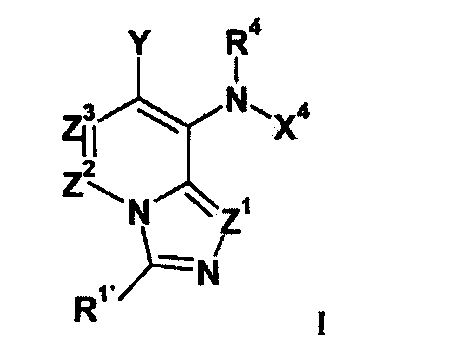
Настоящее изобретение в общем относится к имидазопиридинам формулы I (и/или их сольватам, гидратам и/или солям), обладающим противораковой и/или противовоспалительной активностью, и более конкретно, активностью ингибирования MEK киназы. Некоторые гиперпролиферативные и воспалительные нарушения характеризуются модуляцией функции MEK киназы, например, за счет мутаций или сверхэкспрессии белков. Соответственно, соединения настоящего изобретения и их композиции можно использовать для лечения гиперпролиферативных заболеваний, таких как раковые заболевания или воспалительные заболевания, такие как ревматоидный артрит.
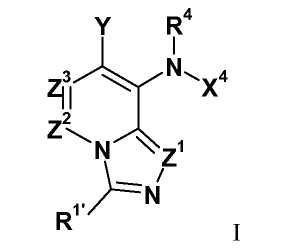
и его соли, где:
Z1 представляет собой CR1 или N;
R1 представляет собой H, C1-C3 алкил, галоген, CF3, CHF2, CN, ORA или NRARA;
R1' представляет собой H, C1-C3 алкил, галоген, CF3, CHF2, CN, ORA, или NRARA;
где каждый RA независимо представляет собой Н или C1-C3 алкил;
Z2 представляет собой CR2 или N;
Z3 представляет собой CR3 или N; при условии, что только один из Z1, Z2 и Z3 может одновременно представлять собой N;
R2 и R3 независимо выбирают из H, галогена, CN, CF3, -OCF3, -NO2, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)nNR11R12, -(CR14R15)nOR11, -(CR14R15)nSR11, -(CR14R15)nNR12C(=Y')R11, -(CR14R15)nNR12C(=Y')OR11, -(CR14R15)nNR13C(=Y')NR11R12, -(CR14R15)nNR12SO2R11, -(CR14R15)nOC(=Y')R11, -(CR14R15)nOC(=Y')OR11, -(CR14R15)nOC(=Y')NR11R12, -(CR14R15)nOS(O)2(OR11), -(CR14R15)nOP(=Y')(OR11)(OR12), -(CR14R15)nOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, -(CR14R15)nS(O)(OR11), -(CR14R15)nS(O)2(OR11), -(CR14R15)nSC(=Y')R11, -(CR14R15)nSC(=Y')OR11, -(CR14R15)nSC(=Y')NR11R12, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, карбоциклила, гетероциклила, арила и гетероарила;
R4 представляет собой H, C1-C6 алкил или C3-C4 карбоциклил;
Y представляет собой W-C(O)- или W';
W представляет собой 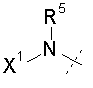 или
или 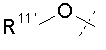 ;
;
R5 представляет собой H или C1-C12 алкил;
X1 выбирают из R11' и -OR11'; если X1 представляет собой R11', X1 необязательно взятый вместе с R5 и атомом азота, к которому они присоединены, образуют 4-7-членное насыщенное или ненасыщенное кольцо, содержащее 0-2 дополнительные гетероатома, выбранные из O, S и N, где указанное кольцо необязательно замещено одной или более из групп, выбранных из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)n-SR16, -(CR19R20)n NR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
каждый R11' независимо представляет собой Н, C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, карбоциклил, гетероциклил, арил или гетероарил;
R11, R12 и R13 независимо представляют собой H, C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, карбоциклил, гетероциклил, арил или гетероарил,
или R11 и R12 вместе с азотом, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, содержащее 0-2 гетероатома, выбранные из O, S и N, где указанное кольцо необязательно земещено одной или более из групп, выбранных из галогена, CN, CF3, -OCF3, -NO2, C1-C6 алкила, -OH, -SH, -O(C1-C6 алкила), -S(C1-C6 алкила), -NH2, -NH(C1-C6 алкила), -N(C1-C6 алкила)2, -SO2(C1-C6 алкила), -CO2H, -CO2(C1-C6 алкила), -C(O)NH2, -C(O)NH(C1-C6 алкила), -C(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)(C1-C6 алкила), -NHC(O)(C1-C6 алкила), -NHSO2(C1-C6 алкила), -N(C1-C6 алкил)SO2(C1-C6 алкила), -SO2NH2, -SO2NH(C1-C6 алкила), -SO2N(C1-C6 алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6 алкила), -OC(O)N(C1-C6 алкила)2, -OC(O)O(C1-C6 алкила), -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)NH(C1-C6 алкила), -N(C1-C6 алкил)C(O)N(C1-C6 алкила)2, -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -NHC(O)O(C1-C6 алкила) и -N(C1-C6 алкил)C(O)O(C1-C6 алкила);
R14 и R15 независимо выбирают из H, C1-C12 алкила, арила, карбоциклила, гетероциклила и гетероарила;
W' представляет собой 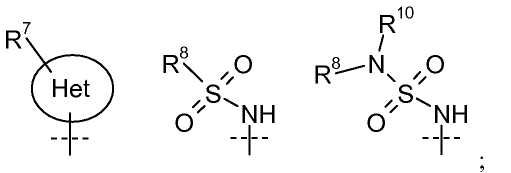
где  представляет собой
представляет собой
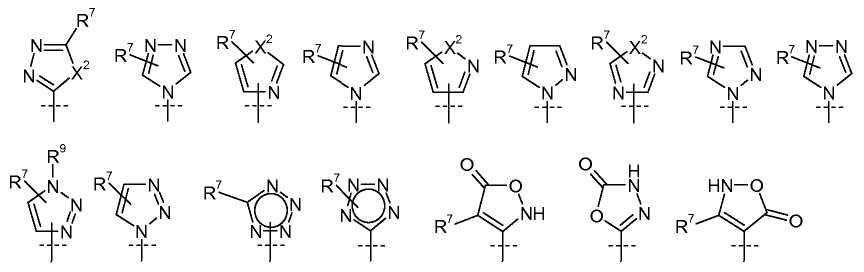
каждый X2 независимо представляет собой O, S, или NR9;
каждый R7 независимо выбирают из H, галогена, CN, CF3, -OCF3, -NO2, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)nNR11R12, -(CR14R15)nOR11, -(CR14R15)nSR11, -(CR14R15)nNR12C(=Y')R11, -(CR14R15)nNR12C(=Y')OR11, -(CR14R15)nNR13C(=Y')NR11R12, -(CR14R15)nNR12SO2R11, -(CR14R15)nOC(=Y')R11, -(CR14R15)nOC(=Y')OR11, -(CR14R15)nOC(=Y')NR11R12, -(CR14R15)nOS(O)2(OR11), -(CR14R15)nOP(=Y')(OR11)(OR12), -(CR14R15)nOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, -(CR14R15)nS(O)(OR11), -(CR14R15)nS(O)2(OR11), -(CR14R15)nSC(=Y')R11, -(CR14R15)nSC(=Y')OR11, -(CR14R15)nSC(=Y')NR11R12, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, карбоциклила, гетероциклила, арила и гетероарила;
каждый R8 независимо выбирают из C1-C12 алкила, арила, карбоциклила, гетероциклила и гетероарила;
R9 выбирают из H, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)qNR11R12, -(CR14R15)qOR11, -(CR14R15)qSR11, -(CR14R15)qNR12C(=Y')R11, -(CR14R15)qNR12C(=Y')OR11, -(CR14R15)qNR13C(=Y')NR11R12, -(CR14R15)qNR12SO2R11, -(CR14R15)qOC(=Y')R11, -(CR14R15)qOC(=Y')OR11, -(CR14R15)qOC(=Y')NR11R12, -(CR14R15)qOS(O)2(OR11), -(CR14R15)qOP(=Y')(OR11)(OR12), -(CR14R15)qOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, карбоциклила, гетероциклила, арила и гетероарила;
R10 представляет собой H, C1-C6 алкил или C3-C4 карбоциклил;
X4 представляет собой 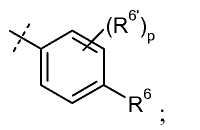
R6 представляет собой H, галоген, C1-C6 алкил, C2-C8 алкенил, C2-C8 алкинил, карбоциклил, гетероарил, гетероциклил, -OCF3, -NO2, -Si(C1-C6 алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16, или -(CR19R20)n-SR16;
R6' представляет собой H, галоген, C1-C6 алкил, карбоциклил, CF3, -OCF3, -NO2, -Si(C1-C6 алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)n-SR16, C2-C8 алкенил, C2-C8 алкинил, гетероциклил, арил, или гетероарил;
p представляет собой 0, 1, 2 или 3;
n представляет собой 0,1, 2 или 3;
q представляет собой 2 или 3;
где каждый указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил в R1, R2, R3, R4, R5, R6, R6', R7, R8, R9, R10, R11, R11', R12, R13, R14, R15 и RA независимо необязательно замещен одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6 алкила), -(CR19R20)nC(=Y')R16, -(CR19R20)n C(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
каждый R16, R17 и R18 независимо представляет собой H, C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, карбоциклил, гетероциклил, арил, или гетероарил, где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил или гетероарил необязательно замещен одной или более группами, выбранными из галогена, CN, -OCF3, CF3, -NO2, C1-C6 алкила, -OH, -SH, -O(C1-C6 алкила), -S(C1-C6 алкила), -NH2, -NH(C1-C6 алкила), -N(C1-C6 алкила)2, -SO2(C1-C6 алкила), -CO2H, -CO2(C1-C6 алкила), -C(O)NH2, -C(O)NH(C1-C6 алкила), -C(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)(C1-C6 алкила), -NHC(O)(C1-C6 алкила), -NHSO2(C1-C6 алкила), -N(C1-C6 алкил)SO2(C1-C6 алкила), -SO2NH2, -SO2NH(C1-C6 алкил), -SO2N(C1-C6 алкил)2, -OC(O)NH2, -OC(O)NH(C1-C6 алкила), -OC(O)N(C1-C6 алкила)2, -OC(O)O(C1-C6 алкила), -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)NH(C1-C6 алкила), -N(C1-C6 алкил)C(O)N(C1-C6 алкила)2, -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -NHC(O)O(C1-C6 алкила) и -N(C1-C6 алкил)C(O)O(C1-C6 алкила);
или R16 и R17 вместе с азотом, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, содержащее 0-2 гетероатома, выбранные из O, S и N, где указанное кольцо необязательно земещено одной или более группами, выбранными из галогена, CN, -OCF3, CF3, -NO2, C1-C6 алкила, -OH, -SH, -O(C1-C6 алкила), -S(C1-C6 алкила), -NH2, -NH(C1-C6 алкила), -N(C1-C6 алкила)2, -SO2(C1-C6 алкила), -CO2H, -CO2(C1-C6 алкила), -C(O)NH2, -C(O)NH(C1-C6 алкила), -C(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)(C1-C6 алкила), -NHC(O)(C1-C6 алкила), -NHSO2(C1-C6 алкила), -N(C1-C6 алкил)SO2(C1-C6 алкила), -SO2NH2, -SO2NH(C1-C6 алкила), -SO2N(C1-C6 алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6 алкила), -OC(O)N(C1-C6 алкила)2, -OC(O)O(C1-C6 алкила), -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)NH(C1-C6 алкила), -N(C1-C6 алкил)C(O)N(C1-C6 алкила)2, -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -NHC(O)O(C1-C6 алкила) и -N(C1-C6 алкил)C(O)O(C1-C6 алкила);
R19 и R20 независимо выбирают из H, C1-C12 алкила, -(CH2)n-арила, -(CH2)n-карбоциклила, -(CH2)n-гетероциклила и -(CH2)n-гетероарила;
R21 представляет собой C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, карбоциклил, гетероциклил, арил, или гетероарил, где каждый член из R21 необязательно замещен одной или более группами, выбранными из галогена, оксо, CN, -OCF3, CF3, -NO2, C1-C6 алкила, -OH, -SH, -O(C1-C6 алкила), -S(C1-C6 алкила), -NH2, -NH(C1-C6 алкила), -N(C1-C6 алкила)2, -SO2(C1-C6 алкила), -CO2H, -CO2(C1-C6 алкила), -C(O)NH2, -C(O)NH(C1-C6 алкила), -C(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)(C1-C6 алкила), -NHC(O)(C1-C6 алкила), -NHSO2(C1-C6 алкила), -N(C1-C6 алкил)SO2(C1-C6 алкила), -SO2NH2, -SO2NH(C1-C6 алкила), -SO2N(C1-C6 алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6 алкила), -OC(O)N(C1-C6 алкила)2, -OC(O)O(C1-C6 алкила), -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -N(C1-C6 алкил)C(O)NH(C1-C6 алкила), -N(C1-C6 алкил)C(O)N(C1-C6 алкила)2, -NHC(O)NH(C1-C6 алкила), -NHC(O)N(C1-C6 алкила)2, -NHC(O)O(C1-C6 алкила) и -N(C1-C6 алкил)C(O)O(C1-C6 алкила);
каждый Y' независимо представляет собой O, NR22, или S; и
R22 представляет собой H или C1-C12 алкил.
Настоящее изобретение включает композицию (например, фармацевтическую композицию), включающую соединение формулы I (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также включает композицию (например, фармацевтическую композицию) включающую соединение формулы I (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель), включающую дополнительно второй химиотерапевтический и/или второй противовоспалительный агент. Композиции настоящего изобретения можно использовать для ингибирования аномального клеточного роста или лечения гиперпролиферативного нарушения у млекопитающего (например, у человека). Композиции настоящего изобретения также можно использовать для лечения воспалительных заболеваний у млекопитающего (например, человека).
Настоящее изобретение включает способ ингибирования аномального клеточного роста или лечения гиперпролиферативного нарушения у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, отдельно или в сочетании со вторым химиотерапевтическим агентом.
Настоящее изобретение включает способ лечения воспалительного заболевания у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, отдельно или в сочетании со вторым противовоспалительным агентом.
Настоящее изобретение включает способ применения соединений настоящего изобретения для in vitro, in situ и in vivo диагностики или лечения клеток, организмов млекопитающих или связанных с этим патологических состояний.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ
Далее приводятся подробности некоторых предпочтительных вариантов настоящего изобретения, примеры которых проиллюстрированы с использованием сопровождающих структур и формул. Хотя настоящее изобретение будет раскрыто в связи с перечисленными вариантами, следует понимать, что они ни коим образом не ограничивают настоящее изобретение указанными вариантами. Напротив, настоящее изобретение включает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, который определен формулой изобретения. Специалистам будут очевидны многие способы и материалы, аналогичные или эквивалентные раскрытым в настоящем описании, которые можно использовать в практике настоящего изобретения. Настоящее изобретение ни коим образом не ограничено раскрытыми здесь способами и материалами. В случае, если один или более из включенных литературных источников, патентов и аналогичных материалов отличается от приведенных или противоречит указанному описанию, включая, но ими не ограничиваясь, определения терминов, использование терминов, описание методик, или т.п., рассматриваемое описание их отклоняет.
ОПРЕДЕЛЕНИЯ
Термин "алкил" в том смысле, как здесь использован, относится к насыщенному линейному или с разветвленной цепочкой одновалентному углеводородному радикалу, содержащему от одного до двенадцати атомов углерода. Примеры алкильных групп включают, но ими не ограничиваются, метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (n-Pr, н-пропил, -CH2CH2CH3), 2-пропил (i-Pr, изо-пропил, -CH(CH3)2), 1-бутил (n-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (i-Bu, изо-бутил, -CH2CH(CH3)2), 2-бутил (s-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (t-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3, 1-гептил, 1-октил и т.п.
Термин "алкенил" относится к линейному или с разветвленной цепочкой одновалентному углеводородному радикалу, состоящему из двух - двенадцати атомом углерода, с, по меньшей мере, одним сайтом ненасыщенности, т.е., углерод-углеродной, sp2 двойной связью, где указанный алкенильный радикал включает радикалы, обладающие "цис" и "транс" ориентациями, или альтернативно, "E" и "Z" ориентациями. Примеры включают, но ими не ограничиваются, этиленил или винил (-CH=CH2), аллил (-CH2CH=CH2) и т.п.
Термин "алкинил" относится к линейному или с разветвленной цепочкой одновалентному углеводородному радикалу, состоящему из двух - двенадцати атомом углерода, с, по меньшей мере, одним сайтом ненасыщенности, т.е., углерод-углеродной, sp тройной связью. Примеры включают, но ими не ограничиваются, этинил (-C≡CH), пропинил (пропаргил, -CH2C≡CH) и т.п.
Термины "карбоцикл", "карбоциклил", "карбоциклическое кольцо" и "циклоалкил" относятся к одновалентному неароматическому, насыщенному или частично ненасыщенному кольцу, содержащему от 3 до 12 атомов углерода в случае моноциклического кольца, или от 7 до 12 атомов углерода в случае бициклического кольца. Бициклические карбоциклы, содержащие от 7 до 12 атомов могут представлять собой, например, бицикло [4,5], [5,5], [5,6] или [6,6] систему, и бициклические карбоциклы, содержащие 9 или 10 кольцевых атомов, могут представлять собой бицикло[5,6] или [6,6] систему, или могут быть мостиковыми системами, такими как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры моноциклических карбоциклов включают, но ими не ограничиваются, циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил, и т.п.
Термин "арил" означает одновалентный ароматический углеводородный радикал, содержащий 6-18 атомов углерода, полученный в результате удаления одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы обозначены в примерах структур как "Ar". Термин арил включает бициклические радикалы, включающие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Типичные арильные группы включают, но ими не ограничиваются, радикалы, полученные из бензола (фенила), замещенных бензолов, нафталинов, антраценов, инденилов, инданилов, 1,2-дигидронафталинов, 1,2,3,4-тетрагидронафтилов и т.п.
Термины "гетероцикл", "гетероциклил" и "гетероциклическое кольцо" здесь используют взаимозаменяемо и они относятся к насыщенному или частично ненасыщенному (то есть, содержащему одну или более из двойных и/или тройных связей в кольце) карбоциклическому радикалу, содержащему от 3 до 18 кольцевых атомов, в котором, по меньшей мере, один кольцевой атом представляет собой гетероатом, выбранный из азота, кислорода и серы, причем остальные кольцевые атомы представляют собой C, где один или более из кольцевых атомов необязательно замещен независимо одним или более из заместителей, раскрытых далее. Гетероцикл может быть моноциклом, содержащим от 3 до 7 кольцевых членов (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, O, P, и S) или бициклом, содержащим от 7 до 10 кольцевых членов (от 4 до 9 атомов углерода и от 1 до 6 гетероатомов, выбранных из N, O, P, и S), например: бицикло [4,5], [5,5], [5,6], или [6,6] системой. Гетероциклы раскрыты в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), в частности, в главах 1, 3, 4, 6, 7, и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), в частности в томах 13, 14, 16, 19, и 28; и J. Am. Chem. Soc. (1960) 82:5566. Термин "гетероциклил" также включает радикалы, где гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом, или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но ими не ограничиваются, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидинил, морфолинил, тиоморфолинил, тиооксанил, пиперазинил, гомопиперазинил, азетидинил, оксэтанил, тиэтанил, гомопиперидинил, оксэпанил, тиэпанил, оксазепинил, диазепинил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Спиро фрагменты также включены в объем указанного определения. Примеры гетероциклических групп, где кольцевые атомы замещены оксо (=O) фрагментами, представляют собой пиримидинонил и 1,1-диоксотиоморфолинил.
Термин "гетероарил" относится к одновалентному ароматическому радикалу, состоящему из 5- или 6-членных колец, и включает конденсированные кольцевые системы (по меньшей мере, одна из которых является ароматической), состоящие из 5-18 атомов, содержащие один или более из гетероатомов, независимо выбранных из азота, кислорода и серы. Примерами гетероарильных групп являются пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
Указанные гетероциклические или гетероарильные группы могут быть присоединены через углерод (углерод-связанные) или азот (азот-связанные), где это возможно. Так, например (но не для ограничения), связанные через углерод гетероциклы или гетероарилы могут быть связаны в положениях 2, 3, 4, 5 или 6 пиридина, в положениях 3, 4, 5 или 6 пиридазина, в положениях 2, 4, 5 или 6 пиримидина, в положениях 2, 3, 5 или 6 пиразина, в положениях 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, в положениях 2, 4 или 5 оксазола, имидазола или тиазола, в положениях 3, 4 или 5 изоксазола, пиразола, или изотиазола, в положениях 2 или 3 азиридина, в положениях 2, 3 или 4 азетидина, в положениях 2, 3, 4, 5, 6, 7 или 8 хинолина или в положениях 1, 3, 4, 5, 6, 7 или 8 изохинолина.
Так, например (но не для ограничения), связанные через азот гетероциклы или гетероарилы могут быть связаны в положении 1 азиридина, азетидина, пиррола, пирролдидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, в положении 2 изоиндола, или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или β-карболина.
Термин “галоген” относится к F, Cl, Br или I. Гетероатомы, присутствующие в гетероарилах или гетероциклилах включают их окисленные формы, такие как N+→O-, S(O) и S(O)2.
Термины "лечить" и "лечение" относятся как к терапевтическому лечению так и профилактическим или превентивным мерам, когда у субъекта предотвращают или снижают (уменьшают) нежелательные физиологические нарушения или заболевания, такие как развитие или метастазирование рака. Для целей настоящего изобретения, благоприятные или желательные клинические результаты включают, но ими не ограничиваются, облегчение симптомов, уменьшение степени заболевания, стабилизацию (то есть, отсутствие ухудшения) состояния болезни, задержку или замедление прогрессирования заболевания, облегчение или временное облегчение болезненного состояния, и ремиссию (как частичную, так и полную), независимо от того, заметны они или незаметны. Термин "лечение" может также означать пролонгирование выживания по сравнению с ожидаемым сроком выживания в отсутствии лечения. Нуждающиеся в лечении субъекты включают тех, у которых уже наблюдается болезненное состояние или заболевание, также как и тех, которые предрасположены к таким болезненным состояниям или заболеваниям, или тех, в отношении которых необходима профилактика указанных болезненных состояний или заболеваний.
Фраза "терапевтически эффективное количество" означает такое количество соединения настоящего изобретения, которое (i) лечит или осуществляет профилактику конкретного заболевания, состояния или нарушения, (ii) ослабляет, улучшает или исключает один или более из симптомов конкретного заболевания, состояния или нарушения, или (iii) предотвращает или замедляет возникновение одного или более из симптомов, описанных здесь конкретных заболеваний, состояний или нарушений. В случае рака терапевтически эффективное количество лекарства может уменьшить количество раковых клеток; уменьшить размер опухоли; ингибировать (то есть, замедлить до некоторой степени и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть, замедлить до некоторой степени и предпочтительно остановить) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или уменьшить до некоторой степени один или более из симптомов, связанных с раком. Что касается степени, до которой указанное лекарство может предотвратить рост и/или уничтожить существующие раковые клетки, эта степень может быть цитостатической и/или цитотоксической. Для терапии рака эффективность можно измерить, например, оценив время прогрессирования заболевания (TTP) и/или определяя степень реакции (RR).
Термины "аномальный рост клеток" и "гиперпролиферативное нарушение" используют в рассматриваемой заявке взаимозаменяемо. "Аномальный рост клеток", в том смысле, как здесь использован, если нет других указаний, относится к клеточному росту, который независим от нормальных регуляторных механизмов (например, утрата контактного ингибирования). Такой рост включает, например, аномальный рост: (1) опухолевых клеток (опухолей), которые пролиферируют за счет экспрессии мутировавшей тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аберрантная активация тирозинкиназы; (3) любых опухолей, которые пролиферируют за счет рецепторной тирозинкиназы; (4) любых опухолей, которые пролиферируют за счет аберрантной активации серин/треонинкиназы; и (5) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аберрантная активация серин/треонинкиназы.
Термины "рак" и "раковый" относятся к, или описывают физиологическое состояние млекопитающих, которое типично характеризуется разрегулированным клеточным ростом. Термин "опухоль" включает одну или более из раковых клеток. Примеры раков включают, но ими не ограничиваются, карциному, лимфому, бластому, саркому и лейкемию или лимфолейкоз. Более конкретные примеры таких раков включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких ("NSCLC"), аденокарциному легких и сквамозную карциному легких, рак перитонеальной полости, гепатоклеточный рак, рак желудка, включая гастоинтестинальный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак мочевого пузыря, рак печени, гепатому, рак молочной железы, рак прямой кишки, ректальный рак, колоректальный рак, эндометриальную карциному или карциному матки, карциному слюнных желез, рак почек или гипернефрому, рак простаты, рак влагалища, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, острую лейкемию, также как рак головы/мозга и рак шеи.
Термин "химиотерапевтический агент" обозначает соединение, которое можно использовать для лечения рака. Примеры химиотерапевтических агентов включают эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), фулвестрант (FASLODEX®, AstraZeneca), сутент (SU11248, Pfizer), летрозол (FEMARA®, Novartis), иматинибмезилат (GLEEVEC®, Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Eloxatin®, Sanofi), 5-FU (5-фторурацмл), леуковарин, рапамицин (Sirolimus, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs) и гефитиниб (IRESSA®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекана); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые аналоги); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеуткробин; панкратизтатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, изосфамид, мехлорэтамин, гидрохлорид мехлорэтаминоксида, мелфалан, новембицин, фенэстерин, преднимустин, трофосфамид, урацил мустард; нитрозмочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энединовые антибиотики (например, калихеамицин, особенно калихеамицин gammalI и калихеамицин omegaIl (Angew Chem. Intl. Ed. Engl. (1994) 33:183-186); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; также как хромофор неокарциностатина и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, актиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин), морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофенольную кислоту, ногаламицин, оливомицин, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; анти-метаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксицридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолонпропионат, эпитиостанол, мепитиостан, тестолактон; анти-адреналы, такие как аминоглутетимид, митотан, трилостан; вспомогательные агенты фолиевой кислоты, такие как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазикуон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лнтинан; лонидайнин; мэйтансиноиды, такие как мэйтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, TAXOL® (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE™ (Cremophor-free), сконструированные на базе альбумина наночастичные композиции паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois), и TAXOTERE® (доксетаксел; Rhône-Poulenc Rorer, Antony, France); хлоранмбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенифозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®); ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифлорометилорнитин (DMFO); ретиноиды, такие как ретиновая кислота; и фармацевтически приемлемые соли, кислоты и производные любого из перечисленных соединений.
В определение "химиотерапевтический агент" также включены: (i) противогормональные агенты, действие которых состоит в регулировании или ингибировании воздействия гормонов на опухоли, такие как анти-эстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (включая NOLVADEX®; тамоксифенцитрат), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон, и FARESTON® (торемифинцитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогена в надпочечниках, такие как, например, 4(5)имидазолы, аминоглутетимид, MEGASE® (мегестролацетат), AROMASIN® (эксеместан; Pfizer), форместанин, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARIMIDEX® (анастрозол; AstraZeneca); (iii) анти-андрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; также как троксацетабин (аналог 1,3-диоксоланнуклеозидцитозина); (iv) ингибиторы протеинкиназы; (v) ингибиторы липидной киназы; (vi) антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнальных схемах, вовлеченных в аберрантную пролиферацию клеток, такие как, например, PKC-alpha, Ralf и H-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®) и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины, используемые при генной терапии, например, ALLOVECTIN®, LEUVECTIN®, и VAXID®; PROLEUKIN® rIL-2; ингибиторы топоизомеразы 1, такие как LURTOTECAN®; ABARELIX® rmRH; (ix) анти-ангиогенные агенты, такие как бевацизумаб (AVASTIN®, Genentech); и (x) фармацевтически приемлемые соли, кислоты и производные любых из вышеперечисленных соединений. Другие анти-ангиогенные агенты включают ингибиторы MMP-2 (матричной металлопротеиназы 2), ингибиторы MMP-9 (матричной металлопротеиназы 9), ингибиторы COX-II (циклооксигеназы II), и ингибиторы VEGF рецепторов тирозинкиназы. Примеры таких подходящих ингибиторов матричных металлопротеиназ, которые можно использовать в сочетании с соединениями/композициями настоящего изобретения (такими как любые из соединений в заголовках примеров 5-14) раскрыты в WO 96/33172, WO 96/27583, EP 818442, EP 1004578, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, EP 606,046, EP 931,788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99/07675, EP 945864, U.S. Pat. No. 5863949, U.S. Pat. No. 5861510, и EP 780386, причем все они включены сюда для ссылки во всей своей полноте. Примеры ингибиторов VEGF рецепторов тирозинкиназы включают 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474; Пример 2 within WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; Пример 240 в WO 00/47212), ваталаниб (PTK787; WO 98/35985) и SU11248 (сунитиниб; WO 01/60814), и соединения, такие как те, что раскрыты в PCT публикациях № WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354).
Другие примеры химиотерапевтических агентов, которые можно использовать в сочетании с соединениями настоящего изобретения (такими как любые из указанных соединений в заголовках примеров 5-14) включают ингибиторы PI3K (фосфоинозитид-3 киназы), такие, о которых сообщалось в Yaguchi et al (2006) Jour. of the Nat. Cancer Inst. 98(8):545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; US 2008/0242665; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070; US 6703414; и WO 97/15658, причем все они включены сюда для ссылки в своей полноте. Конкретные примеры таких ингибиторов PI3K включают SF-1126 (PI3K ингибитор, Semafore Pharmaceuticals), BEZ-235 (PI3K ингибитор, Novartis), XL-147 (PI3K ингибитор, Exelixis, Inc.), и GDC-0941 (PI3K ингибитор, Genentech, Inc.).
Термин "воспалительные заболевания" в том смысле как использован в рассматриваемой заявке, включает, но ими не ограничивается, ревматоидный артрит, атеросклероз, застойную сердечную недостаточность, воспалительные заболевания кишечника (включая, но ими не ограничиваясь, болезнь Крона и язвенный колит), хроническое обструктивное легочное заболевание, Фиброзные заболевания печени и почек, болезнь Крона, волчанку, кожные заболевания, такие как псориаз, экзема и склеродерма, остеоартрит, рассеянный склероз, астму, заболевания и нарушения, связанные с диабетическими осложнениями, фиброзная недостаточность в органах, таких как легкие, печень, почки и воспалительные осложнения сердечно-сосудистой системы, такие как острый коронарный синдром.
Термин "противовоспалительный агент" означат соединение, которое можно использовать для лечения воспалений. Примеры противовоспалительных агентов включают белковые терапевтические препараты для инъекций, такие как Enbrel®, Remicade®, Humira® и Kineret®. Другие примеры противовоспалительных агентов включают нестероидные противовоспалительные агенты (NSAID), такие как ибупрофен или аспирин (который уменьшает отек и облегчает боль); модифицирующие заболевание противоревматоидные лекарственные препараты (DMARD), такие как метотрексат; 5-аминосалицилаты (сульфазалазин и не содержащие сульфамидов агенты); кортикостероиды; иммуномодуляторы, такие как 6-меркаптопутин ("6-MP"), азатиоприн ("AZA"), циклоспорины, и модификаторы биологических реакций, такие как Remicade.RTM. (инфликсимаб) и Enbrel.RTM. (этанерцепт); факторы роста фибробластов; полученные из тромбоцитов факторы роста; блокаторы ферментов, такие как Arava.RTM. (лефлуномид); и/или агенты, защищающие хрящи, такие как гиалуроновая кислота, глюкозамин и хондроитин.
Термин "пролекарство" в том смысле, как использовано в настоящей заявке, относится к предшественнику или к форме производного соединения настоящего изобретения, которое способно быть ферментативно или гидролитически активировано или превращено в более активную исходную форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., " Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства настоящего изобретения включают, но ими не ограничиваются, содержащие сложные эфиры пролекарства, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, модифицированные D-аминокислотой пролекарства, гликозилированные пролекарства, β-лактам-содержащие пролекарства, необязательно замещенные феноксиацетамид-содержащие пролекарства, необязательно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые можно превратить в более активные не цитотоксические лекарства. Примеры цитотоксических лекарств, которые можно превратить в пролекарственные формы для использования в настоящем изобретении, включают, но ими не ограничиваются, соединения настоящего изобретения и химиотерапевтические агенты, такие как раскрыты выше.
Термин "метаболит" обозначает продукт, полученный за счет метаболизма в организме специфического соединения или его соли. Метаболиты соединения можно идентифицировать, используя рутинные технологии, известные специалистам, и определить их активности, используя раскрытые здесь тесты. Такие продукты можно получить, например, в результате окисления, гидроксилирования, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления, и т.п., вводимого соединения. Соответственно, настоящее изобретение включает метаболиты соединений настоящего изобретения, включая соединения, полученные с использованием способа, включающего осуществление контактирования соединения настоящего изобретения с организмом млекопитающего в течение промежутка времени, достаточного для получения его метаболического продукта.
Термин "липосома" обозначает маленький пузырек, состоящий из различного типа липидов, фосфолипидов и/или поверхностно активного агента, который можно использовать для доставки млекопитающему лекарственных средств (таких как ингибиторы MEK, раскрытые здесь, и необязательно, химиотерапевтический агент). Компоненты липосом обычно организованы в виде двухслойного образования, аналогичного липидной структуре биологических мембран.
Термин "вкладыш в упаковку" используют относительно инструкций, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов, и которые содержат информацию о показаниях, способах применения, дозах, способах введения, противопоказаниях и/или предостережениях, касающихся использования таких терапевтических продуктов.
Термин "хиральный" относится к молекулам, которые не обладают свойством взаимоналожения зеркальных изображений друг друга, тогда как термин "ахиральный" относится к молекулам, которые обладают свойством взаимоналожения зеркальных изображений друг друга.
Термин "стереоизомер" относится к соединениям, которые имеют одинаковый химический состав и связи, но отличаются различной ориентацией их атомов в пространстве, которые не является взаимопревращаемыми при вращении вокруг простых связей.
Термин "диастереоизомер" относится к стереоизомеру с двумя или более центрами хиральности, причем такие молекулы не являются зеркальными изображениями друг друга. Диастереоизомеры обладают различными физическими свойствами, например точками плавления, точками кипения, спектральными характеристиками и реактивными способностями. Смеси диастереоизомеров можно разделить, используя аналитические методики высокого разрешения, такие как кристаллизация, электрофорез и хроматография.
Термин "энантиомеры" относится к двум стереоизомерам соединения, которые не являются взаимоналагаемыми зеркальными изображениями друг друга.
Стереохимические определения и условные обозначения, использованные в описании, соответствуют в основном S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения настоящего изобретения могут содержать асимметрические или хиральные центры, и поэтому существовать в различных стереоизомерных формах. Подразумевается, что все стереоизмерные формы указанных соединений настоящего изобретения, включая, но ими не ограничиваясь, диастереоизомеры, энантиомеры и тропизомеры, также как и их смеси, такие как рацемические смеси, составляют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью вращать плоскость плоско-поляризованного света. При описании оптически активных соединений префиксы D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (хиральных центров). Префиксы d и l или (+) и (-) используют для обозначения знака вращения плоско-поляризованного света указанным соединением, причем (-) или 1 означают, что указанное соединение является левовращающим. Символы (+) или d перед соединением означают, что оно является правовращающим. Для конкретной химической структуры, указанные стереоизомеры идентичны, за исключением того, что они являются зеркальными изображениями друг друга. Конкретный стереоизомер может также называться энантиомером, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, который не проявляет стереоселективности или стереоспецифичности в химических реакциях или процессах. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных образцов, лишенной оптической активности.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различными энергиями, которые могут взаимопревращаться за счет низкого энергетического барьера. Например, протонные таутомеры (также известные как прототропные таутомеры) осуществляют взаимопревращения за счет миграции протона, такие как процессы кето-енольной и имин-енаминной изомеризации. Валентные таутомеры включают взаимопревращения за счет реорганизации некоторых связывающих электронов.
Фраза "фармацевтически приемлемая соль" в том смысле, как здесь использована, относится к фармацевтически приемлемым органическим или неорганическим солям соединений настоящего изобретения. Примеры солей включают, но ими не ограничиваются, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат формиат, бензоат, глутамат, метансульфонат “мезилат”, этансульфонат, бензолсульфонат, п-толуолсульфонат, памоат (то есть, 1,1'-метилен-бис(2-гидрокси-3-нафтоат)), соли щелочных металлов (например, натрия и калия), соли щелочноземельных металлов (например, магния), и соли аммония. Фармацевтически приемлемые соли могут содержать включения других молекул, таких как ионы ацетата, ионы сукцината или другие противоионы. Указанный противоион может быть органическим или неорганическим фрагментом, который стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может содержать более одного заряженного атома в своей структуре. В случаях, когда несколько заряженных атомов являются частью фармацевтически приемлемой соли, такая соль может иметь несколько противоионов. Следовательно, фармацевтически приемлемая соль может содержать один или более из заряженных атомов и/или один или более из противоионов.
Если рассматриваемое соединение настоящего изобретения представляет собой основание, нужную фармацевтически приемлемую соль можно получить любым подходящим способом известным специалистам в данной области, например, обработкой свободного основания неорганической кислотой, такой, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, серная кислота и т.п. или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислоты, такие как лимонная кислота или винная кислота, аминокислоты, такие как аспарагиновая кислота или глутамовая кислота, ароматические кислоты, такие как бензойная кислота или коричная кислота, сульфоновые кислоты, такие как п-толуолсульфоновая кислота или этансульфоновая кислота или т.п.
Если рассматриваемое соединение настоящего изобретения представляет собой кислоту, нужную фармацевтически приемлемую соль можно получить любым подходящим способом, например, обрабатывая свободную кислоту неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксидом щелочного металла или гидроксидом щелочноземельного металла или т.п. Иллюстративные примеры подходящих солей включают, но ими не ограничиваются, органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные с натрием, кальцием, калием, магнием, марганцем, железом, медью, цинком, алюминием и литием.
Фраза "фармацевтически приемлемые" означает, что рассматриваемое вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, содержащимися в композиции, и/или с организмом млекопитающего, который ими лечат.
Термин "сольват" относится к ассоциации или комплексу молекул одного или более из растворителей и соединения настоящего изобретения. Примеры растворителей, которые образуют сольваты, включают, но ими не ограничиваются, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, в котором растворителем является вода.
Термин "защитная группа" относится к заместителю, который обычно используют для блокирования или защиты конкретной функциональности, во время реакции других функциональных групп указанного соединения. Например, термин "аминозащитная группа" обозначает заместитель, присоединенный к аминогруппе, который блокирует или защищает функциональные аминогруппы в указанном соединении. Подходящие аминозащитные группы включают ацетил, трифторацетил, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Аналогично, термин "гидроксизащитная группа" относится к заместителю гидроксигруппы, который блокирует или защищает функциональные гидроксигруппы. Подходящие защитные группы включают группы ацетила и триалкилсилила. Термин "карбоксизащитная группа" относится к заместителю у карбоксильной группы, который блокирует или защищает функциональные карбоксигруппы. Обычные карбоксизащитные группы включают фенилсульфонилэтил, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и т.п. Для общего описания защитных групп и их использования см. T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Термины "соединение настоящего изобретения", "соединения настоящего изобретения" "соединения формулы I", "имидазопиридины" и "имидазопиридины формулы I", если нет других указаний, включают соединения/имидазопиридины формулы I и стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли) и их пролекарственные формы.
В настоящем изобретении предложены имидазопиридины формулы I представленной выше, которые можно использовать в качестве ингибиторов киназы, в частности можно использовать в качестве ингибиторов MEK киназы. В одном из вариантов настоящего изобретения, если Z1 представляет собой N, тогда R11' не представляет собой арил; а все остальные переменные определены в формуле I.
В одном из вариантов настоящего изобретения, соединения имеют формулу I-a, и все остальные переменные определены в формуле I, или имеют значения, указанные в раскрытом выше варианте.
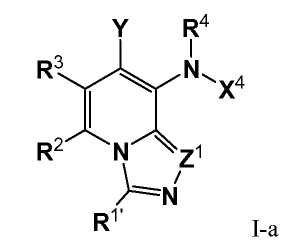
В одном из вариантов настоящего изобретения, R2 представляет собой H, галоген, CF3, или C1-C3 алкил; и все остальные переменные определены в формуле I или I-a,, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R2 представляет собой H, метил, CF3, F, или Cl; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R2 представляет собой H, F или Cl; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, R3 представляет собой H, галоген, CF3, или C1-C3 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R3 представляет собой H, метил, CF3, F, или Cl; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R3 представляет собой H, F или Cl; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, R1' представляет собой H или C1-C3 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов. В другом варианте R1' представляет собой H, и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, Z1 представляет собой CR1 и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, Z1 представляет собой N и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, Z1 представляет собой CR1 и R1 представляет собой H или C1-C3 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов. В другом варианте, R1 представляет собой H, и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов. В другом варианте R1 представляет собой метил, и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, R4 представляет собой H или C1-C6 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R4 представляет собой H или метил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов. В другом варианте настоящего изобретения, R4 представляет собой H; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, R5 представляет собой H или C1-C6 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R5 представляет собой H или метил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R5 представляет собой H; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R5 представляет собой метил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
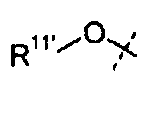
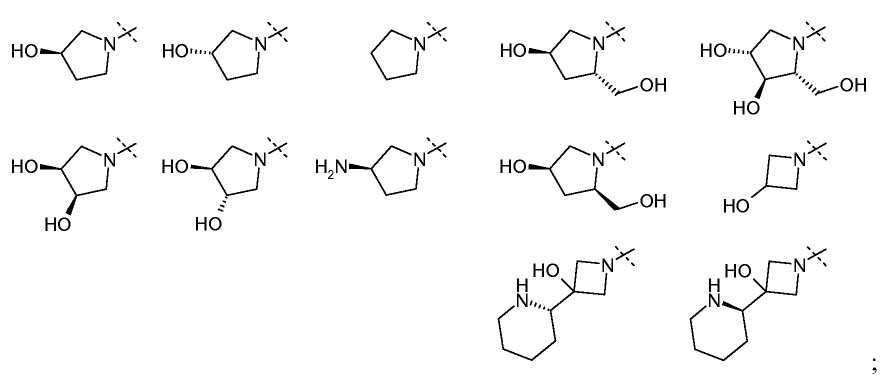
В одном из вариантов настоящего изобретения, X1 представляет собой OR11'; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой OR11' где R11' представляет собой H или C1-C12 алкил (например, C1-C6 алкил), замещенный одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все остальные переменные определены в формуле I или I-a или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой OR11' где R11' представляет собой гетероциклил (например, 4-6-членный гетероциклил), необязательно замещенный одной или более группами, независимо выбранными из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой OR11', где R11' представляет собой 4 - 6-членный гетероциклил, содержащий 1 кольцевой атом азота, где указанный гетероциклил необязательно замещен одной или более из групп, независимо выбранных из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17, и R21; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой:
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой
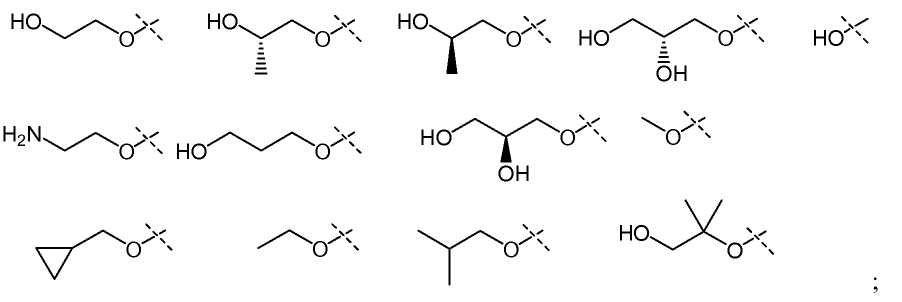
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, X1 представляет собой R11'; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой R11', где R11' представляет собой H или C1-C12 алкил (например, C1-C6 алкил), замещенный одной или более из групп, независимо выбранных из галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6 алкил), -(CR19R20)n C(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой
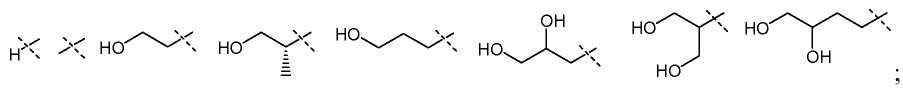
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R5 представляет собой H и X1 представляет собой
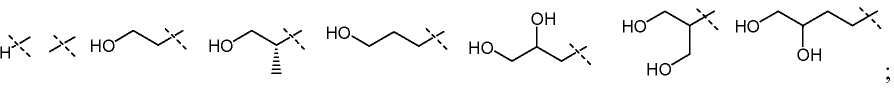
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X1 представляет собой
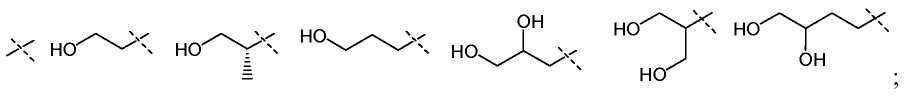
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R5 представляет собой метил и X1 представляет собой
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, X1 представляет собой R11', и X1 взятый вместе с R5 и атомом азота, к которому они присоединены, образует 4-5-членное насыщенное циклическое кольцо, содержащее 0-2 дополнительные гетероатома, выбранные из O, S и N, где указанное циклическое кольцо необязательно замещено одной или более из групп, выбранных из галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)n-SR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)n NR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, W представляет собой:
и остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, W представляет собой -OR11', где R11' представляет собой H или C1-C12 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, W представляет собой -OR11', где R11' представляет собой H; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, W представляет собой -OR11', где R11' представляет собой C1-C6 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, W' представляет собой -NHSO2R8; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
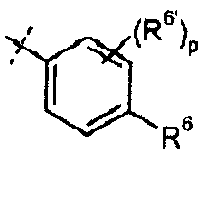
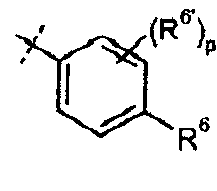
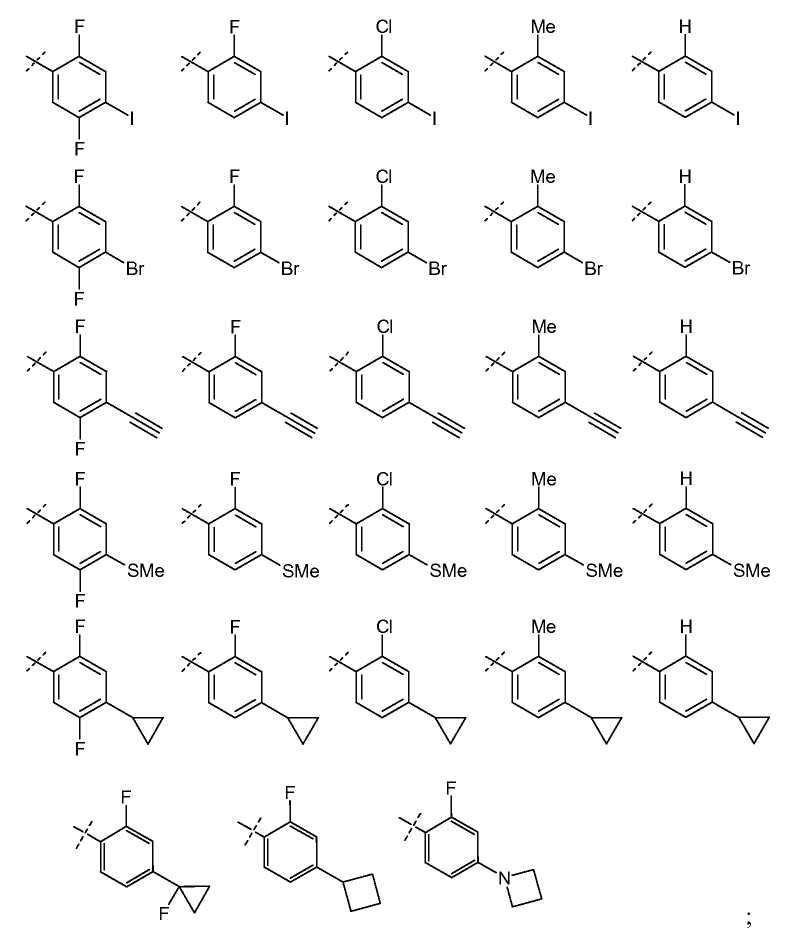
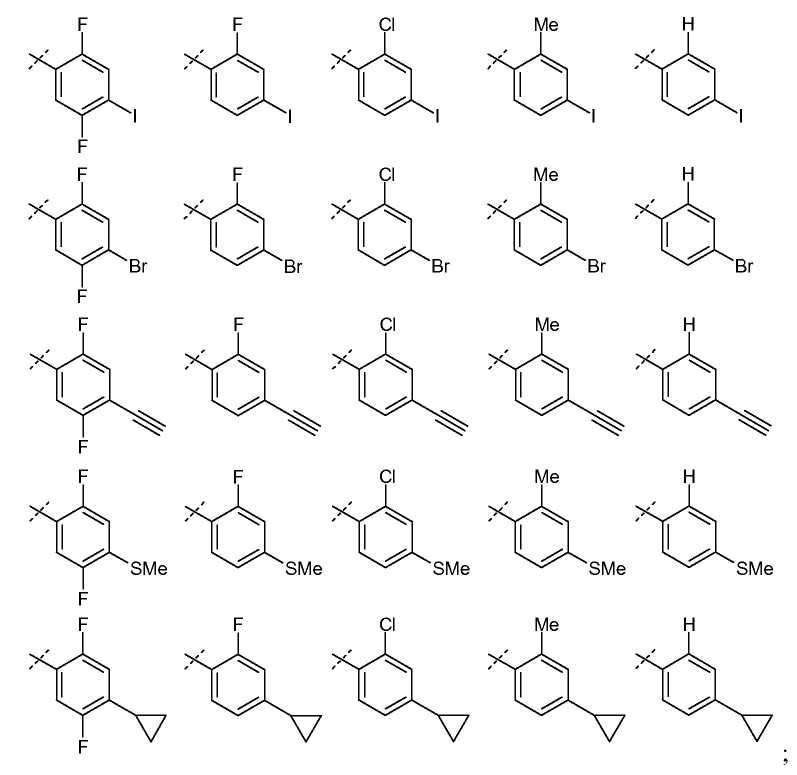
В одном из вариантов настоящего изобретения, R6 представляет собой галоген, C2-C8 алкинил, карбоциклил, или -SR16; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, R6 представляет собой галоген, C2-C3 алкинил, C3-карбоциклил, или -SR16,где R16 представляет собой C1-C2 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, R6' представляет собой H, галоген, или C1-C3 алкил; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, p представляет собой 1 или 2; и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В одном из вариантов настоящего изобретения, X4 представляет собой
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
В другом варианте настоящего изобретения, X4 представляет собой
и все остальные переменные определены в формуле I или I-a, или имеют значения, указанные в любом из раскрытых выше вариантов.
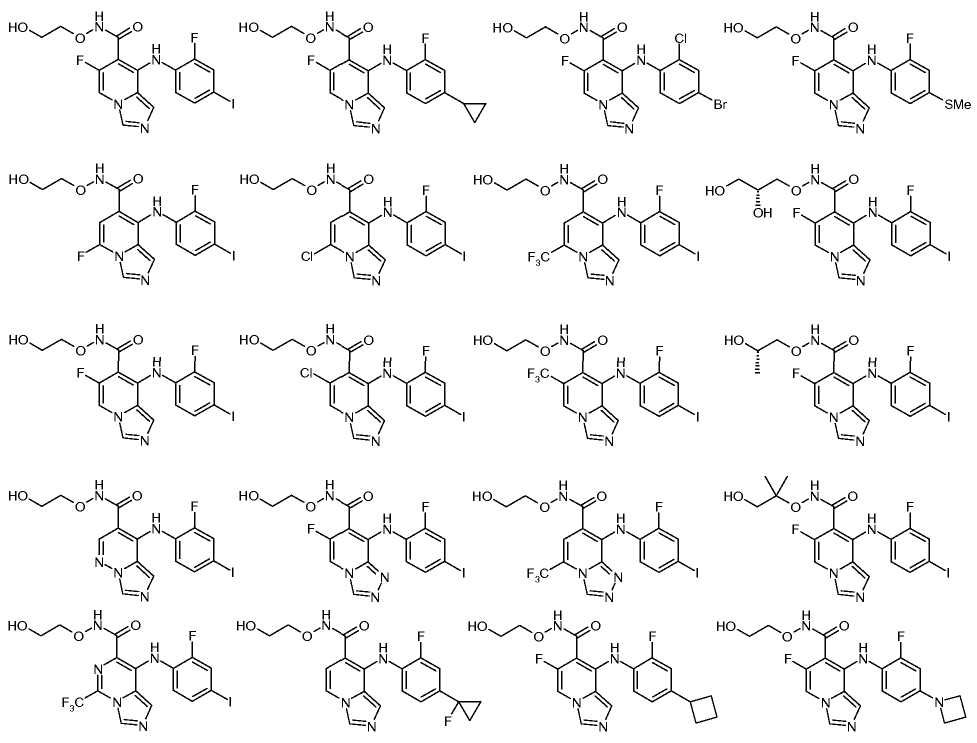
Другой вариант настоящего изобретения включает соединения, раскрытые в примерах 5-14 и представленные далее соединения:
Получение соединений формулы I
Имидазопиридины формулы I получают в соответствии с раскрытыми далее схемами и примерами или известными специалистам в данной области способами. Например, соединения формулы (I), где Y=W-C(O)- можно получить в соответствии со схемой 1.
Схема 1
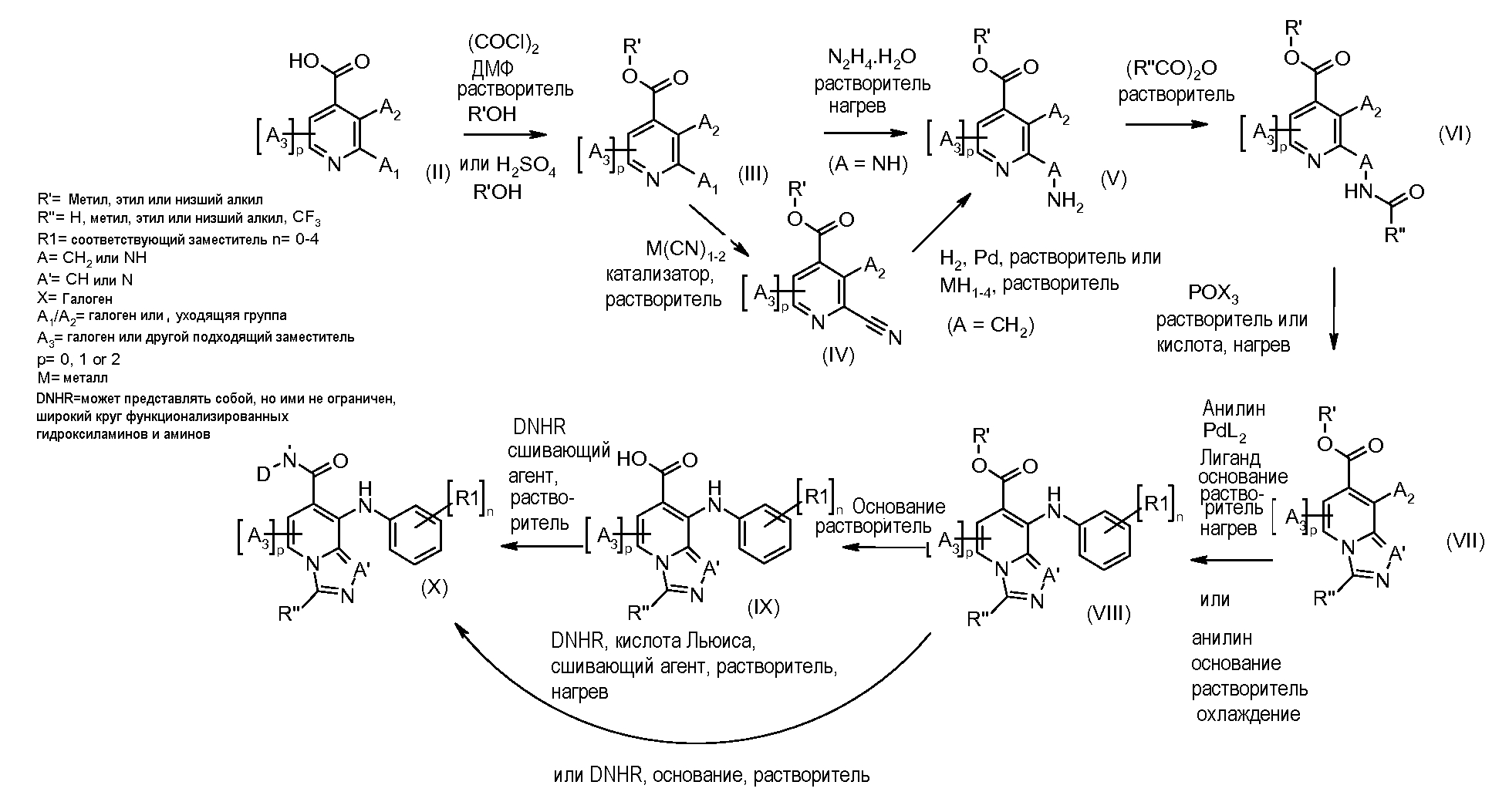
Изоникотиновые кислоты общего строения (II) можно получить из коммерческих источников или получить, используя раскрытые в литературе способы. Кислоты (II) можно превратить в эфиры формулы (III), осуществляя взаимодействие с хлорирующим агентом, таким как оксалилхлорид, в присутствии катализатора, такого как ДМФ, в растворителе, таком как DCM, с последующей обработкой алкиловым спиртом, таким как метанол. Альтернативно кислоты (II) можно подвергнуть взаимодействию с алкиловым спиртом в присутствии кислоты, такой как серная кислота, до получения сложных эфиров формулы (III).
2-Цианопиридины (IV) можно получить из 2-галогенпиридинов (III), осуществляя реакцию с неорганическим цианидом, таким как цианид цинка, в присутствии катализатора переходного металла, такого как Zn, тетракис(трифенилфосфин)палладий(0) или трис-(дибензилиденацетон)дипалладий(0)/1,1'-бис(дифенилфосфино)ферроцен, в растворителе, таком как ДМФ, при температуре от 50°C до температуры кипения с обратным холодильником, или под действием микроволнового облучения при температуре от 70°C до 200°C.
Цианопиридины (IV) можно восстановить, получая 2-аминометилпиридины (V), A=CH2, в результате реакции с водородом при давлении от 1 до 5 атмосфер в присутствии катализатора, такого как палладий-на-угле, в растворителе, таком как метанол, уксусная кислота или муравьиная кислота, с добавлением или без добавления сильной кислоты, такой как концентрированная хлористоводородная кислота. Альтернативно, цианопиридины (IV) можно превратить в 2-аминометилпиридины, осуществляя реакцию с неорганическим гидридом металла, таким как боргидрид натрия, в присутствии соли металла, такой как хлорид кобальта, в растворителе, таком как метанол, при температуре от 0°C до комнатной температуры. Альтернативно соединения формулы (V), A=NH, можно получить из соединений формулы (III), осуществляя реакцию с гидразингидратом, в присутствии растворителя, такого как этанол, при температуре от 0°C до температуры кипения с обратным холодильником.
Соединения формулы (VI) можно получить из соединений (V), осуществляя реакцию с ангидридом, таким как уксусный ангидрид, или смешанным ангидридом, таким как муравьино-уксусный ангидрид, в растворителе, таком как тетрагидрофуран, при температуре от 0°C до температуры кипения с обратным холодильником.
Соединения формулы (VII) можно получить из соединений (VI), осуществляя реакцию с хлорирующим агентом, таким как хлорокись фосфора, в растворителе, таком как толуол, при температуре от 25°C до температуры кипения с обратным холодильником. Альтернативно, соединения формулы (VII) можно получить из соединений формулы (VI), осуществляя реакцию с кислотой, такой как муравьиная кислота, без растворителя или в растворителе, таком как диоксан, при температуре от 50°C до температуры кипения с обратным холодильником.
Соединения формулы (VIII) можно получить из соединений формулы (VII), осуществляя реакцию с анилином (вводя соответствующие заместители R1), в присутствии основания, такого как литий бис(триметилсилил)амид, в растворителе, таком как ТГФ, при температуре от -78°C до комнатной температуры. Альтернативно, соединения формулы (VIII) можно получить из соединений формулы (VII), осуществляя реакцию с анилином (вводя соответствующие заместители R1), в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий (0), основания, такого как калийфосфат, лиганда, такого как 2-дициклогексилфосфино-2',6'-(диизопропокси)бифенил, в подходящем растворителе, таком как толуол, при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя, или при микроволновом облучении при температуре от 70°C до 150°C.
Соединения формулы (IX) можно получить из соединений формулы (VIII), осуществляя реакцию с основанием, таким как гидроксид натрия, в протонном растворителе, таком как этанол или метанол, при температуре от комнатной температуры до температуры кипения с обратным холодильником.
Соединения формулы (IX) можно подвергнуть взаимодействию с функционализированным гидроксиламином формулы (XII) (коммерчески доступен или получен в соответствии с) или амином, и подходящим связывающим агентом, таким как O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат, гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или N,N'-дициклогексилкарбодиимид в присутствии N-гидрокси-1,2,3-бензотриазола, в присутствии подходящего основания, такого как диизопропилэтиламин или триэтиламин в инертном растворителе, таком как тетрагидрофуран, N,N-диметилформамид или дихлорметан, при температуре около комнатной температуры, получая соединения формулы (X). Соединения формулы (X) можно получить непосредственно из соединений формулы (VIII), осуществляя реакцию с амином или гидроксиламином DNHR в присутствии кислоты Льюиса, такой как триметилалюминий, в растворителе, таком как DCM, при температуре от комнатной температуры вплоть до температуры кипения с обратным холодильником. Альтернативно, соединения формулы (X) можно получить из соединений формулы (VIII) путем обработки функционализированным гидроксиламином DNHR в присутствии основания, такого как литий бис(триметилсилил)амид, в растворителе, таком как ТГФ, при температуре от -78°C до 25°C.
Соединения формулы (I), в которых Y=R8SO2NH- можно получить в соответствии со схемой 2.
Схема 2
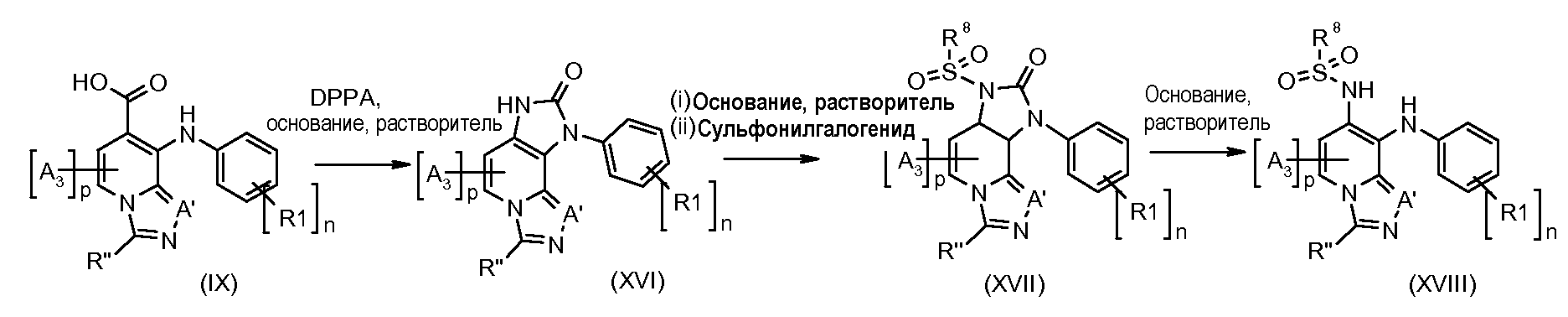
Соединения формулы (XVI) можно получить из соединений формулы (IX) путем обработки дифенилфосфорилазидом в растворителе, таком как толуол, в присутствии основания, такого как триэтиламин. Соединения формулы (XVII) можно получить из соединений формулы (XVI) путем обработки основанием, таким как гидрид натрия, в растворителе, таком как ДМФ, осуществляя затем реакцию с сульфонилхлоридом (соответствующим образом замещенным). Соединения формулы (XVIII) можно получить из соединений формулы (XVII), удаляя защитные группы, используя основание, такое как гидроксид натрия, в растворителе, таком как ДМФ,при температуре от 50°C до 150°C.
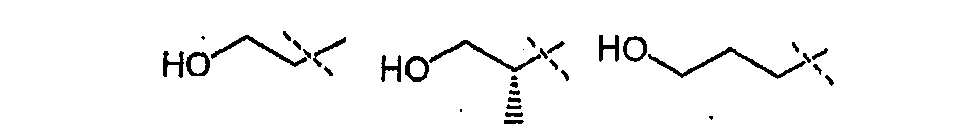
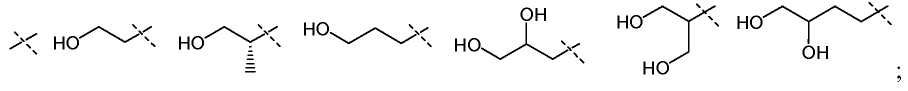
Гидроксиламины формулы (XII) можно получить, используя способы, раскрытые в литературе или способ стнтеза, представленный на схеме 3.
Схема 3
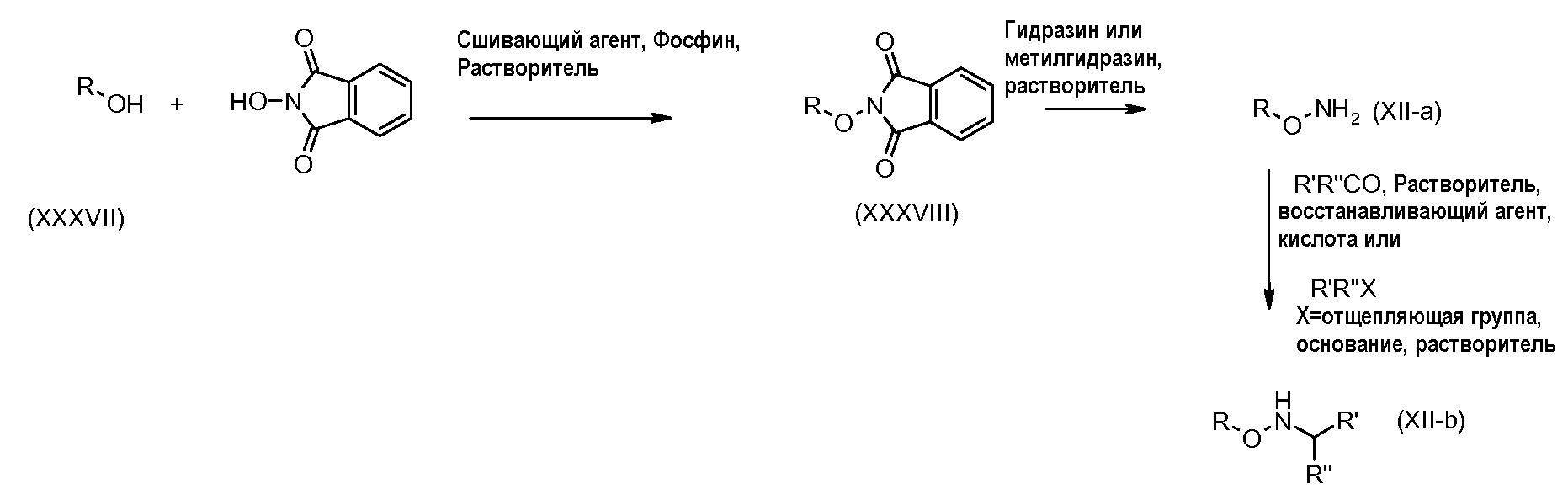
Первичные или вторичные спирты общей формулы (XXXVII) можно получить, используя способы, раскрытые в литературе. Их можно подвергнуть взаимодействию с N-гидроксифталимидом, используя фосфин и связывающий агент, такой как диэтилазодикарбоксилат, до получения соединений общей формулы (XXXVIII). У соединения общей формулы (XXXVIII) можно удалить защитные группы, используя гидразин или метилгидразин, получая гидроксиламины общей формулы (XII-a).
Соединения формулы (XII-a) можно далее модифицировать, используя восстановительное аминирование альдегидами или кетонами, используя восстанавливающий агент, такой как триацетоксиборгидрид натрия, цианоборгидрид натрия, или боран-пиридин в растворителе, таком как дихлорэтан, при температуре от комнатной температуры до температуры кипения с обратным холодильником. Кроме того, соединения формулы (XII-a) можно далее модифицировать путем алкилирования алкилгалогенидом в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, получая гидроксиламины общей формулы (XII-b).
Альтернативно, гидроксиламины формулы (XII-a) можно получить в соответствии со схемой 4.
Схема 4
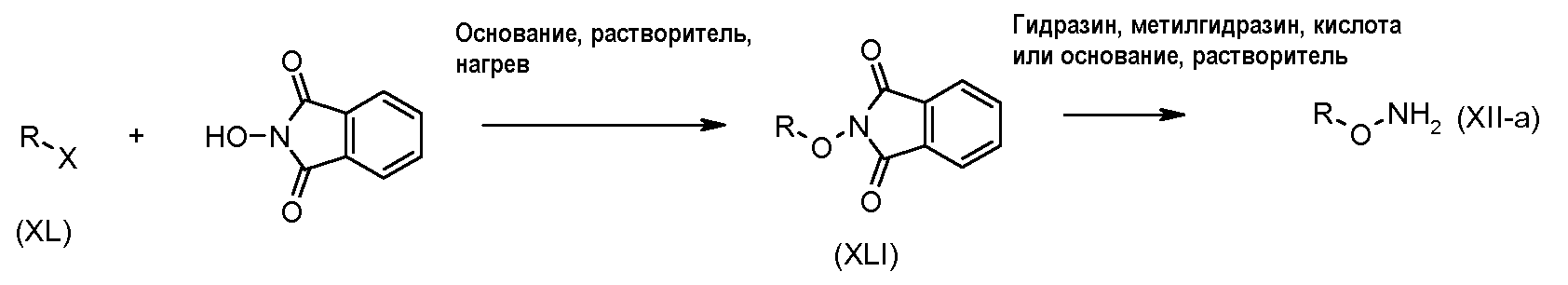
Алкилгалогениды формулы (XL) можно подвергнуть взаимодействию с N-гидроксифталимидом в присутствии основания, такого как карбонат калия, в растворителе, таком как диметилсульфоксид, при температуре от 10°C до 50°C. Соединения формулы (XLI) можно превратить в соединения формулы (XII), используя способы, раскрытые для превращения соединений формулы (XXXVIII) в соединения формулы (XII) на схеме 3.
Альтернативно, соединения формулы (XII-a) можно получить в соответствии со схемой 5.
Схема 5
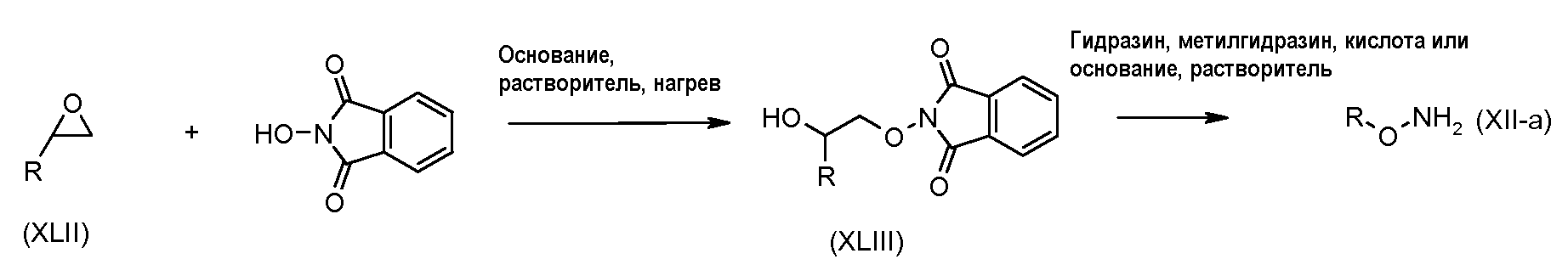
Соединения формулы (XLII) можно подвергнуть взаимодействию с N-гидроксифталимидом в присутствии каталитического количества основания, такого как DIPEA, и сокатализатора, такого как тетрабутиламмонийбромид, в растворителе, таком как толуол, при температуре от 50°C до температуры кипения с обратным холодильником. Соединения формулы (XLIII) можно превратить в соединения формулы (XII), используя способы, раскрытые для превращения соединений формулы (XXXVIII) в соединения формулы (XII) на схеме 3.
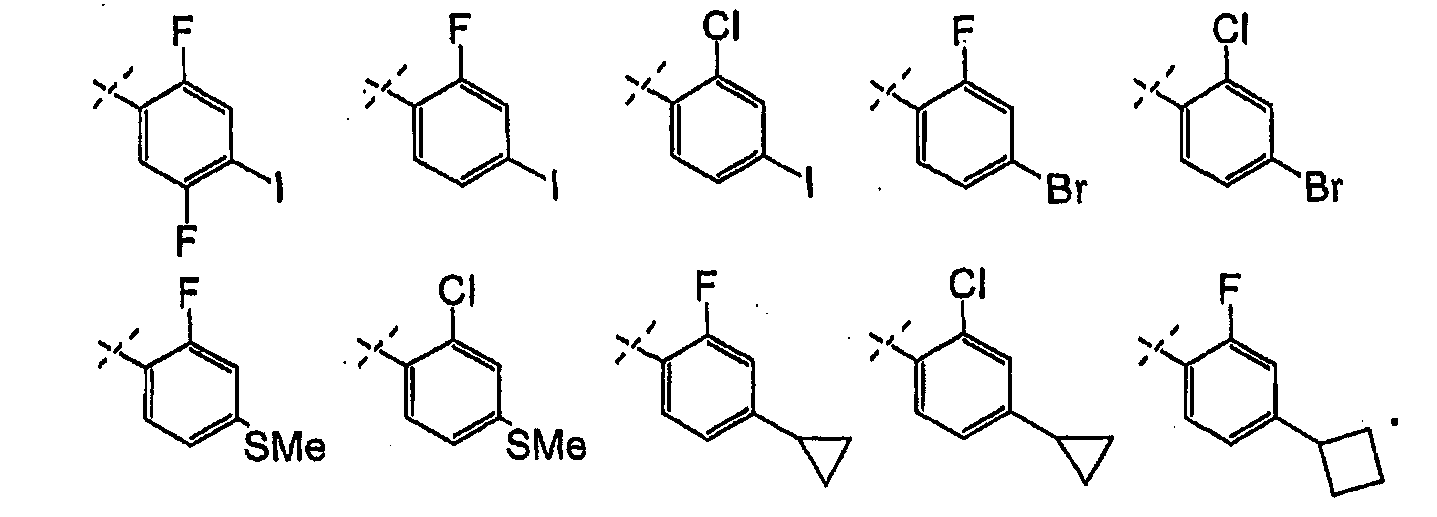
Анилины общей формулы (XXXI), используемые в раскрытых выше реакциях перекрестного сочетания, можно получить, используя раскрытые в литературе способы или в соответствии со схемой 6.
Схема 6
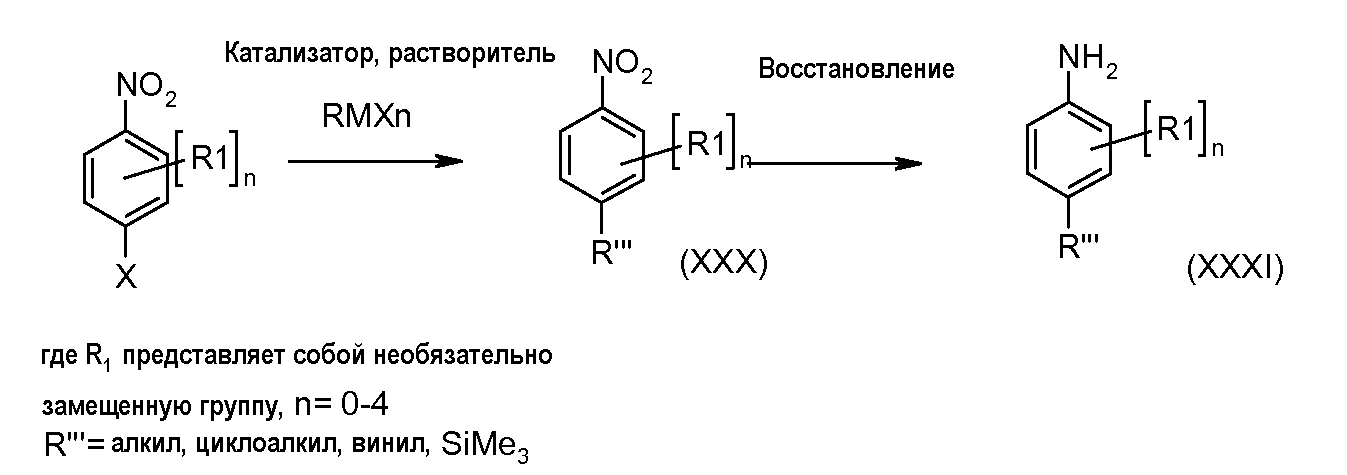
Замещенный 1-хлор-4-нитробензол можно подвергнуть взаимодействию с металлическим RMXn, таким как циклопропилбороновая кислота или гексаметилдисилазан, в растворителе, таком как ксилол, используя катализатор, такой как тетракис(трифенилфосфин)палладий, при температуре от комнатной температуры до температуры кипения с обратным холодильником, получая соединения формулы (XXX). Нитрогруппу можно восстановить, используя раскрытые в литературе способы, такие как осуществление реакции в атмосфере водорода при давлении от 1 до 5 атмосфер, в присутствии катализатора, такого как палладий-на-угле, и в растворителе, таком как этанол или этилацетат, при комнатной температуре, получая соединения формулы (XXXI).
Альтернативно, анилины формулы (LV) можно получить в соответствии со схемой 7.
Схема 7
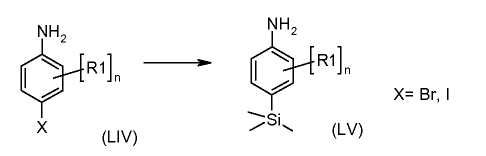
4-Бром- или иодо-анилины формулы (LIV) можно подвергнуть взаимодействию с, по меньшей мере, 2 эквивалентами сильного металлорганического основания, такого как н-бутиллитий, в растворителе, таком как ТГФ, при температуре от -100°C до -20°C с последующим гашением промежуточных ариллитиевых соединений электрофилом, таким как триметилсилилхлорид, получая соединения формулы (LV).
Должно быть понятно, что в тех случаях, когда существуют соответствующие функциональные группы, соединения формулы (I) или любые промежуточные соединения, используемые при их получении, можно далее дериватизировать, используя один или более из стандартных способов синтеза, используя реакции замещения, окисления, восстановления или расщепления. Конкретные схемы замещения включают обычные методики алкилирования, арилирования, гетероарилирования, ацилирования, сульфонилирования, галогенирования, нитрования, формилирования и сочетания.
Например, группы арилбромида или арилхлорида можно превратить в арилиодиды, используя реакцию Финкельштейна, используя источник иодида, такой как иодид натрия, катализатор, такой как иодид меди, и лиганд, такой как транс-N,N'-диметил-1,2-циклогександиамин, в растворителе, таком как 1,4-диоксан, и нагревая полученную реакционную смесь при температуре кипения с обратным холодильником. Арилтриалкилсиланы можно превратить в арилиодиды, обрабатывая силан источником иодида, таким как монохлорид йода в растворителе, таком как дихлорметан, с кислотой Льюиса или без нее, такой как тетрафторборат серебра, при температуре от -40°C до температуры кипения с обратным холодильником.
В другом примере группы первичного амина (-NH2) можно алкилировать, с помощью процесса восстановительного алкилирования, используя альдегид или кетон и боргидрид, например, триацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например 1,2-дихлорэтан, или спирт, такой как этанол, и при необходимости в присутствии кислоты, такой как уксусная кислота, при температуре окружающей среды. Группы вторичного амина (-NH-) можно алкилировать аналогичным способом, используя альдегид.
В следующем примере группы первичного амина или вторичного амина можно превратить в амидные группы (-NHCOR' или -NRCOR') путем ацилирования. Ацилирование можно осуществить, используя реакцию с соответствующим хлорангидридом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, или осуществляя реакцию с соответствующей карбоновой кислотой в присутствии подходящего связывающего агента, такого как HATU (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат) в подходящем растворителе, таком как дихлорметан. Аналогично, группы амина можно превратить в группы сульфонамида (-NHSO2R' или -NR”SO2R'), осуществляя реакцию с соответствующим сульфонилхлоридом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан. Группы первичного или вторичного амина можно превратить в группы мочевины (-NHCONR'R” или -NRCONR'R”), осуществляя реакцию с соответствующим изоцианатом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан.
Амин (-NH2) можно получить путем восстановления нитрогруппы (-NO2), например, каталитическим гидрированием, используя например водород, в присутствии металлического катализатора, например палладия, на такой подложке, как уголь, в растворителе, таком как этилацетат или спирт, например в метаноле. Альтернативно, указанную трансформацию можно осуществить, с помощью химического восстановления, используя, например металл, например, олово или железо, в присутствии кислоты, такой как хлористоводородная кислота.
В следующем примере группы амина (-CH2NH2) можно получить путем восстановления нитрилов (-CN), например, путем каталитического гидрирования, используя, например, водород в присутствии металлического катализатора, например палладия, на такой подложке как уголь, или никель Рэнея, в растворителе, таком как простой эфир, например циклический эфир, такой как тетрагидрофуран, при температуре от -78°C до температуры кипения с обратным холодильником растворителя.
В следующем примере, группы амина (-NH2) можно получить из групп карбоновой кислоты (-CO2H), используя превращение в соответствующий ацилазид (-CON3), перегруппировку Куртиса и гидролиз полученного изоцианата (-N=C=O).
Альдегидные группы (-CHO) можно превратить в группы амина (-CH2NR'R”)) путем восстановительного аминирования, используя амин и боргидрид, например трацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например дихлорметан, или спирт, такой как этанол, при необходимости в присутствии кислоты, такой как уксусная кислота, при температуре окружающей среды.
В следующем примере, альдегидные группы можно превратить в алкенильные группы (-CH=CHR'), используя реакцию Виттига или реакцию Водсворта-Эммонса (Wadsworth-Emmons), используя соответствующий фосфоран или фосфонат в стандартных условиях, известных специалистам в данной области.
Альдегидные группы можно получить путем восстановления сложноэфирных групп (таких как -CO2Et) или нитрилов (-CN), используя диизобутилалюминийгидрид в подходящем растворителе, таком как толуол. Альтернативно, альдегидные группы можно получить путем окисления спиртовых групп, используя любой подходящий окисляющий агент, известный специалистам в данной области.
Сложноэфирные группы (-CO2R') можно превратить в соответствующие кислотные группы (-CO2H), используя катализируемый кислотой гидролиз или катализируемый основанием гидролиз, в зависимости от природы R. Если R представляет собой трет-бутил, катализируемый кислотой гидролиз можно осуществить, например, путем обработки органической кислотой, такой как трифторуксусная кислота, в водном растворителе, или путем обработки неорганической кислотой, такой как хлористоводородная кислота, в водном растворителе.
Группы карбоновой кислоты (-CO2H) можно превратить в амиды (CONHR' или -CONR'R”), осуществляя реакцию с соответствующим амином в присутствии подходящего связывающего агента, такого, как HATU, в подходящем растворителе, таком как дихлорметан.
В следующем примере, можно получить гомологи карбоновых кислот по одному углероду (т.е. -CO2H до -CH2CO2H) путем превращения в соответствующий хлорангидрид (-COCl) с последующим синтезом Арндта-Эйстерта.
В следующем примере -OH группы можно получить из соответствующего сложного эфира (например -CO2R') или альдегида (-CHO) путем восстановления, используя например металл-гидридный комплекс, такой как литий алюминий гидрид в диэтиловом эфире или тетрагидрофуране, или боргидрид натрия в растворителе, таком как метанол. Альтернативно, спирт можно получить путем восстановления соответствующей кислоты (-CO2H), используя например литийалюминийгидрид в растворителе, таком как тетрагидрофуран, или используя боран в растворителе, таком как тетрагидрофуран.
Спиртовые группы можно превратить в отщепляемые группы, такие как атомы галогенов или сульфонилоксигруппы, такие как алкилсульфонилокси, например трифторметилсульфонилокси или арилсульфонилокси, например п-толуолсульфонилокси группа, используя условия, известные специалистам в данной области. Например, спирт можно подвергнуть взаимодействию с тионилхлоридом в галогенированном углеводороде (например, в дихлорметане), получая соответствующий хлорид. В указанной реакции можно также использовать основание (например, триэтиламин).
В другом примере, спиртовые, фенольные или амидные группы можно алкилировать, осуществляя реакцию сочетания фенола или амида со спиртом в растворителе, таком как тетрагидрофуран в присутствии фосфина, например, трифенилфосфина, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Альтернативно алкилирование можно осуществить путем депротонирования, используя подходящее основание, например, гидрид натрия, с последующим добавлением алкилирующего агента, такого как алкилгалогенид.
Ароматические галогенсодержащие заместители в соединениях можно подвергнуть обмену галоген-металл путем обработки основанием, например литиевым основанием, таким как н-бутил- или трет-бутиллитий, необязательно при низкой температуре, например при температуре около -78°C, в растворителе, таком как тетрагидрофуран, и затем погасить электрофильным реагентом для введения нужного заместителя. Так, например, формильную группу можно ввести, используя N,N-диметилформамид в качестве электрофила. Ароматические галогенсодержащие заместители можно альтернативно подвергнуть катализируемым металлом реакциям (например, используя палладий или медь) для введения, например, кислотных, сложноэфирных, циано, амидных, арильных, гетероарильных, алкенильных, алкинильных, тио- или амино- заместителей. Подходящие процедуры, которые можно использовать, включают те, что раскрыты Хеком, Сузуки, Стилле, Бухвальдом или Хартвигом.
Ароматические галогенсодержащие заместители могут также вступать в реакции нуклеофильного замещения с последующей реакцией с соответствующим нуклеофилом, таким как амин или спирт. Выгодно осуществлять такую реакцию при повышенной температуре под действием микроволнового излучения.
Соединения настоящего изобретения тестируют по их способности ингибировать MEK активность и активацию (первичные анализы) и по их биологическому воздействию на растущие клетки (вторичные анализы), как раскрыто далее. Указанные соединения настоящего изобретения, обладающие величиной ИК50 менее чем 5 мкМ (более предпочтительно менее чем 0,1 мкМ, наиболее предпочтительно менее чем 0,01 мкМ) в анализе MEK активности примера 1, ИК50 менее чем 5 мкМ (более предпочтительно менее чем 1 мкМ, еще более предпочтительно менее чем 0,1 мкМ, наиболее предпочтительно менее чем 0,01 мкМ) в анализе активации MEK примера 3, EC50 менее чем 10 мкМ (более предпочтительно менее чем 1 мкМ, еще более предпочтительно менее чем 0,5 мкМ, наиболее предпочтительно менее чем 0,1 мкМ) в клеточном пролиферативном анализе примера 3, и/или EC50 менее чем 10 мкМ (более предпочтительно менее чем 1 мкМ, еще более предпочтительно менее чем 0,5 мкМ, наиболее предпочтительно менее чем 0,1 мкМ) в анализе ERK фосфорилирования примера 4, можно использовать в качестве ингибиторов MEK.
Настоящее изобретение включает композицию (например, фармацевтическую композицию), включающую соединение формулы I (и/или его сольваты и/или соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также включает композицию (например, фармацевтическую композицию), включающую соединение формулы I (и/или его сольваты и/или соли) и носитель (фармацевтически приемлемый носитель), включающая далее второй химиотерапевтический и/или второй противовоспалительный агент, такой как раскрыты в рассматриваемом описании. Композиции настоящего изобретения можно использовать для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у млекопитающего (например, у человека). Композиции настоящего изобретения можно также использовать для лечения воспалительных заболеваний у млекопитающего (например, у человека).
Соединения и композиции настоящего изобретения можно также использовать для лечения автоиммунного заболевания, деструктивного разрушения костей, пролиферативного нарушения, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, у человека). Примеры таких заболеваний/нарушений включают, но ими не ограничиваются, диабет и диабетические осложнения, диабетическую ретинопатию, ретинопатию недоношенных, возрастную мышечную дегенерацию, гемангиому, идиопатический пульмонарный фиброз, ринит и атопический дерматит, болезни почек и почечную недостаточность, поликистозное заболевание почек, сердечную недостаточность с застойными явлениями, нейрофиброматоз, отторжение трансплантированных органов, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантированных органов, Болезнь Алцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как HIV, вирус гепатита (B) (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV). Термин хроническая боль для целей настоящего изобретения включает, но ими не ограничивается, идиопатическую боль и боль, связанную с хроническим алкоголизмом, дефицит витаминов, уремию, гипотироидизм, воспаления, артрит и послеоперационную боль. Невропатическая боль связана с множеством состояний, которые включают, но ими не ограничиваются, воспаление, послеоперационную боль, фантомную боль конечностей, боль при ожогах, подагру, тригеминальную невралгию, острую герпетическую и постгерпетическую боль, каузалгию, диабетическую невропатию, plexus avulsion, неврому, васкулит, вирусную инфекцию, повреждение с разможжением тканей, копрессионные поражения, повреждение тканей, ампутацию конечностей, боль при артритах и нервные поражения между периферической нервной системой и центральной нервной системой.
Соединения и композиции настоящего изобретения также можно использовать для лечения панкреатитов или болезней почек (включая пролиферативный гломерулонефрит и болезни почек, связанные с диабетом) у млекопитающего (например, у человека).
Соединения и композиции настоящего изобретения можно также использовать для профилактики бластоцитной имплантации у млекопитающего (например, у человека).
Настоящее изобретение включает способ ингибирования аномального клеточного роста или лечения гиперпролиферативного нарушения у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции. Также включен в настоящее изобретение способ лечения воспалительного заболевания у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции.
Настоящее изобретение включает способ ингибирования аномального клеточного роста или лечения гиперпролиферативного нарушения у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции, в сочетании со вторым химиотерапевтическим агентом, таким как те, что раскрыты в рассматриваемом описании. Настоящее изобретение также включает способ лечения воспалительного заболевания у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции, в сочетании со вторым противовоспалительным агентом, таким как те, что раскрыты в рассматриваемом описании.
Настоящее изобретение включает способ лечения автоиммунного заболевания, деструктивного разрушения костей, пролиферативных нарушений, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, и необязательно включающий далее второй терапевтический агент. Примеры таких заболеваний/нарушений включают, но ими не ограничиваются, диабет и диабетические осложнения, диабетическую ретинопатию, ретинопатию недоношенных, возрастную мышечную дегенерацию, гемангиому, идиопатический пульмонарный фиброз, ринит и атопический дерматит, болезни почек и почечную недостаточность, поликистозное заболевание почек, сердечную недостаточность с застойными явлениями, нейрофиброматоз, отторжение трансплантированных органов, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантированных органов, болезнь Алцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как HIV, вирус гепатита (B) (HBV), вирус папилломы человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV).
Настоящее изобретение включает способ лечения панкреатита или болезни почек (включая пролиферативный гломерулонефрит и вызванные диабетом заболевания почек) у млекопитающего (например, у человека), включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, и необязательно включающий далее второй терапевтический агент.
Настоящее изобретение включает способ предотвращения бластоцитной имплантации у млекопитающего (например, у человека) включающий введение указанному млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов или солей) или его композиции, и необязательно включающий далее второй терапевтический агент.
Настоящее изобретение включает способ применения соединения настоящего изобретения для in vitro, in situ и in vivo диагностики или лечения клеток или организмов млекопитающих или связанных с ними патологических состояний.
Считают также, что соединения настоящего изобретения могут сделать аномальные клетки более восприимчивыми к лечению с использованием облучения с целью умерщвления таких клеток и/или ингибирования роста таких клеток. Соответственно, настоящее изобретение относится далее к способу сенсибилизации аномальных клеток у млекопитающего (например, у человека) для лечения облучением, который включает введение указанному млекопитающему такого количества соединения формулы I (и/или его сольватов или солей) или его композиции, которое эффективно сенсибилизирует аномальные клетки для последующего лечения их облучением.
Введение соединений настоящего изобретения (здесь и далее "активное соединение (активные соединения)") можно осуществить любым способом, который обеспечит доставку указанных соединений в сайт их действия. Указанные способы включают пероральный, интрадуоденальный, парэнтеральный, (включая внутривенные, подкожные, внутримышечные, внутрисосудистые инъекции или вливания), наружный способы введения или ингаляции.
Количество вводимого активного соединения будет зависеть от подлежащего лечению субъекта, тяжести нарушения или состояния, скорости введения, предполагаемого места действия указанного соединения и усмотрения лечащего врача. Однако, эффективная доза находится в интервале от около 0,001 до около 100 мг на кг веса тела в день, предпочтительно от около 1 до около 35 мг/кг/день, в одной дозе или в разделенных дозах. Для человека весом 70 кг такое количество составит от около 0,05 до 7 г/день, предпочтительно, от около 0,05 до около 2,5 г/день. В некоторых случаях могут оказаться подходящими уровни доз выше или ниже указанных пределов, хотя в других случаях еще большие дозы можно использовать без вредного побочного эффекта, при условии, что такие большие дозы предварительно вначале разделяют на несколько небольших доз для введения в течение дня.
Активное соединение можно использовать как единственную терапию или в сочетании с одним или более из химиотерапевтических или противовоспалительных агентов, например тех, что раскрыты в рассматриваемом описании. Такое совместное лечение можно обеспечить путем одновременного, последовательного, раздельного введения индивидууму компонентов лечения.
Указанная фармацевтическая композиция может быть, например, в форме пригодной для перорального введения, такой как таблетки, капсулы, пилюли, порошки, композиции с замедленным выделением, растворы, суспензии, в форме препаратов для парэнтеральных инъекций в виде стерильных растворов, суспензий или эмульсий, препаратов для наружного применения в виде мазей или кремов, или препаратов для ректального введения в виде суппозитороев. Фармацевтическая композиция может быть в единичных дозовых формах для однократного введения точной дозы. Фармацевтические композиции включают обычный фармацевтический носитель или эксципиент и соединение в соответствии с настоящим изобретением в качестве активного ингредиента. Кроме того, они могут включать другие медицинские или фармацевтические агенты, носители, вспомогательные вещества и т.д.
Примеры форм для парэнтерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например, в водных растворах пропиленгликоля или декстрозы. Такие дозовые формы могут быть при желании соответствующим образом буферированы.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Указанные фармацевтические композиции могут при желании содержать дополнительные ингредиенты, такие как вкусовые агенты, связующие, эксципиенты и т.д. Так, для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, можно использовать вместе с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты и связующие агенты, такие как сахароза, желатин и акация. Для целей таблетирования часто можно использовать дополнительные смазывающие агенты, такие как стеарат магния, натрийлаурилсульфат и тальк. Твердые композиции аналогичного типа можно также использовать, заполняя ими мягкие или твердые желатиновые капсулы. Поэтому предпочтительные материалы включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Если для перорального введения желательны водные суспензии или эликсиры, активное соединение в них можно скомбинировать с различными подсластителями или вкусовыми агентами, окрашивающими веществами или красителями и, при желании, эмульгирующими агентами или суспендирующими агентами вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Способы получения различных фармацевтических композиций, содержащих конкретные количества активных соединений, известны или будут понятны специалистам в указанной области. Примеры можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Company, Ester, Pa., 15.sup.th Edition (1975).
ПРИМЕРЫ
Сокращения
|
|
Общие условия экспериментов
1H ЯМР спектры записаны при комнатной температуре на спектрометре Varian Unity Inova (400 МГц) с 5 мм датчиком с тройным резонансом. Химические сдвиги выражены в миллионных долях относительно тетраметилсилана. Были использованы следующие сокращения: br=широкий сигнал, s=синглет, d=дублет, dd=дублет дублетов, t=триплет, q=квартет, m=мультиплет.
Эксперименты по Высокоэффективной жидкостной хроматографии-Масс-спектрометрии (ЖХМС) для определения времен удерживания (RT) и соответствующих ионных масс осуществляют, используя один из следующих способов.
Способ A: эксперименты осуществляют на масс-спектрометре Waters Micromass ZQ quadrupole, связанном с системой жидкостной хроматографии Hewlett Packard HP1100 LC с диодным детектором в виде матрицы. В этой системе используют колонку Higgins Clipeus 5 микрон C18 100×3,0 мм и скорость потока 1 мл/мин. Исходная система растворителя состоит на 95% из воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B) в течение первой минуты с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 14 минут. Конечная система растворителя поддерживается постоянной в течение следующих 5 минут.
Способ B: Эксперименты осуществляют на масс-пектрометре Waters Platform LC quadrupole связанном с системой жидкостной хроматографии Hewlett Packard HP1100 LC с диодным детектором в виде матрицы и 100 позиционным автоматическим пробоотборником, используя колонку Phenomenex Luna C18(2) 30×4,6 мм и при скорости потока 2 мл/мин. Исходная система растворителя состоит на 95% из воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B) в течение первых 0,5 минут с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 4 минут. Конечная система растворителя поддерживается постоянной в течение следующих 0,5 минут.
Микроволновые эксперименты осуществляют, используя прибор Personal Chemistry Emrys Iniatiator™ или Optimizer™, в котором используется одномодовый резонатор и тьюнинг динамического поля, причем оба обеспечивают воспроизводимость и контроль. Имеется возможность изменять температуру в диапазоне 40-250°C, и давление вплоть до 20 бар.
ПРИМЕР 1 MEK анализ (анализ активности MEK)
Конститутивно активированные человеческие мутантные MEK1, экспрессированные в клетках насекомых, используют в качестве источника ферментативной активности в киназном анализе в конечной концентрации 15 нМ.
Указанный анализ осуществляют в течение 30 минут в присутствии 50 мкМ ATP, используя рекомбинантные GST-ERK1, полученные в E.Coli в качестве субстрата. Фосфорилирование субстрата детектируют и определяют количественно, используя HTRF реагенты, поставляемые Cisbio. Указанные реагенты состоят из анти-GST антител, конъюгированных с аллофикоцианином (XL665) и анти-фосфо (Thr202/Tyr204) ERK антител, конъюгированных с европий-криптатом. Реагенты используют в конечной концентрации 4 мкг/мл и 0,84 мкг/мл соответственно. Анти-фосфо антитела распознают ERK1 двойственно фосфорилированные на Thr202 и Tyr204. Когда оба антитела связаны с ERK1 (то есть, когда субстрат фосфорилирован), перенос энергии с криптата на аллофикоцианин происходит после возбуждения на длине волны 340 нм, что приводит к возникновению флуоресценции, которая пропорциональна количеству образующегося фосфорилированного субстрата. Флуоресценцию определяют, используя многолуночный флуориметр.
Соединения разбавляют в ДМСО перед добавлением в аналитический буфер, и конечная концентрация ДМСО в указанном анализе составляет 1%.
Величину ИК50 определяют как концентрацию, при которой рассматриваемое соединение обеспечивает 50% ингибирования от контроля. Значения ИК50 рассчитывают, используя пакет программного обеспечения XLfit (версия 2.0.5).
Соединения примеров 5-14 демонстрируют значения ИК50 менее чем 1 мкМ в анализе, представленном в примере 1.
ПРИМЕР 2 bRaf анализ (анализ активации MEK)
Конститутивно активированные bRaf мутанты экспрессированные в клетках насекомых используют в качестве источника ферментативной активности.
Указанный анализ осуществляют в течение 30 минут в присутствии 200 мкМ ATP, используя рекомбинантные GST-MEK1, продуцированные в E.Coli в качестве субстрата. Фосфорилирование субстрата детектируют и количественно определяют, используя HTRF и реагенты, поставляемые Cisbio. Указанные реагенты состоят из анти-GST антител, конъюгированных с аллофикоцианином (XL665), и анти-фосфо (Ser217/Ser221) MEK антител, конъюгированных с европий-криптатом. Анти-фосфо антитела распознают MEK двойственно фосфорилированные на Ser217 и Ser221 или единично фосфорилированные на Ser217. Когда оба антитела связаны с MEK (то есть когда субстрат фосфорилирован), перенос энергии с криптата на аллофикоцианин происходит после возбуждения на длине волны 340 нм, что приводит к возникновению флуоресценции, которая пропорциональна количеству образующегося фосфорилированного субстрата. Флуоресценцию детектируют, используя многолуночный флуориметр.
Соединения разбавляют в ДМСО перед добавлением к аналитическому буферу, и конечная концентрация ДМСО в указанном анализе составляет 1%.
Величину ИК50 определяют как концентрацию, при которой рассматриваемое соединение обеспечивает 50% ингибирования от контроля. Значения ИК50 рассчитывают, используя пакет программного обеспечения XLfit (версия 2.0.5).
ПРИМЕР 3 Анализ клеточной пролиферации
Соединения тестируют в клеточном пролиферативном анализе, используя следующие клеточные линии:
HCT116 колоректальная карцинома человека (ATCC)
A375 злокачественная меланома человека (ATCC)
Обе клеточные линии поддерживают в DMEM/F12 (1:1) среде (Gibco), дополненной 10% FCS при 37°C во влажном инкубаторе с 5% CO2.
Клетки высевают в 96-ячееные планшеты в количестве 2000 клеток/лунку и через 24 часа их экспонируют различным концентрациям соединений в 0,83% ДМСО. Клетки культивируют еще в течение 72 часов и в каждую лунку добавляют равные объемы CellTiter-Glo реагента (Promega). Это вызывает лизис клеток и приводит к возникновению сигнала люминесценции, который пропорционален количеству выделившегося ATP (и, следовательно, пропорционален количеству клеток в лунке), которое можно детектировать, используя многолуночный люминометр.
Величину ЭК50 определяют как концентрацию, при которой рассматриваемое соединение обеспечивает 50% ингибирования от контрольного значения. Величины ИК50 рассчитывают, используя пакет программного обеспечения XLfit (версия 2.0.5).
В этом анализе соединения заголовков примеров 5-11 и 13-14 демонстрируют величины ЭК50 менее чем 10 мкМ для обеих клеточных линий. Соединение заголовка примера 12 демонстрирует величину ЭК50 менее чем 0,1 мкМ для HCT116 клеточной линии.
ПРИМЕР 4 Анализ на базе фосфо-ERK клеток
Соединения тестируют, применяя ELISA для фосфо-ERK клеток, используя следующие клеточные линии:
HCT116 колоректальная карцинома человека (ATCC)
A375 злокачественная меланома человека (ATCC)
Обе клеточные линии поддерживают в DMEM/F12 (1:1) среде (Gibco), дополненной 10% FCS при 37°C во влажном инкубаторе с 5% CO2.
Клетки высевают в 96-ячеченые планшеты в количестве 2000 клеток/лунку и через 24 часа их экспонируют различным концентрациям соединений в 0,83% ДМСО. Клетки культивируют еще в течение 2 часов или 24 часов, фиксируют формальдегидом (конечная концентрация 2%) и permeabilised метанолом. После блокирования TBST-3% BSA, фиксированные клетки инкубируют с первичным антителом (анти-фосфо ERK от кролика) в течение ночи при 4°C. Клетки инкубируют с пропидийиодидом (флуоресцентный краситель ДНК) и определение клеточных p-ERK осуществляют, используя анти-кролиьчье вторичное антитело, конъюгированное с флуоресциентным красителем Alexa Fluor 488 dye (Molecular probes). Флуоресценцию анализируют, используя Acumen Explorer (TTP Labtech), лазерный сканирующий микропланшетный цитометр, и полученный Alexa Fluor 488 сигнал нормализуют до PI сигнала (пропорционального числу клеток).
Величину ЭК50 определяют как концентрацию, при которой величина сигнала рассматриваемого соединения соответствует половине расстояния от базовой линии до максимальной величины реакции. Величины ЭК50 рассчитывают, используя пакет программного обеспечения XLfit (версия 2.0.5).
В этом анализе соединения заголовков примеров 5-11 и 13-14 демонстрируют величины ЭК50 менее чем 0,2 мкМ для обеих клеточных линий. Соединение заголовка примера 12 демонстрирует величину ЭК50 менее чем 0,2 мкМ для HCT116 клеточной линии.
СИНТЕЗ ИМИДАЗО[1,5-a]ПИРИДИНОВ
Метиловый эфир 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты
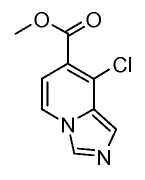
Стадия 1: 2,3-дихлоризоникотиновая кислота
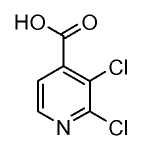
К раствору диизопропиламина (7,0 мл, 50 ммоль) в безводном ТГФ (100 мл) при -25°C добавляют 1,6 M раствор nBuLi в гексанах (31 мл, 50 ммоль) по каплям в инертной атмосфере. Полученную реакционную смесь затем охлаждают до -78°C и добавляют 2,3-дихлорпиридин. Полученную реакционную смесь перемешивают при -78°C в течение 3 часов, затем выливают на твердый диоксид углерода и выдерживают в течение 18 часов при комнатной температуре. Полученную смесь разбавляют водой (100 мл) и промывают диэтиловым эфиром (3×40 мл), затем охлаждают до 0°C, подкисляют концентрированной HCl (примерно 5 мл) и экстрагируют диэтиловым эфиром (3×50 мл). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение в виде твердого вещества белого цвета (7,7 г, 80%). 1H ЯМР (d6-ДМСО, 400 МГц) 8,49 (д, J=5,0 Гц, 1H), 7,72 (д, J=5,0 Гц, 1H).
Стадия 2: Метиловый эфир 2,3-дихлоризоникотиновой кислоты
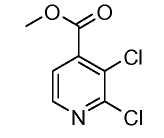
К суспензии 2,3-дихлоризоникотиновой кислоты (7,7 г, 40 ммоль) в дихлорметане (45 мл) добавляют ДМФ (0,1 мл) и оксалилхлорид (17,5 мл, 200 ммоль). Полученную реакционную смесь перемешивают при комнатной температуре в течение 18 часов, и затем концентрируют при пониженном давлении. Полученный остаток азеотропно перегоняют с толуолом, затем охлаждают до 0°C и растворяют в метаноле (135 мл). Полученную смесь оставляют нагреваться до комнатной температуры, и затем концентрируют при пониженном давлении, получая остаток. Полученный остаток растворяют в этилацетате, и полученный раствор промывают насыщенным раствором бикарбоната натрия, водой и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение в виде бесцветного масла, которое кристаллизуется при стоянии (7,9 г, 96%). 1H ЯМР (CDCl3, 400 МГц) 8,38 (д, J=5,0 Гц, 1H), 7,52 (д, J=5,0 Гц, 1H), 3,99 (с, 3H).
Стадия 3: Метиловый эфир 3-хлор-2-цианоизоникотиновой кислоты
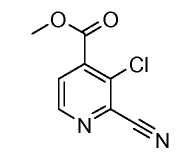
В микроволновую ампулу загружают метиловый эфир 2,3-дихлоризоникотиновой кислоты (7,6 г, 36,9 ммоль), цианид цинка (4,75 г, 40,6 ммоль), тетракис(трифенилфосфин)палладий (1,0 г, 0,9 ммоль) и ДМФ (37 мл), затем герметизируют, откачивают и снова заполняют азотом. Осуществляют микроволновое облучение реакционного раствора, его нагревают при 190°C в течение 20 минут, затем фильтруют через слой Celite ®, который затем промывают этилацетатом. Полученную смесь промывают водой, затем насыщенным раствором бикарбоната натрия, затем солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают на хроматографической колонке, (Si-PPC, градиент от 0% до 100%, этилацетат в циклогексане), получая указанное в заголовке соединение в виде твердого вещества белого цвета (3,1 г, 43%). 1H ЯМР (CDCl3, 400 МГц) 8,70 (д, J=5,0 Гц, 1H), 7,87 (д, J=5,0 Гц, 1H), 4,01 (с, 3H).
Стадия 4: Метиловый эфир 3-хлор-2-формиламинометилизоникотиновой кислоты
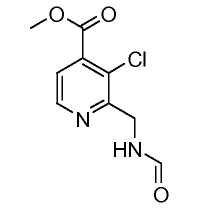
Смесь метилового эфира 3-хлор-2-цианоизоникотиновой кислоты (2,9 г, 14,8 ммоль) и 10% палладий-на-угле (293 мг) в уксусной кислоте (65 мл) дегазируют и снова заполняют водородом трижды. Полученную реакционную смесь перемешивают при комнатной температуре в атмосфере водорода (1 бар) в течение 18 часов и затем фильтруют. Полученный фильтрат концентрируют при пониженном давлении, получая остаток который растворяют в метаноле и помещают в 50 г картридж Isolute® SCX-2, элюируют метанолом, а затем 2M раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют при пониженном давлении, получая остаток. Полученный остаток растворяют в смеси муравьиной кислоты (40 мл) и уксусного ангидрида (8 мл), и перемешивают при комнатной температуре в течение 30 минут. Растворители удаляют при пониженном давлении, получая остаток, который растворяют в дихлорметане. Полученный раствор промывают насыщенным раствором бикарбоната натрия, водный слой выделяют и экстрагируют дважды дихлормтаном. Объединенные органические экстракты пропускают через фазовый разделитель и концентрируют при пониженном давлении, получая остаток, который обрабатывают на хроматографической колонке, получая (Si-PPC, градиент от 0% до 10%, метанол в дихлорметане). Указанное в заголовке соединение получают в виде твердого вещества белого цвета (1,5 г, 44%). ЖХМС (способ B): RT=2,15 мин, [M+H]+=229.
Стадия 5: Метиловый эфир 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты
Смесь метилового эфира 3-хлор-2-формиламинометилизоникотиновой кислоты (1,5 г, 6,6 ммоль) и хлорокиси фосфора (1,3 мл, 14,2 ммоль) в толуоле (80 мл) перемешивают при 90°C в течение 15 минут, затем охлаждают до комнатной температуры и концентрируют при пониженном давлении. Полученный остаток разделяют между этилацетатом и насыщенным раствором бикарбонатом натрия. Полученный органический слой выделяют и промывают водой и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (1,3 г, 93%). ЖХМС (способ B): RT=2,38 мин, [M+H]+=211.
8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновая кислота
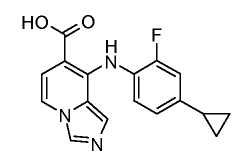
Стадия 1: Метиловый эфир 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
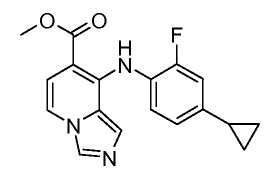
Суспензию метилового эфира 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты (105 мг, 0,50 ммоль), 4-циклопропил-2-фторанилина (101 мг, 0,60 ммоль), Pd2dba3 (18 мг, 0,02 ммоль), 2-дициклогексилфосфино-2',6'-диизопропоксибифенила (37 мг, 0,08 ммоль) и K3PO4 (148 мг, 0,70 ммоль) в толуоле (2 мл) дегазируют и нагревают при 100°C в течение 24 час. Полученную реакционную смесь затем охлаждают до комнатной температуры и разбавляют этилацетатом. Полученный раствор промывают водой и солевым раствором, затем помещают в 10 г картридж Isolute® SCX-2, который элюируют метанолом и затем 2M раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют. Полученный остаток обрабатывают на хроматографической колонке (Si-PPC, градиент от 0% до 10%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде масла желтого цвета (68 мг, 42%). ЖХМС (способ B): RT=3,45 мин, [M+H]+=326.
Стадия 2: 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновая кислота
Суспензию метилового эфира 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (0,28 г, 0,86 ммоль) и 1M NaOH (1,03 мл, 1,03 ммоль) в IMS (5 мл) нагревают при 65°C в течение 5 час. Полученную реакционную смесь затем охлаждают до комнатной температуры и добавляют 1M HCl, чтобы довести величину pH до 2. Образовавшийся осадок отфильтровывают и сушат в пистолете для сушки при 40°C в течение 18 часов, получая указанное в заголовке соединение в виде твердого вещества кремового цвета (0,22 г, 81%). ЖХМС (способ B): RT=2,84 мин, [M+H]+=312.
ПРИМЕР 5: Амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
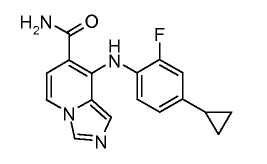
К раствору метилового эфира 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (23 мг, 0,07 ммоль) в IMS (1,0 мл) добавляют 1,0 M водный раствор гидроксида натрия (0,10 мл, 0,10 ммоль). Полученную реакционную смесь нагревают до 65°C в течение 1 часа, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем растворяют в ДМФ (1 мл). Последовательно добавляют аммонийхлорид (7 мг, 0,13 ммоль), N-N-диизопропилэтиламин (47 мкл, 0,27 ммоль) и HATU (51 мг, 0,13 ммоль), перед тем, как полученную реакционную смесь перемешивают в течение 18 час при комнатной температуре. Полученную реакционную смесь затем разбавляют метанолом и помещают в картридж Isolute® SCX-2 (5 г). Затем картридж промывают метанолом, и нужный продукт элюируют, используя 2M NH3 в MeOH. Элюент собирают и концентрируют, получая остаток. Полученный остаток обрабатывают с помощью флэш-хроматографии (Si-PPC, градиент от 0% до 5%, метанол в дихлорметане) получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (5 мг, 23%). ЖХМС (способ A): RT=6,64 мин, [M+H]+=311. 1H ЯМР (CD3OD) 8,18 (1H, д, J=0,88 Гц), 7,64 (1H, дд, J=7,40, 0,97 Гц), 7,13 (1H, т, J=8,28 Гц), 6,93-6,86 (3H, м), 6,35 (1Н, с), 1,98-1,90 (1Н, м), 1,05-0,97 (2Н, м), 0,73-0,68 (2Н, м).
ПРИМЕР 6: 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (2-гидроксиэтокси)амид
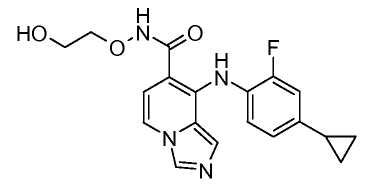
Стадия 1: (2-винилоксиэтокси)амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
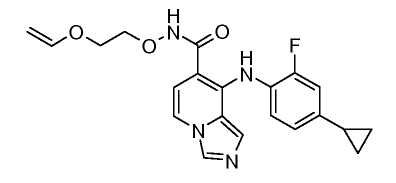
К раствору метилового эфира 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (68 мг, 0,21 ммоль) в IMS (2,5 мл) добавляют 1,0M водный раствор гидроксида натрия (0,25 мл, 0,25 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 1 часа, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в ТГФ (4 мл). Последовательно добавляют O-(2-винилоксиэтил)гидроксиламин (43 мг, 0,42 ммоль), N-N-диизопропилэтиламин (0,14 мл, 0,84 ммоль), EDCI (81 мг, 0,42 ммоль) и HOBt (57 мг, 0,42 ммоль), перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем разбавляют этилацетатом и промывают водой, насыщенным водным раствором бикарбоната натрия и солевым раствором перед тем, как сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают с помощью флэш-хроматографии (Si-PPC, градиент от 0% до 5%, метанол в дихлорметане), получая указанное в заголовке соединение в виде масла бледно желтого цвета (56 мг, 67%). ЖХМС (способ B): RT=3,02 мин, [M+H]+=397.
Стадия 2: (2-гидроксиэтокси)амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-винилоксиэтокси)амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (56 мг, 0,14 ммоль) растворяют в метаноле и помещают в картридж Isolute® SCX-2 (5 г). Картридж затем промывают метанолом и нужный продукт элюируют, используя 2M NH3 в MeOH. Элюент собирают и концентрируют, получая остаток. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 20%, метанол в дихлорметане), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (37 мг, 71%). ЖХМС (способ A): RT=6,40 мин, [M+H]+=371. 1H ЯМР (CH3OH-d4): 8,20 (1H, д, J=0,71 Гц), 7,67-7,65 (1H, м), 7,17-7,11 (1H, м), 6,94-6,87 (2H, м), 6,73 (1Н, д, J=7,38 Гц), 6,39 (1H, с), 4,00-3,97 (2H, м), 3,75-3,72 (2H, м), 1,98-1,89 (1H, м), 1,04-0,98 (2H, м), 0,73-0,68 (2H, м).
ПРИМЕР 7: (2-гидроксиэтокси)амид 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
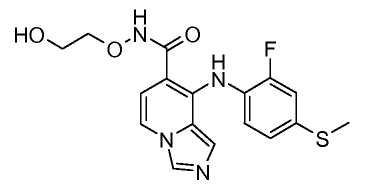
Стадия 1: метиловый эфир 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
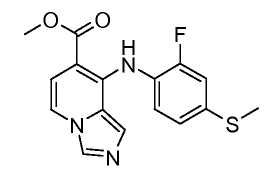
Суспензию метилового эфира 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты (223 мг, 1,06 ммоль), 2-фтор-4-метилсульфанилфениламина (200 мг, 1,27 ммоль), Pd2dba3 (39 мг, 0,04 ммоль), 2-дициклогексилфосфино-2',6'-диизопропоксибифенила (79 мг, 0,17 ммоль) и K3PO4 (315 мг, 1,48 ммоль) в толуоле (4 мл) дегазируют и затем нагревают при 100°C в течение 18 часов. Полученную реакционную смесь затем охлаждают до комнатной температуры и разбавляют этилацетатом. Полученную смесь промывают водой затем солевым раствором, перед тем, как помещают в 10 г картридж Isolute® SCX-2, который элюируют метанолом, и затем 2M раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют в вакууме, получая остаток. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 10%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде масла желтого цвета (136 мг, 39%). ЖХМС (способ B): RT=3,26 мин, [M+H]+=332.
Стадия 2: (2-винилоксиэтокси)амид 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
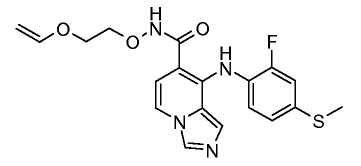
К раствору метилового эфира 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (136 мг, 0,41 ммоль) в IMS (10 мл) добавляют 1,0 M водный раствор гидроксида натрия (0,82 мл, 0,82 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 1 часа, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в ТГФ (10 мл). Последовательно добавляют O-(2-винилоксиэтил)гидроксиламин (84 мг, 0,82 ммоль), N-N-диизопропилэтиламин (0,28 мл, 1,64 ммоль), EDCI (157 мг, 0,82 ммоль) и HOBt (111 мг, 0,82 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем разбавляют этилацетатом и промывают водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Полученный остаток обрабатывают на хроматографической колонке (Si-PPC, градиент от 0% до 100%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде масла бледно желтого цвета (160 мг, 97%). ЖХМС (способ B): RT=2,91 мин, [M+H]+=403.
Стадия 3: (2-гидроксиэтокси)амид 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-винилоксиэтокси)амид 8-(2-фтор-4-метилсульфанилфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (160 мг, 0,40 ммоль) растворяют в метаноле и помещают в картридж Isolute® SCX-2 (10 г). Затем картридж промывают метанолом, и нужный продукт затем элюируют, используя 2M NH3 в MeOH. Элюент собирают и концентрируют, получая остаток, который обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 10%, метанол в дихлорметане), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (77 мг, 51%). ЖХМС (способ A): RT=5,96 мин, [M+H]+=377. 1H ЯМР (ДМСО-d6) 11,54 (1H, с), 10,51 (1H, с), 8,29 (1H, д, J=0,80 Гц), 7,80 (1H, дд, J=7,37, 0,94 Гц), 7,24-7,16 (2H, м), 7,06 (1H, дд, J=8,38, 2,11 Гц), 6,80-6,74 (1H, м), 6,39 (1H, с), 4,70 (1H, с), 3,86 (2H, т, J=4,95 Гц), 3,57 (2H, т, J=4,95 Гц), 2,49 (3H, с).
ПРИМЕР 8: (2-гидроксиэтокси)амид 8-(2-фтор-4-иодофениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
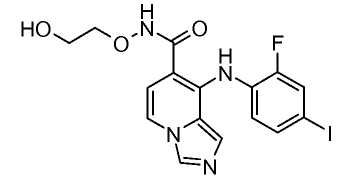
Стадия 1: Метиловый эфир 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
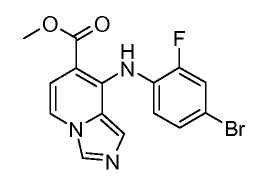
Суспензию метилового эфира 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты (500 мг, 2,38 ммоль), 4-бром-2-фторанилина (543 мг, 2,86 ммоль), Pd2dba3 (110 мг, 0,12 ммоль), 2-дициклогексилфосфино-2',6'-диизопропоксибифенила (224 мг, 0,48 ммоль) и K3PO4 (710 мг, 3,33 ммоль) в толуоле (10 мл) дегазируют и затем нагревают при 100°C в течение 18 часов. Полученную реакционную смесь затем охлаждают до комнатной температуры, разбавляют этилацетатом и фильтруют. Полученный фильтрат промывают водой и солевым раствором, затем помещают в 10 г картридж Isolute® SCX-2, который элюируют метанолом и затем 2M раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 20%, этилацетат в DCM), получая указанное в заголовке соединение в виде масла желтого цвета (240 мг, 28%). ЖХМС (способ B): RT=3,40 мин, [M+H]+=364/366.
Стадия 2: Метиловый эфир 8-(2-фтор-4-иодофениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
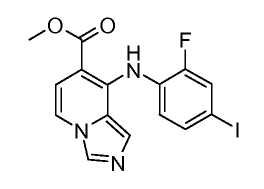
Смесь метилового эфира 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (235 мг, 0,65 ммоль), иодида меди (I) (6 мг, 0,03 ммоль), иодида натрия (195 мг, 1,3 ммоль) и транс-N,N'-диметил-1,2-циклогександиамина (0.01 мл, 0,06 ммоль) в 1,4-диоксане (1,0 мл) нагревают при 110°C в течение 26 часов в атмосфере аргона. Полученную реакционную смесь охлаждают до комнатной температуры, разбавляют метанолом и помещают в картридж Isolute® SCX-2 (10 г). Затем картридж промывают метанолом, и нужный продукт элюируют, используя 2M NH3 в MeOH. Элюент собирают и концентрируют, получая остаток. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 20%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (182 мг, 67%). ЖХМС (способ B): RT=3,45 мин, [M+H]+=412.
Стадия 3: (2-винилоксиэтокси)амид 8-(2-фтор-4-иодофениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
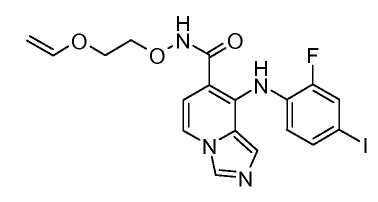
К раствору метилового эфира 8-(2-фтор-4-иодофениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (200 мг, 0,49 ммоль) в IMS (10 мл) добавляют 1,0 M водный раствор гидроксида натрия (1,0 мл, 1,0 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 2 часов и затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в ТГФ (10 мл). Затем последовательно добавляют O-(2-винилоксиэтил)гидроксиламин (103 мг, 1,0 ммоль), N-N-диизопропилэтиламин (0,34 мл, 1,96 ммоль), EDCI (192 мг, 1,0 ммоль) и HOBt (135 мг, 1,0 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем разбавляют этилацетатом и промывают водой, насыщенным водным раствором бикарбоната натрия и затем солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 100%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде масла бледно желтого цвета (151 мг, 64%). ЖХМС (способ B): RT=3,05 мин, [M+H]+=483.
Стадия 4: (2-гидроксиэтокси)амид 8-(2-фтор-4-иодо-фениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-винилоксиэтокси)амид 8-(2-фтор-4-иодо-фениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (151 мг, 0,31 ммоль) растворяют в метаноле и помещают в картридж Isolute® SCX-2 (10 г). Затем картридж промывают метанолом, и нужный продукт элюируют, используя 2M NH3 в MeOH. Соответствующие фракции объединяют и концентрируют, получая остаток, который обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 10%, метанол в дихлорметане), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (115 мг, 81%). ЖХМС (способ A): RT=6,36 мин, [M+H]+=457. 1H NMR (CD3OD): 8,27 (1H, д, J=0,85 Гц), 7,80-7,77 (1H, м), 7,57-7,53 (1H, м), 7,49-7,46 (1H, м), 6,95 (1H, т, J=8,48 Гц), 6,76 (1H, д, J=7,37 Гц), 6,68 (1H, с), 4,00-3,94 (2H, м), 3,75-3,71 (2H,м).
ПРИМЕР 9: ((S)-2-гидроксипропокси)амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
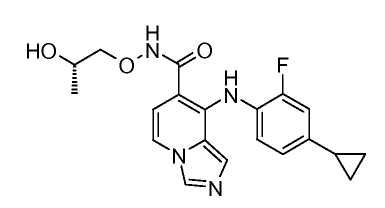
Суспензию 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (0,11 г, 0,35 ммоль), EDCI (0,081 г, 0,42 ммоль), HOBt (0,057 г, 0,42 ммоль), DIPEA (0,085 мл, 0,88 ммоль) и гидрохлорида (S)-1-аминооксипропан-2-ола (0,05 г, 0,39 ммоль) в ДМФ (1,5 мл) перемешивают при комнатной температуре в течение 18 часов. Полученную реакционную смесь разделяют между DCM (5 мл) и насыщенным водным раствором NaHCO3 (5 мл). Полученный органический слой промывают водой (5 мл), затем солевым раствором (5 мл), затем сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% to 60%, этилацетат в DCM), получая липкое твердое вещество желтого цвета, которое затем обрабатывают с помощью препаративной ВЭЖХ (Gemini колонка 5 микрон C18 250 x 21,20 мм, 0,1% муравьиная кислота, градиент ацетонитрил/вода, от 5 до 98%, время вывода установки в рабочий режим 20 минут), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (38 мг, 27%). ЖХМС (способ A): RT=6,87 мин, [M+H]+=385. 1H ЯМР (ДМСО-d6) 10,54 (1H, с), 8,27 (1H, с), 7,76 (1H, дд, J=7,37, 0,93 Гц), 7,14 (1H, т, J=8,37 Гц), 6,98 (1H, дд, J=11,87, 1,95 Гц), 6,95-6,89 (1H, м), 6,76 (1H, д, J=7,33 Гц), 6,27 (1H, с), 3,89-3,79 (1H, м), 3,72-3,62 (2H, м), 1,99-1,90 (1H, м), 1,04 (3H, д, J=6,34 Гц), 0,99-0,93 (2H, м), 0,76-0,67 (2H, м),
ПРИМЕР 10: (2-гидрокси-1,1-диметилэтокси)амид 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
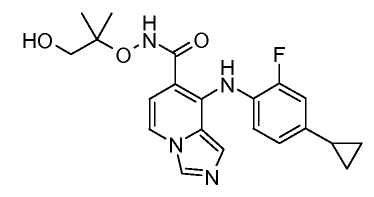
Суспензию 8-(4-циклопропил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (0,11 г, 0,35 ммоль), EDCI (0,081 г, 0,42 ммоль), HOBt (0,057 г, 0,42 ммоль), DIPEA (0,085 мл, 0,88 ммоль) и гидрохлорида 2-аминоокси-2-метилпропан-1-ола (0,055г, 0,39 ммоль) в ДМФ (1,5 мл) перемешивают при комнатной температуре в течение 18 часов. Полученную реакционную смесь разделяют между DCM (5 мл) и насыщенным водным NaHCO3 (5 мл). Полученный органический слой промывают водой (5 мл), затем солевым раствором (5 мл), затем сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 40%, этилацетат в DCM), получая твердое вещество желтого цвета, которое очищают далее, используя препаративную ВЭЖХ (Gemini колонка 5 микрон C18 250×21,20 мм, 0,1% муравьиная кислота, градиент ацетонитрил/вода, от 5 до 98%, время вывода установки в рабочий режим 20 минут), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (11 мг, 8%). ЖХМС (способ A): RT=7,57 мин, [M+H]+=399. 1Н NMR (ДМСО-d6): 10,37 (1H, с), 8,28 (1H, с), 7,79 (1H, дд, J=7,35, 0,95 Гц), 7,14 (1H, с), 7,02-6,93 (1H, м), 6,91 (1H, д, J=8,28 Гц), 6,82 (1H, с), 6,27 (1H, с), 1,99-1,90 (1H, м), 1,15 (6H, с), 0,99-0,92 (2H, м), 0,73-0,67 (2H, м).
ПРИМЕР 11: (2-гидроксиэтокси)амид 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
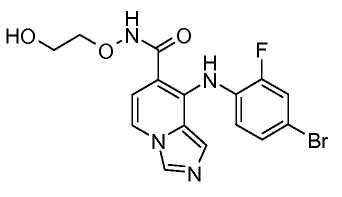
Стадия 1: (2-винилоксиэтокси)амид 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
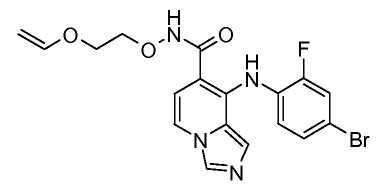
К раствору метилового эфира 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (50 мг, 0,14 ммоль) в IMS (3 мл) добавляют 1,0M водный раствор гидроксида натрия (0,3 мл, 0,3 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 2 часов, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в ТГФ (3 мл). Затем последовательно добавляют O-(2-винилоксиэтил)гидроксиламин (29 мг, 0,28 ммоль), N-N-диизопропилэтиламин (0,10 мл, 0,56 ммоль), EDCI (54 мг, 0,28 ммоль) и HOBt (38 мг, 0,28 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем разбавляют этилацетатом и промывают водой, затем насыщенным водным раствором бикарбоната натрия и солевым раствором. Полученный органический слой выделяют, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 100%, этилацетат в дихлорметане), получая указанное в заголовке соединение в виде масла бледно желтого цвета (40 мг, 65%). ЖХМС (способ B): RT=2,98 мин, [M+H]+=435/437.
Стадия 2: (2-гидроксиэтокси)амид 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-винилоксиэтокси)амид 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (40 мг, 0,09 ммоль) растворяют в метаноле и помещают в картридж Isolute® SCX-2 (5 г). Затем картридж промывают метанолом, и нужный продукт затем элюируют, используя 2M NH3 в MeOH. Соответствующие фракции объединяют и концентрируют, получая остаток, который обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 20%, метанол в дихлорметане), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (11 мг, 29%). ЖХМС (способ A): RT=6,06 мин, [M+H]+=409/411. 1H ЯМР (CD3OD): 8,27 (1H, д, J=0,85 Гц), 7,79 (1H, дд, J=7,39, 0,97 Гц), 7,42 (1H, дд, J=10,00, 2,19 Гц), 7,31 (1H, ддд, J=8,53, 2,20, 1,19 Гц), 7,12 (1H, т, J=8,60 Гц), 6,79-6,73 (1H, м), 6,65 (1H, с), 3,97 (2H, т, J=4,69 Гц), 3,73 (2H, т, J=4,68 Гц).
ПРИМЕР 12: 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты ((S)-2-гидрокси-пропокси)амид
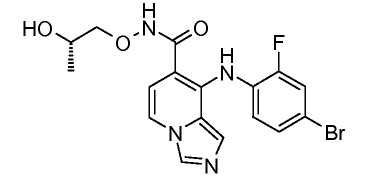
К раствору метилового эфира 8-(4-бром-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (587 мг, 1,61 ммоль) в IMS (20 мл) добавляют 1,0M водный раствор гидроксида натрия (1,7 мл, 1,7 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 2 часов, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в диоксане (15 мл). Затем добавляют EDCI (614 мг, 3,2 ммоль) и HOBt (432 мг, 3,2 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Затем последовательно добавляют гидрохлорид (S)-1-аминооксипропан-2-ола (408 мг, 3,20 ммоль) и N-N-диизопропилэтиламин (1,1 мл, 6,44 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем концентрируют при пониженном давлении. Полученный остаток переносят в этилацетат, затем промывают водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент с 0% до 10%, метанол в дихлорметане). Соответствующие фракции объединяют и концентрируют, получая остаток, который обрабатывают, используя ВЭЖХ (Gemini колонка 5 микрон C18 250×21,20 мм, 0,1% муравьиная кислота, ацетонитрил в воде, градиент от 5% до 85%, время вывода установки в рабочий режим 20 минут), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (180 мг, 26%). ЖХМС (способ A): RT=6,55 мин, [M+H]+=423/425. 1H ЯМР (CДCl3): 10,46 (1H, с), 8,75 (1H, с), 7,99 (1H, с), 7,39 (1H, д, J=7,36 Гц), 7,32 (1H, дд, J=9,31, 2,15 Гц), 7,28 (1H, д, J=8,83 Гц), 7,12 (1H, т, J=8,38 Гц), 6,63 (1H, с), 6,46 (1H, д, J=7,33 Гц), 4,10-4,01 (1H, м), 3,93 (1H, дд, J=11,43, 2,28 Гц), 3,70 (1H, т, J=10,42 Гц), 1,14 (3H, д, J=6,47 Гц).
ПРИМЕР 13: (2-гидроксиэтокси)амид 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
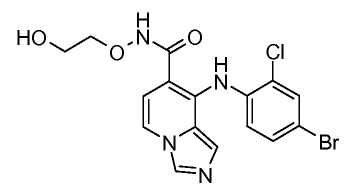
Стадия 1: метиловый эфир 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
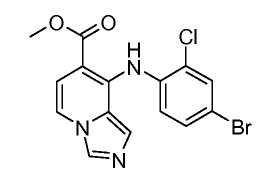
Суспензию метилового эфира 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты (300 мг, 1,43 ммоль), 4-бром-2-хлоранилина (354 мг, 1,72 ммоль), Pd2dba3 (65 мг, 0,07 ммоль), 2-дициклогексилфосфино-2',6'-диизопропоксибифенила (131 мг, 0,28 ммоль) и K3PO4 (424 мг, 2,00 ммоль) в толуоле (5 мл) дегазируют и затем нагревают при 110°C в течение 18 часов. Полученную реакционную смесь затем охлаждают до комнатной температуры и разбавляют этилацетатом. Полученную смесь промывают водой и солевым раствором, затем помещают в 10 г картридж Isolute® SCX-2, который элюируют метанолом и затем 2M раствором аммиака в метаноле. Соответствующие фракции объединяют и концентрируют в вакууме. Полученный остаток обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 100%, этилацетат в DCM), получая указанное в заголовке соединение в виде масла желтого цвета (271 мг, 50%). ЖХМС (способ B): RT=3,65 мин, [M+H]+=381/383.
Стадия 2: (2-винилоксиэтокси)амид 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
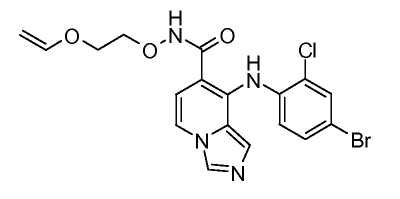
К раствору метилового эфира 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (271 мг, 0,71 ммоль) в IMS (10 мл) добавляют 1,0 M водный раствор гидроксида натрия (0,8 мл, 0,8 ммоль). Полученную реакционную смесь нагревают при 65°C в течение 1 часа, затем охлаждают до комнатной температуры и концентрируют в вакууме. Полученный остаток азеотропно перегоняют с толуолом, и затем суспендируют в ТГФ (10 мл). Затем последовательно добавляют O-(2-винилоксиэтил)гидроксиламин (89 мг, 0,87 ммоль), N-N-диизопропилэтиламин (0,30 мл, 1,73 ммоль), EDCI (166 мг, 0,87 ммоль) и HOBt (117 мг, 0,87 ммоль) перед тем, как полученную реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Полученную реакционную смесь затем разбавляют этилацетатом и промывают водой, насыщенным водным раствором бикарбоната натрия и затем солевым раствором. Выделенный органический слой сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (210 мг, 65%). ЖХМС (способ B): RT=3,17 мин, [M+H]+=451/453.
Стадия 3: (2-гидроксиэтокси)амид 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-Винилоксиэтокси)амид 8-(4-бром-2-хлорфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (196 мг, 0,43 ммоль) растворяют в метаноле и помещают в картридж Isolute® SCX-2 (10 г). Затем картридж промывают метанолом, и затем нужный продукт элюируют, используя 2M NH3 в MeOH. Соответствующие фракции объединяют и концентрируют, получая остаток, который обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 10%, метанол в дихлорметане). Соответствующие фракции объединяют и концентрируют, получая остаток, который обрабатывают, используя ВЭЖХ (Препаративная колонка C18, 0,1% муравьиная кислота, ацетонитрил в воде, градиент от 5% до 98%, время вывода установки в рабочий режим 20 минут), получая указанное в заголовке соединение в виде твердого вещества бледно желтого цвета (43 мг, 23%). ЖХМС (способ A): RT=6,71 мин, [M+H]+=425/427. 1H ЯМР (ДМСО-d6): 11,68 (1H, с), 10,46 (1H, с), 8,35 (1H, д, J=0,79 Гц), 7,95 (1H, д, J=7,36 Гц), 7,78 (1H, д, J=2,27 Гц), 7,42 (1H, дд, J=8,62, 2,29 Гц), 7,01 (1H, д, J=8,63 Гц), 6,79 (1H, д, J=7,35 Гц), 6,56 (1H, с), 4,69 (1H, с), 3,87 (2H, т, J=4,89 Гц), 3,57 (2H, м).
ПРИМЕР 14: (2-гидроксиэтокси)амид 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
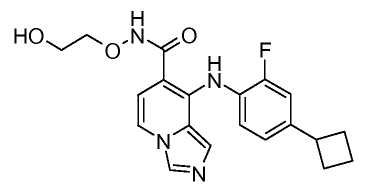
Стадия 1: 4-циклобутил-2-фторнитробензол
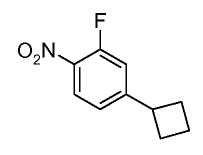
Раствор 3-фтор-4-нитрофенилового эфира трифторметансульфоновой кислоты (1,8 г, 6,2 ммоль), циклобутилбороновой кислоты (0,78 г, 7,5 ммоль), Pd(dppf)Cl2 (0,40 г, 0,5 ммоль), и 2M водного карбоната цезия (aq) (5 мл, 9,9 ммоль) в толуоле (10 мл) дегазируют аргоном в течение 10 минут и нагревают при 90°C в течение 2,5 час. Полученную реакционную смесь затем охлаждают до комнатной температуры и фильтруют через hyflo®. Полученную реакционную смесь разделяют между этилацетатом (70 мл) и водой (70 мл). Полученный органический слой выделяют, затем промывают солевым раствором (50 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученныое твердое вещество обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 30%, DCM в пентане), получая указанное в заголовке соединение в виде жидкости желтого цвета (0,504 г, 42%). 1H ЯМР (ДМSO-d6): 8,08 (1H, т, J=8,3 Гц), 7,44 (1H, д, J=13,2 Гц), 7,28 (1H, д, J=8,5 Гц), 3,65 (1H, м), 2,33 (2H, м), 2,13 (2H, м), 1,99 (1H, м), 1,84 (1H, м).
Стадия 2: 4-циклобутил-2-фторанилин
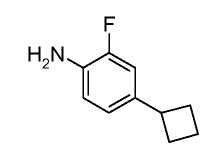
Раствор 4-циклобутил-2-фторнитробензола (0,5 г, 2,6 ммоль) в IMS (5 мл) дегазируют аргоном в течение 2 минут, перед тем, как добавляют 10% Pd/C (0,05 г), и присоединяют баллон с водородом. Полученную смесь перемешивают в течение 18 часов при комнатной температуре, перед тем, как продувают азотом и фильтруют через hyflo®. Полученный фильтрат концентрируют в вакууме, получая указанное в заголовке соединение в виде масла оранжево/красного цвета (0,31 г, 74%). 1H ЯМР (CDCl3): 6,84 (1H, д, J=12,3 Гц), 6,77 (1H, д, J=8,1 Гц), 6,70 (1H, т, J=9,1 Гц), 3,58 (2H, шир.), 3,42 (1H, м), 2,28 (2H, м), 2,01 (3H, м), 1,82 (1H, м).
Стадия 3: метиловый эфир 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
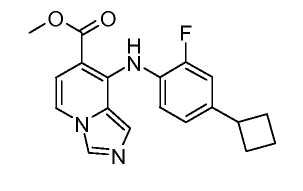
Суспензию метилового эфира 8-хлоримидазо[1,5-a]пиридин-7-карбоновой кислоты (250 мг, 1,2 ммоль), 4-циклобутил-2-фторанилина (230 мг, 1,4 ммоль), Pd2dba3 (43 мг, 0,047 ммоль), 2-дициклогексилфосфино-2',6'-диметокси-1,1'-бифенила (80 мг, 0,19 ммоль) и K3PO4 (350 мг, 1,7 ммоль) в толуоле (5 мл) дегазируют аргоном в течение 10 минут и затем нагревают при 100°C в течение 18 часов. Полученную реакционную смесь затем охлаждают до комнатной температуры и фильтруют через hyflo®. Полученный фильтрат концентрируют в вакууме, и полученную смолу обрабатывают, используя флэш-хроматографию (Si-PPC, элюируя 5% этилацетатом в DCM), получая указанное в заголовке соединение в виде масла желтого цвета (150 мг, 38%). 1H ЯМР (CDCl3): 7,95 (1H, c), 7,73 (1H, д, J=7,4 Гц), 7,23 (1H, т, J=8,6 Гц), 7,07 (1H, д, J=7,3 Гц), 7,01 ( 2H, м), 6,50 (1H, с), 3,90 (3H, с), 3,59 (1H, м), 2,39 (2H, м), 2,17 (2H, м), 2,06 (1H, м), 1,93 (1H, м).
Стадия 4: 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновая кислота
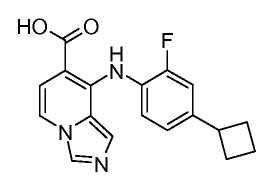
Суспензию метилового эфира 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (150 мг, 0,46 ммоль) и 1M NaOH (1,5 мл, 1,5 ммоль) в IMS (2 мл) нагревают при 60°C в течение 2 часов. Полученную реакционную смесь затем охлаждают до комнатной температуры, разбавляют водой и добавляют ледяную уксусную кислоту, чтобы довести величину pH до 4. Осадок отфильтровывают и сушат в пистолете для сушки при 40°C в течение 18 часов, получая указанное в заголовке соединение в виде твердого вещества кремового цвета (154 мг, 99%). 1H ЯМР (ДМСО-d6): 10,53 (1H, с), 8,34 (1H, с), 7,74 (1H, д, J=7,3 Гц), 7,35 (1H, т, J=8,3 Гц), 7,24 (1H, д, J=11,2 Гц), 7,13 (1H, д, J=8,1 Гц), 7,01 (1H, д, J=9,3 Гц), 6,23 (1H, с), 3,61 (1H, м), 2,38 (2H, м), 2,14 (2H, м), 1,99 (1H, м), 1,84(1H, м).
Стадия 5: (2-винилоксиэтокси)амид.8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
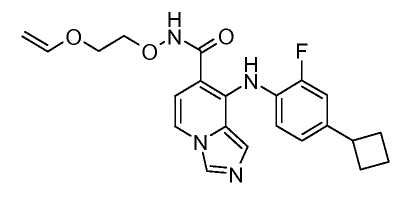
Суспензию 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (154 мг, 0,46 ммоль), EDCI (105 мг, 0,55 ммоль), HOBt (74 мг, 0,55 ммоль), DIPEA (0,19 мл, 1,14 ммоль) и O-(2-винилоксиэтил)гидроксиламины (52 мг, 0,50 ммоль) в ТГФ (2,5 мл) перемешивают при комнатной температуре в течение 18 часов. Полученную реакционную смесь разделяют между DCM (20 мл) и насыщенным водным NaHCO3. Полученный органический слой выделяют, затем промывают водой (20 мл), затем солевым раствором (20 мл), сушат (MgSO4), фильтруют и концентрируют в вакууме. Полученную смолу обрабатывают, используя флэш-хроматографию (Si-PPC, градиент от 0% до 100%, этилацетат в циклогексане), получая указанное в заголовке соединение в виде смолы коричневого цвета (149 мг, 80%). ЖХМС (способ B): RT=3,49 мин, [M+H]+=411.
Стадия 6: (2-гидроксиэтокси)амид 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты
(2-винилоксиэтокси)амид 8-(4-циклобутил-2-фторфениламино)имидазо[1,5-a]пиридин-7-карбоновой кислоты (149 мг, 0,36 ммоль) растворяют в метаноле (2 мл) и обрабатывают 1M HCl (1,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Растворители удаляют в вакууме, и полученный остаток очищают, используя препаративную ВЭЖХ (Gemini колонка 5 микрон C18 250×21,20 мм, 0,1% муравьиная кислота, градиент ацетонитрил/вода, от 5 до 98%, время вывода установки в рабочий режим 20 минут), получая указанное в заголовке соединение в виде твердого вещества желтого цвета (16 мг, 11%). ЖХМС (способ A): RT=7,40 мин, [M+H]+=385. 1H ЯМР (ДМСО-d6): 11,59 (1H, с), 10,60 (1H, с), 8,32 (1H, с), 7,82 (1H, д, J=7,7 Гц), 7,24 (1H, д, J=8,5 Гц), 7,15 (1H, д, J=11,2 Гц), 7,07 (1H, д, J=8,11 Гц), 6,79 (1H, д, J=7,3 Гц), 6,33 (1H, с), 4,73 (1H, с), 3,69 (2H, т, J=4,8 Гц), 3,61 (2H, т, J=5,0 Гц), 3,57 (1H, д, J=8,8 Гц), 2,36 (2H, м), 2,12 (2H, м), 1,96 (1H, м), 1,83 (1H, м).