Результат интеллектуальной деятельности: СПОСОБ ФЛУОРЕСЦЕНТНОГО МЕЧЕНИЯ кДНК ВИРУСА ГРИППА ТИПА А
Вид РИД
Изобретение
Изобретение относится к области молекулярной биологии и вирусологии и касается способа флуоресцентного мечения вирусной кДНК всех возможных подтипов вируса гриппа типа А с помощью единственной пары универсальных праймеров, в процессе реакции мультисегментной обратной транскрипции, совмещенной с реакцией амплификации, ПЦР (М-ОТ-ПЦР).
Вирусы гриппа типа А (ВГА) относятся к важным респираторным патогенам человека и животных, вызывающим как сезонные вспышки гриппа, так и периодические мировые пандемии (Philos Trans R Soc Lond В Biol Sci., 2001) [1]. ВГА отличается высокой степенью вариабельности, особенно это касается поверхностных гликопротеинов вириона: гемагглютинина (НА) и нейраминидазы (NA). На основе комбинации вариантов (подтипов) гемагглютинина (НА) и нейраминидазы (NA) определяется подтип вируса гриппа А. В настоящее время описано 16 подтипов НА и 9 подтипов NA. В популяции человека в основном циркулирует только 3 подтипа НА (H1, H2, Н3) и 2 подтипа NA (N1, N2), однако в последнее время все чаще выявляют случаи инфицирования людей новыми высокопатогенными штаммами ВГА, такими как H5N1, H7N7 и H9N2. Кроме того, реассортация вирусных сегментов может приводить к появлению совершенно новых вирусных вариантов, таких как, например, vH1N1 в 2009 году. Этим обусловлена постоянная необходимость в усовершенствовании методов быстрой диагностики существующих, а также появляющихся новых, подтипов ВГА для эффективного глобального надзора за гриппом. В настоящее время наиболее часто используемыми методами диагностики вируса гриппа являются ПЦР методы (методы на основе полимеразной цепной реакции): метод ПЦР с обратной транскрипцией (ОТ-ПЦР) и метод ОТ-ПЦР в режиме реального времени. В общем, ПЦР методы остаются основным диагностическим инструментом вследствие несложной постановки и надежности, но используемые в настоящее время методы субтипирования ВГА на основе ПЦР в основном являются узко специфическими и не дают информацию о других подтипах ВГА. В связи с этим в последние годы появился целый ряд работ по субтипированию ВГА на основе 16 подтипов НА и 9 подтипов NA ВГА с использованием диагностических биочипов. Технология биочипов показала хорошие результаты в области идентификации и типирования вирусов: биочипы позволяют одновременно выявлять большое количество нуклеотидных последовательностей. Основная проблема в использовании технологии биочипов связана с выбором метода получения меченой вирусной кДНК: для создания диагностического биочипа, позволяющего идентификацию и субтипирование всех известных на данный момент подтипов ВГА, необходима, в том числе, разработка унифицированного метода мечения кДНК генома любого из известных подтипов ВГА. В большинстве случаев для мечения используется флуоресцентная метка (Journal of Microbiological Methods, 2006) [2] или биотин (J Clin Microbiol. 2004; JOURNAL OF CLINICAL MICROBIOLOGY, 2009) [3, 4]. Это могут быть нуклеотиды, конъюгированные с меткой (например, флуоресцентным красителем, частицами золота, биотином и т.д.), которые встраиваются в ДНК последовательность, например, в процессе амплификации, или же метка может ковалентно связываться непосредственно с ДНК последовательностью химическими методами. Помимо флуоресцентных меток иногда используются радиоактивные метки. Так, встраивание 33Р или 35S-меченных нуклеотидов в кДНК проходит более эффективно и обеспечивает большую чувствительность, чем флуоресцентные метки. Однако методические сложности работы с радиоактивным материалом сильно ограничивают применимость таких методик (Microarray analysis Handbook) [5].
В патенте RU 2361924 [6] («Способ обнаружения вируса гриппа А подтипа H5N1») описан, в том числе, способ амплификации кДНК вируса гриппа типа А. Указанный способ амплификации предусматривает проведение реакции обратной транскрипции с РНК вируса, совмещенной с реакцией амплификации на два гена (гемагглютинина и нейраминидазы) и анализ реакционной смеси с помощью электрофореза в агарозном геле. Способ позволяет осуществлять одностадийную экспресс-идентификацию вируса гриппа А подтипа H5N1 с помощью совмещенной реакции обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) участков вирусного гена гемагглютинина и нейраминидазы. Способ включает в себя две основные реакции. Первая - это первая ОТ-ПЦР с праймерами, специфичными к участку гена гемагглютинина вируса гриппа А. Матрицей для этой реакции служит одноцепочечная РНК вируса гриппа, а затравкой - праймеры F-H5, состоящий из 20 звеньев: ACAAGGTCCGACTACAGCTT, и R-H5, состоящий из 22 звеньев: ATTGATTCCAATTTTACTCCAC. Вторая реакция - вторая ОТ-ПЦР с праймерами, специфичными к участку гена нейраминидазы. Матрицей для этой реакции служит одноцепочечная РНК вируса гриппа, а затравкой - праймеры F-N1, состоящий из 22 звеньев: CAGAACATTAATGAGTTGTCCT, и R-N1, состоящий из 22 звеньев: TCTCAGTATGTTGTTCCTCCAA. Реакции могут проводиться либо в двух ПЦР, либо в единой мультиплексной ПЦР, с идентификацией двух генных участков в одной реакции.
Данный способ методически близок к заявляемому, но его результатом является амплификация сегментов генома ВГА строго одного подтипа - H5N1 и не предусмотрено флуоресцентного мечения кДНК ВГА. Таким образом, вышеописанный способ является узко специфичным, позволяет обнаруживать только один подтип ВГА H5N1, при этом отсутствует информация о других подтипах ВГА.
Наиболее близким к заявляемому является способ флуоресцентного мечения кДНК ВГА, описанный в статье "Universal Oligonucleotide Microarray for Sub-Typing of Influenza A Virus", PLoS ONE, 2011 [7].
Способ заключается в следующем. Флуоресцентное мечение кДНК ВГА методом обратной транскрипцией и амплификации кДНК (ПЦР) осуществляется в несколько этапов: на первом этапе для получения кДНК гена нейраминидазы или гемагглютинина проводилась обратная транскрипция на матрице одноцепочечной вирусной РНК с использованием праймера GACTAATACGACTCACTATAGGGAGCAAAAGCAGG и обратной транскриптазы TermoScript (Invitrogen, Carlsbad, CA), перед добавлением фермента реакционная смесь прогревалась 10 минут при 60°С, затем добавлялась обратная транскриптаза, и смесь инкубировалась 5 минут при 55°С и 55 минут при 60°С. На следующем этапе, чтобы амплифицировать полноразмерные гены, проводилась реакция ПЦР с использованием Taq- полимеразы (QIAgen Hot Start Taq-polymerase) и следующих праймеров: NA_F1 и NA_R2 - для нейраминидазы, HA_F1 и HA_R2 - для гемагглютинина [7]. В качестве матрицы в реакцию добавляли кДНК, полученную на первом этапе. Дальнейшую амплификацию фрагментов кДНК с одновременным введением флуоресцентной метки осуществляли на заключительной стадии с использованием праймеров, специфичных для внутренней области гена нейраминидазы или гемагглютинина: NA_F1, NA_R1 и NA_F2, NA_R2 - для нейраминидазы, HA_F1, HA_R1 и HA_F2, HA_R2 - для гемагглютинина. В результате последовательного прохождения всех вышеуказанных этапов способа получали флуоресцентно меченные фрагменты кДНК гена нейраминидазы или гемагглютинина ВГА. Достоинством способа является то, что он позволяет субтипирование всех 16 известных подтипов НА или 9 подтипов NA ви руса гриппа типа А с использованием диагностического биочипа.
Данный способ обеспечивает флуоресцентное мечение кДНК только одного гена - нейраминидазы или гемагглютинина ВГА, но не обоих генов одновременно, в силу того, что используемые пары праймеров строго специфичны только к одному из анализируемых генов (гемагглютинина или нейраминидазы) и не могут быть использованы одновременно в одной реакции. Проведение реакции в несколько этапов и необходимость использовать последовательно нескольких наборов специфичных праймеров усложняет способ, повышает вероятность технических ошибок, увеличивает стоимость и время, необходимое для проведения реакции.
Задачей изобретения является разработка способа одностадийного флуоресцентного мечения кДНК одновременно для всех восьми сегментов вирусного генома для любого из известных подтипов ВГА (16 подтипов НА или 9 подтипов NA) человека и животных.
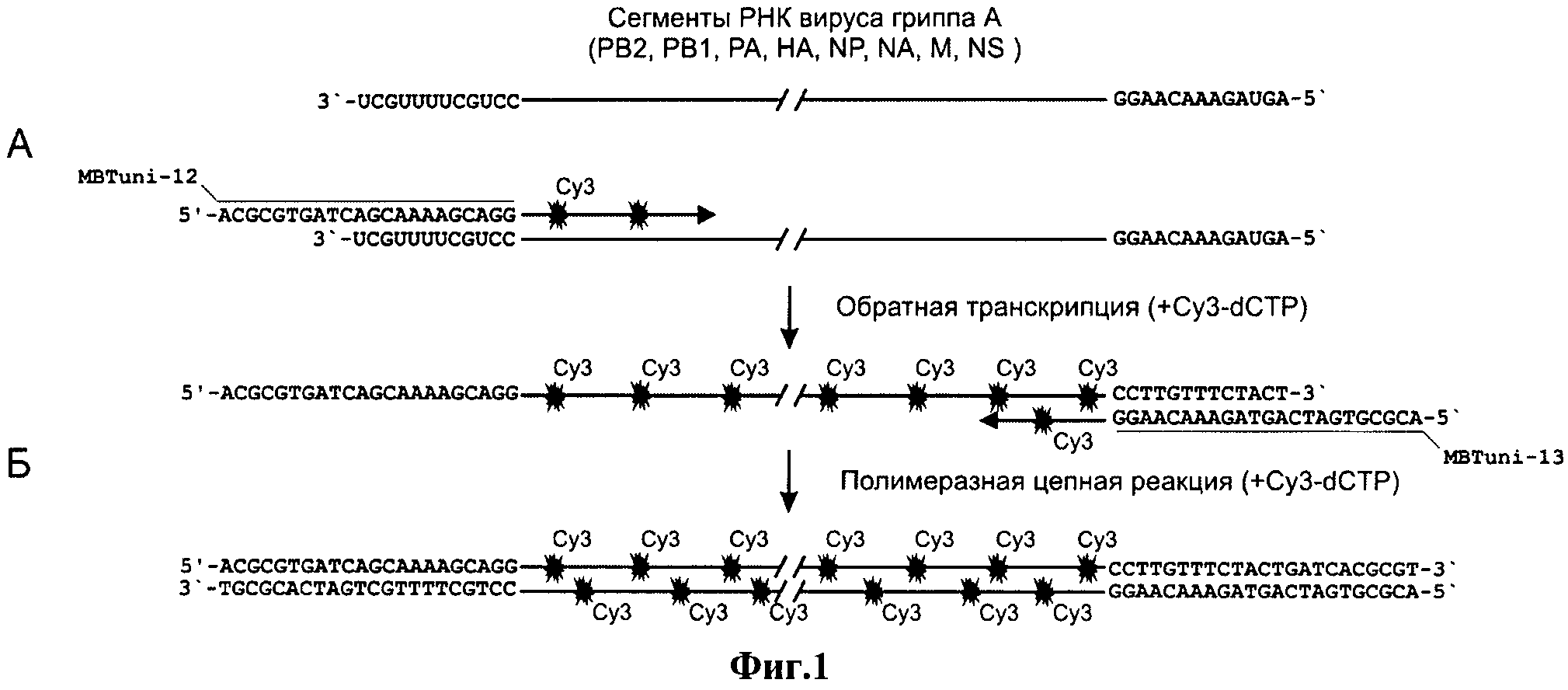
Поставленная задача решается тем, что в способе флуоресцентного мечения кДНК ВГА, включающем проведение реакции обратной транскрипции вирусной РНК и амплификации кДНК (ПЦР), новым является то, что проводят реакцию мультисегментной обратной транскрипции (М-ОТ) вирусной РНК, совмещая с реакцией амплификации кДНК, т.е. реакции проходят в один этап при помощи одной пары универсальных праймеров, подобранных к высококонсервативным областям, имеющимся во всех вирусных сегментах (MBTuni-12 5'-ACGCGTGATCAGCAAAAGCAGG-3' и MBTuni-13 5'-ACGCGTGATCAGTAGAAACAAGG-3'), в присутствии флуоресцентно меченных нуклеотидов. Матрицей для этой совмещенной реакции служит одноцепочечная РНК вируса гриппа из анализируемых биологических образцов. Качество полученной флуоресцентно меченной кДНК ВГА проверяют методом электрофореза в 1% агарозном геле, с визуализацией меченых кДНК сегментов генома ВГА при помощи цифровой системы изображений на длинах волн, соответствующих используемой флуоресцентной метке.
Заявляемый способ основан на экспериментально подобранных условиях для проведения совмещенной реакции М-ОТ-ПЦР с применением универсальных праймеров MBTuni12 и MBTuni13. Универсальные праймеры MBTuni12 и MBTuni13, которые были разработаны ранее для целей, не связанных с флуоресцентным мечением вирусной кДНК, а именно для амплификации полного генома ВГА с целью определения нуклеотидной последовательности методом секвенирования и дальнейшего использования полученных амплификатов для создания рекомбинантных вакцин против гриппа типа А (2009, J. Virol. 83(19): 10309-10313) [8]. Реакция проводится при одновременном добавлении в реакционную смесь флуоресцентно меченных нуклеотидов, что требовало подбора специальных условий для получения качественной флуоресцентно меченной кДНК ВГА.
На фиг.1 представлена схема, поясняющая способ, где представлены реакции мультисегментной обратной транскрипции (А.) и полимеразной цепной реакции (Б.), проводящиеся с помощью единственной пары универсальных праймеров, MBTuni12 и MBTuni13, в единой реакционной смеси.
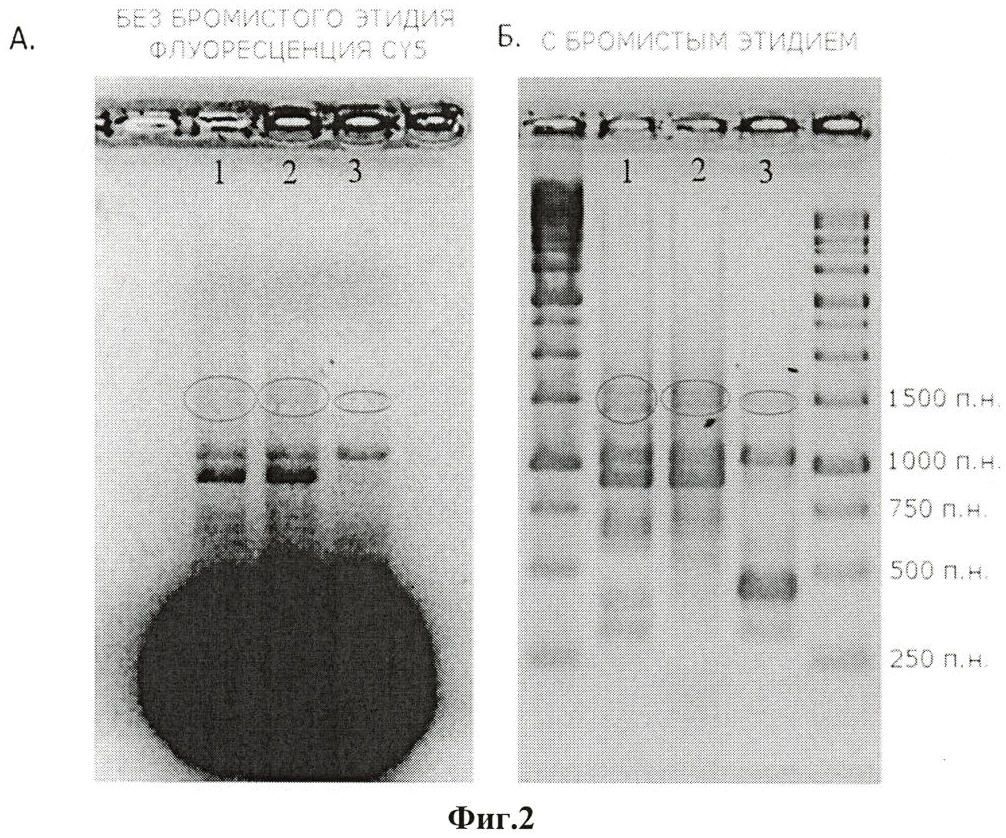
На фиг.2 представлены результаты проверки качества полученной флуоресцентно меченной кДНК ВГА (условия проверки приведены ниже). На панели А. показано электрофоретическое разделение флуоресцентно меченных продуктов М-ОТ-ПЦР (кДНК) в 1% агарозном геле, визуализация проводилась при помощи цифровой системы изображений KODAK Image Station при длине волны 646 нм, соответствующей использовавшейся метке Су5. На панели Б. представлен тот же агарозный гель, после окрашивания бромистым этидием. На обоих изображениях отмечены полосы, соответствующие кДНК НА, NP и NA сегментов вирусного генома.
Заявляемый способ заключается в следующем. Реакция мультисегментной обратной транскрипции (М-ОТ) и амплификации кДНК (ПЦР) в один этап при помощи одной пары универсальных праймеров подобранных к высококонсервативным областям, имеющимся во всех вирусных сегментах (MBTuni-12 5'-ACGCGTGATCAGCAAAAGCAGG-3' и MBTuni-13 5'-ACGCGTGATCAGTAGAAACAAGG-3'), матрицей для этой совмещенной реакции служит одноцепочечная РНК вируса гриппа из анализируемых биологических образцов. Флуоресцентное мечение пробы происходит путем прямого встраивания Су3-dCTP (или любого другого флуоресцентно меченного нуклеотида) непосредственно в процессе М-ОТ-ПЦР с использованием набора Superscript III One-Step Quantitative RT-PCR System (Invitrogen), реакционная смесь при этом дополнительно содержит 1 мкл lmM Су3-dCTP (или любого другого флуоресцентно меченного нуклеотида). Амплификацию проводят в термоциклере согласно подобранной программе.
Пример конкретной реализации.
В отдельной пробирке готовят общую реакционную смесь на N образцов, в число которых входят положительный и отрицательный контроли: на 50 мкл реакционной смеси, на один образец, берут 1 мкл смеси ферментов обратной транскриптазы/Taq полимеразы (SuperScriptIII RT /PlatinumR Taq Mix) из набора «SuperScript™ III One-Step RT-PCR Systems» производства компании Invitrogen, 25 мкл двукратной буферной смеси из того же набора, праймеры MBTuni12 и MBTuni13 в концентрации 20Е/мл - по 1,4 мкл каждого, 1 мкл ингибитора РНКаз RNaseOUT, РНК - 200-400 нг, добавляют 1 мкл 1 mM Су3-dCTP (или любой другой флуоресцентно меченный нуклеотид), объем реакции доводят до 50 мкл DEPC-обработанной водой. Смесь перемешивают и переносят в термоциклер и задают следующий температурный режим: Т=45°С в течение 60 мин, прогрев 2 минуты при Т=94°С, проводят 5 циклов полимеразной цепной реакции (ПЦР) в следующем температурном режиме: 30 сек Т=94°С, 30 сек Т=45°С, 3 мин Т=68°С, затем проводят еще 31 цикл ПЦР в следующих условиях: 30 сек Т=94°С, 30 сек Т=57°С, 3 мин Т=68°С. Способ проводится в термоциклере в одну стадию.
Качество полученной флуоресцентно меченной кДНК ВГА проверяется методом электрофореза в 1% агарозном геле, электрофорез проводят при напряжении 8 вольт/см длины геля, в течение 60 мин (фиг.2). Визуализацию флуоресцентно меченных кДНК сегментов генома ВГА осуществляют при помощи цифровой системы изображений KODAK Image Station на длинах волн, соответствующих используемой флуоресцентной метке. Положительными считают пробы, полосы в которых располагаются в геле на уровне полос, соответствующих восьми сегментам генома ВГА (см. фиг.2). Исследуемые пробы считают отрицательными, если в них не выявлено никаких полос или полосы не соответствуют по размеру сегментам генома ВГА (т.е. располагаются на другом расстоянии от старта).
Предложенный способ флуоресцентного мечения кДНК ВГА методом мультисегментного одностадийного М-ОТ-ПЦР позволяет проводить быстрое получение флуоресцентно меченных амплификатов вирусной кДНК для всех сегментов вирусного генома. Использование данного способа существенно уменьшает время, необходимое для проведения детекциии и субтипирования ВГА на диагностических биочипах в анализируемых образцах. Проведение мечения в один этап в одной реакционной смеси упрощает процедуру мечения и сокращает количество необходимого расходного материала, что снижает финансовые затраты. В то же время, благодаря использованию универсальных праймеров MBTuni-12 и MBTuni-13, с помощью которых в одних условиях возможна наработка амплификатов всех возможных субтипов ВГА, метод позволяет субтипирование фактически любого подтипа ВГА, т.е. сохраняются достоинства, описанные в прототипе. Способ разработан и проверен в ФГБУ «Научно-исследовательский институт гриппа» Министерства здравоохранения и социального развития Российской Федерации.