Результат интеллектуальной деятельности: МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ ВИРУСА ГРИППА В
Вид РИД
Изобретение
Изобретение относится к моноклональным антителам, специфичным к различным штаммам вируса гриппа В, в частности, полученным с помощью гибридомы, и могут быть использованы в диагностике, в частности, в диагностических тест-системах.
По оценкам ВОЗ ежегодные эпидемии сезонного гриппа приводят к 3–5 миллионам случаев тяжелой болезни и 250 000–500 000 случаев смерти во всем мире. Вирус гриппа легко передаётся от человека человеку воздушно-капельным путём при выделении инфицированными людьми мельчайших частиц во время кашля или чихания. Грипп имеет тенденцию быстро распространяться, вызывая сезонные эпидемии. Большинство инфицированных людей выздоравливает за одну-две недели без какого-либо лечения. Однако, для детей, пожилых людей и людей, страдающих серьёзными заболеваниями, грипп представляет опасность — он может привести к осложнениям основных заболеваний, развитию пневмонии и смерти (WHO, 2017).
Клинические симптомы гриппа часто неспецифичны, таким образом, болезнь может быть диагностирована с определённой точностью только лабораторными молекулярно-биологическими методами. Диагностические методы и подходы, которые могут быстро и точно обнаружить новые появляющиеся вирусные варианты, необходимы для быстрого начала антивирусной терапии во время сезонных и пандемических вспышек.
Основными причинами ОРВИ у детей и взрослых являются вирусы гриппа типов A, B и C; вирус парагриппа (ВПГ) типов 1, 2 и 3; респираторно-синцитиальный вирус (РСВ); аденовирус (АВ) и риновирус. Все упомянутые вирусы могут вызвать как инфекцию верхних, так и нижних дыхательных путей, кроме того имеют сходные клинические проявления и зачастую не могут быть различены без специальной лабораторной диагностики (Mahony et al., 2011).
Острые респираторные заболевания занимают ведущее место в структуре инфекционных болезней человека и обуславливают 20–50% временных потерь трудоспособности. Экономический ущерб от ОРЗ можно сравнить лишь с затратами на профилактику и лечение длительно текущих сердечно-сосудистых и онкологических заболеваний.
Наиболее важное место в развитии патологии дыхательных путей занимают вирусы гриппа и парагриппа, респираторно-синцитиальный вирус, аденовирусы.
В России ежегодно регистрируется около 50 миллионов случаев инфекционных заболеваний. До 95% из них приходится на острые респираторные вирусные инфекции, включая грипп (Карпова и др., 2012). Помимо вирусов гриппа в структуре заболеваемости ОРВИ достаточно высока роль возбудителей иной этиологии, среди которых более чем в 20% случаев выявляются РСВ, ВПГ и АВ (Соминина и др., 2012; Walter & Wunderink, 2017).
В большинстве случаев заболевания, вызванные этими патогенами, имеют благоприятное течение в виде заболеваний верхних дыхательных путей. Однако у части пациентов, особенно при наличии иммуносупрессии, а также у детей младшего возраста, эти вирусы вызывают осложнённое течение заболевания.
Так, по данным метаанализа исследований, проведённых в различных странах за 16 лет, среди детей в возрасте до 5 лет, госпитализированных с острыми заболеваниями нижних дыхательных путей (пневмониями, бронхитами и бронхиолитами), вирусы гриппа и парагриппа были выявлены в среднем в 7% и 6% случаев, соответственно. Аденовирусы детектировали у 9% пациентов. В дополнение к этому в 22% случаев были обнаружены смешанные инфекции с детекцией нескольких вышеназванных вирусов (Lukšić et al., 2013).
Дифференциальная диагностика респираторных инфекций необходима для осуществления надзора за заболеваемостью и назначения своевременной терапии, поскольку многие препараты эффективны только на ранних стадиях инфекции. Понимание истинной причины заболевания помогает избежать ненужного использования антибиотиков, которые часто назначают пациентам, инфицированным респираторными вирусами. Быстрое и достоверное обнаружение респираторных патогенов позволяет врачам избежать возникновения внутрибольничных заболеваний, а также прогнозировать возможные осложнения и иммунопатологические явления, которые могут возникнуть при этих инфекциях. Использование точных диагностических тестов даёт возможность клиницистам своевременно поставить диагноз и выявить группы риска. В диагностическом алгоритме должны быть использованы маркеры-индикаторы присоединения бактериальной инфекции. Своевременная дифференциальная диагностика вирусной и бактериальной инфекций особенно актуальна для детей при схожести симптоматики заболеваний, что может привести к неблагоприятному исходу, особенно в группах риска.
Использование при конструировании диагностических тест-систем моноклональных антител (МКА), специфичных к вирусам ОРЗ и гриппа, обеспечивает высокую чувствительность и специфичность анализа, а также необходимый уровень стандартизации препаратов.
Выбор мишеней, к которым должны быть направлены МКА, определяется представительством антигенных детерминант в составе самого вируса и в исследуемых клинических материалах, а также степенью консервативности/вариабельности сайтов-мишеней.
Вирусы гриппа и грипп
Вирусы гриппа относятся к семейству Ortomyxoviridae, геном которых представлен сегментированной однонитевой минус-РНК. Антигенные свойства внутренних белков вириона (мембранный белок M1 и нуклеопротеин NP) определяют принадлежность вирусов гриппа к роду А, В или С. Вирусы гриппа А подразделяются на субтипы в соответствии со структурой поверхностных гликопротеинов гемагглютинина (HA) и нейраминидазы (NA). В настоящее время известно 18 типов НА (НА1–НА18) и 11 типов NA (NA1–NA11). Вирусы гриппа В делятся на 2 антигенно отличные эволюционные линии — Ямагатскую и Викторианскую (Shaw & Palese, 2013).
Грипп является одним из наиболее распространённых инфекционных заболеваний со сложным патогенезом. По данным ВОЗ в мире ежегодно регистрируется около 500 млн случаев этого заболевания. В прошлом столетии от гриппа погибло более 100 млн человек. Смертность от гриппа составляет 2 млн человек, главным образом среди детей до 5 лет и людей старше 65 лет. Основными особенностями вирусов гриппа А являются их многообразие и изменчивость, которая реализуется путём мутаций, рекомбинаций и реассортации генов, что сопровождается изменением биологических свойств возбудителя. Следствием этого является отсутствие популяционного иммунитета к новому варианту вируса, что обуславливает его быстрое распространение в человеческой популяции, приводящее к эпидемиям и пандемиям.
В настоящее время наиболее эпидемиологически значимыми является грипп А(H3N2) и A(H1N1), а также грипп В, вызываемый вирусами обеих эволюционных линий. В большинстве случаев заболевание, вызванное эпидемическими вирусами гриппа, проходит без осложнений. Однако при возникновении антигенно отличных вирусов, к которым у большинства людей отсутствует иммунитет, резко увеличивается частота регистрации осложнённого течения инфекции, как это наблюдалось для вируса А(H1N1)pdm09, появившегося в человеческой популяции в 2009 г. и вызвавшего пандемию.
В связи со всем вышеизложенным существует необходимость создания чувствительных и быстрых методов, позволяющих диагностировать грипп А всех субтипов, а также грипп В вне зависимости от эволюционной линии.
Поверхностные гликопротеины вируса гриппа (НА и NA) характеризуются высокой вариабельностью. В этой связи полученные к ним МКА обладают субтиповой, а часто и штаммовой специфичностью, что делает их непригодными для использования при создании тест-систем с широким диагностическим диапазоном. NP (Nuclear Protein, нуклеопротеин) — структурный РНК-связанный белок кора вирусной частицы, является высококонсервативным и индуцирует образование кросс-протективного иммунитета к вирусам гриппа А различных субтипов (Ng et al., 2009; Hu et al., 2010). Это делает его идеальной мишенью для получения МКА широкого спектра реагирования. МКА, полученные к NP вируса гриппа В, также реагируют с вирусами обеих эволюционных линий.
Из предшествующего уровня техники известны моноклональные антитела против вируса гриппа В. Например, международная публикация WO2013114885A раскрывает человеческие антитела против вируса гриппа В, при этом моноклональное антитело содержит человеческое моноклональное антитело или гуманизированное антитело. Антитела направлены против штаммов B/Florida/4/2006, B/Shanghai/361/2002, B/Johannesburg/5/1999, B/Yamanashi/166/1998, B/Mie/1/1993, B/Malaysia/2506/04, B/Shandong/7/1997 и B/Victoria/2/1987. Данные антитела не имеют высокой специфичности именно к вирусу гриппа В и не имеют такой широкой специфичности к штаммам вируса гриппа В по сравнению с антителами согласно изобретению.
Таким образом, проблема получения антител, которые имели бы высокую специфичность именно к гриппу В, в частности, к максимальному количеству его различных штаммов, и не имели бы специфичности к каким-либо штаммам гриппа А, является крайне актуальной.
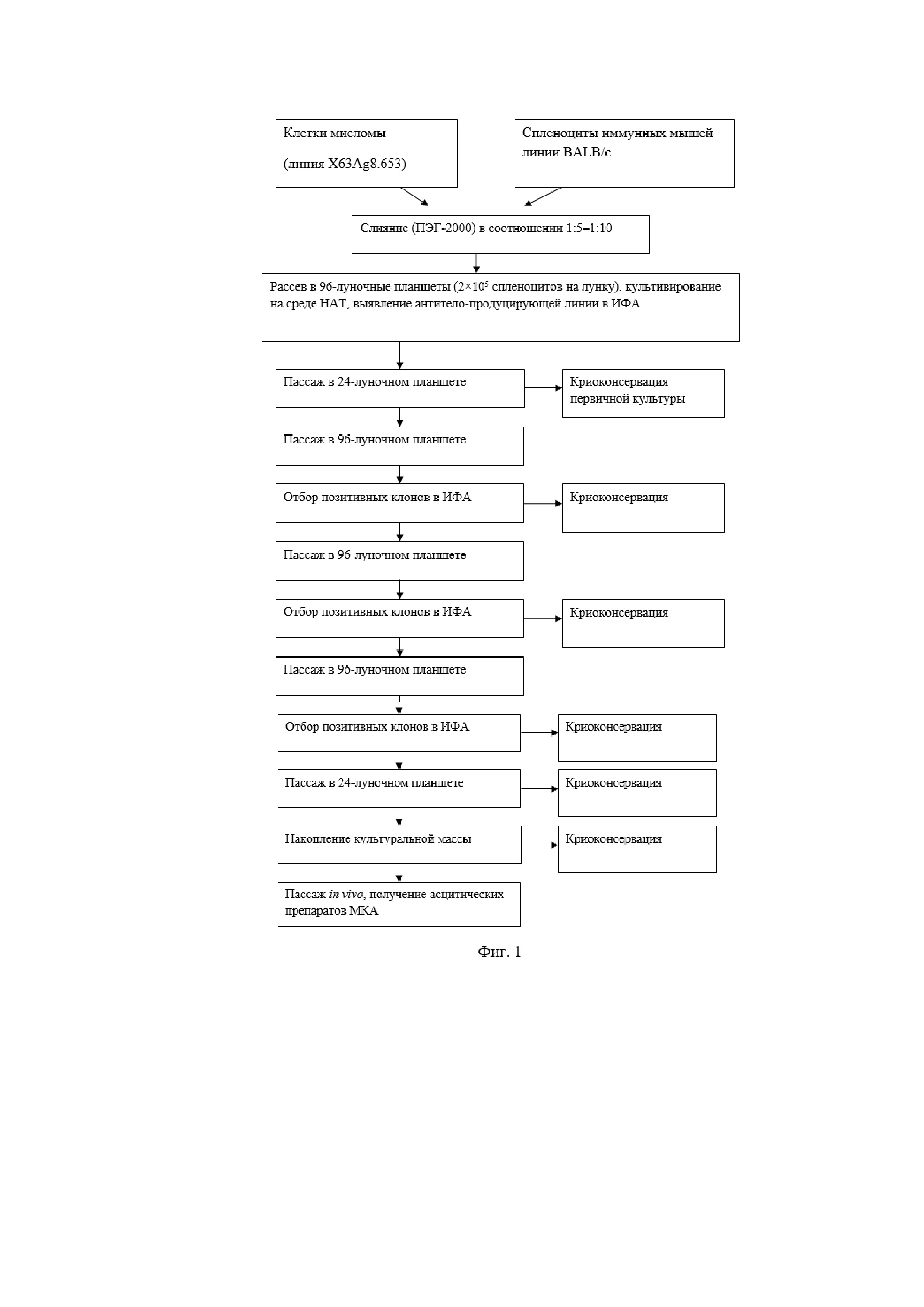
На Фиг. 1 представлена схема получения гибридом — продуцентов МКА в общем виде.
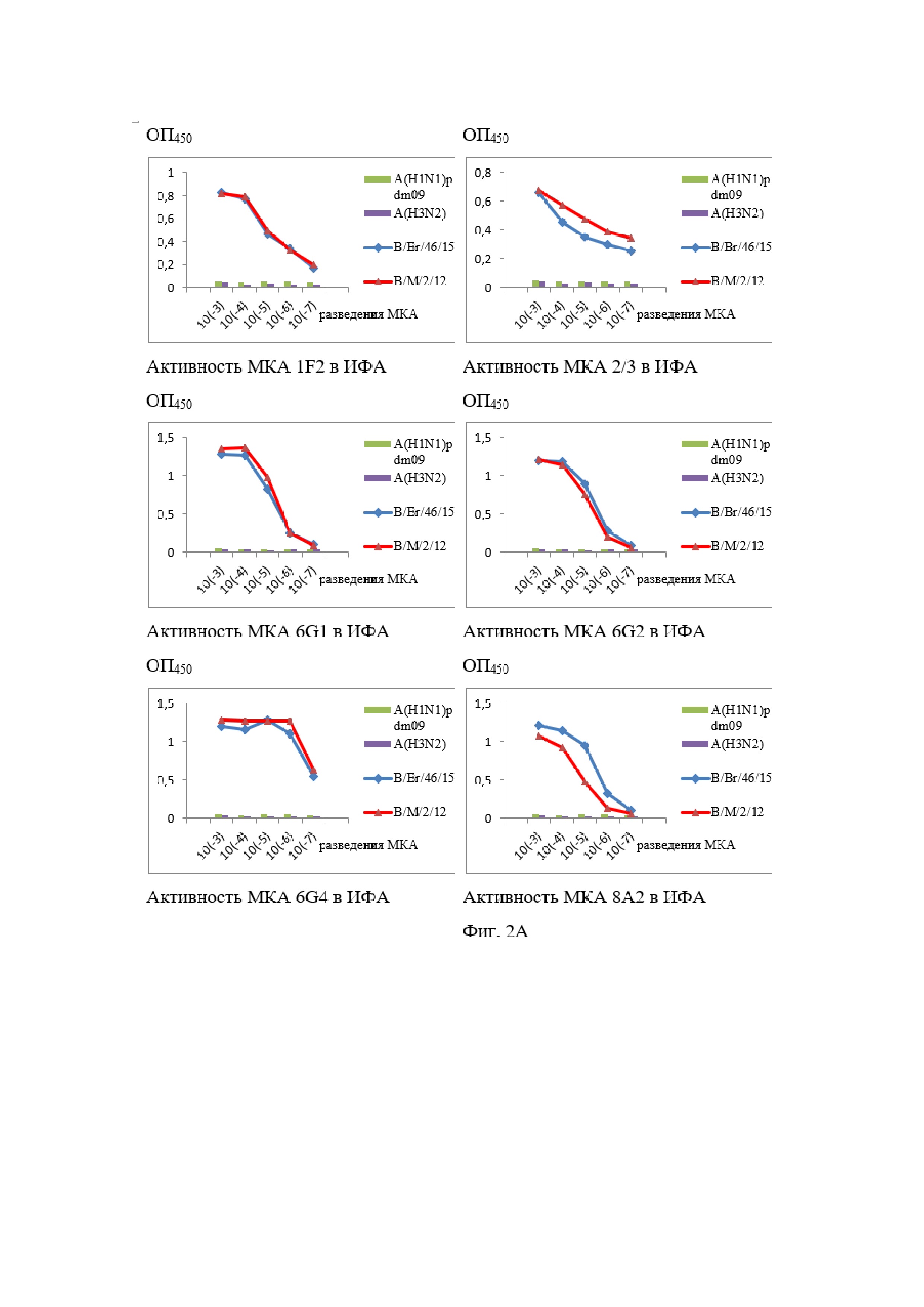
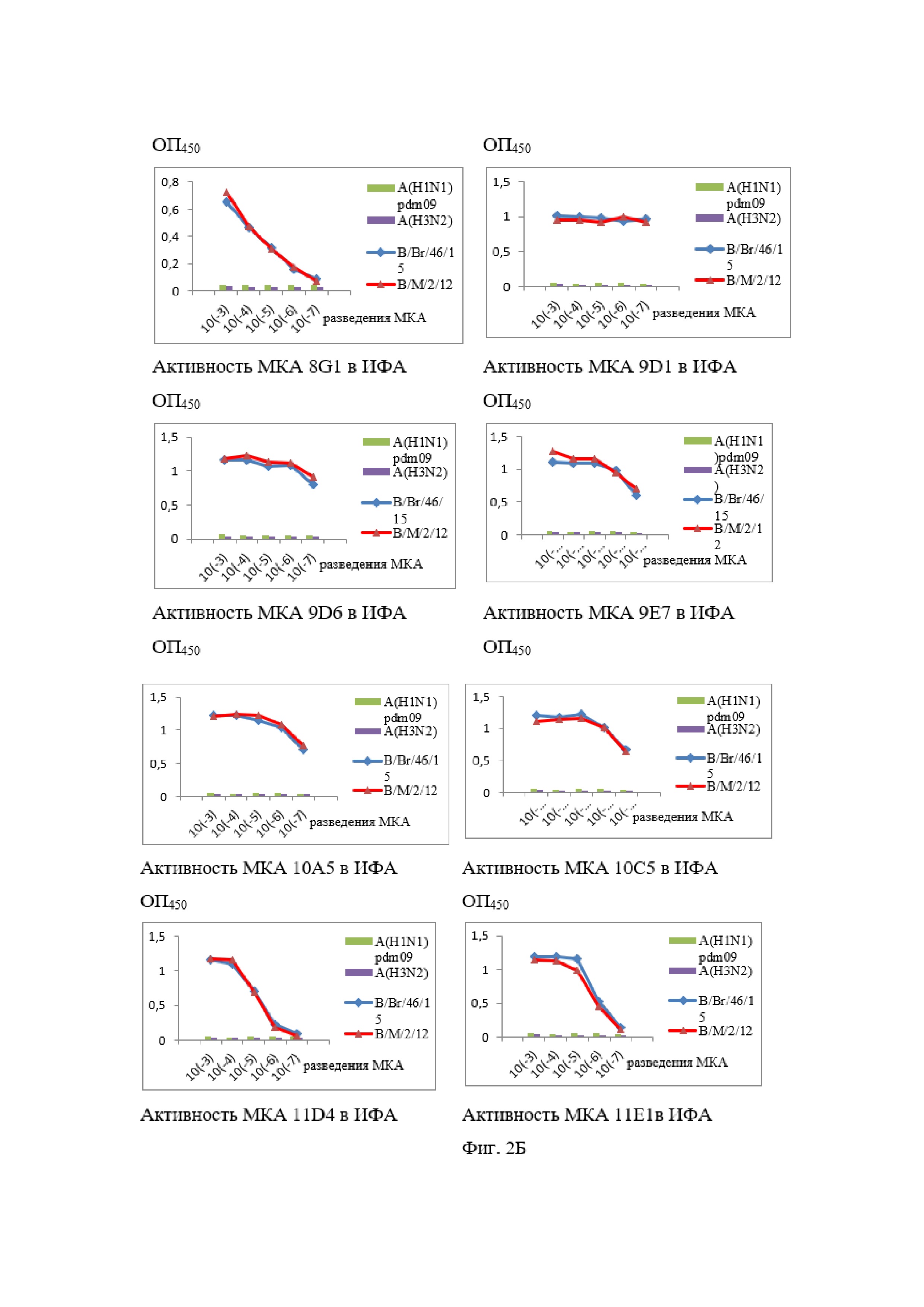
На Фиг. 2А и 2Б показаны результаты ИФА МКА к NP-белку вируса гриппа В.
На Фиг. 3 показаны результаты взаимодействия МКА согласно изобретению с вирусом гриппа B/Brisbane/46/15 в нередуцирующих условиях (по данным иммуноблоттинга).
На Фиг. 4 приведена сенсограмма взаимодействия моноклональных антител 6G1 с анализируемым штаммом вируса гриппа В.
На Фиг. 5 показана диаграмма аффинности моноклональных антител 6G1 к вирусу гриппа В.
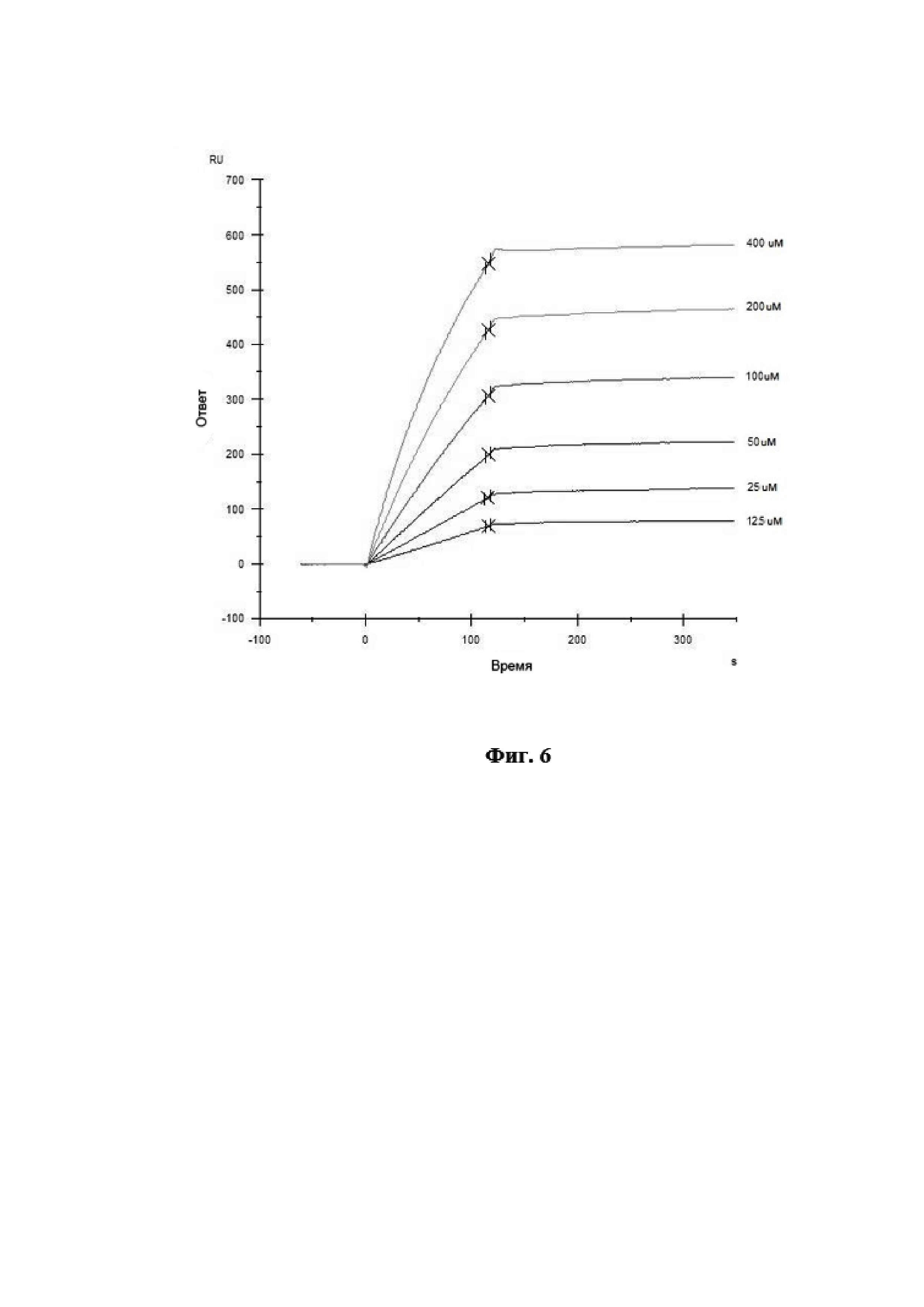
На Фиг. 6 показана сенсограмма взаимодействия моноклональных антител 10A5 с анализируемым штаммом вируса гриппа B.
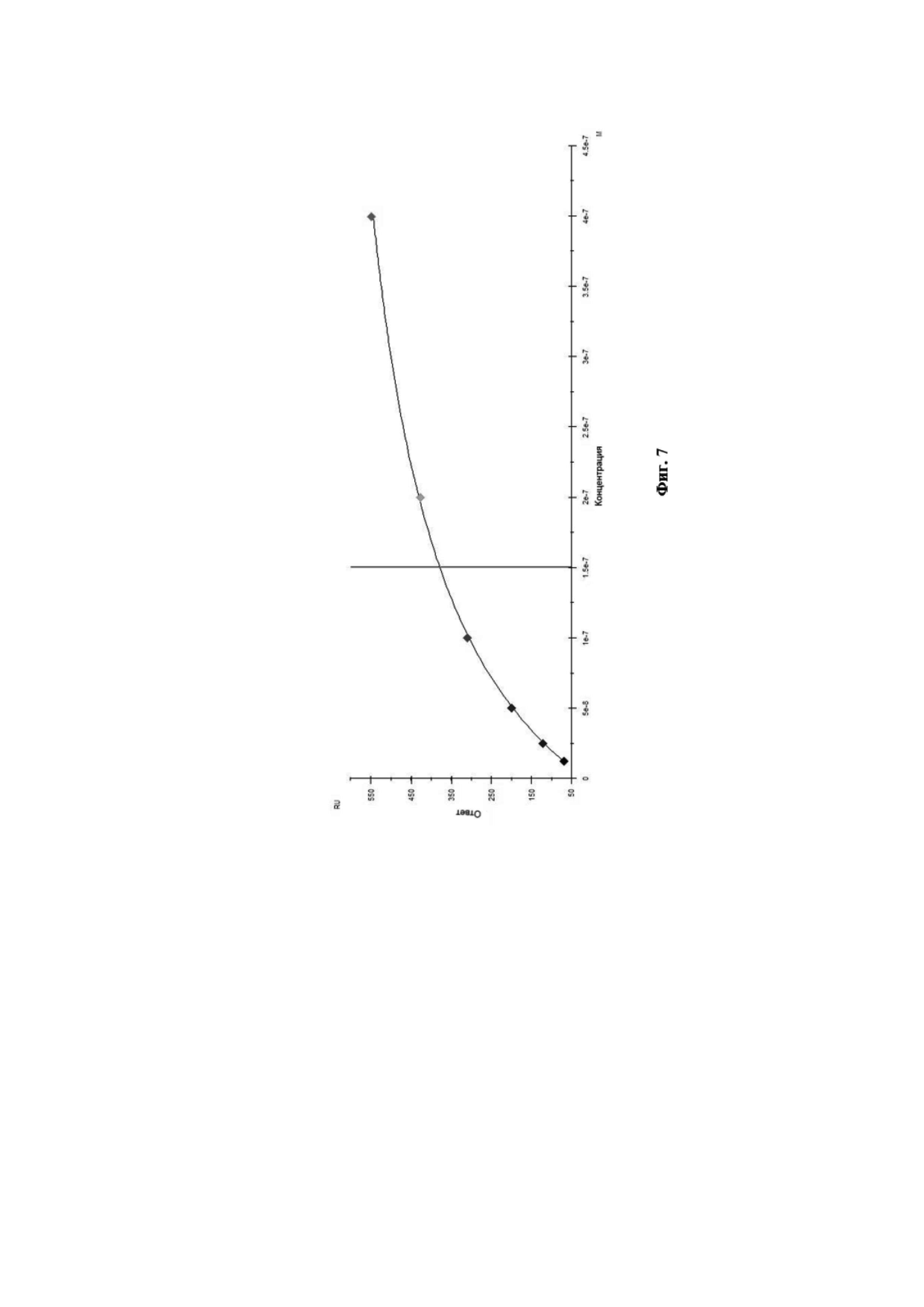
На Фиг. 7 приведена диаграмма аффинности моноклональных антител 10A5 к вирусу гриппа В.
Описание изобретения
Данное изобретение предлагает моноклональные антитела, специфичные к различным штаммам вирусов гриппа В Ямагатской и Викторианской линий и имеющие высокую специфичность к NP-белку. При этом данные антитела представляют собой IgG антитела, в частности, мышиные моноклональные IgG антитела. Данные антитела имеют высокую специфичность к штаммам вируса гриппа В Викторианской линии, в частности, к B/Victoria/2/87 (E); B/Shandong/7/97 (E); B/Shiga/51/98 (E); B/Tokyo/53/99 (E); B/Hong Kong/330/01 (E); B/Malaysia/2506/04 (E); B/Brisbane/60/08 (E); B/Texas/2/13 (E); B/Brisbane/46/15 (E); B/Maryland/15/16 (C), Δ162-163; B/Maryland/15/16 (E), Δ162-163; B/Colorado/6/17 (C), Δ162-163; B/Colorado/6/17 (E), Δ162-163, и не имеют специфичности к штаммам вируса гриппа А. Также данные моноклональные антитела имеют высокую специфичность к штаммам вируса гриппа В Ямагатской эволюционной линии, в частности, к B/Yamagata/16/88 (E), B/Panama/45/90(E), B/Yamanashi/166/98 (E), B/Shanhai/361/02 (E), B/Florida/07/04 (E), B/Florida/04/06 (E), B/Massachusetts/2/12 (E), B/Phuket/3073/13 (E), и не имеют специфичности к штаммам вируса гриппа А. Данные антитела, ввиду своей высокой специфичности, могут быть использованы для диагностики гриппа В, в частности, штаммов Ямагатской и Викторианской эволюционных линий вируса гриппа типа В, например, для диагностики посредством тест-систем.
Способ получения указанных МКА включает:
- получение антитело-продуцирующих спленоцитов;
- накопление клеток мышиной миеломы;
- слияние антитело-продуцирующих спленоцитов с миеломными клетками;
- отбор гибридом;
- инокуляция клеток гибридомы в брюшную полость праймированных пристаном мышей;
- накопление МКА в асцитах;
- очистка полученных МКА.
Для накопления МКА в асцитах были использованы специально полученные гибридомы-продуценты МКА, направленных к NP-белку вируса гриппа В.
Гибридомы — продуценты показательных МКА 6G1 и 10A5 были депонированы как 6G1/В под номером РККК(П) 785Д и 10А5/В под номером РККК(П) 787Д в Специализированную коллекцию культур клеток ЦКП «Коллекция культур клеток позвоночных» ФГБУН Института цитологии РАН, соответственно.
Антитела согласно изобретению ввиду своей специфичности могут быть использованы для диагностики вируса гриппа В, в частности, в тест-системах.
Более подробно получение и анализ указанных МКА иллюстрируют примеры, приведённые ниже.
Примеры
Пример 1
Получение МКА к белкам вируса гриппа типа В
Процесс получения гибридом-продуцентов МКА к консервативным эпитопам в составе вируса гриппа типа В состоял из нескольких стадий.
Стадия 1. Очистка вируса гриппа В, предназначенного для использования в качестве иммуногена.
Очищенный до 99% вирусный концентрат получали в результате дифференциального ультрацентрифугирования вируссодержащей аллантоисной жидкости в градиенте плотности сахарозы. Специфичность полученного вирусного концентрата до начала этапа иммунизации подтверждали в реакции торможения гемагглютинации с референс-сыворотками к различным возбудителям гриппа и других ОРВИ, а также методом ИФА.
Культивирование вируса гриппа B проводили в аллантоисной полости развивающихся куриных эмбрионов. Для получения вируссодержащей аллантоисной жидкости 11–12-дневные куриные эмбрионы стерильно заражали посевным вирусом в дозе от 10 до 100 ЭИД50/0,2 мл. После герметизации парафином эмбрионы помещали в термостат на 72 часа при температуре (32 ± 0,5)°С. Далее эмбрионы охлаждали при температуре 4°С, вируссодержащую аллантоисную жидкость стерильно собирали и проводили контроль гемагглютинирующей активности в реакции гемагглютинации. После накопления вирусные частицы из аллантоисной жидкости осаждали ультрацентрифугированием при 50 000 g в течение 2 ч, суспендировали в малом количестве 10 мМ трис-ЭДТА буфера, рН 7,2 (STE) и проводили очистку вируса через градиент 20–60% сахарозы ультрацентрифугированием при 100 000 g в течение 2,5 ч с последующим осаждением вируса из зоны 36–40% сахарозы на дно при 120 000 g в течение 1 ч. Осадок ресуспендировали в STE. Для измерения концентрации белка в очищенном вирусном концентрате использовали набор “BCATM Protein Assay Kit” (“Pierce”, США). Полученные цельновирионные суспензии хранили до исследования в замороженном состоянии при температуре –80°С.
Стадия 2. Получение антитело-продуцирующих спленоцитов в результате иммунизации мышей соответствующим антигеном под контролем образования специфических сывороточных антител в ИФА.
Мышей линии BALB/c иммунизировали очищенным антигеном, полученным на стадии 1, смешанным с неполным адъювантом Фрейнда, путём внутрибрюшинного введения (иммунизации) очищенного ультрацентрифугированием в градиенте плотности сахарозы антигена вируса гриппа типа В в концентрации 50–100 мкг/мл (по 1 мл на мышь). Затем проводили мониторинг иммунизированных животных на образование специфических антител. Животных с достаточно высоким титром антител отбирали в качестве источника антитело-продуцирующих клеток.
Инъекции антигена проводили двукратно с интервалом в 5 недель. Спустя 7 дней после каждой иммунизации из ретробульбарного синуса мышей брали пробы крови для определения титра сывороточных антител против гомологичного вируса гриппа или рекомбинантного белка в ИФА. Через две недели после последней иммунизации мышей, имевших по данным ИФА антитела в титре 1:10000, бустировали антигеном, полученным на стадии 1, или рекомбинантным белком.
Стадия 3. Определение титра сывороточных антител в ИФА.
Очищенный концентрат вируса гриппа сорбировали на твёрдой поверхности (96-луночный планшет для ИФА) в концентрации 1–5 мкг/мл. После промывания планшета в лунки с сорбированным антигеном вносили серийные двукратные разведения сыворотки от иммунизированной мыши (от 1:10 до 1:20480) и инкубировали в течение часа при температуре 37°C. Для выявления сформированного комплекса антигена с антителом добавляли антитела против IgG мыши, меченные пероксидазой хрена (HRP). После промывания в планшет добавляли субстратную смесь для фермента. В качестве субстрата на стадии детекции использовали раствор ТМБ (3,3’,5,5’-тетраметилбензидин) в концентрации 100 мкг/мл с 0,03% Н2О2. Титр антител оценивали по изменению оптической плотности раствора, регистрируемой спектрофотометрически на фотометре Multiscan FC при длине волны 450 нм.
Стадия 4. Накопление клеток мышиной миеломы.
Через 3 дня после бустер-иммунизации мышь использовали в качестве донора лимфоцитов селезёнки для слияния с клетками мышиной миеломы в целях получения гибридом (Новохатский и др., 1985; Новиков и др., 1988). Для этого проводили гибридизацию спленоцитов иммунизированных мышей с клетками мышиной миеломы в присутствии 50% ПЭГ-2000. В качестве партнёра для слияния при получении гибридом использовали культуру клеток мышиной миеломы линии Х63Аg8.653, адаптированную к росту в среде с добавлением сыворотки крови крупного рогатого скота (СКРС), полученную из коллекции ФГБУ «РНЦРХТ». Данный штамм является устойчивым к 8-азагуанину, то есть дефектным по гену гипоксантин-гуанин-фосфорибозил трансферазы.
Выбранную клеточную линию культивировали на среде RPMI-1640 c добавлением глутамина, 2-меркаптоэтанола (МЭ), гентамицина и СКРС для обеспечения в день слияния со спленоцитами плотности популяции не менее 2×107 клеток/мл. Культивирование миеломы осуществляли в пластиковых культуральных планшетах или во флаконах производства “Sarstedt” (Германия) или “Nunc” (США). Клетки размножали при температуре 36–37°С и 100% влажности в атмосфере воздуха с 5–7% СО2. Базовая культуральная среда содержала 90% RPMI-1640 и 10% СКРС («БиолоT», Санкт-Петербург).
Стадия 5. Слияние антитело-продуцирующих спленоцитов с миеломными клетками.
Для получения антитело-продуцирующих клеток у мышей с высокими титрами специфических антител через 3–4 дня после последней бустер-иммунизации удаляли селезёнку и вымывали из неё спленоциты бессывороточной средой (такой как RPMI-1640) или забуференным физиологическим раствором, после чего их смешивали с миеломными клетками в соотношении от 5:1 до 10:1. Затем клетки центрифугировали (10 мин, 1000 об/мин), осадок разрыхляли, после чего, перемешивая, по каплям добавляли 1 мл бессывороточной среды, содержащей 50% (масс/об) ПЭГ (молекулярный вес 1000–4000 Да). Затем медленно добавляли 10 мл бессывороточной среды, после чего смесь центрифугировали.
Осаждённые клетки суспендировали в соответствующем количестве селективной НАТ-среды. Затем клетки переносили в селективную НАТ-среду, приготовленную на основе RPMI-1640 и 20% СКРС с добавлением гипоксантина (10–4 М), аминоптерина (4×10–7 М) и тимидина (1,6×10–5 М) производства “Sigma-Aldrich” (США), а также 2 мМ глутамина, 1 мМ пирувата натрия (“Sigma-Aldrich”, США), 1 мг/л амфотерицина В и 50 мг/л гентамицина. Суспензию распределяли по ячейкам 96-луночных планшетов для культивирования, содержащих трёхсуточную культуру мышиных макрофагов, и инкубировали в атмосфере 5–7% СО2 при температуре 37°С в течение 3 недель. После 10 суток культивирования НАТ-среду заменяли на более щадящую НТ-среду, а после 20 суток культуры поддерживали на среде RPMI-1640 с СКРС. Для удаления Ig, секретированных неслившимися спленоцитами мышей, культуральную жидкость из ячеек с растущими гибридами отбирали на 5–6, затем 10–12 и на 16–17 дни после слияния.
Стадия 6. Отбор гибридом.
Поскольку используемый штамм миеломы резистентен к 8-азагуанину, он является дефектным по ферменту гипоксантин-гуанин-фосфорибозил трансферазе, и любые не слитые с лимфоцитами миеломные клетки и любые гибриды миелома-миелома не способны выживать в среде НАТ. С другой стороны, гибриды антитело-образующих клеток друг с другом, а также гибридомы, образованные антитело-продуцирующими и миеломными клетками, могут выживать в этой среде, причём гибриды спленоцитов друг с другом имеют ограниченное время жизни (на протяжении 3–4 пассажей) и отмирают в ходе культивирования, тогда как гибридомы спленоцитов с миеломными клетками (СМ) способны к неограниченному размножению.
Стадия 7. Реклонирование и криоконсервирование гибридом.
Скрининг гибридом проводили методом твердофазного ИФА. Из большого числа активно размножающихся гибридом отбирали гибридомы, активно продуцирующие противовирусные антитела. Для этого в супернатантах гибридом определяли титры специфических антител к вирусу-иммуногену в ИФА. Вирусным материалом (очищенные концентраты), разведённым карбонатно-бикарбонатным буфером (КББ) до концентрации 2–5 мкг/мл, сенсибилизировали планшеты в течение 18 часов при температуре 4°С. После отмывания несвязавшегося антигенного материала 0,01 М фосфатно-солевым буфером (PBS) с добавлением 0,05% Tween 20 (PBS-T), рН 7,2 вносили культуральную жидкость в PBS-T в разведении 1:10 (при тестировании субклонов в 2-х повторах) и инкубировали 1 час при 37°С. Связавшиеся с антигеном антитела детектировали с помощью пероксидазных конъюгатов АТ к IgG мыши (“Sigma-Aldrich”, США) в PBS-T в течение 1 часа при температуре 37°С. Пероксидазную реакцию проявляли добавлением субстратной смеси, содержащей 0,1 мг/мл 3,3’,5,5’-тетраметилбензидина (ТМБ) и 0,02% Н2О2 в ацетат-цитратном буфере, рН 5,0. После остановки реакции 2N H2SO4 оптическую плотность измеряли на фотометре Multiscan FC при длине волны 450 нм.
Для последующего клонирования отобранных гибридом СМ использовали метод предельных разведений. Клетки гибридомы разводили из расчёта, чтобы на одну лунку планшета приходилось 1–2 клетки, и затем культивировали их, как выше описано, в ростовой среде в инкубаторе с подачей 5–7% СО2 при температуре 36–37°С. Процедуру клонирования повторяли 3–4 раза для каждого избранного клона, продуцирующего специфические антитела. Клоны — стабильные продуценты антител — отбирали для последующего накопления культивированием в ростовой среде с целью накопления клеток в количестве, достаточном для последующего пассажа на сингенных мышах и криоконсервирования.
Стадия 8. Криоконсервирование гибридом.
Криоконсервированию подвергали культуры гибридомных клеток, находящиеся в логарифмической фазе роста, или клетки, выращенные в перитонеальной полости мышей сингенной линии (при получении асцитных жидкостей). Перед замораживанием клетки подвергали микроскопическому анализу на жизнеспособность и бактериологическому исследованию на отсутствие контаминации микрофлорой. Количество живых клеток оценивали по эксклюзии трипанового синего. После центрифугирования при 1000 об/мин концентрацию клеток доводили до 1–2 млн в мл. Для криоконсервирования клеток использовали среду, состоящую из 90% СКРС и 10% ДМСО (“Sigma-Aldrich”, США). Предварительно охлаждённые до температуры –80°С в парах азота криопробирки с клетками помещали в жидкий азот (для многолетнего хранения при температуре –196°С) и хранили в Криобанке гибридом ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России.
Стадия 9. Накопление МКА в асцитах.
Асцитные жидкости мышей линии BALB/c, содержащие МКА, секретируемые гибридомой, получали следующим образом. Для этого мышам-реципиентам за 12–14 дней до инокуляции гибридомы вводили внутрибрюшинно 0,5 мл пристана (“Sigma-Aldrich”, США) (Hoogenraad et al., 1983). Восстановленные клетки гибридомы в количестве 5–10 млн инокулировали в брюшную полость праймированных мышей. Спустя 2–3 недели после образования асцита, контролируемого визуально, делали прокол брюшной стенки и собирали оттекающую жидкость. После центрифугирования асцитов надосадочная жидкость служила источником МКА, а клетки гибридом, прошедшие пассирование на мышах, криоконсервировали. Исследования выполнялись согласно «Правилам проведения работ с использованием экспериментальных животных» (приказ № 266 МЗ РФ от 19.06.2003).
Концентрации МКА после очистки составили:
Клон 6G1 — 2,03 мг/мл, клон 10A5 — 3,07 мг/мл.
Пример 2
Очистка накопленных моноклональных антител к вирусу гриппа В
Препараты мышиных МКА перед очисткой представляли собой асцитные жидкости мышей, содержащие МКА, секретируемые клетками отобранной гибридомы. Очистку фракции МКА проводили методами аффинной хроматографии и гель-фильтрации. Первый этап очистки МКА методом гидрофобной хроматографии предусматривает удаление большей части белковых примесей из исходных препаратов и получение промежуточных препаратов, содержащих как нативную форму IgG, так и продукты их олигомеризации и деградации. Второй этап очистки предусматривает удаление остаточных белковых примесей, а также агрегатов, димеров и фрагментов IgG из промежуточных препаратов методом гель-фильтрации на колонке с сорбентом высокого разрешения.
Концентрацию IgG определяли при помощи спектрофотометра NanoDrop ND-1000 (“Thermo Fisher Scientific”, США) в режиме IgG (коэффициент молярной экстинции E 1% = 13,70). Результат анализа очищенных препаратов МКА подтверждали методом денатурирующего электрофореза в полиакриламидном геле по методу Лэммли. Гель окрашивали коллоидным кумасси и документировали при помощи системы ChemiDoc MP Imaging System (“Bio-Rad”, США) с последующим денситометрическим анализом. При качественной очистке препарат должен представлять собой две мажорных дорожки — тяжёлая цепь антител представлена на уровне ~ 50 кДа, а лёгкая цепь на уровне ~ 25–30 кДа.
Пример 3
Получение МКА к вирусу гриппа В
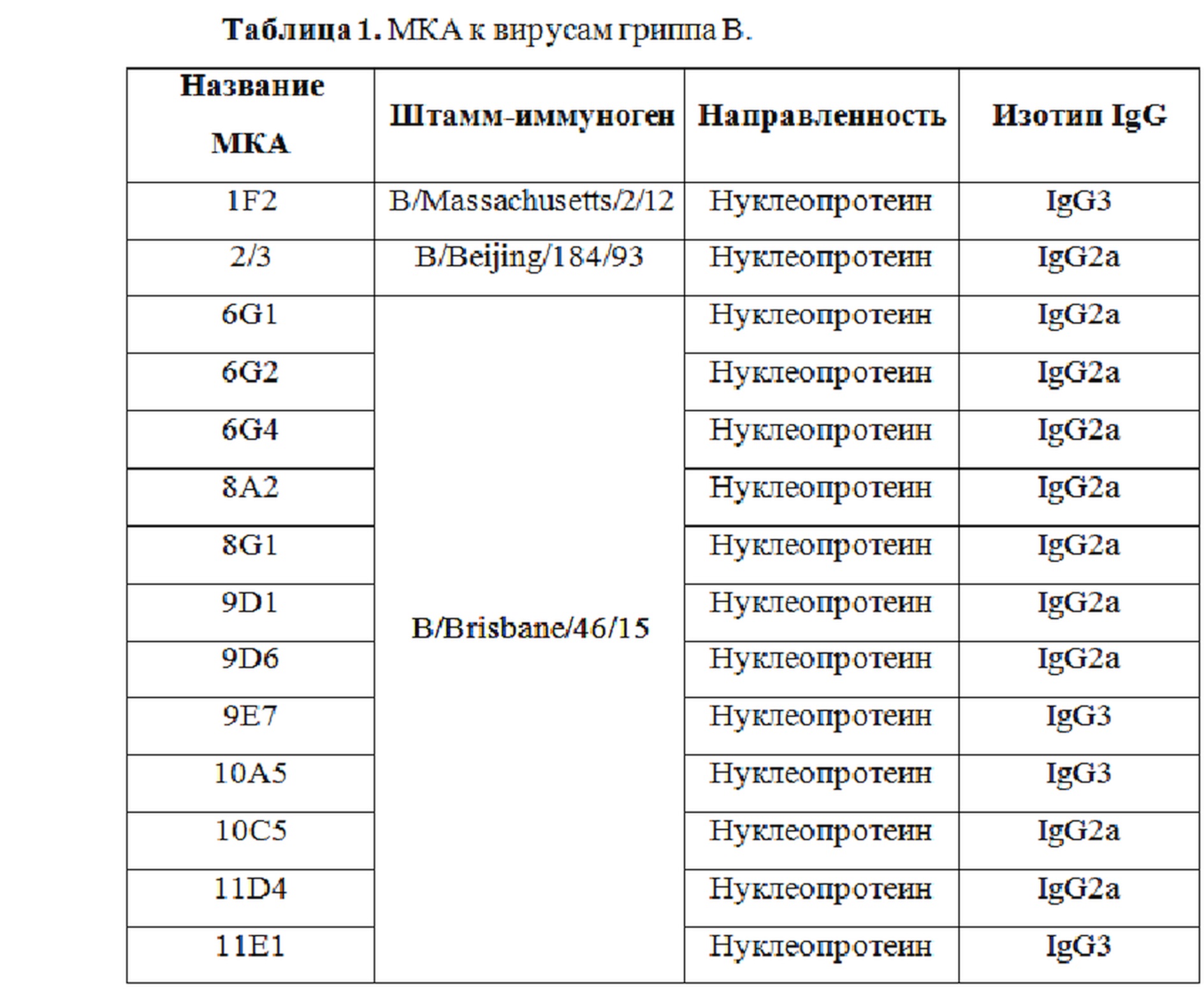
Была получена панель из 14 МКА к вирусу гриппа В и проанализированы их диагностические характеристики. Данные о МКА приведены в таблице 1.
Все МКА специфически взаимодействовали в непрямом варианте ИФА с очищенными концентратами современных вирусов гриппа В Ямагатской (B/Massachusetts/2/12 (В/М/2/12)) и Викторианской (B/Brisbane/46/15 (В/Br/46/15)) эволюционных линий при отсутствии перекрёстного реагирования с гетерологичными вирусами гриппа А (результаты представлены на Фиг. 2).
Для характеристики направленности полученных МКА был проведён вестерн-блоттинг с использованием в качестве антигена очищенного концентрата вируса гриппа B/Brisbane/46/15. В случае проведения электрофореза как в нередуцирующих, так и в редуцирующих условиях, на блоте выявлялась полоса с молекулярной массой примерно 64 кДа, что соответствует нуклеопротеину вируса гриппа В (Фиг. 3).
Для оценки способности полученных новых МКА взаимодействовать со штаммами вируса гриппа В различных эволюционных линий и разных лет выделения был проведён мк-ИФА (микрокультуральный ИФА, cell-ELISA) с использованием монослойных культур клеток MDCK, инфицированных вирусами гриппа В. В эксперименте были использованы 3 штамма Ямагатской эволюционной линии, 5 штаммов Викторианской линии и 4 изолята ранних лет выделения (1940–1969 гг.).
По данным мк-ИФА было установлено, что МКА 6G1, 6G4, 8A2, 9D6, 10A5, 10C5 и 11E1 взаимодействуют с вирусами обеих эволюционных линий, но слабо реагируют или не взаимодействуют со штаммами ранних лет выделения. Исключение составляли МКА 6G4, которые связывались с вирусом B/Russia/69, но не со штаммами более ранних лет. МКА 6G2 не взаимодействовали с рядом штаммов Викторианской линии 1985–1997 гг. (B/Minnesota/1/85, B/Victoria/2/87 и B/Shandong/7/97), но выявляли современные штаммы этой ветви и вирусы гриппа В Ямагатской линии.
По результатам мк-ИФА было также установлено, что МКА 1F2, 2/3, 8G1, 9D1, 9E7 и 11D4 взаимодействуют со всеми протестированными штаммами обеих современных эволюционных линий и с «реликтовыми» вирусами гриппа В. Можно предполагать, что данная группа МКА специфична к высококонсервативному эпитопу (эпитопам) нуклеопротеина вируса гриппа В. Во всех случаях не было отмечено неспецифического реагирования разработанных МКА с незаражённой культурой клеток MDCK.
Таким образом, все включённые в исследование МКА направлены к нуклеопротеину вируса гриппа В, взаимодействуют с широким спектром штаммов и могут быть использованы для детекции вирусов гриппа В в разрабатываемой тест-системе.
Как было показано по данным иммуноблоттинга, МКА 6G1 и 10A5 специфически взаимодействуют с NP-белком вируса гриппа В, не взаимодействуя при этом со штаммами гриппа А. Спектр взаимодействия данных МКА был проанализирован методом мк-ИФА. Для этого в лунки планшетов с монослойными культурами клеток MDCK вносили вируссодержащий материал, содержащий 50–100 ТЦД50 гриппа В. После инкубации в СО2-инкубаторе в течение 3 суток при 34°С среду удаляли, клетки в лунках фиксировали 80% холодным ацетоном. На фиксированный клеточный монослой наносили по 100 мкл вирусспецифичных МКА в рабочем разведении (5–10 мкг/мл) и инкубировали 1 ч при 37°С. На следующем этапе в лунки добавляли по 100 мкл козьих антител против IgG мыши (1/10000), меченных пероксидазой (“Sigma-Aldrich”, США), и инкубировали в течение 1 ч при 37°С. Пероксидазную реакцию проявляли добавлением субстратной смеси, содержащей 0,1 мг/мл 3,3’,5,5’-тетраметилбензидина (ТМБ) и 0,03% Н2О2 в ацетат-цитратном буфере, рН 5,0. После остановки реакции с помощью 2N H2SO4 измеряли оптическую плотность на фотометре при длине волны 450 нм (ОD450).
По результатам мк-ИФА МКА 6G1 и 10A5 показали широкий спектр специфического взаимодействия с референс-штаммами вирусов гриппа В ранних лет выделения, а также со штаммами Ямагатской и Викторианской эволюционных линий, в том числе с вирусами новой генетической подгруппы, подобными B/Colorado/6/17. МКА специфически реагировали со штаммами, выделенными как на куриных эмбрионах, так и в культуре клеток MDCK.
Помимо этого, данные МКА эффективно взаимодействовали с современными штаммами вирусов гриппа В обеих линий, выделенных в ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России. Согласно методу мк-ИФА, МКА 6G1 и 10A5 взаимодействуют со штаммами гриппа В:
Референс-штаммы гриппа В до разделения на линии:
B/Hong Kong/5/72 (E), B/Singapore/222/79 (E), B/Minnesota/1/85 (E).
Референс-штаммы гриппа В Викторианской эволюционной линии:
B/Victoria/2/87 (E); B/Shandong/7/97 (E); B/Shiga/51/98 (E); B/Tokyo/53/99 (E); B/Hong Kong/330/01 (E); B/Malaysia/2506/04 (E); B/Brisbane/60/08 (E); B/Texas/2/13 (E); B/Brisbane/46/15 (E); B/Maryland/15/16 (C), Δ162-163; B/Maryland/15/16 (E), Δ162-163; B/Colorado/6/17 (C), Δ162-163; B/Colorado/6/17 (E), Δ162-163.
Референс-штаммы гриппа В Ямагатской эволюционной линии:
B/Yamagata/16/88 (E), B/Panama/45/90(E), B/Yamanashi/166/98 (E), B/Shanhai/361/02 (E), B/Florida/07/04 (E), B/Florida/04/06 (E), B/Massachusetts/2/12 (E), B/Phuket/3073/13 (E).
Штаммы гриппа В Викторианской эволюционной линии, выделенные из клинических материалов в ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России:
B/Иркутск/4/16 (C), В/СПб/44/17 (E), В/СПб/100/17 (E), В/СПб/124/17 (E), В/СПб/156/17 (E), В/СПб/257/17 (E), В/СПб/120/17 (E), В/СПб/201/17 (E), В/СПб/210/17 (E), В/СПб/225/17 (E), В/СПб/203/17 (E), В/СПб/204/17 (E), В/СПб/104/17 (E), В/СПб/174/17 (E), В/СПб/79/17 (E), В/СПб/80/17 (E), В/СПб/89/17 (E), B/СПб/127/17 (E), B/СПб/238/17 (E), B/СПб/234/17 (E), B/СПб/236/17 (C), B/СПб/200/17 (E), B/СПб/106/17 (E), B/СПб/209/17 (E), В/Астрахань/2/17 (C).
Штаммы гриппа В Ямагатской эволюционной линии, выделенные из клинических материалов в ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России:
B/СПб/115/13 (E), B/СПб/154/15 (E), B/СПб/180/15 (E)
Е – вирусы выделены на куриных эмбрионах, С – вирусы выделены в культуре клеток MDCK.
Пример 4
Определение константы диссоциации МКА 6G1 к белку NP вируса гриппа В (штамм B/Phuket/3073/13 (Yamagata))
Активацию сенсорного чипа СМ5 и иммобилизацию на его поверхность антител 6G1 к белку NP вируса гриппа В (штамм B/Phuket/3073/13 (Yamagata)) проводили в соответствии с инструкцией производителя (“GE Healthcare”, США). Раствор лиганда (моноклональное антитело 6G1) готовили в 10 мМ растворе CH3COONa pH 5,0. Поверхность чипа предварительно активировали обработкой 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлоридом (EDC) и N- гидроксисукцинимидом (NHS) в соотношении 1:1. Далее, в первую ячейку прибора вносили раствор лиганда (50 мкг/мл при скорости потока 10 мкл/мин, время контакта 420 с), иммобилизация которого проходила путём образования ковалентных связей между аминогруппами в полипептидной цепи лиганда и NHS-активированной поверхностью чипа. Затем в первую ячейку вносили 1М раствор этаноламин гидрохлорида-NaOH pH 8,5 для инактивации участков поверхности чипа, не занятых лигандом. Во вторую ячейку прибора вносили только 1М раствор этаноламин гидрохлорида-NaOH pH 8,5 для инактивации поверхности чипа. Таким образом, первая (рабочая) ячейка служила для снятия сигнала взаимодействия лиганд-аналит, вторая (референсная) ячейка служила для снятия фонового сигнала. Увеличение сигнала на 1 RU (Response Unit, единица ответа) соответствовало иммобилизации ≈ 1 пг/мм2 лиганда на поверхность чипа CM5.
Инжектирование аналита (вирус гриппа В, штамм B/Phuket/3073/13 (Yamagata)) проводили в серии двукратных разведений (400; 200; 100; 50; 25; 12.5 нМ). Для регенерации поверхности чипа использовали 10 мМ глицин гидрохлорид pH 2,5.
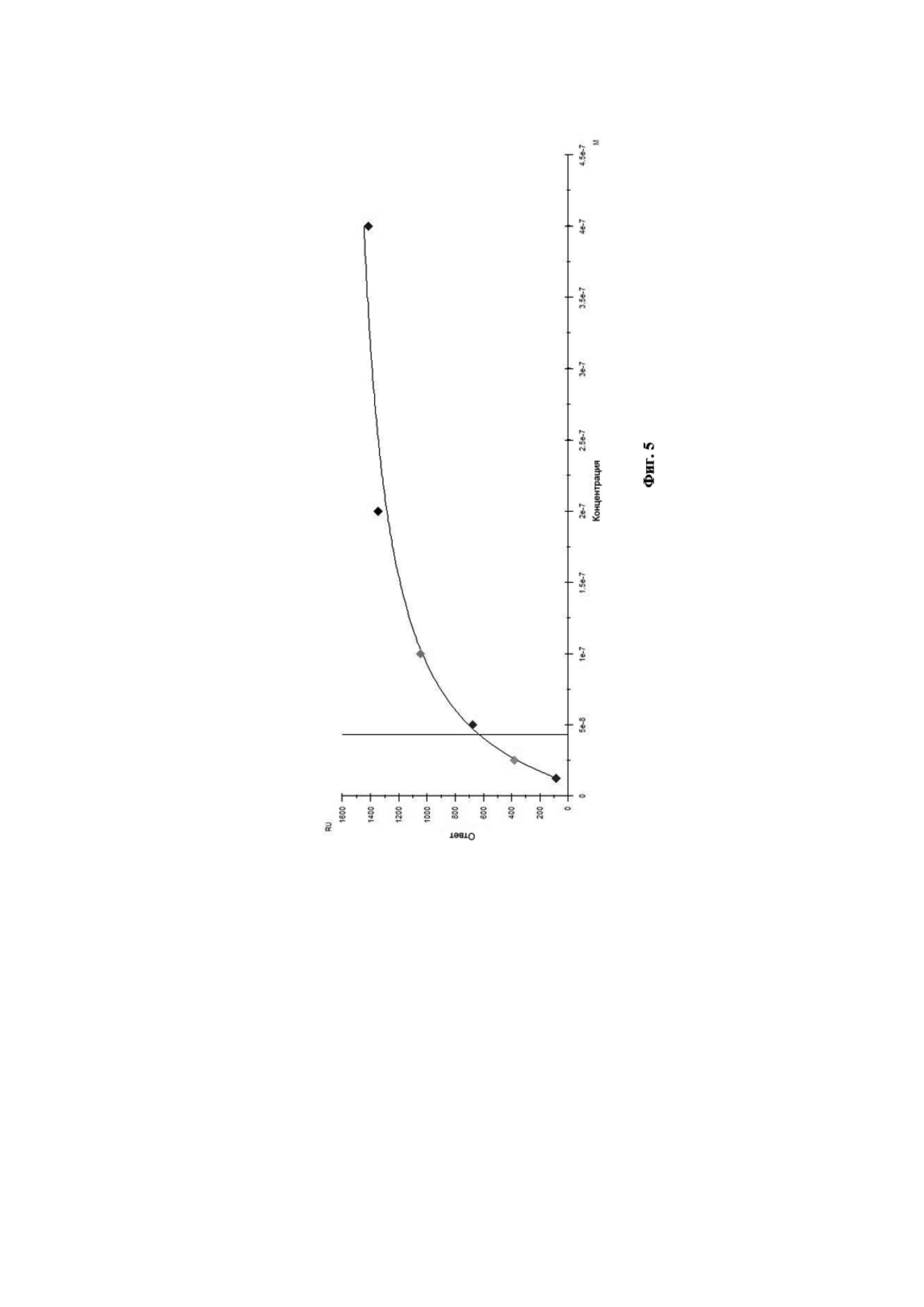
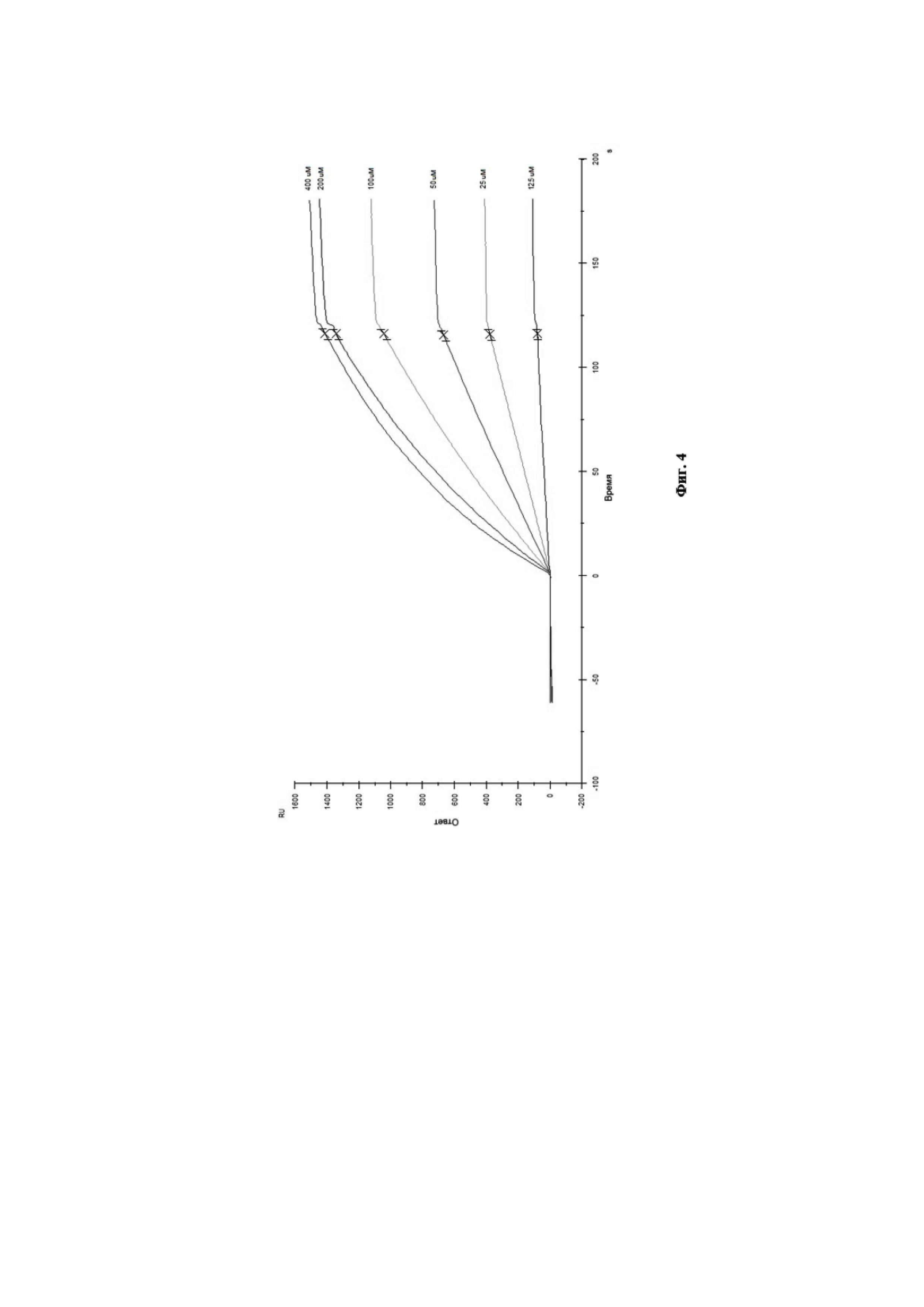
Связывание антител с анализируемым штаммом вируса гриппа В было изучено путём мониторинга изменения значений RU в ходе построения сенсограммы взаимодействия во времени. Полученные кривые взаимодействия были обработаны с использованием программного обеспечения Biacore X100 Evaluation Software. Сенсограмма взаимодействия МКА 6G1 с анализируемым штаммом вируса гриппа В представлена на Фиг. 4. Диаграмма аффинности моноклональных антител 6G1 к вирусу гриппа В при помощи программного обеспечения Biacore X100 Evaluation Software представлена на Фиг. 5.
Данное взаимодействие было описано кинетикой Лэнгмюра. Так, рассчитанная по данному приближению равновесная константа диссоциации составила KD = 4,33×10–8 М, что свидетельствует о высокоаффинном взаимодействии МКА 6G1 c вирусом гриппа В.
Пример 5
Определение константы диссоциации МКА 10A5 к белку NP вируса гриппа В (штамм B/Phuket/3073/13 (Yamagata))
Активацию сенсорного чипа СМ5 и иммобилизацию на его поверхность антител 10A5 к белку NP вируса гриппа В (штамм B/Phuket/3073/13 (Yamagata)) проводили в соответствии с инструкцией производителя (“GE Healthcare”, США). Раствор лиганда (моноклональное антитело 10A5) готовили в 10 мМ растворе CH3COONa pH 5,0. Поверхность чипа предварительно активировали обработкой 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соотношении 1:1. Далее, в первую ячейку прибора вносили раствор лиганда (50 мкг/мл при скорости потока 10 мкл/мин, время контакта 420 с), иммобилизация которого проходила путём образования ковалентных связей между аминогруппами в полипептидной цепи лиганда и NHS-активированной поверхностью чипа. Затем в первую ячейку вносили 1М раствор этаноламин гидрохлорида-NaOH pH 8,5 для инактивации участков поверхности чипа, не занятых лигандом. Во вторую ячейку прибора вносили только 1М раствор этаноламин гидрохлорида-NaOH pH 8,5 для инактивации поверхности чипа. Таким образом, первая (рабочая) ячейка служила для снятия сигнала взаимодействия лиганд-аналит, вторая (референсная) ячейка служила для снятия фонового сигнала. Увеличение сигнала на 1 RU соответствовало иммобилизации ≈ 1 пг/мм2 лиганда на поверхность чипа CM5.
Инжектирование аналита (вирус гриппа В, штамм B/Phuket/3073/13 (Yamagata)) проводили в серии двукратных разведений (400; 200; 100; 50; 25; 12.5 нМ). Для регенерации поверхности чипа использовали 10 мМ глицин гидрохлорид pH 2,5.
Связывание антител с анализируемым штаммом вируса гриппа В было изучено путём мониторинга изменения значений RU в ходе построения сенсограммы взаимодействия во времени. Полученные кривые взаимодействия были обработаны с использованием программного обеспечения Biacore X100 Evaluation Software. Сенсограмма взаимодействия МКА 10A5 с анализируемым штаммом вируса гриппа В представлена на Фиг. 6. Диаграмма аффинности МКА 10A5 к вирусу гриппа В при помощи программного обеспечения Biacore X100 Evaluation Software представлена на Фиг. 7.
Данное взаимодействие было описано кинетикой Лэнгмюра. Так, рассчитанная по данному приближению равновесная константа диссоциации составила KD = 1,51×10–7 М, что свидетельствует о высокоаффинном взаимодействии моноклональных антител 10A5 c вирусом гриппа В.
Описанные МКА могут быть использованы для диагностики, в частности, в диагностических тест-системах, например, в тест-системах по типу «сэндвич»-ИФА или иных тест-системах.