Результат интеллектуальной деятельности: 1,2-БИС(ПЕРФТОР-трет-БУТОКСИ)ЭТАН В КАЧЕСТВЕ КОНТРАСТНОГО ВЕЩЕСТВА ДЛЯ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ НА ЯДРАХ F
Вид РИД
Изобретение
Изобретение относится к медицине и биологии, а именно к созданию биологически инертных эффективных контрастных веществ для получения магнитно-резонансных изображений, используемых в клинической диагностике.
Одним из широко применяемых методов диагностики является магнитно-резонансная томография (МРТ) на ядрах 1Н, в которой для визуализации структур внутренних органов используется наблюдение сигналов от ядер водорода молекул воды и органических молекул, входящих в состав мягких тканей и биологических жидкостей организма. 1H магнитно-резонансная томография стала незаменимым инструментом для определения состояния болезни на уровне описания анатомических изменений. Для идентификации специфических тканей и наблюдения биологических процессов на клеточном уровне требуется уже молекулярная визуализация. Одним из методов, позволяющих получать такую информацию, является МРТ на ядрах 19F, который может обеспечивать не только фиксацию контрастного вещества в зонах интереса, но и определять его количество при использовании оптимального контрастного агента. Это возможно ввиду отсутствия в организме эндогенного фтора, что позволяет обнаруживать фторированные вещества как "горячие точки" при комбинированной МРТ 1H/l9F и делает фторсодержащие молекулы идеальными метками с высокой специфичностью. Наличие семи электронов на внешней оболочке атома фтора приводит к большей чувствительности химических сдвигов 19F к локальному окружению, чем химические сдвиги 1H. Действительно, 19Р-ЯМР спектры фторорганических соединений могут лежать в диапазоне 200 ррм. Это позволяет идентифицировать многие фторсодержащие соединения даже в клинических низкопольных приборах.
Реализуемость такого подхода обусловлена наличием стабильных наноразмерных эмульсий перфторуглеродов (ПФУ). Перфторуглероды являются органическими соединениями, в которых все атомы водорода, связанные с углеродом, заменены атомами фтора. ПФУ обладают высокой химической стабильностью и являются наиболее инертными органическими ксенобиотиками. Они не подвергаются метаболизму в организме и не токсичны in vivo даже в больших дозах. Однако ПФУ не растворимы в воде и могут вводиться в организм в виде водных эмульсий. Первые наноразмерные эмульсии фторуглеродов были созданы около 50 лет назад в качестве кровезаменителей для транспортировки кислорода и углекислого газа. В последние годы эти эмульсионные системы привлекают все большее внимание исследователей. Эмульсии можно формировать, используя различные гидрофильные полимеры в широком диапазоне размеров частиц (90 нм - 1 мкм) и поверхностных зарядов (-95 мВ - 65 мВ). Поверхность эмульсионных частиц может модифицироваться, ковалентно или нековалентно через in situ или post-эмульсионную модификацию. Частицы эмульсии могут служить средством доставки широкого круга лекарственных препаратов и/или являются метками для различных типов клеток. Фторуглеродное ядро при этом представляет собой контрастный агент для МРТ.
МРТ и спектроскопия на ядрах 19F позволяет идентифицировать клетки различных типов после того, как их удается пометить с помощью наноразмерных частиц ПФУ in vitro или in vivo.
При внутривенном введении ПФУ-эмульсии ее частицы захватываются моноцитами, В-клетками, нейтрофильными гранулоцитами и локальными макрофагами, которые становятся помеченными 19F и могут «высвечиваться» после инфильтрации этих клеток в зонах воспаления с помощью 19F-MPT.
Накопление ПФУ в зонах повреждений может происходить не только за счет работы ретикулоэндотолиальной системы, но и за счет течей в эндотелиальном барьере. В печеночных синусоидах имеются нарушения эндотелия с порами порядка 100 нм, селезенка имеет щели в несколько сот нм, а в эндотелии воспаленной ткани и опухолях имеются поры порядка 400 нм. Эти поры позволяют наночастицам эмульсий из кровеносного русла проникать в ткани. Так как и опухоли, и воспаленные ткани характеризуются повышенным притоком крови и сниженным дренажем через лимфатическую систему, наночастицы временно в них накапливаются. Этот эффект может использоваться и для терапевтических целей, и для 19F-визуализации.
Степень 19F-маркировки зоны воспаления зависит от количества и активности моноцитов и нейтрофильных гранулоцитов в кровеносном русле и способности фторуглеродных эмульсионных частиц диффундировать через эндотелиальный барьер. Именно эти факторы ответственны за брутто количество фторуглеродной метки, оказавшейся в зоне воспаления.
Однако для конечного детектирования критически важно и строение фторуглерода, используемого в качестве контраста, а именно количество магнитно-эквивалентных атомов фтора в его молекуле, имеющих одинаковый химический сдвиг в ЯМР-спектре.
В настоящее время в мире используется достаточно ограниченное число ПФУ для приготовления наноразмерных эмульсий. Главным образом это ПФУ, предназначенные для кровезамещающих эмульсий с газотранспортной функцией. Выбор и производство этих ПФУ определялись набором критериев необходимых для создания кровезаменителей с газотранспортной функцией. Для этой цели требовались инертные ПФУ, способные давать стабильные эмульсии и достаточно быстро выводящиеся из организма. Для МРТ-визуализации, помимо этих критериев, возникает требование максимальной контрастности, то есть максимально большого количества магнитно-эквивалентных атомов фтора на грамм-молекулу ПФУ при минимально возможном времени релаксации Т1.
В настоящее время для целей 19F-MPT на рынке присутствуют два соединения с самой высокой контрастностью: перфтор-15-краун-5 эфир (Exfluor Research ТХ), имеющий в своем составе 20 магнитно-эквивалентных атомов фтора, составляющих 65,5% молекулы [WO 2005/072780 А2, Cellular labeling for nuclear magnetic resonance techniques, Eric T. Arens], и перфторполиэфир (ПФПЭ) (Fomblin Z) - линейный перфторированный олигомер окиси тетрафторэтилена. Это высоко гидрофобное и олеофобное масло с высокой температурой кипения, молекулярным весом порядка 1700 Da и низким поверхностным натяжением. В каждой молекуле содержится порядка 55 атомов фтора, причем основная их часть, т.е. те атомы фтора, которые входят во фрагменты CF2CF2O, являются магнитно-эквивалентными и дают в спектре 19F-ЯМР синглет [Jelena М. Janjic, Mangala Srinivas, Deepak K. K. Kadayakkara, and Eric Т. Arens, Self-delivering Nanoemulsions for Dual Fluorine-19 MRI and Fluorescence Detection, J. Am. Chem. Soc, 2008, 130, 2832-2841; US Patent 8,227,610 B2, 2012, Compositions and methods for producing cellular labels for nuclear magnetic resonance techniques, Jelena Janjic, Eric T. Arens]. Концевые сложноэфирные группы этих ПФПЭ превращали в различные производные, содержащие красители. Ковалентно связанные флюоресцентные фрагменты на фторированной молекуле позволяют проводить дополнительный оптический контроль за клетками.

Эти соединения используются исключительно в опытах на животных, поскольку время их полувыведения из организма превышает 150 дней.
Активно используются менее контрастные соединения, разработанные для приготовления кровезаменителей с газотранспортной функцией: перфтороктилбромид и транс-бис(перфторбутил)этилен (F-44-E) [Christoph Jacobya, Sebastian Temmea, Friederike Mayenfelsb, Nicole Benoitc, Marie Pierre Krafft, Rolf Schubertb, Jurgen Schradera and Ulrich Flogela, Probing different perfluorocarbons for in vivo inflammation imaging by 19F MRI: image reconstruction, biological half-lives and sensitivity, NMR Biomed. 2014; 27: 261-271].
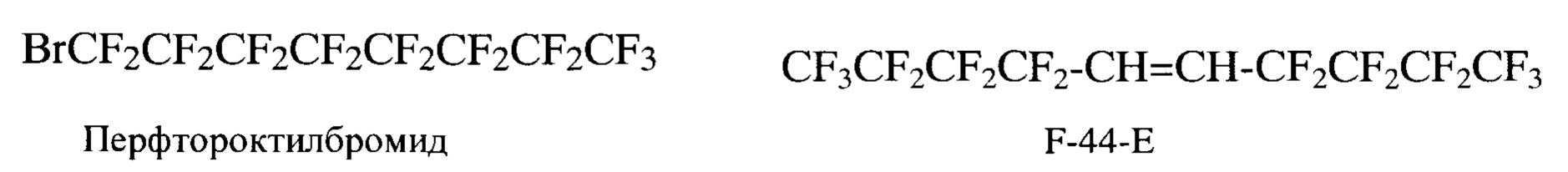
Эти соединения имеют более короткие сроки полувыведения - 14 и 28 дней соответственно. Однако их ЯМР-спектры имеют сложную структуру (несколько сигналов с различным химическим сдвигом) и содержат только 8 и 6 магнитно-эквивалентных атомов фтора соответственно. В перфтороктилбромиде магнитно-эквивалентные атомы фтора составляют 30,5%, а в транс-бис(перфторбутил)этилене 24,6%.
Описан целенаправленный синтез частично фторированных соединений -перфторированных эфиров различного строения, содержащих одну или две концевые CF2H-группы [RU №2159610, 27.11.2000. Мур Джордж Дж., Флинн Ричард М., Гуэрра Мигель А. Физиологически приемлемые эмульсии, содержащие гидриды перфторуглеродного эфира, и способы их использования]. Показано, что данные соединения приобретают повышенную липофильность и скорость их выведения заметно возрастает. При этом токсических свойств за период наблюдения не выявлено. Однако эти соединения имели сложные ЯМР-спектры и, априори, невысокие контрастные показатели.
Перспективным перфторированным фрагментом для введения в молекулу магнитно-эквивалентных атомов фтора является перфтор-трет-бутильная группа. В результате замещения четырех гидроксильных групп в пентаэритрите на перфтор-трет-бутоксильные группы было синтезировано соединение, названное авторами Perfecta, которое содержит 36 магнитно-эквивалентных атомов фтора [Ilaria Tirotta, Alfonso Mastropietro, Chiara Cordiglieri, Lara Gazzera, Fulvio Baggi, Giuseppe Baselli, Maria Grazia Bruzzone, Ileana Zucca, Gabriella Cavallo, Giancarlo Terraneo, Francesca Baldelli Bombelli, Pierangelo Metrangolo, and Giuseppe Resnati, A Superfluorinated Molecular Probe for Highly Sensitive in Vivo 19F-NMRI, J. Am. Chem. Soc, 2014, 136(24), pp 8524-8527].

Однако это соединение имеет М 1008, т.пл. 60°С и не может выводиться из организма в разумные сроки.
Существует потребность в расширении арсенала контрастных агентов на основе фторорганических соединений, применимых для 19F-MRT, которые должны отвечать следующим требованиям:
- максимально возможное содержание магнитно-эквивалентных атомов фтора в молекуле;
- оптимальные для целей МРТ времена релаксации Т1 и Т2.
- достаточная для целевого применения биологическая инертность;
- температура кипения, лежащая в интервале 140-170°С, или упругость пара, которая обеспечит достаточную скорость испарения вещества через мембрану альвеол;
- достаточная липофильность, за которую может отвечать углеводородный фрагмент гибридной молекулы и который должен обеспечивать проницаемость сквозь липидную мембрану альвеол.
Фторуглероды могут накапливаться в тканях человека при вдыхании, проглатывании или внутривенном введении на некоторое время. Поскольку метаболизму эти соединения не подвергаются, основным путем их выведения является выдыхание через легкие. Время, в течение которого они остаются в организме, зависит от скорости диффузии молекул через клеточные мембраны в альвеолах легких. Таким образом, ключевыми параметрами, влияющими на скорость выведения фторуглеродов, являются их липофильность и молекулярная масса (упругость пара): чем лучше фторуглероды проникают сквозь липидную мембрану альвеол, чем более они летучи, тем короче период их полувыведения, который может варьироваться от часов до лет. Фактически, реализуются мембранные процессы с фазовым переходом или испарение через мембрану (первапорация).
При комбинировании в одной молекуле фторсодержащего и углеводородного фрагментов возникает необходимость учитывать возможные метаболические превращения. Многие ксенобиотики, попав в организм, подвергаются биотрансформации и выделяются в виде метаболитов. Алканы подвергаются ферментативной атаке посредством α-, β- или ω-гидроксилирования в микросомах печени. Биологический смысл явления - превращение химического вещества в форму, удобную для выведения из организма. Известно, что насыщенные н-алканы легко окисляются до жирных кислот у крыс. Как первичные, так и вторичные связи С-Н могут быть атакованы. В ходе биопревращений липофильный и, следовательно, трудновыводимый ксенобиотик становится гидрофильным продуктом, что обусловливает возможность его быстрой экскреции.
Сочетание в одной молекуле фторсодержащего и углеводородного фрагментов повышает гидрофобность молекулы и потенциально замедляет процесс гидроксилирования, однако вносит дополнительный риск возможного дегидрофторирования с высвобождением токсичного иона фтора. Для минимизации или предотвращения потенциальной токсичности необходимо, чтобы связь между фторалкильной и углеводородной частью гибридной молекулы была спроектирована таким образом, чтобы свести к минимуму возможность ферментативных или неферментативных реакций деградации. Наилучшим путем является соединение перфторалкильной и углеводородной частей через третичный атом углерода. Максимально замедлить или вообще исключить возможность метаболизма углеводородного фрагмента гибридной молекулы может гантелеобразная структура, в которой углеводородная часть находится между двумя перфторалкильными группами. Такая молекула будет максимально гидрофобна. Центральная углеводородная часть молекулы будет придавать определенную липофильность гибридной молекуле, что будет влиять на скорость ее выведения из организма через механизм первапорации. Соответственно, время нахождения вещества в организме будет снижаться.
Известны фторорганические соединения, включающее перфторуглеродный и углеводородный фрагменты, где углеводородная часть находится между двумя перфторалкильными группами, например 1,2-бис(перфтор-трет-бутокси)этан (CAS Registry Number 2093365-48-9). Данное соединение было синтезировано для изучения возможности его использования в процессах двухфазного катализа. Изучалось изменение фторофильности ряда синтезируемых частично фторированных соединений с перфтор-трет-бутоксильной группой в системах несмешивающихся перфторированных жидкостей и полярных органических растворителей [See-Wing Lo, Edwin Law, Matthew Y. Lui, Xi-Guang Wei, Kai-Chung Lau, Chui Y. Ma, Margaret B. Murphy and Istvan T. Horvath, Development of sustainable fluorous chemistry: the synthesis and characterization of fluorous ethers with nonafluoro-tert-butoxy groups, Org. Chem. Front., 2014, 1, 1180-1187]. В литературе не имеется данных о токсичности, контрастных свойствах и способности образовывать физиологически совместимые эмульсии для этого соединения.
Задача изобретения состояла в разработке контрастного агента, обладающего свойствами, которые делают возможным его применение для МРТ на ядрах 19F.
Технический результат - новый фторорганический контрастный агент для МРТ на ядрах 19F, применимый на живых объектах и расширение ассортимента контрастных веществ для МРТ.
Поставленная задача решается применением 1,2-бис(перфтор-трет-бутокси)этана в качестве контрастного вещества для магнитно-резонансной томографии на ядрах 19F, причем 1,2-бис(перфтор-трет-бутокси)этан используют в виде наноразмерной водной эмульсии на живых объектах.
1,2-Бис(перфтор-трет-бутокси)этан содержит 18 магнитно-эквивалентных атомов фтора, что составляет 68,67% молекулы (М=498). Для сравнения, молекула прототипа - PERFECTA (М=1008) - содержит 36 магнитно-эквивалентных атомов фтора, но их содержание в молекуле составляет 67,83%.
Таким образом, при одинаковой мольной концентрации в единице объема объекта, исследуемого методом МРТ, содержится практически одинаковое с Perfecta количество атомов фтора, обеспечивающих интенсивность сигнала. Температура кипения 1,2-бис(перфтор-трет-бутокси)этана составляет 150°С, что соответствует ранее сформулированным требованиям.
1,2-Бис(перфтор-трет-бутокси)этан является доступным соединением, одним из путей его синтеза является реакция Вильямсона [See-Wing Lo, Edwin Law, Matthew Y. Lui, Xi-Guang Wei, Kai-Chung Lau, Chui Y. Ma, Margaret B. Murphy and Istvan T. Horvath, Development of sustainable fluorous chemistry: the synthesis and characterization of fluorous ethers with nonafluoro-tert-butoxy groups, Org. Chem. Front., 2014, 1, 1180-1187].
Одним из путей синтеза 1,2-бис(перфтор-трет-бутокси)этана является реакция Вильямсона - взаимодействие перфтор-трет-бутоксида натрия с дигалогеналканами. Авторы настоящего изобретения синтезировали 1,2-бис(перфтор-трет-бутокси)этан этим способом по следующему уравнению реакции.

Изобретение иллюстрируется приведенными ниже фигурами и примерами.
На фиг. 1 показаны фотографии, поясняющие процесс изготовления эмульсии: (а) смесь фторуглерода и Проксанола-268 до эмульгирования при простом перемешивании; (б) та же смесь сразу после завершения эмульгирования; (в) визуальный анализ прозрачности полученной эмульсии.
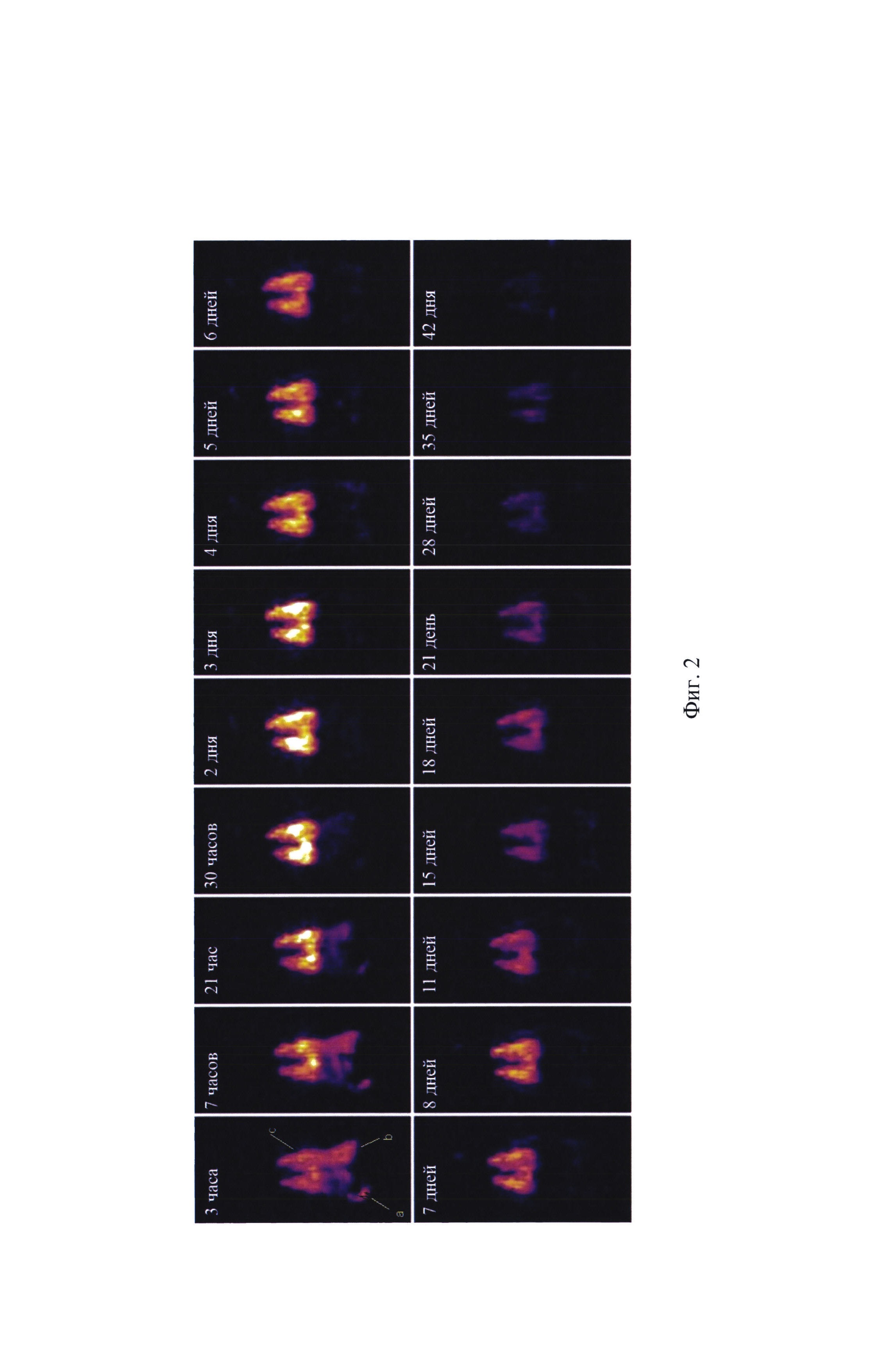
На фигуре 2 представлены 19F-MIP (maximal intensity projection) изображения крысы, полученные в результате 3D19F-MPT сканирования через разные интервалы времени после введения 1 мл 20% эмульсии 1,2-бис(перфтор-трет-бутокси)этана.
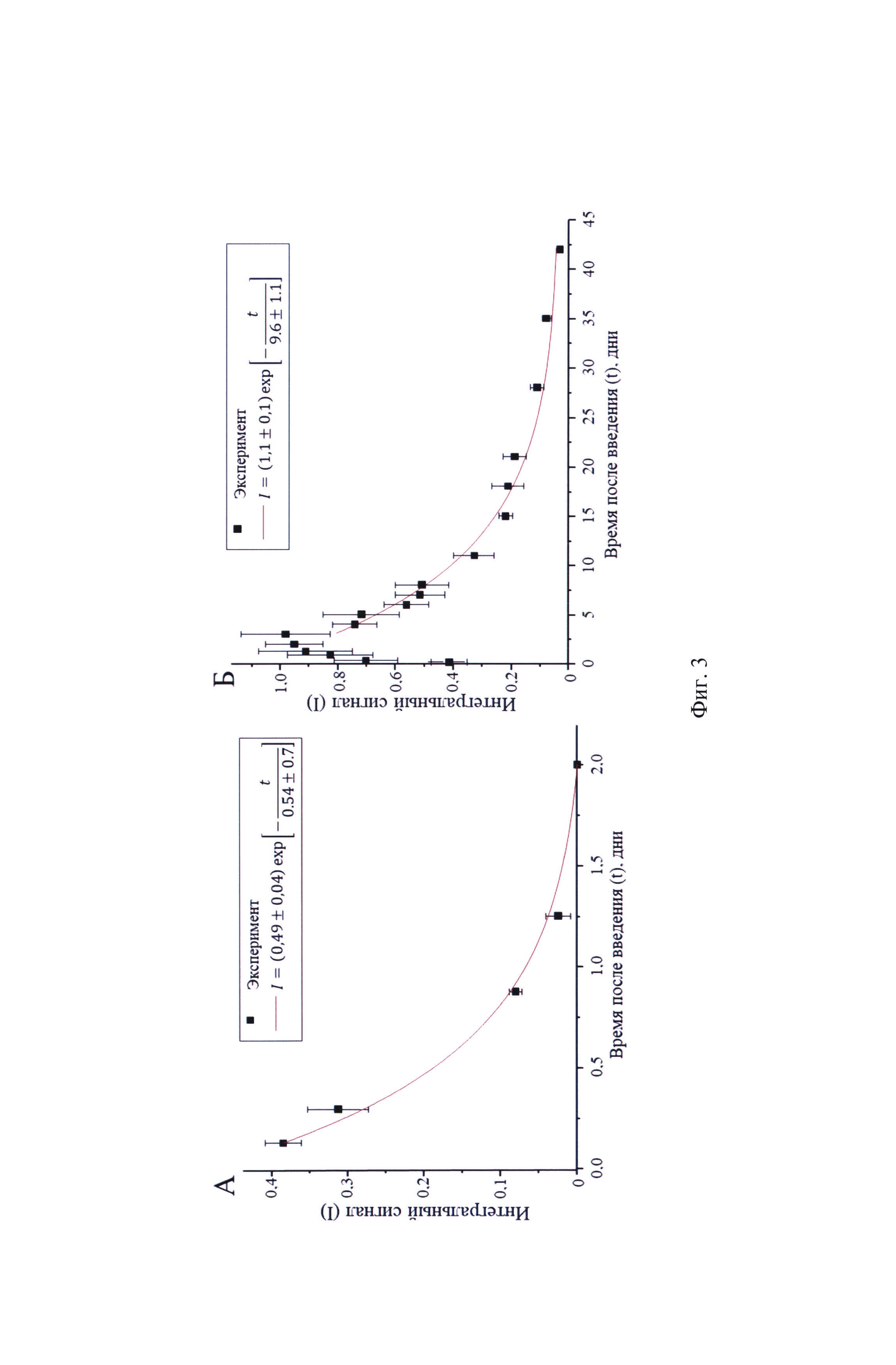
Графики выведения 1,2-бис(перфтор-трет-бутокси)этана из печени и легких представлены на фиг. 3. Ось ординат в данном случае соответствует интегральному сигналу в области печени и легких, а ось абсцисс - времени после введения эмульсии.
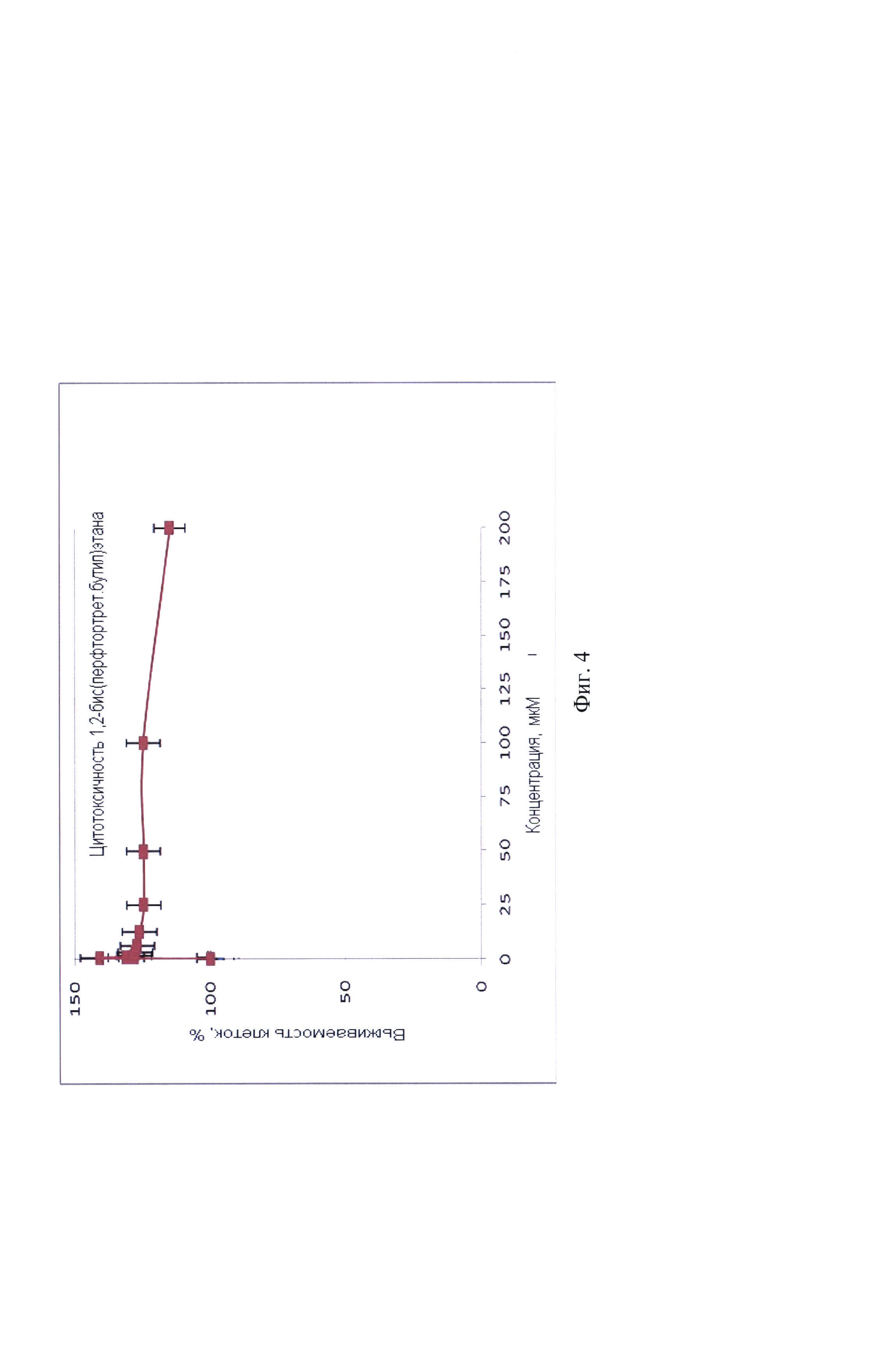
На фигуре 4 изображена зависимость выживаемости клеток от концентрации 1,2-бис(перфтор-трет-бутокси)этана.
Пример 1. Получение 1,2-бис(перфтор-трет-бутокси)этана.
К раствору 1,2-дибромэтана (4 мл, 46,5 ммоль) в 60 мл ДМФА при постепенном нагревании до 80°С порциями добавляли 30 г (116 ммоль) перфтор-трет-бутоксида натрия, полученный раствор переносили во фторопластовый реактор микроволновой установки (Milestone MicroSynth), снабженный оптоволоконным датчиком температуры, обеспечивающим обратную связь системы программирования процесса реакции. Реакцию проводили в течение 10 ч с перемешиванием при температуре 90°С, которая обеспечивалась микроволновым облучением, его максимальная мощность не превышала 150 Вт. Содержимое реактора фильтровали, к полученному раствору добавляли 20 мл воды, фторорганическую фазу отделяли, к водной фазе добавляли 30 мл воды, отделяли нижний слой, органические слои объединяли и перегоняли в вакууме водоструйного насоса, отбирая фракцию с т.кип.80°С/50 мм. Примесные продукты (ДМФА и перфтор-трет-бутанол) удаляли из этой фракции многократным промыванием водным раствором HCl (рН=3) и водой при ГЖХ-контроле. Получали 6,1 г 1,2-бис (перфтор-трет-бутокси)этана в виде бесцветной маслянистой жидкости с выходом 26, 5% и т.кип.Ткип=150°С.Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 425 (с, 4Н). Спектр ЯМР 19F (CDCl3, δ, м.д.): -70.91 (с). Спектр ЯМР 13С [CDCl3 (растворимость вещества ограничена)], δ, м.д., J, Гц): 67.55, 79.68 (Jc-f=29.6), 120.15 (JC-F=289.3).
Тестирование синтезированного 1,2-бис(перфтор-трет-бутокси)этана проводили в поле 7 Тл на MP-томографе BrukerBioSpec 70/30 USR. Релаксационные измерения проводили также и в поле 0.5 Тл на клиническом MP-томографе BrukerTomikonS50. Для проведения 19F МРТ-исследований в поле 7 Тл использовали объемную РЧ-катушку фирмы Bruker «птичья клетка» (birdcage) внутреннего диаметра 72 мм. Для проведения 19F МРТ-исследований в поле 0.5 Тл использовали специально разработанную приемопередающую РЧ катушку, работающую на частоте ядер фтора 19.83 МГц.
Для измерения времени T1 использовали ИП инверсия-восстановление со следующими параметрами сканирования:
- для поля 7 Тл: в качестве возбуждающего 90° (Р90) и инвертирующего 180° (Р180) применяли импульсы прямоугольной формы одинаковой мощности с длительностями 450 и 900 мкс; задержка между срабатыванием ИП (d1) - 8 с; проводили 16 экспериментов с различными задержками d между импульсами 180° и 90°: (d) - 0.001, 0.01, 0.05, 0.1, 0.2, 0.4, 0.8, 1, 1.4, 1.8, 2.5, 3, 4, 5, 7 с; количество dummy сканов (ds) - 4, накоплений (ns) - 8. Полное время сканирования - 26 мин 26 с.
- для поля 0.5 Тл: Р180=900 мкс, Р90=450 мкс, d1=5 с, проводили 13 экспериментов с параметром d=0.001, 0.05, 0.1, 0.2, 0.3, 0.35, 0.5, 0.75, 1, 2, 3, 4, 5 с; ds=0; ns=1.
Для измерения времени Т2 в поле 7 Тл использовали метод CPMG (Карра-Перселла-Мейбума-Гилла) со следующими параметрами сканирования: Род=450 мкс; рефокусирующий P180=900 мкс; d1=8 с; ns=8, ds=16. Задержка между соседними импульсами (d20) - 50 мс.В экспериментах регистрировали 32 эхосигнала.
При измерении времени Т2 в поле 0.5 Тл использовали ИП-спиновое эхо со следующими параметрами сканирования: Р180=900 мкс; Р90=450 мкс; d1=5 с; d20=10, 20, 40, 80, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 700 мс, ds=0, ns=1.
В табл.1 приведены полученные значения времен релаксации T1 и Т2 для 1,2-бис(перфтор-трет-бутокси)этана в поле напряженностью 7 Т и 0,5 Т.

Эмульсии 1,2-бис(перфтор-трет-бутокси)этана получали с помощью ультразвукового диспергатора UltrasonicHeatSystem W375. Были приготовлены 10% и 20% об. эмульсии с использованием в качестве стабилизатора блок-сополимера окиси этилена и окиси пропилена (Проксанола-268) в концентрации 13%. Процесс изготовления эмульсии заключался в следующем. В стеклянную кювету с круглым дном объемом 25 мл помещали 9 мл 13% водного раствора Проксанола-268 и 1 мл эмульгируемого фторсодержащего соединения. Зонд диспергатора диаметром 1 см погружали в кювету и производили «озвучивание» смеси, охлаждаемой водой со льдом в пульсирующем режиме 50/50 в течение 5-6 минут. Затем проводили визуальный контроль за состоянием эмульсии и в случае недостаточной прозрачности процесс повторяли (фиг. 1).
Синтезированный 1,2-бис(перфтор-трет-бутокси)этан в виде наноразмерной эмульсии испытывали в качестве контрастного вещества для метода 19F-MPT на лабораторных крысах.
Животным (беспородные самки весом ~250 г) внутривенно вводили через яремную вену по ~1 мл 20% эмульсии синтезированного вещества 1,2-бис(перфтор-трет-бутокси)этана. Внешнего токсического эффекта от введенной эмульсии у животных не наблюдалось. 19F-MPT и МРС исследования проводили через 3 ч после введения эмульсии в течение 42 дней. На фиг.2 представлены 19F-MIP-изображения крысы, полученные в результате 3D19F МРТ-сканирования через разные интервалы времени после введения 1 мл 20%-эмульсии 1,2-бис(перфтор-трет-бутокси)этана.
Полученные данные можно объяснить следующим образом. После внутривенного введения эмульсии соединение некоторое время циркулирует в кровотоке и поглощается клетками ретикуло-эндотелиальной системы (РЭС). Как известно из литературных данных, основными местами скопления клеток РЭС являются печень и селезенка, и именно они обычно упоминаются в качестве основных визуализируемых органов после введения ПФУ эмульсий. В нашем случае основным местом накопления эмульсии являются легкие. Можно предположить, что поскольку синтезированный фторуглерод обладает большей растворимостью в жировой ткани по сравнению с другими фторуглеродными соединениями, а также учитывая большое количество введенной эмульсии (1 мл 20% эмульсии на 17-19 мл циркулирующей крови у 250 гр. крысы), эмульсионные частицы не успевают полностью захватиться клетками РЭС и начинают растворяться в липидной мембране альвеол легких, которые одними из первых контактируют с ними в кровотоке и являются основным путем выведения всех ПФУ. При этом липидная мембрана легких служит в качестве «депо» для липофильного 1,2-бис(перфтор-трет-бутокси)этана, в связи с чем он не сразу выводится из легких, а остается в них еще в течение некоторого времени.
Выведение 1,2-бис(перфтор-трет-бутокси)этана из печени и легких иллюстрируется графиками, где ось ординат соответствует интегральному сигналу в области печени (А) и легких (Б), нормированных на максимальное значение, а на оси абсцисс показано время после введения эмульсии (фиг. 3).
Оценку токсичности 1,2-бис(перфтор-трет-бутокси)этана проводили с помощью клеточного теста. Для экспериментов использовали клеточную линию человека ПФЧ (неопухолевые фибробласты человека, иммортализованные h-TERT), которая протестирована в American Type Culture Collection, США. Клетки культивировали в среде DMEM. В культуральную среду добавляли следующие компоненты до конечных концентраций: эмбриональную телячью сыворотку - 10%, L-глутамин - до 2mМ, пенициллин - 100 ЕД/мл, стрептомицин - до 100 мкг/мл (среды и добавки производства ПанЭко, Россия), инкубацию проводили при 37°С, 5% СО2 в увлажненной атмосфере. В экспериментах использовали культуру в логарифмической фазе роста. Для профилактики микоплазменного заражения использовали препарат Mycokill (GE, США). Перед началом экспериментов проводили не менее трех пассажей на свободной от антимикоплазменного препарата среде.
Образец 1,2-бис(перфтор-трет-бутокси)этана использовали в виде раствора 20 мМ в ДМСО. Раствор хранили при+4°С, размораживали при комнатной температуре непосредственно перед использованием.
МТТ-тест для исследования цитотоксичности
Цитотоксическое действие соединений исследовали методом МТТ-теста (по способности восстановления желтой соли 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола в темно-синий кристаллический формазан митохондриями живых клеток). По результатам исследования цитотоксичности построены кривые зависимости выживаемости клеток от концентрации 1,2-бис(перфтор-трет-бутокси)этана (фиг.4) и определены показатели IC50 (концентрации, необходимые для гибели 50% клеток).
Клетки рассевали в лунки 96-луночного планшета (NUNC, США) (5000 клеток в 190 мкл культуральной среды), инкубировали 24 ч при 37°С, 5% СО2 в увлажненной атмосфере. Вносили по 10 мкл исследуемых растворов в культуральной среде, приготовленных серийными разведениями из исходного раствора, до конечных концентраций 0,4-200 мкмоль/л (конечная концентрация растворителя не превышала 0,5% об.). Контролем служили клетки без препарата (интактный контроль). Положительным контролем служил доксорубицин (Teva, Нидерланды), показавший цитотоксичность 0,5 мкМ. В эксперименте клетки инкубировали 72 ч при 37°С, 5% СО2 в увлажненной атмосфере, за 2 часа до окончания инкубации клеточную среду меняли на свежую и в лунки вносили по 20 мкл водного раствора МТТ (5 мг/мл, ПанЭко, Россия). После окончания инкубации клеток с МТТ-реагентом культуральную среду отбирали, клетки ресуспендировали в 100 мкл ДМСО и измеряли оптическую плотность раствора на планшетном спектрофотометре Multiscan FC (Thermo Scientific, США) при длине волны 540 нм. Процент клеток, выживших при действии каждой концентрации исследуемого вещества, подсчитывали как частное от деления средней оптической плотности в лунках после инкубации с данной дозой к средней оптической плотности контрольных лунок (значения последних приняты за 100%). Каждую концентрацию изучали с 3-х кратной статистикой, приводили усредненные данные по результатам четырех независимых экспериментов. Стандартные отклонения приведенных на графике средних значений не превысили 10% от среднего.
1,2-Бис(перфтор-трет-бутокси)этан нетоксичен для неопухолевых фибробластов человека за 72 ч инкубации. Образец вызывает рост клеток с увеличением концентрации, гибели клеток не обнаружено. Зависимость выживаемости клеток от концентрации 1,2-бис(перфтор-трет-бутокси)этана представлена графически на фиг. 4.
Проведенные исследования показали, что 1,2-бис(перфтор-трет-бутокси)этан является эффективным контрастным веществом для магнитно-резонансного сканирования на ядрах 19F. Это соединение отвечает требованиям, предъявляемым к контрастным веществам для МРТ. Скорость его выведения составляет примерно 45 дней, что существенно меньше, чем у известных аналогов и прототипа. 1,2-Бис(перфтор-трет-бутокси)этан является нетоксичным соединением, как по результатам клеточного теста, так и по результатам in vivo экспериментов.