Результат интеллектуальной деятельности: ЛИПОФИЛЬНЫЕ ПОЛИАМИНЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области химии, химико-фармацевтической промышленности и медицины и раскрывает липофильные полиамины и их способность вызывать гибель опухолевых клеток различного тканевого происхождения.
Природные полиамины, такие как путресцин, спермидин и спермин, являются необходимыми для нормального роста и функционирования клеток эукариот. Наличие нескольких аминогрупп в структуре определяет их уникальную способность связывать макромолекулы - нуклеиновые кислоты, белки и фосфолипиды [Ramani D. et al. Aliphatic polyamines in physiology and diseases // Clin Nutr, 2014, V. 33, pp. 14-22; Wang J.Y. Polyamines regulate expression of E-cadherin and play an important role in control of intestinal epithelial barrier function // Inflammopharmacol, 2005, V. 13, pp. 91-101]. Содержание полиаминов в клетке регулируется процессами биосинтеза, катаболизма и транспорта. Известно, что повышенное содержание полиаминов в клетке свидетельствует о развитии злокачественных новообразований [Wallace H.M. et al. A perspective of poly amine metabolism // The Biochem. J., 2003, V. 376, №1, pp. 1-14].
В качестве одной из стратегий лечения различных онкологических заболеваний является использование синтетических аналогов природных полиаминов, что позволяет использовать саморегулируемую природу клеточного метаболизма. Преимуществами аналогов полиаминов является способность проникать в клетку, используя различные специальные транспортеры, подавлять активность ферментов биосинтеза полиаминов, и при этом активировать ферменты катаболизма [Nowotarski S.L. et al. Polyamines and cancer: Implications for chemoprevention and chemotherapy // Rev Mol Med.; 2013, V. 15, е3]. Наибольшую противоопухолевую активность проявляют аналоги, которые построены на основе неприродных полиаминов и содержат алкильные заместители различной длины и типа при первичных аминогруппах [Bergeron R.J. et al. Synthesis and Evaluation of Hydroxylated Polyamine Analogues as Antiproliferatives // J. Med. Chem., 2001, V. 44, pp. 2451-2459; Casero R.A. et al. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases // Nat. Rev. Drug Discov., 2007, V. 6, pp. 373-390; Casero R.A. et al. Recent advances in the development of polyamine analogues as antitumor agents // J. Med. Chem., 2009, V. 52, pp. 4551-4573].
В качестве противоопухолевых агентов большой интерес представляют алкильные глицеролипиды, которые являются структурными аналогами фактора активации тромбоцитов. Например, эдельфозин, 1-O-октадецил-2-O-метил-3-глицерофосфохолин, проявлял высокую противоопухолевую активность в отношении ряда раковых клеток [Mollinedo F. Antitumor alkylphospholipid analogs: a promising and growing family of synthetic cell membrane-targeting molecules for cancer treatment // Anti-Cancer agents Med Chem, 2014, V. 14, pp. 495-498], однако быстрая биодеградация и способность разрушать эритроциты (гемолиз) ограничивают применение эдельфозина в клинической практике. Поиск аналогов эдельфозина привел к разработке бесфосфорных катионных алкильных глицеролипидов. Катионные алкильные глицеролипиды должны содержать в своей структуре длинноцепной алкильный заместитель при атоме С(1) и короткоцепной при атоме С(2). Катионная головка может быть представлена аммониевой или гетероциклической группой, которая присоединена непосредственно к глицериновому остову или через спейсер [Plyavnik N.V. et al. Ether lipids as anticancer agents: focus on non-phosphorus cationic glycerolipids // Mini. Rev. Med. Chem., 2006, V. 6, pp. 109-120; Markova A. et al. New alkyl cationic glycerolipids with heterocyclic polar domain are responsible for disorders in the leukemia cells cycle and cells apoptosis // Rus. J. Bioorg. Chem., 2010, V. 36, №4, pp. 574-576]. Данные соединения показывают высокую противоопухолевую активность для ряда клеточных линий и не разрушают эритроциты по сравнению с фосфорсодержащими липидами алкильного типа [Markova А.А. et al. Antitumor phosphate-containing lipids and non-phosphorus alkyl cationic glycerolipids: chemical structures and perspectives of drug development // Russ. Chem. Bull., 2014, V. 5, №63, pp. 1081-1087].
Техническим результатом настоящего изобретения является расширение арсенала средств, обладающих противоопухолевой активностью.
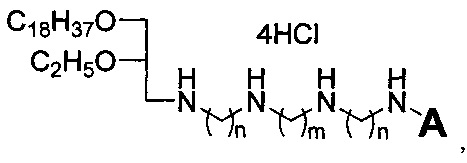
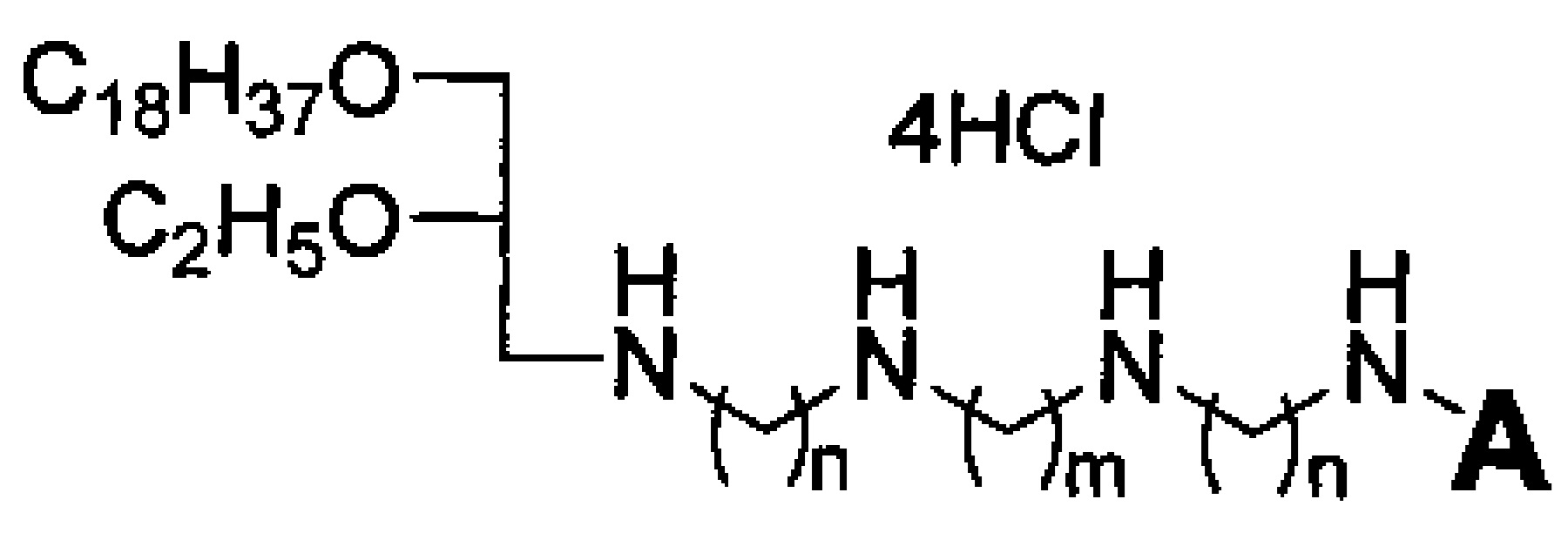
Технический результат достигается липофильными полиаминами общей формулы:
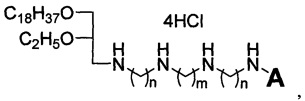
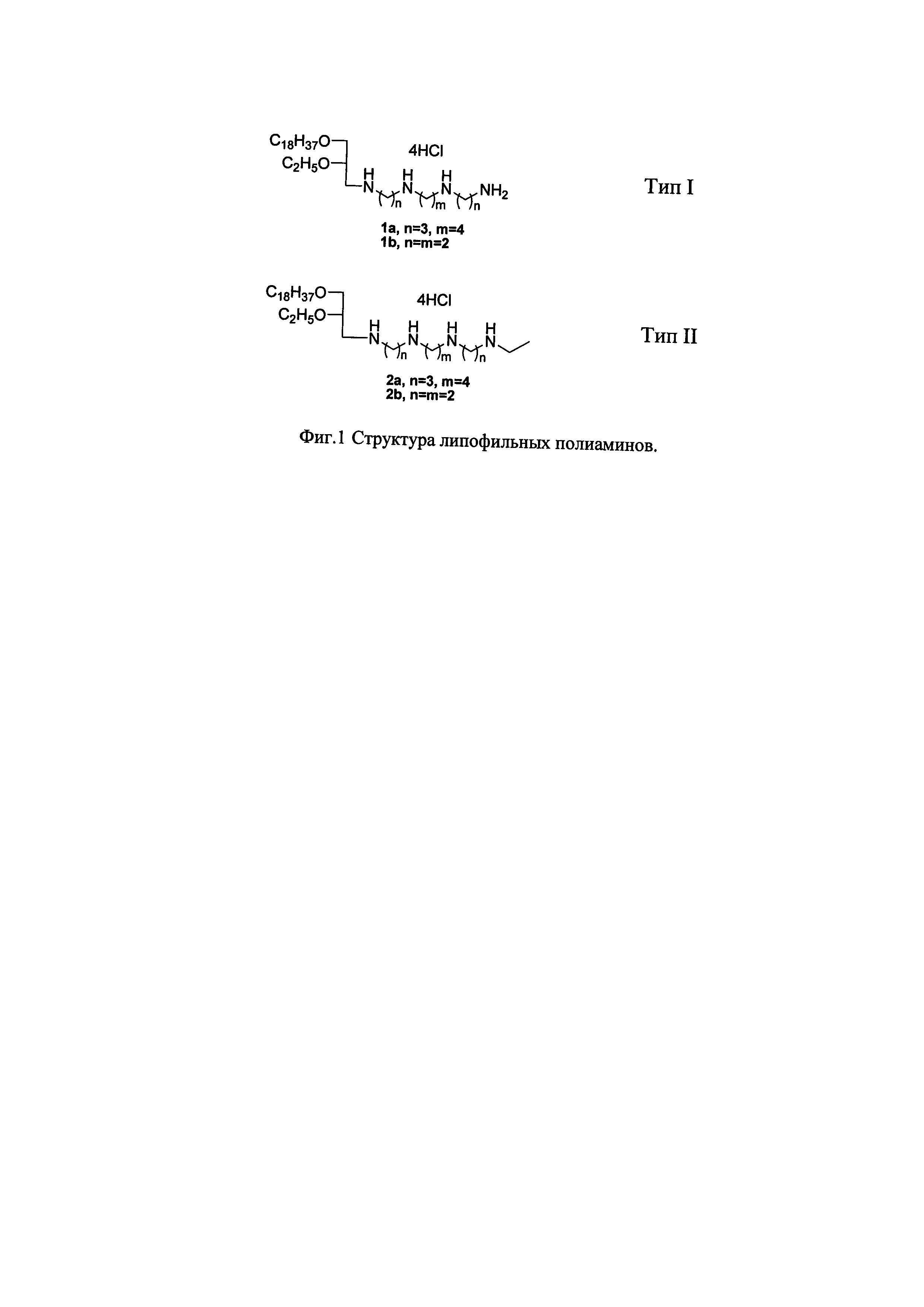
где A выбирается из H и C2H5, n равно 2 или 3, m равно 2 или 4.
Для получения соединений 1a, 1b - Тип I, 2а, 2b - Тип II (фиг. 1) предварительно были получены структурные синтетические блоки. Исходными соединениями служили N4,N9-бис(трет-бутоксикарбонил)-1,12-бис(2-нитробензолсульфониламино)-4,9-диазадодекан, N3,N6-бис(трет-бутоксикарбонил)-1,8-бис(2-нитробензолсульфониламино)-3,6-диазаоктан и 1-дезокси-1-бром-3-O-октадецил-2-O-этил-rac-глицерин. Алкилирование N4,N9-бис(трет-бутоксикарбонил)-1,12-бис(2-нитробензолсульфониламино)-4,9-диазадодекана и N3,N6-бис(трет-бутоксикарбонил)-1,8-бис(2-нитробензолсульфониламино)-3,6-диазаоктана 1-дезокси-1-бром-3-O-октадецил-2-O-этил-rac-глицерином в присутствии карбоната цезия в условиях реакции Фукуямы [Fukuyama Т. et al. 2- and 4-Nitrobenzenesulfonamides: Exceptionally versatile means for preparation of secondary amines and protection of amines // Tetrahedron Lett., 1995, V. 36, pp. 6373-6374] приводило к образованию моноалкилированных производных полиаминов. Для синтеза липофильных полиаминов I типа (Тип I) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекан и N3,N6-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-8-(2-нитробензолсульфониламино)-3,6-диазадодекан подвергали действию тиофенола в присутствии карбоната калия, а затем полученное соединение обрабатывали хлороводородом в диоксане. Для синтеза полиаминов II типа (Тип II) моноалкилированые производные полиаминов N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекан и N3,N6-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-8-(2-нитробензолсульфониламино)-3,6-диазадодекан вводили во взаимодействие с этилбромидом в присутствии карбоната цезия. В последующем полученные соединения были подвергнуты тем же химическим превращениям, как описано для полиаминов I типа.
Этилбромид и карбонат цезия были получены от Fluka; 2-нитробензолсульфонилхлорид, диметилформамид были получены от Aldrich; тиофенол был получен от Merck. Остальные растворители и реагенты были отечественного производства.
Обнаружение пятен на хроматограммах проводили действием хлора с последующим проявлением раствором толуидина, раствора фосформолибденовой кислоты - сульфат церия (IV) с последующим прогреванием и с помощью УФ-лампы (254 нм). Колоночную хроматографию осуществляли на силикагеле Kieselgel 60 (0.040-0.063 mm, Merck). Спектры ЯМР 1H и 13C регистрировали на импульсном Фурье-спектрометре Bruker DPX 300, Bruker DRX 500 (Германия), в CDCl3, MeOH-d4 и D2O. Химические сдвиги ЯМР 1H приведены относительно остаточного сигнала CHCl3 (δН 7.26 м.д.). Значения химических сдвигов (δ) приведены в миллионных долях (м.д.), константа спин-спинового взаимодействия (J) в герцах (Гц). Масс-спектры получали на время-пролетном масс-спектрометре Bruker Ultraflex MALDI-TOF/TOF (Германия) методом лазерно-десорбционной ионизации с использованием 2,5-дигидроксибензойной кислоты в качестве матрицы.
Пример 1.
Синтез 1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-12-амино-4,9-диазадодекан тетрагидрохлорида (1а).
К раствору (0,150 г, 0,344 ммоль) 1-бром-1-дезокси-3-O-октадецил-2-O-этил-rac-глицерина в 15 мл безводного диметилформамида добавили (0,266 г, 0,344 ммоль) N4,N9-бис(трет-бутоксикарбонил)-1,12-бис(2-нитробензолсульфониламино)-4,9-диазадодекана, CS2CO3 (0,168 г, 0,517 ммоль) и NaI (0,052 г, 0,344 ммоль) и перемешивали 18 ч при 85°C. Реакционную смесь после обработки хроматографировали в системе толуол-ацетон (10:1). Получили 0,128 г (33%) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфонил-амино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекана. К раствору (0,065 г, 0,0589 ммоль) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекана в 2 мл безводного диметилформамида добавили тиофенол (0,13 мл, 1,1783 ммоль) и K2CO3 (0,163 г, 1,1783 ммоль) и перемешивали 40 мин при 23°C. После хроматографии на силикагеле (хлороформ-метанол-аммиак, 8:1:0.1) было выделено 0,0319 г (79%) N4,N9-бис-(трет-бутоксикарбонил)-1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-12-амино-4,9-диазадодекана, который растворили в 2 мл хлористого метилена и добавили 4н HCl в диоксане (1 мл). После прохождения реакции растворители удаляли в вакууме, остаток перекристаллизовывали в диэтиловом эфире. Получили 0,0233 г (99%) соединения 1а в виде аморфных белых кристаллов. Спектр ЯМР 1H: 0.88 (т, 3 Н, J 6.9, (CH2)15CH3), 1.24 (т, 3 Н, J 7.0, OCH2CH3), 1.28 (уш.с, 30 Н, (CH2)15CH3), 1.51-1.63 (м, 2 Н, OCH2CH2), 1.78-1.96 (м, 4 Н, NCH2(CH2)2CH2N), 2.05-2.15 (м, 2 Н) и 2.15-2.25 (м, 2 Н, 2 NCH2CH2CH2N), 3.01-3.27 (м, 14 Н, 7 CH2NH), 3.53-3.89 (м, 7 Н CH2OCH2CH2, CHOCH2CH3). Масс-спектр MALDI, m/z: 556.566 [M+H]+, вычислено для [M]+ C33H72N4O2: 557.663.
Пример 2.
Синтез 1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-8-амино-3,6-диазаоктана (1b).
Получали аналогично соединению 1а из N3,N6-бис(трет-бутоксикарбонил)-1,8-бис(2-нитрофенилсульфониламино)-3,6-диазаоктана.
Спектр ЯМР 1H: 0.87 (т, 3 Н, J 6.8, (CH2)15CH3, 1.24 (уш.с, 33 Н, (CH2)15CH3, OCH2CH3), 1.51-1.62 (м, 2 Н, OCH2CH2), 3.09-3.52 (м, 14 Н, 7 CH2NH), 3.58-3.94 (м, 7Н, CH2OCH2CH2, CHOCH2CH3). Масс-спектр MALDI, m/z: 501.659 [M+H]+, вычислено для [M]+ C29H64N4O2: 500.659.
Пример 3.
Синтез 1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-12-этиламино-4,9-диазадодекан тетрагидрохлорида (2а).
К раствору (0,150 г, 0,344 ммоль) 1-бром-1-дезокси-3-O-октадецил-2-O-этил-rac-глицерина в 15 мл безводного диметилформамида добавили (0,266 г, 0,344 ммоль) N4,N9-бис(трет-бутоксикарбонил)-1,12-бис(2-нитробензолсульфониламино)-4,9-диазадодекана, Cs2CO3 (0,168 г, 0,517 ммоль) и NaI (0,052 г, 0,344 ммоль) и перемешивали 18 ч при 85°C. Реакционную смесь после обработки хроматографировали в системе толуол-ацетон (10:1). Получили 0,128 г (33%) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфонил-амино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекана. К раствору (0,0665 г, 0,0597 ммоль) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(2-нитробензолсульфониламино)-4,9-диазадодекана в 2 мл безводного диметилформамида добавили (0,05 мл, 0,5972 ммоль) этилбромида, Cs2CO3 (0,0584 г, 0,1792 ммоль) и NaI (0,0091 г, 0,0597 ммоль) и перемешивали 5 ч при 85°C. После обработки реакционную смесь хроматографировали на силикагеле, элюируя системой толуол-ацетон (10:1). Получили 0,0564 г (83%) N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(N-этил-2-нитробензолсульфониламино)-4,9-диазадодекана. К раствору (0,0564 г, 0,0494 ммоль) соединения N4,N9-бис(трет-бутоксикарбонил)-1-[N-(rac-3-октадецилокси-2-этоксипроп-1-ил)-2-нитробензолсульфониламино]-12-(N-этил-2-нитробензолсульфониламино)-4,9-диазадодекан в 2 мл безводного диметилформамида добавили тиофенол (0,10 мл, 0,9882 ммоль) и K2CO3 (0,136 г, 0,9882 ммоль) и перемешивали 40 мин при 23°C. После хроматографии на силикагеле (хлороформ-метанол-аммиак, 8:1:0.1) было выделено 0,0375 г (97%) N4,N9-бис-(трет-бутоксикарбонил)-1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-12-этиламино-4,9-диазадодекана, который растворили в 2 мл хлористого метилена и добавили 4н HCl в диоксане (1 мл). После прохождения реакции растворители удаляли в вакууме, остаток перекристаллизовывали в диэтиловом эфире. Получили 0,0271 г (97%) соединения 2а в виде аморфных белых кристаллов. Спектр ЯМР 1H: 0.87 (т, 3 Н, J 6.7, (CH2)15CH3), 1.28 (уш.с, 36 Н, (CH2)15CH3, OCH2CH3, NCH2CH3), 1.50-1.62 (м, 2 Н, OCH2CH2), 1.74-1.91 (м, 4 Н, NCH2(CH2)2CH2N), 2.06-2.26 (м, 4 Н, 2 NCH2CH2CH2N), 2.97-3.25 (м, 16 Н, 8 CH2NH), 3.42-3.55 (м, 3 Н), 3.55-3.68 (м, 2 Н), 3.68-3.89 (м, 2 Н CH2OCH2CH2, CHOCH2CH3). Масс-спектр MALDI, m/z: 585.756 [M+H]+, вычислено для [M]+ C35H76N4O2: 584.597.
Пример 4.
Синтез 1-[(rac-3-октадецилокси-2-этоксипроп-1-ил)амино]-8-этиламино-3,6-диазаоктан тетрагидрохлорида (2b).
Получали аналогично соединению 2а из N3,N6-бис(трет-бутоксикарбонил)-1,8-бис(2-нитрофенилсульфониламино)-3,6-диазаоктана.
Спектр ЯМР 1H: 0.87 (т, 3 Н, J 6.8, (CH2)15CH3), 1.31 (уш.с, 36 Н, (CH2)15CH3, OCH2CH3, NHCH2CH3), 1.54-1.69 (м, 2 Н, OCH2CH2), 3.09-3.36 (м, 16 Н, 8 CH2NH), 3.37-3.94 (м, 7Н, CH2OCH2CH2, CHOCH2CH3). Масс-спектр MALDI, m/z: 529.606 [M+H]+, вычислено для [M]+ C31H68N4O2: 528.534.
Пример 5.
Влияние липофильных полиаминов на жизнеспособность клеток линии К562 и НСТ116.
Клетки линий К562 (миелоидный лейкоз) и НСТ1116 (аденокарцинома толстой кишки) культивировали в среде RPMI-1640 или модифицированной Дульбекко среде Игла (ДМЕМ) соответственно, с 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина при 37°C, 5% CO2 в увлажненной атмосфере. В экспериментах использовали культуры в логарифмической фазе роста.
Клетки рассевали на 96-луночные планшеты (Costar, США) в концентрации 5-10×103 клеток в 190 мкл культуральной среды. Растворы соединений в ДМСО (10 мМ) серийно разводили в среде и вносили в лунки с клетками до конечных концентраций 0,1; 0,2; 0,4; 0,8; 1,6; 3,2; 6,4; 12,5; 25; 50 мкМ. Объем вносимых веществ не превышал 5% объема среды в лунках. Каждую концентрацию соединения изучали при 3 повторах. Культуры инкубировали при 37°C в атмосфере с 5% содержанием CO2 в течение 72 часов.
О жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении МТТ в формазан дегидрогеназами митохондрий (МТТ-тест). В лунки вносили по 20 мкл водного раствора МТТ (5 мг/мл, ПанЭко, Россия). После окончания инкубации культуральную среду отбирали, клетки ресуспендировали в 100 мкл ДМСО и измеряли оптическую плотность раствора на планшетном спектрофотометре Multiscan FC (Thermo Scientific, США) при длине волны 591 нм. Процент клеток, выживших при действии каждой дозы полиамина, подсчитывали как частное от деления средней оптической плотности в лунках после инкубации с данной дозой к средней оптической плотности контрольных лунок (значения последних приняты за 100%). Действие растворителя не повлияло на выживаемость клеток. По полученным данным построены кривые выживания клеток.
Из экспериментальных данных вычисляли значение IC50, концентрацию соединения, при которой достигается гибель 50% клеток. Значения IC50 липофильных полиаминов для клеток приведены в таблице 1.

Приведенные данные показывают, что новые липофильные полиамины 1a, 1b, 2а, 2b вызывают гибель опухолевых клеток в микромолярном диапазоне концентраций. Для клеток лейкоза цитотоксичность исследованных соединений выше, чем для аденокарциномы кишки; соединение 2b активно для обеих линий. Значения IC50 для клеток лейкоза К562 ниже, чем соответствующие показатели при действии на эти же клетки ранее полученных глицеролипидов [Markova А.А. et al. Antitumor phosphate-containing lipids and non-phosphorus alkyl cationic glycerolipids: chemical structures and perspectives of drug development // Russ. Chem. Bull., 2014, V. 5, №63, pp. 1081-1087]. Повышенная цитотоксичность и определенная избирательность действия обусловливают перспективность нового химического класса для создания противолейкозных препаратов на его основе.