Результат интеллектуальной деятельности: НОВЫЕ НАЦЕЛИВАЮЩИЕ НА ПЕЧЕНЬ АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ
Вид РИД
Изобретение
[0001] По этой заявке испрашивается приоритет временной заявки на патент США No. 62/671265, поданной 14 мая 2018 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛКИ МАТЕРИАЛА, ПРИНЯТОГО В ЭЛЕКТРОННОЙ ФОРМЕ
[0002] Настоящая заявка содержит, в качестве отдельной части описания, список последовательностей в машиночитаемой форме, полное содержание которого приведено в качестве ссылки, и который идентифицирован следующим образом: наименование файла: 53120_Seqlisting.txt; размер: 68361 байт; создан: 10 мая 2019 г.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Изобретение относится к новым капсидным белкам аденоассоциированного вируса (AAV), к частицам AAV, содержащим новый капсидный белок, к полинуклеотидам, кодирующим эти капсидные белки, и к векторам AAV, экспрессирующим эти капсидные белки. Изобретение также относится к способам получения описанных в настоящем описании векторов AAV, экспрессирующих новые капсидные белки по изобретению, и к ассоциированным их терапевтическим применениям.
УРОВЕНЬ ТЕХНИКИ
[0004] AAV представляет собой дефектный по репликации парвовирус, одноцепочечный ДНК-геном которого имеет длину 4,7 т.п.о., включая 145-нуклеотидный инвертированный концевой повтор (ITR). Нуклеотидная последовательность генома AAV серотипа 2 (AAV2) представлена в Srivastava et al., J. Virol., 45: 555-564 (1983) с коррекцией в Ruffing et al., J. Gen. Virol., 75: 3385-3392 (1994). Цис-действующие последовательности, управляющие репликацией (rep), капсидированием/упаковкой и интеграцией в хромосому клетки-хозяина вирусной ДНК, содержатся внутри ITR. Три промотора AAV, p5, p19 и p40 (названные по их относительным локализациям на карте), управляют экспрессией двух внутренних открытых рамок считывания AAV, кодирующих гены rep и cap. Два промотора rep (p5 и p19), в сочетании с дифференциальным сплайсингом одного интрона AAV (в нуклеотидах 2107 и 2227), приводят к продукции четырех белков rep (rep 78, rep 68, rep 52 и rep 40) с гена rep. Белки rep имеют множество ферментных свойств, которые, в конечном счете, ответственны за репликацию вирусного генома. Ген cap экспрессируется с промотора p40 и кодирует три капсидных белка VP1, VP2 и VP3. Альтернативный сплайсинг и неконсенсусный участок начала трансляции являются ответственными за продукцию трех родственных капсидных белков. Единственный консенсусный участок полиаденилирования локализован в положении 95 карты генома AAV. Обзор жизненного цикла и генетики AAV приведен в Muzyczka, Current Topics in Microbiology and Immunology, 158: 97-129 (1992).
[0005] Когда AAV инфицирует клетку человека, вирусный геном может интегрировать в хромосому 19, приводя к латентной инфекции клетки. Продукция инфекционного вируса не происходит, если только клетка не инфицирована вирусом-помощником (например, аденовирусом или вирусом герпеса). В случае аденовируса, гены E1A, E1B, E2A, E4 и VA обеспечивают функции помощника. После инфекции вирусом-помощником, происходит спасение и амплификация провируса AAV, и продукция как AAV, так и аденовируса.
[0006] AAV имеет уникальные признаки, которые делают его привлекательным в качестве вакцинного вектора для экспрессии иммуногенных пептидов/полипептидов и в качестве вектора для доставки чужеродной ДНК в клетки, например, при генотерапии. Инфекция AAV клеток в культуре не является цитопатической, и естественная инфекция человека и других животных является молчащей и бессимптомной. Кроме того, AAV инфицирует множество клеток млекопитающих, обеспечивая возможность нацеливания на множество различных тканей in vivo. Геном провируса AAV является инфекционным в форме клонированной ДНК в плазмидах, что делает конструирование рекомбинантных геномов целесообразным. Кроме того, поскольку сигналы, управляющие репликацией, капсидированием и интеграцией AAV, содержатся внутри ITR из генома AAV, некоторую часть или все из внутренних приблизительно 4,3 т.п.о. генома (кодирующих белки репликации и структурные капсидные белки, rep-cap) можно заменять чужеродной ДНК, такой как генная кассета, содержащая промотор, представляющую интерес ДНК и сигнал полиаденилирования. Белки rep и cap могут быть предоставлены в транс-положении. Другим важным признаком AAV является то, что он является необычайно стабильным и прочным вирусом. Он легко выдерживает условия, используемые для инактивации аденовируса (56° - 65°C в течение нескольких часов), что делает сохранение rAAV-векторов при охлаждении менее критичным. AAV можно даже подвергать лиофилизации. Наконец, инфицированные AAV клетки не являются устойчивыми к суперинфекции.
[0007] Векторы AAV используют в многочисленных применениях для генотерапии млекопитающих, и существует необходимость в новых и/или модифицированных векторах AAV, и ассоциированном вирусе, используемых в применениях для генотерапии. Настоящее изобретение относится к новым векторам AAV, экспрессирующим новые капсидные белки AAV по настоящему изобретению, и к новым, неприродным вирионам AAV, содержащим эти векторы или капсидные белки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Изобретение относится к новым капсидным белкам AAV, которые могут представлять собой новые капсидные белки VP1, VP2 или VP3, к неприродному вирусу AAV, содержащему любюой из этих капсидных белков, и к использованию такого вируса AAV для применений в генотерапии, и к использованию в получении лекарственных средств для применений в генотерапии. В некоторых вариантах осуществления, капсидные белки AAV были выделены и идентифицированы из различных тканей млекопитающих. Аминокислотные последовательности конкретных новых капсидных белков VP1 полученного из млекопитающего AAV, указаны как SEQ ID NO:1-7, и ассоциированные локализации соответствующих последовательностей VP2 и VP3 также описаны в настоящем описании. В совокупности, новые капсидные белки обозначены в настоящем описании как «капсидные белки AAV по изобретению».
[0009] В одном варианте осуществления, изобретение относится к аденоассоциированному вирусу (AAV), имеющему капсидный белок, имеющий аминокислотную последовательность, которая является по меньшей мере на 95% идентичной (i) любой из SEQ ID NO:1-7, (ii) области VP2 из любой из SEQ ID NO:1-7 или (iii) области VP3 из любой из SEQ ID NO:1-7, и кроме того, имеющему трансген, где трансген состоит из гетерологичного гена, функционально связанного с регуляторными последовательностями, контролирующими экспрессию гетерологичного гена в клетке-хозяине. В другом варианте осуществления, капсидный белок имеет аминокислотную последовательность из (i) любой из SEQ ID NO:1-7, (ii) области VP2 из любой из SEQ ID NO:1-7 или (iii) области VP3 из любой из SEQ ID NO:1-7. В другом варианте осуществления, AAV имеет последовательность инвертированного концевого повтора AAV. В следующих вариантах осуществления, AAV смешивают с физиологически совместимым носителем.
[0010] В другом варианте осуществления, изобретение относится к способу доставки трансгена в клетку, включающему стадию приведения клетки в контакт с любым AAV, описанным в настоящем описании. В другом варианте осуществления, изобретение относится к способу лечения субъекта от нарушения или заболевания, ассоциированного с аномальной активностью эндогенного белка, включающему стадию введения субъекту эффективного количества AAV, описанного в настоящем описании, где AAV имеет трансген, кодирующий биологически активную копию белка. В другом варианте осуществления, способы включают доставку трансгена в клетку печени.
[0011] В следующем варианте осуществления, изобретение относится к композиции, содержащей любой AAV по изобретению, для доставки трансгена в клетку, такую как клетка печени. Кроме того, изобретение относится к применению любого из AAV по изобретению для получения лекарственного средства для доставки трансгена в клетку.
[0012] В одном варианте осуществления, изобретение относится к выделенному капсидному белку аденоассоциированного вируса (AAV), где капсидный белок содержит (i) аминокислотную последовательность, по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности VP1 из любой из SEQ ID NO:1-7, или области VP2 или VP3 из любой из SEQ ID NO:1-7, или (ii) аминокислотную последовательность VP1, содержащую любую из SEQ ID NO:1-7, или области VP2 или VP3 из любой из SEQ ID NO:1-7. В конкретных вариантах осуществления, капсидный белок связан с гетерологичной аминокислотной последовательностью. Изобретение относится также к неприродным частицам AAV, имеющим или содержащим любой из этих капсидных белков. В конкретных вариантах осуществления, неприродная частица AAV, содержащая любой из вышеописанных капсидных белков VP1, VP2 или VP3, содержит нуклеиновую кислоту, имеющую инвертированные концевые повторы AAV, и трансген, содержащий гетерологичный ген, функционально связанный с регуляторными последовательностями, управляющими экспрессией гетерологичного гена в клетке-хозяине. В других вариантах осуществления, неприродная частица AAV, содержащая любую из капсидных последовательностей VP1, VP2 или VP3, описанных в настоящем описании, содержит гетерологичный трансген, функционально связанный с регуляторными последовательностями, контролирующими экспрессию трансгена в клетке-хозяине. В рамках изобретения, термины «гетерологичный ген» или «гетерологичная регуляторная последовательность» означают, что упомянутый ген или регуляторная последовательность, не присутствуют в природе в векторе или частице AAV и искусственно введены туда. Термин «трансген» относится к нуклеиновой кислоте, которая содержит как гетерологичный ген, так и регуляторные последовательности, функционально связанные с гетерологичным геном, контролирующие экспрессию этого гена в клетке-хозяине.
[0013] Изобретение относится также к полинуклеотиду, содержащему нуклеотидную последовательность, кодирующую капсидный белок аденоассоциированного вируса (AAV), где капсидный белок содержит (i) аминокислотную последовательность, по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности VP1 из любой из SEQ ID NO:1-7, или области VP2 или VP3 из любой из SEQ ID NO:1-7, или (ii) аминокислотную последовательность VP1, содержащую любую из SEQ ID NO:1-7 или области VP2 или VP3 из любой из SEQ ID NO:1-7, где полинуклеотид является функционально связанным с гетерологичной регуляторной контрольной последовательностью. Таким образом, понятно, что полинуклеотиды по настоящему изобретению являются неприродными. Изобретение относится также к векторам AAV, содержащим любую из этих полинуклеотидных последовательностей, функционально связанную с гетерологичной регуляторной последовательностью, и к композициям, содержащим эти векторы AAV, включая фармацевтические композиции.
[0014] В другом варианте осуществления, изобретение относится к выделенному аденоассоциированному вирусному (AAV) вектору, содержащему полинуклеотидную последовательность, кодирующую капсидный белок, и гетерологичную последовательность трансгена, где капсидный белок содержит (i) аминокислотную последовательность, по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности VP1 из любой из SEQ ID NO:1-7, или области VP2 или VP3 из любой из SEQ ID NO:1-7, или (ii) аминокислотную последовательность VP1, содержащую любую из SEQ ID NO:1-7, или области VP2 или VP3 из любой из SEQ ID NO:1-7. Изобретение относится также к композициям, содержащим эти векторы AAV, включая фармацевтические композиции.
[0015] В другом варианте осуществления, изобретение относится к аденоассоциированному вирусу (AAV), содержащему капсидный белок, где капсидный белок содержит функциональный фрагмент из любой из SEQ ID NO: 1-7, и дополнительно содержащему трансген, содержащий гетерологичный ген, функционально связанный с регуляторной последовательностью, контролирующей экспрессию гетерологичного гена в клетке-хозяине. Например, функциональный фрагмент содержит одно или несколько из вариабельных областей (VR), константных областей, локализованных между вариабельными областями, домена GBS и петли GH из аминокислотной последовательности из любой из SEQ ID NO: 1-7. Изобретение относится также к композициям, содержащим эти векторы AAV, включая фармацевтические композиции.
[0016] В следующем варианте осуществления, изобретение относится к аденоассоциированному вирусу, содержащему капсидный белок, где капсидный белок содержит аминокислотную последовательность, кодированную нуклеотидной последовательностью, которая гибридизуется с нуклеотидной последовательностью, кодирующей (i) аминокислотную последовательность из любой из SEQ ID NO: 1-7, (ii) область VP2 из аминокислотной последовательности из любой из SEQ ID NO: 1-7, или область VP3 из аминокислотной последовательности из любой из SEQ ID NO: 1-7, и дополнительно содержащему трансген, содержащий гетерологичный ген, функционально связанный с регуляторной последовательностью, контролирующей экспрессию гетерологичного гена в клетке-хозяине. Например, нуклеотидная последовательность гибридизуется с нуклеотидной последовательностью, кодирующей капсидный белок или функциональный фрагмент капсидного белка по изобретению, в строгих условиях. Изобретение относится также к композициям, содержащим эти векторы AAV, включая фармацевтические композиции.
[0017] «Вариабельные области» относятся к девяти вариабельным областям внутри последовательности VP1 капсидного белка AAV. Вариабельные области (VR) обозначены в настоящем описании как VR I, VR II, VR III, VR IV, VR V, VR VI, VR VII, VR VIII и VR IX, и их соответствующие локализации в различных последовательностях VP1 описаны в настоящем описании. VR имеют наивысшую изменчивость последовательности и структуры внутри капсидной последовательности VP1 AAV, и могут также играть роли в присоединении рецепторов, активации транскрипции трансгенов, трансдукции тканей и антигенности.
[0018] «Связывающая гликан последовательность (GBS)» или «домен GBS», или «область GBS» относятся к аминокислотной последовательности, локализованной между VR IV и VR V, управляющей специфичностью связывания гликанов вирусным капсидом. Локализации областей GBS в различных аминокислотных последовательностях VP1 AAV описаны в настоящем описании, и локализации из других аминокислотных последовательностей VP1 AAV известны в данной области и/или могут быть идентифицированы общепринятым образом.
[0019] «Петля GH» относится к последовательности петли, фланкированной β-цепью G и β-цепью H внутри внутренней β-бочки капсидного белка. Последовательность «петли GH» содержит вариабельную область VR IV - VR VIII, включая охваченную последовательность GBS и все перемежающие консервативные последовательности остова от донора. Локализации областей петли GH в различных аминокислотных последовательностях VP1 AAV описаны в настоящем описании, и локализации из других аминокислотных последовательностей VP1 AAV могут быть идентифицированы общепринятым образом.
[0020] Применительно к описанным в настоящем описании локализациям областей VR, GBS и петли GH, отмечено, что локализация N-конца и/или C-конца этих областей может отклоняться на вплоть до 1 аминокислоты, 2 аминокислот, 3 аминокислот, 4 аминокислот или 5 аминокислот от локализаций аминокислот из этих областей, как они явно описаны в настоящем описании (в частности, в таблице 2). Новые капсидные последовательности, содержащие замещенные область(области) VR, GBS и/или петли GH, которые могут отклоняться на вплоть до 5 аминокислот на N-конце и/или C-конце, как определено в настоящем описании, включены в настоящее изобретение.
[0021] Изобретение относится к способам получения частицы рекомбинантного аденоассоциированного вируса (AAV), включающим стадии: культивирования клетки, трансфицированной любым из векторов AAV по изобретению, и выделения рекомбинантной частицы AAV из супернатанта трансфицированной клетки. Кроме того, изобретение относится к вирусным частицам, содержащим любой из вирусных векторов или капсидных белков по изобретению, и к клеткам, содержащим эти вирусные векторы.
[0022] Один вариант осуществления изобретения относится к способу получения любого из рекомбинантных AAV, описанных в настоящем описании, посредством культивирования клетки для вирусной продукции, в которую введен первый вектор на основе нуклеиновой кислоты, имеющий 5’- и 3’-последовательности инвертированного концевого повтора AAV, фланкирующие трансген, имеющий гетерологичный ген, функционально связанный с регуляторными последовательностями, контролирующими экспрессию гетерологичного гена в клетке-хозяине, и второй вектор на основе нуклеиновой кислоты, имеющий последовательности нуклеиновых кислот rep и cap AAV, где указанная последовательность нуклеиновой кислоты cap кодирует капсид AAV, который является по меньшей мере на 95% идентичным любой из SEQ ID NO:1-7; и выделения AAV из супернатанта культуры клеток для вирусной продукции. В другом варианте осуществления, клетка для вирусной продукции происходит из млекопитающего. В предпочтительном варианте осуществления, клетка млекопитающего представляет собой клетку HEK293.
[0023] В другом варианте осуществления, изобретение относится к способам лечения пациента, страдающего от нарушения или заболевания, включающим введение пациенту эффективного количества любого из векторов или вируса AAV по изобретению.
[0024] В следующем варианте осуществления, изобретение относится к применению любого из векторов или вирусов AAV по изобретению для получения лекарственного средства для лечения нарушения или заболевания. Изобретение относится также к композициям, содержащим любой из векторов или вирусов AAV по изобретению, для лечения заболевания или нарушения.
[0025] В другом варианте осуществления, заболевание или нарушение у субъекта ассоциировано с аномальной активностью эндогенного белка. В рамках изобретения, «эндогенный белок» обозначает белок или продукт гена, кодированный геномом субъекта, страдающего заболеванием или нарушением.
[0026] «Вирион AAV» или «вирусная частица AAV», или «векторная частица AAV», или «вирус AAV» относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка AAV и инкапсидированного полинуклеотидного вектора AAV. Если частица содержит гетерологичный полинуклеотид (т.е., полинуклеотид, отличный от генома AAV дикого типа, такой как трансген, подлежащий доставке в клетку млекопитающего), она, как правило, обозначена как «векторная частица AAV» или просто как «вектор AAV». Таким образом, продукция векторной частицы AAV обязательно включает продукцию вектора AAV, поскольку такой вектор содержится внутри векторной частицы AAV.
[0027] Изобретение относится также к клеткам, содержащим любой из векторов AAV по изобретению, и к вирусным частицам, продуцированным этими клетками, по изобретению.
[0028] Термин «инвертированный концевой повтор (ITR)», в рамках изобретения, относится к известным в данной области областям, обнаруженным на 5’- и 3’-концах генома AAV, функционирующим в цис-положении в качестве точек начала репликации ДНК и в качестве сигналов упаковки для вирусного генома. ITR AAV, вместе с кодирующей областью rep AAV, обеспечивают эффективное вырезание и спасение из плазмидного вектора, и интеграцию нуклеотидной последовательности, расположенной между двумя фланкирующими ITR, в геном клетки-хозяина. Последовательности конкретных ассоциированных с AAV ITR описаны в Yan et al., J. Virol. 79(1):364-379 (2005), полное содержание которого приведено в настоящем описании в качестве ссылки.
[0029] Фраза «функции помощника для получения продуктивной инфекции AAV», в рамках изобретения, относится к происходящим из AAV кодирующим последовательностям, которые можно экспрессировать для получения продуктов гена AAV, которые, в свою очередь, функционируют в транс-положении для продуктивной репликации AAV. Таким образом, функции помощника AAV включают области rep и cap. Показано, что продукты экспрессии rep имеют множество функций, включая, среди прочих: узнавание, связывание и внесение ников в точку начала репликации ДНК AAV; активность ДНК-хеликазы; и модуляцию транскрипции с промоторов AAV (или других гетерологичных). Продукты экспрессии cap обеспечивают необходимые функции упаковки. Функции помощника AAV используют в настоящем описании для комплементации в транс-положении функций AAV, отсутствующих в векторах AAV. Функции помощника для получения продуктивной инфекции AAV могут также включать конкретные функции помощника из бакуловируса, вируса герпеса, аденовируса или вируса осповакцины.
[0030] В некоторых вариантах осуществления, вирусная конструкция содержит нуклеотидную последовательность, кодирующую гены rep и cap AAV.
[0031] Термин «ген rep AAV», в рамках изобретения, относится к области генома AAV, известной в данной области, которая кодирует белки репликации вируса, необходимые для репликации вирусного генома и для вставки вирусного генома в геном хозяина в ходе латентной инфекции. Дополнительное описание кодирующей области rep AAV, см., например, в Muzyczka et al., Current Topics in Microbiol. and Immunol. 158:97-129 (1992); Kotin et al., Human Gene Therapy 5:793-801 (1994), полное содержание которых приведено в настоящем описании в качестве ссылки. Кодирующая область rep, в рамках изобретения, может происходить из любого вирусного серотипа, такого как серотипы AAV, описанные выше. Область не должна обязательно включать все гены дикого типа, но ее можно изменять, например, посредством вставки, делеции или замены нуклеотидов, при условии, что гены rep сохраняют желательные функциональные характеристики при экспрессии в подходящей клетке-реципиенте.
[0032] Термин «ген cap AAV», в рамках изобретения, относится к области генома AAV, известной в данной области, которая кодирует белки оболочки вируса, необходимые для упаковки вирусного генома. Дополнительное описание кодирующей области cap, см., например, в Muzyczka et al., Current Topics in Microbiol. and Immunol. 158:97-129 (1992); Kotin et al., Human Gene Therapy 5:793-801 (1994), полное содержание которых приведено в настоящем описании в качестве ссылки. Кодирующая область AAV, в рамках изобретения, может происходить из любого серотипа AAV, как описано выше. Область не должна обязательно включать все гены cap дикого типа, но ее можно изменять, например, посредством вставки, делеции или замены нуклеотидов, при условии, что гены обеспечивают достаточные функции упаковки, когда присутствуют в клетке-хозяине, вместе с вектором AAV.
[0033] Термин «трансфекция» используют для обозначения поглощения чужеродной ДНК клеткой. Клетка была «трансфицирована», когда экзогенная ДНК была введена внутрь мембраны клетки. Ряд способов трансфекции в общем известен в данной области. См., например, Graham et al., Virology 52:456 (1973); Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, New York (1989); Davis et al., Basic Methods in Molecular Biology, Elsevier (1986); Chu et al., Gene 13:197 (1981), полное содержание которых приведено в настоящем описании в качестве ссылки. Такие способы можно использовать для введения одной или нескольких групп экзогенной ДНК, таких как вектор, для интеграции нуклеотидов и других молекул нуклеиновой кислоты, в пригодные клетки-хозяева. Термин включает способы химической, электрической и опосредованной вирусами трансфекции.
[0034] В другом аспекте, настоящее изобретение относится к частице AAV, полученной способом, описанным в настоящем описании. В некоторых вариантах осуществления, частица AAV содержит в своем геноме по меньшей мере один нуклеотид, кодирующий гетерологичный белок.
[0035] Термин «гетерологичные белки или пептиды» относится к любому белку, который не экспрессируется AAV дикого типа, включая метки, такие как гексагистидин, FLAG, myc, полигистидин, или ярлыки или иммуногены, адъюванты, селективные маркеры, терапевтические белки, или нацеливающие белки или пептиды, среди прочего.
[0036] Иллюстративный гетерологичный белок, описанный в настоящем описании, включает, но без ограничения, β-глобин, гемоглобин, тканевой активатор плазминогена и факторы свертывания; колониестимулирующие факторы (CSF); интерлейкины, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9 и т.д.; факторы роста, такие как фактор роста кератиноцитов (KGF), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF, такой как основный FGF и кислый FGF), фактор роста гепатоцитов (HGF), инсулиноподобные факторы роста (IGF), костный морфогенетический белок (BMP), эпидермальный фактор роста (EGF), фактор-9 роста и дифференцировки (GDF-9), происходящий из гепатомы фактор роста (HDGF), миостатин (GDF-8), фактор роста нервов (NGF), нейтрофины, фактор роста тромбоцитов (PDGF), тромбопоэтин (TPO), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β) и т.п.; растворимые рецепторы, такие как растворимые рецепторы TNF-α, растворимые рецепторы интерлейкина (например, растворимые рецепторы IL-1 и растворимые рецепторы IL-1 типа II), растворимые рецепторы γ/Δ-Т-клеток, лигандсвязывающие фрагменты растворимого рецептора и т.п.; ферменты, такие как α-глюкозидаза, имиглюцераза, β-глюкоцереброзидаза и альглюцераза; активаторы ферментов, такие как тканевой активатор плазминогена; хемокины, такие как 1P-10, монокин, индуцированный интерфероном-гамма (Mig), Groα/IL-8, RANTES, MIP-1α, MIP-1β, MCP-1, PF-4 и т.п.; ангиогенные агенты, такие как факторы роста эндотелия сосудов (VEGF, например, VEGF121, VEGF165, VEGF-C, VEGF-2), происходящий из глиомы фактор роста, ангиогенин, ангиогенин-2; и т.п.; антиангиогенные агенты, такие как растворимый рецептор VEGF; белковую вакцину; нейроактивные пептиды, такие как фактор роста нервов (NGF), брадикинин, холицистокинин, гастин, секретин, окситоцин, высвобождающий гонадотропин гормон, бета-эндорфин, энкефалин, субстанцию P, соматостатин, пролактин, галанин, гормон, высвобождающий гормон роста, бомбезин, динорфин, варфарин, нейротензин, мотилин, тиреотропин, нейропептид Y, лютеинизирующий гормон, кальцитонин, инсулин, глюкагоны, вазопрессин, ангиотензин II, высвобождающий тиреотропин гормон, вазоактивный кишечный пептид, пептид сна и т.п.; тромболитические средства; предсердный натрийуретический пептид; релаксин; глиальный фибриллярный кислый белок; фолликулостимулирующий гормон (FSH); антитрипсин альфа-1 человека; ингибирующий лейкоз фактор (LIF); тканевые факторы, лютеинизирующий гормон; факторы активации макрофагов; фактор некроза опухоли (TNF); фактор хемотаксиса нейтрофилов (NCF); тканевые ингибиторы металлопротеиназ; вазоактивный кишечный пептид; ангиогенин; ангиотропин; фибрин; гирудин; антагонисты рецептора IL-1; цилиарный нейротрофический фактор (CNTF); нейротрофический фактор головного мозга (BDNF); нейтрофины 3 и 4/5 (NT-3 и 4/5); нейротрофический фактор глиальных клеток (GDNF); декарбоксилазу ароматических аминокислот (AADC); фактор VIII, фактор IX, фактор X; дистрофин или минидистрофин; лизосомальную кислую липазу; фенилаланингидроксилазу (PAH); ферменты, связанные с гликогенозами ферменты, такие как глюкоза-6-фосфатаза, кислая мальтаза, линеаризующий гликоген фермент, мышечная гликогенфосфорилаза, гликогенфосфорилаза печени, мышечная фосфофруктокиназа, киназа фосфорилазы, транспортер глюкозы, альдолаза A, β-енолаза, гликогенсинтаза; и лизосомальные ферменты.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0037] Фигура 1 представляет собой набор таблиц, показывающий относительную тканеспецифичность инфекционности AAV, имеющего обозначенные новые капсидные белки. Данные представлены как суммарный поток в каждой ткани (фотонов/с/см2/радиан). Для каждой ткани верхний ряд представляет средний поток, и нижний ряд представляет стандартное отклонение.
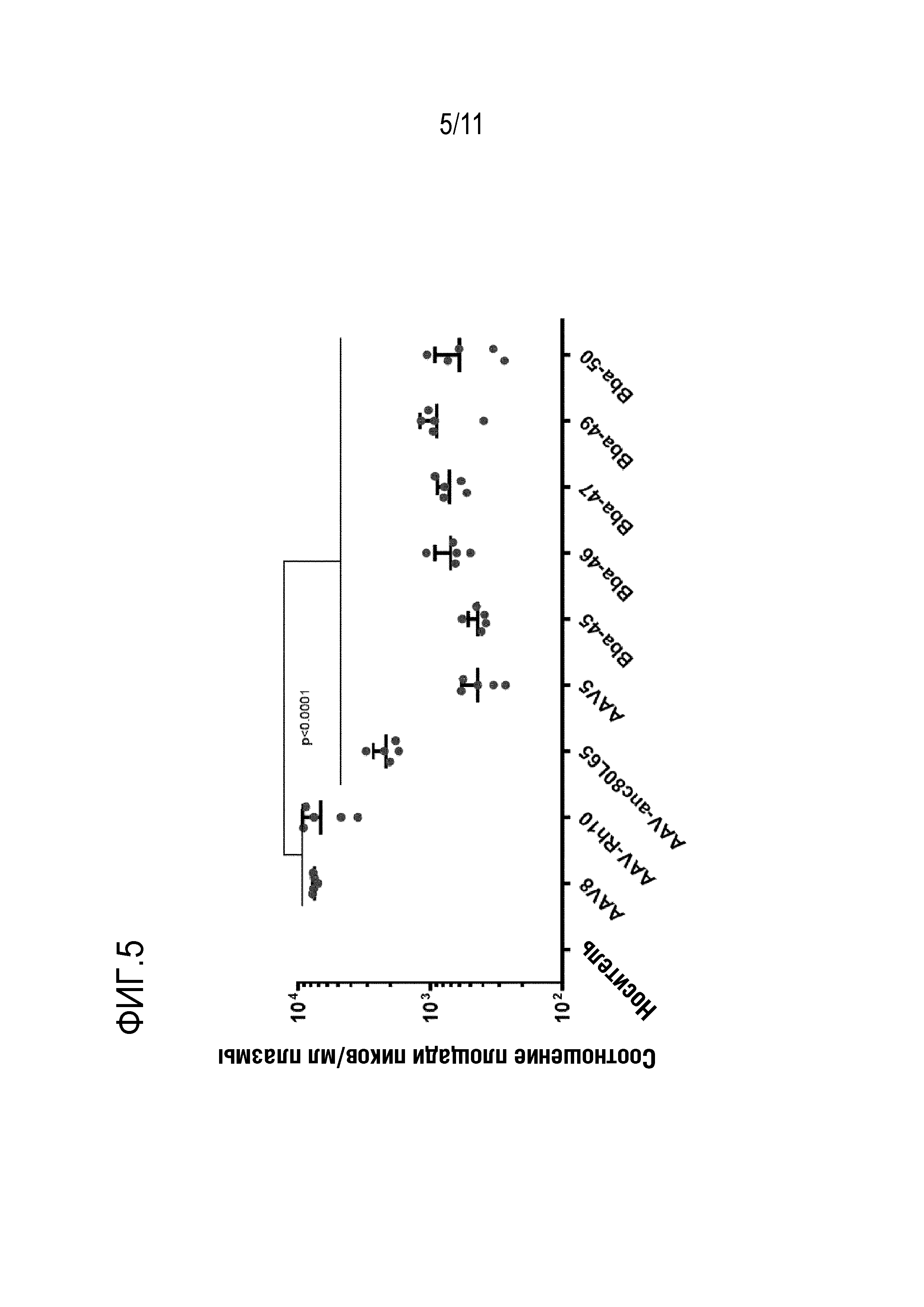
[0038] На фигуре 2 представлены данные анализа нейтрализации IVIG для новых капсидов: Bba-45, Bba-46, Bba-47, Bba-50 и Bba-51, и контрольных капсидов: AAV5, AAV8 и AAV9. Этот анализ показывает, что новые капсиды имеют свойства устойчивости к IVIG.
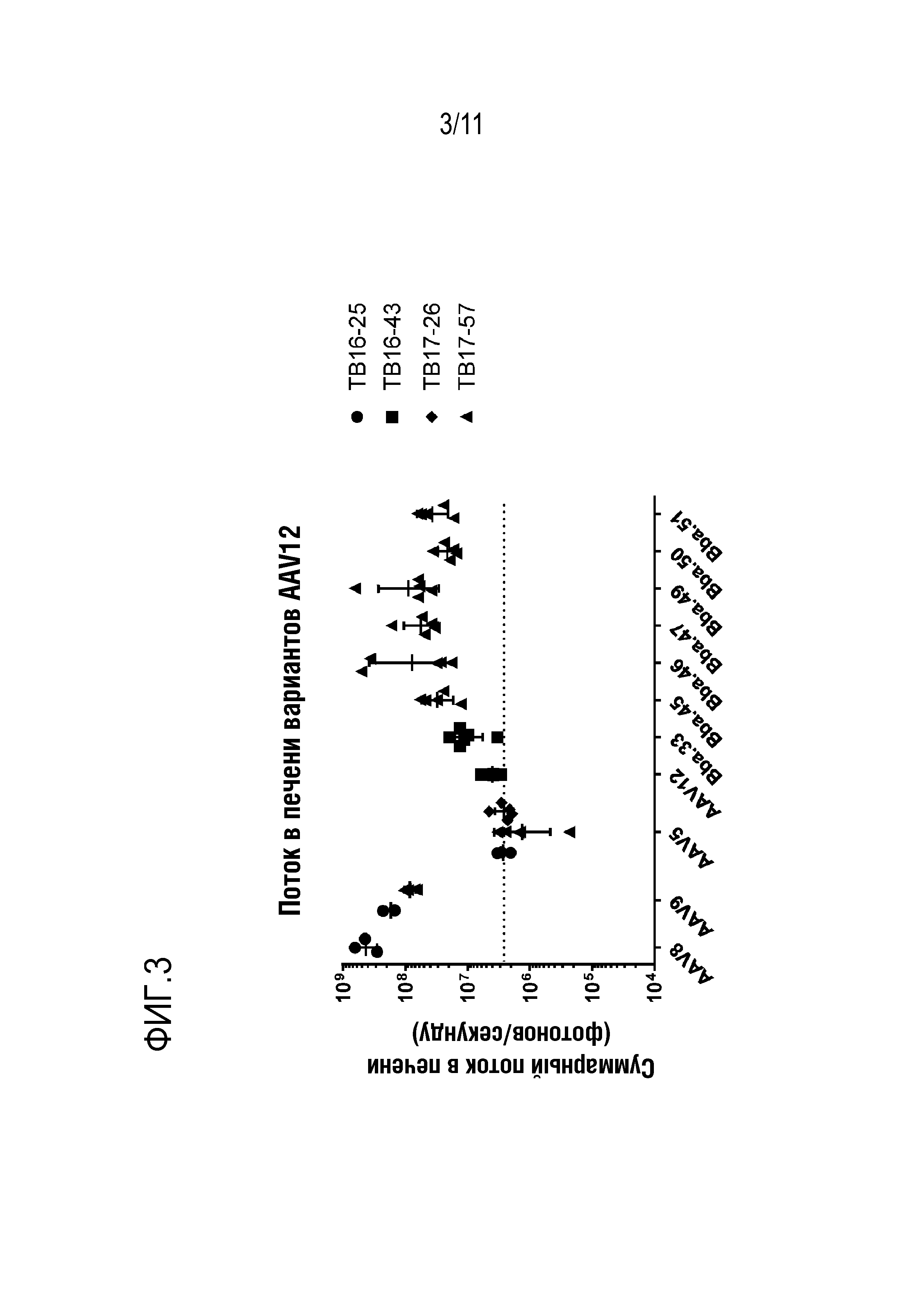
[0039] На фигуре 3 представлены данные трансдукции для новых капсидов: Bba-45, Bba-46, Bba-47, Bba-50 и Bba-51, и контрольных капсидов: AAV5, AAV8 и AAV9. Эти данные получены во множестве экспериментов, и множество точек данных для каждого капсида представляет различные эксперименты. AAV, имеющие новые капсиды, имеют значимо более высокую степень специфичности для клеток печени, по сравнению с AAV5. Данные показаны как суммарный поток активности, который является представлением инфекционности AAV для каждой системы органов.
[0040] На фигуре 4 представлены данные трансдукции множества тканей для новых капсидов: Bba-45, Bba-46, Bba-47, Bba-50 и Bba-51, и контрольных капсидов: AAV5, AAV8 и AAV9. Эти данные показывают, что AAV, имеющие новые капсиды, имеют значимо более высокую степень специфичности для клеток печени, по сравнению с AAV5.
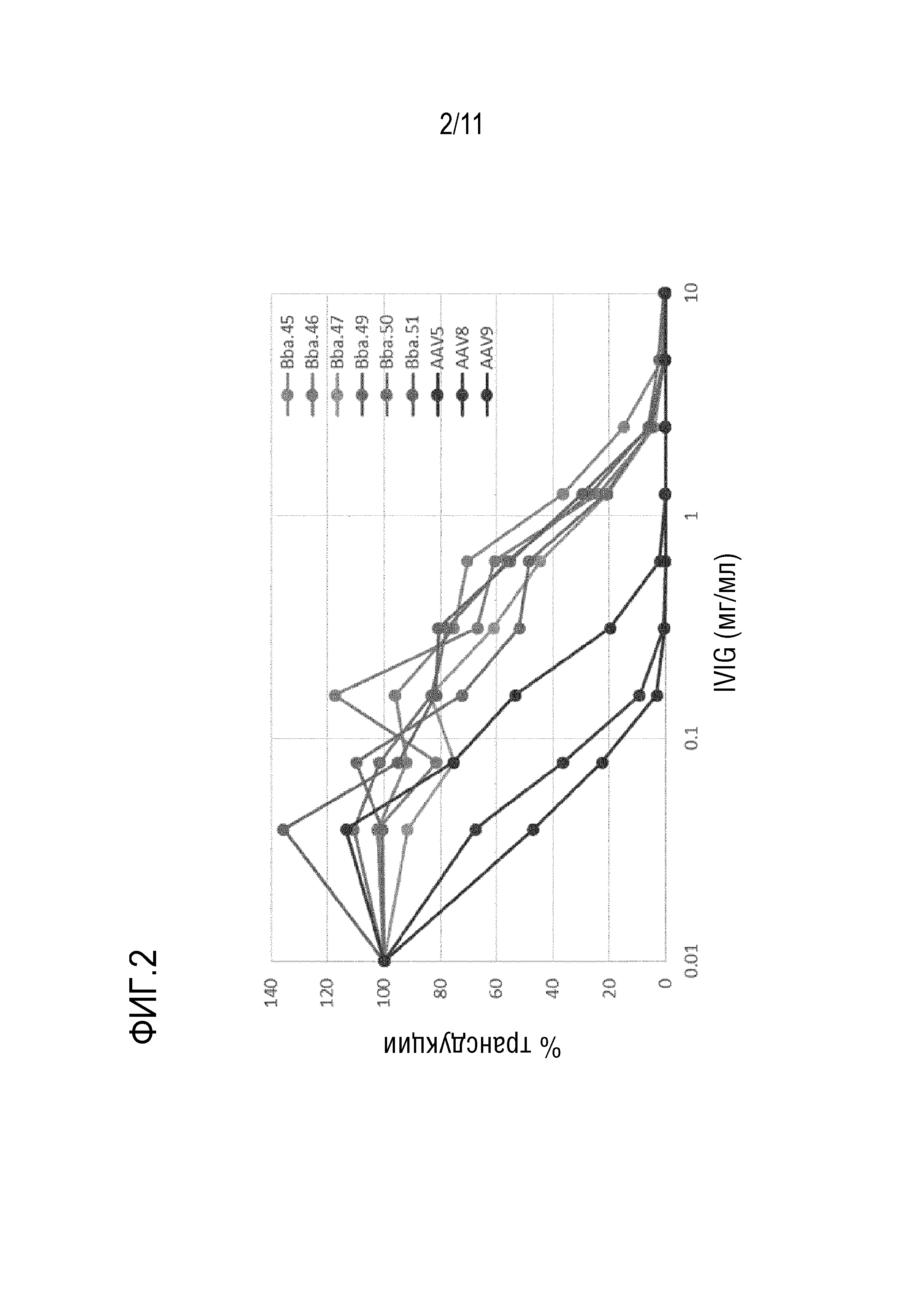
[0041] На фигуре 5 представлены уровни белка bCG в плазме после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50, и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65.
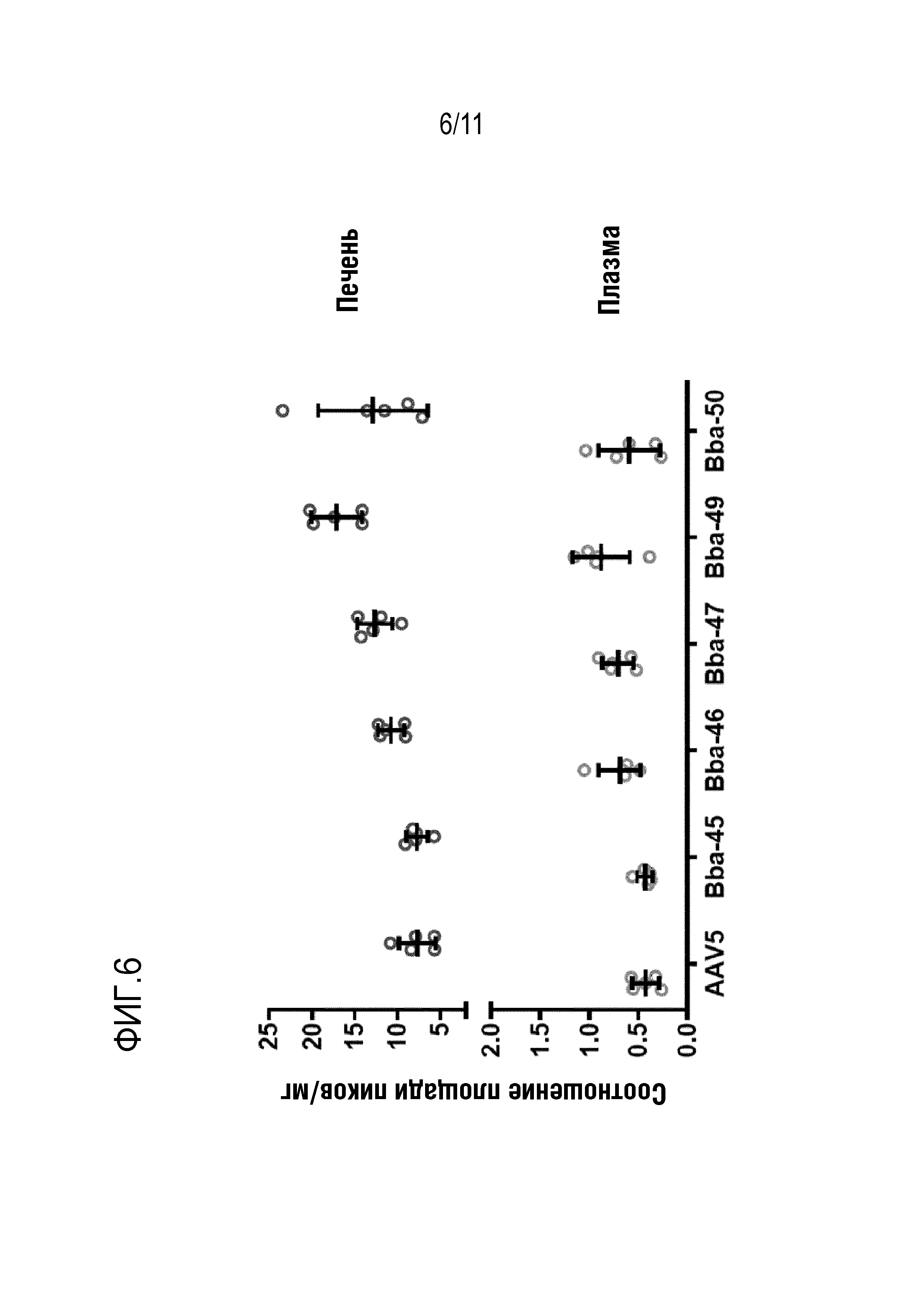
[0042] На фигуре 6 представлены уровни белка bCG в печени и плазме после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50, и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65.
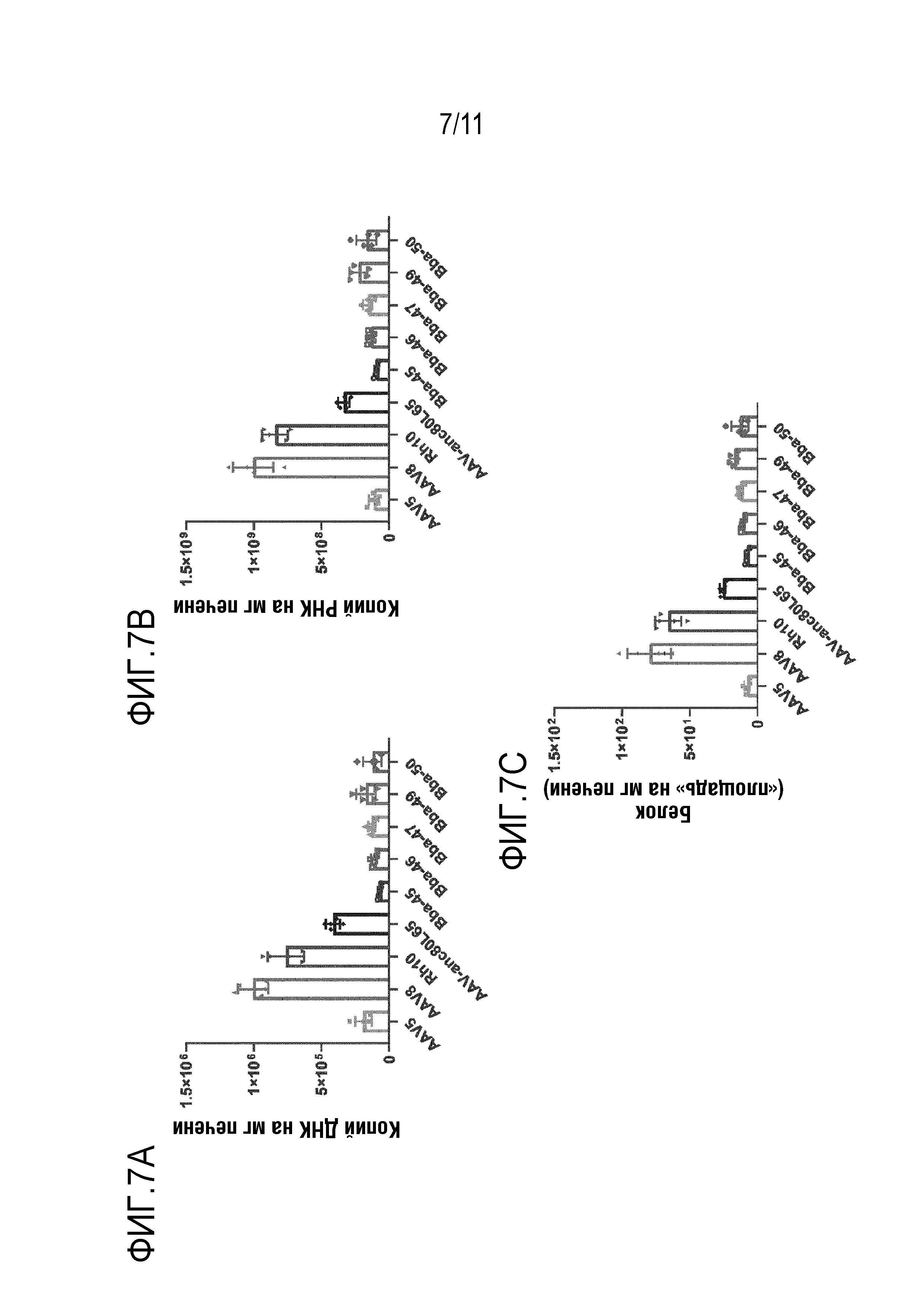
[0043] На фигуре 7A-7C представлены уровни ДНК bCG (панель A), РНК bCG (панель B) и белка bCG (панель C) в печени после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50 и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65.
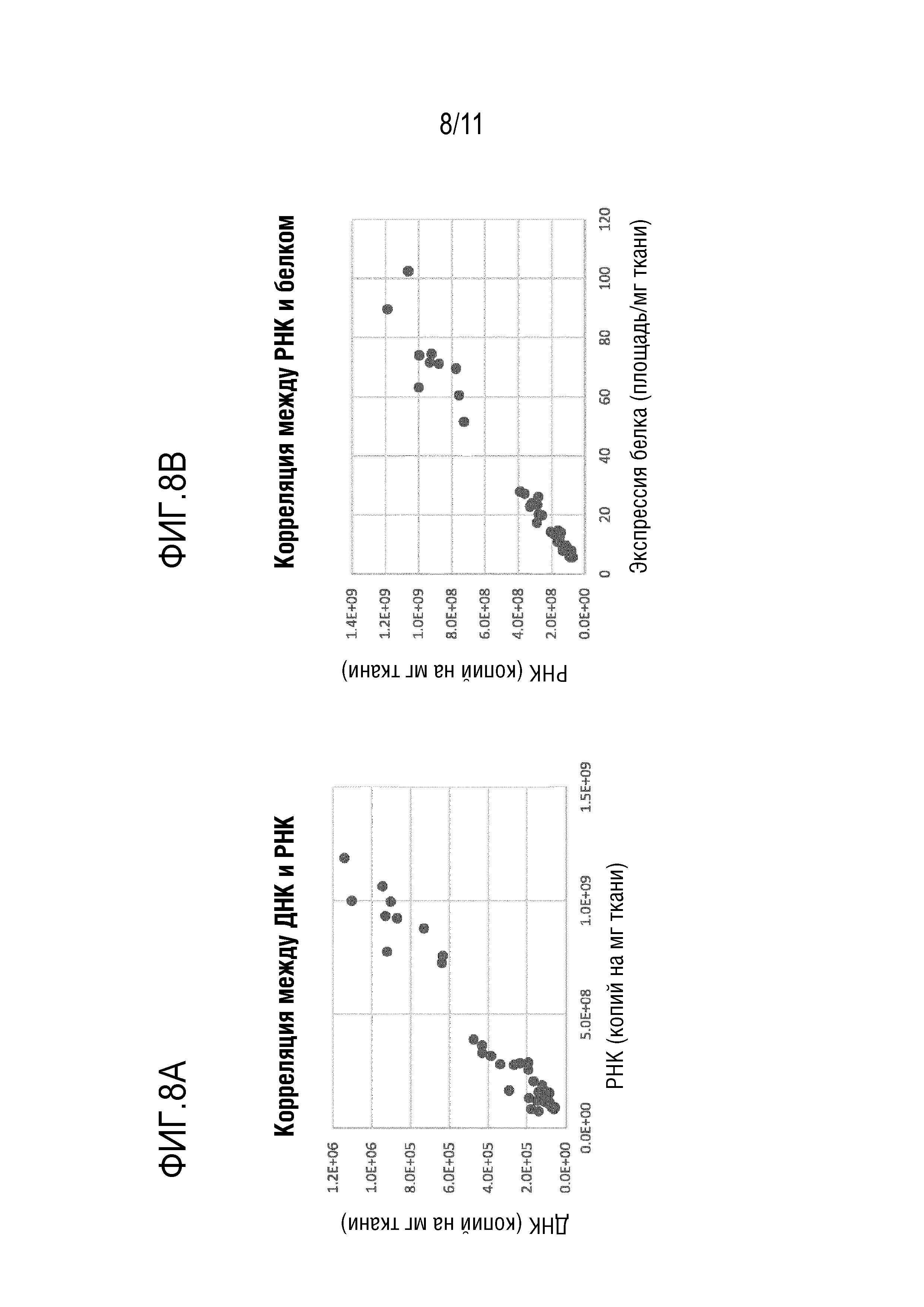
[0044] На фигурах 8A-8B показано, что уровни ДНК bCG и РНК bCG в печени коррелируют с уровнями белка bCG в печени после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50 и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65.
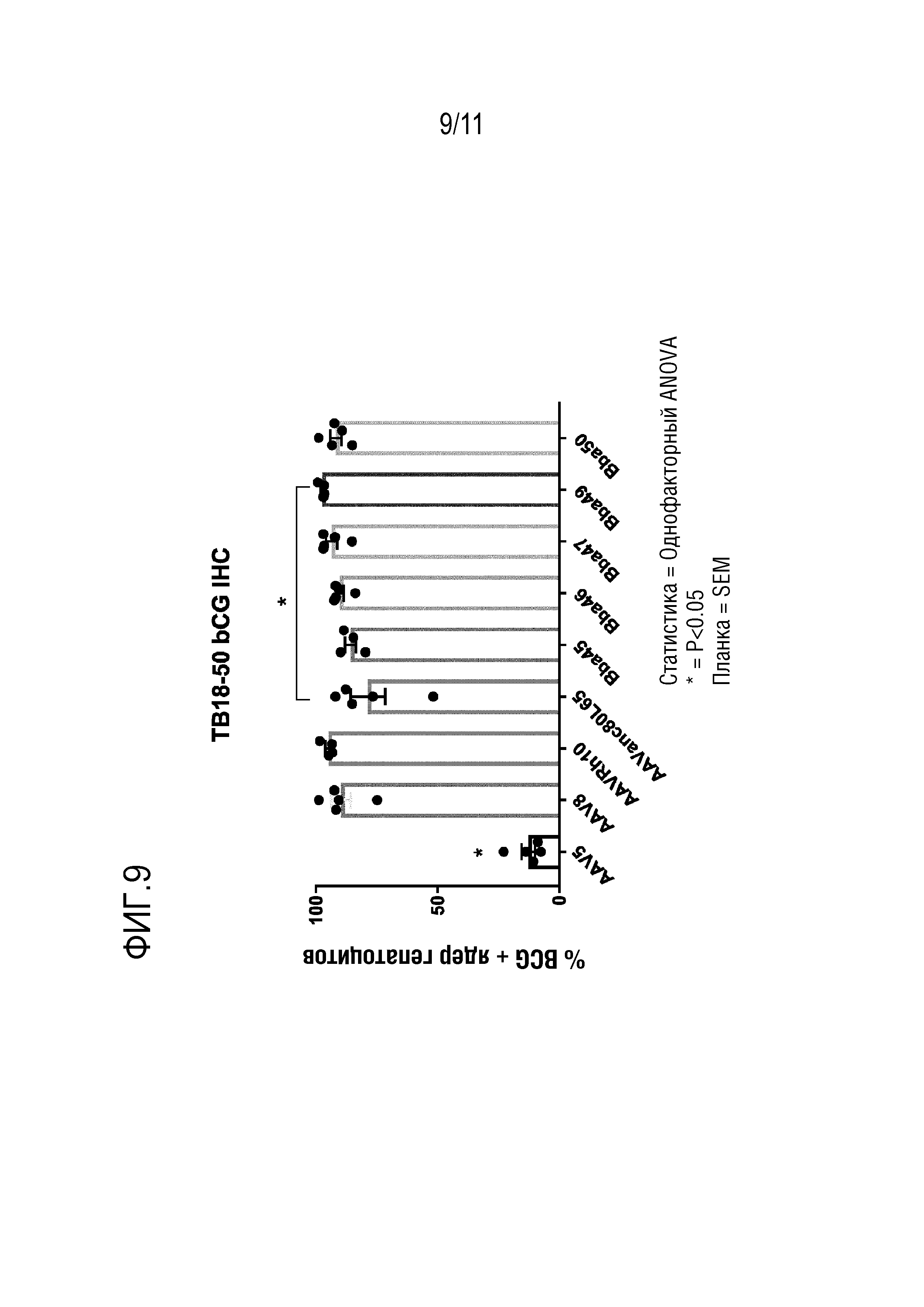
[0045] На фигуре 9 представлен процент гепатоцитов, трансдуцированных AAV, после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50, и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65, как определено посредством иммуногистохимии.
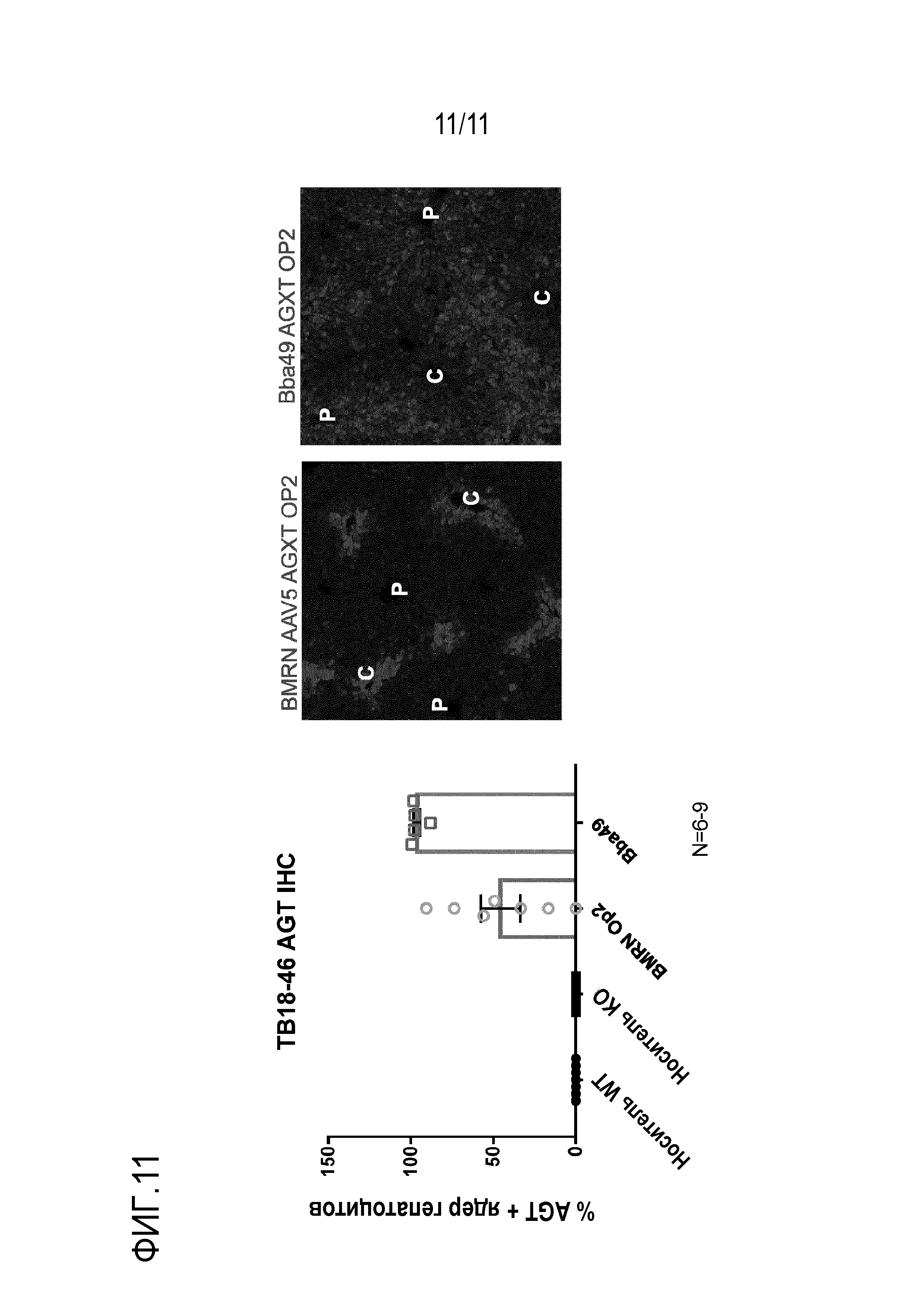
[0046] На фигуре 10 представлены иллюстративные фотографии, показывающие иммуногистохимическое окрашивание гепатоцитов после инъекции новых капсидов: Bba-45, Bba-46, Bba-47, Bba-49 и Bba-50, и контрольных капсидов: AAV8, AAV-rh10 и AAV-anc80L65.
[0047] На фигуре 11 представлен процент гепатоцитов, трансдуцированных AAV, имеющими новый капсид Bba-49 и капсид AAV5, из различных источников. Эти AAV трансдуцировали гепатоциты трансгеном -AGXT. AAV.Bba-49.AGXT трансдуцировал приблизительно 96% гепатоцитов.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение относится к новым капсидным белкам AAV, к нуклеиновой кислоте, кодирующей эти капсидные белки, и к вирусу AAV, содержащему эти новые капсидные белки. В некоторых вариантах осуществления, капсидные белки AAV были выделены и идентифицированы из различных тканей млекопитающих. Аминокислотные последовательности новых капсидных белков VP1 AAV указаны как SEQ ID NO:1-7, и локализации ассоциированных областей VP2 и VP3 описаны в настоящем описании.
Векторы AAV
[0048] В рамках изобретения, термин «AAV» представляет собой стандартное сокращенное наименование для аденоассоциированного вируса. Аденоассоциированный вирус представляет собой одноцепочечный ДНК-парвовирус, который растет только в клетках, в которых определенные функции обеспечиваются совместно инфицируемым вирусом-помощником. В настоящее время существует по меньшей мере тринадцать серотипов AAV, которые были охарактеризованы, как показано ниже в таблице 1. Общую информацию и обзоры AAV можно обнаружить, например, в Carter, Handbook of Parvoviruses, Vol. 1, pp. 169-228 (1989), и Berns, Virology, pp. 1743-1764, Raven Press, (New York, 1990). Однако, нет сомнения, что те же самые принципы применимы к дополнительным серотипам AAV, поскольку хорошо известно, что различные серотипы являются довольно близко родственными, как структурно, так и функционально, даже на генетическом уровне. (См., например, Blacklowe, pp. 165-174 of Parvoviruses and Human Disease, J. R. Pattison, ed. (1988); и Rose, Comprehensive Virology 3:1-61 (1974)). Например, все серотипы AAV, по-видимому, имеют очень сходные репликационные свойства, опосредованные гомологичными генами rep; и все несут три родственных капсидных белка, таких как экспрессируемые в AAV6. О степени родства дополнительно свидетельствует анализ гетеродуплексов, который выявил обширную перекрестную гибридизацию между серотипами по всей длине генома; и присутствие аналогичных самогибридизующихся фрагментов на концах, которые соответствуют «последовательностям инвертированных концевых повторов» (ITR). Сходные паттерны инфекционности также позволяют предполагать, что функции репликации в каждом серотипе находятся под аналогичным регуляторным контролем.
[0049] «Вектор AAV», в рамках изобретения, относится к вектору, содержащему один или несколько представляющих интерес полинуклеотидов (или трансгенов), фланкированных последовательностями концевых повторов (ITR) AAV. Такие векторы AAV могут реплицироваться и упаковываться в инфекционные вирусные частицы, когда они присутствуют в клетке-хозяине, которая была трансфицирована вектором, кодирующим и экспрессирующим продукты генов rep и cap.
[0050] «Вирион AAV» или «вирусная частица AAV», или «векторная частица AAV», или «вирус AAV» относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка AAV и инкапсидированного полинуклеотидного вектора AAV. Если частица содержит гетерологичный полинуклеотид (т.е., полинуклеотид, отличный от генома AAV дикого типа, такой как трансген, подлежащий доставке в клетку млекопитающего), она, как правило, обозначена как «векторная частица AAV» или просто «вектор AAV». Таким образом, получение векторной частицы AAV обязательно включает получение вектора AAV, поскольку такой вектор содержится внутри векторной частицы AAV.
[0051] Гены «rep» и «cap» AAV представляют собой гены, кодирующие белки репликации и капсидирования, соответственно. Гены rep и cap AAV обнаружены во всех серотипах AAV, исследованных до настоящего времени, и описаны в настоящем описании и в процитированных ссылках. В AAV дикого типа, гены rep и cap, как правило, обнаруживают смежными друг с другом в вирусном геноме (т.е., они «соединены» друг с другом как примыкающие или перекрывающиеся транскрипционные единицы), и они, как правило, консервативны среди серотипов AAV. Гены rep и cap AAV также индивидуально и совместно обозначены как «гены упаковки AAV». Ген cap AAV, в соответствии с настоящим изобретением, кодирует белок Cap, который способен упаковывать векторы AAV в присутствии rep и функции аденовируса-помощника, и способен связывать клеточные рецепторы-мишени. В некоторых вариантах осуществления, ген cap AAV кодирует капсидный белок, имеющий аминокислотную последовательность, происходящую из конкретного серотипа AAV, например, из серотипов, показанных в таблице 1.
Таблица 1. Серотипы AAV
|
[0052] Последовательности AAV, используемые для получения AAV, могут происходить из генома любого серотипа AAV. Как правило, серотипы AAV имеют геномные последовательности с значительной гомологией на уровнях аминокислот и нуклеиновых кислот, обеспечивают сходный набор генетических функций, продуцируют вирионы, по существу физически и функционально эквивалентные, и реплицируются и собираются посредством практически идентичных механизмов. Геномные последовательности серотипов AAV и обсуждение геномного сходства см., например, в номере доступа в Genbank U89790; номере доступа в Genbank J01901; номере доступа в Genbank AF043303; номере доступа в Genbank AF085716; Chlorini et al., J. Vir. 71:6823-33(1997); Srivastava et al., J. Vir. 45:555-64 (1983); Chlorini et al., J. Vir. 73:1309-1319 (1999); Rutledge et al., J. Vir. 72:309-319 (1998); и Wu et al., J. Vir. 74: 8635-47 (2000).
[0053] Геномная организация всех известных серотипов AAV является очень сходной. Геном AAV представляет собой линейную, одноцепочечную молекулу ДНК, имеющую длину менее чем приблизительно 5000 нуклеотидов (н.). Инвертированные концевые повторы (ITR) фланкируют уникальные нуклеотидные последовательности, кодирующие неструктурные белки репликации (Rep) и структурные белки (VP). Белки VP формируют капсид. Концевые 145 н. являются самокомплементарными и организованы таким образом, что может образоваться энергетически стабильный внутримолекулярный дуплекс, формирующий T-образную шпильку. Эти шпилечные структуры функционируют как точки начала репликации вирусной ДНК, действуя в качестве праймеров для клеточного комплекса ДНК-полимеразы. Гены Rep кодируют белки Rep, Rep78, Rep68, Rep52 и Rep40. Rep78 и Rep68 транскрибируются с промотора p5, и Rep 52 и Rep40 транскрибируются с промотора p19. Гены cap кодируют белки VP, VP1, VP2 и VP3. Гены cap транскрибируются с промотора p40.
[0054] В некоторых вариантах осуществления, последовательность нуклеиновой кислоты, кодирующая капсидный белок AAV, функционально связана с регуляторными последовательностями, контролирующими экспрессию в специфическом типе клеток, таком как клетки Sf9 или HEK. Способы, известные специалисту в данной области, для экспрессии чужеродных генов в клетках-хозяевах насекомого или клетках-хозяевах млекопитающего, можно использовать для практического осуществления изобретения. Способы молекулярной инженерии и экспрессии полипептидов в клетках насекомых описаны, например, в Summers and Smith. A Manual of Methods for Baculovirus Vectors and Insect Culture Procedures, Texas Agricultural Experimental Station Bull. No. 7555, College Station, Tex. (1986); Luckow. 1991. In Prokop et al., Cloning and Expression of Heterologous Genes in Insect Cells with Baculovirus Vectors' Recombinant DNA Technology and Applications, 97-152 (1986); King, L. A. and R. D. Possee, The baculovirus expression system, Chapman and Hall, United Kingdom (1992); O'Reilly, D. R., L. K. Miller, V. A. Luckow, Baculovirus Expression Vectors: A Laboratory Manual, New York (1992); W.H. Freeman and Richardson, C. D., Baculovirus Expression Protocols, Methods in Molecular Biology, volume 39 (1995); Патенте США No. 4745051; US2003148506; и WO 03/074714. Особенно подходящим промотором для транскрипции нуклеотидной последовательности, кодирующей капсидный белок AAV, является, например, полиэдроновый промотор. Однако, другие промоторы, активные в клетках насекомых, известны в данной области, например, промоторы p10, p35 или IE-1, и предусмотрены также дополнительные промоторы, описанные в вышеуказанных ссылках.
[0055] Использование клеток насекомых для экспрессии гетерологичных белков хорошо документировано, как и способы введения нуклеиновых кислот, таких как векторы, например, совместимые с клетками насекомых векторы, в такие клетки, и способы поддержания таких клеток в культуре. См., например, METHODS IN MOLECULAR BIOLOGY, ed. Richard, Humana Press, NJ (1995); O'Reilly et al., BACULOVIRUS EXPRESSION VECTORS, A LABORATORY MANUAL, Oxford Univ. Press (1994); Samulski et al., J. Vir. 63:3822-8 (1989); Kajigaya et al., Proc. Nat'l. Acad. Sci. USA 88:4646-50 (1991); Ruffing et al., J. Vir. 66:6922-30 (1992); Kirnbauer et al., Vir. 219:37-44 (1996); Zhao et al., Vir. 272:382-93 (2000); и Samulski et al., Патент США No. 6204059. В некоторых вариантах осуществления, конструкция нуклеиновой кислоты, кодирующая AAV в клетках насекомых, представляет собой совместимый с клетками насекомых вектор. «Совместимый с клетками насекомых вектор» или «вектор», в рамках изобретения, относится к молекуле нуклеиновой кислоты, способной к продуктивной трансформации или трансфекции насекомого или клетки насекомого. Иллюстративные биологические векторы включают плазмиды, линейные молекулы нуклеиновых кислот и рекомбинантные вирусы. Можно использовать любой вектор, при условии, что он совместим с клетками насекомых. Вектор может интегрировать в геном клеток насекомого, но присутствие вектора в клетке насекомого не обязательно должно быть постоянным, и временные эписомные векторы также включены. Векторы можно вводить любыми известными способами, например, посредством химической обработки клеток, электропорации или инфекции. В некоторых вариантах осуществления, вектор представляет собой бакуловирус, вирусный вектор или плазмиду. В более предпочтительном варианте осуществления, вектор представляет собой бакуловирус, т.е., конструкция представляет собой бакуловирусный вектор. Бакуловирусные векторы и способы их использования описаны в процитированных выше ссылках по молекулярной инженерии клеток насекомых.
[0056] Бакуловирусы представляют собой оболочечные ДНК-вирусы членистоногих, два члена которых представляют собой хорошо известные экспрессирующие векторы для продукции рекомбинантных белков в культурах клеток. Бакуловирусы имеют кольцевые двухцепочечные геномы (80-200 т.п.о.), которые можно конструировать таким образом, чтобы позволять доставку большого геномного содержимого в специфические клетки. Вирусы, используемые в качестве вектора, как правило, представляют собой мультикапсидный вирус ядерного полиэдроза Autographa californica (AcMNPV) или Bombyx mori (Bm)NPV) (Kato et al., Appl. Microbiol. Biotechnol. 85(3):459-470 (2010)). Бакуловирусы являются общепринятыми для инфекции клеток насекомых для экспрессии рекомбинантных белков. В частности, экспрессию гетерологичных генов в насекомых можно осуществлять, как описано, например, в Патенте США No. 4745051; Friesen et al., Curr. Top. Microbiol. Immunol. 131:31-49. (1986); EP 127,839; EP 155,476; Miller et al., Ann. Rev. of Microbiol. 42: 177-199 (1988); Carbonell et al., Gene 73(2):409-18 (1988); Maeda et al., Nature 315(6020):592-4 (1985); Lebacq-Verheyden et al., Mol. Cell. Biol. 8(8):3129-35 (1988); Smith et al., Proc. Natl. Acad. Sci. U S A. 82(24):8404-8 (1985); Miyajima et al., Gene 58(2-3):273-81 (1987); и Martin et al., DNA 7(2):99-106 (1988). Множество штаммов и вариантов бакуловирусов, и соответствующих пермиссивных клеток-хозяев насекомых, которые можно использовать для продукции белка, описаны в Luckow et al., Nature Biotechnology 6:47-55 (1988), и Maeda et al., Nature 315(6020):592-4 (1985).
Новые капсидные белки AAV
[0057] В первом аспекте, изобретение относится к новым капсидным белкам AAV, выделенным из различных тканей млекопитающих. Новые капсидные белки VP1 AAV представлены как SEQ ID NO:1-7, и локализации ассоциированных областей VP2 и VP3 описаны в настоящем описании. Изобретение относится также к полинуклеотидам, содержащим нуклеотидную последовательность, кодирующую эти новые капсидные белки AAV. Изобретение относится к аминокислотным последовательностям новых капсидных белков AAV (в совокупности обозначенных в настоящем описании как «капсидные белки AAV по изобретению»), и к последовательностям нуклеиновой кислоты, кодирующим капсидные белки AAV по изобретению. Настоящее изобретение относится также к фрагментам нуклеиновой кислоты и аминокислотных последовательностей этих капсидов AAV по изобретению. Каждую из этих последовательностей можно легко использовать во множестве векторных систем и клеток-хозяев. Желательные фрагменты капсидных белков VP1 включают VP2, VP3 и вариабельные области, домен GBS и петлю GH, и полинуклеотидные последовательности, кодирующие эти белки. Эти фрагменты можно легко использовать во множестве векторных систем и клеток-хозяев. Такие фрагменты можно использовать отдельно, в комбинации с другими последовательностями или фрагментами AAV, или в комбинации с элементами из других относящихся к AAV или не относящихся к AAV вирусных последовательностей. В одном особенно желательном варианте осуществления, вектор содержит последовательности капсида AAV по изобретению.
[0058] Последовательности капсида AAV по изобретению и их фрагменты являются полезными в получении rAAV, и являются полезными в качестве векторов для доставки антисмысловых последовательностей, векторов для генотерапии или вакцинных векторов. Изобретение относится также к молекулам нуклеиновой кислоты, к векторам для доставки генов и к клеткам-хозяевам, содержащим новые последовательности капсидов AAV по изобретению.
[0059] Пригодные фрагменты можно определять с использованием информации, представленной в настоящем описании. Выравнивания проводят с использованием любой из множества публично или коммерчески доступных программ для множественного выравнивания последовательностей, таких как «Clustal W», доступных через Web-серверы в интернет. Альтернативно, используют также инструменты Vector NTI. Существует также ряд алгоритмов, известных в данной области, которые можно использовать для измерения идентичности нуклеотидных последовательностей, включая алгоритмы, содержащиеся в программах, описанных выше. В качестве другого примера, полинуклеотидные последовательности можно сравнивать с использованием FASTA, программы в GCG версии 6.1. FASTA предоставляет выравнивания и процентную идентичность последовательностей областей наилучшего перекрывания между запрашиваемой и поисковой последовательностями. Например, процентную идентичность последовательностей между последовательностями нуклеиновой кислоты можно определять с использованием FASTA с параметрами по умолчанию (размер слова 6 и фактор NOPAM для оценочной матрицы), как представлено в GCG версии 6.1, содержание описания которой приведено в настоящем описании в качестве ссылки. Сходные программы являются доступными для аминокислотных последовательностей, например, программа «Clustal X». Дополнительные инструменты для выравнивания последовательностей, которые можно использовать, предоставлены в (выравнивание белковых последовательностей; (http://www.ebi.ac.uk/Tools/psa/emboss_needle/)) и (выравнивание нуклеиновой кислоты; http://www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html)). Как правило, любую из этих программ используют с параметрами по умолчанию, хотя специалист в данной области может изменять эти параметры, по необходимости. Альтернативно, специалист в данной области может использовать другой алгоритм или компьютерную программу, обеспечивающие по меньшей мере такой уровень идентичности или выравнивания, какой обеспечивают эталонные алгоритмы и программы.
[0060] Термины «значительная идентичность», «значительная гомология» или «значительное сходство», применительно к нуклеиновой кислоте или ее фрагменту, показывают, что, при оптимальном выравнивании, с соответствующими вставками или делециями нуклеотидов, с другой нуклеиновой кислотой (или ее комплементарной цепью), присутствует идентичность нуклеотидной последовательности по меньшей мере приблизительно в 95-99% выровненных последовательностей, например, 95% идентичность, 96% идентичность, 97% идентичность, 98% идентичность и 99% идентичность. Предпочтительно, гомология присутствует на протяжении всей длины двух сравниваемых последовательностей или в их открытой рамке считывания, или в другом пригодном фрагменте, имеющем длину по меньшей мере 15 нуклеотидов. Примеры пригодных фрагментов описаны в настоящем описании. В последовательности нуклеиновой кислоты по изобретению включены также природные варианты и сконструированные модификации нуклеиновых кислот, кодирующих капсиды AAV по изобретению, и их комплементарной цепи. Такие модификации включают, например, метки, известные в данной области, метилирование и замену одного или нескольких из природных нуклеотидов на вырожденный нуклеотид.
[0061] Термины «значительная идентичность», «значительная гомология» или «значительное сходство», применительно к аминокислотам или их фрагментам, показывают, что, при оптимальном выравнивании, с соответствующими вставками или делециями аминокислот, с другими аминокислотами (или их комплементарной цепью), присутствует идентичность аминокислотной последовательности по меньшей мере приблизительно в 95-99% выровненных последовательностей, например, 95% идентичность, 96% идентичность, 97% идентичность, 98% идентичность и 99% идентичность. Предпочтительно, гомология присутствует на протяжении всей длины двух сравниваемых последовательностей, или в белке из них, например, белке cap, белке rep или их фрагменте, имеющем длину по меньшей мере 8 аминокислот, или более желательно, по меньшей мере 15 аминокислот. Примеры пригодных фрагментов описаны в настоящем описании.
[0062] Под термином «высоко консервативный» понимают по меньшей мере 80% идентичность, предпочтительно, по меньшей мере 90% идентичность, и более предпочтительно, более 97% идентичность. Идентичность легко определяет специалист в данной области посредством алгоритмов и компьютерных программ, известных специалисту в данной области.
[0063] Термин «процентная идентичность последовательностей» или «идентичный», в контексте последовательностей нуклеиновой кислоты или аминокислотных последовательностей, относится к остаткам в двух последовательностях, которые являются одинаковыми, после выравнивания для максимального соответствия. Протяженность идентичности при сравнении последовательностей является желательной на протяжении всей длины двух сравниваемых последовательностей, на протяжении всей длины кодирующей последовательности гена или на протяжении фрагмента по меньшей мере приблизительно 500-5000 нуклеотидов. Однако, идентичность на протяжении меньших фрагментов, например, по меньшей мере приблизительно девяти нуклеотидов, обычно, по меньшей мере приблизительно 20-24 нуклеотидов, по меньшей мере приблизительно 28-32 нуклеотидов, по меньшей мере приблизительно 36 или более нуклеотидов, также может являться желательной. Подобным образом, «процентную идентичность последовательностей» можно легко определять для аминокислотных последовательностей, на протяжении всей длины белка, или его фрагмента. Подходящим образом, фрагмент имеет длину по меньшей мере приблизительно 8 аминокислот, и может составлять до приблизительно 700 аминокислот. Примеры пригодных фрагментов описаны в настоящем описании.
[0064] Новые капсиды по изобретению могут содержать одну или несколько дополнительных консервативных аминокислотных замен, которые не влияют на биологическую и/или иммуногенную активность полипептида. Термин «консервативная аминокислотная замена» относится к замене природного аминокислотного остатка на неприродный остаток, включая природные и неприродные аминокислоты, таким образом, что присутствует небольшой эффект или отсутствует эффект на полярность или заряд аминокислотного остатка в этом положении. Например, консервативная замена возникает в результате замены неполярного остатка в полипептиде на любой другой неполярный остаток. Кроме того, любой природный остаток в полипептиде можно также заменять на аланин, в соответствии со способами «аланинового сканирующего мутагенеза». Природные аминокислоты характеризуют на основании их боковых цепей следующим образом: основные: аргинин, лизин, гистидин; кислые: глутаминовая кислота, аспарагиновая кислота; незаряженные полярные: глутамин, аспарагин, серин, треонин, тирозин; и неполярные: фенилаланин, триптофан, цистеин, глицин, аланин, валин, пролин, метионин, лейцин, норлейцин, изолейцин. Общие правила для замен аминокислот указаны в таблице ниже.
Консервативные аминокислотные замены
|
[0065] Новые капсиды по изобретению могут быть кодированы полинуклеотидами, по существу эквивалентными последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность из SEQ ID NO: 1-7. Полинуклеотиды по изобретению могут иметь, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, более конкретно, по меньшей мере 90%, 91%, 92%, 93%, или 94% и даже более конкретно, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с полинуклеотидными последовательностями, кодирующими аминокислотные последовательности модифицированного полипептида по изобретению.
[0066] В объем последовательностей нуклеиновой кислоты по изобретению включены фрагменты последовательности нуклеиновой кислоты, которые гибридизуются в строгих условиях с нуклеотидными последовательностями, кодирующими новые капсиды по изобретению, где фрагмент составляет более чем приблизительно 5 нуклеотидов, предпочтительно, 7 нуклеотидов, более предпочтительно, более чем 9 нуклеотидов и наиболее предпочтительно, более чем 17 нуклеотидов. Предусмотрены фрагменты из, например, 15, 17 или 20 нуклеотидов, или более, которые являются избирательными для любого из полинуклеотидов по изобретению (т.е., специфически гибридизуются с любым из полинуклеотидов по изобретению). Зонды, способные к специфической гибридизации с полинуклеотидом, могут отличать полинуклеотидные последовательности по изобретению от других полинуклеотидных последовательностей в том же самом семействе генов или могут отличать гены от других бактериальных генов, и, предпочтительно, основаны на уникальных нуклеотидных последовательностях.
[0067] Термин «строгий» используют для обозначения условий, общепринятых в данной области как строгие. Строгость гибридизации принципиально определяется температурой, ионной силой и концентрацией денатурирующих средств, таких как формамид. Примеры строгих условий для гибридизации и отмывки представляют собой 0,015 M хлорид натрия, 0,0015M цитрат натрия при 65-68°C или 0,015 M хлорид натрия, 0,0015M цитрат натрия и 50% формамид при 42°C См. Sambrook et al., Molecular Cloning: A Laboratory Manual, 2.sup.nd Ed., Cold Spring Harbor Laboratory, (Cold Spring Harbor, N.Y. 1989). Можно использовать также более строгие условия (такие как более высокая температура, более низкая ионная сила, более высокая концентрация формамида или другого денатурирующего средства), однако, это может влиять на скорость гибридизации. В случая, когда предусмотрена гибридизация дезоксиолигонуклеотидов, дополнительные иллюстративные строгие условия гибридизации включают отмывку в 6xSSC, 0,05% пирофосфате натрия при 37°C (для олигонуклеотидов из 14 оснований), 48°C (для олигонуклеотидов из 17 оснований), 55°C (для олигонуклеотидов из 20 оснований) и 60°C (для олигонуклеотидов из 23 оснований).
[0068] Другие средства можно включать в буферы для гибридизации и отмывки с целью уменьшения неспецифической и/или фоновой гибридизации. Примеры представляют собой 0,1% бычий сывороточный альбумин, 0,1% поливинилпирролидон, 0,1% пирофосфат натрия, 0,1% додецилсульфат натрия, NaDodSO4 (SDS), фиколл, раствор Денхардта, обработанную ультразвуком ДНК спермы лосося (или другую некомплементарную ДНК) и декстрансульфат, хотя можно использовать также другие пригодные средства. Концентрацию и типы этих добавок можно менять без значительного влияния на строгость условий гибридизации. Эксперименты гибридизации обычно проводят при pH 6,8-7,4, однако, в условиях типичной ионной силы, скорость гибридизации почти не зависит от pH. См. Anderson et al., Nucleic Acid Hybridisation: A Practical Approach, Ch. 4, IRL Press Limited (Oxford, England). Специалист в данной области может корректировать условия гибридизации, чтобы приспособить их к этим переменным и позволять ДНК с различным сродством последовательностей формировать гибриды.
[0069] Как описано в настоящем описании, векторы по изобретению, содержащие или включающие капсидные белки AAV по изобретению, являются особенно хорошо подходящими для использования в применениях, при которых нейтрализующие антитела уменьшают эффективность векторов на основе других серотипов AAV, так же как других вирусных векторов. Векторы rAAV по изобретению являются особенно преимущественными для повторного введения rAAV и повторной генотерапии.
[0070] Настоящее изобретение относится также к фрагментам нуклеиновых кислот, кодирующих капсидные белки AAV по изобретению, к их комплементарной цепи, к комплементарной им кДНК и РНК. Пригодные фрагменты имеют длину по меньшей мере 15 нуклеотидов и включают функциональные фрагменты, т.е., фрагменты, представляющие биологический интерес. Такие фрагменты включают последовательности, кодирующие три вариабельных белка (VP) капсида, представляющие собой варианты альтернативного сплайсинга: VP1, VP2 и VP3. Другие пригодные фрагменты нуклеиновых кислот, кодирующих капсиды AAV по изобретению, включают фрагмент, содержащий инициирующий кодон для капсидного белка, и фрагменты, кодирующие вариабельные области капсидного белка VP1, описанные в настоящем описании.
[0071] Изобретение не является ограниченным аминокислотными последовательностями, пептидами и белками капсида AAV, экспрессированными с последовательностей нуклеиновой кислоты AAV по изобретению, и включает аминокислотные последовательности, пептиды и белки, полученные другими способами, известными в данной области, включая, например, химический синтез, другие синтетические способы или другие способы. Например, последовательности любых капсидов, описанных в настоящем описании, можно легко получать с использованием множества способов.
[0072] Пригодные способы получения хорошо известны специалисту в данной области. См., например, Sambrook et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press (Cold Spring Harbor, N.Y.). Альтернативно, пептиды также можно синтезировать хорошо известными способами твердофазного пептидного синтеза (Merrifield, J. Am. Chem. Soc., 85:2149 (1962); Stewart and Young, Solid Phase Peptide Synthesis Freeman, (San Francisco, 1969) pp. 27-62. Эти и другие пригодные способы получения известны специалисту в данной области и не являются ограничением настоящего изобретения.
[0073] Капсид AAV состоит из трех белков, VP1, VP2 и VP3, представляющих собой варианты альтернативного сплайсинга. Полноразмерная последовательность капсида обозначена как VP1, который охватывает варианты сплайсинга, обозначенные как VP2 и VP3. Изобретение относится также к другим функциональным фрагментам капсидных белков AAV по изобретению. Другие желательные фрагменты капсидного белка включают вариабельные области (VR), константные области, локализованные между вариабельными областями, домен GBS и петлю GH. Другие желательные фрагменты капсидного белка включают собственно HPV.
[0074] Разработан алгоритм для определения областей дивергенции последовательности в AAV2. (Chiorini et al, J. Virol, 73:1309-19 (1999); Rutledge et al, J. Virol., 72:309-319 (1998)). С использованием этого алгоритма и/или способов выравнивания, описанных в настоящем описании, определяют VR из новых последовательностей капсида AAV. С использованием представленного в настоящем описании выравнивания, проведенного с использованием программы Clustal X с параметрами по умолчанию, или с использованием других коммерчески или публично доступных программ выравнивания с параметрами по умолчанию, специалист в данной области может легко определять соответствующие фрагменты новых капсидов AAV по изобретению.
[0075] Подходящим образом, фрагменты капсидного белка AAV имеют длину по меньшей мере 8 аминокислот, или длину по меньшей мере 9 аминокислот, или длину по меньшей мере 10 аминокислот, или длину по меньшей мере 20 аминокислот, или длину 30 аминокислот, или длину по меньшей мере 50 аминокислот, или длину по меньшей мере 75 аминокислот, или длину по меньшей мере 100 аминокислот, или длину 200 аминокислот, или длину 250 аминокислот, или длину 300 аминокислот, или длину 350 аминокислот, или длину 400 аминокислот. Однако, фрагменты другой желательной длины можно легко использовать. Все фрагменты по изобретению сохраняют биологическую активность белка капсида AAV. Такие фрагменты можно получать рекомбинантным способом или другими пригодными способами, например, химическим синтезом.
[0076] Последовательности, белки и фрагменты по изобретению можно получать любыми пригодными способами, включая рекомбинантную продукцию, химический синтез, или другие способы синтеза. Такие способы получения известны специалисту в данной области и не являются ограничением настоящего изобретения.
[0077] В дополнение к включению последовательностей нуклеиновой кислоты, представленных на фигурах и в списке последовательностей, настоящее изобретение включает молекулы и последовательности нуклеиновой кислоты, сконструированные для экспрессии аминокислотных последовательностей, белков и пептидов капсидных белков AAV по изобретению. Таким образом, изобретение включает последовательности нуклеиновой кислоты, кодирующие следующие аминокислотные последовательности капсида AAV, и искусственные капсидные белки AAV, полученные с использованием этих последовательностей и/или их уникальных фрагментов.
Получение AAV с капсидными белками по изобретению
[0078] Изобретение относится к последовательностям капсидных белков AAV и к нуклеиновым кислотам, кодирующим эти белки, которые являются свободными от ДНК и/или клеточного материала, с которыми эти вирусы ассоциированы в природе. В другом аспекте, настоящее изобретение относится к молекулам, в которых использованы новые последовательности AAV по изобретению, включая их фрагменты, для получения молекул, которые можно использовать для доставки гетерологичного гена или других последовательностей нуклеиновой кислоты в клетку-мишень.
[0079] В другом аспекте, настоящее изобретение относится к молекулам, в которых использованы последовательности капсидных белков AAV по изобретению, включая их фрагменты, для получения вирусных векторов, которые можно использовать для доставки гетерологичного гена или других последовательностей нуклеиновой кислоты в клетку-мишень.
[0080] Молекулы по изобретению, содержащие последовательности нуклеиновой кислоты капсида AAV, включают любой генетический элемент (вектор), который можно доставлять в клетку-хозяина, например, голую ДНК, плазмиду, фаг, транспозон, космиду, эписому, белок в невирусном носителе для доставки (например, носителе на основе липида), вирус и т.д., осуществляющие транспорт последовательностей, которые они несут. Выбранный вектор можно доставлять любым пригодным способом, включая трансфекцию, электропорацию, липосомную доставку, способы слияния мембран, высокоскоростные покрытые ДНК частицы, вирусную инфекцию и слияние протопластов. Способы, используемые для конструирования любого варианта осуществления настоящего изобретения, известны специалисту в области манипуляции с нуклеиновыми кислотами и включают генную инженерию, рекомбинантную инженерию и способы синтеза. См., например, Sambrook et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y.
[0081] В одном варианте осуществления, векторы по изобретению содержат, как минимум, последовательности, кодирующие капсид AAV по изобретению или его фрагмент. В другом варианте осуществления, векторы по изобретению содержат, как минимум, последовательности, кодирующие белок rep AAV или его фрагмент. Необязательно, такие векторы могут содержать оба белка cap и rep AAV. В векторах, в которых представлены оба rep и cap AAV, последовательности rep AAV и cap AAV обе могут происходить из одного и того же серотипа AAV. Альтернативно, настоящее изобретение относится к векторам, в которых последовательности rep происходят из серотипа AAV, отличного от серотипа, предоставляющего последовательности cap. В одном варианте осуществления, последовательности rep и cap экспрессируются из отдельных источников (например, из отдельных векторов, или клетки-хозяина и вектора). В другом варианте осуществления, эти последовательности rep слиты в рамке считывания с последовательностями cap из другого серотипа AAV для образования химерного вектора AAV.
[0082] Таким образом, в одном варианте осуществления, векторы, описанные в настоящем описании, содержат последовательности нуклеиновой кислоты, кодирующие интактный капсидный белок AAV любой из аминокислотных последовательностей SEQ ID NO: 1-7. В другом примере, может являться желательным изменять инициирующий кодон белка VP3 на GTG. Альтернативно, rAAV может содержать одну или несколько из вариабельных областей одного или нескольких капсидных белков AAV по изобретению, или другие фрагменты. Эти модификации могут быть предназначены для увеличения экспрессии, выхода, и/или улучшения очистки в выбранных системах экспрессии, или для другой желательной цели (например, для изменения тропизма или изменения эпитопов нейтрализующих антител).
[0083] Векторы, описанные в настоящем описании, например, плазмида, являются полезными для множества целей, но особенно хорошо подходят для использования в получении rAAV, содержащего капсид, содержащий последовательности AAV или его фрагмента. Эти векторы, включая rAAV, их элементы, конструирование и применения подробно описаны в настоящем описании.
VP1 из новых капсидных белков
[0084] Новые капсидные белки VP1 AAV выделены из печени бабуина.
[0085] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.45), указана как SEQ ID NO:1 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:1, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:1.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANRQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQQRLATDTSFGGNLGKAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRALDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVREVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTATTTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0086] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.46), указана как SEQ ID NO:2 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:2, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:2.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQQRLATDTSFGGNLGKAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGCFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGAATTTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0087] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.47), указана как SEQ ID NO:3 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:3, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:3.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQQRLATDTSFGGNLGKAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTATTTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0088] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.48), указана как SEQ ID NO:4 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:4, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:4.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCRFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTAITTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNAATAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0089] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.49), указана как SEQ ID NO:5 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:5, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:5.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQERLQEDTSFGGNLGRAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTAITTYGKITTGDFAYYRKNWLPGAGIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0090] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.50), указана как SEQ ID NO:6 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS, и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:6, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:6.
MAADGYLPDWLEDNLSESIREWWALKPGAPRPKANQQHQDDARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQQRLATDTSFGGNLGKAVFQAKKRILEPLGLVEEGVKTAPGRKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPLHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTATTTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGEDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0091] Последовательность VP1 из нового капсида AAV, выделенного из бабуина (обозначенного как Bba.51), указана как SEQ ID NO:7 (аминокислоты 1-742), и локализации ассоциированных вариабельных областей и областей GBS и петли GH определены в таблице 2 ниже. Капсидный белок VP2 перекрывает аминокислоты 138-742 из SEQ ID NO:7, и капсидный белок VP3 перекрывает аминокислоты 206-742 из SEQ ID NO:7.
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPGNGLDKGEPVNEADAAALEHDKAYDQQLKSGDNPYLKYNHADAEFQQRLATDTSFGGNLGKAVFQAKKRILEPLGLVEEGVKTAPGKKRPLEKTPNRPTNPDSGKAPAKKKQKDGETADSARRTLDFEDSGAGDGPPEGSSSGEMSHDAEMRAAPGGNAVEAGQGADGVGNASGDWHCDSTWSEGRVTTTSTRTWVLPTYNNHLYLRIGTTANSNTYNGFSTPWGYFDFNRFHCHFSPRDWQRLINNNWGLRPKSMRVKIFNIQVKEVTTSNGETTVANNLTSTVQIFADSTYELPYVMDAGQEGSLPPFPNDVFMVPQYGYCGVVTGENQNQTDRNAFYCLEYFPSQMLRTGNNFEISYQFEKVPFHSMYAHSQSLDRMMNPLLDQYLWHLQSTTTGNSLNQGTATTTYGKITTGDFAYYRKNWLPGACIKQQKFSKNASQNYKIPASGGDALLKYDTHTTLNGRWSNMAPGPPMATAGAGDSDFSNSQLIFAGPNQSGNTTTSSNNLLFTSEEEIATTNPRDTDMFGQIADNNQNATTAPHIANLDAMGIVPGMVWQNRDIYYQGPIWAKVPHTDGHFHPSPLMGGFGLKHPPPQIFIKNTPVPANPNTTFSAARINSFLTQYSTGQVAVQIDWEIQKEHSKRWNPEVQFTSNYGTQNSMLWAPDNAGNYHEPRAIGSRFLTHHL
[0092] Соответствующие последовательности нуклеиновой кислоты, кодирующие процитированные выше капсидные белки, представляют собой SEQ ID NO:8/Bba.45; SEQ ID NO:9/Bba.46; SEQ ID NO:10/Bba.47; SEQ ID NO:11/Bba.48; SEQ ID NO:12/Bba.49; SEQ ID NO:13/Bba.50; и SEQ ID NO:14 /Bba.51.
[0093] SEQ ID NO:8 (Bba.45)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCGACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTCCAGCAGCGCTTGGCGACCGACACCTCTTTTGGGGGCAACCTCGGCAAGGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGGCACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAGGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTACCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTACCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0094] SEQ ID NO:9 (Bba.46)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCAACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTCCAGCAGCGCTTGGCGACCGACACCTCTTTTGGGGGCAACCTCGGCAAGGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGACGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATGCTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAGCAGCTACCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATCCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0095] SEQ ID NO:10 (Bba.47)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCAACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTCCAGCAGCGCTTGGCGACCGACACCTCTTTTGGGGGCAACCTCGGCAAGGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCTCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTACCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGGCAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0096] SEQ ID NO:11 (Bba.48)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCAACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTTCAGGAGCGTCTTCAAGAAGATACGTCTTTTGGGGGCAACCTCGGGCGAGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCGCTTTTCCCCGCGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTATCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCGCCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0097] SEQ ID NO:12 (Bba.49)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCAACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTTCAGGAGCGTCTTCAAGAAGATACGTCTTTTGGGGGCAACCTCGGGCGAGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTATCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCGGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0098] SEQ ID NO:13 (Bba.50)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAAGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACGGCCCAAGGCAAATCAACAACATCAAGACGACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTCCAGCAGCGCTTGGCGACCGACACCTCTTTTGGGGGCAACCTCGGCAAGGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAGGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTCTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTACCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGAAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATCTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[0099] SEQ ID NO:14 (Bba.51)
ATGGCTGCTGACGGTTATCTTCCAGATTGGCTCGAGGACAACCTCTCTGAAGGCATTCGCGAGTGGTGGGCGCTGAAACCTGGAGCCCCACAGCCCAAGGCAAATCAACAACATCAAGACAACGCTCGGGGTCTTGTGCTTCCGGGTTACAAATACTTGGGACCCGGTAACGGACTCGACAAGGGAGAGCCGGTCAACGAGGCAGACGCCGCGGCCCTCGAGCACGACAAGGCCTACGACCAGCAGCTCAAGTCGGGAGACAACCCGTACCTCAAGTACAACCACGCGGACGCCGAGTTCCAGCAGCGCTTGGCGACCGACACCTCTTTTGGGGGCAACCTCGGCAAGGCAGTCTTCCAGGCCAAAAAGAGGATTCTCGAGCCTCTGGGTCTGGTTGAAGAGGGCGTTAAAACGGCTCCTGGAAAGAAACGCCCATTAGAAAAGACTCCAAATCGGCCGACCAACCCGGACTCTGGGAAGGCCCCGGCCAAGAAAAAGCAAAAAGACGGCGAGACAGCCGACTCTGCTAGAAGGACACTCGACTTTGAAGACTCTGGAGCAGGAGACGGACCCCCTGAGGGATCATCTTCCGGAGAAATGTCTCATGATGCTGAGATGCGTGCGGCGCCAGGCGGAAATGCTGTCGAGGCGGGACAAGGTGCCGATGGAGTGGGTAATGCCTCCGGTGATTGGCATTGCGATTCCACCTGGTCAGAGGGCCGAGTCACCACCACCAGCACCCGAACCTGGGTCCTGCCCACCTACAACAACCACCTGTACCTGCGAATCGGAACAACGGCCAACAGCAACACCTACAATGGATTCTCCACCCCCTGGGGATACTTTGACTTTAACCGCTTCCACTGCCACTTTTCCCCACGCGACTGGCAGCGACTCATCAACAACAACTGGGGACTCAGGCCGAAATCGATGCGTGTTAAAATCTTCAACATCCAGGTCAAGGAGGTCACTACGTCAAACGGCGAGACTACGGTCGCTAATAACCTTACCAGCACGGTTCAGATCTTTGCGGATTCAACGTATGAACTCCCATACGTGATGGACGCCGGTCAGGAGGGGAGCCTTCCTCCGTTCCCCAACGACGTGTTTATGGTTCCCCAATACGGGTACTGCGGAGTCGTCACTGGAGAAAACCAGAACCAAACAGACAGAAATGCCTTTTACTGTCTGGAGTACTTTCCATCCCAAATGCTAAGAACTGGCAACAACTTTGAAATCAGTTACCAATTTGAAAAAGTTCCTTTCCATTCAATGTACGCGCACAGCCAGAGCCTGGACAGAATGATGAATCCTTTGCTGGATCAGTACCTGTGGCATCTGCAATCGACCACTACCGGAAATTCCCTTAATCAAGGAACAGCTACCACCACGTACGGGAAAATTACCACTGGGGACTTTGCCTACTACAGGAAAAACTGGTTGCCTGGAGCCTGCATTAAACAACAAAAATTTTCAAAGAATGCCAGTCAAAACTACAAGATTCCCGCCAGCGGGGGAGACGCCCTTTTAAAGTATGACACGCATACCACTTTAAATGGGCGATGGAGTAACATGGCTCCTGGTCCTCCAATGGCCACCGCAGGTGCCGGGGACTCGGATTTTAGCAACAGCCAGCTGATCTTTGCCGGACCCAATCAGAGCGGTAACACGACCACGTCTTCAAACAATTTGTTGTTTACCTCAGAAGAGGAGATTGCCACAACAAACCCACGAGACACGGACATGTTTGGACAGATTGCAGATAATAATCAAAATGCCACCACCGCCCCTCACATCGCTAACCTGGACGCTATGGGAATTGTTCCCGGAATGGTCTGGCAAAACAGAGACATCTACTACCAGGGCCCTATTTGGGCCAAGGTCCCTCACACGGACGGACACTTTCACCCTTCGCCGCTGATGGGAGGATTTGGACTGAAACACCCGCCTCCGCAGATTTTCATCAAAAACACCCCCGTACCCGCCAATCCCAATACTACCTTTAGCGCTGCAAGGATCAATTCTTTTTTGACGCAGTACAGCACCGGACAAGTCGCCGTTCAGATCGACTGGGAAATTCAGAAGGAGCACTCCAAACGCTGGAATCCCGAAGTCCAATTTACTTCAAACTACGGCACTCAAAATTCTATGCTGTGGGCTCCCGACAACGCCGGCAACTACCACGAACCCCGGGCTATTGGGTCCCGTTTCCTCACCCACCACTTGTAA
[00100] В таблице 2 непосредственно ниже, «VR» относится к вариабельной области, и числа относятся к аминокислотным остаткам каждой вариабельной области или областей GBS и петли GH, перекрытых в аминокислотной последовательности.
Таблица 2
|
Трансген
[00101] Трансген представляет собой последовательность нуклеиновой кислоты, гетерологичную для векторных последовательностей, фланкирующих трансген, которая кодирует представляющий интерес полипептид, белок или другой продукт. Кодирующая последовательность нуклеиновой кислоты функционально связана с регуляторными компонентами, способом, позволяющим трансгену осуществлять транскрипцию, трансляцию и/или экспрессию в клетке-хозяине.
[00102] Состав последовательности трансгена может зависеть от применения, предназначенного для полученного вектора. Например, один тип последовательности трансгена включает репортерную последовательность, которая при экспрессии образует поддающийся детекции сигнал. Такие репортерные последовательности включают, без ограничения, последовательности ДНК, кодирующие β-лактамазу, β-галактозидазу (LacZ), щелочную фосфатазу, тимидинкиназу, зеленый флуоресцентный белок (GFP), хлорамфениколацетилтрансферазу (CAT), люциферазу, связанные с мембраной белки, включая, например, CD2, CD4, CD8, белок гемагглютинина вируса гриппа, и другие, хорошо известные в данной области, для которых высокоаффинные антитела, нацеленные на них, существуют или могут быть получены общепринятыми способами, и слитые белки, содержащие связанный с мембраной белок, подходящим образом слитый с доменом антигенной метки, среди прочих, из гемагглютинина или Myc.
[00103] Эти кодирующие последовательности, при ассоциации с регуляторными элементами, управляющими их экспрессией, обеспечивают сигналы, поддающиеся детекции общепринятыми способами, включая ферментные, радиографические, колориметрические, флуоресцентные или другие спектрографические анализы, анализы активированной флуоресценцией сортировки клеток и иммунологические анализы, включая твердофазный иммуноферментный анализ (ELISA), радиоиммунный анализ (RIA) и иммуногистохимию. Например, когда маркерная последовательность представляет собой ген LacZ, присутствие вектора, несущего сигнал, детектируют посредством анализов активности бета-галактозидазы. Когда трансген представляет собой зеленый флуоресцентный белок или люциферазу, вектор, несущий сигнал, можно измерять визуально, по образованию окраски или света, в люминометре.
[00104] Однако, желательно, трансген представляет собой немаркерную последовательность, кодирующую продукт, который можно использовать в биологии и медицине, такой как белки, пептиды, РНК, ферменты, доминантно негативные мутанты или каталитические РНК. Желательные молекулы РНК включают тРНК, дцРНК, рибосомную РНК, каталитические РНК, миРНК, короткошпилечную РНК, подвергнутую транс-сплайсингу РНК и антисмысловые РНК. Одним примером полезной последовательности РНК является последовательность, ингибирующая или прекращающая экспрессию подвергаемой нацеливанию последовательности нуклеиновой кислоты у подвергаемого лечению животного. Как правило, пригодные последовательности-мишени включают онкологические мишени и вирусные заболевания. См. примеры таких мишеней, онкологических мишеней и вирусов, идентифицированные ниже, в разделе, относятся к иммуногенам.
[00105] Трансген можно использовать для коррекции или облегчения недостаточности генов, которая может включать виды недостаточности, при которых нормальные гены экспрессируются на меньших, чем нормальные, уровнях, или виды недостаточности, при которых функциональный продукт гена не экспрессируется. Предпочтительный тип последовательности трансгена кодирует терапевтический белок или полипептид, который экспрессируется в клетке-хозяине. Изобретение, кроме того, относится к применению множества трансгенов, например, для коррекции или облегчения дефекта гена, вызванного мультисубъединичным белком. В конкретных ситуациях, различный трансген можно использовать для кодирования каждой субъединицы белка, или для кодирования различных пептидов или белков. Это является желательным, когда размер ДНК, кодирующей субъединицу белка, является большим, например, для иммуноглобулина, фактора роста тромбоцитов или белка дистрофина. Чтобы клетка продуцировала мультисубъединичный белок, клетку инфицируют рекомбинантным вирусом, содержащим каждую из различных субъединиц. Альтернативно, различные субъединицы белка могут быть кодированы одним и тем же трансгеном. В этом случае, один трансген включает ДНК, кодирующую каждую из субъединиц, где ДНК для каждой субъединицы отделена внутренним участком связывания рибозима (IRES). Является желательным, чтобы размер ДНК, кодирующей каждую из субъединиц, являлся небольшим, например, общий размер ДНК, кодирующей субъединицы и IRES, составлял менее чем пять тысяч пар оснований. В качестве альтернативы IRES, ДНК может быть разделена последовательностями, кодирующими пептид 2A, который саморасщепляется при пост-трансляционном событии. См., например, Donnelly et al, J. Gen. Virol., 78(Pt 1):13-21 (January 1997); Furler, et al, Gene Ther., 8(11):864-873 (June 2001); Klump et al., Gene Ther., 8(10):811-817 (May 2001). Этот пептид 2A значительно меньше, чем IRES, что делает его хорошо подходящим для использования, когда пространство является ограничивающим фактором. Более часто, когда трансген является большим, состоит из множества субъединиц, или два трансгена доставляют совместно, rAAV, несущие желательные трансген(ы) или субъединицы, совместно трансфицируют, чтобы позволить их конкатемеризацию in vivo для формирования одного генома вектора. В таком варианте осуществления, первый AAV может нести экспрессирующую кассету, которая экспрессирует один трансген, и второй AAV может нести экспрессирующую кассету, которая экспрессирует другой трансген, для совместной экспрессии в клетке-хозяине. Однако, выбранный трансген может кодировать любой биологически активный продукт или другой продукт, например, продукт, желательный для исследования.
[00106] Пригодные трансгены может легко выбирать специалист в данной области. Выбор трансгена не рассматривают как ограничение настоящего изобретения.
[00107] В некоторых вариантах осуществления, трансген представляет собой гетерологичный белок, и этот гетерологичный белок представляет собой терапевтический белок. Иллюстративные терапевтические белки включают, но без ограничения, факторы крови, такие как β-глобин, гемоглобин, тканевой активатор плазминогена и факторы свертывания; колониестимулирующие факторы (CSF); интерлейкины, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9 и т.д.; факторы роста, такие как фактор роста кератиноцитов (KGF), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF, такой как основный FGF и кислый FGF), фактор роста гепатоцитов (HGF), инсулиноподобные факторы роста (IGF), костный морфогенетический белок (BMP), эпидермальный фактор роста (EGF), фактор-9 роста и дифференцировки (GDF-9), происходящий из гепатомы фактор роста (HDGF), миостатин (GDF-8), фактор роста нервов (NGF), нейтрофины, фактор роста тромбоцитов (PDGF), тромбопоэтин (TPO), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β.) и т.п.; растворимые рецепторы, такие как растворимые рецепторы TNF-α, растворимые рецепторы VEGF, растворимые рецепторы интерлейкина (например, растворимые рецепторы IL-1 и растворимые рецепторы IL-1 типа II), растворимые рецепторы γ/δ-Т-клеток, лигандсвязывающие фрагменты растворимого рецептора и т.п.; ферменты, такие как α-глюкозидаза, имиглюцераза, β-глюкоцереброзидаза и альглюцераза; активаторы ферментов, такие как тканевой активатор плазминогена; хемокины, такие как 1P-10, монокин, индуцированный интерфероном-гамма (Mig), Groα/IL-8, RANTES, MIP-1α, MIP-1β., MCP-1, PF-4 и т.п.; ангиогенные агенты, такие как факторы роста эндотелия сосудов (VEGF, например, VEGF121, VEGF165, VEGF-C, VEGF-2), происходящий из глиомы фактор роста, ангиогенин, ангиогенин-2; и т.п.; антиангиогенные агенты, такие как растворимый рецептор VEGF; белковую вакцину; нейроактивные пептиды, такие как фактор роста нервов (NGF), брадикинин, холицистокинин, гастин, секретин, окситоцин, высвобождающий гонадотропин гормон, бета-эндорфин, энкефалин, субстанция P, соматостатин, пролактин, галанин, гормон, высвобождающий гормон роста, бомбезин, динорфин, варфарин, нейротензин, мотилин, тиреотропин, нейропептид Y, лютеинизирующий гормон, кальцитонин, инсулин, глюкагоны, вазопрессин, ангиотензин II, высвобождающий тиреотропин гормон, вазоактивный кишечный пептид, пептид сна и т.п.; тромболитические средства; предсердный натрийуретический пептид; релаксин; глиальный фибриллярный кислый белок; фолликулостимулирующий гормон (FSH); антитрипсин альфа-1 человека; ингибирующий лейкоз фактор (LIF); тканевые факторы, лютеинизирующий гормон; факторы активации макрофагов; фактор некроза опухоли (TNF); фактор хемотаксиса нейтрофилов (NCF); тканевые ингибиторы металлопротеиназ; вазоактивный кишечный пептид; ангиогенин; ангиотропин; фибрин; гирудин; антагонисты рецептора IL-1; и т.п.. Некоторые другие неограничивающие примеры представляющего интерес белка включают цилиарный нейротрофический фактор (CNTF); нейротрофический фактор головного мозга (BDNF); нейтрофины 3 и 4/5 (NT-3 и 4/5); нейротрофический фактор глиальных клеток (GDNF); декарбоксилазу ароматических аминокислот (AADC); связанные с гемофилией белки свертывания, такие как фактор VIII, фактор IX, фактор X; дистрофин, минидистрофин, или микродистрофин; лизосомальную кислую липазу; фенилаланингидроксилазу (PAH); связанные с гликогенозами ферменты, такие как глюкоза-6-фосфатаза, кислая мальтаза, линеаризующий гликоген фермент, мышечная гликогенфосфорилаза, гликогенфосфорилаза печени, мышечная фосфофруктокиназа, киназа фосфорилазы (например, PHKA2), транспортер глюкозы (например, GLUT2), альдолаза A, β-енолаза и гликогенсинтаза; лизосомальные ферменты (например, бета-N-ацетилгексозаминидаза A); и любые их варианты.
Регуляторные контрольные элементы
[00108] Вектор AAV включает также общепринятые контрольные элементы или последовательности, которые являются функционально связанными с трансгеном таким образом, который позволяет его транскрипцию, трансляцию и/или экспрессию в клетке, трансфицированной плазмидным вектором или инфицированной вирусом, полученным по изобретению. В рамках изобретения, «функционально связанные» последовательности включают как контрольные последовательности экспрессии, которые являются смежными с представляющим интерес геном, так и контрольные последовательности экспрессии, которые действуют в транс-положении или на расстоянии для контроля представляющего интерес гена.
[00109] Контрольные последовательности экспрессии включают подходящие последовательности для инициации транскрипции, терминации, промоторные и энхансерные последовательности; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования (полиA); последовательности, стабилизирующие цитоплазматическую мРНК; последовательности, улучшающие эффективность трансляции (т.е., консенсусную последовательность Козак); последовательности, улучшающие стабильность белка; и если желательно, последовательности, усиливающие секрецию кодированного продукта. Большое количество контрольных последовательностей экспрессии, включая промоторы, которые являются нативными, конститутивными, индуцируемыми и/или тканеспецифическими, известны в данной области и могут быть использованы.
[00110] Примеры конститутивных промоторов включают, без ограничения, ретровирусный промотор LTR вируса саркомы Рауса (RSV) (необязательно, с энхансером RSV), промотор цитомегаловируса (CMV) (необязательно, с энхансером CMV энхансер) (см., например, Boshart et al, Cell, 41:521-530 (1985)), промотор SV40, промотор дигидрофолатредуктазы, промотор β-актина, промотор фосфоглицеринкиназы (PGK) и промотор EF1 [Invitrogen]. Индуцируемые промоторы позволяют регуляцию экспрессии гена и могут подвергаться регуляции экзогенно вводимыми соединениями, факторами окружающей среды, такими как температура, или присутствием специфического физиологического состояния, например, острой фазы, конкретного состояния дифференцировки клетки, или только в делящихся клетках. Индуцируемые промоторы и индуцируемые системы являются доступными из множества коммерческих источников, включая, без ограничения, Invitrogen, Clontech и Ariad. Множество других систем описаны и могут быть легко выбраны специалистом в данной области. Примеры индуцируемых промоторов, регулируемых экзогенно вводимыми соединениями, включают индуцируемый цинком промотор металлотионина (MT) овцы, индуцируемый дексаметазоном (Dex) промотор вируса опухоли молочной железы мыши (MMTV), промоторную систему полимеразы T7 [WO 98/10088]; промотор экдизона насекомых [No et al, Proc. Natl. Acad. Sci. USA, 93:3346-3351 (1996)], репрессируемую тетрациклином систему [Gossen et al, Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)], индуцируемую тетрациклином систему [Gossen et al, Science, 268:1766-1769 (1995), см. также Harvey et al, Curr. Opin. Chem. Biol., 2:512-518 (1998)], индуцируемую RU486 систему [Wang et al, Nat. Biotech., 15:239-243 (1997) и Wang et al, Gene Ther., 4:432-441 (1997)] и индуцируемую рапамицином систему [Magari et al, J. Clin. Invest., 100:2865-2872 (1997)]. Другими типами индуцируемых промоторов, которые можно использовать в этом контексте, являются промоторы, которые регулируются специфическим физиологическим состоянием, например, температурой, острой фазой, конкретным состоянием дифференцировки клетки или только в делящихся клетках.
[00111] В другом варианте осуществления, можно использовать нативный промотор для трансгена. Нативный промотор может являться предпочтительным, когда желательно, чтобы экспрессия трансгена имитировала естественную экспрессию. Нативный промотор можно использовать, когда экспрессия трансгена должна регулироваться во времени, или в процессе развития, или тканеспецифическим образом, или в ответ на специфические транскрипционные стимулы. В следующем варианте осуществления, другие нативные контрольные элементы для экспрессии, такие как энхансерные элементы, участки полиаденилирования или консенсусные последовательности Козак, также можно использовать для имитации естественной экспрессии.
[00112] Другой вариант осуществления трансгена включает ген, функционально связанный с тканеспецифическим промотором. Например, если экспрессия в скелетной мышце является желательной, необходимо использовать промотор, который активен в мышцах. Они включают промоторы из генов, кодирующих β-актин скелетных мышц, легкую цепь 2A миозина, дистрофин, мышечную креатинкиназу, также как синтетические промоторы для мышц с активностью, превышающей активность встречающихся в природе промоторов (см. Li et al., Nat. Biotech., 17:241-245 (1999)). Примеры промоторов, являющихся тканеспецифическими, известны для печени (промотор альбумина, Miyatake et al., J. Virol., 71:5124-32 (1997); коровый промотор вируса гепатита B, Sandig et al., Gene Ther., 3:1002-9 (1996); промотор альфа-фетопротеина (AFP), Arbuthnot et al., Hum. Gene Ther., 7:1503-14 (1996)), промотор остеокальцина кости (Stein et al., Mol. Biol. Rep., 24:185-96 (1997)); промотор сиалопротеина кости (Chen et al., J. Bone Miner. Res., 11:654-64 (1996)), промотор лимфоцитов (CD2, Hansal et al., J. Immunol., 161:1063-8 (1998); промотор тяжелой цепи иммуноглобулина; промотор цепи T-клеточного рецептора), нейрональный промотор, такой как специфический для нейронов промотор енолазы (NSE) (Andersen et al., Cell. Mol. Neurobiol., 13:503-15 (1993)), промотор гена легкой цепи нейрофиламентов (Piccioli et al., Proc. Natl. Acad. Sci. USA, 88:5611-5 (1991)), и промотор специфического для нейронов гена vgf (Piccioli et al., Neuron, 15:373-84 (1995)), среди прочего.
[00113] Необязательно, плазмиды, несущие терапевтически полезные трансгены, могут также включать селективные маркеры или репортерные гены, которые могут включать последовательности, кодирующие гены устойчивости к генетицину, гигромицину или пуромицину, среди прочего. Такие селективные репортеры или маркерные гены (предпочтительно, локализованные вне вирусного генома, подлежащего спасению способом по изобретению), можно использовать для сигнализации о присутствии плазмид в бактериальных клетках, такой как устойчивость к ампициллину. Другие компоненты плазмиды могут включать точку начала репликации. Выбор этих и других промоторов и векторных элементов является общепринятым, и многие такие последовательности являются доступными [см., например, Sambrook et al, и процитированные в нем ссылки].
Способы получения рекомбинантных AAV
[00114] Настоящее изобретение относится к материалам и способам для продукции рекомбинантных AAV в клетках насекомых или млекопитающих. В некоторых вариантах осуществления, вирусная конструкция дополнительно содержит промотор и участок рестрикции ниже промотора, чтобы позволить вставку полинуклеотида, кодирующего один или несколько представляющих интерес белков, где промотор и участок рестрикции локализованы ниже 5'-ITR AAV и выше 3'-ITR AAV. В некоторых вариантах осуществления, вирусная конструкция дополнительно содержит посттранскрипционный регуляторный элемент ниже участка рестрикции и выше 3'-ITR AAV. В некоторых вариантах осуществления, вирусная конструкция дополнительно содержит полинуклеотид, вставленный в участок рестрикции и функционально связанный с промотором, где полинуклеотид содержит кодирующую область представляющего интерес белка. Как понятно специалисту в данной области, любой из векторов AAV, описанных в настоящем описании, можно использовать в этом способе в качестве вирусной конструкции для продукции рекомбинантного AAV.
[00115] В некоторых вариантах осуществления, функции помощника обеспечивают один или несколько плазмид-помощников или вирусов-помощников, содержащих гены аденовирусного или бакуловирусного помощника. Неограничивающие примеры генов аденовирусных или бакуловирусных помощников включают, но без ограничения, E1A, E1B, E2A, E4 и VA, которые могут обеспечивать функции помощника для упаковки AAV.
[00116] Вирусы-помощники для AAV известны в данной области и включают, например, вирусы из семейства Adenoviridae и семейства Herpesviridae. Примеры вирусов-помощников для AAV включают, но без ограничения, вирус-помощник SAdV-13 и подобный SAdV-13 вирус-помощник, описанный в Патентной публикации США No. 20110201088 (содержание которой приведено в настоящем описании в качестве ссылки), векторы-помощники pHELP (Applied Viromics). Специалисту в данной области понятно, что вирус-помощник или плазмиду-помощника для AAV, способные обеспечивать функцию помощника для AAV, можно использовать по настоящему изобретению.
[00117] В некоторых вариантах осуществления, гены cap AAV присутствуют в плазмиде. Плазмида может дополнительно содержать ген rep AAV. Гены cap и/или ген rep из любого серотипа AAV (включая, но без ограничения, AAV1, AAV2, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV13 и любые их варианты) можно использовать в настоящем описании для получения рекомбинантного AAV. В некоторых вариантах осуществления, гены cap AAV кодируют капсид из серотипа 1, серотипа 2, серотипа 4, серотипа 5, серотипа 6, серотипа 7, серотипа 8, серотипа 9, серотипа 10, серотипа 11, серотипа 12, серотипа 13 или его вариант.
[00118] В некоторых вариантах осуществления, клетку насекомого или млекопитающего можно транфицировать плазмидой-помощником или вирусом-помощником, вирусной конструкцией и плазмидой, кодирующей гены cap AAV; и рекомбинантный вирус AAV можно собирать в различные временные точки после совместной трансфекции. Например, рекомбинантный вирус AAV можно собирать через приблизительно 12 часов, приблизительно 24 часа, приблизительно 36 часов, приблизительно 48 часов, приблизительно 72 часа, приблизительно 96 часов, приблизительно 120 часов или в какое-то время между любыми из двух этих временных точек после совместной трансфекции.
[00119] Рекомбинантный AAV можно также получать с использованием любых общепринятых способов, известных в данной области, подходящих для продукции инфекционного рекомбинантного AAV. В некоторых случаях, рекомбинантный AAV можно получать с использованием клетки насекомого или млекопитающего, стабильно экспрессирующей некоторые из необходимых компонентов для продукции частицы AAV. Например, плазмиду (или множество плазмид), содержащую гены rep и cap AAV, и селективный маркер, такой как ген устойчивости к неомицину, можно интегрировать в геном клетки. Клетку насекомого или млекопитающего можно затем совместно инфицировать вирусом-помощником (например, аденовирусом или бакуловирусом, обеспечивающим функции помощника) и вирусным вектором, содержащим 5'- и 3'-ITR AAV (и нуклеотидную последовательность, кодирующую гетерологичный белок, если желательно). Преимуществами этого способа является то, что клетки поддаются отбору и являются пригодными для крупномасштабной продукции рекомбинантного AAV. В качестве другого неограничивающего примера, аденовирус или бакуловирус вместо плазмид можно использовать для введения генов rep и cap в упаковывающие клетки. В качестве другого неограничивающего примера, как вирусный вектор, содержащий 5'- и 3'-LTR AAV, так и гены rep-cap можно стабильно интегрировать в ДНК клетки-продуцента, и функции помощника можно обеспечивать посредством аденовируса дикого типа для продукции рекомбинантного AAV.
Типы клеток, используемые для продукции AAV
[00120] Вирусные частицы, содержащие векторы AAV по изобретению, можно получать с использованием любого типа клеток беспозвоночных, который позволяет продукцию AAV или биологических продуктов и который можно поддерживать в культуре. Например, используемая линия клеток насекомого может происходить из Spodoptera frugiperda, например, Sf9, SF21, SF900+, линий клеток дрозофиллы, линий клеток комара, например, происходящие из Aedes albopictus линии клеток, линий клеток тутового шелкопряда, например, линий клеток Bombyxmori, линий клеток Trichoplusia ni, таких как клетки High Five, или линий клеток чешуекрылых, таких как линии клеток Ascalapha odorata. Предпочтительными клетками насекомых являются клетки из видов насекомых, которые являются чувствительными к инфекции бакуловирусов, включая High Five, Sf9, Se301, SeIZD2109, SeUCR1, Sf900+, Sf21, BTI-TN-5B1-4, MG-1, Tn368, HzAm1, BM-N, Ha2302, Hz2E5 и Ao38.
[00121] Бакуловирусы представляют собой оболочечные ДНК-вирусы членистоногих, два члена которых представляют собой хорошо известные экспрессирующие векторы для продукции рекомбинантных белков в культурах клеток. Бакуловирусы имеют кольцевые двухцепочечные геномы (80-200 т.п.о.), которые можно конструировать таким образом, чтобы позволять доставку большого геномного содержимого в специфические клетки. Вирусы, используемые в качестве вектора, как правило, представляют собой мультикапсидный вирус ядерного полиэдроза Autographa californica (AcMNPV) или Bombyx mori (Bm NPV) (Kato et al., 2010).
[00122] Бакуловирусы являются общепринятыми для инфекции клеток насекомых для экспрессии рекомбинантных белков. В частности, экспрессию гетерологичных генов в насекомых можно осуществлять, как описано, например, в Патенте США No. 4745051; Friesen et al (1986); EP 127,839; EP 155,476; Vlak et al. (1988); Miller et al. (1988); Carbonell et al. (1988); Maeda et al. (1985); Lebacq-Verheyden et al. (1988); Smith et al. (1985); Miyajima et al. (1987); и Martin et al.(1988). Множество штаммов и вариантов бакуловирусов, и соответствующих пермиссивных клеток-хозяев насекомых, которые можно использовать для продукции белка, описаны в Luckow et al (1988), Miller et al. (1986); Maeda et al. (1985) и McKenna (1989).
[00123] В другом аспекте изобретения, способы по изобретению осуществляют также с использованием любого типа клеток млекопитающих, который позволяют репликацию AAV или продукцию биологических продуктов и который можно поддерживать в культуре. Предпочтительно используемые клетки млекопитающих могут представлять собой клетки HEK293, HeLa, CHO, NS0, SP2/0, PER.C6, Vero, RD, BHK, HT 1080, A549, Cos-7, ARPE-19 и MRC-5.
Получение гетерологичных белков in vitro
[00124] В качестве неограничивающего примера, рекомбинантный AAV, описанный в настоящем описании, можно использовать для получения представляющего интерес белка in vitro, например, в культуре клеток. В качестве неограничивающего примера, некоторые варианты осуществления относятся к способу получения представляющего интерес белка in vitro, включающему получение рекомбинантного AAV, содержащего нуклеотидную последовательность, кодирующую гетерологичный белок; и приведение рекомбинантного AAV в контакт с клеткой в культуре клеток, посредством чего рекомбинантный AAV экспрессирует представляющий интерес белок в клетке. Размер нуклеотидной последовательности, кодирующей представляющий интерес белок, может меняться. Например, нуклеотидная последовательность может иметь длину по меньшей мере приблизительно 1,4 т.п.о., по меньшей мере приблизительно 1,5 т.п.о., по меньшей мере приблизительно 1,6 т.п.о., по меньшей мере приблизительно 1,7 т.п.о., по меньшей мере приблизительно 1,8 т.п.о., по меньшей мере приблизительно 2,0 т.п.о., по меньшей мере приблизительно 2,2 т.п.о., по меньшей мере приблизительно 2,4 т.п.о., по меньшей мере приблизительно 2,6 т.п.о., по меньшей мере приблизительно 2,8 т.п.о., по меньшей мере приблизительно 3,0 т.п.о., по меньшей мере приблизительно 3,2 т.п.о., по меньшей мере приблизительно 3,4 т.п.о., длину по меньшей мере приблизительно 3,5 т.п.о., длину по меньшей мере приблизительно 4,0 т.п.о., длину по меньшей мере приблизительно 5,0 т.п.о., длину по меньшей мере приблизительно 6,0 т.п.о., длину по меньшей мере приблизительно 7,0 т.п.о., длину по меньшей мере приблизительно 8,0 т.п.о., длину по меньшей мере приблизительно 9,0 т.п.о. или длину по меньшей мере приблизительно 10,0 т.п.о. В некоторых вариантах осуществления, нуклеотид имеет длину по меньшей мере приблизительно 1,4 т.п.о.
Получение гетерологичных белков in vivo
[00125] Рекомбинантный AAV, описанный в настоящем описании, можно использовать для получения представляющего интерес белка in vivo, например, у животного, такого как млекопитающее. Некоторые варианты осуществления относятся к способу получения представляющего интерес белка in vivo, включающему получение рекомбинантного AAV, содержащего нуклеотидную последовательность, кодирующую представляющий интерес белок; и введение рекомбинантного AAV субъекту, посредством чего рекомбинантный AAV экспрессирует представляющий интерес белок у субъекта. Субъект может представлять собой, в некоторых вариантах осуществления, не относящегося к человеку млекопитающего, например, обезьяну, собаку, кошку, мышь или корову. Размер нуклеотидной последовательности, кодирующей представляющий интерес белок, может меняться. Например, нуклеотидная последовательность может иметь длину по меньшей мере приблизительно 1,4 т.п.о., по меньшей мере приблизительно 1,5 т.п.о., по меньшей мере приблизительно 1,6 т.п.о., по меньшей мере приблизительно 1,7 т.п.о., по меньшей мере приблизительно 1,8 т.п.о., по меньшей мере приблизительно 2,0 т.п.о., по меньшей мере приблизительно 2,2 т.п.о., по меньшей мере приблизительно 2,4 т.п.о., по меньшей мере приблизительно 2,6 т.п.о., по меньшей мере приблизительно 2,8 т.п.о., по меньшей мере приблизительно 3,0 т.п.о., по меньшей мере приблизительно 3,2 т.п.о., по меньшей мере приблизительно 3,4 т.п.о., длину по меньшей мере приблизительно 3,5 т.п.о., длину по меньшей мере приблизительно 4,0 т.п.о., длину по меньшей мере приблизительно 5,0 т.п.о., длину по меньшей мере приблизительно 6,0 т.п.о., длину по меньшей мере приблизительно 7,0 т.п.о., длину по меньшей мере приблизительно 8,0 т.п.о., длину по меньшей мере приблизительно 9,0 т.п.о. или длину по меньшей мере приблизительно 10,0 т.п.о. В некоторых вариантах осуществления, нуклеотид имеет длину по меньшей мере приблизительно 1,4 т.п.о.
Терапевтические применения
[00126] Рекомбинантный AAV, полученный описанными способами, можно использовать для экспрессии одного или нескольких терапевтических белков для лечения различных заболеваний или нарушений. Неограничивающие примеры заболеваний включают злокачественную опухоль, такую как карцинома, саркома, лейкоз, лимфома; и аутоиммунные заболевания, такие как рассеянный склероз. Неограничивающие примеры карцином включают карциному пищевода; печеночно-клеточную карциному; базально-клеточную карциному, плоскоклеточную карциному (различных тканей); карциному мочевого пузыря, включая переходноклеточную карциному; бронхогенную карциному; карциному ободочной кишки; колоректальную карциному; карциному желудка; карциному легкого, включая мелкоклеточную карциному и немелкоклеточную карциному лекого; карциному коры надпочечников; карциному щитовидной железы; карциному поджелудочной железы; карциному молочной железы; карциному яичника; карциному предстательной железы; аденокарциному; карциному потовых желез; карциному сальной железы; папиллярную карциному; папиллярную аденокарциному; цистаденокарциному; медуллярную карциному; почечноклеточную карциному; карциному протоков in situ или карциному желчных протоков; хориокарциному; семиному; эмбриональную карциному; опухоль Вильмса; карциному шейки матки; карциному матки; карциному яичников; остеогенную карциному; эпителиальную карциному; и носоглоточную карциному. Неограничивающие примеры сарком включают фибросаркому, миксосаркому, липосаркому, хондросаркому, хордому, остеогенную саркому, остеосаркому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому и другие саркомы мягких тканей. Неограничивающие примеры солидных опухолей включают глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому и ретинобластому. Неограничивающие примеры лейкозов включают хронические миелопролиферативные синдромы; острые миелогенные лейкозы; хронические лимфоцитарные лейкозы, включая B-клеточный CLL, T-клеточный CLL, пролимфоцитарный лейкоз и волосатоклеточный лейкоз; и острые лимфобластные лейкозы. Примеры лимфом включают, но без ограничения, B-клеточные лимфомы, такие как лимфома Беркитта; лимфома Ходжкина; и т.п.. Другие неограничивающие примеры заболеваний, которые можно лечить с использованием векторов AAV, рекомбинантных вирусов и способов, описанных в настоящем описании, включают генетические нарушения, включая серповидноклеточную анемию, кистозный фиброз, недостаточность лизосомальной кислой липазы (LAL) 1, болезнь Тея-Сакса, фенилкетонурию, мукополисахаридозы, гликогенозы (GSD, например, GSD типов I, II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII и XIV), галактоземию, мышечную дистрофию (например, мышечную дистрофию Дюшенна) и гемофилю, такую как гемофилия A (классическая гемофилия) и гемофилия B (болезнь Кристмаса), болезнь Вильсона, болезнь Фабри, болезнь Гоше, наследственный ангионевротический отек (HAE) и недостаточность антитрипсина альфа 1. Кроме того, векторы AAV, рекомбинантные вирусы и способы, описанные в настоящем описании, можно использовать против других нарушений, которые можно лечить посредством местной экспрессии трансгена в печени или посредством экспрессии секретированного белка из печени или гепатоцита.
[00127] Количество гетерологичного белка, экспрессированного у субъекта (например, в сыворотке субъекта), может меняться. Например, в некоторых вариантах осуществления, белок может экспрессироваться в сыворотке субъекта в количестве по меньшей мере приблизительно 9 мкг/мл, по меньшей мере приблизительно 10 мкг/мл, по меньшей мере приблизительно 50 мкг/мл, по меньшей мере приблизительно 100 мкг/мл, по меньшей мере приблизительно 200 мкг/мл, по меньшей мере приблизительно 300 мкг/мл, по меньшей мере приблизительно 400 мкг/мл, по меньшей мере приблизительно 500 мкг/мл, по меньшей мере приблизительно 600 мкг/мл, по меньшей мере приблизительно 700 мкг/мл, по меньшей мере приблизительно 800 мкг/мл, по меньшей мере приблизительно 900 мкг/мл, или по меньшей мере приблизительно 1000 мкг/мл. В некоторых вариантах осуществления, представляющий интерес белок экспрессируется в сыворотке субъекта в количестве приблизительно 9 мкг/мл, приблизительно 10 мкг/мл, приблизительно 50 мкг/мл, приблизительно 100 мкг/мл, приблизительно 200 мкг/мл, приблизительно 300 мкг/мл, приблизительно 400 мкг/мл, приблизительно 500 мкг/мл, приблизительно 600 мкг/мл, приблизительно 700 мкг/мл, приблизительно 800 мкг/мл, приблизительно 900 мкг/мл, приблизительно 1000 мкг/мл, приблизительно 1500 мкг/мл, приблизительно 2000 мкг/мл, приблизительно 2500 мкг/мл или в диапазоне между любыми двумя из этих значений. Специалисту в данной области понятно, что уровень экспрессии, необходимый для представляющего интерес белка, чтобы способ являлся эффективным, может меняться в зависимости от неограничивающих факторов, таких как конкретный представляющий интерес белок и субъект, подвергаемый лечению, и эффективное количество белка может легко определять специалист в данной области, с использованием общепринятых способов, известных в данной области, без излишнего экспериментирования.
ПРИМЕРЫ
Пример 1 Выделение новых природных капсидных белков
[00128] Новые природные капсидные белки выделяли из печени бабуина. Замороженную ткань печени получали из Texas Biomedical или New England Primate Research Center. Геномную ДНК получали из ткани печени с использованием набора DNeasy Blood & Tissue (Qiagen, каталожный #69504).
[00129] Полимеразную цепную реакцию (ПЦР) проводили на геномной ДНК с использованием следующих праймеров: праймера rep-1397-F (5’-GTGCCCTTTTACGGCTGCGTGAACTGGACCAATGAAAACTTTCC-3’ SEQ ID NO:21) и праймера cap-2872-R (5’-CCGACGGAGTGGGCAATGCCTCAGGAAATTGGCATTGCGATTCC-3’ SEQ ID NO:22) в следующих условиях: начальная инкубация: 97°C, 120 с, стадия денатурации: 97°C, 15 с, стадия гибридизации: 58°C, 60°C или 62°C, 15 с, стадия удлинения: 72°C, 240 с. Стадии денатурации, гибридизации и удлинения проводили в течение 35 циклов. Затем реакционную смесь инкубировали при 72°C, 7 мин, и хранили при 4°C до анализа. Продукты ПЦР разделяли посредством электрофореза в 1% агарозных гелях, выделяли с использованием набора для выделения из геля Gel Extraction Kit (Qiagen, каталожный #28704) и клонировали в pCR4-TOPO-TA (Invitrogen, каталожный # 450030), в соответствии с инструкциями производителя. После трансформации клеток E. coli, NEB5α, ДНК получали из устойчивых к ампициллину колоний и секвенировали с обоих концов для определения того, кодирует ли вставка родственную последовательность AAV.
[00130] Если вставки в pCR4-TOPO TA являлись родственными последовательностям AAV, конструировали специфические для последовательности праймеры для части последовательности rep, для проведения «ПЦР вокруг эписомы» (далее в настоящем описании «ATE ПЦР»), для получения полного гена капсида. ATE ПЦР основан на наблюдении, что персистирующие геномы AAV образуют кольцевые эписомы в тканях животных. Соответственно, можно использовать «разветвляющийся» набор праймеров, соответствующих последовательности в гене rep для проведения полимеразных цепных реакций для выделения большинства или всех из последовательностей AAV, которые могут существовать в этой эписоме, но в частности, можно выделять полный непрерывный ген капсида. Мультимеры эписом могут формироваться, например, посредством гомологичной рекомбинации, и в этом случае, является возможным выделять более одного гена капсида (которые обычно не являются одинаковыми) в результате одной реакции ATE ПЦР.
[00131] ATE ПЦР проводили в стандартном устройстве для полимеразной цепной реакции с использованием 2-стадийной программы следующим образом: начальная инкубация: 95°C, 240 с, стадия денатурации: 95°C, 30 с, стадия гибридизации/удлинения: 72°C, 300 с. Стадии денатурации и объединенные стадии гибридизации/удлинения проводили в течение 40 циклов. Затем реакционную смесь инкубировали при 72°C, 7 мин, и хранили при 4°C до анализа. Продукты ПЦР подвергали электрофорезу в 1% агарозных гелях. Продукты ПЦР, имеющие длину мультимеров генома AAV (~4,5 тысяч пар оснований) вырезали из геля, очищали с использованием набора для выделения из геля QIAquick Gel Extraction Kit (Qiagen, каталожный #28704) и клонировали в pCR4-TOPO-TA (Invitrogen, каталожный # 450030), в соответствии с инструкциями производителя. После трансформации клеток E. coli, NEB5α, ДНК получали из устойчивых к ампициллину колоний и определяли полную последовательность вставки.
[00132] Если в 2-стадийной программе, описанной выше, не получали продукты ПЦР правильного размера, использовали следующую 3-стадийную программу: Начальная инкубация: 95°C, 240 с, стадия денатурации: 95°C, 30 с, стадия гибридизации: 62°C, 64°C, 66°C или 68°C, 30 с, стадия удлинения: 72°C, 300 с. Стадии денатурации, гибридизации и удлинения проводили в течение 40 циклов. Затем реакционную смесь инкубировали при 72°C, 7 мин, и хранили при 4°C до анализа, как выше.
[00133] После определения полных последовательностей вставки в pCR4-TOPO TA, их идентифицировали как представляющие собой гены капсида AAV с использованием алгоритма BLAST (доступного на веб-сайте NCBI). Их связь с известными AAV определяли с использованием различных программ для выравнивания нуклеотидных или аминокислотных последовательностей, таких как Clustal Omega (доступная на веб-сайте EBI) или Vector NTI (Invitrogen, Inc.).
[00134] Для получения AAV, уникальные гены капсида AAV субклонировали в экспрессирующую плазмиду (pAAV-RC; Agilent, Inc.), затем трансфицировали в клетки 293 вместе с вектором (pAAV-люцифераза) и аденовирусной плазмидой-помощником (pHELPER; Agilent, Inc.). Продукции AAV позволяли проходить в течение 3 суток, и затем получали неочищенные лизаты посредством замораживания-размораживания клеток три раза. Дебрис осаждали, и супернатант (неочищенный AAV) титровали с использованием Q-ПЦР для определения геномного титра (подтверждающего, что капсид является способным к сборке и упаковке ДНК) и затем использовали для оценки трансдукции посредством AAV различных клеток.
[00135] Идентифицированные аминокислотные последовательности VP1 из капсидных белков нового AAV, полученного из ткани млекопитающего, описаны в настоящем описании как SEQ ID NO:1-7. Локализации ассоциированных областей VP2 и VP3 также описаны в настоящем описании. Настоящее изобретение относится к (i) выделенным капсидным белкам AAV, имеющим по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с любым из VP1 из капсидных последовательностей из SEQ ID NO:1-7, или областей VP2 или VP3 из любой из капсидных последовательностей из SEQ ID NO:1-7, или (ii) выделенным капсидным белкам AAV, содержащим или состоящим из любого из VP1 из капсидных последовательностей из SEQ ID NO:1-7, или областей VP2 или VP3 из любой из капсидных последовательностей из SEQ ID NO:1-7. Изобретение также относится к частице AAV, содержащей любой из вышеописанных капсидных белков AAV, где частица AAV дополнительно содержит либо (i) нуклеиновую кислоту, имеющую инвертированные концевые повторы AAV и трансген, содержащий гетерологичный ген, функционально связанный с регуляторными последовательностями управляющими экспрессией гетерологичного гена в клетке-хозяине, либо (ii) нуклеиновую кислоту, содержащую гетерологичный ген, функционально связанный с регуляторными последовательностями, контролирующими экспрессию гетерологичного гена в клетке-хозяине.
[00136] Исследовали также нейтрализацию новых частиц AAV по настоящему изобретению антителами в сыворотке человека. Клетки HEK293T рассевали при плотности 5×104 клеток/лунку и инкубировали в течение ночи. Очищенные rAAV разводили до конечного титра 2×106 г.в./мкл и смешивали с серийными разведениями (0-10 мг/мл) IVIG в течение 1 час. Рекомбинантные AAV добавляли к клеткам HEK293T с использованием MOI 1000 и инкубировали при 37°C. Через семьдесят два часа после инфекции, нейтрализацию IVIG анализировали на основании считывания относительных единиц люциферазы (RLU). Этопозид не использовали в этом исследовании. результаты представлены в таблице 3. Как ожидали, трансдукцию AAV2 (положительный контроль) прекращали посредством добавления IVIG человека (не показано). В отличие от этого, для конкретных из тестированных новых AAV показаны свойства устойчивости к IVIG.
Таблица 3: Данные нейтрализации IVIG:
|
[00137] Кроме того, анализ нейтрализации IVIG повторяли для сравнения нейтрализации рекомбинантных частиц AAV, имеющих капсиды, перечисленные в таблице 3 (обозначенные как «новые капсиды», с нейтрализацией рекомбинантных частиц AAV, имеющих контрольные капсиды: AAV5, AAV8 и AAV9. Как показано на фиг. 2, для AAV, имеющих капсиды, описанные в настоящем описании, показаны свойства устойчивости к IVIG.
[00138] Для определения тканеспецифической инфекционности капсидов AAV, описанных в настоящем описании, получали AAV, содержащий каждый из капсидов и экспрессирующий трансген люциферазы (AAV-RSV-egfp-T2A-Fluc2). Самцов мышей Balb/C закупали из Charles River Breeding Laboratories. Дозу 2×1013 г.в./кг вектора AAV-RSV-egfp-T2A-Fluc2 инъецировали в хвостовую вену мышей в возрасте 8 недель. Через 3 и 5 недель после инъекции, проводили биолюминесцентную визуализацию in vivo с использованием устройства для визуализации in vivo (IVIS Lumina LT, полученного из PerkinElmer Inc., Waltham, MA). Кратко, мышей подвергали анестезии с использованием 2% изофлурана и кислорода. 150 мкл 30 мг/мл биолюминесцентного субстрата D-люциферина RediJect инъецировали внутрибрюшинно. Через десять минут после инъекции субстрата, животных подвергали визуализации с использованием устройства для визуализации in vivo с использованием его охлаждаемой камеры с прибором с зарядовой связью (CCD). Изображения получали в положении животных на спине. Анестезию поддерживали на протяжении всей сессии визуализации посредством доставки изофлурана-кислорода в светонепроницаемую камеру для визуализации.
[00139] Мышей умерщвляли после сессий визуализации через 5 недель после инъекции AAV. Различные органы собирали и подвергали визуализации с использованием устройства для визуализации. Условия измерения являлись такими же, как условия, использованные для визуализации in vivo. Для визуализации, получали черно-белые фотографии животных, с последующим получением биолюминесцентного изображения. Данные изображений обрабатывали и анализировали с использованием программного обеспечения living image версии 4.5.2 (PerkinsElmer Waltham, MA). Отслеживали области интереса (ROI), окружающие каждое животное, так же как индивидуальные органы, для количественной оценки суммарного потока (TF) (фотонов/секунду), высвобождаемого посредством активности люциферазы. Суммарный поток активности является представлением инфекционности AAV для каждой системы органов и показан для каждого капсида AAV на фигуре 1. Данные показывают, что новые капсиды образуют рекомбинантный AAV, имеющий высокую специфичность для клеток печени.
[00140] Дополнительные эксперименты проводили, как описано выше, с использованием AAV, имеющих следующие капсиды, описанные в настоящем описании (Bba.45, Bba.46, Bba.47, Bba.49, Bba.50 и Bba.51), и трансдукцию сравнивали с трансдукцией AAV, имеющими следующие контрольные капсиды: AAV5, AAV8 и AAV9. Как показано на фиг. 3, для AAV, имеющих новые капсиды, показано увеличение эффективности трансдукции, по сравнению с AAV, имеющими капсиды из AAV5 или AAV12. Например, новые капсиды имеют увеличение эффективности трансдукции на 10-40%, по сравнению с AAV, имеющим капсид AAV5. Кроме того, на фиг. 4 показано, что AAV, имеющие новые капсиды, имеют значимо более высокую степень специфичности для клеток печени, по сравнению с AAV5. Кроме того, для AAV, имеющих новые капсиды, показана трансдукция клеток печени, сходная с трансдукцией, наблюдаемой для AAV, имеющих капсиды AAV8 или AAV9.
Пример 2
Исследование для оценки биораспределения и активности новых природных капсидных белков
[00141] Для оценки биораспределения и активности капсидов AAV, описанных в настоящем описании, получали AAV, содержащие капсиды, трансген субъединицы бета хориогонадотропина (cyno-CG-Beta) под контролем промотора ApoE-hAAT (AAV-ApoE-hAAT-Cyno-CG-Beta). Мышей C57BL/6J закупали из Jackson Laboratories. Дозу 2×1013 г.в./кг AAV-ApoE-hAAT-Cyno-CG-Beta инъецировали в хвостовую вену мышей в возрасте 8 недель. Это исследование проводили с использованием AAV, имеющих следующие капсидные белки: Bba-45, Bba-46, Bba-47, Bba-49, Bba-50 (совместно обозначенные как «новые капсиды») и AAV5, AAV8, AAV-Rh10 и AAV-anc80L65 (совместно обозначенные как «контрольные капсиды»). Контрольный носитель вводили без вектора AAV.
[00142] Через 5 недель после инъекции, экспрессию трансгена cyno-CG оценивали посредством измерения уровня в плазме белка bCG с использованием масс-спектрометрии. Как показано на фигуре 5, AAV, имеющие новые капсиды, экспрессировали трансген на уровне, сходном с экспрессией в AAV, имеющем капсид AAV5. Однако, экспрессия белка bCG в печени являлась увеличенной у мышей, подвергнутых инъекции AAV, имеющими новые капсиды, по сравнению с мышами, подвергнутыми инъекции AAV, имеющим капсид AAV5 (фиг. 6). Количество копий ДНК и РНК трансгена cyno-CG в печени мышей, подвергнутых инъекции AAV, имеющими новые капсиды, значимо не отличалось от количества у мышей, подвергнутых инъекции AAV, имеющим капсид AAV5 (фиг. 7A-7C). Данные для ДНК и РНК хорошо коррелировали с данными для белка bCG (см. фиг. 8A-8B).
[00143] Новые капсиды Bba-45 - Bba-50 не приводилли к значимо более высоким уровням трансдукции или транскрипции, по сравнению с контрольными капсидами (AAV5, AAV8, AAV-Rh10 и AAV-anc80L65). Однако, при сравнении всех новых капсидов, для Bba-49 достигали наивысших уровней транскрипции и трансдукции. Для капсида Bba-49 достигали приблизительно в 2 раза более высоких уровней транскриптов (РНК) по сравнению с капсидом AAV5, однако, это различие не являлось значимым (фиг.7B). Соотношения Bba-49 и AAV5 приведены в таблице 4:
Таблица 4
|
[00144] Экспрессию трансгена bCG в гепатоцитах оценивали с использованием иммуногистохимии. Для всех новых капсидов получали в результате более высокий процент гепатоцитов, экспрессирующих bCG, чем для капсида AAV5. Кроме того, трансдукции гепатоцитов AAV, имеющими новые капсиды, являлись сходными с контрольными капсидами, AAV8, AAV-Rh10 и AAV-anc80L65 (фиг. 9 и 10).
[00145] Получали AAV, содержащие капсид Bba-49, промотор ApoE-hAAT, трансген аланинглиоксалатаминотрансферазу (AGXT). Дозу 1E14 г.в./кг AAV-AGXT инъецировали в хвостовую вену самцов мышей -AGXT/-/-C57BL/6J в возрасте 3-4 недель. Трансдукцию гепатоцитов сравнивали с AAV, имеющим капсид AAV5, из различных источников. Экспрессию трансгена AGXT в гепатоцитах оценивали с использованием иммуногистохимии. Как показано на фигуре 11, капсид Bba-49 приводил к большему проценту гепатоцитов, экспрессирующих AGXT, чем тестированный капсид AAV5. AAV.Bba-49. AGXT трансдуцировал приблизительно 96% гепатоцитов.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Biomarin Pharmaceutical Inc.
<120> НОВЫЕ НАЦЕЛИВАЮЩИЕ НА ПЕЧЕНЬ АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ
<130> 30610/53120
<150> US 62/671265
<151> 2018-05-14
<160> 14
<170> PatentIn версии 3.5
<210> 1
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.45
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 1
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Arg Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Gln Arg Leu Ala Thr Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Ala Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Arg Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Thr Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 2
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.46
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 2
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Gln Arg Leu Ala Thr Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Cys Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Ala Ala Thr Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 3
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.47
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 3
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Gln Arg Leu Ala Thr Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Thr Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 4
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.48
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 4
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys Arg Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Ile Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Ala Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 5
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.49
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 5
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Gln Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Ile Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Gly Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 6
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.50
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 6
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Ser Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Arg Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asp Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Gln Arg Leu Ala Thr Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Arg Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Leu His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Thr Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Glu Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 7
<211> 742
<212> белок
<213> Papio
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<223> Bba.51
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (1)..(742)
<223> Капсидный белок VP1
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (138)..(742)
<223> Капсидный белок VP2
<220>
<221> НЕОПРЕДЕЛЕННЫЙ ПРИЗНАК
<222> (206)..(742)
<223> Капсидный белок VP3
<400> 7
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Glu Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ser Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Gln Arg Leu Ala Thr Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Ile Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Gly Val Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Leu Glu Lys Thr Pro Asn Arg Pro Thr Asn Pro Asp Ser Gly Lys
145 150 155 160
Ala Pro Ala Lys Lys Lys Gln Lys Asp Gly Glu Thr Ala Asp Ser Ala
165 170 175
Arg Arg Thr Leu Asp Phe Glu Asp Ser Gly Ala Gly Asp Gly Pro Pro
180 185 190
Glu Gly Ser Ser Ser Gly Glu Met Ser His Asp Ala Glu Met Arg Ala
195 200 205
Ala Pro Gly Gly Asn Ala Val Glu Ala Gly Gln Gly Ala Asp Gly Val
210 215 220
Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp Ser Glu Gly
225 230 235 240
Arg Val Thr Thr Thr Ser Thr Arg Thr Trp Val Leu Pro Thr Tyr Asn
245 250 255
Asn His Leu Tyr Leu Arg Ile Gly Thr Thr Ala Asn Ser Asn Thr Tyr
260 265 270
Asn Gly Phe Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His
275 280 285
Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Asn Trp
290 295 300
Gly Leu Arg Pro Lys Ser Met Arg Val Lys Ile Phe Asn Ile Gln Val
305 310 315 320
Lys Glu Val Thr Thr Ser Asn Gly Glu Thr Thr Val Ala Asn Asn Leu
325 330 335
Thr Ser Thr Val Gln Ile Phe Ala Asp Ser Thr Tyr Glu Leu Pro Tyr
340 345 350
Val Met Asp Ala Gly Gln Glu Gly Ser Leu Pro Pro Phe Pro Asn Asp
355 360 365
Val Phe Met Val Pro Gln Tyr Gly Tyr Cys Gly Val Val Thr Gly Glu
370 375 380
Asn Gln Asn Gln Thr Asp Arg Asn Ala Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Glu Ile Ser Tyr Gln
405 410 415
Phe Glu Lys Val Pro Phe His Ser Met Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Met Met Asn Pro Leu Leu Asp Gln Tyr Leu Trp His Leu Gln
435 440 445
Ser Thr Thr Thr Gly Asn Ser Leu Asn Gln Gly Thr Ala Thr Thr Thr
450 455 460
Tyr Gly Lys Ile Thr Thr Gly Asp Phe Ala Tyr Tyr Arg Lys Asn Trp
465 470 475 480
Leu Pro Gly Ala Cys Ile Lys Gln Gln Lys Phe Ser Lys Asn Ala Ser
485 490 495
Gln Asn Tyr Lys Ile Pro Ala Ser Gly Gly Asp Ala Leu Leu Lys Tyr
500 505 510
Asp Thr His Thr Thr Leu Asn Gly Arg Trp Ser Asn Met Ala Pro Gly
515 520 525
Pro Pro Met Ala Thr Ala Gly Ala Gly Asp Ser Asp Phe Ser Asn Ser
530 535 540
Gln Leu Ile Phe Ala Gly Pro Asn Gln Ser Gly Asn Thr Thr Thr Ser
545 550 555 560
Ser Asn Asn Leu Leu Phe Thr Ser Glu Glu Glu Ile Ala Thr Thr Asn
565 570 575
Pro Arg Asp Thr Asp Met Phe Gly Gln Ile Ala Asp Asn Asn Gln Asn
580 585 590
Ala Thr Thr Ala Pro His Ile Ala Asn Leu Asp Ala Met Gly Ile Val
595 600 605
Pro Gly Met Val Trp Gln Asn Arg Asp Ile Tyr Tyr Gln Gly Pro Ile
610 615 620
Trp Ala Lys Val Pro His Thr Asp Gly His Phe His Pro Ser Pro Leu
625 630 635 640
Met Gly Gly Phe Gly Leu Lys His Pro Pro Pro Gln Ile Phe Ile Lys
645 650 655
Asn Thr Pro Val Pro Ala Asn Pro Asn Thr Thr Phe Ser Ala Ala Arg
660 665 670
Ile Asn Ser Phe Leu Thr Gln Tyr Ser Thr Gly Gln Val Ala Val Gln
675 680 685
Ile Asp Trp Glu Ile Gln Lys Glu His Ser Lys Arg Trp Asn Pro Glu
690 695 700
Val Gln Phe Thr Ser Asn Tyr Gly Thr Gln Asn Ser Met Leu Trp Ala
705 710 715 720
Pro Asp Asn Ala Gly Asn Tyr His Glu Pro Arg Ala Ile Gly Ser Arg
725 730 735
Phe Leu Thr His His Leu
740
<210> 8
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.45
<400> 8
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcgaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttc 300
cagcagcgct tggcgaccga cacctctttt gggggcaacc tcggcaaggc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aagggcactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
agggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctaccacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttacctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 9
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.46
<400> 9
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcaaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttc 300
cagcagcgct tggcgaccga cacctctttt gggggcaacc tcggcaaggc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgacg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tgctttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggagca 1380
gctaccacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
atccccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 10
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.47
<400> 10
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcaaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttc 300
cagcagcgct tggcgaccga cacctctttt gggggcaacc tcggcaaggc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga cctcctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctaccacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg ggcagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 11
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.48
<400> 11
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcaaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttt 300
caggagcgtc ttcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccgc ttttccccgc gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctatcacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgccg ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 12
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba. 49
<400> 12
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcaaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttt 300
caggagcgtc ttcaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctatcacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag ccggcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 13
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.50
<400> 13
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aagcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cggcccaagg caaatcaaca acatcaagac 120
gacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttc 300
cagcagcgct tggcgaccga cacctctttt gggggcaacc tcggcaaggc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaggaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctctccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctaccacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcggggaaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tctgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<210> 14
<211> 2229
<212> ДНК
<213> Papio
<220>
<221> неопределенный признак
<223> Bba.51
<400> 14
atggctgctg acggttatct tccagattgg ctcgaggaca acctctctga aggcattcgc 60
gagtggtggg cgctgaaacc tggagcccca cagcccaagg caaatcaaca acatcaagac 120
aacgctcggg gtcttgtgct tccgggttac aaatacttgg gacccggtaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa ggcctacgac 240
cagcagctca agtcgggaga caacccgtac ctcaagtaca accacgcgga cgccgagttc 300
cagcagcgct tggcgaccga cacctctttt gggggcaacc tcggcaaggc agtcttccag 360
gccaaaaaga ggattctcga gcctctgggt ctggttgaag agggcgttaa aacggctcct 420
ggaaagaaac gcccattaga aaagactcca aatcggccga ccaacccgga ctctgggaag 480
gccccggcca agaaaaagca aaaagacggc gagacagccg actctgctag aaggacactc 540
gactttgaag actctggagc aggagacgga ccccctgagg gatcatcttc cggagaaatg 600
tctcatgatg ctgagatgcg tgcggcgcca ggcggaaatg ctgtcgaggc gggacaaggt 660
gccgatggag tgggtaatgc ctccggtgat tggcattgcg attccacctg gtcagagggc 720
cgagtcacca ccaccagcac ccgaacctgg gtcctgccca cctacaacaa ccacctgtac 780
ctgcgaatcg gaacaacggc caacagcaac acctacaatg gattctccac cccctgggga 840
tactttgact ttaaccgctt ccactgccac ttttccccac gcgactggca gcgactcatc 900
aacaacaact ggggactcag gccgaaatcg atgcgtgtta aaatcttcaa catccaggtc 960
aaggaggtca ctacgtcaaa cggcgagact acggtcgcta ataaccttac cagcacggtt 1020
cagatctttg cggattcaac gtatgaactc ccatacgtga tggacgccgg tcaggagggg 1080
agccttcctc cgttccccaa cgacgtgttt atggttcccc aatacgggta ctgcggagtc 1140
gtcactggag aaaaccagaa ccaaacagac agaaatgcct tttactgtct ggagtacttt 1200
ccatcccaaa tgctaagaac tggcaacaac tttgaaatca gttaccaatt tgaaaaagtt 1260
cctttccatt caatgtacgc gcacagccag agcctggaca gaatgatgaa tcctttgctg 1320
gatcagtacc tgtggcatct gcaatcgacc actaccggaa attcccttaa tcaaggaaca 1380
gctaccacca cgtacgggaa aattaccact ggggactttg cctactacag gaaaaactgg 1440
ttgcctggag cctgcattaa acaacaaaaa ttttcaaaga atgccagtca aaactacaag 1500
attcccgcca gcgggggaga cgccctttta aagtatgaca cgcataccac tttaaatggg 1560
cgatggagta acatggctcc tggtcctcca atggccaccg caggtgccgg ggactcggat 1620
tttagcaaca gccagctgat ctttgccgga cccaatcaga gcggtaacac gaccacgtct 1680
tcaaacaatt tgttgtttac ctcagaagag gagattgcca caacaaaccc acgagacacg 1740
gacatgtttg gacagattgc agataataat caaaatgcca ccaccgcccc tcacatcgct 1800
aacctggacg ctatgggaat tgttcccgga atggtctggc aaaacagaga catctactac 1860
cagggcccta tttgggccaa ggtccctcac acggacggac actttcaccc ttcgccgctg 1920
atgggaggat ttggactgaa acacccgcct ccgcagattt tcatcaaaaa cacccccgta 1980
cccgccaatc ccaatactac ctttagcgct gcaaggatca attctttttt gacgcagtac 2040
agcaccggac aagtcgccgt tcagatcgac tgggaaattc agaaggagca ctccaaacgc 2100
tggaatcccg aagtccaatt tacttcaaac tacggcactc aaaattctat gctgtgggct 2160
cccgacaacg ccggcaacta ccacgaaccc cgggctattg ggtcccgttt cctcacccac 2220
cacttgtaa 2229
<---