Результат интеллектуальной деятельности: НОВЫЙ ВАРИАНТ БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ L-ВАЛИНА С ЕГО ПРИМЕНЕНИЕМ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В данной заявке заявлен приоритет корейской патентной заявки №10-2021-0011008, поданной 26 января 2021 года, полное раскрытие которой включено в данное описание изобретения как часть настоящего раскрытия.
Настоящее раскрытие относится к новому варианту белка, к штамму Corynebacterium glutamicum, содержащему данный вариант, и к способу продуцирования L-валина с использованием данного штамма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Проводят различные исследования для разработки высокоэффективных микроорганизмов и технологий ферментационных способов для производства L-аминокислот и других полезных веществ. Например, главным образом, используют специфичный подход в отношении целевого вещества, при котором увеличивают экспрессию гена, кодирующего фермент, участвующий в биосинтезе L-валина, или при котором удаляют гены, не являющиеся необходимыми для биосинтеза (US 8465962 В2).
Однако все еще необходимо проводить исследования для эффективного увеличения способности к продуцированию L-валина, так как возрастает спрос на L-валин.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Целью настоящего раскрытия является предоставление варианта белка, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой серии (Ser, S), который представляет собой аминокислоту, соответствующую положению 109 в аминокислотной последовательности SEQ ID NO: 3, заменен фенилаланином (Phe, F).
Другой целью настоящего раскрытия является предоставление полинуклеотида, кодирующего вариант по настоящему изобретению.
Еще одной целью настоящего изобретения является предоставление штамма Corynebacterium glutamicum, который содержит вариант по настоящему изобретению, или полинуклеотид, кодирующий данный вариант, и имеет способность к продуцированию L-валина.
Еще одной целью настоящего изобретения является предоставление способа продуцирования L-валина, который включает культивирование в среде штамма Corynebacterium glutamicum, содержащего вариант по настоящему изобретению, или полинуклеотид, кодирующий данный вариант, и имеет способность к продуцированию L-валина в среде.
Техническое решение
Настоящее изобретение будет подробно описано следующим образом. Вместе с тем, каждое из описаний и воплощений, раскрытых в настоящем описании изобретения, можно применять к другим описаниям и воплощениям. Другими словами, все комбинации разных элементов, раскрытых в настоящем описании изобретения, входят в объем настоящего изобретения. Кроме того, нельзя считать, что объем настоящего изобретения ограничен конкретным описанием, приведенным ниже. Кроме того, во всем настоящем описании изобретения приведены ссылки на целый ряд статей и патентных документов и указаны цитаты из них. Вся полнота содержания, раскрытого в процитированных статьях и патентных документах, включена в настоящее описание изобретения посредством ссылки для того, чтобы более ясно описать уровень области техники, к которой принадлежит настоящее изобретение, и содержание настоящего изобретения.
Согласно одному аспекту настоящего изобретения предложен вариант белка, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1, в которой серии (Ser, S), представляющий собой аминокислоту, соответствующую положению 109 в SEQ ID NO: 3, заменен фенилаланином (Phe, F).
Вариант по настоящему изобретению может иметь, содержать или по существу состоять из аминокислотной последовательности, представленной SEQ ID NO: 1.
В варианте по настоящему изобретению аминокислота, соответствующая положению 109 на основе аминокислотной последовательности SEQ ID NO: 3 в аминокислотной последовательности, представленной SEQ ID NO: 1, представляет собой фенилаланин, и данный вариант может содержать аминокислотную последовательность, имеющую по меньшей мере 70%-ную, 75%-ную, 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, 99%-ную, 99,5%-ную, 99,7%-ную или 99,9%-ную или более гомологию или идентичность с аминокислотной последовательностью, представленной SEQ ID NO: 1. Очевидно то, что варианты, имеющие аминокислотные последовательности, в которых некоторые последовательности удалены, модифицированы, заменены, консервативно заменены или добавлены, также включены в объем настоящего изобретения, при условии, что эти аминокислотные последовательности имеют такую гомологию или идентичность и демонстрируют эффективность, соответствующую эффективности варианта по настоящему изобретению.
Его примеры включают варианты, имеющие присоединение к или делецию последовательности, которые не изменяют функцию варианта по настоящему изобретению, на N-конце, С-конце аминокислотной последовательности и/или внутри данной аминокислотной последовательности, встречающуюся в природе мутацию, молчащую мутацию или консервативную замену.
Термин «консервативная замена» означает замену одной аминокислоты другой аминокислотой, имеющей аналогичные структурные и/или химические свойства. Такая аминокислотная замена обычно может произойти на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Обычно консервативная замена может едва влиять или не влиять на активность белков или полипептидов.
В настоящем раскрытии термин «вариант» относится к полипептиду, который имеет аминокислотную последовательность, отличающуюся от аминокислотной последовательности данного варианта перед модификацией в результате консервативной замены и/или модификации одной или более чем одной аминокислоты, но сохраняет функции или свойства. Такой вариант обычно может быть идентифицирован посредством модифицирования одной или более чем одной аминокислоты аминокислотной последовательности данного полипептида и оценки свойств модифицированного полипептида. Другими словами, способность варианта может быть увеличена, оставаться неизменной или может быть снижена по сравнению со способностью полипептида перед изменением. Некоторые варианты могут включать варианты, в которых одна или более чем одна часть, такая как N-концевая лидерная последовательность или транс мембранный домен, были удалены. Другие варианты могут включать варианты, в которых из зрелого белка была удалена часть N- и/или С-конца. Термин «вариант» можно использовать взаимозаменяемо с такими терминами, как модификация, модифицированный полипептид, модифицированный белок, мутант, мутеин и дивергент, и он не ограничен ими, при условии, что он представляет собой термин, используемый со значением вариации. Для целей настоящего изобретения вариант может представлять собой полипептид, содержащий аминокислотную последовательность, представленной SEQ ID NO: 1, в которой серии, представляющий собой аминокислоту, соответствующую положению 109 в SEQ ID NO: 3, заменен фенилаланином.
Данный вариант может содержать делеции или присоединения аминокислот, которые имеют минимальное влияние на свойства и вторичную структуру полипептида. Например, с N-концом варианта может быть конъюгирована сигнальная (или лидерная) последовательность, которая котрансляционно или посттрансляционно участвует в транслокации белка. Вариант может быть конъюгирован с другими последовательностями или линкерами таким образом, чтобы его идентифицировать, очистить или синтезировать.
В настоящем раскрытии термин «гомология» или «идентичность» означает степень сходства между двумя данными аминокислотными последовательностями или последовательностями оснований и может быть выражена в виде процента. Термины «гомология» и «идентичность» часто могут быть использованы взаимозаменяемо.
Гомологию или идентичность последовательности консервативного полинуклеотида или полипептида определяют посредством стандартных алгоритмов выравнивания, и можно совместно использовать штраф за пропуск по умолчанию, установленный применяемой программой. По существу, гомологичные или идентичные последовательности обычно способны к гибридизации со всей или с частью последовательности в условиях умеренной или высокой жесткости. Очевидно, что гибридизация также включает гибридизацию полинуклеотида с полинуклеотидом, содержащим кодон общего типа или кодон с учетом вырожденности кодона.
Имеют ли любые две последовательности полинуклеотида или полипептида гомологию, сходство или идентичность, можно определить с использованием известных компьютерных алгоритмов, таких как программа «FASTA», например, с использованием параметров по умолчанию как в Pearson et al., (1988) Proc. Natl. Acad. Sci. USA 85:2444. В качестве альтернативы, гомология, сходство или идентичность могут быть определены с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), как осуществляется в программе Нидлмана пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздняя) (включая программный пакет GCG (Devereux, J., et al., Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F., et al., J MOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994; и CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, для определения гомологии, сходства или идентичности можно использовать BLAST Национального центра биотехнологической информации или ClustalW.
Гомологию, сходство или идентичность полинуклеотидов или полипептидов можно определять путем сравнения информации о последовательности с использованием, например, компьютерной программы GAP, как, например, в Needleman et al. (1970), J Mol Biol. 48:443, как анонсировано, например, в Smith and Waterman, Adv. Appl. Math (1981) 2:482. В итоге, результат программы GAP может быть определен как значение, полученное делением числа аналогичных выровненных символов (а именно: нуклеотидов или аминокислот) на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию программы GAP могут включать (1) матрицу двоичных сравнений (включающую значения 1 для идентичности и 0 для неидентичности) и матрицу взвешенных сравнений по Gribskov et al., (1986) Nucl. Acids Res. 14:6745 (или матрицу замен EDNAFULL (EMBOSS версии NCBI NUC4.4)), как раскрыто в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979); (2) штраф 3,0 для каждого пропуска и дополнительный штраф 0,10 для каждого символа в каждом пропуске (или штраф 10 за открытие пропуска, штраф 0,5 за удлинение пропуска); и (3) отсутствие штрафа за концевые пропуски.
В качестве примера по настоящему изобретению, вариант по настоящему изобретению может демонстрировать активность, так чтобы иметь повышенную L-валин-продуцирующую способность по сравнению с полипептидом дикого типа.
В настоящем раскрытии термин «соответствующий» относится к аминокислотным остаткам в положениях, перечисленных в полипептиде, или к аминокислотным остаткам, которые являются аналогичными, идентичными или гомологичными остаткам, перечисленным в данном полипептиде. Идентификация аминокислоты в соответствующем положении может определяться конкретной аминокислотой в последовательности, которая относится к конкретной последовательности. При использовании здесь, термин «соответствующая область» обычно относится к аналогичному или соответствующему положению в родственном белке или эталонном белке.
Например, произвольную аминокислотную последовательность выравнивают с SEQ ID NO: 3, и, на основе этого, каждый аминокислотный остаток данной аминокислотной последовательности может быть пронумерован по отношению к аминокислотному остатку SEQ ID NO: 3 и числовому положению соответствующего аминокислотного остатка. Например, алгоритм выравнивания последовательности, как описано в настоящем описании изобретения, может определять положение аминокислоты или положение, в котором происходит модификация, такая как замена, вставка или делеция, посредством сравнения с положением в запрашиваемой последовательности (также именуемой «эталонная последовательность»).
Для таких выравниваний, например, можно использовать алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), программу Нидлмана пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277) и тому подобные, но программа и алгоритм не ограничиваются ими, и подходящим образом можно использовать программу выравнивания последовательностей, алгоритм попарного сравнения последовательностей и тому подобное, известные в данной области.
Другим аспектом настоящего раскрытия является предоставление полинуклеотида, кодирующего вариант по настоящему изобретению.
В настоящем раскрытии термин «полинуклеотид» представляет собой нить ДНК или РНК, имеющую определенную или более длину, в качестве полимера нуклеотидов, в котором нуклеотидные мономеры соединены в длинную цепь ковалентными связями, и, более конкретно, означает фрагмент полинуклеотида, кодирующий данный вариант.
Полинуклеотид, кодирующий вариант по настоящему изобретению, может содержать последовательность оснований, кодирующую аминокислотную последовательность, представленную SEQ ID NO: 1. В качестве примера настоящего изобретения полинуклеотид по настоящему изобретению может иметь или содержать последовательность SEQ ID NO: 2. Полинуклеотид по настоящему изобретению может состоять или по существу состоит из последовательности SEQ ID NO: 2.
В другом воплощении в полинуклеотиде по настоящему изобретению основание, соответствующее положению 326 на основе последовательности нуклеиновой кислоты SEQ ID NO: 4, в последовательности нуклеиновой кислоты, представленной SEQ ID NO: 2, представляет собой T, и данный полинуклеотид может содержать последовательность нуклеиновой кислоты, имеющую по меньшей мере 70%-ную, 75%-ную, 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, 99%-ную, 99,5%-ную, 99,7%-ную или 99,9%-ную или более гомологию или идентичность с последовательностью нуклеиновой кислоты, представленной SEQ ID NO: 2. Очевидно, что полинуклеотиды, имеющие аминокислотные последовательности, в которых некоторые последовательности удалены, модифицированы, заменены, консервативно заменены или добавлены, также включены в объем настоящего изобретения, при условии, что данные последовательности нуклеиновой кислоты имеют такую гомологию или идентичность и кодируют полипептид или белок, демонстрирующий эффективность, соответствующую эффективности варианта по настоящему изобретению.
В полинуклеотиде по настоящему изобретению могут быть сделаны разные модификации в кодирующей области при условии, что аминокислотная последовательность варианта по настоящему изобретению не изменяется с учетом вырожденности кодонов или предпочтительных кодонов в организмах, которые предназначены для экспрессии варианта по настоящему изобретению. В частности, полинуклеотид по настоящему изобретению имеет или содержит последовательность оснований, имеющую 70%-ную или более, 75%-ную или более, 80%-ную или более, 85%-ную или более, 90%-ную или более, 95%-ную или более, 96%-ную или более, 97%-ную или более, 98%-ную или более, но менее чем 100%-ную гомологию или идентичность с последовательностью SEQ ID NO: 2, или может состоять или по существу состоит из последовательности оснований, имеющей 70%-ную или более, 75%-ную или более, 80%-ную или более, 85%-ную или более, 90%-ную или более, 95%-ную или более, 96%-ную или более, 97%-ную или более, 98%-ную или более, но менее чем 100%-ную гомологию или идентичность с последовательностью SEQ ID NO: 2, без ограничения ими. Здесь, в последовательности, имеющей гомологию или идентичность, кодон, кодирующий аминокислоту, соответствующую положению 109 в SEQ ID NO: 1, может представлять собой один из кодонов, кодирующих фенилаланин.
Полинуклеотид по настоящему изобретению может содержать зонд, который может быть получен из известной последовательности гена, например, последовательности без ограничения, при условии, что она представляет собой последовательность, которая может гибридизоваться с комплементарной последовательностью всей или частью последовательности полинуклеотида по настоящему изобретению в жестких условиях. «Жесткие условия» означают условия, которые обеспечивают специфичную гибридизацию между полинуклеотидами. Данные условия конкретно описаны в документах (см. J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York, 9.50 9.51, 11.7 11.8). Их примеры включают условия, в которых полинуклеотиды, имеющие более высокую гомологию или идентичность, а именно полинуклеотиды, имеющие 70%-ную или более, 75%-ную или более, 80%-ную или более, 85%-ную или более, 90%-ную или более, 95%-ную или более, 96%-ную или более, 97%-ную или более, 98%-ную или более, или 99%-ную или более гомологию или идентичность, гибридизуются друг с другом, тогда как полинуклеотиды, имеющие меньшую гомологию или идентичность, не гибридизуются друг с другом, или условия, в которых промывка осуществляется один раз, в частности от двух до трех раз с концентрацией соли и температурой, эквивалентных 60°С, 1×SSC (раствор цитрата и хлорида натрия), 0,1% SDS (додецилсульфат натрия), в частности, при 60°С, 0,1×SSC, 0,1% SDS, более конкретно, при 68°С, 0,1×SSC, 0,1% SDS, которые представляют собой условия промывки для обычной гибридизации по Саузерну.
Для гибридизации требуется, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя и допускаются несоответствия между основаниями, в зависимости от жесткости гибридизации. Термин «комплементарный» используется для описания отношения между нуклеотидными основаниями, способными гибридизоваться друг с другом. Например, в отношении ДНК, аденин является комплементарным тимину, а цитозин является комплементарным гуанину. Следовательно, полинуклеотид по настоящему изобретению также может содержать по существу аналогичные последовательности нуклеиновой кислоты, а также фрагменты выделенной нуклеиновой кислоты, которые являются комплементарными всей последовательности.
В частности, полинуклеотид, имеющий гомологию или идентичность с полинуклеотидом по настоящему изобретению, может быть выявлен с использованием условий гибридизации, включая стадию гибридизации при значении Tm 55°С и вышеописанные условия. Значение Tm может составлять 60°С, 63°С или 65°С, но не ограничивается ими, и его могут подходящим образом корректировать специалисты в данной области согласно цели.
Подходящая жесткость для гибридизации полинуклеотида зависит от длины и степени комплементарности данного полинуклеотида, и переменные хорошо известны в данной области (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989).
Другим аспектом настоящего раскрытия является предложение вектора, содержащего полинуклеотид по настоящему изобретению. Данный вектор может представлять собой экспрессионный вектор для осуществления экспрессии полинуклеотида в клетке-хозяине, но не ограничивается им.
Вектор по настоящему изобретению может включать ДНК-конструкцию, содержащую последовательность полинуклеотида, кодирующую интересующий полипептид, связанную функциональным образом с подходящей регуляторной областью экспрессии (или регуляторной последовательностью экспрессии) так, что интересующий полипептид может экспрессироваться в подходящем хозяине. Регуляторная область экспрессии может содержать промотор, способный инициировать транскрипцию, любую последовательность оператора для осуществления регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и последовательность, регулирующую терминацию транскрипции и трансляции. Данный вектор можно трансформировать в подходящую клетку-хозяина, и затем он может реплицироваться или функционировать независимо от генома хозяина, или может сам интегрироваться в геном.
Вектор, используемый в настоящем изобретении, конкретно не ограничен, но можно использовать любой вектор, известный в данной области. Примеры обычно используемых векторов включают природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и тому подобные, и в качестве плазмидного вектора можно использовать систему pDZ, систему pBR, систему pUC, систему pBluescript II, систему pGEM, систему pTZ, систему pCL, систему рЕТ и тому подобные. В частности, можно использовать векторы pDZ, pDC, pDCM2, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC, и тому подобные.
Например, полинуклеотид, кодирующий интересующий полипептид, можно вставлять в хромосому посредством вектора для внутриклеточной хромосомной вставки. Вставку данного полинуклеотида в хромосому можно осуществлять любым способом, известным в данной области, например посредством гомологичной рекомбинации, но без ограничения ей. Данный вектор может дополнительно содержать селективный маркер для подтверждения вставки в хромосому. Селективный маркер служит для отбора клеток, трансформированных векторами, то есть для подтверждения вставки интересующей молекулы нуклеиновой кислоты, и можно использовать маркеры, которые придают селектируемые фенотипы, такие как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим агентам или экспрессия поверхностных полипептидов. В среде, обработанной селективным агентом, выживают или демонстрируют другие фенотипические признаки только клетки, экспрессирующие селективный маркер, и, таким образом, могут быть отобраны трансформированные клетки.
В настоящем раскрытии термин «трансформация» означает то, что вектор, содержащий полинуклеотид, кодирующий целевой полипептид, вводят в клетку-хозяина или микроорганизм таким образом, что полипептид, кодируемый данным полинуклеотидом, может экспрессироваться в клетке-хозяине. Трансформированный полинуклеотид может локализоваться посредством вставки в хромосому клетки-хозяина или локализоваться вне хромосомы, при условии, что он может экспрессироваться в данной клетке-хозяине. Данный полинуклеотид содержит ДНК и/или РНК, кодирующую интересующий полипептид. Данный полинуклеотид может быть введен в любой форме, при условии, что он может быть введен в клетку-хозяина и может экспрессироваться. Например, данный полинуклеотид может быть введен в клетку-хозяина в виде экспрессионной кассеты, которая представляет собой генетическую конструкцию, содержащую все элементы, необходимые для автономной экспрессии. Экспрессионная кассета обычно может содержать промотор, связанный функциональным образом с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Экспрессионная кассета может находиться в виде экспрессионного вектора, способного к автономной репликации. Полинуклеотид может быть введен в клетку-хозяина сам по себе и связан функциональным образом с последовательностью, требующейся для экспрессии в клетке-хозяине, но не ограничен эти.
В приведенном выше описании термин «связанный функциональным образом» означает, что последовательность полинуклеотида функционально связана с последовательностью промотора, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего интересующий вариант по настоящему изобретению.
Еще одним аспектом настоящего раскрытия является предложение штамма Corynebacterium glutamicum, который содержит вариант по настоящему изобретению или полинуклеотид по настоящему изобретению.
Штамм по настоящему изобретению может содержать модифицированный полипептид по настоящему изобретению, полинуклеотид, кодирующий данный полипептид, или вектор, содержащий полинуклеотид по настоящему изобретению.
В настоящем раскрытии «штамм (или микроорганизм)» включает все микроорганизмы дикого типа или естественно или искусственно генетически модифицированные микроорганизмы, и он может представлять собой микроорганизм, в котором ослаблен или усилен конкретный механизм из-за вставки внешнего гена или усиления активности, или инактивации эндогенного гена, и он может представлять собой микроорганизм, содержащий генетическую модификацию для продуцирования интересующего полипептида, белка или продукта.
Штамм по настоящему изобретению может представлять собой штамм, содержащий любой один или более чем один вариант по настоящему изобретению, полинуклеотид по настоящему изобретению или вектор, содержащий полинуклеотид по настоящему изобретению; штамм, модифицированный для экспрессии варианта по настоящему изобретению или полинуклеотида по настоящему изобретению; штамм (например рекомбинантный штамм), экспрессирующий вариант по настоящему изобретению или полинуклеотид по настоящему изобретению; или штамм (например рекомбинантный штамм), демонстрирующий активность варианта по настоящему изобретению, но не ограничивается ими.
Штамм по настоящему изобретению может представлять собой штамм, обладающий способностью продуцировать L-валин.
Штамм по настоящему изобретению может представлять собой микроорганизм, обладающий в природе способностью продуцировать L-валин, или микроорганизм, в котором вариант по настоящему изобретению или полинуклеотид, кодирующий данный вариант (или вектор, содержащий данный полинуклеотид), введен в родительский штамм, который не имеет способности продуцировать L-валин, и/или в котором способность к продуцированию L-валина придается родительскому штамму, но не ограничивается ими.
Например, штамм по настоящему изобретению представляет собой клетку или микроорганизм, который трансформирован вектором, содержащим полинуклеотид по настоящему изобретению, или полинуклеотидом, кодирующим вариант по настоящему изобретению, и экспрессирует вариант по настоящему изобретению. В целях настоящего раскрытия штамм по настоящему изобретению может включать все микроорганизмы, которые содержат вариант по настоящему изобретению и могут продуцировать L-валин. Например, штамм по настоящему изобретению может представлять собой рекомбинантный штамм, в котором полинуклеотид, кодирующий вариант по настоящему изобретению, введен в природный микроорганизм дикого типа или микроорганизм, продуцирующий L-валин, для того чтобы, таким образом, экспрессировать вариант белка и иметь повышенную способность к продуцированию L-валина. Рекомбинантный штамм, имеющий повышенную способность к продуцированию L-валина, может представлять собой микроорганизм, имеющий повышенную способность к продуцированию L-валина по сравнению с природным микроорганизмом дикого типа или с немодифицированным микроорганизмом (а именно микроорганизмом, экспрессирующим белок дикого типа (SEQ ID NO: 3) или микроорганизм, который не экспрессирует модифицированный (SEQ ID NO: 1) белок), но не ограничивается ими. Например, не модифицированный микроорганизм, который представляет собой целевой штамм для сравнения увеличения способности к продуцированию L-валина, может представлять собой штамм АТСС14067 и/или штамм Corynebaterium glutamicum CA08-0072 (KCCM11201P), но не ограничивается ими.
Например, рекомбинантный штамм, имеющий повышенную способность к продуцированию, может иметь способность к продуцированию L-валина, повышенную примерно на 1% или более, примерно на 2,5% или более, примерно на 5% или более, примерно на 6% или более, примерно на 7% или более, примерно на 8% или более, примерно на 9% или более, примерно на 10% или более, примерно на 10,5% или более, примерно на 11% или более, примерно на 11,5% или более, примерно на 12% или более, примерно на 12,5% или более, примерно на 13% или более, примерно на 13,5% или более, примерно на 14% или более, примерно на 14,5% или более, примерно на 15% или более, примерно на 15,5% или более, примерно на 16% или более, примерно на 16,5% или более, примерно на 17% или более, примерно на 17,5% или более, примерно на 18% или более, примерно на 18,5% или более, примерно на 19% или более, примерно на 19,5% или более, примерно на 20% или более, примерно на 20,5% или более, примерно на 21% или более, примерно на 21,5% или более, примерно на 22% или более, примерно на 22,5% или более, примерно на 23% или более, примерно на 23,5% или более (верхняя граница конкретно не ограничена и может составлять, например, примерно 200% или менее, примерно 150% или менее, примерно 100% или менее, примерно 50% или менее, примерно 45% или менее, примерно 40% или менее, или примерно 35% или менее, примерно 30% или менее, или примерно 25% или менее) по сравнению со способностью к продуцированию L-валина родительского штамма до изменения или с не модифицированным микроорганизмом, но повышенное количество не ограничивается этим до тех пор, пока способность к продуцированию имеет повышенную величину + значения по сравнению со способностью к продуцированию родительского штамма до изменения или не модифицированного микроорганизма. В другом примере рекомбинантный штамм, имеющий повышенную способность к продуцированию, может иметь способность к продуцированию L-валина, увеличенную примерно в 1,1 раза или более, примерно в 1,12 раза или более, примерно в 1,13 раза или более, примерно в 1,15 раза или более, примерно в 1,16 раза или более, примерно в 1,17 раза или более, примерно в 1,18 раза или более, примерно в 1,19 раза или более, примерно в 1,2 раза или более, примерно в 1,21 раза или более, примерно в 1,22 раза или более, примерно в 1,23 раза или более (верхняя граница конкретно не ограничена и может, например, составлять примерно в 10 раз или менее, примерно в 5 раз или менее, примерно в 3 раза или менее, или примерно в 2 раза или менее) по сравнению со способностью к продуцированию L-валина родительского штамма перед изменением или с не модифицированным микроорганизмом, но показатель увеличения не ограничен этим.
Более конкретно, рекомбинантный штамм, имеющий повышенную способность к продуцированию, может иметь способность к продуцированию L-валина, повышенную примерно на 25,0% (или примерно в 1,25 раза) по сравнению со способностью к продуцированию L-валина родительского штамма перед изменением или с немодифицированным микроорганизмом, но показатель увеличения не ограничивается этим. Термин «примерно» представляет собой интервал, включающий все из плюс/минус 0,5; плюс/минус 0,4; плюс/минус 0,3; плюс/минус 0,2; плюс/минус 0,1 и тому подобного, и включает все значения в интервале, равные или аналогичные значению после термина «примерно», но не ограничивается ими.
В настоящем раскрытии «немодифицированный микроорганизм» не исключает штаммы, содержащие мутацию, которая может случаться у микроорганизмов в природе, и может представлять собой штамм дикого типа или сам природный штамм, или может представлять собой штамм перед изменением признака посредством генетической вариации из-за природных или искусственных факторов. Например, немодифицированный микроорганизм может представлять собой штамм, в который не вводят или еще не был введен вариант белка, описанный в настоящем описании изобретения. Термин «немодифицированный микроорганизм» можно использовать взаимозаменяемо с терминами «штамм перед модификацией», «микроорганизм перед модификацией», «неизмененный штамм», «немодифицированный штамм», «неизмененный микроорганизм» или «эталонный микроорганизм».
В другом примере настоящего раскрытия микроорганизм по настоящему изобретению может представлять собой Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens.
В настоящем раскрытии «ослабление» полипептида включает оба случая, когда активность снижена по сравнению с эндогенной активностью или отсутствует. Термин «ослабление» можно использовать взаимозаменяемо с такими терминами, как инактивация, недостаточность, понижающая регуляция, снижение, уменьшение и аттенуация.
Ослабление также может включать случай, когда активность самого полипептида снижена или устранена по сравнению с активностью полипептида, которым исходно обладал микроорганизм, посредством изменения полинуклеотида, кодирующего данный полипептид, и тому подобного, случай, где общий уровень активности и/или концентрация (уровень экспрессии) полипептида в клетке ниже по сравнению с уровнем активности или концентрацией природного штамма посредством ингибирования экспрессии гена полинуклеотида, кодирующего полипептид, или ингибирования трансляции в полипептид, случай, когда полинуклеотид не экспрессируется совсем, и/или случай, когда активность полипептида не проявляется даже при экспрессии полинуклеотида. Термин «эндогенная активность» означает активность конкретного полипептида, которой исходно обладал родительский штамм перед изменением признака, или микроорганизм дикого типа, или немодифицированный микроорганизм при изменении признака генетической вариацией из-за природных или искусственных факторов. Фразу «эндогенная активность» можно использовать взаимозаменяемо с фразой «активность перед модификацией». Тот факт, что активность полипептида является «инактивированной, недостаточной, пониженной, подвергнувшейся понижающей регуляции, сниженной или ослабленной» по сравнению с эндогенной активностью, означает, что активность полипептида снижена по сравнению с активностью конкретного полипептида, которой исходно обладал родительский штамм перед изменением признака, или микроорганизм дикого типа, или немодифицированный микроорганизм.
Такое ослабление активности полипептида можно осуществлять любым способом, известным в данной области, но данный способ не ограничивается ими, и ослабления можно достичь применением разных способов, хорошо известных в данной области (например, Nakashima N. et al., Bacterial cellular engineering by genome editing and gene silencing. Int J Mol Sci. 2014; 15(2):2773-2793, Sambrook et al., Molecular Cloning 2012, и тому подобные).
В частности, ослабление активности полипептида в настоящем раскрытии может представлять собой:
1) делецию всего или части гена, кодирующего полипептид;
2) модификацию регуляторной области экспрессии (или регуляторной последовательности экспрессии) для уменьшения экспрессии гена, кодирующего полипептид;
3) модификацию аминокислотной последовательности, составляющей полипептид, для устранения или ослабления активности полипептида (например, делеция/замена/добавление одной или более чем одной аминокислоты в аминокислотной последовательности);
4) модификацию последовательности гена, кодирующей полипептид, для устранения или ослабления активности данного полипептида (например, делеция/замена/добавление одного или более чем одного основания нуклеиновой кислоты в последовательности оснований нуклеиновой кислоты гена полипептида для кодирования полипептида, который был модифицирован для устранения или ослабления активности данного полипептида);
5) модификацию инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей область 5'-UTR (5'-нетранслируемая область);
6) введение антисмыслового олигонуклеотида (например антисмысловой РНК), который комплементарно связывается с транскриптом гена, кодирующего полипептид;
7) добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно гена, кодирующего полипептид, для того, чтобы образовать вторичную структуру, к которой не может присоединяться рибосома;
8) добавление промотора, подлежащего транскрипции в противоположном направлении относительно 3'-конца открытой рамки считывания (ORF) последовательности гена, кодирующего полипептид (инженерия обратной транскрипции, RTE); или
9) комбинацию двух или более чем двух, выбранных из (1)-(8), но конкретно не ограничивается ими.
Например:
1) Делеция части или всего гена, кодирующего полипептид, может представлять собой удаление всего полинуклеотида, кодирующего интересующий эндогенный полипептид в хромосоме, или замена полинуклеотидом, в котором некоторые нуклеотиды делетированы, или замена маркерным геном.
2) Модификация регуляторной области экспрессии (или регуляторной последовательности экспрессии) может представлять собой делецию, вставку, неконсервативную или консервативную замену, или появление изменения в регуляторной области экспрессии (или регуляторной последовательности экспрессии) из-за их комбинации, или замена последовательностью, демонстрирующей более слабую активность. Регуляторная область экспрессии содержит промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность, регулирующую терминацию транскрипции и трансляции, но не ограничивается ими.
3) Модификация инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR область, может представлять собой, например, замену последовательностью оснований, кодирующей другой инициирующий кодон, имеющий меньшую скорость экспрессии полипептида по сравнению с эндогенным инициирующим кодоном, но не ограничивается этим.
4) и 5) Модификация аминокислотной последовательности или последовательности полинуклеотида может представлять собой делецию, вставку или неконсервативную или консервативную замену аминокислотной последовательности полипептида или последовательности полинуклеотида, кодирующей данный полипептид, или появление изменения в последовательности из-за их комбинации, или замену аминокислотной последовательностью или последовательностью полинуклеотида, модифицированной так, чтобы демонстрировать более слабую активность, или аминокислотной последовательностью, или последовательностью полинуклеотида, модифицированной так, чтобы быть неактивной, таким образом, что активность данного полипептида ослабевает, но не ограничивается ими. Например, экспрессию гена можно ингибировать или ослаблять посредством введения изменения в последовательность полинуклеотида и образования терминирующего кодона, но модификация не ограничивается ей.
6) Для введения антисмыслового олигонуклеотида (например антисмысловой РНК), который комплементарно связывается с транскриптом гена, кодирующего полипептид, можно сделать ссылку на документы, например, Weintraub, H. et al., Antisense-RNA as a molecular tool for genetic analysis, Reviews-Trends in Genetics, Vol. 1(1) 1986.
7) Добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно гена, кодирующего полипептид, для того, чтобы образовать вторичную структуру, к которой не может присоединиться рибосома, для того, чтобы сделать невозможной трансляцию мРНК или для замедления скорости трансляции мРНК.
8) Добавление промотора, подлежащего транскрипции в противоположном направлении к 3'-концу открытой рамки считывания (ORF) последовательности гена, кодирующего полипептид (инженерия обратной транскрипции, RTE), может служить для ослабления активности посредством получения антисмыслового нуклеотида, комплементарного транскрипту гена, кодирующего полипептид.
В настоящем описании изобретения термин «усиление» активности полипептида означает, что активность полипептида увеличивается по сравнению с эндогенной активностью. Термин «усиление» можно использовать взаимозаменяемо с такими терминами, как активация, повышающая регуляция, сверхэкспрессия и увеличение. Здесь активация, усиление, повышающая регуляция, сверхэкспрессия и увеличение могут включать как проявление активности, которой исходно не обладали, так и проявление улучшенной активности по сравнению с эндогенной активностью или активностью перед модификацией. Термин «эндогенная активность» означает активность конкретного полипептида, которой исходно обладал родительский штамм перед изменением признака или немодифицированный микроорганизм при изменении признака посредством генетической вариации из-за природных или искусственных факторов. Его можно использовать взаимозаменяемо с «активностью перед модификацией». Факт, что активность полипептида «усилена», «подвергнута повышающей регуляции», «сверхэкспрессируется» или «увеличена» по сравнению с эндогенной активностью, означает, что активность полипептида улучшена по сравнению с активностью и/или концентрацией (уровнем экспрессии) конкретного полипептида, которыми исходно обладает родительский штамм перед изменением признака или немодифицированный микроорганизм.
Данное усиление может быть достигнуто посредством введения чужеродного полипептида или увеличения эндогенной активности и/или концентрации (уровня экспрессии) данного полипептида. Усиление активности полипептида может быть подтверждено увеличением степени активности и уровня экспрессии полипептида или количества продукта, продуцируемого из данного полипептида.
Для усиления активности полипептида можно применять разные способы, хорошо известные в данной области, и данный способ не ограничен, при условии, что активность интересующего полипептида может быть усилена по сравнению с активностью микроорганизма до модификации. В частности, можно использовать генную инженерию и/или белковую инженерию, хорошо известные специалистам в данной области, которые представляют собой традиционные способы молекулярной биологии, но данный способ не ограничивается ими (например, Sitnicka et al., Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol. 2. 1-16; Sambrook et al., Molecular Cloning 2012; и тому подобные).
В частности, усиление активности полипептида по настоящему изобретению может представлять собой:
1) увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид;
2) замену регуляторной области экспрессии гена на хромосоме, кодирующей полипептид, последовательностью, демонстрирующей сильную активность;
3) модификацию инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR область;
4) модификацию аминокислотной последовательности полипептида для увеличения активности данного полипептида;
5) модификацию последовательности полинуклеотида, кодирующей полипептид, для усиления активности данного полипептида (например модификацию последовательности полинуклеотида гена полипептида для кодирования полипептида, который был модифицирован для усиления активности данного полипептида);
6) введение чужеродного полипептида, демонстрирующего активность данного полипептида, или чужеродного полинуклеотида, кодирующего данный полипептид;
7) оптимизацию кодонов полинуклеотида, кодирующего полипептид;
8) анализ третичной структуры полипептида для отбора и модификации или химической модификации экспонированного сайта; или
9) комбинацию двух или более чем двух, выбранных из (1)-(8), но конкретно не ограничен ими.
Более конкретно:
1) Увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид, может быть достигнуто посредством введения в клетку-хозяина вектора, который может реплицироваться и функционировать независимо от хозяина, и с которым полинуклеотид, кодирующий данный полипептид, связан функциональным образом. В качестве альтернативы, увеличение может быть достигнуто посредством введения одной копии или двух или более копий полинуклеотида, кодирующего данный полипептид, в хромосому в клетке-хозяине. Введение в хромосому можно осуществлять путем введения вектора, способного встраивать полинуклеотид в хромосому клетки-хозяина, в клетку-хозяина, но не ограничивается им. Данный вектор является таким, как описано выше.
2) Замена регуляторной области экспрессии гена (или регуляторной последовательности экспрессии) на хромосоме, кодирующей полипептид, последовательностью, демонстрирующей сильную активность, может представлять собой, например, делецию, вставку, неконсервативную или консервативную замену, или появление изменения в последовательности из-за их комбинации, или замену последовательностью, демонстрирующей более сильную активность, таким образом, что активность регуляторной области экспрессии дополнительно усиливается. Регуляторная область экспрессии конкретно не ограничивается ими, но может содержать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, последовательность, регулирующую терминацию транскрипции и трансляции и тому подобные. Например, замена может представлять собой замену исходного промотора сильным промотором, но не ограничивается ей.
Примеры известных сильных промоторов включают промоторы CJ1-CJ7 (US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet, промотор gapA, промотор SPL7, промотор SPL13 (sm3) (US 10584338 В2), промотор O2 (US 10273491 В2), промотор tkt и промотор уссА, но не ограничиваются ими.
3) Модификация инициирующего кодона транскрипта гена, кодирующего полипептид, или последовательности оснований, кодирующей 5'-UTR область, может представлять собой, например, замену последовательностью оснований, кодирующей другой инициирующий кодон, имеющий более высокую скорость экспрессии полипептида по сравнению с эндогенным инициирующим кодоном, но не ограничивается ей.
4) и 5) Модификация аминокислотной последовательности или последовательности полинуклеотида может представлять собой делецию, вставку, неконсервативную или консервативную замену аминокислотной последовательности полипептида или последовательности полинуклеотида, кодирующей данный полипептид, или появление изменения в данной последовательности из-за их комбинации или замены аминокислотной последовательностью или последовательностью полинуклеотида, модифицированной для демонстрации более сильной активности, или аминокислотной последовательностью или последовательностью полинуклеотида, модифицированной для того, чтобы быть более активной, таким образом, что активность данного полипептида усиливается, но не ограничивается ими. Данную замену можно конкретно осуществлять посредством вставки полинуклеотида в хромосому посредством гомологичной рекомбинации, но не ограничиваясь ей. Используемый здесь вектор может дополнительно содержать селективный маркер для подтверждения вставки в хромосому. Селективный маркер является таким, как описано выше.
6) Введение чужеродного полипептида, демонстрирующего активность полипептида, может представлять собой введение в клетку-хозяина чужеродного полинуклеотида, кодирующего полипептид, демонстрирующий такую же или аналогичную данному полипептиду активность. Чужеродный полинуклеотид не ограничен по его происхождению или последовательности при условии, что он демонстрирует такую же или аналогичную данному полипептиду активность. Введение можно осуществлять посредством подходящего выбора известного способа трансформации специалистами в данной области. Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, может продуцироваться полипептид и его активность может увеличиваться.
7) Оптимизация кодонов полинуклеотида, кодирующего полипептид, может представлять собой оптимизацию кодонов эндогенного полинуклеотида таким образом, чтобы увеличивать транскрипцию или трансляцию в клетке-хозяине, или оптимизацию кодонов чужеродного полинуклеотида таким образом, чтобы осуществлять оптимизированную транскрипцию и трансляцию в клетке-хозяине.
8) Анализ третичной структуры полипептида для выбора и модификации или химическая модификация экспонированного сайта можно осуществлять, например, для определения шаблонного белка-кандидата согласно степени сходства последовательности посредством сравнения информации о последовательности полипептида, подлежащего анализу, с хранилищем информации о последовательностях известных белков в базе данных для подтверждения структуры на основе этого и для выбора и модификации или химической модификации экспонированной части, подлежащей модификации или химической модификации.
Такое усиление активности полипептида может представлять собой увеличение активности или концентрации, или уровня экспрессии соответствующего полипептида на основе активности или концентрации полипептида, экспрессируемого в микробном штамме дикого типа или в микробном штамме перед модификацией, или увеличение количества продукта, продуцируемого от полипептида, но не ограничивается ими.
В микроорганизме по настоящему изобретению частичную или полную модификацию (например модификацию для кодирования варианта белка, как описано выше) полинуклеотида можно индуцировать (а) гомологичной рекомбинацией с использованием вектора для вставки в хромосому в микроорганизме или редактированием генома с использованием генетически модифицированной нуклеазы (например CRISPR-Cas9), и/или (б) обработкой светом, таким как ультрафиолетовые лучи и излучение, и/или химическими агентами, но не ограничиваясь ими. Способ модификации части или всего гена может включать способ с использованием технологии рекомбинантной ДНК. Например, посредством введения в микроорганизм нуклеотидной последовательности или вектора, содержащего нуклеотидную последовательность, гомологичную интересующему гену, для вызова гомологичной рекомбинации можно удалить часть гена или весь данный ген. Введенная нуклеотидная последовательность или вектор может содержать доминантный селективный маркер, но не ограничиваясь им.
В микроорганизме по настоящему изобретению вариант, полинуклеотид, L-валин и тому подобные являются такими, как описано в других аспектах.
Согласно еще одному другому аспекту настоящего раскрытия предложен способ продуцирования L-аминокислоты, который включает культивирование в среде штамма Corynebacterium glutamicum, содержащего вариант по настоящему изобретению или полинуклеотид по настоящему изобретению.
Способ продуцирования L-аминокислоты по настоящему изобретению может включать культивирование в среде штамма Corynebacterium glutamicum, содержащего вариант по настоящему изобретению или полинуклеотид по настоящему изобретению, или вектор по настоящему изобретению.
Кроме того, L-аминокислота по настоящему изобретению может представлять собой L-валин.
В настоящем раскрытии термин «культивирование» означает выращивание штамма Corynebacterium glutamicum по настоящему изобретению в условиях среды, контролируемых подходящим образом. Способ культивирования по настоящему изобретению можно осуществлять в соответствии с подходящей средой и условиями культивирования, известными в данной области. Такой способ культивирования может быть легко скорректирован и использован специалистами в данной области согласно выбранному штамму. В частности, культивирование может быть периодического типа, непрерывного типа и/или типа с подпиткой, но не ограничивается ими.
В настоящем раскрытии термин «среда» означает смешанное вещество, содержащее питательные вещества, требующиеся для культивирования штамма Corynebacterium glutamicum по настоящему изобретению в качестве главного компонента, и данная среда поставляет питательные вещества, факторы роста и тому подобное, включая воду, которые являются незаменимыми для выживания и развития. В частности, в качестве среды и других условий культивирования, используемых для культивирования штамма Corynebacterium glutamicum по настоящему изобретению, можно использовать любые без конкретного ограничения, при условии, что она представляет собой среду, используемую для обычного культивирования микроорганизмов. Штамм Corynebacterium glutamicum по настоящему изобретению можно культивировать в обычной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины, и тому подобное, при контролировании температуры, рН и тому подобного в аэробных условиях.
В частности, культуральную среду для штамма рода Corynebacterium можно найти в документе "Manual of Methods for General Bacteriology" by the American Society for Bacteriology (Washington, D.C., USA, 1981).
В настоящем раскрытии источники углерода включают углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, сахароза и мальтоза; сахароспирты, такие как маннит и сорбит; органические кислоты, такие как пировиноградная кислота, молочная кислота и лимонная кислота; аминокислоты, такие как глутаминовая кислота, метионин и валин; и тому подобное. Можно использовать природные органические питательные вещества, такие как гидролизат крахмала, мелассу, сырую мелассу, рисовые отруби, маниок, остаток сахарного тростника и жидкий кукурузный экстракт. В частности, можно использовать углеводы, такие как глюкоза и стерилизованные предобработанные мелассы (а именно: мелассы, превращенные в восстанавливающий сахар), и можно использовать подходящие количества других источников углерода разными способами без ограничения. Данные источники углерода можно использовать одиночно или в комбинации с двумя или более чем двумя, но не ограничиваясь ими.
В качестве источников азота можно использовать неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; и органические источники азота, такие как аминокислоты, такие как глутаминовая кислота, метионин и глутамин, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее разложения и обезжиренный соевый жмых или продукты его разложения. Данные источники азота можно использовать одиночно или в комбинации двух или более чем двух, но не ограничиваясь ими.
Источники фосфора могут включать монокалия фосфат, дикалия фосфат или соответствующие им натрийсодержащие соли. В качестве неорганических соединений можно использовать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и тому подобное. Помимо них могут содержаться аминокислоты, витамины и/или подходящие предшественники, и тому подобное. Данные компоненты или предшественники можно добавлять в среду порционно или непрерывно, но способ добавления не ограничивается ими.
Во время культивирования штамма Corynebacterium glutamicum по настоящему изобретению рН среды можно корректировать добавлением в среду подходящим образом таких соединений, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Во время культивирования пенообразование можно подавлять посредством применения пеногасителя, такого как сложный полигликолевый эфир жирной кислоты. В среду можно инъецировать кислород или кислородсодержащий газ для поддержания аэробного состояния данной среды, или газ можно не инъецировать, или можно инъецировать газообразный азот, водород или диоксид углерода для того, чтобы поддерживать анаэробное и микроаэробное состояния, но способ поддержания данного состояния не ограничивается ими.
При культивировании по настоящему изобретению можно поддерживать температуру культивирования от 20°С до 45°С, в частности от 25°С до 40°С, и штамм можно культивировать в течение примерно от 10 до 160 часов, но условия культивирования не ограничиваются этим.
L-аминокислота, продуцируемая посредством культивирования по настоящему изобретению, может секретироваться в среду или может оставаться в клетках.
Способ продуцирования L-аминокислоты по настоящему изобретению может дополнительно включать стадию получения штамма Corynebacterium glutamicum по настоящему изобретению, стадию приготовления среды для культивирования штамма или их комбинацию (в любом порядке), например перед стадией культивирования.
Способ продуцирования L-аминокислоты по настоящему изобретению может дополнительно включать стадию выделения L-аминокислоты из среды в соответствии с культивированием (среда, подвергнувшаяся воздействию культуры) или из штамма Corynebacterium glutamicum. После стадии культивирования может быть дополнительно включена стадия выделения.
Выделение может служить для сбора интересующей L-аминокислоты посредством подходящего способа, известного в данной области, согласно способу культивирования микроорганизма по настоящему изобретению, например способу периодического, непрерывного культивирования или культивирования с подпиткой. Например, можно использовать центрифугирование, фильтрование, обработку осадителем кристаллизованного белка (высаливание), экстракцию, ультразвуковую дезинтеграцию, ультрафильтрацию, диализ, разные виды хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, ВЭЖХ (высокоэффективная жидкостная хроматография), или их комбинацию. Интересующую L-аминокислоту можно выделять из среды или микроорганизма посредством подходящего способа, известного в данной области.
Способ продуцирования L-аминокислоты по настоящему изобретению может дополнительно включать стадию очистки. Очистку можно осуществлять посредством подходящего способа, известного в данной области. В одном примере, когда способ продуцирования L-аминокислоты по настоящему изобретению включает и стадию выделения, и стадию очистки, данные стадии выделения и очистки можно осуществлять непрерывно или с перерывами, независимо от порядка, или можно осуществлять одновременно, или посредством объединения в одну стадию, но способ осуществления данных стадий не ограничивается этим.
В способе по настоящему изобретению вариант, полинуклеотид, вектор, штамм и тому подобное являются такими, как описано в других аспектах.
Еще одним аспектом настоящего раскрытия является предложение композиции для продуцирования L-аминокислоты, которая содержит штамм Corynebacterium glutamicum, содержащий вариант по настоящему изобретению, полинуклеотид, кодирующий данный вариант, вектор, содержащий данный полинуклеотид, или полинуклеотид по настоящему изобретению; среду, в которой культивировали данный штамм Corynebacterium glutamicum; или комбинацию двух или более чем двух из них.
Композиция по настоящему изобретению может дополнительно содержать произвольные подходящие эксципиенты, которые обычно применяют в композициях для продуцирования аминокислот. Такие эксципиенты могут представлять собой, например, консервант, увлажнитель, диспергирующий агент, суспендирующий агент, буферный агент, стабилизатор или изотоничный агент, но не ограничиваются ими.
В композиции по настоящему изобретению вариант, полинуклеотид, вектор, штамм, среда, L-аминокислота и тому подобные являются такими, как описано в других аспектах.
Полезные эффекты
В случае культивирования штамма Corynebacterium glutamicum, содержащего вариант белка по настоящему изобретению, возможно продуцирование L-валина с более высоким выходом по сравнению со случаем существующих микроорганизмов, имеющих немодифицированные полипептиды.
Описание графических материалов
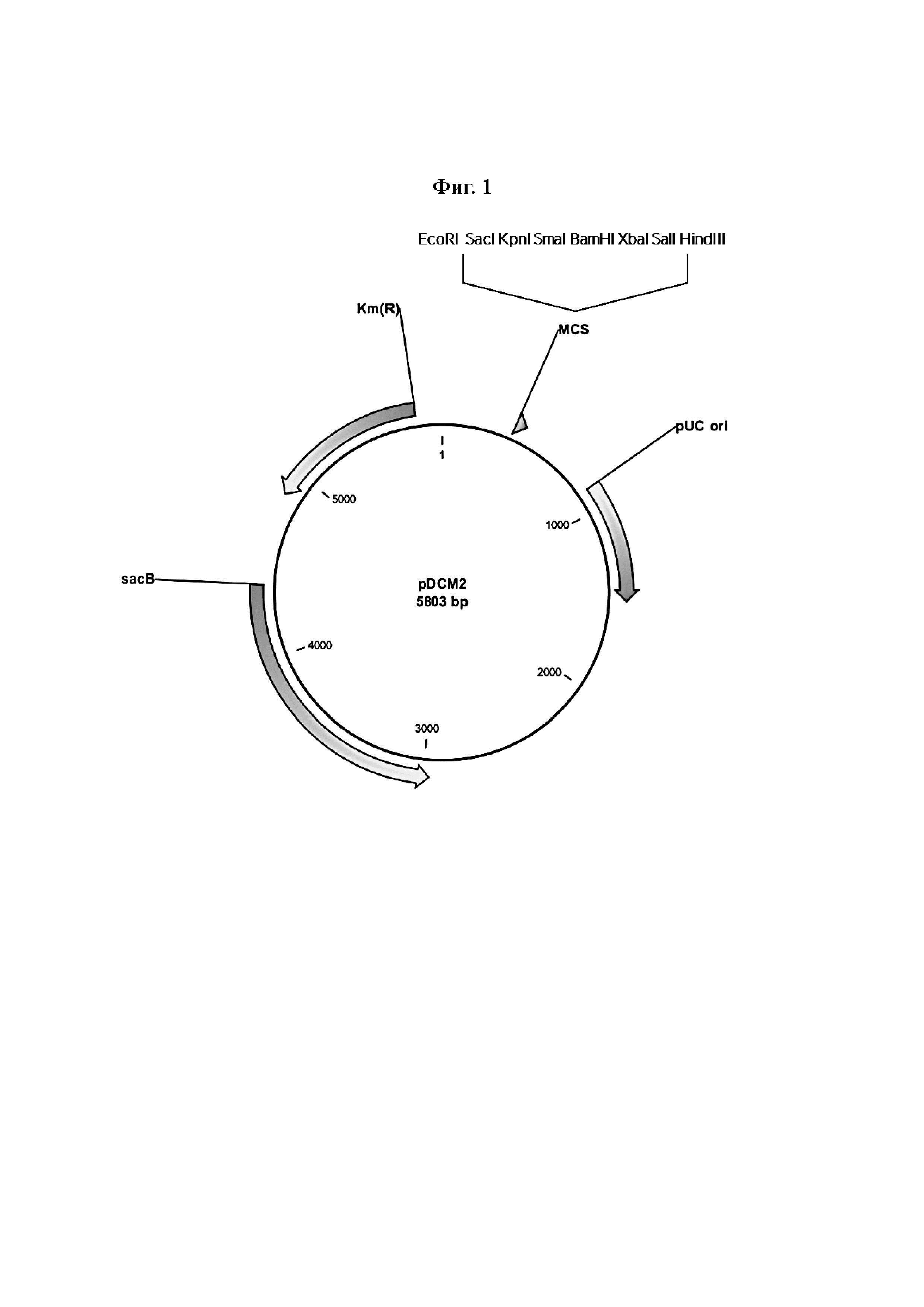
Фиг. 1 представляет собой схематическое изображение плазмиды pDCM2.
Способ осуществления изобретения
Ниже настоящее изобретение будет более подробно описано посредством Примеров. Однако следующие ниже Примеры являются лишь предпочтительными воплощениями для иллюстрации настоящего изобретения и, таким образом, не предназначены для ограничения объема настоящего раскрытия. Вместе с тем, технические вопросы, не описанные в настоящем описании изобретения, могут быть в достаточной степени поняты и легко воплощены специалистами в технической области настоящего изобретения или в аналогичных технических областях.
Пример 1: Конструирование плазмиды
Плазмида (pDCM2, Фиг. 1, SEQ ID №: 11) для вставки и замены генов в хромосоме Corynebacterium была сконструирована и синтезирована с использованием службы синтеза генов BIONICS Co., Ltd. Плазмида была сконструирована так, чтобы содержать сайт рестрикционного фермента, который можно было бы легко использовать для клонирования, обратившись к широко известной статье о системе sacB (Gene, 145 (1994) 69-73). Синтезированная таким образом плазмида pDCM2 обладает следующими свойствами:
1) Плазмида pDCM2 имеет точку начала репликации, которая работает только в Е. coli, и, таким образом, саморепликация возможна в Е. coli, но не в Corynebacterium.
2) Плазмида pDCM2 содержит ген резистентности к канамицину в качестве селекционного маркера.
3) Плазмида pDCM2 содержит ген левансукразы (sacB) в качестве вторичного маркера положительной селекции.
4) В окончательно сконструированном штамме не остается никакой генной информации, полученной из плазмиды pDCM2.
Пример 2: Конструирование вектора для экспрессии варианта белка в микроорганизме
Для того, чтобы подтвердить влияние варианта (S109F; SEQ ID NO: 1), у которого серии (Ser, S) в положении 109 белка, состоящего из аминокислотной последовательности SEQ ID NO: 3, был заменен фенилаланином (Phe, F), на продуцирование L-валина, конструировали вектор для конструирования штамма, экспрессирующего данный вариант, следующим образом.
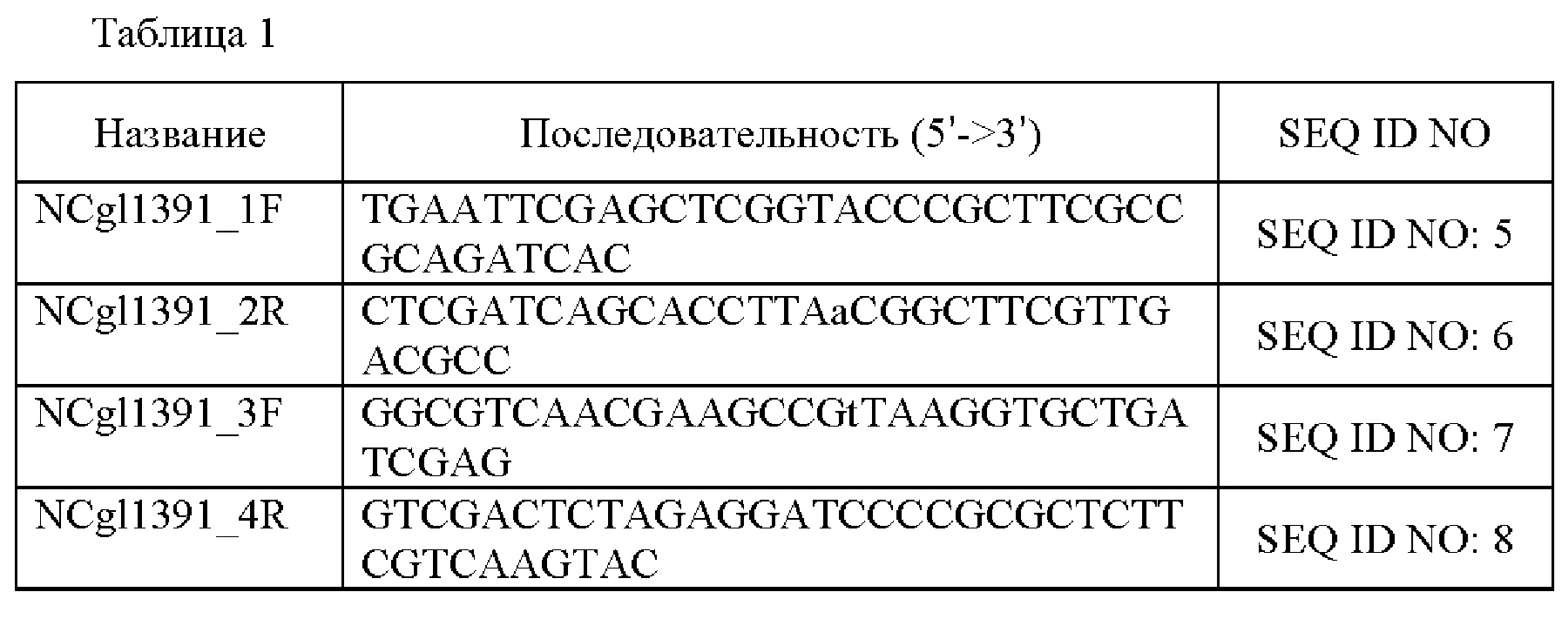
ПЦР (полимеразная цепная реакция) проводили с использованием гДНК (геномная ДНК) Corynebacterium glutamicum дикого типа АТСС14067 в качестве матрицы, пары праймеров, имеющих последовательности SEQ ID NO: 5 и 6, и пары праймеров, имеющих последовательности SEQ ID NO: 7 и 8. Вновь проводили ПЦР с перекрывающимися праймерами с использованием смеси двух фрагментов, полученных выше, в качестве матрицы и пары праймеров, имеющих последовательности SEQ ID NO: 5 и 8, с получением фрагмента. ПЦР проводили следующим образом: денатурация при 94°С в течение 5 минут; 30 циклов при 94°С в течение 30 секунд, 55°С в течение 30 секунд, 72°С в течение 1 минуты 30 секунд; и 72°С в течение 5 минут. Вектор pDCM2 обрабатывали smaI, и ПЦР-продукт, полученный выше, клонировали посредством слияния. Клонирование посредством слияния проводили с использованием набора для клонирования In-Fusion® HD (Clontech). Полученный вектор назвали pDCM2-NCgl1391(S109F). Последовательности праймеров, используемых в данном примере, описаны в следующей Таблице 1:
Пример 3. Оценка способности к продуцированию L-валина микроорганизма, экспрессирующего вариант белка
2-1. Конструирование штамма, экспрессирующего варианта белка
Вектор, сконструированный в Примере 2, трансформировали в Corynebacterium glutamicum СА08-0072 (KCCM11201P).
Штамм, в который был введен данный вариант, был выбран из штаммов, в которых происходила гомологичная рекомбинация с использованием SEQ ID NO: 9 и 10. Выбранный штамм назвали СА08-0072_NCgl1391_S109F. Последовательности праймеров, использованных в данном примере, описаны в следующей Таблице 2:

3-2. Сравнение способности к продуцированию L-валина штаммов, экспрессирующих вариант белка
Способность к продуцированию L-валина анализировали посредством оценки титра ферментации в колбе каждого штамма, сконструированного в Примере 3-1, и контрольного родительского штамма.
Сначала каждую колонию субкультивировали в питательном бульоне и затем каждый штамм инокулировали в 250 мл колбу с угловыми перегородками, содержащей 25 мл продукционной среды, и подвергали культивированию со встряхиванием при 200 об/мин при 30°С в течение 72 часов. После этого концентрацию L-валина анализировали посредством ВЭЖХ и проанализированная концентрация L-валина была показана в Таблице 1 ниже.
Питательный бульон (рН 7,2)
10 г глюкозы, 5 г говяжьего экстракта, 10 г полипептона, 2,5 г хлорида натрия, 5 г дрожжевого экстракта, 20 г агара, 2 г мочевины (из расчета на 1 литр дистиллированной воды).
Продукционная среда (рН 7,0)
100 г глюкозы, 40 г аммония сульфата, 2,5 г соевого белка, 5 г твердых веществ кукурузного экстракта, 3 г мочевины, 1 г гидрофосфата калия, 0,5 г сульфата магния гептагидрата, 100 мкг биотина, 1 мг тиамина хлорида, 2 мг пантотената кальция, 3 мг никотинамида, 30 г карбоната кальция (из расчета на 1 литр дистиллированной воды).
Данный эксперимент повторяли 3 раза, и средние значения результатов его анализа представлены в Таблице 3 ниже.
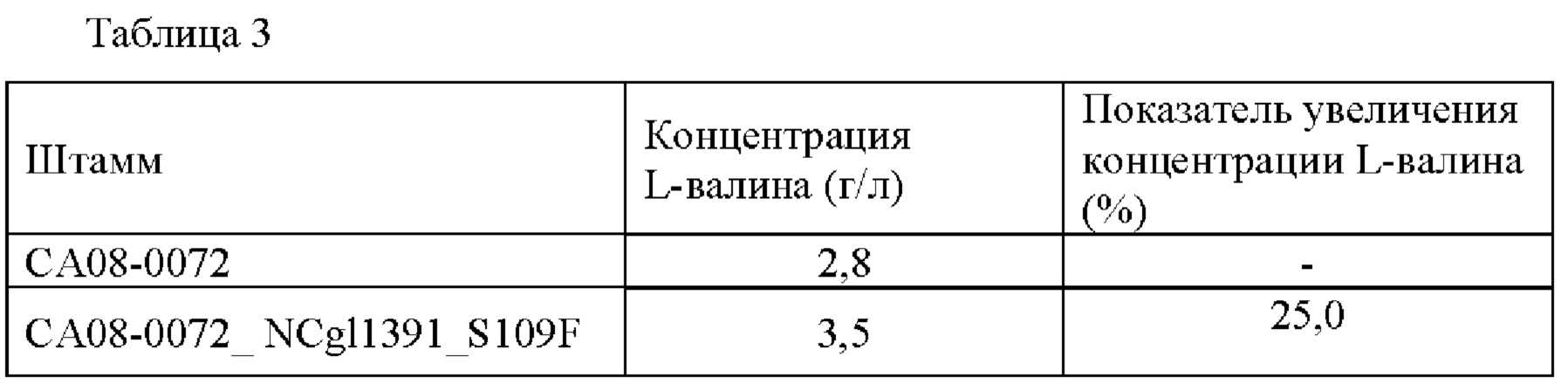
Как представлено в Таблице 3, штамм CA08-0072_NCgl1391_S109F демонстрировал повышенную способность к продуцированию L-валина по сравнению со способностью к продуцированию L-валина контрольной группы.
Модифицированный штамм CA08-0072_NCgl1391_S109F был назван Corynebacterium glutamicum СА08-1743, депонирован в Корейском центре культур микроорганизмов, депозитарном учреждении в соответствии с Будапештским договором, 2 декабря 2020 г. и получил регистрационный номер KCCM12860P.
Из приведенного выше описания специалистам в технической области, к которой принадлежит настоящее изобретение, будет понятно, что настоящее изобретение может быть осуществлено в других конкретных формах без изменения его технической сущности и существенных признаков. В данном отношении следует понимать то, что воплощения, описанные выше, являются во всех отношениях иллюстративными и не ограничивающими. Объем настоящего изобретения следует истолковывать как включающий все изменения или модифицированные формы, происходящие из значения и объема формулы изобретения, приведенной ниже, а не из приведенного выше подробного описания и эквивалентных ему идей.
--->
<110> CJ CheilJedang Corporation
<120>Новый вариант белка и способ получения L-валина с его
применением
<130>OPP20211120KR
<150> KR 10-2021-0011008
<151> 2021-01-26
<160> 11
<170> koPatentIn 3.0
<210> 1
<211> 297
<212> PRT
<213> Artificial Sequence
<220>
<223>Вариант белка
<400> 1
Met Leu Asp Thr Phe His Leu Ser Val Leu Ser Glu Asp Glu Trp Met
1 5 10 15
Glu Leu Ala Arg Ala His His Ala Arg Ala Asp Ser Phe Thr Lys Asp
20 25 30
His Leu Lys Arg Arg Gln Ala His Ile Lys His Pro Val Phe Asp Phe
35 40 45
Leu Phe Glu Tyr Tyr Pro Val Arg Val Ala His Leu Lys Thr Trp His
50 55 60
Pro Gly Ile Gly Val Phe Leu Glu Gly Thr Pro Pro His Ala Thr Met
65 70 75 80
Arg Asp Phe Leu Leu Val Asp Ala Ser Leu His His Ala Ala Gly Val
85 90 95
Gln Leu Asp Leu Ala Ser Tyr Met Gln Arg Arg Gly Phe Ser Val Arg
100 105 110
Tyr Ile His Glu Leu Leu Ser Ala Thr Arg Asp Asn His Ala Gln Phe
115 120 125
Asp Cys Phe Gly Leu His Glu Trp Ala Met Val Tyr Lys Ser Asn Asp
130 135 140
Leu Arg His Asp Leu Pro Leu Arg Leu Thr Pro Ser Glu Thr Asp Arg
145 150 155 160
Val Val Glu Ser His Asn Ile Lys Cys Thr His Phe Asp Ala Tyr Arg
165 170 175
Phe Phe Thr Thr Pro Ala Ile Pro Leu Asn Leu Thr Val Leu Thr Arg
180 185 190
Glu Asp Gln Pro Arg Asn Asp Gln Cys Gly Cys Leu His Ala Thr Met
195 200 205
Asp Leu Tyr Lys Trp Ser Ala Lys Leu Gly Pro Leu Val Pro Gly Asp
210 215 220
Leu Phe Leu Glu Ala Phe Glu Leu Ala Arg Asp Thr Arg Ile Leu Asp
225 230 235 240
Met Glu Ala Ser Pro Tyr Asp Val Arg Gly Tyr Gly Phe Gly Tyr Val
245 250 255
Pro Ile Glu Thr Ala Glu Gly Lys Ala Glu Tyr Val Ser Arg Gln Arg
260 265 270
Glu Leu Ser Glu Arg Ala Lys Pro Ile Arg Asp Arg Leu Val Ser Ile
275 280 285
Thr Lys Gln Ala Leu Gln Ala Ser Ile
290 295
<210> 2
<211> 894
<212> DNA
<213> Artificial Sequence
<220>
<223>Ген, кодирующий вариант белка
<400> 2
gtgttggaca cttttcacct cagcgtattg agcgaggatg agtggatgga actagcccgc 60
gcccaccacg cgcgggctga ttcattcacc aaagaccact tgaagcgtcg acaagcgcat 120
atcaagcacc ccgtcttcga cttcctcttc gagtactacc ccgtgcgcgt cgcgcaccta 180
aaaacctggc accccggcat cggcgtgttc ctagaaggca caccgccgca tgccaccatg 240
cgcgattttt tgcttgtcga cgcctccctc catcacgcag ctggcgtcca gcttgacctg 300
gcctcctata tgcaacgccg tgggttctct gtgcgctaca tccacgaact gttgtccgcc 360
acccgtgaca accacgccca atttgattgt tttggtctgc acgaatgggc aatggtgtac 420
aaatcaaacg atctccgcca tgatcttccc ctgcgcctta ccccatcgga aaccgaccgt 480
gtggtggaaa gccacaacat caaatgcacc cactttgatg cctaccgatt cttcaccaca 540
ccagccatcc cgttgaacct cacggtgtta acccgcgaag atcagccacg caacgatcaa 600
tgcggttgtc tgcatgccac gatggatcta tacaaatggt ccgcaaagct tggccctctt 660
gtgccaggtg atcttttctt ggaagcgttt gaactagccc gcgacacccg catcttggac 720
atggaggctt cgccttacga cgtccgcgga tacggctttg gctacgtccc cattgagacc 780
gccgagggca aagccgaata tgtcagtaga caacgcgagc tgtctgaacg agcaaaaccc 840
atccgtgacc ggcttgtctc cattactaaa caagctctac aggctagtat ttag 894
<210> 3
<211> 297
<212> PRT
<213> Artificial Sequence
<220>
<223>Белок дикого типа
<400> 3
Met Leu Asp Thr Phe His Leu Ser Val Leu Ser Glu Asp Glu Trp Met
1 5 10 15
Glu Leu Ala Arg Ala His His Ala Arg Ala Asp Ser Phe Thr Lys Asp
20 25 30
His Leu Lys Arg Arg Gln Ala His Ile Lys His Pro Val Phe Asp Phe
35 40 45
Leu Phe Glu Tyr Tyr Pro Val Arg Val Ala His Leu Lys Thr Trp His
50 55 60
Pro Gly Ile Gly Val Phe Leu Glu Gly Thr Pro Pro His Ala Thr Met
65 70 75 80
Arg Asp Phe Leu Leu Val Asp Ala Ser Leu His His Ala Ala Gly Val
85 90 95
Gln Leu Asp Leu Ala Ser Tyr Met Gln Arg Arg Gly Ser Ser Val Arg
100 105 110
Tyr Ile His Glu Leu Leu Ser Ala Thr Arg Asp Asn His Ala Gln Phe
115 120 125
Asp Cys Phe Gly Leu His Glu Trp Ala Met Val Tyr Lys Ser Asn Asp
130 135 140
Leu Arg His Asp Leu Pro Leu Arg Leu Thr Pro Ser Glu Thr Asp Arg
145 150 155 160
Val Val Glu Ser His Asn Ile Lys Cys Thr His Phe Asp Ala Tyr Arg
165 170 175
Phe Phe Thr Thr Pro Ala Ile Pro Leu Asn Leu Thr Val Leu Thr Arg
180 185 190
Glu Asp Gln Pro Arg Asn Asp Gln Cys Gly Cys Leu His Ala Thr Met
195 200 205
Asp Leu Tyr Lys Trp Ser Ala Lys Leu Gly Pro Leu Val Pro Gly Asp
210 215 220
Leu Phe Leu Glu Ala Phe Glu Leu Ala Arg Asp Thr Arg Ile Leu Asp
225 230 235 240
Met Glu Ala Ser Pro Tyr Asp Val Arg Gly Tyr Gly Phe Gly Tyr Val
245 250 255
Pro Ile Glu Thr Ala Glu Gly Lys Ala Glu Tyr Val Ser Arg Gln Arg
260 265 270
Glu Leu Ser Glu Arg Ala Lys Pro Ile Arg Asp Arg Leu Val Ser Ile
275 280 285
Thr Lys Gln Ala Leu Gln Ala Ser Ile
290 295
<210> 4
<211> 894
<212> DNA
<213> Artificial Sequence
<220>
<223>Ген, кодирующий белок дикого типа
<400> 4
gtgttggaca cttttcacct cagcgtattg agcgaggatg agtggatgga actagcccgc 60
gcccaccacg cgcgggctga ttcattcacc aaagaccact tgaagcgtcg acaagcgcat 120
atcaagcacc ccgtcttcga cttcctcttc gagtactacc ccgtgcgcgt cgcgcaccta 180
aaaacctggc accccggcat cggcgtgttc ctagaaggca caccgccgca tgccaccatg 240
cgcgattttt tgcttgtcga cgcctccctc catcacgcag ctggcgtcca gcttgacctg 300
gcctcctata tgcaacgccg tgggtcctct gtgcgctaca tccacgaact gttgtccgcc 360
acccgtgaca accacgccca atttgattgt tttggtctgc acgaatgggc aatggtgtac 420
aaatcaaacg atctccgcca tgatcttccc ctgcgcctta ccccatcgga aaccgaccgt 480
gtggtggaaa gccacaacat caaatgcacc cactttgatg cctaccgatt cttcaccaca 540
ccagccatcc cgttgaacct cacggtgtta acccgcgaag atcagccacg caacgatcaa 600
tgcggttgtc tgcatgccac gatggatcta tacaaatggt ccgcaaagct tggccctctt 660
gtgccaggtg atcttttctt ggaagcgttt gaactagccc gcgacacccg catcttggac 720
atggaggctt cgccttacga cgtccgcgga tacggctttg gctacgtccc cattgagacc 780
gccgagggca aagccgaata tgtcagtaga caacgcgagc tgtctgaacg agcaaaaccc 840
atccgtgacc ggcttgtctc cattactaaa caagctctac aggctagtat ttag 894
<210> 5
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_1F
<400> 5
tcgagctcgg tacccacggc ctcatggatg acgtct 36
<210> 6
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_2R
<400> 6
tcgtggatgt agcgcacaga gaacccacgg cgttgcatat agga 44
<210> 7
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_3F
<400> 7
tcctatatgc aacgccgtgg gttctctgtg cgctacatcc acga 44
<210> 8
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_4R
<400> 8
ctctagagga tcccctttgc tcgttcagac agctcg 36
<210> 9
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_5F
<400> 9
acggcctcat ggatgacgtc t 21
<210> 10
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> NCgl1391_6R
<400> 10
tttgctcgtt cagacagctc g 21
<210> 11
<211> 5803
<212> DNA
<213> Artificial Sequence
<220>
<223> pDCM2
<400> 11
gttcgcttgc tgtccataaa accgcccagt ctagctatcg ccatgtaagc ccactgcaag 60
ctacctgctt tctctttgcg cttgcgtttt cccttgtcca gatagcccag tagctgacat 120
tcatccgggg tcagcaccgt ttctgcggac tggctttcta cgtgttccgc ttcctttagc 180
agcccttgcg ccctgagtgc ttgcggcagc gtgaagctag cttttatcgc cattcgccat 240
tcaggctgcg caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc 300
tggcgaaagg gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt 360
cacgacgttg taaaacgacg gccagtgaat tcgagctcgg tacccgggga tcctctagag 420
tcgacctgca ggcatgcaag cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 480
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 540
ggtgcctaat gagtgagcta actcacatta attgcgttgc gctcactgcc cgctttccag 600
tcgggaaacc tgtcgtgcca gctgcattaa tgaatcggcc aacgcgcggg gagaggcggt 660
ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg 720
ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg 780
gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag 840
gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga 900
cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct 960
ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc 1020
tttctccctt cgggaagcgt ggcgctttct caatgctcac gctgtaggta tctcagttcg 1080
gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc 1140
tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca 1200
ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag 1260
ttcttgaagt ggtggcctaa ctacggctac actagaagga cagtatttgg tatctgcgct 1320
ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc 1380
accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga 1440
tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca 1500
cgttaaggga ttttggtcat gagattatca aaaaggatct tcacctagat ccttttgggg 1560
tgggcgaaga actccagcat gagatccccg cgctggagga tcatccagcc ctgatagaaa 1620
cagaagccac tggagcacct caaaaacacc atcatacact aaatcagtaa gttggcagca 1680
tcacccgacg cactttgcgc cgaataaata cctgtgacgg aagatcactt cgcagaataa 1740
ataaatcctg gtgtccctgt tgataccggg aagccctggg ccaacttttg gcgaaaatga 1800
gacgttgatc ggcacgtaag aggttccaac tttcaccata atgaaataag atcactaccg 1860
ggcgtatttt ttgagttatc gagattttca ggagctgata gaaacagaag ccactggagc 1920
acctcaaaaa caccatcata cactaaatca gtaagttggc agcatcaccc gacgcacttt 1980
gcgccgaata aatacctgtg acggaagatc acttcgcaga ataaataaat cctggtgtcc 2040
ctgttgatac cgggaagccc tgggccaact tttggcgaaa atgagacgtt gatcggcacg 2100
taagaggttc caactttcac cataatgaaa taagatcact accgggcgta ttttttgagt 2160
tatcgagatt ttcaggagct ctttggcatc gtctctcgcc tgtcccctca gttcagtaat 2220
ttcctgcatt tgcctgtttc cagtcggtag atattccaca aaacagcagg gaagcagcgc 2280
ttttccgctg cataaccctg cttcggggtc attatagcga ttttttcggt atatccatcc 2340
tttttcgcac gatatacagg attttgccaa agggttcgtg tagactttcc ttggtgtatc 2400
caacggcgtc agccgggcag gataggtgaa gtaggcccac ccgcgagcgg gtgttccttc 2460
ttcactgtcc cttattcgca cctggcggtg ctcaacggga atcctgctct gcgaggctgg 2520
ccggctaccg ccggcgtaac agatgagggc aagcggatgg ctgatgaaac caagccaacc 2580
aggaagggca gcccacctat caaggtgtac tgccttccag acgaacgaag agcgattgag 2640
gaaaaggcgg cggcggccgg catgagcctg tcggcctacc tgctggccgt cggccagggc 2700
tacaaaatca cgggcgtcgt ggactatgag cacgtccgcg agggcgtccc ggaaaacgat 2760
tccgaagccc aacctttcat agaaggcggc ggtggaatcg aaatctcgtg atggcaggtt 2820
gggcgtcgct tggtcggtca tttcgaaaaa ggttaggaat acggttagcc atttgcctgc 2880
ttttatatag ttcantatgg gattcacctt tatgttgata agaaataaaa gaaaatgcca 2940
ataggatatc ggcattttct tttgcgtttt tatttgttaa ctgttaattg tccttgttca 3000
aggatgctgt ctttgacaac agatgttttc ttgcctttga tgttcagcag gaagctcggc 3060
gcaaacgttg attgtttgtc tgcgtagaat cctctgtttg tcatatagct tgtaatcacg 3120
acattgtttc ctttcgcttg aggtacagcg aagtgtgagt aagtaaaggt tacatcgtta 3180
ggcggatcaa gatccatttt taacacaagg ccagttttgt tcagcggctt gtatgggcca 3240
gttaaagaat tagaaacata accaagcatg taaatatcgt tagacgtaat gccgtcaatc 3300
gtcatttttg atccgcggga gtcagtgaac aggtaccatt tgccgttcat tttaaagacg 3360
ttcgcgcgtt caatttcatc tgttactgtg ttagatgcaa tcagcggttt catcactttt 3420
ttcagtgtgt aatcatcgtt tagctcaatc ataccgagag cgccgtttgc taactcagcc 3480
gtgcgttttt tatcgctttg cagaagtttt tgactttctt gacggaagaa tgatgtgctt 3540
ttgccatagt atgctttgtt aaataaagat tcttcgcctt ggtagccatc ttcagttcca 3600
gtgtttgctt caaatactaa gtatttgtgg cctttatctt ctacgtagtg aggatctctc 3660
agcgtatggt tgtcgcctga gctgtagttg ccttcatcga tgaactgctg tacattttga 3720
tacgtttttc cgtcaccgtc aaagattgat ttataatcct ctacaccgtt gatgttcaaa 3780
gagctgtctg atgctgatac gttaacttgt gcagttgtca gtgtttgttt gccgtaatgt 3840
ttaccggaga aatcagtgta gaataaacgg atttttccgt cagatgtaaa tgtggctgaa 3900
cctgaccatt cttgtgtttg gtcttttagg atagaatcat ttgcatcgaa tttgtcgctg 3960
tctttaaaga cgcggccagc gtttttccag ctgtcaatag aagtttcgcc gactttttga 4020
tagaacatgt aaatcgatgt gtcatccgca tttttaggat ctccggctaa tgcaaagacg 4080
atgtggtagc cgtgatagtt tgcgacagtg ccgtcagcgt tttgtaatgg ccagctgtcc 4140
caaacgtcca ggccttttgc agaagagata tttttaattg tggacgaatc aaattcagaa 4200
acttgatatt tttcattttt ttgctgttca gggatttgca gcatatcatg gcgtgtaata 4260
tgggaaatgc cgtatgtttc cttatatggc ttttggttcg tttctttcgc aaacgcttga 4320
gttgcgcctc ctgccagcag tgcggtagta aaggttaata ctgttgcttg ttttgcaaac 4380
tttttgatgt tcatcgttca tgtctccttt tttatgtact gtgttagcgg tctgcttctt 4440
ccagccctcc tgtttgaaga tggcaagtta gttacgcaca ataaaaaaag acctaaaata 4500
tgtaaggggt gacgccaaag tatacacttt gccctttaca cattttaggt cttgcctgct 4560
ttatcagtaa caaacccgcg cgatttactt ttcgacctca ttctattaga ctctcgtttg 4620
gattgcaact ggtctatttt cctcttttgt ttgatagaaa atcataaaag gatttgcaga 4680
ctacgggcct aaagaactaa aaaatctatc tgtttctttt cattctctgt attttttata 4740
gtttctgttg catgggcata aagttgcctt tttaatcaca attcagaaaa tatcataata 4800
tctcatttca ctaaataata gtgaacggca ggtatatgtg atgggttaaa aaggatcacc 4860
ccagagtccc gctcagaaga actcgtcaag aaggcgatag aaggcgatgc gctgcgaatc 4920
gggagcggcg ataccgtaaa gcacgaggaa gcggtcagcc cattcgccgc caagctcttc 4980
agcaatatca cgggtagcca acgctatgtc ctgatagcgg tccgccacac ccagccggcc 5040
acagtcgatg aatccagaaa agcggccatt ttccaccatg atattcggca agcaggcatc 5100
gccatgggtc acgacgagat cctcgccgtc gggcatccgc gccttgagcc tggcgaacag 5160
ttcggctggc gcgagcccct gatgctcttc gtccagatca tcctgatcga caagaccggc 5220
ttccatccga gtacgtgctc gctcgatgcg atgtttcgct tggtggtcga atgggcaggt 5280
agccggatca agcgtatgca gccgccgcat tgcatcagcc atgatggata ctttctcggc 5340
aggagcaagg tgagatgaca ggagatcctg ccccggcact tcgcccaata gcagccagtc 5400
ccttcccgct tcagtgacaa cgtcgagaca gctgcgcaag gaacgcccgt cgtggccagc 5460
cacgatagcc gcgctgcctc gtcttggagt tcattcaggg caccggacag gtcggtcttg 5520
acaaaaagaa ccgggcgccc ctgcgctgac agccggaaca cggcggcatc agagcagccg 5580
attgtctgtt gtgcccagtc atagccgaat agcctctcca cccaagcggc cggagaacct 5640
gcgtgcaatc catcttgttc aatcatgcga aacgatcctc atcctgtctc ttgatcagat 5700
cttgatcccc tgcgccatca gatccttggc ggcaagaaag ccatccagtt tactttgcag 5760
ggcttcccaa ccttaccaga gggcgcccca gctggcaatt ccg 5803
<---