Результат интеллектуальной деятельности: Вариант репрессора глюконата, микроорганизм-продуцент L-лизина, содержащий его, и способ получения L-лизина с его использованием
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к новому варианту репрессора глюконата, содержащему его микроорганизму и способу получения L-лизина с его использованием.
Предшествующий уровень техники
Для массового производства полезных продуктов, таких как аминокислоты, регуляция потребления глюкозы и пентозофосфатного пути у штамма Corynebacterium является очень важной (Handbook of Corynebacterium glutamicum. 2005. 215-240).
Репрессор глюконата (GntR) представляет собой важный регуляторный белок, который регулирует поток углерода через потребление глюкозы и пентозофосфатный путь. Известно, что у штамма Corynebacterium glutamicum обнаружены два репрессора глюконата (GntR1 и GntR2).
GntR1 и GntR2 сильно ингибируют экспрессию генов, кодирующих глюконатпермеазу (gntP), глюконаткиназу (gntK) и 6-фосфоглюконат-дегидрогеназу (gnd), которые связаны с метаболизмом глюконата и оказывают действие, слабо ингибируя экспрессию оперона tkt-tal-zwf-opcA-devB, который представляет собой основной ген пути фосфорилирования пентоз. Между тем, экспрессия генов, кодирующих специфичный к глюкозе фермент-транспортер II (ptsG) и специфичный к сахарозе фермент-транспортер II (ptsS) фосфотрансферазной системы (PTS), которая представляет собой основной метаболический путь потребления сахаров (sugar-infusion) штамма Corynebacterium, активируется для вовлечения в значительной степени в потребление сахаров (Julia Frunzke, Verena Engels, Sonja Hasenbein, Cornelia Gatgens and Michael Bott, Molecular Microbiology (2008) 67(2), 305-322).
Раскрытие изобретения
Техническая задача
Задача настоящего изобретения заключалась в том, чтобы выявить ген, оказывающий эффективное действие на продуктивность по L-лизину, и разработать новый вариант репрессора 1 глюконата (GntR1), и было подтверждено, что у микроорганизма-продуцента L-лизина, содержащего этот вариант, скорость потребления сахаров и продуктивность по L-лизину увеличивалась по сравнению с микроорганизмом, содержащим репрессор 1 глюконата дикого типа, и тем самым авторы настоящего изобретения осуществили настоящее изобретение.
Техническое решение
В качестве объекта настоящего изобретения предложен новый вариант белка-репрессора глюконата.
В качестве другого объекта настоящего изобретения предложен полинуклеотид, кодирующий этот вариант, и вектор экспрессии, содержащий этот полинуклеотид.
В качестве еще одного объекта настоящего изобретения предложен микроорганизм-продуцент L-лизина, который экспрессирует вариант белка-репрессора глюконата.
В качестве еще одного объекта настоящего изобретения предложен способ получения L-лизина, включающий: (а) культивирование микроорганизма-продуцента L-лизина в среде, и (б) выделение L-лизина из культивированного микроорганизма или из среды со стадии (а).
Полезные эффекты изобретения
Микроорганизм-продуцент L-лизина, содержащий вариант репрессора глюконата по настоящему изобретению, демонстрирует повышенную скорость потребления сахаров по сравнению с микроорганизмом, не содержащим этот вариант, и может обеспечить эффективное продуцирование L-лизина. Более конкретно, L-лизин представляет собой незаменимую аминокислоту корма животных, и необходимо ее производство в промышленных масштабах, и когда L-лизин продуцируется с высокой эффективностью в соответствии с настоящим изобретением, это также может снизить затраты при производстве корма.
Наилучшее воплощение изобретения
В одном воплощении настоящего изобретения предложен новый вариант белка-репрессора глюконата.
Как его используют здесь, термин "белок-репрессор глюконата" относится к регуляторному белку, вовлеченному в метаболизм глюконата или в потребление сахаров. Белок-репрессор глюконата конкретно не ограничен, но может представлять собой белок микроорганизма, принадлежащего роду Corynebacterium, в частности, белок-репрессор глюконата, имеющий происхождение из Corynebacterium glutamicum. Более конкретно, белок-репрессор глюконата может представлять собой белок GntR1, имеющий происхождение из Corynebacterium glutamicum, но не ограничен этим. Белок-репрессор глюконата может представлять собой, без ограничения, GntR1, содержащий аминокислотную последовательность SEQ ID NO: 4. Например, белок-репрессор глюконата может представлять собой аминокислотную последовательность, содержащую аминокислотную последовательность SEQ ID NO: 4 и имеющую гомологию по меньшей мере 80%, в частности по меньшей мере 90%, более конкретно по меньшей мере 95% и еще более конкретно по меньшей мере 99%. Дополнительно белок-репрессор глюконата, содержащий аминокислотную последовательность SEQ ID NO: 4, может кодироваться геном gntR1, содержащим нуклеотидную последовательность SEQ ID NO: 3, но не ограничен этим. Например, это может быть нуклеотидная последовательность SEQ ID NO: 3 или может быть нуклеотидная последовательность, имеющая гомологию по меньшей мере 80%, в частности по меньшей мере 90%, более конкретно по меньшей мере 95% или еще более конкретно по меньшей мере 99%.
Как его используют здесь, термин "гомология" относится к проценту идентичности между двумя полинуклеотидными или полипептидными группировками. Гомология между последовательностями из одной группировки и другой группировки может быть определена известными методиками. Например, гомологию можно определить путем выравнивания последовательностей и непосредственно выравнивания последовательностей двух полинуклеотидных молекул или двух полипептидных молекул с использованием компьютерной программы, доступной в настоящее время. Компьютерная программа может представлять собой BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlignTM (DNASTAR Inc.) и так далее. Кроме того, гомология между полинуклеотидами может быть определена путем гибридизации полинуклеотидов в условиях образования стабильных двойных связей между гомологичными участками, затем разрезая их специфичными к одноцепочечной нуклеиновой кислоте нуклеазами для определения размера отделенного фрагмента.
Вариант белка-репрессора глюконата может представлять собой полипептид, в котором аргинин (R), представляющий собой 102ую аминокислоту в аминокислотной последовательности SEQ ID NO: 4, заменен на аминокислоту, отличную от аргинина. В частности, вариант белка-репрессора глюконата может представлять собой полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, где аминокислота в положении 102 заменена на цистеин (С).
Такой вариант белка-репрессора глюконата включает не только полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1, но также вариант, имеющий гомологию 80% или более, в частности 90% или более, более конкретно 95% или более, еще более конкретно 99% или более, и по существу, это очевидно, что аминокислотная последовательность, обладающая биологической активностью, идентичной или соответствующей таковой белка, имеющего аминокислотную последовательность SEQ ID NO: 1, даже в случаях, когда некоторые из последовательностей имеют делецию, модификацию, замену или вставку в аминокислотные последовательности, включена в объем настоящего изобретения.
В другом воплощении настоящего изобретения предложен полинуклеотид, кодирующий вариант белка-репрессора глюконата, и вектор экспрессии, содержащий этот полинуклеотид.
Белок-репрессор глюконата и его вариант являются такими как описано выше.
В частности, полинуклеотид, кодирующий вариант белка-репрессора глюконата, может представлять собой полинуклеотид, кодирующий белок, содержащий аминокислотную последовательность SEQ ID NO: 1, или может представлять собой полинуклеотид, имеющий гомологию по меньшей мере 80%, в частности по меньшей мере 90%, более конкретно 95%, еще более конкретно по меньшей мере 99%. Полинуклеотид, кодирующий вариант белка-репрессора глюконата, может иметь, например, нуклеотидную последовательность SEQ ID NO: 2, но не ограничен этим.
Как его используют здесь, термин "полинуклеотид" относится к полимеру нуклеотидов, в которых нуклеотидные мономеры связаны в длинную цепь ковалентными связями. В целом это относится к цепям ДНК или РНК длиннее определенной длины. Полинуклеотид может иметь разнообразные нуклеотидные последовательности, которые кодируют одну и ту же аминокислотную последовательность, вследствие вырожденности генетического кода. Дополнительно, для оптимизации экспрессии в зависимости от типа клеток-хозяев можно использовать кодон-оптимизированные последовательности.
Как его используют здесь, термин "вектор" относится к любой молекуле нуклеиновой кислоты для клонирования и/или переноса полинуклеотида в клетку-хозяина. Вектор может представлять собой репликон, который может осуществлять репликацию фрагмента, соединенного с другим фрагментом ДНК. Термин "единица репликации" относится к любой генетической единице (например, плазмиде, фагу, космиде, хромосоме и вирусу). В настоящем изобретении вектор конкретно не ограничен, при условии, что он способен реплицироваться в хозяине, и можно использовать любой вектор, известный в данной области техники. Вектор, используемый для конструирования рекомбинантного вектора, может представлять собой плазмиду, космиду, вирус и бактериофаг в природной или рекомбинантной форме. Например, pWE15, М13, λEMBL3, λEMBL4, λFIXII, λDASHII, λZAPII, λgt10, λgt11, Charon4A, Charon21A и так далее можно использовать в качестве фагового вектора или космидного вектора, а в качестве плазмидного вектора можно использовать вектор pDZ, систему pBR, систему pUC, систему pBluescriptll, систему pGEM, систему pTZ, систему pCL, систему рЕТ и так далее. Доступные векторы конкретно не ограничены, и можно использовать известные векторы экспрессии. В частности, можно использовать pDZ (Регистрационный No. патента Кореи 10-0924065; включен в данное описание посредством ссылки во всей своей полноте), но не ограничиваясь этим.
Как его используют здесь, термин "трансформация" означает процесс, осуществляемый путем введения полинуклеотида, кодирующего вариант белка-репрессора глюконата, в клетку-хозяина таким образом, что полинуклеотид может экспрессироваться в клетке-хозяине, и полинуклеотид, которым трансформируют, при условии, что он может экспрессироваться в клетке-хозяине, включает без ограничения, полинуклеотиды, которые встраиваются в хромосому или локализуются за пределами хромосомы.
Полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой конструкцию, содержащую все элементы, необходимые для собственной экспрессии. Обычно экспрессионная кассета может включать промотор, функционально связанный с геном, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессионная кассета может находиться в форме вектора экспрессии, способного к саморепликации. Более того, полинуклеотид может быть введен в клетку-хозяина сам по себе или в форме экспрессионной кассеты и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине, но не ограничен этим.
В другом воплощении настоящего изобретения предложен микроорганизм-продуцент L-лизина, который экспрессирует вариант белка-репрессора глюконата.
Белок-репрессор глюконата и его вариант описаны выше.
Как его используют здесь, термин "L-лизин" означает незаменимую аминокислоту, которая не синтезируется в организме как основная α-аминокислота, и относится к типу L-аминокислоты, имеющей химическую формулу NH2(CH2)4CH(NH2)COOH. Биосинтез L-лизина начинается с щавелевоуксусной кислоты и происходит через лизиновый путь биосинтеза, и NADPH-зависимая редуктаза катализирует промежуточный процесс в биосинтезе лизина. В процессе биосинтеза одной молекулы L-лизина ферменты переработки сахаров непосредственно потребляют три молекулы NADPH, и одна молекула NADPH используется опосредованно.
Микроорганизм может содержать варианты белка-репрессора глюконата вследствие мутации, или он может быть трансформирован вектором, содержащим полинуклеотид, кодирующий вариант белка-репрессора глюконата.
Микроорганизм включает белок, обладающий мутантной активностью белка-репрессора глюконата, либо прокариотический микроорганизм, либо эукариотический микроорганизм, если микроорганизм трансформирован таким образом, что экспрессируется белок гликозилтрансфераза. Например, могут выть включены штаммы микроорганизмов, такие как штаммы рода Escherichia, рода Erwinia, рода Serratia, рода Providencia, рода Enterobacteria, рода Salmonella, рода Streptomyces, рода Pseudomonas, рода Brevibacterium или рода Corynebacterium и так далее. В частности, они могут представлять собой микроорганизмы, принадлежащие роду Corynebacterium, и более конкретно, Corynebacterium glutamicum, но не ограничены этим.
Когда мутантный белок белка-репрессора глюконата по настоящему изобретению содержится в микроорганизме-продуценте L-лизина, способность продуцировать L-лизин может быть увеличена путем эффективного потребления сахарида по сравнению с микроорганизмом, содержащим белок-репрессор глюконата дикого типа.
Микроорганизм-продуцент L-лизина может включать любой тип микроорганизма, если он обладает способностью продуцировать L-лизин, и включает все формы природных штаммов и рекомбинантных штаммов.
Микроорганизм рода Corynebacterium, способный продуцировать L-лизин, может представлять собой мутантный штамм, устойчивый к аналогу L-лизина. Аналоги L-лизина ингибируют рост микроорганизмов-коринебактерий, но такое ингибирование полностью или частично устраняется, когда в среде одновременно присутствует L-лизин. Примеры аналогов L-лизина включают окса-L-лизин, L-лизин-гидроксамат, S-(2-аминоэтил)-L-цистеин (АЕС), γ-метил-L-лизин, α-хлоркапролактам и так далее, но не ограничены ими. Вариант, обладающий устойчивостью к таким аналогам L-лизина, может быть получен путем обработки микроорганизма рода Corynebacterium традиционным методом искусственного мутагенеза, но не ограничиваясь этим. Неограничивающие примеры этого включают Corynebacterium glutamicum КССМ11016Р (Регистрационный No. патента Кореи 10-0159812), Corynebacterium glutamicum KFCC 11001 и Corynebacterium glutamicum KCCM11347P (Регистрационный No. патента Кореи 10-0073610), но не ограничены ими.
Дополнительно, микроорганизм рода Corynebacterium, обладающий способностью продуцировать L-лизин, может быть модифицирован таким образом, что активность белка, связанного с биосинтезом L-лизина, усилена по сравнению с немодифицированными штаммами. То есть экспрессия одного или более чем одного типа генов, связанных с биосинтезом L-лизина, усилена. Такое усиление экспрессии может включать, без ограничения, амплификацию гена, замену или изменение последовательностей, таких как промоторы или инициирующие кодоны, введение модификаций для улучшения экспрессии и так далее. Неограничивающие примеры этого включают Corynebacterium glutamicum CJ3P (Binder et al. Genome Biology 2012, 13:R40), но не ограничены этим.
Дополнительно примеры гена, связанного с биосинтезом L-лизина, включают гены, вовлеченные в путь биосинтеза L-лизина, и в частности, ген синтазы дигидродипиколиновой кислоты (dapA), ген аспартокиназы (lysC), ген редуктазы дигидродипиколиновой кислоты (dapB), ген диаминопимелат-декарбоксилазы (lysA), ген диаминопимелат-дегидрогеназы (ddh), ген фосфоенолпируват-карбоксилазы (ррс), ген аспартат-полуальдегид-дегидрогеназы (asd), ген аспартазы (aspA) и пируваткарбоксилазы (рус), но не ограничены ими. Кроме того, может быть рассмотрена транскетолаза (tkt), присутствующая в пентозофосфатном пути, и так далее, но ген не ограничен ими.
Между тем, микроорганизм может представлять собой микроорганизм рода Corynebacterium, который может обладать способностью продуцировать L-лизин вследствие введения модификаций, известных в данной области техники, ассоциированных с продуцированием L-лизина, но не ограничен этим.
В другом аспекте настоящего изобретения предложен способ получения L-лизина, включающий: (а) культивирование микроорганизма-продуцента L-лизина в среде, и (б) выделение L-лизина из культивированного микроорганизма или из культуральной среды со стадии (а).
L-лизин и продуцирующий его микроорганизм являются такими, как описано выше.
Как его используют здесь, термин "культура" относится к культивированию микроорганизма в умеренно искусственно контролируемых условиях окружающей среды. Процесс культивирования по настоящему изобретению можно проводить в соответствии с подходящей культуральной средой и условиями культивирования, известными в данной области техники. Условия, такие как определенная температура культивирования, время инкубации и рН среды, можно выполнить в соответствии с общими знаниями специалиста в данной области техники или в соответствии с известными традиционными способами. В частности, эти известные способы культивирования описаны в следующих источниках [Chmiel; Bioprozesstechnik 1. Einfuhrung indie Bioverfahrenstechnik (Gustav Fischer Verlag, Stuttgart, 1991) и Storhas; Bioreaktoren und periphere Einrichtungen (Vieweg Verlag, Braunschweig / Wiesbaden, 1994)]. Кроме того, способ культивирования включает периодическое культивирование, непрерывное культивирование и периодическое культивирование с подпиткой. В частности, периодический процесс или периодический процесс с подпиткой или повторяющийся периодический процесс с подпиткой могут быть проведены в форме непрерывного культивирования, но процесс культивирования не ограничивается этим.
Среда, применяемая для культивирования, должна соответствовать требованиям конкретных штаммов должным образом. Источники углерода, которые можно использовать в среде, включают сахариды и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал, целлюлоза и так далее; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло, кокосовое масло и так далее; жирную кислоту, такую как пальмитиновая кислота, стеариновая кислота, линолевая кислота и так далее; глицерин; спирт, такой как этанол, и органическую кислоту, такую как уксусная кислота, но не ограничены ими. Эти вещества можно использовать по отдельности или в виде смеси, без ограничения. Источники азота, которые можно использовать, включают пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, жидкий кукурузный экстракт, соевую муку и мочевину, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония, нитрат аммония и так далее, но не ограничены ими, и источники азота также могут быть использованы по отдельности или в виде смеси. Доступные источники фосфата включают дигидрофосфат калия, гидроортофосфат калия или соответствующие натрий-содержащие соли и так далее, но не ограничены ими. Дополнительно среда для культивирования может содержать соли металлов, такие как сульфат магния или сульфат железа, но соли не ограничены ими. Наконец, в дополнение к веществам, описанным выше, могут быть использованы вещества, необходимые для роста, такие как аминокислоты и витамины. Дополнительно можно использовать предшественники, подходящие для культуральной среды. Исходные вещества, описанные выше, можно добавлять в инкубатор порциями или непрерывно в процессе инкубации, но не ограничиваясь этим.
Дополнительно, химические соединения, такие как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, могут быть подходящим образом добавлены в инкубатор во время культивирования для подведения рН культуральной среды. Во время инкубации образование пузырьков можно подавлять путем использования пеногасителей, таких как полигликолевый эфир жирной кислоты. Кроме того, для поддержания аэробных условий в инкубаторе или в инкубационной смеси в инкубатор может быть добавлен кислород или кислородсодержащий газ, или для поддержания анаэробных условий может быть введен азот, водород или углекислый газ, или газ можно не вводить. Температура инкубации обычно составляет от 20°С до 40°С, в частности от 30°С до 35°С, но не ограничена этим. Период инкубации можно продолжать вплоть до достижения желаемого количества полезного вещества, и в частности может составлять от 10 часов до 100 часов. L-лизин можно выделять из культуральной среды, или он может находиться внутри микроорганизмов.
Дополнительно, способы получения L-лизина по настоящему изобретению или способы выделения L-лизина из культуральной среды широко известны в данной области техники. Для способов выделения L-лизина можно использовать фильтрование, анионообменную хроматографию, кристаллизацию и ВЭЖХ (высокоэффективную жидкостную хроматографию) и так далее, но способы не ограничены этими примерами.
Наилучшее воплощение изобретения
Здесь и далее настоящее изобретение будет описано более подробно с помощью следующих примеров. Однако эти примеры предназначены исключительно для иллюстративных целей и не предназначены никаким образом ограничивать объем настоящего изобретения.
Пример 1: Получение библиотеки рекомбинантной геномной ДНК Corynebacterium glutamicum
В данном примере для обнаружения способности продуцировать L-лизин и генов и вариантов, которые оказывают полезное действие на продуктивность, после введения искусственных мутаций в штаммы Corynebacterium glutamicum АТСС13032 с помощью N-метил-N-нитро-N-нитрогуанидина (NTG) геномную ДНК экстрагировали с использованием методов экстракции, общеизвестных в данной области техники. Полученную ДНК подвергали действию фермента рестрикции Sau3Al для получения частичных фрагментов, имеющих размер от 1 т.п.н. до 3 т.п.н. После соединения этих фрагментов с трансформирующим челночным вектором pECCG122 в Е. coli и Corynebacterium по концам, полученным после расщепления ферментом рестрикции BamHI, ими трансформировали Е. coli DH5α и наносили на твердую среду LB, содержащую канамицин (25 мг/л). После отбора колоний, трансформированных вследствие вставки в вектор фрагментов путем ПЦР (с использованием праймеров с последовательностями SEQ ID NO: 5 и 6), всех их смешивали вместе для выделения плазмид путем общеизвестного метода выделения.


Пример 2: Введение искусственного варианта библиотеки и усиление способности продуцировать L-лизин
С использованием штамма КССМ11016Р в качестве родительского штамма (микроорганизм был раскрыт как KFCC10881 и повторно депонирован в международном органе депонирования в соответствии с Будапештским договором и получил номер доступа КССМ11016Р, Регистрационный номер патента Кореи 10-0159812) была проведена трансформация полученным вектором и нанесение на комплексную среду для чашки.
Комплексная среда для чашки
Глюкоза 20 г, (NH4)2SO4 50 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 5 г, K2HPO4 10 г, MgSO4 7H2O 0,5 г, биотин 100 мкг, соль тиаминхлорид 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 2000 мкг, агар 20 г и канамицин 25 мг (1 л дистиллированной воды).
Примерно 10000 колоний высевали на каждые 300 мкл селективной среды и культивировали в течение примерно 16 часов при 1000 об/мин при 32°С в 96-луночном планшете с глубокими лунками. Для анализа уровня продукции L-лизина, продуцируемого во время культивирования, применяли нингидриновый метод (J. Biol. Chem. 1948. 176:367-388). После завершения культивирования проводили реакцию между 10 мкл культурального супернатанта и 190 мкл раствора для нингидриновой реакции (63% глицерин, 27% раствор нингидрина) при 65°С в течение 30 минут, измеряли поглощение при длине волны 570 нм с помощью спектрофотометра и сравнивали с поглощением в контрольной группе (KCCM11016P/pECCG122); было отобрано 248 типов варианта штамма, демонстрирующих похожее или повышенное поглощение. Во время культивирования в этих условиях, поскольку штамм из контрольной группы имел остаточный сахар от 1 г/л до 2 г/л, скорость потребления сахара в контрольной группе была высокой, и можно было отобрать штаммы с повышенной способностью продуцировать лизин.
Селективная среда (рН 8,0)
Глюкоза 10 г, сульфат аммония 5,5 г, MgSO4⋅7H2O 1,2 г, KH2PO4 0,8 г, K2HPO4 16,4 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг и никотинамид 2000 мкг (1 л стандарта - дистиллированной воды).
Дополнительно, на основе 248 выбранных типов штаммов способ выполняли в повторах. В результате были выбраны варианты штаммов 29 типов из вышеупомянутых, которые имели способность продуцировать L-лизин, увеличенную более чем на 10% по сравнению со штаммом KCCM11016P/pECCG122.
Пример 3: Способность выбранных искусственных вариантов штаммов продуцировать L-лизин и анализ скорости потребления сахара
29 выбранных типов штаммов из Примера 2 культивировали в соответствии с описанным ниже способом и анализировали на способность продуцировать L-лизин и скорость потребления сахара.
Каждый штамм высевали в колбу на 250 мл с угловыми перегородками и культивировали при покачивании при 30°С в течение 20 часов при 200 об/мин. После этого 1 мл культурального раствора штамма высевали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды. Концентрацию L-лизина анализировали посредством ВЭЖХ, и для измерения скорости потребления сахара штаммов и их продуктивности измеряли остаточную концентрацию сахара в культуральной среде с течением времени.
Среда для выращивания штамма (рН 7,0)
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 2000 мкг (1 л стандарта-дистиллированной воды).
Продукционная среда (рН 7,0)
Глюкоза 100 г, (NH4)2SO4 40 г, соевый белок 2,5 г, твердая фракция кукурузного экстракта 5 г, мочевина 3 г, KH2PO4 1 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, соль тиамин-хлорид 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 3000 мкг и СаСО3 30 г (1 л стандарта - дистиллированной воды).
Среди вариантов штаммов 29 типов концентрация L-лизина по сравнению с контрольной группой была выше эквивалентного уровня, и были выбраны три типа штаммов с повышенной скоростью потребления сахара и продуктивностью для повторного выполнения культивирования и анализа, и проанализированные результаты представлены в Таблице 1.
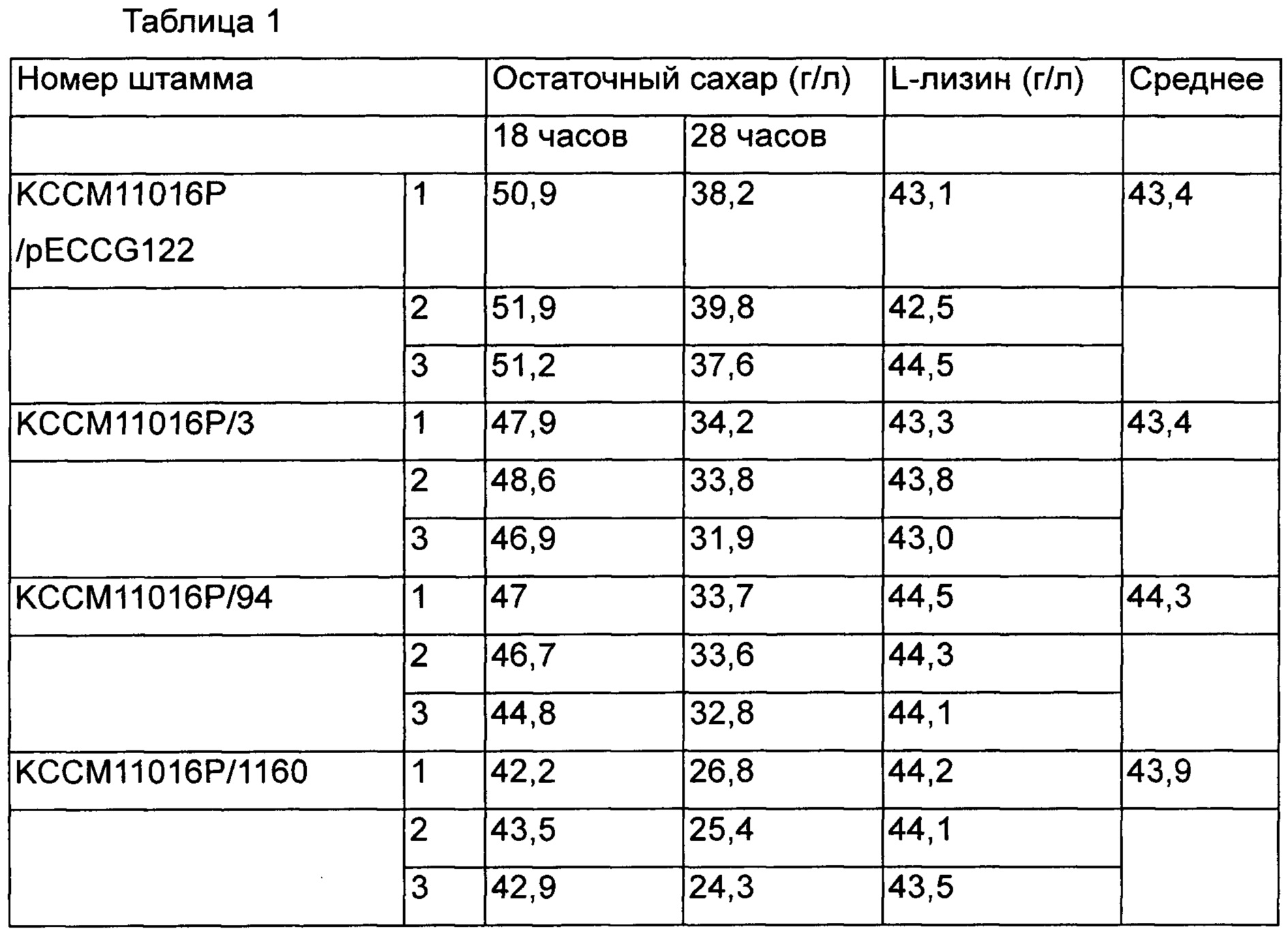
Было подтверждено, что три штамма продуцировали L-лизин на уровне выше эквивалентного уровня контрольной группы, и скорость потребления в единицу времени была увеличена путем улучшения продуктивности ферментирования. Среди отобранных вариантов штаммов был выбран в итоге штамм КССМ11016Р/1160 с наиболее значимо повышенной продуктивностью, и были выделены плазмиды для поиска мутаций нуклеотидной последовательности на базовом генетическом уровне, которые вызывали увеличение скорости потребления сахара и продуктивности. Впоследствии нуклеотидные последовательности анализировали с использованием SEQ ID NO: 5 и 6. Плазмиды, происходящие из КССМ11016Р/1160, содержали участок примерно от 450 п. н. вверх по ходу транскрипции от ORF (открытой рамки считывания) инициирующего кодона гена NCgl2440 до зоны примерно 350 п. н. вниз по ходу транскрипции от терминирующего кодона. Далее, путем анализа нуклеотидной последовательности гена, основанном на информации из базы данных GenBank Национального Института Здравоохранения (NIH), было подтверждено, что ген представляет собой gntR1, который является одним из репрессоров глюконата, и вариант gntR1, который был введен в штамм КССМ11016Р/1160, содержал замену С на Т в 304ом положении нуклеотидной последовательности, и было подтверждено, что 102ая аминокислота была изменена с аргинина на цистеин.
Таким образом, было подтверждено, что аргинин, который представляет собой 102ую аминокислоту gntR1, имеющего аминокислотную последовательность SEQ ID NO: 4, был заменен на цистеин.
Пример 4: Получение вектора для введения варианта gntR1 в хромосому штамма-продуцента L-лизина
Для подтверждения эффекта применения варианта gntR1, который был подтвержден в Примере 3, был получен вектор, который может вводить его в хромосому.
На основании описанных нуклеотидных последовательностей был синтезирован праймер (SEQ ID NO: 7), в котором участок для фермента рестрикции EcoRI был вставлен на 5'-конце и участок для фермента рестрикции SalI был вставлен на 3'-конце. С помощью таких пар праймеров была проведена ПЦР с использованием плазмиды КССМ11016Р/1160 в качестве матрицы для амплификации фрагментов гена gntR1. Условия ПЦР состояли в 30-кратном повторении цикла денатурации при 94°С в течение 5 минут, денатурации при 94°С в течение 30 секунд, отжига при 56°С в течение 30 секунд и полимеризации при 72°С в течение 40 секунд, и реакцию полимеризации проводили при 72°С в течение 7 минут.
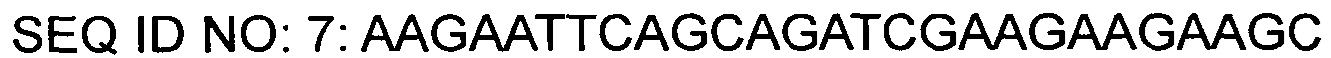
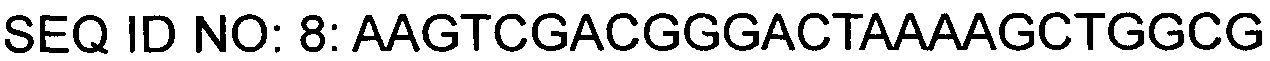
После обработки фрагментов гена, которые были амплифицированы путем ПЦР, ферментами рестрикции EcoRI и SalI, каждый фрагмент ДНК выделяли, и после его соединения с вектором pDZ (Регистрационный номер патента Кореи 10-0924065), имеющим концы, полученные с помощью ферментов рестрикции EcoRI и SalI, ими трансформировали Е. coli DH5α и переносили на твердую среду LB, содержащую канамицин (25 мг/л). После отбора колонии, которая была трансформирована вектором, в котором ген-мишень был вставлен с помощью ПЦР, была получена плазмида с использованием общеизвестного метода выделения плазмид, и в соответствии с вариантом, который был вставлен в gntR1 плазмиды, он получил название pDZ-gntR1 (R102C).
Пример 5: Получение штамма, в котором вариант gntR1 введен в КССМ11016Р, штамм-продуцент L-лизина, и сравнение продуктивности
Новым вариантом вектора для введения, полученном в Примере 4, трансформировали Corynebacterium glutamicum КССМ11016Р, который представляет собой штамм-продуцент L-лизина, в соответствии с двухстадийной гомологичной рекомбинацией хромосом. После этого штамм, в хромосому которого был введен вариант gntR1, отбирали с помощью анализа секвенирования хромосом, и штамм, в который был введен вариант gntR1, получил название KCCM11016P::gntR1(R102C).
Измеряли концентрацию L-лизина и остаточную концентрацию сахара на основании культивирования такими же способами, как в Примере 3. Дополнительно для подтверждения эффектов при культивировании на нерафинированном сахаре, для анализа с использованием тех же самых способов использовали продукционную среду на основе нерафинированного сахара вместо продукционной среды на основе глюкозы [Таблица 2].
Исходная продукционная среда на основе сахара (рН 7,0)
Нерафинированный сахар 100 г, (NH4)2SO4 40 г, соевый белок 2,5 г, твердая фракция кукурузного экстракта 5 г, фермент 3 г, КН2РО4 1 г, MgSO4⋅7 H2O 0,5 г, биотин 100 мкг, кислая соль тиамин-хлорид 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 3000 мкг, СаСО3 30 г (дистиллированная вода до уровня 1 л).

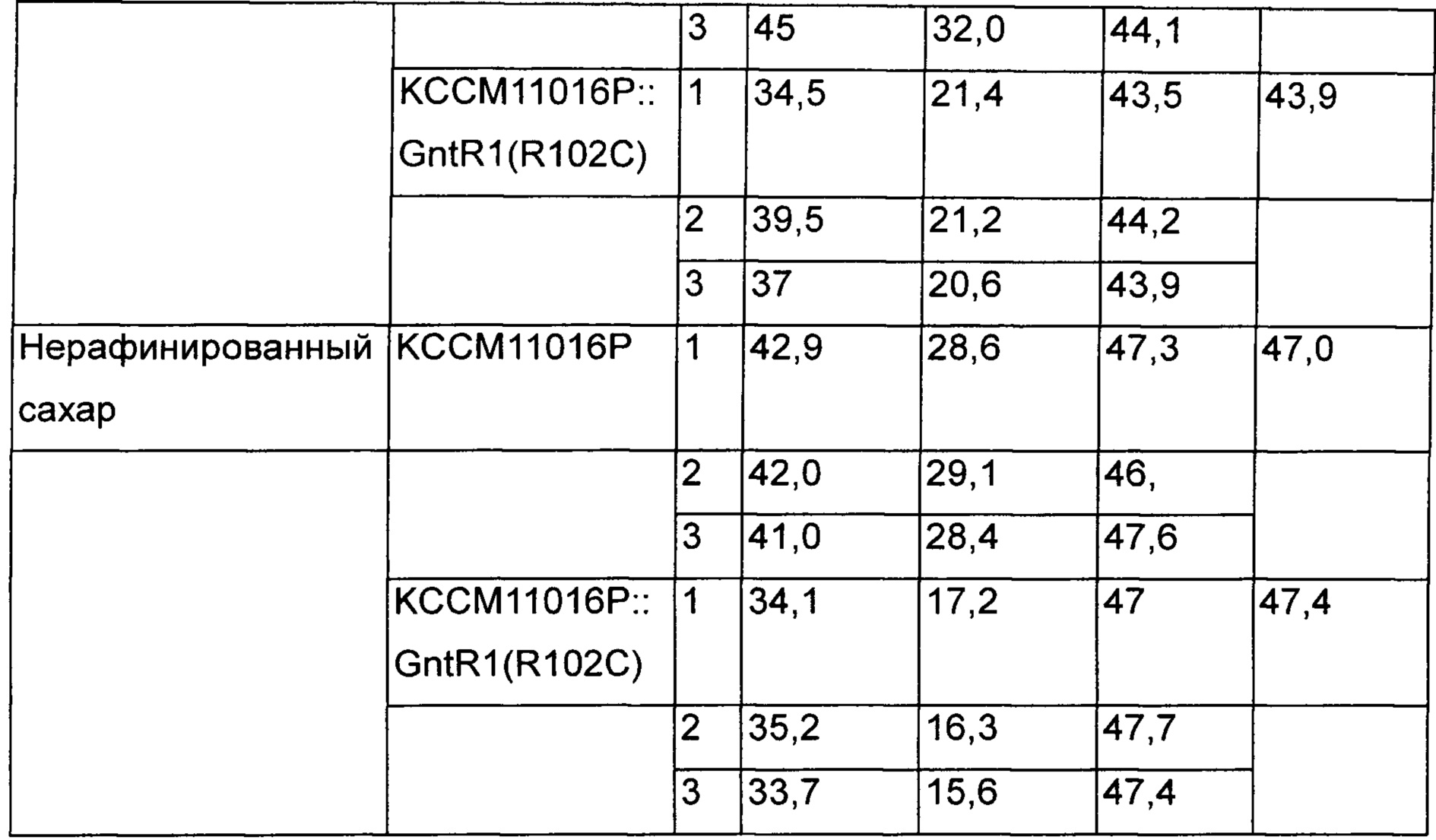
В результате было подтверждено, что скорость потребления сахара повышалась без влияния на способность продуцировать L-лизин больше у KCCM11016P::gntR1(R102C), чем у КССМ11016, который представляет собой группу сравнения в среде с глюкозой и исходной среде с сахаром. Кроме того, в результате подтверждения интервалов времени, в течение которых вся глюкоза и исходный сахар были потреблены, было показано, что в группах сравнения они были полностью потреблены через 72 часа и 68 часов, и было продуцировано 43,5 г/л и 47,0 г/л L-лизина, соответственно, а варианты штаммов с введением gntR1 продуцировали 43,9 г/л и 47,4 г/л через 60 часов и 58 часов. То есть было подтверждено, что в случае штаммов, которым был введен вариант gntR1, способность продуцировать L-лизин в зависимости от времени была увеличена на 21% и 18% в среде с глюкозой и нерафинированным сахаром, соответственно [Таблица 3].
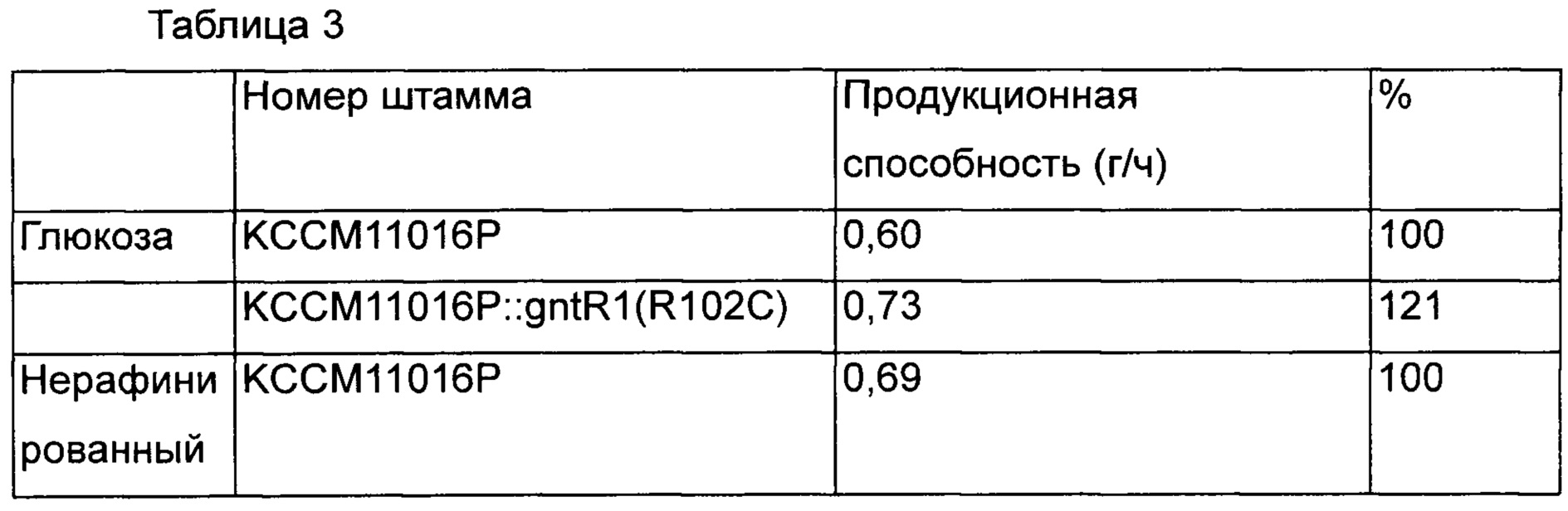

Как видно из вышеприведенных результатов, введение варианта gntR1 дает способность продуцировать L-лизин на таком же уровне и является эффективным в отношении скоростей потребления глюкозы и нерафинированного сахара. То есть, можно полагать, что введение варианта gntR1 по настоящему изобретению, дает превосходную эффективность в отношении способности продуцировать L-лизин. Как таковой KCCM11016P::gntR1(R102C), названный авторами настоящего изобретения Corynebacterium glutamicum "CA01-2293", который обладает повышенной скоростью потребления глюкозы и продуктивностью, 5 декабря 2014 депонирован в Корейском центре культур микроорганизмов (КССМ), международном органе депонирования, с номером доступа КССМ11628Р.
Пример 6: Получение штаммов, у которых вариант gntR1 введен в штамм-продуцент L-лизина, и сравнение продуктивности
Для определения эффектов других штаммов, принадлежащих Corynebacterium glutamicum, штамм, у которого вариант gntR1 введен в Corynebacterium glutamicum КССМ11347Р (микроорганизм раскрыт как KFCC10750 и повторно депонирован в международном органе депонирования согласно Будапештскому договору, и обозначен как КССМ11347Р. Регистрационный номер патента Кореи 10-0073610) был получен и назван как KCCM11347P::gntR1(R102C). Используя тот же способ, как в Примере 5, полученные штаммы культивировали и сравнивали их способность продуцировать лизин и остаточный сахар [Таблица 4].
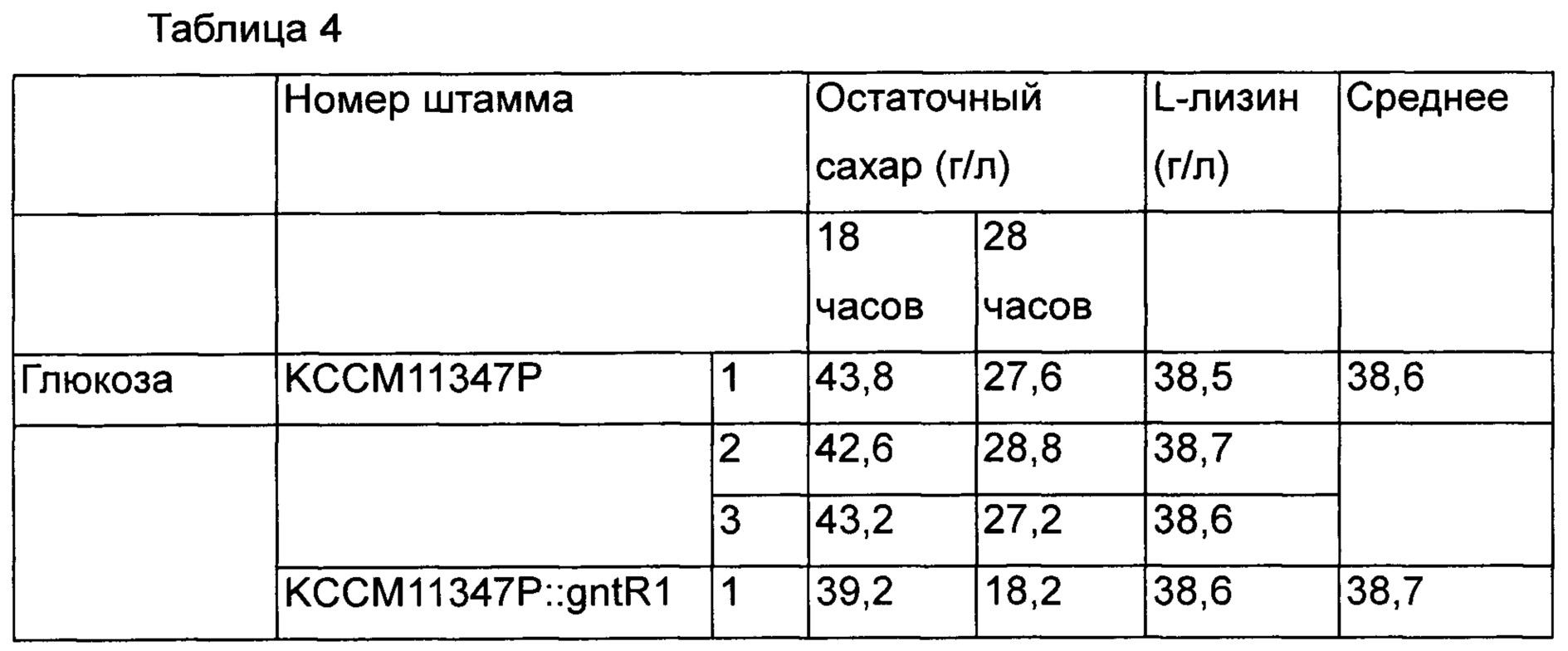

В результате, так же как в Примере 5, было подтверждено, что во всех случаях скорость потребления глюкозы была увеличена в среде с глюкозой и нерафинированным сахаром по сравнению с группой сравнения. Кроме того, в результате определения интервалов времени, в течение которых глюкоза и нерафинированный сахар были полностью потреблены, было показано, что в группе сравнения весь сахар был потреблен за 72 часа и 69 часов, и было продуцировано 38,6 г/л и 41,3 г/л L-лизина, а штамм с вариантом gntR1 продуцировал L-лизин через 61 час и 58 часов в концентрации 38,7 г/л и 41,4 г/л. То есть было подтверждено, что в случае штаммов, которым был введен вариант gntR1, продуктивность по L-лизину в зависимости от времени была увеличена на 18% и 19% в среде с глюкозой и нерафинированным сахаром, соответственно [Таблица 5].

Пример 7: Получение штамма, в котором вариант gntR1 введен в L-лизин-продуцирующий штамм CJ3P, и сравнение продуктивности
Для подтверждения эффектов других штаммов, принадлежащих Corynebacterium glutamicum, был получен штамм, в котором вариант gntR1 введен в Corynebacterium glutamicum CJ3P (Binder et al. Genome Biology 2012, 13: R40), и он получил название CJ3P::GntR1(R102C). Штамм CJ3P представляет собой штамм Corynebacterium glutamicum, обладающий способностью продуцировать L-лизин, в котором 3 типа изменений (pyc(Pro458Ser), hom(Val59Ala), lysC(Thr311Ile)) были введены в штаммы дикого типа на основе раскрытого способа. С использованием такого же способа, как в Примере 5, был получен штамм, и были измерены его способность продуцировать лизин и концентрация остаточного сахара в культуральной среде с течением времени [Таблица 6].

В результате, также как в Примерах 5 и 6, было подтверждено, что скорость потребления сахара была увеличена у варианта штамма со вставкой gntR1 по сравнению с контрольной группой. Кроме того, в результате подтверждения интервалов времени, в течение которых глюкоза и нерафинированный сахар были полностью потреблены, было показано, что глюкоза и нерафинированный сахар были полностью потреблены через 48 часов и 42 часа в контрольной группе, и L-лизин был продуцирован в концентрации 8,2 г/л и 8,8 г/л, соответственно, а штамм со вставкой gntR1(R102C) продуцировал лизин через 42 часа и 38 часов в концентрации 8,4 г/л и 9,0 г/л, соответственно. То есть, было подтверждено, что в случае штамма с введенным изменением gntR1 скорость продукции L-лизина в зависимости от времени увеличивалась на 17% и 13%, соответственно [Таблица 7].
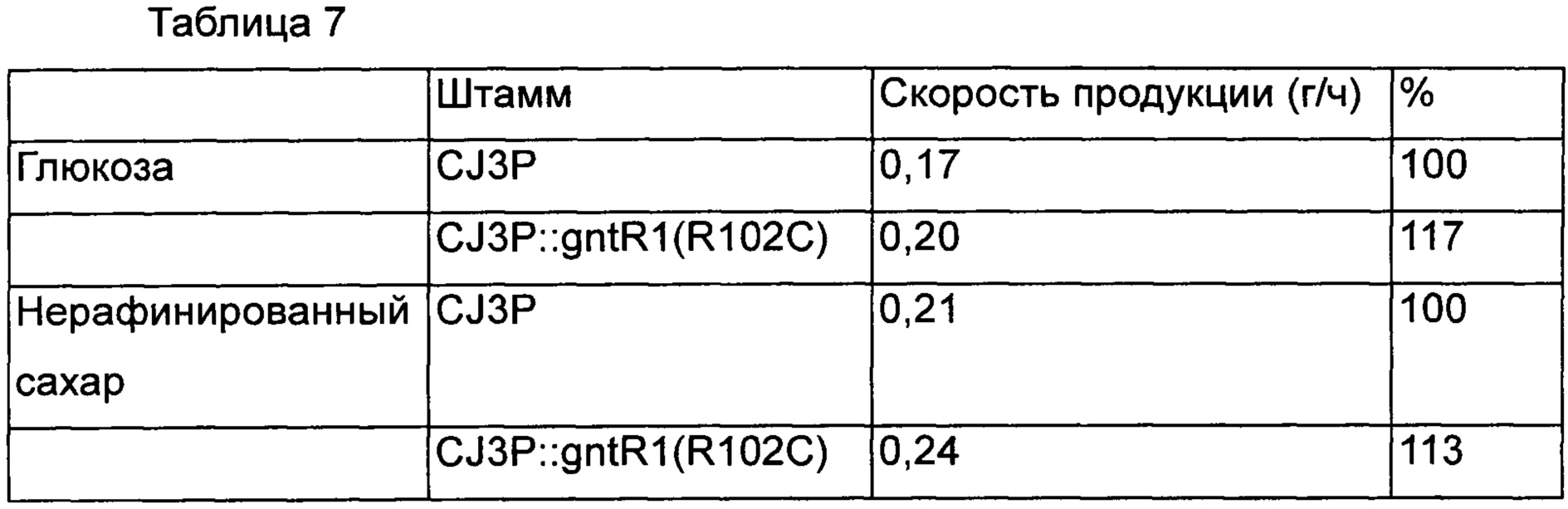
Соответственно, вышеизложенные результаты подтверждают, что когда изменение gntR1 введено в лизин-продуцирующий штамм рода Corynebacterium, вследствие увеличения скорости потребления сахара скорость продуцирования лизина эффективно увеличивается.
На основании вышеизложенного специалист в данной области техники, к которой принадлежит данное изобретение, понимает, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической идеи или существенных признаков настоящего изобретения. В этом отношении примеры воплощений, раскрытых здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. Наоборот, настоящее изобретение предназначено охватывать не только воплощения, представленные в примерах, но также различные альтернативные, модифицированные, эквивалентные и другие воплощения могут быть включены, сохраняющие идею и входящие в объем настоящего изобретения, как определено в прилагаемой формуле изобретения.

