Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ТЕТРАОКСАТИОСПИРОАЛКАНОВ
Вид РИД
Изобретение
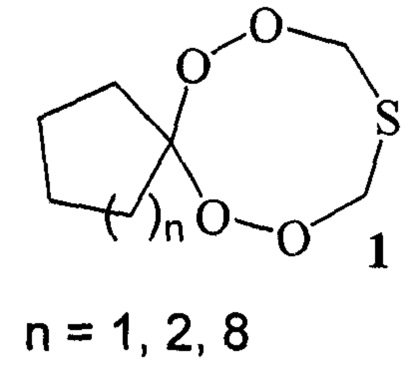
Предлагаемое изобретение относится к области органической химии, конкретно к способу получения тетраоксатиоспироалканов общей формулы
(1):
Фрагмент восьмичленного циклического азапероксида содержит биологически активный алкалоид фумитреморгин (fumitremorgins) Verruculogen, который производится грибами рода Penicilfium verrucutosum [Cole, R.J.; Kirksey, J.W.; Moore, J.H.; Blankenship, B.R.; Diner, U.L.; Davis N.D. J. Appl. Microbiol. 1972, 24, 248-250], Aspergillus caepitosus [Schroeder, H.W.; Cole, R.J.; Hein, H.; Kirksey, J.W. J Appl. Microbiol. 1975, 29, 857-858], A. fumigatus [Dorner, J.W.; Cole, R.J.; Hill, R.A. J. Agric. Food. Chem. 1984, 32, 411-413], A. fisheri [Patterson, D.S.P.; Shreeve, B.J.; Roberts, B.A.; MacDonald, S.M. Appl. Environ. Microbiol. 1981, 42, 916-917], Penicillum piscarium [Gallagher, R.T.; Latch, G.C.M. Appl. Environ. Microbiol. 1977, 33, 730-731], P. paxilli [Cockrum, P.A.; Culvenor, C.C.J.; Edgar, J.A.; Payne, A.L. J. Nat. Prod. 1979, 42, 534-536], P. estinogenum [Day, J.B.; Mantle, P.G.; Show, B.I. J. Gen. Microbiol. 1980, 117, 405-410], P. simplicissmum, P. piceum, P. nigricans, P. raistricki [Day, J.B.; Mantle, P.G, Appl. Environ. Microbiol. 1982, 43, 514-516], Eupenicillium sp. [Y. Horie, Y. Maebayashi, and M. Yamazaki, Maikotokishin (Tokyo), 1985, 22, 35 (Chem. Abstr., 1986, 105, 3148)] и Neosartorya fischeri [Nelsen, P.V.; Beuchat, L.R.; Frisvad J.C. // Appl. Environ. Microbiol. 1988, 54, 1504-1510].
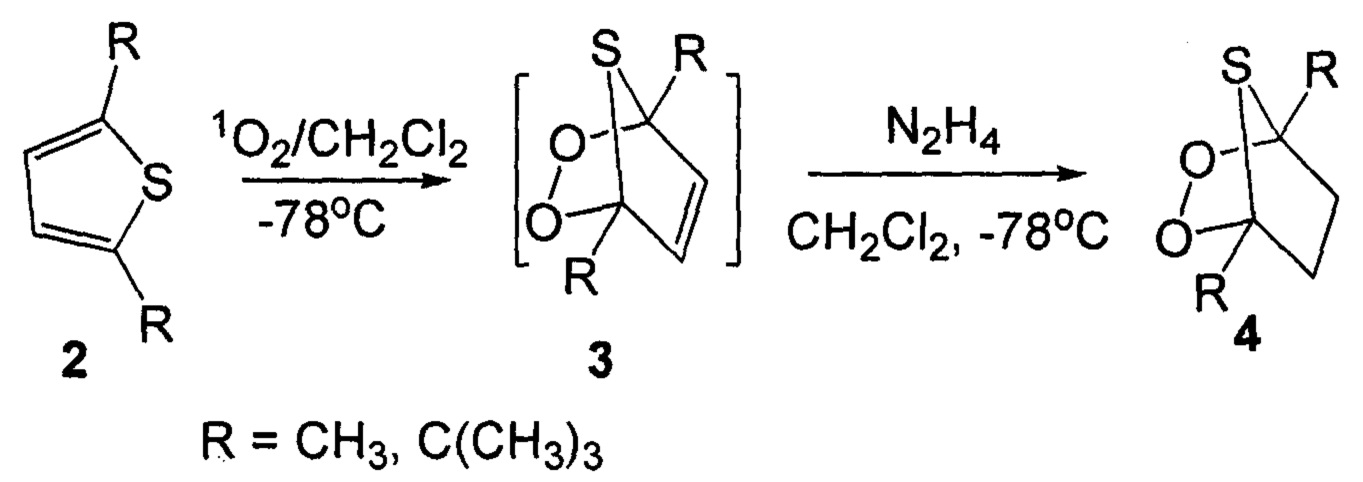
Известен способ получения 1,4-диалкил-2,3-диокса-7-тиабицикло[2.2.1]гептана формулы 4 фотоокислением раствора соответствующих 2,5-диалкилтиофена 2 в хлористом метилене при -78°С с последующим восстановлением тиоозонида 3 (Waldemar Adam, Henny J. Eggelte // Angew. Chem. - 1978. - 90. - P. 811) по схеме:
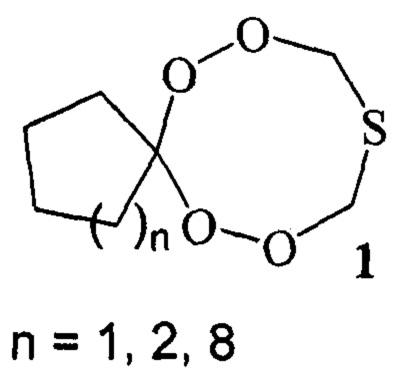
Известным способом не могут быть получены тетраоксатиоспироалканы общей формулы (1).
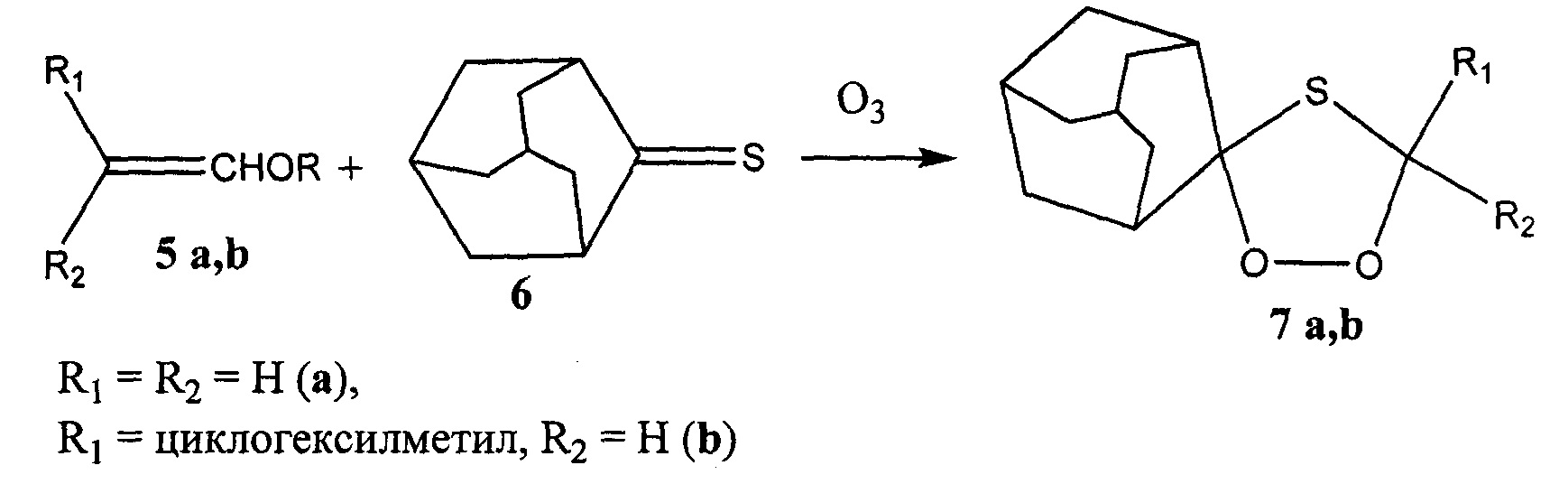
Известен способ получения тиоозонидов 7 а,b с выходом до 70% озонолизом виниловых эфиров 5 a,d в присутствии тиоадамантан-2-она 6 (Т. Tabuchi, М. Nojima, and S. Kusabayashi // J. Chem. Soc., Chem. Commun. - 1990.- P. 625-627).
Известным способом не могут быть получены тетраоксатиоспироалканы общей формулы (1).
Известен способ получения тиоозонида формулы 9 фотоокислением 2,5-диметилтиофена 8 в присутствии тетрафенилпорфирина (ТРР) в хлористом метилене при температуре 13°С (K. Gollnick, A. Griesbeck // Tetrahedron Lett. - 1984. - V. 25. - №43. - P. 4921-4924).
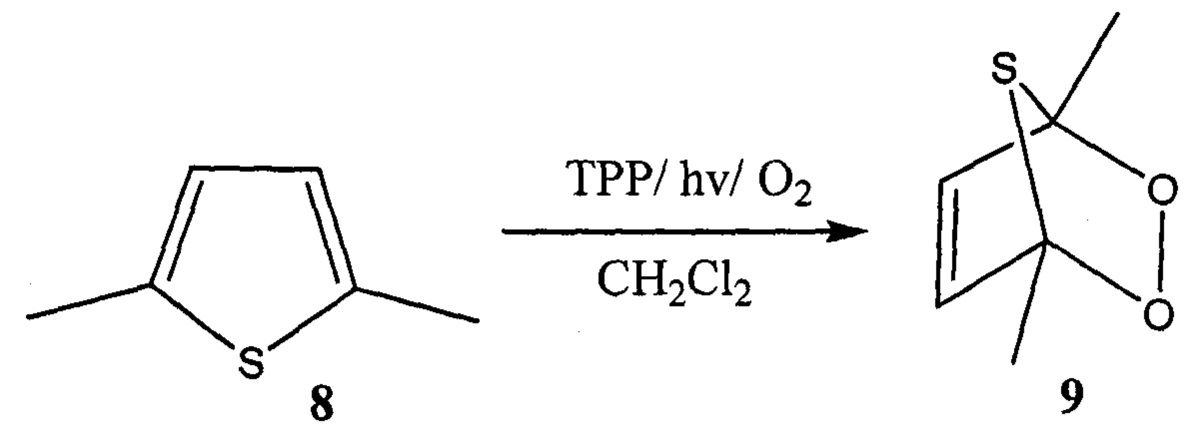
Известным способом не могут быть получены тетраоксатиоспироалканы общей формулы (1).
Таким образом, в литературе отсутствуют сведения о способах получения тетраоксатиоспироалканов формулы (1).
Предлагается новый способ селективного получения тетраоксатиоспироалканов общей формулы (1).
Сущность способа заключается во взаимодействии пентаоксаспироалканов (6,7,9,11,12-пентаоксаоспиро[4.7]додекан или 7,8,10,12,13-пентаоксаспиро[5.7]тридекан или 1,2,4,6,7-пентаоксаспиро[7.11]нонадекан) с сероводородом в присутствии катализатора Ho(NO3)3⋅6H2O, взятыми в мольном соотношении пентаоксаспироалкан : сероводород : Ho(NO3)3⋅6H2O=10 : 20 : (0.03-0.07), предпочтительно 10 : 20 : 0.5, при комнатной температуре (~20°С) и атмосферном давлении в тетрагидрофуране в качестве растворителя в течение 4-6 ч, предпочтительно 5 ч. Выход тетраоксатиоспироалканов (1) составляет 85-98%. Реакция протекает по схеме:
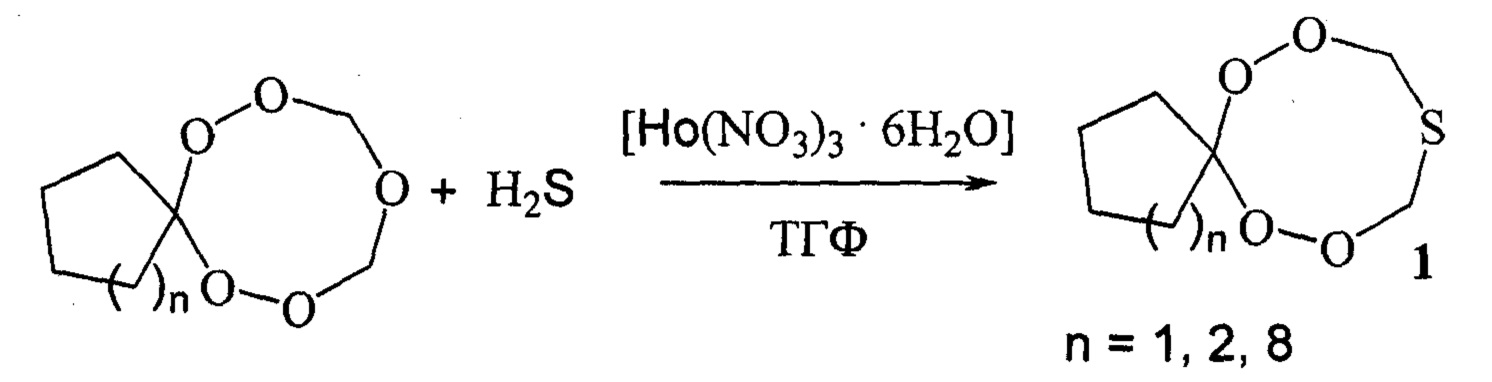
Тетраоксатиоспироалканы (1) образуются только лишь с участием пентаоксаспироалканов и сероводорода. В присутствии других S-содержащих соединений (например, Na2S, NaHS) целевые продукты (1) не образуются. Без катализатора реакция не идет.
Проведение указанной реакции в присутствии катализатора Ho(NO3)3⋅6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Ho(NO3)3⋅6H2O менее 3 мол. % снижает выход продукта (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°С. При температуре выше 20°С (например, 60°С) снижается селективность реакции и увеличиваются энергозатраты, а при температуре ниже 20°С (например, -10°С) снижается скорость реакции. Опыты проводили в тетрагидрофуране, т.к. в нем хорошо растворяются исходные реагенты.
Существенные отличия предлагаемого способа:
В известном способе реакция озонолиза идет с участием в качестве исходных соединений виниловых эфиров в присутствии тиоадамантан-2-она. Способ не позволяет получать тетраоксатиоспироалканы общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются пентаоксаканы, сероводород и Ho(NO3)3⋅6H2O в каталитических количествах. В отличие от известных предлагаемый способ позволяет получать индивидуальные тетраоксатиоспироалканы общей формулы (1).
Способ поясняется следующими примерами:
Синтез исходного 7,8,10,12,13-пентаоксаспиро[5.7]тридекана. В сосуд Шленка, установленный на магнитной мешалке, при температуре ~20°С помещают 5 мл тетрагидрофурана, 1.46 мл (20 ммоль) водного раствора (37%) формальдегида и 1.34 г (10 ммоль) 1,1-дигидропероксициклопентан (D. Azarifar, Z. Najminejad, K. Khosravi. Synthetic Commun. 2013, 43, 826-836), затем добавляют 0.02 г (0.05 ммоль) Sm(NO3)3⋅6H2O. Реакционную смесь перемешивают при температуре ~20°С в течение 5 ч, выделяют 3-гексил-3-метил-1,2,4,5,7-пентаоксакан с выходом 90% (N.N. Makhmudiyarova, G.M. Khatmullina, R.Sh. Rakhimov, A.G. Ibragimov, and U.M. Dzhemilev. Arkivoc, 2016, V, pp. 427-433).
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, помещают 5 мл тетрагидрофурана, 1.76 г (10 ммоль) 7,8,10,12,13-пентаоксаспиро[5.7]тридекана (N.N. Makhmudiyarova, G.M. Khatmullina, R.Sh. Rakhimov, A.G. Ibragimov, and U.M. Dzhemilev. Arkivoc, 2016, V, pp. 427-433), 0.05 ммоль Ho(NO3)3⋅6H2O, перемешивают в течение 1 часа, затем барботируют сероводород количестве 0.64 г (20 ммоль) в течение 3 часов при 20°С. Из реакционной массы выделяют 7,8,12,13-тетраокса-10-тиаспиро[5.7]тридекан с выходом 92%.
Другие примеры, подтверждающие способ, приведены в табл. 1.
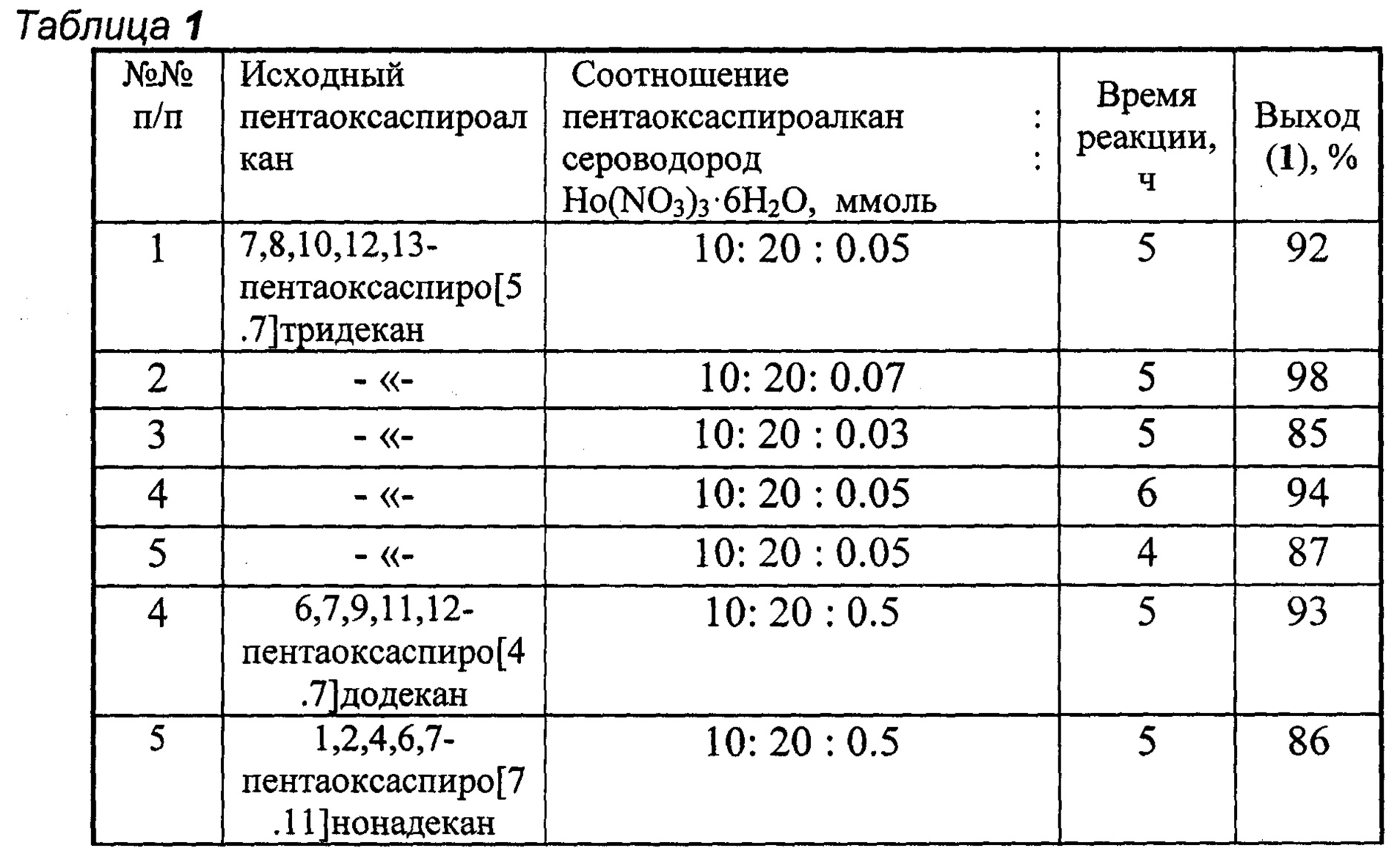
Все опыты проводили в тетрагидрофуране при комнатной температуре (~20°С).
6,7,11,12-Тетраокса-9-тиаспиро[4.7]додекан. Rf 0.74 (PE/Et2O=10/1). 1Н ЯМР (400 MHz, CDCl3, 25°С): δ=1.43-1.58 (м, 4Н, СН2), 1.78-1.99 (м, 4Н, СН2), 5.18-5.22 (м, 4Н, СН2). 13С ЯМР (100 MHz, CDCl3, 25°С): δ=22.4, 24.5, 25.3, 29.7, 29.5, 33.0, 81.8, 81.9, 82.3, 110.1, 110.5. MALDI TOF/TOF, m/z: 191 [М-Н]+ Вычислено для C7H12O4S: С, 43.74; Н, 6.29; S, 16.68%. Найдено С, 43.72; Н, 6.27; S, 16.66%.
7,8,12,13-Тетраокса-10-тиаспиро[5.7]тридекан. Rf 0.76 (PE/Et2O=10/1). 1Н ЯМР (400 MHz, CDCl3, 25°С): δ=1.45-1.62 (м, 6Н, СН2), 1.74-1.90 (м, 4Н, СН2), 5.20 (с, 4Н, СН2). 13С ЯМР (100 MHz, CDCl3, 25°С): δ=22.4, 25.3, 24.9, 25.4, 29.5, 29.8, 81.8, 110.1, 110.5. MALDI TOF/TOF, m/z: 205 [М-Н]+. Вычислено для C8H14O4S: С, 46.59; Н, 6.84; S, 15.54%. Найдено С, 46.58; Н, 6.82; S, 15.52%).
1,2,6,7-Тетраокса-4-тиаспиро[7.11]нонадекан. Rf 0.78 (PE/Et2O=10/1). 1H ЯМР (400 MHz, CDCl3, 25°C): δ=1.27-1.81 (м, 22H, CH2), 5.17-5.20 (м, 4H, CH2). 13C ЯМР (100 MHz, CDCl3, 25°C): δ=19.3, 21.8, 22.2, 22.3, 22.6, 24.2, 24.6, 24.7, 25.9, 26.0, 26.1, 26.2, 26.9, 82.4, 83.6, 113.9. MALDI TOF/TOF, m/z: 289 [M-H]+. Вычислено для C14H26O4S: С, 57.90; H, 9.02; S, 11.04%. Найдено С, 57.88; Н, 9.00; S, 11.01%.