Результат интеллектуальной деятельности: АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 62/057,541, поданной 30 сентября 2014 года, и предварительной заявки на патент США 62/172,511, поданной 8 июня 2015 года, содержание которых настоящим полностью включено посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антителам против PD-L1 собаки, обладающим специфическими свойствами. Настоящее изобретение также относится к канинизированным антителам против PD-L1 собаки, имеющим определенные последовательности и высокую аффинность связывания с PD-L1 собаки. Настоящее изобретение также относится к эпитопам PD-L1 собаки, которые связываются с указанными антителами, а также к антителам против PD-L1 собаки, связывающим эти эпитопы. Изобретение также относится к применению антител настоящего изобретения в лечении собак, включая лечение рака.
УРОВЕНЬ ТЕХНИКИ
Иммуноингибиторный рецептор, который, прежде всего, экспрессируется на активированных T и В-клетках, Рецептор программируемой клеточной смерти 1, также называемый Рецептором программируемой смерти 1 (PD-1), является членом суперсемейства иммуноглобулинов, связанных с CD28 и белком цитотоксических Т-лимфоцитов 4 (CTLA-4). PD-1 и подобные представители семейства являются трансмембранными гликопротеинами 1-го типа, содержащими внеклеточный домен Ig-вариабельного типа (V-тип), который связывает его лиганды, и цитоплазматический хвост, связывающий сигнальные молекулы. Цитоплазматический хвост PD-1А содержит два сигнальных тирозиновых мотива, ITIM (иммунорецепторный тирозиновый ингибирующий мотив) и ITSM (иммунорецепторный тирозиновый переключающий мотив).
PD-1 ослабляет Т-клеточные реакции при связывании с лигандом программируемой клеточной смерти 1, также называемым лигандом программируемой смерти 1 (PD-L1), и/или лигандом программируемой клеточной смерти 2, также называемым лигандом программируемой смерти 2 (PD-L2). Связывание любого из этих лигандов с PD-1 негативно регулирует антигенную сигнализацию рецептора. Блокирование связывания PD-L1 с PD-1 усиливает опухолеспецифический CD8+ Т-клеточный иммунитет и способствует элиминации опухолевых клеток иммунной системой. Была описана трехмерная структура мышиного PD-1, а также сокристаллическая структура PD-1Е мыши с PD-L1 человека [Zhang et al., Immunity 20: 337-347 (2004); Lin et al., Proc. Natl. Acad. Sci. USA 105: 3011-3016 (2008)].
PD-L1 и PD-L2 являются трансмембранными лигандами 1-го типа, содержащими и IgV- и IgC-подобные домены во внеклеточной области в сочетании с короткими цитоплазматическими областями, не содержащими известных сигнальных мотивов. PD-L1 и PD-L2 экспрессируются конститутивно или могут быть индуцированы во многих типах клеток, в том числе негемопоэтических тканях, а также различных типах опухолей. PD-L1 не только экспрессируется на B, T, миелоидных и дендритных клетках (ДК), но также и на периферических клетках, таких как эндотелиальные клетки капилляров и нелимфоидные органы, например, сердце или легкое. Напротив, PD-L2 обнаружен только на макрофагах и ДК. Профиль экспрессии лигандов PD-1 указывает, что PD-1 играет роль в поддержании периферической толерантности и может также служить для регуляции аутореактивных T- и B-клеточных ответов в периферии.
В любом случае, теперь совершенно ясно, что PD-1 и PD-L1 играют важные роли, по меньшей мере, при некоторых онкологических заболеваниях человека, по-видимому, опосредуя иммунное ускользание. Таким образом, было показано, что PD-L1 экспрессировался на некоторых опухолях мыши и человека, и может быть индуцирован IFN-γ в большинстве линий PD-L1 отрицательных опухолевых клеток [Iwai et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002); Strome et al., Cancer Res., 63: 6501-6505 (2003)]. Кроме того, экспрессия PD-1А на инфильтрирующих опухоль лимфоцитах и/или PD-L1 на опухолевых клетках была обнаружена в ряде биопсий первичных человеческих опухолей. Такие опухолевые ткани включают раковые опухоли легкого, печени, яичника, шейки матки, кожи, толстой кишки, глиому, мочевого пузыря, молочной железы, почки, пищевода, желудка, плоскоклеточные полости рта, из уротелиальных клеткок и поджелудочной железы, а также опухоли головы и шеи [Brown et al., J. Immunol. 170: 1257-1266 (2003); Dong et al., Nat. Med. 8: 793-800 (2002); Wintterle et al., Cancer Res. 63: 7462-7467 (2003); Strome et al., Cancer Res., 63: 6501-6505 (2003); Thompson et al., Cancer Res. 66: 3381-5 (2006); Thompson et al., Clin. Cancer Res. 13: 1757-1761 (2007); Nomi et al., Clin.Cancer Res. 13: 2151-2157 (2007)]. Более примечательно то, что экспрессия PD-лиганда на опухолевых клетках коррелировала с неблагоприятным прогнозом у больных раком людей с различными типами опухолей [см. обзор Okazaki and Honjo, Int. Immunol. 19: 813-824 (2007)].
Кроме того, Номи с сотр. [Nomi et al., Clin. Cancer Res. 13: 2151-2157 (2007)] продемонстрировали терапевтическую эффективность блокирования связывания PD-L1 с PD-1 в модели агрессивного рака поджелудочной железы на мышах при введении антитела, направленного против PD-1 или PD-L1. Эти антитела эффективно активировали инфильтрацию опухолереактивных CD8+ Т-клеток в опухоль, приводящую к апрегуляции противоопухолевых эффекторов, включающих IFN-γ, гранзим B и перфорин. Аналогичным образом, применение антител для блокирования связывания PD-L1 и PD-1 значительно ингибировало рост опухоли в модели мышиной плоскоклеточной карциномы [Tsushima et al., Oral Oncol. 42: 268-274 (2006)].
В других исследованиях трансфекция линии мышиной мастоцитомы PD-L1 приводила к пониженному лизису опухолевых клеток при сокультивировании с опухолеспецифическим клоном ЦТЛ. Лизис восстанавливался при добавлении моноклонального антитела против PD-L1 [Iwai et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002)]. Было показано, что блокирование взаимодействия PD1/PD-L1 in vivo увеличивало эффективность терапии с адоптивным переносом Т-клеток в модели опухоли на мышах [Strome et al., Cancer Res. 63: 6501-6505 (2003)]. Другое подтверждение роли PD-1А и PD-L1 в лечении рака было получено из экспериментов, проведенных на мышах с нокаутом PD-1, у которых миеломные клетки, экспрессирующие PD-L1, росли только у животных дикого типа (что приводило к росту опухоли и последующей гибели животных), но не у PD-1 дефицитных мышей [Iwai Y. et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002)]. Совсем недавно гуманизированные мышиные моноклональные антитела против человеческого PD-1 показали первоначальный успех в терапии рака у людей [см., например, US 8,354,509 B2, US 8,008,449 B2 и US 7,595,048 B2].
Антитела против PD-L1 также могут применяться при хронической вирусной инфекции. CD8+ Т-клетки памяти, полученные после острой вирусной инфекции, обладают высокой функциональностью и составляют важный компонент защитного иммунитета. В то же время, хронические инфекции часто характеризуются различными степенями функционального нарушения (истощения) вирусспецифических T-клеточных ответов, причем такой дефект является основной причиной неспособности организма-хозяина уничтожать персистирующий патоген. Хотя функциональные эффекторные Т-клетки первоначально образуются на ранних стадиях инфекции, они постепенно теряют функцию при хроническом течении инфекции. Барбер с сотр. [Barber et al., Nature 439: 682-687 (2006)] показали, что у мышей, зараженных лабораторным штаммом LCMV, развивалась хроническая инфекция, которая приводила к высоким уровням вируса в крови и других тканях. У этих мышей первоначально развивался сильный T-клеточный ответ, но, в конечном счете, они погибали от инфекции после истощения T-клеток. Барбер с сотр. обнаружили, что снижение количества и функции эффекторных T-клеток у мышей с хронической инфекцией могло быть устранено путем введения антитела, которое блокировало взаимодействие между PD-1 и PD-L1.
Антитела собак (также называемые иммуноглобулином G или IgG) являются крупными тетрамерными белками массой приблизительно 150 кДа. Каждый белок IgG состоит из двух идентичных легких цепей приблизительно по 25 кДа каждая и двух идентичных тяжелых цепей приблизительно по 50 кДа каждая. Существует четыре известных субкласса тяжелых цепей IgG собак, они называются IgGA, IgGB, IgGC и IgGD. Существует два типа легких цепей: каппа и лямбда цепи. Каждая из легких цепей каппа или лямбда состоит из одного вариабельного домена (VL) и одного константного домена (CL). Каждая из двух тяжелых цепей состоит из одного вариабельного домена (VH) и трех константных доменов, называемых CH-1, CH-2 и CH-3. Домен CH-1 связан с доменом CH-2 через аминокислотную последовательность, называемую "шарниром" или, в альтернативе, "шарнирной областью". У людей IgG существует в одном из четырех субклассов, называемых IgG1, IgG2, IgG3 и IgG4. Субкласс IgG определяется в основном последовательностью шарнирной области, которая отличается у четырех субклассов IgG. Две тяжелых цепи связаны друг с другом дисульфидными связями, причем каждая тяжелая цепь связана с одной из легких цепей также через дисульфидную связь.
Расщепление антител IgG ферментом папаином разрушает молекулу антитела в шарнирной области и приводит к образованию трех фрагментов. Два из этих фрагментов являются идентичными, причем каждый такой фрагмент состоит из легкой цепи, удерживаемой с VH и CH1 доменами тяжелой цепи. Эти фрагменты называют "Fab" фрагментами, при этом они содержат антигенсвязывающие участки антитела. Третий фрагмент, получаемый при расщеплении папаином, называют "Fc", при этом он содержит остальную часть двух тяжелых цепей, соединенную дисульфидными связями. Таким образом, Fc содержит димер, состоящий из CH2 и CH3 домена каждой из двух тяжелых цепей. Тогда как Fab позволяет антителу связываться с его когнатным эпитопом, Fc позволяет антителу опосредовать функции иммунного эффектора, такие как антителозависимую клеточную цитотоксичность (ADCC), антителозависимый фагоцитоз (ADCP) и комплементзависимую цитотоксичность (CDC).
Из уровня техники известно, что IgG антитела опосредуют эффекторные функции, такие как ADCC и ADCP, при связывании их Fc фрагмента с семейством белков, известных как Fcγ рецепторы, тогда как CDC опосредуется при связывании Fc с первым компонентом комплемента, C1q. Также из уровня техники хорошо известно, что различные субклассы IgG отличаются по своей возможности опосредовать такие эффекторные функции. Например, человеческий IgG1 демонстрирует сильный ADCC и CDC, тогда как IgG4 демонстрирует от слабого ADCC и CDC до их отсутствия. Кроме того, способы идентификации того, какой из субклассов IgG проявляет эффекторные функции или нет, известны в уровне техники.
Методы, основанные на применении моноклональных антител в терапевтических целях, требуют создания специфических антител или фрагментов антител для достижения требуемой терапевтической реакции. Например, некоторые методы лечения рака требуют, чтобы терапевтические антитела обладали улучшенными эффекторными функциями, тогда как другие методы требуют, чтобы эффекторные функции были значимо уменьшены или полностью устранены. Улучшение или устранение эффекторных функций может быть достигнуто путем введения одной или более аминокислотных мутаций (замен) в Fc-фрагмент антитела для увеличения или уменьшения связывания с Fcγ рецепторами и первым компонентом комплемента. В предшествующем уровне техники существуют многочисленные сообщения, в которых описывают аминокислотные замены, которые могут быть введены в молекулу антитела с целью модуляции его эффекторных функций. Например, Шилдс с сотр. [Shields et al., J. of Biol. Chem., 276 (9): 6591-6604 (2001)] раскрыли, что замена аспарагина на аланин (N297A), которая приводит к негликозилированному антителу, значительно уменьшает связывание антитела с некоторыми Fcγ рецепторами. Кроме того, Шилдс с сотр. раскрыли, что замена аспарагиновой кислоты на аланин (D265A) также значительно уменьшала связывание антитела с Fcγ рецепторами. Каждая из замен N297A и D265A, как также было показано, значительно нарушала CDC. Существуют другие подобные сообщения, в которых определены потенциальные замены для уменьшения или устранения эффекторной функции антител [например, Sazinsky et al., Proc.Nat.Acad.Sci.,105:20167-20172 (2008), Alegre et al., Transplantation, 57:1537-1543 (1994), Hutchins et al., Proc.Nat.Acad.Sci. 92:11980-11984 (1994), McEarchem et al., Blood, 109:1185-1192 (2007)].
Цитирование любой ссылки в настоящем документе не следует считать допущением того, что такая ссылка доступна как "предшествующий уровень техники" в отношении настоящей заявки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены антитела и их антигенсвязывающие фрагменты (в том числе выделенные антитела и их выделенные антигенсвязывающие фрагменты), которые со специфичностью связывают Лиганд программируемой смерти 1 собаки (PD-L1 собаки). В определенных вариантах осуществления антитела и их фрагменты являются антителами млекопитающих. В более конкретных вариантах осуществления антитела млекопитающих являются мышиными антителами (т.е. мыши). В соответствующем аспекте настоящего изобретения выделенные антитела являются канинизированными антителами. В определенных вариантах осуществления канинизированные антитела являются канинизированными антителами млекопитающих (например, мыши) против PD-L1 собаки. Антитела и их антигенсвязывающие фрагменты согласно настоящему изобретению связывают PD-L1 собаки и могут блокировать связывание PD-L1 собаки с Рецептором программируемой смерти 1 (PD-1) собаки. В настоящем изобретении также предложено применениие таких антител или их антигенсвязывающих фрагментов в лечении заболевания, например, в лечении рака у псовых.
В определенных вариантах осуществления антитела или их антигенсвязывающие фрагменты, со специфичностью связывающие PD-L1 собаки, включают три определяющих комплементарность области (CDR-области) легкой цепи: CDR 1 легкой цепи (CDRL1), CDR 2 легкой цепи (CDRL2) и CDR 3 легкой цепи (CDRL3); и три CDR-области тяжелой цепи: CDR 1 тяжелой цепи (CDRH1), CDR 2 тяжелой цепи (CDRH2) и CDR 3 тяжелой цепи (CDRH3).
В некоторых вариантах осуществления CDRH1 включает аминокислотную последовательность SEQ ID NO: 13. В других вариантах осуществления CDRH1 включает консервативно модифицированный вариант SEQ ID NO: 13. В других вариантах осуществления CDRH1 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 13, который включает каноническую структуру класса 1. В других вариантах осуществления CDRH1 включает аминокислотную последовательность SEQ ID NO: 19. В других вариантах осуществления CDRH1 включает консервативно модифицированный вариант SEQ ID NO: 19. В других вариантах осуществления CDRH1 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 19, который включает каноническую структуру класса 1.
В некоторых вариантах осуществления CDRH2 включает аминокислотную последовательность SEQ ID NO: 14. В других вариантах осуществления CDRH2 включает консервативно модифицированный вариант SEQ ID NO: 14. В других вариантах осуществления CDRH2 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 14, который включает каноническую структуру класса 3B. В других вариантах осуществления CDRH2 включает аминокислотную последовательность SEQ ID NO: 20. В других вариантах осуществления CDRH2 включает консервативно модифицированный вариант SEQ ID NO: 20. В других вариантах осуществления CDRH2 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 20, который включает каноническую структуру класса 3B.
В некоторых вариантах осуществления CDRH3 включает аминокислотную последовательность SEQ ID NO: 15. В других вариантах осуществления CDRH3 включает консервативно модифицированный вариант SEQ ID NO: 15. В других вариантах осуществления CDRH3 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 15, который включает каноническую структуру класса 10. В других вариантах осуществления CDRH3 включает аминокислотную последовательность SEQ ID NO: 21. В других вариантах осуществления CDRH3 включает консервативно модифицированный вариант SEQ ID NO: 21. В других вариантах осуществления CDRH3 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 21, который включает каноническую структуру класса 8.
В некоторых вариантах осуществления CDRL1 включает аминокислотную последовательность SEQ ID NO: 16. В других вариантах осуществления CDRL1 включает консервативно модифицированный вариант SEQ ID NO: 16. В других вариантах осуществления CDRL1 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 16, который включает каноническую структуру класса 2. В других вариантах осуществления аминокислотная последовательность CDRL1 включает SEQ ID NO: 22. В других вариантах осуществления CDRL1 включает консервативно модифицированный вариант SEQ ID NO: 22. В других вариантах осуществления CDRL1 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 22, который включает каноническую структуру класса 3.
В некоторых вариантах осуществления CDRL2 включает аминокислотную последовательность SEQ ID NO: 17. В других вариантах осуществления CDRL2 включает консервативно модифицированный вариант SEQ ID NO: 17. В других вариантах осуществления CDRL2 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 17, который включает каноническую структуру класса 1. В других вариантах осуществления CDRL2 включает SEQ ID NO: 23. В других вариантах осуществления CDRL2 включает консервативно модифицированный вариант SEQ ID NO: 23. В других вариантах осуществления CDRL2 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 23, который включает каноническую структуру класса 1.
В некоторых вариантах осуществления CDRL3 включает аминокислотную последовательность SEQ ID NO: 18. В других вариантах осуществления CDRL3 включает консервативно модифицированный вариант SEQ ID NO: 18. В других вариантах осуществления CDRL3 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 18, который включает каноническую структуру класса 1. В других вариантах осуществления CDRL3 включает аминокислотную последовательность SEQ ID NO: 24. В других вариантах осуществления CDRL3 включает консервативно модифицированный вариант SEQ ID NO: 24. В других вариантах осуществления CDRL3 включает вариант (например, функционально консервативный вариант) SEQ ID NO: 24, который включает каноническую структуру класса 1.
В настоящем изобретении также предложены комбинации двух или более CDR-областей настоящего изобретения (или их вариантов) в данном антителе, например, CDRH3, которая включает аминокислотную последовательность SEQ ID NO: 15, и CDRL3, которая включает аминокислотную последовательность SEQ ID NO: 18.
В определенных вариантах осуществления антитела и их антигенсвязывающие фрагменты, связывающие PD-L1 собаки, включают CDRH1, которая включает аминокислотную последовательность SEQ ID NO: 13, консервативно модифицированный вариант SEQ ID NO: 13 или вариант (например, функционально консервативный вариант) SEQ ID NO: 13, который включает каноническую структуру класса 1; CDRH2, которая включает аминокислотную последовательность SEQ ID NO: 14, консервативно модифицированный вариант SEQ ID NO: 14 или вариант (например, функционально консервативный вариант) SEQ ID NO: 14, который включает каноническую структуру класса 3B; CDRH3, которая включает SEQ ID NO: 15, консервативно модифицированный вариант SEQ ID NO: 15 или вариант (например, функционально консервативный вариант) SEQ ID NO: 15, который включает каноническую структуру класса 10; CDRL1, которая включает аминокислотную последовательность SEQ ID NO: 16, консервативно модифицированный вариант SEQ ID NO: 16 или вариант (например, функционально консервативный вариант) SEQ ID NO: 16, который включает каноническую структуру класса 2; CDRL2, которая включает аминокислотную последовательность SEQ ID NO: 17, консервативно модифицированный вариант SEQ ID NO: 17 или вариант (например, функционально консервативный вариант) SEQ ID NO: 17, который включает каноническую структуру класса 1; и CDRL3, которая включает аминокислотную последовательность SEQ ID NO: 18, консервативно модифицированный вариант SEQ ID NO: 18 или вариант (например, функционально консервативный вариант) SEQ ID NO: 18, который включает каноническую структуру класса 1.
В соответствующих вариантах осуществления антитела и их антигенсвязывающие фрагменты, связывающие PD-L1 собаки, включают CDRH1, которая включает аминокислотную последовательность SEQ ID NO: 19, консервативно модифицированный вариант SEQ ID NO: 19 или вариант (например, функционально консервативный вариант) SEQ ID NO: 19, который включает каноническую структуру класса 1; CDRH2, которая включает аминокислотную последовательность SEQ ID NO: 20, консервативно модифицированный вариант SEQ ID NO: 20 или вариант (например, функционально консервативный вариант) SEQ ID NO: 20, который включает каноническую структуру класса 3B; CDRH3, которая включает SEQ ID NO: 21, консервативно модифицированный вариант SEQ ID NO: 21 или вариант (например, функционально консервативный вариант) SEQ ID NO: 21, который включает каноническую структуру класса 8; CDRL1, которая включает аминокислотную последовательность SEQ ID NO: 22, консервативно модифицированный вариант SEQ ID NO: 22 или вариант (например, функционально консервативный вариант) SEQ ID NO: 22, который включает каноническую структуру класса 3; CDRL2, которая включает аминокислотную последовательность SEQ ID NO: 23, консервативно модифицированный вариант SEQ ID NO: 23 или вариант (например, функционально консервативный вариант) SEQ ID NO: 23, который включает каноническую структуру класса 1; и CDRL3, которая включает аминокислотную последовательность SEQ ID NO: 24, консервативно модифицированный вариант SEQ ID NO: 24 или вариант (например, функционально консервативный вариант) SEQ ID NO: 24, который включает каноническую структуру класса 1.
Таким образом, в определенном аспекте настоящего изобретения, в настоящем изобретении также предложены канинизированные антитела против PD-L1 собаки. В некоторых вариантах осуществления канинизированные антитела против PD-L1 собаки являются канинизированными антителами млекопитающих (например, мышиными) против PD-L1 собаки. В определенных вариантах осуществления канинизированные антитела против PD-L1 собаки (например, канинизированные антитела млекопитающих против PD-L1 собаки, такие как канинизированные мышиные антитела против PD-L1 собаки) включают cFc, который был генетически модифицирован с целью усиления, ослабления или устранения одной или более эффекторных функций. В определенных вариантах осуществления данного типа генетически модифицированный cFc ослабляет или устраняет одну или более эффекторных функций. В других конкретных вариантах генетически модифицированный cFc усиливает одну или более эффекторных функций.
В некоторых вариантах осуществления генетически модифицированная cFc-область является генетически модифицированной Fc-областью IgGB собаки. В другом таком варианте осуществления генетически модифицированная cFc-область является генетически модифицированной Fc-областью IgGC собаки. В конкретном варианте эффекторная функция является антителозависимой цитотоксичностью (ADCC), которая усилена, ослаблена или устранена. В другом варианте осуществления эффекторная функция является комплементзависимой цитотоксичностью (CDC), которая усилена, ослаблена или устранена. В еще одном варианте осуществления cFc-область была генетически модифицирована с целью усиления, ослабления или устранения ADCC и CDC.
В настоящем изобретении также предложены каркасы и/или полноразмерные тяжелые цепи собак, включающие генетически модифицированные cFc-области. Таким образом, в настоящем изобретении предложены полноразмерные тяжелые цепи антител, в которых полноразмерные тяжелые цепи включают генетически модифицированные cFc-области согласно настоящему изобретению и CDR-области согласно настоящему изобретению. Такие полноразмерные тяжелые цепи могут быть также объединены с соответствующими легкими (каппа или лямбда) цепями собаки с получением полного антитела. В определенных вариантах осуществления данного типа полученное в результате антитело связывается с PD-L1 собаки.
В некоторых вариантах осуществления генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 (или SEQ ID NO: 68), в которой от одного до семи из следующих аминокислотных остатков заменены другим аминокислотным остатком в обозначенных положениях: P4, D31, N63, G64, T65, A93 или P95. Аминокислота, заменяющая P4, D31, N63, G64, T65, A93 и/или P95, индивидуально выбрана из одной из других 19 стандартных природных аминокислот, перечисленных в Таблице 1 ниже. В настоящем изобретении также предложены варианты генетически модифицированных cFc-областей, которые включают аминокислотную последовательность, которая является на 90%, 95%, 98% или 99% идентичной аминокислотной последовательности таких генетически модифицированных cFc-областей и сохраняет по меньшей мере 50%, 75%, 90%, 95% или больше из усиления, ослабления или устранения ADCC и/или CDC, как генетически модифицированные cFc-области, включающие аминокислотную последовательность SEQ ID NO: 66 (или SEQ ID NO: 68), в которой были заменены один или более следующих аминокислотных остатков: т.е. в положениях P4, D31, N63, G64, T65, A93 или P95.
В других вариантах осуществления от двух до пяти из следующих аминокислотных остатков заменены другим аминокислотным остатком в указанных положениях: P4, D31, N63, G64, T65, A93 или P95. В определенных вариантах осуществления данного типа генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 или SEQ ID NO: 68 со следующими заменами: P4A, D31A, N63A, A93G и P95A. В соответствующих вариантах осуществления генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 или SEQ ID NO: 68 со следующими заменами: P4A, D31A, N63A и P95A. В других вариантах осуществления генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 или SEQ ID NO: 68 с заменами в положениях D31 и N63. В определенных вариантах осуществления данного типа остаток аспарагиновой кислоты в положении 31 заменен остатком глутаминовой кислоты, остатком аспарагина или остатком аланина, тогда как остаток аспарагина в положении 63 заменен остатком глутамина, остатком гистидина или остатком аланина. В более конкретном варианте осуществления данного типа генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 или SEQ ID NO: 68 со следующими заменами: D31A и N63A. В определенных вариантах осуществления генетически модифицированная cFc-область кодируется нуклеотидной последовательностью SEQ ID NO: 65 или SEQ ID NO: 67, включающей нуклеотидные изменения, соответствующие аминокислотным последовательностям, которые они кодируют.
В других вариантах осуществления генетически модифицированная cFc-область включает аминокислотную последовательность SEQ ID NO: 66 или SEQ ID NO: 68 с заменой в положении A93. В конкретном варианте осуществления данного типа заменой является A93G. В соответствующем варианте осуществления заменой является A93S. Как описано в предварительной заявке на патент США 62/030,812, поданной 30 июля 2014 года, настоящим полностью включенной посредством отсылки, замена A93G приводит к улучшению связывания комплемента C1q, что указывает на повышение CDC активности.
В соответствующих вариантах осуществления генетически модифицированная cFc-область дополнительно включает шарнирную область, которая включает аминокислотную последовательность SEQ ID NO: 45. В других вариантах осуществления генетически модифицированная Fc-область дополнительно включает шарнирную область, которая включает аминокислотную последовательность SEQ ID NO: 46. В других вариантах осуществления генетически модифицированная Fc-область дополнительно включает шарнирную область, которая включает аминокислотную последовательность SEQ ID NO: 47. В других вариантах осуществления генетически модифицированная Fc-область дополнительно включает генетически модифицированную шарнирную область, которая включает аминокислотную последовательность SEQ ID NO: 48.
В альтернативных вариантах осуществления настоящего изобретения предложена Fc-область IgGD собаки с генетически модифицированной шарнирной областью из IgGD антитела собаки, шарнирной областью из IgGA антитела собаки, шарнирной областью из IgGB антитела собаки или шарнирной областью из IgGC антитела собаки. Кроме того, в настоящем изобретении предложены полноразмерные тяжелые цепи антител, где полноразмерные тяжелые цепи включают Fc-область IgGD собаки согласно настоящему изобретению с генетически модифицированной шарнирной областью из IgGD антитела собаки, шарнирной областью из IgGA антитела собаки, шарнирной областью из IgGB антитела собаки или шарнирной областью из IgGC антитела собаки. Такие полноразмерные тяжелые цепи также могут быть объединены с соответствующими легкими (каппа или лямбда) цепями собаки с получением полного антитела.
Таким образом, в настоящем изобретении предложена Fc-область IgGD собаки, дополнительно включающая генетически модифицированную шарнирную область из IgGD антитела собаки. В определенных вариантах осуществления данного типа Fc-область IgGD собаки и генетически модифицированная шарнирная область включают аминокислотную последовательность SEQ ID NO: 6 или аминокислотную последовательность, которая является на 90%, 95%, 98% или 99% идентичной аминокислотной последовательности SEQ ID NO: 6, которая включает остаток пролина в положении 10 (P10). В более конкретном варианте Fc-область IgGD собаки и генетически модифицированная шарнирная область кодируются нуклеотидной последовательностью SEQ ID NO: 5. в других вариантах осуществления Fc-область IgGD собаки дополнительно включает шарнирную область из IgGA антитела собаки. В определенных вариантах осуществления данного типа Fc-область IgGD собаки и шарнирная область включают аминокислотную последовательность SEQ ID NO: 8 или аминокислотную последовательность, которая является на 90%, 95%, 98% или 99% идентичной аминокислотной последовательности SEQ ID NO:8. В более конкретном варианте Fc-область IgGD собаки и шарнирная область кодируются нуклеотидной последовательностью SEQ ID NO: 7. В других вариантах осуществления Fc-область IgGD собаки дополнительно включает шарнирную область из IgGB антитела собаки. В определенных вариантах осуществления данного типа Fc-область IgGD собаки и шарнирная область включают аминокислотную последовательность SEQ ID NO: 10 или аминокислотную последовательность, которая является на 90%, 95%, 98% или 99% идентичной аминокислотной последовательности SEQ ID NO: 10. В более конкретном варианте Fc-область IgGD собаки и шарнирная область кодируются нуклеотидной последовательностью SEQ ID NO: 9. В других вариантах осуществления Fc-область IgGD собаки дополнительно включает шарнирную область из IgGC антитела собаки. В определенных вариантах осуществления данного типа собачья область IgGD cFc и шарнирная область включают аминокислотную последовательность SEQ ID NO: 12 или аминокислотную последовательность, которая является на 90%, 95%, 98% или 99% идентичной аминокислотной последовательности SEQ ID NO: 12. В более конкретном варианте cFc-область IgGD собаки и шарнирная область кодируются нуклеотидной последовательностью SEQ ID NO: 11. В настоящем изобретении также предложены канинизированные антитела, которые включают такие собачьи Fc-области IgGD и шарнирные области. В конкретном варианте канинизированное антитело или его антигенсвязывающий фрагмент со специфичностью связывают Рецептор программируемой смерти 1 собаки (PD-1 собаки).
В настоящем изобретении, таким образом, предложены канинизированные антитела против PD-L1 собаки со специфичностью к, и/или которые обладают высокой аффинностью связывания с PD-L1 собаки. В определенных вариантах осуществления канинизированные антитела против PD-L1 собаки также обладают способностью блокировать связывание PD-L1 собаки с PD-1 собаки. Такие канинизированные антитела или их антигенсвязывающие фрагменты, специфично связывающие PD-L1 собаки, могут включать тяжелую цепь IgG собаки согласно настоящему изобретению и каппа или лямбда легкую цепь собаки. В определенных вариантах осуществления канинизированные антитела против PD-L1 собаки являются канинизированными мышиными антителами против PD-L1 собаки. Настоящее изобретение также относится к применению таких канинизированных антител в лечении заболевания, такого как рак и/или заболевания, обусловленные инфекциями.
В определенных вариантах осуществления канинизированное антитело против PD-L1 собаки включают генетически модифицированную cFc-область согласно настоящему изобретению. В альтернативных вариантах осуществления канинизированное антитело против PD-L1 собаки включает Fc-область IgGD собаки с генетически модифицированной шарнирной областью из IgGD антитела собаки, шарнирной областью из IgGA антитела собаки, шарнирной областью из IgGB антитела собаки или шарнирной областью из IgGC антитела собаки. В настоящем изобретении также предложены такие канинизированные антитела против PD-L1 собаки, включающие каркасы собаки согласно настоящему изобретению в сочетании с CDR-областями, полученными из мышиных антител против PD-L1 собаки, т.е. тремя CDR-областями легкой цепи: CDR 1 легкой цепи (CDRL1), CDR 2 легкой цепи (CDRL2) и CDR 3 легкой цепи (CDRL3), и тремя CDR-областями тяжелой цепи: CDR 1 тяжелой цепи (CDRH1), CDR 2 тяжелой цепи (CDRH2) и CDR 3 тяжелой цепи (CDRH3).
В определенных вариантах осуществления канинизированные мышиные антитела против PD-L1 собаки включают генетически модифицированную cFc-область IgGB или IgGC согласно настоящему изобретению или, в альтернативе, Fc-область IgGD собаки, вместе с генетически модифицированной шарнирной областью из IgGD антитела собаки, шарнирной областью из IgGA антитела собаки, шарнирной областью из IgGB антитела собаки или шарнирной областью из IgGC антитела собаки, в сочетании с CDR-областями, полученными из мышиных антител против PD-L1 собаки. Кроме того, в настоящем изобретении предложены не только канинизированные мышиные антитела против PD-L1 собаки с определенными CDR-областями, как подробно описано в настоящей заявке, но также предложены канинизированные мышиные антитела против PD-L1 собаки, включающие консервативно измененные варианты указанных CDR-областей, а также варианты, которые включают (например, обладают) такую же каноническую структуру.
Таким образом, в определенных вариантах осуществления канинизированное антитело против PD-L1 собаки дополнительно включает определяющие комплементарность области (CDR-области), где CDR-области имеют канонические структуры: H1-1, H2-3B и H3-10, соответственно, для CDR1, CDR2 и CDR3 тяжелой цепи. В еще более конкретных вариантах осуществления CDR-области соответствующих легких цепей имеют канонические структуры: L1-2, L2-1 и L3-1, соответственно, для CDR1, CDR2 и CDR3 легкой цепи. В других вариантах осуществления канинизированное антитело против PD-L1 собаки дополнительно включает определяющие комплементарность области (CDR-области), где CDR-области имеют канонические структуры: H1-1, H2-3B и H3-8, соответственно, для CDR1, CDR2 и CDR3 тяжелой цепи. В еще более конкретных вариантах осуществления данного типа CDR-области соответствующих легких цепей имеют канонические структуры: L1-3, L2-1 и L3-1, соответственно, для CDR1, CDR2 и CDR3 легкой цепи.
В более конкретных вариантах осуществления канинизированное антитело настоящего изобретения или его антигенсвязывающий фрагмент включают одну или более определяющих комплементарность областей 1 тяжелой цепи (VH CDR1) с аминокислотной последовательностью SEQ ID NO: 13 или SEQ ID NO: 19. В другом варианте осуществления определяющая комплементарность область 2 тяжелой цепи (VH CDR2) включает аминокислотную последовательность SEQ ID NO: 14 или SEQ ID NO: 20. В другом варианте осуществления определяющая комплементарность область 3 тяжелой цепи (VH CDR3) включает аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 21. В конкретном варианте осуществления данного типа канинизированные антитела или антигенсвязывающий фрагмент включают и VH CDR1, включающую аминокислотную последовательность SEQ ID NO: 13 или SEQ ID NO: 19, и VH CDR2, включающую аминокислотную последовательность SEQ ID NO: 14 или SEQ ID NO: 20.
В другом таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают и VH CDR1, включающую аминокислотную последовательность SEQ ID NO: 13 или SEQ ID NO: 19, и VH CDR3, включающую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 21. В еще одном таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают и VH CDR2, включающую аминокислотную последовательность SEQ ID NO: 14 или SEQ ID NO: 20, и VH CDR3, включающую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 21. В другом таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают VH CDR1, включающую аминокислотную последовательность SEQ ID NO: 13 или SEQ ID NO: 19, VH CDR2, включающую аминокислотную последовательность SEQ ID NO: 14 или SEQ ID NO: 20, и VH CDR3, включающую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 21.
В определенных вариантах осуществления канинизированное антитело или антигенсвязывающий фрагмент также включают определяющую комплементарность область 1 легкой цепи (VL CDR1), включающую аминокислотную последовательность SEQ ID NO: 16 или SEQ ID NO: 22. В соответствующих вариантах осуществления определяющая комплементарность область 2 легкой цепи (VL CDR2) включает аминокислотную последовательность SEQ ID NO: 17 или SEQ ID NO: 23. В другом варианте осуществления определяющая комплементарность область 3 легкой цепи (VL CDR3) включает аминокислотную последовательность SEQ ID NO: 18 или SEQ ID NO: 24. В конкретном варианте осуществления данного типа канинизированные антитела или антигенсвязывающий фрагмент включают и VL CDR1, включающую аминокислотную последовательность SEQ ID NO: 16 или SEQ ID NO: 22, и VL CDR2, включающую аминокислотную последовательность SEQ ID NO: 17 или SEQ ID NO: 23. В другом таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают и VL CDR1, включающую аминокислотную последовательность SEQ ID NO: 16 или SEQ ID NO: 22, и VL CDR3, включающую аминокислотную последовательность SEQ ID NO: 18 или SEQ ID NO: 24. В еще одном таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают и VL CDR2, включающую аминокислотную последовательность SEQ ID NO: 17 или SEQ ID NO: 23, и VL CDR3, включающую аминокислотную последовательность SEQ ID NO: 18 или SEQ ID NO: 24. В другом таком варианте осуществления канинизированное антитело или антигенсвязывающий фрагмент включают VL CDR1, включающую аминокислотную последовательность SEQ ID NO: 16 или SEQ ID NO: 22, VL CDR2, включающую аминокислотную последовательность SEQ ID NO: 17 или SEQ ID NO: 23, и VL CDR3, включающую аминокислотную последовательность SEQ ID NO: 18 или SEQ ID NO: 24.
В настоящем изобретении также предложены канинизированные антитела, включающие аминокислотную последовательность SEQ ID NO: 26, или которые являются на 90%, 95%, 98% или 99% идентичными аминокислотной последовательности SEQ ID NO: 26 и SEQ ID NO: 28, или которые являются на 90%, 95%, 98% или 99% идентичными аминокислотной последовательности SEQ ID NO: 28, или антигенсвязывающие фрагменты этих канинизированных антител. В настоящем изобретении также предложены канинизированные антитела, включающие аминокислотную последовательность SEQ ID NO: 30, или которые являются на 90%, 95%, 98% или 99% идентичными аминокислотной последовательности SEQ ID NO: 30 и SEQ ID NO: 32, или которые являются на 90%, 95%, 98% или 99%, идентичными аминокислотной последовательности SEQ ID NO: 32, или антигенсвязывающие фрагменты этих канинизированных антител.
В определенных вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P, A, G или S в положении 242, (ii) A, G или S в положении 269, (iii) A, G или S в положении 301, (iv) G, P или A в положении 302, (v) T, A, G или S в положении 303, (vi) A, G или S в положении 331 и (vii) P, A, G или S в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P, A, G или S в положении 240, (ii) A, G или S в положении 267, (iii) A, G или S в положении 299, (iv) G, P или A в положении 300, (v) T, A, G или S в положении 301, (vi) A, G или S в положении 329 и (vii) P, A, G или S в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P, A, G или S в положении 238, (ii) A, G или S в положении 265, (iii) A, G или S в положении 297, (iv) G, P или A в положении 298, (v) T, A, G или S в положении 299, (vi) A, G или S в положении 327 и (vii) P, A, G или S в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P, A, G или S в положении 242, (ii) A в положении 269, (iii) A в положении 301, (iv) G, P или A в положении 302, (v) T, A, G или S в положении 303, (vi) A, G или S в положении 331 и (vii) P, A, G или S в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P, A, G или S в положении 240, (ii) A в положении 267, (iii) A в положении 299, (iv) G, P или A в положении 300, (v) T, A, G или S в положении 301, (vi) A, G или S в положении 329 и (vii) P, A, G или S в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P, A, G или S в положении 238, (ii) A в положении 265, (iii) A в положении 297, (iv) G, P или A в положении 298, (v) T, A, G или S в положении 299, (vi) A, G или S в положении 327 и (vii) P, A, G или S в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) A в положении 242, (ii) A в положении 269, (iii) A в положении 301, (iv) P в положении 302, (v) A в положении 303, (vi) G в положении 331 и (vii) A в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) A в положении 240, (ii) A в положении 267, (iii) A в положении 299, (iv) P в положении 300, (v) A в положении 301, (vi) G в положении 329 и (vii) A в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) A в положении 238, (ii) A в положении 265, (iii) A в положении 297, (iv) P в положении 298, (v) A в положении 299, (vi) G в положении 327 и (vii) A в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P в положении 242, (ii) A, G или S в положении 269, (iii) A, G или S в положении 301, (iv) G в положении 302, (v) T в положении 303, (vi) A в положении 331 и (vii) P в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P в положении 240, (ii) A, G или S в положении 267, (iii) A, G или S в положении 299, (iv) G в положении 300, (v) T в положении 301, (vi) A в положении 329 и (vii) P в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P в положении 238, (ii) A, G или S в положении 265, (iii) A, G или S в положении 297, (iv) G в положении 298, (v) T в положении 299, (vi) A в положении 327 и (vii) P в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P в положении 242, (ii) A в положении 269, (iii) A в положении 301, (iv) G в положении 302, (v) T в положении 303, (vi) A в положении 331 и (vii) P в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P в положении 240, (ii) A в положении 267, (iii) A в положении 299, (iv) G в положении 300, (v) T в положении 301, (vi) A в положении 329 и (vii) P в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P в положении 238, (ii) A в положении 265, (iii) A в положении 297, (iv) G в положении 298, (v) T в положении 299, (vi) A в положении 327 и (vii) P в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P, A, G или S в положении 242, (ii) A, G или S в положении 269, (iii) A, G или S в положении 301, (iv) G в положении 302, (v) T в положении 303, (vi) A, G или S в положении 331 и (vii) P, A, G или S в положении 333. В других таких вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P, A, G или S в положении 240, (ii) A, G или S в положении 267, (iii) A, G или S в положении 299, (iv) G в положении 300, (v) T в положении 301, (vi) A, G или S в положении 329 и (vii) P, A, G или S в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P, A, G или S в положении 238, (ii) A, G или S в положении 265, (iii) A, G или S в положении 297, (iv) G в положении 298, (v) T в положении 299, (vi) A, G или S в положении 327 и (vii) P, A, G или S в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) P, A, G или S в положении 242, (ii) A в положении 269, (iii) A в положении 301, (iv) G в положении 302, (v) T в положении 303, (vi) A, G или S в положении 331, и (vii) P, A, G или S в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) P, A, G или S в положении 240, (ii) A в положении 267, (iii) A в положении 299, (iv) G в положении 300, (v) T в положении 301, (vi) A, G или S в положении 329 и (vii) P, A, G или S в положении 331. В других таких вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) P, A, G или S в положении 238, (ii) A в положении 265, (iii) A в положении 297, (iv) G в положении 298, (v) T в положении 299, (vi) A, G или S в положении 327 и (vii) P, A, G или S в положении 329.
В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 26), которая включает (i) A в положении 242, (ii) A в положении 269, (iii) A в положении 301, (iv) G в положении 302, (v) T в положении 303, (vi) G в положении 331 и (vii) A в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 28 или 30), которая включает (i) A в положении 240, (ii) A в положении 267, (iii) A в положении 299, (iv) G в положении 300, (v) T в положении 301, (vi) G в положении 329 и (vii) A в положении 331. В других таких вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 32 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 32), которая включает (i) A в положении 238, (ii) A в положении 265, (iii) A в положении 297, (iv) G в положении 298, (v) T в положении 299, (vi) G в положении 327 и (vii) A в положении 329. Кроме того, в настоящем изобретении предложено канинизированное антитело или его антигенсвязывающий фрагмент, которые дополнительно включают легкую цепь собаки, которая включает аминокислотную последовательность SEQ ID NO: 38 или SEQ ID NO: 44.
Таким образом, в настоящем изобретении также предложено канинизированное антитело или его антигенсвязывающий фрагмент, которые включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 34, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 36, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В другом варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 42, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44.
В еще одном варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 34, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 36, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В другом варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 42, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38.
В настоящем изобретении также предложено канинизированное антитело или его антигенсвязывающий фрагмент, которые включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 26, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 28, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В другом варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 30, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 32, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44.
В настоящем изобретении также предложено канинизированное антитело или его антигенсвязывающий фрагмент, которые включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 26, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 28, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44. В другом варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 30, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38. В соответствующем варианте осуществления канинизированное антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 32, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38.
В настоящем изобретении также предложены нуклеиновые кислоты, которые кодируют любую из аминокислотных последовательностей настоящего изобретения, включающих CDR-области, cFc-области, cFc-области с шарнирными областями, а также тяжелые цепи и легкие цепи канинизированных антител настоящего изобретения. В настоящем изобретении также предложены векторы экспрессии, включающие одну или более нуклеиновых кислот настоящего изобретения. В настоящем изобретении также предложены клетки-хозяева, включающие один или более векторов экспрессии настоящего изобретения, а также способы экспрессии CDR-областей и/или cFc-областей, и/или cFc областей с шарнирными областями, и/или тяжелых цепей и/или легких цепей канинизированных антител настоящего изобретения с применением таких клеток-хозяев. В настоящем изобретении также предложены клетки-хозяева, которые были получены методами генной инженерии с целью экспрессии CDR-областей и/или cFc-областей, и/или cFc-областей с шарнирными областями, и/или тяжелых цепей и/или легких цепей канинизированных антител настоящего изобретения в отсутствие таких векторов. В определенных вариантах осуществления указанные нуклеиновые кислоты, векторы экспрессии, полипептиды или клетки-хозяева согласно изобретению могут применяться в способах получения антитела.
В определенных вариантах осуществления антитело является рекомбинантным антителом или его рекомбинантным антигенсвязывающим фрагментом. В соответствующих вариантах осуществления вариабельный домен тяжелой цепи и вариабельный домен легкой цепи связаны гибким линкером с получением одноцепочечного антитела.
В некоторых вариантах осуществления настоящего изобретения предложено антитело или его антигенсвязывающий фрагмент (например, выделенное антитело или его выделенный антигенсвязывающий фрагмент), которые со специфичностью связывают PD-L1 собаки, и в случае связывания с PD-L1 собаки антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 82. В соответствующих вариантах осуществления антитело или его антигенсвязывающий фрагмент, со специфичностью связывающие PD-L1 собаки, также связываются по меньшей мере с одним аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 83. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент, со специфичностью связывающие PD-L1 собаки, также связываются по меньшей мере с одним аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 82 и по меньшей мере с одним аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 83. В определенных вариантах осуществления эти антитела и/или их антигенсвязывающие фрагменты блокируют связывание PD-L1 собаки с PD-1 собаки. В соответствующих вариантах осуществления антитело является моноклональным антителом. В определенных вариантах осуществления данного типа антитело является моноклональным мышиным антителом против PD-L1 собаки. В более конкретных вариантах осуществления моноклональное антитело является канинизированным антителом. В еще более конкретных вариантах моноклональное антитело является канинизированным мышиным антителом против PD-L1 собаки.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с 2-5 аминокислотными остатками SEQ ID NO: 82. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с 6-12 аминокислотными остатками SEQ ID NO: 82. В других вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связываются с 13-20 аминокислотными остатками SEQ ID NO: 82. В соответствующих вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с 2-5 аминокислотными остатками SEQ ID NO: 83. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с 6-11 аминокислотными остатками SEQ ID NO: 83.
В других вариантах осуществления предложены моноклональные антитела или их антигенсвязывающие фрагменты, которые перекрестно конкурируют за связывание с PD-L1 собаки с одним или более антителами против PD-L1 собаки согласно настоящему изобретению. В определенных вариантах осуществления перекрестно конкурирующие антитела и их антигенсвязывающие фрагменты связывают PD-L1 собаки и блокируют связывание PD-L1 собаки с PD-1 собаки. В более конкретных вариантах осуществления моноклональные антитела или их антигенсвязывающие фрагменты перекрестно конкурируют с 4F9 (или антителом с 6 CDR-областями 4F9) за связывание PD-L1 собаки. В других более конкретных вариантах осуществления моноклональные антитела или их антигенсвязывающие фрагменты перекрестно конкурируют с 5F12 (или антителом с 6 CDR-областями 5F12) за связывание PD-L1 собаки. В других вариантах осуществления моноклональные антитела или их антигенсвязывающие фрагменты перекрестно конкурируют и с 4F9, и с 5F12 за связывание PD-L1 собаки.
В определенных вариантах осуществления моноклональное антитело настоящего изобретения являются мышиным антителом. В других вариантах осуществления моноклональное антитело является канинизированным антителом. В более конкретных вариантах осуществления моноклональное антитело настоящего изобретения является канинизированным мышиным антителом.
Кроме того, в настоящем изобретении предложены антитела (например, канинизированные антитела) к PD-L1 собаки, включающие CDR-области настоящего изобретения или варианты CDR-областей, имеющие соответствующие канонические структуры, предложенные в настоящей заявке, и/или которые связываются с аминокислотной последовательностью SEQ ID NO: 82 и/или 83 PD-L1. В определенных вариантах осуществления данного типа константа диссоциации (Kd) для связывания канинизированного антитела-PD-L1 собаки составляет от 1×10-5 до 1×10-12 М. В более конкретных вариантах осуществления канинизированные антитела к PD-L1 собаки включают варианты CDR-областей настоящего изобретения, которые имеют соответствующие канонические структуры, предложенные в настоящей заявке, и связываются с аминокислотной последовательностью SEQ ID NO: 82 и/или 83 PD-L1. Настоящее изобретение, таким образом, включает канинизированные антитела и их антигенсвязывающие фрагменты, со специфичностью связывающие PD-L1 собаки, и в случае их связывания с PD-L1 собаки антитело связывается по меньшей мере с одним аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 82 и/или 83 PD-L1. В определенных вариантах осуществления данного типа антитела и их антигенсвязывающие фрагменты связывают PD-L1 собаки и блокируют связывание PD-L1 собаки с PD-1 собаки. Таким образом, в определенных вариантах осуществления, при связывании с PD-L1 собаки, канинизированное антитело (включая антитела с одной или более различными CDR-областями, например, вариант, такой как, без ограничения, консервативно модифицированный вариант и/или вариант, включающий каноническую структуру определенного класса) связывается по меньшей мере с одним аминокислотным остатком в эпитопе PD-L1, например, аминокислотной последовательности SEQ ID NO: 82 и/или SEQ ID NO: 83.
В настоящем изобретении также предложены канинизированные антитела или их антигенсвязывающие фрагменты, которые связываются с PD-L1 собаки с константой диссоциации (Kd), которая ниже чем 1×10-12 М (например, 1×10-13 М или еще ниже). В других вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой диссоциации от 1×10-5 М до 1×10-12 М. В более конкретных вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой диссоциации от 1×10-7 М до 1×10-11 М. В еще более конкретных вариантах канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой диссоциации от 1×10-8 М до 1×10-11 М. В еще более конкретных вариантах канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой диссоциации от 1×10-8 М до 1×10-10 М.
В настоящем изобретении также предложены канинизированные антитела или их антигенсвязывающие фрагменты, связывающиеся с PD-L1 собаки с константой скорости ассоциации (kon), которая превышает 1×107 M-1с-1. В других вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости ассоциации от 1×102 M-1с-1 до 1×107 M-1с-1. В более конкретных вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости ассоциации от 1×103 M-1с-1 до 1×106 M-1с-1. В еще более конкретных вариантах канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости ассоциации от 1×103 M-1с-1 до 1×105 M-1с-1. В еще более конкретных вариантах канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости ассоциации от 1×104 M-1с-1 до 1×105 M-1с-1.
В настоящем изобретении также предложены канинизированные антитела или их антигенсвязывающие фрагменты, связывающиеся с PD-L1 собаки с константой скорости диссоциации (koff) ниже 1×10-7 с-1. В определенных вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости диссоциации от 1×10-3 с-1 до 1×10-8 с-1. В более конкретных вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости диссоциации от 1×10-4 с-1 до 1×10-7 с-1. В еще более конкретных вариантах осуществления канинизированные антитела или их антигенсвязывающие фрагменты связываются с PD-L1 собаки с константой скорости диссоциации от 1×10-5 с-1 до 1×10-7 с-1.
В соответствующих вариантах осуществления антитела (например, канинизированные антитела) или их антигенсвязывающие фрагменты стимулируют антигенспецифические вторичные иммунные ответы на опухоль или патоген. В определенных вариантах осуществления антитела (например, канинизированные антитела) или их антигенсвязывающие фрагменты стимулируют гуморальный иммунный ответ in vivo. В других конкретных вариантах антитела (например, канинизированные антитела) или их антигенсвязывающие фрагменты стимулируют иммунный ответ у животного субъекта. В более конкретных вариантах осуществления животное субъект является псовым. В соответствующем варианте осуществления животное субъект является кошачьим.
Таким образом, любое из антител (например, канинизированных антител) настоящего изобретения может проявлять одно, два, три, четыре, пять или все такие свойства, т.е. вышеуказанные константы диссоциации с PD-L1 собаки, вышеуказанные константы скорости ассоциации для связывания с PD-L1 собаки, вышеуказанные константы скорости диссоциации для диссоциации из комплекса связывания канинизированного антитела-PD-L1 собаки, стимуляция антигенспецифических вторичных иммунных ответов на опухоль или патоген, стимуляция гуморального иммунного ответа in vivo и/или стимуляция иммунного ответа у животного субъекта.
В более конкретных вариантах осуществления антитела и/или их антигенсвязывающие фрагменты настоящего изобретения связывают PD-L1 собаки, а также блокируют связывание PD-L1 собаки с PD-1. В еще более конкретных вариантах канинизированные антитела и их антигенсвязывающие фрагменты согласно настоящему изобретению связывают PD-L1 собаки и блокируют связывание PD-L1 собаки с PD-1.
Как указано выше, антитела (и их антигенсвязывающие фрагменты) настоящего изобретения, включая некоторые вышеуказанные антитела (и их антигенсвязывающие фрагменты), могут быть моноклональными антителами (и их антигенсвязывающими фрагментами), антителами млекопитающих (и их антигенсвязывающими фрагментами), например, мышиными (мыши) антителами (и их антигенсвязывающими фрагментами), канинизированными антителами (и их антигенсвязывающими фрагментами), включая канинизированные мышиные антитела (и их антигенсвязывающие фрагменты). В некоторых вариантах осуществления антитела (и их антигенсвязывающие фрагменты) являются выделенными.
В определенных вариантах осуществления антитело является рекомбинантным антителом или его антигенсвязывающим фрагментом. В соответствующих вариантах осуществления вариабельный домен тяжелой цепи и вариабельный домен легкой цепи связаны гибким линкером с получением одноцепочечного антитела.
В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент являются Fab-фрагментом. В других вариантах осуществления антитело или антигенсвязывающий фрагмент являются Fab'-фрагментом. В других вариантах осуществления антитело или антигенсвязывающий фрагмент являются (Fab')2-фрагментом. В других вариантах осуществления антитело или антигенсвязывающий фрагмент являются диателом. В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент являются доменным антителом. В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент являются камелизированным однодоменным антителом.
В определенных вариантах осуществления канинизированное мышиное антитело против PD-L1 собаки или антигенсвязывающий фрагмент усиливают иммунный ответ обрабатываемого животного субъекта (например, псового или кошачьего).
В настоящем изобретении также предложены нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты), которые кодируют любое из антител и их фрагменты (в том числе CDR-области) согласно настоящему изобретению. В некоторых вариантах осуществления в настоящем изобретении предложены нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты), которые кодируют любую из легких цепей канинизированных антител или их фрагменты согласно настоящему изобретению. Аналогичным образом, в настоящем изобретении предложены нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты), которые кодируют любую из тяжелых цепей канинизированных антител или их фрагменты согласно настоящему изобретению. В настоящем изобретении также предложены векторы экспрессии, включающие одну или более нуклеиновых кислот (в том числе выделенных нуклеиновых кислот) согласно настоящему изобретению. Таким образом, в настоящем изобретении предложены нуклеиновые кислоты, кодирующие канинизированные мышиные антитела против PD-L1 собаки или их фрагменты согласно настоящему изобретению. В соответствующих вариантах осуществления такие антитела или антигенсвязывающие фрагменты могут применяться для получения лекарственного средства для лечения рака у псового и/или кошачьего. В альтернативе или в совокупности, в настоящем изобретении предложено применение любого из антител или фрагментов антител настоящего изобретения для диагностического применения. В других дополнительных вариантах осуществления предложен набор, включающий любое из канинизированных антител или антигенсвязывающих фрагментов, раскрытых в настоящей заявке. В определенных вариантах осуществления предложен вектор экспрессии, включающий выделенную нуклеиновую кислоту, кодирующую любое из канинизированных мышиных антител против PD-L1 собаки или антигенсвязывающие фрагменты изобретения. В настоящем изобретении также предложены клетки-хозяева, включающие один или более векторов экспрессии настоящего изобретения. В определенных вариантах осуществления указанные нуклеиновые кислоты, векторы экспрессии или полипептиды изобретения могут применяться в способах получения антитела.
В настоящем изобретении также предложены антигенные пептиды (в том числе выделенные антигенные пептиды), которые состоят из 80 или меньше аминокислотных остатков, которые составляют аминокислотную последовательность SEQ ID NO: 82 и/или SEQ ID NO: 83. В соответствующих вариантах осуществления антигенные пептиды (в том числе выделенные пептиды) состоят из 60 или меньше аминокислотных остатков, которые составляют аминокислотную последовательность SEQ ID NO: 82 и/или SEQ ID NO: 83. В соответствующих вариантах осуществления антигенные пептиды (в том числе выделенные пептиды) состоят из 11-45 аминокислотных остатков, которые составляют аминокислотную последовательность SEQ ID NO: 82 и/или SEQ ID NO: 83. В других вариантах осуществления антигенные пептиды состоят из 5-20 аминокислотных остатков из аминокислотной последовательности SEQ ID NO: 83. В других вариантах осуществления антигенные пептиды состоят из 5-11 аминокислотных остатков из аминокислотной последовательности SEQ ID NO: 83.
В настоящем изобретении также предложены антигенные пептиды (в том числе выделенные пептиды), которые состоят из 80 или меньше аминокислотных остатков, которые составляют аминокислотную последовательность, которая на 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности SEQ ID NO: 82 и/или SEQ ID NO: 83 и связывается с выделенным антителом млекопитающего или его антигенсвязывающим фрагментом согласно настоящему изобретению. В соответствующих вариантах осуществления антигенные пептиды (в том числе выделенные антигенные пептиды) состоят из 60 или меньше аминокислотных остатков, которые составляют аминокислотную последовательность, которая на 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности SEQ ID NO: 82 и/или SEQ ID NO: 83 и связывается с выделенным антителом млекопитающего или его антигенсвязывающим фрагментом. В других вариантах осуществления пептиды состоят из 5-20 аминокислотных остатков из аминокислотной последовательности, которая на 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности SEQ ID NO: 82 и связывается с выделенным антителом млекопитающего или его антигенсвязывающим фрагментом. В других вариантах осуществления пептиды состоят из 5-11 аминокислотных остатков из аминокислотной последовательности, которая на 80%, 85%, 90%, 95% или 100% идентична аминокислотной последовательности SEQ ID NO: 83 и связывается с выделенным антителом млекопитающего или его антигенсвязывающим фрагментом. В определенных вариантах осуществления антителом млекопитающего является 4E9. В других вариантах осуществления антителом млекопитающего является 5F12.
В настоящем изобретении также предложены слитые белки, включающие любой из вышеуказанных антигенных пептидов. В конкретном варианте осуществления слитый белок включает такой антигенный пептид и Fc-область IgG антитела не относящегося к псовым млекопитающего. В более конкретном варианте слитый белок включает Fc-область IgG антитела не относящегося к псовым млекопитающего. В определенных вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является мышиным IgG. В альтернативных вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является человеческим IgG. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является конским IgG. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является свиным IgG. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является бычьим IgG.
В определенных вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является IgG1. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является IgG2a. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является IgG3. В других вариантах осуществления IgG антитело не относящегося к псовым млекопитающего является IgG4.
В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и мальтозосвязывающий белок. В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и бета-галактозидазу. В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и глутатион-S-трансферазу. В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и тиоредоксин. В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и Gro EL. В других вариантах осуществления слитый белок включает любой из вышеуказанных антигенных пептидов и NusA.
В настоящем изобретении также предложены нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты), которые кодируют антигенные пептиды и соответствующие слитые белки настоящего изобретения. В настоящем изобретении также предложены векторы экспрессии, которые включают указанные нуклеиновые кислоты, и клетки-хозяева, которые включают один или более векторов экспрессии настоящего изобретения.
Кроме того, настоящее изобретение включает фармацевтические композиции, включающие антитела против PD-L1 собаки или их антигенсвязывающие фрагменты согласно настоящему изобретению, антигенные пептиды (в том числе выделенные антигенные пептиды) из PD-L1 собаки, слитые белки, включающие антигенные пептиды из PD-L1 собаки согласно настоящему изобретению, нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты), кодирующие антигенные фрагменты и/или слитые белки согласно настоящему изобретению, векторы экспрессии, включающие такие нуклеиновые кислоты, или их любую комбинацию, и фармацевтически приемлемый носитель или разбавитель.
В определенных вариантах осуществления такие фармацевтические композиции дополнительно включают антитело против PD-1 собаки или его антигенсвязывающий фрагмент. В более конкретных вариантах осуществления антитело против PD-1 собаки является канинизированным мышиным антителом против PD-1 собаки или антигенсвязывающим фрагментом канинизированного мышиного антитела против PD-1 собаки. В соответствующих вариантах осуществления такие фармацевтические композиции дополнительно включают антитело против CTLA-4 собаки или его антигенсвязывающий фрагмент. В определенных вариантах осуществления антитело против CTLA-4 собаки является канинизированным мышиным антителом против CTLA-4 собаки или антигенсвязывающим фрагментом канинизированного мышиного антитела против CTLA-4 собаки.
Таким образом, в настоящем изобретении предложены фармацевтические композиции, включающие один, два, три или более следующего: антитело против PD-L1 собаки, антитело против PD-1 собаки, антитело против CTLA-4 собаки, антигенсвязывающий фрагмент антитела против PD-L1 собаки, антигенсвязывающий фрагмент антитела против PD-1 собаки или антигенсвязывающий фрагмент антитела против CTLA-4 собаки. В определенных вариантах осуществления такие антитела против белка собаки (т.е. против PD-L1, PD-1 или CTLA-4 собаки) или их антигенсвязывающие фрагменты являются мышиными антителами против белков собаки. В других такие антитела против белков собаки или их антигенсвязывающие фрагменты являются канинизированными антителами против белков собаки. В более конкретных вариантах осуществления антитела против белков собаки или их антигенсвязывающие фрагменты являются канинизированными мышиными антителами против белков собаки.
Кроме того, в настоящем изобретении предложены способы увеличения активности иммунной клетки, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции настоящего изобретения. В некоторых вариантах осуществления способ применяется для лечения рака. В других вариантах осуществления способ применяется при лечении инфекции или инфекционного заболевания. В других вариантах осуществления канинизированное антитело настоящего изобретения или его антигенсвязывающий фрагмент применяются в качестве адъюванта вакцины. В определенных вариантах осуществления фармацевтическая композиция, включающая канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент, может быть введена до, после или одновременно с канинизированным мышиным антителом против PD-1 собаки или его антигенсвязывающим фрагментом, и/или канинизированным мышиным антителом против CTLA-4 собаки или его антигенсвязывающим фрагментом.
Эти и другие аспекты настоящего изобретения будут лучше поняты при обращении к следующему Краткому описанию чертежей и Подробному описанию.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
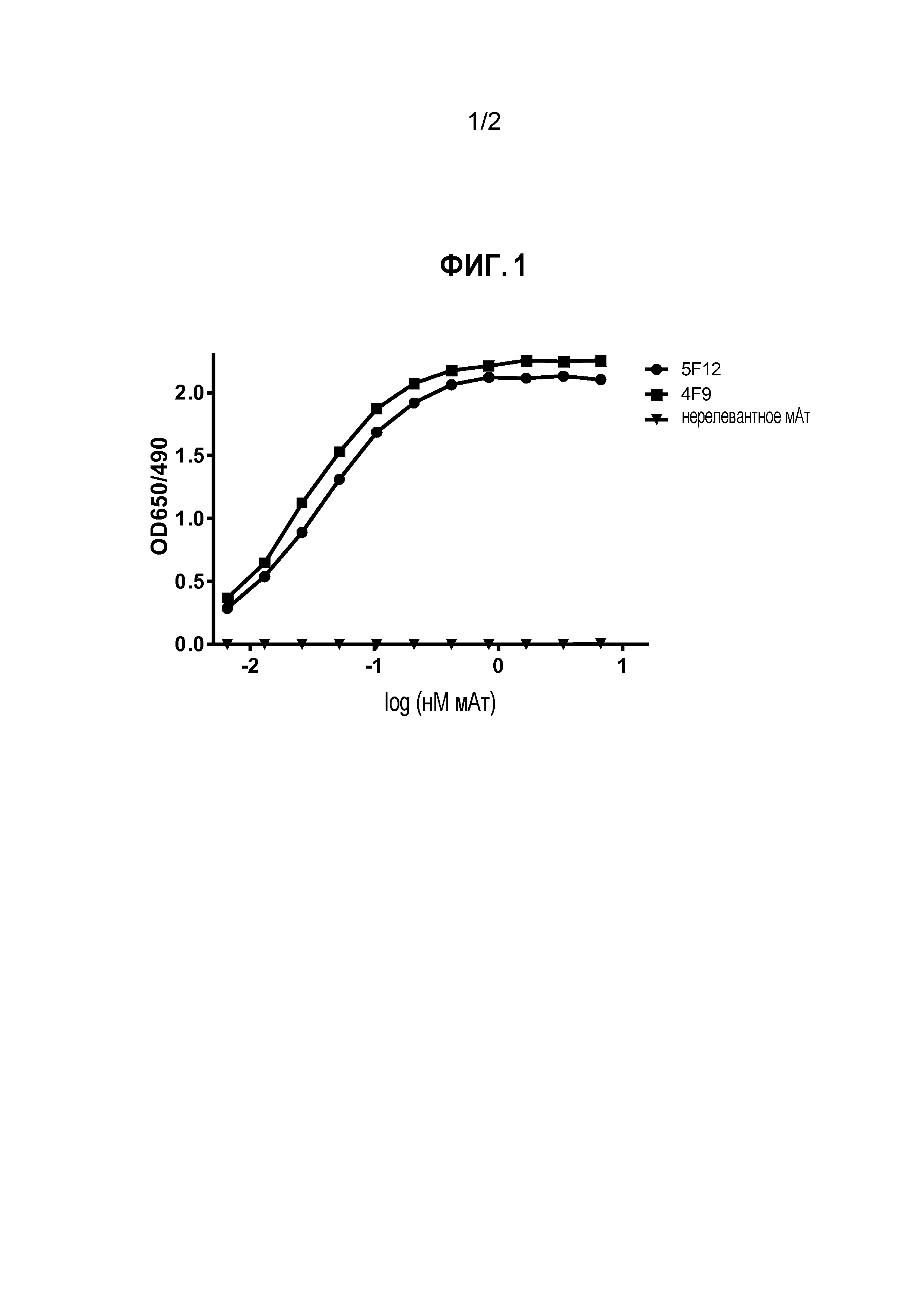
На Фигуре 1 показаны результаты ELISA по реактивности двух мышиных мАт против PD-L1 собаки в отношении PD-L1 собаки, как функция OD 650/490 в зависимости от log мАт (нМ). Оба мАт, обозначенные 4F9 и 5F12, демонстрируют сильное и дозозависимое связывание с PD-L1 собаки.
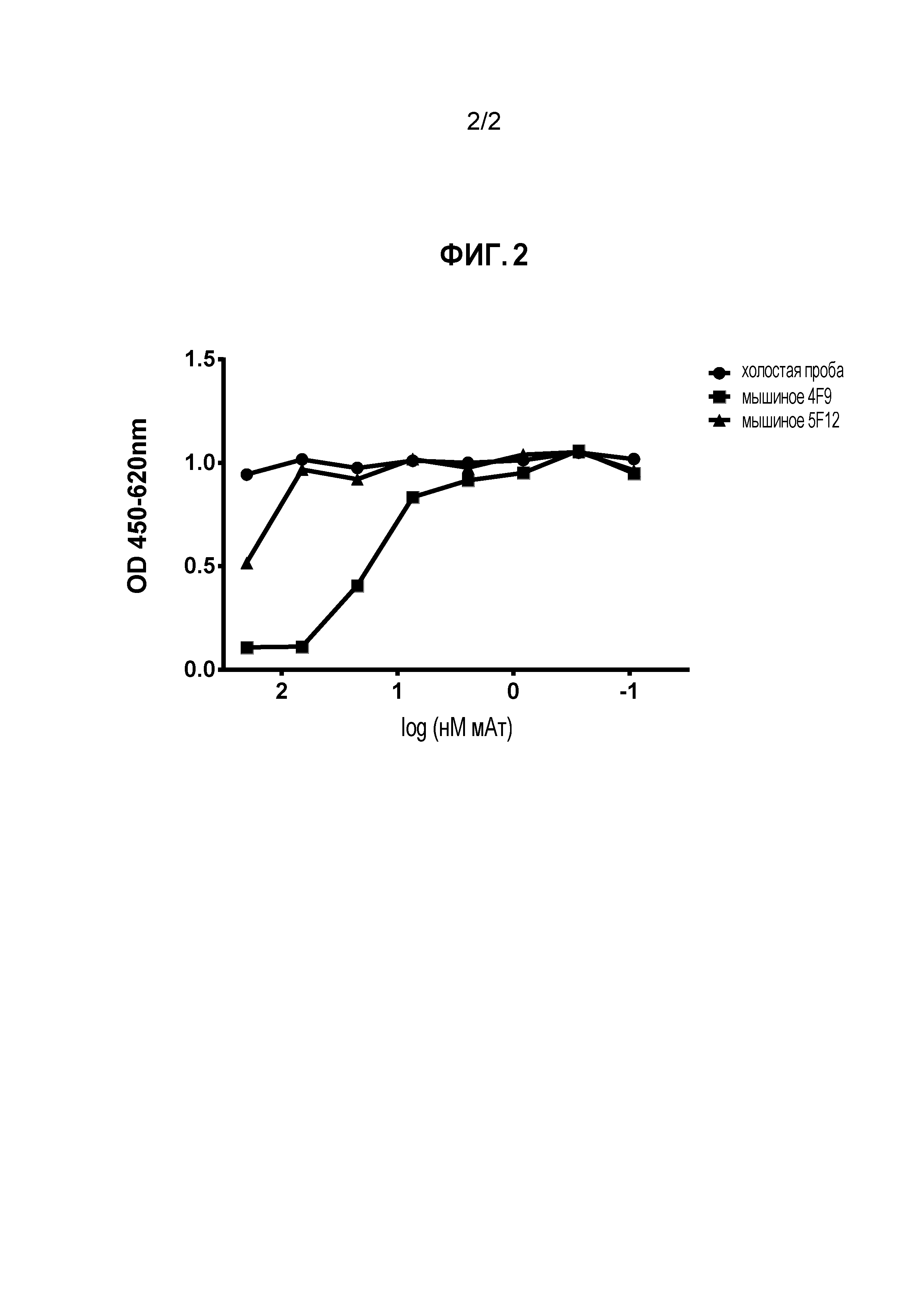
На Фигуре 2 показана блокада лиганда мышиными мАт против PD-L1 собаки. Два мАт, обозначенные 4F9 и 5F12, тестировали на их способность ингибировать связывание PD-L1 с PD-1, экспрессированным на клетках CHO. Оба мАт блокировали связывание PD-L1 с PD-1, хотя мАт 4F9 является более сильным ингибитором, чем 5F12.
ПОДРОБНОЕ ОПИСАНИЕ
Сокращения
По всему тексту подробного описания и примеров изобретения используются следующие сокращения:
|
ОПРЕДЕЛЕНИЯ
Для того чтобы изобретение можно было понять с большей легкостью, некоторые технические и научные термины прямо определены ниже. Если прямо не определено где-либо в настоящем документе, все остальные технические и научные термины, используемые в настоящем описании, имеют значение, под которым их обычно понимает средний специалист в области техники, к которой относится настоящее изобретение.
При использовании в настоящем описании, включая прилагаемую формулу изобретения, формы единственного числа в оригинальном тексте, такие как "a", "an" и "the", включают свои соответствующие множественные ссылки, если из контекста прямо не следует иное.
"Активация", применительно к клеткам или рецепторам, относится к активации или обработке клетки или рецептора лигандом, если из контекста не следует или прямо не указано иное. "Лиганд" охватывает природные и синтетические лиганды, например, цитокины, варианты цитокинов, аналоги, мутеины и связывающие соединения, полученные из антител. "Лиганд" также охватывает малые молекулы, например, пептидные миметики цитокинов и пептидные миметики антител. "Активация" может относиться к активации клеток, регулируемой внутренними механизмами, а также внешними факторами или факторами внешней среды.
"Активность" молекулы может описывать или относиться к связыванию молекулы с лигандом или с рецептором, к каталитической активности; к способности стимулировать экспрессию гена или сигнализацию, дифференцировку или созревание клеток; к антигенной активности, к модуляции активностей других молекул и т.п. "Активность" молекулы также может относиться к активности при модуляции или поддерживании межклеточных взаимодействий, например, адгезии, или к активности при сохранении структуры клетки, например, клеточных мембран или цитоскелета. "Активность" также может означать удельную активность, например, [каталитическая активность]/[мг белка] или [иммунологическая активность]/[мг белка], концентрацию в биологическом компартементе и т.п. "Активность" может относиться к модуляции компонентов врожденной или адаптивной иммунных систем.
"Введение" и "обработка" (или лечение), применительно к животному, например, используемому в исследовании псовому, его клетке, ткани, органу или биологической жидкости, относятся к контакту экзогенного фармацевтического, терапевтического, диагностического средства или композиции с животным, например, псовым, его клеткой, тканью, органом или биологической жидкостью. Обработка клетки охватывает контакт реактива с клеткой, а также контакт реактива с жидкостью, где жидкость находится в контакте с клеткой. "Обработка" или "лечение" означают введение терапевтического средства, такого как композиция, содержащая антитело или антигенсвязывающий фрагмент согласно настоящему изобретению, внутрь или наружно животному (например, псовому или кошачьему), имеющему один или более симптомов заболевания или подозреваемому на наличие заболевания, в отношении которого указанное средство обладает терапевтической активностью. Таким образом, "введение" и "обработка" также включают обработку in vitro и ex vivo, например клетки, реактивом, диагностическим, связывающим соединением или другой клеткой.
Как правило, средство вводят в количестве, эффективном для облегчения и/или уменьшения тяжести одного или более симптомов заболевания у подвергаемого лечению субъекта или популяции, либо путем индукции регрессии, либо ингибирования прогрессии такого симптома (симптомов) в любой клинически измеряемой степени. Количество терапевтического средства, которое является эффективным для облегчения какого-либо конкретного симптома заболевания (также называемое "терапевтически эффективным количеством") может изменяться в зависимости от таких факторов, как состояние заболевания, возраст и вес субъекта (например, псового), а также способности фармацевтической композиции вызывать требуемую реакцию у субъекта. Облегчение и/или уменьшение тяжести симптома заболевания можно оценить с помощью любого клинического измерения, обычно используемого ветеринарами или другими квалифицированными медицинскими работниками для оценки тяжести или статуса прогрессии такого симптома. Хотя вариант осуществления настоящего изобретения (например, способ лечения или изделие) может не быть эффективным при облегчении целевого симптома (симптомов) заболевания у каждого субъекта, он должен облегчать целевой симптом (симптомы) заболевания у статистически значимого количества субъектов, определяемого с помощью любого статистического анализа, известного в уровне техники, такого как t-критерий Стьюдента, хи2-критерий, U-критерий Манна и Уитни, критерий Краскела-Уоллиса (H-критерий), критерий Джонкхиера-Терпстра и критерий Уилкоксона.
Термин "иммунный ответ" относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитов, гранулоцитов и растворимых макромолекул, вырабатываемых вышеуказанными клетками или печенью (в том числе антител, цитокинов и комплемента), которое приводит к селективному повреждению, разрушению или выведению из организма млекопитающего (например, организма псового) раковых клеток, клеток или тканей, инфекцированных патогенами, или инвазивных патогенов.
Термин "субъект" включает любой организм, предпочтительно животное, более предпочтительно млекопитающее (например, псового, кошачьего или человека) и наиболее предпочтительно псового.
При использовании в настоящем описании термин "псовое" включает всех домашних собак, Canis lupus familiaris или Canis familiaris, если не указано иное.
При использовании в настоящем описании термин "кошачье" относится к любому представителю семейства Felidae. Представители этого семейства включают диких, содержащихся в зоопарках и домашних представителей, таких как любой представитель подсемейств Felinae, например, кошек, львов, тигров, пум, ягуаров, леопардов, снежных барсов, пантер, североамериканских пум, гепардов, рысь, рыжих рысей, каракалов или их любые помеси. Кошки также включают домашних кошек, чистокровных и/или нечистокровных кошек-компаньонов, выставочных кошек, лабораторных кошек, клонированных кошек и диких или одичавших кошек.
PD-1 собаки, как было обнаружено, включает аминокислотную последовательность SEQ ID NO: 50 [предварительная заявка на патент США 61/918,946, поданная 20 декабря 2013 года, содержание которой полностью включено в настоящую заявку]. В определенном варианте осуществления PD-1 собаки кодируется нуклеиновой кислотой, включающей нуклеотидную последовательность SEQ ID NO: 49.
PD-L1 собаки, как было обнаружено, включает аминокислотную последовательность SEQ ID NO: 56 [предварительная заявка на патент США 61/918,946, поданная 20 декабря 2013 года, выше]. В определенном варианте осуществления PD-L1 собаки кодируется нуклеотидной последовательностью, включающей SEQ ID NO: 55.
При использовании в настоящем описании "замена аминокислотного остатка" другим аминокислотным остатком в аминокислотной последовательности, например антитела, эквивалентна "замещению аминокислотного остатка" другим аминокислотным остатком и означает, что конкретный аминокислотный остаток в определенном положении в аминокислотной последовательности был замещен (или заменен) другим аминокислотным остатком. Например, одна такая замена (замещение) обозначена как P4A Fc-области аминокислотной последовательности IgGB или IgGC, при этом остаток пролина в аминокислотном положении 4 аминокислотной последовательности Fc-области IgGB или Fc-области IgGC заменен (замещен) остатком аланина.
Таким образом, такие замены могут быть введены специально, т.е. путем направленной замены аланина серином в определенном положении аминокислотной последовательности, например, с помощью технологии рекомбинантной ДНК. В альтернативе конкретный аминокислотный остаток или ряд аминокислотных остатков антитела могут быть заменены одним или более аминокислотными остатками посредством процессов более естественной селекции, например, основанных на способности антитела, продуцируемого клеткой, связываться с определенной областью на таком антигене, например, с областью, содержащей эпитоп или его часть, и/или антителом, включающим конкретную CDR, которая сохраняет ту же каноническую структуру, что и CDR, которую она заменяет. Такие замены/замещения могут приводить к "вариантам" CDR и/или вариантам антител.
Идентичность последовательности относится к степени, в которой аминокислоты двух полипептидов являются одинаковыми в эквивалентных положениях при оптимальном выравнивании двух соответствующих последовательностей. При использовании в настоящем описании одна аминокислотная последовательность на 100% "идентична" второй аминокислотной последовательности, когда аминокислотные остатки обеих последовательностей являются идентичными. Таким образом, аминокислотная последовательность на 50% "идентична" второй аминокислотной последовательности, когда идентичными являются 50% аминокислотных остатков этих двух аминокислотных последовательностей. Сравнение последовательностей выполняют на протяжении непрерывного блока аминокислотных остатков, содержащихся в данном белке, например, сравниваемом белке или части полипептида. В конкретном варианте осуществления учитывают выбранные делеции или вставки, которые могут в ином случае изменять соответствие между двумя указанными аминокислотными последовательностями.
Подобие последовательностей включает идентичные остатки и неидентичные, биохимически родственные аминокислоты. Биохимически родственные аминокислоты, которые обладают общими подобными свойствами и могут быть взаимозаменяемыми, обсуждаются ниже.
Следующие источники относятся к алгоритмам BLAST, часто используемым для анализа последовательностей: BLAST ALGORITHMS: Altschul, S.F., et al., J. Mol. Biol. 215:403-410 (1990); Gish, W., et al., Nature Genet. 3:266-272 (1993); Madden, T.L., et al., Meth. Enzymol. 266:131-141(1996); Altschul, S.F., et al., Nucleic Acids Res. 25:3389-3402 (1997); Zhang, J., et al., Genome Res. 7:649-656 (1997); Wootton, J.C., et al., Comput. Chem. 17:149-163 (1993); Hancock, J.M. et al., Comput. Appl. Biosci. 10:67-70 (1994); ALIGNMENT SCORING SYSTEMS: Dayhoff, M.O., et al., "A model of evolutionary change in proteins", Atlas of Protein Sequence and Structure, vol. 5, suppl. 3. M.O. Dayhoff (ed.), pp. 345-352, (1978); Natl. Biomed. Res. Found., Washington, DC; Schwartz, R.M., et al., "Matrices for detecting distant relationships", Atlas of Protein Sequence and Structure, vol. 5, suppl. 3." (1978), M.O. Dayhoff (ed.), pp. 353-358 (1978), Natl. Biomed. Res. Found., Washington, DC; Altschul, S.F., J. Mol. Biol. 219:555-565 (1991); States, D.J., et al., Methods 3:66-70(1991); Henikoff, S., et al., Proc. Natl. Acad. Sci. USA 89:10915-10919 (1992); Altschul, S.F., et al., J. Mol. Evol. 36:290-300 (1993); ALIGNMENT STATISTICS: Karlin, S., et al., Proc. Natl. Acad. Sci. USA 87:2264-2268 (1990); Karlin, S., et al., Proc. Natl. Acad. Sci. USA 90:5873-5877 (1993); Dembo, A., et al., Ann. Prob. 22:2022-2039 (1994); и Altschul, S.F. "Evaluating the statistical significance of multiple distinct local alignments", Theoretical and Computational Methods in Genome Research (S. Suhai, ed.), pp. 1-14, Plenum, New York (1997).
Канинизированные антитела против антигенов собаки
При использовании в настоящем описании антитело, как говорят, специфично связывается с полипептидом, включающим последовательность данного антигена (в этом случае часть аминокислотной последовательности антигена собаки, например, PD-L1 собаки), если оно связывается с полипептидами, включающими такую часть аминокислотной последовательности антигена собаки, например, PD-L1 собаки, но не связывается с другими белками собаки, не содержащими такую часть последовательности антигена собаки, например, PD-L1 собаки. Например, антитело, которое специфично связывается с полипептидом, включающим PD-L1 собаки, может связываться с FLAG®-меченой формой PD-L1 собаки, но не будет со специфичностью связываться с другими FLAG®-мечеными белками собаки. Антитело или связывающее соединение, полученное из антигенсвязывающего участка антитела, связывается со своим антигеном собаки или его вариантом или мутеином "со специфичностью", если оно обладает аффинностью к такому антигену собаки или его варианту или мутеину, которая по меньшей мере в десять раз больше, более предпочтительно по меньшей мере в 20 раз больше и еще более предпочтительно по меньшей мере в 100 раз больше, чем его аффинность к любому другому протестированному антигену собаки.
При использовании в настоящем описании термин "антитело" относится к любой форме антитела, проявляющей требуемую биологическую активность. Таким образом, он используется в самом широком смысле и прямо охватывает, без ограничения, моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), канинизированные антитела, полностью собачьи антитела, химерные антитела и камелизированные однодоменные антитела. "Исходные антитела" являются антителами, полученными при экспонировании иммунной системы антигену перед модификацией антител для предполагаемого применения, такой как канинизация антитела для применения в качестве терапевтического антитела для собак.
При использовании в настоящем описании, если не указано иное, "фрагмент антитела" или "антигенсвязывающий фрагмент" относится к антигенсвязывающим фрагментам антител, т.е. фрагментам антител, которые сохраняют способность специфично связываться с антигеном, связываемым полноразмерным антителом, например, фрагментам, которые сохраняют одну или более CDR-областей. Примеры антигенсвязывающих фрагментов включают, без ограничения, Fab, Fab', F(ab')2 и Fv-фрагменты; диатела; линейные антитела; молекулы одноцепочечных антител, например, sc-Fv; нанотела и мультиспецифические антитела, полученные из фрагментов антител.
"Fab-фрагмент" состоит из одной легкой цепи и CH1 и вариабельных областей одной тяжелой цепи. Тяжелая цепь Fab молекулы не может образовывать дисульфидную связь с другой молекулой тяжелой цепи. "Fab-фрагмент" может быть продуктом расщепления антитела папаином.
"Кристаллизующийся фрагмент" ("Fc-область") содержит два фрагмента тяжелой цепи (т.е. два идентичных полипептида), включающие CH2 и CH3 домены антитела. Два фрагмента тяжелой цепи удерживаются вместе двумя или более дисульфидными связями и гидрофобными взаимодействиями CH3 доменов. В настоящем изобретении аминокислотная последовательность каждого из четырех Fc-фрагментов IgG собаки основана на установленной границе CH1 и CH2 доменов, как определено Tang et al. [Vet. Immunol. Immunopathol. 80: 259-270 (2001)].
"Fab' фрагмент" содержит одну легкую цепь и часть или фрагмент одной тяжелой цепи, которая содержит VH домен и CH1 домен, а также область между CH1 и CH2 доменами, при этом между двумя тяжелыми цепями двух Fab' фрагментов может образовываться межцепочечная дисульфидная связь с образованием F(ab')2 молекулы.
"F(ab')2 фрагмент" содержит две легких цепи и две тяжелых цепи, содержащие часть константной области между CH1 и CH2 доменами, при этом между этими двумя тяжелыми цепями образуется межцепочечная дисульфидная связь. F(ab')2 фрагмент, таким образом, состоит из двух Fab' фрагментов, которые удерживаются вместе дисульфидной связью между двумя тяжелыми цепями. "F(ab')2 фрагмент" может быть продуктом расщепления антитела пепсином.
"Fv-область" включает вариабельные области из тяжелой и из легкой цепей, но не содержит константных областей.
Термин "одноцепочечное Fv" или "scFv" антитело относится к фрагментам антитела, включающим VH и VL домены антитела, где эти домены присутствуют в одной полипептидной цепи. Обычно Fv полипептид дополнительно включает полипептидный линкер между VH и VL доменами, который позволяет scFv образовывать требуемую структуру для связывания антигена. [См., Pluckthun, THE PHARMACOLOGY OF MONOCLONAL ANTIBODIES, vol. 113 Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); WO 88/01649; а также U.S. 4,946,778 и U.S. 5,260,203]
При использовании в настоящем описании термин "каноническая структура" относится к локальной конформации, которую может принимать каждая из гипервариабельных областей тяжелой и легкой цепи антитела в каркасе, в котором они находятся. Для каждой гипервариабельной области существует небольшое количество канонических структур (обычно обозначаемых простыми целыми числами, такими как 1 или 2 и т.д.), которые можно с большой точностью предсказать по аминокислотным последовательностям соответствующей гипервариабельной области (в частности, в контексте аминокислотной последовательности ее каркаса, как предусмотрено ниже для соответствующих канинизированных мышиных вариабельных доменов против PD-L1 собаки). Такие канонические структуры могут быть определяющими в отношении того, приведет ли модификация аминокислотной последовательности данной CDR к сохранению или потере способности связываться с ее антигенсвязывающим партнером [см., Chothia and Lesk, Canonical Structures for the hypervariable regions of immunoglobulins, J. Mol. Biol. 196:901-917(1987); Chothia et al., Conformation of immunoglobulin hypervaribale regions, Nature, 34:877-883(1989); и Al-Lazikani et al., Standard Conformations for the canonical structures of immunoglobulins, J. Mol. Biol. 273:927-948 (1997)].
"Доменное антитело" является иммунологически функциональным фрагментом иммуноглобулина, содержащим только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях две или более VH областей ковалентно связаны пептидным линкером с получением бивалентного доменного антитела. Две VH области бивалентного доменного антитела могут быть направлены против одних и тех же или разных антигенов.
"Бивалентное антитело" включает два антигенсвязывающих участка. В некоторых случаях два связывающих участка имеют одинаковые антигенные специфичности. Однако бивалентные антитела могут быть биспецифическими (см. ниже).
В некоторых вариантах осуществления моноклональные антитела в настоящей заявке также включают камелизированные однодоменные антитела. [См., например, Muyldermans et al., Trends Biochem. Sci. 26:230 (2001); Reichmann et al., J. Immunol. Methods 231:25 (1999); WO 94/04678; WO 94/25591; U.S. 6,005,079]. В одном варианте осуществления в настоящем изобретении предложены однодоменные антитела, включающие два VH домена с модификациями, при этом образуются однодоменные антитела.
При использовании в настоящем описании термин "диатела" относится к малым фрагментам антитела с двумя антигенсвязывающими участкам, где такие фрагменты включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (VH-VL или VL-VH). При использовании линкера, который является слишком коротким, чтобы допускать спаривание между двумя указанными доменами на одной цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. [См., EP 0 404 097 B1; WO 93/11161; и Holliger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)]. По поводу общего обзора сконструированных вариантов антител смотреть [Holliger and Hudson Nat. Biotechnol. 23:1126-1136 (2005)].
Как правило, антитело или антигенсвязывающий фрагмент согласно изобретению сохраняют по меньшей мере 10% своей связывающей активности в отношении PD-L1 собаки (по сравнению с исходным антителом) при выражении такой активности в молярном отношении. Предпочтительно антитело или антигенсвязывающий фрагмент изобретения сохраняют по меньшей мере 20%, 50%, 70%, 80%, 90%, 95% или 100% или большую аффинность связывания в отношении антигена собаки (например, PD-L1), как исходное антитело. Также подразумевается, что канинизированное антитело или антигенсвязывающий фрагмент согласно изобретению могут включать консервативные или неконсервативные аминокислотные замены (называемые "консервативными вариантами" или "функционально консервативными вариантами" антитела), которые по существу не изменяют его биологическую активность.
"Выделенное антитело" относится к статусу очистки и в таком контексте означает, что молекула по существу свободна от других биологических молекул, таких как нуклеиновые кислоты, белки, липиды, углеводы или другой материал, такие как клеточный дебрис и питательная среда. Обычно термин "выделенный" не должен относиться к полному отсутствию такого материала или к отсутствию воды, буферов или солей, если они не присутствуют в количествах, существенно препятствующих экспериментальному или терапевтическому применению связывающего соединения, как описано в настоящей заявке.
При использовании в настоящем описании "химерное антитело" является антителом, содержащим вариабельный домен из первого антитела и константный домен из второго антитела, где первое и второе антитела получены из различных биологических видов. [U.S. 4,816,567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)]. Как правило, вариабельные домены получены из антитела экспериментального животного ("исходное антитело"), такого как грызун, а последовательности константных доменов получены из антител животного субъекта, например, псового, при этом полученное химерное антитело с меньшей вероятностью вызывает нежелательный иммунный ответ у псового субъекта, чем исходное антитело (например, грызуна).
При использовании в настоящем описании термин "канинизированное антитело" относится к формам антител, содержащих последовательности из собачьих и несобачьих (например, мышиных) антител. Как правило, канинизированное антитело будет включать по существу все из по меньшей мере одного, и обычно два вариабельные домена, где все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям из несобачьего иммуноглобулина (например, включают 6 мышиных CDR-областей против PD-L1 собаки, как представлено ниже), и весь или по существу весь каркас собаки.
Термин "полностью собачье антитело" относится к антителу, включающему только белковые последовательности иммуноглобулина собаки. Полностью собачье антитело может содержать мышиные углеводные цепи, если оно получено в мыши, в клетке мыши или в гибридоме, полученной из клетки мыши. Аналогичным образом, "мышиное антитело" относится к антителу, включающему только последовательности иммуноглобулина мыши. В альтернативе полностью собачье антитело может содержать крысиные углеводные цепи, если оно получено в крысе, в крысиной клетке или в гибридоме, полученной из крысиной клетки. Аналогичным образом, "крысиное антитело" относится к антителу, включающему только последовательности иммуноглобулина крысы.
Вариабельные области каждой пары легкой/тяжелой цепей образуют связывающий участок антитела. Таким образом, как правило, интактное антитело имеет два связывающих участка. За исключением бифункциональных или биспецифических антител, два указанные связывающих участка являются, как правило, одинаковыми.
Как правило, вариабельные домены тяжелых и легких цепей включают три гипервариабельных области, также называемые определяющими комплементарность областями (CDR-областями), расположенные в относительно консервативных каркасных областях (FR). CDR-области обычно фланкированы каркасными областями, допускающими связывание с определенным эпитопом. Как правило, от N-конца до C-конца, вариабельные домены легкой и тяжелой цепей включают FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Отнесение аминокислот к каждому домену в случае человеческих антител обычно соответствует определениям из Sequences of Proteins of Immunological Interest, Kabat, et al.; National Institutes of Health, Bethesda, Md.; 5th ed.; NIH Publ. No. 91-3242 (1991); Kabat, Adv. Prot. Chem. 32:1-75 (1978); Kabat, et al., J. Biol. Chem. 252:6609-6616 (1977); Chothia, et al., J. Mol. Biol. 196:901-917 (1987) or Chothia, et al., Nature 342:878-883 (1989).
При использовании в настоящем описании термин "гипервариабельная область" относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область включает аминокислотные остатки из "определяющей комплементарность области" или "CDR" (т.е. CDRL1, CDRL2 и CDRL3 в вариабельном домене легкой цепи и CDRH1, CDRH2 и CDRH3 в вариабельном домене тяжелой цепи). [См. Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), определение CDR-областей человеческого антитела по последовательности; см. также Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987), определение CDR-областей антитела по структуре]. При использовании в настоящем описании термин "каркасные" или "FR" остатки относится к таким остаткам вариабельных доменов за исключением остатков гипервариабельной области, определенных в настоящем описании как остатки CDR.
При использовании в настоящем описании термин "каркас собаки" относится к аминокислотной последовательности тяжелой цепи и легкой цепи антитела собаки за исключением остатков гипервариабельной области, определенных в настоящем описании как CDR остатки. В обеих цепях аминокислотные последовательности нативных CDR-областей собаки заменены соответствующими чужеродными CDR-областями (например, CDR-областями из мышиного антитела). Необязательно тяжелая и/или легкая цепи антитела собаки могут содержать некоторые чужеродные не-CDR остатки, например, для сохранения структуры чужеродных CDR-областей в антителе собаки и/или изменения функции Fc, как показано ниже.
При использовании в настоящем описании "антитело против PD-L1 собаки" относится к антителу, которое было индуцировано против PD-L1 собаки (например, у млекопитающего, такого как мышь или кролик), и которое специфично связывается с PD-L1 собаки. Антитело, которое "специфично связывается с PD-L1 собаки", или антитело, которое "специфично связывается с полипептидом, включающим аминокислотную последовательность SEQ ID NO: 56", является антителом, которое демонстрирует предпочтительное связывание с PD-L1 собаки по сравнению с другими антигенами, например, связывает PD-L1 собаки "со специфичностью". Связывание не требует абсолютной специфичности связывания. Антитело против собаки LPD-1А считают "специфичным" к PD-L1 собаки, если его связывание позволяет определить присутствие PD-L1 собаки в образце, или если оно способно изменять активность PD-L1 собаки без излишнего нарушениия активности других молекул в образце собаки, например, без получения нежелательных результатов, таких как ложноположительные результаты в диагностическом контексте или побочные действия в терапевтическом контексте. Степень специфичности, требуемая для антитела против PD-L1 собаки, может зависеть от предполагаемого применения антитела и, во всяком случае, определяется его пригодностью для применения в соответствии с предполагаемой целью. Антитело или связывающее соединение, полученное из антигенсвязывающего участка антитела, согласно рассматриваемому способу связывается со своим антигеном или его вариантом или мутеином с аффинностью, которая по меньшей мере в два раза больше, предпочтительно по меньшей мере в десять раз больше, более предпочтительно по меньшей мере в 20 раз больше и наиболее предпочтительно по меньшей мере в 100 раз больше, чем аффинность с любым другим антигеном.
Таким образом, в настоящем изобретении предложены канинизированные антитела против PD-L1 собаки или их антигенсвязывающие фрагменты (в том числе в выделенной форме), которые связывают PD-L1 собаки (например, со специфичностью), а также применения таких антител или их фрагментов. В определенных вариантах осуществления предложены мышиные CDR-области против PD-L1 собаки из мышиных антител против PD-L1 собаки, которые, как было показано, связывали PD-L1 собаки и блокировали связывание PD-L1 собаки со своим рецептором, например, PD-1 собаки. Указанные CDR-области могут быть встроены в модифицированный каркас собаки согласно настоящему изобретению с получением канинизированного мышиного антитела против PD-L1 собаки, как показано в настоящей заявке.
Более конкретно "канинизированное мышиное антитело против PD-L1" настоящего изобретения относится к антителу, включающему три CDR-области тяжелой цепи и три CDR-области легкой цепи из мышиного антитела против PD-L1 собаки вместе с каркасом собаки или модифицированным каркасом собаки. Модифицированный каркас собаки включает изменения одной или более аминокислот, как показано в настоящей заявке, которые дополнительно оптимизируют эффективность канинизированного антитела, например, для усиления, ослабления или устранения эффекторных функций антитела, для повышения его связывания с антигеном собаки, например, PD-L1 собаки, и/или увеличения его способности блокировать связывание антигена собаки, например, PD-L1 собаки, с его природным партнером связывания (например, PD-1 собаки в случае, когда антигеном является PD-L1 собаки).
"Гомология" относится к подобию последовательности между двумя полинуклеотидными последовательностями или между двумя полипептидными последовательностями при их оптимальном выравнивании. Когда положение в обеих из двух сравниваемых последовательностей занято одинаковым основанием или мономерной аминокислотной субъединицей, например, если положение в каждой из двух молекул ДНК занято аденином, то молекулы являются гомологичными по данному положению. Процент гомологии является количеством гомологичных положений, содержащихся в этих двух последовательностях, деленным на общее количество сравниваемых положений и ×100. Например, если 6 из 10 положений в двух последовательностях совпадают или являются гомологичными при оптимальном выравнивании последовательностей, то тогда две последовательности являются гомологичными на 60%. Обычно сравнение производят при выравнивании двух последовательностей, чтобы получить максимальный процент гомологии.
"Выделенная молекула нуклеиновой кислоты" означает ДНК или РНК геномного, мРНК, кДНК или синтетического происхождения или их некоторую комбинацию, которая не ассоциирована с полным или частью полинуклеотида, в котором выделенный полинуклеотид присутствует в природе, или связана с полинуклеотидом, с которым она не связана в природе. В рамках настоящего описания следует понимать, что "молекула нуклеиновой кислоты, включающая" определенную нуклеотидную последовательность, не охватывает интактные хромосомы. Выделенные молекулы нуклеиновых кислот, "включающие" указанные последовательности нуклеиновых кислот, могут включать, в дополнение к указанным последовательностям, кодирующие последовательности для максимум десяти или даже до двадцати или более других белков или их частей или фрагментов, или могут включать функционально связанные регуляторные последовательности, которые регулируют экспрессию кодирующей области указанных последовательностей нуклеиновых кислот, и/или могут включать векторные последовательности.
Фраза "регулирующие последовательности" относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регулирующие последовательности, подходящие для прокариотов, например, включают промотор, необязательно последовательность оператора и участок связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является "функционально связанной", когда она находится в функциональном отношении с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или лидерной последовательности функционально связана с ДНК полипептида, если он экспрессируется в виде пребелка, участвующего в секреции полипептида; промотор или энхансер функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или участок связывания рибосомы функционально связан с кодирующей последовательностью, если он помещен так, чтобы способствовать трансляции. Как правило, "функционально связанный" означает, что связываемые последовательности ДНК являются смежными и, в случае лидерной последовательности, смежными и находящимися в рамке считывания. Впрочем, энхансеры не должны быть смежными. Соединение достигается путем лигирования по удобным сайтам рестрикции. Если такие сайты отсутствуют, синтетические олигонуклеотидные адаптеры или линкеры используются в соответствии со стандартной практикой.
При использовании в настоящем описании выражения "клетка", "линия клеток" и "культура клеток" используются попеременно, и все такие обозначения включают потомство. Таким образом, слова "транформанты" и "транформированные клетки" включают первичную клетку и культуры, полученные из нее без учета количества переносов. Также понятно, что не все потомство будет иметь полностью идентичное содержание ДНК вследствие намеренных или случайных мутаций. Включено мутантное потомство, которое имеет такую же функцию или биологическую активность, как было показано при скрининге исходной транформированной клетки. В случае, когда подразумеваются иные обозначения, это будет ясно из контекста.
При использовании в настоящем описании "последовательность зародышевой линии" относится к последовательности неперестроенных ДНК последовательностей иммуноглобулинов. Может использоваться любой подходящий источник неперестроенных последовательностей иммуноглобулинов. Человеческие последовательности зародышевой линии могут быть получены, например, из баз последовательностей зародышевой линии JOINSOLVER® на веб-сайте Национального института артрита, скелетно-мышечных и кожных заболеваний Национальных институтов здравоохранения США. Последовательности зародышевой линии мыши могут быть получены, например, как описано в Giudicelli et al. [Nucleic Acids Res. 33:D256-D261 (2005)].
Свойства канинизированных антител
У псовых существует четыре тяжелых цепи IgG, называемые A, B, C и D. Эти тяжелые цепи представляют четыре различных субкласса IgG собаки, называемые IgGA, IgGB, IgGC и IgGD. ДНК и аминокислотные последовательности этих четырех тяжелых цепей первоначально были определены Тангом с сотр. [Tang et al., Vet. Immunol. Immunopathol. 80: 259-270 (2001)]. Аминокислотные и ДНК последовательности этих тяжелых цепей также доступны в базах GenBank. Например, аминокислотная последовательность тяжелой цепи IgGA имеет регистрационный номер AAL35301.1, IgGB имеет регистрационный номер AAL35302.1, IgGC имеет регистрационный номер AAL35303.1, и IgGD имеет регистрационный номер (AAL35304.1). Антитела собаки также содержат два типа легких цепей, каппа и лямбда. ДНК и аминокислотная последовательности этих легких цепей могут быть получены в базах GenBank. Например, аминокислотная последовательность каппа легкой цепи имеет регистрационный номер ABY 57289.1, и лямбда легкая цепь имеет регистрационный номер ABY 55569.1. В настоящем изобретении аминокислотная последовательность каждого из четырех Fc-фрагментов IgG собаки основана на установленной границе CH1 и CH2 доменов, определенной в Tang et al. выше.
Создание терапевтического моноклонального антитела является сложным процессом, который включает координацию сложного комплекса операций для получения требуемого антитела. Они включают оптимизацию специфичности антитела, аффинности, функциональной активности, уровня экспрессии в рекомбинантных клеточных линиях, длительной стабильности, устранения или улучшения эффекторных функций и разработки рентабельных способов производства и очистки. С учетом целей настоящего изобретения и помимо способности активировать клетки иммунных систем, канинизированное или собачье моноклональное антитело против PD-L1 собаки в оптимальном варианте имеет три дополнительных признака:
1. отсутствие эффекторных функций, таких как антителозависимая цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC),
2. относительно длительный полупериод существованиия in vivo; и
3. возможность очистки в крупном масштабе с помощью стандартных промышленных технологий, таких как хроматография на основе белка A.
Ни один из природных субклассов IgG собаки не соответствует все этим критериям. Например, IgGB может быть очищен с помощью белка A, но имеет высокий уровень ADCC активности. IgGC также обладает значительной ADCC активностью. С другой стороны, IgGA слабо связывается с белком A, но проявляет нежелательную активность ADCC. Кроме того, ни IgGC, ни IgGD не могут быть очищены на колонках с белком A, хотя IgGD не проявляет ADCC активности. Помимо этого IgGC имеет короткий полупериод существования в сыворотке, поскольку он не связывается с FcRn рецептором собаки. Настоящее изобретение позволяет преодолеть эту сложность путем предоставления модифицированных IgG антител собаки, специфичных к антигенам собаки, например, PD-L1 собаки; такие антитела не имеют эффекторных функций, таких как ADCC и CDC, демонстрируют относительно длительный полупериод существования и могут быть легко очищены с помощью стандартной промышленной хроматографии с белком A.
До настоящего момента генетически модифицированные IgG собаки, которые не обладают ADCC и CDC эффекторными функциями и, кроме этого, могут быть очищены с помощью хроматографии с белком A, не были описаны. Как раскрыто в настоящей заявке, одна замена в положении IgG собаки, которая аналогична IgG человека и мыши, такая как N297A или D265A, не позволяет полностью устранить ADCC и CDC эффекторные функции в соответствующем антителе собаки. Например, тогда как каждая из замен N297 и D265 в человеческих или мышиных антителах приводит к устранению связывания с Fcγ рецептором и C1q, ни одна из замен в отдельности не обеспечивала полного устранения связывания антител собаки с C1q. Вместо этого, как дополнительно раскрыто ниже, для одновременного устранения ADCC и CDC в антителах собаки IgGB или IgGC субклассов, как оказалось, потребовалось сделать двойную замену в Fc антитела собаки, сочетающую замену аспарагина на аланин и аспарагиновой кислоты на аланин. Кроме того, совершенно неожиданно одна замена, которая, как было показано, уменьшала эффекторные функции человеческих антител, на деле приводила к усилению связывания соответствующего IgG собаки с FcγR и C1q.
Для создания вариантов IgGB и IgGC собаки, которые не имеют эффекторных функций, могут быть получены модифицированные тяжелые цепи IgGB собаки или модифицированные тяжелые цепи IgGC собаки. В общей сложности семь аминокислотных остатков, которые присутствуют в обоих из указанных областей кристаллизующихся фрагментов собаки (cFc), были идентифицированы для выполнения такой возможной замены. Эти семь аминокислотных остатков являются следующими: P4, D31, N63, G64, T65, A93 и P95 для аминокислотной последовательности SEQ ID NO: 66 Fc IgGB собаки и для аминокислотной последовательности SEQ ID NO: 68 Fc IgGC собаки. Таким образом, аминокислотная последовательность SEQ ID NO: 2 отличается от аминокислотной последовательности SEQ ID NO: 66 наличием аминокислотных остатков в положениях: 4, 31, 63, 64, 65, 93 и 95, которые являются пролином (P), аспарагиновой кислотой (D), аспарагином (N), глицином (G), треонином (T), аланином (A) и пролином (P), соответственно, в аминокислотной последовательности SEQ ID NO: 66 как "X" (или "Xaa" в трехбуквенном коде) для всех семи положений, что означает то, что указанные семь аминокислотных положений могут быть любой из двадцати природных аминокислот (см. список в столбце 1 Таблицы 1 ниже). Аналогичным образом, аминокислотная последовательность SEQ ID NO: 4 отличается от аминокислотной последовательности SEQ ID NO: 68 наличием аминокислотных остатков в положениях 4, 31, 63, 64, 65, 93 и 95, которые перечислены как "X" (или "Xaa" в трехбуквенном коде) для всех семи положений, что означает то, что эти семь аминокислотных положений могут быть любой из двадцати природных аминокислот. Аминокислотная последовательность SEQ ID NO: 2 кодируется нуклеотидной последовательностью SEQ ID NO: 1, тогда как аминокислотная последовательность SEQ ID NO: 4 кодируется нуклеотидной последовательностью SEQ ID NO: 3.
В одном варианте осуществления cFc включает аминокислотную последовательность SEQ ID NO: 66 со следующими заменами: P4 (A, G или S), D31 (A, G или S), N63 (A, G или S), G64 (A или P), T65 (A, G или S), A93 (G или S) и P95 (A, G или S); где P4 (G или S) означает, что остаток пролина в положении 4 заменен остатком аланина, глицина или серина, и, аналогично, G64 (P или A) означает, что остаток глицина в положении 64 заменен остатком пролина или аланина, и т.д.). В конкретном варианте осуществления cFc включает аминокислотную последовательность SEQ ID NO: 66 со следующими заменами: P4A, D31A, N63A, G64P, T65A, A93G и P95A,
В соответствующем варианте осуществления cFc включает аминокислотную последовательность SEQ ID NO: 4, которая содержит 7 аминокислот, обозначенных как Xaa, со следующими аминокислотными остатками: A4, A31, A63, G64, T65, G93 и A95, т.е. аминокислотная последовательность SEQ ID NO: 68 со следующими пятью (5) изменениями аминокислотных остатков: P4A, D31A, N63A, A93G и P95A, и два остальных аминокислотных остатка из семи, G64 и T65, сохраняются из аминокислотной последовательности SEQ ID NO: 68.
Все аминокислотные последовательности SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO: 32 содержат "X" (или "Xaa" в трехбуквенном коде) в семи аминокислотных положениях, что означает то, что семь указанных аминокислотных положений могут быть любой из двадцати природных аминокислот, перечисленных в столбце 1 Таблицы 1 ниже. В частности, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO: 32 включают либо аминокислотную последовательность SEQ ID NO: 2, либо аминокислотную последовательность SEQ ID NO: 4 в их соответствующих последовательностях. Определенные примеры аминокислотных остатков в одном или более из семи указанных положений в аминокислотных последовательностях определены выше и ниже и, таким образом, включены в род отдельных аминокислотных последовательностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO: 32, а также в канинизированные антитела, включающие эти последовательности.
В Таблице 10, предоставленной ниже, прямо сравниваются семь аминокислотных положений, которые могут быть заменены, как раскрыто в настоящей заявке, в Fc cIgGB (SEQ ID NO: 66 и SEQ ID NO: 2) и Fc cIgGC (SEQ ID NO: 68 и SEQ ID NO: 4), с положениями в полноразмерных тяжелых цепях собаки, включающих указанные аминокислотные последовательности cFc, т.е. SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO: 32. Таким образом, фактическое положение в полноразмерной последовательности IgGB или IgGC можно с легкостью согласовать с положением cFc, которое он включает, с помощью Таблицы 10 ниже.
В определенных вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 26, включающую: (i) P, A, G или S в положении 242, (ii) D, A, G или S в положении 269, (iii) N, A, G или S в положении 301, (iv) G, P или A в положении 302, (v) T, A, G или S в положении 303, (vi) A, G или S в положении 331 и (vii) P, A, G или S в положении 333. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 28 или 30, включающую: (i) P, A, G или S в положении 240, (ii) D, A, G или S в положении 267, (iii) N, A, G или S в положении 299, (iv) G, P или A в положении 300, (v) T, A, G или S в положении 301, (vi) A, G или S в положении 329 и (vii) P, A, G или S в положении 331. В других вариантах осуществления тяжелая цепь антитела включает аминокислотную последовательность SEQ ID NO: 31, включающую: (i) P, A, G или S в положении 238, (ii) D, A, G или S в положении 265, (iii) N, A, G или S в положении 297, (iv) G, P или A в положении 298, (v) T, A, G или S в положении 299, (vi) A, G или S в положении 327 и (vii) P, A, G или S в положении 329.
В настоящем изобретении также предложены модифицированные IgGD собаки, включающие шарнирную область из IgGA, IgGB или IgGC вместо его природной шарнирной области IgGD. В альтернативе шарнирная область IgGD может быть генетически модифицирована путем замены остатка серина остатком пролина, как показано в Таблице 5. Такие модификации могут приводить к IgGD собаки, который не имеет обмена Fab-фрагментами. Модифицированные IgGD собаки могут быть сконструированы с помощью стандартных методов технологии рекомбинантных ДНК [например, Maniatis et al., Molecular Cloning, A Laboratory Manual (1982)]. Для создания таких вариантов нуклеиновые кислоты, кодирующие аминокислотную последовательность IgGD собаки, могут быть модифицированы так, чтобы они кодировали модифицированные IgGD. Модифицированные последовательности нуклеиновых кислот затем клонируют в экспрессионные плазмиды для экспрессии белка. Нуклеиновые кислоты, кодирующие Fc IgGD собаки с замененной шарнирной областью, представлены нуклеотидными последовательностями SEQ ID NO: 7, 9 и 11, которые кодируют аминокислотные последовательности SEQ ID NO: 8, 10 и 12. Нуклеиновая кислота, кодирующая Fc IgGD собаки с модифицированной шарнирной областью IgGD, включает нуклеотидную последовательность SEQ ID NO: 5, которая кодирует аминокислотную последовательность SEQ ID NO: 6.
В настоящем изобретении также предложены полноразмерные тяжелые цепи собаки, которые могут быть сопряжены с соответствующими легкими цепями с получением канинизированного антитела. Таким образом, в настоящем изобретении также предложены канинизированные мышиные антитела против антигена собаки (в том числе выделенные канинизированные мышиные антитела против PD-L1 собаки), а также способы применения антител или их антигенсвязывающих фрагментов в лечении заболевания, например лечении рака, у собак.
Кроме того, в настоящем изобретении предложены канинизированные мышиные антитела против PD-L1 собаки или антигенсвязывающие фрагменты, связывающиеся с PD-L1 собаки и блокирующие связывание PD-1 собаки с PD-L1 собаки. В некоторых вариантах осуществления канинизированные мышиные антитела против PD-L1 собаки включают модифицированную Fc IgGB собаки, модифицированную Fc IgGC собаки или модифицированный IgGD собаки, не имеющий обмена Fab-фрагментами, как описано в настоящей заявке.
Антитело или его антигенсвязывающий фрагмент, связывающие антиген собаки, например, PD-L1 собаки, могут включать одну, две, три, четыре, пять или шесть из определяющих комплементарность областей (CDR-областей) мышиного антитела против собаки, как описано в настоящей заявке. Одна, две, три, четыре, пять или шесть CDR-областей могут быть независимо выбраны из CDR последовательностей, представленных ниже. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент, которые связывают PD-L1 собаки, включают каппа легкую цепь антитела собаки, включающую мышиные CDR 1, CDR 2 и/или CDR 3 легкой цепи, и тяжелую цепь IgG антитела собаки, включающую мышиные CDR 1, CDR 2 и/или CDR 3 тяжелой цепи. Таким образом, в настоящем изобретении также предложены полноразмерные тяжелые цепи собаки, которые могут быть сопряжены, например, с соответствующими легкими цепями, с получением канинизированного антитела [см. Таблицу 2 ниже, в которой представлены последовательности двух наборов CDR-областей мышиного антитела к PD-L1 собаки, например, 4F9 и 5F12].
В других вариантах осуществления изобретения предложены антитела или их антигенсвязывающие фрагменты, со специфичностью связывающие PD-L1 и имеющие каппа легкие цепи антитела собаки, включающие от одной до шести различных CDR-областей, включающих по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичности последовательности с аминокислотными последовательностями SEQ ID NO: 16, 17, 18, 22, 23 и/или 24, и тяжелую цепь IgG антитела собаки, включающую от одной до шести различных CDR-областей, включающих по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичности последовательности с аминокислотными последовательностями SEQ ID NO: 13, 14, 15, 19, 20 и/или 21, которые сохраняют требуемые связывающие и функциональные свойства. В другом варианте осуществления антитело или антигенсвязывающий фрагмент настоящего изобретения включают каркас собаки, включающий комбинацию последовательности тяжелой цепи IgG с каппа легкой цепью, имеющей одну или более вышеуказанных аминокислотных последовательностей CDR с 0, 1, 2, 3, 4 или 5 консервативными или неконсервативными аминокислотными заменами, с сохранением требуемых связывающих и функциональных свойств.
"Консервативно модифицированные варианты" или "консервативная замена" относятся к заменам аминокислот в белке другими аминокислотами, обладающими подобными свойствами (например, зарядом, размером боковой цепи, гидрофобностью/гидрофильностью, конформацией и жесткостью скелета и т.д.), при этом изменения можно часто вводить без изменения биологической активности белка. Специалистам в данной области будет очевидно, что в целом замены одиночных аминокислот в несущественных областях полипептида не вызывают существенного изменения биологической активности [см., например, Watson et al., Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Ed.; 1987)]. Кроме того, замены структурно или функционально подобных аминокислот с меньшей вероятностью нарушают биологическую активность. Примеры консервативных замен приведены в Таблице I непосредственно ниже.
ТАБЛИЦА 1
ПРИМЕРНЫЕ КОНСЕРВАТИВНЫЕ АМИНОКИСЛОТНЫЕ ЗАМЕНЫ
|
Функционально консервативные варианты антител изобретения также предусмотрены в настоящем изобретении. "Функционально консервативные варианты" при использовании в настоящем описании относятся к антителам или фрагментам, в которых один или более аминокислотных остатков были изменены без изменения требуемого свойства, такого как антигенная аффинность и/или специфичность. Такие варианты включают, без ограничения, замену аминокислоты аминокислотой, обладающей подобными свойствами, такую как консервативные аминокислотные замены в Таблице I выше.
Нуклеиновые кислоты
Настоящее изобретение дополнительно включает нуклеиновые кислоты, кодирующие иммуноглобулиновые цепи канинизированного мышиного антитела против PD-L1 собаки и его антигенсвязывающие фрагменты, раскрытые в настоящей заявке (см. Примеры ниже).
Также в настоящее изобретение включены нуклеиновые кислоты, которые кодируют иммуноглобулиновые полипептиды, включающие аминокислотные последовательности, которые по меньшей мере на приблизительно 70% идентичны, предпочтительно по меньшей мере на приблизительно 80% идентичны, более предпочтительно по меньшей мере на приблизительно 90% идентичны и наиболее предпочтительно по меньшей мере на приблизительно 95% идентичны (например, на 95%, 96%, 97%, 98%, 99%, 100%) аминокислотным последовательностям CDR-областей и/или cFc собаки, и/или антител, предложенных в настоящей заявке, при выполнении сравнения с помощью алгоритма BLAST, где параметры алгоритма подобраны так, чтобы получить наибольшее совпадение между соответствующими последовательностями по всей длине соответствующих референсных последовательностей. В настоящем изобретении также предложены нуклеиновые кислоты, которые кодируют иммуноглобулиновые полипептиды, включающие аминокислотные последовательности, которые по меньшей мере на приблизительно 70% подобны, предпочтительно по меньшей мере на приблизительно 80% подобны, более предпочтительно по меньшей мере на приблизительно 90% подобны и наиболее предпочтительно по меньшей мере на приблизительно 95% подобны (например, на 95%, 96%, 97%, 98%, 99%, 100%) любой из референсных аминокислотных последовательностей при выполнении сравнения с помощью алгоритма BLAST, где параметры алгоритма подобраны так, чтобы получить наибольшее совпадение между соответствующими последовательностями по всей длине соответствующих референсных последовательностей.
В настоящем изобретении также предложены векторы экспрессии, включающие нуклеиновые кислоты (в том числе выделенные нуклеиновые кислоты) изобретения, где нуклеиновая кислота функционально связана с регулирующими последовательностями, распознаваемыми клеткой-хозяином, когда клетка-хозяин трансфицирована вектором. Также предложены клетки-хозяева, включающие вектор экспрессии настоящего изобретения, и способы получения антитела или его антигенсвязывающего фрагмента, раскрытых в настоящей заявке, включающие культивирование клеток-хозяев, несущих вектор экспрессии, кодирующий антитело или антигенсвязывающий фрагмент, в питательной среде и выделение антигена или его антигенсвязывающего фрагмента из клеток-хозяев или питательной среды.
Канинизированное мышиное антитело против PD-L1 собаки, например, может быть получено рекомбинантно, с помощью способов, которые известны в данной области техники. Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии антител или фрагментов, раскрытых в настоящей заявке, известны в уровне техники и включают множество иммортализованных клеточных линий, доступных из Американской коллекции типовых культур (ATCC). Они включают, среди прочего, клетки яичника китайского хомячка (CHO), NSO, клетки SP2, клетки HeLa, клетки почки новорожденного хомяка (BHK), клетки почки обезьяны (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), клетки A549, клетки 3T3, клетки HEK-293 и многие другие клеточные линии. Клетки-хозяева, происходящие из млекопитающих, включают клетки человека, мыши, крысы, собаки, обезьяны, свиньи, козы, быка, лошади и хомяка. Особо предпочтительные клеточные линии выбирают при определении того, какие клеточные линии имеют высокие уровни экспрессии. Другие клеточные линии, которые могут использоваться, являются линиями клеток насекомых, такими как клетки Sf9, клетки земноводных, бактериальные клетки, растительные клетки и клетки грибов. При введени рекомбинантных векторов экспрессии, кодирующих тяжелую цепь или ее антигенсвязывающую часть или фрагмент, легкую цепь и/или ее антигенсвязывающий фрагмент, в клетки-хозяева млекопитающих, антитела получают при культивировании клеток-хозяев в течение периода времени, достаточного для экспрессии антитела в клетках-хозяевах или, более предпочтительно, секреции антитела в среду культивирования, в которой выращивают клетки-хозяева.
Антитела могут быть выделены из среды культивирования с помощью стандартных методов очистки белков. Кроме того, экспрессия антител изобретения (или других молекул на их основе) из линий клеток-продуцентов может быть увеличена с помощью многих известных методов. Например, система экспрессии генов на основе глутаминсинтетазы (система GS) является стандартным методом повышения экспрессии при некоторых условиях. Система GS описана полностью или частично в связи с европейскими патентами 0 216 846, 0 256 055 и 0 323 997 и заявкой на европейский патент 89303964.4.
Как правило, гликопротеины, продуцируемые в конкретной линии клеток или трансгенном животном, имеют профиль гликозилирования, характерный для гликопротеинов, продуцируемых в линии клеток или трансгенном животном. Таким образом, конкретный профиль гликозилирования антитела будет зависеть от конкретной линии клеток или трансгенного животного, используемых для продукции антитела. Впрочем, все антитела, кодируемые молекулами нуклеиновых кислот, предложенными в настоящей заявке, или включающие аминокислотные последовательности, предложенные в настоящей заявке, включены в настоящее изобретение независимо от профиля гликозилирования, который могут иметь антитела. Аналогичным образом, в определенных вариантах осуществления антитела с профилем гликозилирования, включающим только нефукозилированные N-гликаны, могут быть предпочтительными, поскольку такие антитела, как было показано, демонстрруют, как правило, более высокую эффективность, чем их фукозилированные аналоги, как in vitro, так и in vivo [см., например, Shinkawa et al., J. Biol. Chem. 278: 3466-3473 (2003); патенты США 6,946,292 и 7,214,775].
Настоящее изобретение дополнительно включает фрагменты канинизированных мышиных антител против PD-L1 собаки, раскрытые в настоящей заявке. Фрагменты антител включают F(ab)2-фрагменты, которые могут быть получены в результате ферментативного расщепления IgG, например, пепсином. Fab-фрагменты могут быть получены, например, при восстановлении F(ab)2 дитиотреитолом или меркаптоэтиламином. Fab-фрагмент представляет собой VL-CL цепь, прикрепленную к VH-CH1 цепи дисульфидным мостиком. F(ab)2 фрагмент представляет собой два Fab-фрагмента, которые, в свою очередь, соединены двумя дисульфидными мостиками. Fab часть молекулы F(ab)2 включает часть FC-области, между которой расположены дисульфидные мостики. FV Фрагмент является VL или VH областью.
В одном варианте осуществления антитело или антигенсвязывающий фрагмент включают константную область тяжелой цепи, например, константную область собаки, такую как константную область тяжелой цепи IgGA, IgGB, IgGC и IgGD собаки или ее вариант. В другом варианте осуществления антитело или антигенсвязывающий фрагмент включают константную область легкой цепи, например, константную область легкой цепи собаки, такую как лямбда или каппа область легкой цепи собаки или ее вариант. В качестве примера, и без ограничения, константная область тяжелой цепи собаки может быть из IgGB, а константная область легкой цепи собаки может быть из каппа.
Инженерия антител
Канинизированные мышиные антитела против PD-L1 собаки согласно настоящему изобретению могут быть сконструированы таким образом, что они включают модификации в собачьем каркасе исходного (т.е. собачьего) моноклонального антитела, например, для улучшения свойств антитела, как подробно описано ниже.
Перекрестно-блокирующие антитела и связывание эпитопа
Перекрестно-блокирующие антитела и их антигенсвязывающие фрагменты, которые перекрестно конкурируют с 4F9 и/или 5F12, включая канинизированные перекрестно-блокирующие антитела и их антигенсвязывающие фрагменты, являются частью настоящего изобретения. Кроме того, антитела и их антигенсвязывающие фрагменты, которые связываются с тем же эпитопом, что и любое из антител против PD-L1 собаки или их фрагментов согласно настоящему изобретению, также являются частью настоящего изобретения. Перекрестно-блокирующие антитела и антигенсвязывающие фрагменты могут быть идентифицированы по их способности перекрестно конкурировать с 4F9 и/или 5F12 в стандартных анализах связывания (например, BIACore®, ELISA или проточной цитометрии). Например, могут использоваться стандартные анализы ELISA, в которых рекомбинантный белок PD-L1 собаки иммобилизирован на планшете, одно из антител флуоресцентно мечено, при этом оценивают способность немеченых антител конкурировать с меченым антителом за связывание. Дополнительно или альтернативно анализ BIAcore® может использоваться для оценки способности антител перекрестно конкурировать. Способность тестируемого антитела ингибировать связывание, например 4F9 и/или 5F12 с PD-L1 собаки, демонстрирует, что тестируемое антитело может конкурировать с 4F9 и/или 5F12 за связывание с PD-L1 собаки и, таким образом, может, в некоторых случаях, связываться с тем же эпитопом на PD-L1 собаки, что и 4F9 и/или 5F12. В более конкретных вариантах осуществления перекрестно-блокирующие антитела и их антигенсвязывающие фрагменты, которые перекрестно конкурируют с 4F9 и/или 5F12, а также связываются с тем же эпитопом на PD-L1 собаки, что и 4F9 и/или 5F12, также являются частью настоящего изобретения.
Вакцины на основе пептидов и слитых белков
Пептиды, включающие эпитопы (или их части), распознаваемые моноклональными антителами и слитыми белками против PD-L1 собаки, включающими такие пептиды, могут применяться в качестве вакцин для индукции антител, которые блокируют связывание PD-L1 с PD-1 и приводят к активации Т-клеток и усилению иммунного ответа. Такие вакцины могут применяться в качестве терапевтических вакцин при заболеваниях, таких как рак, или действовать в качестве усилителей иммунного ответа на другие вакцины. Для применения этих пептидов в качестве вакцин один, или более этих пептидов могут быть соединены химически или с помощью методов генной инженерии с белком-носителем для повышения иммуногенности этих пептидов и индукции пептид-специфических антител. Методики присоединения пептидов к белкам-носителям известны специалистам. Вакцины на основе пептидов (и соответствующих слитых белков) могут применяться для вакцинации животных, например, внутримышечным (в/м), подкожным (п/к), пероральным путем, распылением или in ovo (см. также ниже). Такие вакцины могут применяться в качестве субъединичных белков, экспрессированных в бактериальных, вирусных, дрожжевых или бакуловирусных системах. В альтернативе такие вакцины на основе пептидов (или слитых белков) можно доставлять при введении различных вирусных или бактериальных векторов, экспрессирующих такой пептид или слитые белки, что можно осуществлять способами, известными специалистам. Вакцины на основе пептидов или слитых белков могут применяться в дозах от 1-1000 мкг и необязательно могут содержать адъювант и приемлемый фармацевтический носитель.
Фармацевтические композиции и введение
Для получения фармацевтических или стерильных композиций канинизированного мышиного антитела против PD-L1 собаки или его антигенсвязывающего фрагмента, они могут быть смешаны с фармацевтически приемлемым носителем или вспомогательным веществом. [См., например, Remington's Pharmaceutical Sciences and U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, PA (1984)].
Лекарственные формы терапевтических и диагностических средств могут быть получены путем смешивания с походящими носителями, вспомогательными веществами или стабилизаторами в форме, например, лиофилизированных порошков, водных растворов или суспензий [см., например, Hardman, et al. (2001) Goodman and Gilmanʹs The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, NY; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, NY; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, NY]. В одном варианте осуществления антитела против PD-L1 согласно настоящему изобретению разведены в подходящей концентрации в растворе ацетата натрия с pH 5-6, при этом NaCl или сахарозу добавляют для тоничности. Дополнительные вещества, такие как полисорбат 20 или полисорбат 80, могут быть добавлены для увеличения стабильности.
Токсичность и терапевтическая эффективность композиций антител, вводимых отдельно или в сочетании с другим средством, могут быть определены с помощью стандартных фармацевтических методик в культурах клеток или на экспериментальных животных, например, для определения LD50 (дозы, смертельной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Отношение дозы между токсическими и терапевтическими эффектами является терапевтическим индексом (LD50/ED50). В определенных аспектах предпочтительны антитела, демонстрирующие высокие терапевтические индексы. Данные, полученные из таких анализов культур клеток и исследований на животных, могут использоваться при составлении диапазона вводимых доз для применения на собаках. Дозировка таких соединений предпочтительно находится в диапазоне циркулирующих концентраций, которые включают ED50 с минимальной токсичностью или без нее. Дозировка может изменяться в пределах данного диапазона в зависимости от используемой лекарственной формы и пути введения.
Схема введения может быть различной. Подходящие пути введения включают пероральный, ректальный, трансмукозальный, кишечный, парентеральный; внутримышечный, подкожный, внутрикожный, интрамедуллярный, интратекальный, прямой интравентрикулярный, внутривенный, внутрибрюшинный, интраназальный, внутриглазной, ингаляцию, инсуффляцию, наружный, кожный, трансдермальный или внутриартериальный. В определенных вариантах осуществления канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент могут быть введены инвазивным путем, таким как инъекция. В других вариантах осуществления изобретения мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент или его фармацевтическую композицию вводят внутривенно, подкожно, внутримышечно, внутриартериально, интратуморально или с помощью ингаляции, аэрозольной доставки. Введение неинвазивными путями (например, перорально; например, в пилюле, капсуле или таблетке), также включно в объем настоящего изобретения.
Фармацевтические композиции, раскрытые в настоящей заявке, также можно вводить инфузией. Примеры известных имплантатов и модулей для введения фармацевтических композиций включают: патент США 4,487,603, в котором раскрыт имплантируемый микроинфузионный насос для дозирования лекарственного средства с регулируемой скорость; патент США 4,447,233, в котором раскрыт медицинский инфузионный насос для доставки лекарственного средства с точной скоростью инфузии; патент США 4,447,224, в котором раскрыто имплантируемое инфузионное устройство переменного потока для непрерывной доставки лекарственного средства; патент США 4,439,196, в котором раскрыта осмотическая система доставки лекарственного средства, имеющая многокамерные емкости. Многие другие подобные имплантаты, системы доставки и модули известны специалистам.
Попеременно можно вводить канинизированное мышиное антитело против PD-L1 собаки местным, а не системным путем, например, при помощи инъекции антитела непосредственно в пораженный артритом сустав или вызванное патогеном поражение, характеризуемое иммунопатологией, часто в лекарственной форме депо или с замедленным высвобождением. Кроме того, можно вводить антитело в системе направленной доставки лекарственного средства, например, в липосоме, покрытой тканеспецифическим антителом, направленным, например, против пораженного артритом сустава или вызванного патогеном поражения, характеризуемого иммунопатологией. Липосомы будут направляться и селективно захватываться пораженной тканью.
Схема введения зависит от нескольких факторов, включающих скорость выведения терапевтического антитела из сыворотки или ткани, уровень симптомов, иммуногенность терапевтического антитела и доступность клеток-мишеней в биологической матрице. Предпочтительно схема введения обеспечивает доставку достаточного количества терапевтического антитела для улучшения целевого патологического состояния при одновременном сведении к минимуму нежелательных побочных действий. Таким образом, количество доставляемого биопрепарата частично зависит от конкретного терапевтического антитела и тяжести подвергаемого лечению состояния. Доступно руководство по подбору подходящих доз терапевтических антител [см., например, Wawrzynczak Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK (1996); Kresina (ed.) Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, NY (1991); Bach (ed.) Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, NY (1993); Baert, et al. New Engl. J. Med. 348:601-608 (2003); Milgrom et al. New Engl. J. Med. 341:1966-1973 (1999); Slamon et al. New Engl. J. Med. 344:783-792 (2001); Beniaminovitz et al. New Engl. J. Med. 342:613-619 (2000); Ghosh et al. New Engl. J. Med. 348:24-32 (2003); Lipsky et al. New Engl. J. Med. 343:1594-1602 (2000)].
Определение подходящей дозы производится ветеринаром, например, с помощью параметров или факторов, которые, как известно или предполагается в уровне техники, влияют на лечение. Обычно доза начинается с количества, которое несколько меньше оптимальной дозы, и затем ее увеличивают с малыми приращениями, пока не будет достигнут нужный или оптимальный эффект по отношению к каким-либо негативным побочным действиям. Важные диагностические параметры включают показатели симптомов, например, воспаление или уровень вырабатываемых воспалительных цитокинов.
Антитела или их антигенсвязывающие фрагменты, раскрытые в настоящей заявке, могут быть введены путем непрерывной инфузии, или в дозах, вводимых, например, ежедневно, 1-7 раз в неделю, еженедельно, раз в две недели, ежемесячно, два раза в месяц, ежеквартально, раз в полгода, ежегодно и т.д. Дозы могут быть введены, например, внутривенно, подкожно, наружно, перорально, назально, ректально, внутримышечно, интрацеребрально, интраспинально или ингаляцией. Общая еженедельная доза обычно составляет по меньшей мере 0,05 мкг/кг массы тела, более широко по меньшей мере 0,2 мкг/кг, 0,5 мкг/кг, 1 мкг/кг, 10 мкг/кг, 100 мкг/кг, 0,25 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 5,0 мг/мл, 10 мг/кг, 25 мг/кг, 50 мг/кг или больше [см., например, Yang, et al. New Engl. J. Med. 349:427-434 (2003); Herold, et al. New Engl. J. Med. 346:1692-1698 (2002); Liu, et al. J. Neurol. Neurosurg. Psych. 67:451-456 (1999); Portielji, et al. Cancer Immunol. Immunother. 52:133-144 (2003)]. Дозы могут быть также предоставлены с достижением заданной целевой концентрации канинизированного мышиного антитела против PD-L1 собаки в сыворотке субъекта, такой как 0,1, 0,3, 1, 3, 10, 30, 100, 300 мкг/мл или больше. В других вариантах осуществления канинизированное мышиное антитело против PD-L1 собаки согласно настоящему изобретению вводят подкожно или внутривенно, еженедельно, раз в две недели, "каждые 4 недели", ежемесячно, два раза в месяц или ежеквартально в количестве 10, 20, 50, 80, 100, 200, 500, 1000 или 2500 мг/субъект.
При использовании в настоящем описании "ингибирование" или "лечить" или "лечение" включают задержку развития симптомов, связанных с нарушением, и/или уменьшение тяжести симптомов такого нарушения. Данные термины дополнительно включают уменьшение тяжести существующих неконтролируемых или нежелательных симптомов, предотвращение дополнительных симптомов и уменьшение тяжести или предотвращение первопричин таких симптомов. Таким образом, термины обозначают, что полезный результат был достигнут у позвоночного субъекта с нарушением, заболеванием или симптомом, или с возможностью развития такого нарушения, заболевания или симптома.
При использовании в настоящем описании термины "терапевтически эффективное количество", "терапевтически эффективная доза" и "эффективное количество" относятся к такому количеству канинизированного мышиного антитела против PD-L1 собаки или его антигенсвязывающего фрагмента согласно настоящему изобретению, которое при введении отдельно или в сочетании с дополнительным терапевтическим средством в клетку, ткань или субъекту является эффективным, чтобы вызвать поддающееся измерению улучшение одного или более симптомов заболевания или состояния, или прогрессии такого заболевания или состояния. Терапевтически эффективная доза также относится к такому количеству связывающего соединения, которое достаточно, по меньшей мере, для частичного уменьшения тяжести симптомов, например, лечения, заживления, предотвращения или уменьшения тяжести соответствующего заболевания или повышения скорости лечения, заживления, профилактики или уменьшения тяжести таких состояний. Применительно к индивидуальному активному ингредиенту, вводимому отдельно, терапевтически эффективная доза относится к одному такому ингредиенту. Применительно к комбинации, терапевтически эффективная доза относится к общим количествам активных ингредиентов, которые приводят к терапевтическому эффекту, независимо от их введения в комбинации, последовательно или одновременно. Эффективное количество терапевтического средства приведет к улучшению диагностического показателя или параметра по меньшей мере на 10%; обычно по меньшей мере на 20%; предпочтительно по меньшей мере приблизительно 30%; более предпочтительно по меньшей мере 40% и наиболее предпочтительно по меньшей мере на 50%. Эффективное количество также может приводить к улучшению субъективного показателя в тех случаях, когда субъективные показатели используются для оценки тяжести заболевания.
Другие комбинированные терапии
Как описано ранее, канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент можно вводить совместно с одним или более другими терапевтическими средствами (такими как химиотерапевтическое средство). Антитело может быть связано со средством (в виде иммунного комплекса) или может быть введено отдельно от средства. В последнем случае (отдельное введение) антитело может быть введено до, после или одновременно со средством или может применяться совместно с другими известными терапиями.
В случае определенных комбинированных терапий канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент можно вводить совместно с канинизированным мышиным антителом против PD-1 собаки или его антигенсвязывающим фрагментом [например, как раскрыто в предварительной заявке на патент США 61/918,946, поданной 20 декабря 2013 года, и предварительной заявке на патент США 62/030,812, поданной 30 июля 2014 года, предварительной заявке на патент США 62/092,496, поданной 16 декабря 2014 года, PCT/EP2014/078655 (WO2015091911) и PCTEP2014/078653 (WO2015/091910), содержание которых полностью включено в настоящую заявку посредством отсылки] и/или канинизированным мышиным антителом против белка цитотоксических Т-лимфоцитов 4 собаки (CTLA-4) или его антигенсвязывающим фрагментом. Таким образом, любую комбинацию этих трех канинизированных мышиных антител против белка собаки (т.е. антител к PD-L1, PD-1 или CTLA-4 собаки) или их антигенсвязывающих фрагментов можно вводить совместно. Например, канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент могут быть введены до, после или одновременно с канинизированным мышиным антителом против PD-1 собаки или его антигенсвязывающим фрагментом и/или с канинизированным мышиным антителом к CTLA-4 или его антигенсвязывающим фрагментом. Кроме того, комбинацию канинизированного мышиного антитела против PD-L1 собаки или его антигенсвязывающего фрагмента с канинизированным мышиным антителом против PD-1 собаки или его антигенсвязывающим фрагментом и/или канинизированным мышиным антителом к CTLA-4 или его антигенсвязывающим фрагментом также можно применять совместно с другими известными терапиями, т.е. до, после или параллельно.
Наборы
Кроме того, предложены наборы, включающие один или более компонентов, которые включают, без ограничения, антитело или антигенсвязывающий фрагмент, обсуждаемые в настоящей заявке, которые специфично связывают PD-L1 (например, канинизированное мышиное антитело против PD-L1 собаки или его антигенсвязывающий фрагмент), в сочетании с одним или более дополнительными компонентами, включающими, без ограничения, канинизированное мышиное антитело против PD-1 собаки или его антигенсвязывающий фрагмент и/или канинизированное мышиное антитело против CTLA-4 собаки или его антигенсвязывающий фрагмент, фармацевтически приемлемый носитель и/или химиотерапевтическое средство, как обсуждается в настоящей заявке. В альтернативных вариантах осуществления набор может включать один или более пептидов, включающих эпитоп или его часть (или слитый белок, включающий эпитоп или его часть), распознаваемые моноклональными антителами против PD-L1 собаки, как обсуждается выше. Связывающая композиция и/или химиотерапевтическое средство или пептид, включающий эпитоп или его часть (или слитый белок, включающий эпитоп или его часть), могут быть включены в виде чистой композиции или в сочетании с фармацевтически приемлемым носителем в фармацевтическую композицию.
В одном варианте осуществления набор включает связывающую композицию согласно настоящему изобретению, например, канинизированное мышиное антитело против PD-L1 собаки (или его антигенсвязывающий фрагмент) или его фармацевтическую композицию в одном контейнере (например, в стерильном стеклянном или пластмассовом флаконе), и/или его фармацевтическую композицию и/или химиотерапевтическое средство в другом контейнере (например, в стерильном стеклянном или пластмассовом флаконе), и/или канинизированное мышиное антитело против PD-1 собаки (или его антигенсвязывающий фрагмент) и/или канинизированное мышиное антитело против CTLA-4 собаки (или его антигенсвязывающий фрагмент), или его фармацевтическую композицию в одном или более других контейнерах (например, в стерильном стеклянном или пластмассовом флаконе).
Если набор включает фармацевтическую композицию для парентерального введения субъекту, набор также может включать устройство для выполнения такого введения. Например, набор может включать одну или более игл для подкожных инъекций или другие инъекционные устройства, как обсуждается выше. Набор также может включать вкладыш в упаковку, содержащий информацию в отношении фармацевтических композиций и лекарственных форм в наборе. Обычно такая информация помогает владельцам домашних животных и ветеринарам эффективно и безопасно применять помещенные в упаковку фармацевтические композиции и лекарственные формы. Например, следующая информация по поводу комбинации изобретения может быть представлена во вкладыше: фармакокинетика, фармакодинамика, клинические исследования, параметры эффективности, показания и применение, противопоказания, предупреждения, меры предосторожности, нежелательные реакции, передозировка, надлежащая дозировка и введение, форма выпуска, надлежащие условия хранения, ссылки, информация о производителе/дистрибьюторе и патентная информация.
Для удобства антитело или специфичное связывающее средство, раскрытое в настоящей заявке, может быть предоставлено в наборе, т.е. упакованной комбинации реактивов в установленных количествах с инструкциями по выполнению диагностического анализа или анализа на обнаружение. В случае, когда антитело мечено ферментом, набор будет включать субстраты и кофакторы, требуемые для фермента (например, предшественник субстрата, который дает детектируемый хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и т.п. Относительные количества различных реактивов могут изменяться в широких пределах, обеспечивая концентрации в растворе реактивов, которые существенно оптимизируют чувствительность анализа. В частности, реактивы могут быть предоставлены в виде сухих порошков, обычно лиофилизированных, включающих вспомогательные вещества, которые при растворении образуют раствор реактивов, имеющий подходящую концентрацию.
ПРИМЕРЫ
ПРИМЕР 1
PD-1 И PD-L1 СОБАКИ
Последовательности PD-1 и PD-L1 собаки :
В предварительных заявках на патент США 61/918,946, поданной 20 декабря 2013 года, и 62/030,812, поданной 30 июля 2014 года, настоящим полностью включенных посредством отсылок, предложены: полноразмерная нуклеотидная последовательность PD-1 собаки (CPD-1) SEQ ID NO: 49 [SEQ ID NO: 69 включает сигнальную последовательность]; соответствующая транслированная аминокислотная последовательность SEQ ID NO: 50 [SEQ ID NO: 70 включает сигнальную последовательность]; нуклеотидная последовательность, кодирующая внеклеточный домен (ECD) PD-1 собаки, SEQ ID NO: 51; аминокислотная последовательность ECD PD-1 собаки, SEQ ID NO: 52; нуклеотидная последовательность ECD PD-1 собаки плюс GT линкер и часть Fc из гена Fc IgG1 человека, SEQ ID NO: 53; и аминокислотная последовательность ECD PD-1 собаки плюс GT линкер и часть Fc из гена Fc IgG1 человека, SEQ ID NO: 54 [SEQ ID NO: 81 включает сигнальную последовательность].
В предварительных заявках на патент США 61/918,946, поданной 20 декабря 2013 года, и 62/030,812, поданной 30 июля 2014 года, настоящим полностью включенных посредством отсылок также предложены: полноразмерная нуклеотидная последовательность PD-L1 собаки (CPD-L1) SEQ ID NO: 55 [SEQ ID NO: 71 включает сигнальную последовательность]; соответствующая транслированная аминокислотная последовательность SEQ ID NO: 56 [SEQ ID NO: 72 включает сигнальную последовательность]; нуклеотидная последовательность, кодирующая внеклеточный домен (ECD) PD-L1 собаки, SEQ ID NO: 57; аминокислотная последовательность ECD PD-L1 собаки, SEQ ID NO: 58; нуклеотидная последовательность ECD PD-L1 собаки плюс GT линкер и часть Fc из гена Fc IgG1 человека, SEQ ID NO: 59; и аминокислотная последовательность ECD PD-L1 плюс GT линкер и часть Fc из гена Fc IgG1 человека, SEQ ID NO: 60.
Идентификация и клонирование PD-1 собаки :
Нуклеиновая кислота, кодирующая полноразмерный PD-1 собаки (CPD-1), была определена при поиске в базах данных банка генов NCBI (регистрационный номер XM_543338.4). Транслированная аминокислотная последовательность (регистрационный номер XP_543338.3) соответствовала предполагаемому белку PD-1 собаки, также определенному при поиске в базах данных белков банка генов (NCBI) и выравнивании идентифицированной аминокислотной последовательности с аминокислотными последовательностями мышиного, кошачьего и человеческого PD-1. Последовательность ДНК, соответствующая полноразмерному гену PD-1 собаки, который был оптимизирован по кодонам для клеток CHO, синтезировали и клонировали в плазмиду, обозначенную p96793. Сравнение последовательностей ДНК и белка предсказанного PD-1 собаки с последовательностями известных ДНК и белков PD-1 привели к идентификации последовательностей ДНК, кодирующих внеклеточный домен (ECD) PD-1 собаки, и аминокислотной последовательности ECD PD-1 собаки.
Последовательность ДНК, кодирующая ECD PD-1 собаки, в дополнение к GT линкеру и 8 остаткам гистидина синтезировали и клонировали в плазмиду, обозначенную LPD2726. Последовательность нуклеиновой кислоты, соответствующую ECD PD-1 собаки плюс GT линкер и часть Fc из гена Fc IgG1 человека, синтезировали химически и клонировали в плазмиду, обозначенную LPD2727. ECD PD-1 собаки и часть Fc из Fc IgG1 человека включают аминокислотную последовательность SEQ ID NO: 81 (в том числе сигнальную последовательность).
Идентификация и клонирование PD-L1 собаки :
Нуклеиновую кислоту, кодирующую полноразмерный PD-L1 собаки, идентифицировали при поиске в базах данных банка генов NCBI (регистрационный номер XM_541302.4). Транслированную аминокислотную последовательность (регистрационный номер XP-541302.4), соответствующую предполагаемому белку PD-L1 собаки, определяли при поиске в базах данных белков банка генов (NCBI) и выравнивании идентифицированной последовательности с известными последовательностями PD-L1 мыши и человека.
При сравнении ДНК, кодирующей PD-L1 собаки, с известными последовательностями PD-L1 идентифицировали последовательность ДНК, соответствующую ECD домену PD-L1 собаки (который оптимизировали по кодонам для клеток CHO). Предсказанная аминокислотная последовательность ECD PD-L1 собаки приведена в SEQ ID NO: 58. ДНК, кодирующую ECD PD-L1 плюс GT линкер и 8 остатков гистидина, синтезировали и клонировали в плазмиду, обозначенную LPD2695.
Последовательность ДНК, кодирующую аминокислотную последовательность ECD PD-L1 собаки плюс GT линкер и часть Fc из Fc IgG1 человека, синтезировали химически и клонировали в плазмиду, обозначенную LPD2697. ECD PD-L1 собаки плюс GT линкер и часть Fc из IgG1 человека включает аминокислотную последовательность SEQ ID NO:60.
Экспрессия белков PD-1 и PD-L1 :
Экспрессионные плазмиды, кодирующие белки PD-1 ECD-HIS, PD-1 ECD-Fc, PD-L1 ECD-HIS и PD-L1 ECD-Fc, трансфицировали в клетки HEK 293 и очищали белки из супернатанта трансфицированных клеток при использовании колоночной хроматографии с белком A для Fc слитых белков или никелем (Ni2+) для HIS-меченых белков. Очищенные белки использовали для ELISA или анализов связывания, как подробно описано ниже. Экспрессированные белки анализировали с помощью гелей ДСН-ПААГЭ.
Последовательность ДНК полноразмерного PD-1 собаки: сигнальная последовательность подчеркнута и выделена жирным. Нуклеотидная последовательность SEQ ID NO: 49 не содержит сигнальной последовательности.
atggggagccggcgggggccctggccgctcgtctgggccgtgctgcagctgggctggtggccaggatggctc ctagactcccctgacaggccctggagcccgctcaccttctccccggcgcagctcacggtgcaggagggagagaacgccacgttcacctgcagcctggccgacatccccgacagcttcgtgctcaactggtaccgcctgagcccccgcaaccagacggacaagctggccgccttccaggaggaccgcatcgagccgggccgggacaggcgcttccgcgtcatgcggctgcccaacgggcgggacttccacatgagcatcgtcgctgcgcgcctcaacgacagcggcatctacctgtgcggggccatctacctgccccccaacacacagatcaacgagagtccccgcgcagagctctccgtgacggagagaaccctggagccccccacacagagccccagccccccacccagactcagcggccagttgcaggggctggtcatcggcgtcacgagcgtgctggtgggtgtcctgctactgctgctgctgacctgggtcctggccgctgtcttccccagggccacccgaggtgcctgtgtgtgcgggagcgaggacgagcctctgaaggagggccccgatgcagcgcccgtcttcaccctggactacggggagctggacttccagtggcgagagaagacgccggagcccccggcgccctgtgccccggagcagaccgagtatgccaccatcgtcttcccgggcaggccggcgtccccgggccgcagggcctcggccagcagcctgcagggagcccagcctccgagccccgaggacggacccggcctgtggcccctctga
Аминокислотная последовательность полноразмерного PD-1 собаки: сигнальная последовательность подчеркнута и выделена жирным. Аминокислотная последовательность SEQ ID NO: 50 не содержит сигнальной последовательности.
MGSRRGPWPLVWAVLQLGWWPGWL LDSPDRPWSPLTFSPAQLTVQEGENATFTCSLADIPDSFVLNWYRLSPRNQTDKLAAFQEDRIEPGRDRRFRVMRLPNGRDFHMSIVAARLNDSGIYLCGAIYLPPNTQINESPRAELSVTERTLEPPTQSPSPPPRLSGQLQGLVIGVTSVLVGVLLLLLLTWVLAAVFPRATRGACVCGSEDEPLKEGPDAAPVFTLDYGELDFQWREKTPEPPAPCAPEQTEYATIVFPGRPASPGRRASASSLQGAQPPSPEDGPGLWPL
Последовательность ДНК внеклеточного домена PD-1 собаки: SEQ ID NO: 51 (оптимизирована по кодонам для экспрессии в клетках CHO)
ctggattcccccgacagaccctggagccctctcaccttctcccctgcccagctgaccgtccaggaaggcgagaatgccaccttcacctgcagcctcgccgacatccccgacagcttcgtgctgaactggtacagactgagccccaggaaccagaccgacaagctggccgctttccaggaggacaggatcgaacccggcagggacaggaggtttagggtcatgaggctgcccaacggcagggacttccacatgtccatcgtggccgccagactgaacgactccggcatctacctgtgcggcgctatctacctgccccccaacacccagatcaacgagagccccagggccgaactgagcgtgacagagagaaccctggaacctcccacccagagcccttcccctcctcctagactgagcggacagctgcagggcctggtg
Внеклеточный домен PD-1 собаки: SEQ ID NO: 52
LDSPDRPWSPLTFSPAQLTVQEGENATFTCSLADIPDSFVLNWYRLSPRNQTDKLAAFQEDRIEPGRDRRFRVMRLPNGRDFHMSIVAARLNDSGIYLCGAIYLPPNTQINESPRAELSVTERTLEPPTQSPSPPPRLSGQLQGLV
Последовательность ДНК внеклеточного домена PD-1 собаки - Fc IgG1 человека: SEQ ID NO: 53 (оптимизирована по кодонам для экспрессии в клетках HEK 293)
ctggattcccccgacagaccctggagccctctcaccttctcccctgcccagctgaccgtccaggaaggcgagaatgccaccttcacctgcagcctcgccgacatccccgacagcttcgtgctgaactggtacagactgagccccaggaaccagaccgacaagctggccgctttccaggaggacaggatcgaacccggcagggacaggaggtttagggtcatgaggctgcccaacggcagggacttccacatgtccatcgtggccgccagactgaacgactccggcatctacctgtgcggcgctatctacctgccccccaacacccagatcaacgagagccccagggccgaactgagcgtgacagagagaaccctggaacctcccacccagagcccttcccctcctcctagactgagcggacagctgcagggcctggtgggtaccgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga
Слитый белок внеклеточного домена PD-1 собаки - Fc IgG1 человека: сигнальная последовательность подчеркнута и выделена жирным: аминокислота SEQ ID NO: 54 не содержит сигнальной последовательности.
MNFLLSWVHWSLALLLYLHHAKWSQA LDSPDRPWSPLTFSPAQLTVQEGENATFTCSLADIPDSFVLNWYRLSPRNQTDKLAAFQEDRIEPGRDRRFRVMRLPNGRDFHMSIVAARLNDSGIYLCGAIYLPPNTQINESPRAELSVTERTLEPPTQSPSPPPRLSGQLQGLVGTDKTHTCPPCPAPELLGGPSVFLFPFCFCDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Последовательность ДНК полноразмерного PD-L1 собаки: сигнальная последовательность подчеркнута и выделена жирным. Нуклеотидная последовательность SEQ ID NO: 55 не содержит сигнальной последовательности.
atgagaatgtttagtgtctttacattcatggcctactgccatttgctaaaagca tttacgatcacagtttctaaggacctgtatgtggtagagtatggtggcaatgtgacaatggaatgcaaattcccggtggaaaaacagttaaacttgtttgcactaatcgtctactgggaaatggaggataaaaaaattatacaatttgtgaatggaaaggaagacctgaaagttcagcacagcagctacagccagagggctcagctattgaaggaccagctcttcttggggaaggctgcgcttcagatcacagatgtgagattgcaggatgcaggggtttactgctgcttgatcggctatggcggtgctgactacaagcggattactttgaaagttcatgccccgtaccgcaacatcagccaaagaatttctgtggatcctgtcacctctgaacatgaactaatgtgtcaggctgagggttaccctgaggctgaagtcatctggacaagcagtgaccaccgagtcctgagtggcaaaaccaccatcactaattccaatagggaagagaagcttttcaatgtgaccagcacgctgaacatcaatgcaacagctaatgagattttctactgcacttttcaaagatcaggtcctgaggaaaacaatactgccgagttggtcatcccagaacgactgcccgttccagcaagtgagaggactcatttcatgattctgggacctttcctgttgcttcttggtgtagtcctggcagtcactttctgtctaaaaaaacatgggagaatgatggatgtggaaaaatgttgcacccgagataggaactcaaagaaacgaaatgatatacaatttgaagagacataa
Полноразмерный PD-L1 собаки: сигнальная последовательность подчеркнута и выделена жирным. Аминокислотная последовательность SEQ ID NO: 56 не содержит сигнальной последовательности.
MRMFSVFTFMAYCHLLKA FTITVSKDLYVVEYGGNVTMECKFPVEKQLNLFALIVYWEMEDKKIIQFVNGKEDLKVQHSSYSQRAQLLKDQLFLGKAALQITDVRLQDAGVYCCLIGYGGADYKRITLKVHAPYRNISQRISVDPVTSEHELMCQAEGYPEAEVIWTSSDHRVLSGKTTITNSNREEKLFNVTSTLNINATANEIFYCTFQRSGPEENNTAELVIPERLPVPASERTHFMILGPFLLLLGVVLAVTFCLKKHGRMMDVEKCCTRDRNSKKRNDIQFEET
Последовательность ДНК внеклеточного домена PD-L1 собаки: SEQ ID NO: 57 (оптимизирована по кодонам для экспрессии в клетках CHO)
tttaccatcaccgtgtccaaggacctgtacgtggtcgagtacggcggcaatgtgaccatggagtgcaagttccccgtggagaagcagctgaacctgttcgccctcatcgtgtactgggagatggaggacaagaagatcatccagttcgtgaacggcaaggaggacctgaaggtgcagcactccagctactcccagagagcccagctgctgaaggaccagctgttcctgggcaaggccgccctgcagatcaccgacgtgagactgcaggacgccggcgtgtattgctgcctgatcggctacggaggcgccgactacaagaggatcaccctgaaggtgcatgcaccctacaggaacatcagccagaggatcagcgtcgatcccgtgaccagcgagcacgagctgatgtgccaagccgagggctatcccgaggccgaagtgatctggaccagcagcgaccacagggtcctgagcggcaagaccaccatcaccaacagcaacagggaggagaagctgttcaacgtgaccagcaccctcaacatcaacgccaccgccaacgagatcttctactgcaccttccagaggagcggccccgaagagaacaacaccgccgagctggtgatccccgagagactgcctgtgcctgccagcgagaggacccac
Белок внеклеточного домена PD-L1 собаки: SEQ ID NO: 58
FTITVSKDLYVVEYGGNVTMECKFPVEKQLNLFALIVYWEMEDKKIIQFVNGKEDLKVQHSSYSQRAQLLKDQLFLGKAALQITDVRLQDAGVYCCLIGYGGADYKRITLKVHAPYRNISQRISVDPVTSEHELMCQAEGYPEAEVIWTSSDHRVLSGKTTITNSNREEKLFNVTSTLNINATANEIFYCTFQRSGPEENNTAELVIPERLPVPASERTH
Последовательность ДНК внеклеточного домена PD-L1 собаки - Fc IgG1 человека: SEQ ID NO: 59 (оптимизирована по кодонам для экспрессии в клетках HEK-293)
tttaccatcaccgtgtccaaggacctgtacgtggtcgagtacggcggcaatgtgaccatggagtgcaagttccccgtggagaagcagctgaacctgttcgccctcatcgtgtactgggagatggaggacaagaagatcatccagttcgtgaacggcaaggaggacctgaaggtgcagcactccagctactcccagagagcccagctgctgaaggaccagctgttcctgggcaaggccgccctgcagatcaccgacgtgagactgcaggacgccggcgtgtattgctgcctgatcggctacggaggcgccgactacaagaggatcaccctgaaggtgcatgcaccctacaggaacatcagccagaggatcagcgtcgatcccgtgaccagcgagcacgagctgatgtgccaagccgagggctatcccgaggccgaagtgatctggaccagcagcgaccacagggtcctgagcggcaagaccaccatcaccaacagcaacagggaggagaagctgttcaacgtgaccagcaccctcaacatcaacgccaccgccaacgagatcttctactgcaccttccagaggagcggccccgaagagaacaacaccgccgagctggtgatccccgagagactgcctgtgcctgccagcgagaggacccacggtaccgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga
Слитый белок внеклеточного домена PD-L1 собаки -IgG1 Fc человека: SEQ ID NO: 60
FTITVSKDLYVVEYGGNVTMECKFPVEKQLNLFALIVYWEMEDKKIIQFVNGKEDLKVQHSSYSQRAQLLKDQLFLGKAALQITDVRLQDAGVYCCLIGYGGADYKRITLKVHAPYRNISQRISVDPVTSEHELMCQAEGYPEAEVIWTSSDHRVLSGKTTITNSNREEKLFNVTSTLNINATANEIFYCTFQRSGPEENNTAELVIPERLPVPASERTHGTDKTHTCPPCPAPELLGGPSVFLFPFCFCDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
ПРИМЕР 2
МЫШИНЫЕ АНТИТЕЛА ПРОТИВ PD-L1 СОБАКИ
Создание моноклональных антител против PD-L1 собаки :
В общей сложности три мыши Balb/c иммунизировали несколько раз (по 10 мкг каждый раз) в течение 17-дневного периода. Для иммунизации в качестве антигена использовали слитый белок PD-L1 собаки с ECD-Fc. После иммунизации у каждой мыши забирали сыворотку и исследовали на реактивность с PD-L1 собаки ECD-HIS меченным белком. Клетки селезенки мыши с наиболее высоким титром против PD-L1 ECD-HIS в сыворотке подвергали слиянию с линией клеток миеломы P3X63Ag8.653. Приблизительно через 2 недели после слияния супернатант от предполагаемых гибридомных клеток исследовали с помощью ELISA на реактивность к PD-L1 ECD-HIS меченному белку. Гибридомы, дающие сильные положительные сигналы в ELISA, субклонировали методом серийного разведения и снова тестировали на реактивность с собачьим PD-L1 ECD-HIS меченным белком.
Подтверждение реактивности моноклональных антител против PD-L1 собаки :
Реактивность антител, секретируемых гибридомами, в отношении ECD PD-L1 собаки подтверждали с помощью ELISA. Клетки гибридом культивировали с использованием биореакторов CELLine (Integra-biosciences) в течение 10-30 дней. Клетки первоначально поддерживали в DMEM с добавкой 4 мМ L-глутамина и 10% эмбриональной бычьей сыворотки (FBS) Ultra Low IgG производства Gibco. Клетки гибридом сеяли в клеточные камеры биореактора CELLine при плотности клеток приблизительно 2×106 клеток/мл в 15 мл той же среды с увеличенной до 20% концентрацией FBS. Внешнюю камеру заполняли 1 л питательной среды (DMEM с 4 мМ L-глутамина и 2% стандартной FBS). Клетки гибридом в клеточной камере размножали до приблизительно 2,5×107 клеток/мл в течение 3-7 дней. Затем 10 мл суспензии клеток собирали из клеточной камеры и заменяли свежей средой, чтобы обеспечить повторное размножение клеток и последующий сбор. Эту процедуру повторяли по мере необходимости для получения требуемых количеств мАт из каждого клона гибридомы. Полученные суспензии клеток центрифугировали и фильтровали супернатанты через мембраны с порами 0,2 микрона. Для очистки антител супернатант каждого клона очищали с помощью колонки Protein G Sepharose 4 Fast flow 5 мл (GE Healthcare) в потоке под действием силы тяжести. После промывки Трис ЭДТА (TE) буфером с pH 8,0 связавшиеся антитела элюировали с использованием 0,1 М глицинового буфера с pH 2,7, с последующей pH нейтрализацией с использованием 1 М Трис, pH 8,0. Антитела концентрировали и заменяли буфер фосфатно-солевым буфером (PBS) с помощью центрифужных фильтрующих элементов Centriprep YM-10, 10 кДа NMWL (Millipore). Концентрации антител определяли количественно с помощью спектрофотометрии.
Очищенные мАт против PD-L1 собаки тестировали на реактивность со слитым белком PD-L1-hFc собаки с помощью ELISA следующим образом: слитый белок PD-L1-hFc собаки разбавляли до 10 мкг/мл в буфере для нанесения (карбонат/бикарбонат, pH 9,0) и вносили в количестве 100 мкл/лунка в 96-луночные плоскодонные планшеты для ELISA (NUNC). Планшеты инкубировали при 4°C в течение ночи. Затем планшеты три раза промывали фосфатно-солевым буфером, содержащим 0,05% Tween-20 (PBST). Затем в каждую лунку добавляли 200 мкл блокирующего буфера (5% обезжиренное молоко в PBST) и инкубировали планшеты при 37°C в течение 60 минут. Затем планшеты три раза промывали PBST. Затем по 100 мкл тестируемых мАт, разведенных в блокирующем буфере, добавляли в первые лунки соответствующих колонок. Тестируемые мАт затем разбавляли в два раза до соответствующего положения планшета. После инкубирования планшетов при 37°C в течение 60 минут, планшеты три раза промывали PBST. Затем в планшеты добавляли по 100 мкл в лунку разведения 1:2000 конъюгированного с пероксидазой хрена антитела козы против IgG мыши (KPL), после чего инкубировали при 37°C в течение 60 минут. Затем планшеты три раза промывали PBST и добавляли в планшеты по 100 мкл/лунка 3,3ʹ,5,5ʹ-тетраметил-бензидина (TMB), субстрата (производства KPL). Цветную реакцию проявляли в течение 5-20 минут при 37°C до измерения поглощения при 650 нм.
Клетки CHO, экспрессирующие белок PD-1 собаки :
Полноразмерный ген PD-1 собаки клонировали в плазмиду p96793. В этой плазмиде экспрессия белка PD-1 находится под контролем промотора hCMV. Клетки CHO DXB11 (dhfr-) поддерживали в MEM-alpha (Gibco) с добавкой 10% эмбриональной бычьей сыворотки. Трансфекцию клеток CHO плазмидой p96793 выполняли в колбах объемом 75 см2, содержащих приблизительно 6×106 клеток, с помощью опосредованной липосомами доставки гена при использовании липофектамина (Invitrogen). Через 48 часов клетки пересевали в среду MEM-alpha без нуклеозидов, с добавкой 10% FBS и 400 мкг/мл гигромицина B (селективная среда). Клонирование методом серийных разведений выполняли с пулом dhfr+ гигромицин-резистентных клеток. Клоны оценивали на экспрессию PD-1 собаки с помощью иммунофлуоресцентного анализа. Кратко, монослои клеток фиксировали в 96-луночном планшете 80% ацетоном. Затем фиксированные и высушенные монослои клеток инкубировали в течение 1 часа с поликлональным антителом козы против PD-1 человека (R&D Systems). Планшеты промывали PBS и затем инкубировали в течение 1 часа с флуоресцеин-меченым антителом кролика против IgG козы (KPL). Планшеты промывали PBS. Клоны, показывающие флуоресценцию, размножали и получали стоковые культуры клеток.
Блокада лиганда мышиными мАт против PD-L1 :
Клеточный анализ ELISA (CELISA) на основе линии клеток CHO, экспрессирующих PD-1 собаки, использовали для демонстрации способности мышиных антител против PD-L1 собаки блокировать взаимодействие (например, блокировать связывание) между PD-L1 собаки и его рецептором, PD-1 собаки. Блокаду лиганда подтверждали с помощью этого анализа вместе с белком собаки PD-L1/h Fc следующим образом:
1. В 96-луночные планшеты сеют cPD-1 CHO клетки и выращивают клетки до 95-100% конфлюэнтности.
Общие руководства по посеву клеток CHO,
в день -3: 1×103 кл/лунка (1×105 кл/мл)
- 2: 2×104 кл/лунка (2×105 кл/мл)
- 1: 4×104 кл/лунка (4×105 кл/мл)
2. мАт против cPDL1 разводят в 3 раза в среде CHO, начиная с уровня 30 мкг/мл, 100 мкл/лунка. Добавляют cPD-L1-hFc до 4 мкг/мл в среде CHO, 100 мкл/лунка, инкубируют вместе в планшете для разведения при 37°C, 5% CO2 с встряхиванием в течение 60 мин.
3. Среду культивирования клеток отбирают из покрытых клетками планшетов, промывают планшеты 3×PBS+0,05% Tween20 и 1× среде CHO.
4. Добавляют коинкубированные PD-L1 мАт/PD-L1 Fc из планшета для разведения в покрытый клетками планшет. 100 мкл/лунка. Инкубируют при 37°C, 5% CO2 с встряхиванием в течение 60 мин.
5. Планшеты промывают 6× PBS+0,05% Tween 20 (при использовании протокола промывки вручную).
6. Добавляют Fc-HRP против человека (Calbiochem) (1:2500) в среде CHO, 100 мкл/лунка, инкубируют 30-60 мин при 37°C/5% CO2.
7. Планшеты промывают 5× PBS+0,05% Tween20 (при использовании протокола промывки вручную).
8. Добавляют 100 мкл/лунка микролуночного субстрата TMB. Инкубируют при комнатной температуре в течение 10 минут. Используют субстрат 1-step (Pierce).
9. Реакцию останавливают 100 мкл/лунка 1,5 М фосфорной кислоты.
10. Измеряют A450-A620 на спектрофотометре ELISA.
Клонирование и идентификация последовательностей ДНК, соответствующих вариабельным областям мышиных мАт против PD-L1 собаки :
Последовательность ДНК мышиных VH и VL цепей и последовательности ДНК, кодирующие их CDR-области, идентифицировали после выделения мРНК из каждой гибридомы с помощью стандартных методов молекулярной биологии. Последовательности вариабельных областей тяжелых и легких цепей двух антител, представленных в настоящей заявке, приведены в Таблице 12 ниже. Номера SEQ ID NO предсказанных аминокислотных последовательностей CDR-областей из этих гибридом перечислены в Таблице 2 ниже:
ТАБЛИЦА 2
АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ CDR-ОБЛАСТЕЙ
|
Канонические структуры (классы) CDR-областей VH цепей
мАт: 4F9: CDR1: H1-1; CDR2: H2-3B; CDR3: H3-10
мАт: 5F12: CDR1: H1-1; CDR2: H2-3B; CDR3: H3-8
Канонические структуры (классы) для CDR-областей VL цепей
мАт: 4F9: CDR1: L1-2; CDR2: L2-1; CDR3: L3-1
мАт: 5F12: CDR1: L1-3; CDR2: L2-1; CDR3: L3-1
ПРИМЕР 3
КАНИНИЗАЦИЯ И ОПРЕДЕЛЕНИЕ СВОЙСТВ КАНИНИЗИРОВАННЫХ АНТИТЕЛ
Для получения канинизированных антител было необходимо определить последовательность ДНК, кодирующую тяжелую и легкую цепи собачьего IgG. Нуклеотидная и аминокислотная последовательности тяжелой цепи собаки могут быть получены из баз данных генов и белков NCBI. Существует четыре известных IgG субкласса IgG собаки: IgGA, IgGB, IgGC и IgGD, и два типа легких цепей: каппа и лямбда. В Таблице 7 перечислены номера SEQ ID NO аминокислотных и нуклеотидных последовательностей немодифицированных Fc фрагментов собаки.
Не будучи связанными с каким-либо определенным подходом, способ получения вариантов моноклональных антител против PD-L1 с различным содержанием последовательностей собаки и мыши включал следующую общую схему:
i) Определяют нуклеотидную последовательность VH и VL цепи мышиных мАт;
ii) Определяют CDR-области H и L цепи мышиных мАт;
iii) Определяют подходящую H и L цепь IgG собаки;
iv) Определяют нуклеотидную последовательность H и L цепей IgG собаки;
v) Заменяют нуклеотидную последовательность, кодирующую эндогенные CDR-области H и L цепи собаки, нуклеотидными последовательностями, кодирующими соответствующие CDR-области мыши. Кроме того, необязательно заменяют некоторые остатки каркаса собаки выбранными остатками из каркасных областей мыши;
vi) Синтезируют нуклеотид из этапа (v) и встраивают его в подходящую экспрессионную плазмиду; трансфицируют плазмиды в подходящие клетки, например, клетки HEK 293;
vii) Очищают экспрессированное антитело из супернатанта HEK 293; и
viii) Тестируют очищенное антитело на связывание с PD-L1 собаки.
ПРИМЕР 4
ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ IgG СОБАКИ
Для получения вариантов IgG собаки, не обладающих эффекторными функциями, получали ряд мутантных тяжелых цепей IgGB собаки [см. предварительную заявку на патент США 62/030,812, поданную 30 июля 2014 года, настоящим полностью включенную посредством отсылки]. Указанные варианты могут включать одну из следующих одиночных или комбинированных замен в Fc части аминокислотной последовательности тяжелой цепи: P4A, D31A, N63A, G64P, T65A, A93G и P95A. Варианты тяжелых цепей (т.е. содержащие такие аминокислотные замены) клонировали в экспрессионные плазмиды и трансфицировали в клетки HEK 293 вместе с плазмидой, содержащей ген, кодирующий легкую цепь. Интактные антитела, экспрессированные и очищенные из клеток HEK 293, оценивали на связывание с FcγRI и C1q для оценки их потенциала для опосредования иммуноэффекторных функций. В Таблице 3 перечислены примеры плазмид, кодирующих генетически модифицированные канинизированные тяжелые цепи, канинизированные тяжелые цепи; и генетические модификации в этих тяжелых цепях. Варианты тяжелых цепей использовали для оценки эффекторной функции генетически модифицированных мАт. Все тяжелые цепи включали CDR-области из мышиных антител против PD-1 собаки. [См. предварительную заявку на патент США 62/030,812, выше]
ТАБЛИЦА 3
|
ТАБЛИЦА 4
Модифицированный cFc или нативный cFc с шарнирными последовательностями
|
*Замены присутствуют в положениях P4, D31, N63, G64, T65, A93 и P95 аминокислотных последовательностей SEQ ID NO: 2 и 4; или в нуклеотидах, которые кодируют указанные аминокислоты для нуклеотидных последовательностей SEQ ID NO: 1 и 3. #Одиночная аминокислотная замена, как показано в Таблице 5 ниже, в шарнирной области IgGD.
ТАБЛИЦА 5
ПОСЛЕДОВАТЕЛЬНОСТИ ШАРНИРНОЙ ОБЛАСТИ
|
#Одиночная аминокислотная замена серина на пролин выделена жирным шрифтом и подчеркнута.
ТАБЛИЦА 6
ПОСЛЕДОВАТЕЛЬНОСТИ PD-1/PD-L1 СОБАКИ
|
ТАБЛИЦА 7
НАТИВНЫЕ cFc ПОСЛЕДОВАТЕЛЬНОСТИ
|
ТАБЛИЦА 8
АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ CDR
|
ТАБЛИЦА 9
ОТДЕЛЬНЫЕ КАНИНИЗИРОВАННЫЕ ТЯЖЕЛЫЕ ЦЕПИ С ЗАМЕНАМИ
|
Потенциальные специфические замены присутствуют в положениях P4, D31, N63, G64, T65, A93 и P95
ТАБЛИЦА 10
КОРРЕЛЯЦИЯ ПОЛОЖЕНИЙ АМИНОКИСЛОТНЫХ ОСТАТКОВ#
|
# корреляция положений аминокислотных остатков нативных и замещенных cFc с положениями соответствующих собачьих замещенных тяжелых цепей. В первом столбце перечислены номера SEQ ID NO; в остальных столбцах перечислены соответствующие аминокислотные положения. Для двух нативных аминокислотных последовательностей (SEQ ID NO: 66 и 68) также представлен однобуквенный код для природных аминокислотных остатков.
ТАБЛИЦА 11
ОТДЕЛЬНЫЕ КАНИНИЗИРОВАННЫЕ ТЯЖЕЛЫЕ И ЛЕГКИЕ ЦЕПИ БЕЗ ЗАМЕН
|
ТАБЛИЦА 12
ВАРИАБЕЛЬНЫЕ ОБЛАСТИ ТЯЖЕЛЫХ И ЛЕГКИХ ЦЕПЕЙ
|
Модифицированный Fc
cIgGB Fc [SEQ ID NO: 2]
LGGXSVFIFPFCFCDTLLIARTPEVTCVVVXLDPEDPEVQISWFVDGKQMQTAKTQPREEQFXXXYRVVSVLPIGHQDWLKGKQFTCKVNNKXLXSPIERTISKARGQAHQPSVYVLPPSREELSKNTVSLTCLIKDFFPPDIDVEWQSNGQQEPESKYRTTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQESLSHSPGK
cIgGB Fc [SEQ ID NO: 1]
ctgggcggcnnnagcgtgtttatttttccgccgaaaccgaaagataccctgctgattgcgcgcaccccggaagtgacctgcgtggtggtgnnnctggatccggaagatccggaagtgcagattagctggtttgtggatggcaaacagatgcagaccgcgaaaacccagccgcgcgaagaacagtttnnnnnnnnntatcgcgtggtgagcgtgctgccgattggccatcaggattggctgaaaggcaaacagtttacctgcaaagtgaacaacaaannnctgnnnagcccgattgaacgcaccattagcaaagcgcgcggccaggcgcatcagccgagcgtgtatgtgctgccgccgagccgcgaagaactgagcaaaaacaccgtgagcctgacctgcctgattaaagatttttttccgccggatattgatgtggaatggcagagcaacggccagcaggaaccggaaagcaaatatcgcaccaccccgccgcagctggatgaagatggcagctattttctgtatagcaaactgagcgtggataaaagccgctggcagcgcggcgatacctttatttgcgcggtgatgcatgaagcgctgcataaccattatacccaggaaagcctgagccatagcccgggcaaa
cIgGC Fc [SEQ ID NO: 4]
LGGXSVFIFPFCFCDILVTARTPTVTCVVVXLDPENPEVQISWFVDSKQVQTANTQPREEQSXXXYRVVSVLPIGHQDWLSGKQFKCKVNNKXLXSPIEEIISKTPGQAHQPNVYVLPPSRDEMSKNTVTLTCLVKDFFPPEIDVEWQSNGQQEPESKYRMTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQISLSHSPGK
cIgGC Fc [SEQ ID NO: 3]
ctgggcggcnnnagcgtgtttatttttccgccgaaaccgaaagatattctggtgaccgcgcgcaccccgaccgtgacctgcgtggtggtgnnnctggatccggaaaacccggaagtgcagattagctggtttgtggatagcaaacaggtgcagaccgcgaacacccagccgcgcgaagaacagagcnnnnnnnnntatcgcgtggtgagcgtgctgccgattggccatcaggattggctgagcggcaaacagtttaaatgcaaagtgaacaacaaannnctgnnnagcccgattgaagaaattattagcaaaaccccgggccaggcgcatcagccgaacgtgtatgtgctgccgccgagccgcgatgaaatgagcaaaaacaccgtgaccctgacctgcctggtgaaagatttttttccgccggaaattgatgtggaatggcagagcaacggccagcaggaaccggaaagcaaatatcgcatgaccccgccgcagctggatgaagatggcagctattttctgtatagcaaactgagcgtggataaaagccgctggcagcgcggcgatacctttatttgcgcggtgatgcatgaagcgctgcataaccattatacccagattagcctgagccatagcccgggcaaa
cIgGD Fc (S→P в D шарнире) обмен Fab-фрагментами [SEQ ID NO: 6]
FCESTCKCIPPCPVPESLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
cIgGD Fc (S→P в D шарнире) обмен Fab-фрагментами [SEQ ID NO: 5]
ccgaaagaaagcacctgcaaatgcattccgccgtgcccggtgccggaaagcctgggcggcccgagcgtgtttatttttccgccgaaaccgaaagatattctgcgcattacccgcaccccggaaattacctgcgtggtgctggatctgggccgcgaagatccggaagtgcagattagctggtttgtggatggcaaagaagtgcataccgcgaaaacccagccgcgcgaacagcagtttaacagcacctatcgcgtggtgagcgtgctgccgattgaacatcaggattggctgaccggcaaagaatttaaatgccgcgtgaaccatattggcctgccgagcccgattgaacgcaccattagcaaagcgcgcggccaggcgcatcagccgagcgtgtatgtgctgccgccgagcccgaaagaactgagcagcagcgataccgtgaccctgacctgcctgattaaagatttttttccgccggaaattgatgtggaatggcagagcaacggccagccggaaccggaaagcaaatatcataccaccgcgccgcagctggatgaagatggcagctattttctgtatagcaaactgagcgtggataaaagccgctggcagcagggcgatacctttacctgcgcggtgatgcatgaagcgctgcagaaccattataccgatctgagcctgagccatagcccgggcaaa
cIgGD Fc (A шарнир) обмен Fab-фрагментами [SEQ ID NO: 8]
FNECRCTDTPPCPVPEPLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
cIgGD Fc (A шарнир) обмен Fab-фрагментами [SEQ ID NO: 7]
tttaacgaatgccgctgcaccgataccccgccgtgcccggtgccggaaccgctgggcggcccgagcgtgtttatttttccgccgaaaccgaaagatattctgcgcattacccgcaccccggaaattacctgcgtggtgctggatctgggccgcgaagatccggaagtgcagattagctggtttgtggatggcaaagaagtgcataccgcgaaaacccagccgcgcgaacagcagtttaacagcacctatcgcgtggtgagcgtgctgccgattgaacatcaggattggctgaccggcaaagaatttaaatgccgcgtgaaccatattggcctgccgagcccgattgaacgcaccattagcaaagcgcgcggccaggcgcatcagccgagcgtgtatgtgctgccgccgagcccgaaagaactgagcagcagcgataccgtgaccctgacctgcctgattaaagatttttttccgccggaaattgatgtggaatggcagagcaacggccagccggaaccggaaagcaaatatcataccaccgcgccgcagctggatgaagatggcagctattttctgtatagcaaactgagcgtggataaaagccgctggcagcagggcgatacctttacctgcgcggtgatgcatgaagcgctgcagaaccattataccgatctgagcctgagccatagcccgggcaaa
cIgGD Fc (B шарнир) обмен Fab-фрагментами [SEQ ID NO: 10]
FCRENGRVPRPPDCFCCPAPEMLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
cIgGD Fc (B шарнир) обмен Fab-фрагментами [SEQ ID NO: 9]
ccgaaacgcgaaaacggccgcgtgccgcgcccgccggattgcccgaaatgcccggcgccggaaatgctgggcggcccgagcgtgtttatttttccgccgaaaccgaaagatattctgcgcattacccgcaccccggaaattacctgcgtggtgctggatctgggccgcgaagatccggaagtgcagattagctggtttgtggatggcaaagaagtgcataccgcgaaaacccagccgcgcgaacagcagtttaacagcacctatcgcgtggtgagcgtgctgccgattgaacatcaggattggctgaccggcaaagaatttaaatgccgcgtgaaccatattggcctgccgagcccgattgaacgcaccattagcaaagcgcgcggccaggcgcatcagccgagcgtgtatgtgctgccgccgagcccgaaagaactgagcagcagcgataccgtgaccctgacctgcctgattaaagatttttttccgccggaaattgatgtggaatggcagagcaacggccagccggaaccggaaagcaaatatcataccaccgcgccgcagctggatgaagatggcagctattttctgtatagcaaactgagcgtggataaaagccgctggcagcagggcgatacctttacctgcgcggtgatgcatgaagcgctgcagaaccattataccgatctgagcctgagccatagcccgggcaaa
cIgGD Fc (C шарнир) обмен Fab-фрагментами [SEQ ID NO: 12]
AKECECKCNCNNCPCPGCGLLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
cIgGD Fc (C шарнир) обмен Fab-фрагментами [SEQ ID NO: 11]
gccaaggagtgcgagtgcaagtgcaactgcaacaactgcccctgccccggctgcggcctgctgggcggccccagcgtgttcatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgagatcacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagcccagagagcagcagttcaacagcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcggcctgcccagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgaccctgacctgcctgatcaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcccgagcccgagagcaagtaccacaccaccgccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgacaccttcacctgcgccgtgatgcacgaggccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
Нативный Fc
cIgGA Fc [SEQ ID NO: 62]
LGGPSVLIFPFCFCDILRITRTPEVTCVVLDLGREDPEVQISWFVDGKEVHTAKTQSREQQFNGTYRVVSVLPIEHQDWLTGKEFKCRVNHIDLPSPIERTISKARGRAHKPSVYVLPPSFCELSSSDTVSITCLIKDFYPPDIDVEWQSNGQQEPERKHRMTPPQLDEDGSYFLYSKLSVDKSRWQQGDPFTCAVMHETLQNHYTDLSLSHSPGK
cIgGA Fc [SEQ ID NO: 61]
ctgggcggccccagcgtgctgatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgaggtgacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagagcagagagcagcagttcaacggcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcgacctgcccagccccatcgagagaaccatcagcaaggccagaggcagagcccacaagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgagcatcacctgcctgatcaaggacttctacccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagaaagcacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgaccccttcacctgcgccgtgatgcacgagaccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
cIgGD Fc [SEQ ID NO: 64]
LGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
cIgGD Fc [SEQ ID NO: 63]
ctgggcggccccagcgtgttcatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgagatcacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagcccagagagcagcagttcaacagcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcggcctgcccagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgaccctgacctgcctgatcaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcccgagcccgagagcaagtaccacaccaccgccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgacaccttcacctgcgccgtgatgcacgaggccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
cIgGB Fc [SEQ ID NO: 66]
LGGPSVFIFPFCFCDTLLIARTPEVTCVVVDLDPEDPEVQISWFVDGKQMQTAKTQPREEQFNGTYRVVSVLPIGHQDWLKGKQFTCKVNNKALPSPIERTISKARGQAHQPSVYVLPPSREELSKNTVSLTCLIKDFFPPDIDVEWQSNGQQEPESKYRTTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQESLSHSPGK
cIgGB Fc [SEQ ID NO: 65]
ctgggcggccccagcgtgttcatcttcccccccaagcccaaggacaccctgctgatcgccagaacccccgaggtgacctgcgtggtggtggacctggaccccgaggaccccgaggtgcagatcagctggttcgtggacggcaagcagatgcagaccgccaagacccagcccagagaggagcagttcaacggcacctacagagtggtgagcgtgctgcccatcggccaccaggactggctgaagggcaagcagttcacctgcaaggtgaacaacaaggccctgcccagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagcagagaggagctgagcaagaacaccgtgagcctgacctgcctgatcaaggacttcttcccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaaccacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccaggagagcctgagccacagccccggcaag
cIgGC Fc [SEQ ID NO: 68]
LGGPSVFIFPFCFCDILVTARTPTVTCVVVDLDPENPEVQISWFVDSKQVQTANTQPREEQSNGTYRVVSVLPIGHQDWLSGKQFKCKVNNKALPSPIEEIISKTPGQAHQPNVYVLPPSRDEMSKNTVTLTCLVKDFFPPEIDVEWQSNGQQEPESKYRMTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQISLSHSPGK
cIgGC Fc [SEQ ID NO: 67]
ctgggcggccccagcgtgttcatcttcccccccaagcccaaggacatcctggtgaccgccagaacccccaccgtgacctgcgtggtggtggacctggaccccgagaaccccgaggtgcagatcagctggttcgtggacagcaagcaggtgcagaccgccaacacccagcccagagaggagcagagcaacggcacctacagagtggtgagcgtgctgcccatcggccaccaggactggctgagcggcaagcagttcaagtgcaaggtgaacaacaaggccctgcccagccccatcgaggagatcatcagcaagacccccggccaggcccaccagcccaacgtgtacgtgctgccccccagcagagacgagatgagcaagaacaccgtgaccctgacctgcctggtgaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccagatcagcctgagccacagccccggcaag
Отдельные тяжелые цепи с заменами
4F9-VH3 cIgGB [SEQ ID NO: 26]
EVQLVQSGGDLVKPGGSVRLSCVASGFTFSYAMSWVRQAPGKGLQWMGTISDGGSYTHYPDNLMGRFTFSLDTAKNTAYLQLNSLRAEDTAVYYCARESYDGYYVANWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLYSLSSMVTVPSSRWPSETFTCNVAHPASKTKVDKPVFCRENGRVPRPPDCFCCPAPEMLGGXSVFIFPFCFCDTLLIARTPEVTCVVVXLDPEDPEVQISWFVDGKQMQTAKTQPREEQFXXXYRVVSVLPIGHQDWLKGKQFTCKVNNKXLXSPIERTISKARGQAHQPSVYVLPPSREELSKNTVSLTCLIKDFFPPDIDVEWQSNGQQEPESKYRTTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQESLSHSPGK
ДНК 4F9-VH3 cIgGB [SEQ ID NO: 25]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcggcttcaccttcagctacgccatgagctgggtgagacaggcccccggcaagggcctgcagtggatgggcaccatcagcgacggcggcagctacacccactaccccgacaacctgatgggcagattcaccttcagcctggacaccgccaagaacaccgcctacctgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcgccagagagagctacgacggctactacgtggccaactggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggcccaccccgccagcaagaccaaggtggacaagcccgtgcccaagagagagaacggcagagtgcccagaccccccgactgccccaagtgccccgcccccgagatgctgggcggcnnnagcgtgttcatcttcccccccaagcccaaggacaccctgctgatcgccagaacccccgaggtgacctgcgtggtggtgnnnctggaccccgaggaccccgaggtgcagatcagctggttcgtggacggcaagcagatgcagaccgccaagacccagcccagagaggagcagttcnnnnnnnnntacagagtggtgagcgtgctgcccatcggccaccaggactggctgaagggcaagcagttcacctgcaaggtgaacaacaagnnnctgnnnagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagcagagaggagctgagcaagaacaccgtgagcctgacctgcctgatcaaggacttcttcccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaaccacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccaggagagcctgagccacagccccggcaag
4F9-VH3 cIgGC [SEQ ID NO: 28]
EVQLVQSGGDLVKPGGSVRLSCVASGFTFSYAMSWVRQAPGKGLQWMGTISDGGSYTHYPDNLMGRFTFSLDTAKNTAYLQLNSLRAEDTAVYYCARESYDGYYVANWGQGTLVTVSSASTTAPSVFPLAPSCGSQSGSTVALACLVSGYIPEPVTVSWNSVSLTSGVHTFPSVLQSSGLYSLSSMVTVPSSRWPSETFTCNVAHPATNTKVDKPVAKECECKCNCNNCPCPGCGLLGGXSVFIFPFCFCDILVTARTPTVTCVVVXLDPENPEVQISWFVDSKQVQTANTQPREEQSXXXYRVVSVLPIGHQDWLSGKQFKCKVNNKXLXSPIEEIISKTPGQAHQPNVYVLPPSRDEMSKNTVTLTCLVKDFFPPEIDVEWQSNGQQEPESKYRMTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQISLSHSPGK
ДНК 4F9-VH3 cIgGC [SEQ ID NO: 27]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcggcttcaccttcagctacgccatgagctgggtgagacaggcccccggcaagggcctgcagtggatgggcaccatcagcgacggcggcagctacacccactaccccgacaacctgatgggcagattcaccttcagcctggacaccgccaagaacaccgcctacctgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcgccagagagagctacgacggctactacgtggccaactggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagccagagcggcagcaccgtggccctggcctgcctggtgagcggctacatccccgagcccgtgaccgtgagctggaacagcgtgagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggcccaccccgccaccaacaccaaggtggacaagcccgtggccaaggagtgcgagtgcaagtgcaactgcaacaactgcccctgccccggctgcggcctgctgggcggcnnnagcgtgttcatcttcccccccaagcccaaggacatcctggtgaccgccagaacccccaccgtgacctgcgtggtggtgnnnctggaccccgagaaccccgaggtgcagatcagctggttcgtggacagcaagcaggtgcagaccgccaacacccagcccagagaggagcagagcnnnnnnnnntacagagtggtgagcgtgctgcccatcggccaccaggactggctgagcggcaagcagttcaagtgcaaggtgaacaacaagnnnctgnnnagccccatcgaggagatcatcagcaagacccccggccaggcccaccagcccaacgtgtacgtgctgccccccagcagagacgagatgagcaagaacaccgtgaccctgacctgcctggtgaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccagatcagcctgagccacagccccggcaag
5F12-VH3 CIgGB [SEQ ID NO: 30]
EVQLVQSGGDLVKPGGSVRLSCVASFTFDYYMNWVRQAPGKGLQWIGRWIFPGSGATYYNERFMGKATISADTAKNTAYMQLNSLRAEDTAVYYCLRSDWDVGDFWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLYSLSSMVTVPSSRWPSETFTCNVAHPASKTKVDKPVFCRENGRVPRPPDCFCCPAPEMLGGXSVFIFPFCFCDTLLIARTPEVTCVVVXLDPEDPEVQISWFVDGKQMQTAKTQPREEQFXXXYRVVSVLPIGHQDWLKGKQFTCKVNNKXLXSPIERTISKARGQAHQPSVYVLPPSREELSKNTVSLTCLIKDFFPPDIDVEWQSNGQQEPESKYRTTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQESLSHSPGK
ДНК 5F12-VH3 CIgGB [SEQ ID NO: 29]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcttcaccttcgactactacatgaactgggtgagacaggcccccggcaagggcctgcagtggatcggcagatggatcttccccggcagcggcgccacctactacaacgagagattcatgggcaaggccaccatcagcgccgacaccgccaagaacaccgcctacatgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcctgagaagcgactgggacgtgggcgacttctggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggcccaccccgccagcaagaccaaggtggacaagcccgtgcccaagagagagaacggcagagtgcccagaccccccgactgccccaagtgccccgcccccgagatgctgggcggcnnnagcgtgttcatcttcccccccaagcccaaggacaccctgctgatcgccagaacccccgaggtgacctgcgtggtggtgnnnctggaccccgaggaccccgaggtgcagatcagctggttcgtggacggcaagcagatgcagaccgccaagacccagcccagagaggagcagttcnnnnnnnnntacagagtggtgagcgtgctgcccatcggccaccaggactggctgaagggcaagcagttcacctgcaaggtgaacaacaagnnnctgnnnagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagcagagaggagctgagcaagaacaccgtgagcctgacctgcctgatcaaggacttcttcccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaaccacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccaggagagcctgagccacagccccggcaag
5F12-VH3-cIgGC Fc [SEQ ID NO: 32]
EVQLVQSGGDLVKPGGSVRLSCVASFTFDYYMNWVRQAPGKGLQWIGRWIFPGSGATYYNERFMGKATISADTAKNTAYMQLNSLRAEDTAVYYCLRSDWDVGDFWGQGTLVTVSSASTTAPSVFPLAPSCGSQSGSTVALACLVSGYIPEPVTVSWNSVSLTSGVHTFPSVLQSSGLYSLSSMVTVPSSRWPSETFTCNVAHPATNTKVDKPVAKECECKCNCNNCPCPGCGLLGGXSVFIFPFCFCDILVTARTPTVTCVVVXLDPENPEVQISWFVDSKQVQTANTQPREEQSXXXYRVVSVLPIGHQDWLSGKQFKCKVNNKXLXSPIEEIISKTPGQAHQPNVYVLPPSRDEMSKNTVTLTCLVKDFFPPEIDVEWQSNGQQEPESKYRMTPPQLDEDGSYFLYSKLSVDKSRWQRGDTFICAVMHEALHNHYTQISLSHSPGK
ДНК 5F12-VH3-cIgGC Fc [SEQ ID NO: 31]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcttcaccttcgactactacatgaactgggtgagacaggcccccggcaagggcctgcagtggatcggcagatggatcttccccggcagcggcgccacctactacaacgagagattcatgggcaaggccaccatcagcgccgacaccgccaagaacaccgcctacatgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcctgagaagcgactgggacgtgggcgacttctggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagccagagcggcagcaccgtggccctggcctgcctggtgagcggctacatccccgagcccgtgaccgtgagctggaacagcgtgagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggcccaccccgccaccaacaccaaggtggacaagcccgtggccaaggagtgcgagtgcaagtgcaactgcaacaactgcccctgccccggctgcggcctgctgggcggcnnnagcgtgttcatcttcccccccaagcccaaggacatcctggtgaccgccagaacccccaccgtgacctgcgtggtggtgnnnctggaccccgagaaccccgaggtgcagatcagctggttcgtggacagcaagcaggtgcagaccgccaacacccagcccagagaggagcagagcnnnnnnnnntacagagtggtgagcgtgctgcccatcggccaccaggactggctgagcggcaagcagttcaagtgcaaggtgaacaacaagnnnctgnnnagccccatcgaggagatcatcagcaagacccccggccaggcccaccagcccaacgtgtacgtgctgccccccagcagagacgagatgagcaagaacaccgtgaccctgacctgcctggtgaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcaggagcccgagagcaagtacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagagaggcgacaccttcatctgcgccgtgatgcacgaggccctgcacaaccactacacccagatcagcctgagccacagccccggcaag
Отдельные канинизированные тяжелые и легкие цепи без замен
4F9-VH3-cIgGA Fc [SEQ ID NO: 34]
EVQLVQSGGDLVKPGGSVRLSCVASGFTFSYAMSWVRQAPGKGLQWMGTISDGGSYTHYPDNLMGRFTFSLDTAKNTAYLQLNSLRAEDTAVYYCARESYDGYYVANWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLHSLSSMVTVPSSRWPSETFTCNVVHPASNTKVDKPVFNECRCTDTPPCPVPEPLGGPSVLIFPFCFCDILRITRTPEVTCVVLDLGREDPEVQISWFVDGKEVHTAKTQSREQQFNGTYRVVSVLPIEHQDWLTGKEFKCRVNHIDLPSPIERTISKARGRAHKPSVYVLPPSFCELSSSDTVSITCLIKDFYPPDIDVEWQSNGQQEPERKHRMTPPQLDEDGSYFLYSKLSVDKSRWQQGDPFTCAVMHETLQNHYTDLSLSHSPGK
4F9-VH3-cIgGA Fc [SEQ ID NO: 33]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcggcttcaccttcagctacgccatgagctgggtgagacaggcccccggcaagggcctgcagtggatgggcaccatcagcgacggcggcagctacacccactaccccgacaacctgatgggcagattcaccttcagcctggacaccgccaagaacaccgcctacctgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcgccagagagagctacgacggctactacgtggccaactggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgcacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggtgcaccccgccagcaacaccaaggtggacaagcccgtgttcaacgagtgcagatgcaccgacacccccccctgccccgtgcccgagcccctgggcggccccagcgtgctgatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgaggtgacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagagcagagagcagcagttcaacggcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcgacctgcccagccccatcgagagaaccatcagcaaggccagaggcagagcccacaagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgagcatcacctgcctgatcaaggacttctacccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagaaagcacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgaccccttcacctgcgccgtgatgcacgagaccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
4F9-VH3 cIgGD Fc [SEQ ID NO: 36]
EVQLVQSGGDLVKPGGSVRLSCVASGFTFSYAMSWVRQAPGKGLQWMGTISDGGSYTHYPDNLMGRFTFSLDTAKNTAYLQLNSLRAEDTAVYYCARESYDGYYVANWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLYSLSSTVTVPSSRWPSETFTCNVVHPASNTKVDKPVFCESTCKCISPCPVPESLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
4F9-VH3 cIgGD Fc [SEQ ID NO: 35]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcggcttcaccttcagctacgccatgagctgggtgagacaggcccccggcaagggcctgcagtggatgggcaccatcagcgacggcggcagctacacccactaccccgacaacctgatgggcagattcaccttcagcctggacaccgccaagaacaccgcctacctgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcgccagagagagctacgacggctactacgtggccaactggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcaccgtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggtgcaccccgccagcaacaccaaggtggacaagcccgtgcccaaggagagcacctgcaagtgcatcagcccctgccccgtgcccgagagcctgggcggccccagcgtgttcatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgagatcacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagcccagagagcagcagttcaacagcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcggcctgcccagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgaccctgacctgcctgatcaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcccgagcccgagagcaagtaccacaccaccgccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgacaccttcacctgcgccgtgatgcacgaggccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
4F9-VL3-cL-Каппа [SEQ ID NO: 38]
DIVMTQTPLSLSVSPGEPASMSCRASQSISNNLHWYRQKPGQSPQVLVKYASQSISGVPDRFIGSGSGTDFTLRISRVEADDLGVYYCQQSNSWPQTFGQGTKLELKRNDAQPAVYLFQPSPDQLHTGSASVVCLLNSFYFCDINVKWKVDGVIQDTGIQESVTEQDSKDSTYSLSSTLTMSSTEYLSHELYSCEITHKSLPSTLIKSFQRSECQRVD
4F9-VL3-cL-Каппа [SEQ ID NO: 37]
gacatcgtgatgacccagacccccctgagcctgagcgtgagccccggcgagcccgccagcatgagctgcagagccagccagagcatcagcaacaacctgcactggtacagacagaagcccggccagagcccccaggtgctggtgaagtacgccagccagagcatcagcggcgtgcccgacagattcatcggcagcggcagcggcaccgacttcaccctgagaatcagcagagtggaggccgacgacctgggcgtgtactactgccagcagagcaacagctggccccagaccttcggccagggcaccaagctggagctgaagagaaacgacgcccagcccgccgtgtacctgttccagcccagccccgaccagctgcacaccggcagcgccagcgtggtgtgcctgctgaacagcttctaccccaaggacatcaacgtgaagtggaaggtggacggcgtgatccaggacaccggcatccaggagagcgtgaccgagcaggacagcaaggacagcacctacagcctgagcagcaccctgaccatgagcagcaccgagtacctgagccacgagctgtacagctgcgagatcacccacaagagcctgcccagcaccctgatcaagagcttccagagaagcgagtgccagagagtggac
5F12-VH3-cIgGA Fc [SEQ ID NO: 40]
EVQLVQSGGDLVKPGGSVRLSCVASFTFDYYMNWVRQAPGKGLQWIGRWIFPGSGATYYNERFMGKATISADTAKNTAYMQLNSLRAEDTAVYYCLRSDWDVGDFWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLHSLSSMVTVPSSRWPSETFTCNVVHPASNTKVDKPVFNECRCTDTPPCPVPEPLGGPSVLIFPFCFCDILRITRTPEVTCVVLDLGREDPEVQISWFVDGKEVHTAKTQSREQQFNGTYRVVSVLPIEHQDWLTGKEFKCRVNHIDLPSPIERTISKARGRAHKPSVYVLPPSFCELSSSDTVSITCLIKDFYPPDIDVEWQSNGQQEPERKHRMTPPQLDEDGSYFLYSKLSVDKSRWQQGDPFTCAVMHETLQNHYTDLSLSHSPGK
5F12-VH3-cIgGA Fc [SEQ ID NO: 39]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcttcaccttcgactactacatgaactgggtgagacaggcccccggcaagggcctgcagtggatcggcagatggatcttccccggcagcggcgccacctactacaacgagagattcatgggcaaggccaccatcagcgccgacaccgccaagaacaccgcctacatgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcctgagaagcgactgggacgtgggcgacttctggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgcacagcctgagcagcatggtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggtgcaccccgccagcaacaccaaggtggacaagcccgtgttcaacgagtgcagatgcaccgacacccccccctgccccgtgcccgagcccctgggcggccccagcgtgctgatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgaggtgacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagagcagagagcagcagttcaacggcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcgacctgcccagccccatcgagagaaccatcagcaaggccagaggcagagcccacaagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgagcatcacctgcctgatcaaggacttctacccccccgacatcgacgtggagtggcagagcaacggccagcaggagcccgagagaaagcacagaatgacccccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgaccccttcacctgcgccgtgatgcacgagaccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
5F12-VH3-cIgGD Fc [SEQ ID NO: 42]
EVQLVQSGGDLVKPGGSVRLSCVASFTFDYYMNWVRQAPGKGLQWIGRWIFPGSGATYYNERFMGKATISADTAKNTAYMQLNSLRAEDTAVYYCLRSDWDVGDFWGQGTLVTVSSASTTAPSVFPLAPSCGSTSGSTVALACLVSGYFPEPVTVSWNSGSLTSGVHTFPSVLQSSGLYSLSSTVTVPSSRWPSETFTCNVVHPASNTKVDKPVFCESTCKCISPCPVPESLGGPSVFIFPFCFCDILRITRTPEITCVVLDLGREDPEVQISWFVDGKEVHTAKTQPREQQFNSTYRVVSVLPIEHQDWLTGKEFKCRVNHIGLPSPIERTISKARGQAHQPSVYVLPPSFCELSSSDTVTLTCLIKDFFPPEIDVEWQSNGQPEPESKYHTTAPQLDEDGSYFLYSKLSVDKSRWQQGDTFTCAVMHEALQNHYTDLSLSHSPGK
5F12-VH3-cIgGD Fc [SEQ ID NO: 41]
gaggtgcagctggtgcagagcggcggcgacctggtgaagcccggcggcagcgtgagactgagctgcgtggccagcttcaccttcgactactacatgaactgggtgagacaggcccccggcaagggcctgcagtggatcggcagatggatcttccccggcagcggcgccacctactacaacgagagattcatgggcaaggccaccatcagcgccgacaccgccaagaacaccgcctacatgcagctgaacagcctgagagccgaggacaccgccgtgtactactgcctgagaagcgactgggacgtgggcgacttctggggccagggcaccctggtgaccgtgagcagcgccagcaccaccgcccccagcgtgttccccctggcccccagctgcggcagcaccagcggcagcaccgtggccctggcctgcctggtgagcggctacttccccgagcccgtgaccgtgagctggaacagcggcagcctgaccagcggcgtgcacaccttccccagcgtgctgcagagcagcggcctgtacagcctgagcagcaccgtgaccgtgcccagcagcagatggcccagcgagaccttcacctgcaacgtggtgcaccccgccagcaacaccaaggtggacaagcccgtgcccaaggagagcacctgcaagtgcatcagcccctgccccgtgcccgagagcctgggcggccccagcgtgttcatcttcccccccaagcccaaggacatcctgagaatcaccagaacccccgagatcacctgcgtggtgctggacctgggcagagaggaccccgaggtgcagatcagctggttcgtggacggcaaggaggtgcacaccgccaagacccagcccagagagcagcagttcaacagcacctacagagtggtgagcgtgctgcccatcgagcaccaggactggctgaccggcaaggagttcaagtgcagagtgaaccacatcggcctgcccagccccatcgagagaaccatcagcaaggccagaggccaggcccaccagcccagcgtgtacgtgctgccccccagccccaaggagctgagcagcagcgacaccgtgaccctgacctgcctgatcaaggacttcttcccccccgagatcgacgtggagtggcagagcaacggccagcccgagcccgagagcaagtaccacaccaccgccccccagctggacgaggacggcagctacttcctgtacagcaagctgagcgtggacaagagcagatggcagcagggcgacaccttcacctgcgccgtgatgcacgaggccctgcagaaccactacaccgacctgagcctgagccacagccccggcaag
5F12-VL3-cLКаппа [SEQ ID NO: 44]
DIVMTQTPLSLSVSLGEPASISCRSSRSLLHTNGITYLSWYRQKPGQIPQLLIYQMSNLASGVPDRFSGSGSGTDFTLRISRVEADDAGVYYCAQTLGLPRTFGQGTKVEIKRNDAQPAVYLFQPSPDQLHTGSASVVCLLNSFYFCDINVKWKVDGVIQDTGIQESVTEQDSKDSTYSLSSTLTMSSTEYLSHELYSCEITHKSLPSTLIKSFQRSECQRVD
5F12-VL3-cLКаппа [SEQ ID NO: 43]
gacatcgtgatgacccagacccccctgagcctgagcgtgagcctgggcgagcccgccagcatcagctgcagaagcagcagaagcctgctgcacaccaacggcatcacctacctgagctggtacagacagaagcccggccagatcccccagctgctgatctaccagatgagcaacctggccagcggcgtgcccgacagattcagcggcagcggcagcggcaccgacttcaccctgagaatcagcagagtggaggccgacgacgccggcgtgtactactgcgcccagaccctgggcctgcccagaaccttcggccagggcaccaaggtggagatcaagagaaacgacgcccagcccgccgtgtacctgttccagcccagccccgaccagctgcacaccggcagcgccagcgtggtgtgcctgctgaacagcttctaccccaaggacatcaacgtgaagtggaaggtggacggcgtgatccaggacaccggcatccaggagagcgtgaccgagcaggacagcaaggacagcacctacagcctgagcagcaccctgaccatgagcagcaccgagtacctgagccacgagctgtacagctgcgagatcacccacaagagcctgcccagcaccctgatcaagagcttccagagaagcgagtgccagagagtggac
Вариабельные области мыши против PDL-1 собаки:4F9
Тяжелая цепь: последовательность ДНК [SEQ ID NO: 73]
gaagtgcagctggtggagtctgggggaggcttagtgaagcctggagggtccctgaaactctcctgtgcagcctctggattcactttcagtagctatgccatgtcttgggttcgccagactccggacaagagactggagtgggtcgcaaccattagtgatggtggaagttacacccactaccccgacaatttaatgggccgattcaccatctccagagacaatgccaagaacaacctgtacctgcaaatgagccatctgaagtctgacgacacagccatgtattactgtgcacgagagagctatgatggttactacgtggctaactggggccaagggactctggtcactgtctcagca
Тяжелая цепь: аминокислотная последовательность [SEQ ID NO: 74]
EVQLVESGGGLVKPGGSLKLSCAASGFTFSSYAMSWVRQTPDKRLEWVATISDGGSYTHYPDNLMGRFTISRDNAKNNLYLQMSHLKSDDTAMYYCARESYDGYYVANWGQGTLVTVSA
Легкая цепь: последовательность ДНК [SEQ ID NO: 75]
gatattgtgctaactcagtctccagccaccctgtctgtgaatccaggagatagcgtcagtctttcctgcagggccagccaaagtattagcaacaacctacactggtatcaacaaaaatcacatgagtctccaaggcttctcatcaagtatgcttcccagtccatctctgggatcccctccaggttcagtggcagtggatcagggacagatttcactctcagtatcaacagtgtggagactgaagattttggaatgtatttctgtcaacagagtaacagctggcctcagacgttcggtggaggcaccaagctggaaatcaaa
Легкая цепь: аминокислотная последовательность [SEQ ID NO: 76]
DIVLTQSPATLSVNPGDSVSLSCRASQSISNNLHWYQQKSHESPRLLIKYASQSISGIPSRFSGSGSGTDFTLSINSVETEDFGMYFCQQSNSWPQTFGGGTKLEIK
Вариабельные области мыши против PDL-1 собаки: 5F12 против PDL-1
Тяжелая цепь: последовательность ДНК [SEQ ID NO: 77]
caggtccagctacagcagtctggacctgagctggtgaagcctggggcttcagtgaagatatcctgcaaggcttctggctacaccttcactgactactatatgaattgggtgaaacagaggcctggacagggacttgagtggattggatggatttttcccggaagtggtgctacttactacaatgagaggttcatgggcaaggccacacttactgtggataaatcttccaacacagcctacatgttgttcagtagcctgacctctgaggactctgcggtctatttctgtttaagatctgactgggacgtcggggacttctggggccaaggcaccactctcacagtctcctca
Тяжелая цепь: аминокислотная последовательность [SEQ ID NO: 78]
QVQLQQSGPELVKPGASVKISCKASGYTFTDYYMNWVKQRPGQGLEWIGWIFPGSGATYYNERFMGKATLTVDKSSNTAYMLFSSLTSEDSAVYFCLRSDWDVGDFWGQGTTLTVSS
Легкая цепь: последовательность ДНК [SEQ ID NO: 79]
gatattgtgatgacgcaggctgcattctccaatccagtcactcttggaacatcagcttccatctcctgcaggtctagtaggagtctcctacatactaatggcatcacttatttgtcttggtttctgcagaagccaggccagtctcctcagctcctgatttatcagatgtccaaccttgcctcaggagtcccagacaggttcagtagcagtgggtcaggaactgatttcacactgagaatcagtagagtggaggctgaggatgtgggtatttattactgtgctcaaactctaggacttcctcggacgttcggtggaggcaccaagctggaaatcaaa
Легкая цепь: аминокислотная последовательность [SEQ ID NO: 80]
DIVMTQAAFSNPVTLGTSASISCRSSRSLLHTNGITYLSWFLQKPGQSPQLLIYQMSNLASGVPDRFSSSGSGTDFTLRISRVEAEDVGIYYCAQTLGLPRTFGGGTKLEIK
ПРИМЕР 5
КАРТИРОВАНИЕ ЭПИТОПОВ АНТИТЕЛ ПРОТИВ PD-L1 СОБАКИ
Взаимодействие антител с их когнатными белковыми антигенами опосредовано через связывание определенных аминокислот антител (паратопов) с определенными аминокислотами (эпитопами) антигенов-мишеней. Эпитоп является антигенной детерминантой, которая вызывает специфическую реакцию с иммуноглобулином. Эпитоп состоит из группы аминокислот на поверхности антигена. Представляющий интерес белок может содержать несколько эпитопов, распознаваемых различными антителами. Эпитопы, распознаваемые антителами, классифицируют как линейные или конформационные эпитопы. Линейные эпитопы сформированы отрезком непрерывной последовательности аминокислот в белке, тогда как конформационные эпитопы состоят из аминокислот, которые не являются смежными (например, расположены на расстоянии друг от друга) в первичной аминокислотной последовательности, но собираются вместе при трехмерном сворачивании белка.
Картирование эпитопов относится к процессу идентификации аминокислотных последовательностей (т.е. эпитопов), которые распознаются антителами на их антигенах-мишенях. Идентификация эпитопов, распознаваемых моноклональными антителами (мАт) на антигенах-мишенях, имеет важные применения. Например, это может способствовать разработке новых терапевтических, диагностических средств и вакцин. Картирование эпитопов может также помочь при выборе оптимизированных терапевтических мАт и объяснить их механизмы действия. Информация об эпитопе на PD-L1 также может помочь выявить уникальные эпитопы раковых опухолей и определить защитные или патогенные эффекты вакцин. Идентификация эпитопов также может привести к созданию субъединичных вакцин на основе химического или генетического связывания идентифицированного пептидного эпитопа с белком-носителем или другими иммуностимулирующими средствами.
Картирование эпитопов может быть выполнено с помощью поликлональных или моноклональных антител, при этом несколько спсобов используют для идентификации эпитопов в зависимости от предполагаемой природы эпитопа (т.е. линейного или конформационного). Картирование линейных эпитопов является более прямым и относительно более легким для выполнения. С этой целью поставщики коммерческих услуг для линейного картирования эпитопов часто используют пептидное сканирование. В данном случае перекрывающийся набор коротких пептидных последовательностей целевого белка синтезируют химически и проверяют на их способность связывать интересующие антитела. Стратегия является быстрой, высокопроизводительной и относительно недорогой для выполнения. С другой стороны, картирование несплошного эпитопа является технически более сложным и требует более специализированных методов, таких как рентгеновская сокристаллография моноклонального антитела вместе с его белком-мишенью, водородно-дейтериевый (H/D) обмен, масс-спектрометрия в сочетании с ферментативным расщеплением, а также некоторые другие методы, известные специалистам.
Картирование эпитопов PD-L1 с помощью масс-спектрометрии :
Способ на основе химического сшивания и детектирования с помощью масс-спектроскопии использовали для выявления эпитопов, распознаваемых мАт против PD-L1 собаки [CovalX® Instrument Incorporated]. Применение этой технологии для картирования эпитопов собачьего PD-L1 привело к идентификации эпитопов, распознаваемых указанными мАт, перечисленными в Таблице 13. Результаты картирования эпитопов собачьего PD-L1 с мАт 4F9 показывают, что данное мАт распознает эпитоп, расположенный во внеклеточном домене PD-L1 собаки, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 82, и аминокислотной последовательности, представленной в SEQ ID NO: 83 [см. Таблицу 13]. Кроме того, результаты эксперимента по картированию эпитопов с мАт 5F12 показывают, что данное мАт распознает эпитоп, расположенный во внеклеточном домене PD-L1 собаки, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 82. В частности, положение эпитопов на PD-L1 собаки, идентифицированных в настоящей заявке, в достаточной мере согласуется с данными, недавно опубликованными для соответствующего человеческого PD-L1 [Hao et al., J. Mol. Recognit. 28:269-276 (2015)], что обеспечивает дополнительную достоверность результатов, представленных выше.
Таблица 13
|
Все ссылки, процитированные в настоящей заявке, включены посредством отсылки в такой же степени, как если бы каждая отдельная публикация, значение в базе данных (например, последовательности GenBank или номера GeneID), заявка на патент или патент были прямо и индивидуально указаны как включенные посредством отсылки. Это утверждение включения посредством отсылки, как предполагают заявители согласно 1.57(b)(1) 37 C.F.R., относится к каждой отдельной публикации, значению в базе данных (например, последовательностям GenBank или номерам GeneID), заявке на патент или патенту, каждый из которых прямо определен согласно 1.57(b)(2) 37 C.F.R., даже если такое цитирование не прилагается непосредственно к специальному указанию включения посредством отсылки. Включение специальных указаний включения посредством отсылки, если таковые имеются, в настоящем описании ни коим образом не ослабляет данное общее указание включения посредством отсылки. Цитирование источников в настоящей заявке не предполагается в качестве допущения того, что такой источник имеет отношение к предшествующему уровню техники, равно как и не включает какого-либо допущения в отношении содержания или даты этих публикаций или документов.
Настоящее изобретение не должно быть ограничено в объеме определенными вариантами осуществления, описанными в настоящей заявке. Фактически, различные модификации изобретения, в дополнение к описанным в настоящей заявке, станут очевидными для специалистов из предыдущего описания и сопровождающих чертежей. Предполагается, что такие модификации включены в объем прилагаемой формулы изобретения.
Предыдущее письменное описание считается достаточным, для того чтобы позволить специалисту в данной области практически осуществить изобретение. Различные модификации изобретения, в дополнение к показанным и описанным в настоящем документе, будут очевидными для специалистов в данной области из предыдущего описания и включены в объем прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Intervet, Inc.
Intervet International, BV
Mohamad, Morsey
Yuanzheng, Zhang
Bartels-Morozov, Denise
Erskine, Jason
Tarpey, Ian
<120> АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ
<130> 23837 WO
<150> 62/057541
<151> 2014-09-30
<150> 62/172511
<151> 2015-06-08
<160> 83
<170> PatentIn version 3.5
<210> 1
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<220>
<221> misc_feature
<222> (10)..(12)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (91)..(93)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (187)..(195)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (277)..(279)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (283)..(285)
<223> n представляет собой a, c, g или t
<400> 1
ctgggcggcn nnagcgtgtt tatttttccg ccgaaaccga aagataccct gctgattgcg 60
cgcaccccgg aagtgacctg cgtggtggtg nnnctggatc cggaagatcc ggaagtgcag 120
attagctggt ttgtggatgg caaacagatg cagaccgcga aaacccagcc gcgcgaagaa 180
cagtttnnnn nnnnntatcg cgtggtgagc gtgctgccga ttggccatca ggattggctg 240
aaaggcaaac agtttacctg caaagtgaac aacaaannnc tgnnnagccc gattgaacgc 300
accattagca aagcgcgcgg ccaggcgcat cagccgagcg tgtatgtgct gccgccgagc 360
cgcgaagaac tgagcaaaaa caccgtgagc ctgacctgcc tgattaaaga tttttttccg 420
ccggatattg atgtggaatg gcagagcaac ggccagcagg aaccggaaag caaatatcgc 480
accaccccgc cgcagctgga tgaagatggc agctattttc tgtatagcaa actgagcgtg 540
gataaaagcc gctggcagcg cggcgatacc tttatttgcg cggtgatgca tgaagcgctg 600
cataaccatt atacccagga aagcctgagc catagcccgg gcaaa 645
<210> 2
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (31)..(31)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (63)..(65)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (93)..(93)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (95)..(95)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 2
Leu Gly Gly Xaa Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr
1 5 10 15
Leu Leu Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Xaa Leu
20 25 30
Asp Pro Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys
35 40 45
Gln Met Gln Thr Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Xaa Xaa
50 55 60
Xaa Tyr Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu
65 70 75 80
Lys Gly Lys Gln Phe Thr Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser
85 90 95
Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro
100 105 110
Ser Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr
115 120 125
Val Ser Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp
130 135 140
Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg
145 150 155 160
Thr Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser
165 170 175
Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile
180 185 190
Cys Ala Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser
195 200 205
Leu Ser His Ser Pro Gly Lys
210 215
<210> 3
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<220>
<221> misc_feature
<222> (10)..(12)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (91)..(93)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (187)..(195)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (277)..(279)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (283)..(285)
<223> n представляет собой a, c, g или t
<400> 3
ctgggcggcn nnagcgtgtt tatttttccg ccgaaaccga aagatattct ggtgaccgcg 60
cgcaccccga ccgtgacctg cgtggtggtg nnnctggatc cggaaaaccc ggaagtgcag 120
attagctggt ttgtggatag caaacaggtg cagaccgcga acacccagcc gcgcgaagaa 180
cagagcnnnn nnnnntatcg cgtggtgagc gtgctgccga ttggccatca ggattggctg 240
agcggcaaac agtttaaatg caaagtgaac aacaaannnc tgnnnagccc gattgaagaa 300
attattagca aaaccccggg ccaggcgcat cagccgaacg tgtatgtgct gccgccgagc 360
cgcgatgaaa tgagcaaaaa caccgtgacc ctgacctgcc tggtgaaaga tttttttccg 420
ccggaaattg atgtggaatg gcagagcaac ggccagcagg aaccggaaag caaatatcgc 480
atgaccccgc cgcagctgga tgaagatggc agctattttc tgtatagcaa actgagcgtg 540
gataaaagcc gctggcagcg cggcgatacc tttatttgcg cggtgatgca tgaagcgctg 600
cataaccatt atacccagat tagcctgagc catagcccgg gcaaa 645
<210> 4
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (31)..(31)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (63)..(65)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (93)..(93)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (95)..(95)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 4
Leu Gly Gly Xaa Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile
1 5 10 15
Leu Val Thr Ala Arg Thr Pro Thr Val Thr Cys Val Val Val Xaa Leu
20 25 30
Asp Pro Glu Asn Pro Glu Val Gln Ile Ser Trp Phe Val Asp Ser Lys
35 40 45
Gln Val Gln Thr Ala Asn Thr Gln Pro Arg Glu Glu Gln Ser Xaa Xaa
50 55 60
Xaa Tyr Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu
65 70 75 80
Ser Gly Lys Gln Phe Lys Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser
85 90 95
Pro Ile Glu Glu Ile Ile Ser Lys Thr Pro Gly Gln Ala His Gln Pro
100 105 110
Asn Val Tyr Val Leu Pro Pro Ser Arg Asp Glu Met Ser Lys Asn Thr
115 120 125
Val Thr Leu Thr Cys Leu Val Lys Asp Phe Phe Pro Pro Glu Ile Asp
130 135 140
Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg
145 150 155 160
Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser
165 170 175
Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile
180 185 190
Cys Ala Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Ile Ser
195 200 205
Leu Ser His Ser Pro Gly Lys
210 215
<210> 5
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 5
ccgaaagaaa gcacctgcaa atgcattccg ccgtgcccgg tgccggaaag cctgggcggc 60
ccgagcgtgt ttatttttcc gccgaaaccg aaagatattc tgcgcattac ccgcaccccg 120
gaaattacct gcgtggtgct ggatctgggc cgcgaagatc cggaagtgca gattagctgg 180
tttgtggatg gcaaagaagt gcataccgcg aaaacccagc cgcgcgaaca gcagtttaac 240
agcacctatc gcgtggtgag cgtgctgccg attgaacatc aggattggct gaccggcaaa 300
gaatttaaat gccgcgtgaa ccatattggc ctgccgagcc cgattgaacg caccattagc 360
aaagcgcgcg gccaggcgca tcagccgagc gtgtatgtgc tgccgccgag cccgaaagaa 420
ctgagcagca gcgataccgt gaccctgacc tgcctgatta aagatttttt tccgccggaa 480
attgatgtgg aatggcagag caacggccag ccggaaccgg aaagcaaata tcataccacc 540
gcgccgcagc tggatgaaga tggcagctat tttctgtata gcaaactgag cgtggataaa 600
agccgctggc agcagggcga tacctttacc tgcgcggtga tgcatgaagc gctgcagaac 660
cattataccg atctgagcct gagccatagc ccgggcaaa 699
<210> 6
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 6
Pro Lys Glu Ser Thr Cys Lys Cys Ile Pro Pro Cys Pro Val Pro Glu
1 5 10 15
Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp
20 25 30
Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val Val Leu Asp
35 40 45
Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly
50 55 60
Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp
85 90 95
Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Gly Leu Pro
100 105 110
Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln
115 120 125
Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser
130 135 140
Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Glu
145 150 155 160
Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro Glu Ser Lys
165 170 175
Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu
180 185 190
Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Thr
195 200 205
Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His Tyr Thr Asp
210 215 220
Leu Ser Leu Ser His Ser Pro Gly Lys
225 230
<210> 7
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 7
tttaacgaat gccgctgcac cgataccccg ccgtgcccgg tgccggaacc gctgggcggc 60
ccgagcgtgt ttatttttcc gccgaaaccg aaagatattc tgcgcattac ccgcaccccg 120
gaaattacct gcgtggtgct ggatctgggc cgcgaagatc cggaagtgca gattagctgg 180
tttgtggatg gcaaagaagt gcataccgcg aaaacccagc cgcgcgaaca gcagtttaac 240
agcacctatc gcgtggtgag cgtgctgccg attgaacatc aggattggct gaccggcaaa 300
gaatttaaat gccgcgtgaa ccatattggc ctgccgagcc cgattgaacg caccattagc 360
aaagcgcgcg gccaggcgca tcagccgagc gtgtatgtgc tgccgccgag cccgaaagaa 420
ctgagcagca gcgataccgt gaccctgacc tgcctgatta aagatttttt tccgccggaa 480
attgatgtgg aatggcagag caacggccag ccggaaccgg aaagcaaata tcataccacc 540
gcgccgcagc tggatgaaga tggcagctat tttctgtata gcaaactgag cgtggataaa 600
agccgctggc agcagggcga tacctttacc tgcgcggtga tgcatgaagc gctgcagaac 660
cattataccg atctgagcct gagccatagc ccgggcaaa 699
<210> 8
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 8
Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys Pro Val Pro Glu
1 5 10 15
Pro Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp
20 25 30
Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val Val Leu Asp
35 40 45
Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly
50 55 60
Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp
85 90 95
Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Gly Leu Pro
100 105 110
Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln
115 120 125
Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser
130 135 140
Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Glu
145 150 155 160
Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro Glu Ser Lys
165 170 175
Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu
180 185 190
Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Thr
195 200 205
Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His Tyr Thr Asp
210 215 220
Leu Ser Leu Ser His Ser Pro Gly Lys
225 230
<210> 9
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 9
ccgaaacgcg aaaacggccg cgtgccgcgc ccgccggatt gcccgaaatg cccggcgccg 60
gaaatgctgg gcggcccgag cgtgtttatt tttccgccga aaccgaaaga tattctgcgc 120
attacccgca ccccggaaat tacctgcgtg gtgctggatc tgggccgcga agatccggaa 180
gtgcagatta gctggtttgt ggatggcaaa gaagtgcata ccgcgaaaac ccagccgcgc 240
gaacagcagt ttaacagcac ctatcgcgtg gtgagcgtgc tgccgattga acatcaggat 300
tggctgaccg gcaaagaatt taaatgccgc gtgaaccata ttggcctgcc gagcccgatt 360
gaacgcacca ttagcaaagc gcgcggccag gcgcatcagc cgagcgtgta tgtgctgccg 420
ccgagcccga aagaactgag cagcagcgat accgtgaccc tgacctgcct gattaaagat 480
ttttttccgc cggaaattga tgtggaatgg cagagcaacg gccagccgga accggaaagc 540
aaatatcata ccaccgcgcc gcagctggat gaagatggca gctattttct gtatagcaaa 600
ctgagcgtgg ataaaagccg ctggcagcag ggcgatacct ttacctgcgc ggtgatgcat 660
gaagcgctgc agaaccatta taccgatctg agcctgagcc atagcccggg caaa 714
<210> 10
<211> 238
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 10
Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro Asp Cys Pro Lys
1 5 10 15
Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val Phe Ile Phe Pro
20 25 30
Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr
35 40 45
Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser
50 55 60
Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg
65 70 75 80
Glu Gln Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile
85 90 95
Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn
100 105 110
His Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg
115 120 125
Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys
130 135 140
Glu Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp
145 150 155 160
Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro
165 170 175
Glu Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp
180 185 190
Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln
210 215 220
Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
225 230 235
<210> 11
<211> 708
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 11
gccaaggagt gcgagtgcaa gtgcaactgc aacaactgcc cctgccccgg ctgcggcctg 60
ctgggcggcc ccagcgtgtt catcttcccc cccaagccca aggacatcct gagaatcacc 120
agaacccccg agatcacctg cgtggtgctg gacctgggca gagaggaccc cgaggtgcag 180
atcagctggt tcgtggacgg caaggaggtg cacaccgcca agacccagcc cagagagcag 240
cagttcaaca gcacctacag agtggtgagc gtgctgccca tcgagcacca ggactggctg 300
accggcaagg agttcaagtg cagagtgaac cacatcggcc tgcccagccc catcgagaga 360
accatcagca aggccagagg ccaggcccac cagcccagcg tgtacgtgct gccccccagc 420
cccaaggagc tgagcagcag cgacaccgtg accctgacct gcctgatcaa ggacttcttc 480
ccccccgaga tcgacgtgga gtggcagagc aacggccagc ccgagcccga gagcaagtac 540
cacaccaccg ccccccagct ggacgaggac ggcagctact tcctgtacag caagctgagc 600
gtggacaaga gcagatggca gcagggcgac accttcacct gcgccgtgat gcacgaggcc 660
ctgcagaacc actacaccga cctgagcctg agccacagcc ccggcaag 708
<210> 12
<211> 236
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная канинизированная последовательность
<400> 12
Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn Cys Pro Cys Pro
1 5 10 15
Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
20 25 30
Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val
35 40 45
Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe
50 55 60
Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln
65 70 75 80
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His
85 90 95
Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile
100 105 110
Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln
115 120 125
Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu
130 135 140
Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Phe
145 150 155 160
Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro
165 170 175
Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser
180 185 190
Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln
195 200 205
Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His
210 215 220
Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
225 230 235
<210> 13
<211> 5
<212> Белок
<213> Mus musculus
<400> 13
Ser Tyr Ala Met Ser
1 5
<210> 14
<211> 17
<212> Белок
<213> Mus musculus
<400> 14
Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu Met
1 5 10 15
Gly
<210> 15
<211> 10
<212> Белок
<213> Mus musculus
<400> 15
Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn
1 5 10
<210> 16
<211> 11
<212> Белок
<213> Mus musculus
<400> 16
Arg Ala Ser Gln Ser Ile Ser Asn Asn Leu His
1 5 10
<210> 17
<211> 7
<212> Белок
<213> Mus musculus
<400> 17
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 18
<211> 9
<212> Белок
<213> Mus musculus
<400> 18
Gln Gln Ser Asn Ser Trp Pro Gln Thr
1 5
<210> 19
<211> 5
<212> Белок
<213> Mus musculus
<400> 19
Asp Tyr Tyr Met Asn
1 5
<210> 20
<211> 17
<212> Белок
<213> Mus musculus
<400> 20
Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe Met
1 5 10 15
Gly
<210> 21
<211> 8
<212> Белок
<213> Mus musculus
<400> 21
Ser Asp Trp Asp Val Gly Asp Phe
1 5
<210> 22
<211> 16
<212> Белок
<213> Mus musculus
<400> 22
Arg Ser Ser Arg Ser Leu Leu His Thr Asn Gly Ile Thr Tyr Leu Ser
1 5 10 15
<210> 23
<211> 7
<212> Белок
<213> Mus musculus
<400> 23
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 24
<211> 9
<212> Белок
<213> Mus musculus
<400> 24
Ala Gln Thr Leu Gly Leu Pro Arg Thr
1 5
<210> 25
<211> 1359
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (724)..(726)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (805)..(807)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (901)..(909)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (991)..(993)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (997)..(999)
<223> n представляет собой a, c, g или t
<400> 25
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcggctt caccttcagc tacgccatga gctgggtgag acaggccccc 120
ggcaagggcc tgcagtggat gggcaccatc agcgacggcg gcagctacac ccactacccc 180
gacaacctga tgggcagatt caccttcagc ctggacaccg ccaagaacac cgcctacctg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcgccag agagagctac 300
gacggctact acgtggccaa ctggggccag ggcaccctgg tgaccgtgag cagcgccagc 360
accaccgccc ccagcgtgtt ccccctggcc cccagctgcg gcagcaccag cggcagcacc 420
gtggccctgg cctgcctggt gagcggctac ttccccgagc ccgtgaccgt gagctggaac 480
agcggcagcc tgaccagcgg cgtgcacacc ttccccagcg tgctgcagag cagcggcctg 540
tacagcctga gcagcatggt gaccgtgccc agcagcagat ggcccagcga gaccttcacc 600
tgcaacgtgg cccaccccgc cagcaagacc aaggtggaca agcccgtgcc caagagagag 660
aacggcagag tgcccagacc ccccgactgc cccaagtgcc ccgcccccga gatgctgggc 720
ggcnnnagcg tgttcatctt cccccccaag cccaaggaca ccctgctgat cgccagaacc 780
cccgaggtga cctgcgtggt ggtgnnnctg gaccccgagg accccgaggt gcagatcagc 840
tggttcgtgg acggcaagca gatgcagacc gccaagaccc agcccagaga ggagcagttc 900
nnnnnnnnnt acagagtggt gagcgtgctg cccatcggcc accaggactg gctgaagggc 960
aagcagttca cctgcaaggt gaacaacaag nnnctgnnna gccccatcga gagaaccatc 1020
agcaaggcca gaggccaggc ccaccagccc agcgtgtacg tgctgccccc cagcagagag 1080
gagctgagca agaacaccgt gagcctgacc tgcctgatca aggacttctt cccccccgac 1140
atcgacgtgg agtggcagag caacggccag caggagcccg agagcaagta cagaaccacc 1200
cccccccagc tggacgagga cggcagctac ttcctgtaca gcaagctgag cgtggacaag 1260
agcagatggc agagaggcga caccttcatc tgcgccgtga tgcacgaggc cctgcacaac 1320
cactacaccc aggagagcct gagccacagc cccggcaag 1359
<210> 26
<211> 453
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (242)..(242)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (269)..(269)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (301)..(303)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (331)..(331)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (333)..(333)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 26
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Met Gly
35 40 45
Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu Met
50 55 60
Gly Arg Phe Thr Phe Ser Leu Asp Thr Ala Lys Asn Thr Ala Tyr Leu
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Lys Thr Lys Val Asp Lys Pro Val Pro Lys Arg Glu Asn Gly Arg Val
210 215 220
Pro Arg Pro Pro Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly
225 230 235 240
Gly Xaa Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu
245 250 255
Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Xaa Leu Asp Pro
260 265 270
Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met
275 280 285
Gln Thr Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Xaa Xaa Xaa Tyr
290 295 300
Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly
305 310 315 320
Lys Gln Phe Thr Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser Pro Ile
325 330 335
Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val
340 345 350
Tyr Val Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser
355 360 365
Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp Val Glu
370 375 380
Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr
385 390 395 400
Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu
405 410 415
Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser
435 440 445
His Ser Pro Gly Lys
450
<210> 27
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (718)..(720)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (799)..(801)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (895)..(903)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (985)..(987)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (991)..(993)
<223> n представляет собой a, c, g или t
<400> 27
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcggctt caccttcagc tacgccatga gctgggtgag acaggccccc 120
ggcaagggcc tgcagtggat gggcaccatc agcgacggcg gcagctacac ccactacccc 180
gacaacctga tgggcagatt caccttcagc ctggacaccg ccaagaacac cgcctacctg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcgccag agagagctac 300
gacggctact acgtggccaa ctggggccag ggcaccctgg tgaccgtgag cagcgccagc 360
accaccgccc ccagcgtgtt ccccctggcc cccagctgcg gcagccagag cggcagcacc 420
gtggccctgg cctgcctggt gagcggctac atccccgagc ccgtgaccgt gagctggaac 480
agcgtgagcc tgaccagcgg cgtgcacacc ttccccagcg tgctgcagag cagcggcctg 540
tacagcctga gcagcatggt gaccgtgccc agcagcagat ggcccagcga gaccttcacc 600
tgcaacgtgg cccaccccgc caccaacacc aaggtggaca agcccgtggc caaggagtgc 660
gagtgcaagt gcaactgcaa caactgcccc tgccccggct gcggcctgct gggcggcnnn 720
agcgtgttca tcttcccccc caagcccaag gacatcctgg tgaccgccag aacccccacc 780
gtgacctgcg tggtggtgnn nctggacccc gagaaccccg aggtgcagat cagctggttc 840
gtggacagca agcaggtgca gaccgccaac acccagccca gagaggagca gagcnnnnnn 900
nnntacagag tggtgagcgt gctgcccatc ggccaccagg actggctgag cggcaagcag 960
ttcaagtgca aggtgaacaa caagnnnctg nnnagcccca tcgaggagat catcagcaag 1020
acccccggcc aggcccacca gcccaacgtg tacgtgctgc cccccagcag agacgagatg 1080
agcaagaaca ccgtgaccct gacctgcctg gtgaaggact tcttcccccc cgagatcgac 1140
gtggagtggc agagcaacgg ccagcaggag cccgagagca agtacagaat gacccccccc 1200
cagctggacg aggacggcag ctacttcctg tacagcaagc tgagcgtgga caagagcaga 1260
tggcagagag gcgacacctt catctgcgcc gtgatgcacg aggccctgca caaccactac 1320
acccagatca gcctgagcca cagccccggc aag 1353
<210> 28
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (240)..(240)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (267)..(267)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (299)..(301)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (329)..(329)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (331)..(331)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 28
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Met Gly
35 40 45
Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu Met
50 55 60
Gly Arg Phe Thr Phe Ser Leu Asp Thr Ala Lys Asn Thr Ala Tyr Leu
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Gln Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Ile Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Val Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Thr
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Ala Lys Glu Cys Glu Cys Lys Cys
210 215 220
Asn Cys Asn Asn Cys Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Xaa
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala
245 250 255
Arg Thr Pro Thr Val Thr Cys Val Val Val Xaa Leu Asp Pro Glu Asn
260 265 270
Pro Glu Val Gln Ile Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr
275 280 285
Ala Asn Thr Gln Pro Arg Glu Glu Gln Ser Xaa Xaa Xaa Tyr Arg Val
290 295 300
Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln
305 310 315 320
Phe Lys Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser Pro Ile Glu Glu
325 330 335
Ile Ile Ser Lys Thr Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr
355 360 365
Cys Leu Val Lys Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln
370 375 380
Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro
385 390 395 400
Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val
405 410 415
Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser
435 440 445
Pro Gly Lys
450
<210> 29
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (718)..(720)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (799)..(801)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (895)..(903)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (985)..(987)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (991)..(993)
<223> n представляет собой a, c, g или t
<400> 29
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcttcac cttcgactac tacatgaact gggtgagaca ggcccccggc 120
aagggcctgc agtggatcgg cagatggatc ttccccggca gcggcgccac ctactacaac 180
gagagattca tgggcaaggc caccatcagc gccgacaccg ccaagaacac cgcctacatg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcctgag aagcgactgg 300
gacgtgggcg acttctgggg ccagggcacc ctggtgaccg tgagcagcgc cagcaccacc 360
gcccccagcg tgttccccct ggcccccagc tgcggcagca ccagcggcag caccgtggcc 420
ctggcctgcc tggtgagcgg ctacttcccc gagcccgtga ccgtgagctg gaacagcggc 480
agcctgacca gcggcgtgca caccttcccc agcgtgctgc agagcagcgg cctgtacagc 540
ctgagcagca tggtgaccgt gcccagcagc agatggccca gcgagacctt cacctgcaac 600
gtggcccacc ccgccagcaa gaccaaggtg gacaagcccg tgcccaagag agagaacggc 660
agagtgccca gaccccccga ctgccccaag tgccccgccc ccgagatgct gggcggcnnn 720
agcgtgttca tcttcccccc caagcccaag gacaccctgc tgatcgccag aacccccgag 780
gtgacctgcg tggtggtgnn nctggacccc gaggaccccg aggtgcagat cagctggttc 840
gtggacggca agcagatgca gaccgccaag acccagccca gagaggagca gttcnnnnnn 900
nnntacagag tggtgagcgt gctgcccatc ggccaccagg actggctgaa gggcaagcag 960
ttcacctgca aggtgaacaa caagnnnctg nnnagcccca tcgagagaac catcagcaag 1020
gccagaggcc aggcccacca gcccagcgtg tacgtgctgc cccccagcag agaggagctg 1080
agcaagaaca ccgtgagcct gacctgcctg atcaaggact tcttcccccc cgacatcgac 1140
gtggagtggc agagcaacgg ccagcaggag cccgagagca agtacagaac cacccccccc 1200
cagctggacg aggacggcag ctacttcctg tacagcaagc tgagcgtgga caagagcaga 1260
tggcagagag gcgacacctt catctgcgcc gtgatgcacg aggccctgca caaccactac 1320
acccaggaga gcctgagcca cagccccggc aag 1353
<210> 30
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (240)..(240)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (267)..(267)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (299)..(301)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (329)..(329)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (331)..(331)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 30
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Phe Thr Phe Asp Tyr Tyr Met
20 25 30
Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Ile Gly Arg
35 40 45
Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe Met
50 55 60
Gly Lys Ala Thr Ile Ser Ala Asp Thr Ala Lys Asn Thr Ala Tyr Met
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Leu
85 90 95
Arg Ser Asp Trp Asp Val Gly Asp Phe Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala Cys Leu
130 135 140
Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser Arg Trp
180 185 190
Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Ser Lys Thr
195 200 205
Lys Val Asp Lys Pro Val Pro Lys Arg Glu Asn Gly Arg Val Pro Arg
210 215 220
Pro Pro Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly Gly Xaa
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Xaa Leu Asp Pro Glu Asp
260 265 270
Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met Gln Thr
275 280 285
Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Xaa Xaa Xaa Tyr Arg Val
290 295 300
Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly Lys Gln
305 310 315 320
Phe Thr Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser Pro Ile Glu Arg
325 330 335
Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser Leu Thr
355 360 365
Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp Val Glu Trp Gln
370 375 380
Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro
385 390 395 400
Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val
405 410 415
Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser His Ser
435 440 445
Pro Gly Lys
450
<210> 31
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<220>
<221> misc_feature
<222> (712)..(714)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (793)..(795)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (889)..(897)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (979)..(981)
<223> n представляет собой a, c, g или t
<220>
<221> misc_feature
<222> (985)..(987)
<223> n представляет собой a, c, g или t
<400> 31
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcttcac cttcgactac tacatgaact gggtgagaca ggcccccggc 120
aagggcctgc agtggatcgg cagatggatc ttccccggca gcggcgccac ctactacaac 180
gagagattca tgggcaaggc caccatcagc gccgacaccg ccaagaacac cgcctacatg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcctgag aagcgactgg 300
gacgtgggcg acttctgggg ccagggcacc ctggtgaccg tgagcagcgc cagcaccacc 360
gcccccagcg tgttccccct ggcccccagc tgcggcagcc agagcggcag caccgtggcc 420
ctggcctgcc tggtgagcgg ctacatcccc gagcccgtga ccgtgagctg gaacagcgtg 480
agcctgacca gcggcgtgca caccttcccc agcgtgctgc agagcagcgg cctgtacagc 540
ctgagcagca tggtgaccgt gcccagcagc agatggccca gcgagacctt cacctgcaac 600
gtggcccacc ccgccaccaa caccaaggtg gacaagcccg tggccaagga gtgcgagtgc 660
aagtgcaact gcaacaactg cccctgcccc ggctgcggcc tgctgggcgg cnnnagcgtg 720
ttcatcttcc cccccaagcc caaggacatc ctggtgaccg ccagaacccc caccgtgacc 780
tgcgtggtgg tgnnnctgga ccccgagaac cccgaggtgc agatcagctg gttcgtggac 840
agcaagcagg tgcagaccgc caacacccag cccagagagg agcagagcnn nnnnnnntac 900
agagtggtga gcgtgctgcc catcggccac caggactggc tgagcggcaa gcagttcaag 960
tgcaaggtga acaacaagnn nctgnnnagc cccatcgagg agatcatcag caagaccccc 1020
ggccaggccc accagcccaa cgtgtacgtg ctgcccccca gcagagacga gatgagcaag 1080
aacaccgtga ccctgacctg cctggtgaag gacttcttcc cccccgagat cgacgtggag 1140
tggcagagca acggccagca ggagcccgag agcaagtaca gaatgacccc cccccagctg 1200
gacgaggacg gcagctactt cctgtacagc aagctgagcg tggacaagag cagatggcag 1260
agaggcgaca ccttcatctg cgccgtgatg cacgaggccc tgcacaacca ctacacccag 1320
atcagcctga gccacagccc cggcaag 1347
<210> 32
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированная мышь anitbody
<220>
<221> misc_feature
<222> (238)..(238)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (265)..(265)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (297)..(299)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (327)..(327)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<220>
<221> misc_feature
<222> (329)..(329)
<223> Xaa может быть любой встречающейся в природе аминокислотой
<400> 32
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Phe Thr Phe Asp Tyr Tyr Met
20 25 30
Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Ile Gly Arg
35 40 45
Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe Met
50 55 60
Gly Lys Ala Thr Ile Ser Ala Asp Thr Ala Lys Asn Thr Ala Tyr Met
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Leu
85 90 95
Arg Ser Asp Trp Asp Val Gly Asp Phe Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Cys Gly Ser Gln Ser Gly Ser Thr Val Ala Leu Ala Cys Leu
130 135 140
Val Ser Gly Tyr Ile Pro Glu Pro Val Thr Val Ser Trp Asn Ser Val
145 150 155 160
Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser Arg Trp
180 185 190
Pro Ser Glu Thr Phe Thr Cys Asn Val Ala His Pro Ala Thr Asn Thr
195 200 205
Lys Val Asp Lys Pro Val Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys
210 215 220
Asn Asn Cys Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Xaa Ser Val
225 230 235 240
Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala Arg Thr
245 250 255
Pro Thr Val Thr Cys Val Val Val Xaa Leu Asp Pro Glu Asn Pro Glu
260 265 270
Val Gln Ile Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr Ala Asn
275 280 285
Thr Gln Pro Arg Glu Glu Gln Ser Xaa Xaa Xaa Tyr Arg Val Val Ser
290 295 300
Val Leu Pro Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys
305 310 315 320
Cys Lys Val Asn Asn Lys Xaa Leu Xaa Ser Pro Ile Glu Glu Ile Ile
325 330 335
Ser Lys Thr Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val Leu Pro
340 345 350
Pro Ser Arg Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr Cys Leu
355 360 365
Val Lys Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn
370 375 380
Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu
385 390 395 400
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
405 410 415
Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser Pro Gly
435 440 445
Lys
<210> 33
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 33
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcggctt caccttcagc tacgccatga gctgggtgag acaggccccc 120
ggcaagggcc tgcagtggat gggcaccatc agcgacggcg gcagctacac ccactacccc 180
gacaacctga tgggcagatt caccttcagc ctggacaccg ccaagaacac cgcctacctg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcgccag agagagctac 300
gacggctact acgtggccaa ctggggccag ggcaccctgg tgaccgtgag cagcgccagc 360
accaccgccc ccagcgtgtt ccccctggcc cccagctgcg gcagcaccag cggcagcacc 420
gtggccctgg cctgcctggt gagcggctac ttccccgagc ccgtgaccgt gagctggaac 480
agcggcagcc tgaccagcgg cgtgcacacc ttccccagcg tgctgcagag cagcggcctg 540
cacagcctga gcagcatggt gaccgtgccc agcagcagat ggcccagcga gaccttcacc 600
tgcaacgtgg tgcaccccgc cagcaacacc aaggtggaca agcccgtgtt caacgagtgc 660
agatgcaccg acaccccccc ctgccccgtg cccgagcccc tgggcggccc cagcgtgctg 720
atcttccccc ccaagcccaa ggacatcctg agaatcacca gaacccccga ggtgacctgc 780
gtggtgctgg acctgggcag agaggacccc gaggtgcaga tcagctggtt cgtggacggc 840
aaggaggtgc acaccgccaa gacccagagc agagagcagc agttcaacgg cacctacaga 900
gtggtgagcg tgctgcccat cgagcaccag gactggctga ccggcaagga gttcaagtgc 960
agagtgaacc acatcgacct gcccagcccc atcgagagaa ccatcagcaa ggccagaggc 1020
agagcccaca agcccagcgt gtacgtgctg ccccccagcc ccaaggagct gagcagcagc 1080
gacaccgtga gcatcacctg cctgatcaag gacttctacc cccccgacat cgacgtggag 1140
tggcagagca acggccagca ggagcccgag agaaagcaca gaatgacccc cccccagctg 1200
gacgaggacg gcagctactt cctgtacagc aagctgagcg tggacaagag cagatggcag 1260
cagggcgacc ccttcacctg cgccgtgatg cacgagaccc tgcagaacca ctacaccgac 1320
ctgagcctga gccacagccc cggcaag 1347
<210> 34
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 34
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Met Gly
35 40 45
Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu Met
50 55 60
Gly Arg Phe Thr Phe Ser Leu Asp Thr Ala Lys Asn Thr Ala Tyr Leu
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu His Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Phe Asn Glu Cys Arg Cys Thr Asp
210 215 220
Thr Pro Pro Cys Pro Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val
260 265 270
Gln Ile Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr
275 280 285
Gln Ser Arg Glu Gln Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Pro Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn His Ile Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Ala Arg Gly Arg Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro
340 345 350
Ser Pro Lys Glu Leu Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu
355 360 365
Ile Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn
370 375 380
Gly Gln Gln Glu Pro Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu
385 390 395 400
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asp Pro Phe Thr Cys Ala Val Met His Glu
420 425 430
Thr Leu Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly
435 440 445
Lys
<210> 35
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 35
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcggctt caccttcagc tacgccatga gctgggtgag acaggccccc 120
ggcaagggcc tgcagtggat gggcaccatc agcgacggcg gcagctacac ccactacccc 180
gacaacctga tgggcagatt caccttcagc ctggacaccg ccaagaacac cgcctacctg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcgccag agagagctac 300
gacggctact acgtggccaa ctggggccag ggcaccctgg tgaccgtgag cagcgccagc 360
accaccgccc ccagcgtgtt ccccctggcc cccagctgcg gcagcaccag cggcagcacc 420
gtggccctgg cctgcctggt gagcggctac ttccccgagc ccgtgaccgt gagctggaac 480
agcggcagcc tgaccagcgg cgtgcacacc ttccccagcg tgctgcagag cagcggcctg 540
tacagcctga gcagcaccgt gaccgtgccc agcagcagat ggcccagcga gaccttcacc 600
tgcaacgtgg tgcaccccgc cagcaacacc aaggtggaca agcccgtgcc caaggagagc 660
acctgcaagt gcatcagccc ctgccccgtg cccgagagcc tgggcggccc cagcgtgttc 720
atcttccccc ccaagcccaa ggacatcctg agaatcacca gaacccccga gatcacctgc 780
gtggtgctgg acctgggcag agaggacccc gaggtgcaga tcagctggtt cgtggacggc 840
aaggaggtgc acaccgccaa gacccagccc agagagcagc agttcaacag cacctacaga 900
gtggtgagcg tgctgcccat cgagcaccag gactggctga ccggcaagga gttcaagtgc 960
agagtgaacc acatcggcct gcccagcccc atcgagagaa ccatcagcaa ggccagaggc 1020
caggcccacc agcccagcgt gtacgtgctg ccccccagcc ccaaggagct gagcagcagc 1080
gacaccgtga ccctgacctg cctgatcaag gacttcttcc cccccgagat cgacgtggag 1140
tggcagagca acggccagcc cgagcccgag agcaagtacc acaccaccgc cccccagctg 1200
gacgaggacg gcagctactt cctgtacagc aagctgagcg tggacaagag cagatggcag 1260
cagggcgaca ccttcacctg cgccgtgatg cacgaggccc tgcagaacca ctacaccgac 1320
ctgagcctga gccacagccc cggcaag 1347
<210> 36
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 36
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Met Gly
35 40 45
Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu Met
50 55 60
Gly Arg Phe Thr Phe Ser Leu Asp Thr Ala Lys Asn Thr Ala Tyr Leu
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala
130 135 140
Cys Leu Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Thr Val Thr Val Pro Ser Ser
180 185 190
Arg Trp Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser
195 200 205
Asn Thr Lys Val Asp Lys Pro Val Pro Lys Glu Ser Thr Cys Lys Cys
210 215 220
Ile Ser Pro Cys Pro Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro
245 250 255
Glu Ile Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val
260 265 270
Gln Ile Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr
275 280 285
Gln Pro Arg Glu Gln Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Pro Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn His Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro
340 345 350
Ser Pro Lys Glu Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu
355 360 365
Ile Lys Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn
370 375 380
Gly Gln Pro Glu Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu
385 390 395 400
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu
420 425 430
Ala Leu Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly
435 440 445
Lys
<210> 37
<211> 654
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 37
gacatcgtga tgacccagac ccccctgagc ctgagcgtga gccccggcga gcccgccagc 60
atgagctgca gagccagcca gagcatcagc aacaacctgc actggtacag acagaagccc 120
ggccagagcc cccaggtgct ggtgaagtac gccagccaga gcatcagcgg cgtgcccgac 180
agattcatcg gcagcggcag cggcaccgac ttcaccctga gaatcagcag agtggaggcc 240
gacgacctgg gcgtgtacta ctgccagcag agcaacagct ggccccagac cttcggccag 300
ggcaccaagc tggagctgaa gagaaacgac gcccagcccg ccgtgtacct gttccagccc 360
agccccgacc agctgcacac cggcagcgcc agcgtggtgt gcctgctgaa cagcttctac 420
cccaaggaca tcaacgtgaa gtggaaggtg gacggcgtga tccaggacac cggcatccag 480
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 540
atgagcagca ccgagtacct gagccacgag ctgtacagct gcgagatcac ccacaagagc 600
ctgcccagca ccctgatcaa gagcttccag agaagcgagt gccagagagt ggac 654
<210> 38
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 38
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Pro Ala Ser Met Ser Cys Arg Ala Ser Gln Ser Ile Ser Asn Asn
20 25 30
Leu His Trp Tyr Arg Gln Lys Pro Gly Gln Ser Pro Gln Val Leu Val
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Val Pro Asp Arg Phe Ile Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile Ser Arg Val Glu Ala
65 70 75 80
Asp Asp Leu Gly Val Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Gln
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Leu Lys Arg Asn Asp Ala Gln
100 105 110
Pro Ala Val Tyr Leu Phe Gln Pro Ser Pro Asp Gln Leu His Thr Gly
115 120 125
Ser Ala Ser Val Val Cys Leu Leu Asn Ser Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Val Asp Gly Val Ile Gln Asp Thr Gly Ile Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Leu Ser His Glu Leu Tyr
180 185 190
Ser Cys Glu Ile Thr His Lys Ser Leu Pro Ser Thr Leu Ile Lys Ser
195 200 205
Phe Gln Arg Ser Glu Cys Gln Arg Val Asp
210 215
<210> 39
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 39
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcttcac cttcgactac tacatgaact gggtgagaca ggcccccggc 120
aagggcctgc agtggatcgg cagatggatc ttccccggca gcggcgccac ctactacaac 180
gagagattca tgggcaaggc caccatcagc gccgacaccg ccaagaacac cgcctacatg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcctgag aagcgactgg 300
gacgtgggcg acttctgggg ccagggcacc ctggtgaccg tgagcagcgc cagcaccacc 360
gcccccagcg tgttccccct ggcccccagc tgcggcagca ccagcggcag caccgtggcc 420
ctggcctgcc tggtgagcgg ctacttcccc gagcccgtga ccgtgagctg gaacagcggc 480
agcctgacca gcggcgtgca caccttcccc agcgtgctgc agagcagcgg cctgcacagc 540
ctgagcagca tggtgaccgt gcccagcagc agatggccca gcgagacctt cacctgcaac 600
gtggtgcacc ccgccagcaa caccaaggtg gacaagcccg tgttcaacga gtgcagatgc 660
accgacaccc ccccctgccc cgtgcccgag cccctgggcg gccccagcgt gctgatcttc 720
ccccccaagc ccaaggacat cctgagaatc accagaaccc ccgaggtgac ctgcgtggtg 780
ctggacctgg gcagagagga ccccgaggtg cagatcagct ggttcgtgga cggcaaggag 840
gtgcacaccg ccaagaccca gagcagagag cagcagttca acggcaccta cagagtggtg 900
agcgtgctgc ccatcgagca ccaggactgg ctgaccggca aggagttcaa gtgcagagtg 960
aaccacatcg acctgcccag ccccatcgag agaaccatca gcaaggccag aggcagagcc 1020
cacaagccca gcgtgtacgt gctgcccccc agccccaagg agctgagcag cagcgacacc 1080
gtgagcatca cctgcctgat caaggacttc tacccccccg acatcgacgt ggagtggcag 1140
agcaacggcc agcaggagcc cgagagaaag cacagaatga ccccccccca gctggacgag 1200
gacggcagct acttcctgta cagcaagctg agcgtggaca agagcagatg gcagcagggc 1260
gaccccttca cctgcgccgt gatgcacgag accctgcaga accactacac cgacctgagc 1320
ctgagccaca gccccggcaa g 1341
<210> 40
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 40
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Phe Thr Phe Asp Tyr Tyr Met
20 25 30
Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Ile Gly Arg
35 40 45
Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe Met
50 55 60
Gly Lys Ala Thr Ile Ser Ala Asp Thr Ala Lys Asn Thr Ala Tyr Met
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Leu
85 90 95
Arg Ser Asp Trp Asp Val Gly Asp Phe Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala Cys Leu
130 135 140
Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln Ser Ser
165 170 175
Gly Leu His Ser Leu Ser Ser Met Val Thr Val Pro Ser Ser Arg Trp
180 185 190
Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser Asn Thr
195 200 205
Lys Val Asp Lys Pro Val Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro
210 215 220
Pro Cys Pro Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile
260 265 270
Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Ser
275 280 285
Arg Glu Gln Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro
290 295 300
Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn His Ile Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala
325 330 335
Arg Gly Arg Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser Pro
340 345 350
Lys Glu Leu Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile Lys
355 360 365
Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln
370 375 380
Gln Glu Pro Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp Glu
385 390 395 400
Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr Leu
420 425 430
Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 41
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 41
gaggtgcagc tggtgcagag cggcggcgac ctggtgaagc ccggcggcag cgtgagactg 60
agctgcgtgg ccagcttcac cttcgactac tacatgaact gggtgagaca ggcccccggc 120
aagggcctgc agtggatcgg cagatggatc ttccccggca gcggcgccac ctactacaac 180
gagagattca tgggcaaggc caccatcagc gccgacaccg ccaagaacac cgcctacatg 240
cagctgaaca gcctgagagc cgaggacacc gccgtgtact actgcctgag aagcgactgg 300
gacgtgggcg acttctgggg ccagggcacc ctggtgaccg tgagcagcgc cagcaccacc 360
gcccccagcg tgttccccct ggcccccagc tgcggcagca ccagcggcag caccgtggcc 420
ctggcctgcc tggtgagcgg ctacttcccc gagcccgtga ccgtgagctg gaacagcggc 480
agcctgacca gcggcgtgca caccttcccc agcgtgctgc agagcagcgg cctgtacagc 540
ctgagcagca ccgtgaccgt gcccagcagc agatggccca gcgagacctt cacctgcaac 600
gtggtgcacc ccgccagcaa caccaaggtg gacaagcccg tgcccaagga gagcacctgc 660
aagtgcatca gcccctgccc cgtgcccgag agcctgggcg gccccagcgt gttcatcttc 720
ccccccaagc ccaaggacat cctgagaatc accagaaccc ccgagatcac ctgcgtggtg 780
ctggacctgg gcagagagga ccccgaggtg cagatcagct ggttcgtgga cggcaaggag 840
gtgcacaccg ccaagaccca gcccagagag cagcagttca acagcaccta cagagtggtg 900
agcgtgctgc ccatcgagca ccaggactgg ctgaccggca aggagttcaa gtgcagagtg 960
aaccacatcg gcctgcccag ccccatcgag agaaccatca gcaaggccag aggccaggcc 1020
caccagccca gcgtgtacgt gctgcccccc agccccaagg agctgagcag cagcgacacc 1080
gtgaccctga cctgcctgat caaggacttc ttcccccccg agatcgacgt ggagtggcag 1140
agcaacggcc agcccgagcc cgagagcaag taccacacca ccgcccccca gctggacgag 1200
gacggcagct acttcctgta cagcaagctg agcgtggaca agagcagatg gcagcagggc 1260
gacaccttca cctgcgccgt gatgcacgag gccctgcaga accactacac cgacctgagc 1320
ctgagccaca gccccggcaa g 1341
<210> 42
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 42
Glu Val Gln Leu Val Gln Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Val Arg Leu Ser Cys Val Ala Ser Phe Thr Phe Asp Tyr Tyr Met
20 25 30
Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Gln Trp Ile Gly Arg
35 40 45
Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe Met
50 55 60
Gly Lys Ala Thr Ile Ser Ala Asp Thr Ala Lys Asn Thr Ala Tyr Met
65 70 75 80
Gln Leu Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Leu
85 90 95
Arg Ser Asp Trp Asp Val Gly Asp Phe Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Thr Ala Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Cys Gly Ser Thr Ser Gly Ser Thr Val Ala Leu Ala Cys Leu
130 135 140
Val Ser Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ser Leu Thr Ser Gly Val His Thr Phe Pro Ser Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Thr Val Thr Val Pro Ser Ser Arg Trp
180 185 190
Pro Ser Glu Thr Phe Thr Cys Asn Val Val His Pro Ala Ser Asn Thr
195 200 205
Lys Val Asp Lys Pro Val Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser
210 215 220
Pro Cys Pro Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile
245 250 255
Thr Cys Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile
260 265 270
Ser Trp Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro
275 280 285
Arg Glu Gln Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro
290 295 300
Ile Glu His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn His Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala
325 330 335
Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro
340 345 350
Lys Glu Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys
355 360 365
Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln
370 375 380
Pro Glu Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu
385 390 395 400
Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu
420 425 430
Gln Asn His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 43
<211> 669
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 43
gacatcgtga tgacccagac ccccctgagc ctgagcgtga gcctgggcga gcccgccagc 60
atcagctgca gaagcagcag aagcctgctg cacaccaacg gcatcaccta cctgagctgg 120
tacagacaga agcccggcca gatcccccag ctgctgatct accagatgag caacctggcc 180
agcggcgtgc ccgacagatt cagcggcagc ggcagcggca ccgacttcac cctgagaatc 240
agcagagtgg aggccgacga cgccggcgtg tactactgcg cccagaccct gggcctgccc 300
agaaccttcg gccagggcac caaggtggag atcaagagaa acgacgccca gcccgccgtg 360
tacctgttcc agcccagccc cgaccagctg cacaccggca gcgccagcgt ggtgtgcctg 420
ctgaacagct tctaccccaa ggacatcaac gtgaagtgga aggtggacgg cgtgatccag 480
gacaccggca tccaggagag cgtgaccgag caggacagca aggacagcac ctacagcctg 540
agcagcaccc tgaccatgag cagcaccgag tacctgagcc acgagctgta cagctgcgag 600
atcacccaca agagcctgcc cagcaccctg atcaagagct tccagagaag cgagtgccag 660
agagtggac 669
<210> 44
<211> 223
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированное антитело мыши
<400> 44
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu His Thr
20 25 30
Asn Gly Ile Thr Tyr Leu Ser Trp Tyr Arg Gln Lys Pro Gly Gln Ile
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Ala Gly Val Tyr Tyr Cys Ala Gln Thr
85 90 95
Leu Gly Leu Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Asn Asp Ala Gln Pro Ala Val Tyr Leu Phe Gln Pro Ser Pro Asp
115 120 125
Gln Leu His Thr Gly Ser Ala Ser Val Val Cys Leu Leu Asn Ser Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Val Asp Gly Val Ile Gln
145 150 155 160
Asp Thr Gly Ile Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Met Ser Ser Thr Glu Tyr Leu
180 185 190
Ser His Glu Leu Tyr Ser Cys Glu Ile Thr His Lys Ser Leu Pro Ser
195 200 205
Thr Leu Ile Lys Ser Phe Gln Arg Ser Glu Cys Gln Arg Val Asp
210 215 220
<210> 45
<211> 17
<212> Белок
<213> Canis familiaris
<400> 45
Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys Pro Val Pro Glu
1 5 10 15
Pro
<210> 46
<211> 22
<212> Белок
<213> Canis familiaris
<400> 46
Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro Asp Cys Pro Lys
1 5 10 15
Cys Pro Ala Pro Glu Met
20
<210> 47
<211> 20
<212> Белок
<213> Canis familiaris
<400> 47
Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn Cys Pro Cys Pro
1 5 10 15
Gly Cys Gly Leu
20
<210> 48
<211> 17
<212> Белок
<213> Canis familiaris
<400> 48
Pro Lys Glu Ser Thr Cys Lys Cys Ile Pro Pro Cys Pro Val Pro Glu
1 5 10 15
Ser
<210> 49
<211> 795
<212> ДНК
<213> Canis familiaris
<400> 49
ctagactccc ctgacaggcc ctggagcccg ctcaccttct ccccggcgca gctcacggtg 60
caggagggag agaacgccac gttcacctgc agcctggccg acatccccga cagcttcgtg 120
ctcaactggt accgcctgag cccccgcaac cagacggaca agctggccgc cttccaggag 180
gaccgcatcg agccgggccg ggacaggcgc ttccgcgtca tgcggctgcc caacgggcgg 240
gacttccaca tgagcatcgt cgctgcgcgc ctcaacgaca gcggcatcta cctgtgcggg 300
gccatctacc tgccccccaa cacacagatc aacgagagtc cccgcgcaga gctctccgtg 360
acggagagaa ccctggagcc ccccacacag agccccagcc ccccacccag actcagcggc 420
cagttgcagg ggctggtcat cggcgtcacg agcgtgctgg tgggtgtcct gctactgctg 480
ctgctgacct gggtcctggc cgctgtcttc cccagggcca cccgaggtgc ctgtgtgtgc 540
gggagcgagg acgagcctct gaaggagggc cccgatgcag cgcccgtctt caccctggac 600
tacggggagc tggacttcca gtggcgagag aagacgccgg agcccccggc gccctgtgcc 660
ccggagcaga ccgagtatgc caccatcgtc ttcccgggca ggccggcgtc cccgggccgc 720
agggcctcgg ccagcagcct gcagggagcc cagcctccga gccccgagga cggacccggc 780
ctgtggcccc tctga 795
<210> 50
<211> 264
<212> Белок
<213> Canis familiaris
<400> 50
Leu Asp Ser Pro Asp Arg Pro Trp Ser Pro Leu Thr Phe Ser Pro Ala
1 5 10 15
Gln Leu Thr Val Gln Glu Gly Glu Asn Ala Thr Phe Thr Cys Ser Leu
20 25 30
Ala Asp Ile Pro Asp Ser Phe Val Leu Asn Trp Tyr Arg Leu Ser Pro
35 40 45
Arg Asn Gln Thr Asp Lys Leu Ala Ala Phe Gln Glu Asp Arg Ile Glu
50 55 60
Pro Gly Arg Asp Arg Arg Phe Arg Val Met Arg Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Ile Val Ala Ala Arg Leu Asn Asp Ser Gly Ile
85 90 95
Tyr Leu Cys Gly Ala Ile Tyr Leu Pro Pro Asn Thr Gln Ile Asn Glu
100 105 110
Ser Pro Arg Ala Glu Leu Ser Val Thr Glu Arg Thr Leu Glu Pro Pro
115 120 125
Thr Gln Ser Pro Ser Pro Pro Pro Arg Leu Ser Gly Gln Leu Gln Gly
130 135 140
Leu Val Ile Gly Val Thr Ser Val Leu Val Gly Val Leu Leu Leu Leu
145 150 155 160
Leu Leu Thr Trp Val Leu Ala Ala Val Phe Pro Arg Ala Thr Arg Gly
165 170 175
Ala Cys Val Cys Gly Ser Glu Asp Glu Pro Leu Lys Glu Gly Pro Asp
180 185 190
Ala Ala Pro Val Phe Thr Leu Asp Tyr Gly Glu Leu Asp Phe Gln Trp
195 200 205
Arg Glu Lys Thr Pro Glu Pro Pro Ala Pro Cys Ala Pro Glu Gln Thr
210 215 220
Glu Tyr Ala Thr Ile Val Phe Pro Gly Arg Pro Ala Ser Pro Gly Arg
225 230 235 240
Arg Ala Ser Ala Ser Ser Leu Gln Gly Ala Gln Pro Pro Ser Pro Glu
245 250 255
Asp Gly Pro Gly Leu Trp Pro Leu
260
<210> 51
<211> 438
<212> ДНК
<213> Canis familiaris
<400> 51
ctggattccc ccgacagacc ctggagccct ctcaccttct cccctgccca gctgaccgtc 60
caggaaggcg agaatgccac cttcacctgc agcctcgccg acatccccga cagcttcgtg 120
ctgaactggt acagactgag ccccaggaac cagaccgaca agctggccgc tttccaggag 180
gacaggatcg aacccggcag ggacaggagg tttagggtca tgaggctgcc caacggcagg 240
gacttccaca tgtccatcgt ggccgccaga ctgaacgact ccggcatcta cctgtgcggc 300
gctatctacc tgccccccaa cacccagatc aacgagagcc ccagggccga actgagcgtg 360
acagagagaa ccctggaacc tcccacccag agcccttccc ctcctcctag actgagcgga 420
cagctgcagg gcctggtg 438
<210> 52
<211> 146
<212> Белок
<213> Canis familiaris
<400> 52
Leu Asp Ser Pro Asp Arg Pro Trp Ser Pro Leu Thr Phe Ser Pro Ala
1 5 10 15
Gln Leu Thr Val Gln Glu Gly Glu Asn Ala Thr Phe Thr Cys Ser Leu
20 25 30
Ala Asp Ile Pro Asp Ser Phe Val Leu Asn Trp Tyr Arg Leu Ser Pro
35 40 45
Arg Asn Gln Thr Asp Lys Leu Ala Ala Phe Gln Glu Asp Arg Ile Glu
50 55 60
Pro Gly Arg Asp Arg Arg Phe Arg Val Met Arg Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Ile Val Ala Ala Arg Leu Asn Asp Ser Gly Ile
85 90 95
Tyr Leu Cys Gly Ala Ile Tyr Leu Pro Pro Asn Thr Gln Ile Asn Glu
100 105 110
Ser Pro Arg Ala Glu Leu Ser Val Thr Glu Arg Thr Leu Glu Pro Pro
115 120 125
Thr Gln Ser Pro Ser Pro Pro Pro Arg Leu Ser Gly Gln Leu Gln Gly
130 135 140
Leu Val
145
<210> 53
<211> 1128
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слияние собаки и человека
<400> 53
ctggattccc ccgacagacc ctggagccct ctcaccttct cccctgccca gctgaccgtc 60
caggaaggcg agaatgccac cttcacctgc agcctcgccg acatccccga cagcttcgtg 120
ctgaactggt acagactgag ccccaggaac cagaccgaca agctggccgc tttccaggag 180
gacaggatcg aacccggcag ggacaggagg tttagggtca tgaggctgcc caacggcagg 240
gacttccaca tgtccatcgt ggccgccaga ctgaacgact ccggcatcta cctgtgcggc 300
gctatctacc tgccccccaa cacccagatc aacgagagcc ccagggccga actgagcgtg 360
acagagagaa ccctggaacc tcccacccag agcccttccc ctcctcctag actgagcgga 420
cagctgcagg gcctggtggg taccgacaaa actcacacat gcccaccgtg cccagcacct 480
gaactcctgg ggggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 540
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 600
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 660
gaggagcagt acaacagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 720
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 780
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgccc 840
ccatcccggg atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 900
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 960
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1020
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1080
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaatga 1128
<210> 54
<211> 375
<212> Белок
<213> Искусственная последовательность
<220>
<223> слияние собаки и человека
<400> 54
Leu Asp Ser Pro Asp Arg Pro Trp Ser Pro Leu Thr Phe Ser Pro Ala
1 5 10 15
Gln Leu Thr Val Gln Glu Gly Glu Asn Ala Thr Phe Thr Cys Ser Leu
20 25 30
Ala Asp Ile Pro Asp Ser Phe Val Leu Asn Trp Tyr Arg Leu Ser Pro
35 40 45
Arg Asn Gln Thr Asp Lys Leu Ala Ala Phe Gln Glu Asp Arg Ile Glu
50 55 60
Pro Gly Arg Asp Arg Arg Phe Arg Val Met Arg Leu Pro Asn Gly Arg
65 70 75 80
Asp Phe His Met Ser Ile Val Ala Ala Arg Leu Asn Asp Ser Gly Ile
85 90 95
Tyr Leu Cys Gly Ala Ile Tyr Leu Pro Pro Asn Thr Gln Ile Asn Glu
100 105 110
Ser Pro Arg Ala Glu Leu Ser Val Thr Glu Arg Thr Leu Glu Pro Pro
115 120 125
Thr Gln Ser Pro Ser Pro Pro Pro Arg Leu Ser Gly Gln Leu Gln Gly
130 135 140
Leu Val Gly Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
145 150 155 160
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
165 170 175
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
180 185 190
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
195 200 205
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
210 215 220
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
225 230 235 240
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
245 250 255
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
260 265 270
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
275 280 285
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
290 295 300
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
305 310 315 320
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
325 330 335
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
340 345 350
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
355 360 365
Leu Ser Leu Ser Pro Gly Lys
370 375
<210> 55
<211> 816
<212> ДНК
<213> Canis familiaris
<400> 55
tttacgatca cagtttctaa ggacctgtat gtggtagagt atggtggcaa tgtgacaatg 60
gaatgcaaat tcccggtgga aaaacagtta aacttgtttg cactaatcgt ctactgggaa 120
atggaggata aaaaaattat acaatttgtg aatggaaagg aagacctgaa agttcagcac 180
agcagctaca gccagagggc tcagctattg aaggaccagc tcttcttggg gaaggctgcg 240
cttcagatca cagatgtgag attgcaggat gcaggggttt actgctgctt gatcggctat 300
ggcggtgctg actacaagcg gattactttg aaagttcatg ccccgtaccg caacatcagc 360
caaagaattt ctgtggatcc tgtcacctct gaacatgaac taatgtgtca ggctgagggt 420
taccctgagg ctgaagtcat ctggacaagc agtgaccacc gagtcctgag tggcaaaacc 480
accatcacta attccaatag ggaagagaag cttttcaatg tgaccagcac gctgaacatc 540
aatgcaacag ctaatgagat tttctactgc acttttcaaa gatcaggtcc tgaggaaaac 600
aatactgccg agttggtcat cccagaacga ctgcccgttc cagcaagtga gaggactcat 660
ttcatgattc tgggaccttt cctgttgctt cttggtgtag tcctggcagt cactttctgt 720
ctaaaaaaac atgggagaat gatggatgtg gaaaaatgtt gcacccgaga taggaactca 780
aagaaacgaa atgatataca atttgaagag acataa 816
<210> 56
<211> 271
<212> Белок
<213> Canis familiaris
<400> 56
Phe Thr Ile Thr Val Ser Lys Asp Leu Tyr Val Val Glu Tyr Gly Gly
1 5 10 15
Asn Val Thr Met Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asn Leu
20 25 30
Phe Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Lys Ile Ile Gln
35 40 45
Phe Val Asn Gly Lys Glu Asp Leu Lys Val Gln His Ser Ser Tyr Ser
50 55 60
Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Phe Leu Gly Lys Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Arg Leu Gln Asp Ala Gly Val Tyr Cys Cys
85 90 95
Leu Ile Gly Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Leu Lys Val
100 105 110
His Ala Pro Tyr Arg Asn Ile Ser Gln Arg Ile Ser Val Asp Pro Val
115 120 125
Thr Ser Glu His Glu Leu Met Cys Gln Ala Glu Gly Tyr Pro Glu Ala
130 135 140
Glu Val Ile Trp Thr Ser Ser Asp His Arg Val Leu Ser Gly Lys Thr
145 150 155 160
Thr Ile Thr Asn Ser Asn Arg Glu Glu Lys Leu Phe Asn Val Thr Ser
165 170 175
Thr Leu Asn Ile Asn Ala Thr Ala Asn Glu Ile Phe Tyr Cys Thr Phe
180 185 190
Gln Arg Ser Gly Pro Glu Glu Asn Asn Thr Ala Glu Leu Val Ile Pro
195 200 205
Glu Arg Leu Pro Val Pro Ala Ser Glu Arg Thr His Phe Met Ile Leu
210 215 220
Gly Pro Phe Leu Leu Leu Leu Gly Val Val Leu Ala Val Thr Phe Cys
225 230 235 240
Leu Lys Lys His Gly Arg Met Met Asp Val Glu Lys Cys Cys Thr Arg
245 250 255
Asp Arg Asn Ser Lys Lys Arg Asn Asp Ile Gln Phe Glu Glu Thr
260 265 270
<210> 57
<211> 660
<212> ДНК
<213> Canis familiaris
<400> 57
tttaccatca ccgtgtccaa ggacctgtac gtggtcgagt acggcggcaa tgtgaccatg 60
gagtgcaagt tccccgtgga gaagcagctg aacctgttcg ccctcatcgt gtactgggag 120
atggaggaca agaagatcat ccagttcgtg aacggcaagg aggacctgaa ggtgcagcac 180
tccagctact cccagagagc ccagctgctg aaggaccagc tgttcctggg caaggccgcc 240
ctgcagatca ccgacgtgag actgcaggac gccggcgtgt attgctgcct gatcggctac 300
ggaggcgccg actacaagag gatcaccctg aaggtgcatg caccctacag gaacatcagc 360
cagaggatca gcgtcgatcc cgtgaccagc gagcacgagc tgatgtgcca agccgagggc 420
tatcccgagg ccgaagtgat ctggaccagc agcgaccaca gggtcctgag cggcaagacc 480
accatcacca acagcaacag ggaggagaag ctgttcaacg tgaccagcac cctcaacatc 540
aacgccaccg ccaacgagat cttctactgc accttccaga ggagcggccc cgaagagaac 600
aacaccgccg agctggtgat ccccgagaga ctgcctgtgc ctgccagcga gaggacccac 660
<210> 58
<211> 220
<212> Белок
<213> Canis familiaris
<400> 58
Phe Thr Ile Thr Val Ser Lys Asp Leu Tyr Val Val Glu Tyr Gly Gly
1 5 10 15
Asn Val Thr Met Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asn Leu
20 25 30
Phe Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Lys Ile Ile Gln
35 40 45
Phe Val Asn Gly Lys Glu Asp Leu Lys Val Gln His Ser Ser Tyr Ser
50 55 60
Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Phe Leu Gly Lys Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Arg Leu Gln Asp Ala Gly Val Tyr Cys Cys
85 90 95
Leu Ile Gly Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Leu Lys Val
100 105 110
His Ala Pro Tyr Arg Asn Ile Ser Gln Arg Ile Ser Val Asp Pro Val
115 120 125
Thr Ser Glu His Glu Leu Met Cys Gln Ala Glu Gly Tyr Pro Glu Ala
130 135 140
Glu Val Ile Trp Thr Ser Ser Asp His Arg Val Leu Ser Gly Lys Thr
145 150 155 160
Thr Ile Thr Asn Ser Asn Arg Glu Glu Lys Leu Phe Asn Val Thr Ser
165 170 175
Thr Leu Asn Ile Asn Ala Thr Ala Asn Glu Ile Phe Tyr Cys Thr Phe
180 185 190
Gln Arg Ser Gly Pro Glu Glu Asn Asn Thr Ala Glu Leu Val Ile Pro
195 200 205
Glu Arg Leu Pro Val Pro Ala Ser Glu Arg Thr His
210 215 220
<210> 59
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слияние собаки и человека
<400> 59
tttaccatca ccgtgtccaa ggacctgtac gtggtcgagt acggcggcaa tgtgaccatg 60
gagtgcaagt tccccgtgga gaagcagctg aacctgttcg ccctcatcgt gtactgggag 120
atggaggaca agaagatcat ccagttcgtg aacggcaagg aggacctgaa ggtgcagcac 180
tccagctact cccagagagc ccagctgctg aaggaccagc tgttcctggg caaggccgcc 240
ctgcagatca ccgacgtgag actgcaggac gccggcgtgt attgctgcct gatcggctac 300
ggaggcgccg actacaagag gatcaccctg aaggtgcatg caccctacag gaacatcagc 360
cagaggatca gcgtcgatcc cgtgaccagc gagcacgagc tgatgtgcca agccgagggc 420
tatcccgagg ccgaagtgat ctggaccagc agcgaccaca gggtcctgag cggcaagacc 480
accatcacca acagcaacag ggaggagaag ctgttcaacg tgaccagcac cctcaacatc 540
aacgccaccg ccaacgagat cttctactgc accttccaga ggagcggccc cgaagagaac 600
aacaccgccg agctggtgat ccccgagaga ctgcctgtgc ctgccagcga gaggacccac 660
ggtaccgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggatgagctg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcctct ccctgtctcc gggtaaatga 1350
<210> 60
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> слияние собаки и человека
<400> 60
Phe Thr Ile Thr Val Ser Lys Asp Leu Tyr Val Val Glu Tyr Gly Gly
1 5 10 15
Asn Val Thr Met Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asn Leu
20 25 30
Phe Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Lys Ile Ile Gln
35 40 45
Phe Val Asn Gly Lys Glu Asp Leu Lys Val Gln His Ser Ser Tyr Ser
50 55 60
Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Phe Leu Gly Lys Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Arg Leu Gln Asp Ala Gly Val Tyr Cys Cys
85 90 95
Leu Ile Gly Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Leu Lys Val
100 105 110
His Ala Pro Tyr Arg Asn Ile Ser Gln Arg Ile Ser Val Asp Pro Val
115 120 125
Thr Ser Glu His Glu Leu Met Cys Gln Ala Glu Gly Tyr Pro Glu Ala
130 135 140
Glu Val Ile Trp Thr Ser Ser Asp His Arg Val Leu Ser Gly Lys Thr
145 150 155 160
Thr Ile Thr Asn Ser Asn Arg Glu Glu Lys Leu Phe Asn Val Thr Ser
165 170 175
Thr Leu Asn Ile Asn Ala Thr Ala Asn Glu Ile Phe Tyr Cys Thr Phe
180 185 190
Gln Arg Ser Gly Pro Glu Glu Asn Asn Thr Ala Glu Leu Val Ile Pro
195 200 205
Glu Arg Leu Pro Val Pro Ala Ser Glu Arg Thr His Gly Thr Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 61
<211> 648
<212> ДНК
<213> Canis familiaris
<400> 61
ctgggcggcc ccagcgtgct gatcttcccc cccaagccca aggacatcct gagaatcacc 60
agaacccccg aggtgacctg cgtggtgctg gacctgggca gagaggaccc cgaggtgcag 120
atcagctggt tcgtggacgg caaggaggtg cacaccgcca agacccagag cagagagcag 180
cagttcaacg gcacctacag agtggtgagc gtgctgccca tcgagcacca ggactggctg 240
accggcaagg agttcaagtg cagagtgaac cacatcgacc tgcccagccc catcgagaga 300
accatcagca aggccagagg cagagcccac aagcccagcg tgtacgtgct gccccccagc 360
cccaaggagc tgagcagcag cgacaccgtg agcatcacct gcctgatcaa ggacttctac 420
ccccccgaca tcgacgtgga gtggcagagc aacggccagc aggagcccga gagaaagcac 480
agaatgaccc ccccccagct ggacgaggac ggcagctact tcctgtacag caagctgagc 540
gtggacaaga gcagatggca gcagggcgac cccttcacct gcgccgtgat gcacgagacc 600
ctgcagaacc actacaccga cctgagcctg agccacagcc ccggcaag 648
<210> 62
<211> 216
<212> Белок
<213> Canis familiaris
<400> 62
Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro Lys Pro Lys Asp Ile
1 5 10 15
Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys Val Val Leu Asp Leu
20 25 30
Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys
35 40 45
Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu Gln Gln Phe Asn Gly
50 55 60
Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp Leu
65 70 75 80
Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Asp Leu Pro Ser
85 90 95
Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Arg Ala His Lys Pro
100 105 110
Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser Asp
115 120 125
Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe Tyr Pro Pro Asp Ile
130 135 140
Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Arg Lys His
145 150 155 160
Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr
165 170 175
Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Pro Phe
180 185 190
Thr Cys Ala Val Met His Glu Thr Leu Gln Asn His Tyr Thr Asp Leu
195 200 205
Ser Leu Ser His Ser Pro Gly Lys
210 215
<210> 63
<211> 648
<212> ДНК
<213> Canis familiaris
<400> 63
ctgggcggcc ccagcgtgtt catcttcccc cccaagccca aggacatcct gagaatcacc 60
agaacccccg agatcacctg cgtggtgctg gacctgggca gagaggaccc cgaggtgcag 120
atcagctggt tcgtggacgg caaggaggtg cacaccgcca agacccagcc cagagagcag 180
cagttcaaca gcacctacag agtggtgagc gtgctgccca tcgagcacca ggactggctg 240
accggcaagg agttcaagtg cagagtgaac cacatcggcc tgcccagccc catcgagaga 300
accatcagca aggccagagg ccaggcccac cagcccagcg tgtacgtgct gccccccagc 360
cccaaggagc tgagcagcag cgacaccgtg accctgacct gcctgatcaa ggacttcttc 420
ccccccgaga tcgacgtgga gtggcagagc aacggccagc ccgagcccga gagcaagtac 480
cacaccaccg ccccccagct ggacgaggac ggcagctact tcctgtacag caagctgagc 540
gtggacaaga gcagatggca gcagggcgac accttcacct gcgccgtgat gcacgaggcc 600
ctgcagaacc actacaccga cctgagcctg agccacagcc ccggcaag 648
<210> 64
<211> 216
<212> Белок
<213> Canis familiaris
<400> 64
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile
1 5 10 15
Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val Val Leu Asp Leu
20 25 30
Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys
35 40 45
Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln Gln Phe Asn Ser
50 55 60
Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp Leu
65 70 75 80
Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Gly Leu Pro Ser
85 90 95
Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro
100 105 110
Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser Asp
115 120 125
Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Glu Ile
130 135 140
Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro Glu Ser Lys Tyr
145 150 155 160
His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr
165 170 175
Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Thr Phe
180 185 190
Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His Tyr Thr Asp Leu
195 200 205
Ser Leu Ser His Ser Pro Gly Lys
210 215
<210> 65
<211> 645
<212> ДНК
<213> Canis familiaris
<400> 65
ctgggcggcc ccagcgtgtt catcttcccc cccaagccca aggacaccct gctgatcgcc 60
agaacccccg aggtgacctg cgtggtggtg gacctggacc ccgaggaccc cgaggtgcag 120
atcagctggt tcgtggacgg caagcagatg cagaccgcca agacccagcc cagagaggag 180
cagttcaacg gcacctacag agtggtgagc gtgctgccca tcggccacca ggactggctg 240
aagggcaagc agttcacctg caaggtgaac aacaaggccc tgcccagccc catcgagaga 300
accatcagca aggccagagg ccaggcccac cagcccagcg tgtacgtgct gccccccagc 360
agagaggagc tgagcaagaa caccgtgagc ctgacctgcc tgatcaagga cttcttcccc 420
cccgacatcg acgtggagtg gcagagcaac ggccagcagg agcccgagag caagtacaga 480
accacccccc cccagctgga cgaggacggc agctacttcc tgtacagcaa gctgagcgtg 540
gacaagagca gatggcagag aggcgacacc ttcatctgcg ccgtgatgca cgaggccctg 600
cacaaccact acacccagga gagcctgagc cacagccccg gcaag 645
<210> 66
<211> 215
<212> Белок
<213> Canis familiaris
<400> 66
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr
1 5 10 15
Leu Leu Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Leu
20 25 30
Asp Pro Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly Lys
35 40 45
Gln Met Gln Thr Ala Lys Thr Gln Pro Arg Glu Glu Gln Phe Asn Gly
50 55 60
Thr Tyr Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu
65 70 75 80
Lys Gly Lys Gln Phe Thr Cys Lys Val Asn Asn Lys Ala Leu Pro Ser
85 90 95
Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln Pro
100 105 110
Ser Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr
115 120 125
Val Ser Leu Thr Cys Leu Ile Lys Asp Phe Phe Pro Pro Asp Ile Asp
130 135 140
Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg
145 150 155 160
Thr Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser
165 170 175
Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile
180 185 190
Cys Ala Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Glu Ser
195 200 205
Leu Ser His Ser Pro Gly Lys
210 215
<210> 67
<211> 645
<212> ДНК
<213> Canis familiaris
<400> 67
ctgggcggcc ccagcgtgtt catcttcccc cccaagccca aggacatcct ggtgaccgcc 60
agaaccccca ccgtgacctg cgtggtggtg gacctggacc ccgagaaccc cgaggtgcag 120
atcagctggt tcgtggacag caagcaggtg cagaccgcca acacccagcc cagagaggag 180
cagagcaacg gcacctacag agtggtgagc gtgctgccca tcggccacca ggactggctg 240
agcggcaagc agttcaagtg caaggtgaac aacaaggccc tgcccagccc catcgaggag 300
atcatcagca agacccccgg ccaggcccac cagcccaacg tgtacgtgct gccccccagc 360
agagacgaga tgagcaagaa caccgtgacc ctgacctgcc tggtgaagga cttcttcccc 420
cccgagatcg acgtggagtg gcagagcaac ggccagcagg agcccgagag caagtacaga 480
atgacccccc cccagctgga cgaggacggc agctacttcc tgtacagcaa gctgagcgtg 540
gacaagagca gatggcagag aggcgacacc ttcatctgcg ccgtgatgca cgaggccctg 600
cacaaccact acacccagat cagcctgagc cacagccccg gcaag 645
<210> 68
<211> 215
<212> Белок
<213> Canis familiaris
<400> 68
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Ile
1 5 10 15
Leu Val Thr Ala Arg Thr Pro Thr Val Thr Cys Val Val Val Asp Leu
20 25 30
Asp Pro Glu Asn Pro Glu Val Gln Ile Ser Trp Phe Val Asp Ser Lys
35 40 45
Gln Val Gln Thr Ala Asn Thr Gln Pro Arg Glu Glu Gln Ser Asn Gly
50 55 60
Thr Tyr Arg Val Val Ser Val Leu Pro Ile Gly His Gln Asp Trp Leu
65 70 75 80
Ser Gly Lys Gln Phe Lys Cys Lys Val Asn Asn Lys Ala Leu Pro Ser
85 90 95
Pro Ile Glu Glu Ile Ile Ser Lys Thr Pro Gly Gln Ala His Gln Pro
100 105 110
Asn Val Tyr Val Leu Pro Pro Ser Arg Asp Glu Met Ser Lys Asn Thr
115 120 125
Val Thr Leu Thr Cys Leu Val Lys Asp Phe Phe Pro Pro Glu Ile Asp
130 135 140
Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg
145 150 155 160
Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser
165 170 175
Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile
180 185 190
Cys Ala Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Ile Ser
195 200 205
Leu Ser His Ser Pro Gly Lys
210 215
<210> 69
<211> 867
<212> ДНК
<213> Canis familiaris
<400> 69
atggggagcc ggcgggggcc ctggccgctc gtctgggccg tgctgcagct gggctggtgg 60
ccaggatggc tcctagactc ccctgacagg ccctggagcc cgctcacctt ctccccggcg 120
cagctcacgg tgcaggaggg agagaacgcc acgttcacct gcagcctggc cgacatcccc 180
gacagcttcg tgctcaactg gtaccgcctg agcccccgca accagacgga caagctggcc 240
gccttccagg aggaccgcat cgagccgggc cgggacaggc gcttccgcgt catgcggctg 300
cccaacgggc gggacttcca catgagcatc gtcgctgcgc gcctcaacga cagcggcatc 360
tacctgtgcg gggccatcta cctgcccccc aacacacaga tcaacgagag tccccgcgca 420
gagctctccg tgacggagag aaccctggag ccccccacac agagccccag ccccccaccc 480
agactcagcg gccagttgca ggggctggtc atcggcgtca cgagcgtgct ggtgggtgtc 540
ctgctactgc tgctgctgac ctgggtcctg gccgctgtct tccccagggc cacccgaggt 600
gcctgtgtgt gcgggagcga ggacgagcct ctgaaggagg gccccgatgc agcgcccgtc 660
ttcaccctgg actacgggga gctggacttc cagtggcgag agaagacgcc ggagcccccg 720
gcgccctgtg ccccggagca gaccgagtat gccaccatcg tcttcccggg caggccggcg 780
tccccgggcc gcagggcctc ggccagcagc ctgcagggag cccagcctcc gagccccgag 840
gacggacccg gcctgtggcc cctctga 867
<210> 70
<211> 288
<212> Белок
<213> Canis familiaris
<400> 70
Met Gly Ser Arg Arg Gly Pro Trp Pro Leu Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Trp Pro Gly Trp Leu Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Ser Pro Leu Thr Phe Ser Pro Ala Gln Leu Thr Val Gln Glu Gly Glu
35 40 45
Asn Ala Thr Phe Thr Cys Ser Leu Ala Asp Ile Pro Asp Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Leu Ser Pro Arg Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Gln Glu Asp Arg Ile Glu Pro Gly Arg Asp Arg Arg Phe Arg
85 90 95
Val Met Arg Leu Pro Asn Gly Arg Asp Phe His Met Ser Ile Val Ala
100 105 110
Ala Arg Leu Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile Tyr Leu
115 120 125
Pro Pro Asn Thr Gln Ile Asn Glu Ser Pro Arg Ala Glu Leu Ser Val
130 135 140
Thr Glu Arg Thr Leu Glu Pro Pro Thr Gln Ser Pro Ser Pro Pro Pro
145 150 155 160
Arg Leu Ser Gly Gln Leu Gln Gly Leu Val Ile Gly Val Thr Ser Val
165 170 175
Leu Val Gly Val Leu Leu Leu Leu Leu Leu Thr Trp Val Leu Ala Ala
180 185 190
Val Phe Pro Arg Ala Thr Arg Gly Ala Cys Val Cys Gly Ser Glu Asp
195 200 205
Glu Pro Leu Lys Glu Gly Pro Asp Ala Ala Pro Val Phe Thr Leu Asp
210 215 220
Tyr Gly Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro
225 230 235 240
Ala Pro Cys Ala Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro
245 250 255
Gly Arg Pro Ala Ser Pro Gly Arg Arg Ala Ser Ala Ser Ser Leu Gln
260 265 270
Gly Ala Gln Pro Pro Ser Pro Glu Asp Gly Pro Gly Leu Trp Pro Leu
275 280 285
<210> 71
<211> 870
<212> ДНК
<213> Canis familiaris
<400> 71
atgagaatgt ttagtgtctt tacattcatg gcctactgcc atttgctaaa agcatttacg 60
atcacagttt ctaaggacct gtatgtggta gagtatggtg gcaatgtgac aatggaatgc 120
aaattcccgg tggaaaaaca gttaaacttg tttgcactaa tcgtctactg ggaaatggag 180
gataaaaaaa ttatacaatt tgtgaatgga aaggaagacc tgaaagttca gcacagcagc 240
tacagccaga gggctcagct attgaaggac cagctcttct tggggaaggc tgcgcttcag 300
atcacagatg tgagattgca ggatgcaggg gtttactgct gcttgatcgg ctatggcggt 360
gctgactaca agcggattac tttgaaagtt catgccccgt accgcaacat cagccaaaga 420
atttctgtgg atcctgtcac ctctgaacat gaactaatgt gtcaggctga gggttaccct 480
gaggctgaag tcatctggac aagcagtgac caccgagtcc tgagtggcaa aaccaccatc 540
actaattcca atagggaaga gaagcttttc aatgtgacca gcacgctgaa catcaatgca 600
acagctaatg agattttcta ctgcactttt caaagatcag gtcctgagga aaacaatact 660
gccgagttgg tcatcccaga acgactgccc gttccagcaa gtgagaggac tcatttcatg 720
attctgggac ctttcctgtt gcttcttggt gtagtcctgg cagtcacttt ctgtctaaaa 780
aaacatggga gaatgatgga tgtggaaaaa tgttgcaccc gagataggaa ctcaaagaaa 840
cgaaatgata tacaatttga agagacataa 870
<210> 72
<211> 289
<212> Белок
<213> Canis familiaris
<400> 72
Met Arg Met Phe Ser Val Phe Thr Phe Met Ala Tyr Cys His Leu Leu
1 5 10 15
Lys Ala Phe Thr Ile Thr Val Ser Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Gly Asn Val Thr Met Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asn Leu Phe Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Lys Ile
50 55 60
Ile Gln Phe Val Asn Gly Lys Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Ser Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Phe Leu Gly Lys
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Arg Leu Gln Asp Ala Gly Val Tyr
100 105 110
Cys Cys Leu Ile Gly Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Leu
115 120 125
Lys Val His Ala Pro Tyr Arg Asn Ile Ser Gln Arg Ile Ser Val Asp
130 135 140
Pro Val Thr Ser Glu His Glu Leu Met Cys Gln Ala Glu Gly Tyr Pro
145 150 155 160
Glu Ala Glu Val Ile Trp Thr Ser Ser Asp His Arg Val Leu Ser Gly
165 170 175
Lys Thr Thr Ile Thr Asn Ser Asn Arg Glu Glu Lys Leu Phe Asn Val
180 185 190
Thr Ser Thr Leu Asn Ile Asn Ala Thr Ala Asn Glu Ile Phe Tyr Cys
195 200 205
Thr Phe Gln Arg Ser Gly Pro Glu Glu Asn Asn Thr Ala Glu Leu Val
210 215 220
Ile Pro Glu Arg Leu Pro Val Pro Ala Ser Glu Arg Thr His Phe Met
225 230 235 240
Ile Leu Gly Pro Phe Leu Leu Leu Leu Gly Val Val Leu Ala Val Thr
245 250 255
Phe Cys Leu Lys Lys His Gly Arg Met Met Asp Val Glu Lys Cys Cys
260 265 270
Thr Arg Asp Arg Asn Ser Lys Lys Arg Asn Asp Ile Gln Phe Glu Glu
275 280 285
Thr
<210> 73
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 73
gaagtgcagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgcca tgtcttgggt tcgccagact 120
ccggacaaga gactggagtg ggtcgcaacc attagtgatg gtggaagtta cacccactac 180
cccgacaatt taatgggccg attcaccatc tccagagaca atgccaagaa caacctgtac 240
ctgcaaatga gccatctgaa gtctgacgac acagccatgt attactgtgc acgagagagc 300
tatgatggtt actacgtggc taactggggc caagggactc tggtcactgt ctcagca 357
<210> 74
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Asp Gly Gly Ser Tyr Thr His Tyr Pro Asp Asn Leu
50 55 60
Met Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser His Leu Lys Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Tyr Asp Gly Tyr Tyr Val Ala Asn Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 75
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 75
gatattgtgc taactcagtc tccagccacc ctgtctgtga atccaggaga tagcgtcagt 60
ctttcctgca gggccagcca aagtattagc aacaacctac actggtatca acaaaaatca 120
catgagtctc caaggcttct catcaagtat gcttcccagt ccatctctgg gatcccctcc 180
aggttcagtg gcagtggatc agggacagat ttcactctca gtatcaacag tgtggagact 240
gaagattttg gaatgtattt ctgtcaacag agtaacagct ggcctcagac gttcggtgga 300
ggcaccaagc tggaaatcaa a 321
<210> 76
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 76
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Asn Pro Gly
1 5 10 15
Asp Ser Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asn Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Thr
65 70 75 80
Glu Asp Phe Gly Met Tyr Phe Cys Gln Gln Ser Asn Ser Trp Pro Gln
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 77
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 77
caggtccagc tacagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaagg cttctggcta caccttcact gactactata tgaattgggt gaaacagagg 120
cctggacagg gacttgagtg gattggatgg atttttcccg gaagtggtgc tacttactac 180
aatgagaggt tcatgggcaa ggccacactt actgtggata aatcttccaa cacagcctac 240
atgttgttca gtagcctgac ctctgaggac tctgcggtct atttctgttt aagatctgac 300
tgggacgtcg gggacttctg gggccaaggc accactctca cagtctcctc a 351
<210> 78
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 78
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Ser Gly Ala Thr Tyr Tyr Asn Glu Arg Phe
50 55 60
Met Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Leu Phe Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Leu Arg Ser Asp Trp Asp Val Gly Asp Phe Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 79
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 79
gatattgtga tgacgcaggc tgcattctcc aatccagtca ctcttggaac atcagcttcc 60
atctcctgca ggtctagtag gagtctccta catactaatg gcatcactta tttgtcttgg 120
tttctgcaga agccaggcca gtctcctcag ctcctgattt atcagatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtagcagt gggtcaggaa ctgatttcac actgagaatc 240
agtagagtgg aggctgagga tgtgggtatt tattactgtg ctcaaactct aggacttcct 300
cggacgttcg gtggaggcac caagctggaa atcaaa 336
<210> 80
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> канинизированная мышь
<400> 80
Asp Ile Val Met Thr Gln Ala Ala Phe Ser Asn Pro Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu His Thr
20 25 30
Asn Gly Ile Thr Tyr Leu Ser Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Ala Gln Thr
85 90 95
Leu Gly Leu Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 81
<211> 401
<212> Белок
<213> Искусственная последовательность
<220>
<223> слияние собаки и человека
<400> 81
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Leu Asp Ser Pro Asp Arg
20 25 30
Pro Trp Ser Pro Leu Thr Phe Ser Pro Ala Gln Leu Thr Val Gln Glu
35 40 45
Gly Glu Asn Ala Thr Phe Thr Cys Ser Leu Ala Asp Ile Pro Asp Ser
50 55 60
Phe Val Leu Asn Trp Tyr Arg Leu Ser Pro Arg Asn Gln Thr Asp Lys
65 70 75 80
Leu Ala Ala Phe Gln Glu Asp Arg Ile Glu Pro Gly Arg Asp Arg Arg
85 90 95
Phe Arg Val Met Arg Leu Pro Asn Gly Arg Asp Phe His Met Ser Ile
100 105 110
Val Ala Ala Arg Leu Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile
115 120 125
Tyr Leu Pro Pro Asn Thr Gln Ile Asn Glu Ser Pro Arg Ala Glu Leu
130 135 140
Ser Val Thr Glu Arg Thr Leu Glu Pro Pro Thr Gln Ser Pro Ser Pro
145 150 155 160
Pro Pro Arg Leu Ser Gly Gln Leu Gln Gly Leu Val Gly Thr Asp Lys
165 170 175
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
180 185 190
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
195 200 205
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
210 215 220
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
225 230 235 240
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
245 250 255
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
260 265 270
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
275 280 285
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
290 295 300
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
305 310 315 320
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
325 330 335
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
340 345 350
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
355 360 365
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
370 375 380
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
385 390 395 400
Lys
<210> 82
<211> 20
<212> Белок
<213> Canis familiaris
<400> 82
Leu Asn Leu Phe Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Lys
1 5 10 15
Ile Ile Gln Phe
20
<210> 83
<211> 11
<212> Белок
<213> Canis familiaris
<400> 83
Lys Arg Ile Thr Leu Lys Val His Ala Pro Tyr
1 5 10
<---