Результат интеллектуальной деятельности: СОБАЧЬИ АНТИТЕЛА С МОДИФИЦИРОВАННЫМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ CH2-CH3
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей патентной заявке испрашивается приоритет по патентной заявке США серийный № 62/030,812, поданной 30 июля 2914 года, по патентной заявке США серийный № 61/918,847, поданной 20 декабря 2013 года, и по патентной заявке США серийный № 61/918,946, поданной 20 декабря 2014 года, содержание каждой из которых введено здесь ссылкой в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к канинизированным антителам со специфическими свойствами. Также настоящее изобретение относится к канинизированным антителам против собачьего PD-1, которые имеют специфические последовательности и высокую аффинность связывания с собачьим PD-1. Дополнительно настоящее изобретение относится к применению антитела по настоящему изобретению для лечения собак, включая лечение рака.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Собачьи антитела (также указываемые как иммуноглобулин G или IgG) представляют крупные тетрамерные белки около 150 кДа. Каждый белок IgG состоит из двух идентичных легких цепей около 25 кДа каждая и двух идентичных тяжелых цепей около 50 кДа каждая. Существует четыре известных подкласса тяжелых цепей собачьего IgG, и они указываются как IgGA, IgGB, IgGC и IgGD. Существует два типа легких цепей: каппа и лямбда цепи. Каждая из каппа или лямбда легких цепей состоит из одного вариабельного домена (VL) и одного константного домена (CL). Каждая из двух тяжелых цепей состоит из одного вариабельного домена (VH) и трех константных доменов, указываемых как CH-1, CH-2 и CH-3. Домен CH-1 соединен с доменом CH-2 аминокислотной последовательностью, указанной как «шарнир», или в качестве альтернативы, как «шарнирная область». У людей IgG присутствует в виде одного из четырех подклассов, указываемых как IgG1, IgG2, IgG3 и IgG4. Подкласс IgG главным образом определяется последовательностью шарнирной области, которая отличается у каждого из четырех подклассов IgG. Две тяжелые цепи соединены друг с другом дисульфидными связями, и каждая тяжелая цепь также связана с одной из легких цепей через дисульфидную связь.
Расщепление антитела IgG ферментом папаином разрушает молекулу антитела в шарнирной области и в результате приводит к образованию трех фрагментов. Два из этих фрагментов являются идентичными и каждый состоит из легкой цепи, удерживающей вместе домены VH и CH1 тяжелой цепи. Эти фрагменты называются «Fab» фрагментами и они содержат антигенсвязывающие участки антитела. Третий фрагмент, образовавшийся в результате расщепления папаином, называется «Fc» и он содержит остаток двух тяжелый цепей, удерживаемых вместе дисульфидными связями. Следовательно, Fc содержит димер, состоящий из CH2 и CH3 домена, каждый из которых состоит из двух тяжелых цепей. Fab позволяет антителу связываться с его родственным эпитопом, Fc позволяет антителу опосредовать функции иммунного эффектора, такие как антитителозависимая клеточная цитотоксичность (ADCC), антителозависимый фагоцитоз (ADCP) и комплиментзависимая цитотоксичность (CDC).
Из предшествующего уровня техники хорошо известно, что антитела IgG опосредуют эффекторные функции, такие как ADCC и ADCP через связывание их Fc фрагментом с семейством белков, известных как Fcγ рецепторы, в свою очередь CDC опосредовано связыванием через Fc с первым компонентом комплимента C1q. Также из предшествующего уровня техники хорошо известно, что различные подклассы IgG отличаются по своей способности опосредовать эти эффекторные функции. Например, человеческий IgG1 демонстрирует сильную ADCC и CDC, в то время как IgG4 демонстрирует от слабой ADCC и CDC до отсутствия ADCC и CDC. Дополнительно, из предшествующего уровня техники хорошо известны способы определения, какой из подклассов IgG демонстрирует или у него отсутствуют эффекторные функции.
Подходы, основывающиеся на применении моноклональных антител для терапевтических целей, требуют конструкции, соответствующей целевому назначению антитела или фрагментов антитела для достижения заданного терапевтического ответа. Например, некоторые терапевтические подходы для рака требуют терапевтического антитела, обладающего усиленными эффекторными функциями, в то время как другие требуют эффекторные функции, которые будут значительно ослаблены или совсем элиминированы. Усиление или элиминирование эффекторных функций может быть достигнуто через введение одной или более мутации аминокислоты (замещения) в Fc части антитела, таким образом, чтобы усилить или ослабить связывание с рецепторами Fcγ и первым компонентом комплимента. В предшествующем уровне техники имеет место множество сообщений, в которых описываются замещения, которые могут быть введены в молекулу антитела для модулирования ее эффекторых функций. Например, Shields et al., [J. of Biol. Chem., 276 (9): 6591-6604 (2001)] описано замещение аспарагина на аланин (N297A), которое в результате позволяет получить не гликозилированное антитело, значительно ослабленное связывание антитела с отдельными Fcγ рецепторами. Дополнительно Shields et al. описано, что замещение аспарагиновой кислоты на аланин (D265A) также значительно снижает связывание антитела с рецепторами Fcγ. Каждое из замещений N297A и D265A также демонстрирует значительное ухудшение CDC. Существуют и другие аналогичные сообщения, описывающие потенциальные замещения для ослабления или элиминирования эффекторной функции антитела [например, Sazinsky et al., Proc.Nat.Acad.Sci.,105:20167-20172 (2008), Alegre et al., Transplantation, 57:1537-1543 (1994), Hutchins et al., Proc.Nat.Acad.Sci. 92:11980-11984 (1994), McEarchem et al., Blood, 109:1185-1192 (2007)].
Иммуноингибирующий рецептор, который главным образом экспрессируется на активированных T и B клетках, рецептор запрограммированной гибели клеток 1, также указываемый, как рецептор запрограммированной смерти 1 (PD-1), является членом суперсемейства иммуноглобулина, относящегося к CD28 и CTLA-4. PD-1, как и члены семейства, представляют трансмембранные гликобелки типа I, содержащие внеклеточный вариабельный (V-тип) домен Ig, который связывается своими лигандами и цитоплазматический концевой сегмент, который связывается с сигнальными молекулами. Цитоплазматический концевой сегмент PD-1 содержит два сигнальных мотива на основе тирозина, ITIM (тирозинсодержащий ингибирующий мотив иммунорецептора) и ITSM (тирозинсодержащий активирующий мотив иммунорецептора).
PD-1 ослабляет T-клеточные ответы, когда связан с лигандом запрограммированной гибели клеток 1, также указываемым, как лиганд запрограммированной смерти 1 (PD-L1), и/или лигандом запрограммированной гибели клеток 2, также указываемым как лиганд запрограммированной смерти 2 (PD-L2). Связывание любого из этих лигандов с PD-1 негативно регулирует передачу сигнала через рецептор антигена. Блокирование связывания PD-L1 с PD-1 усиливает опухоль-специфический CD8+ T-клеточный иммунитет, при этом способствуя клиренсу опухолевых клеток иммунной системой. О пространственной структуре мышиного PD-1, наряду с сокристаллической структурой мышиного PD-1 с человеческим PD-L1 сообщалось в [Zhang et al., Immunity 20: 337-347 (2004); Lin et al., Proc. Natl. Acad. Sci. USA 105: 3011-3016 (2008)].
PD-L1 и PD-L2 представляют трансмембранные лиганды типа I, которые содержат оба IgV- и IgC-подобные домены во внеклеточной области вместе с короткими цитоплазматическими участками с неизвестными сигнальными мотивами. Оба и PD-L1 и PD-L2 либо постоянно экспрессируются либо могут быть индуцированы в различных типах клеток, включая не кроветворные ткани наряду с различными типами опухолей. PD-L1 не только экспрессируется на B, T, миелоидных и дендритных клетках (DCs), но также на периферических клетках, таких как эндотелиальные клетки микрососудов, и в не лимфоидных органах, например, сердце или легкие. В противоположность, PD-L2 обнаруживается только на макрофагах и DCs. Паттерн экспрессии лигандов PD-1 предполагает, что PD-1 играет роль в поддержании периферической толерантности и может дополнительно служить для регуляции аутореактивных T- и B-клеточных ответов в периферии.
В любом случае, совершенно ясно, что PD-1 играет решающую роль по меньшей мере в определенных видах рака человека, предположительно опосредуемых ускользанием от механизмов иммунологического надзора. Соответственно, PD-L1 продемонстрировал способность экспрессироваться на множестве мышиных и человеческих опухолей и индуцируется IFN-γ в большинстве PD-L1 негативных линий опухолевых клеток [Iwai et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002); Strome et al., Cancer Res., 63: 6501-6505 (2003)]. Дополнительно была определена экспрессия PD-1 на проникающих в опухоль лимфоцитах и/или PD-L1 на опухолевых клетках во множестве биопсий первичных опухолей человека. Такие опухолевые ткани включают рак легкого, печени, яичников, шейки матки, кожи, толстой кишки, глиомы, рака мочевого пузыря, груди, почек, пищевода, желудка, сквамозные клетки ротовой полости, уротелиальные клетки и поджелудочной железы, наряду с опухолями головы и шеи [Brown et al., J. Immunol. 170: 1257-1266 (2003); Dong et al., Nat. Med. 8: 793-800 (2002); Wintterle et al., Cancer Res. 63: 7462-7467 (2003); Strome et al., Cancer Res., 63: 6501-6505 (2003); Thompson et al., Cancer Res. 66: 3381-5 (2006); Thompson et al., Clin. Cancer Res. 13: 1757-1761 (2007); Nomi et al., Clin.Cancer Res. 13: 2151-2157. (2007)]. Очень удивительно, что экспрессия PD-лигандов на опухолевых клетках коррелирует с плохим прогнозом у пациентов с раком у человека со множеством различных типов опухолей [reviewed in Okazaki and Honjo, Int. Immunol. 19: 813-824 (2007)].
Дополнительно в Nomi et al. [Clin. Cancer Res. 13: 2151-2157 (2007)] продемонстрирован терапевтический эффект блокирования связывания PD-L1 с PD-1 на мышиной модели агрессивного рака поджелудочной железы посредством введения PD-1 или PD-L1 специфического антитела. Эти антитела эффективно промотируют опухолереактивную CD8+ T клеточную инфильтрацию в опухоли с позитивной регуляцией противоопухолевых эффекторов, включая IFN-γ, гранзим B, и перфорин. Аналогично применение антител для блокировки связывания PD-L1 и PD-1 значительно ингибирует рост опухоли на мышиной модели карциномы сквамозных клеток [Tsushima et al., Oral Oncol. 42: 268-274 (2006)].
В других исследованиях трансфекция линии мышиной мастоциомы PD-L1 привела к снижению лизиса опухолевых клеток при сокультивировании с опухоль-специфическим CTL клоном. Лизис был восстановлен введение анти -PD-L1 моноклонального антитела [Iwai et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002)]. In vivo блокирование взаимодействия PD1/PD-L1 показало повышение эффективности терапии переносом адоптивных T-клеток на мышиной опухолевой модели [Strome et al., Cancer Res. 63: 6501-6505 (2003)]. Дополнительное свидетельство роли PD-1 в лечении рака получено в ходе экспериментов, проведенных при участии мышей с выключенным PD-1, у которых PD-L1 экспрессирующие клетки миеломы выросли только у животных дикого типа (с ростом опухоли и связанной с этим смерти животного), но не у мышей дефицитных по PD-1 [Iwai Y. et al., Proc. Natl. Acad. Sci. U.S.A. 99: 12293-12297 (2002)]. Совсем недавно антитела против PD-1 (включая гуманизированное мышиное моноклональное антитело против человеческого PD 1) показали по меньшей мере успех на начальном этапе в терапии рака у людей [смотрите, например, US 8,354,509 B2, US 8,008,449 B2, и US 7,595,048 B2].
Анти-PD-1 антитело также может быть использовано при хронической вирусной инфекции. CD8+ T -клетки памяти, генерированные после острой вирусной инфекции, представляют высоко функциональные и являются важным компонентом защитного иммунитета. В противоположность, хронические инфекции часто характеризуются различными степенями функциональных нарушений (истощение) вирус-специфических T-клеточных ответов, и этот дефект является основной причиной неспособности хозяина избавиться от персистентного патогена. Хотя функциональные эффекторные T клетки сначала генерируются во время ранних стадий инфекции, их функция постепенно истощается во время течения хронической инфекции. Barber et al. [Nature 439: 682-687 (2006)] показали, что у мышей, инфицированных лабораторным штаммом LCMV, развилась хроническая инфекция с высокими уровнями вируса в крови и других тканях. У этих мышей сначала развился активный T клеточный ответ, но со временем прекратилось сопротивление инфекции при истощении T клеток. Barber et al. обнаружили, что снижение числа и функции эффекторных T клеток у хронически инфицированных мышей может быть обращено вспять инъекцией антитела, блокирующего взаимодействие между PD-1 и PD-L1.
Цитирование любой ссылки в описании настоящей патентной заявки не следует понимать, как признание того, что такая ссылка делает настоящую патентную заявку частью «предшествующего уровня техники».
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает кристаллизуемую область фрагмента собачьего (cFc область) антитела, где cFc был генетически модифицирован для усиления, ослабления или элиминирования одной или более эффекторной функции. В одном аспекте настоящего изобретения генетически модифицированный cFc снижает или элиминирует одну или более эффекторную функцию. В другом аспекте настоящего изобретения генетически модифицированный cFc усиливает одну или более эффекторную функцию.
В некоторых вариантах воплощения настоящего изобретения генетически модифицированная cFc область представляет генетически модифицированную Fc область собачьего IgGB. В другом таком варианте воплощения настоящего изобретения генетически модифицированная cFc область представляет генетически модифицированную Fc область собачьего IgGC. В конкретном варианте воплощения настоящего изобретения эффекторная функция представляет антителозависимую цитотоксичность (ADCC), которая усилена, снижена или элиминирована. В другом варианте воплощения настоящего изобретения эффекторная функция представляет комплиментзависимую цитотоксичность (CDC), которая усилена, снижена или элиминирована. В другом варианте воплощения настоящего изобретения cFc область была генетически модифицирована для усиления, снижения или элиминирования обоих, и ADCC, и CDC.
Дополнительно, настоящее изобретение обеспечивает собачьи каркасы и/или полноразмерные тяжелые цепи, которые содержат генетически модифицированные cFc области. Соответственно, настоящее изобретение обеспечивает полноразмерные тяжелые цепи антитела, в котором полноразмерные тяжелые цепи содержат генетически модифицированные cFc области по настоящему изобретению. Такие полноразмерные тяжелые цепи также могут быть скомбинированы с соответствующими собачьими легкими (каппа или лямбда) цепями с образованием полного антитела. В конкретных вариантах воплощения для такого типа по настоящему изобретению полученное в результате антитело специфически связывается с конкретным собачьим антигеном. В таких конкретных вариантах воплощения настоящего изобретения собачий антиген представляет собачий PD-1. В других вариантах воплощения настоящего изобретения собачий антиген представляет собачий PD-L1. В других вариантах воплощения настоящего изобретения собачий антиген представляет альфа цепь рецептора IL-4. В других вариантах воплощения настоящего изобретения собачий антиген представляет собачий тимусовый стромальный лимфопоэтиновый белок (cTSLP) [смотрите, США 7,718,772 B2, содержимое которого введено здесь ссылкой в полном объеме].
В некоторых вариантах воплощения настоящего изобретения генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 (или SEQ ID NO: 132), в которой от одного до семи следующих остатков замещены другим аминокислотным остатком в указанных позициях: P4, D31, N63, G64, T65, A93 или P95. Аминокислотные замещения для P4, D31, N63, G64, T65, A93 и/или P95 индивидуально выбирают из одной из других 19 стандартных природных аминокислот, приведенных в Таблице 1 ниже. Дополнительно, настоящее изобретение обеспечивает варианты генетически модифицированных cFc областей, которые содержат аминокислотные последовательности, имеющие 90%, 95%, 98% или 99% идентичность аминокислотной последовательности таких генетически модифицированных cFc областей и сохраняют по меньшей мере 50%, 75%, 90%, 95% или более усиления, снижения или элиминирования ADCC и/или CDC как генетически модифицированные cFc области, содержащие аминокислотную последовательность SEQ ID NO: 130 (или SEQ ID NO: 132), в которой один или более из следующих аминокислотных остатков были замещены: то есть в P4, D31, N63, G64, T65, A93 или P95.
В других вариантах воплощения настоящего изобретения от двух до пяти следующих аминокислотных остатков замещены другим аминокислотным остатком в указанных позициях: P4, D31, N63, G64, T65, A93 или P95. В конкретных вариантах воплощения для такого типа по настоящему изобретению генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 или SEQ ID NO: 132 со следующими замещениями: P4A, D31A, N63A, A93G и P95A. В близких вариантах воплощения настоящего изобретения генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 или SEQ ID NO: 132 со следующими замещениями: P4A, D31A, N63A и P95A. В других вариантах воплощения настоящего изобретения генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 или SEQ ID NO: 132 с замещениями в D31 и N63. В конкретных вариантах воплощения для такого типа по настоящему изобретению остаток аспарагиновой кислоты в позиции 31 замещен остатком глутаминовой кислоты, остатком аспарагина или остатком аланина, при этом остаток аспарагина в позиции 63 замещен остатком глутамина, остатком гистидина или остатком аланина. В более конкретном варианте воплощения настоящего изобретения генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 или SEQ ID NO: 132 со следующими замещениями: D31A и N63A. В конкретных вариантах воплощения настоящего изобретения генетически модифицированная cFc область кодируется нуклеотидной последовательностью SEQ ID NO: 129 или SEQ ID NO: 131, содержащей нуклеотидные цепи, которые соответствуют аминокислотным последовательностям, которые они кодируют.
В другом варианте воплощения настоящего изобретения генетически модифицированная cFc область содержит аминокислотную последовательность SEQ ID NO: 130 или SEQ ID NO: 132 с замещением в A93. В конкретном варианте воплощения для такого типа по настоящему изобретению замещение представляет A93G. В соответствующем варианте воплощения настоящего изобретения замещение представляет A93S. Как показано ниже в Примере 4, замещение A93G приводит к усилению связывания C1q комплемента, что указывает на повышение активности CDC.
В близких вариантах воплощения настоящего изобретения генетически модифицированная cFc область дополнительно содержит шарнирную область, которая сдержит аминокислотную последовательность SEQ ID NO: 109. В других вариантах воплощения настоящего изобретения генетически модифицированная Fc область дополнительно содержит шарнирную область, которая содержит аминокислотную последовательность SEQ ID NO: 110. В других вариантах воплощения настоящего изобретения генетически модифицированная Fc область дополнительно содержит шарнирную область, которая содержит аминокислотную последовательность SEQ ID NO: 111. В других вариантах воплощения настоящего изобретения генетически модифицированная Fc область дополнительно содержит генетически модифицированную шарнирную область, которая содержит аминокислотную последовательность SEQ ID NO: 112.
В альтернативных вариантах воплощения настоящее изобретение обеспечивает Fc область собачьего IgGD с генетически модифицированной шарнирной областью из собачьего IgGD антитела, шарнирную область из собачьего IgGA антитела, шарнирную область из собачьего IgGB антитела или шарнирную область из собачьего IgGC антитела. Дополнительно настоящее изобретение обеспечивает полноразмерные тяжелые цепи антител, в которых полноразмерные тяжелые цепи содержат Fc область собачьего IgGD по настоящему изобретению с генетически модифицированной шарнирной областью из собачьего IgGD антитела, шарнирную область из собачьего IgGA антитела, шарнирную область из собачьего IgGB антитела или шарнирную область из собачьего IgGC антитела. Такие полноразмерные тяжелые цепи также могут быть скомбинированы с соответствующими собачьими легкими (каппа или лямбда) цепями с получением полного антитела.
Соответственно настоящее изобретение обеспечивает Fc область собачьего IgGD, которая дополнительно содержит генетически модифицированную шарнирную область из собачьего IgGD антитела. В конкретных вариантах воплощения для такого типа по настоящему изобретению Fc область собачьего IgGD и генетически модифицированная шарнирная область содержат аминокислотную последовательность SEQ ID NO: 6 или аминокислотную последовательность, которая на 90%, 95%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 6, которая содержит остаток пролина в позиции 10 (P10). В более конкретном варианте воплощения настоящего изобретения Fc область собачьего IgGD и генетически модифицированная шарнирная область кодируется нуклеотидной последовательностью SEQ ID NO: 5. В других вариантах воплощения настоящего изобретения Fc область собачьего IgGD дополнительно содержит шарнирную область из собачьего IgGA антитела. В конкретных вариантах воплощения для такого типа по настоящему изобретению Fc область собачьего IgGD и шарнирная область содержат аминокислотную последовательность SEQ ID NO: 8 или аминокислотную последовательность, которая на 90%, 95%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 8. В более конкретном варианте воплощения настоящего изобретения Fc область собачьего IgGD и шарнирная область кодируется нуклеотидной последовательностью SEQ ID NO: 7. В других вариантах воплощения настоящего изобретения Fc область собачьего IgGD дополнительно содержит шарнирную область из собачьего IgGB антитела. В конкретных вариантах воплощения для такого типа по настоящему изобретению Fc область собачьего IgGD и шарнирная область содержит аминокислотную последовательность SEQ ID NO: 10 или аминокислотную последовательность, которая на 90%, 95%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 10. В более конкретном варианте воплощения настоящего изобретения Fc область собачьего IgGD и шарнирная область кодируется нуклеотидной последовательностью SEQ ID NO: 9. В других вариантах воплощения настоящего изобретения Fc область собачьего IgGD дополнительно содержит шарнирную область из собачьего IgGC антитела. В конкретных вариантах воплощения для такого типа по настоящему изобретению cFc область собачьего IgGD и шарнирная область содержат аминокислотную последовательность SEQ ID NO: 12 или аминокислотную последовательность, которая на 90%, 95%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 12. В более конкретном варианте воплощения настоящего изобретения cFc область собачьего IgGD и шарнирная область кодируется нуклеотидной последовательностью SEQ ID NO: 11. Дополнительно, настоящее изобретение обеспечивает канинизированные антитела, которые содержат Fc области собачьего IgGD и шарнирные области. В конкретном варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент специфически связывает собачий рецептор запрограммированной смерти 1 (собачий PD-1).
Следовательно, настоящее изобретение обеспечивает канинизированные антитела против собачьего PD-1, специфически связывающиеся и/или имеющие высокую аффинность связывания с собачьим PD 1. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела против собачьего PD-1 также имеют способность блокировать связывание собачьего PD 1 с собачим PD L1. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела против собачьего PD-1 имеют высокую аффинность связывания с собачим PD 1, наряду со способностью также блокировать связывание собачьего PD 1 с собачим PD L2. Канинизированные антитела или их антигенсвязывающие фрагменты, которые специфично связываются с собачьим PD-1, могут содержать тяжелую цепь собачьего IgG по настоящему изобретению и легкую каппа или лямбда цепь собачьего IgG. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела против собачьего PD-1 представляют канинизированные мышиные антитела против собачьего PD-1. Также настоящее изобретение относится к применению таких канинизированных антител в лечении таких заболеваний, как рак, и/или вызванных инфекцией.
В конкретных вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 содержит генетически модифицированную cFc область по настоящему изобретению. В альтернативных вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 содержит Fc область собачьего IgGD с генетически модифицированной шарнирной областью из собачьего IgGD антитела, шарнирную область из собачьего IgGA антитела, шарнирную область из собачьего IgGB антитела или шарнирную область из собачьего IgGC антитела. Дополнительно, настоящее изобретение обеспечивает такие канинизированные антитела против собачьего PD-1, содержащие собачьи каркасы по настоящему изобретению в комбинации с CDRs, полученными из мышиных антител против собачьего PD-1, то есть три CDRs легкой цепи: CDR 1 из легкой (CDRL1), CDR 2 из легкой (CDRL2) и CDR 3 из легкой (CDRL3), и три CDRs тяжелой цепи: CDR 1 из тяжелой (CDRH1), CDR 2 из тяжелой (CDRH2) и CDR 3 из тяжелой (CDRH3).
В конкретных вариантах воплощения настоящее изобретение относится к канинизированному мышиным против собачьего PD-1 антителам, содержащим генетически модифицированную cFc область IgGB или IgGC по настоящему изобретению или в качестве альтернативы, Fc область собачьего IgGD вместе с генетически модифицированной шарнирной областью собачьего IgGD антитела, шарнирную область собачьего IgGA антитела, шарнирную область собачьего IgGB антитела, или шарнирную область собачьего IgGC антитела в комбинации с CDRs, полученными из мышиных антител против собачьего PD-1. Кроме того, настоящее изобретение не только обеспечивает канинизированные мышиные антитела против собачьего PD-1 со специфическими CDRs, как приведено в описании настоящей патентной заявки, но дополнительно обеспечивает канинизированные мышиные антитела против собачьего PD-1, содержащие консервативно модифицированные варианты таких CDRs наряду с вариантами, которые содержат (например, часть) идентичные канонические структуры.
Соответственно, в конкретных вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 дополнительно содержит определяющие комплиментарность области (CDRs), в которых CDRs имеют каноническую структуру из: H1-1, H2-1, и H3-6, соответственно для CDR1, CDR2, и CDR3 тяжелой цепи, то есть CDR1 тяжелой цепи имеет каноническую структуру класса 1, CDR2 тяжелой цепи имеет каноническую структуру класса 1, и CDR3 тяжелой цепи имеет каноническую структуру класса 6. В более конкретных вариантах воплощения настоящего изобретения CDRs для соответствующих легких цепей имеют канонические структуры: L1-3, L2-1 и L3-1, соответственно для CDR1, CDR2 и CDR3 легкой цепи. В других вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 дополнительно содержит определяющие комплементарность области (CDRs), в которых CDRs имеют канонические структуры: H1-1, H2-1 и H3-11, соответственно, для CDR1, CDR2 и CDR3 тяжелой цепи. В еще более конкретных вариантах воплощения для таких типов по настоящему изобретению CDRs для соответствующих легких цепей имеют канонические структуры: L1-2A, L2-1 и L3-1, соответственно, для CDR1, CDR2 и CDR3 легкой цепи. В других вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 дополнительно содержит определяющие комплементарность области (CDRs), в которых CDRs имеют канонические структуры: H1-1, H2-2A и H3-11, соответственно, для CDR1, CDR2 и CDR3 тяжелой цепи. В еще более конкретных вариантах воплощения для таких типов по настоящему изобретению CDRs для соответствующих легких цепей имеют канонические структуры L1-2A, L2-1 и L3-1, соответственно, для CDR1, CDR2 и CDR3 легкой цепи. В других вариантах воплощения настоящего изобретения канинизированное антитело против собачьего PD-1 дополнительно содержит определяющие комплементарность области (CDRs), в которой CDRs имеют канонические структуры: H1-1, H2-2A и H3-13, соответственно, для CDR1, CDR2 и CDR3 тяжелой цепи. В еще более конкретных вариантах воплощения для таких типов по настоящему изобретению CDRs для соответствующих легких цепей имеют канонические структуры: L1-4, L2-1 и L3-1, соответственно, для CDR1, CDR2 и CDR3 легкой цепи.
В более конкретных вариантах воплощения настоящего изобретения канинизированное антитело по настоящему изобретению или его антигенсвязывающий фрагмент содержит одну или более определяющую комплементарность область 1 (VH CDR1) тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30. В другом варианте воплощения настоящего изобретения определяющая комплементарность область 2 (VH CDR2) тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35. В другом варианте воплощения настоящего изобретения определяющая комплементарность область 3 (VH CDR3) тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38 или SEQ ID NO: 146. В конкретном варианте воплощения для такого типа по настоящему изобретению канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VH CDR1, содержащую аминокислотную последовательность SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30, и VH CDR2, содержащую аминокислотную последовательность SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35. В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VH CDR1, содержащую аминокислотную последовательность SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30 и VH CDR3, содержащую аминокислотную последовательность SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38 или SEQ ID NO: 146. В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VH CDR2, содержащую аминокислотную последовательность SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35, и VH CDR3, содержащую аминокислотную последовательность SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38 или SEQ ID NO: 146. В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит VH CDR1, содержащую аминокислотную последовательность SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30, VH CDR2, содержащую аминокислотную последовательность SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35, и VH CDR3, содержащую аминокислотную последовательность SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38 или SEQ ID NO: 146.
В конкретных вариантах воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент также содержит определяющую комплементарность область 1 (VL CDR1) легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15. В близких вариантах воплощения настоящего изобретения определяющая комплементарность область 2 (VL CDR2) легкой цепи содержит аминокислотную последовательность SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20 или SEQ ID NO: 21. В другом варианте воплощения настоящего изобретения определяющая комплементарность область 3 (VL CDR3) легкой цепи содержит аминокислотную последовательность SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26. В конкретном варианте воплощения для такого типа по настоящему изобретению канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VL CDR1, содержащую аминокислотную последовательность SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, и VL CDR2 содержащую аминокислотную последовательность SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20 или SEQ ID NO: 21.
В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VL CDR1, содержащую аминокислотную последовательность SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, и VL CDR3 содержащую аминокислотную последовательность SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26. В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит обе, и VL CDR2, содержащую аминокислотную последовательность SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, или SEQ ID NO: 21, и VL CDR3 содержащую аминокислотную последовательность SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26. В другом таком варианте воплощения настоящего изобретения канинизированное антитело или антигенсвязывающий фрагмент содержит VL CDR1, содержащую аминокислотную последовательность SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, VL CDR2, содержащую аминокислотную последовательность SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, или SEQ ID NO: 21, и VL CDR3, содержащую аминокислотную последовательность SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 или SEQ ID NO: 26.
Дополнительно, настоящее изобретение обеспечивает канинизированные антитела, которые содержат аминокислотную последовательность SEQ ID NO: 40 или таковую на 90%, 95%, 98%, или 99% идентичную аминокислотной последовательности SEQ ID NO: 40; SEQ ID NO: 42 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 42; SEQ ID NO: 44 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 44; SEQ ID NO: 46 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 46; SEQ ID NO: 48 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 48; SEQ ID NO: 50 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 50; SEQ ID NO: 52 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 52; SEQ ID NO: 54 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 54; SEQ ID NO: 56 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 56; SEQ ID NO: 58 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 58; SEQ ID NO: 60 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 60; SEQ ID NO: 62 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 62; SEQ ID NO: 64 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 64; или SEQ ID NO: 66 или таковую на 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NO: 66, или антигенсвязывающие фрагменты таких канинизированных антител.
В конкретных вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 40, 52, 56, или 64), которая содержит (i) P, A, G или S в позиции 239, (ii) A, G или S в позиции 266, (iii) A, G или S в позиции 298, (iv) G, P или A в позиции 299, (v) T, A, G или S в позиции 300, (vi) A, G или S в позиции 328, и (vii) P, A, G или S в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 42, 54, 58, или 66), которая содержит (i) P, A, G или S в позиции 237, (ii) A, G или S в позиции 264, (iii) A, G или S в позиции 296, (iv) G, P или A в позиции 297, (v) T, A, G или S в позиции 298, (vi) A, G или S в позиции 326, и (vii) P, A, G или S в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) P, A, G или S в позиции 244, (ii) A, G или S в позиции 271, (iii) A, G или S в позиции 303, (iv) G, P или A в позиции 304, (v) T, A, G или S в позиции 305, (vi) A, G или S в позиции 333, и (vii) P, A, G или S в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P, A, G или S в позиции 242, (ii) A, G или S в позиции 269, (iii) A, G или S в позиции 301, (iv) G, P или A в позиции 302, (v) T, A, G или S в позиции 303, (vi) A, G или S в позиции 331, и (vii) P, A, G или S в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 48) которая содержит (i) P, A, G или S в позиции 246, (ii) A, G или S в позиции 273, (iii) A, G или S в позиции 305, (iv) G, P или A в позиции 306, (v) T, A, G или S в позиции 307, (vi) A, G или S в позиции 335, и (vii) P, A, G или S в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) P, A, G или S в позиции 239, (ii) A в позиции 266, (iii) A в позиции 298, (iv) G, P или A в позиции 299, (v) T, A, G или S в позиции 300, (vi) A, G или S в позиции 328, и (vii) P, A, G или S в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) P, A, G или S в позиции 237, (ii) A в позиции 264, (iii) A в позиции 296, (iv) G, P или A в позиции 297, (v) T, A, G, или S в позиции 298, (vi) A, G, или S в позиции 326, и (vii) P, A, G, или S в позиции 328. В других вариантах воплощения настоящего изобретения, тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50, или 60 (или 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 44, 50, или 60) которая содержит (i) P, A, G, или S в позиции 244, (ii) A в позиции 271, (iii) A в позиции 303, (iv) G, P или A в позиции 304, (v) T, A, G, или S в позиции 305, (vi) A, G или S в позиции 333, и (vii) P, A, G или S в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P, A, G или S в позиции 242, (ii) A в позиции 269, (iii) A в позиции 301, (iv) G, P или A в позиции 302, (v) T, A, G или S в позиции 303, (vi) A, G или S в позиции 331, и (vii) P, A, G или S в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) P, A, G или S в позиции 246, (ii) A в позиции 273, (iii) A в позиции 305, (iv) G, P или A в позиции 306, (v) T, A, G или S в позиции 307, (vi) A, G или S в позиции 335, и (vii) P, A, G или S в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) A в позиции 239, (ii) A в позиции 266, (iii) A в позиции 298, (iv) P в позиции 299, (v) A в позиции 300, (vi) G, в позиции 328, и (vii) A в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58, или 66), которая содержит (i) A в позиции 237, (ii) A в позиции 264, (iii) A в позиции 296, (iv) P в позиции 297, (v) A в позиции 298, (vi) G в позиции 326, и (vii) A в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) A в позиции 244, (ii) A в позиции 271, (iii) A в позиции 303, (iv) P в позиции 304, (v) A в позиции 305, (vi) G в позиции 333, и (vii) A в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) A в позиции 242, (ii) A в позиции 269, (iii) A в позиции 301, (iv) P в позиции 302, (v) A в позиции 303, (vi) G в позиции 331, и (vii) A в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) A в позиции 246, (ii) A в позиции 273, (iii) A в позиции 305, (iv) P в позиции 306, (v) A в позиции 307, (vi) G в позиции 335, и (vii) A в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) P в позиции 239, (ii) A, G или S в позиции 266, (iii) A, G или S в позиции 298, (iv) G в позиции 299, (v) T в позиции 300, (vi) A в позиции 328, и (vii) P в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) P в позиции 237, (ii) A, G или S в позиции 264, (iii) A, G или S в позиции 296, (iv) G в позиции 297, (v) T в позиции 298, (vi) A в позиции 326, и (vii) P в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) P в позиции 244, (ii) A, G или S в позиции 271, (iii) A, G или S в позиции 303, (iv) G в позиции 304, (v) T в позиции 305, (vi) A в позиции 333, и (vii) P в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P в позиции 242, (ii) A, G или S в позиции 269, (iii) A, G или S в позиции 301, (iv) G в позиции 302, (v) T в позиции 303, (vi) A в позиции 331, и (vii) P в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) P в позиции 246, (ii) A, G или S в позиции 273, (iii) A, G или S в позиции 305, (iv) G в позиции 306, (v) T в позиции 307, (vi) A в позиции 335, и (vii) P в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) P в позиции 239, (ii) A в позиции 266, (iii) A в позиции 298, (iv) G в позиции 299, (v) T в позиции 300, (vi) A в позиции 328, и (vii) P в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) P в позиции 237, (ii) A в позиции 264, (iii) A в позиции 296, (iv) G в позиции 297, (v) T в позиции 298, (vi) A в позиции 326, и (vii) P в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или 90%, 95%, 98% или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) P в позиции 244, (ii) A в позиции 271, (iii) A в позиции 303, (iv) G в позиции 304, (v) T в позиции 305, (vi) A в позиции 333, и (vii) P в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P в позиции 242, (ii) A в позиции 269, (iii) A в позиции 301, (iv) G в позиции 302, (v) T в позиции 303, (vi) A в позиции 331, и (vii) P в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) P в позиции 246, (ii) A в позиции 273, (iii) A в позиции 305, (iv) G в позиции 306, (v) T в позиции 307, (vi) A в позиции 335, и (vii) P в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) P, A, G или S в позиции 239, (ii) A, G или S в позиции 266, (iii) A, G или S в позиции 298, (iv) G в позиции 299, (v) T в позиции 300, (vi) A, G или S в позиции 328, и (vii) P, A, G или S в позиции 330. В других таких вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) P, A, G или S в позиции 237, (ii) A, G или S в позиции 264, (iii) A, G или S в позиции 296, (iv) G в позиции 297, (v) T в позиции 298, (vi) A, G или S в позиции 326, and (vii) P, A, G или S в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) P, A, G или S в позиции 244, (ii) A, G или S в позиции 271, (iii) A, G или S в позиции 303, (iv) G в позиции 304, (v) T в позиции 305, (vi) A, G, или S в позиции 333, и (vii) P, A, G или S в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P, A, G или S в позиции 242, (ii) A, G или S в позиции 269, (iii) A, G или S в позиции 301, (iv) G в позиции 302, (v) T в позиции 303, (vi) A, G или S в позиции 331, и (vii) P, A, G или S в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) P, A, G или S в позиции 246, (ii) A, G или S в позиции 273, (iii) A, G или S в позиции 305, (iv) G в позиции 306, (v) T в позиции 307, (vi) A, G или S в позиции 335, и (vii) P, A, G или S в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) P, A, G или S в позиции 239, (ii) A в позиции 266, (iii) A в позиции 298, (iv) G в позиции 299, (v) T в позиции 300, (vi) A, G или S в позиции 328, и (vii) P, A, G или S в позиции 330. В других таких вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) P, A, G или S в позиции 237, (ii) A в позиции 264, (iii) A в позиции 296, (iv) G в позиции 297, (v) T в позиции 298, (vi) A, G или S в позиции 326, и (vii) P, A, G или S в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) P, A, G или S в позиции 244, (ii) A в позиции 271, (iii) A в позиции 303, (iv) G в позиции 304, (v) T в позиции 305, (vi) A, G или S в позиции 333, и (vii) P, A, G или S в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98%, или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) P, A, G или S в позиции 242, (ii) A в позиции 269, (iii) A в позиции 301, (iv) G в позиции 302, (v) T в позиции 303, (vi) A, G или S в позиции 331, и (vii) P, A, G или S в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) P, A, G или S в позиции 246, (ii) A в позиции 273, (iii) A в позиции 305, (iv) G в позиции 306, (v) T в позиции 307, (vi) A, G или S в позиции 335, и (vii) P, A, G или S в позиции 337.
В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56 или 64 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 40, 52, 56 или 64), которая содержит (i) A в позиции 239, (ii) A в позиции 266, (iii) A в позиции 298, (iv) G в позиции 299, (v) T в позиции 300, (vi) G в позиции 328, and (vii) A в позиции 330. В других таких вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 42, 54, 58 или 66), которая содержит (i) A в позиции 237, (ii) A в позиции 264, (iii) A в позиции 296, (iv) G в позиции 297, (v) T в позиции 298, (vi) G в позиции 326, и (vii) A в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 44, 50 или 60), которая содержит (i) A в позиции 244, (ii) A в позиции 271, (iii) A в позиции 303, (iv) G в позиции 304, (v) T в позиции 305, (vi) G в позиции 333, и (vii) A в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 46 или 62), которая содержит (i) A в позиции 242, (ii) A в позиции 269, (iii) A в позиции 301, (iv) G в позиции 302, (v) T в позиции 303, (vi) G в позиции 331, и (vii) A в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48 (или на 90%, 95%, 98% или 99% идентичную SEQ ID NO: 48), которая содержит (i) A в позиции 246, (ii) A в позиции 273, (iii) A в позиции 305, (iv) G в позиции 306, (v) T в позиции 307, (vi) G в позиции 335, и (vii) A в позиции 337.
Дополнительно, настоящее изобретение обеспечивает канинизированное антитело или его антигенсвязывающий фрагмент, которое дополнительно содержит собачью легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 72, SEQ ID NO: 78, SEQ ID NO: 84, SEQ ID NO: 90, SEQ ID NO: 96, SEQ ID NO: 102 или SEQ ID NO: 108.
Соответственно, дополнительно настоящее изобретение обеспечивает канинизированное антитело или его антигенсвязывающий фрагмент, которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 68, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 72. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 72. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 74, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 76, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 80, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 84. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 82, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 84. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 86, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 90. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 88, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 90. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 92, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 94, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 98, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 102. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 100, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 102. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 104, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 108. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 106, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 108.
Дополнительно настоящее изобретение обеспечивает канинизированное антитело или его антигенсвязывающий фрагмент, которое содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 72. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 42, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 72. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 44, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 48, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 84. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 50, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 84. В другом варианте воплощения настоящего изобретения, канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 52, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 90. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 54, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 90. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 58, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 96.
В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 60, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 102. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 62, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 102. В другом варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 108. В близком варианте воплощения настоящего изобретения канинизированное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 66, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 108.
Дополнительно, настоящее изобретение обеспечивает нуклеиновые кислоты, которые кодируют любую из аминокислотных последовательностей по настоящему изобретению, включая CDRs, cFc области, cFc области с шарнирными областями, и тяжелые цепи, и легкие цепи канинизированных антител по настоящему изобретению. Дополнительно, настоящее изобретение обеспечивает векторы экспрессии, которые содержат одну или более из нуклеиновых кислот по настоящему изобретению. Дополнительно, настоящее изобретение обеспечивает клетки-хозяева, которые содержат один или более векторы экспрессии по настоящему изобретению, и способы экспрессирования CDRs, и/или cFc областей, и/или cFc областей с шарнирными областями, и/или тяжелых цепей, и/или легких цепей канинизированных антител по настоящему изобретению при использовании таких клеток-хозяев. Настоящее изобретение также обеспечивает клетки-хозяева, которые подверглись воздействию генной инженерии для экспрессии CDRs, и/или cFc областей, и/или cFc областей с шарнирными областями, и/или тяжелых цепей, и/или легких цепей канинизированных антител по настоящему изобретению при отсутствии таких векторов. В конкретных вариантах воплощения настоящего изобретения эти нуклеиновые кислоты, векторы экспрессии, полипептиды или клетки-хозяева по настоящему изобретению используют в способах получения антител.
В конкретных вариантах воплощения настоящего изобретения антитело представляет рекомбинантное антитело или его антигенсвязывающий фрагмент. В близких вариантах воплощения настоящего изобретения вариабельный домен тяжелой цепи и вариабельный домен легкой цепи соединены гибким линкером с образованием одноцепопчечного антитела.
В конкретных вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет Fab фрагмент.
В других вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет Fab' фрагмент. В других вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет (Fab')2 фрагмент. В других вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет диатело. В конкретных вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет домен антитела. В конкретных вариантах воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент представляет однодоменное камелизованное антитело.
В конкретных вариантах воплощения настоящего изобретения канинизированное мышиное антитело против собачьего PD-1 или антигенсвязывающий фрагмент повышает иммунный ответ у лечимой им собаки.
В конкретных вариантах воплощения настоящего изобретения, когда канинизированное антитело или его антигенсвязывающий фрагмент связаны с собачьим PD-1, то связываются по меньшей мере с одним аминокислотным остатком в одной или более аминокислотной последовательности из следующих: SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, и/или SEQ ID NO: 145.
Дополнительно, настоящее изобретение обеспечивает канинизированные антитела к собачьему PD-1, которые содержат варианты CDRs по настоящему изобретению, которые имеют соответствующие канонические структуры, обеспеченные в описании настоящей патентной заявки, и/или которые связываются с аминокислотной последовательностью SEQ ID NO: 144. В конкретных вариантах воплощения для такого типа по настоящему изобретению константа диссоциации (Kd) для связывания канинизированное антитело-собачий PD-1 составляет от 1×10-5 до 1×10-12 M. В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела к собачьему PD-1 содержат варианты CDRs по настоящему изобретению, которые имеют соответствующие канонические структуры, обеспеченные в описании настоящей патентной заявки, и связывающиеся с аминокислотной последовательностью SEQ ID NO: 145. Следовательно, настоящее изобретение включает канинизированные антитела и их антигенсвязывающие фрагменты, которые специфически связываются с собачьим PD-1, и которые, когда они связаны с собачьим PD-1, то антитело связывается по меньшей мере с одним аминокислотным остатком в SEQ ID NO: 144. В конкретных вариантах воплощения для такого типа по настоящему изобретению антитела и их антигенсвязывающие фрагменты связывают собачий PD-1 и блокируют связывание собачьего PD 1 с собачьим лигандом запрограммированной смерти 1 (PD-L1).
Соответственно, в конкретных вариантах воплощения настоящего изобретения, когда канинизированное антитело (включая антитела с одним или более вариантом CDR, например, вариант, включающий консервативно модифицированный вариант и/или вариант, который содержит определенный класс канонической структуры) связано с собачьим PD-1, то оно связывается по меньшей мере с одним аминокислотным остатком в одной или более аминокислотной последовательности из следующих: SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143 и/или SEQ ID NO: 145. В еще более конкретных вариантах воплощения настоящего изобретения, когда канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1, то они связываются с одним или более аминокислотным остатком из следующих остатков аргинина: R62, R69, R72, R75 и R90 SEQ ID NO: 114. В конкретных вариантах воплощения настоящего изобретения, когда канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1, то они связываются по меньшей мере с одним аминокислотным остатком в SEQ ID NO: 145. В конкретных вариантах воплощения настоящего изобретения, когда антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1, то они связываются с одним или более аминокислотным остатком из следующих остатков аргинина: R62, R69, R72 и R75 SEQ ID NO: 114. В более конкретных вариантах воплощения настоящего изобретения, когда антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1, то они связываются с R75 SEQ ID NO: 114.
Дополнительно, настоящее изобретение обеспечивает канинизированные антитела или их антигенсвязывающие фрагменты, которые связываются с собачьим PD-1 с константой диссоциации (Kd), которая составляет менее (например, 1×10-13 M, или ниже), чем 1×10-12 M. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты к собачьему PD-1 имеют константу диссоциации от 1×10-5 M до 1×10-12 M. В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 с константой диссоциации от1×10-7 M до 1×10-11 M. В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 с константой диссоциации от 1×10-8 M до 1×10-11 M. В других конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 с константой диссоциации от 1×10-8 M до 1×10-10 M.
Настоящее изобретение также обеспечивает канинизированные антитела или их антигенсвязывающие фрагменты, которые связаны с собачьим PD-1 со скоростью ассоциации (kon), составляющей более чем 1×107 M-1s-1. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты thereof связаны с собачьим PD-1 со скоростью ассоциации от 1×102 M-1s-1 до 1×107 M-1s-1. В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью ассоциации от 1×103 M-1s-1 до 1×106 M-1s-1. В еще более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью ассоциации от 1×103 M-1s-1 до 1×105 M-1s-1. В еще более конкретных вариантах воплощения настоящего изобретения, канинизированные антитела или антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью ассоциации от 1×104 M-1s-1 до 1×105 M-1s-1.
Дополнительно, настоящее изобретение обеспечивает канинизированные антитела или их антигенсвязывающие фрагменты, которые связаны с собачьим PD-1 со скоростью диссоциации (koff) медленнее, чем 1×10-7с-1. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью диссоциации от 1×10-3с-1 до 1×10-8с-1. В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью диссоциации от 1×10-4с-1 до 1×10-7с-1. В еще более конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты связаны с собачьим PD-1 со скоростью диссоциации от 1×10-5с-1 до 1×10-7с-1.
В близких вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты стимулируют память антиген-специфических ответов на опухоль или патоген. В конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты стимулируют гуморальный иммунный ответ in vivo. В других конкретных вариантах воплощения настоящего изобретения канинизированные антитела или их антигенсвязывающие фрагменты стимулируют иммунный ответ у животного-субъекта. В более конкретных вариантах воплощения настоящего изобретения животное-субъект представляет представителя собачьих. В близком варианте воплощения настоящего изобретения животное-субъект представляет представителя кошачьих.
Соответственно, любое канинизированное антитело по настоящему изобретению может демонстрировать одно, два, три, четыре, пять или все эти свойства, то есть указанные выше константы диссоциации с собачьим PD-1, указанные выше скорости связывания с собачьим PD-1, указанные выше скорости диссоциации для диссоциирования из комплекса связывания канинизированное антитело-собачий PD-1, стимуляцию ответов антигенспецифической памяти на опухоль или патоген, стимуляцию гуморального иммунного ответа in vivo, и/или стимуляцию иммунного ответа у животного-субъекта.
В более конкретных вариантах воплощения настоящего изобретения канинизированные антитела и их антигенсвязывающие фрагменты по настоящему изобретению связываются с собачьим PD-1 и также блокируют связывание собачьего PD 1 с PD-L1. В еще более конкретных вариантах воплощения настоящего изобретения канинизированные антитела и их антигенсвязывающие фрагменты по настоящему изобретению связываются с собачьим PD-1, блокируют связывание собачьего PD 1 с PD-L1, и также блокируют связывание собачьего PD-1 с PD-L2.
Дополнительно, настоящее изобретение обеспечивает нуклеиновые кислоты, которые кодируют канинизированное мышиное антитело против собачьего PD-1 или его части по настоящему изобретению. В близких вариантах воплощения настоящего изобретения такие антитела или их антигенсвязывающие фрагменты могут быть использованы для получения лекарственного средства для лечения рака у субъекта-животного. В качестве альтернативы или в совокупности, настоящее изобретение обеспечивает использование одного или более антитела или фрагментов антитела по настоящему изобретению для диагностики. В дополнительных вариантах воплощения настоящего изобретения обеспечивается набор, содержащий любое из канинизированных антител или его антигенсвязывающих фрагментов, как приведено в описании настоящей патентной заявки.
Дополнительно настоящее изобретение включает фармацевтические композиции, содержащие антитело против собачьего антигена или его связывающие фрагменты (например, антитело против собачьего PD -1 или его антигенсвязывающий фрагмент) вместе с фармацевтически приемлемым носителей или разбавителем. Настоящее изобретение также обеспечивает способ повышения активности иммунной клетки, включающий введение субъекту (например, собаке), нуждающемуся в нем, терапевтически эффективного количества фармацевтической композиции по настоящему изобретению. В конкретных вариантах воплощения настоящего изобретения способ используют для лечения рака. В других вариантах воплощения настоящего изобретения способ используют для лечения инфекции или инфекционных заболеваний. В других вариантах воплощения настоящего изобретения канинизированное антитело по настоящему изобретению или его антигенсвязывающий фрагмент используют в качестве адъюванта вакцины. В другом варианте воплощения настоящего изобретения канинизированное анти-TSLP антитело вводят собаке для лечения атопического дерматита.
Эти другие аспекты настоящего изобретения будут более понятны понятны из следующего краткого описания чертежей и подробного описания, на которые делается ссылка.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
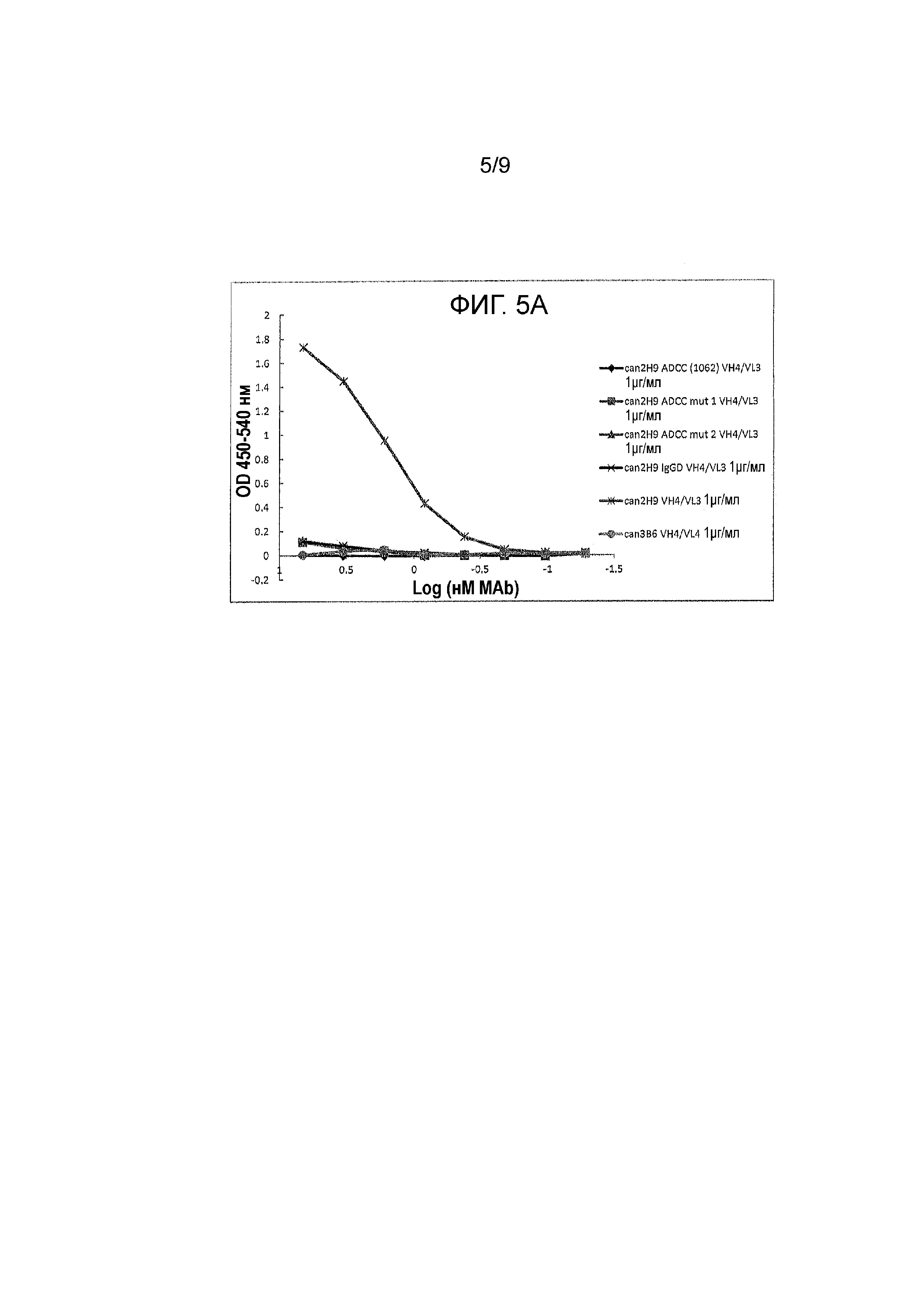
Фигура 1 - реактивность канинизированных моноклональных антител (mAbs) против внеклеточного домена собачьего PD-1, как функции OD 650/490 от log mAb (nM). Протестировали различные канинизированные mAbs на их связывание с внеклеточным доменом собачьего PD-1 при использовании ELISA. Четыре протестированных mAbs указаны, как: 2H9 VH4 IgGB/VL3, 3B6 VH3 IgGB/ VL3, 2H9 VH4 IgGB (YZZ1062)/VL3 и 2H9 VH4 IgGB (YZZ1068)/VL3.
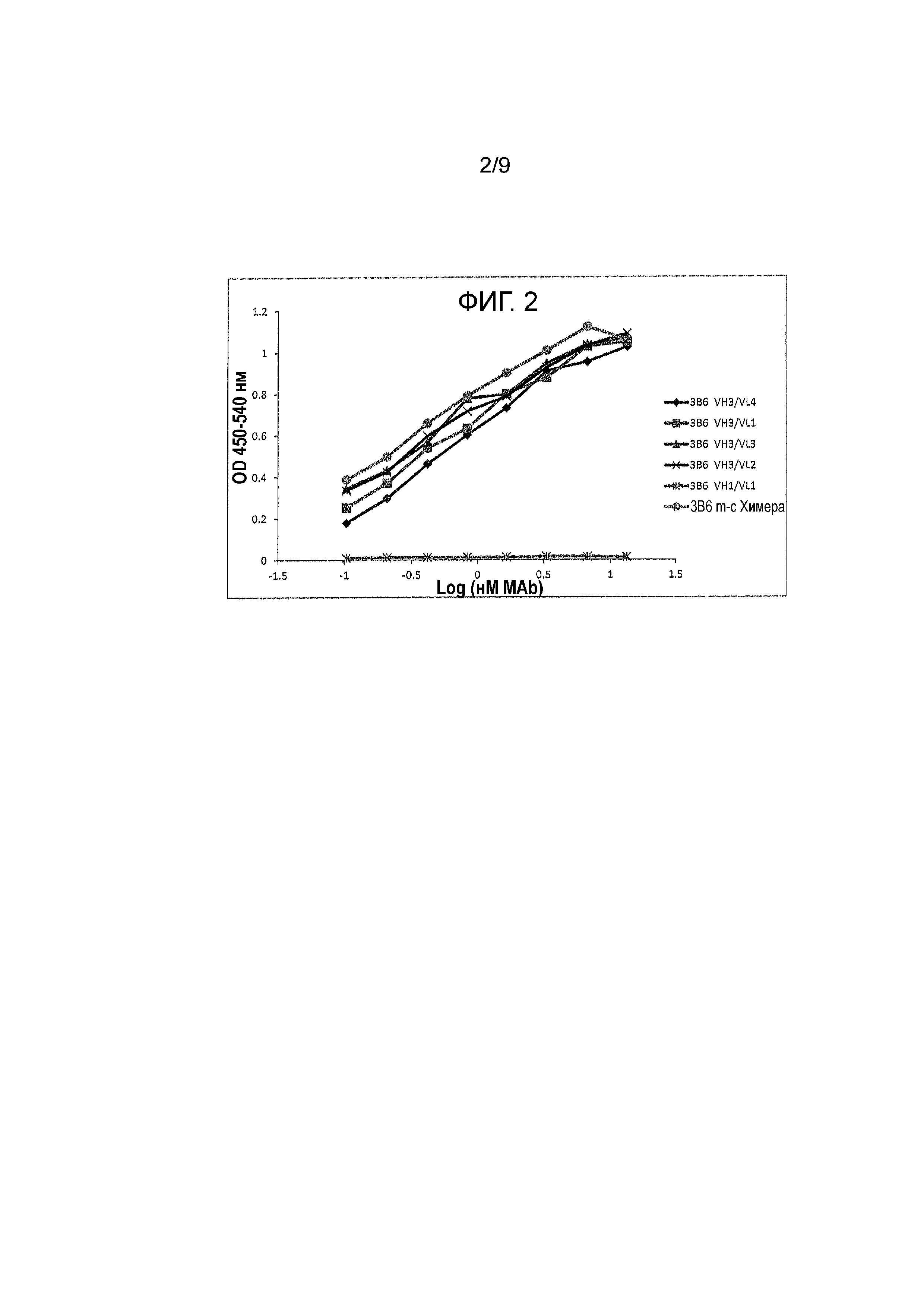
Фигура 2 - реактивность канинизированных mAbs против собачьего PD-1, экспрессированного на поверхности клеток. Протестировали различные мышиные mAbs на их связывание с собачьим PD-1, экспрессированным на CHO клетках при использовании CELISA как функцию OD 450/540 от log mAb (nM). Шесть протестированных mAbs были указаны, как: 3B6 VH3/VL4, 3B6 VH3/VL1, 3B6 VH3/VL3, 3B6 VH3/VL2, 3B6 VH1/VL1 и 3B6 m-c Chimera.
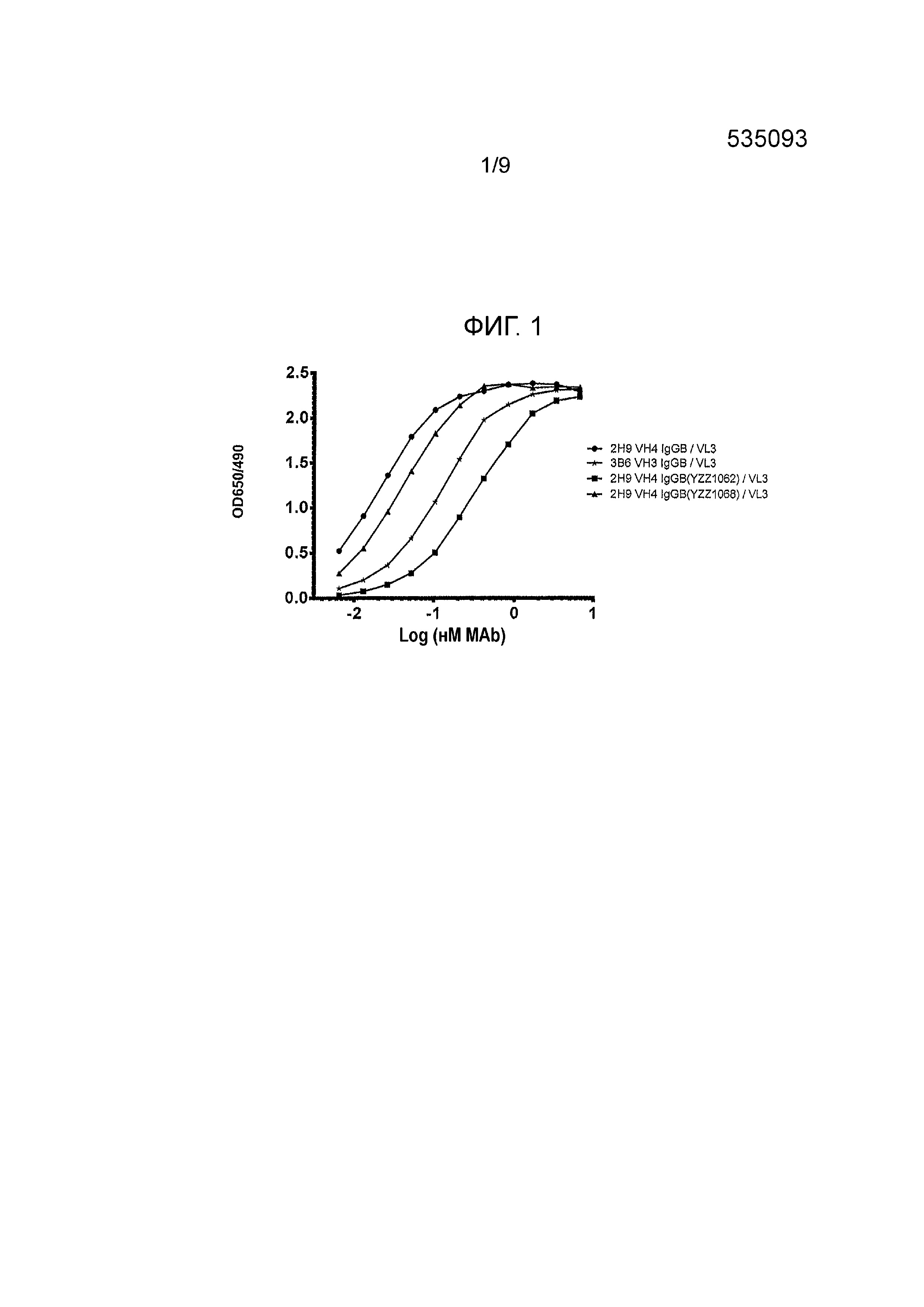
Фигура 3 - блокирование лиганда канинизированными mAbs против собачьего PD-1. Протестировали различные канинизированные mAbs на способность ингибировать связывание PD-1, экспрессированного на CHO клетках с PD- L1 как функции OD 450/540 от log mAb (nM). Протестировали шесть mAbs, обозначенные как: 3B6 VH3/VL4, 3B6 VH3/VL1, 3B6 VH3/VL3, 3B6 VH3/VL2, 3B6 VH1/VL1 и 3B6 m-c Chimera.
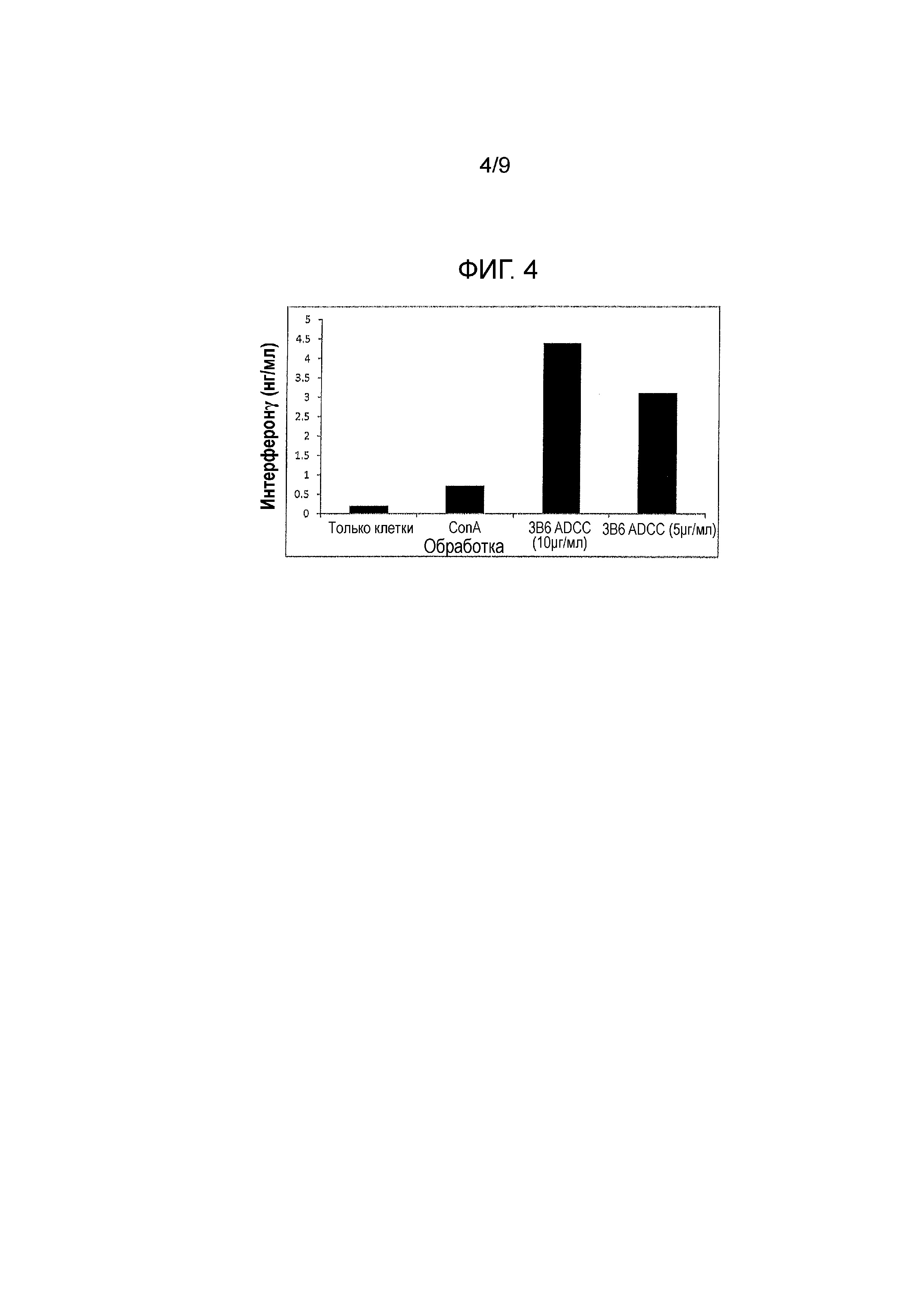
Фигура 4 - секреция цитокина, индуцированная канинизированными mAbs против собачьего PD-1. Протестировали различные канинизированные mAbs и их варианты на способность индуцировать секрецию цитокина PBMC у здоровых собак.
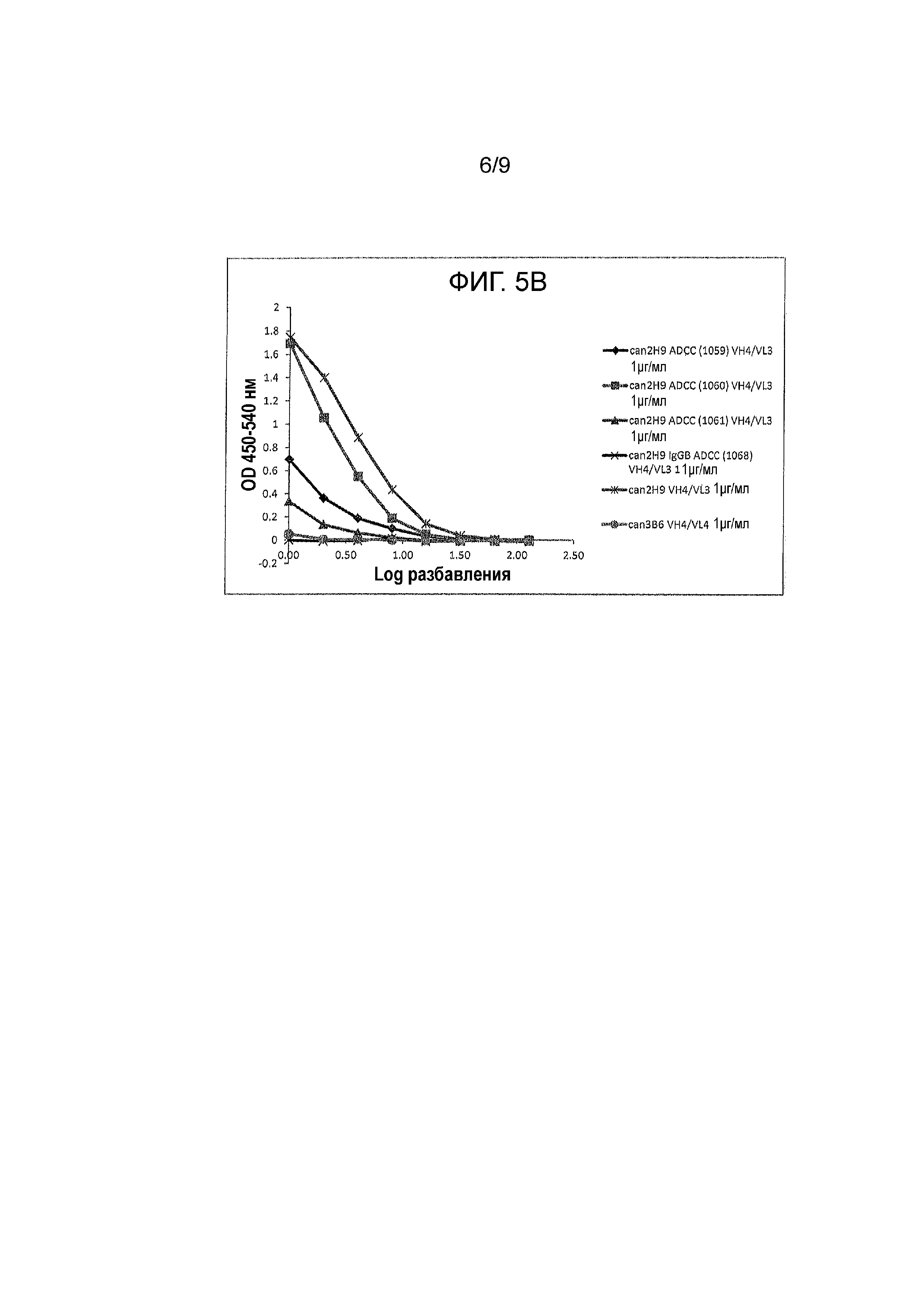
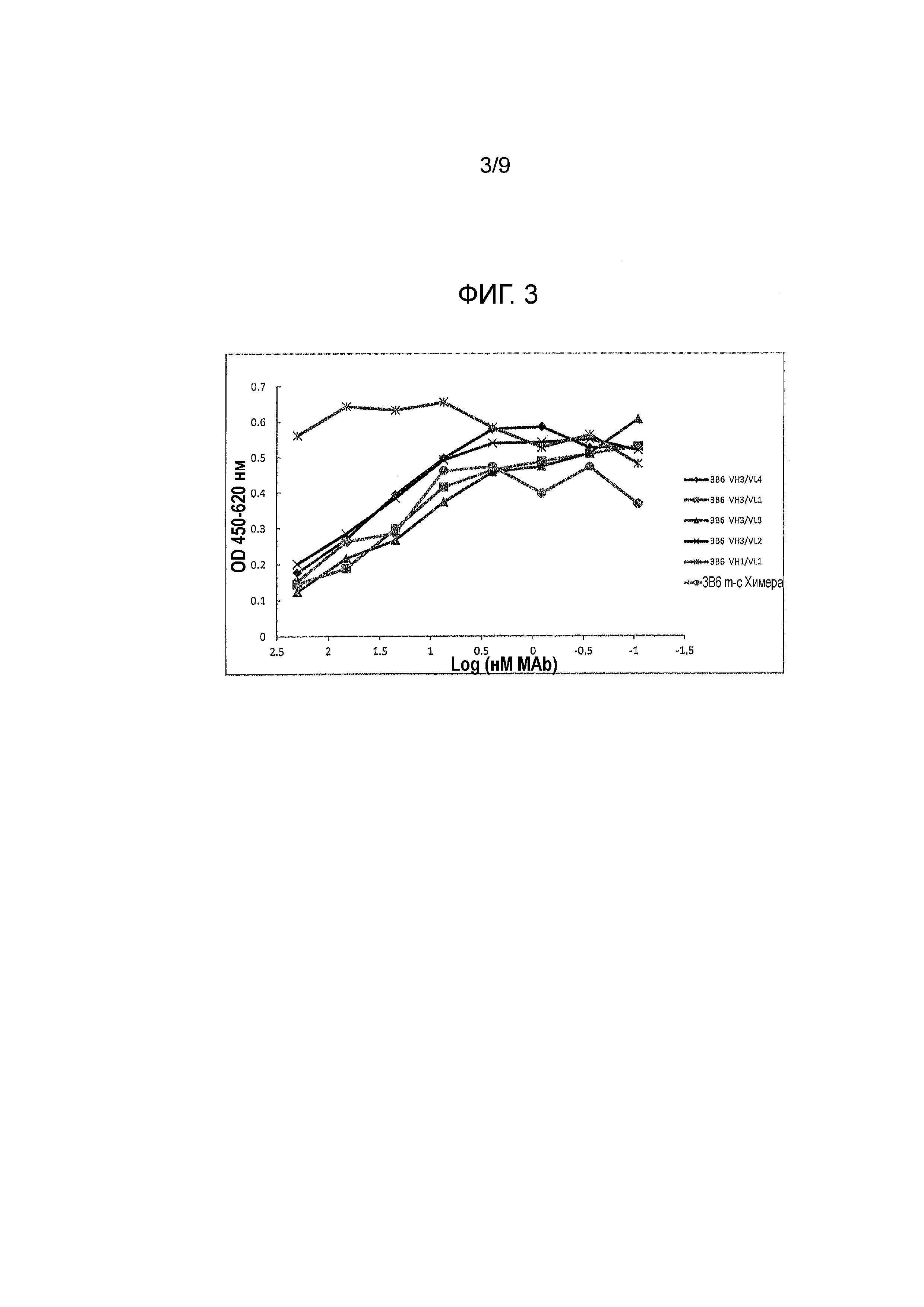
Фигура 5A и 5B - связывание канинизированных mAbs и их вариантов (при начальной 1 μг/мл) с FcγRI. Протестировали различные mAbs на их способность связываться с FcRI. Антитела обозначили как: can 2H9 ADCC (1062) VH4/VL3, can 2H9 ADCC mut 1 VH4/VL3, can 2H9 ADCC mut 2 VH4/VL3, can 2H9 IgGD VH4/VL3, can 2H9 VH4/VL3 и can 3B6 VH4/VL4 на Фигуре 5A; и can 2H9 ADCC (1059) VH4/VL3, can 2H9 ADCC (1060) VH4/VL3, can 2H9 ADCC (1061) VH4/VL3, can 2H9 IgGB ADCC (1068) VH4/VL3, can 2H9 VH4/VL3 и can 3B6 VH4/VL4 на Фигуре 5B.
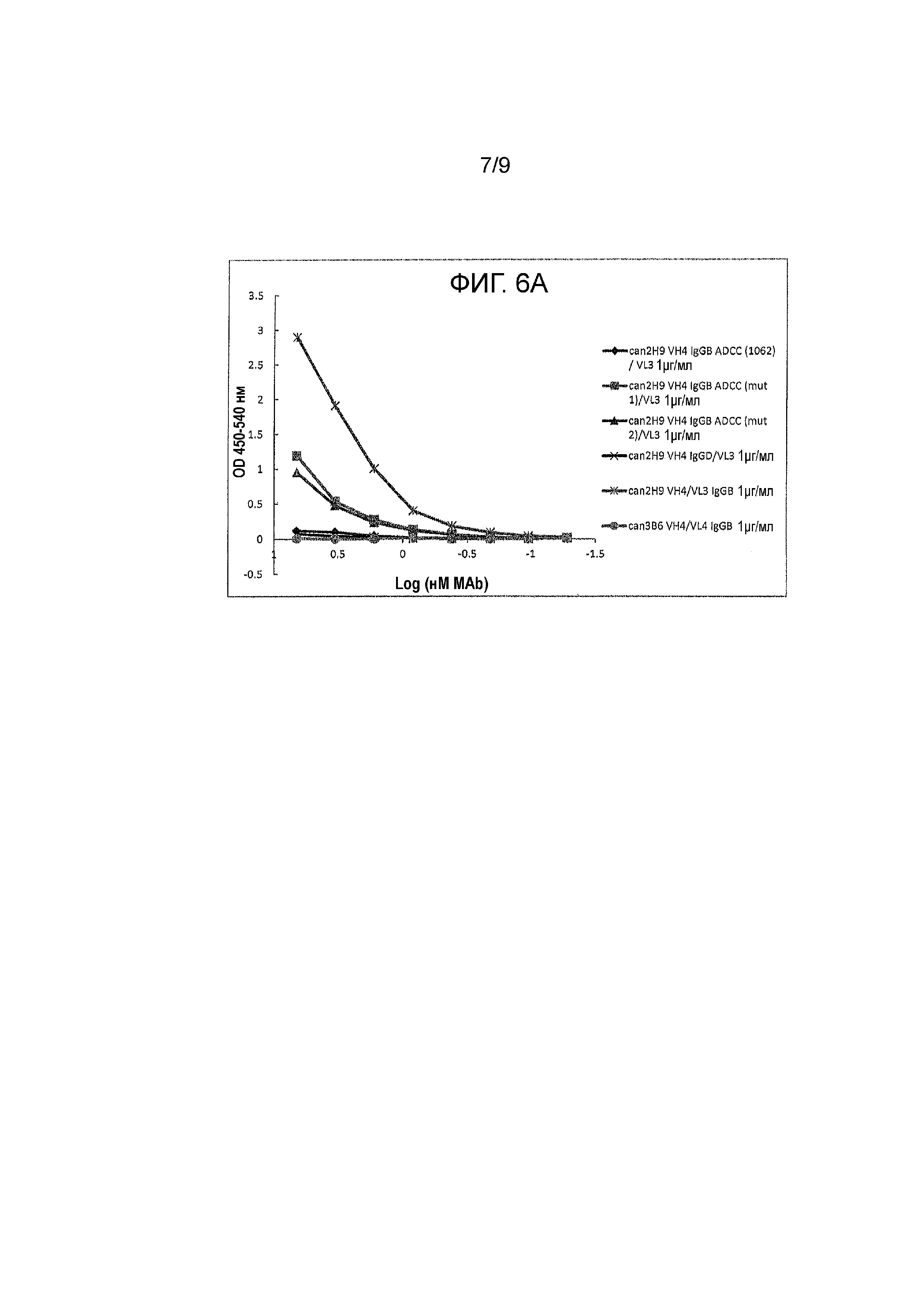
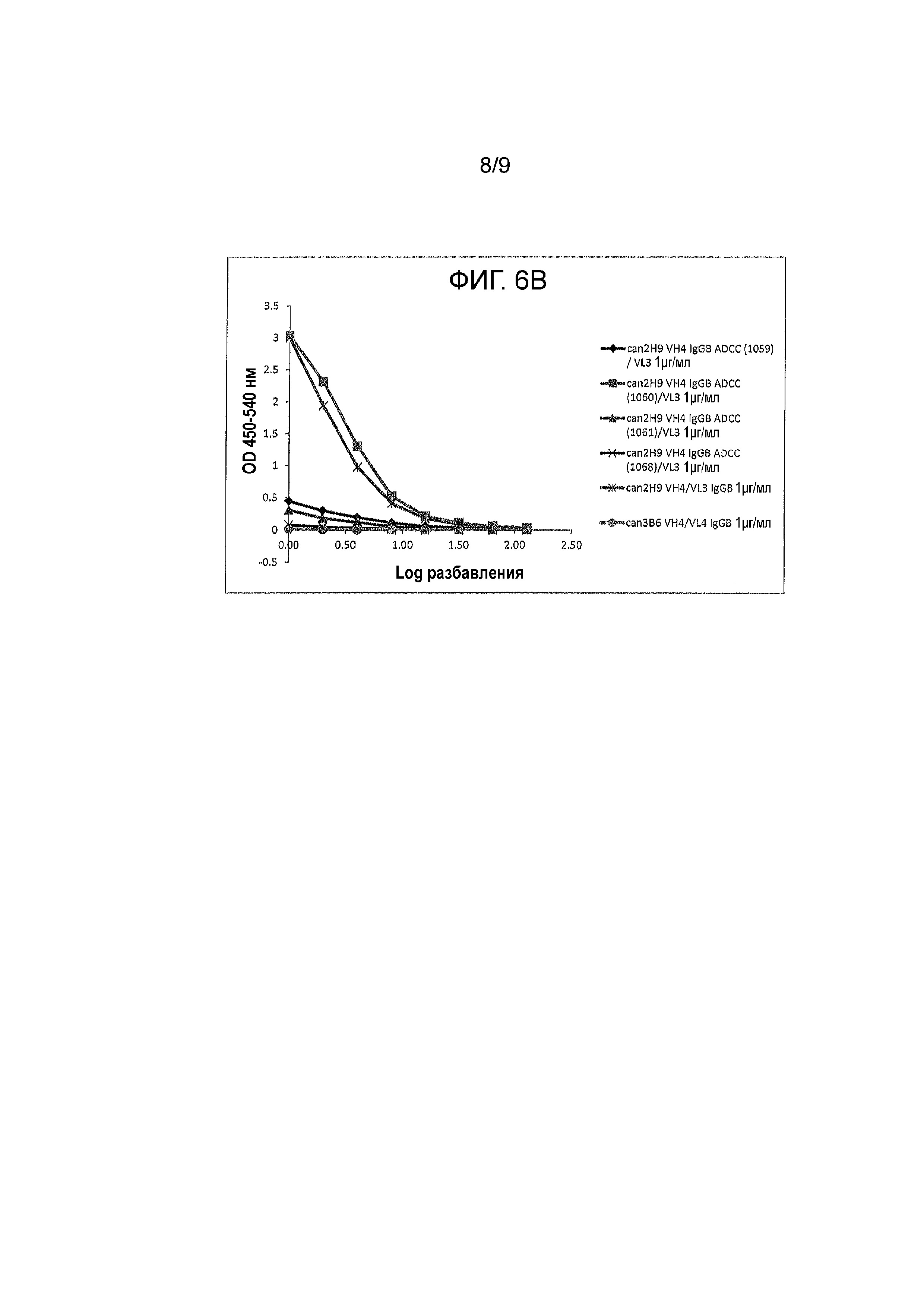
Фигура 6A и 6B - связывание канинизированных mAbs и их вариантов (при начальной 1 μг/мл) с C1Q. Протестировали различные mAbs на их способность связываться с C1Q. Антитела обозначили как: can 2H9 VH4 IgGB ADCC (1062) /VL3, can 2H9 VH4 IgGB ADCC (mut 1)/VL3, can 2H9 VH4 IgGB ADCC (mut 2)/VL3, can 2H9 VH4 IgGD/VL3, can 2H9 VH4/VL3 и can 3B6 VH4/VL4 IgGB на Фигуре 6A; и can 2H9 VH4 IgGB ADCC (1059) /VL3, can 2H9 VH4 IgGB ADCC (1060)/VL3, can 2H9 VH4 IgGB ADCC (1061)/VL3, can 2H9 VH4 IgGB ADCC (1068)/VL3, can 2H9 VH4/VL3 IgGB и can 3B6 VH4/VL4 IgGB на Фигуре 6B.
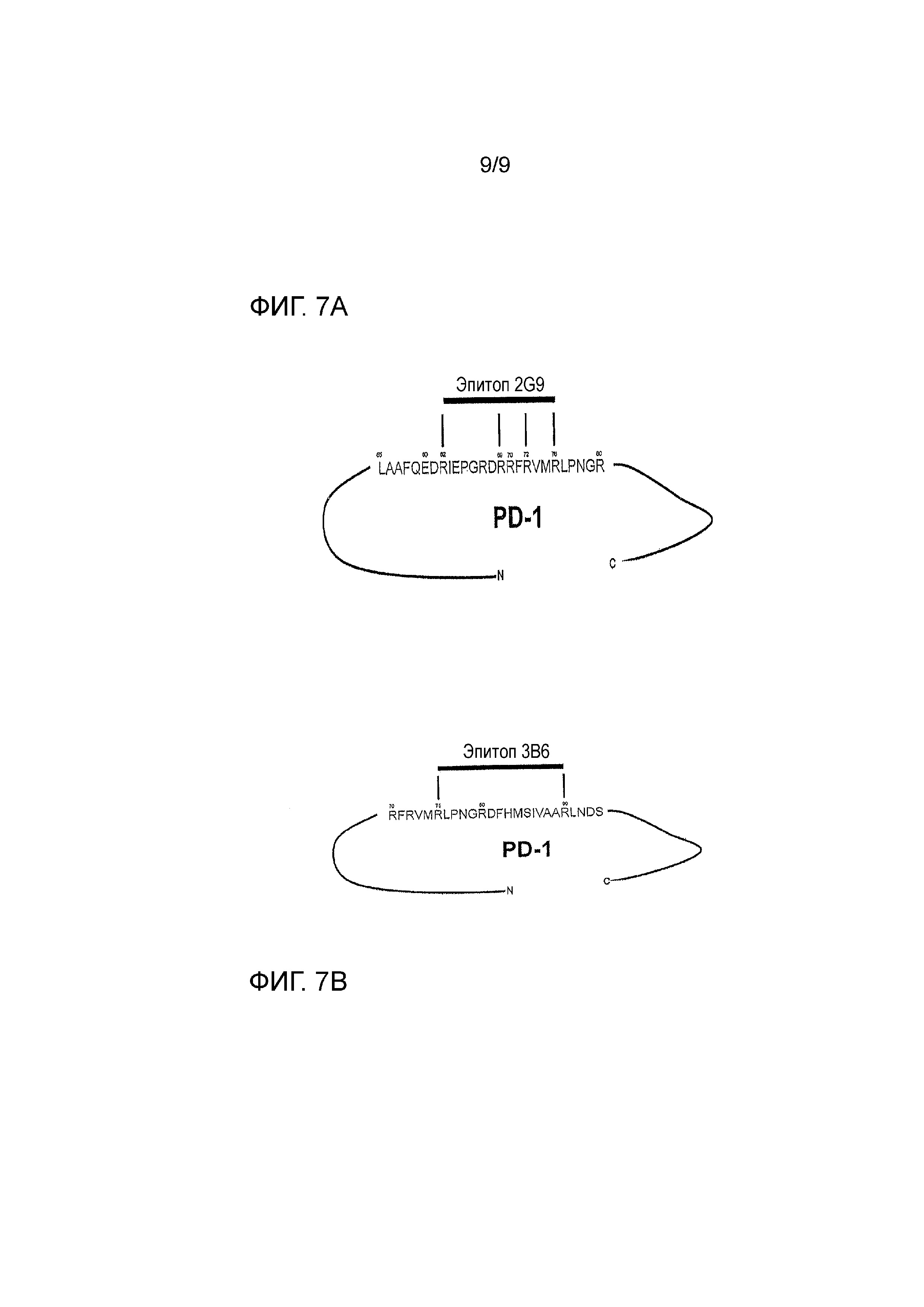
Фигура 7A - характеристика области контакта собачьего PD-1 и канинизированного антитела 2G9. Положение аминокислот приведено относительно аминокислотной последовательности PD-1 без сигнальной последовательности, то есть SEQ ID NO: 114. Определение провели при использовании химического перекрестного сшивания, матрично-активированной лазерной десорбции-ионизации в комбинации с детектором частиц с высокой массой и в сочетании с масс-спектрометрией (High-Mass MALDI mass spectrometry) и не линейной хроматографии с орбитальной ионной ловушкой в сочетании с масс- спектрометрией (nLC-Orbitrap mass spectrometry).
Фигура 7B - характеристика области контакта собачьего PD-1 и канинизированного антитела 3B6. Положение аминокислот приведено относительно аминокислотной последовательности PD-1 без сигнальной последовательности, то есть SEQ ID NO: 114. Определение провели при использовании химического перекрестного сшивания, матрично-активированной лазерной десорбции-ионизации в комбинации с детектором частиц с высокой массой и в сочетании с масс-спектрометрией (High-Mass MALDI mass spectrometry) и не линейной хроматографии с орбитальной ионной ловушкой в сочетании с масс-спектрометрией (nLC-Orbitrap mass spectrometry).
ПОДРОБНОЕ ОПИСАНИЕ
Сокращения
В подробном описании и примерах настоящей патентной заявки используются следующие сокращения:
ADCC Антитело-зависимая клеточная цитотоксичность
CDC Комплимент-зависимая цитотоксичность
CDR Определяющая комплементарность область в вариабельных областях иммуноглобулина, определенных для человеческих антител при использовании номенклатуры Кэбота
CHO Яичник китайского хомячка
EC50 концентрация, обеспечивающая 50% эффективность или связывание
ELISA Иммуносорбентный анализ с ферментной меткой
FR Каркасный участок антитела: вариабельные области иммуноглобулина, исключая CDR области.
HRP Пероксидаза хрена
IFN Интерферон
IC50 концентрация, обеспечивающая 50% ингибирование
IgG Иммуноглобулин G
Kabat Выравнивание иммуноглобулина и номенклатура человеческих антител, введенные Elvin A. Kabat [Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]
mAb Моноклональное антитело (также Mab или MAb)
MES 2-(N-морфолино)этансульфоновая кислота
MOA Механизм действия
NHS Сыворотка здорового человека
PCR Полимеразная цепная реакция
PK Фармакокинетика
SEB Энтеротоксин B стафилококка
TT Столбнячный токсин
V область Сегмент цепей человеческого IgG, последовательность которого у различных антител вариабельны. Он располагается до 109 остатка по Кэботу в легкой цепи и до 113 остатка в тяжелой цепи.
VH Вариабельный участок тяжелой цепи иммуноглобулина
VK Вариабельный участок каппа легкой цепи иммуноглобулина
ОПРЕДЕЛЕНИЯ
Для лучшего понимания настоящего изобретения ниже приведены некоторые технические и научные термины. Если в этом документе ясно не указано иное, все другие технические и научные термины, используемые в описании настоящей патентной заявки, имеют значение общепринятое в области техники, к которой относится настоящее изобретение.
Используемые в описании настоящей патентной заявки формы единственного числа включают и множественное число, если в контексте ясно не просматривается иное.
«Активация» в отношении клеток или рецепторов относится к активации или воздействию лигандов на клетку или рецептор, если из контекста не просматривается иное, или ясно не указано иное. «Лиганд» включает в объем понятия натуральные и синтетические лиганды, например, цитокины, варианты цитокинов, аналоги, мутантные белки и связывающие соединения, полученные из антител. «Лиганд» также включает в объем понятия малые молекулы, например, пептидные миметики цитокинов и пептидные миметики антител. «Активация» может относиться к клеточной активации, как регулируемой внутренними механизмами, наряду с внешними факторами или факторами окружающей среды.
«Активность» молекулы может описываться или относиться к связыванию молекулы с лигандом или рецептором, каталитической активности; к способности стимулировать генную экспрессию или сигнальной системе клетки, дифференцировке или созреванию; к антигенной активности, модуляции активностей других молекул и аналогичному им. «Активность» молекулы может также относиться к активности в модулируемых или поддерживаемым взаимодействиям клетка-клетка, например, адгезия, или активности в сохранении структуры клетки, клеточных мембран или цитоскелета. «Активность» также может означать специфическую активность, например, [каталитическая активность]/[мг белка], или [иммунологическая активность]/[мг белка], концентрация в биологическом компартменте, или аналогичное им. «Активность» может относиться к модуляции компонентов врожденной или адаптивной иммунных систем.
«Введение» или «лечебное воздействие» в отношении животного, например, подопытного, относящегося к собачьим, клетки, ткани, органа или биологической жидкости относится к контакту экзогенного фармацевтического, терапевтического, диагностического агента или композиции с животным, например, субъектом, относящимся к собачьим, клеткой, тканями, органом или биологической жидкостью. Воздействие на клетку включает контакт реагента с клеткой, наряду с контактом реагента с жидкостью, где жидкость находится в контакте с клеткой. «Введение» и «лечебное воздействие» также означает in vitro и ex vivo воздействие, например, на клетку реагентом, диагностическим соединением, связывающим соединением или другой клеткой.
Используемый в описании настоящей патентной заявки термин «субъект» включает в объем понятия любой организм, предпочтительно животное, более предпочтительно млекопитающее (например, относящееся к собачьим, кошачьим или человеку) и наиболее предпочтительно относящийся к собачьим.
Используемый в описании настоящей патентной заявки термин «относящийся к кошачьим» относится к любому члену семейства кошачьих. Члены этого семейства включают диких, содержащихся в зоопарках и домашних членов, таких как любой член из подсемейства кошачьих, например, кошки, львы, тигры, пумы, ягуары, леопарды, снежные леопарды, пантеры, североамериканские горные львы, гепарды, рыси, рыжие рыси, каракалы и любые их гибриды. Кошки также включают домашних кошек, чистопородных и/или беспородных кошек-компаньонов, выставочных кошек, лабораторных кошек, клонированных кошек и диких или бродячих кошек.
Используемый в описании настоящей патентной заявки термин «замещение аминокислотного остатка» другим аминокислотным остатком в аминокислотной последовательности является эквивалентом «замена аминокислотного остатка» другим аминокислотным остатком и означает, что конкретный аминокислотный остаток в специфической позиции в аминокислотной последовательности замещается (или заменяется) на отличающуюся аминокислоту. Например, одно такое замещение (замена) обозначается как P4A Fc области аминокислотной последовательности IgGB или IgGC, в таком случае остаток пролина в позиции 4 аминокислотной последовательности Fc области IgGB или Fc области IgGC замещен на (заменен) остатком аланина.
Соответственно, такие аминокислотные замещения могут быть разработаны специально, то есть целенаправленное замещение аланина серином в специфической позиции в аминокислотной последовательности, например, при использовании технологии рекомбинантной ДНК. В качестве альтернативы, конкретный аминокислотный остаток или ряд аминокислотных остатков антитела могут быть замещены одним или более аминокислотным остатком при использовании более естественных процессов отбора, например, на основе способности антитела, продуцируемого клеткой, связываться с заданной областью такого антигена, например, таковой, содержащей эпитоп или его часть, и/или для включения в антитело конкретной CDR, которая сохраняет такую же каноническую структуру, как и замещаемая CDR. Такие замещения/замены могут привести к «варианту» CDRs и/или антител.
«Лечение» или «лечебное воздействие» означает введение терапевтического агента, такого как композиция, содержащая любое антитело или его антигенсвязывающие фрагменты по настоящему изобретению, внутренне или внешне субъекту, относящемуся к собачьим или пациенту, имеющему один или более симптом заболевания или предрасположенному к возникновению заболевания, для которого терапевтический агент имеет терапевтическую активность.
Как правило, агент вводят в количестве, эффективном для облегчения и/или улучшения одного или более симптома заболевания у лечимого субъекта или популяции, либо за счет индуцирования регрессии, либо за счет ингибирования прогрессирования такого симптома(ов) в любой клинически измеримой степени. Количество терапевтического агента, которое является эффективным для облегчения любого конкретного симптома заболевания (также указанное как «терапевтически эффективное количество»), может варьировать согласно факторам, таким как стадия заболевания, возраст и масса субъекта (например, относящегося к собачьим), и способности фармацевтической композиции вызвать заданный ответ у субъекта. Облегчение или улучшение симптомов заболевания может быть оценено при использовании любого клинического измерения, как правило используемого ветеринарами или другими медицинскими работниками, способными оценить тяжесть состояния или прогресс состояния такого симптома. Хотя вариант воплощения настоящего изобретения (например, способ лечения или изделие промышленного производства) может не быть эффективным в облегчении целевого симптома(ов) заболевания у каждого субъекта, это должно быть облегчение целевого симптома(ов) у статистически значимого числа субъектов, как определяется при использовании любого статистического теста, известного из предшествующего уровня техники, такого как параметрический t-критерий Стьюдента, критерий хи2, U-критерий Манна-Уитни, критерий Крускала-Уоллиса (H-критерий), критерий Джонкхиера- Терпстра и критерий Уилкоксона.
«Лечение» в отношении человека, ветеринарного субъекта (например, относящегося к собачьим) или субъекта, участвующего в исследованиях, относится к терапевтическому лечению, наряду с исследовательскими применениями и диагностическими применениями. «Лечение» в отношении человека, ветеринарного субъекта (например, относящегося к собачьим) или субъекта, участвующего в исследованиях или клетки, ткани, или органа включает контакт канинизированного антитела или антигенсвязывающих фрагментов по настоящему изобретению с относящемся к собачьим или другим субъектом-животным, клеткой, тканями, физиологическим компартментом или физиологической жидкостью.
Было обнаружено, что собачий PD- 1 содержит аминокислотную последовательность SEQ ID NO: 114 [Предварительная заявка на патент США № 61/918,946, поданная 20 декабря 2013, содержание которой введено здесь ссылкой в полном объеме]. В конкретном варианте воплощения настоящего изобретения собачий PD- 1 кодируется нуклеиновой кислотой, которая содержит нуклеотидную последовательность SEQ ID NO: 113.
Было обнаружено, что собачий PD- 1 содержит аминокислотную последовательность SEQ ID NO: 120 [Предварительная заявка на патент США № 61/918,946, поданная 20 декабря 2013, как указано выше]. В конкретном варианте воплощения настоящего изобретения собачий PD- L1 кодируется нуклеиновой кислотой, которая содержит нуклеотидную последовательность SEQ ID NO: 119.
Используемый в описании настоящей патентной заявки термин «иммунный ответ» относится к воздействию, например, лимфоцитов, антиген-презентирующих клеток, фагоцитов, гранулоцитов и растворимых макромолекул, продуцированных указанными выше клетками или печенью (включая антитела, цитокины, и комплемент), которые приводят к селективному повреждению, разрушению или элиминированию в организме млекопитающего (например, в организме относящегося к собачьим) раковых клеток, клеток или тканей, инфицированных патогенами или инвазированных патогенами.
Канинизированные антитела против собачьего антигена
Используемый в описании настоящей патентной заявки термин «относящийся к собачьим» включает в объем понятия всех домашних собак, животных семейства волчьих или семейства собачьих, если не указано иное.
Как известно антитело специфически связывается с полипептидом, содержащим заданную антигенную последовательность (в этом случае часть аминокислотной последовательности собачьего антигена, например, собачий PD -1), если оно связывается с полипептидом, содержащим эту часть аминокислотной последовательности собачьего антигена, например, собачий PD-1, то не связывается с другими собачьими белками, у которых отсутствует часть последовательности собачьего антигена, например, собачьего PD-1. Например, антитело, которое специфически связывается с полипептидом, содержащим собачий PD-1 может связываться с FLAG®-меченной формой собачьего PD-1, но не связывается специфически с другими FLAG®-меченными собачьими белками. Антитело или связывающее соединение, полученное из антигенсвязывающего участка антитела, «специфически» связывается с собачьим антигеном или его вариантом, или его мутантными белками, когда оно имеет сродство с таковым собачьим антигеном или его вариантом, или его мутантными белками, которое по меньшей мере в десять раз больше, более предпочтительно по меньшей мере в 20 раз больше, и еще более предпочтительно по меньшей мере в 100 раз больше, чем его сродство с любым другим тестируемым собачьим антигеном.
Используемый в описании настоящей патентной заявки термин «антитело» относится к любой форме антитела, которая демонстрирует заданную биологическую активность. Следовательно, он используется в самом широком смысле и конкретно включает в объем понятия без ограничения моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), канинизированные антитела, полностью собачьи антитела, химерные антитела и однодоменные камелизованные антитела. «Родительские антитела» представляют антитела, полученные воздействием иммунной системы на антиген перед модификацией антитела для предполагаемого использования, такого как канинизация антитела для применения в качестве собачьего терапевтического антитела.
Используемый в описании настоящей патентной заявки термин, если не указано иное, «фрагмент антитела» или «антигенсвязывающий фрагмент» относится к антигенсвязывающим фрагментам антитела, то есть фрагментам антитела, которые сохранили способность специфически связываться с антигеном, связанным полноразмерным антителом, например фрагменты, которые сохранили одну или более CDR область. Примеры антигенсвязывающих фрагментов включают без ограничения Fab, Fab', F(ab')2 и Fv фрагменты; диатела; линейные антитела; молекулами одноцепочечных антител, например, sc-Fv; нанотела и мультиспецифические антитела, образованные из фрагментов антител.
«Fab фрагмент» состоит из одной легкой цепи и CH1, и вариабельных участков одной тяжелой цепи. Молекула Fab тяжелой цепи не может образовывать дисульфидную связь с другой молекулой тяжелой цепи. «Fab фрагмент» может представлять продукт расщепления антитела папаином.
«Кристаллизуемый фрагмент» («Fc») области содержит два фрагмента тяжелой цепи (то есть два идентичных полипептида), содержащих CH2 и CH3 домены антитела. Два фрагмента тяжелой цепи удерживаются вместе двумя или более дисульфидными связями и гидрофобными взаимодействиями доменов CH3. В настоящем изобретении аминокислотная последовательность каждого из четырех Fc фрагментов собачьего IgG располагается на определенной границе доменов CH1 и CH2, как определено Tang et al. [Vet. Immunol. Immunopathol. 80: 259-270 (2001)].
«Fab' фрагмент» содержит одну легкую цепь и часть или фрагмент одной тяжелой цепи, которая содержит VH домен и CH1 домен, также область между CH1 и CH2 доменами, таким образом, что между двумя Fab' фрагментами тяжелой цепи может быть образована межцепьевая дисульфидная связь с образованием молекулы F(ab')2.
«F(ab')2 фрагмент» содержит две легких цепи и две тяжелых цепи, содержащие часть константной области между CH1 и CH2 доменами, таким образом, что между двумя тяжелыми цепями образуется межцепьевая дисульфидная связь. Следовательно, F(ab')2 фрагмент состоит из двух фрагментов Fab', которые удерживаются вместе дисульфидной связью между двумя тяжелыми цепями. «F(ab')2 фрагмент» может представлять продукт расщепления пепсином антитела.
«Fv область» содержит вариабельные области обеих, и тяжелой и легко цепи, но не содержат константные области.
Используемый в описании настоящей патентной заявки термин «одноцепочечный Fv» или «scFv» антитела относится к фрагментам антител, содержащим VH и VL домены антител, где эти домены присутствуют в единственной полипептидной цепи. Как правило, полипептидный Fv дополнительно содержит полипептидный линкер между VH и VL доменами, которые позволяют scFv образовывать заданную структуру для антиген-связывания. [Смотрите, Pluckthun, THE PHARMACOLOGY OF MONOCLONAL ANTIBODIES, vol. 113 Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); WO 88/01649; и США 4,946,778 и США 5,260,203.]
Используемый в описании настоящей патентной заявки термин «каноническая структура» относится к локальной конформации, которая может быть адаптирована для каждой гипервариабельной области тяжелой и легкой цепи антитела в каркасе, в котором они находятся. Для каждой гипервариабельной области существует небольшое число канонических структур (как правило, обозначаются простыми числами, таким как 1 или 2, и тому подобными), которое может быть спрогнозировано с высокой точностью по аминокислотным последовательностям соответствующей гипервариабельной области (в частности в контексте аминокислотной последовательности этого каркаса, как приведено ниже для соответствующих вариабельных доменов канонизированного мышиного антитела против собачьего PD-1). Эти канонические структуры могут быть определяющими относительно того, приведет ли модификация аминокислотной последовательности заданной CDR в результате к сохранению или к потере способности связываться с его антиген-связывающим партнером [Смотрите, Chothia and Lesk, Canonical Structures for the hypervariable regions of immunoglobulins, J. Mol. Biol. 196:901-917(1987); Chothia et al., Conformation of immunoglobulin hypervaribale regions, Nature, 34:877-883(1989); and Al-Lazikani et al., Standard Conformations for the canonical structures of immunoglobulins, J. Mol. Biol. 273:927-948 (1997)].
«Домен антитела» представляет иммунологически функциональный фрагмент иммуноглобулина, содержащий только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях, две или более VH области ковалентно связаны с пептидным линкером с образованием домена бивалентного антитела. Две VH области домена бивалетного антитела могут быть нацелены на идентичные или различные антигены.
«Бивалентное антитело» содержит два антигенсвязывающих участка. В некоторых случаях два сайта связывания обладают идентичной антиген-специфичностью. Однако бивалентные антитела могут быть биспецифическими (смотрите, ниже).
В некоторых вариантах воплощения настоящего изобретения моноклональные антитела по настоящему изобретению также включают однодоменные камелизованные антитела. [Смотрите, например, Muyldermans et al., Trends Biochem. Sci. 26:230 (2001); Reichmann et al., J. Immunol. Methods 231:25 (1999); WO 94/04678; WO 94/25591; U.S. 6,005,079]. В одном варианте воплощения настоящее изобретение обеспечивает однодоменные антитела, содержащие два VH домена с модификациями, таким образом, что образуются однодоменные антитела.
Используемый в описании настоящей патентной заявки термин «диатела» относится к малым фрагментам антител с двумя участками связывания антигенов, такие фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (VH-VL или VL-VH). Использование линкера, который является слишком коротким, позволяет объединить два домена одной и той же цепи, домены вынуждены соединяться с комплементарными доменами другой цепи и создают два участка связывания антигенов. [Смотрите, EP 0 404 097 B1; WO 93/11161; and Holliger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)]. Для обзора сконструированных вариантов антител [смотрите, Holliger and Hudson Nat. Biotechnol. 23:1126-1136 (2005)].
Как правило, антитело или антигенсвязывающий агент по настоящему изобретению сохраняет по меньшей мере 10% своей связывающей активности собачьего PD-1 (по сравнению с родительским антителом), когда активность выражается в молях. Предпочтительно антитело или антигенсвязывающий агент по настоящему изобретению сохраняет по меньшей мере 20%, 50%, 70%, 80%, 90%, 95% или 100% или более аффинности связывания собачьего антигена, (например, PD-1) по сравнению с родительским антителом. Также предполагается, что канинизированное антитело или антиген-связывающий фрагмент по настоящему изобретению могут включать консервативные или не консервативные аминокислотные замещения (указанные, как «консервативные варианты» или «варианты консервативных функций» антитела), которые по существу не изменяют их биологическую активность.
«Выделенное антитело» относится к статусу очистки и в таком контексте означает молекулу по существу свободную от других биологических молекул, таких как нуклеиновые кислоты, белки, липиды, углеводы или другой материал, такой как продукт распада клеток и ростовая среда. Как правило, используемый в описании настоящей патентной заявки термин «выделенный» относится к полному отсутствию такого материала или к отсутствию воды, буферов или солей, если они не присутствуют в количествах по существу препятствующим экспериментальному или терапевтическому применению приведенного в описании настоящей патентной заявки связывающего соединения.
Используемый в описании настоящей патентной заявки термин «химерное антитело» относится к антителу, имеющему вариабельный домен от первого антитела и константный домен от второго антитела, где первое и второе антитела относятся к различным видам. [США 4,816,567; and Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)]. Как правило, вариабельные домены получают из антител от экспериментального животного («родительское антитело»), такого как грызун, а последовательности константного домена получают из антитела животного-субъекта, например, относящегося к собачьим, таким образом, полученное в результате химерное антитело будет с меньшей вероятностью вызывать нежелательный иммунный ответ у субъекта, относящегося к собачьим, по сравнению с родительским (например, грызуна) антителом.
Используемый в описании настоящей патентной заявки термин «канинизированное антитело» относится к формам антитела, которые содержат последовательности от обоих, и от относящегося к собачьим и от не относящегося к собачьим (например, относящиеся к мышиным) антителам. Традиционно канинизированное антитело содержит по существу все из, по меньшей мере один, и как правило, два вариабельных домена, в котором все или по существу все гипервариабельные петли, соответствуют таковым не собачьего иммуноглобулина (например, содержащего 6 CDRs мышиного антитела против собачьего PD-1, как приведено в качестве примера ниже), все или по существу все из каркаса, относящегося к собачьим.
Используемый в описании настоящей патентной заявки термин «полностью собачье антитело» относится к антителу, которое содержит только последовательности белка иммуноглобулина, относящегося к собачьим. Полностью собачье антитело может содержать углеводные цепи, в случае, когда они получены в мыши, в клетке мыши или в гибридоме, полученной из мышиной клетки. Аналогично «мышиное антитело» относится к антителу, которое содержит только последовательности мышиного иммуноглобулина. В качестве альтернативы, полностью собачье антитело может содержать крысиные углеводные цепи, в случае, когда они получены в крысе, в клетке крысы или в гибридоме, полученной из крысиной клетки. Аналогично «крысиное антитело» относится к антителу, которое содержит только последовательности крысиного иммуноглобулина.
Вариабельные области каждой пары легкой/тяжелой цепи образуют сайт связывания антитела. Следовательно, как правило, интактное антитело имеет два сайта связывания. За исключением бифункционального или биспецифического антитела, где два сайта связывания являются, как правило, идентичными.
Как правило, вариабельные домены обеих, и тяжелой и легкой цепи содержат три гипервариабельные области, которые также называются областями, определяющими комплементарность (CDRs), расположенными в относительно консервативных областях каркаса (FR). CDRs, как правило, фланкированы областями каркаса, позволяющими связываться со специфическим эпитопом. Как правило, от N-конца до C-конца вариабельные домены обеих, и легкой и тяжелой цепи содержат FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Соотнесение аминокислот к каждому домену для человеческого антитела, как правило, находится в соответствии с определениями Sequences of Proteins of Immunological Interest, Kabat, et al.; National Institutes of Health, Bethesda, Md. ; 5th ed.; NIH Publ. No. 91-3242 (1991); Kabat, Adv. Prot. Chem. 32:1-75 (1978); Kabat, et al., J. Biol. Chem. 252:6609-6616 (1977); Chothia, et al., J. Mol. Biol. 196:901-917 (1987) or Chothia, et al., Nature 342:878-883 (1989)].
Используемый в описании настоящей патентной заявки термин «гипервариабельная область» относится к аминокислотным остаткам антитела, которые ответственны за антиген-связывание. Гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплиментарность» или «CDR» (то есть, CDRL1, CDRL2 и CDRL3, в вариабельном домене легкой цепи и CDRH1, CDRH2 и CDRH3 в вариабельном домене тяжелой цепи). [Смотрите, Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), definining the CDR regions of a human antibody by sequence; see also Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987) defining the CDR regions of an antibody by structure]. Используемый в описании настоящей патентной заявки термин «каркасные» или «FR» остатки относится к таковым остаткам вариабельного домена иным, чем остатки гипервариабельной области, определенные в описании настоящей патентной заявки, как CDR остатки.
Используемый в описании настоящей патентной заявки термин «собачий каркас» относится к аминокислотной последовательности тяжелой цепи и легкой цепи собачьего антитела иной, чем остатки гипервариабельной области, определенные в описании настоящей патентной заявки, как CDR остатки. В обеих цепях аминокислотные последовательности нативных собачьих CDRs замещены соответствующими привнесенными CDRs (например, таковыми из мышиного антитела). Необязательно тяжелые и/или легкие цепи собачьего антитела могут содержать некоторые привнесенные не CDR остатки, например, сохраняя, таким образом, конформацию привнесенных в собачье антитело CDRs, и/или модифицируя Fc функцию, как приведено в качестве примера ниже.
Используемый в описании настоящей патентной заявки термин «антитело против собачьего PD-1» относится к антителу, которое было создано против собачьего PD-1 (у млекопитающих, таких как мышь или крыса) и которое специфически связывается с собачьим PD-1. Антитело, которое «специфически связывается с собачьим PD-1», или антитело, которое «специфически связывается с полипептидом, содержащим аминокислотную последовательность SEQ ID NO: 114», представляет антитело, которое демонстрирует преферентивное связывание с собачьим PD-1 по сравнению с другими антигенами, например, «специфическое» связывание с собачьим PD-1. Связывание не требует абсолютной специфичности связывания. Антитело против собачьего PD-1 считается «специфичным» к собачьему PD-1, если его связывание является определено присутствием в образце собачьего PD-1, если оно способно изменять активность собачьего PD-1 без излишнего препятствования активности других молекул в образце, относящемся к собачьим, например, без приведения к нежелательным результатам, таким как ложноположительный результат в диагностическом контексте или побочные эффекты в терапевтическом контексте. Степень специфичности, необходимая для антитела против собачьего PD-1, может зависеть от предполагаемого использования антитела, и по меньшей мере определяется его пригодностью для использования в предполагаемых целях.
Соответственно, настоящее изобретение обеспечивает канинизированное антитело против собачьего PD-1 или его антигенсвязывающие фрагменты (включая в выделенной форме), которые связываются с собачьим PD-1 (например, специфически), и применение такого антитела или его фрагментов. В конкретных вариантах воплощения настоящее изобретение обеспечивает CDRs мышиного антитела против собачьего PD-1 из мышиных антител против собачьего PD-1, которые продемонстрировали оба, и связывание с собачьим PD-1, и блокирование связывания собачьего PD-1 по меньшей мере с одним его лигандом, например, собачьим PD-L1. Эти CDRs могут быть вставлены в модифицированный собачий каркас по настоящему изобретению с получением канинизированного мышиного антитела против собачьего PD-1, как приведено в качестве примера ниже в описании настоящей патентной заявки.
В частности «канинизированное мышиное антитело против PD-1» по настоящему изобретению относится к антителу, которое содержит три CDRs тяжелой цепи и три CDRs легкой цепи с образованием мышиного антитела против собачьего PD-1 вместе с собачьим каркасом или модифицированным собачьим каркасом. Модифицированный собачий каркас содержит одно или более изменение аминокислоты, как приведено в качестве примера ниже в описании настоящей патентной заявки, что дополнительно оптимизирует эффективность канинизированного антитела, например, усилены, снижены или элиминированы эффекторные свойства антитела для усиления его связывания с собачьим антигеном, например, собачьим PD-1, и/или усиления его способности блокировать связывание собачьего антигена, например, собачьего PD-1 с его природным партнером связывания (например, собачий PD-L1 в случае, когда антиген представляет собачий PD-1).
«Гомология» относится к сходству последовательности между двумя полинуклеотидными последовательностями или между двумя полипептидными последовательностями, когда они оптимально выровнены. Когда позиция в обоих из двух, сравниваемых последовательностей, занята идентичными основаниями или аминокислотной мономерной субъединицей, например, в случае, когда позиция в каждой из двух молекул ДНК занята аденином, то молекулы являются гомологичными в этой позиции. Процент гомологии является числом гомологичных позиций, разделенным на две последовательности, деленным на общее число сравниваемых позиций ×100. Например, в случае, когда 6 из 10 позиций в двух последовательностях совпадают или гомологичны при оптимальном выравнивании последовательностей, то две последовательности гомологичны на 60%. Как правило, сравнение проводят, когда две последовательности выравнены с достижением максимального процента гомологии.
«Выделенная молекула нуклеиновой кислоты» относится к геномной ДНК или РНК, mРНК, cДНК или синтетического происхождения или некой их комбинации, которая не связана со всеми или с частью полинуклеотида, в котором выделенный полинуклеотид находится в природе, или связан с полинуклеотидом, с которым он не связан в природе. Для целей настоящего изобретения следует понимать, что «молекула нуклеиновой кислоты, содержащая» конкретную нуклеотидную последовательность, не входит в интактные хромосомы. Выделенные молекулы нуклеиновой кислоты, «содержащие» специфические последовательности нуклеиновой кислоты, могут включать дополнительно к специфическим последовательностям, кодирующие последовательности вплоть до десяти или даже вплоть до двадцати или более других белков или их частей или фрагментов, или могут включать функционально связанные регуляторные последовательности, которые контролируют экспрессию кодирующей области указанных последовательностей нуклеиновой кислоты, и/или могут включать векторные последовательности.
Используемый в описании настоящей патентной заявки термин «контрольные последовательности» относится к ДНК последовательностям, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, подходящие для прокариотов, например, включают промотор, необязательно операторную последовательность и сайт связывания рибосом. Известно использование эукариотических клеток в качестве промоторов, сигналов полиаденирования полиаденилирования, и энхансеров.
Нуклеиновая кислота «функционально связана», когда она находится в функциональной связи с последовательностью другой нуклеиновой кислоты. Например, ДНК для предпоследовательности или секреторного лидера функционально связана с ДНК для полипептида, если он экспрессирован, как пребелок, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если это оказывает воздействие на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, «функционально связан» означает, что связанные ДНК последовательности являются перекрывающими sequences, и в случае секреторного линкера, перекрываются и в фазе считывания. Однако энхансеры не должны быть перекрывающимися. Связывание осуществляют лигированием в подходящих сайтах рестрикции. Если такие сайты отсутствуют, то используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с обычной практикой.
Используемые в описании настоящей патентной заявки термины «клетка», «клеточная линия» и «клеточная культура» взаимозаменяемы и все такие обозначения включают потомков. Следовательно, термины «трансформанты» и «трансформированные клетки» включают первичную клетку субъекта и культуры, полученные из нее, без учета количества переносов. Также понятно, что не все потомки будут иметь точное идентичное содержание ДНК в следствие преднамеренных или случайных мутаций. Включены мутировавшие потомки, которые имеют туже функцию или биологическую активность, как у прошедших отсев оригинально трансформированных клеток. Где предложены различные обозначения, будет ясно из контекста.
Используемый в описании настоящей патентной заявки термин «зародышевая последовательность» относится к не аранжированным последовательностям ДНК иммуноглобулина. Может быть использован любой подходящий источник не аранжированных последовательностей иммуноглобулина. Человеческие зародышевые последовательности могут быть получены, например, из баз данных зародышевых линий JOINSOLVER® на сайте the National Institute of Arthritis and Musculoskeletal and Skin Diseases of the United States National Institutes of Health. Мышиные зародышевые последовательности могут быть получены, например, как описано в Giudicelli et al. [Nucleic Acids Res. 33:D256-D261 (2005)].
Свойства канинизированного антитела
У относящихся к собачьим существует четыре тяжелые цепи IgG, указанные как A, B, C и D. Эти тяжелые цепи представляют четыре различных подкласса собачьего IgG, которые указаны, как IgGA, IgGB, IgGC и IgGD. ДНК и аминокислотные последовательности этих четырех тяжелых цепей были впервые идентифицированы Tang et al. [Vet. Immunol. Immunopathol. 80: 259-270 (2001)]. Аминокислотные последовательности и ДНК для этих четырех цепей также доступны из базы данных GenBank. Например, аминокислотная последовательность тяжелой цепи IgGТ имеет учетный номер AAL35301.1, IgGB имеет учетный номер AAL35302.1, IgGC имеет учетный номер AAL35303.1 и IgGD имеет учетный номер (AAL35304.1). Антитела собак также содержат два типа легких цепей, каппа и лямбда. Аминокислотная последовательность и ДНК этих легких цепей может быть получена из базы данных GenBank. Например, аминокислотная последовательность каппа легкой цепи имеет учетный номер ABY 57289.1, и лямбда легкой цепи имеет учетный номер ABY 55569.1. В настоящем изобретении аминокислотная последовательность для каждого из четырех Fc фрагментов собачьего IgG располагается на определенной границе доменов CH1 и CH2, как определено Tang et al., выше.
Разработка терапевтического моноклонального антитела представляет комплекс процессов, который влечет координацию совокупности действий для генерирования заданного антитела. Они включают оптимизацию специфичности антитела, аффиности, функциональной активности, уровня экспрессии в сконструированных клеточных линиях, долговременной стабильности, элиминации или усиления эффекторных функций и развитие коммерчески доступных способов получения и способов очистки. Принимая во внимание объекты настоящего изобретения независимо от способности активировать клетки иммунных систем человека, канинизированное или собачье моноклональное антитело против собачьего PD-1 оптимально имеет три дополнительных определяющих признака:
1. Отсутствие эффекторных функций, таких как антителозависимая цитотоксичность (ADCC) и комплиментзависимая цитотоксичность (CDC),
2. относительно длинный срок жизни in vivo; и
3. легкая очищаемость в большом масштабе при использовании промышленных стандартных технологий, таких как на основе хроматографии с белком A.
Ни один из встречающихся в природе подклассов собачьего IgG не удовлетворяет всем этим критериям. Например, IgGB может быть очищен при использовании белка A, но имеет высокий уровень ADCC активности. IgGC также имеет значительную ADCC активность. С другой стороны, IgGA слабо связывается с белком A, но имеет нежелательную ADCC активность. Дополнительно, ни IgGC, ни IgGD не могут быть очищены на колонках с белком A, хотя IgGD не имеет ADCC активности. Дополнительно IgGC имеет короткое время полужизни в кровяном русле, поскольку он не связывается с рецептором собачьего FcRn. Настоящее изобретение преодолевает эту трудность, обеспечивая модифицированное антитело собачьего IgG, специфическое к собачьим антигенам, например, собачьему PD-1; такое, как антитела с отсутствующими эффекторными функциями, такие как ADCC и CDC, и имеет относительно длинный срок полужизни, и может быть легко очищено при использовании промышленной стандартной хроматографии с белком A.
До настоящего времени не описывались генетически модифицированные собачьи IgGs, у которых отсутствуют обе, и DCC, и CDC эффекторные функции, и дополнительно они могут быть очищены при использовании хроматографии с белком A. Как приведено в описании настоящей патентной заявки, единственное замещение в позиции собачьего IgG, которое является аналогичным таковому в человеческом и мышином IgG, такое как N297A или D265A, не полностью элиминирует обе, и DCC, и CDC эффекторные функции в соответствующем собачьем антителе. Например, в то время, как каждое из замещений N297 и D265 в человеческом или мышином антителе в результате приводит к аннулированию связывания с Fcγ рецептором и C1q, ни одно замещение полностью не аннулирует связывание собачьего антитела с C1q. Вместо этого, как указано ниже, для элиминирования обоих, и DCC, и CDC в собачьем антителе подкаласса IgGB или IgGC доказана необходимость проведения двойного замещения в Fc собачьего антитела, комбинируя оба замещения, и аспарагин на аланин, и аспарагиновую кислоту на аланин. Дополнительно, совершенно неожиданно одно замещение, которое продемонстрировало снижение эффекторных функций в человеческом антителе, фактически привело к усилению связывания соответствующего собачьего IgG с FcγR и C1q.
Для получения вариантов собачьего IgGB и IgGC, не имеющих эффекторных функций, могут быть получены модифицированные тяжелые цепи собачьего IgGB или модифицированные тяжелые цепи собачьего IgGC. Всего для возможных замещений идентифицировано семь аминокислотных остатков, которые присутствуют в кристаллизуемых фрагментах обоих этих собачьих (cFcs). Эти семь аминокислотных остатков представляют: P4, D31, N63, G64, T65, A93 и P95 для обоих аминокислотных последовательностей SEQ ID NO: 130 для Fc собачьего IgGB; и аминокислотной последовательности SEQ ID NO: 132 для Fc собачьего IgGC. Соответственно, аминокислотная последовательность SEQ ID NO: 2 отличается от таковой SEQ ID NO: 130 наличием аминокислотных остатков в позициях: 4, 31, 63, 64, 65, 93 и 95, которые представляют пролин (P), аспарагиновую кислоту (D), аспарагин (N), глицин (G), треонин (T), аланин (A) и пролин (P), соответственно, в аминокислотной последовательности SEQ ID NO: 130 «X» (или «Xaa» в трехбуквенном коде) для всех семи позиций, означает, что эти семь аминокислотных позиций могут представлять любую из двадцати природных аминокислот (смотрите, в колонке 1 Таблицы 1 ниже). Аналогично, аминокислотная последовательность SEQ ID NO: 4 отличается от таковой SEQ ID NO: 132 наличием аминокислотных остатков в позициях 4, 31, 63, 64, 65, 93 и 95, приведенные как «X» (или «Xaa» в трехбуквенном коде) для всех семи позиций, обозначая эти семь аминокислотных позиций. Аминокислотная последовательность SEQ ID NO: 2 кодируется нуклеотидной последовательностью SEQ ID NO: 1, в то время аминокислотная последовательность SEQ ID NO: 4 кодируется нуклеотидной последовательностью SEQ ID NO: 3.
В одном варианте воплощения настоящего изобретения cFc содержит аминокислотную последовательность SEQ ID NO: 130 со следующими замещениями P4(A, G, или S), D31(A, G, или S) N63(A, G, или S), G64(A or P), T65(A, G, или S), A93(G или S) и P95(A, G, или S); в которой P4 (A G, или S) означает, что остаток пролина в позиции 4 замещен либо остатком аланина, глицина, либо остатком серина, и аналогично G64(P или A) означает, что остаток глицина в позиции 64 замещен либо остатком пролина, либо остатком аланина, и аналогичное им). В конкретном варианте воплощения настоящего изобретения cFc содержит аминокислотную последовательность SEQ ID NO: 130 со следующими замещениями: P4A, D31A, N63A, G64P, T65A, A93G и P95A.
В близком варианте воплощения настоящего изобретения cFc содержит аминокислотную последовательность SEQ ID NO: 4, которая содержит 7 аминокислот, обозначенных как Xaa следующими аминокислотными остатками: A4, A31, A63, G64, T65, G93, и 95, то есть аминокислотная последовательность SEQ ID NO: 132 со следующими пятью (5) изменениями аминокислотных остатков: P4A, D31A, N63A, A93G и P95A, сохранением двух аминокислотных остатков из семи, G64 и T65, неизменными из аминокислотной последовательности SEQ ID NO: 132.
Аминокислотные последовательности SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64и SEQ ID NO: 66 -все содержат «X» (или «Xaa» в трехбуквенном коде) в семи аминокислотных позициях, означая, что эти семь аминокислотных позиций могут представлять любую из двадцати природных аминокислот, приведеных в колонке 1 Таблицы 1 ниже. В частности, в соответствующих последовательностях SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64 и SEQ ID NO: 66 содержит либо аминокислотную последовательность SEQ ID NO: 2, либо таковую SEQ ID NO: 4. Конкретные примеры аминокислотных остатков в одной или более из этих семи позиций аминокислотных последовательностей приведены выше и ниже, следовательно, они включаются в семейство индивидуальных аминокислотных последовательностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64 и SEQ ID NO: 66, наряду с канинизированными антителами, которые содержат эти последовательности.
В приведенной ниже Таблице 10, в частности коррелируют семь аминокислотных позиций, как приведено в описании настоящей патентной заявки, Fc cIgGB (SEQ ID NO: 130 и SEQ ID NO: 2) и Fc cIgGC (SEQ ID NO: 132 и SEQ ID NO: 4) с таковыми полноразмерных тяжелых цепей собачьего, которые содержат эти аминокислотные последовательностей cFc, то есть, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64 и SEQ ID NO: 66. Соответственно, фактическая позиция полноразмерной последовательности IgGB или IgGC может быть легко синхронизирована с таковой cFc, как приведено в Таблице 10, ниже.
В конкретных вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 40, 52, 56, или 64, содержащую (i) P, A, G или S в позиции 239, (ii) D, A, G или S в позиции 266, (iii) N, A, G или S в позиции 298, (iv) G, P или A в позиции 299, (v) T, A, G или S в позиции 300, (vi) A, G или S в позиции 328 и (vii) P, A, G или S в позиции 330. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 42, 54, 58 или 66, содержащую (i) P, A, G или S в позиции 237, (ii) D, A, G или S в позиции 264, (iii) N, A, G или S в позиции 296, (iv) G, P или A в позиции 297, (v) T, A, G или S в позиции 298, (vi) A, G или S в позиции 326и (vii) P, A, G или S в позиции 328. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 44, 50 или 60, содержащую (i) P, A, G или S в позиции 244, (ii) D, A, G или S в позиции 271, (iii) N, A, G или S в позиции 303, (iv) G, P или A в позиции 304, (v) T, A, G или S в позиции 305, (vi) A, G или S в позиции 333и (vii) P, A, G или S в позиции 335. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 46 или 62, содержащую (i) P, A, G или S в позиции 242, (ii) D, A, G или S в позиции 269, (iii) N, A, G или S в позиции 301, (iv) G, P или A в позиции 302, (v) T, A, G или S в позиции 303, (vi) A, G или S в позиции 331 и (vii) P, A, G или S в позиции 333. В других вариантах воплощения настоящего изобретения тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO: 48, содержащую (i) P, A, G или S в позиции 246, (ii) D, A, G или S в позиции 273, (iii) N, A, G или S в позиции 305, (iv) G, P или A в позиции 306, (v) T, A, G или S в позиции 307, (vi) A, G или S в позиции 335 и (vii) P, A, G или S в позиции 337.
Настоящее изобретение также обеспечивает модифицированные собачьи IgGDs, которые содержат шарнирную область либо из IgGA, IgGB, либо из IgGC вместо природой шарнирной области IgGD. В качестве альтернативы, шарнирная область IgGD может быть генетически модифицирована замещением остатка серина на остаток пролина, как приведено в Таблице 5. Такие модификации приводят к тому, что у собачьго IgGD отсутствует изменение fab-области. Модифицированный собачий IgGDs может быть сконструирован при использовании стандартных способов технологии рекомбинантной ДНК [например, Maniatis et al., Molecular Cloning, A Laboratory Manual (1982)]. Для конструирования этих вариантов нуклеиновые кислоты, кодирующие аминокислотную последовательность собачьего IgGD, могут быть модифицированы, таким образом, что они будут кодировать модифицированные IgGDs. Модифицированные последовательности нуклеиновых кислот в таком случае клонируются в экспрессионных плазмидах для экспрессии белка. Нуклеиновые кислоты, кодирующие Fcs собачьего IgGD, с заменой шарнирной области в качестве примера представлены нуклеотидными последовательностями SEQ ID NO: 7, 9 и 11, которые кодируют аминокислотные последовательности SEQ ID NO: 8, 10 и 12. Нуклеиновая кислота, кодирующая Fc собачьего IgGD с модифицированной шарнирной областью IgGD, содержит нуклеотидную последовательность SEQ ID NO: 5, которая кодирует аминокислотную последовательность SEQ ID NO: 6.
Дополнительно настоящее изобретение обеспечивает полноразмерные собачьи тяжелые цепи, которые могут находиться в соответствии с соответствующими легкими цепями, с получением канинизированного антитела. Соответственно, дополнительно настоящее изобретение обеспечивает канинизированные мышиные антитела против собачьего антигена (включая выделенное канинизированное мышиное антитело против собачьего PD-1 антитела) и способы получения антитела или его антигенсвязывающих фрагментов для лечения заболеваний, например, лечения рака у относящихся к собачьим.
Дополнительно, настоящее изобретение обеспечивает канинизированное мышиное антитело против собачьего PD-1 или антигенсвязывающие фрагменты, которые связываются с собачьим PD-1 и блокируют связывание собачьего PD-1 с собачьим PD-L1. В конкретных вариантах воплощения настоящего изобретения канинизированное мышиное антитело против собачьего PD-1 содержит модифицированный Fc собачьего IgGB, модифицированный Fc собачьего IgGC, или у собачьего IgGD отсутствуют изменения fab-области, как приведено в описании настоящей патентной заявки.
Антитело или его антигенсвязывающий фрагмент, который связывается с собачьим антигеном, например, собачий PD-1, может содержать одну, две, три, четыре, пять или шесть областей, определяющих комплементарность (CDRs) мышиного антитела против собачьего, как приведено в описании настоящей патентной заявки. Одна, две, три, четыре, пять, или шесть CDRs могут быть независимо выбраны из CDR последовательностей, которые приведены ниже. В дополнительном варианте воплощения настоящего изобретения антитело или его антиген-связывающий фрагмент, который связывается с собачьим PD-1, содержит каппа легкую цепь собачьего антитела, содержащую CDR-1, CDR-2 и/или CDR-3 легкой цепи мышиного антитела, и тяжелую цепь собачьего IgG, содержащую CDR-1, CDR-2 и/или CDR 3 тяжелой цепи мышиного антитела. Соответственно, дополнительно настоящее изобретение обеспечивает полноразмерные собачьи тяжелые цепи, которые могут находиться в соответствии, например, с соответствующими легкими цепями, с получением канинизированного антитела [смотрите, Таблица 2 ниже, в которой приведены последовательности семи CDRs мышиного антитела против собачьего PD-1, например, 1B5, 2G9, 2H9, 3B6, 4D12, 5G5 и 7C9].
В других вариантах воплощения настоящее изобретение обеспечивает антитела или их антигенсвязывающие фрагменты, которые связываются специфически с PD-1 и имеют каппа легкие цепи собачьего антитела, содержащие от одной до шести различных CDRs, содержащих последовательность по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичную аминокислотным последовательностям SEQ ID NOs: 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и/или 26 и тяжелые цепи собачьего IgG, содержащие от одной до шести CDRs, содержащих последовательность по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичную аминокислотной последовательности SEQ ID NOs: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38 и/или 146, продолжая при этом демонстрировать заданное связывание и функциональные свойства. В другом варианте воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент по настоящему изобретению содержит собачий каркас, содержащий комбинацию последовательности тяжелой цепи IgG с каппа легкой цепью, имеющей одну или более аминокислотную последовательность с 0, 1, 2, 3, 4 или 5 консервативными или не консервативными аминокислотными замещениями указанной выше CDR, продолжая при этом демонстрировать заданное связывание и функциональные свойства.
Идентичность последовательности относится к степени, до которой аминокислоты двух полипептидов идентичны в эквивалентных позициях, когда две последовательности оптимально выравнены. Используемый в описании настоящей патентной заявки термин одна аминокислотная последовательность на 100% «идентична» второй аминокислотной последовательности относится к случаю, когда аминокислотные остатки обеих последовательностей идентичны. Соответственно, аминокислотная последовательность на 50% «идентична» второй аминокислотной последовательности в случае, когда 50% аминокислотных остатков двух аминокислотных последовательностей идентичны. Сравнение последовательности проводят через перекрывающийся блок аминокислотных остатков, содержащихся в данном белке, например, сравниваемый белок или часть полипептида. В конкретном варианте воплощения настоящего изобретения во внимание принимаются выбранные делеции или вставки, которые могли бы в противном случае изменить сходство между двумя аминокислотными последовательностями.
Сходство последовательности включает идентичные остатки и не идентичные биохимически сходные аминокислоты. Биохимически сходные представляют таковые со сходными свойствами и взаимозаменяемые.
«Консервативно модифицированные варианты» или «консервативные замещения» относится к замещениям аминокислот в белке другими аминокислотами, имеющими сходные характеристики (например заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация и жесткость скелета и, тому подобное), таким образом, что изменения могут быть часто сделаны без изменения биологической активности белка. Специалисту в области техники, к которой относится настоящее изобретение, известно, что как правило, одиночные аминокислотные замещения в несущественных областях полипептида по существу не изменяют биологическую активность [смотрите, например, Watson et al., Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Ed.; 1987)]. Дополнительно, замещения структурно или функционально сходных аминокислот с меньшей вероятностью разрушить биологическую активность. Примеры консервативных замещений приведены в Таблице I непосредственно ниже.
|
Консервативный вариант функции антитела по настоящему изобретению также входит в объем притязаний настоящего изобретения. Используемый в описании настоящей патентной заявки термин «консервативный вариант функции» относится к антителу или фрагментам, в которых один или более аминокислотный остаток заменен без изменения заданного свойства, такого как аффиность и/или специфичность антигена, такие варианты включают без ограничения замену аминокислоты на таковую, имеющую сходные свойства, такую как консервативные аминокислотные замещения, приведенные в Таблице I выше.
Нуклеиновые кислоты
Дополнительно, настоящее изобретение включает нуклеиновые кислоты, кодирующие цепи иммуноглобулина канинизированного мышиного антитела против собачьего PD-1 и его антигенсвязывающие фрагменты, как приведено в описании настоящей патентной заявки (смотрите, Примеры ниже).
Также настоящее изобретение включает нуклеиновые кислоты, которые кодируют полипептиды иммуноглобулина, содержащие аминокислотные последовательности, которые по меньшей мере на около 70% идентичны, предпочтительно по меньшей мере на около 80% идентичны, более предпочтительно по меньшей мере на около 90% идентичны и наиболее предпочтительно по меньшей мере на около 95% идентичны (например, 95%, 96%, 97%, 98%, 99%, 100%) аминокислотным последовательностям CDRs и/или собачьих cFc's и/или антител по настоящему изобретению, когда сравнение проводят при использовании алгоритма BLAST, где параметры алгоритма, выбраны, таким образом, чтобы дать наибольшее совмещение между соответствующими последовательностями по всей длине соответствующих референсных последовательностей. Дополнительно, настоящее изобретение обеспечивает нуклеиновые кислоты, которые кодируют полипептиды иммуноглобулина, содержащие аминокислотные последовательности, которые по меньшей мере на около 70% сходны, предпочтительно по меньшей мере на около 80% сходны, более предпочтительно по меньшей мере на около 90% сходны и наиболее предпочтительно по меньшей мере на около 95% сходны (например, 95%, 96%, 97%, 98%, 99%, 100%) с любой референсной аминокислотной последовательностью, когда сравнение проводят при использовании алгоритма BLAST, где параметры алгоритма выбраны, таким образом, чтобы дать наибольшее совмещение между соответствующими последовательностями по всей длине соответствующих референсных последовательностей.
Используемый в описании настоящей патентной заявки термин процент идентичности нуклеотидной аминокислотной последовательности может быть определен при использовании C, MacVector (MacVector, Inc. Cary, NC 27519), Vector NTI (Informax, Inc. MD), Oxford Molecular Group PLC (1996) и алгоритма Clustal W с используемыми по умолчанию параметрами выравнивания для идентичности. Эти коммерчески доступные программы также могут быть использованы для определения сходства последовательности при использовании идентичных или аналогичных параметров по умолчанию. В качестве альтернативы, может быть использован поиск Advanced Blast на условиях фильтрации по умолчанию, например, при использовании GCG (Genetics Computer Group, Program Manual for the GCG Package, Version 7, Madison, Wisconsin) pileup program при использовании параметров по умолчанию.
Следующие ссылки относятся к часто используемым для анализа последовательностей алгоритмам BLAST: BLAST ALGORITHMS: Altschul, S.F., et al., J. Mol. Biol. 215:403-410 (1990); Gish, W., et al., Nature Genet. 3:266-272 (1993); Madden, T.L., et al., Meth. Enzymol. 266:131-141(1996); Altschul, S.F., et al., Nucleic Acids Res. 25:3389-3402 (1997); Zhang, J., et al., Genome Res. 7:649-656 (1997); Wootton, J.C., et al., Comput. Chem. 17:149-163 (1993); Hancock, J.M. et al., Comput. Appl. Biosci. 10:67-70 (1994); ALIGNMENT SCORING SYSTEMS: Dayhoff, M.O., et al., "A model of evolutionary change in proteins." in Atlas of Protein Sequence and Structure, vol. 5, suppl. 3. M.O. Dayhoff (ed.), pp. 345-352, (1978); Natl. Biomed. Res. Found., Washington, DC; Schwartz, R.M., et al., "Matrices for detecting distant relationships." in Atlas of Protein Sequence and Structure, vol. 5, suppl. 3." (1978), M.O. Dayhoff (ed.), pp. 353-358 (1978), Natl. Biomed. Res. Found., Washington, DC; Altschul, S.F., J. Mol. Biol. 219:555-565 (1991); States, D.J., et al., Methods 3:66-70(1991); Henikoff, S., et al., Proc. Natl. Acad. Sci. USA 89:10915-10919 (1992); Altschul, S.F., et al., J. Mol. Evol. 36:290-300 (1993); ALIGNMENT STATISTICS: Karlin, S., et al., Proc. Natl. Acad. Sci. USA 87:2264-2268 (1990); Karlin, S., et al., Proc. Natl. Acad. Sci. USA 90:5873-5877 (1993); Dembo, A., et al., Ann. Prob. 22:2022-2039 (1994); and Altschul, S.F. "Evaluating the statistical significance of multiple distinct local alignments." in Theoretical and Computational Methods in Genome Research (S. Suhai, ed.), pp. 1-14, Plenum, New York (1997).
Также настоящее изобретение обеспечивает векторы экспрессии, содержащие нуклеиновые кислоты (включая выделенные нуклеиновые кислоты) по настоящему изобретению, где нуклеиновая кислота функционально связана с контрольными последовательностями, которые распознаются клеткой-хозяином, когда трансфецируются вектором. Также обеспечены клетки-хозяева, содержащие вектор экспрессии по настоящему изобретению, и способы получения антитела или его антигенсвязывающего фрагмента, как приведено в описании настоящей патентной заявки, включающие культивирование клетки-хозяина, содержащей вектор экспрессии, кодирующий антитело или антигенсвязывающий фрагмент, в культуральной среде, и выделение антигена или его антигенсвязывающего фрагмента из клетки-хозяина или культуральной среды.
Канинизированное мышиное антитело против собачьего PD-1 может быть получено, например, рекомбинантно при использовании способов, известных из предшествующего уровня техники. Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии антитела или фрагментов по настоящему изобретению, хорошо известны из предшествующего уровня техники и включают множество иммортализованных клеточных линий, доступных от American Type Culture Collection (ATCC). Среди прочего они включают клетки яичника китайского хомячка (CHO), NSO, SP2 клетки, HeLa клетки, клетки почек новорожденного хомячка (BHK), клетки почек обезьяны (COS), клетки злокачественной гепатомы человека (например, Hep G2), A549 клетки, 3T3 клетки, HEK-293 клетки и множество других клеточных линий. Клетки-хозяева млекопитающих включают клетки человека, мышей, крыс, собак, обезьян, свиней, коз, жвачных животных, лошадей и хомяков. По существу предпочтительно клеточные линии выбирают, определяя, какие клеточные линии имеют высокие уровни экспрессии. Другие клеточные линии, которые могут быть использованы, представляют клеточные линии насекомых, такие как Sf9 клетки, клетки земноводных, бактериальные клетки, клетки растений и клетки грибов. В случае когда рекомбинантные векторы экспрессии, кодирующие тяжелую цепь или ее часть или антиген-связывающий фрагмент, легкую цепь и/или ее антиген-связывающий фрагмент вводят в клетки-хозяева млекопитающих, антитела получают культивированием клеток-хозяев в течение периода времени, достаточного для экспрессии антитела в клетках-хозяевах, или более предпочтительно секрецией антитела в культуральную среду, в которой выращивают клетки-хозяева.
Антитела могут быть выделены из культуральной среды при использовании стандартных методов очистки белка. Дополнительно, экспрессия антитела по настоящему изобретению (или других его фрагментов) из продуктивных клеточных линий может быть усилена при использовании множества известных технологий. Например, система генной экспрессии с глутаминсинтазой (GS система) представляет распространенный подход для усиления экспрессии при определенных условиях. GS система описана в целом или частично в европейских патентах № 0 216 846, 0 256 055и 0 323 997 и в европейской патентной заявкой № 89303964.4.
Как правило, гликобелки, полученные в определенных линиях клеток или от трансгенного животного, будут иметь профиль гликозилирования характерный для гликобелков, полученных в клеточной линии или от трансгенного животного. Следовательно, конкретный профиль гликозилирования будет зависеть от конкретной, используемой для получения клеточной линии или трансгенного животного. Однако, все антитела, кодируемые молекулами нуклеиновой кислоты по настоящему изобретению или содержащие аминокислотные последовательности по настоящему изобретению, входят в объем настоящего изобретения независимо от профиля гликозилирования, который имеет антитело. Аналогично, в конкретных вариантах воплощения настоящего изобретения антитела с профилем гликозилирования, содержащие только не фукозилированные N-гликаны, могут быть преимущественными, поскольку эти антитела показали, как правило, большую эффективность по сравнению с их фукозилированными аналогами, и in vitro, и in vivo [Смотрите, например, Shinkawa et al., J. Biol. Chem. 278: 3466-3473 (2003); патенты США №№ 6,946,292 и 7,214,775].
Дополнительно, настоящее изобретение включает фрагменты антител канинизированного мышиного антитела против собачьего PD-1 по настоящему изобретению. Фрагменты антитела включают F(ab)2 фрагменты, которые могут быть получены ферментативным расщеплением IgG, например, пепсином. Fab фрагменты могут быть получены, например, разделением F(ab)2 дитиотриэтолом или меркаптоэтиламином. Fab фрагмент представляет VL-CL цепь, присоединенную к VH-CH1 цепи дисульфидным мостиком. F(ab)2 фрагмент представляет два Fab фрагмента, которые в свою очередь прикреплены двумя дисульфидными мостиками. Fab часть F(ab)2 молекулы включает часть Fc области, между которыми расположены дисульфидные мостики. FV фрагмент представляет VL или VH область.
В одном варианте воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент содержит константную область тяжелой цепи, например, собачью константную область, такую как константная область тяжелой цепи собачьего IgGA, IgGB, IgGC и IgGD или ее вариант. В другом варианте воплощения настоящего изобретения антитело или антигенсвязывающий фрагмент содержит константную область легкой цепи, например, константную область собачей легкой цепи, такую как область лямбда или каппа собачей легкой цепи или ее вариант. Приведенная в качестве примера и не ограничивающая константная область собачей тяжелой цепи может представлять IgGB, а константная область собачей легкой цепи может представлять каппа.
Конструирование антитела
Канинизированное мышиное антитело против собачьего PD-1 по настоящему изобретению может быть сконструировано, таким образом, чтобы включать модификации в собачьем каркасе родительского (то есть относящийся к собачьим) моноклонального антитела, например, для улучшения свойств антитела, как детально описано ниже.
Приведенное в описании настоящей патентной заявки перекрестное блокирование канинизированного антитела и его антиген-связывающих фрагментов может быть определено на основе их способности перекрестно конкурировать с любым из IB5, 3B6, 4D12, 7C9, 2H9, 5G5, и/или 2G9 или при использовании стандартного анализа связывания (например, BIACore®, ELISA, как приведено в качестве примера ниже, или проточной цитометрии). Например, может быть использован стандартный анализ ELISA, в котором рекомбинантный собачий белок PD-1 иммобилизован на пластине, одно из антител флуоресцентно мечено и оценивается способность не меченного антитела конкурировать за связывание с меченным антителом. Дополнительно или в качестве альтернативы, может быть использован BIAcore® анализ для оценки способности антитела перекрестно конкурировать. Способность тестируемого антитела ингибировать связывание, например, IB5, 3B6, 4D12, 7C9, 2H9, 5G5 и/или 2G9 с собачьим PD-1 демонстрирует, что антитело может конкурировать с IB5, 3B6, 4D12, 7C9, 2H9, 5G5 и/или 2G9 за связывание с собачьим PD-1 и, следовательно, может в некоторых случаях связываться с тем же самым эпитопом на собачьем PD-1 как и IB5, 3B6, 4D12, 7C9, 2H9, 5G5 и/или 2G9. Как указано выше, антитела и фрагменты, которые связываются с одним и тем же эпитопом, как и любое из антител против собачьего PD-1 или фрагментов по настоящему изобретению, также является частью настоящего изобретения.
Фармацевтические композиции и введение
Для получения фармацевтических или стерильных композиций канинизированное мышиное антитело против собачьего PD-1 или его антигенсвязывающий фрагмент оно может быть смешано с фармацевтически приемлемым носителем или наполнителем. [Смотрите, например, Remington's Pharmaceutical Sciences и США Pharmacopeia: National Formulary, Mack Publishing Company, Easton, PA (1984)].
Составы терапевтических и диагностических агентов могут быть получены смешиванием с приемлемыми носителями, наполнителями или стабилизаторами в форме, например, лиофилизированных порошков, дисперсий, водных растворов или суспензий [смотрите, например, Hardman, et al. (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, NY; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams and Wilkins, New York, NY; Avis, et al. (eds.) (1993) Pharmaceutical Лекарственные формы: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Лекарственные формы: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Лекарственные формы: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, NY]. В одном варианте воплощения настоящего изобретения антитело против PD-1 по настоящему изобретению разводят до подходящей концентрации в растворе ацетата натрия pH 5-6 и для тоничности добавляют NaCl или сахарозу. Для усиления стабильности могут быть добавлены дополнительные агенты, такие как полисорбат 20 или полисорбат 80.
Токсичность и терапевтическая эффективность композиций антитела, вводимых как таковых или в комбинации с другим агентом, может быть определена при использовании стандартных фармацевтических процедур на клеточных культурах или экспериментальных животных, например, для определения LD50 (летальной дозы для 50% популяции) и ED50 (терапевтически эффективной дозы для 50% популяции). Соотношение дозы между токсическим и терапевтическим эффектом представляет терапевтический индекс (LD50/ ED50). В конкретных аспектах желательными являются антитела, демонстрирующие высокие терапевтические индексы. Данные, полученные из исследований клеточных культур и исследований на животных, могут быть использованы для составления диапазона доз для применения у животных, относящийся к собачьим. Предпочтительно доза таких соединений составляет в пределах циркулирующей концентрации, которая включает ED50 с малой токсичностью или без токсичности. Дозировка может варьировать в этих пределах в зависимости от используемой формы дозировки и способа введения.
Способ введения может варьировать. Подходящие способы введения включают оральный, ректальный, трансмукозальный, интестинальный, парентеральный, внутримышечный, подкожный, внутрикожный, интрамедуллярно, внутриоболочечно, напрямую внутрижелудочково, внутривенно, внутрибрюшинно, интраназально, интраокулярно, ингаляцией, инсуффляцией, местным нанесением, накожно, трансдермально или внутриартериально.
В конкретных вариантах воплощения настоящего изобретения канинизированное мышиное антитело против собачьего PD-1 или его антигенсвязывающий фрагмент может быть введен инвазивным способом, таким как инъекция. В других дополнительных вариантах воплощения настоящего изобретения мышиное антитело против собачьего PD-1 или его антигенсвязывающий фрагмент, или его фармацевтическую композицию вводят внутривенно, подкожно, внутримышечно, внутриартериально, внутриопухолево или ингаляцией, аэрозольным введением. Введение не инвазивными способами (например, орально; например, в пилюлях, капсулах или таблетках) также входит в объем притязаний настоящего изобретения.
Фармацевтические композиции по настоящему изобретению также могут быть введены капельно. Примеры хорошо известных имплантов и модульных форм введения фармацевтических композиций включают: Патент США № 4,487,603, в котором описывается имплантируемый микроинфузионный насос для дозирования лекарства с контролируемой скоростью; Патент США № 4,447,233, в котором описывается инфузионный насос для лекарственного средства для доставки лекарственного средства с точной скоростью инфузии; Патент США № 4,447,224, в котором описывается имплантируемое инфузионное устройство с регулятором расхода для непрерывной доставки лекарственного средства; Патент США № 4,439,196, в котором описывается осмотическая система доставки с камерой с множеством отделений. Многие другие такие импланты, системы доставки и модули хорошо известны специалисту в области техники, к которой относится настоящее изобретение.
В качестве альтернативы, введение канинизированного мышиного антитела против собачьего PD-1 может быть осуществлено локально а не системно, например, инъекцией антитела непосредственно в артритный сустав или патоген-индуцированное поражение, характеризующееся иммунопаталогией, часто в форме депо или состава с замедленным высвобождением. Дополнительно, можно вводить антитело в системе целевой доставки лекарственного средства, например, ткане-специфическое антитело с липосомальным покрытием, нацеленное, например, на артритный сустав или патоген-индуцированное поражение, характеризующееся иммунопатологией. Липосомы могут быть нацелены или селективно поглощены пораженными тканями.
Режим введения зависит от нескольких факторов, включая скорость метаболизма терапевтического антитела в сыворотке или тканях, уровень симптомов, иммуногенность терапевтического антитела и доступность целевых клеток в биологической матрице. Предпочтительно режим введения позволяет доставить достаточно терапевтических антител для достижения улучшения целевой стадии заболевания, при этом одновременно минимизируя нежелательные побочные эффекты. Соответственно, биологически доставленное количество зависит частично от конкретного терапевтического антитела и тяжести лечимого состояния. Доступно руководство по выбору подходящих доз терапевтического антитела [смотрите, например, Wawrzynczak Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK (1996); Kresina (ed.) Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, NY (1991); Bach (ed.) Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, NY (1993); Baert, et al. New Engl. J. Med. 348:601-608 (2003); Milgrom et al. New Engl. J. Med. 341:1966-1973 (1999); Slamon et al. New Engl. J. Med. 344:783-792 (2001); Beniaminovitz et al. New Engl. J. Med. 342:613-619 (2000); Ghosh et al. New Engl. J. Med. 348:24-32 (2003); Lipsky et al. New Engl. J. Med. 343:1594-1602 (2000)].
Определение подходящей дозы проводится ветеринаром, например, при использовании параметров или факторов, влияющих на лечение, известных или предполагаемых в области техники, к которой относится настоящее изобретение. Как правило, доза начинается с критерии включают таковые количества немного меньшего, чем оптимальная доза, и повышается при малом шаге приращения до достижения заданного или оптимального эффекта относительно любых негативных побочных эффектов. Важные диагностические симптомов, например, воспаление или уровень продуцированных воспалительных цитокинов.
Антитела или их антигенсвязывающие фрагменты по настоящему изобретению могут быть обеспечены непрерывной инфузией или введением доз, например, ежедневно, 1-7 раз в неделю, еженедельно, дважды в неделю, ежемесячно, дважды в месяц, ежеквартально, раз в полгода, ежегодно и тому подобное. Дозы могут быть обеспечены, например, внутривенно, подкожно, местным нанесением, орально, назально, ректально, внутримышечно, интрацеребрально, интраспинально или ингаляцией. Общая недельная доза, как правило, составляет по меньшей мере 0,05 μг/кг массы тела, более распространено по меньшей мере 0,2 μг/кг, 0,5 μг/кг, 1 μг/кг, 10 μг/кг, 100 μг/кг, 0,25 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 5,0 мг/мл, 10 мг/кг, 25 мг/кг, 50 мг/кг или более [смотрите, например, Yang, et al. New Engl. J. Med. 349:427-434 (2003); Herold, et al. New Engl. J. Med. 346:1692-1698 (2002); Liu, et al. J. Neurol. Neurosurg. Psych. 67:451-456 (1999); Portielji, et al. Cancer Immunol. Immunother. 52:133-144 (2003)]. Также дозы могут быть обеспечены для достижения заранее определенной целевой концентрации канинизированного мышиного антитела против собачьего PD-1 в сыворотке субъекта, такой как 0,1, 0,3, 1, 3, 10, 30, 100, 300 μг/мл или более. В других вариантах воплощения настоящего изобретения канинизированное мышиное антитело против собачьего PD-1 по настоящему изобретению вводят подкожно или внутривенно, еженедельно, дважды в неделю, «каждые 4 недели», ежемесячно, дважды в месяц или ежеквартально из расчета 10, 20, 50, 80, 100, 200, 500, 1000 или 2500 мг/субъекту.
Используемый в описании настоящей патентной заявки термин «ингибирование» или «терапия», или «лечение» включает отсрочку развития симптомов, связанных с заболеванием, и/или снижение тяжести симптомов такого заболевания. Используемые в описании настоящей патентной заявки термины дополнительно включают облегчение существующих неконтролируемых или нежелательных симптомов, предотвращение дополнительных симптомов и облегчение или предотвращение первоначальных причин таких симптомов. Следовательно, используемые в описании настоящей патентной заявки термины обозначают, что положительный результат достигнут у позвоночного субъекта с заболеванием или болезнью, или симптомом, или с потенциальном для развития такого заболевания, болезни или симптома.
Используемые в описании настоящей патентной заявки термины «терапевтически эффективное количество», «терапевтически эффективная доза» и «эффективное количество» относятся к количеству канинизированного мышиного антитела против собачьего PD-1 или его антигенсвязывающих фрагментов по настоящему изобретению, которое при введении как такового или в комбинации с дополнительным терапевтическим агентом в клетку, ткань или субъекту, эффективно для достижения измеряемого улучшения одного или более симптома заболевания или состояния, или прогрессирования такого заболевания или состояния. Дополнительно, терапевтически эффективная доза относится к такому количеству связывающего соединения, которое достаточно для достижения по меньшей мере частичного ослабления симптомов, например, лечение, излечение, профилактика или улучшение релевантного медицинского состояния, или повышение скорости лечения, излечения, профилактики или ослабления таких состояний. При применении введением только индивидуального активного ингредиента, терапевтически эффективная доза относится к ингредиенту как таковому. При применении введением в комбинации, терапевтически эффективная доза относится к комбинированным количествам активных ингредиентов, которые приводят к терапевтическому эффекту, независимо от введения в комбинации периодически или одновременно. Терапевтически эффективное количество приводит к улучшению диагностичекого критерия или параметра по меньшей мере на 10%; как правило по меньшей мере на 20%; предпочтительно по меньшей мере на около 30%; более предпочтительно по меньшей мере 40% и наиболее предпочтительно по меньшей мере на 50%. Эффективное количество также может привести к улучшению субъективной оценки в случае, когда субъективные оценки используют для оценки тяжести заболевания.
Другая комбинированная терапия
Как указано выше, канинизированное мышиное антитело против собачьего PD-1 или его антигенсвязывающий фрагмент могут быть введены совместно с одним или более другим терапевтическим агентом (таким как химиотерапевтический агент). Антитело может быть связано с агентом (как иммунокомплекс) или может быть введено отдельно от агента. В последнем случае (раздельное введение) антитело может быть введено перед, после или одновременно с агентом или может быть совместно введено с другими известными лекарственным средством.
Наборы
Дополнительно обеспечены наборы, содержащие один или более компонент, которые включают без ограничения антитело или антигенсвязывающий фрагмент по настоящей заявке, который специфически связывается с PD-1 (например, канинизированное мышиное антитело против собачьего PD-1 или его антигенсвязывающий фрагмент) в сочетании с одним или более дополнительным компонентом, включая без ограничения фармацевтически приемлемый носитель и/или химиотерапевтический агент, как указано выше. Связывающая композиция и/или химиотерапевтическая композиция может быть составлена, как чистая композиция или в комбинации с фармацевтически приемлемым носителем в фармацевтической композиции.
В одном варианте воплощения настоящего изобретения набор включает связывающую композицию по настоящему изобретению (например, канинизированное мышиное антитело против собачьего PD-1 или его фармацевтическая композиция в одном контейнере (например, в стерильной стеклянной или пластиковой пробирке) и его фармацевтическую композицию и/или химиотерапевтический агент в другом контейнере (например, в стерильной стеклянной или пластиковой пробирке).
В случае, когда набор содержит фармацевтическую композицию для парентерального введения субъекту, набор также содержит устройство для проведения такого введения. Например, набор может содержать одну или более гиподермальную иглу или другие устройства для инъекции, как указано выше. Также набор содержит листок-вкладыш, содержащий информацию о фармацевтической композиции и лекарственных формах в наборе. Как правило, такая информация помогает владельцу животного и ветеринарам эффективно и безопасно использовать укупоренные фармацевтические композиции и лекарственные формы. Например, на вкладыш может быть помещена следующая информация, относящаяся к комбинации по настоящему изобретению: фармакокинетика, фармакодинамика, клинические исследования, показатели эффективности, показания к применению, противопоказания, предостережения и меры предосторожности, побочные реакции, передозировка, правильная дозировка и введение, форма выпуска, надлежащие условия хранения, референсные препараты, информация о производителе/дистрибьюторе и патентная информация.
Для удобства в наборе может быть обеспечено антитело или агент специфического связывания, то есть в виде комплекта реагентов в заранее определенных количествах с инструкциями для проведения диагностического анализа или анализа на обнаружение. В случае, когда антитело метят ферментом, набор будет содержать субстраты и кофакторы, требуемые для фермента (например, субстрат-предшественник, который обеспечивает детектируемый хромофор или флуорофор). Дополнительно, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий или лизисный буфер) и аналогичное им. Относительные количества различных реагентов могут широко варьировать для обеспечения концентраций в растворе реагентов, которые по существу оптимизируют чувствительность анализа. В частности, реагенты могут быть обеспечены в форме сухих порошков, как правило лиофилизованных, включая наполнители, которые при растворении будут обеспечивать раствор реагентов интрацеребрально в подходящей концентрации.
ПРИМЕРЫ
ПРИМЕР 1
СОБАЧИЙ PD-1 И PD-L1
Собачий PD-1 и PD-L1:
Предварительная заявка на патент США № 61/918,946, поданная 20 декабря 2013, введенная здесь ссылкой в полном объеме обеспечивает: полноразмерную нуклеотидную последовательность для собачьего PD-1 (cPD-1) SEQ ID NO: 113 [SEQ ID NO: 133 включает сигнальную последовательность]; соответствующую транслированную аминокислотную последовательность SEQ ID NO: 114 [SEQ ID NO: 134 включает сигнальную последовательность]; нуклеотидную последовательность, кодирующую внеклеточный домен (ECD) собачьего PD-1, SEQ ID NO: 115; аминокислотную последовательность ECD собачьего PD-1, SEQ ID NO: 116; нуклеотидную последовательность собачьего PD-1 ECD плюс GT линкер и Fc часть человеческого гена Fc IgG1, SEQ ID NO: 117; и аминокислотную последовательность собачьего PD-1 ECD плюс GT линкер и Fc часть человеческого гена Fc IgG1, SEQ ID NO: 118 [SEQ ID NO: 137 включает сигнальную последовательность].
Предварительная заявка на патент США № 61/918,946 дополнительно обеспечивает: полноразмерную нуклеотидную последовательность для собачьего PD-L1 (cPD-L1) SEQ ID NO: 119 [SEQ ID NO: 135 включает сигнальную последовательность]; соответствующую транслированную аминокислотную последовательность SEQ ID NO: 120 [SEQ ID NO: 136 включает сигнальную последовательность]; нуклеотидную последовательность, кодирующую внеклеточный домен (ECD) собачьего PD-L1, SEQ ID NO: 121; аминокислотную последовательность ECD собачьего PD-L1, SEQ ID NO: 122; нуклеотидную последовательность собачьего PD-L1 ECD плюс GT линкер и Fc часть человеческого гена Fc IgG1, SEQ ID NO: 123; и аминокислотную последовательность собачьего PD-L1 ECD плюс GT линкер и Fc часть человеческого гена Fc IgG1, SEQ ID NO: 124.
ПРИМЕР 2
МЫШИНЫЕ АНТИТЕЛА ПРОТИВ СОБАЧЬЕГО PD-1
Получение моноклонального антитела против собачьего PD1:
В общей сложности трех Balb/c мышей иммунизировали несколько раз (каждый раз 10 μг) в течение 17 дневного периода. Иммунизирующий антиген представлял собачий слитый белок PD-1 ECD-Fc. После иммунизации собирали сыворотку каждой мыши, проводили тестирование на реактивность к целевому собачьему белку PD-1 ECD-HIS. Клетки печени мышей с самым высоким титром сыворотки против PD-1 ECD-HIS слили с клеточной линией миеломы P3X63Ag8.653. Через около 2 недели после слития супернатант клеток предполагаемой гибридомы протестировали при использовании ELISA на реактивность к целевому белкку PD-1 ECD-HIS. Гибридомы, продуцирующие резко-положительные сигналы, в ELISA субклонировали серийным разведением и снова протестировали на реактивность к целевому белку собачьего PD-1 ECD-HIS.
Подтверждение реактивности моноклональных антител против собачьего PD-1:
Реактивность антитела, секретированного гибридомами к ECD собачьего PD-1 подтверждали при использовании ELISA. Гибридомные клетки культивировали при использовании биореакторов CELLine (Integra-biosciences) в течение 10-30 дней. Сначала клетки выдерживали в DMEM с добавлением 4 мM на л глутамина и 10% Ultra Low IgG фетальной бычьей сыворотки (FBS) от Gibco. Гибридомные клетки высеяли в клеточные камеры биореактора CELLine с плотностью клеток около 2×106 клетки/мл в 15 мл той же самой среды с концентрацией FBS, повышенной до 20%. Внешнюю камеру заполнили 1 л питательной среды (DMEM с 4 мM на л глутамина и 2% стандартной FBS). Гибридомные клетки в клеточной камере размножились до около 2,5×107 клеток/мл в течение 3-7 дней. Затем из клеточной камеры собрали 10 мл клеточной суспензии и поместили на свежую среду для последующего размножения клеток и затем провели сбор клеток. Эту процедуру повторяли по необходимости для получения адекватных количеств mAb от каждого клона гибридомы. Суспензии собранных клеток центрифугировали и фильтровали супернатанты через 0,2 микронную фильтрационную мембрану. Для очистки антитела супернатант каждого клона очистили при использовании Protein G Sepharose 4 Fast flow 5 мл колонки (GE Healthcare) самотеком. После промывки буфером трис ЭДТА (TE) pH 8,0, связанные антитела элюировали при использовании 0,1 M глицинового буфера, pH 2,7, с последующей нейтрализацией pH при использовании 1 M трис, pH 8,0. Антитела концентрировали и заменили буфер на фосфатно-солевой буфер (PBS) при использовании установок - фильтрующих центрифуг Centriprep® YM-10, 10 кДа NMWL (Ultracel-10 представляет собой ультрафильтрационную мембрану с NMWL 10000 кДа из регенерированной целлюлозы,) (Millipore). Концентрации антител оценивали при использовании спектрофотометрии.
Очищенные mAbs против собачьего PD-1 протестировали на реактивность к HIS-целевым ECD домену собачьего PD-1 при использовании ELISA следующим образом: HIS-целевой ECD собачьего PD-1 белка развели до 10 μг/мл в буфере для сенсибилизации поверхностей (Carbonate/Bicarbonate pH 9,0) и распределили в 100 μл/лунку 96-луночных плоскодонных планшетов ELISA (NUNC). Планшеты инкубировали при температуре 4°C в течение ночи. Затем планшеты промыли три раза фосфатно-солевым буфером, содержащим 0,05% Tween® 20 (PBST). Затем добавили 200 μл блокирующего буфера (5% обезжиренного молока в PBST) в каждую лунку и инкубировали при температуре 37°C в течение 60 минут. Затем планшеты промыли три раза PBST. Далее 100 μл тестируемых mAbs, разведенных в блокирующем буфере, добавили в первые лунки соответствующих колонок. Затем тестируемые mAbs двухкратно развели в соответствующем положении планшета. После инкубирования планшетов при температуре 37°C в течение 60 минут, планшеты промыли три раза PBST. Далее в планшеты добавили 100 μl на лунку 1:2,000 разведения козий пероксидазный конъюгат хрена против IgG мыши (KPL), которые затем инкубировали при температуре 37°C в течение 60 минут. Затем планшеты промыли три раза PBST и добавили в планшеты 100 μл/лунку 3,3',5,5' тетраметил бензидина, (TMB) субстрат (из KPL). Позволили развиться цветной реакции в течение 5-20 минут при температуре 37°C перед измерением поглощения при 650 нм.
CHO клетки, экспрессирующие собачий PD-1 белок:
Полноразмерный собачий PD-1 ген клонировали в плазмиде p96793. В этой плазмиде провели экспрессию PD-1 белка при использовании промотора hCMV. CHO DXB11 клетки (dhfr-) выдерживали в MEM-альфа (Gibco) с добавлением 10% фетальной бычьей сыворотки. Трансфецировали CHO клетки плазмидой p96793 в 75 см2 колбах, содержащих около 6×106 клеток, липосомно-опосредованной доставкой генов при использовании липофектамина (Invitrogen). Через 48 часов клетки переместили в MEM-альфа среду без нуклеотидов с добавлением 10% FBS и 400 μг/мл гидромицина B (селективная среда). Провели клонирование методом серийных разведений в пуле dhfr+ гидромицин резистентных клеток. Провели оценку клонов на экспрессию собачьего PD-1 при использовании иммунофлуоресцентного анализа. Кратко, монослои клеток зафиксировали в 96 луночных планшетах 80% ацетоном. Зафиксированные и высушенные монослои клеток затем инкубировали в течение 1 часа с поликлональным козьим антителом против человеческого PD-1 (R&D Systems). Планшеты промыли PBS, затем инкубировали в течение 1 часа с флуоресцентно-меченным кроличьим антителом против козьего IgG (KPL). Планшеты промыли PBS. Клоны, демонстрировавшие флуоресценцию, размножили с получением запаса клеток.
Реактивность мышиных mAbs против собачьего PD-1 белка, экспрессированного CHO клетками:
Реактивность мышиных mAbs против собачьего PD-1 к собачим PD-1 на CHO клетках определили исследованием на клетках при использовании CHO клеток, экспрессирующих PD-1. Кратко, CHO клетки, экспрессирующие собачий PD-1, культивировали до 80-100% заселенности в 50 μл среды (DMEM/HAM's F12, 10% FBS). Далее 50 μл среды, содержащей различные концентрации очищенных mAbs, добавили на 1 час при температуре 37°C. Затем промыли три раза PBS-Tween, 100 μл козьего пероксидазного конъюгата хрена против мыши (HRP), разведенного 1:1000 в культуральной среде, добавили на один час при температуре 37°C. После трех дополнительных промывок PBS-Tween, связанные mAbs визуализировали при использовании пероксидазного субстрата (TMB). Увеличение поглощения света из-за активности пероксидазы 450 нм измерили с использованием считывающего устройства для микропланшетов.
Характеристика мышиного антитела против собачьего PD-1:
Как указано выше, наряду с Предварительной заявкой на патент США № 61/918,946, поданной 20 декабря 2013, введенной здесь ссылкой в полном объеме, мышиное антитело против собачьего PD-1 характеризуется множеством параметров, включая: реактивность к ECD собачьего PD-1 при использовании ELISA, реактивность к PD-1, экспрессированному на поверхности CHO клетки, способность блокировать связывание PD-1 с PD-L1 и способность связываться с PBMC клетками от здоровой собаки и от собаки с раком. Выбрали аминокислотные последовательности CDRs семи мышиных антител против собачьего PD-1 (обозначенные, как IB5, 2G9, 2H9, 3B6, 4D12, 5G5 и 7C9, соответственно), обладавшие значительной гомологией, как приведено в Таблице 2 ниже.
|
ПРИМЕР 3
КАНИНИЗАЦИЯ И ХАРАКТЕРИСТИКА КАНИНИЗИРОВАННОГО АНТИТЕЛА
Для получения канинизированных антител необходимо идентифицировать ДНК последовательность, кодирующую тяжелую и легкую цепи собачьего IgG. Нуклеотидные и аминокислотные последовательности собачьей тяжелой цепи могут быть получены из NCBI гена и базы данных белка. Существует четыре известных подкласса собачьего IgG: IgGA, IgGB, IgGC и IgGD и два типа легких цепей: каппа и лямбда. В Таблице 7 приведены аминокислотная и нуклеотидная SEQ ID NO не модифицированных Fc фрагментов собачьего антитела.
Не ограничиваясь каким-либо конкретным подходом получения вариантов моноклональные антитела против PD-1 с различным содержанием собачьих и мышиных последовательностей, способ включен в следующую общую схему:
i) Определение нуклеотидной последовательности VH и VL цепей мышиных mAbs;
ii) Идентификация CDRs H и L цепи мышиных mAbs;
iii) Идентификация подходящей H и L цепи собачьего IgG;
iv) Определение нуклеотидной последовательности H и L цепей собачьего IgG;
v) Замена нуклеотидной последовательности, кодирующей эндогенные CDRs собачьих H и L цепей, нуклеотидными последовательностями, кодирующими соответствующие мышиные CDRs. Также необязательная замена некоторых остатков собачьего каркаса на выбранные остатки областей мышиного каркаса;
vi) Синтез нуклеотида со стадии (v) и вставка в подходящую экспрессионную плазмиду; Трансфекция плазмид в подходящие клетки, например, HEK 293 клетки;
vii) Очистка экспрессированного антитела от супернатанта HEK 293; и
viii)Тестирование очищенного антитела на связывание с собачьим PD-1.
Для получения ряда вараинтов канинизированных антител с различным содержанием собачьих и мышиных последовательностей провели ряд экспериментов, следуя указанным выше стадиям.
Реактивность канинизированных mAbs против собачьего PD-1 белка, экспрессированного на CHO клетках:
Реактивность мышиных mAbs канинизированных собачим PD-1 против собачьего PD-1 на CHO клетках определили исследованием на клетках при использовании CHO клеток, экспрессирующих PD-1. Кратко, CHO клетки, экспрессирующие собачий PD-1, культивировали до 80-100% заселенности в 50 μл среды (DMEM/HAM's F12, 10% FBS). Далее 50 μл среды, содержащей различные концентрации очищенных mAbs, добавили на 1 час при температуре 37°C. Затем промыли три раза PBS-Tween, 100 μл козьего пероксидазного конъюгата хрена против мыши (HRP), разведенного 1:1000 в культуральной среде добавили на один час при температуре 37°C. После трех дополнительных промывок PBS-Tween, связанные mAbs визуализировали с использованием пероксидазного субстрата (TMB). Увеличение поглощения света из-за активности пероксидазы 450 нм измерили с использованием считывающего устройства для микропланшетов.
Исследование связывания мышиных mAbs против собачьего PD-1 и канинизированных собачим PD-1 мышиных mAbs против собачьего PD-1
Около 70 резонансных единиц (RU) антигена собачьего PD-1 иммобилизовали прямым аминным спариванием. Измерение аффиности провели на основе технологии свободного от мечения поверхностного плазмонного резонанса (например, Biacore® T200) со временем ассоциации 300 секунд, временем диссоциации 1200 секунд, при наномолярных концентрациях 50, 100, 200 (x2) 400 и 800 (нM). Использовали подбор модели связываний 1:1. Антиген (собачий PD-1) иммобилизовали на сенсорном чипе через аминное спаривание и в качестве аналитов использовали четыре антитела, как указано в Таблице 14 ниже, которые пропускали по поверхности антигена. Результаты показали, что аффиность связывания антитела против собачьего PD-1 по настоящему изобретению для собачьего PD-1 антигена -сильная, с наномолярной и даже субмолярной константами диссоциации (Kd). Дополнительно моноклональное мышиное антитело против собачьего PD-1 и соответствующее канинизированное моноклональное мышиное антитело против собачье PD-1 из одного и того же клона дали поразительно схожие показатели Kd (смотрите, Таблица 14 ниже).
|
Блокировка лиганда канинизированными mAbs против собачьего PD1:
Для канинизированного антитела, реагирующего с собачьим PD-1 (cPD-1), использовали анализ на основе клеточного ELISA (CELISA), который основывается на клеточной линии CHO, экспрессирующей собачий PD-1. Кратко, cPD-1 CHO клетки поместили в 96-луночные планшеты при 4x104 клеток на лунку и инкубировали клетки при температуре 37°C в течение 18-24 часов до достижения 95-100% заселенности. Культуральную среду удалили отсасыванием, планшеты промыли 3x PBS плюс 0,05% Tween® 20 и 1x CHO средой. Получили 3-кратные серийные разведения канинизированных mAbs против cPD1 в CHO среде, и добавили в планшет, начиная с 30 μг/мл и 50 μл/лунку каждого разведения антитела. Затем планшеты инкубировали при температуре 37°C, 5% CO2 в течение 30 минут, при встряхивании. Добавили человеческий PD-L1-Fc в 4 μг/мл в CHO среду, 50 μл/лунку без удаления или промывки инкубированных mAbs против PD1, затем инкубировали при температуре 37°C, 5% CO2 в течение 45 минут, при встряхивании. Планшеты промыли 6x PBS плюс 0,05% Tween® 20, добавили 100 μл/лунку против человеческого Fc-HRP (Calbiochem) (1:2500) в CHO среде и инкубировали при температуре 37°C/5% CO2 в течение 30-60 минут (против человеческого Fc-HRP не связывается с собачьим Fc.). Планшеты промыли 5x PBS плюс 0,05% Tween® 20, добавили 100 μл/лунку TMB микролуночного субстрата и затем инкубировали при комнатной температуре в течение 10 минут. Реакцию остановили 100 μл/лунку 1,5 M фосфорной кислоты. Показатели A450-A620 на считывающем устройстве ELISA.
Выделение цитокина из собачьего PBMC:
PBMC получили из EDTA образцов крови, полученных от здоровых собак и от собак с раком при использовании разделения Фиколла. Клетки промыли 3 раза и ресуспендировали в полной среде для культуры тканей в концентрации 2,5×105 с трех кратным повторном лунок в 96-луночных планшетах. Клетки активировали конканавалином A в концентрации 1 μг/мл. Тестируемые антитела добавили в различных концентрациях и инкубировали культуры в течение 96 часов. Контроли включали клетки, инкубированные с conA и без антител или с conA и иррелевантными изотипически сходными антителами. Через 96 часов культивирования собрали супернатанты и провели анализ на выделение IFN-ᵧ при использовании коммерческого собачьего IFN-ᵧ набора ELISA (R & D Systems) [смотрите, Фигура 4].
ПРИМЕР 4
ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ СОБАЧЬИ IgGs
Для получения вариантов собачьего IgG с отсутствующими эффекторными функциями получили множество мутантных тяжелых цепей собачьего IgGB. Эти варианты могут включать одно из следующих: одиночного или комбинированного замещения в Fc части тяжелой цепи аминокислотной последовательности: P4A, D31A, N63A, G64P, T65A, A93G и P95A. Варианты тяжелых цепей (то есть, содержащих такие аминокислотные замещения) клонировали в экспрессионных плазмидах и трансфецировали в HEK 293 клетки вместе с плазмидой, содержащей ген, кодирующий легкую цепь. Экспрессированные интактные антитела очистили от HEK 293 клеток и провели оценку связывания с FcγRI и C1q для оценки потенциала опосредования иммунных эффекторных функций. В Таблице 3 приведены примеры плазмид, кодирующих тяжелые цепи генетически модифицированного канинизированного антитела, канинизированные тяжелые цепи; и генетические модификации в этих тяжелых цепях. Вариант тяжелой цепи использовали для оценки эффекторной функции в генетически модифицированных mAbs. Все тяжелые цепи содержали CDRs из 2H9 мышиного антитела против собачьего PD-1.
|
FcᵧRI связывание:
Связывание с FcRγI представляет критерий способности антитела опосредовать ADCC антитела. Для оценки этого свойства провели анализ канинизированного антитела для измерения связывания канинизированного антитела с FcγRI следующим образом: Покрыли пленкой 96-луночные планшеты 100 μл на лунку 2,5 μг/мл PD-1 HIS. Инкубировали при температуре 2-7°C в течение ночи. Планшеты доводили до комнатной температуры в течение 15 минут. Планшеты промыли 3X фосфатно-солевым буфером, содержащим 0,05% Tween® 20 (PBST), и затем блокировали лунки при использовании 200 μл/лунку 5% NFDM (нежирное сухое молоко). Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 3X PBST. Провели 2-кратное разведение антитела, начиная с 1 μг/мл в 5% NFDM. Добавили 100 μл/лунку разведенного антитела. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку рекомбинантного человеческого CD64 белка (R&D systems), разведенного до 1 μг/мл. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку биотинилированного антитела против CD64 (R&D systems), разведенного до 1:3000. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку антитело+стрептавидин-HRP (R&D systems), разведенного до 1:7500. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку субстрата TMB. Инкубировали в течение 10 минут при температуре 15-30°C. Для считывания планшетов использовали считывающее устройство планшетного типа ELISA при 450-540 нм.
Результаты: На Фигуре 5A показано, что канинизированное mAb, обозначенное, как can2H9 ADCC mut-1 VH4/VL3, которое имело генетическую модификацию D31A, или mAb, обозначенное, как can2H9 ADCC mut-2 VH4/VL3, которое имело генетическую модификацию N63A, продемонстрировали практически полное снижение связывания с FcγRI. С другой стороны, mab, обозначенное, как can2H9 ADCC (1062) VH4/VL3, которое содержит комбинированные генетические модификации D31A плюс N63A, не продемонстрировало детектируемое связывание с FcγRI. На Фигуре 5A can2H9 IgGD VH4/VL3, представляющий канинизированное антитело, которое содержит Fc из собачьего IgGD, и can3B6 VH4/VL4 IgGB, представляющее канинизированное антитело, которое не связывается с покрывающим антигеном (PD-1 HIS), и канинизированное mAb, которое обозначено, как can2H9 VH4/VL3, представляет антитело, которое содержит не модифицированный Fc IgGB. На Фигуре 5B показано, что канинизированное mAb, обозначенное, как can2H9 ADCC(1059) VH4/VL3, которое содержит генетическую модификацию P4A, и mAb, обозначенное, как can2H9 ADCC (1061) VH4/VL3, которое содержит генетическую модификацию P95A, продемонстрировало значительное снижение связывания FcγRI, при этом mAb, обозначенное, как can2H9 ADCC(1060) VH4/VL3, которое содержит генетическую модификацию A93G, продемонстрировало слабое снижение связывания с FcγRI. С другой стороны, mAb, обозначенное, как can2H9 IgGB ADCC (1068) VH4/VL3, которое содержит пять генетических модификаций (D31A, N63A, P4A, A93G, P95A), продемонстрировало полное отсутствие связывания с FcγRI.
C1q связывание:
Связывание с первым компонентом комплемента C1q представляет критерий способности антитела опосредовать CDC. Для оценки этого свойства провели анализ канинизированного антитела для измерения связывания канинизированного антитела с C1q следующим образом: Покрыли пленкой 96-луночные планшеты 100 μл на лунку 2,5 μг/мл PD-1 HIS. Инкубировали при температуре 2-7°C в течение ночи. Планшеты доводили до комнатной температуры в течение 15 минут. Планшеты промыли 3X PBST. Блокировали 200 μл/лунку 5% BSA. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 3X PBST. Провели 2-кратное разведение антитела, начиная с 1 μг/мл в 5% BSA. Добавили 100 μл/лунку разведенного антитела. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку C1q белка до 4 μг/мл. Инкубировали в течение 60 минут при температуре 36-38°C. Добавили 100 μл/лунку покрывающего антитела против C1q, разведенного до 1:3000. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST.
Добавили 100 μл/лунку ослиного против козьего антитела - HRP, разведенного до 1:10000. Инкубировали в течение 60 минут при температуре 36-38°C. Промыли 6X PBST. Добавили 100 μл/лунку субстрата TMB. Инкубировали в течение 10 минут при температуре 15-30°C. Для считывания планшетов использовали считывающее устройство планшетного типа ELISA при 450-540 нм.
Результаты: На Фигуре 6A показано, что канинизированное mAb, обозначенное, как can2H9VH4 IgGB ADCC (mut-1)/VL3, которое имеет генетическую модификацию D31A, или mAb, обозначенное, как can2H9 VH4 IgGB ADCC (mut-2)/VL3, которое имеет генетическую модификацию N63A, продемонстрировало значительное снижение связывания с C1q. С другой стороны, mAb, обозначенное, как can2H9 VH4 IgGB ADCC (1062)/VL3, которое содержит комбинированные генетические модификации D31A плюс N63A, не продемонстрировало детектируемое связывание с C1q.
На Фигуре 6A can2H9 VH4 IgGD/VL3, представляющее канинизированное антитело, которое содержит Fc из собачьего IgGD, и can3B6 VH4/VL4 IgGB, представляющее канинизированное антитело, которое не связывается с покрывающим антигеном (PD-1 HIS), и канинизированное mAb, обозначенное, как can2H9 VH4/VL3 IgGB, представляет антитело, которое содержит не мутированный IgGB Fc. На Фигуре 6B показано, что канинизированное mAb, обозначенное, как can2H9 VH4 IgGB ADCC(1059)/VL3, которое содержит замещение P4A, и mAb, обозначенное, как can2H9 VH4 IgGB ADCC (1061)/VL3, которая содержит замещение P95A, продемонстрировало значительное снижение связывание с C1q, при этом mAb, обозначенное, как can2H9 VH4 IgGB ADCC(1060)/VL3, которое содержит замещение A93G, продемонстрировало усиление связывания с C1q. С другой стороны, mAb, обозначенное, как can2H9 VH4 IgGB ADCC (1068) /VL3, которое содержит пять замещений (D31A, N63A, P4A, A93G, P95A), продемонстрировало полное отсутствие связывания с C1q. На Фигуре 6B mAb, обозначенное, как can3B6 VH4/VL4 IgGB, представляет канинизированное антитело, которое не связывается с покрывающим антигеном (PD-1 HIS), и канинизированное mAb, обозначенное, как can2H9 VH4/VL3 IgGB, представляет антитело, которое содержит не мутированный IgGB Fc.
|
|
|
|
|
|
Потенциальные специфические замещения в P4, D31, N63, G64,T65, A93 и P95
|
|
ПРИМЕР 5
КАРТИРОВАНИЕ ЭПИТОПА АНТИТЕЛА ПРОТИВ СОБАЧЬЕГО PD-1
Введение
Взаимодействие антитела с его распознанным белковым антигеном опосредованно через связывание специфических аминокислот (активных центров) антитела со специфическими аминокислотами (эпитопы) целевых антигенов. Эпитоп представляет антигенный детерминант, который вызывает специфическую реакцию иммуноглобулина. Он состоит из группы аминокислот на поверхности антигена.
Интересующий белок может содержать несколько эпитопов, которые распознаются различными антителами. Эпитопы, распознанные антителами, классифицируются как линейные или конформационные эпитопы. Линейные эпитопы формируются вытягиванием непрерывной последовательности аминокислот белка, в то время, как конформационные эпитопы состоят из аминокислот, которые являются дискретными (например, на большом расстоянии друг от друга) в первичной аминокислотной последовательности, но сходятся вместе в трехмерной укладке белка.
Картирование эпитопа относится к процессу идентификации аминокислотных последовательностей (то есть, эпитопов), которые распознаются антителом на их целевых антигенах. Идентификация эпитопов, распознанных моноклональными антителами (mAbs) на целевых антигенах, имеет важное значение. Например, это может помогать при разработке новых терапевтических средств, диагностических средств и вакцин. Картирование эпитопа также может помочь в выборе оптимальных терапевтических mAbs и помогает выяснить механизм их действия. Информация об эпитопе также может объяснить уникальные эпитопы рака и определить защитные или патогеннные эффекты вакцины.
Картирование эпитопа может быть проведено при использовании поликлональных или моноклональных антител, и для идентификации используют несколько способов в зависимости от предполагаемой природы эпитопа (то есть, линейный по сравнению с конформационным). Картирование линейных эпитопов более простое и относительно проще для выполнения. Для этой цели коммерческие организации для картирования линейных эпитопов часто используют сканирование пептидов. В таком случае химически синтезируют ряд перекрывающихся коротких пептидных последовательностей целевого белка и тестируют его на способность связываться с интересующим антителом. Такой подход является быстрым, имеет высокую пропускную способность и относительно недорог в осуществлении. С другой стороны, картирование прерывистого эпитопа технически более сложное и требует более специализированных методов, таких как рентгеновская кристаллография моноклонального антитела совместно с целевым белком, водород-дейтериевый (H/D) обмен, и/или масс-спектроскопия совместно с ферментативным расщеплением.
Картирование эпитопов PD-1 при использовании микроматриц ProImmune®:
Для идентификации аминокислот, которые образуют эпитопы для mAbs против PD1, химически синтезировали всего 28 пептидов, которые тмели 15 аминокислот в длину и перекрывались 10 аминокислотами. Эту библиотеку перекрывающихся пептидов разработали для охвата полноразмерного собачьего белка PD-1. Определение антитело-связывающего пептида провели связыванием образцов антитела с пептидной микроматрицей ProArray Ultra® с последующим инкубированием с вторичным флуоресцентно-меченным антителом. Все пептиды синтезировали отдельно и затем связывали с поверхностью слайда ProImmune® наряду с контролями мышиных IgG ProImmune®. Такой оптимизированный процесс гарантирует, что пептиды будут присутствовать на эррее, таким образом, что он близко иммитирует свойства соответствующей области белка, обходя природную физикохимическую вариацию свободных пептидов и делая совместимой комбинированную эррей платформу пептида и белка. Тестируемые аналиты (пептиды) расположили на слайде ProArray Ultra® в отдельных точках подходящих gal-файлов, что позволяет точно сгруппировать полученный массив признаков по отношению к внесенному аналиту. Слайды ProArray Ultra® блокировали при использовании валидированного блокирующего буфера для снижения неспецифического связывания mAbs. Затем их инкубировали с образцами mAb, с последующим инкубированием со специфическим вторичным флуоресцентно-меченным антителом. После нескольких стадий промывки, эррей ProArray Ultra® высушили и провели сканирование при использовании флуорисцентной сканирующей системы микроматриц с высоким разрешением. После сканирования флуорисцентно меченных слайдов ProArray Ultra® сканер записывает изображение, которое оценивают при использовании программного обеспечения для анализа изображений, позволяя интерпретировать и проводить количественную оценку уровней интенсивности флуоресценции, связанных с каждой флуоресцентной точкой на отсканированном слайде микроматрицы. Результаты этого эксперимента показали, что некоторые пептиды собачьего PD-1 были распознаны некоторыми из оцениваемых mAbs. Идентичность mAbs и аминокислотной последовательности, распознаваемой этими mAbs, приведена в Таблице 12. Это исследование показало, что mAb 2H9 распознает эпитоп, расположенный во внеклеточном домене собачьего PD-1, содержащем аминокислотную последовательность, представленную SEQ ID NO: 138, и что mAb 1A1 распознает эпитоп, содержащий аминокислотную последовательность, представленную SEQ ID NO: 138, и перекрывающая аминокислотная последовательность представлена аминокислотной последовательностью SEQ ID NO: 139.
Картирование эпитопов PD-1 при использовании масс-спектрометрии:
Для идентификации потенциально прерывистых эпитопов, распознанных против собачьего PD-1, использовали способ на основе химического перекрестного сшивания и детекцию масс-спектрометрией (CovalX® Instrument Incorporated). Применение этой технологии для картирования эпитопа собачьего PD-1 позволяет идентифицировать по меньшей мере части эпитопов, распознанные указанными mAbs, которые представляют приведенные в Таблице 13. Как видно из Таблицы 13, mAb 3B6 распознает по меньшей мере часть эпитопа, расположенного во внеклеточном домене собачьего PD-1 в аминокислотной последовательности, представленной SEQ ID NO: 140, и что mAb 2G9 распознает по меньшей мере часть эпитопа в аминокислотной последовательности, представленной SEQ ID NO: 141. С другой стороны, mAb 1E4 и mAb 1B5 распознают по меньшей мере часть эпитопа в аминокислотной последовательности, представленной SEQ ID NO: 142, в аминокислотной последовательности, представленной SEQ ID NO: 143, соответственно.
Как показано на Фигуре 9A, определение, проведенное при использовании химического перекрестного сшивания, детектора частиц с высокой массой в сочетании с масс-спектрометрией (High-Mass MALDI mass spectrometry) и не линейной хроматографии с орбитальной ионной ловушкой в сочетании с масс- спектрометрией (nLC-Orbitrap mass spectrometry) показало, что эпитоп на собачьем PD-1, распознанный канинизированным антителом 2G9, содержит R62, R69, R72 и R75 SEQ ID NO: 114. Аналогичное определение для эпитопа на собачьем PD-1, распознанного канинизированным антителом 3B6, содержит R75 и R90 SEQ ID NO: 114. Соответственно, R75 по-видимому оказывается очень важным важным аминокислотным остатком в одном или более эпитопе собачьего PD-1. Интересно, что после проведения этих анализов было установлено, что аминокислотная последовательность для CDRs 1A1 идентична таковой 2G9. Совместимость между областью на PD-1, с которой связывается 2G9, и установленная для 1A1, которая была получена этими двумя очень разными методами, указывает на то, что область содержит аминокислотные остатки, составляющие эпитоп PD-1, который распознается антителом против собачьего PD-1 (смотрите, Таблицы 12 и 13 ниже).
Дополнительно, область аминокислотной последовательности PD-1, которая распознается блокирующим протестированным антителом по настоящему изобретению, расположена во внеклеточном домене собачьего PD-1. Распознанная область состоит из следующего пептида (смотрите, Таблицы 12 и 13 ниже).
NQTDKLAAFQEDRIEPGRDRRFRVM*RLPNGRDFHMSIVAARLNDS (SEQ ID NO:144)
В этом пептиде представлен более короткий пептид, который выделен жирным шрифтом. Более короткий пептид был распознан при использовании микроматрицы ProImmune® (смотрите, Таблица 12).
DRIEPGRDRRFRVM*RLPNGR (SEQ ID NO:145).
Следует отметить, что R62, R69, R72 и R75 SEQ ID NO: 114 все входят в состав, как более длинного пептида (SEQ ID NO: 144), так и более короткого пептида (SEQ ID NO: 145), при этом R90 SEQ ID NO: 114 присутствует в более длинном пептиде. Эти пять аргининовых остатков по-видимому являются очень важными аминокислотными остатками в одном или более эпитопе собачьего PD-1. Как указано в Таблицах 6-8, помеченный звездочкой метиониновый остаток (*) также указывался как представляющий треониновый остаток been.
|
|
Все ссылки, приведенные в описании настоящей патентной заявки, введены ссылками в том же объеме, как если бы это была отдельная публикация, значение в базе данных (например, Genbank sequences или GeneID entries), патентная заявка или патент был конкретно или отдельно указан вводимой ссылкой. Это утверждение о введение ссылкой, как предполагается заявителями, в соответствии с 37 C.F.R. §1.57(b)(1), относительно каждой и каждой отдельной публикации, значению в базе данных (например, Genbank sequences или GeneID entries), патентной заявке или патенту, каждое из которых четко определено в соответствии с 37 C.F.R. §1.57(b)(2), даже если с таким цитированием в непосредственной близости не приведено специального утверждение о введении ссылкой. Включение при использовании специальных утверждений о введении ссылкой, если такое имеет место быть, в описании никаким образом не ослабляет это общее утверждение о введении ссылкой. Цитирование ссылок в описании настоящей патентной заявки не следует рассматривать, как признание того, что ссылка относится к предшествующему уровню техники, а также не предполагает какого-либо признания в качестве содержимого или данных этих публикаций или документов.
Объем притязаний настоящего изобретения не ограничивается приведенными конкретными вариантами его воплощения. Естественным образом, специалисту в области техники, к которой относится настоящее изобретение, будут понятны различные модификации настоящего изобретения в дополнение к приведенному в указанном выше описании и приложенных фигурах. Такие модификации также входят в объем притязаний настоящего изобретения, изложенный в приложенной формуле изобретения.
Приведенное выше описание считается достаточным для возможности осуществления настоящего изобретения специалистом в области техники, к которой относится настоящее изобретение. Различные модификации настоящего изобретения дополнительно к приведенным и описанным выше будут ясны специалисту в области техники, к которой относится настоящее изобретение из приведенного выше описания, и входят в объем притязаний, изложенный в приложенной формуле изобретения.