Результат интеллектуальной деятельности: НОВЫЕ ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ ДЛЯ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПРОДУКТА
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к области технологии рекомбинантной экспрессии. Настоящее изобретение inter alia относится к модифицированным эукариотическим клеткам, способным к повышенному продуцированию представляющего интерес продукта, а также к использованию в методах рекомбинантной экспрессии. Кроме того, настоящее изобретение относится к способам, которые позволяют предварительно, еще в процессе отбора, идентифицировать эукариотические клетки, которые экспрессируют рекомбинантный продукт с высоким выходом и повышенной стабильностью, исходя из профиля экспрессии эукариотических клеток. Предпочтительной эукариотической клеткой является клетка млекопитающего.
Предшествующий уровень техники
Рынок биофармацевтических средств продолжает быстро расширяться, поскольку биофармацевтические средства приобретают все более важное значение в современной медицине. В настоящее время все возрастающее число биофармацевтических средств продуцируется с использованием эукариотических клеток, а в частности, таких как клетки млекопитающих. Таким образом, эффективное и крупномасштабное продуцирование биофармацевтических средства в клетках млекопитающих имеет исключительно важное значение. Генерирование клеточных линий, продуцирующих представляющий интерес терапевтический белок, занимает значительную часть времени, необходимого для доставки любого биофармацевтического материала в клинику. Кроме того, также важно учесть стоимость приготовления биофармацевтических средств, поскольку для их продуцирования необходимо получить рекомбинантные эукариотические клеточные линии со стабильной и высокопродуктивной экспрессией, а в частности клеточные линии млекопитающих.
Для эффективного продуцирования биофармацевтических средств, а в частности, в промышленном масштабе, были приложены огромные усилия на разработку способа отбора клона в целях идентификации высокопродуктивных клонов, обладающих способностью к стабильной экспрессии и к росту в течение короткого периода времени. Создание рекомбинантных клеточных клонов для продуцирования терапевтических белков обычно включает проведение избыточного скрининга отдельных клонов в целях детектирования и выделения клонов с высоким уровнем экспрессии. Однако даже если в результате такого скрининга будут идентифицированы клоны с высоким уровнем экспрессии, то эти исходные клоны часто теряют свои преимущественные экспрессионные свойства, и со временем, будет наблюдаться снижение уровня экспрессии. Такое постепенное снижение экспрессии рекомбинантного белка в клеточных клонах в процессе длительного субкультивирования является общей проблемой при продуцировании многих клеточных линий, таких как клеточные линии CHO, и этот процесс называется нестабильностью. Такая нестабильность серьезно препятствует успешному осуществлению способа промышленного продуцирования рекомбинантных полипептидов. Поэтому для идентификации в популяции клеток и даже среди клеточных клонов, эфффективно экспрессирующих представляющий интерес белок, сначала следует выбрать клетки и, соответственно, клеточные клоны, с высоким выходом этого белка, которые также обладают высокой стабильностью при продуцировании в процессе длительного культивирования, а поэтому они не будут постепенно терять способность к экспрессии рекомбинантного белка. Такие клоны также называются «стабильными» клонами. В процессе длительного культивирования, стабильные клоны не должны терять более чем 30%, а предпочтительно, 25% от своей первоначальной продуктивности в течение 8-12 недель. Продуктивность определяют как волюметрическую продуктивность, которая выражается в количестве белка на объем (например, г/л) за определенный период культивирования, и соответственно, как удельную клеточную продуктивность, которая представляет собой определенное количество экспрессированного белка на клетку в день (например, пг/клетку/день). Для исключения вероятности того, что клеточный клон, отобранный для последующего крупномасштабного продуцирования, будет иметь предрасположенность к нестабильности, а следовательно будет иметь низкий титр в процессе длительного культивирования, обычно проводят тщательные анализы на стабильность в течение периода времени от нескольких недель до нескольких месяцев для удаления клеточных клонов, которые становятся нестабильными в течение этого периода времени, и для идентификации стабильных клонов. Следовательно, генерирование рекомбинантных клеточных клонов в целях продуцирования терапевтических белков и других рекомбинантных полипептидов, продуцируемых в больших объемах, обычно включает избыточный и длительный скрининг отдельных клонов для идентификации клеточных клонов с высоким уровнем экспрессии, которые также обладают экспрессионной стабильностью, необходимой для крупномасштабного продуцирования. Такая практика затягивает биотехнологические процессы, такие как процессы приготовления биофармацевтических средств. Даже если используется система отбора с высокой жесткостью, которая благоприятствует выживанию клеток с высоким уровнем экспрессии в этих условиях отбора, то в популяции выживших клеток достаточно трудно найти подходящий продуктивный клон, который имел бы высокий уровень экспрессии и, при этом, сохранял бы хороший рост и стабильность.
Целью настоящего изобретения является повышение уровня рекомбинантного продуцирования представляющего интерес продукта в эукариотических клетках, таких как, в частности, клетки млекопитающих. В частности, целью настоящего изобретения является получение новой эукариотической клеточной линии, которая, после ее трансфекции полинуклеотидом, кодирующим представляющий интерес продукт, будет экспрессировать этот продукт с более высоким выходом. Кроме того, одной из целей настоящего изобретения является разработка способа отбора, позволяющего идентифицировать успешно трансфецированные клетки с более высоким уровнем экспрессии. Кроме того, целью настоящего изобретения является разработка усовершенствованного способа рекомбинантного продуцирования представляющего интерес продукта. Более того, одной из целей настоящего изобретения является разработка способов анализа, позволяющих идентифицировать рекомбинантные клеточные клоны с высоким и низким уровнем продуцирования белка и/или стабильные и нестабильные клеточные клоны на ранней стадии развития.
Описание сущности изобретения
Настоящее изобретение основано inter alia на неожиданном обнаружении того факта, что ингибирование функции продукта экспрессии гена C12orf35 в эукариотической клетке, например, путем снижения или блокирования функциональной экспрессии гена C12orf35 в указанной клетке, позволяет значительно повысить уровень экспрессии представляющего интерес рекомбинантного продукта в указанной клетке. Таким образом, был идентифицирован ключевой ген, который ингибирует рекомбинантную экспрессию. Ингибирование функции продукта экспрессии гена C12orf35 в клетке, описанной в настоящей заявке, позволяет значительно повысить уровень рекомбинантного продуцирования представляющего интерес продукта благодаря повышению уровня экспрессии. Следовательно, настоящее изобретение вносит важный вклад в уже имеющиеся успехи в данной области.
В соответствии со своим первым аспектом, настоящее изобретение относится к получению выделенной эукариотической клетке, в которой ингибируется функция продукта экспрессии гена C12orf35. Такое ингибирование может быть достигнуто, например, путем снижения или блокирования функциональной экспрессии эндогенного гена C12orf35 в указанной клетке, например, путем сайленсинга гена, делеции гена или мутации гена, приводящих к экспрессии нефункционального или менее функционального белка. Как показано в примерах, после транзиентной или стабильной трансфекции, соответственно, модифицированные эукариотические клетки неожиданно приобретают способность продуцировать представляющий интерес рекомбинантный продукт с более высоким выходом. Таким образом, эти эукариотические клетки являются особенно подходящими для их использования в качестве клеток-хозяев в методах рекомбинантного продуцирования и могут быть использованы для рекомбинантного продуцирования представляющего интерес продукта.
В соответствии со своим вторым аспектом, настоящее изобретение относится к способу отбора клетки-хозяина, которая рекомбинантно экспрессирует представляющий интерес продукт, где указанный способ включает:
(a) получение эукариотических клеток в качестве клеток-хозяев согласно первому аспекту изобретения, где указанные клетки-хозяева содержат по меньшей мере один гетерологинный полинуклеотид, кодирующий представляющий интерес продукт; и
(b) отбор одной или более клеток-хозяев, экспрессирующих представляющий интерес продукт.
В соответствии со своим третьим аспектом, настоящее изобретение относится к способу рекомбинантного продуцирования представляющего интерес продукта, где указанный способ включает использование эукариотической клетки согласно первому аспекту изобретения в качестве клетки-хозяина для рекомбинантной экспрессии представляющего интерес продукта. Как было описано выше, эти новые эукариотические клетки, благодаря их повышенной продуцирующей способности, являются особенно подходящими для использования в качестве клеток-хозяев в целях рекомбинантного продуцирования продукта.
В соответствии со своим четвертым аспектом, настоящее изобретение относится к способу продуцирования эукариотической клетки, подходящей для рекомбинантного продуцирования представляющего интерес продукта, где указанный способ включает ингибирование функции продукта экспрессии эндогенного гена C12orf35 в эукариотической клетке. Это может быть достигнуто, например, путем снижения или блокирования функциональной экспрессии гена C12orf35 в указанной клетке.
В соответствии со своим пятым аспектом, настоящее изобретение относится к способу анализа эукариотических клеток на возможность их использования в качестве клеток-хозяев для рекомбинантной экспрессии представляющего интерес продукта, где указанный способ включает прямой или опосредованный анализ ингибирования функции продукта экспрессии гена C12orf35 в указанных клетках. Этот способ может быть преимущественно применен, например, в комбинации со способом согласно четвертому аспекту изобретения для идентификации полученной эукариотической клетки, в которой ингибируется функция продукта экспрессии гена C12orf35. Кроме того, этот способ может быть применен в качестве аналитического метода, позволяющего идентифицировать рекомбинантные клеточные клоны с высоким и низким уровнем экспрессии белка, а в некоторых вариантах осуществления изобретения, стабильные и нестабильные клоны, экспрессирующие представляющий интерес продукт.
В соответствии со своим шестым аспектом, настоящее изобретение относится к применению выделенной эукариотической клетки для рекомбинантной экспрессии представляющего интерес продукта, где в указанной клетке наблюдается ингибирование функции продукта экспрессии гена C12orf35.
Другие цели, признаки, преимущества и аспекты настоящего изобретения будут очевидны для специалиста исходя из нижеследующего описания и прилагаемой формулы изобретения. Однако, следует отметить, что хотя нижеследующее описание, прилагаемая формула изобретения и конкретные примеры представляют собой предпочтительные варианты осуществления изобретения, однако, они приводятся лишь в целях иллюстрации. Для специалиста в данной области соверешенно очевидно, что в настоящее изобретение могут быть внесены различные изменения и модификации, не выходящие за рамки существа и объема изобретения.
Краткое описание графического материала
На фиг. 1 схематически представлена теломерная область хромосомы 8 клеток яичника китайского хомячка (CHO) и генов, локализованных в указанной теломерной области. Геномная область, проиллюстрированная на этой фигуре, представляет собой конструкцию, полученную путем совмещения каркасов с номерами 6 и 25 на хромосоме 8. Общее представление генов и предполагаемых генов на хромосоме 8 клеток CHO может быть получено с использованием файла аннотации банка генов в комплекте с руководством Brinkrolf et al. (Nature Biotechnology Volume 31, 694-695 (2013); см. банк генов: APMK00000000, версия APMK01000000, описанная в данной публикации). Кроме того, в Пекинском Институте Геномики (Beijing Genomics Institute) также имеется описание данной области (Xu et al., Nature Biotechnology, Volume 29, number 8, 735-741 (2011); см. Банк генов: AFTD00000000, версия AFTD01000000). Примечания, которые отмечены * на фиг. 1, взяты из файла банка генов AFTD01000000.
Соответствующий общий вид теломерной области мышиной хромосомы 6 может быть получен, например, из базы даных Ensembl. Мышиная хромосома 6 имеет структуру, соответствующую структуре хромосомы 8 китайского хомячка. Представленная ниже строка базы даных Ensembl относится к теломерной области мышиной хромосомы 6, содержащей ген C12orf35 (обозначенный здесь 2810474O19Rik):
http://www.ensembl.org/Mus_musculus/Location/View?db=core;g=ENSMUSG00000032712;r=6:149309414-149335658.
В представленной ниже таблице 1 даны аббревиатуры и альтернативные названия (альтернативные имена) генов и кодируемых продуктов, указанных на фиг. 1, и где это необходимо, даны соответствующие аннотации для мышиных генов и генов китайского хомячка (согласно руководству Brinkrolf et al., 2013 и/или Xu et al., 2011). В таблице 1 также приводится список альтернативных названий, используемых, например, для обозначения различных видов. Если в настоящем описании приводится название конкретного белка или гена, то оно также означает и охватывает любые альтернативные имена указанного белка или гена, используемого, например, для характеризации соответствующего гена или белка других видов. В частности, настоящее изобретение охватывает гомологи и ортологи, имеющие одинаковые функции.
|
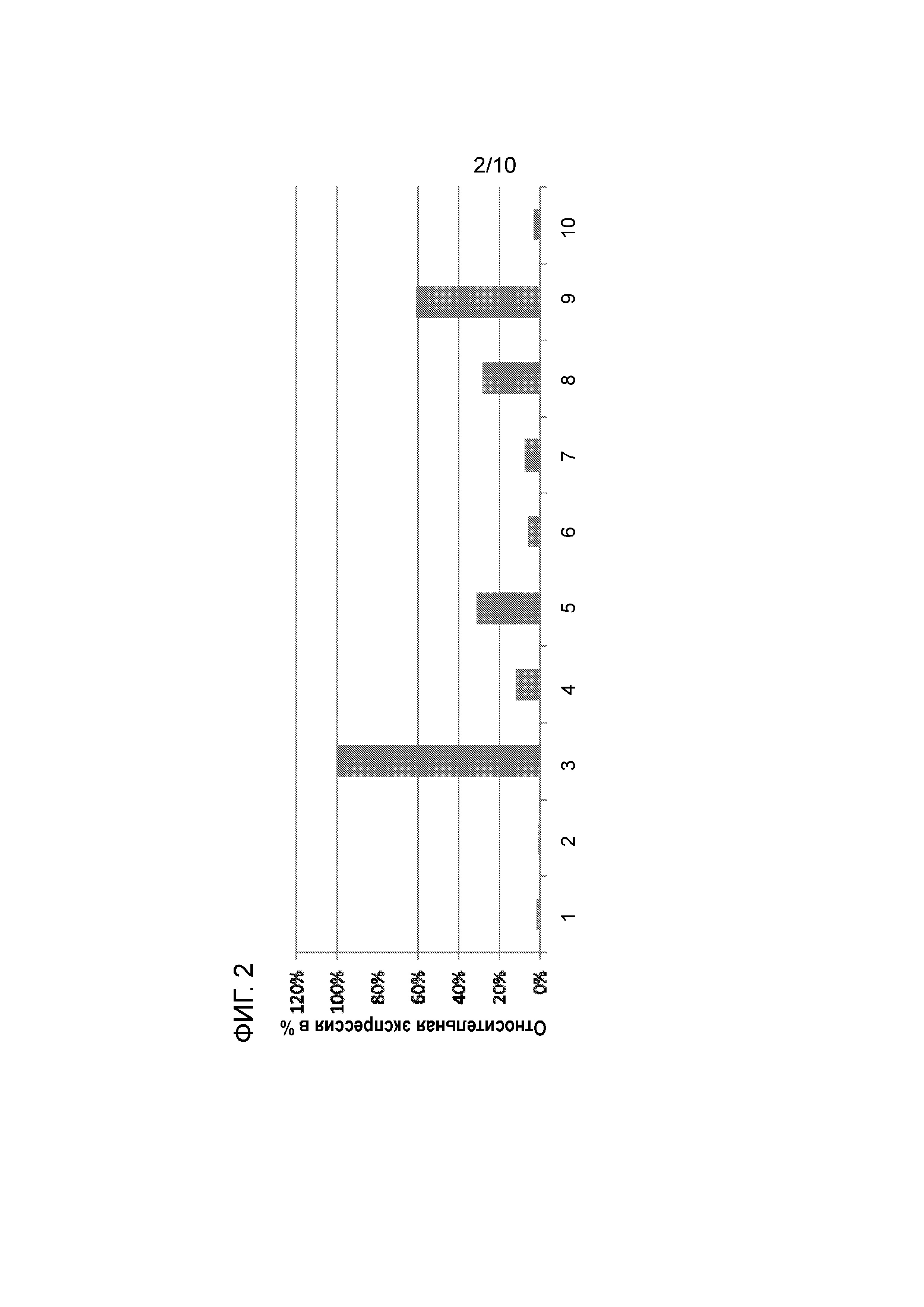
На фиг. 2 показаны относительные уровни экспрессии генов, локализованных в теломерной области хромосомы 8 в клеточной линии CHO, а именно, TMTC1 (1), RPS4Y2 (2), IPO8 (3), CAPRIN2 (4), FAM60A (5), Dennd5b (6), METTL 20 (7), AMN1 (8), C12orf35 (9), Bicd1 (10).
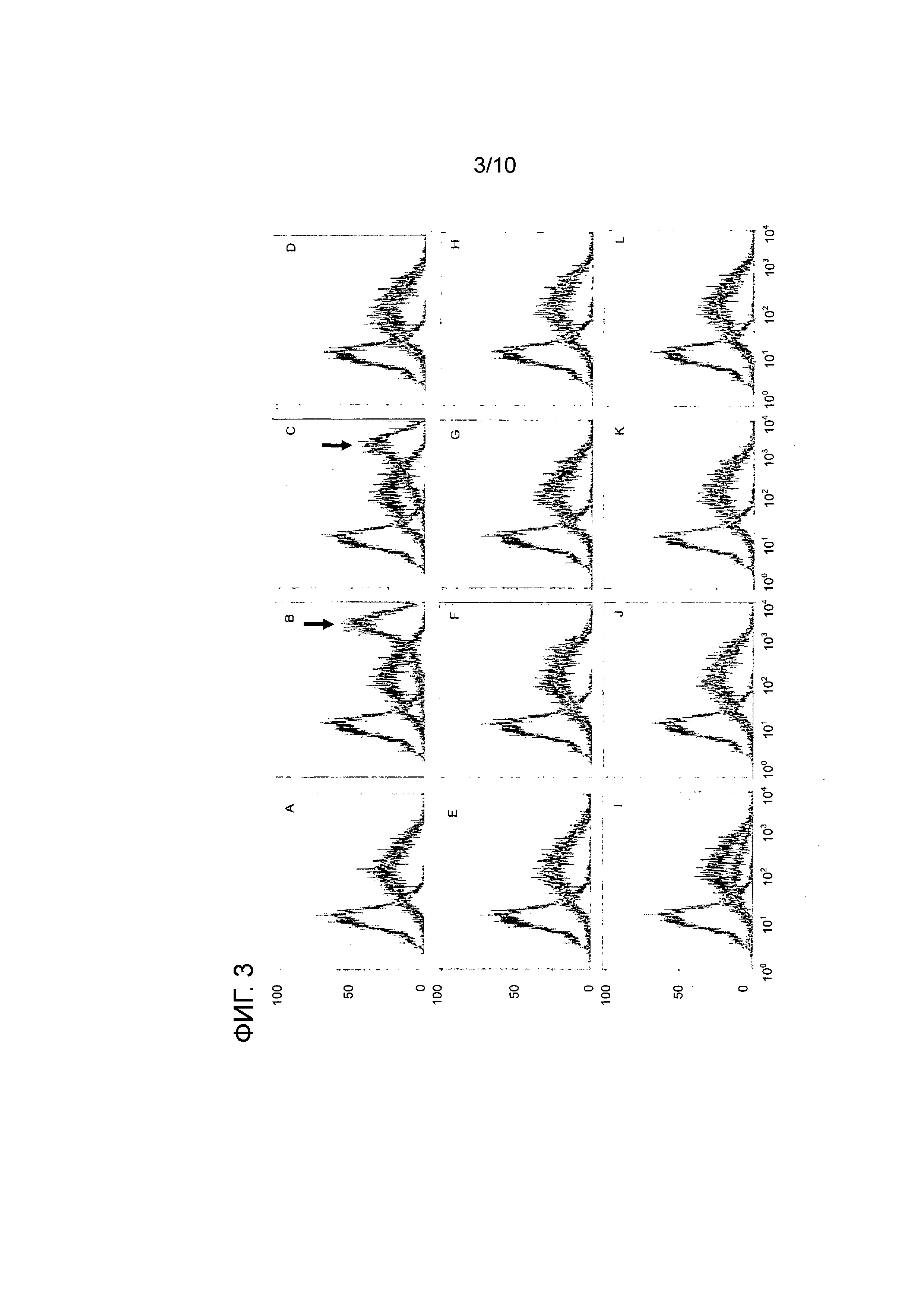
На фиг. 3A-L показаны FACS-профили, полученные после снижения уровня экспрессии различных генов-мишеней, локализованных в теломерной области хромосомы 8 клеток китайского хомячка (CHO), с использованием киРНК. Клетки, которые были стабильно трнасфецированы экспрессионным вектором и экспрессировали кодируемое антитело в качестве представляющего интерес продукта, были флуоресцентно окрашены для детектирования уровня рекомбинантно экспрессируемого антитела. Чем выше интенсивность FACS-профиля, тем выше уровень экспрессии антитела в окрашенной клетке. Левый пик представляет собой FACS-профиль, соответствующий родительской клеточной линии (нетрансфецированной, а поэтому не экспрессирующей антитело), которая была включена для сравнения. Две других кривых были построены по данным, полученным для клеточного клона, который был стабильно трансфецирован и рекомбинантно экспрессировал антитело. Этот клеточный клон был трансфецирован либо киРНК, используемой в качестве негативного контррля (темная кривая; отсутствие влияния на экспрессию любого гена), либо киРНК, которая нижает уровень экспрессии гена-мишени (светло-серая кривая). Если сайленсинг гена-мишени не влияет на рекомбинантную экспрессию антитела, то кривые для флуоресценции киРНК-контроля и киРНК-мишени перекрываются и не изменяются. Если сайленсинг гена-мишени приводит к повышению уровня экспрессии рекомбинантно экспрессируемого антитела, то интенсивность соответствующего FACS-профиля повышается и наблюдается сдвиг кривой вправо. A: ген Mettl20_1, 125 пмоль, 24,9%; B: ген C12orf35_1, 125 пмоль, 30,6%; C: ген C12orf35_2, 150 пмоль, 31,7%; D: ген Caprin2_6, 100 пмоль, 53,3%; E: FAM60A_3, 150 пмоль, 48%; F: Ipo8_1, 125 пмоль, 20,3%; G: Ipo8_2, 150 пмоль, 57,5%; H: Ipo8_3, 150 пмоль, 21,5%; I: Dennd5b_2, 100 пмоль, 36,9%; J: Amn1_4, 125 пмоль, 30,8%; K: TMTC1_1, 150 пмоль, 60,6%; L: TMTC1_2, 150 пмоль, 53,4% (процентные величины соответствуют уровню экспрессии мРНК гена-мишени, определяемому путем сравнения киРНК с контрольной киРНК). На фиг. 3B и C показано, что ингибирование гена C12orf35 приводит к значительному повышению экспрессии рекомбинантного антитела и, тем самым, к повышению продуктивности, на что указывает явный сдвиг FACS-профиля вправо (см. светло-серую кривую справа, также помеченную стрелкой).
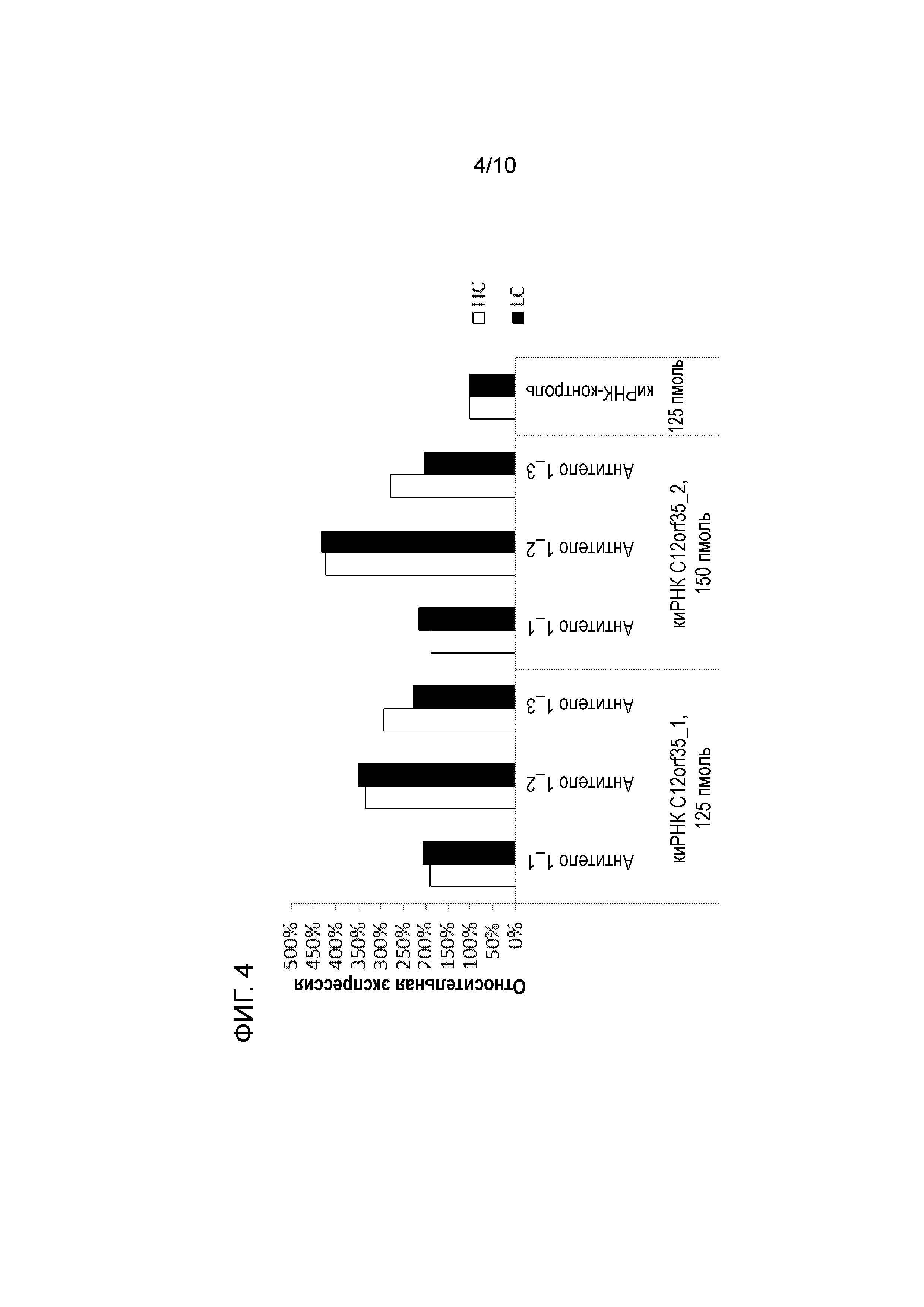
На фиг. 4 и 5 показаны уровни экспрессии мРНК, кодирующей легкую и тяжелую цепи антител двух различных моделей представляющих интерес полипептидов (антитело 1 и 2) в различных клонах и пулах в каждом случае после снижения уровня экспрессии гена C12orf35 в клетках CHO под действием РНКи. Уровни мРНК, кодирующей цепи антител, повышаются в том случае, если уровень экспрессии гена C12orf35 снижается посредством сайленсинга гена. Таким образом, неожиданно было обнаружено, что снижение уровня экспрессии C12orf35 приводит к повышению уровней мРНК, кодирующей HC и LC.
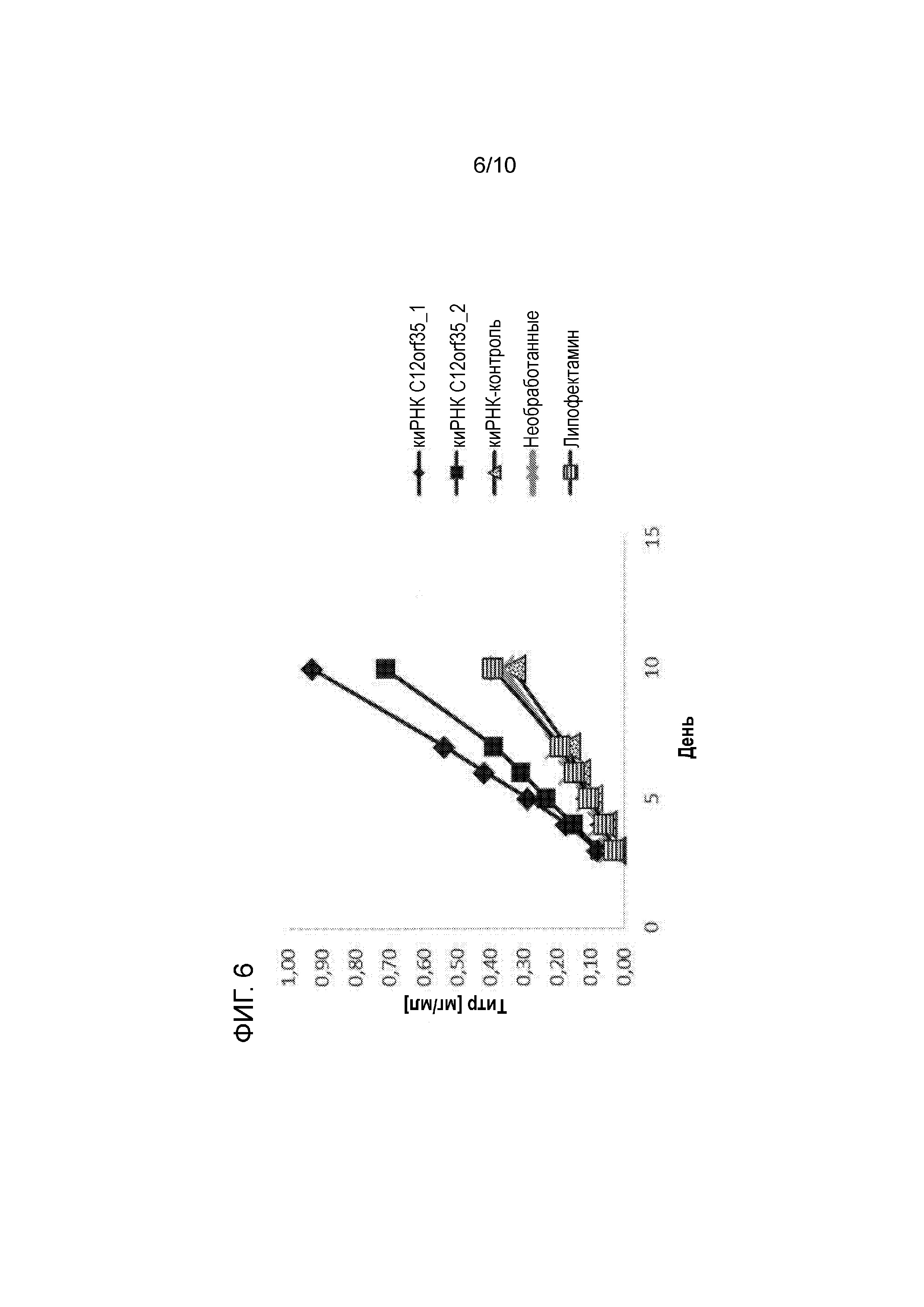
На фиг. 6 показано, что после сайленсинга гена C12orf35 с использованием киРНК были получены значительно более высокие волюметрические титры.
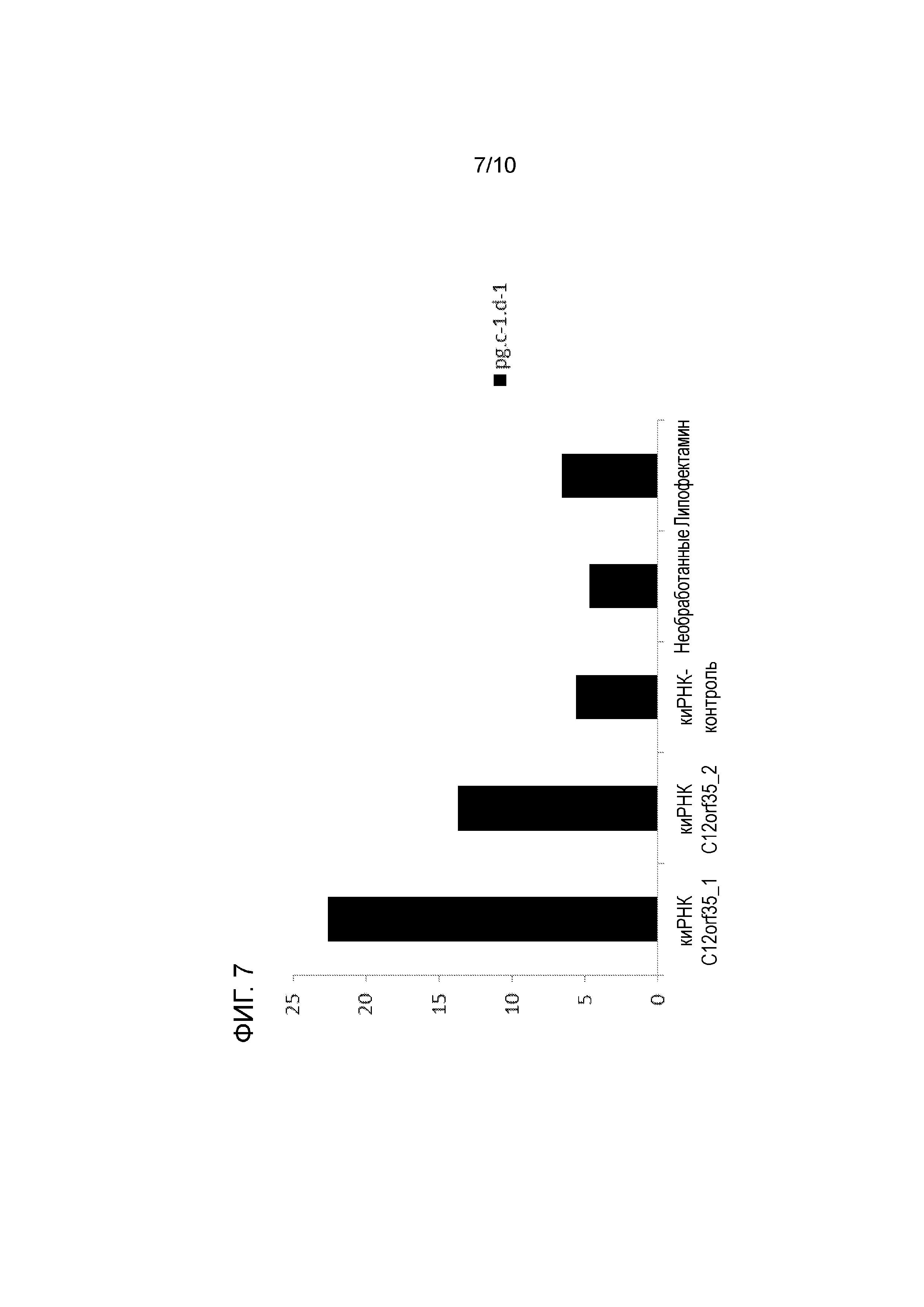
На фиг. 7 также продемонстрировано, что сайленсинг гена C12orf35 приводит к более высокой удельной продуктивности (вычисляемой на дни культивирования 3, 4, 5 и 6). киРНК-1 имела более выраженный эффект сайленсинга, чем киРНК-2, что способствовало повышению уровня экспрессии.
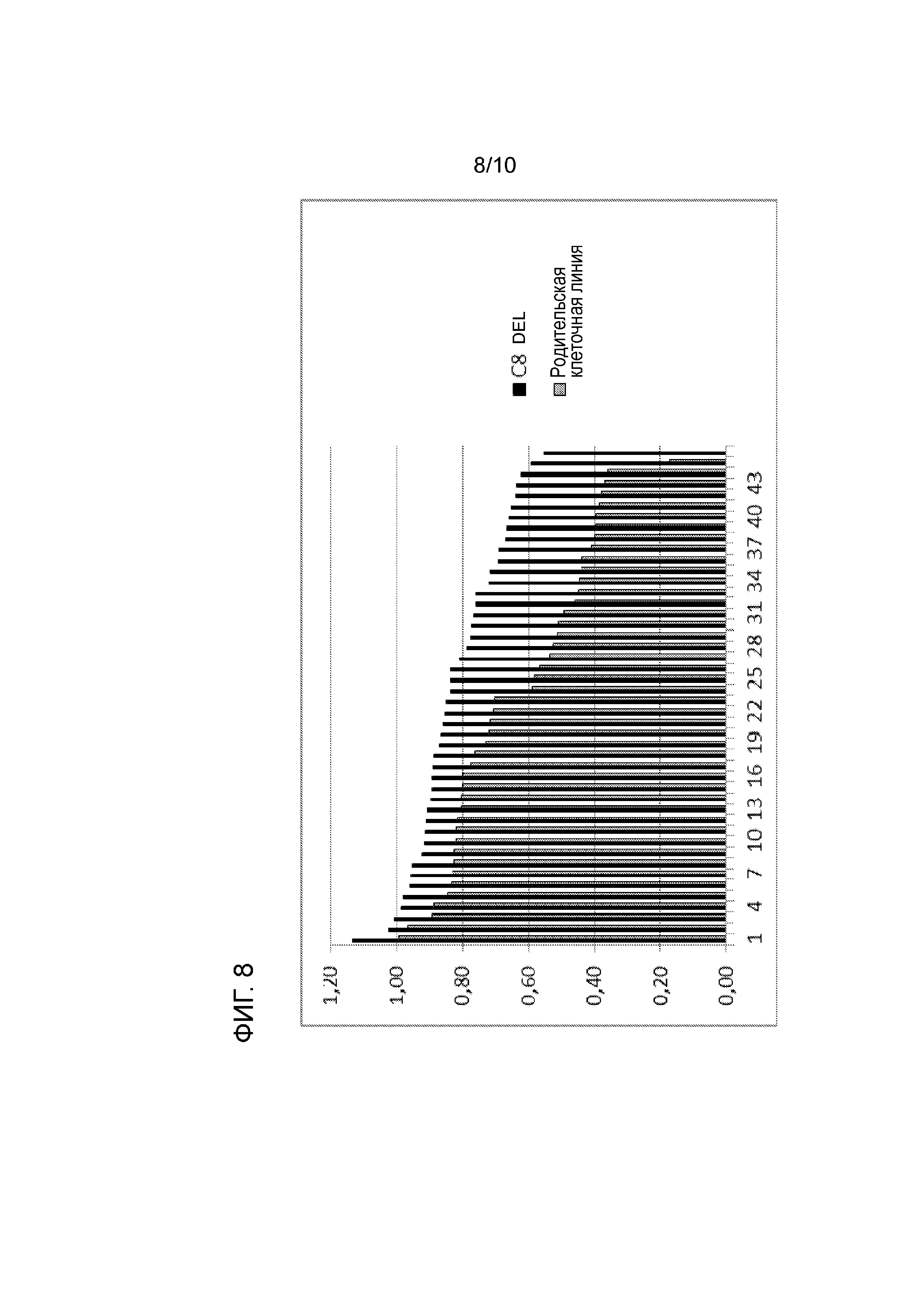
На фиг. 8 показано, что 46 самых высокопродуктивных клонов (черные), происходящих от клеточной линии CHO, в которой теломерная область, содержащая ген C12orf35 на хромосоме 8 (плечо q), была делетирована (C8DEL), имеют более высокие титры по сравнению с 45 самыми высокопродуктивными клонами, полученными от родительской клеточной линии, которая, как было протестировано, является позитивной по IPO8 (серая).
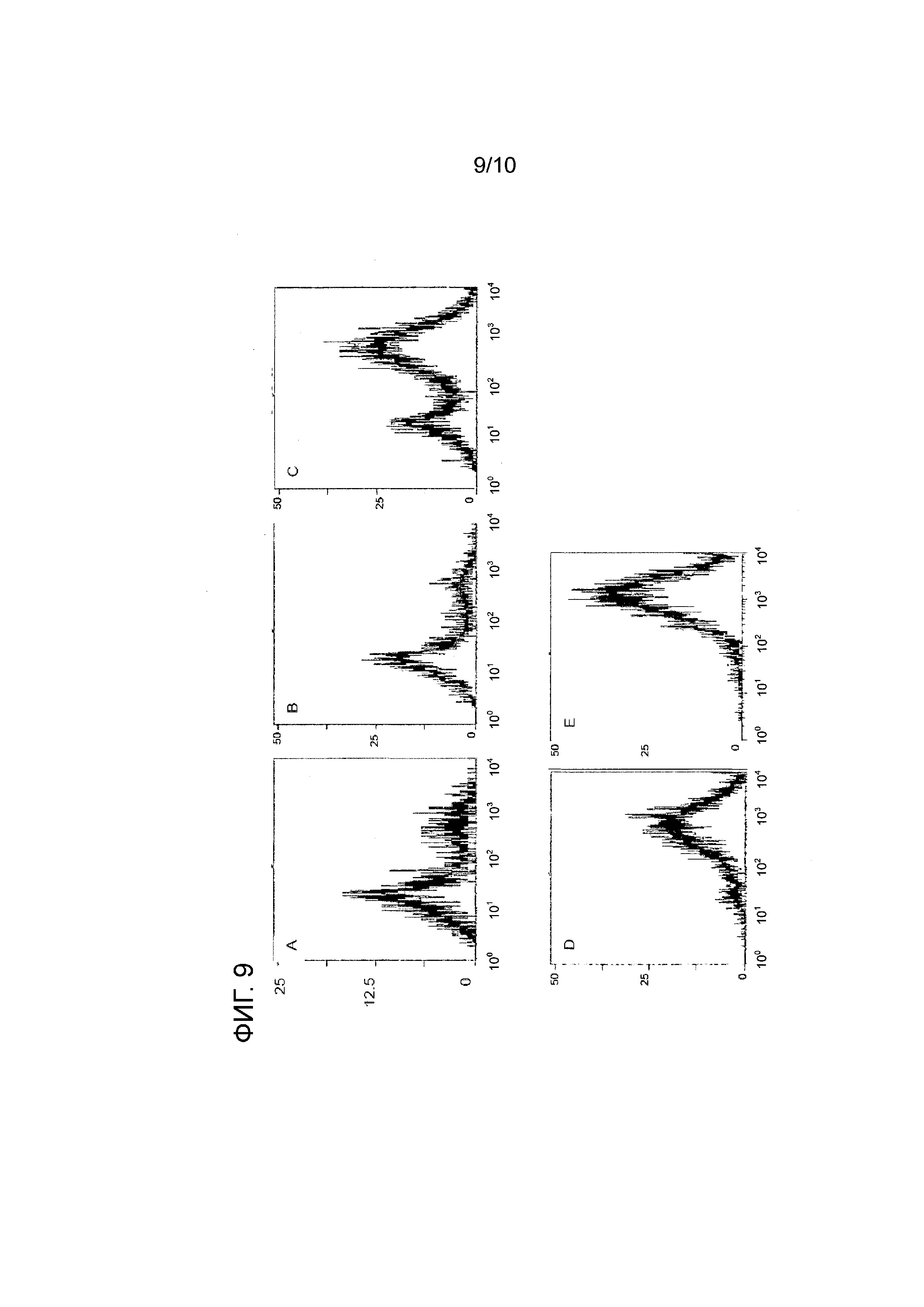
На фиг. 9 показаны FACS-профили стабильно трансфецированных клеточных пулов C8DEL после отбора с использованием системы фолатный рецептор/DHFR. Концентрация MTX возрастала от A до E (A: без MTX; B: 1 нМ MTX; C: 5 нМ MTX; D: 10 нМ MTX; E: 50 нМ MTX). Экспрессия рекомбинантного антитела была детектирована по интенсивности флуоресценции. При 50 нМ MTX в полученном пуле присутствовали преимущественно высокопродуктивные клетки, как показал FACS-анализ. Профиль полученного пула очень напоминал профиль клеточного клона. Эти данные подтвердили, что описанный здесь метод является чрезвычайно эффективным для повышения уровня экспрессии.
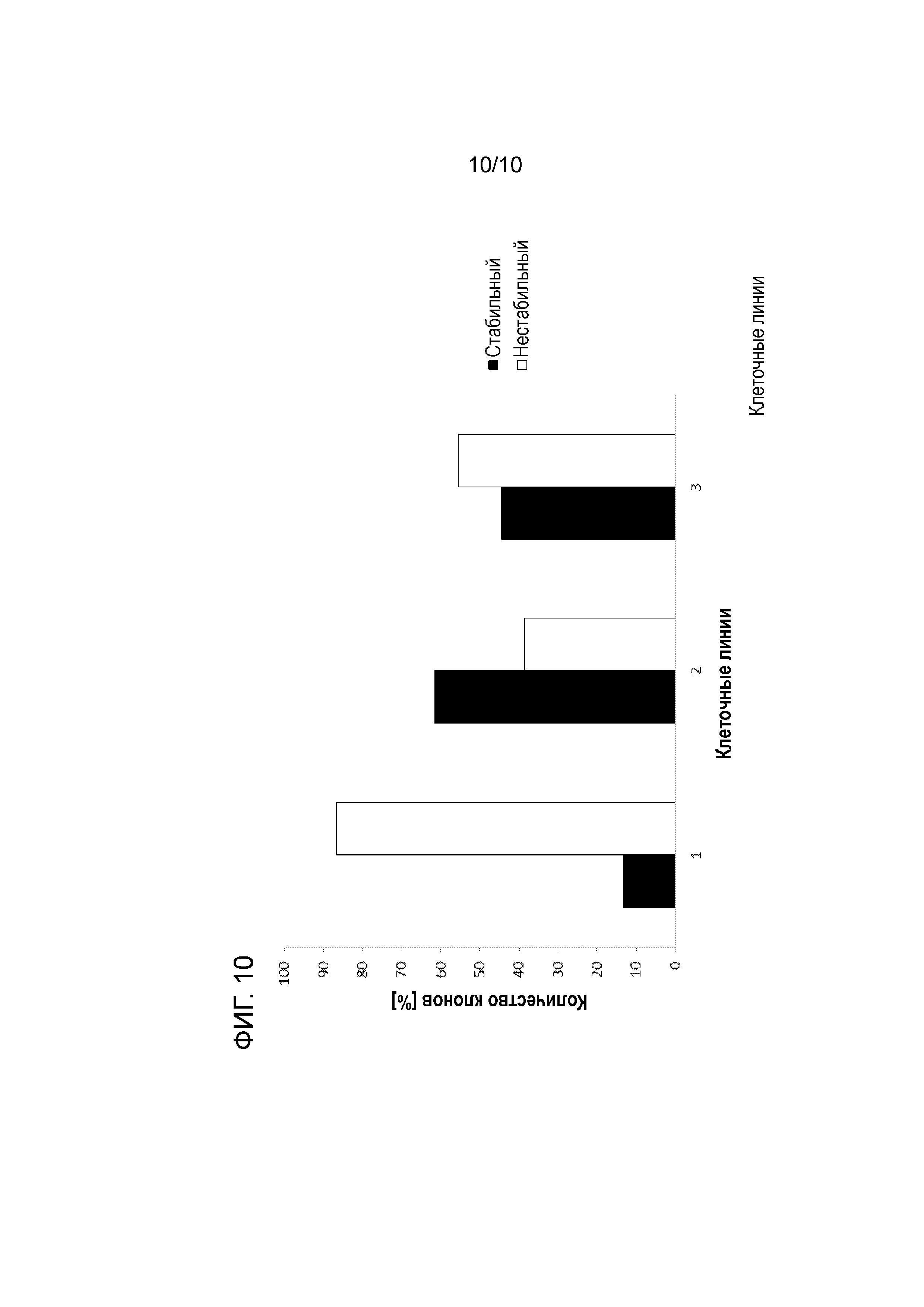
На фиг. 10 показаны результаты тестов на стабильность, проводимых в течение 7/8 недель для трех различных клеточных клонов (клонов СНО дикого типа и двух FAM60A-дефицитных клонов s16 и s23, происходящих от указанных клеток дикого типа) после стабильной трансфекции экспрессионным вектором, кодирующим антитело в качестве представляющего интерес продукта: (1) показаны результаты теста на стабильность, проводимого с использованием родительских клеток дикого типа (происходящих от CHO-K1); (2) показаны результаты теста на стабильность, проводимого с использованием FAM60A-дефицитного клона s16; (3) показаны результаты теста на стабильность, проводимого с использованием FAM60A-дефицитного клона s23. Исходя из этих результатов можно сделать вывод, что стабильность экспрессии значительно возрастает в клеточных клонах, происходящих от FAM60A-дефицитных клеток (см. (2) и (3)). При использовании FAM60A-дефицитных клеток для рекомбинантной экспрессии, число стабильных клонов значительно увеличивалось. Таким образом, ингибирование функции FAM60A в клетке-хозяине, в данном случае путем «нокаута» гена, приводило к значительному повышению стабильности экспрессии. Поэтому в одном из вариантов осуществления изобретения, функцию белка FAM60A в эукариотических клетках дополнительно ингибируют, предпочтительно, путем снижения или блокирования функциональной экспрессии в целях повышения стабильности экспрессии после стабильной трансфекции.
Подробное описание настоящего изобретения
Настоящее изобретение основано inter alia на неожиданном обнаружении того факта, что эукариотические клетки, в которых наблюдается ингибирование функции продукта экспрессии гена C12orf35, например, посредством снижения или блокирования функциональной экспрессии эндогенного гена C12orf35 в результате делеции указанного гена или введения мутаций, обладают способностью экспрессировать представляющий интерес рекомбинантный продукт со значительно более высоким выходом. Настоящее изобретение основано на неожиданном обнаружении того факта, что ген C12orf35 оказывает значительное влияние на экспрессию представляющего интерес рекомбинантного продукта, а поэтому оно также относится к новым способам отбора и продуцирования и ассоциированным с ними технологиями, которые позволяют повышать уровень рекомбинантного продуцирования представляющего интерес продукта. Следовательно, настоящее изобретение вносит важный вклад в уже имеющиеся разработки в данной области.
Отдельные аспекты изобретения, а также подходящие и предпочтительные варианты его осуществления более подробно описаны ниже.
A. Модифицированные эукариотические клетки
В соответствии со своим первым аспектом, настоящее изобретение относится к выделенной эукариотической клетке, в которой ингибируется функция продукта экспрессии гена C12orf35. Как показано в примерах для клеток млекопитающих, соответствующие модифицированные эукариотические клетки обнаруживают значительно более высокую продуктивность после стабилизации, а также после транзиентной трансфекции экспрессионным вектором, содержащим полинуклеотид, кодирующий представляющий интерес продукт, как было продемонстрировано в примерах. Кроме того, при использовании соответствующим образом модифицированных эукариотических клеток, число клеток с высоким уровнем экспрессии в популяции трансфецированных клеток увеличивается. В некоторых вариантах осуществления изобретения, клоны также обнаруживают более высокую стабильность. Повышенная стабильность экспрессии позволяет сократить или даже вообще не затрачивать время на проведение исследований на стабильност клеточных клонов с высоким уровнем экспрессии. Дополнительные преимущества также описаны ниже и будут очевидны из примеров. Таким образом, использование этих преимуществ новых эукариотических клеточных линий для рекомбинантного продуцирования представляющего интерес продукта позволяет не прилагать значительных усилий на скрининг для идентификации клеток или клеточных клонов с высоким уровнем экспрессии, а в частности, позволяет сократить время на получение клеточных клонов с высоким уровнем экспрессии, подходящих для крупномасштабного продуцирования представляющего интерес продукта. Таким образом, эти эукариотические клеточные линии имеют ценные преимущества, позволяющие использовать эти клетки в качестве клеток-хозяев в методах рекомбинантного продуцирования.
Ген C12orf35 эндогенно экспрессируется в эукариотических клетках, таких как, например, клетки млекопитающих, а именно, человека, мыши и хомячка. Продукт экспрессии гена C12orf35 представляет собой довольно крупный белок. В списке последовательностей представлены репрезентативные аминокислотные последовательности или предполагаемые аминокислотные последовательности белка, кодируемого эндогенным геном млекопитающх различных видов, таких как хомячки (SEQ ID NO:1 и 2), человек (SEQ ID NO:3 и 4), мыши (SEQ ID NO:5), крупный рогатый скот (SEQ ID NO:6) и дикие кабаны (SEQ ID NO:7). CDS (кодирующая последовательность ДНК) гена C12orf35 китайского хомячка представлена как SEQ ID NO:8. Кроме того, был секвенирован фрагмент 5’UTR (см. SEQ ID NO: 9) и 3’UTR (см. SEQ ID NO: 10) мРНК C12orf35 китайского хомячка. Ген C12orf35 также называется C12orf35-подобным геном или гомологом C12orf35 у хомячка или 2810474O19Rik у мышей. Информация об этом гене, кодирующей последовательности и предсказанном белке C12orf35 также приводится для Cricetulus griseus в базе данных NCBI: XM_003512865, которая вводится в настоящее описание посредством ссылки. Человеческий ген также обозначается KIAA1551. Белкам или генам других видов могут быть присвоены и другие названия, и такие неограничивающие альтернативные названия (альтернативные имена) также представлены выше в таблице 1. Используемый здесь термин «C12orf35» также включает любые гомологи и ортологи C12orf35, которые имеют такую же функцию, как и C12orf35. В соответствии с этим, используемый здесь термин «ген C12orf35», в частности, включает любой эндогенный ген, кодирующий белок, последовательность которого по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологична или идентична одной или более аминокислотным последовательностям, представленным в SEQ ID NO:1-7, или аминокислотным последовательностям белка, кодируемого последовательностью SEQ ID NO:8. Белок, кодируемый таким геном, предпочтительно, имеет такую же функцию, как и белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1, или одну или более аминокислотных последовательностей, представленных в SEQ ID NO:2-7, или белок, кодируемый SEQ ID NO:8. Указанный ген может быть модифицирован, как описано в настоящей заявке для ингибирования функции продукта экспрессии, экспрессируемого немодифицированной клеткой. В литературе нет подробного описания белка, экспрессируемого геном C12orf35. Используемые здесь термины «белок C12orf35» или «продукт экспрессии эндогенного гена C12orf35» и аналогичные термины включают гомологи и ортологи C12orf35, а в частности, любой белок, имеющий последовательность, которая по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологична или идентична одной или более аминокислотным последовательностям, представленным в SEQ ID NO:1-7, или аминокислотным последовательностям белка, кодируемого последовательностью SEQ ID NO:8. Такой белок C12orf35, предпочтительно, имеет такую же функцию, как и белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1, или одну или более аминокислотных последовательностей, представленных в SEQ ID NO:2-7, или белок, кодируемый последовательностью SEQ ID NO:8. Гомология, а в частности, идентичность белка по отношению к сравниваемому белку может быть вычислена по всей длине.
Настоящее изобретение относится inter alia к модифицированным эукариотическим клеткам, таким как, предпочтительно, клетки млекопитающих, где ингибируется функция продукта экспрессии гена C12orf35, который обычно эндогенно экспрессируется соответствующей немодифицированной эукариотической клеткой. Как показано в примерах, такая модификация клетки, которая может быть транзиентной или перманентной, приводит к повышению уровня экспрессии представляющего интерес рекомбинантного продукта.
Существует несколько вариантов модификации эукариотических клеток для ингибирования функции продукта экспрессии гена C12orf35 в указанной клетке. Функция продукта экспрессии гена C12orf35, а следовательно, белка C12orf35 может ингибироваться, например, на генном или на белковом уровне. Функция C12orf35 может быть ингибирована, например, путем модификации структуры/последовательности белка C12orf35, транскрипции и/или трансляции. Неограничивающие варианты этих модификаций описаны ниже.
В соответствии с одним из вариантов осуществления изобретения, ингибирование функции продукта экспрессии гена C12orf35 в эукариотических клетках обусловлено снижением или блокированием функциональной экспрессии гена C12orf35 в указанной клетке. Как показано в примерах, модификация экспрессии гена C12orf35, например, посредством сайленсинга гена иди делеции указанного гена, является очень эффективным средством для получения эукариотических клеток, способных экспрессировать представляющий интерес рекомбинантный продукт с высоким выходом. При снижении экспрессии гена C12orf35 или его элиминации в эукариотических клетках, а следовательно, при продуцировании менее функционального или нефункционального белка C12orf35 соответствующей модифицированной клеткой, выход экспрессии представляющего интерес рекомбинантного продукта значительно повышается. Была неожиданно обнаружена корреляция между функциональной экспрессией C12orf35 и выходом экспрессии рекомбинантного белка.
Снижение или блокирование функциональной экспрессии гена C12orf35 может быть достигнуто различными способами. Функциональная экспрессия может быть понижена, например, путем снижения уровня экспрессии гена C12orf35 или путем блокирования функции C12orf35 или с применением комбинации таких методов. В соответствии с одним из вариантов осуществления изобретения, клетку модифицируют так, чтобы функциональная экспрессия гена C12orf35 снижалась или блокировалась посредством «отключения» («нокаута») гена, мутации гена, делеции гена, сайленсинга гена или комбинации любых этих методов. В соответствии с одним из вариантов осуществления изобретения, функциональная экспрессия гена C12orf35 в клетке снижается или блокируется посредством «нокаута» гена. «Нокаут» гена представляет собой генетический метод, который позволяет получить неактивный ген путем подавления его функции. Так, например, в кодирующую последовательность может быть встроена нуклеиновая кислота, что будет приводить к подавлению функции гена. Кроме того, полноразмерный ген C12orf35 или его часть могут быть делетированы, что будет приводить к блокированию экспрессии белка в соответствующей модифицированной клетке или к экспрессии нефункционального белка в этой клетке. Другим вариантом является введение одной или более нокаут-мутаций в кодирующую последовательность, что будет приводить к продуцированию нефункционального продукта или менее функционального продукта экспрессии. Так, например, могут быть введены одна или более мутаций со сдвигом рамки считывания, что будет приводить к продуцированию нефункционального белка или менее функционального белка. Альтернативно или дополнительно, в кодирующую последовательность могут быть введены один или более стоп-кодонов так, чтообы это приводило к продуцированию усеченного белка, нефункционального белка или менее функционального белка. Следовательно, в одном из вариантов осуществления изобретения, ген C12orf35 имеет одну или более мутаций, способствующих образованию нефункционального продукта или менее функционального продукта экспрессии. Другими вариантами являются, но не ограничиваются ими, введение одной или более мутаций в промотор, в 5’- и/или 3’-UTR или в другие регуляторные элементы. В соответствии с одним из вариантов осуществления изобретения, промоторная функция гена C12orf35 подавляется, например, путем введения в промотор делеции или путем введения конструкции между промтором и сайтом инициации транскрипции. Способы достижения «нокаута» гена для подавления или блокирования экспрессии гена-мишени хорошо известны специалистам, а поэтому подробно не описаны в настоящей заявке. Тем не менее некоторые неограничивающие примеры таких методов приводятся ниже.
В соответствии с одним из вариантов осуществления изобретения, ген C12orf35 функционально блокируют методом генной инженерии. Примерами являются, но не ограничиваются ими, редактирование генома, например, редактирование генома с использованием сконструированных нуклеаз (GEEN). Такой метод представляет собой метод генной инженерии, в котором ДНК встраивают, заменяют или удаляют из генома с помощью искусственно сконструированных нуклеаз или «молекулярных ножниц». Эти нуклеазы создают специфические двухцепочечные разрывы (DSB) в нужных положениях генома и используют клеточнеы эндогенные механизмы для репарации индуцированного разрыва благодаря природным процессам гомологичной рекомбинации (HR) и негомологичного присоединения по концам (NHEJ). Существуют по меньшей мере четыре семейства сконструированных нуклеаз, которые могут быть использованы в этих целях, а именно, нуклеазы «цинковый палец» (ZFN), эффекторные нуклеазы, подобные активатору транскрипции (TALEN), CRISPR и сконструированые хоминг-эндонуклеазы, реконструированные с использованием мегануклеаз.
В соответствии с одним из вариантов осуществления изобретения, одна или более копий гена C12orf35, присутствующего в геноме эукариотических клеток, были модифицированы, например, ингибированы или делетированы для ослабления или блокирования, а следовательно, ингибирования функции продукта экспрессии гена C12orf35 в эукариотической клетке. Таким образом, в соответствии с одним из вариантов осуществления изобретения, в геноме эукариотической клетки, по меньшей мере одна копия гена C12orf35 была делетирована или функционально инактивирована. Так, например, в копию или в копии гена C12orf35 (если присутствует более чем одна копия) могут быть встроены одна или более мутаций для получения нефункционального или менее функционального продукта экспрессии или для блокирования или снижения экспрессии in toto, а следовательно, для ингибирования функции C12orf35 в клетке млекопитающего. Поэтому ген C12orf35, по существу, инактивирован в геноме. В соответствии с одном из вариантов осуществления изобретения, в случае присутствия более чем одной копии, все копии гена C12orf35 являются соответствующим образом модифицированными в эукариотической клетке, которая, предпочтительно, представляет собой клетку млекопитающего.
В соответствии с одним из вариантов осуществления изобретения, эукариотическими клетками являются клетки многоклеточных, клетки позвоночных или, предпочтительно, клетки млекопитающих. В соответствии с одним из вариантов осуществления изобретения, часть хромосомы в указанной клетке является делетированной, где такая делетированная часть содержит ген C12orf35. В соответствии с одним из вариантов осуществления изобретения, часть хромосомы, содержащая ген C12orf35, была делетирована во всех хромосомах, включающих копию гена C12orf35. Таким образом, все копии гена C12orf35 в этом геноме были делетированы.
В соответствии с одним из вариантов осуществления изобретения, часть теломерной области хромосомы была делетирована, где указанная делетированная часть содержит ген C12orf35. В соответствии с предпочтительным вариантом осуществления изобретения, модифицированной клеткой является клетка грызуна. В соответствии с одним из вариантов осуществления изобретения, указанной клеткой является клетка хомячка, такая как клетка CHO, и по меньшей мере часть теломерной области хромосомы 8 в геноме этой клетки была делетирована, где указанная делетированная часть содержит ген C12orf35. Значение термина «C12orf35» объясняется выше, и неограничивающие альтернативные названия гомологов и ортологов, которые также входят в объем указанного термина, представлены в таблице 1. В соответствии с одним из вариантов осуществления изобретения, такая делеция имеется в плече q хромосомы 8 клетки хомячка, а в частности, клетки китайского хомячка, содержащей ген FAM60A. Как показано в примерах, клетка СНО, содержащая соответствующую делецию в теломерной области хромосомы 8, является особенно подходящей для ее использования в качестве клетки-хозяина для рекомбинантной экспрессии. После стабилизации или транзиентной трансфекции экспрессионным вектором, эти клетки приобретают значительно более высокую продуктивность по сравнению с клетками, в которых указанная часть в теломерной области хромосомы 8 не была делетирована. Кроме того, количество и соответствующее соотношение клеток с высоким уровнем экспрессии в популяции трансфецированных клеток значительно повышается. В случае стабильной трансфекции, стабильность рекомбинантой экспрессии значительно повышается, например, в таких клетках хомячка, в которых отсутствует указанная часть теломерной области хромосомы 8. Другие важные преимущества подробно описаны в примерах, где клетки СНО, в которых соответствующая часть теломерной области хромосомы 8 была детектирована посредством разрыва хромосомы, были дополнительно охарактеризованы. Эти преимуществнные свойства делают такие клетки хомячка особенно подходящими для их использования в промышленном продуцировании в качестве клеточных линий. Альтернативно, модифицированной клеткой грызуна может быть мышиная клетка, где по меньшей мере часть теломерной области хромосомы 6 в геноме этой клетки была делетирована, и где указанная делетированная часть содержит ген C12orf35. Теломерная область мышиной хромосомы 6 имеет большое сходство с теломерной областью хромосомы 8 хомячка.
В соответствии с одним из вариантов осуществления изобретения, по меньшей мере часть теломерной области хромосомы является делетированной или отсутствует в обеих хромосомах пары хромосом 8 хомячка (или пары хромосом 6 в случае мышиных клеток), где эти делетированные области включают ген C12orf35.
В соответствии с одним из вариантов осуществления изобретения, по меньшей мере часть теломерной области хромосомы делетирована в одной хромосоме пары хромосом 8 хомячка (или пары хромосом 6 в случае мышиных клеток), где указанная делетированная часть содержит ген C12orf35, и где экспрессия гена C12orf35 в другой хромосоме была снижена или блокирована. Подходящие способы снижения или блокирования экспрессии гена известны специалистам, и неограничивающие примеры этих способов также описаны в настоящей заявке. В соответствии с одним из вариантов осуществления изобретения, такая делеция имеется в плече q хромосомы 8 хомячка, а в частности, китайского хомячка.
В соответствии с одним из вариантов осуществления изобретения, делетированная область хромосомы содержит ген C12orf35 и дополнительно один или более или все гены, выбранные из группы, состоящей из генов Bicd1, Amn1, метилтрансферазо-подобного белка 20, Dennd5b, FAM60A, Caprin2 и Ipo8. В соответствии с одним из вариантов осуществления изобретения, все вышеупомянутые гены были делетированы. В соответствии с одним из вариантов осуществления изобретения, делетированная область хромосомы дополнительно содержит по меньшей мере часть полноразмерного гена Tmtc1. В клетках хомячка, таких как клетки СНО, эти гены также локализованы в теломероной области хромосомы 8. В соответствии с одним из вариантов осуществления изобретения, эта делетированная область хромосомы, если она присутствовала, также содержала ген RPS4Y2. Теломерная область хромосомы 8 генома китайского хомячка, в которой находятся вышеупомянутые гены, схематически представлена на фиг. 1. Как показано в примерах, клетки СНО, имеющие соответствующую делецию в теломерной области хромосомы 8 (плечо q), обладают конкретными преимущественными свойствами, такими как высокий выход и стабильность экспрессии. В мышиных клетках, вышеупомянутые гены присутствуют в теломерной области хромосомы 6. Неограничивающие альтернативные названия вышеупомянутых отдельных генов и/или кодируемых белков, включая гомологи и ортологи, также представлены выше в таблице 1, и эти соответствующие гены входят в объем значений терминов, употребляемых выше для отдельных генов.
В соответствии с одним из вариантов осуществления изобретения, делеция гена C12orf35 обусловлена хромосомным разрывом. Хромосомный разрыв может быть индуцирован, например, путем обработки эукариотических клеток токсическим агентом, который стимулирует хромосомный разрыв, таким как, например, MTX, афидиколин или гигромицин. Другими методами индуцирования хромосомных разрывов являются, но не ограничиваются ими, облучение, лучевая обработка, мутагенез, обработка канцерогенными веществами и блеомицином. Хромосомные разрывы могут также происходить спонтанно в процессе трансфекции, например, электропорации. Методы индуцирования хромосомных разрывов также известны специалистам, а поэтому здесь не приводится их подробного описания. После индуцирования хромосомного разрыва, эукариотические клетки, имеющие нужную точку разрыва (приводящего к делеции гена C12orf35), могут быть идентифицированы, например, путем анализа ДНК или с применением способа согласно пятому аспекту настоящего изобретения. Так, например, профиль экспрессии обработанных клеток может быть проанализирован для того, чтобы определить, экспрессируются ли ген C12orf35 или гены, расположенные со стороны центромеры по отношению к гену C12orf35, и наблюдается ли снижение уровня экспрессии генов или эти гены вообще не экспрессируются. Так, например, в случае мышиных клеток или клеток хомячка может быть проведен анализ для того, чтобы определить, экспрессируется ли в этих клетках ген C12orf35, и альтернативно или дополнительно может быть проведен анализ для того, чтобы определить, экспрессируется ли в этих клетках один или более генов, выбранных из группы, состоящей из генов метилтрансферазо-подобного белка 20, Dennd5b, FAM60A, Caprin2, Ipo8, Tmtc1 или генов, которые локализуются в теломерной области вышеупомянутых генов (где, в данном контексте, слово «теломерный» означает расположение в направлении теломерного конца), и/или для того, чтобы определить, наблюдается ли снижение или блокирование экспрессии. Если точка индуцированного разрыва расположена со стороны центромеры по отношению к соответствующему(им) гену(ам) (где, в этом контексте, слово «центромерный» означает расположение также в хромосоме, но на значительном удалении от теломерного конца), то теломерный конец, содержащий указанные гены, является делетированным, что приводит к блокированию или снижению уровня их экспрессии (если экспрессируются другие копии имеющихся генов). Как видно на фиг. 1, ген C12orf35 расположен со стороны теломеры по отношению к вышеупомянутым генам, то есть, он расположен ближе к теломерному концу. Таким образом, если вышеупомянутые гены были делетированы посредством хромосомного разрыва, то делетированная область также включает ген C12orf35. Таким образом, вышеупомянутые гены могут быть действительно использованы в качестве маркеров, которые позволяют, в основном, опосредованно определить, может ли индуцированный хромосомный разрыв приводить к делеции хромосомной части, включающей ген C12orf35. Кроме того, было обнаружено, что даже несмотря на локализацию гена Bicd1 со стороны теломеры по отношению к гену C12orf35, этот ген Bicd1 может быть использован в качестве маркера для того, чтобы определить, может ли индуцированный хромосомный разрыв приводить к делеции гена C12orf35. Было обнаружено, что если ген Bicd1 в клетках СНО был делетирован посредством хромосомного разрыва, то такая делеция также обычно включает ген C12orf35. С помощью анализа экспрессионных свойств нескольких сотен клонов было подтверждено, что вышеупомянутые гены действительно могут быть использованы в качестве маркеров для дифференциации клеточных клонов с высокой и стабильной экспрессией от клеточных клонов с низкой и нестабильной экспрессией. Относительная экспрессия вышеупомянутых генов в клетках CHO показана на фиг. 2. Как видно на фиг. 2, гены Ipo8 (3), FAM60A (5) и C12orf35 (9) имеют относительно высокий уровень экспрессии по сравнению с экспрессией других генов, которые локализуются в теломерной области хромосомы 8 в нормальных клетках СНО, таких как клетки CHO-K1, которые не имеют делеции в теломерной области хромосомы 8. Таким образом, при проведении данного анализа предпочтительно использовать один или более вышеупомянутых генов, поскольку это упрощает детектирование блокирования или снижения уровня экспрессии. Неограничивающие альтернативные названия вышеупомянутых отдельных генов и кодируемых белков, включая гомологи и ортологи, также приводятся выше в таблице 1, и эти соответствующие гены входят в объем значений терминов, употребляемых выше для отдельных генов.
В соответствии с одним из вариантов осуществления изобретения, точка разрыва на хромосоме 8 расположена со стороны центромеры по отношению к гену метилтрансферазо-подобного белка 20, со стороны центромеры по отношению к гену Dennd5b, со стороны центромеры по отношению к гену FAM60A, со стороны центромеры по отношению к гену Caprin2, со стороны центромеры по отношению к гену Ipo8 или со стороны центромеры по отношению к гену RPS4Y2. Было обнаружено, что точка разрыва на хромосоме 8 генома хомячка часто расположена со стороны центромеры по отношению к гену Ipo8. В соответствии с одним из вариантов осуществления изобретения, точка разрыва на хромосоме 8 расположена в гене Tmtc1, и указанный ген либо не экспрессируется, либо экспрессируется на низком уровне. В соответствии с одним из вариантов осуществления изобретения, ген Ergic2, который расположен со стороны центромеры по отношению к гену Tmtc1, не делетирован на хромосоме 8. Таким образом, в соответствии с этим вариантом осуществления изобретения, точка разрыва присутствует со стороны теломеры по отношению к гену Ergic 2 (где, в данном контексте, слово «теломерный» означает расположение в направлении ближе к теломерному концу), и этот ген Ergic 2 не делетирован.
В соответствии с одним из вариантов осуществления изобретения, функциональная экспрессия гена C12orf35 в эукариотичесой клетке, которая, предпочтительно, представляет собой клетку млекопитающего, снижается или блокируется. На функциональную экспрессию гена C12orf35 можно воздействовать различными способами, например, путем модификации промотора и/или энхансера гена C12orf35 так, чтобы транскрипт продуцировался на более низком уровне или вообще не продуцировался, или методами сайленсинга генов, такими как транскрипционный или посттранскрипционный сайленсинг генов. В соответствии с одним из вариантов осуществления изобретения, выделенная эукариотическая клетка имеет одну или более мутаций в промоторной области гена C12orf35. Так, например, промоторная область может быть модифицирована так, чтобы промотор был менее функциональным или нефункциональным, причем, такой промотор может быть полностью элиминирован. Альтернативно или дополнительно, может быть присоединена полинуклеотидная последовательность, кодирующая полипептид, включая стоп-кодон, между промотором и старт-кодоном гена C12orf35, что будет приводить к экспрессии другого полипептида, а не C12orf35. Соответствующие методы хорошо известны специалистам, а поэтому в их подробном описании нет необходимости.
Снижение уровня экспрессии функционального гена может достигать такого уровня, при котором экспрессия этого гена может даже полностью прекращаться. Посттранскрипционный сайленсинг гена может быть достигнут с использованием, например, антисмысловых молекул или молекул, опосредующих интерференцию РНК. Неограничивающие примеры такого сайленсинга вкратце описаны ниже.
Антисмысловые полинуклеотиды могут быть сконструированы так, чтобы они специфически связывались с РНК, что будет приводить к образованию гибридов РНК-ДНК или РНК-РНК с прекращением обратной транскрипции или трансляции матричной РНК. Было получено множество форм антисмысловых молекул, и эти молекулы могут принадлежать к широкой категории фермент-зависимых антисмысловых молекул или стерически блокирующих антисмысловых молекул. Фермент-зависимая антисмысловая молекула включает формы, зависящие от активности РНКазы Н, и эти формы способствуют разложению мРНК-мишени, включая одноцепочечую ДНК, РНК и фосфортиоатную антисмысловую молекулу. Антисмысловые полинуклеотиды обычно продуцируются в клетке посредством экспрессии из антисмысловой конструкции, содержащей антисмысловую цепь в качестве транскрибируемой цепи. Трансрасщепляемыми каталитическими РНК (рибозимами) являются молекулы РНК, обладающие эндорибонуклеазной активностью. Рибозимы могут быть специально сконструированы так, чтобы они связывались с конкретной мишенью, или так, чтобы они расщепляли любые молекулы РНК по сайт-специфичесому механизму в остове клеточной РНК. Такое событие расщепления делает мРНК нестабильной и блокирует экспрессию белка. Геном эукариотической клетки может быть модифицирован так, чтобы соответствующая антисмысловая молекула экспрессировалась, например, перманентно.
Другим подходящим способом снижения функциональной экспрессии гена C12orf35 на посттранскрипционном уровне является метод на основе интерференции РНК (РНКи). Как показано в примерах, снижение уровня экспрессии гена C12orf35 под действием РНКи является эффективным для повышения продуктивности клетки-хозяина. Значительно более модифицированный продукт продуцируется после сайленсинга гена C12orf35 под действием РНКи. Кроме того, как было продемонстрировано в примерах, уровни экспрессии мРНК представляющего интерес продукта повышаются после сайленсинга гена C12orf35. Методы сайленсинга генов посредством РНКи хорошо известны специалистам, а поэтому в их подробном описании нет необходимости. Примерами РНКи-индуцирующих соединений, которые могут быть использованы для сайленсинга экспрессии гена C12orf35, являются, но не ограничиваются ими, короткие интерферирующие нуклеиновые кислоты (киНК), короткая интерферирующая РНК (киРНК), микроРНК (миРНК), короткие шпилечные РНК (кшРНК), а также их предшественники, которые процессируются в клетке с образованием фактического РНКи-индуцирующего соединения. В соответствии с одним из вариантов осуществления изобретения, киРНК используют для сайленсинга. киРНК может быть получена в виде двухцепочечной молекулы, на каждой цепи которой имеются 3’-выступающие концы. Могут быть также использованы и «затупленные» по концам молекулы. Указанная киРНК может содержать дезоксирибонуклеотиды, а также рибонуклеотиды, и кроме того, она может содержать модифицированные нуклеотиды. Специалистам известно несколько вариантов и типов соединений киРНК, которые могут быть использованы для снижения уровня экспрессии гена C12orf35. Подходящие киРНК, нацеленные на выбранные/идентифицированные последовательности-мишени генов-мишеней на уровне РНК могут быть идентифицированы с помощью соответствующих компьютерных технологий, в которых применяются определенные алгоритмы проектирования. Для получения киРНК, направленной против транскрипта-мишени, двухцепочечная молекула может быть трансфецирована непосредственно в клетку. Как показано в примерах, такие транзиентные методы снижения уровня экспрессии гена C12orf35 являются эффективными для повышения уровня рекомбинантной экспрессии представляющего интерес продукта. Альтернативно, киРНК может образовываться в результате процессинга ферментом дайсером, то есть, ферментом, который превращает ддинные дцРНК или короткие шпилечные РНК (кшРНК) в киРНК. Эти предшественники или конечные молекулы киРНК могут быть продуцированы экзогенно (искусственно), а затем они могут быть введены в эукариотические клетки различными методами трансфекции. В соответствии с другим вариантом осуществления изобретения, РНКи-индуцирующее соединение экспрессируется вектором, который вводят в эукариотическую клетку. В случае киРНК, это может быть достигнуто, например, путем введения петли между двумя цепями, что будет приводить к продуцированию одного транскрипта, который затем может процессироваться в функциональную киРНК в эукариотической клетке. В таких кластерах для транскрипции обычно используются промотор РНК-полимеразы 3 (например, U6 или H1), который обычно регулирует транскрипцию небольших ядерных РНК (кшРНК). Было высказано предположение, что полученный кшРНК-транскрипт, происходящий от вектора, затем процессируется ферментом дайсером с образованием двухцепочечных молекул киРНК, предпочтительно, имеющих характерные 3’-выступающие концы. В соответствии с одним из вариантов осуществления изобретения, такой кшРНК-продуцирующий вектор стабильно интегрируют в геном эукариотической клетки. Этот вариант осуществления изобретения является предпочтительным, поскольку ингибирование гена C12orf35 обусловлено продуцированием киРНК, которое является постоянным, достаточно стабильным и не транзиентным. Затем клетки, содержащие соответствующий кшРНК-продуцирующий вектор, могут быть трансфецированым экспрессионным вектором, содержащим полинуклеотид, кодирующий представляющий интерес продукт. Альтернативно, могут быть применены стратегии котрансфекции, в которых вектор, генерирующий кшРНК, котрансфецируют экспрессионным вектором, содержащим полинуклеотид, кодирующий представляющий интерес продукт.
Транскрипционный сайленсинг гена может включать, например, эпигенетические модификации. В соответствии с одним из вариантов осуществления изобретения, уровень экспрессии гена C12orf35 снижается посредством эпигенетического сайленсинга. Были идентифицированы клетки млекопитающих, в которых уровень экспрессии гена C12orf35 значительно снижается посредством эпигенетического сайленсинга, предположительно, посредством метилирования ДНК, и рекомбинантная продуктивность указанных клеток является чрезвычайно высокой. Кроме того, последовательность гена может быть модифицирована для снижения времени полужизни мРНК. Это также приводит к ослаблению функции белка C12orf35 в соответствующим образом модифицированной клетке.
В соответствии с одним из вариантов осуществления изобретения, функциональная экспрессия гена C12orf35 снижается или блокируется посредством нацеливания на регуляторный элемент, участвующий в регуляции экспрессии гена C12orf35. Так, например, может быть осуществлен таргетинг фактора транскрипции, промотора (см. также выше), энхансера, UTR и других регуляторных элементов, например, посредством нокаута, делеции, ингибирования или любой другой модификации, которые инактивируют или снижают активность указанного регуляторного элемента, что приводит к блокированию или снижению функциональной экспрессии гена C12orf35 и тем самым к ингибированию функции эндогенного продукта экспрессии.
В соответствии с одним из вариантов осуществления изобретения, геном эукариотической клетки модифицируют для ингибирования функции C12orf35 посредством гетерологичной экспрессии мутантного C12orf35, который является нефункциональным или менее функциональным, чем эндогенно экспрессируемый белок C12orf35. В этом варианте осуществления изобретения, выделенная эукариотическая клетка содержит, помимо гетерологичного полинуклеотида, кодирующего представляющий интерес полипептид, другой гетерологичный полинуклеотид, кодирующий мутантный C12orf35. Посредством сверхэкспрессии соответствующей нефункциональной или менее функциональной мутантной формы C12orf35 может быть создан доминантно-негативный фенотип. Другим вариантом ингибирования и снижения функции C12orf35 в клетке является гетерологичная экспрессия белка, такого как антитело, которое нейтрализует C12orf35, а поэтому ингибирует функцию C12orf35 в клетке. В соответствии с одним из вариантов осуществления изобретения, функцию C12orf35 в клетке ингибируют путем снижения или блокировния функциональной экспрессии молекул, которые функционально взаимодействуют с C12orf35.
В другом варианте осуществления изобретения используют низкомолекулярное соединение, которое ингибирует экспрессию гена C12orf35 посредством специфического ингибирования связывания фактора транскрипции с регуляторной областью промотора или посредством ингибирования активатора транскрипции, необходимого для осуществления транскрипции гена-мишени.
В соответствии с одним из вариантов осуществления изобретения, экспрессия гена C12orf35 снижается по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз, по меньшей мере в 70 раз, по меньшей мере в 75 раз, по меньшей мере в 80 раз, по меньшей мере в 90 раз, по меньшей мере в 100 раз или по меньшей мере в 125 раз, по меньшей мере в 250 раз, по меньшей мере в 500 раз, по меньшей мере в 750 раз, по меньшей мере в 1000 раз, по меньшей мере в 1250 раз, по меньшей мере в 1500 раз, по меньшей мере в 1750 раз или по меньшей мере в 2000 раз. Это может быть определено, например, с помощью ОТ-ПЦР в реальном времени или с применением других чувствительных методов детектирования РНК. В данном варианте, такое снижение экспрессии может быть достигнуто, тогда как в случае немодифицированной исходной клетки, экспрессия гена C12orf35 не снижается. В соответствии с одним из вариантов осуществления изобретения, экспрессия гена C12orf35 составляет 0,05% или менее, 0,0475% или менее, 0,045% или менее, 0,0425% или менее, 0,04% или менее, 0,0375% или менее, 0,035% или менее, 0,0325% или менее, 0,03% или менее, 0,0275% или менее, 0,025% или менее, 0,0225% или менее, 0,02% или менее, 0,0175% или менее, 0,015% или менее по сравнению с экспрессией 18S РНК (принимаемой за 100%) в той же самой клетке. В соответствии с одним из вариантов осуществления изобретения, экспрессия гена C12orf35 может быть даже еще более низкой, например, она может составлять 0,001% или менее, 0,0001% или менее или даже 0,00001 или менее по сравнению с экспрессией 18S РНК (принимаемой за 100%) в той же самой клетке. Функциональную экспрессию гена C12orf35 снижают так, чтобы это приводило к повышению уровня экспрессии представляющего интерес рекомбинантного продукта, если указанная модифицированная эукариотическая клетка была трансфецирована экспрессионным вектором, кодирующии представляющий интерес продукт по сравнению с соответствующей клеткой, в которой функциональная экспрессия гена C12orf35 не снижалась или не блокировалась. В соответствии с одним из вариантов осуществления изобретения, экспрессия представляющего интерес рекомбинантного продукта по меньшей мере в 1,5 раза, по меньшей мере в 1,75 раза, по меньшей мере в 2 раза, по меньшей мере в 2,5 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза или по меньшей мере в 5 раз превышает экспрессию в соответствующей клетке, в которой функциональная экспрессия гена C12orf35 не снижалась или не блокировалась. В соответствии с некоторыми вариантами осуществления изобретения, уровни экспрессии по меньшей мере в 8 раз, по меньшей мере в 10 раз или по меньшей мере в 15 раз превышают уровни экспрессии в соответствующей клетке, в которой экспрессия гена C12orf35 не снижалась или не блокировалась. Так, например, уровни экспрессии были определены после отбора с использованием G418, и эти уровни в 35 раз превышали уровни экспрессии в соответствующей клетке, в которой экспрессия гена C12orf35 не снижалась или не блокировалась. Уровень экспрессии рекомбинантного продукта может быть определен, например, с помощью анализов, описанных в примерах.
В соответствии с другим вариантом осуществления изобретения, функцию продукта экспрессии гена C12orf35 снижают или блокируют с использованием соединения, которое подавляет или ингибирует функцию продукта экспрессии гена C12orf35. Соответствующие ингибирующие соединения могут иметь любую природу, и такими соединениями являются, но не ограничиваются ими, химические соединения, а в частности, небольшие молекулы, белки и пептиды. Другим вариантом является использование таких соединений, как низкомолекулярные соединения, стимулирующие разложение белкового продукта, например, посредством стимуляции убихитинизации белка.
В соответствии с одним из вариантов осуществления изобретения осущетвляют дополнительное ингибирование функции продукта экспрессии одного или более генов, выбранных из группы, состоящей из генов Bicd1, Amn1, метилтрансферазо-подобного белка 20, Dennd5b, FAM60A, Caprin2, Ipo8, RPS4Y2 и Tmtc1 или одного или более генов, расположенных со стороны теломеры по отношению к вышеупомянутым генам. Неограничивающие альтернативные названия вышеупомянутых отдельных генов и/или кодируемых белков, включая гомологи и ортологи, также приводятся выше в таблице 1, и эти соответствующие гены, кодирующие соответствующие белки, входят в объем значений терминов, употребляемых выше для отдельных генов. Аналогичнным образом, ингибирование такой функции может быть достигнуто, например, путем снижения или блокирования функциональной экспрессии соответствующих генов. Подходящие технологии и варианты описаны выше для гена C12orf35, и эти технологии и варианты могут быть применены для любых других генов-мишеней. Как описано выше, указанные гены расположены в теломерной области хромосомы 8 китайского хомячка и в мышиной хромосоме 6. Если часть указанной теломерной области была делетирована, например, путем индуцирования хромосомного разрыва, как описано выше, то такая делетированная область обычно содержит один или более вышеупомянутых генов.
В соответствии с предпочтительным вариантом осуществления изобретения, в указанной клетке, в которой ингибируется функция C12orf35, также ингибируется функция белка FAM60A, предпочтительно, посредством снижения или блокирования функциональной экспрессии гена FAM60A. Было также неожиданно обнаружено, что ингибирование функции FAM60A в эукариотической клетке, например, посредством снижения или блокирования функциональной экспрессии гена FAM60A, достигается в результате стабильной трансфекции полинуклеотидом, кодирующим представляющий интерес продукт, что приводит к значительному увеличению числа полученных клеточных клонов, которые экспрессируют рекомбинантный продукт, имеющий более высокую стабильность. Таким образом, в случае гена FAM60A, был идентифицирован ключевой ген, который влияет на стабильность рекомбинантной экспрессии. Дополнительное ингибирование функции FAM60A в этих клетках приводит к значительному повышению уровня рекомбинантного продуцирования представляющего интерес продукта благодаря повышению стабильности экспрессии. Как показано в примерах, ингибирование функции FAM60A, например, посредством нокаута гена, способствует значительному повышению стабильности. Заметное снижение стабильности экспрессии в процессе длительного культивирования наблюдается реже в случае использования соответствующих клеток-хозяев и, если даже такое снижение наблюдается, то оно приводит к менее резкому снижению продуктивности клеток по сравнению с продуктивностью клеток, в которых геном не был модифицирован для ингибирования функции белка FAM60A в этой клетке. После стабильной трансфекции число стабильных клонов увеличивается. Поэтому анализы на стабильность, проводимые для идентификация клеток-хозяев, которые не теряют свою стабильность или менее предрасположены к потере такой стабильности в процессе длительного культивирования, могут быть проведены в течение более короткого периода времени, либо вообще могут не проводиться. Это является важным преимуществом, поскольку такой способ позволяет сократить время, необходимое для получения стабильно экспрессирующих клеточных клонов, которые экспрессируют представляющий интерес рекомбинантный продукт с высоким выходом в течение длительного периода времени, и которые, соответственно, являются подходящими для крупномасштабного продуцирования. Это позволяет значительно снизить затраты на скрининг. Следовательно, ингибирование функции FAM60A и C12orf35 в одной и той же клетке является особенно предпочтительным, поскольку были получены эукариотические клетки-хозяева, обладающие улучшенными свойствами, такими как стабильная экспрессия и высокий выход. Таким образом, были получены эукариотические клетки-хозяева, обладающие особенно предпочтительными свойствами, такими как повышенный уровень продуцирования представляющего интерес рекомбинантного продукта. Как описано в настоящей заявке, эукариотической клеткой, предпочтительно, является клетка млекопитающего.
FAM60A представляет собой субъединицу SIN3-гистон-деацетилазного (HDAC) комплекса (SIN3/HDAC-комплекса), который функционирует как репрессор транскрипции (Munoz et al., 2012, THE Journal of Biological Chemistry VOL. 287, NO. 39, pp. 32346-32353; Smith et al., 2012, Mol. Cell Proteomics 11 (12):1815-1828). Гистон-деацетилазы (HDAC) катализируют удаление ацетильных групп из гистонов. Ацетилирование гистонов на лизинах представляет собой основной механизм модуляции конформации хроматина. Ацетилирование гистона стимулирует образование релаксированного транскрипционно активного хроматина, а деацетилирвоание, катализируемое гистон-деацетилазами (HDAC), благоприятствует образованю хроматина в «молчащей» неактивной форме. Анализ баз данных выявил присутствие по меньшей мере одного ортолога FAM60A у большинства многоклеточных, но не в нематодах. Ген FAM60A является консервативным у многоклеточных и может присутствовать в полностью секвенированных геномах всех позвоночных и большинства беспозвоночных. Так, например, у человека, крыс, мышей и коров была обнаружена 100% идентичность последовательностей белка FAM60A. Исследования, проводимые для оценки сходства последовательностей гомологов FAM60A, показали, что в геноме присутствует преимущественно только один репрезентативный член этого семейства. Однако имеется несколько исключений. Как описано в публикации Smith et al., 2012, белок FAM60A имеет уникальную последовательность, в которой отсутствуют все известные домены белка. Кроме того, в публикации Smith et al., 2012, указано, что не было обнаружено какой-либо гомологии последовательностей этого белка с последовательностями других известных человеческих белков. Сравнение последовательностей белков FAM60A различных видов показало, что белок FAM60A обычно включает три области: (1) N-конец, содержащий сегменты, которые являются в высокой степени консервативными у всех позвоночных; (2) промежуточную область, которая является в высокой степени консервативной у позвоночных, а у беспозвоночных, она состоит из неконсервативных спейсеров различной длины; (3) C-конец, содержащий сегменты, которые являются в высокой степени консервативными у всех позвоночных. Таким образом, наиболее консервативными являются N- и C-концевые области FAM60A. Как описано выше, исследования показали, что FAM60A ассоциируется с SIN3/HDAC-комплексами в эукариотических клетках различных типов, а в частности, клетках млекопитающих. Однако до настоящего времени информация о функциях FAM60A почти отсутствовала. Надавно проведенные функциональные исследования (см. Smith et al., 2012) показали, что FAM60A может ингибировать экспрессию гена и регулировать специфическую субсерию генов. В публикации Smith et al., 2012, имеется сообщение о роли FAM60A в регуляции пути передачи сигнала TGF-бета, который играет ведущую роль в таких процессах, как прогрессирование рака, метастазирование, миграция клеток и надзор за иммунной системой. Также имеются данные, указывающие на то, что FAM60A действует как транскрипционный репрессор компонентов пути передачи сигнала TGF-бета, где функция FAM60A, очевидно, играет определенную роль в комплексе SIN3-HDAC. Истощение FAM60A в различных раковых клеточных линиях, достигаемое с использованием киРНК против FMA60A, приводит к изменению обычной морфологии раковых клеток. Кроме того, было обнаружено, что уровни белка FAM60A периодически изменяются за период клеточного цикла в клетках U2OS (Munoz et al., 2012). Эксперименты по ингибированию FAM60A, проводимые с использованием киРНК FAM60A в человеческих клетках остеосаркомы U2OS, показали, что FAM60A ограничивает экспрессию гена циклина D1. Вопреки существующим научным данным, очень неожиданным оказалось обнаружение того факта, что ингибирование функции белка FAM60A в эукариотических клетках, а предпочтительно, в клетках млекопитающих, приводит к значительному повышению стабильности экспрессии гетерологичного гена в указанной клетке, но, при этом, не оказывает какого-либо негативного влияния на другие свойства клетки, играющие важную роль в рекомбинантной экспрессии. Такая корреляция между действием белка FAM60A и стабильностью экспрессии в процессе длительного культивирования клеток оказалась весьма неожиданной.
Как было описано, ген FAM60A эндогенно экспрессировался у многоклеточных, а в частности, у млекопитающих, таких как человек, мышь, крыса и хомячок, и аминокислотные последовательности FAM60A являются в высокой степени консервативными у млекопитающих, а также у позвоночных. Модифицированная эукариотическая клетка, в которой ингибируется функция FAM60A, происходит от эукариотической клетки, эндогенно экспрессирующей FAM60A. Для простоты, белок FAM60A, а также ген FAM60A, кодирующий белок FAM60A, обозначаются здесь прописными буквами, даже несмотря на то, что для некоторых видов используется другое обозначение гена и/или белка. В списке последовательностей представлены репрезентативные аминокислотные последовательности известных и/или предсказанных белков FAM60A позвоночных различных видов, а именно, Homo sapiens (SEQ ID NO:11), Rattus norvegicus (SEQ ID NO:12), Mus musculus (SEQ ID NO:13), Cricetulus griseus (SEQ ID NO:14), Gallus gallus (SEQ ID NO:15), Pan troglodytes (SEQ ID NO:16), Pongo abelii (SEQ ID NO:17) и Bos taurus (SEQ ID NO:18). Предсказанная кДНК FAM60A Cricetulus griseus представлена в SEQ ID NO:19 (кодирующая последовательность в положениях 14-679; см. также эталонную последовательность NCBI: XM_003505482.1). Белок FAM60A или ген FAM60A у различных видов могут иметь различные обозначения, и их неограничивающие альтернативные названия (альтернативные имена) также перечислены выше в таблице 1. Используемый здесь термин «FAM60A» также охватывает любые гомологи и ортологи FAM60A, которые имеют такую же функцию, как и FAM60A. В соответствии с одним из вариантов осуществления изобретения, используемый здесь термин «FAM60A», в частности, означает белок, который по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомологичен одной или более аминокислотным последовательностям, представленным в SEQ ID NO:11-18. В соответствии с одним из вариантов осуществления изобретения, вышеуказанные процентные величины означают идентичность, а не гомологию полипептидов. Гомология, а в частности, идентичность белка по отношению к сравниваемому белку, может быть вычислена по всей длине этого белка. Соответствующий белок, предпочтительно, имеет такую же функцию, как и белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO:11 или в одной или более SEQ ID NO:12-18, а предпочтительно, в SEQ ID NO:14. Белок FAM60A не был подробно описан в литературе. Таким образом, крайне неожиданным является тот факт, что стабильность экспрессии рекомбинантной клетки-хозяина может быть повышена в том случае, если геном клетки-хозяина будет модифицирован так, чтобы это приводило к ингибированию функции эндогенного белка FAM60A в клетке, и это может быть достигнуто, например, путем снижения или блокирования функциональной экспрессии гена FAM60A в указанной клетке. Было неожиданно обнаружено, что FAM60A влияет на стабильность экспрессии представляющего интерес рекомбинантного продукта. В соответствии с одним из вариантов осуществления изобретения, ген FAM60A, кодирующий белок FAM60A, модифицируют в целях ингибирования функции FAM60A в клетке. Это может быть достигнуто, например, с применением методов генной инженерии, таких как методы нокаута гена, описанные в настоящей заявке. Генная последовательность генома млекопитающих различных видов является известной и описана, например, для Homo sapiens (NCBI Gene-ID: 58516); Rattus norvegicus (NCBI Gene-ID: 686611); Mus musculus (NCBI Gene-ID: 56306); Bos Taurus (NCBI Gene-ID: 538649) и т.п. Варианты транскрипта могут существовать в различных формах, в зависимости от вида, и в различных количествах. Так, например, человеческий ген FAM60A экспрессирует 3 предполагаемых изоформы транскрипта, которые отличаются последовательностями UTR, но кодируют один и тот же белок.
В соответствии с одним из вариантов осуществления изобретения, экспрессии гена FAM60A снижается по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз, по меньшей мере в 70 раз, по меньшей мере в 75 раз, по меньшей мере в 80 раз, по меньшей мере в 90 раз, по меньшей мере в 100 раз или по меньшей мере в 125 раз, по меньшей мере в 250 раз, по меньшей мере в 500 раз, по меньшей мере в 750 раз, по меньшей мере в 1000 раз, по меньшей мере в 1250 раз, по меньшей мере в 1500 раз, по меньшей мере в 1750 раз, по меньшей мере в 2000 раз, по меньшей мере в 2500 раз, по меньшей мере в 3000 раз или по меньшей мере в 3500 раз. Экспрессия может быть определена, например, с помощью ОТ-ПЦР в реальном времени или с применением других чувствительных методов детектирования РНК. В данном варианте, такое снижение экспрессии может быть достигнуто, тогда как в случае немодифицированной исходной клетки, экспрессия гена FAM60A не снижается. В соответствии с одним из вариантов осуществления изобретения, экспрессия гена FAM60A составляет 0,05% или менее, 0,04% или менее, 0,03% или менее, 0,02% или менее, 0,01% или менее, 0,005% или менее или 0,0025% или менее по сравнению с экспрессией 18S РНК (принимаемой за 100%) в той же самой клетке. В соответствии с одним из вариантов осуществления изобретения, экспрессия гена FAM60A может быть даже еще более низкой, например, она может составлять 0,001% или менее, 0,0005% или менее или даже 0,0002% или менее по сравнению с экспрессией РНК 18S (принимаемой за 100%) в той же самой клетке.
В соответствии с одним из вариантов осуществления изобретения, выделенная эукариотическая клетка происходит от популяции эукариотических клеток, которые были модифицированы в целях дополнительного ингибирования функции белка FAM60A в указанных клетках, где указанные клетки содержат стабильно интегрированный в их геном гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, и где, в среднем, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% клеток, происходящих от указанной популяции, теряет не более чем 30%, а предпочтительно, не более чем 25% титра экспрессии представляющего интерес продукта в течение периода времени по меньшей мере 8 недель, предпочтительно, 10 недель, а более предпочтительно, 12 недель. Как показано в примерах, после трансфекции и идентификации стабильно трансфецированных клеток, количество клеток, которые не обнаруживают постепенную потерю продуктивности в процессе длительного культивирования, увеличивается в том случае, если описанные здесь модифицированные клетки, то есть более стабильные клеточные клоны были получены от выбранной популяции клеток. Стабильность может быть протестирована, например, путем культивирования отдельных клеток, происходящих от указанной популяции и используемых в качестве клеточных клонов, с последующим определением титра в течение указанного периода времени. Стабильность может быть протестирована с помощью анализов, описанных в примерах. В различных экспериментах, показатели стабильности могут варьироваться в зависимости от типа экспрессируемого белка и, например, от оптимизации кодонов. Однако, в случае модифицированных эукариотических клеток согласно изобретению, во всех анализах, проводимых в данных исследованиях, наблюдалось значительное увеличение числа стабильно экспрессирующих клонов по сравнению с клетками дикого типа, в которых функция FAM60A не ингибировалось. Число клеток со стабильной экспрессией значительно увеличивалось в популяции успешно трансфецированных клеток-хозяев. Поэтому в данном варианте осуществления изобретения, в котором ингибируются функции FAM60A и C12orf35 в указанных клетках, риск выбора нестабильного клона, который постепенно теряет свою продуктивность в процессе длительного культивирования, для промышленного продуцирования, значительно снижается. Это важное преимущество позволяет значительно сократить время проведения анализов на стабильность, которые обычно осуществляют для исключения нестабильных клонов, или даже вообще не проводить такие анализы.
Эукариотическая клетка происходит от видов, в которых эндогенно экспрессируется ген C12orf35. Кроме того, эукариотическая клетка происходит от клетки, которая обычно экспрессирует указанный ген. Примеры приводятся ниже. Используемый здесь термин «выделенный» относится к эукариотической клетке, которая не содержится в живом организме, таком как организм животного или человека. Как описано в настоящей заявке, клеткой может быть клеточная культура, клеточная линия, клеточный клон и т.п. Примеры также приводятся ниже. Как описано выше, указанную эукариотическую клетку модифицируют в целях ингибирования функции продукта экспрессии гена C12orf35 в указанной клетке по сравнению с соответствующей немодифицированной эукариотической клеткой, которая эндогенно экспрессирует C12orf35. Ингибирование, предпочтительно, достигается путем снижения или блокирования функциональной экспрессии гена C12orf35. Варианты описаны выше. Для получения клеточных линий с одинаковыми и предсказанными свойствами, геном эукариотической клетки, предпочтительно, модифицируют для достижения такого ингибирования. Подходящие варианты описаны выше. Затем, соответствующии образом модифицированная эукариотическая клетка может быть трансфецирована экспрессионным вектором, содержащим полинуклеотид, кодирующий представляющий интерес продукт. Эукариотической клеткой может быть клетка многоклеточных, такая как клетка позвоночных, а предпочтительно, клетка млекопитающих. Таким образом, все описанные здесь варианты, относящиеся к эукариотическим клеткам, по существу, могут относиться к предпочтительному варианту, в котором используются клетки млекопитающих. Эукариотическая клетка может быть, например, выбрана из группы, состоящей из клеток грызунов, клеток человека и клеток обезьяны. Предпочтительными эукариотическими клетками являются клетки грызунов, например, клетки хомячка или мышиные клетки. Эти клетки могут быть выбраны из группы, состоящей из клеток китайского хомячка, таких как клетка CHO, клеток BHK, клеток NS0, клеток C127, мышиных фибробластов 3T3 и клеток SP2/0. Особенно предпочтительной является клетка CHO. Примерами клеток CHO являются CHO-K1, CHO-S, CHO-K1SV, CHO-SSF3, CHO-DG44, CHO-DUXB11 или клеточная линия, происходящая от этих клеток. Как показано в примерах, снижение или блокирование экспрессии гена C12orf35 в клетках CHO позволяет получить клетки CHO, способные продуцировать рекомбинантный продукт на значительно более высоком уровне. Ген C12orf35 также экспрессируется в человеческих клетках. Таким образом, в соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка происходит от человеческой клетки, которая может быть, например, выбрана из группы, состоящей из клеток HEK293, клеток MCF-7, клеток PerC6, клеток CAP, гемопоэтических клеток и клеток HeLa. Другой альтернативой являются клетки обезьян, которые, например, могут быть выбраны из группы, состоящей из клеток COS, клеток COS-1, клеток COS-7 и клеток Vero. В соответствии с одним из вариантов осуществления изобретения, эукариотическую клетку, которой предпочтительно является клетка млекопитающего, получают в виде клеточного клона или клеточной линии.
В соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка не содержит гетерологичного полинуклеотида, кодирующего представляющий интерес продукт, гетерологичного полинуклеотида, кодирующего селективный маркер, и/или гетерологичного полинуклеотида, кодирующего репортерный полипептид, которые экспрессируются в указанной клетке, а в частности, секретируются указанной клеткой. Соответствующая «пустая» эукариотическая клетка может быть использована, например, в качестве клонирующей клеточной линии в методах рекомбинантного продуцирования. Соответствующая клетка может быть трансфецирована гетерологичным полинуклеотидом, кодирующим представляющий интерес продукт, например, с использованием соответствующего экспрессионного вектора. Такие «пустые» эукариотические клетки, в которых ингибируется функция продукта экспрессии гена C12orf35, и в которых не экспрессируется, а в частности, не секретируется рекомбинантный продукт, могут быть трансфецированы различными экспрессионными векторами в зависимости от типа представляющего интерес продукта, который, как предполагается, был рекомбинантно продуцирован. Таким образом, указанная эукариотическая клеточная линия может быть использована для различных целей, то есть для продуцирования различных представляющих интерес продуктов, а в частности, представляющих интерес серетируемых полипептидов. Трансфекция может быть транзиентной или стабильной, и как показано в примерах, в обоих вариантах осуществления изобретения достигается повышенный уровень экспрессии.
В соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка содержит гетерологичный полинуклеотид, кодирующий представляющий интерес продукт. Представляющий интерес продукт представляет собой рекомбинантный продукт, который, предположительно, экспрессируется эукариотической клеткой в большом количестве. Предпочтительным представляющим интерес продуктом является полипептид. Кроме того, эукариотическая клетка может также содержать гетерологичный полинуклеотид, кодирующий селективный маркер, и/или гетерологичный полинуклеотид, кодирующий репортерный полипептид. Это позволяет облегчить отбор клеток-хозяев, которые были успешно трансфецированы, а поэтому экспрессируют представляющий интерес продукт. Кроме того, эукариотическая клетка может содержать несколько полинуклеотидов, кодирующих различные селективные маркеры и/или репортерные полипептиды. В соответствии с одним из вариантов осуществления изобретения, гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, стабильно интегрирован в геном эукариотической клетки согласно первому аспекту изобретения.
Используемые здесь термины «гетерологичный полинуклеотид» или «гетерологичная нуклеиновая кислота» и аналогичные термины означают, в частности, полинуклеотидную последовательность, которая была введена в эукариотическую клетку, например, с помощью рекомбинантной технологии, такой как трансфекция. Термин «полинуклеотид» означает, в частности, полимер, который состоит из нуклеотидов, обычно связанных друг с другом посредством дезоксирибозы или рибозы, и который представляет собой ДНК и РНК в зависимости от контекста описания. Термин «полинуклеотид» охватывает полинуклеотиды любого размера.
Экспрессионный вектор может быть использован для введения гетерологичных полинуклеотидов. Полинуклеотиды могут содержаться в экспрессионном кластере. Полинуклеотид(ы), кодирующий(ие) представляющий интерес продукт, и полинуклеотид(ы), кодирующий(ие) селективный маркер или репортерный полипептид, могут быть локализованы на одном и том же или на различных экспрессионных векторах. Введение в эукариотическую клетку может быть достигнуто, например, путем введения подходящего экспрессионного вектора, содержащего полинуклеотид, кодирующий представляющий интерес продукт, в клетки-хозяева. Экспрессионный вектор, предпочтительно, интегрируют в геном клетки-хозяина (стабильная трансфекция). В случае если гетерологичную нуклеиновую кислоту не встаивают в геном, то такая гетерологичная нуклеиновая кислота может элиминироваться на более поздней стадии, например, на стадии митоза клетки (транзиентная трансфекция). Как показано в примерах, описанные здесь новые эукариотические клетки являются предпочтительными для обоих вариантов, то есть, для транзиентной, а также для стабильной трансфекции. Стабильная трансфекция является предпочтительной для генерирования клеточных клонов с высоким уровнем экспрессии, продуцирующих представляющий интерес продукт, такой как представляющий интерес полипептид, который может быть получен промышленным способом. Это особенно важно для получения представляющих интерес терапевтических или диагностических полипептидов. Некоторые подходящие методы введения гетерологичной нуклеиновой кислоты, такой как экспрессионный вектор, в эукариотические клетки, такие как клетки-хозяева млекопитающих, известны специалистам, а поэтому нет необходимости в их подробном описании. Соответствующими методами являются, но не ограничиваются ими, трансфекция, опосредуемая фосфатом кальция, электропорация, липофекция, биобаллистические методы переноса генов и методы переноса генов, опосредуемые полимером, и т.п. Для переноса гетерологичного полинуклеотида в геном клетки-хозяина, помимо традиционных методов на основе рандомизированной интеграции могут быть также применены методы на основе рекомбинации. Поскольку эти методы хорошо известны специалистам, то нет необходимости в их подробном описании. Неограничивающие варианты конструирования подходящих векторов также описаны ниже и входят в объем настоящего изобретения.
Экспрессионные векторы, используемые для достижения экспрессии представляющего интерес рекомбинантного продукта, обычно содержат элементы регуляции транскрипции, подходящие для инициации транскрипции, такие как, например, промоторы, энхансеры, сигналы полиаденилирования, сигналы транзиторного прерывания или терминации транскрипции, которые обычно представляют собой элементы экспрессионного кластера. Если нужным продуктом является полипептид, то подходящие элементы регуляции трансляции, предпочтительно, вводят в вектор, например, в 5’-нетранслируемые области, что приводит к образованию 5’-кэп-структур, подходящих для рекрутинга рибосом и стоп-кодонов, терминирующих трансляцию. Полученные транскрипты имеют функциональные элементы трансляции, которые облегчают экспрессию белка (то есть трансляцию) и обеспечивают соответствующую терминацию трансляции. Функциональная экспрессионная единица, способная «правильно» индуцировать экспрессию встроенного полинуклеотида, также называется «экспрессионным кластером». Способ конструирования экспрессионного кластера, обеспечивающего экспрессию в эукариотической клетке, такой как, предпочтительно, клетка млекопитающего, хорошо известен специалистам.
Полинуклеотид(ы), кодирующий(е) представляющий интерес продукт, и полинуклеотиды, кодирующие селективный(е) маркер(ы) и/или репортерный(е) полипептид(ы), описанные в настоящей заявке, предпочтительно, содержатся в экспрессионных кластерах. При этом подходящими являются несколько вариантов. Так, например, каждый из указанных полинуклеотидов может содержаться в отдельном экспрессионном кластере. Этот кластер также называется моноцистронным кластером. В объем настоящего изобретения также входят по меньшей мере два соответствующих полинуклеотида, содержащихся в одном экспрессионном кластере. В соответствии с одним из вариантов осуществления изобретения, по меньшей мере один элемент, такой как внутренний сайт связывания с рибосомой (IRES), функционально расположен между полинуклеотидами, которые экспрессируются в одном и том же экспрессионном кластере. Следовательно, в данном случае гарантируется получение отдельных продуктов трансляции из указанного транскрипта. Соответствующие методы экспрессии на основе IRES и другие би- и полицистронные системы хорошо известны специалистам, а поэтому нет необходимости в их подробном описании.
Как описано выше, экспрессионный вектор может содержать по меньшей мере один промотор и/или промотор/энхансер, который служит в качестве элемента экспрессионного кластера. Промоторы могут быть подразделены на два класса, а именно, промоторы, которые функционируют конститутивно, и промоторы, которые регулируются посредством индукции или дерепрессии. Оба этих промотора являются подходящими для их применения в настоящем изобретении. Сильными конститутивными промоторами, которые индуцируют экспрессию в клетках многих типов, являются, но не ограничиваются ими, главный поздний промотор аденовируса, предранний промотор человеческого цитомегаловируса, промотор SV40 и промотор вируса саркомы Рауса, а также мышиный промотор 3-фосфоглицерат-киназы, EF1a. В соответствии с одним из вариантов осуществления изобретения, промотор и/или энхансер получают из CMV и/или SV40. Промоторы транскрипции могут быть выбраны из группы, состоящей из промотора SV40, промотора CMV, промотора EF1-альфа, промотора RSV, промотора BROAD3, мышиного промотора вируса саркомы Рауса 26, промотора pCEFL и промотора β-актина. При этом могут быть также использованы и другие промоторы, при условии, что они будут индуцировать экспрессию представляющего интерес продукта в эукариотической клетке, которая, предпочтительно, представляет собой клетку млекопитающего.
Кроме того, экспрессионный кластер может содержать по меньшей мере один интрон. Обычно, интроны расположены у 5’-конца открытой рамки считывания, но они могут быть также расположены и у 3’-конца. Указанный интрон может быть расположен между промоторным(ми) и/или промоторным(ми)/энхансерным(ми) элементом(ами) и 5’-концом открытой рамки считывания полинуклеотида, кодирующего экспрессируемый представляющий интерес продукт. Некоторые подходящие интроны известны специалистам и могут быть использованы в настоящем изобретении.
Представляющим интерес продуктом может быть любой биологический продукт, способный продуцироваться посредством транскрипции, трансляции или любого другого события экспрессии генетической информации, кодируемой полинуклеотидом, кодирующим представляющий интерес продукт. Представляющий интерес продукт может быть выбран из группы, состоящей из полипептидов и нуклеиновых кислот, а в частности РНК. Указанным продуктом может быть фармацевтически или терапевтически активные соединения или тестируемые средства, используемые в анализах и т.п. Предпочтительно, представляющим интерес продуктом является полипептид. Любой представляющий интерес полипептид может быть экспрессирован способом согласно изобретению. Термин «полипептид» означает молекулу, содержащую полимер из аминокислот, связанных друг с другом пептидной(ыми) связью(связями). Полипептидами являются полипептиды любой длины, включая белки (например, имеющие более чем 50 аминокислот) и пептиды (например, имеющие 2-49 аминокислот). Полипептидами являются белки и/или пептиды, имеющие любую активность, любую функцию или любой размер, и такими полипептидами могут быть, например, ферменты (например, протеазы, киназы, фосфатазы), рецепторы, транспортные белки, бактерицидные и/или эндотоксин-связывающие белки, структурные полипептиды, мембраносвязанные полипептиды, гликопротеины, глобулярные белки, иммунные полипептиды, токсины, антибиотики, гормоны, факторы роста, факторы крови, вакцины или т.п. Полипептид может быть выбран из группы, состоящей из пептидных гормонов, интерлейкинов, тканевых активаторов плазминогена, цитокинов, иммуноглобулинов, а в частности антител или функциональных фрагментов антител или их вариантов и Fc-гибридных белков. Представляющий интерес полипептид, который экспрессируют с применением описанных здесь способов, может также представлять собой субъединицу или домен полипептида, такой как, например, тяжелая цепь или легкая цепь антитела или его функционального фрагмента или производного. Термины «представляющий интерес продукт» или «представляющий интерес полипептид» могут означать отдельную субъединицу или отдельный домен или конечный белок, состоящий из соответствующих субъединиц или доменов в зависимости от контекста описания изобретения. В предпочтительном варианте осуществления изобретения, представляющим интерес полипептидом является молекула иммуноглобулина, а более предпочтительно, антитело или его субъединица или домен, такие как, например, тяжелая или легкая цепь антитела. Используемый здесь термин «антитело», в частности, означает белок, содержащий по меньшей мере две тяжелых цепи и две легких цепи, связанных дисульфидными связями. Термин «антитело» включает природные антитела, а также рекомбинантные формы антител, например, гуманизованные антитела, полностью человеческие антитела и химерные антитела. Каждая тяжелая цепь обычно состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (CH). Каждая легкая цепь обычно состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Однако, термин «антитело» также включает и антитела других типов, такие как однодоменные антитела, антитела с тяжелой цепью, то есть состоящие только из одной или более, а в частности, из двух тяжелых цепей, и наноантитела, то есть антитела, состоящие только из одного мономерного вариабельного домена. Как обсуждалось выше, полинуклеотид, кодирующий представляющий интерес полипептид, может также кодировать одну или более субъединиц или доменов антитела, например, тяжелую или легкую цепь или их функциональный фрагмент или производное, используемые здесь в качестве представляющего интерес полипептида. Указанные субъединицы или домены могут экспрессироваться из одного и того же или из различных экспрессионных кластеров. Термин «функциональный фрагмент или производное» антитела, в частности, означает полипептид, происходящий от антитела и способный связываться с одним и тем же антигеном, а в частности, с тем же самым эпитопом, с котоым связывается антитело. Было показано, что антигенсвязывающая функция антитела может обеспечиваться фрагментами полноразмерного антитела или его производных. Примерами фрагментов или производных антитела являются: (i) Fab-фрагменты, одновалентные фрагменты, состоящие из вариабельной области и первого константного домена каждой тяжелой и легкой цепи; (ii) F(ab)2-фрагменты, двухвалентные фрагменты, содержащие два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагменты. состоящие из вариабельной области и первого константного домена CH1 тяжелой цепи; (iv) Fv-фрагменты, состоящие из вариабельной области тяжелой и легкой цепи одной ветви антитела; (v) scFv-фрагменты, Fv-фрагменты, состоящие из одной полипептидной цепи; (vi) (Fv)2-фрагменты, состоящие из двух Fv-фрагментов, ковалентно связанных друг с другом; (vii) вариабельный домен тяжелой цепи; и (viii) мультиантитела, состоящие из вариабельной области тяжелой цепи и вариабельной области легкой цепи, ковалентно связанных друг с другом так, что ассоциация вариабельных областей тяжелой цепи и легкой цепи может быть только межмолекулярной, а не внутримолекулярной. В соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка секретирует представляющий интерес рекомбинантный полипептид в среду для культивирования клеток. В соответствии с одним из вариантов осуществления изобретения, представляющим интерес полипептидом не является белок C12orf35, либо этот полипептид не содержит белка C12orf35.
Эукариотическая клетка может содержать, а может и не содержать эндогенный полинуклеотид, который, соответственно, идетичен полинуклеотиду, кодирующему представляющий интерес продукт. В соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка не содержит эндогенного гена, соответствующего представляющему интерес продукту.
Как описано выше, в предпочтительных вариантах осуществления изобретения, эукариотическая клетка содержит по меньшей мере один гетерологичный полипептид, кодирующий селеоктивный маркер, и/или гетерологичный полинуклеотид, кодирующий репортерный полипептид, а также гетерологичный полинуклеотид, кодирующий представляющий интерес продукт.
«Селективный маркер» позволяет осуществлять отбор клеток-хозяев, экспрессирующих указанный селективный маркер, в подходящих условиях селективного культивирования. Селективный маркер содержит носитель, который в условиях отбора обеспечивает выживание и/или рост клеток. Таким образом, клетки-хозяева, успешно трансфецированные экспрессионным вектором, могут быть отобраны в соответствующих условиях отбора. Обычно, селективный маркерный ген сообщает резистентность к селективному агенту, такому как лекарственное средство, например, антибиотик или другой токсический агент, или компенсирует метаболический или катаболический дефект в клетке-хозяине. Таким маркером может быть маркер позитивного или негативного отбора. Для отбора успешно трансфецированных клеток-хозяев может быть использована культуральная среда в целях культивирования клеток-хозяев, содержащих селективный агент, позволяющий проводить отбор на используемый селективный маркер. В других вариантах осуществления изобретения, селективный маркер обеспечивает выживание и пролиферацию клетки-хозяина в отсутствии соединения или при низком количестве соединения, играющего важную роль в выживании и/или пролиферации клеток-хозяев, не содержащих селективного маркера. При клонирования клеток-хозяев в среде, не содержащей этого главного соединения в концентрации, достаточной для выживания и/или пролиферации клетки-хозяина, или содержащей низкое количество указанного главного соединения, выживать и/или пролиферироваться могут только клетки-хозяева, экспрессирующие селективный маркер. В соответствии с одним из вариантов осуществления изобретения, селективным маркером является маркер резистентности, кодирующий белок, который сообщает резистентность к указанному лекарственному средству в условиях отбора. В литературе описан ряд селективных маркерных генов (см., например, WO 92/08796, WO 94/28143, WO2004/081167, WO2009/080759, WO2010/097240). Так, например, может быть использован по меньшей мере один селективный маркер, сообщающий резистентность к одному или более антибиотикам. В соответствии с одним из вариантов осуществления изобретения, селективным маркером может быть амплифицируемый селективный маркер. Амплифицируемый селективный маркер позволяет проводить отбор вектора, содержащего клетки-хозяева, и может стимулировать амплификацию гена указанного вектора в клетках-хозяевах. Селективные маркерные гены обычно используют вместе с эукариотическими клетками, такими как, в частности, клетки млекопитающего, и такими генами являются гены аминогликозид-фосфотрансферазы (APH), гигромицин-фосфотрансферазы (hyg), дигидрофолатредуктазы (DHFR), тимидинкиназы (tk), глутаминсинтетазы и аспарагинсинтетазы, и гены, кодирующие резистентность к неомицину (G418), пуромицину, гигромицину, зеоцину, оубаину, бластицидину, гистидинолу D, блеомицину, флеомицину и микофеноловой кислоте. В соответствии с одним из вариантов осуществления изобретения, фолатный рецептор используется в качестве селективного маркера в комбинации с описанными здесь новыми эукариотическими клетками (см., например, WO2009/080759), которыми, предпочтительно, являются клетки млекопитающих. В соответствии с одним из вариантов осуществления изобретения, эукариотическая клетка содержит гетерологичный полинуклеотид, кодирующий фолатный рецептор, используемый в качестве селективного маркера, и/или гетерологичный полинуклеотид, кодирующий дигидрофолатредуктазу (DHFR), используемую в качестве селективного маркера. Этот вариант также подробно описан ниже вместе со способом отбора согласно второму аспекту изобретения. Эукариотическая клетка может эндогенно экспрессировать DHFR и фолатный рецептор.
«Репортерный полипептид» позволяет идентифицировать клетку, экспрессирующую указанный репортерный полипептид, исходя из детектирующих признаков (например, по флуоресценции). Репортерные гены обычно не сообщают клеткам-хозяевам способность к выживанию. Однако, экспрессия репортерного полипептида может быть использована для дифференциации клеток, экспрессирующих репортерный полипептид, и клеток, которые не экспрессируют этот полипептид. Следовательно, с использованием такого репортерного гена можно также проводить отбор успешно трансфецированных клеток-хозяев. Подходящими репортерными полипептидами являются, но не ограничиваются ими, белок, флуоресцирующий в зеленом диапазоне спектра (GFP), YFP, CFP и люцифераза. В соответствии с одним из вариантов осуществления изобретения, репортерный полипептид обладает свойствами, позволяющими проводить отбор с помощью проточной цитометрии.
Как описано выше, экспрессионный вектор, содержащий полинуклеотид, кодирующий представляющий интерес продукт, может также включать более чем один селективный маркер и/или репортерный ген. Кроме того, один или более полинуклеотидов, кодирующих селективный(е) маркер(ы), и/или один или более полинуклеотидов, кодирующих репортерный(е) полипептид(ы), могут также присутствовать на одном или более различных экспрессионных векторах, которые были котрнасфецированы экспрессионным вектором, содержащим полинуклеотид, кодирующие представляющий интерес продукт. Такие стратегии котрансфекции, которые также позволяют проводить отбор, хорошо известны специалистам.
Экспрессионный вектор или комбинация по меньшей мере двух экспрессионных векторов, содержащихся в эукариотической клетке, может дополнительно содержать другие векторые элементы. Так, например, может присутствовать по меньшей мере один дополнительный полинуклеотид, кодирующий другой представляющий интерес продукт. Как указывалось выше, и как очевидно из описанных здесь примеров, относящихся к полипептидам, которые могут быть экспрессированы способами согласно изобретению, конечный полипептид, продуцируемый, а предпочтительно, секретируемый клеткой-хозяином, может также представлять собой белок, состоящий из нескольких отдельных субъединиц или доменов. Предпочтительным примером соответствующего белка является молекула иммуноглобулина, а в частности, антитело, содержащее, например, тяжелую и легкую цепи. Специалистам известно несколько вариантов продуцирования соответствующего белка, состоящего из различных отдельных субъединиц или доменов, и подходящих векторных конструкций. В соответствии с одним из вариантов осуществления изобретения, две или более субъединиц или два или более доменов указанного белка экспрессируются из одного экспрессионного кластера. В этом варианте осуществления изобретения, один длинный транскрипт получают из соответствующего экспрессионного кластера, содержащего кодирующие области из отдельных субъединиц или доменов белка. В соответствии с одним из вариантов осуществления изобретения, по меньшей мере один элемент IRES (внутренний сайт связывания с рибосомой) функционально расположен между кодирующими областями отдельных субъединиц или доменов, а за секреторной лидерной последовательностью расположены кодирующие области. Следовательно, в данном случае гарантируется получение отдельных продуктов трансляции из указанного транскрипта и конечного белка, который может быть подвергнут соответствующему фолдингу и секреции. Соответствующие методы известны специалистам, а поэтому нет необходимости в их подробном описании.
В некоторых вариантах осуществления изобретения, относящихся к экспрессии антител, еще более предпочтительно, чтобы отдельные субъединицы или домены экспрессировались из различных экспрессионных кластеров. В соответствии с одним из вариантов осуществления изобретения, экспрессионным кластером, используемым для экспрессии представляющего интерес продукта, является моноцистронный экспрессионный кластер. Все экспрессионные кластеры, содержащиеся в экспрессионном векторе или в комбинации экспрессионных векторов, могут быть моноцистронными. В соответствии с одним из вариантов осуществления изобретения, каждый экспрессионный кластер, сконструированный для экспрессии представляющего интерес продукта, включает полинуклеотид, кодирующий одну субъединицу или один домен белка, который экспрессируется как представляющий интерес полипептид. Так, например, в случае антител, один экспрессионный кластер может кодировать легкую цепь антитела, а другой экспрессионный кластер может кодировать тяжелую цепь антитела. После экспрессии отдельных субъединиц или доменов из отдельных экспрессионных кластеров, конечный белок, такой как антитело, подвергается укладке из указанных субъединиц или доменов, и секретируется клеткой-хозяином. Этот вариант является особенно подходящим для экспрессии молекул иммуноглобулина, таких как антитела. В этом случае, первый гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, кодирует, например, тяжелую или легкую цепь молекулы иммуноглобулина, а второй гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, кодирует другую цепь молекулы иммуноглобулина. В соответствии с одним из вариантов осуществления изобретения, экспрессионный вектор или комбинация по меньшей мере двух экспрессионных векторов, используемых для трансфекции клетки-хозяина млекопитающего, содержит по меньшей мере один экспрессионный кластер, включающий полинуклеотид, кодирующий тяжелую цепь молекулы иммуноглобулина или ее функциональный фрагмент, и по меньшей мере один экспрессионный кластер, включающий полинуклеотид, кодирующий легкую цепь молекулы иммуноглобулина или ее функциональный фрагмент. Указанные полинуклеотиды могут быть расположены на одном и том же или на различных экспрессионных векторах в том случае, если используется комбинация по меньшей мере двух экспрессионных векторов. После экспрессии указанных полинуклеотидов в трансфецированной клетке-хозяине, функциональная молекула иммуноглобулина продуцируется, а предпочтительно, секретируется такой клеткой-хозяином. Как показано в примерах, используемые здесь новые клетки и клеточные линии, в которых ингибируется функция продукта экспрессии гена C12orf35, предпочтительно, благодаря снижению или блокированию функциональной экспрессии указанного гена, являются особенно подходящими для экспрессии белков, а в частности, белков, состоящих из нескольких субъединиц или доменов, таких как антитела. Как показано в примерах, общее количество антитела, экспрессируемого указанными эукариотическими клетками, увеличивается. Кроме того, в некоторых вариантах осуществления изобретения, а в частности, в случае дополнительного ингибирования функции FAM60A в клетке, стабильность экспрессии также повышается. Следовательно, описанные здесь новые эукариотические клеточные линии имеют конкретные преимущества, позволяющие использовать эти клетки для рекомбинантной экспрессии полипептидов, включая белки, состоящие из нескольких субъединиц или доменов, таких как, например, антитела. Другие преимущества также описаны в примерах.
B. Способ отбора
В соответствии со своим вторым аспектом, настоящее изобретение относится к способу отбора клетки-хозяина, которая рекомбинантно экспрессирует представляющий интерес продукт, где указанный способ включает:
(a) получение эукариотических клеток в качестве клеток-хозяев согласно первому аспекту изобретения, где указанные клетки-хозяева содержат по меньшей мере один гетерологинный полинуклеотид, кодирующий представляющий интерес продукт; и
(b) отбор одной или более клеток-хозяев, экспрессирующих представляющий интерес продукт.
Эукариотические клетки согласно первому аспекту изобретения, включая подходящие и предпочтительные варианты осуществления изобретения, а также их преимущества подробно описаны выше в соответствующих разделах настоящей заявки. Как описано выше, в качестве клеток-хозяев предпочтительно используются клетки позвоночных, а в частности клетки млекопитающих. Преимущественные свойства указанных эукариотических клеток облегчают, например, отбор и тем самым идентификацию подходящих продуцирующих клонов. Кроме того, при использовании описанных здесь эукариотических клеток, благодаря значительному увеличению числа высокопродуктивных клеток в популяции трансфецированных клеток, для идентификации подходящих продуцирующих клонов потребуется меньшее число клонов, необходимых для анализа и скрининга на их продуктивные свойства. Это позволит сэкономить время, а также провести большее число параллельных исследований. Кроме того, как показано в примерах, при использовании указанных новых эукариотических клеток, число и, соответственно, процент клеток с высоким уровнем экспрессии будет возрастать после проведения стадий трансфекции и отбора. Такие экспрессирующие клетки, также называемые клеточными пулами, продуцируют значительное количество представляющего интерес продукта. Таким образом, указанные клеточные пулы, содержащие клетки с высоким уровнем экспрессии, могут быть, например, использованы для продуцирования представляющего интерес полипептида за короткий период времени. Следовательно, представляющий интерес продукт будет продуцироваться в соответствующих клетках достаточно быстро.
В соответствии с одним из вариантов осуществления изобретения, стадия (a) способа отбора согласно второму аспекту изобретения включает трансфекцию эукариотических клеток согласно первому аспекту изобретения, которые, предпочтительно, еще не содержат гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, гетерологичным полинуклеотидом, кодирующим представляющий интерес продукт, и тем самым, получение эукариотических клеток, содержащих гетерологичный полинуклеотид, кодирующий представляющий интерес продукт. Как описано выше, клетки млекопитающих, предпочтительно, используются в качестве эукариотических клеток-хозяев. Полинуклеотид, кодирующий представляющий интерес продукт, может присутствовать в экспрессионном векторе, который затем вводят в эукариотическую клетку.
Стадия отбора (b) может представлять собой многостадийный способ отбора, включающий несколько стадий для отбора и, тем самым, для идентификации клеток-хозяев, экспрессирующих представляющий интерес продукт с высоким выходом. Так, например, стадия (b) может включать одну или более стадий отбора для идентификации клеток, которые были успешно трансфецированы, а также одну или более дополнительных стадий для отбора клеток с высоким уровнем экспрессии из пула успешно трансфецированных клеток. Соответствующая стратегия отбора зависит от конструкции экспрессионного вектора, используемого доя введения полинуклеотида, кодирующего представляющий интерес продукт, а в частности, от типа используемого(ых) маркера(ов) и/или репортера(ов) для отбора. Неограничивающие варианты осуществления изобретения описаны ниже.
Как описано выше, эукариотические клетки-хозяева могут содержать по меньшей мере один гетерологичный полинуклеотид, кодирующий селективный маркер. Полинуклеотид, кодирующий селективный маркер, может быть введен в клетку-хозяина вместе с полинуклеотидом, кодирующим представляющий интерес продукт, с использованием того же самого или другого котрансфецированного экспрессионного вектора. Затем стадия (b) включает культивирование множества указанных клеток-хозяев в условиях, обеспечивающих давление отбора клеток-хозяев для идентификации успешно трансфецированных клеток-хозяев, например, в подходящей селективной среде. Используемый здесь термин «селективная среда», в частности, означает среду для культивирования клеток, подходящую для отбора клеток-хозяев, экспрессирующих селективный маркер. Эта среда может включать, например, агент для отбора, такой как токсическое лекарственное средство, позволяющее идентифицировать успешно трансфецированные клетки-хозяева. Альтернативно, в селективной среде, главное соединение может отсутствовать, либо его концентрация может быть снижена. В соответствии с одним из вариантов осуществления изобретения, клетки-хозяева, которые не были успешно трансфецированы, а следовательно, не экспрессировали селективный(е) маркер(ы) или экспрессировали этот маркер на низком уровне, не могли пролиферировать или погибали в условиях селективного культивирования. В противоположность этому, клетки-хозяева, которые были успешно трансфецированы экспрессионным(и) вектором(ами), и которые экспрессировали селективный(е) маркер(ы) (и соответственно, совместно введенный представляющий интерес продукт) с достаточно высоким выходом, были резистентными к давлению отбора или почти не подвергались давлению отбора, а поэтому могли пролиферовать, что приводило к размножению клеток-хозяев, которые не были успешно трансфецированы, или в геноме которых присутствовал «неподходящий» сайт интеграции. В соответствии с одним из вариантов осуществления изобретения, селективный маркер выбран из группы, состоящей из маркеров резистентности к антибиотикам, маркеров резистентности к лекарственным средствам и метаболических маркеров. Подходящие примеры селективных маркеров и стратегий отбора описаны выше в соответствии с первым аспектом изобретения, и соответствующие условия отбора отдельных селективных маркеров также хорошо известны специалистам. Неограничивающие, но предпочтительные варианты осуществления изобретения кратко описаны ниже.
Как показано в примерах, одно из преимуществ описаннх здесь новых эукариотических клеток, в частности, таких как клеточная линия CHO, имеющая делецию в теломерной области хромосомы 8, которая включает ген C12orf35, заключается в том, что уже после одной стандартной стадии отбора, такой как, например, отбор с использованием G418/neo, процент высокопродуктивных клеток значительно увеличивается. Так, например, при трансфекции нормальных клеточных линий CHO, где экспрессия гена C12orf35 не снижается или не блокируется, в большинстве случаев, 60% или даже до 80% этих клеток, сохранивших свою жзнеспособность после отбора с использованием G418/neo, являются непродуктивными. Однако, при использовании новых эукариотических клеток клеточных линий согласно изобретению, число непродуктивных клеток или клеток с низкой продуктивностью значительно снижалось. Это позволяет осуществлять эффективный отбор в стадии (b) с помощью лишь одного селективного маркера и проводить лишь одну стадию отбора, такую как, например, отбор с использованием G418/neo, если это необходимо. Этот способ ускоряет отбор, и тем самым позволяет сократить время, необходимое для получения трансфецированных клеток, которые экспрессируют представляющий интерес продукт. Кроме того, поскольку число высокопродуктивных клеток возрастает, то совершенно очевидно, что даже без проведения селективного отбора на высокопродуктивные клетки могут быть получены популяции клеток с высокоэффективными клонами и, при этом, за очень короткое время. Следовательно, даже из таких пулов может быть получен представляющий интерес продукт. Таким образом, в случае, когда, например, необходимо очень быстро получить лишь некоторое количество белка, например, для исследования или проведения анализа, такая система экспресс-отбора, которая позволяет очень быстро получить клетки или пулы клеток с хорошей продуктивностью, имеет очень большие преимущества.
Однако, если неоходимо еще больше повысить продуктивность, то предпочтительно провести несколько стадий отбора (b). Это особенно желательно в случае, когда необходимо получить клональную клеточную линию для продуцирования представляющего интерес продукта в больших количествах, а в частности, в промышленном производстве.
Как было описано выше, экспрессионный вектор или экспрессионные векторы, вводимые в эукариотические клетки, могут содержать два или более генов селективных маркеров, и стадии отбора на различные селективные маркеры могут быть осуществлены одновременно или последовательно для выявления клеток-хозяев, успешно трансфецированных экспрессионным(и) вектором(ами) и экспрессирующих представляющий интерес продукт с высоким выходом. Селективная среда, используемая для культивирования, может содержать селективные агенты для всех используемых селективных маркеров. В другом варианте осуществления изобретения, культивирование может быть сначала осуществлено в селективной среде, содержащей только селективный(е) агент(ы) для одного гена или субсерии генов используемых селективных маркеров, а затем могут быть добавлены один или более селективных агентов для остальных генов селективных маркеров. В другом варианте осуществления изобретения, клетки-хозяева культивируют в первой селективной среде, содержащей только селективный(е) агент(ы) для одного векторного гена или субсерии векторных генов используемых селективных маркеров, а затем эти клетки культивируют во второй селективной среде, содержащей один или более селективных агентов для остальных генов селективных маркеров. В соответствии с одним из вариантов осуществления изобретения, вторая селективная среда не содержит селективного(ых) агента(ов), используемого(ых) в первой селективной среде.
В соответствии с одним из вариантов осуществления изобретения, эукариотические клетки, полученные в стадии (a), содержат гетерологичный полинуклеотид, кодирующий дигидрофолатредуктазу (DHFR), используемую в качестве селективного маркера, а стадия (b) включает проведение отбора на DHFR. В соответствующей стадии отбора обычно используют селективную среду, содержащую ингибитор DHFR. Некоторые подходящие ферменты DHFR и, соответственно, гены DHFR известны специалистам и могут быть использованы в качестве селективного маркера. Термин «DHFR» означает: DHFR дикого типа, а также ферменты DHFR, имеющие одну или более модификаций в аминокислотной последовательности (например, делеций, замен или добавлений) по сравнению с аминокислотной последовательностью соответствующего фермента DHFR дикого типа; гибридные белки, содержащие фермент DHFR и ферменты DHFR, которые были модифицированы для сообщения им дополнительной структуры и/или функции, а также функциональные фрагменты вышеуказанных ферментов, которые обладают по меньшей мере одной из функций фермента DHFR. Такие варианты хорошо известны специалистам, а поэтому нет необходимости в их подробном описании. Так, например, фермент DHFR может быть использован в качестве селективного маркера, который является более или менее чувствительным к антифолатам, таким как MTX, по сравнению с ферментом DHFR дикого типа и/или ферментом DHFR, эндогенно экспрессируемым клетой-хозяином, если указанная клетка экспрессирует такой фермент. Соответствующие ферменты DHFR хорошо известны специалистам и описаны, например, в EP 0246049 и в других документах. Фермент DHFR может происходить из любых источников, при условии, что он явлется функциональным при его использовании в настоящем изобретении, то есть совместимым с используемой клеткой-хозяином млекопитающего. Так, например, мутантный мышиный DHFR, обладающий значительной резистентностью к MTX, широко используется в качестве доминантно-селективного маркера в эукариотических клетках. Фермент DHFR может быть использован в качестве селективного маркера, который является менее восприимчивым к ингибитору DHFR, такому как MTX, чем фермент DHFR, эндогенно экспрессируемый в DHFR+ (плюс)-клетке-хозяине, то есть, в клетке-хозяине, которая содержит функциональный эндогенный ген DHFR. В соответствии с одним из вариантов осуществления изобретения, интрон или его фрагмент расположены у 3’-конца открытой рамки считывания гена DHFR. Интрон, используемый в DHFR-экспрессирующем кластере, находится перед менее крупным нефункциональным вариантом гена DHFR (Grillari et al., 2001, J. Biotechnol. 87, 59-65). Таким образом, уровень экспрессии гена DHFR снижается, что приводит к дополнительному повышению жесткости отбора. Альтернативные методы использования интрона для снижения уровня экспрессии гена DHFR описаны в EP0724639 и могут быть также применены в настоящем изобретении.
Термин «ингибитор DHFR», в частности, означает соединение, которое ингибирует активность дигидрофолатредуктазы (DHFR). Соответствующий ингибитор может, например, конкурировать с субстратом DHFR за связывание с DHFR. Подходящими ингибиторами DHFR являются, например, антифолаты, такие как метотраксат (MTX). Таким образом, в соответствии с одним из вариантов осуществления изобретения, стадия (b) включает проведение стадии отбора на DHFR путем культивирования множества указанных клеток-хозяев в селективной культуральной среде, содержащей по меньшей мере один ингибитор DHFR, такой как, предпочтительно, антифолат. Соответствующие условия отбора известны специалистам. В соответствии с одним из вариантов осуществления изобретения, в стадии (b) используется селективная культуральная среда, содержащая антифолат в концентрации 1500 нМ или менее, 1250 нМ или менее, 1000 нМ или менее, 750 нМ или менее, 500 нМ или менее, 250 нМ или менее, 200 нМ или менее, 150 нМ или менее, 125 нМ или менее, 100 нМ или менее или 75 нМ или менее. Жесткость условий отбора может быть определена с использованием концентрации указанного ингибитора в селективной культуральной среде (где указанная концентрация может также постепенно повышаться). Предпочтительные интервалы значений концентраций антифолата могут быть выбраны из 500 нМ - 0,1 нМ, 350 нМ - 1 нМ, 200 нМ - 2,5 нМ, 150 нМ - 5 нМ, 100 нМ - 7,5 нМ и 75 нМ - 10 нМ. В соответствии с одним из вариантов осуществления изобретения, селективная культуральная среда содержит MTX в качестве антифолата. Как показано в примерах, для проведения DHFR-отбора, а в частности, если такой отбор осуществляют в комбинации с лимитирующей концентрацией фолата, то при использовании описанных здесь новых эукариотических клеток, MTX может быть взят в низких концентрациях.
В соответствии с одним из вариантов осуществления изобретения, клетки-хозяева согласно изобретению, используемые в стадии (a), содержат гетерологичный полинуклеотид, кодирующий переносчик фолата, в качестве селективного маркера. Система отбора на основе переносчика фолата, если она используется в комбинации с эукариотическими клетками, действие которых зависит от поглощения фолата, такими как клетки млекопитающих, имеет ряд преимуществ. Переносчик фолата позволяет переносить по меньшей мере один фолат из культуральной среды в клетку-хозяина, которая, предпочтительно, является клеткой млекопитающего. В соответствии с одним из вариантов осуществления изобретения, переносчик фолата представляет собой или содержит восстановленный носитель фолата (RFC). RFC представляет собой повсеместно экспрессируемый мембранный гликопртеин, который служит в качестве основного переносчика восстановленных фолатов, таких как 5-метил-THF и 5-формил-THF, в клетку. Однако RFC обладает очень слабой активностью по отношению к окисленному фолату, то есть, к фолиевой кислоте. Следовательно, клетки, которые не экспрессируют RFC, или из которых был удален геномный локус RFC, могут служить в качестве реципиентов для трансфекции селективного маркерного гена RFC в условиях, при которых восстановленные фолаты, такие как 5-формил-THF, будут постепенно удаляться из культуральной среды, что позволяет идентифицировать клетки, экспрессирующие повышенные уровни этого переносчика фолата и, соответственно, представляющего интерес продукта. Подходящие условия отбора, в которых используется RFC в качестве селективного маркера, известны специалистам и описаны, например, в WO2006/059323.
В соответствии с одним из вариантов осуществления изобретения, который также подробно описан ниже и в разделе «Примеры», переносчиком фолата, используемым в качестве селективного маркера, является фолатный рецептор. Система отбора на основе фолатного рецептора имеет ряд преимуществ. Так, например, в этом случае, для отбора необязательно использовать токсические вещества (даже если они могут быть использованы), и кроме того, эндогенный фолатный рецептор клетки-хозяина необязательно должен быть ингибирован. Кроме того, такая система экспрессии особенно хорошо функционирует в комбинации с описанной здесь новой эукариотической клеточной линией, в которой была снижена или блокирована функция продукта экспрессии гена C12orf35, предпочтительно, посредством снижения или блокирования экспрессии гена C12orf35. Одним из объяснений этого факта является то, что встроенные гены, такие как гены представляющего интерес полипептида, а также селективные маркерные гены экспрессируются на более высоком уровне, что упрощает отбор.
Используемый здесь термин «фолатный рецептор» означает фолатный рецептор, который является функциональным, и таким образом, обладает способностью переносить фолат или его производное в эукариотическую клетку или способствовать поглощению такого фолата или его производного эукариотической клеткой. Предпочтительно, указанный рецептор обладает способностью осуществлять однонаправленный перенос фолата или его производного в эукариотическую клетку или однонаправленное поглощение такого фолата или его производного эукариотической клеткой. Кроме того, используемый здесь фолатный рецептор является мембраносвязанным. Таким образом, описанные здесь фолатные рецепторы представляют собой функциональные мембраносвязанные фолатные рецепторы. Заякоривание на мембране может быть достигнуто, например, посредством трансмембранного якоря или GPI-якоря. GPI-якорь является предпочтительным, поскольку он соответствует природной структуре мембраносвязанного фолатного рецептора. Фолатные рецепторы (FR) представляют собой высокоаффинные фолат-связывающие гликопротеины. Эти рецепторы кодируются тремя отдельными генами, FR альфа, FR бета и FR гамма. FR альфа и FR бета представляют собой гликопротеины клеточной поверхности, заякоренные на гликозилфосфотидилинозите (GPI), а FR-гамма не содержит GPI-якоря и представляет собой секретированный белок. Однако, этот рецептор может быть генетически модифицирован так, чтобы он включал трансмембранный якорь или GPI-якорь. Такая модифицированная форма FR-гамма, которая включает мембранный якорь, также рассматривается как мембраносвязанный фолатный рецептор, если он обладает способностью осуществлять перенос фолата или его производного в эукариотическую клетку или поглощение такого фолата или его производного эукариотической клеткой. Термин «фолатный рецептор» также включает мембраносвязанные мутанты фолатных рецепторов дикого типа, способных поглощать фолат, и гибридные белки, содержащие соответствующий фолатный рецептор.
Используемый здесь фолатный рецептор может происходить от фолатного рецептора любого вида, при условии, что он явлется функциональным при его использовании в настоящем изобретении, то есть, совместимым с используемой клеткой-хозяином, и при экспрессии этого рецептора в трансформированной клетке-хозяине, он переносит фолат, а в частности фолиевую кислоту из культуральной среды в клетку-хозяина, действие которой зависит от поглощения фолата. Вообще говоря, фолатный рецептор, который вводится в клетку-хозяина в качестве селективного маркера, может быть гомологичным или гетерологичным по отношению к эндогенному фолатному рецептору клетки-хозяина (если в ней присутствует эндогенный фолатный рецептор, что предпочтительно). Если этот рецептор является гомологичным, то он может происходить от клетки того же самого вида, к которому принадлежит клетка-хозяин. Если этот рецептор является гетерологичным, то он может происходить от клетки другого вида. Так, например, человеческий фолатный рецептор может быть использован в качестве селективного маркера для клетки-хозяина грызунов, например, клетки хомячка, такой как клетка CHO. Предпочтительно использовать фолатный рецептор, происходящий от млекопитающего, например, от грызуна, такого как мышь, крыса или хомячок, или более предпочтительно, от человека. Мембраносвязанный фолатный рецептор, используемый в качестве селективного маркера, может быть выбран из группы, состоящей из фолатного рецептора альфа, фолатного рецептора бета и фолатного рецептора гамма. В соответствии с одним из вариантов осуществления изобретения, в качестве селективного маркера используют человеческий фолатный рецептор альфа.
Мембраносвязанный фолатный рецептор, используемый в качестве переносчика фолата, является предпочтительным, поскольку в этом случае могут быть использованы клетки, которые эндогенно экспрессируют свои собственные фолатные рецепторы, и в которых происходит процессинг фолиевой кислоты посредством фолатного рецептора. Подходящие мембраносвязанные фолатные рецепторы, которые могут быть использованы в качестве селективных маркеров для эукариотических клеток, действие которых зависит от поглощения фолата, таких как клетки млекопитающих, и подходящие условия отбора также описаны в заявке WO 2009/080759, которая вводится в настоящее описание посредством ссылки. В соответствии с одним из вариантов осуществления изобретения, используемый зрелый человеческий фолатный рецептор альфа дикого типа содержит нижеследующую аминокислотную последовательность, представленную в SEQ ID NO: 20 (однобуквенный код, в направлении от N-конца до C-конца).
Фолатный рецептор альфа обычно заякорен на клеточной мембране посредством GPI-якоря. Сигнальная последовательность GPI-якоря не представлена в SEQ ID NO: 20. В соответствии с одним из вариантов осуществления изобретения, фолатный рецептор альфа, который происходит от SEQ ID NO: 20 или содержит SEQ ID NO: 20, включает GPI-заякоривающий сигнал у С-конца. При этом может быть использован любой подходящий GPI-заякоривающий сигнал. Природная сигнальная последовательность GPI-якоря человеческого фолатного рецептора альфа представлена в SEQ ID NO: 21 (однобуквенный код, в направлении от N-конца до C-конца).
Альтернативно, заякоривание на мембране может быть достигнуто с использованием мембранного якоря, например, трансмембранного якоря. В этом варианте осуществления изобретения, фолатный рецептор содержит мембранный якорь у С-конца. Подходящие якори известны специалистам. Фолатный рецептор альфа, который происходит от SEQ ID NO: 20 или содержит SEQ ID NO: 20, может иметь лидерную последовательность у N-конца. При этом, может быть использована любая подходящая лидерная последовательность, которая будет обеспечивать функциональную экспрессию фолатного рецептора.
Полноразмерная аминокислотная последовательность, включающая природную лидерную последовательность (у N-конца) и природную сигнальную последовательность GPI-якоря (у С-конца) человеческого фолатного рецептора альфа дикого типа представлена в SEQ ID NO: 22 (однобуквенный код, в направлении от N-конца до C-конца).
В соответствии с одним из вариантов осуществления изобретения, мембраносвязанный фолатный рецептор имеет или содержит аминокислотную последовательность SEQ ID NO: 20 или 22 или функциональный вариант вышеуказанной последовательности, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% гомологична или идентична последовательности SEQ ID NO: 20 или 22, является мембраносвязанной и способна обеспечивать поглощение фолиевой кислоты клеткой.
При использовании эукариотической клетки, функция которой зависит от поглощения фолата, например, клетки-хозяина млекопитающего, содержащей гетерологичный полинуклеотид, кодирующий переносчик фолата, а предпочтительно, фолатный рецептор, стадия (b) включает проведение стадии отбора, где множество указанных клеток-хозяев культивируют в селективной культуральной среде, содержащей фолат в лимитирующей концентрации. Используемый здесь термин «лимитирующая концентрация фолата», в частности, означает концентрацию фолата(ов) в селективной культуральной среде, которая обеспечивает давление отбора на клетку-хозяина. В таких условиях отбора, расти и пролиферовать могут только те клетки-хозяева, в которые был включен экспрессионный вектор, и которые, тем самым, экспрессируют переносчик фолата в качестве селективного маркера. В соответствии с этим, фолаты не содержатся в избытке в селективной культуральной среде, и такое ограниченное количество фолата(ов) в культуральной среде обеспечивает давление отбора на клетки-хозяева. Фолат, содержащийся в селективной культуральной среде в лимитирующей концентрации, способен поглощаться клеткой-хозяином и процессироваться в этой клетке, а в частности, в клетках-хозяевах, которые имеют переносчик фолата, используемый в качестве селективного маркера. Фолаты, а в частности, производные фолата, которые не процессируются или не могут процессироваться в клетке-хозяине, не вносят свой вклад в давление отбора, что усложняет отбор клеток-хозяев, в которые был включен переносчик фолата в качестве селективного маркера, а поэтому в этих клетках не обеспечивается лимитирующая концентрация фолата. Однако при этом могут присутствовать соответствующие фолаты, такие как, например, антифолаты, и их присутствие даже является предпочтительным в том случае, если осуществляют отбор в комбинации с DHFR как описано ниже. Фолат, присутствующий с селективной культуральной среде в лимитирующей концентрации, может представлять собой, например, окисленный фолат или восстановленный фолат или его производное. Окисленные фолаты, такие как фолиевая кислота, а также восстановленные производные фолиевой кислоты, известные как восстановленные фолаты или тетрагидрофолаты (THF), принадлежат к группе витаминов B-9, которые представляют собой основные кофакторы и/или коферменты, участвующие в биосинтезе пуринов, тимидилата и некоторых аминокислот в эукариотических клетках, функция которых зависит от поглощения фолата, таких как клетки млекопитающих. Кофакторы THF являются осоенно подходящими для репликации ДНК и следовательно, для пролиферации клеток. Предпочтительным фолатом, который содержится в селективной культуральной среде в лимитирующей концентрации, является фолиевая кислота. Подходящие интервалы концентраций, обеспечивающие лимитирующую концентрацию фолата, приводятся ниже.
Система отбора с использованием переносчика фолата основана на ограниченной доступности фолата, а предпочтительно, фолиевой кислоты в среде для культивирования клеток. Клетки-хозяева, в которые не был(и) успешно встроен(ы) экспрессионный(е) вектор(ы), и которые, тем самым, не экспрессировали переносчик фолата, а предпочтительно, фолатный рецептор, в достаточном количестве, погибали или плохо размножались в селективных условиях культивирования, по сравнению с клетками-хозяевами, в которые был(и) успешно встроен(ы) экспрессионный(е) вектор(ы). Как показано в примерах, отбор на основе фолатного рецептора, осуществляемый на описанных здесь новых эукариотических клетках, позволяет ускорить проведение такого отбора и скрининга, а также получения эукариотических клеточных клонов, сверхэкспрессирующих высокие уровни представляющих интерес рекомбинантных продуктов, таких как полипептиды.
Селективная культуральная среда, используемая в стадии (b), и соответственно, в субстадии стадии (b), для отбора посредством фолатного рецептора, используемого в качестве селективного маркера, может включать фолат, а в частности, фолиевую кислоту в концентрации, выбранной из:
(a) приблизительно 5000 нМ - 0,1 нМ;
(b) приблизительно 2500 нМ - 0,1 нМ;
(c) приблизительно 1500 нМ - 0,1 нМ;
(d) приблизительно 1000 нМ- 0,1 нМ;
(e) приблизительно 750 нМ - 0,1 нМ;
(f) приблизительно 500 нМ - 0,1 нМ;
(g) приблизительно 250 нМ - 0,2 нМ; предпочтительно, приблизительно 250 нМ - 1 нМ или приблизительно 250 нМ - 2,5 нМ;
(h) приблизительно 150 нМ - 0,3 нМ; предпочтительно, приблизительно 150 нМ - 1 нМ или приблизительно 150 нМ - 2,5 нМ;
(i) приблизительно 100 нМ - 0,5 нМ; предпочтительно, приблизительно 100 нМ - 1 нМ или приблизительно 100 нМ - 2,5 нМ;
(j) приблизительно 75 нМ - 0,6 нМ, предпочтительно, приблизительно 75 нМ - 1 нМ или приблизительно 75 нМ - 2,5нМ;
(k) приблизительно 50 нМ - 1 нМ; предпочтительно, приблизительно 50 нМ - 2,5 нМ или приблизительно 50нМ - 5нМ;
(l) приблизительно 35 нМ - 0,75 нМ; и
(m) приблизительно 25 нМ - 1 нМ или приблизительно 25 нМ - 2,5 нМ, приблизительно 20 нМ - 3 нМ, приблизительно 15 нМ - 4 нМ или 10 нМ - 5 нМ.
Концентрации и интервалы концентраций, описанные выше, являются особенно подходящими для быстрого роста суспензионной культуры клеток млекопитающих, таких как клетки CHO, которые представляют собой предпочтительный вариант для промышленного продуцирования клеточных линий. Однако, различные клеточные линии могут обладать различными свойствами поглощения фолиевой кислоты. Тем не менее подходящие концентрации могут быть легко определены экспериментально самим специалистом. Фолатом, содержащимся в селективной культуральной среде, предпочтительно, является фолиевая кислота, и в соответствии с одним из вариантов осуществления изобретения, фолиевой кислотой является только тот фолат, который содержится в селективной культуральной среде в лимитирующей концентрации.
В соответствии с одним из вариантов осуществления изобретения, клетки-хозяева, полученные в стадии (a), содержат гетерологичный полинуклеотид, кодирующий переносчик фолата в качестве первого селективного маркера, и гетерологичный полинуклеотид, кодирующий второй селективный маркер, который процессирует субстрат с образованием фолата, производного фолата и/или продукта, который может быть получен путем процессинга фолата. Так, например, вторым селективным маркером может быть дигидрофолатредуктаза (DHFR) или фермент, действующий после DHFR или в комбинации с DHFR, такой как тимидилатсинтаза (TS) и серингидроксиметилтрансфераза (SHMT). Предпочтительно, мембраносвязанный фолатный рецептор используется в качестве первого селективного маркера, а вторым селективным маркером является дигидрофолатредуктаза (DHFR). В соответствии с этим вариантом осуществления изобретения, стадия (b) включает культивирование клеток-хозяев в селективной культуральной среде, содержащей фолат, а предпочтительно, фолиевую кислоту в лимитирующей концентрации, и по меньшей мере один ингибитор DHFR, такой как, например, MTX. Как показано в примерах, в результате использования описанных здесь новых эукариотических клеточных линий в качестве клеток-хозяев для рекомбинантной экспрессии в комбинации с такой системой отбора на основе фолатного рецептора/DHFR, была достигнута высокая степень гомогенной экспрессии уже на уровне клеточного пула. Как описано в разделе «Примеры», даже при низких концентрациях ингибитора DHFR, экспрессия на уровне пулов повышалась в 7-8 раз. Такое значительное увеличение титров пула является предпочтительным, например, если необходимо быстрое продуцирование меньших количеств представляющего интерес полипептида, поскольку в данном случае можно использовать отобранные клеточные пулы, что позволить сэкономить время на получение клональной клеточной линии. Кроме того, по мере значительного увеличения числа высокопродуктивных клеток в пуле, процесс получения высокопродуктивных клеточных клонов из указанного клеточного пула упрощается. В этом случае понадобится меньше клеточных кллнов, что позволит сократить затраты на скрининг. Подходящие варианта фолатного рецептора и DHFR, а также подходящие условия отбора и концентрации описаны выше в разделе, относящемся к этим вариантам. Указанные концентрации и варианты концентраций фолата и антифолата, описанных выше, могут быть представлены в комбинации. В одном из вариантов осуществления изобретения, концентрация фолата, ссотавляющая приблизительно 0,1 нМ - 150 нМ, 1 нМ - 125 нМ, 5 нМ - 100 нМ или 7,5 нМ - 75 нМ, указана вместе с концентрацией антифолата, составляющей 0,1 нМ - 150 нМ, 1 нМ - 12 5нМ, 2,5 нМ - 100 нМ, 5 нМ - 75 нМ или 7,5 нМ - 5,0 нМ в селективной культуральной среде. Как описано выше, фолиевая кислота, предпочтительно, используется в качестве фолата, а MTX используется в качестве антифолата.
Использование соответствующей комбинации фолатного рецептора и DHFR в качестве селективного маркера в стадии (b), то есть, условий отбора с использованием обоих маркеров одновременно в соответствующей селективной культуральной среде, позволяет создать очень жесткую систему отбора, обеспечивающую эффективное обогащение популяции трансфецированных клеток-хозяев высокопродуктивными клетками. Жизнеспособность клеток-хозяев значительно повышается в селективных условиях в том случае, если оба селективных маркера экспрессировались на выскоком уровне. Таким образом, эукариотические клетки, функция которых зависит от поглощения фолата, такие как клетки млекопитающих, могут быть отобраны по увеличению уровня экспрессии представляющего интерес продукта. Такая концепция применения фолатного рецептора в качестве селективного маркера в комбинации с дополнительным селективным маркером, участвующим в метаболизме фолата, таким как, предпочтительно, DHFR, описана в заявке WO 2010/097240, которая вводится в настоящее описание посредством ссылки. Как показано в примерах, высокая жесткость системы отбора согласно этому варианту осуществления изобретения, может быть, предпочтительно, применена вместе с использованием описанных здесь новых эукариотических клеток, в которых функция продукта экспрессии гена C12orf35 ингибируется, предпочтительно, посредством снижения или блокирования экспрессии указанного гена. С применением такой комбинации можно снизить число слабых продуцентов и получить более гомогенную популяцию высокопродуктивных клеток после отбора. Этот способ inter alia упрощает клонирование высокопродуктивных клеток из одной клетки. Кроме того, с использованием такой комбинации можно значительно снизить концентрацию MTX, необходимую для DHFR-отбора.
В соответствии с одним из вариантов осуществления изобретения, стадию (b) осуществляют в два или более раундов отбора, где эти два или более раундов отбора основаны на одном и том же приниципе или на различных принципах отбора. Так, например, если помимо фолатного рецептора и/или DHFR используют дополнительный селективный маркер, то сначала может быть проведен отбор в условиях, подходящих для этого дополнительного селективного маркера (например, на этапе предварительного отбора), либо такой отбор может быть проведен одновременно с отбором в условиях, подходящих для фолатного рецептора и/или DHFR. Так, например, в случае использования гена неомицин-фосфотрансферазы (neo) в качестве дополнительного селективного маркера, в стадии (b) может быть сначала проведено культивирование клеток в среде, содержащей, например, G418, для отбора клеток, в которые был введен экспрессионный вектор или комбинация по меньшей мере двух экспрессионных векторов, а затем может быть осуществлена стадия отбора на селективной культуральной среде, содержащей лимитирующую концентрацию фолата и ингибитора второго селективного маркера, такого как, например, MTX, в случае, если в качестве второго селективного маркера используется DHFR.
В соответствии с одним из вариантов осуществления изобретения, в стадии (b) осуществляют отбор на основе проточной цитометрии. Стадия отбора на основе проточной цитометрии, а в частности, на основе клеточного сортинга с активацией флуоресценции (FACS), имеет преимущество, заключающееся в том, что большое число клеток может быть подвергнуто быстрому скринингу на нужный выход экспрессии.
В соответствии с одним из вариантов осуществления изобретения, указанный отбор на основе проточной цитометрии осуществляют одновременно с проведением, а предпочтительно, после проведения одной или более стадий отбора с использованием одного или более селективных маркерных генов. Таким образом, клеточные клоны с высоким уровнем экспрессии могут быть идентифицированы в популяции успешно трансфецированных клеток и отделены от этих клеток.
В соответствии с одним из вариантов осуществления изобретения, клетки с высоким уровнем экспрессии идентифицируют путем детектирования экспрессии коэкспрессированного репортерного полипептида, такого как, например, белок, флуоресцирующий в зеленом диапазоне спектра (GFP), CFP, YFP, люцифераза или другой широко распространенный репортерный полипептид, который может быть детектирован с помощью проточной цитометрии. В соответствии с этим вариантом осуществления изобретения, стадия (a) включает получение множества клеток-хозяев, содержащих по меньшей мере один гетерологичный полинуклеотид, кодирующий репортер, а стадия (b) включает идентификацию клеток-хозяев, экспрессирующих репортер, исходя по меньшей мере из одного свойства указанного репортерного полипептида, с помощью проточной цитометрии. При таком отборе с использованием репортера, экспрессия гена-репортера будет коррелировать с экспрессией представляющего интерес продукта. Репортерный полипептид может присутствовать внутри клетки, что является показателем экспрессии этого полипептида в указанной клетке. В соответствии с одним из вариантов осуществления изобретения, экспрессия репортерного полипептида тесно ассоциирована с экспрессией представляющего интерес продукта, которым является полипептид. Так, например, репортерный полипептид и представляющий интерес полипептид могут экспрессироваться как отдельные полипептиды, происходящие от одного экспрессионного кластера, однако, эти полипептиды разделены элементом IRES (внутренним сайтом связывания с рибосомой). Кроме того, репортерный полипептид и представляющий интерес полипептид могут экспрессироваться как гибридный белок. В соответствии с одним из вариантов осуществления изобретения, в кластере, экспрессирующем представляющий интерес полипептид, полинуклеотид, кодирующий представляющий интерес полипептид, разделен по меньшей мере одним стоп-кодоном, происходящим от полинуклеотида, кодирующего репортер. Гибридный белок, содержащий репортерный полипептид, экспрессируется только в том случае, если трансляция прочитывается по всему стоп-кодону. Поскольку считывание стоп-кодона происходит лишь до определенной степени, что может быть обусловлено числом и конструкцией стоп-кодона и условиями культивирования, то некоторая часть представляющего интерес полипептида продуцируется как гибридный белок, содержащий репортерный полипептид, который может быть детектирован с помощью проточной цитометрии. Применение соответствующей стратегии позволяет установить взаимосвязь между экспрессией репортерного полипептида и экспрессией представляющего интерес полипептида. Принцип получения гибридных белков посредством считывания стоп-кодона будет также объяснен ниже в варианте, в котором гибридный белок (необязательно содержащий репортер) представлен на клеточной поверхности и, например, окрашен детектирующим соединением. Для экспрессии представляющего интерес секретируемого полипептида, полипептид, кодирующий мембранный якорь, может быть также встроен между стоп-кодоном и полинуклеотидом, кодирующим репортер, или ниже полинуклеотида, кодирующего репортер. Наличие мембранного якоря будет гарантировать сохранение ассоциации репортерного полипептида с экспрессирующей клеткой. Таким образом, репортерный полипептид, содержащийся в гибридном белке, сообщает экспрессирующим клеткам селективный признак, который может быть определен с помощью проточной цитометрии. Представляющий интерес полипептид экспрессируется в культуральной среде. Например, чем выше флуоресценция репортерного полипептида, тем больше количество продуцируемого гибридного белка и, соответственно, выше уровень экспрессии представляющего интерес полипептида. Соответствующий метод описан, например, в заявке WO 03/014361, которая вводится посредством ссылки.
В соответствии с одним из вариантов осуществления изобретения, стадия (b) включает:
(i) проведение по меньшей мере одного раунда отбора в условиях отбора для одного или более селективных маркеров, экспрессируемых трансфецированными клетками-хозяевами; и
(ii) проведение отбора на основе проточной цитометрии.
Одна или более дополнительных стадий отбора могут быть осуществлены, но необязательно, до или после проведения стадии (i) и/или стадии (ii).
В соответствии с одним из вариантов осуществления изобретения, отбор на основе проточной цитометрии включает отбор множества клеток-хозяев, экспрессирующих представляющий интерес полипептид с желаемым выходом, исходя из присутствия или количества представляющего интерес полипептида. Предпочтительно, представляющим интерес полипептидом является секретируемый полипептид. В соответствии с одним из вариантов осуществления изобретения, представляющий интерес полипептид детектируют на клеточной поверхности с использованием детектирующего соединения, которое связывается с представляющим интерес полипептидом. В соответствии с одним из вариантов осуществления изобретения, представляющий интерес секретируемый полипептид детектируют по его прохождению через клеточную мембрану и, соответственно, по транзиентной ассоциации с плазматической мембраной в процессе секреции полипептида. Соответствующая система отбора на основе проточной цитометрии описана, например, в заявке WO03/099996, которая вводится посредством ссылки.
В соответствии с одним из вариантов осуществления изобретения, часть представляющего интерес экспрессируемого полипептида присоединена к мембранному якорю и, таким образом, экспрессируется как мембраносвязанный гибридный полипептид. Таким образом, часть полипептида представлена на клеточной поверхности как гибридный полипептид и может быть окрашена детектирующим соединением. Для проведения отбора такого типа не требуется репортерного полипептида, хотя он все же может быть использован. Представляющий интерес полипептид жестко заякорен на экспрессирующей клетке благодаря присутствию мембранного якоря. Поскольку количество продуцируемого гибридного полипептида коррелирует с общим уровнем экспрессии в клетке, то клетки-хозяева могут быть отобраны с помощью проточной цитометрии исходя из количества гибридного полипептида, представленного на клеточной поверхности посредством мембранного якоря. Это ускоряет отбор высокопродуктивных клеток-хозяев. Для эффективного отбора с помощью проточной цитометрии, а предпочтительно, FACS, в целях экспрессии представляющего интерес полипептида преимущественно используются специально сконструированные экспрессионные кластеры. Таким образом, в соответствии с одним из вариантов осуществления изобретения, полинуклеотид, кодирующий представляющий интерес полипептид, содержится в экспрессионном кластере, который был сконструирован так, чтобы часть экспрессируемого представляющего интерес полипептида включала мембранный якорь. Представляющий интерес полипептид, присоединенный к мембранному якорю, также называется гибридным полипептидом или гибридным белком. Для достижения нужного результата существует несколько вариантов.
В соответствии с одним из вариантов осуществления изобретения, клетки-хозяева, полученные в стадии (a), содержат:
(i) гетерологичный экспрессионный кластер, включающий:
aa) полинуклеотид, кодирующий представляющий интерес полипептид;
bb) по меньшей мере один стоп-кодон, расположенный ниже полинуклеотида, кодирующего представляющий интерес полипептид, и
cc) дополнительный полинуклеотид, расположенный ниже стоп-кодона, кодирующего мембранный якорь и/или сигнал для мембранного якоря; и
(ii) по меньшей мере один гетерологичный экспрессионный кластер, включающий полинуклеотид, кодирующий селективный маркер;
а отбор, проводимый в стадии (b), включает:
(i) культивирование указанных клеток-хозяев в условиях отбора по меньшей мере для одного селективного маркера и экспрессию представляющего интерес полипептида, где по меньшей мере часть представляющего интерес полипептида экспрессируется как гибридный полипептид, содержащий мембранный якорь, и где указанный гибридный полипептид представлен на поверхности указанной клетки-хозяина;
(ii) проведение отбора на основе проточной цитометрии, включающего отбор множества клеток-хозяев, экспрессирующих представляющий интерес полипептид с нужным выходом, исходя из присутствия или количества гибридного полипептида, представленного на клеточной поверхности, с помощью проточной цитометрии.
Транскрипция полинуклеотида, кодирующего представляющий интерес полипептид, содержащийся в вышеописанном экспрессионном кластере, приводит к образованию транскрипта, содержащего, в следующем порядке, по меньшей мере:
aa) полинуклеотид, где трансляция указанного полинуклеотида приводит к образованию представляющего интерес полипептида;
bb) по меньшей мере один стоп-кодон, расположенный ниже указанного полинуклеотида;
cc) полинуклеотид, расположенный ниже указанного стоп-кодона, кодирующего мембранный якорь и/или сигнал для мембранного якоря.
По меньшей мере часть транскрипта транслируется в гибридный полипептид, содержащий представляющий интерес полипептид и мембранный якорь, посредством трансляционного считывания по меньшей мере одного стоп-кодона. Действие такой конструкции экспрессионного кластера, используемого в этом варианте осуществления изобретения, заключается в том, что благодаря трансляционному считыванию («ликового» стоп-кодона), определенная часть представляющего интерес полипептида продуцируется как гибридный полипептид, содержащий мембранный якорь. Таким образом, по меньшей мере часть транскрипта транслируется в гибридный полипептид, содержащий представляющий интерес полипептид и мембранный якорь, посредством трансляционного считывания по меньшей мере одного стоп-кодона. Трансляционное считывание может происходить естественым путем благодаря выбору стоп-кодона/модели сигнала терминации трансляции или может быть индуцировано путем адаптации условий культивирования, например, с использованием агента-супрессора терминации. Считывание на таком уровне приводит к получению гибридных полипептидов в определенном соотношении. Эти гибридные полипептиды включают мембранный якорь, который жестко заякоривает гибридные полипептиды на клеточной поверхности. В результате, гибридный полипептид может быть представлен на клеточной поверхности, и клетки, содержащие высокие уровни гибридного полипептида, заякоренного на мембране, могут быть отобраны с помощью проточной цитометрии, а предпочтительно, FACS. Таким образом, могут быть отобраны клетки-хозяева, экспрессирующие представляющий интерес полипептид с высоким выходом. Подробное описание и предпочтительные варианты технологии на основе считывания стоп-кодона приводятся в заявках WO2005/073375 и WO 2010/022961, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В соответствии с одним из вариантов осуществления изобретения, экспрессионный кластер дополнительно включает (iv) полинуклеотид, кодирующий репортерный полипептид, такой как, например, GFP. Указанный полинуклеотид, кодирующий репортерный полипептид, расположен ниже стоп-кодона. После считывания стоп-кодона гибридного полипептида, содержащего репортер, проводят отбор с помощью проточной цитометрии исходя из свойств репортерного полипептида, например, по его флуоресценции. Подробное описание указанного варианта уже приводится выше и вводится далее посредством ссылки. Предпочтительно, полинуклеотид, кодирующий репортерный полипептид, расположен ниже полинуклеотида, кодирующего мембранный якорь.
В соответствии с альтернативным вариантом осуществления изобретения, часть представляющего интерес полипептида экспрессируют в виде гибридного полипептида, представленного на клеточной поверхности, с применением технологий, описанных в WO2007/131774. В настоящем описании, по меньшей мере две различных зрелых мРНК (мРНК-представляющего интерес полипептида и мРНК-представляющего интерес полипептида-якоря) получают из экспрессионного кластера, кодирующего представляющий интерес полипептид, посредством транскрипции и процессинга транскрипта. Трансляция мРНК-представляющего интерес полипептида приводит к получению представляющего интерес полипептида. Трансляция мРНК-представляющего интерес полипептида-якоря приводит к получению гибридного полипептида, содержащего представляющий интерес полипептид и мембранный якорь. В результате, такой гибридный полипептид может быть снова представлен на клеточной поверхности, и клетки, содержащие высокие уровни гибридного полипептида, заякоренного на мембране, могут быть отобраны с помощью проточной цитометрии, а предпочтительно, FACS. Затем снова могут быть отобраны клетки-хозяева, имеющие высокий уровень экспрессии. В соответствии с одним из вариантов осуществления изобретения, экспрессионный кластер дополнительно включает полинуклеотид, кодирующий репортерный полипептид, такой как, например, GFP. Указанный полинуклеотид, кодирующий репортерный полипептид, расположен ниже интрона. Таким образом, может быть получен гибридный полипептид, содержащий репортерный полипептид, что позволяет проводить отбор с помощью проточной цитометрии исходя из свойств репортерного полипептида, например, по его флуоресценции. Предпочтительно, полинуклеотид, кодирующий репортерный полипептид, расположен ниже полинуклеотида, кодирующего мембранный якорь. Таким образом, репортер расположен внутри клетки-хозяина.
Описанные выше репрезентативные варианты показали, что часть представляющего интерес полипептида экспрессируется как гибридный полипептид, который представлен на поверхности клеток-хозяев, и что клетки, имеющие высокие уровни гибридных полипептидов, заякоренных на мембране (что является показателем высокого уровня секретируемого полипептида), могут быть отобраны, например, с помощью проточной цитометрии, а в частности, клеточного сортинга с активацией флуоресценции (FACS). В настоящей заявке описаны различные варианты. Так, например, если репортерный полипептид содержится в гибридном полипептиде, то клетки-хозяева с высоким уровнем экспрессии могут быть отобраны исходя из свойств репортерного полипептида, например, по его флуоресценции. Кроме того, могут быть использованы соответствующим образом меченные детектирующие соединения, краткое описание которых приводится ниже.
В соответствии с одним из вариантов осуществления изобретения, стадия (b) включает отбор множества эукариотических клеток-хозяев, экспрессирующих представляющий интерес полипептид с нужным выходом, исходя из присутствия или количества гибридного полипептида, представленного на клеточной поверхности, с помощью проточной цитометрии, где указанный способ включает контактирование клеток-хозяев с детектирующим соединением, связывающимся с гибридным полипептидом, представленным на клеточной поверхности, и отбор множества клеток-хозяев, экспрессирующих представляющий интерес полипептид с нужным выходом, исходя из присутствия или количества связанного детектирующего соединения с помощью проточной цитометрии. Таким образом, клетки могут контактировать соответствующим образом меченным детектирующим соединением, которое связывается с гибридным белком, например, с частью, соответствующей представляющему интерес полипептиду. Детектирующее соединение, используемое для связывания с гибридным полипептидом, может иметь по меньшей мере одно из нижеследующий свойств: указанное соединение может быть меченным, а в частности, флуоресцентно меченным, может представлять собой антиген, молекулу иммуноглобулина или его связывающий фрагмент, либо указанное соединение может представлять собой белок А, G-белок или белок L. Детектирующим соединением, используемым для связывания с гибридным полипептидом на клеточной поверхности, может быть, например, молекула иммуноглобулина или ее фрагмент, такие как антитело или фрагмент антитела, распознающие гибридный полипептид. При этом могут быть детектированы почти все доступные части гибридного полипептида, в результате чего такая часть, соответствующая представляющему интерес полипептиду, может секретироваться одновременно с гибридным полипептидом в растворимой форме. В целях проведения детектирования и отбора, указанное детектирующее соединение, используемое для связывания с гибридным полипептидом, может быть помечено. Меченое детектирующее соединение, которое связывается с гибридным полипептидом, представленным на клеточной поверхности, становится меткой, окрашивающей, соответственно, клеточную поверхность. Чем больше количество гибридного полипептида, экспрессируемого клеткой-хозяином, тем выше уровень связывания меченного детектирующего соединения и более интенсивным является окрашивание. Этот способ имеет определенное преимущество, заключающееся в том, что отбор клеток-хозяев на основе проточной цитометрии может быть легко осуществлен, поскольку в данном случае может быть определено не только присутствие, но также и количество связанного детектирующего соединения. Для отбора высокопродуктивных клеток-хозяев, эти клетки-хозяева могут быть взяты из популяции клеток-хозяев, которые были наиболее эффективно и, соответственно, интенсивно окрашены детектирующим соединением. Такая метка является подходящей для отбора на основе проточной цитометрии, а в частности, FACS-отбора. Флуоресцентная метка является предпочтительной, поскольку она может быть легко детектирована с помощью проточной цитометрии.
В соответствии с одним из вариантов осуществления изобретения, экспрессионный кластер конструируют так, чтобы было получено приблизительно ≤50%, ≤25%, ≤15%, ≤10%, ≤5%, ≤2,5%, ≤1,5%, ≤1% или менее чем ≤0,5% гибридного полипептида. Остальная часть продуцируется в виде секретируемого полипептида в форме, не содержащей мембранного якоря.
Мембранный якорь может представлять собой мембранный якорь любого вида, при условии, что он будет обладать способностью заякоривать представляющий интерес полипептид на клеточной мембране и визуализировать гибридный полипептид на клеточной поверхности. Подходящие варианты осуществления изобретения включают, но не ограничиваются ими, GPI-якорь или трансмембранный якорь. Трансмембранный якорь является предпочтительным, поскольку он обеспечивает тесное связывание гибридного полипептида с клеточной поверхностью и позволяет избежать «слущивния» гибридного белка с поверхности клеток. Особенно предпочтительно, а в частности, в случае экспрессии антител в виде представляющего интерес полипептида, использовать трансмембранный якорь, связывающийся с иммуноглобулином. Другие мембранные якори и предпочтительные варианты трансмембранного якоря, связывающегося с иммуноглобулином, описаны в заявках WO2007/131774, WO2005/073375 и WO 2010/022961.
В соответствии с одним из вариантов осуществления изобретения, клетки-хозяева экспрессируют молекулу иммуноглобулина, такую как антитело, которое представляет собой представляющий интерес полипептид. Полинуклеотид, кодирующий тяжелую цепь молекулы иммуноглобулина, и полинуклеотид, кодирующий легкую цепь молекулы иммуноглобулина, могут присутствовать в одном экспрессионном кластере или, предпочтительно, в отдельных экспрессионных кластерах, как описано выше в соответствии с первым аспектом изобретения. При использовании описанной выше конструкции экспрессионного кластера, где часть представляющего интерес полипептида продуцируется в виде заякоренного на мембране гибридного полипептида посредством трансляционного считывания или альтернативного сайленсинга, такая конструкция может быть применена для экспрессии тяжелой цепи антитела.
В соответствии с одним из вариантов осуществления изобретения, два или более раундов отбора на основе проточной цитометрии могут быть осуществлены в стадии (b) для отбора клеток-хозяев с высоким уровнем экспрессии и обогащения популяции этими клетками-хозяевами.
В одном из вариантов осуществления изобретения, клетки-хозяева, экспрессирующие представляющий интерес полипептид в большом количестве, на что указывает высокий уровень сигнала, подвергают сортингу на клеточном сортере с активацией флуоресценции (FACS). FACS-сортинг является предпочтительным, поскольку он позволяет осуществлять быстрый скрининг большого числа клеток-хозяев и идентификацию клеток, экспрессирующих представляющий интерес полипептид с высоким выходом, а также обогащение популяции этими клетками. Этот вариант является особенно подходящим в том случае, если клетки отбирают на основе экспрессии гибридного белка, описанного выше. Эти клетки, обнаруживающие самую высокую интенсивность флуоресценции, могут быть идентифицированы и выделены с помощью FACS. Была обнаружена позитивная и статистически значимая корреляция между флуоресценцией, определенной с помощью FACS, и количеством продуцируемого полипептида. Следовательно, FACS-сортинг может быть применен не только для качественного анализа клеток, экспрессирующих представляющий интерес полипептид, но фактически и для количественного анализа этих клеток-хозяев, экспрессирующих представляющий интерес полипептид на высоком уровне. Таким образом, наилучшие клетки-продуценты могут быть отобраны/обогащены в стадии (b).
В соответствии с одним из вариантов осуществления изобретения, клетки, экспрессирующие представляющий интерес полипептид с нужным выходом, например, выше определенного порогового значения и/или максимум 15%, максимум 10%, максимум 5% или максимум 2% клеток-хозяев, отбирают в виде пула. Так, например, несколько клеток с высоким уровнем экспрессии, например, по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 50, по меньшей мере 100, по меньшей мере 200, по меньшей мере 300, по меньшей мере 500, по меньшей мере 1000 или по меньшей мере 5000 клеток с высоким уровнем экспрессии могут быть отобраны в стадии (b) и подвергнуты сортингу с получением клеточного пула. Этот клеточный пул, содержащий множество различных клеток с высоким уровнем экспрессии, также называется клеточным пулом с высоким уровнем экспрессии. Указанный клеточный пул, содержащий различные отдельные клетки с высоким уровнем экспрессии, может быть использован в целях получания отдельных клеточных клонов для крупномасштабного продуцирования представляющего интерес полипептида. Как показано в примерах, клетки-хозяева млекопитающих согласно изобретению, в которых экспрессия гена C12orf35 была снижена или блокирована, используются после отбора с помощью одного или более селективных маркеров и проведения FACS-отбора клеточного пула с предпочтительными свойствами. Так, например, определенные FACS-профили показали, что такие клеточные пулы с высоким уровнем экспрессии имеют FACS-профиль, который очень напоминает FACS-профиль клеток, выделенных из клеточного клона. Снижение или блокирование экспрессии гена C12orf35 осуществляют после трансфекции и отбора описанных клеток-хозяев, которые экспрессируют представляющий интерес полипептид с достаточно равномерным и высоким выходом. Это приводит к значительному снижению числа низкопродуктивных или непродуктивных клонов в выбранной популяции клеток. Кроме того, эти клеточные пулы могут быть непосредственно использованы для продуцирования представляющего интерес полипептида, например, для анализа, или, если необходимо меньшее количество, то значительно более высокие титры пула могут быть получены с использованием новых эукариотических клеток согласно изобретению. Однако было обнаружено, что даже без проведения FACS-отбора для обогащения клеточными пулами с высоким уровнем экспрессии, клеточные популяции, имеющие клоны с такой же продуктивностью, могут быть получены за очень короткий период времении с использованием клеточных линий согласно изобретению. Этот вариант является особенно предпочтительным, например, в случае быстрого продуцирования представляющего интерес полипептида. Полученные пулы являются подходящими для продуцирования. Другим преимуществом также является уменьшение времени отбора.
В соответствии с одним из вариантов осуществления изобретения, эукариотическими клетками, полученными в стадии (a), являются клетки млекопитающих, предпочтительно, клетки грызунов, а более предпочтительно, клетки хомячка, такие как клетки CHO. Подходящие и предпочтительные варианты описаны выше в соответствии с первым аспектом изобретения и вводятся в настоящее описание посредством ссылки. Как описано выше, в соответствии с одним из вариантов осуществления изобретения, в указанных клетках СНО отсутсттвует часть теломерной области хромосомы 8, где указанная отсутствующая часть содержит ген C12orf35. Альтернативные варианты осуществления изобретения также описаны выше. Особенно предпочтительным является вариант, в котором такая отсутсвующая часть дополнительно включает ген FAM60A. Эти клетки обладают особенно ценными свойствами, такими как повышенная продуктивность и стабильность. В соответствии с одним из вариантов осуществления изобретения, указанный способ согласно второму аспекту изобретения включает стадию анализа на снижение или блокирование экспрессии гена C12orf35. Такой анализ может быть осуществлен после отбора, а в частности, после DHFR-отбора. Такой аналитический метод подробно описан выше в первом аспекте изобретения, а также ниже вместе со способом согласно пятому аспекту изобретения и вводится в настоящее описание посредством ссылки.
Другие предпочтительные варианты осуществления изобретения, а в частности варианты, относящиеся к эукариотическим клеткам согласно первому аспекту изобретения, и представляющие собой, предпочтительно, клетки млекопитающих, экспрессионный вектор или комбинацию экспрессионных векторов, подробно описаны выше. Эти варианты вводятся в настоящее описание посредством ссылки.
Клетки, полученные способом отбора согласно второму аспекту изобретения, могут быть выделены и культивированы в виде отдельных клеток. Однако, популяцию, обогащенную различными клетками-хозяевами, то есть клеточный пул, можно также использовать в дальнейшем. Полученные клетки-хозяева могут быть также подвергнуты дополнительному качественному или количественному анализу, либо они могут быть использованы, например, при получении клональной клеточной линии для продуцирования белка. Клональная клеточная линия может быть выделена из выбранной клетки-хозяина, которая стабильно экспрессирует представляющий интерес продукт с высоким выходом.
Таким образом, в соответствии с одним из вариантов осуществления изобретения, отобранные клетки культивируют с получением клеточных клонов, а в частности, в форме клональных клеточных культур. Клональной клеточной культурой является клеточная культура, происходящая от одного единственного предшественника. В клональной клеточной культуре, все клетки являются клонами. Предпочтительно, все клетки в клеточной культуре имеют одинаковую или почти одинаковую генетическую информацию. В некоторых вариантах осуществления изобретения, для оценки продуктивности определяют количество или концентрацию представляющего интерес полипептида в клеточной культуре. Так, например, титр может быть определен путем анализа супернатанта культуры. В соответствии с одним из вариантов осуществления изобретения, полсе оценки продуктивности каждого отдельного клона осуществляют ранжирование титра для отбора самых высокопродуктивных клонов в качестве клонов-продуцентов. Кроме того, исследование на стабильность может быть осуществлено с использованием полученных клеточных клонов. Однако, как показано в примерах, описанные здесь новые эукариотические клетки, взятые в качестве клеток-хозяев, а в частности, клетки СНО, в которой отсутствует часть теломерной области хромосомы 8, содержащей ген C12orf35 и ген FAM60A, используются после отбора рекомбинантных клеточных клонов, обладающих достаточно высокой стабильностью. Таким образом, в соответствующих клетках-хозяевах, потеря стабильности экспрессии наблюдается редко, но если она все же наблюдается, то она приводит лишь к менее резкому снижению продуктивности по сравнению с продуктивностью клеток, в которых была снижена или блокирована функциональная экспрессия гена C12orf35 и FAM60A. Следовательно, в тех вариантах осуществления изобретения, в которых наблюдается ингибирование функции C12orf35 и FAM60A, что обусловлено, например, отсутствием по меньшей мере части теломерной области, включающей ген C12orf35 и ген FAM60A, анализы на стабильность могут быть проведены за более короткий период времени, либо они могут вообще не проводиться, что является важным преимущетвом, поскольку это позволяет сократить время, необходимое для получения стабильно экспрессирующих клеточных клонов, которые могут быть использованы для крупномасштабного продуцирования представляющего интерес продукта.
C. Способ продуцирования представляющего интерес продукта
В соответствии со своим третьим аспектом, настоящее изобретение относится к способу продуцирования представляющего интерес рекомбинантного продукта, где указанный способ включает использование эукариотической клетки согласно первому аспекту изобретения в качестве клетки-хозяина для рекомбинантной экспрессии представляющего интерес продукта.
Как описано выше, полученные здесь новые эукариотические клетки являются особенно подходящими в качестве продуктивных клеток-хозяев для рекомбинантного продуцирования представляющего интерес продукта, такого как представляющий интерес полипептид. Подходящие и предпочтительные примеры указанных эукариотических клеток, в которых ингибируется функциия продукта экспрессии гена C12orf35, предпочтительно, посредством снижения или блокирования функциональной экспрессии гена C12orf35, а также подходящие и предпочтительные примеры представляющего интерес продукта более подробно описаны выше и вводятся в настоящее описание посредством ссылки. Как указывается выше, эукариотической клеткой, предпочтительно, является клетка позвоночного, а более предпочтительно, клетка млекопитающего. Особенно предпочтительным вариантом является вариант, в котором ингибируется функция C12orf35 и FAM60A посредством снижения или блокирования функциональной экспрессии гена FAM60A, поскольку было обнаружено, что в этом случае, стабильность экспрессии может быть значительно более высокой. При этом количество стабильно экспрессирующих клонов возрастает. В результате блокирования функции белка FAM60A, а также белка C12orf35 могут быть получены эукариотические клетки-хозяева, а предпочтительно, клетки-хозяева млекопитающих, обладающие улучшенными свойствами, такими как более длительная стабильность, а также выход продукта, а следовательно, имеющие ключевые признаки, играющие важную роль в крупномасштабном продуцировании представляющего интерес продукта, а в частности, представляющего интерес полипептида.
В соответствии с одним из вариантов осуществления изобретения, указанный способ включает введение в указанную эукариотическую клетку полинуклеотида, кодирующего представляющий интерес продукт, и отбор клетки-хозяина, экспрессирующей представляющий интерес продукт. Введение может быть достигнуто путем трансфекции, описанной выше. Отбор может быть осуществлен способом согласно второму аспекту изобретения. Предпочтительно отбирают такие клетки-хозяева, в которых гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, стабильно интегрирован в геном клетки-хозяина.
В соответствии с одним из вариантов осуществления изобретения, указанный способ включает:
(a) культивирование эукариотических клеток согласно первому аспекту изобретения, содержащих гетерологичный полинуклеотид, кодирующий представляющий интерес продукт, и/или клеток-хозяев, выбранных способом согласно второму аспекту изобретения в условиях, подходящих для экспрессии представляющего интерес продукта;
(b) выделение представляющего интерес продукта из указанной клеточной культуральной среды и/или из указанных клеток-хозяев; и
(c) необязательную обработку представляющего интерес выделенного продукта.
В соответствии с одним из вариантов осуществления изобретения, указанные клетки-хозяева культивируют в бессывороточной среде. Представляющий интерес экспрессируемый продукт может быть получен путем дизрупции клеток-хозяев. Предпочтительно, представляющим интерес продуктом является полипептид. Указанный полипептид, предпочтительно, экспрессиуется, например, секретируется в культуральную среду и может быть выделен из этой среды. Для этих целей, в представляющий интерес полипептид вводят соответствующий лидерный пептид. Лидерные последовательности и конструкции экспрессионных кластеров, используемые для достижения секреции, хорошо известны специалистам. Также может быть использована комбинация соответствующих способов. Таким образом, полипептиды, такие как белки, могут быть эффективно продуцированы/выделены с высоким выходом.
Представляющий интерес продукт, которым, предпочтительно, является представляющий интерес полипептид, может быть выделен, а затем очищен, обработан и/или модифицирован известными методами. Так, например, полипептид может быть выделен из питательной среды стандартными методами, включая, но не ограничиваясь ими, центрифугирование, фильтрацию, ультрафильтрацию, экстракцию или преципитацию. Другие стадии обработки, такие как стадии очистки, могут быть осуществлены различными известными методами, включая, но не ограничиваясь ими, хроматографию (например, ионообменную хроматографию, аффинную хроматографию, гидрофобную хроматографию, хроматофокусирование и эксклюзионную хроматографию), электрофорез (например, препаративное изоэлектрическое фокусирование), дифференциальную солюбилизацию (например, преципитацию сульфатом аммония) или экстракцию. Кроме того, выделенный и очищенный представляющий интерес полипептид может быть также обработан, например, приготовлен в виде композиции, такой как фармацевтическая композиция.
D. Способ продуцирования эукариотической клеточной линии
В соответствии со своим четвертым аспектом, настоящее изобретение относится к способу продуцирования эукариотической клетки, подходящей для рекомбинантного продуцирования представляющего интерес продукта, где указанный способ включает ингибирование функции продукта экспрессии гена C12orf35 в указанной клетке. Подходящие и предпочтительные варианты для достижения этой цели описаны выше для эукариотических клеток согласно первому аспекту изобретения и вводятся в настоящее описание посредством ссылки. Неограничивающие варианты осуществления изобретения кратко описаны ниже.
В соответствии с одним из вариантов осуществления изобретения, указанный способ включает снмжение или блокирование функциональной экспрессии гена C12orf35 и, тем самым, ингибирование функции продукта экспрессии гена C12orf35 в указанной клетке. Подходящие способы описаны выше для эукариотических клеток согласно первому аспекту изобретения и вводятся в настоящее описание посредством ссылки. В соответствии с одним из вариантов осуществления изобретения, геном эукариотической клетки модифицируют для снижения или блокирования функциональной экспрессии гена C12orf35. Так, например, нокаутированный ген может быть введен в ген C12orf35. В соответствии с одним из вариантов осуществления изобретения, такой нокаутированный ген вводят во все копии гена C12orf35. В соответствии с одним из вариантов осуществления изобретения, ген C12orf35 является делетипованным. Все копии гена C12orf35 в геноме могут быть делетированы. В соответствии с одним из вариантов осуществления изобретения, указанный способ включает делецию части хромосомы, где такая делетированная часть содержит ген C12orf35. Делетированная часть может соответствовать теломерной области. Така делеция может быть индуцирована, например, с использованием агента, индуцирующего хромосомные разрывы. В описании настояще заявки, клетки могут быть повторно обработаны таким агентом с получением клеток, в которых функциональная экспрессия гена C12orf35 была снижена или блокирована, например, в результате делеции всех копий указанного гена благодаря индуцированным хромосомным разрывам.
В соответствии с одним из вариантов осуществления изобретени, эукариотической клеткой является клетка многоклеточных, предпочтительно, клетка позвоночных, а еще более предпочтительно, клетка млекопитающего. В соответствии с одним из вариантов осуществления изобретения, клеткой млекопитающего является клетка грызуна. Предпочтительно, клеткой грызуна является клетка хомячка, такая как клетка СНО, происходящая от CHO-K1. В соответствии с одним из вариантов осуществления изобретения, указанный способ включает делецию по меньшей мере части теломерной области хромосомы 8 в клетке хомячка, где указанная делетированная часть содержит ген C12orf35. Как показано в примерах, клетки СНО, имеющие соответствующую делецию в теломерной области хромосомы 8, а в данном случае в плече q, обладают ценными экспрессионными свойствами, а поэтому они являются особенно подходящими в качестве клеток-хозяев для рекомбинантного продуцирования. В соответствии с одним из вариантов осуществления изобретения, делетированная теломерная область содержит ген C12orf35, где один или более генов или все гены выбраны из группы, состоящей из гена Bicd1, Amn1, метилтрансферазо-подобного белка 20, Dennd5b, FAM60A, Caprin2, Ipo8 и RPS4Y2. В соответствии с одним из вариантов осуществления изобретения, делетированная область лополнительно включает по меньшей мере часть гена Tmtc1 или весь этот ген. В соответствии с одним из вариантов осуществления изобретения, указанный способ включает делецию по меньшей мере соответствующей части теломерной области в обеих хромосомах хромосомной пары 8. Неограничивающие альтернативные названия вышеупомянутых отдельных генов и кодируемых ими белков, а также гомологов и ортологов отдельных генов и/или кодируемыъ ими белков, входящих в объем настоящего изобретения, представлены выше в таблице 1.
Как описано выше, теломерная область мышиной хромосомы 6 соответствует теломерной области хромосомы 8 китайского хомячка. Таким образом, вышеприведенное описание теломерной области хромосомы 8 хомячка соответствует описанию теломерной области мышиной хромосомы 6.
В соответствии с одним из вариантов осуществления изобретения, указанный способ включает индуцирование хромосомного разрыва в теломерной области хромосомы 8 генома хомячка (или хромосомы 6 мышиного генома), где разрыв на хромосоме 8 (или на хромосоме 6 мышиного генома) расположен со стороны центромеры по отношению к гену метилтрансферазо-подобного белка 20 (называемого мышиным 4833442J19Rik), со стороны центромеры по отношению к гену Dennd5b, со стороны центромеры по отношению к гену FAM60A, со стороны центромеры по отношению к гену Caprin2, со стороны центромеры по отношению к гену Ipo8 или со стороны центромеры по отношению к гену RPS4Y2. Таким образом, все гены, которые присутствуют в теломере, то есть, гены, расположенные ближе к теломерному концу, были делетированы. Неограничивающие альтернативные названия вышеупомянутых отдельных генов и соответствующих генов и кодируемых ими белков, входящих в объем настоящего изобретения, представлены выше в таблице 1. В соответствии с одним из вариантов осуществления изобретения, полученные клетки, содержащие хромосомный разрыв в теломерной области, имеют одно или более из нижеследующих свойств:
(а) точка разрыва расположена со стороны центромеры по отношению к гену Ipo8;
(b) точка разрыва расположена в гене Tmtc1.
Как обсуждалось выше, все гены, расположенные со стороны центромеры по отношению к точке разрыва, то есть, расположенные в направлении теломерного конца, содержатся в делетированной области. Эта область включает ген C12orf35. Методы идентификации соответствующих эукариотических клеток, имеющих такую точку разрыва, описаны выше, а также в разделе, относящемся к пятому аспекту изобретения. В соответствии с одним из вариантов осуществления изобретения, ген Ergic2 не является делетированным.
В соответствии с одним из вариантов осуществления изобретения, клетка CHO, предпочтительно, происходящая от клеточной линии K1, используется для продуцирования эукариотической клеточной линии, в которой ингибируется функция продукта экспрессии гена C12orf35, предпочтительно, благодаря снижению или блокированию функциональной экспрессии гена C12orf35. В соответствии с одним из вариантов осуществления изобретения, теломерная область на плече q хромосомы 8, содержащей ген C12orf35, является делетированной. В литературе существует подробное описание способа получения данного результата, и подходящие варианты такого способа также описаны в настоящей заявке, и это описание вводится в настоящее описание посредством ссылки. Особенно предпочтительным вариантом является вариант, в котором, в указанной клетке, кроме того, ингибируется функция FAM60A, например, благодаря снижению или блокированию функциональной экспрессии гена FAM60A, поскольку было обнаружено, что стабильность экспрессии может быть значительно повышена. Подробное объяснение приводится выше, и далее это описание вводится посредством ссылки. Клетки-хозяева млекопитающих, которые были модифицированы для ингибирования функции C12orf35 и FAM60A в указанных клетках, имеют особенно предпочтительные экспрессионные свойства. Таким образом, были получены клетки-хозяева млекопитающих, обладающие улучшеннными свойствами, такими как длительная стабильность, а также высокий выход продукта, и следовательно, имеющие ключевые признаки, играющие важную роль в крупномасштабном продуцировании представляющего интерес продукта, а в частности, представляющего интерес полипептида.
В соответствии с одним из вариантов осуществления изобретения, способ согласно четвертому аспекту изобретения включает ввдение в эукариотическую клетку, в которой ингибируется или блокируется экспрессия гена C12orf35, по меньшей мере одного полинуклеотида, кодирующего представляющий интерес продукт, а предпочтительно, по меньшей мере одного полинуклеотида, кодирующего селективный маркер. В соответствии с одним из вариантов осуществления изобретения, полинуклеотид, кодирующий представляющий интерес продукт, и полинуклеотид, кодирующий селективный маркер, расположены на одних и тех же или на различных экспрессионных векторах. Экспрессионные векторы могут быть введены путем трансфекции, а предпочтительно, стабильной трансфекции. Подходящие и предпочтительные варианты также описаны выше, и это описание вводится в настоящее описание посредством ссылки. Клетки-хозяева, которые были успешно трансфецированы и экспрессировали представляющий интерес продукт, могут быть отобраны способом согласно второму аспекту изобретения. Эти клетки вводятся в настоящее описание посредством ссылки.
E. Способ анализа эукариотических клеток
В соответствии со своим пятым аспектом, настоящее изобретение относится к способу анализа эукариотических клеток на возможность их использования в качестве клеток-хозяев для рекомбинантной экспрессии представляющего интерес продукта, где указанный способ включает прямой или опосредованный анализ ингибирования функции продукта экспрессии гена C12orf35 в указанных клетках. Как описано выше, эукариотической клеткой, предпочтительно, является клетка млекопитающего.
Этот способ анализа может быть преимущественно применен, например, в комбинации со способом согласно четвертому аспекту изобретения для идентификации продуцирования эукариотической клетки, в которой ингибируется функция продукта экспрессии гена C12orf35. Кроме того, указанный способ может быть применен, например, для дифференциации высоко- и низкопродуктивных клонов. Кроме того, в некоторых вариантах осуществления изобретения, указанный способ может быть также применен, например, для дифференциации стабильных или нестабильных клонов в процессе отбора/скрининга. С применением этого аналитического метода, на ранней стадии процесса отбора могут быть идентифицированы клоны, обладающие ценными экспрессионными свойствами. Это повышает вероятность отбора большего количества стабильных и высокопродуктивных клонов. Поэтому такой способ анализа имеет важное значение в проведении последующих разработок и усовершенствования технологии рекомбинантной экспрессии.
В соответствии с предпочтительным вариантом осуществления изобретения, указанный способ включает анализ на снижение или блокирование функциональной экспрессии гена C12orf35 в указанных клетках. Анализ на снижение или блокирование функциональной экспрессии гена C12orf35 может быть осуществлен прямо или опосредованно. Неограничивающие варианты этого способа описаны ниже. Возможность применения такого способа анализа также зависит от способа модификации клеток для снижения или блокирования функциональной экспрессии эндогенного гена C12orf35.
Так, например, при осуществлении нокаута гена C12orf35 для снижения или блокирования экспрессии гена C12orf35 можно амплифицировать соответствующую часть ДНК и секвенировать амплифицированную ДНК для подтверждения того, что был осуществлен нокаут гена C12orf35. Если функциональная экспрессия гена C12orf35 была снижена или блокирована путем полной или частичной делеции указанного гена, то можно детектировать делецию на уровне ДНК, например, с применением подходящих методов детектирования на основе амплификации в целях идентификации указанной делеции (такие методы известны специалистам).
В соответствии с одним из вариантов осуществления изобретения, профиль экспрессии эукариотических клеток анализируют для идентификации снижения или блокирования функциональной экспрессии гена C12orf35. Так, например, указанный анализ может включать проведение качественной или количественной ПЦР с ОТ (обратной транскриптазой) для детектирования присутствия или отсутствия мРНК C12orf35, а также для определения количества или длины мРНК C12orf35. Это может быть осуществлено, например, с помощью прямого анализа, поскольку данный анализ позволяет непосредственно детектировать транскрипт гена C12orf35. Непрямые анализы, в которых статус экспрессии гена C12orf35 может быть определен непрямым методом путем анализа профиля экспрессии генов, отличающихся от гена C12orf35, и где, соответственно, указанный анализ не позволяет непосредственно анализировать ген C12orf35 или его транскрипт, такэже являются подходящими для достижения данной цели и таким образом, входят в объем определения термина «анализ на снижение или блокирование функциональной экспрессии гена C12orf35». Такой непрямой анализ может быть применен, например, в том случае, если хромосомная часть, содержащая ген C12orf35 (и другие гены), была делетирована в результате хромосомного разрыва, как описано ниже. Для проведения количественного анализа может быть осуществлено сравнение со стандартом (например, с немодифицированной соответствующей клеткой).
В соответствии с одним из вариантов осуществления изобретения проводят дополнительный прямой или непрямой анализ на ингибирование функции белка FAM60A в указанных клетках. Такой анализ может быть проведен путем определения снижения или блокирования функциональной экспрессии эндогенного FAM60A в указанных клетках. Этот анализ может быть осуществлен с соответствующими необходимыми изменениями (mutatis mutandis) как описано для гена C12orf35. Данный анализ обсуждается выше.
В соответствии с одним из вариантов осуществления изобретения, перед проведением анализа, клетки обрабатывают агентом, который индуцирует хромосомные разрывы, для делеции части хромосомы, содержащей ген C12orf35. Как описано выше, все копии гена C12orf35 могут быть делетированы. Затем может быть проведен анализ для того, чтобы определить, приводит ли обработка указанным агентом к делеции части хромосомы, включающей ген C12orf35. Клетки обрабатывают агентом, индуцирующим хромосомный разрыв, в соответствующей концентрации, стимулирующей хромосомный разрыв. В данном случае, такая обработка может включать несколько раундов. Хромосомный разрыв может быть индуцирован в процессе отбора, если такой отбор включает использование агента, индуцирующего хромосомные разрывы, в достаточно высокой концентрации. Неограничивающим примером подходящего агента является, например, MTX. В этом случае, клетка может содержать гетерологичный полинуклеотид, кодирующий DHFR в качестве селективного маркера, который является невосприимчивым к MTX-обработке. Однако, как обсуждается выше, могут быть также использованы и другие агенты, такие как, например, гигромицин, как описано в примерах.
После обработки клеток для индуцирования хромосомных разрывов, полученные клетки могут быть проанализированы способом согласно этому аспекту изобретения, для того, чтобы определить, может ли обработка указанным агентом приводить к делеции части хромосомы, включающей ген C12orf35. Для этой цели подходящими являются различные варианты. В соответствии с одним из вариантов осуществления изобретения проводят анализ профиля экспрессии обработанных клеток. Так, например, можно пронанализировать экспрессию гена C12orf35 или одного или более генов, расположенных со стороны центромеры по отношению к гену C12orf35 (то есть еще дальше от теломерного конца по направлению к центру хромосомы). Так, например, в случае мышиных клеток или клеток китайского хомячка может быть проанализирована экспрессия гена C12orf35 и, соответственно, в случае детектирования мРНК (например, в прямом анализе) и альтернативно или дополнительно, может быть проведен анализ для того, чтобы определить, могут ли один или более генов, выбранных из группы, состоящей из генов метилтрансферазо-подобного белка 20 (называемых далее мышиным 4833442J19Rik), Dennd5b, FAM60A, Caprin2, Ipo8, Tmtc1 или генов, которые расположены со стороны теломеры по отношению к вышеупомянутым генам, экспрессироваться указанной клеткой (например, это может быть определено с помощью непрямого анализа). Неограничивающие альтернативные названия вышеупомянутых отдельных генов также указаны выше в таблице 1, и соответствующие гены входят в объем значений терминов, определяемых выше для отдельных генов и кодируемых ими продуктов. Если индуцированный разрыв расположен со стороны центромеры по отношению к соответствующему(им) гену(ам), то гены, которые блокируют или снижают экспрессию, были делетированы (если присутствуют другие копии экспрессируемого гена). Как видно на фиг 1, ген C12orf35 расположен со стороны теломеры по отношению к вышеупомянутым генам. Таким образом, если вышеупомянутые гены были делетировны, то такая делетированная область также включает ген C12orf35. Таким образом, вышеупомянутые гены могут быть эффективно использованы в качестве маркеров в непрямом анализе, для того, чтобы определить, приводит ли индуцированный хромосомый разрыв к делеции гена C12orf35 и тем самым к снижению или блокированию экспрессии гена C12orf35. Таким образом, анализ на снижение или блокирование экспрессии гена C12orf35 необязательно должен быть проведен прямым методом, например, с использованием мРНК C12orf35, и такие непрямые методы также входят в объем способа согласно пятому аспекту изобретения. Кроме того, было обнаружено, что даже в случае расположения гена со стороны телоомеры по отношению к гену C12orf35 (то есть в направлении теломерного конца), ген Bicd1 также может быть использован в качестве маркера для того, чтобы определить, может ли индуцированый хромосомный разрыв приводить к делеции гена C12orf35. При проведении анализа клеток китайского хомячка, таких как клетки СНО, было обнаружено, что если ген Bicd1 был делетирован в результате хромосомного разрыва, то делетированная теломерная область также обычно включает C12orf35. С помощью анализа экспрессионных свойств нескольких сотен клонов было обнаружено, что вышеупомянутые гены могут быть эффективно использованы в качестве маркеров для дифференциации клеточных клонов с высокой и стабильной экспрессией и клеточных клонов с низкой и нестабильной экспрессией. Относительный уровень экспрессии вышеупомянутых генов в клетках СНО показан на фиг. 2.
В соответствии с одним из вариантов осуществления изобретения, способ согласно пятому аспекту изобретения применяется для анализа клеток хомячка, а предпочтительно, клеток СНО, где указанный способ включает анализ на снижение уровня экспрессии гена C12orf35 в указанных клетках путем оценки снижения или блокирования экспрессии одного или более генов, расположенных в теломерной области хромосомы 8 и выбранных из группы, состоящей из гена Tmtc1 и генов, расположенных со стороны теломеры по отношению к гену Tmtc1 в указанных клетках. Как описано выше, соответствующие клетки, которые, после обработки агентом, индуцирующим хромосомный разрыв, больше не экспрессируют ген Tmtc1 и/или гены, расположенные со стороны телоомеры по отношению к гену Tmtc1, обычно имеют делецию в теломерной области хромосомы 8, которая содержит указанные гены, а в частности, ген C12orf35. Генетический материал, расположенный со стороны теломеры по отношению к точке разрыва, отсутствует.
В соответствии с одним из вариантов осуществления изобретения, выбранные клетки-хозяева, обладающие описанными выше свойствами, трансфецируют экспрессионным вектором, содержащим по меньшей мере один полинуклеотид, кодирующий представляющий интерес продукт, а предпочтительно, по меньшей мере один селективный маркер. Подходящие варианты описаны выше в комбинации с другими аспектами изобретения, которые также описаны выше.
В соответствии с одним из вариантов осуществления изобретения, перед проведением анализа способом согласно пятому аспекту изобретения, эукариотические клетки трансфецируют по меньшей мере одним гетерологичным полинуклеотидом, кодирующим представляющий интерес продукт, и по меньшей мере одним гетерологичным полинуклеотидом, кодирующим селективный маркер, а затем проводят по меньшей мере одну стадию отбора для идентификации успешно трансфецированных клеток-хозяев. Подходящие варианты подробно описаны выше. В соответствии с одним из вариантов осуществления изобретения, стадия отбора включает использование агента для отбора, который индуцирует хромосомные разрывы. В этом варианте осуществления изобретения, селективным маркером может быть DHFR, а селективным агентом может быть MTX. Альтернативно, селективным агентом может быть гмгромицин, а селективным маркером может быть ген, сообщающий резистентность к гигромицину, такой как, например, ген hph. В тех случаях, когда указанный способ осуществляют во время или после проведения стадии отбора, способ согласно пятому аспекту изобретения может быть применен в качестве аналитического средства для идентификации клеток в выбранной популяции, в которых наблюдается снижение или блокирование экспрессии гена C12orf35. Как описано выше, такое снижение или блокирование может быть индуцировано условиями отбора или может поддерживаться в таких условиях, например, если индуцирование хромосомного разрыва приводит к делеции гена C12orf35, где указанный способ согласно пятому аспекту изобретения позволяет идентифицировать такие клетки, например, по профилю их экспрессии. Это позволяет идентифицировать такие клетки или клеточные клоны, которые, благодаря профилю их экспрессии, а в частности, благодаря снижению или блокированию экспрессии гена C12orf35, являются особеннно подходящими для продуцирования рекомбинантной клеточной линии продуцента, поскольку, как и ожидалось, представляющий интерес продукт с высоким уровнем экспрессии остается стабильным. Как описано выше, в случае клеток хомячка, таких как клетки СНО, в которых ген FAM60A расположен в теломерной области хромосомы 8, предпочтительно, чтобы клетки, в которых отсутствует теломерная область хромосомы 8, а предпочтительно, плеча q, имели пониженный уровень экспрессии гена C12orf35 или вообще не экспрессировали этот ген. Такой аналитический метод может быть проведен после выделения клеточных клонов из клеток, содержащихся в популяции клеток с высоким уровнем экспрессии. В соответствии с одним из вариантов осуществления изобретения, множество клеточных клонов анализировали для дифференциации стабильных и нестабильных клеточных клонов и/или высоко- и низкопродуктивных клеточных клонов.
В соответствии с одним из вариантов осуществления изобретения, способ согласно пятому аспекту изобретения включает отбор по меньшей мере одной клетки, в которой ингибируется функция продукта экспрессии гена C12orf35, предпочтительно, посредством снижения или блокирования функциональной экспрессии гена C12orf35, где указанные клетки используют для рекомбинантной экспрессии представляющего интерес продукта, а предпочтительно, представляющего интерес полипептида. Клетки, обладающие соответствующими свойствами, являются особенно подходящими для рекомбинантной экспрессии как показано в примерах. Другие варианты соответствующих клеток также более подробно описаны выше. Как описано выше, в качестве эукариотических клеток-хозяев предпочтительно использовать клетки позвоночных, а наиболее предпочтительно, клетки млекопитающих.
F. Применение модифицированных эукариотических клеток для рекомбинантного продуцирования представляющего интерес продукта
В соответствии со своим шестым аспектом, настоящее изобретение относится к применению выделенной эукариотической клетки для рекомбинантной экспрессии представляющего интерес продукта, где в указанной клетке наблюдается ингибирование функции продукта экспрессии C12orf35. Подробное описание соответствующих эукариотических клеток-хозяев и вариантов, подходящих для достижения ингибирования функции продукта экспрессии гена C12orf35 в указанных клетках, предпочтительно, посредством снижения или блокирования функциональной экспрессии гена C12orf35, приводится выше в разделах, относящихся к данным вариантам. Неограничивающие варианты осуществления изобретения кратко описаны ниже.
Предпочтительно, в качестве эукариотических клеток-хозяев используется эукариотическая клетка-хозяин согласно первому аспекту изобретения. Указанные клетки подробно описаны выше и вводятся в настоящее описание посредством ссылки. Эукариотическая клетка может быть выбрана из клеток многоклеточных, позвоночных или млекопитающих. Предпочтительной эукариотической клеткой является клетки млекопитающего, такая как клетка грызуна. Предпочтительными являются клетки СНО. Геном эукариотической клетки может быть модифицирован, как подробно описано выше для ингибирования его функции. В соответствии с одним из вариантов осуществления изобретения, функция белка FAM60A была дополнительно ингибирована в указанной клетке, предпочтительно, посредством снижения или блокирования функциональной экспрессии эндогенного гена FAM60A. Подробное описание этого варианта и его преимуществ приводится выше и вводится посредством ссылки.
В соответствии с одним из вариантов осуществления изобретения, представляющим интерес продуктом является полипептид. Предпочтительно, представляющий интерес полипептид, после его экспрессии в эукариотической клетке, секретируется в клеточную культуральную среду. Подробное описание представляющего интерес полипептида приводится выше и вводится посредством ссылки. Для экспрессии представляющего интерес продукта, эукариотическая клетка-хозяин может быть транзиентно или предпочтительно стабильно трансфецирована экспрессионным вектором, содержащим полинуклеотид, кодирующий представляющий интерес полипептид. Подробное описание этого варианта приводится выше и вводится посредством ссылки.
Описанные здесь численные интервалы являются инклюзивными и включают числа, определяющие границы интервала. Представленные здесь заголовки разделов не рассматриваются как ограничение объема различных аспектов или вариантов осуществления изобретения, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. В соответствии с одним из вариантов осуществления изобретения, описанный здесь объект изобретения, содержащий некоторые элементы, также означает объект изобретения, состоящий из соответствующих элементов. В частности, описанные здесь полинуклеотиды, содержащие некоторые последовательности, могут также состоять из соответствующих последовательностей. При этом предпочтительно, чтобы описанные здесь предпочтительные варианты были выбраны из конкретных объектов изобретения, входящих в состав соответствующей комбинации предпочтительных вариантов, и объединены с этими объектами, к которым также относится настоящее изобретение.
В настощящей заявке испрашивается приоритет предварительной заявки на патент США № 61/919313, поданной 20 декабря 2013, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Примеры
Нижеследующие примеры приводятся в целях иллюстрации настоящего изобретения и не должны рассматриваться как ограничение его объема. В частности, в этих примерах описаны предпочтительные варианты осуществления изобретения.
Пример 1: Снижение уровня экспрессии гена C12orf35 посредством интерференции РНК (РНКи) в клетках CHO приводит к увеличению выхода продукта экспрессии
Для того чтобы продемонстрировать, что снижение уровня экспрессии гена C12orf35 приводит к повышению волюметрической или удельной продуктивности, были сконструированы киРНК, направленные против различных генов-мишеней, расположенных в теломерной области хромосомы 8 анализируемого генома китайского хомячка (CHO-K1). Были сконструированы киРНК, направленные против генов-мишеней, перечисленных ниже в таблице 2:
|
Используемые киРНК были идентифицированы с помощью ОТ-ПЦР в реальном времени для подтверждения снижения уровня экспрессии генов-мишеней посредством сайленсинга генов. Экспрессия гена была нормализована по РНК 18S. Экспрессия гена, наблюдаемая после трансфекции киРНК, используемой в качестве негативного контроля, была принята за 100%. Относительное снижение экспрессии гена-мишени проиллюстрировано ниже в таблице 3, где представлены две различных киРНК, направленных против гена-мишени C12orf35:
|
Кроме того, было подтверждено, что киРНК против мишени, используемая в данном эксперименте, не ингибирует рост трансфецированных клеток. Кроме того, анализ BLAST (Basic Local Alignment Search Tool), основанный на имеющихся данных о геноме китайского хомячка, не указывал на какие-либо побочные эффекты.
Были трансфецированы нижеследующие клеточные линии: клеточная линия CHO, происходящая от CHO-K1, была использована в качестве родительской клеточной линии. Указанная клеточная линия экспрессирует вышеописанные гены, как показано на фиг. 2. Эта родительская клеточная линия не была трансфецирована экспрессионным вектором и служила в качестве контроля. Клетки CHO (клоны и пулы), происходящие от указанной родительской клеточной линии, которая содержит экспрессионный вектор, кодирующий антитело в качестве представляющего интерес белка, стабильно интегрированного в геном, использовали для определения функции киРНК. Экспрессионный вектор, содержащийся в указанном клеточном клоне, включал селективные маркерные гены и тяжелую цепь антитела и легкую цепь антитела, которые были экспрессированы из различных экспрессионных кластеров. Экспрессионный кластер, используемый для тяжелой цепи, был сконструирован так, чтобы часть тяжелой цепи экспрессировалась в результате считывания стоп-кодона в качестве гибридного полипептида, содержащего мембранный якорь. Гибридный белок был представлен на клеточной поверхности, что упрощает проведение FACS-анеализа (см. описание). Указанные клетки CHO экспрессировали вышеупомянутую киРНК против генов-мишеней по аналогии с родительской клеточной линией, как было определено с использованием микромассивов для нескольких сотен клонов и пулов. Клон CHO, который рекомбинантно экспрессировал антитело, был использован для того, чтобы определить, может ли ингибирование одного или болене из вышеупомянутых генов-мишеней приводить к повышению уровня экспрессии представляющего интерес полипептида. В этом случае может наблюдаться увеличение волюметрической продуктивности антитела указанным клеточным клоном, которое может детектироваться с помощью FACS-анализа.
Клон CHO, содержащий экспрессионный вектор, стабильно интегрированный в геном, трансфецировали либо киРНК-контролем (не влияющим на экспрессию гена), либо одной из вышеупомянутых киРНК, направленных против генов-мишеней. После трансфекции киРНК был проведен анализ для того, чтобы определить, может ли снижение уровня экспрессии гена-мишени приводить к повышению уровня экспрессии антитела. Inter alia, трансфецированные клетки окрашивали флуоресцентным детектирующим соединением и анализировали с помощью FACS для определения уровня экспрессии антитела. Чем больше количество продуцируемого антитела, тем выше интенсивность окрашивания представленного гибридного белка меченным соединением, и соответственно, тем интенсивнее флуоресцентный сигнал, детектируемый с помощью FACS. Поэтому, чем выше интенсивность FACS-профиля, тем выше уровень экспрессии антитела.
Результаты для различных тестируемых киРНК представлены на фиг. 3A-L. Левый пик на этих профилях соответствует сигналу, полученному для родительской клеточной линии, которая не экспрессирует антитело. На двух других кривых представлены результаты, полученные для антитело-экспрессирующего клеточного клона, который был трансфецирован либо киРНК, используемой в качестве негативного контроля (не влияющего на экспрессию), либо тестируемой киРНК, которая снижает уровень экспрессии гена-мишени. Если тестируемая киРНК и, соответственно, ингибирование гена-мишени не влияют на экспрессию антитела (то есть не повышают волюметрическую продуктивность), то полученная кривая флуоресценции для киРНК, используемсой в качестве негативного контроля, и кривая флуоресценции для киРНК, направленной против мишени, перекрываются и, по существу, являются идентичными. Этот случай, по существу, относится ко всем тестируемым генам-мишеням, за исключением гена C12orf35. Однако для FAM60A наблюдается небольшой сдвиг на уровен пула, что, вероятно, обусловлено повышением стабильности экспрессии (данные не приводятся).
Как можно видеть по результатам для киРНК, направленных против C12orf35 (см. фиг. 3B и C), пики флуоресценции, полученные для киРНК, используемой в качестве негативного контроля, и киРНК, направленной против гена C12orf35, четко отделены от пиков, полученных для сайленсинга гена C12orf35 посредством РНКи. Флуоресцентный пик, полученный для клеточного клона, трансфецированного киРНК, направленной против гена C12orf35, имеет явный сдвиг вправо (показано стрелками), что указывает на значительное повышение интенсивности флуоресценции. Такое наблюдаемое повышение интенсивности флуоресценции можно объяснить более высоким уровнем экспрессии антитела в результате присутствия большего количества гибридного белка, окрашенного на клеточной поверхности. Поэтому этот эксперимент явно показал, что ингибирование функциональной экспрессии гена C12orf35 непосредственно приводит к значительному повышению уровня рекомбинантной экспрессии антитела (повышению выхода антитела). Такой же заметный сдвиг FACS-профилей наблюдался при использовании указанных киРНК против C12orf35 во всех трех концентрациях. Более длительное снижение экспрессии гена C12orf35 посредством интерференции РНК может быть достигнуто, например, в случае стабильной интеграции в экспрессионный вектор, который экспрессирует РНКи-индуцирующий транскрипт, например, как описано в настоящей заявке. Кроме того, снижение или блокирование экспрессии гена C12orf35 может быть достигнуто посредством нокаута гена или делеции/мутации гена, а в соответствии с одним из вариантов осуществления изобретения, посредством делеции части теломерной области хромосомы 8 в клетках хомячка, таких как клетки СНО, описанные в настоящей заявке. Кроме того, как описано в настоящей заявке, снижение или блокирование функции продукта экспрессии может быть также достигнуто, например, путем введения одной или более мутаций, приводящих к продуцированию нефункционального или менее функционального белка.
Достигнутое повышение уровня экспрессии представляющего интерес рекомбинантного полипептида было также подтверждено с помощью анализа уровней экспрессии мРНК тяжелой и легкой цепей (которые экспрессировались из отдельных экспрессионных кластеров, см. выше). Эти результаты представлены для двух различных представляющих интерес полипептидов (антитела 1 и 2) на фиг. 4 и 5. Полученные данные нормализовали по киРНК, используемой в качестве негативного контроля (125 пмоль). Было обнаружено, что снижение уровня экспрессии гена C12orf35 приводит к значительному повышению уровней мРНК тяжелой и легкой цепей экспрессируемого антитела. В противоположность этому, снижение уровня экспрессии других тестируемых генов-мишеней не влияет на уровень экспрессии мРНК тяжелой и легкой цепей. Таким образом, снижение уровня экспрессии гена C12orf35 приводит к значительному увеличению уровня мРНК представляющего интерес рекомбинантного полипептида. Кроме того, было обнаружено, что другие введенные гены, такие как селективные маркеры, ингибируются в случае сайленсинга гена C12orf35. Эксперимент, в котором эффект сайленсинга гена оценивали в течение всего периода времени, начиная со дня 3, показал, что киРНК1 (см. киРНК C12orf35_1 в таблице 4) действует в течение более длительного периода времени, чем киРНК2 (см. киРНК C12orf35_2 в таблице 4). Кроме того, число и титры клеток определяли в течение всего эксперимента, и было обнаружено, что ингибирование C12orf35 приводит к значительному повышению удельной и волюметрической продуктивности (см. фиг. 6 и 7).
Кроме того, экспрессию гена C12orf35 по сравнению с экспрессией РНК 18S анализировали в антитело-экспрессирующем клоне после ингибирования под действием киРНК 1 и 2 и сравнивали с различными контролями. Результаты представлены ниже в таблице 4:
|
Пример 2: Получение клеточной линии CHO, имеющей делецию в теломерной области хромосомы 8
Была получена новая клеточная линия CHO (C8DEL), имеющая делецию в теломерной области плеча q хромосомы 8. Делеция была индуцирована хромосомным разрывом. Такая делетированная часть содержит ген C12orf35, а также, среди прочих, ген FAM60A (см. фиг. 1). Указанная новая клеточная линия была получена из родительской клеточной линии, происходящей от CHO-K1. Указанную клеточную линию получали следующим образом. Родительские клетки СНО культивировали при плотности 2E5 клеток/мл в культуральной среде, содержащей 0,5 мкМ, 1 мкМ или 2 мкМ MTX. Через шесть дней, жизнеспособность клеток составляла приблизительно 30-40%. Клетки центрифугировали при 180xg в течение 5 минут и культивировали в культуральной среде без MTX до тех пор, пока жизнеспособность клеток не превышала 95% (приблизительно 21 день). Эту процедуру повторяли еще два раза. Моноклеточные клоны получали из клеточных пулов. Всего был культивирован 561 клеточный клон, после чего выделяли ДНК с использованием набора для ПЦР «Extract-N-Amp Blood PCR Kit». Затем проводили ПЦР-скриниг с использованием праймеров, детектирующих ген Ipo8. Три из 561 клона были «IPO8-негативными», что указывало на отсутствие теломерной области хромосомы 8, включающей ген Ipo8. Ген Ipo8 расположен со стороны центромеры по отношению к гену C12orf35 (см. фиг. 1). Таким образом, если ген Ipo8 был делетирован в результате хромосомного разрыва, то все гены, расположенные со стороны теломеры по отношению к гену Ipo8 (и соответственно также к гену C12orf35 и гену FAM60A), были также делетированы. Эти три клона были размножены и дополнительно проанализированы. Один из этих клонов называвается клеточной линией «C8DEL». Точка разрыва теломерной области хромосомы 8 клеточной линии C8DEL может быть опредлелена с помощью ПЦР. Точку разрыва определяли между двумя ПЦР, называемыми PCR20 и PCR28:
PCR20: прямой 5’-ACC AGT GAA TAA TCG TGT TT-3’ (SEQ ID NO: 47), обратный 5’-CTA TGA GTC AAT GTC CCA AG-3’ (SEQ ID NO: 48);
PCR28: прямой 5’-CAC ACA CAA CCT CCT AAC AAC CC-3’ (SEQ ID NO: 49), обратный 5’-TTC CGC ACC GAC TCA GTT CT-3’ (SEQ ID NO: 50).
Точка разрыва находится в гене Tmtc1. Кроме того, было продемонстрировано, что идентифицированная точка разрыва клеточной линии C8DEL сохраняется в течение нескольких недель культивирования (как было определено с помощью ПЦР). Трансфекция этой новой эукариотической клеточной линии экспрессионным вектором, кодирующим представляющий интерес продукт, приводила к значительному увеличению волюметрических титров продукта по сравнению с родительской клеточной линией (не имеющей указанной делеции в теломерной области), а также к повышению вероятности отбора стабильно продуцирующих клонов как описано ниже. Трансфекция и MTX-обработка клеточной линии C8DEL не оказывала какого-либо значительного влияния на точку разрыва (то есть не наблюдалось какой-либо потери генетического материала), на что указывал анализ трансфецированных клонов.
Пример 3: Анализ свойств клеточной линии C8DEL
Клеточную линию C8DEL анализировали на ее эффективность в отношении рекомбинантной экспрессии представляющего интерес полипептида и сравнивали с родительской клеточной линией, от которой происходит клеточная линия C8DEL. Как описано выше, указанная родительская клеточная линия не содержит соответствующую делецию в теломерной области хромосомы 8.
3.1. Анализ на продуктивность
Волюметрическую продуктивность C8DEL оценивали по сравнению с родительской клеточной линией, от которой она происходит. Была осуществлена стабильная, а также транзиентная трансфекция.
Стабильная трансфекция
Культивирование клеток, трансфекцию и скрининг осуществляли в шейкерных колбах с использованием суспензии растущих клеток CHO в культуральной среде определенного химического состава. Клетки трансфецировали путем электропорации различными экспрессионными векторами, кодирующими различные антитела и терапевтические белки. Используемые экспрессионные векторы содержали экспрессионный кластер, включающий полинуклеотид, кодирующий неомицин-фосфотрансферазу в качестве селективного маркера, и экспрессионный кластер, кодирующий DHFR в качестве селективного маркера. Экспрессионные векторы, используемые для экспрессии антител, также содержали экспрессионный кластер, включающий полинуклеотид, кодирующий легкую цепь антитела, и экспрессионный кластер, включающий полинуклеотид, кодирующий тяжелую цепь антитела, так, чтобы все антитело экспрессировалось указанным экспрессионным вектором. Экспрессионные векторы, используемые для экспрессии полипептида, не являющегося антителом, содержали экспрессионный кластер, включающий полинуклеотид, который, помимо селективного маркера, кодировал указанный полипептид. Все экспрессионные кластеры, содержащиеся в экспрессионных векторах, были ориентировны в одном и том же направлении. Этот вектор является подходящим для FACS-отбора, и подробное описание такого вектора приводится выше.
В зависимости от жизнеспособности клеток, первую стадию отбора начинали через 24-48 часов после трансфекции путем добавления селективной среды с G418 в клетки. После достижения жизнеспособности клеток выше 80% проводили вторую стадию отбора путем пропускания клеток через среду, содержащую 500 нМ MTX или 1 мкM MTX.
Волюметрическую продуктивность выбранных клеточных популяций анализировали после проведения стадии отбора с использованием G418 или MTX путем культивирования быстро растущих периодических культур в шейкерных колбах в среде с G418 или MTX. Объем периодической культуры с G418 составлял 30 мл (125 мл-колба), а объем периодической культуры с подпиткой и с MTX составлял 100 мл (500 мл-колба). Периодические культуры с G418 высевали при 1E5 капиллярных объемов (к.о.)/мл в шейкерной колбе и культивировали в шейкерном сосуде (без увлажнения) при 150 об/мин и в атмосфере 10% CO2. Периодические культуры с подпиткой высевали при 4E5 к.о./мл. В начале анализа, жизнеспособность клеток составляла >90%. Титр определяли на 14-й день. Титры антител в супернатанте клеточной культуры определяли с помощью ВЭЖХ на белке А через 14 дней после начала культивирования.
После первой стадии отбора (отбора с использованием G418) очень большое увеличение волюметрического титра (в 12-35 раз) было детектировано для стабильно трансфецированных пулов C8DEL, но не для стабильно трансфецированных родительских пулов. После второй стадии отбора (отбора с использованием MTX), пулы периодической культуры с подпиткой C8DEL экспрессировали в 4-7 раз большее количество представляющего интерес полипептида по сравнению с трансфецированными родительскими клетками, где указанный полипептид представлен 2 антителами (антителом 1 и антителом 2). Волюметрические титры C8DEL в культуре с G418 и MTX (в периодической культуре с подпиткой) по сравнению с родительской клеточной линией CHO, не содержащей делеции в теломерной области хромосомы 8, являются репрезентативными для двух экспериментов с антителами, данные которых представлены ниже в таблицах 5.a и 5.b. В таблицах 5.a и 5.b представлены волюметрические титры пула клеток C8DEL (экспрессирующих антитело) в периодической культуре с подпиткой, содержащей G418 и MTX, по сравнению с пулами родительских клеток (представлены в среднем 4 пула/среду).
|
Результаты подтвердили, что делеция в теломерной области хромосомы 8, включающей ген C12orf35, коррелирует с более высокой волюметрической продуктивностью. Что касается волюметрического титра пула, то клеточная линия C8DEL по своим свойствам уже превосходила родительскую клеточную линию, не содержащую соответствующей делеции в теломерной области хромосомы 8. Был проведен анализ на частоту и распределение сайтов интеграции в пулах с кариотипом C8DEL и в родительских пулах. Оба эти пула имели более чем 100 различных сайтов интеграции в 200 анализируемых клетках, что указывает на огромную вариабельность этих двух пулов при отсутствии какого-либо различия между двумя этими клеточными линиями. Это указывает на то, что более высокая волюметрическая продуктивность не обусловлена какими-либо артефактами интеграции.
Транзиентная трансфекция
Клетки C8DEL и родительские клеточные линии, культивированные к культуральной среде, были транзиентно трансфецированы с тремя повторностями экспрессионными плазмидами, кодирующими либо eGFP, либо гибридный Fc-белок, используемый в качестве представляющей интерес модели. В качестве реагента для трансфекции использовали полиэтиленимин (PEI). Титр белка-модели в супернатане среды измеряли с помощью ВЭЖХ на белке А через 3 и 6 дней после трансфекции. Экспрессия белка-модели в C8DEL была приблизительно в 3 раза выше. Процент eGFP-экспрессирующих клеток измеряли через 48 часов после трансфекции с помощью проточной цитометрии, где нетрансфецированные клетки использовали в качестве негативного контроля. Клетки, уровень флуоресценции которых более чем на 99% превышал уровень флуоресценции клеток, используемых в качестве негативного контроля, рассматривались как «трансфецированные». Клетки, уровень флуоресценции которых более чем в 1000 раз превышал уровень флуоресценции клеток, используемых в качестве негативного контроля, рассматривались как «в высокой степени флуоресцентные». При использовании клеточной линии C8DEL, число в высокой степени флуоресцентных клеток в 2-3 раза превышало число родительских клеточных линий, от которых происходили клетки C8DEL.
В этом примере показано, что повышенная волюметрическая продуктивность может быть также достигнута путем транзиентной трансфекции клеточной линии C8DEL, в которой часть теломерной области хромосомы 8 теряется в результате хромосомного разрыва.
3.2. Анализ на стабильность
Стабильность 46 клонов, происходящих от C8DEL, и 37 клонов, происходящих от родительской клеточной линии (которые, как показал анализ, были IPO8-позитивными, а поэтому в них присутствовала теломерная область хромосомы 8), анализировали после стабильной трансфекции. Все клоны рекомбинантно экспрессировали то же самое антитело в качестве представляющего интерес продукта и были классифицированы как стабильные, если они не утрачивали более чем 25% титра антител (волюметрического) через 12 недель. 76% анализируемых клонов, происходящих от родительской клеточной линии, утрачивали более чем 25% титра (волюметрического) через 12 недель культивирования. При этом только 24% анализируемых клонов были классифицированы как стабильные. Таким образом, степень нестабильности была высокой. Для сравнения, 67% клонов C8DEL были классифицированы как стабильные, и только 33% были нестабильными, как показано в таблице 6:
|
P-величина 0,0002 была вычислена с применением критерия χ2 с поправкой Йетса, что указывает на то, что клоны, происходящие от C8DEL, обнаруживали значительно более выраженную тенденцию к стабильному продуцированию продукта. Таким образом, для клеточной линии C8DEL было выявлено значительно большее число стабильно продуцирующих клонов. Этот эксперимент в совокупности с нокаут-экспериментами, описанными в примере 5, еще раз подтвердил, что клетки хомячка, такие как клетки СНО, в которых была делетирована часть теломерной области хромосомы 8, также содержащая ген FAM60A, обладают превосходной стабильностью. Таким образом, использование такой клеточной линии для рекомбинантной экспрессии повышает шанс идентифицировать рекомбинантные клетки, обладающие высокой продуктивностью и хорошей стабильностью. Кроме того, была проналализирована волюметрическая продуктивность указанных клонов (см. 3.3.).
3.3. Дополнительные анализы свойств C8DEL
Свойства клеточной линии CHO, имеющей делецию в теломерной области хромосомы 8, где указанная делеция содержит ген C12orf35, были проанализированы в дополнительных экспериментах, которые продемонстрировали другие преимущества указанной клеточной линии.
Для отбора высокопродуктивных клеток требуется клонирование по меньшей мере одной клетки
После клонирования одной клетки, большую часть составляли высокопродуктивные клоны клеточной линии C8DEL с преимущественными свойствами. Было обнаружено, что пулы C8DEL имеют большее число высокопродуктивных клеток (что приводит к увеличению волюметрического титра пула) по сравнению с родительской клеточной линией, происходящей от CHO-K1. После клонирования одной клетки из пула C8DEL с применением FACS-технологии было отобрано значительно большее число клонов, экспрессирующих большие количества антител, по сравнению с пулами, происходящими от родительской клеточной линии. В таблице 7 показано, что большинство клонов, происходящих от родительской клеточной линии, имели волюметрический «титр в 96 лунках» 0-20 мг/л. В противоположность этому, большинство клонов, происходящих от клеточной линии C8DEL, имели средний волюметрический титр 80-100 мг/л, что значительно превышает предыдущие значения. Одним из преимуществ использования пулов C8DEL является меньшее число клонов, достаточное для получения сравнимого количества высокопродуктивных клонов. Это позволяет значительно снизить затраты на скрининг.
|
С использованием клеточной линии C8DEL в качестве клеточной линии-продуцента можно получить не только большое количество высокопродуктивных клонов, но также увеличить волюметрический титр отдельных клонов C8DEL. На фиг. 8 показан волюметрический титр 45 самых высокопродуктивных клонов, происходящих от родительской клеточной линии CHO-K1 (все они являются Ipo8-позитивными), и клона C8DEL, экспрессирующего антитело (результаты анализа на стабильность указанных клонов представлены в разделе 3.2). Как уже указывалось, средний волюметрический титр клонов, происходящих от клеточной линии C8DEL, был выше по сравнению с титром родительской клеточной линии, и кроме того, клоны, продуцирующие самые высокие уровни антител, происходили от клеточной линии C8DEL.
Пригодность для культивирования в биореакторе
Были проведены дополнительные тесты для оценки клеточной линии C8DEL по сравнению с родительской клеточной линией, происходящей от CHO-K1, inter alia, в целях определения ее пригодности для промышленного продуцирования. Культивирование в биореакторе показало, что клеточная линия C8DEL является подходящей для промышленного продуцирования. Клеточная линия C8DEL, культивированая в биореакторах, имела плотность популяции жизнеспособных клеток, достаточную для крупномасштабного продуцирования. Кроме того, было обнаружено, что жизнеспособность клеточной линии C8DEL превышает жизнеспособность родительской клеточной линии. В целом, клеточная линия C8DEL является подходящей для промышленного продуцирования, и ее жизнеспособность превышает жизнеспособность родительской клеточной линии, от которой она происходит. Жизнеспособность клеточной линии C8DEL сохраняется в течение более длительного периода времени на более высоком уровне.
Увеличение периода времени, начиная с трансфекции до стабильного продуцирования пула
Другим преимуществом клеточной линии C8DEL является более быстрое восстановление клеток после отбора с использованием MTX. Восстановление пулов после инкубирования с MTX осуществляется на 7-8 дней раньше, чем для родительской клеточной линии, в которой часть теломерной области хромосомы 8, содержащей ген C12orf35, не была делетирована. В целом, было обнаружено, что разрушение клетки было значително ниже в случае, когда экспрессия гена C12orf35 была снижена или блокирована. Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что это, по всей вероятности, можно объяснить более высоким уровнем экспрессии гетерогенных генов, то есть экзогенов, включая селективный маркер.
Пример 4: Отбор с использованием фолатного рецептора в качестве селективного маркера
Клеточную линию C8DEL использовали в различных экспериментах вместе с рецептором фолиевой кислоты в качестве селективного маркера, и было обнаружено, что применение указанной комбинированной системы отбора имеет конкретные преимущества. В частности, такой комбинированный отбор с использованием фолатного рецептора и DHFR в качестве селективных маркеров является предпочтительным. В данном случае, трансфецированные клетки содержат человеческий фолатный рецептор альфа и DHFR в качестве селективных маркеров и экспрессируют антитело. При отборе родительской клеточной линии с использованием очень небольших количеств фолиевой кислоты (50 нМ фолиевой кислоты (FA)/50 нМ MTX) возникают определенные проблемы, связанные с жесткостью отбора (клетки не всегда восстанавливаются), и в таких условиях жесткости, комбинация C8DEL и фолатного рецептора, используемых в качестве селективных маркеров, является очень эффективной и способствует значительному увеличению волюметрического титра. В таблице 8 указаны различия волюметрических титров для родительской клеточной линии и для C8DEL, а также указано дальнейшее увеличение волюметрического титра, которое может быть достигнуто в стадии отбора с использованием фолатного рецептора в качестве селективного маркера в комбинации с небольшими количествами фолиевой кислоты вместо 500 нМ MTX. Таким образом, использование описанных здесь эукариотических клеток, в которых снижается или блокируется экспрессия гена C12orf35 и гена FAM60A, в комбинации с системой отбора с использованием фолатного рецептора/DHFR позволяет проводить отбор в очень жестких условиях, которые не требуют введения больших количеств токсических агентов.
|
Кроме того, клетки C8DEL были трансфецированы (подвергнуты нуклеофекции) экспрессионным вектором, содержащим экспрессионный кластер, включающий полинуклеотид, кодирующий человеческий фолатный рецептор альфа, и экспрессионный кластер, включающий полинуклеотид, кодирующий DHFR. Таким образом, оба селективных маркера FR-альфа и DHFR находились на одном и том же экспрессионном векторе. Кроме того, экспрессионный вектор содержал экспрессионный кластер, включающий полинуклеотид, кодирующий легкую цепь антитела, и экспрессионный кластер, включающий полинуклеотид, кодирующий тяжелую цепь антитела. Экспрессионный кластер для тяжелой цепи антитела был сконструирован так, чтобы часть тяжелой цепи экспрессировалась посредством считывания стоп-кодона в виде заякоренного на мембране гибрида, что облегчает FACS-отбор (см. выше). Было протестировано пять различных условий отбора с использованием 100 нМ фолиевой кислоты (FA) и различных концентраций MTX. Состав селективной среды систематизирован в нижеследующей таблице 9. После отбора, отобранные клеточные пулы переносили в полную среду и культивировали в шейкерных колбах в виде периодических культур. На 13-й день культивирования были взяты образцы культуральной среды, и эти образцы были проанализированы на содержание антитела с помощью ВЭЖХ на белке A. Результаты также представлены в таблице 9.
|
Как можно видеть из таблицы, концентрация MTX, составляющая по меньшей мере 5 нМ, является предпочтительной для отбора. Повышение жесткости условий отбора также приводит к увеличению волюметрического пула титра. Таким образом, волюметрическая продуктивность антитела значительно повышается. Кроме того, по сравнению со стандартными условиями отбора с использованием МТХ, в процессе указанного отбора могут быть использованы значительно более низкие концентрации MTX. Это является важным преимуществом, если учесть, что МТХ представляет собой токсический агент. Кроме того, был проведен анализ для того, чтобы определить, как условия жесткости отбора влияют на волюметрические титры пула и на время отбора. Было обнаружено, что повышение жесткости отбора путем увеличения концентрации MTX увеличивает время восстановления. Таким образом, жесткость отбора может быть скорректирована в зависимости от различных целей применения (время зависит от волюметрического титра). Для некоторых целей, где достаточным является меньшее общее количество представляющего интерес белка, могут потребоваться менее жесткие условия отбора, и в этом случае могут быть получены пулы с достаточной высоким уровнем продуктивности, что позволит осуществлять очистку соответствующего белка в достаточных количествах. Для получения клональной клеточной линии, которая может быть использована в целях промышленного продуцирования представляющего интерес белка, предпочтительно, повышать жесткость отбора, в результате чего можно получить моноклеточные клоны с очень высоким уровнем экспрессии и с хорошей стабильностью.
Кроме того, анализ пулов, полученных после отбора с использованием фолиевой кислоты/МТХ, на поверхностную экспрессию антитела с помощью FACS, показал, что использование этой системы отбора в комбинации с новой клеточной линией приводит к значительному увеличению числа высокопродуктивных клеток в клеточном пуле, на что указывают профили флуоресценции, проиллюстрированные на фиг. 9A-E. Концентрация MTX была увеличена от A до E (A: без MTX; B: 1 нМ MTX; C: 5 нМ MTX; D: 10 нМ MTX; E: 50 нМ MTX). При увеличении концентрации MTX, число клеточных клонов с высоким уровнем экспрессии в клеточном пуле увеличивалось, на что указывает увеличение размера пика с правой стороны (более высокая интенсивность флуоресценции коррелирует с более высоким уровнем экспрессии антитела). Использование 50 нМ фолиевой кислоты в комбинации с 10 нМ MTX (см. фиг. 9D) уже приводит к получению клеточного пула, содержащего преимущественно высокопродуктивные клеточные клоны (один доминантный пик с правой стороны). Кроме того, при увеличении концентрации MTX до 50 нМ (см. фиг. 9E), в полученном пуле будут содержаться почти исключительно высокопродуктивные клетки. Эти результаты являются достойными внимания, поскольку с использованием клеточной линии C8DEL в комбинации с системой отбора фолатный рецептор/DHFR можно получить профиль пула, который, как показал FACS-анализ, будет больше напоминать профиль пула клеточного клона (содержащего генетически идентичные клетки), чем профиль клеточного пула (содержащего генетически отличающиеся клетки). Очевидно, что делеция гена C12orf35, имеющаяся в делетированной теломерной области клеточной линии C8DEL, будет приводить к значительному повышению волюметрической продуктивности, а поэтому большинство клеток в клеточных пулах, полученных после отбора с использованием фолевой кислоты/МТХ в соответствующих условиях, будут представлять собой высокопродуктивные клетки в соответствии с FACS-профилями.
Кроме того, было обнаружено, что при культивировании стабильно трансфецированных клонов, полученных из клеточной линии C8DEL (ген FAM60A был делетирован, см. выше), в селективной среде (50 нМ фолиевой кислоты, 10 нМ MTX), стабильность будет составлять до 80%, а в перспективе, она может достигнуть почти 100%. Достаточно выскокая стабильность также достигалась в полуселективной среде, которая содержала только ограниченную концентрацию фолиевой кислоты (50нМ), и не содержала MTX. В этом случае, стабильность такой клеточной линии составляла до 87%. В некоторых экспериментах, стабильность составляла почти 100%.
Пример 5: Нокаут гена FAM60A в клетках CHO, достигаемый с применением технологии TALEN
Два клеточных клона, полученных на основе клеток CHO, происходящих от клеточной линии CHO-K1, были созданы так, чтобы они содержали нокаут-мутацию гена FAM60A. Для создания FAM60A-мутантных клеток была применена технология TALEN, то есть, технология с использованием эффекторных нуклеаз, подобных активатору транскрипции (Transcription Activator-Like Effector Nucleases). Для нокаута гена FAM60A, мишенью является кодирующая область (предположительно, экзон 1) гена FAM60A. Клетки CHO-K1, используемые в качестве родительской клетки, содержат только одну копию FAM60A. Таким образом, одной нокаут-мутации на клетку достаточно для ингибирования функции FAM60A в указанной клетке.
5.1. Конструирование/продуцирование и применение нуклеаз TALEN, которые являются специфичными к FAM60A
Таргетингу была подвергнута нижеследующая последовательность экзона геномной ДНК гена FAM60A в родительской клеточной линии CHO:
atgtttggttttcacaagccaaagatgtaccgaagtatagagggctgctgtatctgcagagccaagtcctccagctctcggttcacggacagtaaacgttatgaaaaggacttccagagctgttttgg (SEQ ID NO: 51).
Нуклеотиды TALEN-связывающих сайтов отмечены жирным шрифтом. Были сконструированы две последовательности TAL Fok I, нацеленные на кодирующую последовательность FAM60, представленную выше (SEQ ID NO: 51). TALEN TAL-L нацелена на помеченные 25 нуклеотидов и связывается с этими нуклеотидами на 5’ (прямой) ДНК-цепи, а TALEN TAL-R нацелена на помеченные 25 нуклеотидов и связывается с этими нуклеотидами на 3’ (обратной) ДНК-цепи гена FAM60A как показано выше для SEQ ID NO: 51 (см. таблицу 10, где также показаны дополнительные праймерные последовательности, которые были использованы для идентификации нокаут-генов). Эти два связывающих сайта разделены 16 нуклеотидами разрезающего сайта. Были получены плазмиды, кодирующие две последовательности TALENS, TAL-L и TAL-R.
|
Часть геномной последовательности ДНК гена FAM60A, которая включает кодирующую последовательность-мишень, представленную в SEQ ID NO: 51, и которая также простирается за пределы праймер-связывающих сайтов для праймеров 1, 2 и 4, расположенных в интронных областях, показана как SEQ ID NO: 58.
5.2. Трансфекция плазмидой TALEN
Трансфекцию осуществляли в соответствии со стандартным протоколом трансфекции, включающим электропорацию с использованием родительских клеток CHO в экспоненциальной фазе роста с жизнеспособностью выше 95% и с использованием 5 мкг каждой из плазмид TALEN.
5.3. Cel-I-анализ и клеточный сортинг
Cel-l-анализ осуществляли согласно руководству SAFC Biosciences. Cel-I-анализ представляет собой стандартный анализ для определения эффективности разрезания. Вкратце, после культивирования в течение нескольких дней, геномную ДНК выделяли из клеток и проводили ПЦР с использованием праймеров 1 и 2 (см. таблицу 10). Продукт амплификации денатурировали, а затем оставляли для ренатурации. После этого добавляли энхансер нуклеазы S и нуклеазу S, а затем инкубировали. Гидролизованный продукт анализировали. Если наблюдалась TALEN-активность, то присутствовали две менее крупные полосы, что указывает на наличие TALEN-активности в этой области генома, и следовательно, подтверждает нокаут гена FAM60A в клетках анализируемого клеточного пула. Из позитивных клеточных пулов в 96-луночных планшетах были отобраны отдельные клетки путем лимитирующего разведения.
5.4. Стратегия скрининга
Геномную ДНК (гДНК) экстрагировали из каждого клона в 96-луночных планшетах. гДНК анализировали стандартным методом для идентификации нокаут-клонов с помощью ПЦР-анализа. Для этой цели использовали праймеры 3 и 4 (см. таблицу 10). В случае мутации в разрезающей области, праймер 3 не связывается и ПЦР-продукт не образуется. ПЦР-продукты, полученные после ПЦР с использованием праймеров 1 и 2 гДНК (см. выше) позитивных клонов, были секвенированы для анализа введенной мутации.
Были получены два клеточных клона с нокаут-мутацией: FAM60A_ko_s16 (s16) с делецией 14 нуклеотидов и FAM60A-ko_s23 (s23) с делецией 5 нуклеотидов. Мутированные последовательности клеточных клонов представлены в таблице 11. Каждая из делеций приводит к сдвигу рамки считывания. Из-за сдвига рамки считывания в таргетированной последовательности FAM60A, стоп-кодоны присутствуют в рамке считывания (в таблице 11, эти нуклеотиды выделены курсивом и подчеркнуты). Таким образом, предполагается, что аномально короткий и менее функциональный или нефункциональный продукт экспрессии FAM60A экспрессируется полученными клонами с нокаутом FAM60A.
|
5.5. Анализ на стабильность
Была получена родительская клеточная линия дикого типа (WT), от которой происходят клоны с нокаутом FAM60A, и эти полученные клетки с нокаутом FAM60A были стабильно трансфецированы экспрессионным вектором, кодирующим представляющее интерес антитело в качестве полипептида. Трансфецированный экспрессионный вектор содержал экспрессионный кластер, включающий полинуклеотид, кодирующий неомицин-фосфотрансферазу в качестве селективного маркера, экспрессионный кластер, кодирующий DHFR в качестве селективного маркера, экспрессионный кластер, включающий полинуклеотид, кодирующий легкую цепь антитела, и экспрессионный кластер, включающий полинуклеотид, кодирующий тяжелую цепь антитела, так, чтобы все антитело экспрессировалось указанным экспрессионным вектором. Все экспрессионные кластеры в экспрессионных векторах были ориентированы в одном и том же направлении. Экспрессионный кластер, используемый для тяжелой цепи, был сконструирован так, чтобы часть тяжелой цепи экспрессировалась посредством считывания стоп-кодона в виде гибридного полипептида, содержащего мембранный якорь. Этот гибридный белок представлен на клеточной поверхности, что упрощает FACS-анализ (см. описание). Трансфецированные клетки были выбраны для рекомбинантной экспрессии путем отбора с использованием G418 и MTX (1 мкМ). Из отобранных пулов каждой стабильно трансфецированной клеточной линии (CHO WT, s16 и s23) были взяты клеточные клоны, которые экспрессировали представляющий интерес продукт с высоким выходом, и эти клоны были культивированы в течение нескольких недель (7 недель для родительской клеточной линии СНО WT (45 клонов) и 8 недель для клеток с FAM60A-нокаутом (13 клонов для s16 и 18 клонов для s23)) для анализа на стабильную экспрессию в течение длительного периода культивирования. Для гарантии того, что клеточные линии-продуценты могут быть применены для промышленного продуцирования в биореакторах большого объема, были также проведены исследования на стабильность в течение 12 недель, а в частности, дополнительный анализ на стабильную экспрессию в течение 12-недельного культивирования. Клоны были классифицированы как нестабильные, если они утрачивали более чем 25% от первоначального волюметрического титра экспрессии в течение всего периода анализа на стабильность. При обычном уровне вариабельности, некоторые клоны давали титры чуть выше или ниже предельного значения в 25%. Более высокое содержание нестабильных клонов в течение 7/8 недель по сравнению с 12 неделями культивирования родительскиой клеточной линии можно объяснить вариабельностью анализа на продуктивность клонов, которая была близка к пороговому значению 25%.
В таблице 12 сравниваются результаты анализов на стабильность для клеточных линий. Как можно видеть из таблицы, процент клонов со стабильным волюметрическим титром значительно выше для клонов, происходящих от клеточной линии с нокаутом FAM60A, по сравнению с клонами, происходящими от клеточной линии дикого типа. Это указывает на то, что ингибирование функции эндогенного FAM60A в клетках, достигаемое путем нокаута гена, значительно повышает стабильность в процессе длительного культивирования. Отношение стабильных клонов к нестабильным клонам значительно повышается при использовании клеток согласно изобретению, полученных так, чтобы более стабильные клоны сохраняли свои предпочтительные высокопродуктивные свойства в процессе длительного культивирования. Антитело, которое было рекомбинантно экспрессировано как описано в этом примере, не является оптимизированным по кодонам и присутствует в родительской клеточной линии с очень высокой степенью нестабильности. Из-за такой высокой нестабильности, этот вариант был выбран для сравнения, поскольку он продемонстрировал значительную эффективность, которая была достигнута при осуществлении настоящего изобретения даже вопреки имеющимся трудностям, связанным с высокой степенью нестабильности немодифицированной клеточной линии дикого типа. Однако, как обсуждается выше, в других вариантах, степень нестабильности родительской клеточной линии CHO дикого типа является менее высокой. Однако во всех проанализированных случаях использование клеток-хозяев согласно изобретению, в которых ингибируется функция FAM60A, по сравнению с немодифицированной клеточной линией дикого типа, позволяет достичь значительного увеличения количества стабильных кклеток. Степень стабильности может достигать 60% или более, 70% или более, 80% или более, 85% или более, или даже 90% или более, в зависимости от выбранного варианта. При использовании клеток согласно изобретению, которые, например, имеют нокаут гена FAM60A, или где часть теломерной области, содержащая ген FAM60A, утрачивается в результате хромосомного разрыва, нестабильные клоны встречаются гораздо реже независимо от анализируемого варианта, но даже если они и встречаются, то потеря их волюметрической продуктивности является менее выраженной, чем у соответствующих клеток, в которых не ингибируется функция FAM60A. Следовательно, в результате увеличения процента стабильных клонов, полученных после трансфекции и отбора, использование клеток согласно изобретению позволяет значительно сократить время проведения исследований на стабильность или даже вообще не проводить такие исследования. Исследования на стабильность клонов с нокаутом FAM60A подтвердили ценность результатов, которые были получены с применением технологии согласно изобретению.
|
Результаты, представленные на фиг. 10, продемонстрировали важные преимущества, которые были достигнуты благодаря ингибированию функции FAM60A в клетках, а в данном случае, благодаря нокауту гена. Следовательно, предпочтительно также ингибировать функцию белка FAM60A в эукариотической клетке, например, посредством снижения или блокирования функциональной экспрессии гена FAM60A после модификации генома эукариотической клетки, что будет приводить к повышению стабильности экспрессии.
Пример 6: Способ подтверждения идентификации высокопродуктивных и стабильных продуцентов исходя из профиля экспрессии
Был разработан аналитический ОТ-ПЦР-анализ в реальном времени для предсказания продуктивности и стабильности клона на ранней стадии исследования. ОТ-ПЦР-анализ в реальном времени был проведен для четырех генов: C12orf35, Dennd5b, FAM60A и Ipo8 (все эти гены расположены в теломерной области на плече q хромосомы 8). После отбора и получения клона было проанализировано несколько сотен клонов, стабильно экспрессирующих антитело в качестве представляющего интерес полипептида, на присутствие и уровень экспрессии этих четырех генов в теломерной области хромосомы 8 и на выход продукта экспрессии. Наблюдалась четкая корреляция между волюметрической продуктивностью антитела и отсутствием теломерной области хромосомы 8. Кроме того, было обнаружено, что в этих клетках наблюдаются более высокие уровни мРНК тяжелой цепи и легкой цепи. Таким образом, с применением указанного аналитического метода могут быть идентифицированы клеточные клоны с высоким уровнем экспрессии.
Кроме того, было проведено исследование для того, чтобы определить, существует ли корреляция между стабильностью и присутствием теломерной области хромосомы 8. Клоны были классифицированы как стабильные, если они не утрачивали более чем 25% волюметрического титра через 12 недель. Существует значительная корреляция между утратой теломерной области хромосомы 8 и стабильностью клона (p-величина 4,67E-06 была вычислена с применением критерия χ2). Впоследствии, такая потеря теломерной области на хромосоме 8 может быть использована в качестве средства для предсказания стабильности. Анализ на присутствие теломерной области хромосомы 8, проводимый посредством ОТ-ПЦР в реальном времени, повышает вероятность отбора большего числа стабильных клонов в экспериментальном проекте.
Кроме того, в результате анализа нескольких сотен клонов, в которых отсутствует часть теломерной области хромосомы 8, было обнаружено, что в имеющейся теломерной области хромосомы 8 может быть индуцировано несколько точек разрыва. В большинстве проанализированных случаев, точки разрыва расположены со стороны центромеры по отношению к гену Ipo8. Точки разрыва были также детектированы между геном метилтрансферазо-подобного белка 20 (называемым далее мышиным 4833442J19Rik) и геном Dennd5b, между геном Dennd5b и геном FAM60A, между геном FAM60A и геном Ipo8. Во всех случаях, делетированная область содержит ген C12orf35 (который расположен со стороны теломеры по отношению к гену, кодирующему метилтрансферазо-подобный белок 20). Все точки разрыва были ассоциированы с высокой волюметрической продуктивностью, что, тем самым, подтверждает релевантность гена C12orf35 для волюметрической продуктивности.
Пример 7: Снижение уровня экспрессии гена C12orf35 посредством интерференции РНК (РНКи) в клеточной линии, происходящей от HEK293, приводит к увеличению выхода продукта экспрессии
Для того, чтобы продемонстрировать, что снижение уровня экспрессии гена C12orf35 в других клеточных линиях млекопитающих также приводит к повышению волюметрической продуктивности, были сконструированы две киРНК, направленные против C12orf35 Homo sapiens. Последовательности киРНК перечислены в таблице 13. В качестве негативного контроля использовали РНКи (киРНК), а именно, киРНК Silencer® Negative Control No.1 (AM4611).
|
Используемые киРНК оценивали с помощью ОТ-ПЦР в реальном времени для подтверждения снижения уровня экспрессии генов-мишеней этими киРНК посредством сайленсинга гена. Экспрессию гена нормализовали по РНК 18S. Наблюдаемую экспрессию гена, в случае трансфекции киРНК, используемой в качестве негативного контроля, принимали за 100%. Относительное снижение уровня экспрессии гена-мишени проиллюстрировано в нижеследующей таблице 14 для двух различных киРНК, направленных против гена-мишени C12orf35:
|
Кроме того, анализ BLAST (Basic Local Alignment Search Tool), основанный на имеющихся данных о геноме Homo sapiens, не указывал на какие-либо побочные эффекты.
Были трансфецированы нижеследующие клеточные линии: клеточная линия, происходящая от HEK293, была использована в качестве родительской клеточной линии. Указанная клеточная линия стабильно экспрессирует эндогенный C12orf35. Пул, полученный в результате стабильной трансфекции клеточной линии HEK293 экспрессионным вектором, кодирующим представляющий интерес рекомбинантный терапевтический белок, стабильно интегрированный в геном, использовали для определения функции киРНК. Экспрессионный вектор, присутствующий в указанном клеточном пуле, содержит селективные маркерные гены и рекомбинантный терапевтический белок. Пул, который рекомбинантно экспрессирует рекомбинантный белок, использовали для того, чтобы определить, может ли ингибирование C12orf35 приводить к повышению уровня экспрессии представляющего интерес полипептида. В случае такого повышения экспрессии может наблюдаться увеличение волюметрической продуктивности белка-мишени указанным клеточным клоном.
Пул, происходящий от HEK и содержащий экспрессионный вектор, стабильно интегрированный в геном, трансфецировали либо киРНК-контролем (не влияющим на экспрессию гена), либо одной из вышеупомянутых киРНК, направленных против C12orf35. После трансфекции киРНК был проведен анализ для того, чтобы определить, может ли снижение уровня экспрессии C12orf35 приводить к повышению уровня экспрессии рекомбинантного белка.
Результаты для различных тестируемых киРНК представлены в таблице 15. Клетки, происходящие от HEK293, трансфецировали в 6-луночном планшете соответствующими киРНК с использованием липофектамина 2000 в качестве трансфецирующего реагента. Через пять дней после трансфекции измеряли концентрацию рекомбинантного белка-мишени в супернатанте клеточной культуры с помощью аффинной ВЭЖХ. Для этой цели использовали короткую патентованную метку, присоединенную к представляющему интерес рекомбинантному белку. Повышение уровня экспрессии представляющего интерес белка может быть детектировано независимо от того, какую из двух оцениваемых киРНК использовали в данном случае. Длительное снижение уровня экспрессии гена C12orf35 посредством интерференции РНК может быть достигнуто, например, в случае стабильной интеграции этого гена в экспрессионный вектор, который экспрессирует РНКи-индуцирующий транскрипт. Кроме того, снижение или блокирование экспрессии гена C12orf35 может быть достигнуто путем нокаута гена или делеции/мутации гена. Кроме того, как описано в настоящей заявке, также может оказаться предпочтительным снижение или блокирование функции продукта экспрессии, например, путем введения одной или более мутаций, приводящего к продуцированию нефункционального или низкофункционального белка.
|
Кроме того, экспрессия гена C12orf35 была проанализирована после ингибирования с использованием киРНК 3 и 5 на день 3 и на день 5. Результаты представлены ниже в таблице 16.
|
Пример 8: Создание клеточных линий CHO с нокаутом гена C12orf35 после введения мутаций в ген C12orf35 со сдвигом рамки считывания
Три клеточных клона с нокаутом гена C12orf35 («KO»), происходящих от клеток CHO-K1, было создано с применением технологии TALEN, то есть, технологии с использованием эффекторных нуклеаз, подобных активатору транскрипции (Transcription Activator-Like Effector Nucleases). Для нокаута, ген C12orf35 таргетировали в 5’-области. Введение мутаций со сдвигом рамки считывания в 5’-область имеет то преимущество, что усеченный белок является коротким.
8.1. Конструирование/продуцирование и применение TALEN
Были сконструированы две усеченные нуклеазы TAL FokI, нацеленные на 5’-область. Каждая TALEN нацелена на 19 нуклеотидов и связывается с этими нуклеотидами на 5’ (прямой) ДНК-цепи или на 3’ (обратной) ДНК-цепи, соответственно. Эти два связывающих сайта разделены 16 нуклеотидами разрезающего сайта. Каждая сконструированная TAL была синтезирована и клонирована в вектор, подходящий для введения, и субклонирована в конечный вектор pcDNA3.3_DEST_A343. Описание продукта и методов имеется в Life Technology/GeneArt.
8.2. Трансфекция TALEN-плазмидами
Для трансфекции были использованы родительские клетки CHO в эспоненциальной фазе роста, жизнеспособность которых превышает 95%. Электропорацию (нуклеофекцию) осуществляли с применением технологии Amaxa™, Nucleofector™ Technology в соответствии с инструкциями производителей (Lonza). Трансфецированные клетки размножали на 5-й день после трансфекции, и на 8-й день выделяли одиночные клетки в 20×96-луночных планшетах. Моноклональность и конфлюэнтность регулировали на визуализаторе CloneSelectTM (Genetix).
8.3. Cel-I-анализ и стратегия скрининга
Cel-l-анализ осуществляли согласно руководству SAFC Biosciences. Cel-I-анализ представляет собой стандартный анализ для определения эффективности разрезания. Вкратце, после культивирования в течение 6 дней, геномную ДНК выделяли из клеток и проводили ПЦР с использованием нижеследующих праймеров:
Прямой: GCATCCAGTGAACTTACTTATCCAGAT (SEQ ID NO: 65)
Обратный: GCTCTGCCACTGCTGTTGAAAG (SEQ ID NO: 66)
Продукт амплификации денатурировали, а затем оставляли для ренатурации. После этого добавляли нуклеазу S и энхансер нуклеазы S, а затем инкубировали. Гидролизованный продукт анализировали. Было обнаружен присутствие двух менее крупных полос, что указывает на TALEN-активность в этой области генома, и следовательно, подтверждает, что клетки, в которых ген C12orf35 был модифицирован путем мутации, присутствовали в анализируемых клеточных пулах. Из большинства позитивных клеточных пулов (с более сильной интенсивностью двух менее крупных полос) в 96-луночных планшетах были отобраны отдельные клетки.
Геномную ДНК (гДНК) экстрагировали из каждого клона в 96-луночных планшетах с использованием наборов для ПЦР «Extract-N-AmpTM Blood PCR» (cat. XNAB2R, Sigma). Экстракты гДНК использовали для скрининга мутированных клонов в ПЦР-анализе, проводимом с использованием прямого праймера (Fwd) (SEQ ID NO 67: TGCTGGGATTAAAGGGGAAAGCTTT) в комбинации с праймером («Разрезающим праймером»), который связывается с разрезающим сайтом и имеет следующую последовательность:
Разрезающий праймер: TCTAGAAACAGACTGAGAATTTTGCAC (SEQ ID NO: 68)
Клоны с мутациями переносили в 125-миллилитровые шейкерные колбы и секвенировали. В указанных скрининг-анализах было идентифицировано 10 клонов, и три из них были отобраны для последующего анализа. Генотипы трех клонов представлены в таблице 17, где выделены 5’-последовательности C12orf35, соответствующие последовательностям дикого типа и последовательностям с мутациями. Соответствующие аминокислотные последовательности представлены в таблице 18.
|

Для подтверждения результатов экспериментов с использованием киРНК, антитело-кандидат экспрессировали в трех клеточных клонах с нокаутом C12orf35 путем культивирования периодической культуры и периодической культуры с подпиткой, а затем определяли волюметрические титры антител, и полученные результаты сравнивали с результатами для соответствующей клеточной линии CHO дикого типа, которая эндогенно экспрессирует интактный C12orf35.
8.4. Трансфекция mAb-кодирующим вектором
Клеточную линию CHO дикого типа, вышеописанные клеточные клоны C8DEL и клеточные клоны CHO с нокаутом C12orf35 (см. таблицы 17 и 18) трансфецировали экспрессионными векторами, содержащими полинуклеотиды, кодирующие моноклональные антитела (mAb) и два селективных маркерных гена, а именно, neo и DHFR. Были оценены два вектора, кодирующих два различных репрезентативных антитела (антитело 1 и антитело 2). Для трансфекции, клетки культивировали до экспоненциальной фазы роста, и 5×106 клеток трансфецировали 3 мкг ДНК-вектора. Трансфекцию осуществляли с тремя повторностями. Отбор клеток, стабильно трансфецированных векторами, кодирующими представляющий интерес белок, осуществляли с использованием G418 (концентрация G418 составляла 0,8 мг/мл), а затем с использованием MTX (500 нМ). Условия отбора были одинаковыми для всех пулов. В процессе отбора определяли волюметрические титры экспрессируемого mAb в среде. Волюметрический титр в супернатанте клонов с нокаутом C12orf35 сравнивали с волюметрическим титром СНО дикого типа. Клетки культивировали в шейкерных колбах, содержащих среду определенного химического состава. Культивирование периодической культуры осуществляли при температуре 37°C со встряхиванием. Во время культивирования периодической культуры с подпиткой, клетки выращивали в шейкерах, содержащих среду определенного химического состава, обогащенную аминокислотами. Культивирование периодической культуры с подпиткой осуществляли при температуре 37°C со встряхиванием, а затем, на 5-й день, температуру снижали до 33°C. Кроме того, в течение всего периода культивирования, в среду регулярно добавляли подпитку, содержащую глюкозу и аминокислоты. В процессе культивирования периодической культуры с подпиткой, образцы периодической культуры с подпиткой регулярно собирали для определения плотности жизнеспособных клеток (vcd) на анализаторе жизнеспособности клеток Vi-Cell (Beckman Coulter) и для определения титров белка в клеточной культуральной среде. По окончании культивирования периодической культуры и периодической культуры с подпиткой (день 14), процесс культивирования прекращали. Анализ периодической культуры и периодической культуры с подпиткой показал, что после культивирования в течение 14 дней, волюметрический титр экспрессируемого mAb в культуральной среде для пулов с нокаутом C12orf35 был аналогичен волюметрическому титру C8DEL и значительно превышал титр в культуральной среде для пулов клеток СНО дикого типа.
После первой стадии отбора (отбора с использованием G418), очень большое увеличение волюметрического титра (в 4-10 раз) было детектировано для стабильно трансфецированных пулов с нокаутом C12orf35, но не для стабильно трансфецированных родительских пулов. После второй стадии отбора (отбора с использованием MTX), пулы с нокаутом C12orf35 экспрессировали в 4-7 раз большее количество представляющего интерес полипептида по сравнению с трансфецированными родительскими клетками (периодическая культура) и в 2-6 раз большее количество полипептида (периодическая культура с подпиткой). Волюметрические титры пулов с нокаутом C12orf35, полученные с использованием G418 и MTX (в периодической культуре с подпиткой), по сравнению с родительской клеточной линией CHO, являются репрезентативными для двух экспериментов с антителами 1 и 2, данные которых представлены ниже в таблицах 19 и 20. В таблицах 19 и 20 представлены волюметрические титры пулов с нокаутом C12orf35, продуцируемых с использованием G418 и MTX в периодической культуре и в периодической культуре с подпиткой, по сравнению с титрами пулов родительских клеток (представлены в среднем 3 пула/среду).
|
|
Эти результаты подтверждают вывод, что утрата функции C12orf35 коррелирует с более высокой волюметрической продуктивностью.
Кроме того, стабильно трансфецированные пулы с нокаутом C12orf35 могут быть детектированы за меньший период времени отбора (стадии с использованием G418 и MTX), чем стабильно трансфецированные родительские пулы. Время отбора для пулов с нокаутом C12orf35 в среднем короче на 7 дней.
--->
Список последовательностей
<110> Novartis AG
<120> Новые эукариотические клетки и способы рекомбинантной экспрессии представляющего интерес продукта
<130> PAT056008-WO-PCT
<150> US 61/919313
<151> 2013-12-20
<160> 78
<170> PatentIn version 3.5
<210> 1
<211> 1547
<212> PRT
<213> Cricetulus griseus
<400> 1
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Tyr Ser Cys Arg Tyr
275 280 285
Gly Ser Gln His Val Gln Asn Ser Gln Ser Val Ser Arg His Leu Pro
290 295 300
Val Glu Val Pro Gln Ser Ser Glu Met His Ser Ser Glu Lys Lys Lys
305 310 315 320
Asp Ala Tyr Lys Val Phe Gln Gln Gln Trp Gln Ser Thr Ser Lys Asn
325 330 335
Val Ser Thr Ile Gly Lys Phe Cys Glu Leu Lys Ile Asn Thr Lys Gln
340 345 350
Ser Tyr Asn Asp Ser Ala Gly Ser Ser Gly Asp Gly Val His Thr Leu
355 360 365
Val Gln Asn Asn Gln Glu Glu Arg Lys Tyr Ser Tyr Asn Pro Ser Thr
370 375 380
Asn Gln Ile Leu Asp Thr Asn Val Thr Lys Glu Lys Leu Val Arg Asp
385 390 395 400
Ile Lys Ser Leu Val Glu Ile Lys Lys Lys Phe Ser Glu Leu Ala Arg
405 410 415
Lys Ile Lys Ile Asn Lys Lys Leu Leu Met Ala Ala Gly Cys Ser Lys
420 425 430
Thr Ala Asn Thr Ser Tyr Thr Glu Pro Thr Arg His Ser Glu Phe Ser
435 440 445
Ala Lys Glu Met Ser Ala Lys Arg Asp Asn Gln Cys Ser Met Glu Leu
450 455 460
Leu Ala Thr Cys Leu Ser Leu Trp Lys Asn Gln Pro Pro Lys Thr Thr
465 470 475 480
Glu Glu Asn Val Ser Lys Pro Leu Glu Glu Lys Gln Tyr Asn Ala Ser
485 490 495
Arg Thr Ser Thr Thr Ala Val Gly Pro Ser Asn Pro Met Asn Glu Val
500 505 510
His Val Lys Asn Phe Cys Ser Gly Val Arg Asn Ser Gln Lys Ile Thr
515 520 525
Thr Ser Ser Gln Thr Val Leu Ser Val Leu Thr Pro Val Tyr Asp Ser
530 535 540
Ser Asp Val Ala Val Gly Lys Gly Thr Glu Leu Gln Ile Ala Val Val
545 550 555 560
Ser Pro Leu Ile Leu Ser Asp Val Ser Thr Val Pro Gly Lys Glu Leu
565 570 575
Ala Pro Glu Val Val Ser Glu Thr Val Tyr Pro Val Val Lys Glu Gly
580 585 590
Ser Val Cys Ser Leu Gln Asn Gln Gln Ala Glu Asn Ala Thr Val Thr
595 600 605
Ala Gly Leu Pro Phe Asp Val Ile Arg Ala Val Ala Ser Ala Thr Val
610 615 620
Ser Ala Glu Leu Ser Leu Pro Gly His Lys Glu Lys Gln His Lys Pro
625 630 635 640
Thr Gln Ser Asp Leu Asp Ile Ala Asp Gly Ser Leu Gly Lys His Ser
645 650 655
Pro Gln Gly Ala Glu Ala Leu Pro Asn Pro Arg Asp Ser Thr Ile Val
660 665 670
Ser Gly Pro Ile Leu Gln Ile Glu Ser Ile Cys Ser Leu Ala Glu Gly
675 680 685
Asp Val Ser Tyr Asn Ser Gln Ile Ala Glu Ile Phe Asn Ser Val Gln
690 695 700
Asn Glu Pro Gln Lys Pro Ser Pro Asp Gln Gln Val Ile Asn Ser Gln
705 710 715 720
Gln Glu Glu Gln Val Asp Lys Val Ala Glu Asn Lys Asp Leu Ser Phe
725 730 735
Leu Lys Asp Lys Cys Met Gln Cys Thr Asp Val Pro His Glu Val Thr
740 745 750
Glu Gln Pro Glu Pro Leu Gln Pro Leu Glu Thr Thr Ser Asp Glu Tyr
755 760 765
Val Glu Ala Asn Gly Glu Ile Leu Glu Glu Ser Ser Lys Glu Asn Pro
770 775 780
Gly Glu Lys Glu Met Thr Lys Asp Ile Leu Cys Ser Pro Ala Ala Val
785 790 795 800
Gln Gln Asp Pro Gln Pro Gln Glu Ile Asp Thr Ala Ser Ser Lys Ser
805 810 815
Gly His Ser Phe Ser Thr Val Asn Glu Ile Asn Asp Glu Asn Glu Pro
820 825 830
Val Ser Tyr Leu His Asp Gln Leu Leu Glu Leu Leu Lys Glu Phe Pro
835 840 845
Tyr Gly Ile Glu Thr Ile Ala Arg Pro Glu Val Tyr Val Gly Gln Gln
850 855 860
Lys Thr His Glu Ile Leu Glu Asn Gln Thr Gly Ser Lys Thr Gly Asn
865 870 875 880
Val Ser Gly Asp Asn Thr Asp Gln Ile Lys Ile Thr Val Leu Asn Ser
885 890 895
Glu Gln Ile Lys Glu Leu Phe Pro Glu Glu Asp Gln Pro Cys Asp Val
900 905 910
Asp Lys Leu Ala Glu Pro Glu Asn Thr Lys Ile Ile Ala Glu Val Lys
915 920 925
Ser Leu Cys Asp Ser Gln Val Pro Arg Glu Glu Ser His Asn Pro Gly
930 935 940
Met Leu Asp Leu Glu Lys Asp Lys Ile His Cys Cys Ala Leu Gly Trp
945 950 955 960
Leu Ser Met Val Tyr Glu Gly Val Pro Gln Cys Gln Cys Ser Ser Met
965 970 975
Glu Glu Lys Glu Lys Asp Gln Cys Ser Leu Glu Ile Ser Asn Cys Lys
980 985 990
Gln Gly Glu Gln Ala Cys Asn Ser Gly Ile Thr Ile Phe Glu Ile Asn
995 1000 1005
Pro Ile Ser Asn Asn Ser Lys Ser Pro Leu Ile Gln Glu Ser Glu
1010 1015 1020
Lys Gly His Phe Ser Asp Ile His Gly Glu Lys Ile Lys Thr Ser
1025 1030 1035
Glu Thr Lys Asn Ser Ser Ser Pro Arg Val Glu Gln Glu Leu Thr
1040 1045 1050
Gly His Phe Ser Met Lys Cys Tyr Gln Lys Asp Lys Ser Thr Thr
1055 1060 1065
Lys Gln Asp Ser Ser Leu Lys Thr Glu Gln Lys Ile Lys Asn Leu
1070 1075 1080
Ser Ser Lys Cys Asp Lys Pro Asn Pro Leu Lys Ser Ser Lys Ile
1085 1090 1095
Pro Thr Pro Glu Thr Phe Asn Val Val Thr Ser Asn Ser Asp Lys
1100 1105 1110
Asn Met Pro Ala Phe Ser Lys Gln Asp Ser Gln Gly Ser Leu Gln
1115 1120 1125
Lys Lys His Leu Phe Gln Asp Ser Asp Pro Val Lys Gly His Val
1130 1135 1140
Trp Leu Leu Pro Asn Lys Asp Pro Arg Arg Arg Asn Thr Phe Leu
1145 1150 1155
Val Gln Ser Val Ser Pro Glu Lys Lys Lys Leu Lys Phe Lys Ser
1160 1165 1170
Gly Ser Ser Lys Leu Lys Tyr Phe Glu Lys Arg Lys Met Asp His
1175 1180 1185
Leu Leu Ile Ser Asp Val Glu Ile Lys Lys Lys Lys Tyr Glu Lys
1190 1195 1200
Gln Glu Gln Asn Lys Asn Ala Gly Gly Thr Leu Lys Leu Cys Ser
1205 1210 1215
Thr Leu Thr Glu Pro Asn Glu Arg Ala Cys Ala Lys Glu Lys Ile
1220 1225 1230
Val Thr Asn Ser Glu Pro Ser Asp Ser Lys Gly Ser Ser Ser Lys
1235 1240 1245
Ser Thr Arg Val Ile Thr Val Gln Glu Tyr Leu Gln Arg Lys Lys
1250 1255 1260
Asp Lys His Val Ile Gly Asn Asn Ala Ser Lys Asn Ile Cys Val
1265 1270 1275
Glu Asn Val Pro Cys Asp Ser Glu Pro Met Lys Ser Ser Lys His
1280 1285 1290
Ser Ala Ser Pro Ser Leu Gly Lys Leu Ile Glu Gly Gln Gly Val
1295 1300 1305
Ser Ala Glu Thr Leu Lys Glu Val Glu His Asn Ser Thr Ser His
1310 1315 1320
Gly Lys Asn Leu Lys Thr His Arg Ser Glu Glu Thr Arg Pro Tyr
1325 1330 1335
Ser Val Ser Asn Ser Lys Glu Lys Phe Tyr Arg Thr His Pro Asp
1340 1345 1350
Lys Ser Tyr Ile Asp Lys Ala Lys Leu Glu Arg Leu Thr Ser Met
1355 1360 1365
Ser Ser Lys Ser Ser Gln Leu Gln Val Lys Glu Lys Arg Lys Gln
1370 1375 1380
Tyr Leu Asn Arg Val Ala Phe Lys Cys Thr Glu Gln Glu Ser Ile
1385 1390 1395
Cys Leu Thr Lys Leu Asp Ser Ala Ser Lys Lys Leu Ser Lys Glu
1400 1405 1410
Lys Glu Lys Ser Thr Ala Cys Ala Pro Met Thr Lys Asp Tyr Thr
1415 1420 1425
His Lys Pro Met Leu Glu Phe Lys Leu Cys Pro Asp Val Leu Leu
1430 1435 1440
Lys Asn Thr Ser Ser Ile Asp Lys Gly Asp Asp Pro Arg Pro Gly
1445 1450 1455
Pro Glu Lys Glu Arg Ala Pro Val Gln Val Ser Gly Ile Lys Thr
1460 1465 1470
Thr Lys Glu Asp Trp Leu Lys Cys Ile Pro Thr Arg Thr Lys Met
1475 1480 1485
Pro Glu Ser Ser Glu Gln Thr Asp Arg Ala Asp Ser Arg Leu Ser
1490 1495 1500
Lys Arg Ser Phe Ser Ala Asp Glu Phe Glu Thr Leu Gln Asn Pro
1505 1510 1515
Val Lys Asp Ser Asn Val Met Phe Arg Thr Phe Lys Lys Met Tyr
1520 1525 1530
Leu Glu Lys Arg Ser Arg Ser Leu Gly Ser Ser Pro Val Lys
1535 1540 1545
<210> 2
<211> 1515
<212> PRT
<213> Cricetinae gen. sp.
<220>
<221> UNSURE
<222> (879)..(879)
<400> 2
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Tyr Ser Cys Arg Tyr
275 280 285
Gly Ser Gln His Val Gln Asn Ser Gln Ser Val Ser Arg His Leu Pro
290 295 300
Val Glu Val Pro Gln Ser Ser Glu Met His Ser Ser Glu Lys Lys Lys
305 310 315 320
Asp Ala Tyr Lys Val Phe Gln Gln Gln Trp Gln Ser Thr Ser Lys Asn
325 330 335
Val Ser Thr Ile Gly Lys Phe Cys Glu Leu Lys Ile Asn Thr Lys Gln
340 345 350
Ser Tyr Asn Asp Ser Ala Gly Ser Ser Gly Asp Gly Val His Thr Leu
355 360 365
Val Gln Asn Asn Gln Glu Glu Arg Lys Tyr Ser Tyr Asn Pro Ser Thr
370 375 380
Asn Gln Ile Leu Asp Thr Asn Val Thr Lys Glu Lys Leu Val Arg Asp
385 390 395 400
Ile Lys Ser Leu Val Glu Ile Ser Trp Ala Met Val Ala His Ser Glu
405 410 415
Phe Ser Ala Lys Glu Met Ser Ala Lys Arg Asp Asn Gln Cys Ser Met
420 425 430
Glu Leu Leu Ala Thr Cys Leu Ser Leu Trp Lys Asn Gln Pro Pro Lys
435 440 445
Thr Thr Glu Glu Asn Val Ser Lys Pro Leu Glu Glu Lys Gln Tyr Asn
450 455 460
Ala Ser Arg Thr Ser Thr Thr Ala Val Gly Pro Ser Asn Pro Met Asn
465 470 475 480
Glu Val His Val Lys Asn Phe Cys Ser Gly Val Arg Asn Ser Gln Lys
485 490 495
Ile Thr Thr Ser Ser Gln Thr Val Leu Ser Val Leu Thr Pro Val Tyr
500 505 510
Asp Ser Ser Asp Val Ala Val Gly Lys Gly Thr Glu Leu Gln Ile Ala
515 520 525
Val Val Ser Pro Leu Ile Leu Ser Asp Val Ser Thr Val Pro Gly Lys
530 535 540
Glu Leu Ala Pro Glu Val Val Ser Glu Thr Val Tyr Pro Val Val Lys
545 550 555 560
Glu Gly Ser Val Cys Ser Leu Gln Asn Gln Gln Ala Glu Asn Ala Thr
565 570 575
Val Thr Ala Gly Leu Pro Phe Asp Val Ile Arg Ala Val Ala Ser Ala
580 585 590
Thr Val Ser Ala Glu Leu Ser Leu Pro Gly His Lys Glu Lys Gln His
595 600 605
Lys Pro Thr Gln Thr Asp Leu Asp Thr Ala Asp Gly Ser Leu Gly Lys
610 615 620
His Ser Pro Gln Gly Ala Glu Ala Leu Pro Asn Pro Arg Asp Ser Thr
625 630 635 640
Ile Val Ser Gly Pro Ile Leu Gln Ile Glu Ser Ile Cys Ser Leu Ala
645 650 655
Glu Gly Asp Val Ser Tyr Asn Ser Gln Ile Ala Glu Ile Phe Asn Ser
660 665 670
Val Gln Asn Glu Pro Gln Lys Pro Ser Pro Asp Gln Gln Val Ile Asn
675 680 685
Ser Gln Gln Glu Glu Gln Val Asp Lys Val Ala Glu Asn Lys Asp Leu
690 695 700
Ser Phe Leu Lys Asp Lys Cys Met Gln Cys Thr Asp Val Pro His Glu
705 710 715 720
Val Thr Glu Gln Pro Glu Pro Leu Gln Pro Leu Glu Thr Thr Ser Asp
725 730 735
Glu Tyr Val Glu Ala Asn Gly Glu Ile Leu Glu Glu Ser Ser Lys Glu
740 745 750
Asn Pro Gly Glu Lys Glu Met Thr Lys Asp Ile Leu Cys Ser Pro Ala
755 760 765
Ala Val Gln Gln Asp Pro Gln Pro Gln Glu Ile Asp Thr Ala Ser Ser
770 775 780
Lys Ser Gly His Ser Phe Ser Thr Val Asn Glu Ile Asn Asp Glu Asn
785 790 795 800
Glu Pro Val Ser Tyr Leu His Asp Gln Leu Leu Glu Leu Leu Lys Glu
805 810 815
Phe Pro Tyr Gly Ile Glu Thr Ile Ala Arg Pro Glu Val Tyr Val Gly
820 825 830
Gln Gln Lys Thr His Glu Ile Leu Glu Asn Gln Thr Gly Ser Lys Thr
835 840 845
Gly Asn Val Ser Gly Asp Asn Thr Asp Gln Ile Lys Ile Thr Val Leu
850 855 860
Asn Ser Glu Gln Ile Lys Glu Leu Phe Pro Glu Glu Asp Gln Xaa Val
865 870 875 880
Asp Lys Leu Ala Glu Pro Glu Asn Thr Lys Ile Ile Ala Glu Val Lys
885 890 895
Ser Leu Cys Asp Ser Gln Val Pro Arg Glu Glu Ser His Asn Pro Gly
900 905 910
Met Leu Asp Leu Glu Lys Asp Lys Ile His Cys Cys Ala Leu Gly Trp
915 920 925
Leu Ser Met Val Tyr Glu Gly Val Pro Gln Cys Gln Cys Ser Ser Met
930 935 940
Glu Glu Lys Glu Lys Asp Gln Cys Ser Leu Glu Ile Ser Asn Cys Lys
945 950 955 960
Gln Gly Glu Gln Ala Cys Asn Ser Gly Ile Thr Ile Phe Glu Ile Asn
965 970 975
Pro Ile Ser Asn Asn Ser Lys Ser Pro Leu Ile Gln Glu Ser Glu Lys
980 985 990
Gly His Phe Ser Asp Ile His Gly Glu Lys Ile Lys Thr Ser Glu Thr
995 1000 1005
Lys Asn Ser Ser Ser Pro Arg Val Glu Gln Glu Leu Thr Gly His
1010 1015 1020
Phe Ser Met Lys Cys Tyr Gln Lys Asp Lys Ser Thr Thr Lys Gln
1025 1030 1035
Asp Ser Ser Leu Lys Thr Glu Gln Lys Ile Lys Asn Leu Ser Ser
1040 1045 1050
Lys Cys Asp Lys Pro Asn Pro Leu Lys Ser Ser Lys Ile Pro Thr
1055 1060 1065
Pro Glu Thr Phe Asn Val Val Thr Ser Asn Ser Asp Lys Asn Met
1070 1075 1080
Pro Ala Phe Ser Lys Gln Asp Ser Gln Gly Ser Leu Gln Lys Lys
1085 1090 1095
His Leu Phe Gln Asp Ser Asp Pro Val Lys Gly His Val Trp Leu
1100 1105 1110
Leu Pro Asn Lys Asp Pro Arg Arg Arg Asn Thr Phe Leu Val Gln
1115 1120 1125
Ser Val Ser Pro Glu Lys Lys Lys Leu Lys Phe Lys Ser Gly Ser
1130 1135 1140
Ser Lys Leu Lys Tyr Phe Glu Lys Arg Lys Met Asp His Leu Leu
1145 1150 1155
Ile Ser Asp Val Glu Ile Lys Lys Lys Lys Tyr Glu Lys Gln Glu
1160 1165 1170
Gln Asn Lys Asn Ala Gly Gly Thr Leu Lys Leu Cys Ser Thr Leu
1175 1180 1185
Thr Glu Pro Asn Glu Arg Ala Cys Ala Lys Glu Lys Ile Val Thr
1190 1195 1200
Asn Ser Glu Pro Ser Asp Ser Lys Gly Ser Ser Ser Lys Ser Thr
1205 1210 1215
Arg Val Ile Thr Val Gln Glu Tyr Leu Gln Arg Lys Lys Asp Lys
1220 1225 1230
His Val Ile Gly Asn Asn Ala Ser Lys Asn Ile Cys Val Glu Asn
1235 1240 1245
Val Pro Cys Asp Ser Glu Pro Met Lys Ser Ser Lys His Ser Ala
1250 1255 1260
Ser Pro Ser Leu Gly Lys Leu Ile Glu Gly Gln Gly Val Ser Ala
1265 1270 1275
Glu Thr Leu Lys Glu Val Glu His Asn Ser Ser Ser His Gly Lys
1280 1285 1290
Asn Leu Lys Thr His Arg Ser Glu Glu Thr Arg Pro Tyr Ser Val
1295 1300 1305
Ser Asn Ser Lys Glu Lys Phe Tyr Arg Thr His Pro Asp Lys Ser
1310 1315 1320
Tyr Ile Asp Lys Ala Lys Leu Glu Arg Leu Thr Ser Met Ser Ser
1325 1330 1335
Lys Ser Ser Gln Leu Gln Val Lys Glu Lys Arg Lys Gln Tyr Leu
1340 1345 1350
Asn Arg Val Ala Phe Lys Cys Thr Glu Gln Glu Ser Ile Cys Leu
1355 1360 1365
Thr Lys Leu Asp Ser Ala Ser Lys Lys Leu Ser Lys Glu Lys Glu
1370 1375 1380
Lys Ser Thr Ala Cys Ala Pro Met Thr Lys Asp Tyr Thr His Lys
1385 1390 1395
Pro Met Leu Glu Phe Lys Leu Cys Pro Asp Val Leu Leu Lys Asn
1400 1405 1410
Thr Ser Ser Ile Asp Lys Gly Asp Asp Pro Arg Pro Gly Pro Glu
1415 1420 1425
Lys Glu Arg Ala Pro Val Gln Val Ser Gly Ile Lys Thr Thr Lys
1430 1435 1440
Glu Asp Trp Leu Lys Cys Ile Pro Thr Arg Thr Lys Met Pro Glu
1445 1450 1455
Ser Ser Glu Gln Thr Asp Arg Ala Asp Ser Arg Leu Ser Lys Arg
1460 1465 1470
Ser Phe Ser Ala Asp Glu Phe Glu Thr Leu Gln Asn Pro Val Lys
1475 1480 1485
Asp Ser Asn Val Met Phe Arg Thr Phe Lys Lys Met Tyr Leu Glu
1490 1495 1500
Lys Arg Ser Arg Ser Leu Gly Ser Ser Pro Val Lys
1505 1510 1515
<210> 3
<211> 1747
<212> PRT
<213> Homo sapiens
<400> 3
Met Asn Trp Asn Glu Lys Pro Lys Ser Ala Thr Leu Pro Pro Leu Tyr
1 5 10 15
Pro Lys Ser Gln Pro Pro Phe Leu His Gln Ser Leu Ile Asn Gln Ile
20 25 30
Thr Thr Thr Ser Gln Ser Ser Phe Ser Tyr Pro Gly Ser Asn Gln Glu
35 40 45
Ala Cys Met Tyr Pro Gly Asn Ser Asn Pro Ile Ser Gln Pro Leu Leu
50 55 60
Asn Ile Gln Asn Tyr Pro Gln Gln Ile Ser Val Ser Asp Met His Asn
65 70 75 80
Gly Thr Val Val Ala Ser His Thr Ser Val Glu Arg Ile Thr Tyr Ala
85 90 95
Asn Val Asn Gly Pro Lys Gln Leu Thr His Asn Leu Gln Met Ser Ser
100 105 110
Gly Val Thr Gln Asn Val Trp Leu Asn Ser Pro Met Arg Asn Pro Val
115 120 125
His Ser His Ile Gly Ala Thr Val Ser His Gln Thr Asp Phe Gly Ala
130 135 140
Asn Val Pro Asn Met Pro Ala Leu Gln Ser Gln Leu Ile Thr Ser Asp
145 150 155 160
Thr Tyr Ser Met Gln Met Gln Met Ile Pro Ser Asn Ser Thr Arg Leu
165 170 175
Pro Val Ala Tyr Gln Gly Asn Gln Gly Leu Asn Gln Ser Phe Ser Glu
180 185 190
Gln Gln Val Asp Trp Thr Gln Gln Cys Ile Ser Lys Gly Leu Thr Tyr
195 200 205
Pro Asp Tyr Arg Pro Pro Pro Lys Leu Tyr Arg Tyr Ser Pro Gln Ser
210 215 220
Phe Leu Pro Asp Ser Thr Ile Gln Lys Gln Asn Phe Ile Pro His Thr
225 230 235 240
Ser Leu Gln Val Lys Asn Ser Gln Leu Leu Asn Ser Val Leu Thr Leu
245 250 255
Pro Ser Arg Gln Thr Ser Ala Val Pro Ser Gln Gln Tyr Ala Thr Gln
260 265 270
Thr Asp Lys Arg Pro Pro Pro Pro Pro Tyr Asn Cys Arg Tyr Gly Ser
275 280 285
Gln Pro Leu Gln Ser Thr Gln His Ile Thr Lys His Leu Ser Met Glu
290 295 300
Val Pro Gln Ser Arg Glu Met Leu Ser Ser Glu Ile Arg Thr Ser Phe
305 310 315 320
Gln Gln Gln Trp Gln Asn Pro Asn Glu Asn Val Ser Thr Ile Gly Asn
325 330 335
Phe Thr Asn Leu Lys Val Asn Thr Asn Ser Lys Gln Pro Phe Asn Ser
340 345 350
Pro Ile Arg Ser Ser Val Asp Gly Val Gln Thr Leu Ala Gln Thr Asn
355 360 365
Glu Glu Lys Ile Met Asp Ser Cys Asn Pro Thr Ser Asn Gln Val Leu
370 375 380
Asp Thr Ser Val Ala Lys Glu Lys Leu Val Arg Asp Ile Lys Thr Leu
385 390 395 400
Val Glu Ile Lys Gln Lys Phe Ser Glu Leu Ala Arg Lys Ile Lys Ile
405 410 415
Asn Lys Asp Leu Leu Met Ala Ala Gly Cys Ile Lys Met Thr Asn Thr
420 425 430
Ser Tyr Ser Glu Pro Ala Gln Asn Ser Lys Leu Ser Leu Lys Gln Thr
435 440 445
Ala Lys Ile Gln Ser Gly Pro Gln Ile Thr Pro Val Met Pro Glu Asn
450 455 460
Ala Glu Arg Gln Thr Pro Thr Val Val Glu Ser Ala Glu Thr Asn Lys
465 470 475 480
Thr Gln Cys Met Leu Asn Ser Asp Ile Gln Glu Val Asn Cys Arg Arg
485 490 495
Phe Asn Gln Val Asp Ser Val Leu Pro Asn Pro Val Tyr Ser Glu Lys
500 505 510
Arg Pro Met Pro Asp Ser Ser His Asp Val Lys Val Leu Thr Ser Lys
515 520 525
Thr Ser Ala Val Glu Met Thr Gln Ala Val Leu Asn Thr Gln Leu Ser
530 535 540
Ser Glu Asn Val Thr Lys Val Glu Gln Asn Ser Pro Ala Val Cys Glu
545 550 555 560
Thr Ile Ser Val Pro Lys Ser Met Ser Thr Glu Glu Tyr Lys Ser Lys
565 570 575
Ile Gln Asn Glu Asn Met Leu Leu Leu Ala Leu Leu Ser Gln Ala Arg
580 585 590
Lys Thr Gln Lys Thr Val Leu Lys Asp Ala Asn Gln Thr Ile Gln Asp
595 600 605
Ser Lys Pro Asp Ser Cys Glu Met Asn Pro Asn Thr Gln Met Thr Gly
610 615 620
Asn Gln Leu Asn Leu Lys Asn Met Glu Thr Pro Ser Thr Ser Asn Val
625 630 635 640
Ser Gly Arg Val Leu Asp Asn Ser Phe Cys Ser Gly Gln Glu Ser Ser
645 650 655
Thr Lys Gly Met Pro Ala Lys Ser Asp Ser Ser Cys Ser Met Glu Val
660 665 670
Leu Ala Thr Cys Leu Ser Leu Trp Lys Lys Gln Pro Ser Asp Thr Ala
675 680 685
Lys Glu Lys Glu Cys Asp Lys Leu Arg Thr Asn Thr Thr Ala Val Gly
690 695 700
Ile Ser Lys Pro Ala Asn Ile His Val Lys Ser Pro Cys Ser Val Val
705 710 715 720
Gly Asn Ser Asn Ser Gln Asn Lys Ile Ser Asn Pro Ser Gln Gln Thr
725 730 735
Ala Leu Ser Met Val Met His Asn Tyr Glu Ser Ser Gly Ile Asn Ile
740 745 750
Thr Lys Gly Thr Glu Leu Gln Ile Ala Val Val Ser Pro Leu Val Leu
755 760 765
Ser Glu Val Lys Thr Leu Ser Val Lys Gly Ile Thr Pro Ala Val Leu
770 775 780
Pro Glu Thr Val Tyr Pro Val Ile Lys Glu Gly Ser Val Cys Ser Leu
785 790 795 800
Gln Asn Gln Leu Ala Glu Asn Ala Lys Ala Thr Ala Ala Leu Lys Val
805 810 815
Asp Val Ser Gly Pro Val Ala Ser Thr Ala Thr Ser Thr Lys Ile Phe
820 825 830
Pro Leu Thr Gln Lys Glu Lys Gln Asn Glu Ser Thr Asn Gly Asn Ser
835 840 845
Glu Val Thr Pro Asn Val Asn Gln Gly Lys His Asn Lys Leu Glu Ser
850 855 860
Ala Ile His Ser Pro Met Asn Asp Gln Gln Ile Ser Gln Glu Ser Arg
865 870 875 880
Asn Ser Thr Val Val Ser Ser Asp Thr Leu Gln Ile Asp Asn Ile Cys
885 890 895
Ser Leu Val Glu Gly Asp Thr Ser Tyr Asn Ser Gln Ile Ala Lys Ile
900 905 910
Phe Ser Ser Leu Pro Leu Lys Met Val Glu Pro Gln Lys Pro Ser Leu
915 920 925
Pro Asn Gln Gln Gly Ile Gly Ser Arg Glu Pro Glu Lys Gln Leu Asp
930 935 940
Asn Thr Thr Glu Asn Lys Asp Phe Gly Phe Gln Lys Asp Lys Pro Val
945 950 955 960
Gln Cys Thr Asp Val Ser His Lys Ile Cys Asp Gln Ser Lys Ser Glu
965 970 975
Pro Pro Leu Glu Ser Ser Phe Asn Asn Leu Glu Thr Asn Arg Val Ile
980 985 990
Leu Glu Lys Ser Ser Leu Glu His Ala Thr Glu Lys Ser Thr Ala Asn
995 1000 1005
Asp Thr Cys Ser Ser Ala Ala Ile Gln Glu Asp Ile Tyr Pro Gln
1010 1015 1020
Glu Ile Asp Ala Ser Ser Asn Tyr Thr Pro Gln Asp Pro Ala Arg
1025 1030 1035
Asn Glu Ile His Ser Asp Lys Ala Pro Val Leu Tyr Leu His Asp
1040 1045 1050
Gln Leu Ser Glu Leu Leu Lys Glu Phe Pro Tyr Gly Ile Glu Ala
1055 1060 1065
Val Asn Thr Arg Glu Gly Ser Val Gly Gln Gln Thr Thr Tyr Gln
1070 1075 1080
Thr Ser Glu Asp Gln Thr Ala Asp Lys Thr Ser Ser Asp Ser Lys
1085 1090 1095
Asp Pro Ala Asp Gln Ile Gln Ile Thr Ile Leu Ser Ser Glu Gln
1100 1105 1110
Met Lys Glu Ile Phe Pro Glu Gln Asp Asp Gln Pro Tyr Val Val
1115 1120 1125
Asp Lys Leu Ala Glu Pro Gln Lys Glu Glu Pro Ile Thr Glu Val
1130 1135 1140
Val Ser Gln Cys Asp Leu Gln Ala Pro Ala Ala Gly Gln Ser Arg
1145 1150 1155
Asp Ser Val Ile Leu Asp Ser Glu Lys Asp Asp Ile His Cys Cys
1160 1165 1170
Ala Leu Gly Trp Leu Ser Met Val Tyr Glu Gly Val Pro Gln Cys
1175 1180 1185
Gln Cys Asn Ser Ile Lys Asn Ser Ser Ser Glu Glu Glu Lys Gln
1190 1195 1200
Lys Glu Gln Cys Ser Pro Leu Asp Thr Asn Ser Cys Lys Gln Gly
1205 1210 1215
Glu Arg Thr Ser Asp Arg Asp Val Thr Val Val Gln Phe Lys Ser
1220 1225 1230
Leu Val Asn Asn Pro Lys Thr Pro Pro Asp Gly Lys Ser His Phe
1235 1240 1245
Pro Glu Leu Gln Asp Asp Ser Arg Lys Asp Thr Pro Lys Thr Lys
1250 1255 1260
His Lys Ser Leu Pro Arg Thr Glu Gln Glu Leu Val Ala Gly Gln
1265 1270 1275
Phe Ser Ser Lys Cys Asp Lys Leu Asn Pro Leu Gln Asn His Lys
1280 1285 1290
Arg Lys Lys Leu Arg Phe His Glu Val Thr Phe His Ser Ser Asn
1295 1300 1305
Lys Met Thr Ala Ser Tyr Glu Gln Ala Ser Gln Glu Thr Arg Gln
1310 1315 1320
Lys Lys His Val Thr Gln Asn Ser Arg Pro Leu Lys Thr Lys Thr
1325 1330 1335
Ala Phe Leu Pro Asn Lys Asp Val Tyr Lys Lys His Ser Ser Leu
1340 1345 1350
Gly Gln Ser Leu Ser Pro Glu Lys Ile Lys Leu Lys Leu Lys Ser
1355 1360 1365
Val Ser Phe Lys Gln Lys Arg Lys Leu Asp Gln Gly Asn Val Leu
1370 1375 1380
Asp Met Glu Val Lys Lys Lys Lys His Asp Lys Gln Glu Gln Lys
1385 1390 1395
Gly Ser Val Gly Ala Thr Phe Lys Leu Gly Asp Ser Leu Ser Asn
1400 1405 1410
Pro Asn Glu Arg Ala Ile Val Lys Glu Lys Met Val Ser Asn Thr
1415 1420 1425
Lys Ser Val Asp Thr Lys Ala Ser Ser Ser Lys Phe Ser Arg Ile
1430 1435 1440
Leu Thr Pro Lys Glu Tyr Leu Gln Arg Gln Lys His Lys Glu Ala
1445 1450 1455
Leu Ser Asn Lys Ala Ser Lys Lys Ile Cys Val Lys Asn Val Pro
1460 1465 1470
Cys Asp Ser Glu His Met Arg Pro Ser Lys Leu Ala Val Gln Val
1475 1480 1485
Glu Ser Cys Gly Lys Ser Asn Glu Lys His Ser Ser Gly Val Gln
1490 1495 1500
Thr Ser Lys Glu Ser Leu Asn Gly Leu Thr Ser His Gly Lys Asn
1505 1510 1515
Leu Lys Ile His His Ser Gln Glu Ser Lys Thr Tyr Asn Ile Leu
1520 1525 1530
Arg Asn Val Lys Glu Lys Val Gly Gly Lys Gln Pro Asp Lys Ile
1535 1540 1545
Trp Ile Asp Lys Thr Lys Leu Asp Lys Leu Thr Asn Ile Ser Asn
1550 1555 1560
Glu Ala Gln Phe Ser Gln Met Pro Pro Gln Val Lys Asp Gln Lys
1565 1570 1575
Lys Leu Tyr Leu Asn Arg Val Gly Phe Lys Cys Thr Glu Arg Glu
1580 1585 1590
Ser Ile Ser Leu Thr Lys Leu Glu Ser Ser Pro Arg Lys Leu His
1595 1600 1605
Lys Asp Lys Arg Gln Glu Asn Lys His Lys Thr Phe Leu Pro Val
1610 1615 1620
Lys Gly Asn Thr Glu Lys Ser Asn Met Leu Glu Phe Lys Leu Cys
1625 1630 1635
Pro Asp Ile Leu Leu Lys Asn Thr Asn Ser Val Glu Glu Arg Lys
1640 1645 1650
Asp Val Lys Pro His Pro Arg Lys Glu Gln Ala Pro Leu Gln Val
1655 1660 1665
Ser Gly Ile Lys Ser Thr Lys Glu Asp Trp Leu Lys Phe Val Ala
1670 1675 1680
Thr Lys Lys Arg Thr Gln Lys Asp Ser Gln Glu Arg Asp Asn Val
1685 1690 1695
Asn Ser Arg Leu Ser Lys Arg Ser Phe Ser Ala Asp Gly Phe Glu
1700 1705 1710
Met Leu Gln Asn Pro Val Lys Asp Ser Lys Glu Met Phe Gln Thr
1715 1720 1725
Tyr Lys Gln Met Tyr Leu Glu Lys Arg Ser Arg Ser Leu Gly Ser
1730 1735 1740
Ser Pro Val Lys
1745
<210> 4
<211> 1747
<212> PRT
<213> Homo sapiens
<400> 4
Met Asn Trp Asn Glu Lys Pro Lys Ser Ala Thr Leu Pro Pro Leu Tyr
1 5 10 15
Pro Lys Ser Gln Pro Pro Phe Leu His Gln Ser Leu Ile Asn Gln Ile
20 25 30
Thr Thr Thr Ser Gln Ser Ser Phe Ser Tyr Pro Gly Ser Asn Gln Glu
35 40 45
Ala Cys Met Tyr Pro Gly Asn Ser Asn Pro Ile Ser Gln Pro Leu Leu
50 55 60
Asn Ile Gln Asn Tyr Pro Gln Gln Ile Ser Val Ser Asp Met His Asn
65 70 75 80
Gly Thr Val Val Ala Ser His Thr Ser Val Glu Arg Ile Thr Tyr Ala
85 90 95
Asn Val Asn Gly Pro Lys Gln Leu Thr His Asn Leu Gln Met Ser Ser
100 105 110
Gly Val Thr Gln Asn Val Trp Leu Asn Ser Pro Met Arg Asn Pro Val
115 120 125
His Ser His Ile Gly Ala Thr Val Ser His Gln Thr Asp Phe Gly Ala
130 135 140
Asn Val Pro Asn Met Pro Ala Leu Gln Ser Gln Leu Ile Thr Ser Asp
145 150 155 160
Thr Tyr Ser Met Gln Met Gln Met Ile Pro Ser Asn Ser Thr Arg Leu
165 170 175
Pro Val Ala Tyr Gln Gly Asn Gln Gly Leu Asn Gln Ser Phe Ser Glu
180 185 190
Gln Gln Val Asp Trp Thr Gln Gln Cys Ile Ser Lys Gly Leu Thr Tyr
195 200 205
Pro Asp Tyr Arg Pro Pro Pro Lys Leu Tyr Arg Tyr Ser Pro Gln Ser
210 215 220
Phe Leu Pro Asp Ser Thr Ile Gln Lys Gln Asn Phe Ile Pro His Thr
225 230 235 240
Ser Leu Gln Val Lys Asn Ser Gln Leu Leu Asn Ser Val Leu Thr Leu
245 250 255
Pro Ser Arg Gln Thr Ser Ala Val Pro Ser Gln Gln Tyr Ala Thr Gln
260 265 270
Thr Asp Lys Arg Pro Pro Pro Pro Pro Tyr Asn Cys Arg Tyr Gly Ser
275 280 285
Gln Pro Leu Gln Ser Thr Gln His Ile Thr Lys His Leu Ser Met Glu
290 295 300
Val Pro Gln Ser Arg Glu Met Leu Ser Ser Glu Ile Arg Thr Ser Phe
305 310 315 320
Gln Gln Gln Trp Gln Asn Pro Asn Glu Asn Val Ser Thr Ile Gly Asn
325 330 335
Phe Thr Asn Leu Lys Val Asn Thr Asn Ser Lys Gln Pro Phe Asn Ser
340 345 350
Pro Ile Arg Ser Ser Val Asp Gly Val Gln Thr Leu Ala Gln Thr Asn
355 360 365
Glu Glu Lys Ile Met Asp Ser Cys Asn Pro Thr Ser Asn Gln Val Leu
370 375 380
Asp Thr Ser Val Ala Lys Glu Lys Leu Val Arg Asp Ile Lys Thr Leu
385 390 395 400
Val Glu Ile Lys Gln Lys Phe Ser Glu Leu Ala Arg Lys Ile Lys Ile
405 410 415
Asn Lys Asp Leu Leu Met Ala Ala Gly Cys Ile Lys Met Thr Asn Thr
420 425 430
Ser Tyr Ser Glu Pro Ala Gln Asn Ser Lys Leu Ser Leu Lys Gln Thr
435 440 445
Ala Lys Ile Gln Ser Gly Pro Gln Ile Thr Pro Val Met Pro Glu Asn
450 455 460
Ala Glu Arg Gln Thr Pro Thr Val Val Glu Ser Ala Glu Thr Asn Lys
465 470 475 480
Thr Gln Cys Met Leu Asn Ser Asp Ile Gln Glu Val Asn Cys Arg Arg
485 490 495
Phe Asn Gln Val Asp Ser Val Leu Pro Asn Pro Val Tyr Ser Glu Lys
500 505 510
Arg Pro Met Pro Asp Pro Ser His Asp Val Lys Val Leu Thr Ser Lys
515 520 525
Thr Ser Ala Val Glu Met Thr Gln Ala Val Leu Asn Thr Gln Leu Ser
530 535 540
Ser Glu Asn Val Thr Lys Val Glu Gln Asn Ser Pro Ala Val Cys Glu
545 550 555 560
Thr Ile Ser Val Pro Lys Ser Met Ser Thr Glu Glu Tyr Lys Ser Lys
565 570 575
Ile Gln Asn Glu Asn Met Leu Leu Leu Ala Leu Leu Ser Gln Ala Arg
580 585 590
Lys Thr Gln Lys Thr Val Leu Lys Asp Ala Asn Gln Thr Ile Gln Asp
595 600 605
Ser Lys Pro Asp Ser Cys Glu Met Asn Pro Asn Thr Gln Met Thr Gly
610 615 620
Asn Gln Leu Asn Leu Lys Asn Met Glu Thr Pro Ser Thr Ser Asn Val
625 630 635 640
Ser Gly Arg Val Leu Asp Asn Ser Phe Cys Ser Gly Gln Glu Ser Ser
645 650 655
Thr Lys Gly Met Pro Ala Lys Ser Asp Ser Ser Cys Ser Met Glu Val
660 665 670
Leu Ala Thr Cys Leu Ser Leu Trp Lys Lys Gln Pro Ser Asp Thr Ala
675 680 685
Lys Glu Lys Glu Cys Asp Lys Leu Arg Thr Asn Thr Thr Ala Val Gly
690 695 700
Ile Ser Lys Pro Ala Asn Ile His Val Lys Ser Pro Cys Ser Val Val
705 710 715 720
Gly Asn Ser Asn Ser Gln Asn Lys Ile Ser Asn Pro Ser Gln Gln Thr
725 730 735
Ala Leu Ser Met Val Met His Asn Tyr Glu Ser Ser Gly Ile Asn Ile
740 745 750
Thr Lys Gly Thr Glu Leu Gln Ile Ala Val Val Ser Pro Leu Val Leu
755 760 765
Ser Glu Val Lys Thr Leu Ser Val Lys Gly Ile Thr Pro Ala Val Leu
770 775 780
Pro Glu Thr Val Tyr Pro Val Ile Lys Glu Gly Ser Val Cys Ser Leu
785 790 795 800
Gln Asn Gln Leu Ala Glu Asn Ala Lys Ala Thr Ala Ala Leu Lys Val
805 810 815
Asp Val Ser Gly Pro Val Ala Ser Thr Ala Thr Ser Thr Lys Ile Phe
820 825 830
Pro Leu Thr Gln Lys Glu Lys Gln Asn Glu Ser Thr Asn Gly Asn Ser
835 840 845
Glu Val Thr Pro Asn Val Asn Gln Gly Lys His Asn Lys Leu Glu Ser
850 855 860
Ala Ile His Ser Pro Met Asn Asp Gln Gln Ile Ser Gln Glu Ser Arg
865 870 875 880
Asn Ser Thr Val Val Ser Ser Asp Thr Leu Gln Ile Asp Asn Ile Cys
885 890 895
Ser Leu Val Glu Gly Asp Thr Ser Tyr Asn Ser Gln Ile Ala Lys Ile
900 905 910
Phe Ser Ser Leu Pro Leu Lys Met Val Glu Pro Gln Lys Pro Ser Leu
915 920 925
Pro Asn Gln Gln Gly Ile Gly Ser Arg Glu Pro Glu Lys Gln Leu Asp
930 935 940
Asn Thr Thr Glu Asn Lys Asp Phe Gly Phe Gln Lys Asp Lys Pro Val
945 950 955 960
Gln Cys Thr Asp Val Ser His Lys Ile Cys Asp Gln Ser Lys Ser Glu
965 970 975
Pro Pro Leu Glu Ser Ser Phe Asn Asn Leu Glu Thr Asn Arg Val Ile
980 985 990
Leu Glu Lys Ser Ser Leu Glu His Ala Thr Glu Lys Ser Thr Ala Asn
995 1000 1005
Asp Thr Cys Ser Ser Ala Ala Ile Gln Glu Asp Ile Tyr Pro Gln
1010 1015 1020
Glu Ile Asp Ala Ser Ser Asn Tyr Thr Pro Gln Asp Pro Ala Arg
1025 1030 1035
Asn Glu Ile His Ser Asp Lys Ala Pro Val Leu Tyr Leu His Asp
1040 1045 1050
Gln Leu Ser Glu Leu Leu Lys Glu Phe Pro Tyr Gly Ile Glu Ala
1055 1060 1065
Val Asn Thr Arg Glu Gly Ser Val Gly Gln Gln Thr Thr Tyr Gln
1070 1075 1080
Thr Ser Glu Asp Gln Thr Ala Asp Lys Thr Ser Ser Asp Ser Lys
1085 1090 1095
Asp Pro Ala Asp Gln Ile Gln Ile Thr Ile Leu Ser Ser Glu Gln
1100 1105 1110
Met Lys Glu Ile Phe Pro Glu Gln Asp Asp Gln Pro Tyr Val Val
1115 1120 1125
Asp Lys Leu Ala Glu Pro Gln Lys Glu Glu Pro Ile Thr Glu Val
1130 1135 1140
Val Ser Gln Cys Asp Leu Gln Ala Pro Ala Ala Gly Gln Ser Arg
1145 1150 1155
Asp Ser Val Ile Leu Asp Ser Glu Lys Asp Asp Ile His Cys Cys
1160 1165 1170
Ala Leu Gly Trp Leu Ser Met Val Tyr Glu Gly Val Pro Gln Cys
1175 1180 1185
Gln Cys Asn Ser Ile Lys Asn Ser Ser Ser Glu Glu Glu Lys Gln
1190 1195 1200
Lys Glu Gln Cys Ser Pro Leu Asp Thr Asn Ser Cys Lys Gln Gly
1205 1210 1215
Glu Arg Thr Ser Asp Arg Asp Val Thr Val Val Gln Phe Lys Ser
1220 1225 1230
Leu Val Asn Asn Pro Lys Thr Pro Pro Asp Gly Lys Ser His Phe
1235 1240 1245
Pro Glu Leu Gln Asp Asp Ser Arg Lys Asp Thr Pro Lys Thr Lys
1250 1255 1260
His Lys Ser Leu Pro Arg Thr Glu Gln Glu Leu Val Ala Gly Gln
1265 1270 1275
Phe Ser Ser Lys Cys Asp Lys Leu Asn Pro Leu Gln Asn His Lys
1280 1285 1290
Arg Lys Lys Leu Arg Phe His Glu Val Thr Phe His Ser Ser Asn
1295 1300 1305
Lys Met Thr Ala Ser Tyr Glu Gln Ala Ser Gln Glu Thr Arg Gln
1310 1315 1320
Lys Lys His Val Thr Gln Asn Ser Arg Pro Leu Lys Thr Lys Thr
1325 1330 1335
Ala Phe Leu Pro Asn Lys Asp Val Tyr Lys Lys His Ser Ser Leu
1340 1345 1350
Gly Gln Ser Leu Ser Pro Glu Lys Ile Lys Leu Lys Leu Lys Ser
1355 1360 1365
Val Ser Phe Lys Gln Lys Arg Lys Leu Asp Gln Gly Asn Val Leu
1370 1375 1380
Asp Met Glu Val Lys Lys Lys Lys His Asp Lys Gln Glu Gln Lys
1385 1390 1395
Gly Ser Val Gly Ala Thr Phe Lys Leu Gly Asp Ser Leu Ser Asn
1400 1405 1410
Pro Asn Glu Arg Ala Ile Val Lys Glu Lys Met Val Ser Asn Thr
1415 1420 1425
Lys Ser Val Asp Thr Lys Ala Ser Ser Ser Lys Phe Ser Arg Ile
1430 1435 1440
Leu Thr Pro Lys Glu Tyr Leu Gln Arg Gln Lys His Lys Glu Ala
1445 1450 1455
Leu Ser Asn Lys Ala Ser Lys Lys Ile Cys Val Lys Asn Val Pro
1460 1465 1470
Cys Asp Ser Glu His Met Arg Pro Ser Lys Leu Ala Val Gln Val
1475 1480 1485
Glu Ser Cys Gly Lys Ser Asn Glu Lys His Ser Ser Gly Val Gln
1490 1495 1500
Thr Ser Lys Glu Ser Leu Asn Gly Leu Thr Ser His Gly Lys Asn
1505 1510 1515
Leu Lys Ile His His Ser Gln Glu Ser Lys Thr Tyr Asn Ile Leu
1520 1525 1530
Arg Asn Val Lys Glu Lys Val Gly Gly Lys Gln Pro Asp Lys Ile
1535 1540 1545
Trp Ile Asp Lys Thr Lys Leu Asp Lys Leu Thr Asn Ile Ser Asn
1550 1555 1560
Glu Ala Gln Phe Ser Gln Met Pro Pro Gln Val Lys Asp Gln Lys
1565 1570 1575
Lys Leu Tyr Leu Asn Arg Val Gly Phe Lys Cys Thr Glu Arg Glu
1580 1585 1590
Ser Ile Ser Leu Thr Lys Leu Glu Ser Ser Pro Arg Lys Leu His
1595 1600 1605
Lys Asp Lys Arg Gln Glu Asn Lys His Lys Thr Phe Leu Pro Val
1610 1615 1620
Lys Gly Asn Thr Glu Lys Ser Asn Met Leu Glu Phe Lys Leu Cys
1625 1630 1635
Pro Asp Ile Leu Leu Lys Asn Thr Asn Ser Val Glu Glu Arg Lys
1640 1645 1650
Asp Val Lys Pro His Pro Arg Lys Glu Gln Ala Pro Leu Gln Val
1655 1660 1665
Ser Gly Ile Lys Ser Thr Lys Glu Asp Trp Leu Lys Phe Val Ala
1670 1675 1680
Thr Lys Lys Arg Thr Gln Lys Asp Ser Gln Glu Arg Asp Asn Val
1685 1690 1695
Asn Ser Arg Leu Ser Lys Arg Ser Phe Ser Ala Asp Gly Phe Glu
1700 1705 1710
Met Leu Gln Asn Pro Val Lys Asp Ser Lys Glu Met Phe Gln Thr
1715 1720 1725
Tyr Lys Gln Met Tyr Leu Glu Lys Arg Ser Arg Ser Leu Gly Ser
1730 1735 1740
Ser Pro Val Lys
1745
<210> 5
<211> 1521
<212> PRT
<213> Mus musculus
<400> 5
Met Asn Trp Asn Thr Lys Gln Glu Asn Val Pro Lys Pro Pro Pro Tyr
1 5 10 15
Ser Lys Thr Gln Ser Ser Ile Leu Gln His Phe Leu Met Thr Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Asn Tyr Ser Pro His Asn Gln Glu Ala Ser
35 40 45
Gln Thr Ser Phe Asn Tyr Ser Leu His Asn Gln Glu Ala Cys Met Tyr
50 55 60
Ser Gly Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Ser Gly Arg Asn
65 70 75 80
Tyr Ile Thr Pro Gln Thr Gln Ile Ser Val Ser Asn Met Pro Thr Arg
85 90 95
Thr Ile Val Ala Ser Gln Ser Ser Met Glu Arg Val Val Ser Thr Asn
100 105 110
Gly Lys Gly Pro Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
115 120 125
Gly Ile Met Gln Asn Val Trp Leu Pro Ser His Thr Glu Ala Thr Ile
130 135 140
Ser His Asn Pro Asp Gly Gly Thr Asn Met Pro Tyr Met His Pro Pro
145 150 155 160
Gln Asn Gln Leu Val Thr Ser Asp Thr Tyr Ser Met Gln Leu Gln Met
165 170 175
Ala Pro Leu His Ser Gly Lys Val Pro Met Thr His Gln Gly Ser Gln
180 185 190
Gly Leu Asn His Phe Ile Pro Asp Gln Leu Val Asp Trp Thr Gln Tyr
195 200 205
Thr Ser Asn Glu Leu Ser Tyr Pro Glu Tyr Arg Pro Pro Pro Lys Gln
210 215 220
Tyr Ser Tyr Ile Leu Pro Ala Thr Thr Ser Leu Gln Val Lys Asn Asn
225 230 235 240
Gln Leu Pro Thr Tyr Thr Gln Ser Leu Gln Ser Lys His Ser Val Pro
245 250 255
Leu Ser Ser His Gln Tyr Ala Ala Glu Ala Ser Lys Arg Leu Ser Ala
260 265 270
Leu Pro Tyr Ser Cys Arg Tyr Glu Asn Gln His Val Gln Asn Ala Gln
275 280 285
Pro Val Ser Lys His Leu Pro Met Glu Val Pro Gln Ser Ser Glu Val
290 295 300
His Ser Ser Glu Lys Lys Lys Asp Thr Tyr Arg Gly Phe Lys Gln Gln
305 310 315 320
Trp Gln Asn Pro Asn Glu Lys Val Ser Ile Gly Gln Phe Ser Glu Val
325 330 335
Lys Ile Asn Ile Lys Gln Pro Tyr Ser Glu Ser Val Arg Pro Ser Gly
340 345 350
Asp Gly Val Gln Ala Leu Val Gln Asn Asn Gln Glu Lys Arg Lys Tyr
355 360 365
Thr Tyr Asn Pro Asn Thr Asn Gln Val Ile Asp Thr Asn Ala Thr Lys
370 375 380
Glu Lys Leu Val Arg Asp Ile Lys Ser Leu Val Glu Ile Lys Lys Lys
385 390 395 400
Phe Ser Glu Leu Ala Arg Lys Ile Lys Ile Asn Lys Ser Leu Leu Met
405 410 415
Ala Ala Gly Cys Ser Lys Thr Ala Asn Thr Ser Tyr Thr Glu Pro Ile
420 425 430
Gln His Ser Glu Phe Ser Ala Lys Glu Met Ser Ala Lys Asn Gly Asn
435 440 445
Asp Cys Ser Met Glu Leu Leu Ala Thr Cys Leu Ser Leu Trp Lys Asn
450 455 460
Gln Pro Ser Lys Thr Thr Glu Glu Asn Val Pro Lys Pro Leu Glu Glu
465 470 475 480
Lys Gln Cys Asn Thr Ser Arg Ile Ser Thr Thr Val Val Gly Ser Ala
485 490 495
Asn Pro Thr Asn Glu Val His Val Lys Ser Leu Cys Ser Gly Val Gly
500 505 510
Asn Ser Gln Lys Met Met Ser Ser Ser Gln Thr Val Leu Pro Val Leu
515 520 525
Ile Pro Ser Cys Glu Ser Ser Gly Val Ala Val Gly Lys Gly Thr Glu
530 535 540
Leu Gln Ile Ala Val Val Ser Pro Leu Val Leu Ser Asp Thr Asn Thr
545 550 555 560
Leu Pro Gly Lys Asp Ser Val Pro Glu Val Leu Pro Glu Thr Leu Tyr
565 570 575
Pro Val Val Lys Glu Gly Ser Val Cys Ser Leu Gln Thr Gln Pro Thr
580 585 590
Glu Thr Val Ala Leu Pro Phe Asp Val Ile Gly Ala Val Ala Ser Asn
595 600 605
Asn Ile Ser Ala Glu Ile Pro Leu Pro Val Asp Lys Glu Lys Gln His
610 615 620
Lys Pro Ile Gln Gly Asp Pro Asp Ile Ala Asp Ser Ser Leu Gly Lys
625 630 635 640
His Ser Pro Leu Gly Thr Glu Val Leu Pro Lys Pro Met Asp Ser Thr
645 650 655
Ile Val Ser Gly Pro Met Leu Gln Ile Glu Ser Ile Cys Ser Leu Ala
660 665 670
Glu Gly Asp Val Ser Tyr Asn Ser Gln Ile Ala Glu Ile Phe Asn Ser
675 680 685
Val Gln Thr Glu Pro Gln Lys Pro Ser Pro Asn Gln Val Ile Asp Ser
690 695 700
Gln Gln Glu Gln Val Tyr Asp Thr Thr Glu Asn Lys Asp Phe Ser Leu
705 710 715 720
Gln Lys Asp Lys Cys Val Gln Cys Thr Asp Val Pro His Glu Val Pro
725 730 735
Glu Gln Pro Glu Pro Leu Gln Pro Glu Glu Pro Ala Ser Ser Glu Tyr
740 745 750
Val Glu Ala Asn Arg Glu Ala Thr Glu Glu Ser Cys Arg Glu Tyr Thr
755 760 765
Gly Arg Lys Glu Ser Thr Ala Lys Asp Val Cys Leu Pro Ala Ala Ile
770 775 780
Gln Gln Asp Pro His Pro Arg Glu Thr Asp Met Phe Ser Lys Ser Asp
785 790 795 800
His Ser Leu Pro Ala Ile Asn Glu Ile Asn Asp Glu Ser Glu Pro Ile
805 810 815
Ser Tyr Leu His Asp Gln Leu Ser Glu Leu Leu Lys Glu Phe Pro Tyr
820 825 830
Gly Ile Glu Thr Phe Asn Arg His Glu Val Ser Leu Asp Gln Gln Lys
835 840 845
Thr His Lys Ile Val Glu Asn Gln Thr Gly Gly Lys Thr Ser Asn Val
850 855 860
Ser Gly Asp Ser Thr Asp Gln Ile Lys Ile Thr Val Leu Asn Ser Glu
865 870 875 880
Gln Ile Lys Glu Leu Phe Pro Glu Asp Asp Gln Pro Cys Asp Lys Leu
885 890 895
Ala Glu Pro Glu Asn Lys Glu Ile Val Ala Glu Val Lys Ser Pro Cys
900 905 910
Asp Ser Gln Ile Pro Arg Glu Glu Ser His Asp Leu Gly Met Leu Asp
915 920 925
Pro Glu Lys Asp Lys Ile His Cys Cys Ala Leu Gly Trp Leu Ser Met
930 935 940
Val Tyr Glu Gly Val Pro Gln Cys His Cys Ser Ser Thr Glu Lys Lys
945 950 955 960
Glu Lys Asp Gln Cys Leu Asp Ile Asn Ser Ser Lys Gln Gly Glu Gln
965 970 975
Pro Cys Asn Ser Gly Ile Thr Ile Phe Glu Ile Asn Pro Val Ser Asn
980 985 990
Asn Ser Lys Thr Pro Leu Thr Gln Ala Thr Glu Glu Gly His Phe Ser
995 1000 1005
Ala Val His Gly Glu Lys Thr Lys Ala Ser Lys Thr Lys Asp Asn
1010 1015 1020
Arg Glu Gly Gln Glu Leu Ala Cys His Phe Ser Ala Lys Cys Tyr
1025 1030 1035
Lys Lys Asp Lys Lys Gly Asn Phe Lys Ile Arg His Asp Thr Ser
1040 1045 1050
Leu Lys Met Glu Gln Lys Leu Lys Asn Ile Ser Ser Lys Cys Asp
1055 1060 1065
Ile Pro Asn Pro Ser Lys Cys Asn Lys Ile Ala Ala Pro Glu Ile
1070 1075 1080
Leu His Val Thr Thr Ser Asn Ser Ala Lys Asn Met Pro Phe Ser
1085 1090 1095
Lys Gln Ala Ser Gln Glu Ser Leu Gln Lys Lys His Thr Ser Gln
1100 1105 1110
Asp Leu Gly Pro Val Lys Ala Pro Ile Glu Leu Ser Ser Asn Thr
1115 1120 1125
Asp Pro Cys Arg Ser Asn Thr Ser Ser Val Gln Ser Val Ser Pro
1130 1135 1140
Glu Lys Lys Lys Leu Lys Phe Lys Ala Gly Gly Ser Arg Leu Lys
1145 1150 1155
Tyr Phe Glu Lys Arg Lys Thr Asp His Val Ile Ile Pro Asp Val
1160 1165 1170
Glu Ile Lys Lys Lys Lys Tyr Glu Lys Gln Glu Gln Asn Lys Asn
1175 1180 1185
Ala Gly Asp Thr Leu Lys Leu Cys Ser Ile Leu Thr Glu Ser Asn
1190 1195 1200
Glu Arg Ala Ser Val Gln Glu Lys Thr Val Pro Ser Pro Glu Ser
1205 1210 1215
Ser Asp Pro Lys Gly Ser Ser Ser Lys Ser Thr Arg Val Ile Thr
1220 1225 1230
Val Gln Glu Tyr Leu Gln Arg Gln Lys Asp Lys Gln Ile Thr Gly
1235 1240 1245
Asn Asn Ala Ser Arg Asn Ile Cys Val Glu Thr Val Leu Cys Asp
1250 1255 1260
Ser Gly His Thr Lys Thr Ser Lys His Ser Ala Ala Val Ser Trp
1265 1270 1275
Gly Lys Leu Val Glu Gly Gln Ser Ile Ser Ala Glu Thr Ala Lys
1280 1285 1290
Glu Leu Glu His Asn Ser Ser Ser His Gly Lys Asp Phe Lys Ile
1295 1300 1305
His His Ser Glu Ala Ser Arg Thr His Ser Val Ser Asn Asn Asn
1310 1315 1320
Lys Gly Lys Phe Asp Gly Lys Gln Pro Asp Lys Met Phe Lys Asn
1325 1330 1335
Lys Thr Ser Met Asn Asn Glu Ser Asn Gln Met Pro Leu Gln Val
1340 1345 1350
Lys Glu Gln Arg Lys Gln Tyr Leu Asn Arg Val Ala Phe Lys Cys
1355 1360 1365
Thr Glu Arg Glu Ser Ile Cys Leu Thr Lys Leu Asp Ser Ala Ser
1370 1375 1380
Lys Lys Leu Ser Ile Glu Lys Lys Ser Gly Glu Tyr Thr Ser Lys
1385 1390 1395
Thr Lys Asp Thr Asp Lys Pro Ser Met Leu Glu Phe Lys Leu Cys
1400 1405 1410
Pro Asp Val Leu Leu Lys Asn Thr Ser Thr Val Asp Lys Gln Asp
1415 1420 1425
Cys Pro Gly Pro Gly Pro Glu Lys Glu Gln Ala Pro Val Gln Val
1430 1435 1440
Ser Gly Ile Lys Ser Thr Lys Glu Asp Trp Leu Lys Cys Ile Pro
1445 1450 1455
Thr Arg Thr Lys Met Pro Glu Ser Ser Gln Arg Asp Ser Ala Asp
1460 1465 1470
Ser Arg Leu Ser Lys Arg Ser Leu Ser Ala Asp Glu Phe Glu Ile
1475 1480 1485
Leu Gln Asn Pro Val Lys Glu Ser Asn Ile Met Phe Arg Thr Tyr
1490 1495 1500
Lys Lys Met Tyr Leu Glu Lys Arg Ser Arg Ser Leu Gly Ser Ser
1505 1510 1515
Pro Val Lys
1520
<210> 6
<211> 1741
<212> PRT
<213> Bos taurus
<400> 6
Met Asn Trp Asn Ala Lys Pro Glu Ser Val Thr Leu Pro Pro Gln Tyr
1 5 10 15
Pro Lys Lys Gln Ala Ser Phe Leu Glu Gln Gly Leu Val Asn Thr Leu
20 25 30
Ser Thr Thr Ser Gln Ser Ser Phe His Thr Gly Ser Asn Gln Glu Pro
35 40 45
Cys Leu Phe Leu Ser Asn Ser His Pro Val Ser Gln Pro Leu Leu Asn
50 55 60
Ile Arg Asn His Lys Thr Pro Pro Gln Ile Pro Ile Ser Asp Leu His
65 70 75 80
Ser Gly Thr Ile Val Thr Ser Gln Thr Ser Val Glu Arg Ile Thr Tyr
85 90 95
Ala Asn Val Lys Gly Pro Lys Gln Leu Ser His Asp Leu Gln Ile Ser
100 105 110
Ser Gly Val Thr Pro Asp Val Trp Leu Asn Ser Pro Met Gly Ser Ser
115 120 125
Thr Leu Ser His Thr Gly Ala Thr Val Ser His Gln Thr Gly Phe Gly
130 135 140
Thr Asn Val Pro Asn Val His Ala Leu Gln Asn Gln Phe Leu Thr Ser
145 150 155 160
Asp Thr Tyr Ser Met Gln Leu His Met Ile Pro Ser Asn Ser Gly Arg
165 170 175
Val Pro Ile Thr Tyr Gln Gly Asn Thr Arg Leu Asn Leu Pro Leu Ser
180 185 190
Glu Gln Gln Val Asp Trp Ala Pro Gln Arg Ala Ser Ser Gly Leu Thr
195 200 205
Tyr Gln Asp Tyr Arg Pro Leu Pro Lys Gln Tyr Asn Tyr Ser Pro Arg
210 215 220
Ser Phe Leu Gln Glu Pro Ala Leu Gln Lys Gln Asn Ala Met Ser Ser
225 230 235 240
Val Ser Phe Gln Val Lys Asn Asn Gln Ser Pro Asn Pro Ala Leu Thr
245 250 255
Phe Lys Ser Lys Gln Ile Ala Ala Val Pro Ser Tyr Gln Tyr Ala Val
260 265 270
Thr Gln Thr Asp Lys Arg Pro Pro Pro Pro Tyr Asp Cys Arg Tyr Ala
275 280 285
Ser Gln Ser Leu Gln Ser Thr Pro Arg Val Val Lys Gln Ser Ser Met
290 295 300
Glu Val Pro Gln Ser Gln Glu Met His Leu Pro Glu Met Arg Lys Asp
305 310 315 320
Phe Cys Arg Asp Phe Gln Gln Gln Trp Gln Asn Leu Asn Glu Asn Phe
325 330 335
Ser Met Met Gly Gly Ser Cys Asn Leu Lys Val Asn Thr Ser Val Asn
340 345 350
His Pro Phe Asn Glu Pro Val Arg Ser Ser Val Thr Gly Ala Gln Ala
355 360 365
Leu Ala Gln Asn Asn Gln Glu Arg Thr Val Asp Ser Gln Asn Leu Thr
370 375 380
Ser Asn Gln Ala Leu Asp Thr Ser Ala Thr Lys Glu Lys Leu Val Arg
385 390 395 400
Asp Ile Lys Thr Leu Val Glu Ile Lys Lys Lys Phe Ser Asp Leu Ala
405 410 415
Arg Lys Ile Lys Ile Asn Lys Ser Leu Leu Met Ala Ala Gly Cys Ile
420 425 430
Lys Thr Pro Asn Thr Ser Tyr Ser Glu Ser Ala Gln Asn Ser Gly Leu
435 440 445
Ser Leu Lys Gln Thr Ala Lys Ile Gln Ser Glu Pro Gln Leu Thr Leu
450 455 460
Val Thr Pro Glu Ile Val Glu Asp Lys Pro Pro Thr Val Met Glu Ser
465 470 475 480
Ala Glu Glu Thr Asn Arg Pro Gln Arg Val Leu Ser Ser Asn Leu Gln
485 490 495
Asp Arg Asn Phe Asn Gln Val Ser Ser Val Ser Leu Asn Ser Ala Cys
500 505 510
Ser Glu Lys Leu Pro Ile Pro Glu Gln Val His Asp Leu Glu Val Val
515 520 525
Asn Ser Leu Lys Thr Ser Thr Val Glu Val Thr Gln Ala Pro Leu Asn
530 535 540
Asn Thr Gln Leu Ser Ser Gly Asn Ser Val Ser Ile Ala Gln Asn Val
545 550 555 560
Pro Thr Asn Ser Glu Val Thr Phe Leu Pro His Ser Thr Ser Ser Glu
565 570 575
Glu Tyr Ile Ser Lys Tyr Pro Asn Lys Asn Arg Leu Ile Leu Ser Leu
580 585 590
Leu Thr Ser Gly Ser Lys Thr Gln Lys Lys Leu Leu Lys Asp Thr Gly
595 600 605
Glu Cys Ile His Asp Ser Lys Leu His Asn Phe Glu Met Asn Ala Asn
610 615 620
Thr Glu Asn Thr Gly Asn Gln Leu Lys Thr Thr Glu Thr Val Asn Leu
625 630 635 640
Pro Arg Thr Cys Asn Arg Asn Ala Lys Val Ala Asp Thr Ser Cys Leu
645 650 655
Glu Cys Lys Ser Phe Asn Gly Val Ser Ser Asn Ser Gly Ser Arg Phe
660 665 670
Ser Met Glu Leu Leu Ala Thr Cys Leu Ser Leu Trp Lys Lys Gln Pro
675 680 685
Ser Glu Pro Thr Lys Glu Lys Gln Asp Asn Glu Ser Lys Thr Asn Ile
690 695 700
Thr Ala Ile Ala Val Ser Lys Pro Ala Pro Ile Cys Glu Ser Ser Pro
705 710 715 720
Phe Ser Pro Val Gly Asn Ser Gln Asn Lys Ile Val Asn Ser Ser Leu
725 730 735
Glu Thr Ile Ser Ser Val Val Ala Gln Asn Tyr Glu Ser Ser Gly Thr
740 745 750
Thr Thr Thr Lys Gly Ile Ala Val Val Ser Pro Leu Ile Leu Ser Asp
755 760 765
Val Asn Thr Leu Ser Val Lys Asp Thr Thr Ser Glu Ala Leu Pro Glu
770 775 780
Met Val Tyr Pro Val Ile Lys Glu Gly Ser Val Cys Ser Leu Gln Asn
785 790 795 800
Lys Leu Thr Glu Asn Thr Ala Ala Leu Lys Ile Asn Val Asn Glu Pro
805 810 815
Val Thr Ser Thr Thr Gly Ile Met Ile Phe Pro Leu Ile Glu Asp Lys
820 825 830
Gln Ser Glu Ser Thr Asn Thr Asn Ser Glu Gly Ile Pro Asn Thr Asn
835 840 845
Gln Gly Lys His Asn Glu Ser Glu Pro Asp Ile Gln Cys Pro Val Ser
850 855 860
Asp Gln Gln Thr Ser Tyr Ile Ser Lys Asp Ser Ser Ser Val Gly Ser
865 870 875 880
Asp Val Leu Gln Ile Gly Ser Ile Cys Ser Leu Val Glu Gly Asp Thr
885 890 895
Ser Tyr Asp Ser Gln Ile Ala Glu Ile Phe Asn Leu Leu Pro Leu Gln
900 905 910
Lys Val Glu Pro Gln Lys Pro Leu Pro Asn His Gln Met Met Ser Ser
915 920 925
Arg Gln Gln Asn Glu His Leu Glu Asn Ile Thr Glu Ser Lys Asp Phe
930 935 940
Asp Phe Lys Lys Asp Glu Phe Val Gln Cys Thr Asp Val Ser Asn Lys
945 950 955 960
Ile Thr Asp Gln Ser Glu Ser Leu Gln Leu Pro Ala Leu Ser Pro Leu
965 970 975
Lys Cys Val Glu Ala Lys Ser Gly Ile Leu Glu Glu Gly Ser Leu Glu
980 985 990
His Ile Thr Glu Asn Glu Ser Met Ala Asn Asp Thr Cys Ser Ser Ala
995 1000 1005
Ala Thr Gln Gln Asp Ser Tyr Pro Gln Glu Ala Asp Thr Ser Cys
1010 1015 1020
Ser Tyr Thr Glu Gln Asp Pro Thr Thr Asp Glu Ser Leu His Asp
1025 1030 1035
Lys Thr Ser Ile Leu Tyr Leu His Asp Gln Leu Ser Glu Leu Leu
1040 1045 1050
Lys Glu Phe Pro Tyr Gly Ile Glu Pro Val Asn Met His Glu Ser
1055 1060 1065
Ser Val Val Gln Gln Met Ala Asn Gln Ile Ser Glu Ala Gln Thr
1070 1075 1080
Cys Gly Lys Thr Asp Cys Asp Ser Lys Gly Ser Thr Asp Gln Ile
1085 1090 1095
Gln Ile Thr Ile Leu Asn Thr Asp Gln Met Lys Glu Leu Phe Pro
1100 1105 1110
Glu Gln Asp Asp Gln Pro Ser Glu Val Asp Lys Leu Thr Glu Pro
1115 1120 1125
Gln Lys Glu Lys Pro Val Thr Lys Glu Glu Lys Gln Cys Asp Pro
1130 1135 1140
Gln Ala Cys Arg Val Glu Glu Arg Cys Ala Ser Val Pro Leu Asp
1145 1150 1155
Ser Glu Lys Asp Asp Ile Arg Cys Cys Ala Leu Gly Trp Leu Ser
1160 1165 1170
Met Val Tyr Glu Gly Val Pro Gln Cys Gln Cys Asn Ser Ile Lys
1175 1180 1185
Lys Ser Asp Ser Lys Glu Lys Lys Gln Ile Asn Pro Cys Ser Pro
1190 1195 1200
Ser Glu Ala Lys Ser Tyr Lys Gln Gly Glu Arg Thr Ser Asp Arg
1205 1210 1215
Asp Val Pro Val Ala Leu Asn Ser Pro Pro Asn Asn Pro Pro Lys
1220 1225 1230
Ser Pro Leu Thr Ser Ser Val Glu Lys Lys His Phe Pro Glu Thr
1235 1240 1245
Lys Gln Ser Ser Asn Ile Lys Asp Lys Ser Lys Thr Glu Arg Asn
1250 1255 1260
Ser Ser Leu Arg Thr Glu Gln Glu Leu Ser Gly Gln Leu Leu Ser
1265 1270 1275
Lys Gly Asp Lys Lys Leu Asp Ser Leu Gln Ser His Lys Arg Lys
1280 1285 1290
Arg Asn Leu Gln Phe His Glu Val Asn Phe Asn Ser Ala Asn Lys
1295 1300 1305
Ile Thr Lys Phe Ser Gln Glu Ser Leu Gln Arg Lys Phe Met Ala
1310 1315 1320
Gln Asn Leu Gly Pro Leu Lys Pro Lys Met Ser Phe Leu Thr Ser
1325 1330 1335
Lys Thr Lys Asp Leu Asn Met Lys Asn Gly Ser Ser Val Gln Ser
1340 1345 1350
Val Ser Pro Glu Lys Arg Lys Leu Lys Ser Ala Gly Ser Lys Gln
1355 1360 1365
Lys Ser Leu Glu Glu Arg Lys Leu Asp Glu Gly Ile Thr Leu Asp
1370 1375 1380
Ser Glu Ile Lys Arg Lys Lys His Asp Lys Gln Glu Gln Asn Lys
1385 1390 1395
Asn Val Gly Gly Gly Ala Phe Lys Phe Cys Asn Phe Ser Thr Pro
1400 1405 1410
Asn Glu Arg Ala Trp Ile Lys Glu Lys Thr Val Ser Asn Val Lys
1415 1420 1425
Ser Ser Gly Ser Lys Asp Ser Ser Ser Lys Met Asn Arg Val Leu
1430 1435 1440
Ser Pro Lys Glu Tyr Leu Ser Arg Gln Lys His Lys Glu Ala Leu
1445 1450 1455
Lys Lys Asn Tyr Leu Lys Asn Ser Asp Ser Gln Tyr Met Arg Pro
1460 1465 1470
Ser Lys Leu Ser Val Gln Val Glu Ser Ser Gly Lys Ser Asn Glu
1475 1480 1485
Arg Pro Asn Gly Ser Val Gln Thr Cys Lys Glu Ser Leu Asn Ile
1490 1495 1500
Gly Thr Gly His Gly Lys Ser Ile Lys Thr His His Ser Lys Glu
1505 1510 1515
Ser Lys Thr Tyr Ile Ser Arg Asn Ile Lys Gly Thr Val Gly Gly
1520 1525 1530
Lys Gln Ser Asp Lys Met Trp Ile Asp Arg Thr Lys Leu Asp Lys
1535 1540 1545
Asn Leu Asn Asn Ile Asn Asn Glu Gly Glu Leu Ser Gln Met Ser
1550 1555 1560
Ser Gln Thr Lys Asp Gln Arg Lys Leu Tyr Leu Asn Arg Val Ala
1565 1570 1575
Phe Lys Cys Thr Glu Arg Glu Arg Ile Cys Leu Thr Lys Leu Asp
1580 1585 1590
Asn Ser Pro Arg Lys Leu Lys Glu Lys Arg Pro Glu Ser Lys Cys
1595 1600 1605
Lys Asn Pro Leu Pro Val Lys Asp Thr Thr Glu Lys Leu Ser Met
1610 1615 1620
Leu Glu Phe Lys Leu Cys Pro Asp Gly Val Phe Lys Asn Thr Asn
1625 1630 1635
Thr Val Glu Asp Gln Lys Asp Leu Gln His Thr Pro Arg Lys Glu
1640 1645 1650
Gln Ala Pro Val Gln Val Ser Gly Ile Lys Ser Thr Lys Glu Asp
1655 1660 1665
Trp Leu Lys Cys Val Thr Glu Glu Lys Arg Met Pro Glu Ala Asn
1670 1675 1680
Gln Glu Ile Asp Asp Asn Val Leu Ala Asn Ser Arg Leu Ser Lys
1685 1690 1695
Arg Asn Cys Ser Ala Asp Gly Phe Glu Ile Leu Gln Asn Pro Val
1700 1705 1710
Lys Asp Ser Lys Ala Met Phe Gln Thr Tyr Lys Lys Leu Tyr Met
1715 1720 1725
Glu Lys Arg Ser Arg Ser Leu Gly Ser Ser Pro Leu Glu
1730 1735 1740
<210> 7
<211> 1746
<212> PRT
<213> Sus scrofa
<400> 7
Met Asn Trp Asn Ala Lys Pro Glu Ser Val Thr Leu Pro Pro Gln Tyr
1 5 10 15
Pro Arg Lys Gln Thr Ser Phe Leu Glu Gln Ala Leu Val Ser Thr Leu
20 25 30
Thr Thr Ser Gln Ser Pro Leu Asn His Pro Gly Ser Asn Gln Glu Ala
35 40 45
Cys Leu Phe Leu Ser Asn Ser Asn Pro Val Ser Gln Pro Leu Leu Asn
50 55 60
Asn Arg Asn Tyr Lys Thr Pro Gln Gln Ile Pro Ile Ser Asp Met His
65 70 75 80
Ser Gly Thr Ile Val Thr Ser Gln Thr Ser Val Glu Arg Ile Thr Tyr
85 90 95
Thr Asn Val Lys Gly Pro Lys Gln Leu Asn Gln Asp Leu Gln Val Ser
100 105 110
Ser Gly Val Thr Gln Asp Met Trp Leu Asn Ser Pro Met Arg Asn Ser
115 120 125
Met Leu Ser His Thr Gly Ala Thr Val Ser His Gln Thr Gly Phe Gly
130 135 140
Thr Asn Pro Pro Asn Val His Ala Leu Gln Asn Gln Phe Val Thr Ser
145 150 155 160
Asp Thr Tyr Ser Met Gln Leu Gln Met Met Pro Ser Asn Ser Gly Arg
165 170 175
Ala Pro Ile Thr Tyr Gln Asp Asn Pro Arg Leu Asn Pro Pro Leu Ser
180 185 190
Glu Gln Gln Val Asp Trp Pro Gln Gln Cys Ala Ser Ser Gly Leu Ala
195 200 205
Tyr Pro Asn Tyr Arg Pro Leu Pro Lys Gln Tyr Gly Tyr Ser Ser Arg
210 215 220
Ser Phe Val Gln Gly Pro Thr Leu Pro Lys Gln Asn Thr Met Ser Ala
225 230 235 240
Gly Ser Leu Gln Val Lys Asn Ser Pro Ser Pro Asn Pro Val Leu Pro
245 250 255
Leu Gln Ser Lys Gln Ile Ala Thr Ile Pro Ser Tyr Gln Tyr Ala Val
260 265 270
Thr His Thr Asp Glu Arg Pro Pro Pro Pro Tyr Asp Cys Arg Tyr Ala
275 280 285
Ser Gln Pro Leu Gln Ser Ile Gln His Val Val Lys Arg Ser Ser Met
290 295 300
Asp Gly Pro Gln Thr Gln Glu Met Tyr Leu Pro Glu Met Gly Lys Asp
305 310 315 320
Phe Cys Arg Gly Phe Gln Gln Gln Trp Gln Asn Ser Asn Glu Asn Phe
325 330 335
Ser Met Met Gly Asn Thr Cys Asn Leu Lys Val Asn Thr Asn Val Gly
340 345 350
Gln Pro Phe Asn Arg Pro Val Arg Ser Ser Leu Asp Ser Val Gln Ala
355 360 365
Leu Gly Gln Asn Thr Gln Glu Lys Arg Val Asp Ser Gly Asn Leu Thr
370 375 380
Ser Asn Gln Val Leu Asp Thr Arg Ala Lys Lys Lys Lys Leu Val Arg
385 390 395 400
Asp Ile Lys Thr Leu Val Glu Ile Lys Lys Lys Phe Ser Asp Leu Ala
405 410 415
Arg Lys Ile Lys Ile Asn Lys Ser Leu Leu Met Ala Ala Gly Cys Ile
420 425 430
Lys Thr Thr Ser Ser Pro Tyr Ser Asn Thr Ala Gln Asn Ser Gln Phe
435 440 445
Ser Leu Lys Gln Thr Ala Lys Val Gln Cys Gly Pro Gln Val Thr Ile
450 455 460
Val Thr Pro Glu Thr Met Glu Asn Lys Ser Pro Ile Val Met Glu Ser
465 470 475 480
Ser Glu Val Ala Asn Lys Thr His Ser Pro Ser Asn Ser Asn Leu Gln
485 490 495
Asp Arg His Phe Asn Gln Val Ser Ser Val Leu Leu Asn Ser Val Pro
500 505 510
Ser Glu Lys Leu Pro Ile Pro Glu Gln Leu Arg Asp Leu Lys Val Val
515 520 525
Thr Ser Ser Lys Met Ser Thr Val Glu Ile Pro His Ala Thr Ser Asn
530 535 540
Asn Ile Gln Phe Ser Ser Gly Asn Leu Val Asn Ser Thr Lys Asn Val
545 550 555 560
Pro Ala His Ser Glu Thr Thr Pro Leu Pro Gln Phe Met Thr Phe Glu
565 570 575
Glu Tyr Ile Ser Lys His Pro Asn Lys Asn Arg Leu Val Leu Ser Leu
580 585 590
Leu Ala Pro Gly Gly Lys Ile Glu Arg Lys Leu Leu Lys Asp Thr Ile
595 600 605
Glu Thr Val Lys Asp Ser Lys Met Arg Ser Ser Asp Val Asn Pro Asn
610 615 620
Thr Thr Asn Thr Gly Asn Leu Met Asn Leu Lys Thr Val Glu Thr Ala
625 630 635 640
Ser Ala Cys Asn Ile Asn Ala Lys Ile Ser Asp Asn Ser Ser Gly Phe
645 650 655
Glu His Lys Ser Leu Asn Gly Met Ser Ser Lys Ser Asp Ser His Phe
660 665 670
Ser Met Glu Leu Leu Ala Thr Cys Leu Ser Leu Trp Lys Lys Gln Pro
675 680 685
Ser Glu Pro Thr Val Glu Lys Gln Ser Asn Glu Ser Lys Thr Asn Arg
690 695 700
Ala Ala Ala Gly Val Ser Lys Pro Val Glu Val Cys Glu Thr Ser Pro
705 710 715 720
Phe Ser Ala Val Gly Asn Ser Gln Asn Lys Val Thr Ser Ser Ser Gln
725 730 735
Glu Thr Val Leu Ser Met Val Thr Gln Asn Phe Glu Ser Ser Gly Ser
740 745 750
Thr Thr Thr Lys Gly Ile Ala Val Val Ser Pro Leu Ile Leu Ser Asp
755 760 765
Val Lys Thr Leu Ser Val Lys Gly Ile Thr Pro Glu Ala Leu Pro Glu
770 775 780
Thr Ala Tyr Pro Val Ile Lys Glu Gly Ser Ile Cys Ser Leu Gln Asn
785 790 795 800
Lys Leu Glu Asn Thr Ala Ala Leu Lys Val Ser Val His Glu Pro Val
805 810 815
Thr Ser Thr Thr Ser Thr Lys Ile Phe Pro Leu Ile Gln Lys Glu Lys
820 825 830
Gln Asn Glu Ser Thr Asn Ala Asn Ser Glu Gly Thr Pro Asn Thr Ser
835 840 845
Gln Gly Lys Tyr Asn Glu Thr Glu Pro Asp Val Gln Cys Pro Val Ser
850 855 860
Asp Gln Gln Thr Ser Tyr Val Ser Lys Asp Ser Asp Asp Val His Ser
865 870 875 880
Asp Val Leu Gln Ile Asp Asn Ile Cys Ser Leu Val Glu Gly Asp Thr
885 890 895
Ser Tyr Asn Ser Gln Ile Ala Lys Ile Phe Asn Leu His Pro Leu Glu
900 905 910
Lys Val Glu Gln Gln Lys Pro Leu Leu Ser His Gln Val Met Ser Ser
915 920 925
Arg Gln Gln Asn Glu Gln Val Asp Val Thr Glu Ser Lys Asp Phe Asp
930 935 940
Cys Gln Lys Asp Asn Phe Val Gln Cys Thr Asp Thr Ser His Glu Thr
945 950 955 960
Ile Asp Gln Ser Met Leu Leu His Pro Pro Glu Ser Ser Ser Leu Lys
965 970 975
Tyr Thr Glu Ala Lys Arg Gly Ile Pro Glu Glu Ser Ser Leu Glu Gln
980 985 990
Ile Thr Glu Ile Glu Ser Leu Ala Asp Asp Val Val Ser Pro Ala Ala
995 1000 1005
Ile Gln Gln Asp Asn Cys Pro Gln Glu Thr Asp Met Ser Cys Ser
1010 1015 1020
Tyr Thr Ala Gln Asp Pro Thr Lys Asn Glu Leu Leu Asp Asp Glu
1025 1030 1035
Thr Ser Ile Leu Tyr Leu Gln Asp Gln Leu Ser Glu Leu Leu Lys
1040 1045 1050
Glu Phe Pro Tyr Gly Ile Glu Pro Val Asn Met His Glu Gly Cys
1055 1060 1065
Ala Val Gln Gln Met Ala Asp Pro Ile Ser Lys Pro Gln Thr Cys
1070 1075 1080
Glu His Thr Gly Cys Asp Ser Lys Asp Ser Thr Asp Gln Ile Gln
1085 1090 1095
Ile Thr Ile Leu Asn Ser Glu Gln Met Lys Glu Leu Phe Pro Glu
1100 1105 1110
Gln Asp Gly Pro Pro Asn Glu Val Asp Arg Leu Thr Glu Leu Gln
1115 1120 1125
Glu Glu Lys Pro Val Thr Lys Glu Gly Asn Gln Cys Asp Pro Gln
1130 1135 1140
Ala Arg Thr Ile Glu Glu Ser Cys Glu Ser Val Val Leu Asp Ser
1145 1150 1155
Glu Lys Asp Asp Val Arg Cys Cys Ala Leu Gly Trp Leu Ser Met
1160 1165 1170
Val Tyr Glu Gly Val Pro Gln Cys Gln Cys Asn Ser Ile Lys Asn
1175 1180 1185
Ser Ala Ser Lys Glu Glu Lys Gly Lys Asp Pro Cys Ser Leu Glu
1190 1195 1200
Ala Asn Ala Asn Ser Tyr Lys Arg Gly Glu Arg Thr Ser Asp Gly
1205 1210 1215
Asp Asp Ser Val Thr Phe Glu Asn Pro Pro Asp Asn Gln Lys Leu
1220 1225 1230
Pro Leu Thr Phe Pro Val Glu Glu Lys His Phe Pro Glu Thr Glu
1235 1240 1245
Gly Gly Arg Asn Ile Asn Asp Lys Ser Glu Thr Glu Gln Asn Ser
1250 1255 1260
Ser Leu Arg Thr Glu Gln Glu Leu Pro Gly Gln Phe Leu Cys Lys
1265 1270 1275
Gly Gly Lys Arg Arg Asp Pro Leu Gln Arg His Lys Lys Lys Pro
1280 1285 1290
Leu Gln Phe His Glu Val Thr Phe Gln Ser Thr Asn Lys Thr Ile
1295 1300 1305
Lys Ile Cys Gln Glu Ser Leu Gln Arg Lys Leu Met Ala Gln Asn
1310 1315 1320
Leu Arg Pro Leu Lys Pro Lys Met Gly Phe Leu Thr Ser Lys Asn
1325 1330 1335
Lys Asp Leu His Val Lys Asn Ala Ser Leu Val Gln Ser Ile Thr
1340 1345 1350
Pro Glu Lys Arg Lys Leu Lys Ala Ala Gly Ser Lys His Lys Val
1355 1360 1365
Leu Glu Lys Arg Lys Leu Asp Asp Gly Ser Ile His Asp Ser Glu
1370 1375 1380
Val Lys Lys Lys Lys Tyr Asp Lys Gln Glu Gln Asn Lys Asn Val
1385 1390 1395
Gly Ser Gly Thr Phe Lys Leu Tyr Asn Phe Ser Thr Pro Ser Glu
1400 1405 1410
Arg Ala Met Thr Lys Glu Lys Thr Val Ser Asn Val Lys Ser Ser
1415 1420 1425
Gly Ser Lys Asp Gly Ser Ser Lys Ile Asn Arg Val Leu Thr Ala
1430 1435 1440
Lys Glu Tyr Leu Ala Arg Gln Lys His Lys Glu Ala Val Ser Gly
1445 1450 1455
Lys Thr Leu Lys Lys Asn Cys Leu Lys Asn Leu Pro Cys Asp Ser
1460 1465 1470
Gln Tyr Lys Lys Ser Ser Lys Leu Pro Val Arg Val Gly Ser Cys
1475 1480 1485
Gly Lys Ser Ser Glu Arg Gln Asn Ser Asn Val Gln Thr Thr Lys
1490 1495 1500
Glu Ser Leu Pro Ile Ser Ser Asn His Gly Lys Ser Leu Lys Ile
1505 1510 1515
His His Ser Arg Asp Ser Lys Thr His Ile Leu Arg Asn Ile Lys
1520 1525 1530
Gly Thr Val Gly Gly Lys Gln Pro Asp Lys Met Trp Ile Asp Lys
1535 1540 1545
Thr Lys Ser Asp Lys Asn Val Asn Asn Val Asn Asn Glu Ala Glu
1550 1555 1560
Phe Ser Gln Met Ser Ser Gln Ala Lys Asp Gln Arg Lys Thr Tyr
1565 1570 1575
Leu Asn Arg Val Gly Phe Lys Cys Thr Glu Arg Glu Arg Ile Cys
1580 1585 1590
Leu Thr Lys Leu Asp Gly Ser Pro Arg Lys Leu Asn Lys Glu Lys
1595 1600 1605
Arg Pro Glu Asn Lys Pro Lys Asn His Val Pro Gly Lys Asp Thr
1610 1615 1620
Ser Glu Lys Leu Ser Met Leu Glu Phe Lys Leu Cys Pro Asp Gly
1625 1630 1635
Leu Phe Lys Asn Pro Asn Pro Val Glu Asp Gln Lys Asp Leu Gln
1640 1645 1650
Pro Cys Pro Met Lys Glu Gln Ala Pro Val Gln Val Ser Gly Ile
1655 1660 1665
Lys Ser Thr Lys Glu Asp Trp Leu Lys Cys Val Thr Glu Glu Lys
1670 1675 1680
Lys Ile Pro Glu Pro Asn Gln Glu Ile Asp Asp Val Leu Ala Asn
1685 1690 1695
Ser Arg Leu Ser Lys Arg Ser Phe Ser Ala Asp Gly Tyr Glu Thr
1700 1705 1710
Gln Gln Asn Gln Val Lys Asp Ser Lys Ala Met Phe Gln Thr Tyr
1715 1720 1725
Lys Lys Met Tyr Met Glu Lys Arg Ser Arg Ser Leu Gly Ser Ser
1730 1735 1740
Pro Leu Glu
1745
<210> 8
<211> 4644
<212> ДНК
<213> Cricetulus griseus
<400> 8
atgaattgga atgcaaaacc agagaatgct gccccaaacc caccatattc taaaagccag 60
tcgtctcttt tgcagcagtt tttaatgcct tccacaactt ctcaaagttc tttcagctgt 120
ctcccacata accaagaagc atgcatatat cccactaatt caaattcagt ttcacagcca 180
cttctgaacg tcaggagttt cataaatcct ccgatctctg tttctaatgt gcataatagg 240
acagttgtgg cctcacagac ctcagtagaa agagtcacat atacaaatgt taaaggagcc 300
caacaaccaa accacaattt gcaaacagtg tcttctggag ttgtgcaaaa tgcctggatg 360
aattcaacaa tgaggaattt tatgccttct cttacagagg caaccatatc tcataaacct 420
gatggtgggc ctagtatgcc atatatgcat gcaccacaga gtcatcttgt cacatcagac 480
acctactctg tgcaactaca gatgactcct tcaaactctg taagaggccc tgtaacttac 540
caaggaaatt atcaaggaaa tccgggactt aaccactcga tggcaggtga gcttggctgg 600
gtacaatgtg catccagtga acttacttat ccagattaca gaccacctcc aaagcaatat 660
ccttatttac cacaaagctt tgtgcaagac acttctgttc agaaacaaaa ctttgtgtca 720
tctacatcat tacaagttaa aaataatcag cttccacctt ctacacagac cttaccatca 780
aagcgccctg tacctgtgtc gtcatatcag tatgctgcag aaaccagcaa aagactccct 840
cccccccctt acagctgtag atatggaagc caacatgtgc aaaattctca gtctgtttct 900
agacacttgc ctgtggaagt tcctcagagt tcagaaatgc actcgtctga aaaaaagaaa 960
gatgcttaca aagtctttca acagcagtgg cagagcacta gtaaaaatgt cagtacaata 1020
ggaaaattct gtgagttgaa aattaataca aaacagtctt acaatgactc tgctggctct 1080
tctggggatg gtgttcatac tcttgttcaa aataatcaag aagaaagaaa gtattcttat 1140
aatccaagta caaatcaaat actagacaca aatgtcacaa aagaaaagct ggtgagggat 1200
attaaatcac tagtagaaat taaaaagaaa ttttcagaac ttgcaagaaa aattaaaatc 1260
aacaaaaagc ttttgatggc agctggttgc agtaaaacag ctaatacttc ttatactgaa 1320
ccaactcggc attctgaatt ttcagcaaaa gaaatgtctg ctaaaaggga caatcagtgc 1380
tccatggaat tgctagcaac atgcctttct ctttggaaaa accaacctcc aaaaaccaca 1440
gaagaaaatg tttcaaaacc tttagaagaa aaacaatata atgcatcaag aactagtaca 1500
acagcggttg gcccttcaaa tcccatgaat gaagttcatg tgaagaattt ttgttcaggt 1560
gttagaaatt ctcagaaaat aaccacctcg tcacaaacag tcttgtcagt tctcacacca 1620
gtttacgatt cttcagatgt agctgttgga aaaggaacag agcttcagat tgctgtggtt 1680
tcacctttaa ttctttcaga tgtcagtact gtacctggga aagagttagc tcctgaagtc 1740
gtatctgaaa ctgtatatcc agttgtgaag gaaggcagtg tttgtagctt acaaaaccag 1800
caggcagaaa atgcaacagt aactgctggt ttgccctttg atgttatcag agcagtagca 1860
agtgctactg tatcagctga gctatcactg cctgggcata aagaaaagca gcacaaacca 1920
acacagagtg atctagacat cgctgatggc agcctaggga aacactctcc ccagggtgct 1980
gaagctttgc ctaaccctag ggacagcacc attgtgagtg ggcctatatt acagattgaa 2040
agtatctgtt ctcttgcaga aggtgatgta tcttacaatt cccaaatagc agagatattc 2100
aactctgtac aaaatgagcc ccagaaacct tcacctgatc agcaagtaat taatagtcaa 2160
caagaagaac aagtagataa ggttgctgaa aataaagact taagttttct gaaagacaag 2220
tgtatgcagt gtacagatgt tcctcatgaa gtcactgaac agccagagcc actgcagcct 2280
ttagagacaa catctgatga gtatgttgaa gcaaacggag aaatcctaga ggaaagcagt 2340
aaggagaatc ctggtgaaaa agagatgact aaggacatat tgtgttcacc agctgctgtt 2400
cagcaagatc ctcaacctca ggaaattgac acagccagca gtaagtcagg acacagtttt 2460
tctacagtaa atgagattaa tgatgaaaat gaacctgtct catacctaca tgaccagctg 2520
ttagaacttc taaaagagtt tccttatggc attgaaacta ttgccaggcc tgaagtttat 2580
gtgggccaac aaaagacaca tgaaatctta gaaaatcaaa ctggtagtaa aactggtaat 2640
gtgtctgggg ataacacaga ccaaataaaa attacagtat taaactcaga acaaatcaaa 2700
gaattatttc ctgaagagga tcagccatgt gatgtagaca aattggcaga acccgagaat 2760
acaaaaatca ttgcagaagt aaagagcctg tgtgattcac aggtccccag agaagaaagt 2820
cacaaccctg gaatgttgga tctggagaaa gataaaatcc attgctgtgc cttgggctgg 2880
ctctcaatgg tttatgaagg tgtgccacag tgtcagtgca gttccatgga agagaaagag 2940
aaagaccagt gttctttgga aatctctaat tgcaaacaag gagagcaggc ctgcaatagt 3000
ggaatcacta tttttgaaat taatcctatt tctaataact caaaaagtcc tctgatccaa 3060
gaatctgaga aaggccattt ttctgacata catggtgaaa agataaaaac atctgaaaca 3120
aaaaacagca gctcaccaag ggtagaacag gaattaactg gtcatttttc aatgaaatgt 3180
taccagaaag ataaatctac aacaaaacag gatagctcac tgaaaacaga gcaaaaaata 3240
aaaaatcttt cttctaaatg tgacaaacca aatcccttaa aaagcagtaa aataccaacc 3300
cctgaaacat ttaatgtggt aacttccaac tctgataaaa atatgccagc attttctaaa 3360
caagattctc agggaagcct gcagaagaaa cacctattcc aagactcaga tccagtaaaa 3420
ggacatgtat ggcttttgcc aaataaagat ccacgcagga ggaatacctt tttagtacag 3480
tcagtatcac cagaaaagaa aaagttaaaa ttcaaatcgg gtagctccaa actgaaatat 3540
tttgaaaaaa gaaaaatgga ccatttgctt atctcagatg tggaaataaa aaagaagaaa 3600
tacgaaaaac aagagcagaa caaaaatgct ggaggcacac tcaaattatg tagtactctg 3660
actgaaccaa atgaaagagc ctgtgctaaa gaaaagatag tgacaaattc tgagccctca 3720
gactcaaagg gaagctcctc taagagtact agagttataa ctgtgcagga atatttacag 3780
cggaaaaaag acaaacatgt aataggaaat aatgcctcca aaaacatctg tgtagaaaat 3840
gtgccatgtg actctgaacc catgaagtcc agtaaacatt ctgcatcacc tagtttggga 3900
aaattaattg agggccaggg tgtcagtgca gagactttaa aagaagtaga acataattcc 3960
accagccatg gcaaaaatct caagacccac cgttctgagg agactaggcc atacagtgtg 4020
tcaaatagta aagagaaatt ttataggaca catccagaca aatcttacat tgataaagct 4080
aaattagaaa gattgaccag tatgagtagt aagtccagcc agctccaggt aaaggaaaaa 4140
aggaaacagt acctgaatcg agttgcattc aaatgcacag aacaggaaag catttgtctc 4200
accaaattgg acagtgcatc caagaagctt agtaaagaga aagaaaagag tacagcatgt 4260
gcacccatga caaaagacta cacacacaag cccatgttgg agtttaaatt atgtccagat 4320
gtgctattga agaatacaag ctccattgac aaaggggatg atccaaggcc tgggcctgag 4380
aaggagcgag cacctgtgca agtttcagga ataaaaacta caaaagaaga ctggttaaaa 4440
tgtatcccaa caaggacaaa gatgcccgaa tcaagtgaac aaacagatcg ggctgactca 4500
agactctcta agagaagctt cagtgcagat gaatttgaaa ctctacaaaa cccagtaaaa 4560
gactcaaatg tcatgttccg gactttcaaa aagatgtacc tggagaagag aagcaggagc 4620
ctggggagca gtccagtgaa gtag 4644
<210> 9
<211> 112
<212> ДНК
<213> Cricetulus griseus
<400> 9
tgctgggatt taaggggaaa gctttaataa aagatcttta tttgtatttc ttgcagattt 60
gtgacattca aaaccacaga ctatgcaaca ctactactaa accaggtcaa at 112
<210> 10
<211> 36
<212> ДНК
<213> Cricetulus griseus
<400> 10
cttcgggata gagtggtttt gcttttacca ccagga 36
<210> 11
<211> 221
<212> PRT
<213> Homo sapiens
<400> 11
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Ile Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Asp Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Gly Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Asn Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Glu Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 12
<211> 221
<212> PRT
<213> Rattus norvegicus
<400> 12
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Met Lys Ser Ser Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Glu Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Ser Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Ser Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Ala Pro Ala Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 13
<211> 221
<212> PRT
<213> Mus musculus
<400> 13
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Met Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Glu Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Ser Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Ser Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Ala Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 14
<211> 221
<212> PRT
<213> Cricetulus griseus
<400> 14
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Ser His Ser
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Met Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Asp Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Ser Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Ser Lys Lys Ala Ala Pro Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Ala Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 15
<211> 222
<212> PRT
<213> Gallus gallus
<400> 15
Met Phe Gly Phe Arg Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Asn Cys Phe Gly Leu His Glu Ala Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Met Lys
85 90 95
Thr Leu Ser Gly Ser Arg Ile Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Glu Gly
130 135 140
Ser Asp Thr Glu Met Ser Ala Gly Ser Ser Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Val Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Asn Lys Lys Ser Ala Thr Glu Lys Pro Glu Gln
195 200 205
Glu Gly Pro Gln Ser Pro Ala Ile Ser Thr Gln Glu Glu Trp
210 215 220
<210> 16
<211> 221
<212> PRT
<213> Pan troglodytes
<400> 16
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Ile Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Asp Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Gly Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Asn Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Glu Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 17
<211> 221
<212> PRT
<213> Pongo abelii
<400> 17
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Ile Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Arg Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Asp Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Gly Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Asn Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Glu Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 18
<211> 221
<212> PRT
<213> Bos taurus
<400> 18
Met Phe Gly Phe His Lys Pro Lys Met Tyr Arg Ser Ile Glu Gly Cys
1 5 10 15
Cys Ile Cys Arg Ala Lys Ser Ser Ser Ser Arg Phe Thr Asp Ser Lys
20 25 30
Arg Tyr Glu Lys Asp Phe Gln Ser Cys Phe Gly Leu His Glu Thr Arg
35 40 45
Ser Gly Asp Ile Cys Asn Ala Cys Val Leu Leu Val Lys Arg Trp Lys
50 55 60
Lys Leu Pro Ala Gly Ser Lys Lys Asn Trp Asn His Val Val Asp Ala
65 70 75 80
Arg Ala Gly Pro Ser Leu Lys Thr Thr Leu Lys Pro Lys Lys Val Lys
85 90 95
Thr Leu Ser Gly Asn Arg Ile Lys Ser Asn Gln Ile Ser Lys Leu Gln
100 105 110
Lys Glu Phe Lys Arg His Asn Ser Asp Ala His Ser Thr Thr Ser Ser
115 120 125
Ala Ser Pro Ala Gln Ser Pro Cys Tyr Ser Asn Gln Ser Asp Asp Gly
130 135 140
Ser Asp Thr Glu Met Ala Ser Gly Ser Asn Arg Thr Pro Val Phe Ser
145 150 155 160
Phe Leu Asp Leu Thr Tyr Trp Lys Arg Gln Lys Ile Cys Cys Gly Ile
165 170 175
Ile Tyr Lys Gly Arg Phe Gly Glu Val Leu Ile Asp Thr His Leu Phe
180 185 190
Lys Pro Cys Cys Ser Asn Lys Lys Ala Ala Ala Glu Lys Pro Glu Glu
195 200 205
Gln Gly Pro Glu Pro Leu Pro Ile Ser Thr Gln Glu Trp
210 215 220
<210> 19
<211> 1236
<212> ДНК
<213> Cricetulus griseus
<400> 19
ctcagaagaa aagatgtttg gttttcacaa gccaaagatg taccgaagta tagagggctg 60
ctgtatctgc agagccaagt cctccagctc tcggttcacg gacagtaaac gttatgaaaa 120
ggacttccag agctgttttg ggttgcacga gactcgctca ggagatatct gcaatgcctg 180
tgtgctgctt gtgaaaagat ggaagaagtt gccagcagga tcaaaaaaaa actggaatca 240
tgtgtcacac tcaagggcag gacccagtct aaagacaaca ttgaaaccaa agaaagtgaa 300
aactctatct ggaaacagga tgaaaagcaa ccagatcagt aaactgcaga aggagtttaa 360
acgccacaac tctgatgctc acagtaccac ctcaagtgcc tcgccagccc agtctccctg 420
ctacagtaac cagtcagatg atggctcaga cacagagatg gcttccagct ctaacagaac 480
tccagttttt tccttcttag atcttaccta ctggaaaaga cagaaaatat gttgtgggat 540
catctataag ggccgttttg gggaagtcct catcgacacg catctcttca agccttgctg 600
cagcagtaag aaggcagctc ctgagaagcc tgaggaacag ggaccagcgc ctctgcccat 660
ctctactcag gagtggtgac tgaggttcat gcagaaggga acaaagagca atttaaactt 720
tgaaaagacc acaaagcaac agactgaccc tcctattttt aacttggata cctgctattc 780
tgccaaaaga cattttctag aatagttttt aatgggttac ccatcccccc atccaacaaa 840
ctcggaagcc agttctagct tactgcaaga agagagtgta cataatattt aatatgctga 900
gtatttcata ggaaggctga atgctgctgt aaagtgctct ttaagtcttt tttttttttt 960
aatcccctct aatgaatgag attagggggg tttcagggga cagagatggg atttgttgtg 1020
tgataaacca tatgtagttt agtctttctg tggagaggca gtggttgggg cattttaaat 1080
ggctggctac acttgttttc ccctcatggt aatttgtcat aactcagtag cacgacctgc 1140
ccctagaagt agttaaagat ttttaaatgc taaggcgttg ccaaggttct gatgattcag 1200
acctgtacta ctgattatta agcaggacag actgag 1236
<210> 20
<211> 205
<212> PRT
<213> Homo sapiens
<400> 20
Ile Ala Trp Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asn Ala Lys
1 5 10 15
His His Lys Glu Lys Pro Gly Pro Glu Asp Lys Leu His Glu Gln Cys
20 25 30
Arg Pro Trp Arg Lys Asn Ala Cys Cys Ser Thr Asn Thr Ser Gln Glu
35 40 45
Ala His Lys Asp Val Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His Cys
50 55 60
Gly Glu Met Ala Pro Ala Cys Lys Arg His Phe Ile Gln Asp Thr Cys
65 70 75 80
Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val Asp
85 90 95
Gln Ser Trp Arg Lys Glu Arg Val Leu Asn Val Pro Leu Cys Lys Glu
100 105 110
Asp Cys Glu Gln Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys Lys
115 120 125
Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Phe Asn Lys Cys
130 135 140
Ala Val Gly Ala Ala Cys Gln Pro Phe His Phe Tyr Phe Pro Thr Pro
145 150 155 160
Thr Val Leu Cys Asn Glu Ile Trp Thr His Ser Tyr Lys Val Ser Asn
165 170 175
Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro Ala
180 185 190
Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala
195 200 205
<210> 21
<211> 27
<212> PRT
<213> Homo sapiens
<400> 21
Ala Ala Met Ser Gly Ala Gly Pro Trp Ala Ala Trp Pro Phe Leu Leu
1 5 10 15
Ser Leu Ala Leu Met Leu Leu Trp Leu Leu Ser
20 25
<210> 22
<211> 257
<212> PRT
<213> Homo sapiens
<400> 22
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Ile Ala Trp Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Arg Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Gln Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Ala Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr His Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Phe Leu Leu Ser Leu Ala Leu Met Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 23
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - METTL20_1, смысловая
<400> 23
cccugauguu guuagaggat t 21
<210> 24
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - METTL20_1 антисмысловая
<400> 24
uccucuaaca acaucagggt t 21
<210> 25
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК- C12orf35_1 смысловая
<400> 25
cauccagaca aaucuuacat t 21
<210> 26
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - C12orf35_1 антисмысловая
<400> 26
uguaagauuu gucuggaugt g 21
<210> 27
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - C12orf35_2 смысловая
<400> 27
ccagaaagau aaaucuacat t 21
<210> 28
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - C12orf35_2 антисмысловая
<400> 28
uguagauuua ucuuucuggt a 21
<210> 29
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Caprin2_6 смысловая
<400> 29
ugaccugccc ugaaagaaat t 21
<210> 30
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Caprin2_6 антисмысловая
<400> 30
uuucuuucag ggcaggucag t 21
<210> 31
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - FAM60A смысловая
<400> 31
gcuuccagcu cuaacagaat t 21
<210> 32
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - FAM60A антисмысловая
<400> 32
uucuguuaga gcuggaagcc a 21
<210> 33
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_1 смысловая
<400> 33
gacccgaacu uugacccuat t 21
<210> 34
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_1 антисмысловая
<400> 34
uagggucaaa guucggguct g 21
<210> 35
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_2 смысловая
<400> 35
cggagacucu ucaaauugat t 21
<210> 36
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_2 антисмысловая
<400> 36
ucaauuugaa gagucuccgg a 21
<210> 37
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_3 смысловая
<400> 37
gccugauuga agacgaggat t 21
<210> 38
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - IPO8_3 антисмысловая
<400> 38
uccucgucuu caaucaggct t 21
<210> 39
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Dennd5b_2 смысловая
<400> 39
gggucucccu uauucaagat t 21
<210> 40
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Dennd5b_2 антисмысловая
<400> 40
ucuugaauaa gggagaccct g 21
<210> 41
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Amn1_4 смысловая
<400> 41
gcugcuuaag uauuacugat t 21
<210> 42
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - Amn1_4 антисмысловая
<400> 42
ucaguaauac uuaagcagcc a 21
<210> 43
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - TMTC1_1 смысловая
<400> 43
guauaccugu gauaaaacat t 21
<210> 44
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - TMTC1_1 антисмысловая
<400> 44
uguuuuauca cagguauaca t 21
<210> 45
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - TMTC1_2 смысловая
<400> 45
cggugaaugu cauucuacat t 21
<210> 46
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> киРНК - TMTC1_2 антисмысловая
<400> 46
uguagaauga cauucaccgc a 21
<210> 47
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> PCR20, прямой праймер
<400> 47
accagtgaat aatcgtgttt 20
<210> 48
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> PCR20, обратный праймер
<400> 48
ctatgagtca atgtcccaag 20
<210> 49
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> PCR28, прямой праймер
<400> 49
cacacacaac ctcctaacaa ccc 23
<210> 50
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> PCR28, обратный праймер
<400> 50
ttccgcaccg actcagttct 20
<210> 51
<211> 128
<212> ДНК
<213> Cricetulus griseus
<400> 51
atgtttggtt ttcacaagcc aaagatgtac cgaagtatag agggctgctg tatctgcaga 60
gccaagtcct ccagctctcg gttcacggac agtaaacgtt atgaaaagga cttccagagc 120
tgttttgg 128
<210> 52
<211> 25
<212> ДНК
<213> Cricetulus griseus
<400> 52
tgtaccgaag tatagagggc tgctg 25
<210> 53
<211> 25
<212> ДНК
<213> Cricetulus griseus
<400> 53
tgtccgtgaa ccgagagctg gagga 25
<210> 54
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1
<400> 54
gtcccagcac tcatgaggat 20
<210> 55
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 2
<400> 55
cctcctagct ccaggtattt 20
<210> 56
<211> 20
<212> ДНК
<213> Искусственная Sequence
<220>
<223> Праймер 3
<400> 56
gaggacttgg ctctgcagat 20
<210> 57
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 4
<400> 57
ttccacagag cacagccgat 20
<210> 58
<211> 1080
<212> ДНК
<213> Cricetulus griseus
<400> 58
ccttagtatt gggattttga ccagggtagt taatttcagt catcatttct aaactctaag 60
gttgtcatat ctgtgatttt cataccttcc taaaggtgac tgtatagaac ttcagttatc 120
aaagaacaca ccccccactt ccacagagca cagccgatat gtggagcctc ttgtgtcctg 180
ggaacagagt ggtcatagtg aatgcacact actttcccag cagggagttt aaagttttag 240
gtacattctt aatggcatgt gtgtatgggg gtgggcacag tagtaaagaa agtgccaaca 300
tgactgactg ctccatgatg tggttaaggt ttttattaga tgaacagcag ccagcaaact 360
gggcatggcc agggttctgt ctcttgagta ttgtggtata gttagttcct atgttgtgtg 420
atataagaaa caaaggaggt agtggatgcc tcctagctcc aggtattttc gaatgttttg 480
tatactggcc ctatggagta gtagatctgg ggaattcttg tagtttgttt gacttggcta 540
taaaattgta tgtgctggag gtagggtgga acagagaaaa gtccttgcat cgtttcttgt 600
catttccctt aacaaagctg tgccaattcc tttgtcttta caggtattgc tcagaagaaa 660
agatgtttgg ttttcacaag ccaaagatgt accgaagtat agagggctgc tgtatctgca 720
gagccaagtc ctccagctct cggttcacgg acagtaaacg ttatgaaaag gacttccaga 780
gctgttttgg gtaagattag ttatggtccc tcccccaccc cattacccct cactctccac 840
cgaggcaggg tttctctgta gcttaagagc ttgtcctgga actggctctg tagaccaggt 900
tagcctcaaa ctcacagaga tcctcatgag tgctgggact aaaggcatgc accaccacca 960
tccacctgta ttccattctt agagggaaaa ataatcagga ttgtgtggaa atgtttccat 1020
gcaaagcaat gggaacaatg tgctaatatt taaaatcact agttttctat tatttgggtt 1080
<210> 59
<211> 114
<212> ДНК
<213> Cricetulus griseus
<400> 59
atgtttggtt ttcacaagcc aaagatgtac cgaagtatag agggctgctg tatcctccag 60
ctctcggttc acggacagta aacgttatga aaaggacttc cagagctgtt ttgg 114
<210> 60
<211> 123
<212> ДНК
<213> Cricetulus griseus
<400> 60
atgtttggtt ttcacaagcc aaagatgtac cgaagtatag agggctgctg tatctgccaa 60
gtcctccagc tctcggttca cggacagtaa acgttatgaa aaggacttcc agagctgttt 120
tgg 123
<210> 61
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - C12orf35_3 смысловая
<400> 61
cagtgtatcc cgttattaa 19
<210> 62
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - C12orf35_3 антисмысловая
<400> 62
ttaataacgg gatacactg 19
<210> 63
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - C12orf35_5 смысловая
<400> 63
gcaactgtat ctcatcaaa 19
<210> 64
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> киРНК - C12orf35_5 антисмысловая
<400> 64
tttgatgaga tacagttgc 19
<210> 65
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер
<400> 65
gcatccagtg aacttactta tccagat 27
<210> 66
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер
<400> 66
gctctgccac tgctgttgaa ag 22
<210> 67
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер
<400> 67
tgctgggatt aaaggggaaa gcttt 25
<210> 68
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Разрезающий праймер
<400> 68
tctagaaaca gactgagaat tttgcac 27
<210> 69
<211> 1188
<212> ДНК
<213> Cricetulus griseus
<220>
<221> misc_feature
<222> (864)..(917)
<223> TALEN-связывающий сайт и спейсер
<400> 69
atgaattgga atgcaaaacc agagaatgct gccccaaacc caccatattc taaaagccag 60
tcgtctcttt tgcagcagtt tttaatgcct tccacaactt ctcaaagttc tttcagctgt 120
ctcccacata accaagaagc atgcatatat cccactaatt caaattcagt ttcacagcca 180
cttctgaacg tcaggagttt cataaatcct ccgatctctg tttctaatgt gcataatagg 240
acagttgtgg cctcacagac ctcagtagaa agagtcacat atacaaatgt taaaggagcc 300
caacaaccaa accacaattt gcaaacagtg tcttctggag ttgtgcaaaa tgcctggatg 360
aattcaacaa tgaggaattt tatgccttct cttacagagg caaccatatc tcataaacct 420
gatggtgggc ctagtatgcc atatatgcat gcaccacaga gtcatcttgt cacatcagac 480
acctactctg tgcaactaca gatgactcct tcaaactctg taagaggccc tgtaacttac 540
caaggaaatt atcaaggaaa tccgggactt aaccactcga tggcaggtga gcttggctgg 600
gtacaatgtg catccagtga acttacttat ccagattaca gaccacctcc aaagcaatat 660
ccttatttac cacaaagctt tgtgcaagac acttctgttc agaaacaaaa ctttgtgtca 720
tctacatcat tacaagttaa aaataatcag cttccacctt ctacacagac cttaccatca 780
aagcgccctg tacctgtgtc gtcatatcag tatgctgcag aaaccagcaa aagactccct 840
cccccccctt acagctgtag atatggaagc caacatgtgc aaaattctca gtctgtttct 900
agacacttgc ctgtggaagt tcctcagagt tcagaaatgc actcgtctga aaaaaagaaa 960
gatgcttaca aagtctttca acagcagtgg cagagcacta gtaaaaatgt cagtacaata 1020
ggaaaattct gtgagttgaa aattaataca aaacagtctt acaatgactc tgctggctct 1080
tctggggatg gtgttcatac tcttgttcaa aataatcaag aagaaagaaa gtattcttat 1140
aatccaagta caaatcaaat actagacaca aatgtcacaa aagaaaag 1188
<210> 70
<211> 1180
<212> ДНК
<213> Cricetulus griseus
<400> 70
atgaattgga atgcaaaacc agagaatgct gccccaaacc caccatattc taaaagccag 60
tcgtctcttt tgcagcagtt tttaatgcct tccacaactt ctcaaagttc tttcagctgt 120
ctcccacata accaagaagc atgcatatat cccactaatt caaattcagt ttcacagcca 180
cttctgaacg tcaggagttt cataaatcct ccgatctctg tttctaatgt gcataatagg 240
acagttgtgg cctcacagac ctcagtagaa agagtcacat atacaaatgt taaaggagcc 300
caacaaccaa accacaattt gcaaacagtg tcttctggag ttgtgcaaaa tgcctggatg 360
aattcaacaa tgaggaattt tatgccttct cttacagagg caaccatatc tcataaacct 420
gatggtgggc ctagtatgcc atatatgcat gcaccacaga gtcatcttgt cacatcagac 480
acctactctg tgcaactaca gatgactcct tcaaactctg taagaggccc tgtaacttac 540
caaggaaatt atcaaggaaa tccgggactt aaccactcga tggcaggtga gcttggctgg 600
gtacaatgtg catccagtga acttacttat ccagattaca gaccacctcc aaagcaatat 660
ccttatttac cacaaagctt tgtgcaagac acttctgttc agaaacaaaa ctttgtgtca 720
tctacatcat tacaagttaa aaataatcag cttccacctt ctacacagac cttaccatca 780
aagcgccctg tacctgtgtc gtcatatcag tatgctgcag aaaccagcaa aagactccct 840
cccccccctt acagctgtag atatggaagc caacatgtgc aagtctgttt ctagacactt 900
gcctgtggaa gttcctcaga gttcagaaat gcactcgtct gaaaaaaaga aagatgctta 960
caaagtcttt caacagcagt ggcagagcac tagtaaaaat gtcagtacaa taggaaaatt 1020
ctgtgagttg aaaattaata caaaacagtc ttacaatgac tctgctggct cttctgggga 1080
tggtgttcat actcttgttc aaaataatca agaagaaaga aagtattctt ataatccaag 1140
tacaaatcaa atactagaca caaatgtcac aaaagaaaag 1180
<210> 71
<211> 20
<212> ДНК
<213> Cricetulus griseus
<400> 71
gcaaaattct cagtctgttt 20
<210> 72
<211> 1168
<212> ДНК
<213> Cricetulus griseus
<400> 72
atgaattgga atgcaaaacc agagaatgct gccccaaacc caccatattc taaaagccag 60
tcgtctcttt tgcagcagtt tttaatgcct tccacaactt ctcaaagttc tttcagctgt 120
ctcccacata accaagaagc atgcatatat cccactaatt caaattcagt ttcacagcca 180
cttctgaacg tcaggagttt cataaatcct ccgatctctg tttctaatgt gcataatagg 240
acagttgtgg cctcacagac ctcagtagaa agagtcacat atacaaatgt taaaggagcc 300
caacaaccaa accacaattt gcaaacagtg tcttctggag ttgtgcaaaa tgcctggatg 360
aattcaacaa tgaggaattt tatgccttct cttacagagg caaccatatc tcataaacct 420
gatggtgggc ctagtatgcc atatatgcat gcaccacaga gtcatcttgt cacatcagac 480
acctactctg tgcaactaca gatgactcct tcaaactctg taagaggccc tgtaacttac 540
caaggaaatt atcaaggaaa tccgggactt aaccactcga tggcaggtga gcttggctgg 600
gtacaatgtg catccagtga acttacttat ccagattaca gaccacctcc aaagcaatat 660
ccttatttac cacaaagctt tgtgcaagac acttctgttc agaaacaaaa ctttgtgtca 720
tctacatcat tacaagttaa aaataatcag cttccacctt ctacacagac cttaccatca 780
aagcgccctg tacctgtgtc gtcatatcag tatgctgcag aaaccagcaa aagactccct 840
cccccccctt acagctgtag atatggaagc caacatgtct agacacttgc ctgtggaagt 900
tcctcagagt tcagaaatgc actcgtctga aaaaaagaaa gatgcttaca aagtctttca 960
acagcagtgg cagagcacta gtaaaaatgt cagtacaata ggaaaattct gtgagttgaa 1020
aattaataca aaacagtctt acaatgactc tgctggctct tctggggatg gtgttcatac 1080
tcttgttcaa aataatcaag aagaaagaaa gtattcttat aatccaagta caaatcaaat 1140
actagacaca aatgtcacaa aagaaaag 1168
<210> 73
<211> 59
<212> ДНК
<213> Cricetulus griseus
<400> 73
caacatgtgc aaaattctca gtctgtttct agacacttgc ctgtggaagt tcctcagag 59
<210> 74
<211> 1131
<212> ДНК
<213> Cricetulus griseus
<400> 74
atgaattgga atgcaaaacc agagaatgct gccccaaacc caccatattc taaaagccag 60
tcgtctcttt tgcagcagtt tttaatgcct tccacaactt ctcaaagttc tttcagctgt 120
ctcccacata accaagaagc atgcatatat cccactaatt caaattcagt ttcacagcca 180
cttctgaacg tcaggagttt cataaatcct ccgatctctg tttctaatgt gcataatagg 240
acagttgtgg cctcacagac ctcagtagaa agagtcacat atacaaatgt taaaggagcc 300
caacaaccaa accacaattt gcaaacagtg tcttctggag ttgtgcaaaa tgcctggatg 360
aattcaacaa tgaggaattt tatgccttct cttacagagg caaccatatc tcataaacct 420
gatggtgggc ctagtatgcc atatatgcat gcaccacaga gtcatcttgt cacatcagac 480
acctactctg tgcaactaca gatgactcct tcaaactctg taagaggccc tgtaacttac 540
caaggaaatt atcaaggaaa tccgggactt aaccactcga tggcaggtga gcttggctgg 600
gtacaatgtg catccagtga acttacttat ccagattaca gaccacctcc aaagcaatat 660
ccttatttac cacaaagctt tgtgcaagac acttctgttc agaaacaaaa ctttgtgtca 720
tctacatcat tacaagttaa aaataatcag cttccacctt ctacacagac cttaccatca 780
aagcgccctg tacctgtgtc gtcatatcag tatgctgcag aaaccagcaa aagactccct 840
ccccccccct tacagctgta gatatggaag cattcagaaa tgcactcgtc tgaaaaaaag 900
aaagatgctt acaaagtctt tcaacagcag tggcagagca ctagtaaaaa tgtcagtaca 960
ataggaaaat tctgtgagtt gaaaattaat acaaaacagt cttacaatga ctctgctggc 1020
tcttctgggg atggtgttca tactcttgtt caaaataatc aagaagaaag aaagtattct 1080
tataatccaa gtacaaatca aatactagac acaaatgtca caaaagaaaa g 1131
<210> 75
<211> 396
<212> PRT
<213> Cricetulus griseus
<400> 75
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Tyr Ser Cys Arg Tyr
275 280 285
Gly Ser Gln His Val Gln Asn Ser Gln Ser Val Ser Arg His Leu Pro
290 295 300
Val Glu Val Pro Gln Ser Ser Glu Met His Ser Ser Glu Lys Lys Lys
305 310 315 320
Asp Ala Tyr Lys Val Phe Gln Gln Gln Trp Gln Ser Thr Ser Lys Asn
325 330 335
Val Ser Thr Ile Gly Lys Phe Cys Glu Leu Lys Ile Asn Thr Lys Gln
340 345 350
Ser Tyr Asn Asp Ser Ala Gly Ser Ser Gly Asp Gly Val His Thr Leu
355 360 365
Val Gln Asn Asn Gln Glu Glu Arg Lys Tyr Ser Tyr Asn Pro Ser Thr
370 375 380
Asn Gln Ile Leu Asp Thr Asn Val Thr Lys Glu Lys
385 390 395
<210> 76
<211> 297
<212> PRT
<213> Cricetulus griseus
<400> 76
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Tyr Ser Cys Arg Tyr
275 280 285
Gly Ser Gln His Val Gln Val Cys Phe
290 295
<210> 77
<211> 293
<212> PRT
<213> Cricetulus griseus
<400> 77
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Tyr Ser Cys Arg Tyr
275 280 285
Gly Ser Gln His Val
290
<210> 78
<211> 286
<212> PRT
<213> Cricetulus griseus
<400> 78
Met Asn Trp Asn Ala Lys Pro Glu Asn Ala Ala Pro Asn Pro Pro Tyr
1 5 10 15
Ser Lys Ser Gln Ser Ser Leu Leu Gln Gln Phe Leu Met Pro Ser Thr
20 25 30
Thr Ser Gln Ser Ser Phe Ser Cys Leu Pro His Asn Gln Glu Ala Cys
35 40 45
Ile Tyr Pro Thr Asn Ser Asn Ser Val Ser Gln Pro Leu Leu Asn Val
50 55 60
Arg Ser Phe Ile Asn Pro Pro Ile Ser Val Ser Asn Val His Asn Arg
65 70 75 80
Thr Val Val Ala Ser Gln Thr Ser Val Glu Arg Val Thr Tyr Thr Asn
85 90 95
Val Lys Gly Ala Gln Gln Pro Asn His Asn Leu Gln Thr Val Ser Ser
100 105 110
Gly Val Val Gln Asn Ala Trp Met Asn Ser Thr Met Arg Asn Phe Met
115 120 125
Pro Ser Leu Thr Glu Ala Thr Ile Ser His Lys Pro Asp Gly Gly Pro
130 135 140
Ser Met Pro Tyr Met His Ala Pro Gln Ser His Leu Val Thr Ser Asp
145 150 155 160
Thr Tyr Ser Val Gln Leu Gln Met Thr Pro Ser Asn Ser Val Arg Gly
165 170 175
Pro Val Thr Tyr Gln Gly Asn Tyr Gln Gly Asn Pro Gly Leu Asn His
180 185 190
Ser Met Ala Gly Glu Leu Gly Trp Val Gln Cys Ala Ser Ser Glu Leu
195 200 205
Thr Tyr Pro Asp Tyr Arg Pro Pro Pro Lys Gln Tyr Pro Tyr Leu Pro
210 215 220
Gln Ser Phe Val Gln Asp Thr Ser Val Gln Lys Gln Asn Phe Val Ser
225 230 235 240
Ser Thr Ser Leu Gln Val Lys Asn Asn Gln Leu Pro Pro Ser Thr Gln
245 250 255
Thr Leu Pro Ser Lys Arg Pro Val Pro Val Ser Ser Tyr Gln Tyr Ala
260 265 270
Ala Glu Thr Ser Lys Arg Leu Pro Pro Pro Pro Leu Gln Leu
275 280 285
<---