СИСТЕМА РЕДАКТИРОВАНИЯ ГЕНОМА ДРОЖЖЕЙ DEBARYOMYCES HANSENII НА ОСНОВЕ CRISPR/CAS9
Вид РИД
Изобретение
Изобретение относится к генной инженерии и может быть использовано для экспрессии нуклеазы Cas9 в промышленно ценных штаммах Debaryomyces hansenii.
Эффективные генетические инструменты для манипуляции с геномами разработаны для всех хорошо изученных модельных организмов-продуцентов, таких как Escherichia coli или Saccharomyces cerevisiae. Несмотря на простоту генетических модификаций дрожжи S. cerevisiae не удобны для производства гетерологичных белков, это связано с относительно низкой эффективностью их систем внеклеточной секреции белков и нежелательным гипергликозилированием секретируемых белков, которое часто инактивирует эти белки. Поэтому в последние годы растёт интерес к так называемым «нетрадиционным» дрожжам, которые имеют специфичные особенности метаболизма, позволяющие преодолеть ряд трудностей в продукции гетерологичных белков. Одним из представителей «нетрадиционных» дрожжей является Debaryomyces hansenii.
Debaryomyces hansenii - это непатогенный, экстремофильный, маслянистый аскомицет, первоначально выделенный из морской воды и обычно встречающийся в условиях высокой осмотической и соленой среды [см. BREUER U, Harms H. (2006) Debaryomyces hansenii - an extremophilic yeast with biotechnological potential. Yeast 23: 415-437; Prista C. et al. (2016) The halotolerant Debaryomyces hansenii, the Cinderella of non-conventional yeasts. Yeast 33: 523-533].
Debaryomyces hansenii способны расти в экстремальных условиях, например, при высоких концентрациях NaCl, например, 10-25% NaCl [BUTINAR L. et al. (2005) Yeast diversity in hypersaline habitats. Fems Microbiol Lett 244: 229-234]), широком диапазоне температур 15-35°С [NAKASE T., Suzuki M (1985) Taxonomic studies on Debaryomyces hansenii (Zopf) Lodder et Kreger-van Rij and related species. I. Chemotaxonomic investigations. J Gen Appl Microbiol 31: 49-69.] и широком диапазоне рН от 3,0 до 10,0 [BREUER U., Harms H. (2006)].
Debaryomyces hansenii особенно известен своей ассоциацией с ферментацией мяса и сыров, а также производством тонких химических веществ, таких как ксилит и рибофлавин [BREUER U., HARMS H. (2006); PRISTA C. et al. (2016)]. Научный интерес к D. hansenii сосредоточен вокруг его осмотолерантности и галотолерантности, а также его экстремофильной и маслянистой природы [BANSAL P.K., Mondal A.K. Isolation and sequence of the HOG1 homologue from Debaryomyces hansenii by complementation of the hog1 Delta strain of Saccharomyces cerevisiae. Yeast 2000, 16: 81-88].
Подобные особенности обуславливают его важность при производстве некоторых пищевых продуктов, включая различные типы мясных и сырных продуктов, а также при производстве соевых соусов.
Применение в пищевой промышленности и многочисленные исследования данного вида дрожжей позволяют судить о безвредности в отношении здоровья человека, что дает возможность рассматривать его как перспективную экспрессионную системы и применять Debaryomyces hansenii в качестве продуцента ферментов [VIANA P. A. et al. "Debaryomyces hansenii UFV-1 Intracellular α-Galactosidase Characterization and Comparative Studies with the Extracellular Enzyme". Journal of Agricultural and Food Chemistry, 2009, 57(6), 2515-2522. doi:10.1021/jf8030919; NOBRE A. et al. "A physiological and enzymatic study of Debaryomyces hansenii growth on xylose- and oxygen-limited chemostats". Appl Microbiol Biotechnol., 2002, 59:509-516, DOI 10.1007/s00253-002-1050-4; CALAHORRA M. et al. "Activation of fermentation by salts in Debaryomyces hansenii". FEMS Yeast Res, 2009, 9, p.1293-1301, DOI:10.1111/j.1567-1364.2009.00556.x].
Применение Debaryomyces hansenii в биотехнологическом производстве затруднено из-за отсутствия эффективных генетических инструментов используемых при работе с геномом данных дрожжей.
Известно несколько плазмид, сконструированных для D. hansenii.
Плазмиды pMR95 и pMR96 были сконструированы с автономно реплицирующимися последовательностями (ARS), нативными для D. hansenii, идентифицированными с помощью скрининга геномной библиотеки в S. cerevisiae [GOVIND N.S., Banaszak A.T. (1992) Isolation and characterization of an autonomously replicating sequence (ARSD) from the marine yeast Debaryomyces hansenii. Mol Mar Biol Biotechnol 1: 215-218]. Плазмида pMR95 была сконструирована путем включения автономной системы репликации (ARS), гена устойчивости к бактериальному гигромицину B (hyg) и промотора и терминатора CYC1, происходящих из S. cerevisiae. В плазмиду pMR96 добавили ген S. cerevisiae URA3 в качестве прототрофного маркера. Частоты трансформации плазмид в D. hansenii были низкими при выборе для гена Hyg, поэтому требуются дальнейшие исследования для улучшения эффективности трансформации данных дрожжей [RICAURTE M.L., Govind N.S. (1999) Construction of plasmid vectors and transformation of the marine yeast Debaryomyces hansenii. Mar Biotechnol 1: 15-19].
Известна разработка системы трансформации для D. hansenii, которая основана на гистидиновом ауксотрофном штамме реципиента и гене DhHIS4 в качестве селектируемого маркера. Две плазмиды, pGEM-HIS4 и pDhARS2, были сконструированы на основе использования ARS от D. hansenii. Плазмиду pDhARS2 использовали в качестве основы для конструирования восьми плазмид с различными ARS, три из которых, pDhARS2, pDhARS3 и pDhARS9, показали эффективную трансформацию. Две плазмиды, pDH4 и pDH11, были сконструированы с геном DhHIS4, а также с ARS, происходящим из D. hansenii. Это исследование впервые продемонстрировало нарушение генов у D. hansenii путем гомологичной рекомбинации [MINHAS A, et al. (2009) Development of host and vector for high-efficiency transformation and gene disruption in Debaryomyces hansenii. FEMS Yeast Res 9: 95-102].
Шесть эписомальных экспрессирующих векторов для D. hansenii были сконструированы с использованием терминатора, производного от S. cerevisiae, пять из шести векторов были сконструированы с индуцибельными гетерологичными промоторами из S. cerevisiae, а конечный вектор был сконструирован с эндогенным промотором D. hansenii. Все векторы имели ORI E. coli, ген bla, ауксотрофный маркер урацила URA3, ARS из D. hansenii и репортер GFPm3.1. Наивысшие уровни экспрессии GFP были достигнуты с промотором GPD1 из D. hansenii в среде с 6% NaCl. В дополнение к высокому уровню экспрессии, достигнутому c промотором GPD1d, у D. hansenii был обнаружен низкий уровень секретируемого белка. 5-кратное снижение флуоресценции относительно общего уровня белка произошло во внеклеточной фракции GFP D. hansenii [MAGGI R.G., Govind N.S. (2004) Regulated expression of green fluorescent protein in Debaryomyces hansenii. J Ind Microbiol Biot 31: 301-310].
Известен интегративный вектор экспрессии, первоначально разработанный для Arxula adeninivorans, который был применен для трансформации множества видов дрожжей, включая D. hansenii. Вектор содержит консервативную последовательность 25S рДНК, полученную из A. adeninivorans, для нацеливания, промотор TEF1, полученный из A. adeninivorans, для контроля экспрессии репортерной последовательности, и ген hph, полученный из Escherichia coli, придающий устойчивость к гигромицину B, для отбора рекомбинантов. Экспрессию гетерологичного гена оценивали с использованием репортерного гена зеленого флуоресцентного белка (GFP). Хотя интеграция генов была успешной, D. hansenii продемонстрировал самый слабый сигнал экспрессии GFP [TERENTIEV Y. et al. (2004) A wide-range integrative yeast expression vector system based on Arxula adeninivorans-derived elements. J Ind Microbiol Biotechnol 31: 223-228].
Эти исследования подчеркивают необходимость дополнительной оптимизации и расширения генетического инструментария для D. hansenii.
Одной из причин отсутствия эффективных методов манипуляции с геномной ДНК in vivo для D. hansenii являются отклонения от стандартного генетического кода у этих дрожжей. Так, кодон CTG обычно кодирует лейцин, однако, у D. hansenii он кодирует серин. Таким образом, актуальна проблема создания методов геномной инженерии D. hansenii, которые могут значительно ускорить его исследования и реализацию его биотехнологического потенциала.
В целях детального исследования физиологических процессов дрожжевых клеток для получения новых штаммов продуцентов, создания новых лекарственных средств разрабатываются новые инструменты генной и геномной инженерии дрожжей. Одним из таких инструментов стала система CRISPR/Cas9 из бактерий Streptococcus pyogenes. С помощью этой системы повысилась эффективность внесения изменений в геном дрожжей, а также расширился набор вносимых изменений. Система CRISPR/Cas9 адаптирована к редактированию геномов различных видов дрожжей: Saccharomyces cerevisiae, Kluyveromyces lactis, Yarrowia lipolytica, Pichia pastoris, Candida albicans, Candida glabrata, Schizosaccharomyces pombe и других [RASCHMANOVÁ H., et al. Implementing CRISPR-Cas technologies in conventional and non-conventional yeasts: Current state and future prospects. Biotechnology Advances 36 (2018) 641-665].
При разработке системы CRISPR/Cas9 для редактирования данного вида дрожжей учитываются особенности его генетического кода, частота использования кодонов, отбираются наиболее сильные промоторы для высокой экспрессии компонентов системы. Выбираются способы искусственного процессинга химерного транскрипта, состоящего из нескольких направляющих РНК. Отдельное внимание уделяется контролю активностей клеточных систем репарации ДНК, чтобы повысить эффективность внесения интересующего типа изменения в геном.
Известна конструкция нуклеиновой кислоты, способная осуществлять конститутивную экспрессию Cas9 в дрожжах. Конструкция нуклеиновой кислоты содержит дрожжевой промотор Tef1, оперативно связанный с геном Cas9, источник репликации от pBR322 и его метку скрининга, а также область репликации от CEN6ARS4 и метку скрининга. Конструкция нуклеиновой кислоты находится в форме репликации одной копии в дрожжах и многокопийной репликации в Escherichia coli (CN106480083 A, 08.03.2017). В указанной заявке не сообщается об использовании конструкции в дрожжах Debaryomyces hansenii для экспрессии Cas9.
Наиболее близким к заявленным изобретениям является модификация генома дрожжевой клетки Candida, включающая: а) введение в дрожжевую клетку первой нуклеиновой кислоты, содержащей совместимую с Candida CRISPR/Cas9 нуклеотидную последовательность (CaCas9); б) введение в дрожжевую клетку второй нуклеиновой кислоты, содержащей кодирующую последовательность sgRNA; и с) экспрессию кодирующих последовательностей CaCas9 и sgRNA в дрожжевой клетке, тем самым модифицируя геном дрожжевой клетки. Система CaCas9 обеспечивает высокоэффективный мутагенез у Candida (US 2017166928 A1, 15.06.2017).
В заявке US 2017166928 не сообщается о мутагенезе Debaryomyces hansenii с использованием CaCas9.
Из данных отечественной и зарубежной литературы, патентов и патентных заявок авторам не известно создание и использование генетических конструкций на базе системы CRISPR/Cas9 для редактирования генома Debaryomyces hansenii.
Задачей заявленной группы изобретений является разработка CRISPR/Cas9 системы редактирования генома D. hansenii, которая позволяет получить мутанты, экспрессирующие нуклеазу Cas9.
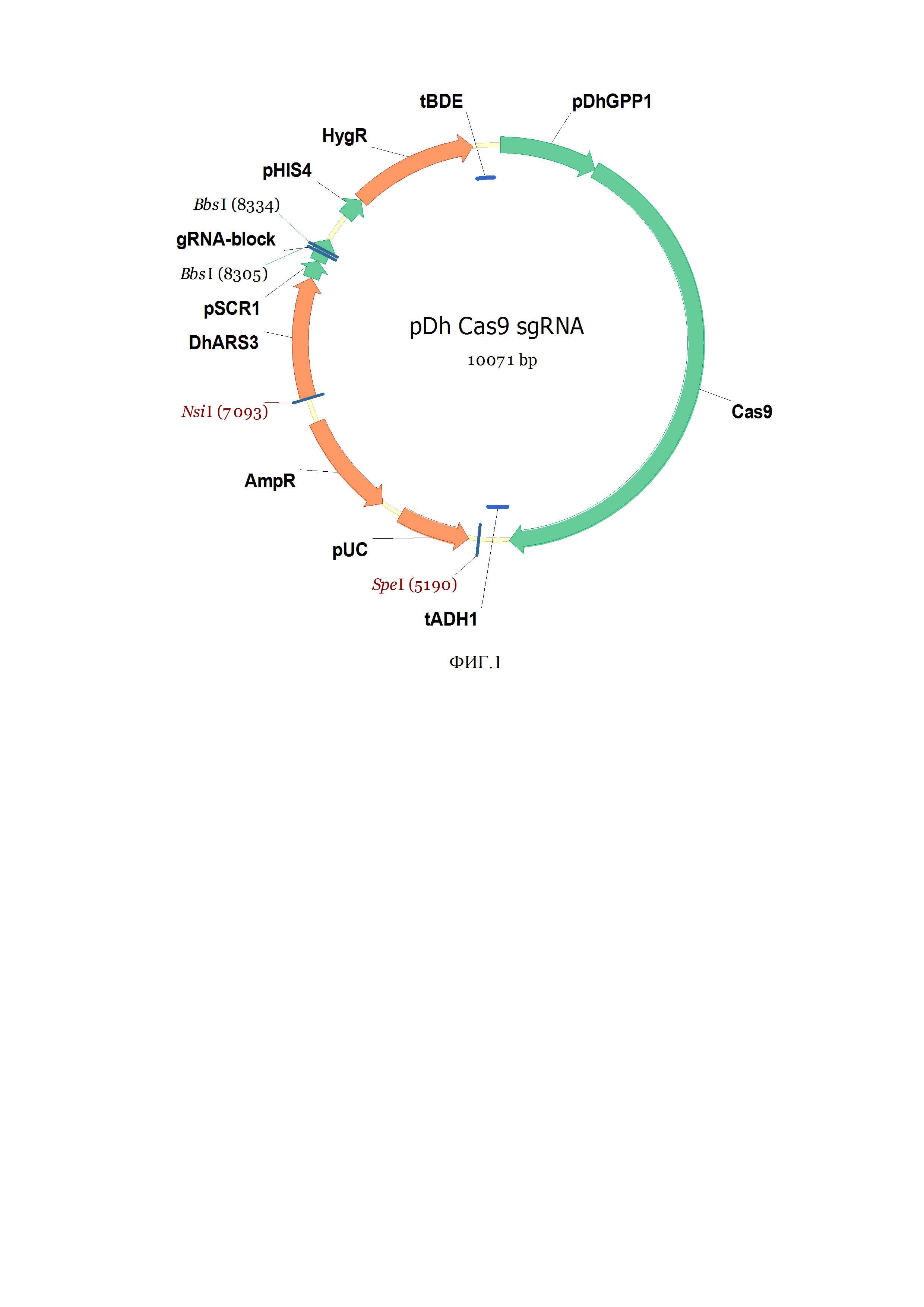
Решение поставленной задачи достигается тем, что получают генетическую конструкцию pDhCas9sgRNA (фиг.1, SEQ ID NO.1) на основе системы редактирования генома CRISPR/Cas9, которая кодирует нуклеазу Сas9, экспрессируемую в клетке Debaryomyces hansenii и специфически транспортируемую в клеточное ядро.
Изобретение обеспечивает синтез нуклеазы Cas9 в дрожжах Debaryomyces hansenii и эффективное редактирование хромосомальной ДНК.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Штамм и среды.
Все эксперименты проводились на штамме Debaryomyces hansenii Y-3014 (http://vkpm.genetika.ru/katalog-mikroorganizmov/cat3002516002721/).
Штаммы наращивались на жидкой среде YPD (10 г/л дрожжевой экстракт, 20 г/л пептона, 20 г/л глюкоза). В качестве твёрдой среды использовалась агаризованная среда YPDa (YPD + 2% агароза). Трансформанты рассевались на среде YPDa с добавление 1М сорбитола и гигромицина 200 мкг/мл.
Генетическая конструкция на основе системы редактирования генома CRISPR/Cas9, кодирующая нуклеазу Cas9, специфически импортируемую в клетки D. hansenii Y-3014, представляет собой плазмиду pDhCas9sgRNA (фиг.1, SEQ ID NO.1), разработанную на базе вектора pUC19 (Invitrogen).
Конструкция плазмиды pDhCas9sgRNA (фиг.1) содержит:
• pDhGPP1 - промотор Cas9 1 п.н. - 800 п.н. из D. hansenii,
• Cas9 - нуклеаза Cas9 801 п.н. - 4940 п.н. Streptococcus pyogenes,
• tADH1 - терминатор 4941 п.н. - 5129 п.н. взят из генома Saccharomyces cerevisiae,
• SpeI - нуклаза рестрикции 5190 п.н. (#ER1251 Thermo Scientific),
• pUC - ориджин репликации E. Coli 5269 п.н. - 5857 п.н.,
• AmpR - ген устойчивости к ампициллину 6031 п.н. - 6888 п.н., pUC и AmpR часть идёт из плазмиды pUC19,
• NsiI - нуклаза рестрикции 7093 п.н. (#ER0731 Thermo Scientific),
• DhARS3 - автореплицирующаяся последовательность 7095 п.н. - 8085 п.н из генома D. hansenii,
• pSCR1 - промотор РНК-субъединицы распознавания сигнала SRP 8087 п.н. - 8232 п.н D. hansenii,
• BbsI - нуклаза рестрикции, сайты лигирования спейсеров 8305 п.н., 8334 п.н. (#ER1011 Thermo Scientific),
• gRNA-block - гидовая (направляющая) РНК 8233 п.н. - 8430 п.н. стандартная синтетическая последовательность sgRNA,
• pHIS4 - гистидиновый промотор 8659 п.н. - 8840 п.н. из D. hansenii.
• HygR - ген устойчивости к гигромицину 8841 п.н. - 9863 п.н. ген устойчивости к гигромицину E. сoli,
• tBDE - терминатор 4-бутандиол диакрилатэстеразы 9864 п.н. - 10029 п.н из генома D. hansenii.
Техническим результатом изобретения является получение системы, позволяющей редактировать геном D. hansenii c эффективностью от 45 до 95%.
Достижение технического результата обусловлено следующим:
1. получением рекомбинантного штамма дрожжей D. hansenii путем трансформации плазмидой pDhCas9sgRNA (фиг.1, SEQ ID NO.1) нативного штамма дрожжей Debaryomyces hansenii Y-3014.
2. оптимизацией элементов плазмиды pDhCas9sgRNA для дрожжей D. hansenii.
Перечень фигур:
Фиг. 1. Физическая карта рекомбинантной плазмиды pDhCas9sgRNA.
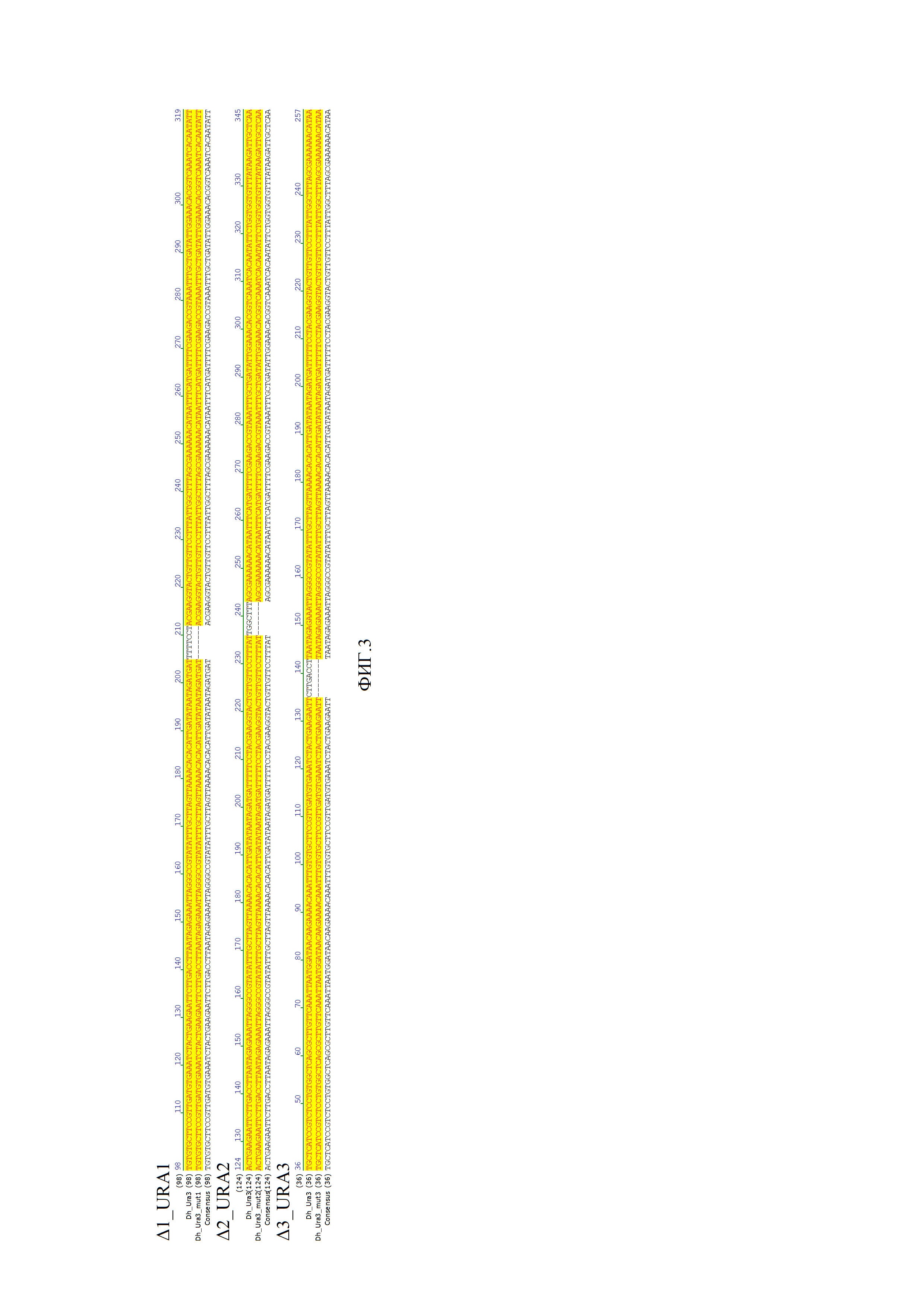
Фиг. 2. представляет собой фото чашки, содержащей флюоротовую кислоту, где WT- дикий штамм, Δ1 - мутант №1, Δ2 - мутант №2, Δ3 - мутант №3.
Фиг. 3. демонстрирует участок, в котором произошла делеция, что подтверждается при наложении на последовательность гена URA3 дикого штамма.
Фиг. 4. показывает, что колонии, содержащие делеции, не окрашиваются в синий цвет. Количество мутантов составляет от 40 до 60%. WT- дикий штамм, Δ1 - мутант №1, Δ2 - мутант №2, Δ3 - мутант №3.
Фиг. 5. демонстрирует участок, в котором произошла делеция, что подтверждается при наложении на последовательность гена дикого штамма.
Осуществление изобретения
Пример 1. Получение рекомбинантной плазмиды pDhCas9sgRNA с нуклеотидной последовательностью SEQ ID NO. 1.
Плазмида включает функциональную нуклеазу Cas9, имеющую последовательность аминокислот, как представлено в SEQ ID NO. 2 или в SEQ ID NO. 3 положения 801..4940.
Функциональная часть CRISPR/Cas9 системы включала в себя ориджин репликации DhARS3) (A. MINHAS et al. Developmentof host and vector for high-efciency transformation and gene disruption inDebaryomyces hansenii. FEMS Yeast Research, 2009, v.9, Issue 1, pp.95-102).
В качестве маркёра использовался ген резистентности к гигромицину под промотором гена гистидина pHIS4 D. hansenii, терминатор был взят от гена 4-бутандиол диакрилат эстераза (D. hansenii) tBDE. Промотор для Cas9 был так же взят из нативного генома D. hansenii от гена галактозы-1-фосфат фосфатазы (pDhGPP1). Терминатор для Cas-белка был взят от гена алкогольдегидрогеназы (tADH1).
Синтез функциональной части системы Cas9 был заказан у GenScript.
После получения образца ДНК-и, лиофилизат был восстановлен в воде mQ. Далее для клонирования данного участка в вектор pUC19 с праймерами DhCas9_F и DhCas9_R был поставлена полимеразная цепная реакция с Phusion® High-Fidelity DNA Polymerase (# M0530S, NEB). После наработки участка функциональной части Cas9, ампликон был почищен на колонке GeneJET PCR Purification Kit фирмы Thermo Scientific. Для линирезации pUC19 (#SD0061 Thermo Scientific), использовали рестриктазы SpeI (#ER1251 Thermo Scientific) и NsiI (#ER0731 Thermo Scientific). Теми же рестриктазами подготавливали и концы ДНК у ампликона с функциональной частью Cas9-системы.
Далее смешивали линерезованную плазмиду и подготовленный ампликон и ставили лигирование с T4 DNA Ligase (#EL0014 Thermo Scientific). Через час лигазной смесью трансформировали компетентные клетки NEB Turbo (C2984I, NEB https://international.neb.com/products/c2984-neb-turbo-competent-e-coli-high-efficiency#Product%20Information) методом Heat Shock (https://www.addgene.org/protocols/bacterial-transformation/). Полученные трансформанты высевали на чашки Петри с ампицилином. Для наработки плазмиды трансформанты растили на жидкой среде LB с ампицилином и выделяли с помощью GeneJET Plasmid Miniprep Kit (#K0502, Thermo Scientific).
Праймеры для клонирования участка Cas9 в pUC19:
DhCas9_F с сайтом рестрикции SpeI:
5' - ATATAACTAGTAACGCAGGAAAGAACATG
DhCas9_R с сайтом рестрикции NsiI:
5' - ATATAATGCATACGAAAGGGCCTCGTG.
Для получения «заряженной» системы pDhCas9sgRNA (т.е. системы с лигированными в неё спейсерами): в плазмиду pDhCas9sgRNA спейсеры лигировали по сайтам BbsI (ER1011 Thermo Scientific).
Праймеры для спейсеров (участки мишени для действия нуклеазы):
Δ1_URA3_F:
5' - TGCGCAGAGGAACAACAGTACCTTCGT
Δ1_URA3_R:
5' - AAACACGAAGGTACTGTTGTTCCTCTG
Δ2_URA3_F:
5' - TTGCGCAGAGGTACTGTTGTTCCTTTAT
Δ2_URA3_R:
5' - AAACATAAAGGAACAACAGTACCTCTG
Δ3_URA3_F:
5' - TGCGCAGCGGCCCTAATTTCTCTATTA
Δ3_URA3_R:
5' - AAACTAATAGAGAAATTAGGGCCGCTG
Δ1_αGal1_F:
5' - TGCGCAGGTAGAAAATGGGTCTTCCAG
Δ1_αGal1_R:
5' - AAACCTGGAAGACCCATTTTCTACCTG
Δ2_αGal2_F:
5' - TGCGCAGCGTAGGCTTGTGTAGAACCA
Δ2_αGal2_R:
5' - AAACTGGTTCTACACAAGCCTACGCTG
Δ3_αGal3_F:
5' - TGCGCAGCAGCGCAAATCAGCTATAAG
Δ3_αGal3_R:
5' - AAACCTTATAGCTGATTTGCGCTGCTG.
Пример 2. Трансформация D. hansenii плазмидой pDhCas9sgRNA.
Методика трансформации сферопласт D. hansenii, была модифицирована из описанной ранее для Candida famata (VORONOVSKY A. A. et al. Development of a transformation system for the flavinogenic yeast Candida famata, FEMS Yeast Research 2 (2002), pp. 203-253). Свежеразмузееные клетки растили на среде YPD до образования моноколоний, далее переносили и инокулировали в 3 мл YPD, культивирование проходило при аэрации приблизительно 24 ч при 28°С. После, доращивая до 0,4-0,8 при OD600, клетки были собраны центрифугированием, 5000 об/минуту 5 минут. Далее клетки отмывали в равном объёме буфера A (1M cахароза, 25 мМ ЭДТА, 50 мМ дитиотритола). После осаждения клетки промывали 1М сахарозой и далее осадок ресуспензировали в буфере Б (1М сахароза, 0,1М цитрат натрия рН 5,8, 10 мМ ЭДТА). Клетки перемешивали с добавлением литиказы (1000 U на 20 мг сухого веса клеток) и выдерживали 1 час при 30°С. Сферопласты собирали при 750g в течение 10 минут. Затем сферопласты промывали 1М раствором сахарозы и один раз буфером В (10 мМ CaCL2, 1М сахарозы, 10 мМ Трис-HCl рН 7,5) далее осадок ресуспензировали в 0,5 мл буфера В. К 100 мкл сферопластов добавляли 5 мкг плазмиды pDhCas9sgRNA и выдерживали при комнатной темпертуре (22-25°C) 15 минут. Далее добавляли 1 мл 20% PEG3350 c 10 мМ CaCl2 и оставили при комнатной температуре на 10 минут. После центрифугирования при 750g в течение 5 минут осадок ресуспензировали в 150 мкл среды SOS (YPD, 1M сахарозы). Далее оставляли при комнатной темпертуре (22-25°C) в течение 20 минут и далее рассевали 100-200 мкл на чашки Петри. Трансформанты росли в течение 4-6 дней при температуре 28°С.
Пример 3. Подтверждение трансформация D. hansenii и экспрессии Cas9.
Действие нуклеазы Cas9 и её работу можно детектировать при действии её на ДНК и соответствующим изменениям свойств штамма D. hansenii. Экспрессия целевого гена подтверждается делецией и изменением свойств исследуемого штамма.
Штаммы наращивались на жидкой среде YPD (10 г/л дрожжевой экстракт, 20 г/л пептона, 20 г/л глюкоза). В качестве твёрдой среды использовалась агаризованная среда YPDa (YPD + 2% агароза). Трансформанты рассевались на среде YPDa с добавление 1М сорбитола и гигромицина 200 мкг/мл.
Выделение ДНК для передачи на секвенирование.
Для оценки эффективности редактирования CRISPR/Cas9-системой дрожжей D. hansenii методом секвенирования была выделена ДНК при помощи набора GeneJET Genomic DNA Purification Kit (Thermo Scientific). В качестве лизирующего агента дрожжей использовалась литиказа (Lyticase from Arthrobacter luteus, Sigma).
Для секвенирования использовались праймеры:
URA3_seq_F:
5' - GGTTAAAACCCAAACGTACAC
URA3_seq_R:
5' - CCAGTCTTCTTTAAATATGC
α-Gal_seq_F:
5' - CTTGCAGCTATCTCGACGC
α-Gal _seq_R:
5' - TACCCAAGTCTTCGTCAGT.
Для проверки делеции в гене URA3 использовалась методика с 5-флюоротовой кислотой (Sigma #F5013) (D. BOEKE et al. 5-Fluoroorotic acid as a selective agent in yeast molecular genetics. Methods in Enzymology. 1987, v. 154, pp.164-175). Мутанты, имеющие делеции в гене URA3 лишаются активности оротидин-5'-фосфатдекарбоксилазы, в связи с чем свободно растут на среде содержащей флуоротовую кислоту (YPDa + 0,5мкг флюоротовой кислоты).
Разработанные спейсеры (регионы направляющей РНК (gRNA), комплементарные участку ДНК мишени) позволили получить мутанты и привели к потере активности гена URA3.
Подтверждение делеции нуклеотидов было получено при помощи секвенирования:
Результаты представлены на фиг.2 и 3. Фигура 2 представляет собой фото чашки содержащей флюоротовую кислоту, где WT- дикий штамм, Δ1 - мутант №1, Δ2 - мутант №2, Δ3 - мутант №3. Количество мутантов составляет от 40 до 60 процентов. Фигура 3 демонстрирует участок, в котором произошла делеция, что подтверждается при наложении на ДНК дикого штамма.
Проверка делеции в гене альфа-галактозидазы проводилась по методике описанной в статье AHO S. et al. (AHO S. et al. Novel Reporter GeneMEL1for the Yeast Two-Hybrid System, Analytical Biochemistry. 1997, v. 253, Issue 2, pp. 270-272).
Определение активности альфа-галактозидазы детектировали на среде YPSLa (10 г/л дрожжевой экстракт, 20 г/л пептона, 20 г/л лактоза, 2% агароза + X-α-Gal (Sigma #16555)).
Мутанты, имеющие делеции в гене альфа-галактозидазы лишаются её активности, вследствие чего перестают расщеплять X-α-Gal.
Разработанные спейсеры позволили получить мутанты и привели к потере активности гена X-α-Gal.
Подтверждение делеции нуклеотидов было получено при помощи секвенирования.
Результаты представлены на фиг.4 и 5.
При создании мутантов по гену альфа-амилазы получаются колонии неспособные гидролизовать X-α-Gal, вследствие чего не происходит окраска колоний в синий цвет. На фиг. 4 видно, сколько колоний окрасилось в синий цвет (дикие штаммы без мутаций) и белые колонии - колонии, имеющие мутации в гене альфа-амилазы, приведшие к потере функции данного фермента. На фиг. 4 видно, что количество мутантов составляет от 40 до 60%. Фигура 5 демонстрирует участок, в котором произошла делеция, что подтверждается при наложении на ДНК дикого штамма.
Таким образом, подтверждена трансформация D. hansenii плазмидой pDhCas9sgRNA на основе системы CRISPR/Cas9 и экспрессия Cas9 в клетках дрожжей.
--->
ПОСЛЕДОВАТЕЛЬНОСТЬ
<110> ssnab
<120> СИСТЕМA РЕДАКТИРОВАНИЯ ГЕНОМА ДРОЖЖЕЙ DEBARYOMYCES HANSENII НА ОСНОВЕ CRISPR/CAS9
<160> 4
<170> BiSSAP 1.3.6
<210> 1
<211> 10071
<212> DNA
<213> Debaryomyces hansenii
<220>
<223> pDhCas9sgRNA
<400> 1
ttattcctcc tttgggcctg tatcatggtc tttaagaatc ataggacatt ttactcgttc 60
ccattgggcc agtactgtac caacactgtg cccacaatag atccagaatt attgtcgtcg 120
catgcgtcct tactaccgta cgtatatgtt ctagagtagt atccaactcg tacctctaga 180
ctacgagaga tccatcacaa atccgtggta gttccacaga tccaagaggt ccaagaaaat 240
taaacctaat tttgacacca gcgctgctat cgtttttccg atcttcactg taatatcgag 300
ctatcgtggg tattctcgtg gtccttctaa aaccgttgca agcggttttt aaccacaaaa 360
agaaataatg gaacaatttc caaaagaaat aaaattacaa aatcaaccgt gaattacccg 420
ttttggtcaa tttgtttccg atcaattacg taataggttt tttatttctg ttggccacaa 480
taccaccgga acataacttt acacttttag agcgtattat atggtaacat accggaatca 540
agcgtatata gcgcatcaaa agcatcgtta cgtaatagaa ttttcaagaa aatggcgtta 600
cgtaataaga tgatgataac caaaaaaaaa aatcgtatgc tagagtagta cattcagata 660
gctagacatt tctttttgtt gaaggaaata attgatgaat ataaataccg tggtaatccc 720
tgttacaatg gataaataaa atatatattt ttacagtatt caatactttc attaatacaa 780
acataataaa ataaattaca atggacaaga agtactccat cggactcgac atcggaacca 840
actccgtcgg atgggccgtc atcaccgacg agtacaaggt cccatccaag aagttcaagg 900
tcctcggaaa caccgaccgt cactccatca agaagaacct catcggagcc ctcctcttcg 960
actccggaga gaccgccgag gccacccgtc tcaagcgtac cgcccgtcgt cgttacaccc 1020
gtcgtaagaa ccgtatctgc tacctccagg agatcttctc caacgagatg gccaaggtcg 1080
acgactcctt cttccaccgt ctcgaggagt ccttcctcgt cgaggaggac aagaagcacg 1140
agcgtcaccc aatcttcgga aacatcgtcg acgaggtcgc ctaccacgag aagtacccaa 1200
ccatctacca cctccgtaag aagctcgtcg actccaccga caaggccgac ctccgtctca 1260
tctacctcgc cctcgcccac atgatcaagt tccgtggaca cttcctcatc gagggagacc 1320
tcaacccaga caactccgac gtcgacaagc tcttcatcca gctcgtccag acctacaacc 1380
agctcttcga ggagaaccca atcaacgcct ccggagtcga cgccaaggcc atcctctccg 1440
cccgtctctc caagtcccgt cgtctcgaga acctcatcgc ccagctccca ggagagaaga 1500
agaacggact cttcggaaac ctcatcgccc tctccctcgg actcacccca aacttcaagt 1560
ccaacttcga cctcgccgag gacgccaagc tccagctctc caaggacacc tacgacgacg 1620
acctcgacaa cctcctcgcc cagatcggag accagtacgc cgacctcttc ctcgccgcca 1680
agaacctctc cgacgccatc ctcctctccg acatcctccg tgtcaacacc gagatcacca 1740
aggccccact ctccgcctcc atgatcaagc gttacgacga gcaccaccag gacctcaccc 1800
tcctcaaggc cctcgtccgt cagcagctcc cagagaagta caaggagatc ttcttcgacc 1860
agtccaagaa cggatacgcc ggatacatcg acggaggagc ctcccaggag gagttctaca 1920
agttcatcaa gccaatcctc gagaagatgg acggaaccga ggagctcctc gtcaagctca 1980
accgtgagga cctcctccgt aagcagcgta ccttcgacaa cggatccatc ccacaccaga 2040
tccacctcgg agagctccac gccatcctcc gtcgtcagga ggacttctac ccattcctca 2100
aggacaaccg tgagaagatc gagaagatcc tcaccttccg tatcccatac tacgtcggac 2160
cactcgcccg tggaaactcc cgtttcgcct ggatgacccg taagtccgag gagaccatca 2220
ccccttggaa cttcgaggag gtcgtcgaca agggagcctc cgcccagtcc ttcatcgagc 2280
gtatgaccaa cttcgacaag aacctcccaa acgagaaggt cctcccaaag cactccctcc 2340
tctacgagta cttcaccgtc tacaacgagc tcaccaaggt caagtacgtc accgagggaa 2400
tgcgtaagcc agccttcctc tccggagagc agaagaaggc catcgtcgac ctcctcttca 2460
agaccaaccg taaggtcacc gtcaagcagc tcaaggagga ctacttcaag aagatcgagt 2520
gcttcgactc cgtcgagatc tccggagtcg aggaccgttt caacgcctcc ctcggaacct 2580
accacgacct cctcaagatc atcaaggaca aggacttcct cgacaacgag gagaacgagg 2640
acatcctcga ggacatcgtc ctcaccctca ccctcttcga ggaccgtgag atgatcgagg 2700
agcgtctcaa gacctacgcc cacctcttcg acgacaaggt catgaagcag ctcaagcgtc 2760
gtcgttacac cggatgggga cgtctctccc gtaagctcat caacggaatc cgtgacaagc 2820
agtccggaaa gaccatcctc gacttcctca agtccgacgg attcgccaac cgtaacttca 2880
tgcagctcat ccacgacgac tccctcacct tcaaggagga catccagaag gcccaggtct 2940
ccggacaggg agactccctc cacgagcaca tcgccaacct cgccggatcc ccagccatca 3000
agaagggaat cctccagacc gtcaaggtcg tcgacgagct cgtcaaggtc atgggacgtc 3060
acaagccaga gaacatcgtc atcgagatgg cccgtgagaa ccagaccacc cagaagggac 3120
agaagaactc ccgtgagcgt atgaagcgta tcgaggaggg aatcaaggag ctcggatccc 3180
agatcctcaa ggagcaccca gtcgagaaca cccagctcca gaacgagaag ctctacctct 3240
actacctcca gaacggacgt gacatgtacg tcgaccagga gctcgacatc aaccgtctct 3300
ccgactacga cgtcgaccac atcgtcccac agtccttcct caaggacgac tccatcgaca 3360
acaaggtcct cacccgttcc gacaagaacc gtggaaagtc cgacaacgtc ccatccgagg 3420
aggtcgtcaa gaagatgaag aactactggc gtcagctcct caacgccaag ctcatcaccc 3480
agcgtaagtt cgacaacctc accaaggccg agcgtggagg actctccgag ctcgacaagg 3540
ccggattcat caagcgtcag ctcgtcgaga cccgtcagat caccaagcac gtcgcccaga 3600
tcctcgactc ccgtatgaac accaagtacg acgagaacga caagctcatc cgtgaggtca 3660
aggtcatcac cctcaagtcc aagctcgtct ccgacttccg taaggacttc cagttctaca 3720
aggtccgtga gatcaacaac taccaccacg cccacgacgc ctacctcaac gccgtcgtcg 3780
gaaccgccct catcaagaag tacccaaagc tcgagtccga gttcgtctac ggagactaca 3840
aggtctacga cgtccgtaag atgatcgcca agtccgagca ggagatcgga aaggccaccg 3900
ccaagtactt cttctactcc aacatcatga acttcttcaa gaccgagatc accctcgcca 3960
acggagagat ccgtaagcgt ccactcatcg agaccaacgg agagaccgga gagatcgtct 4020
gggacaaggg acgtgacttc gccaccgtcc gtaaggtcct ctccatgcca caggtcaaca 4080
tcgtcaagaa aaccgaggtc cagaccggag gattctccaa ggagtccatc ctcccaaagc 4140
gtaactccga caagctcatc gcccgtaaga aggactggga cccaaagaag tacggaggat 4200
tcgactcccc aaccgtcgcc tactccgtcc tcgtcgtcgc caaggtcgag aagggaaagt 4260
ccaagaagct caagtccgtc aaggagctcc tcggaatcac catcatggag cgttcctcct 4320
tcgagaagaa cccaatcgac ttcctcgagg ccaagggata caaggaggtc aagaaggacc 4380
tcatcatcaa gctcccaaag tactccctct tcgagctcga gaacggacgt aagcgtatgc 4440
tcgcctccgc cggagagctc cagaagggaa acgagctcgc cctcccatcc aagtacgtca 4500
acttcctcta cctcgcctcc cactacgaga agctcaaggg atccccagag gacaacgagc 4560
agaagcagct cttcgtcgag cagcacaagc actacctcga cgagatcatc gagcagatct 4620
ccgagttctc caagcgtgtc atcctcgccg acgccaacct cgacaaggtc ctctccgcct 4680
acaacaagca ccgtgacaag ccaatccgtg agcaggccga gaacatcatc cacctcttca 4740
ccctcaccaa cctcggagcc ccagccgcct tcaagtactt cgacaccacc atcgaccgta 4800
agcgttacac ctccaccaag gaggtcctcg acgccaccct catccaccag tccatcaccg 4860
gactctacga gacccgtatc gacctctccc agctcggagg agactcccgt gccgacccaa 4920
agaagaagcg taaggtctga agcgaatttc ttatgattta tgatttttat tattaaataa 4980
gttataaaaa aaataagtgt atacaaattt taaagtgact cttaggtttt aaaacgaaaa 5040
ttcttattct tgagtaactc tttcctgtag gtcaggttgc tttctcaggt atagtatgag 5100
gtcgctctta ttgaccacac ctctaccggt ctagacccta gaggctcact caaaggcggt 5160
aatacggtta tccacagaat caggggatac tagtaacgca ggaaagaaca tgtgagcaaa 5220
aggccagcaa aaggccagga accgtaaaaa ggccgcgttg ctggcgtttt tccataggct 5280
ccgcccccct gacgagcatc acaaaaatcg acgctcaagt cagaggtggc gaaacccgac 5340
aggactataa agataccagg cgtttccccc tggaagctcc ctcgtgcgct ctcctgttcc 5400
gaccctgccg cttaccggat acctgtccgc ctttctccct tcgggaagcg tggcgctttc 5460
tcatagctca cgctgtaggt atctcagttc ggtgtaggtc gttcgctcca agctgggctg 5520
tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta tccggtaact atcgtcttga 5580
gtccaacccg gtaagacacg acttatcgcc actggcagca gccactggta acaggattag 5640
cagagcgagg tatgtaggcg gtgctacaga gttcttgaag tggtggccta actacggcta 5700
cactagaagg acagtatttg gtatctgcgc tctgctgaag ccagttacct tcggaaaaag 5760
agttggtagc tcttgatccg gcaaacaaac caccgctggt agcggtggtt tttttgtttg 5820
caagcagcag attacgcgca gaaaaaaagg atctcaagaa gatcctttga tcttttctac 5880
ggggtctgac gctcagtgga acgaaaactc acgttaaggg attttggtca tgagattatc 5940
aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga agttttaaat caatctaaag 6000
tatatatgag taaacttggt ctgacagtta ccaatgctta atcagtgagg cacctatctc 6060
agcgatctgt ctatttcgtt catccatagt tgcctgactc cccgtcgtgt agataactac 6120
gatacgggag ggcttaccat ctggccccag tgctgcaatg ataccgcgag acccacgctc 6180
accggctcca gatttatcag caataaacca gccagccgga agggccgagc gcagaagtgg 6240
tcctgcaact ttatccgcct ccatccagtc tattaattgt tgccgggaag ctagagtaag 6300
tagttcgcca gttaatagtt tgcgcaacgt tgttgccatt gctacaggca tcgtggtgtc 6360
acgctcgtcg tttggtatgg cttcattcag ctccggttcc caacgatcaa ggcgagttac 6420
atgatccccc atgttgtgca aaaaagcggt tagctccttc ggtcctccga tcgttgtcag 6480
aagtaagttg gccgcagtgt tatcactcat ggttatggca gcactgcata attctcttac 6540
tgtcatgcca tccgtaagat gcttttctgt gactggtgag tactcaacca agtcattctg 6600
agaatagtgt atgcggcgac cgagttgctc ttgcccggcg tcaatacggg ataataccgc 6660
gccacatagc agaactttaa aagtgctcat cattggaaaa cgttcttcgg ggcgaaaact 6720
ctcaaggatc ttaccgctgt tgagatccag ttcgatgtaa cccactcgtg cacccaactg 6780
atcttcagca tcttttactt tcaccagcgt ttctgggtga gcaaaaacag gaaggcaaaa 6840
tgccgcaaaa aagggaataa gggcgacacg gaaatgttga atactcatac tcttcctttt 6900
tcaatattat tgaagcattt atcagggtta ttgtctcatg agcggataca tatttgaatg 6960
tatttagaaa aataaacaaa taggggttcc gcgcacattt ccccgaaaag tgccacctga 7020
cgtctaagaa accattatta tcatgacatt aacctataaa aataggcgta tcacgaggcc 7080
ctttcgtatg catatgaaac acatggaccc aatgactgaa taaagttatt tgacttcatg 7140
aatttaaacc aatgatttac tgtatcttgt tgtatgtttg ggttttgaac gagcaattca 7200
gtcaatattt tcatctgatc aataattaga agatgacttt ccgtatttat tatctcatct 7260
aatgagtctg aaacccccgt aataaatgat ctattcgcaa ctgatttgat caattcttcg 7320
aggctattta ttaaatcatt ggtgtatgtt ttagaaagat atatctcctt tcccaagttc 7380
tgaatagtcg acgaagtttc tgaattagat ttattgttta acaattcaat aaccaagcga 7440
agaactattc ttctttctct caatactctg ctggaataaa gcaaaattct ttcttcttct 7500
agatattttt ctctatcatc tggcaatttg gattttaatt tttcataatt ataaaccttt 7560
ctttcaggga tccgtttaca agtttggctt attactctca acacatcgtt gtaatctaaa 7620
ttcaaaacat tacttatggt ttcggcgtct ttaatattat ttggtgttat gtctgaatat 7680
aaaatattac gcaacgataa ttctttagcc tccttattag gacttttggt cacacgttta 7740
aacggtaatg gattcaacaa tagcttactg tttagaagta gaaattcatc taatgcaaca 7800
agaatatatg ggtcttgata tgatttcaat aatgaaaggg cattgtcgaa tccccataat 7860
tgagtaggtt gaatgggttt caaaggttta acttccttgg ccgcctttag ctctacggta 7920
gaaacaggca tattcaaacc tttaggaata tctctttata gtacggatct gatattggat 7980
atcttttacg ctgttgctta tatgtttttg tttcgatgtg tgagatggtg gaaatttttg 8040
acttcctaaa tcggaaataa ctgcgaaatg gaaatacaac cctaccatat cagaccgaac 8100
atatctcact ttttttcatt tttctatgct gtgatggcgt atggcagaag cgcgcagatt 8160
gtgtactttt gattctttat tacagtttaa gtgtccggtt cgatctctgc ggtcgcaaac 8220
ttgtgaattt gaacaattag cgcaaatggt ttagtggtaa aatccaacgt tgccatcgtt 8280
gggcccccgg ttcgattccg ggtttgcgca gtcttctggt acccagaaga cctgttttag 8340
agctagaaat agcaagttaa aataaggcta gtccgttatc aacttgaaaa agtggcaccg 8400
agtcggtggt gctttttttg ttttttatgt aatatcggtt gttacaaaga agcagcggaa 8460
catttactta gtggcttatc aatgcaccaa gtcgaaggag ttcaaacgga tgcgtcaagc 8520
acgctaaacc ataatcaatc gacttccttg acagaaactt tgaagagagc ttttattgca 8580
ttggatcgca gagatttgtt ggagaaggtc aaacctgaca tggatataaa tcaattcaga 8640
ggtgaattta gcttttaaga ggttgcagat gttcttagta catagtaata acatgaaaat 8700
ggtcaggtga ccaccatgac tcagtctaaa attttctcaa aagatactgg agcatagata 8760
aaagatagtt gaagttagcg gttaatatta gtagtataca tttccgataa atataagaga 8820
taaatctgta ttagtataat atgaaaaagc ctgaactcac cgcgacgtct gtcgagaagt 8880
ttctaatcga aaagttcgac agcgtctccg acctaatgca gctctcggag ggcgaagaat 8940
ctcgtgcttt cagcttcgat gtaggagggc gtggatatgt cctacgggta aatagctgcg 9000
ccgatggttt ctacaaagat cgttatgttt atcggcactt tgcatcggcc gcgctcccga 9060
ttccggaagt gcttgacatt ggggagttta gcgagagcct aacctattgc atctcccgcc 9120
gtgcacaggg tgtcacgttg caagacctac ctgaaaccga actacccgct gttctacaac 9180
cggtcgcgga ggctatggat gcgatcgctg cggccgatct tagccagacg agcgggttcg 9240
gcccattcgg accgcaagga atcggtcaat acactacatg gcgtgatttc atatgcgcga 9300
ttgctgatcc ccatgtgtat cactggcaaa ctgtgatgga cgacaccgtc agtgcgtccg 9360
tcgcgcaggc tctcgatgag ctaatgcttt gggccgagga ctgccccgaa gtccggcacc 9420
tcgtgcacgc ggatttcggc tccaacaatg tcctaacgga caatggccgc ataacagcgg 9480
tcattgactg gagcgaggcg atgttcgggg attcccaata cgaggtcgcc aacatcttct 9540
tctggaggcc gtggttggct tgtatggagc agcagacgcg ctacttcgag cggaggcatc 9600
cggagcttgc aggatcgcca cgactccggg cgtatatgct ccgcattggt cttgaccaac 9660
tctatcagag cttggttgac ggcaatttcg atgatgcagc ttgggcgcag ggtcgatgcg 9720
acgcaatcgt ccgatccgga gccgggactg tcgggcgtac acaaatcgcc cgcagaagcg 9780
cggccgtctg gaccgatggc tgtgtagaag tactcgccga tagtggaaac cgacgcccca 9840
gcactcgtcc gagggcaaag aaataatgta actaagtacc aagtttagag taatcttgta 9900
tagacaaaat atatttaatt aagcgtatgc taactttatt atatagttct gctggtcaac 9960
aaaaattagt agttaaaaat cttgaatcat attagttcta taatttggat ttggttgact 10020
cttctctagg ggctgcagga attcgatatc aagcttatcg ataccgtcga c 10071
<210> 2
<211> 1379
<212> PRT
<213> Debaryomyces hansenii
<220>
<223> Cas9
<400> 2
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala Lys
1010 1015 1020
Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser
1025 1030 1035 1040
Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu
1045 1050 1055
Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile
1060 1065 1070
Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser
1075 1080 1085
Met Pro Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly
1090 1095 1100
Phe Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1105 1110 1115 1120
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp Ser
1125 1130 1135
Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu Lys Gly
1140 1145 1150
Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly Ile Thr Ile
1155 1160 1165
Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala
1170 1175 1180
Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys
1185 1190 1195 1200
Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser
1205 1210 1215
Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr
1220 1225 1230
Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys His
1250 1255 1260
Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys Arg Val
1265 1270 1275 1280
Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys
1285 1290 1295
His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu
1300 1305 1310
Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp
1315 1320 1325
Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp
1330 1335 1340
Ala Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1345 1350 1355 1360
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys Lys
1365 1370 1375
Arg Lys Val
<210> 3
<211> 10071
<212> DNA
<213> Debaryomyces hansenii
<220>
<223> /plasmid="pDhCas9sgRNA"
<220>
<221> CDS
<222> 801..4940
<223> /gene="Cas9"
/transl_table=12
<400> 3
ttattcctcc tttgggcctg tatcatggtc tttaagaatc ataggacatt ttactcgttc 60
ccattgggcc agtactgtac caacactgtg cccacaatag atccagaatt attgtcgtcg 120
catgcgtcct tactaccgta cgtatatgtt ctagagtagt atccaactcg tacctctaga 180
ctacgagaga tccatcacaa atccgtggta gttccacaga tccaagaggt ccaagaaaat 240
taaacctaat tttgacacca gcgctgctat cgtttttccg atcttcactg taatatcgag 300
ctatcgtggg tattctcgtg gtccttctaa aaccgttgca agcggttttt aaccacaaaa 360
agaaataatg gaacaatttc caaaagaaat aaaattacaa aatcaaccgt gaattacccg 420
ttttggtcaa tttgtttccg atcaattacg taataggttt tttatttctg ttggccacaa 480
taccaccgga acataacttt acacttttag agcgtattat atggtaacat accggaatca 540
agcgtatata gcgcatcaaa agcatcgtta cgtaatagaa ttttcaagaa aatggcgtta 600
cgtaataaga tgatgataac caaaaaaaaa aatcgtatgc tagagtagta cattcagata 660
gctagacatt tctttttgtt gaaggaaata attgatgaat ataaataccg tggtaatccc 720
tgttacaatg gataaataaa atatatattt ttacagtatt caatactttc attaatacaa 780
acataataaa ataaattaca atg gac aag aag tac tcc atc gga ctc gac atc 833
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile
1 5 10
gga acc aac tcc gtc gga tgg gcc gtc atc acc gac gag tac aag gtc 881
Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val
15 20 25
cca tcc aag aag ttc aag gtc ctc gga aac acc gac cgt cac tcc atc 929
Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile
30 35 40
aag aag aac ctc atc gga gcc ctc ctc ttc gac tcc gga gag acc gcc 977
Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala
45 50 55
gag gcc acc cgt ctc aag cgt acc gcc cgt cgt cgt tac acc cgt cgt 1025
Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg
60 65 70 75
aag aac cgt atc tgc tac ctc cag gag atc ttc tcc aac gag atg gcc 1073
Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala
80 85 90
aag gtc gac gac tcc ttc ttc cac cgt ctc gag gag tcc ttc ctc gtc 1121
Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val
95 100 105
gag gag gac aag aag cac gag cgt cac cca atc ttc gga aac atc gtc 1169
Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly Asn Ile Val
110 115 120
gac gag gtc gcc tac cac gag aag tac cca acc atc tac cac ctc cgt 1217
Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg
125 130 135
aag aag ctc gtc gac tcc acc gac aag gcc gac ctc cgt ctc atc tac 1265
Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr
140 145 150 155
ctc gcc ctc gcc cac atg atc aag ttc cgt gga cac ttc ctc atc gag 1313
Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu
160 165 170
gga gac ctc aac cca gac aac tcc gac gtc gac aag ctc ttc atc cag 1361
Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln
175 180 185
ctc gtc cag acc tac aac cag ctc ttc gag gag aac cca atc aac gcc 1409
Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala
190 195 200
tcc gga gtc gac gcc aag gcc atc ctc tcc gcc cgt ctc tcc aag tcc 1457
Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser
205 210 215
cgt cgt ctc gag aac ctc atc gcc cag ctc cca gga gag aag aag aac 1505
Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn
220 225 230 235
gga ctc ttc gga aac ctc atc gcc ctc tcc ctc gga ctc acc cca aac 1553
Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn
240 245 250
ttc aag tcc aac ttc gac ctc gcc gag gac gcc aag ctc cag ctc tcc 1601
Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser
255 260 265
aag gac acc tac gac gac gac ctc gac aac ctc ctc gcc cag atc gga 1649
Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly
270 275 280
gac cag tac gcc gac ctc ttc ctc gcc gcc aag aac ctc tcc gac gcc 1697
Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala
285 290 295
atc ctc ctc tcc gac atc ctc cgt gtc aac acc gag atc acc aag gcc 1745
Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala
300 305 310 315
cca ctc tcc gcc tcc atg atc aag cgt tac gac gag cac cac cag gac 1793
Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His His Gln Asp
320 325 330
ctc acc ctc ctc aag gcc ctc gtc cgt cag cag ctc cca gag aag tac 1841
Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr
335 340 345
aag gag atc ttc ttc gac cag tcc aag aac gga tac gcc gga tac atc 1889
Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile
350 355 360
gac gga gga gcc tcc cag gag gag ttc tac aag ttc atc aag cca atc 1937
Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile
365 370 375
ctc gag aag atg gac gga acc gag gag ctc ctc gtc aag ctc aac cgt 1985
Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg
380 385 390 395
gag gac ctc ctc cgt aag cag cgt acc ttc gac aac gga tcc atc cca 2033
Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro
400 405 410
cac cag atc cac ctc gga gag ctc cac gcc atc ctc cgt cgt cag gag 2081
His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu
415 420 425
gac ttc tac cca ttc ctc aag gac aac cgt gag aag atc gag aag atc 2129
Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile
430 435 440
ctc acc ttc cgt atc cca tac tac gtc gga cca ctc gcc cgt gga aac 2177
Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn
445 450 455
tcc cgt ttc gcc tgg atg acc cgt aag tcc gag gag acc atc acc cct 2225
Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro
460 465 470 475
tgg aac ttc gag gag gtc gtc gac aag gga gcc tcc gcc cag tcc ttc 2273
Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe
480 485 490
atc gag cgt atg acc aac ttc gac aag aac ctc cca aac gag aag gtc 2321
Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val
495 500 505
ctc cca aag cac tcc ctc ctc tac gag tac ttc acc gtc tac aac gag 2369
Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu
510 515 520
ctc acc aag gtc aag tac gtc acc gag gga atg cgt aag cca gcc ttc 2417
Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe
525 530 535
ctc tcc gga gag cag aag aag gcc atc gtc gac ctc ctc ttc aag acc 2465
Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr
540 545 550 555
aac cgt aag gtc acc gtc aag cag ctc aag gag gac tac ttc aag aag 2513
Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys
560 565 570
atc gag tgc ttc gac tcc gtc gag atc tcc gga gtc gag gac cgt ttc 2561
Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe
575 580 585
aac gcc tcc ctc gga acc tac cac gac ctc ctc aag atc atc aag gac 2609
Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp
590 595 600
aag gac ttc ctc gac aac gag gag aac gag gac atc ctc gag gac atc 2657
Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile
605 610 615
gtc ctc acc ctc acc ctc ttc gag gac cgt gag atg atc gag gag cgt 2705
Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg
620 625 630 635
ctc aag acc tac gcc cac ctc ttc gac gac aag gtc atg aag cag ctc 2753
Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met Lys Gln Leu
640 645 650
aag cgt cgt cgt tac acc gga tgg gga cgt ctc tcc cgt aag ctc atc 2801
Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile
655 660 665
aac gga atc cgt gac aag cag tcc gga aag acc atc ctc gac ttc ctc 2849
Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu
670 675 680
aag tcc gac gga ttc gcc aac cgt aac ttc atg cag ctc atc cac gac 2897
Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp
685 690 695
gac tcc ctc acc ttc aag gag gac atc cag aag gcc cag gtc tcc gga 2945
Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly
700 705 710 715
cag gga gac tcc ctc cac gag cac atc gcc aac ctc gcc gga tcc cca 2993
Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala Gly Ser Pro
720 725 730
gcc atc aag aag gga atc ctc cag acc gtc aag gtc gtc gac gag ctc 3041
Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu
735 740 745
gtc aag gtc atg gga cgt cac aag cca gag aac atc gtc atc gag atg 3089
Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val Ile Glu Met
750 755 760
gcc cgt gag aac cag acc acc cag aag gga cag aag aac tcc cgt gag 3137
Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu
765 770 775
cgt atg aag cgt atc gag gag gga atc aag gag ctc gga tcc cag atc 3185
Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile
780 785 790 795
ctc aag gag cac cca gtc gag aac acc cag ctc cag aac gag aag ctc 3233
Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu
800 805 810
tac ctc tac tac ctc cag aac gga cgt gac atg tac gtc gac cag gag 3281
Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu
815 820 825
ctc gac atc aac cgt ctc tcc gac tac gac gtc gac cac atc gtc cca 3329
Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro
830 835 840
cag tcc ttc ctc aag gac gac tcc atc gac aac aag gtc ctc acc cgt 3377
Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg
845 850 855
tcc gac aag aac cgt gga aag tcc gac aac gtc cca tcc gag gag gtc 3425
Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val
860 865 870 875
gtc aag aag atg aag aac tac tgg cgt cag ctc ctc aac gcc aag ctc 3473
Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu
880 885 890
atc acc cag cgt aag ttc gac aac ctc acc aag gcc gag cgt gga gga 3521
Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly
895 900 905
ctc tcc gag ctc gac aag gcc gga ttc atc aag cgt cag ctc gtc gag 3569
Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu
910 915 920
acc cgt cag atc acc aag cac gtc gcc cag atc ctc gac tcc cgt atg 3617
Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp Ser Arg Met
925 930 935
aac acc aag tac gac gag aac gac aag ctc atc cgt gag gtc aag gtc 3665
Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val
940 945 950 955
atc acc ctc aag tcc aag ctc gtc tcc gac ttc cgt aag gac ttc cag 3713
Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln
960 965 970
ttc tac aag gtc cgt gag atc aac aac tac cac cac gcc cac gac gcc 3761
Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala His Asp Ala
975 980 985
tac ctc aac gcc gtc gtc gga acc gcc ctc atc aag aag tac cca aag 3809
Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys
990 995 1000
ctc gag tcc gag ttc gtc tac gga gac tac aag gtc tac gac gtc cgt 3857
Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg
1005 1010 1015
aag atg atc gcc aag tcc gag cag gag atc gga aag gcc acc gcc aag 3905
Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys
1020 1025 1030 1035
tac ttc ttc tac tcc aac atc atg aac ttc ttc aag acc gag atc acc 3953
Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr
1040 1045 1050
ctc gcc aac gga gag atc cgt aag cgt cca ctc atc gag acc aac gga 4001
Leu Ala Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly
1055 1060 1065
gag acc gga gag atc gtc tgg gac aag gga cgt gac ttc gcc acc gtc 4049
Glu Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
cgt aag gtc ctc tcc atg cca cag gtc aac atc gtc aag aaa acc gag 4097
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr Glu
1085 1090 1095
gtc cag acc gga gga ttc tcc aag gag tcc atc ctc cca aag cgt aac 4145
Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn
1100 1105 1110 1115
tcc gac aag ctc atc gcc cgt aag aag gac tgg gac cca aag aag tac 4193
Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr
1120 1125 1130
gga gga ttc gac tcc cca acc gtc gcc tac tcc gtc ctc gtc gtc gcc 4241
Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala
1135 1140 1145
aag gtc gag aag gga aag tcc aag aag ctc aag tcc gtc aag gag ctc 4289
Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu
1150 1155 1160
ctc gga atc acc atc atg gag cgt tcc tcc ttc gag aag aac cca atc 4337
Leu Gly Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile
1165 1170 1175
gac ttc ctc gag gcc aag gga tac aag gag gtc aag aag gac ctc atc 4385
Asp Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1180 1185 1190 1195
atc aag ctc cca aag tac tcc ctc ttc gag ctc gag aac gga cgt aag 4433
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys
1200 1205 1210
cgt atg ctc gcc tcc gcc gga gag ctc cag aag gga aac gag ctc gcc 4481
Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala
1215 1220 1225
ctc cca tcc aag tac gtc aac ttc ctc tac ctc gcc tcc cac tac gag 4529
Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu
1230 1235 1240
aag ctc aag gga tcc cca gag gac aac gag cag aag cag ctc ttc gtc 4577
Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val
1245 1250 1255
gag cag cac aag cac tac ctc gac gag atc atc gag cag atc tcc gag 4625
Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu
1260 1265 1270 1275
ttc tcc aag cgt gtc atc ctc gcc gac gcc aac ctc gac aag gtc ctc 4673
Phe Ser Lys Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu
1280 1285 1290
tcc gcc tac aac aag cac cgt gac aag cca atc cgt gag cag gcc gag 4721
Ser Ala Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu
1295 1300 1305
aac atc atc cac ctc ttc acc ctc acc aac ctc gga gcc cca gcc gcc 4769
Asn Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
ttc aag tac ttc gac acc acc atc gac cgt aag cgt tac acc tcc acc 4817
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser Thr
1325 1330 1335
aag gag gtc ctc gac gcc acc ctc atc cac cag tcc atc acc gga ctc 4865
Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr Gly Leu
1340 1345 1350 1355
tac gag acc cgt atc gac ctc tcc cag ctc gga gga gac tcc cgt gcc 4913
Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala
1360 1365 1370
gac cca aag aag aag cgt aag gtc tga agcgaatttc ttatgattta 4960
Asp Pro Lys Lys Lys Arg Lys Val
1375
tgatttttat tattaaataa gttataaaaa aaataagtgt atacaaattt taaagtgact 5020
cttaggtttt aaaacgaaaa ttcttattct tgagtaactc tttcctgtag gtcaggttgc 5080
tttctcaggt atagtatgag gtcgctctta ttgaccacac ctctaccggt ctagacccta 5140
gaggctcact caaaggcggt aatacggtta tccacagaat caggggatac tagtaacgca 5200
ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa ggccgcgttg 5260
ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg acgctcaagt 5320
cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc tggaagctcc 5380
ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc ctttctccct 5440
tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc ggtgtaggtc 5500
gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta 5560
tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc actggcagca 5620
gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga gttcttgaag 5680
tggtggccta actacggcta cactagaagg acagtatttg gtatctgcgc tctgctgaag 5740
ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac caccgctggt 5800
agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg atctcaagaa 5860
gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc acgttaaggg 5920
attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga 5980
agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta ccaatgctta 6040
atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt tgcctgactc 6100
cccgtcgtgt agataactac gatacgggag ggcttaccat ctggccccag tgctgcaatg 6160
ataccgcgag acccacgctc accggctcca gatttatcag caataaacca gccagccgga 6220
agggccgagc gcagaagtgg tcctgcaact ttatccgcct ccatccagtc tattaattgt 6280
tgccgggaag ctagagtaag tagttcgcca gttaatagtt tgcgcaacgt tgttgccatt 6340
gctacaggca tcgtggtgtc acgctcgtcg tttggtatgg cttcattcag ctccggttcc 6400
caacgatcaa ggcgagttac atgatccccc atgttgtgca aaaaagcggt tagctccttc 6460
ggtcctccga tcgttgtcag aagtaagttg gccgcagtgt tatcactcat ggttatggca 6520
gcactgcata attctcttac tgtcatgcca tccgtaagat gcttttctgt gactggtgag 6580
tactcaacca agtcattctg agaatagtgt atgcggcgac cgagttgctc ttgcccggcg 6640
tcaatacggg ataataccgc gccacatagc agaactttaa aagtgctcat cattggaaaa 6700
cgttcttcgg ggcgaaaact ctcaaggatc ttaccgctgt tgagatccag ttcgatgtaa 6760
cccactcgtg cacccaactg atcttcagca tcttttactt tcaccagcgt ttctgggtga 6820
gcaaaaacag gaaggcaaaa tgccgcaaaa aagggaataa gggcgacacg gaaatgttga 6880
atactcatac tcttcctttt tcaatattat tgaagcattt atcagggtta ttgtctcatg 6940
agcggataca tatttgaatg tatttagaaa aataaacaaa taggggttcc gcgcacattt 7000
ccccgaaaag tgccacctga cgtctaagaa accattatta tcatgacatt aacctataaa 7060
aataggcgta tcacgaggcc ctttcgtatg catatgaaac acatggaccc aatgactgaa 7120
taaagttatt tgacttcatg aatttaaacc aatgatttac tgtatcttgt tgtatgtttg 7180
ggttttgaac gagcaattca gtcaatattt tcatctgatc aataattaga agatgacttt 7240
ccgtatttat tatctcatct aatgagtctg aaacccccgt aataaatgat ctattcgcaa 7300
ctgatttgat caattcttcg aggctattta ttaaatcatt ggtgtatgtt ttagaaagat 7360
atatctcctt tcccaagttc tgaatagtcg acgaagtttc tgaattagat ttattgttta 7420
acaattcaat aaccaagcga agaactattc ttctttctct caatactctg ctggaataaa 7480
gcaaaattct ttcttcttct agatattttt ctctatcatc tggcaatttg gattttaatt 7540
tttcataatt ataaaccttt ctttcaggga tccgtttaca agtttggctt attactctca 7600
acacatcgtt gtaatctaaa ttcaaaacat tacttatggt ttcggcgtct ttaatattat 7660
ttggtgttat gtctgaatat aaaatattac gcaacgataa ttctttagcc tccttattag 7720
gacttttggt cacacgttta aacggtaatg gattcaacaa tagcttactg tttagaagta 7780
gaaattcatc taatgcaaca agaatatatg ggtcttgata tgatttcaat aatgaaaggg 7840
cattgtcgaa tccccataat tgagtaggtt gaatgggttt caaaggttta acttccttgg 7900
ccgcctttag ctctacggta gaaacaggca tattcaaacc tttaggaata tctctttata 7960
gtacggatct gatattggat atcttttacg ctgttgctta tatgtttttg tttcgatgtg 8020
tgagatggtg gaaatttttg acttcctaaa tcggaaataa ctgcgaaatg gaaatacaac 8080
cctaccatat cagaccgaac atatctcact ttttttcatt tttctatgct gtgatggcgt 8140
atggcagaag cgcgcagatt gtgtactttt gattctttat tacagtttaa gtgtccggtt 8200
cgatctctgc ggtcgcaaac ttgtgaattt gaacaattag cgcaaatggt ttagtggtaa 8260
aatccaacgt tgccatcgtt gggcccccgg ttcgattccg ggtttgcgca gtcttctggt 8320
acccagaaga cctgttttag agctagaaat agcaagttaa aataaggcta gtccgttatc 8380
aacttgaaaa agtggcaccg agtcggtggt gctttttttg ttttttatgt aatatcggtt 8440
gttacaaaga agcagcggaa catttactta gtggcttatc aatgcaccaa gtcgaaggag 8500
ttcaaacgga tgcgtcaagc acgctaaacc ataatcaatc gacttccttg acagaaactt 8560
tgaagagagc ttttattgca ttggatcgca gagatttgtt ggagaaggtc aaacctgaca 8620
tggatataaa tcaattcaga ggtgaattta gcttttaaga ggttgcagat gttcttagta 8680
catagtaata acatgaaaat ggtcaggtga ccaccatgac tcagtctaaa attttctcaa 8740
aagatactgg agcatagata aaagatagtt gaagttagcg gttaatatta gtagtataca 8800
tttccgataa atataagaga taaatctgta ttagtataat atgaaaaagc ctgaactcac 8860
cgcgacgtct gtcgagaagt ttctaatcga aaagttcgac agcgtctccg acctaatgca 8920
gctctcggag ggcgaagaat ctcgtgcttt cagcttcgat gtaggagggc gtggatatgt 8980
cctacgggta aatagctgcg ccgatggttt ctacaaagat cgttatgttt atcggcactt 9040
tgcatcggcc gcgctcccga ttccggaagt gcttgacatt ggggagttta gcgagagcct 9100
aacctattgc atctcccgcc gtgcacaggg tgtcacgttg caagacctac ctgaaaccga 9160
actacccgct gttctacaac cggtcgcgga ggctatggat gcgatcgctg cggccgatct 9220
tagccagacg agcgggttcg gcccattcgg accgcaagga atcggtcaat acactacatg 9280
gcgtgatttc atatgcgcga ttgctgatcc ccatgtgtat cactggcaaa ctgtgatgga 9340
cgacaccgtc agtgcgtccg tcgcgcaggc tctcgatgag ctaatgcttt gggccgagga 9400
ctgccccgaa gtccggcacc tcgtgcacgc ggatttcggc tccaacaatg tcctaacgga 9460
caatggccgc ataacagcgg tcattgactg gagcgaggcg atgttcgggg attcccaata 9520
cgaggtcgcc aacatcttct tctggaggcc gtggttggct tgtatggagc agcagacgcg 9580
ctacttcgag cggaggcatc cggagcttgc aggatcgcca cgactccggg cgtatatgct 9640
ccgcattggt cttgaccaac tctatcagag cttggttgac ggcaatttcg atgatgcagc 9700
ttgggcgcag ggtcgatgcg acgcaatcgt ccgatccgga gccgggactg tcgggcgtac 9760
acaaatcgcc cgcagaagcg cggccgtctg gaccgatggc tgtgtagaag tactcgccga 9820
tagtggaaac cgacgcccca gcactcgtcc gagggcaaag aaataatgta actaagtacc 9880
aagtttagag taatcttgta tagacaaaat atatttaatt aagcgtatgc taactttatt 9940
atatagttct gctggtcaac aaaaattagt agttaaaaat cttgaatcat attagttcta 10000
taatttggat ttggttgact cttctctagg ggctgcagga attcgatatc aagcttatcg 10060
ataccgtcga c 10071
<---