Результат интеллектуальной деятельности: ПЕСТИВИРУС
Вид РИД
Изобретение
Настоящее изобретение относится к новому пестивирусу, белкам вируса и вакцинам, основанным на этом вирусе и его белках. Изобретение также относится к фрагментам ДНК, содержащим ген вируса, и к ДНК-вакцинам, основанным на генах вируса. Кроме того, изобретение относится к антителам, которые реагируют с новым вирусом, и к диагностическим тестам для выявления вируса или антител к этому вирусу.
На протяжении последних десятилетий во всем мире наблюдается сильное увеличение потребления свиного мяса. Как следствие, увеличивается число и размер ферм, чтобы удовлетворить растущие потребности рынка. Как известно из животноводства в целом, большое количество животных, живущих близко друг к другу, становятся уязвимыми для известных заболеваний и для заболеваний, малоизвестных или маловстречаемых или даже неизвестных до дней крупномасштабного коммерческого сельского хозяйства.
Известно, что одно заболевание, для которого ожидается идентификация возбудителя, существует уже с начала 20 века, когда «танцующие свиньи» упоминались Kinsley в Veterinary Medicine 1922;17. В течение почти столетия было опубликовано несколько статей, описывающих одни и те же симптомы под разными названиями, включая «дрожание свиней», тремор у свиней, Myoclonia Congenita(1) или врожденный тремор (CT)(2). Далее заболевание будет называться CT. Симптомами CT являются тремор головы и ног новорожденных свиней, которые различаются по тяжести, но отсутствуют во время сна. Этот тремор может усугубляться возбуждением и холодом. Он длится от нескольких недель до месяцев, но уменьшается по мере взросления свиней. Хотя дрожание само по себе не вызывает непосредственно смерть, тремор может помешать поросятам найти сосок для сосания. Тогда это может привести к смерти от голода. Болезнь широко распространена и регулярно встречается в свиноводческих хозяйствах по всему миру.
Известно, что CT вызывают несколько патологических состояний, и в настоящее время эти состояния классифицируются в две группы; A и B. Группа А состоит из случаев с видимыми гистологическими поражениями, тогда как в случаях группы В нет видимых поражений. Группа А дополнительно делится на пять подгрупп, основываясь на различных причинах CT. Известно, что случаи группы А-I CT вызваны вирусом классической чумы свиней (CSF). Причиной А-III группы является генетический (сцепленный с полом) дефект, существующий только в породе ландрас, тогда как рецессивный генетический (аутосомно-связанный) дефект в породе седлбек является причиной типа А-IV. Случаи группы A-V вызваны отравлением трихлорфона, интоксикацией, которая часто связана с пищей, обработанной фосфорорганическими соединениями(3, 4).
Случаи группы A-II были и остаются приводящими в наибольшее затруднение. Предполагается, что они вызваны неизвестным инфекционным агентом.
Хотя группу А-II CT в прошлом связывали с инфекцией PCV(5), теперь различные исследования продемонстрировали обратное. Например, PCV отсутствует в нервной ткани свиней с CT(6), и только небольшое, незначительное количество PCV было обнаружено в ткани, не являющейся нервной(4). В целом, до сих пор не существует убедительных доказательств в пользу группы А-II CT. Однако есть достаточные основания полагать, что группа A-II CT вызвана инфекционным агентом. Большинство дрожащих поросят группы A-II рождаются в пометах молодых свиней (то есть самок свиней в период между оплодотворением и их первым выводком), которые недавно были введены в новую среду. Примечательно, что после первого помета с дрожащими поросятами в последующих пометах той же свиноматки почти никогда не обнаруживают признаков CT. Это является показателем того, что у свиноматки развивается какой-то вид иммунитета, защищающего от агента, вызывающего CT. Около 40 лет назад Patterson с соавторами (50) удалось индуцировать группу A-II CT у поросят через экспериментальное инфицирование беременных свиноматок эмульсией спинного мозга, головного мозга и селезенок клинически пораженных свиней.
Но, как указано выше, ни один вызывающий болезнь инфекционный агент не был когда-либо выделен ни у поросят с CT, ни у беременных свиноматок.
Целью настоящего изобретения является создание нового инфекционного агента, который является возбудителем CT группы A-II, а также вакцин, направленных на борьбу с данным заболеванием. Кроме того, целью настоящего изобретения является получение средств для обнаружения и идентификации инфекционного агента, связанного с заболеванием.
С целью окончательного обнаружения и выделения возбудителя группы A-II CT, с сентября 2012 года до начала 2014 года на 8 различных фермах в Нидерландах были получены сыворотка и во многих случаях дополнительный биологический материал поросят, страдающих CT группы A-II. На этих 8 фермах в прошлом имелись поросята с CT (как правило, в одном из четырех пометов, поросята, как обнаружилось, страдали от CT во время пика эпидемии на одной конкретной ферме).
На свиноферме в Нидерландах в начале 2012 года была диагностирована вспышка врожденного тремора типа A-II. В первую очередь поражались поросята, рожденные у молодых свиней, впервые родивших животных, но также иногда поражались много рожавшие свиноматки. Диагноз был основан на клинических наблюдениях и последующем исключении врожденного тремора типов A-I, A-III, A-IV и A-V в качестве возможной причины заболевания. Клинически пораженные поросята демонстрировали дрожь различной степени вследствие чрезмерных мышечных сокращений во время активности. Симптомы уменьшались во время сна. Потеря поросят была вторичным эффектом, вызванным неспособностью пораженных животных прокормить себя, особенно в течение первой недели после рождения. Гистологически головной мозг и спинной мозг характеризовались гипомиелинизацией. (Гистологические аномалии, однако, не всегда обнаруживаются у пораженных поросят. В литературе степень гипомиелинизации также описывается, как переменная). Как дополнительно описано ниже, не все пострадавшие свиньи выжили. У тех, которые выжили, тремор уменьшался и, наконец, исчезал, когда свиньи становились старше. Из 231 пометов, в общей сложности родившихся у молодых свиней, в первые 20 недель 2012 года у молодых свиней в общей сложности родились 48 пометов с симптомами врожденного тремора. Это составляет 21% всех пометов, родившихся у молодых свиней. На пике инфекции, через 8 недель после первоначальной вспышки, 85% пометов у молодых свиней показали поросят с врожденным тремором типа А-II. Процент потери поросят (гибель поросят) до отъема составил 26% в пораженных пометах по сравнению с 11% в непораженных пометах. В пораженных пометах 60% гибели поросят было обусловлено врожденным тремором. Общее количество поросят, рожденных на помет, не пострадало. Врожденный тремор поражал новорожденных поросят как мужского, так и женского пола, а распространенность в помете колебалась между <10% и 100%.
Проблемы с вспышками врожденного тремора продолжались на этой ферме с 2012 года, и пораженные поросята были получены в 2013 и 2014 годах (см. ниже). Тем не менее уровень заболеваемости снизился.
Образцы плазмы крови были получены в марте 2012 г. (6 образцов, все поросята с симптомами CT, где могли быть исключены причины, не связанные с A-II) и в апреле 2012 г. (5 образцов, все поросята с симптомами CT, где могли быть исключены причины, не связанные с A-II). Новый вирус, временно названный «Michael» (M), был обнаружен в 11/11 образцов.
Больше образцов плазмы крови были получены с той же фермы в июле 2012 г. Всего было проанализировано 16 образцов сыворотки от поросят, родившихся от 2 свиноматок и 1 молодой свиньи. Ни у одного из этих поросят не было врожденного тремора. Michael 1 был найден в 1/16 образцах.
Новая вспышка заболевания была диагностирована в январе 2013 года. Для вскрытия были получены четыре новорожденных доколостральных поросенка, у всех были симптомы CT, при которых были исключены причины, не связанные с А-II. Новый вирус был назван Michael 1A, потому что, хотя он произошел из той же фермы, прошло значительное время между первоначальной вспышкой и появлением новых клинических проблем. Новый вирус Michael 1A был обнаружен у 4/4 поросят.
Новая вспышка заболевания была снова диагностирована в марте 2013 года. Для вскрытия были получены три новорожденных доколостральных поросенка, у всех были симптомы CT, при которых были исключены причины, не связанные с А-II. Данный вирус был назван Michael 1B (M 1B). Новый вирус Michael 1B был обнаружен в 3/3 образцах. Головной мозг и спинной мозг демонстрировали признаки демиелинизации (см. фигуру 2).
Новая вспышка заболевания была диагностирована в январе 2014 года. Были получены четыре новорожденных доколостральных поросенка, у всех были выявлены симптомы CT, при которых были исключены причины, не связанные с А-II. Данный вирус был назван Michael 1C (M 1C). Новый вирус Michael 1C был обнаружен в 4/4 образцах. В феврале 2014 года было проведено вскрытие еще 3 поросят, снова все 3 поросенка показали группу А-II CT, а Michael был обнаружен в 3/3 образцах.
Посмертное исследование поросят из вспышек проводили в январе 2013 года, марте 2013 года и феврале 2014 года. Головной мозг и спинной мозг демонстрировали признаки демиелинизации.
В качестве отрицательного контроля для ПЦР и для посмертного исследования использовали всего 7 сывороток, полученных от новорожденных доколостральных поросят с фермы без врожденного тремора типа A-II в анамнезе. Все образцы плазмы были отрицательными на вирус Michael, и патологических аномалий у этих поросят не наблюдалось.
Сравнительный анализ вспышек CT A-II был проведен на 7 других фермах в Нидерландах. Проанализировали образцы CT-пометов, и новый вирус был обнаружен у 100% CT-поросят, у которых был взят преколосторальный материал (материал был взят перед первым приемом молозива или материнского молока).
Новый вирус согласно изобретению еще официально не классифицирован, но на данный момент его лучше всего называть «свиной пестивирус, ассоциированный с врожденным тремором группы A-II». Ниже вирус также будет упоминаться как CTAPV.
Была проанализирована последовательность вирусного генома и выявлено, что новый вирус неожиданно имеет некоторое, хотя и относительно низкое, сходство с семейством Flaviviridae, более конкретно с родом Pestivirus в этом семействе. Известными представителями рода Pestivirus являются вирус классической свиной лихорадки, вирус вирусной диареи крупного рогатого скота и вирус пограничной болезни.
Вирионы пестивирусов имеют диаметр около 50 нм, сферические и покрытые оболочкой, и они содержат одноцепочечную положительно-смысловую РНК длиной около 12 килобаз (кб).
Полноразмерная последовательность ДНК представителя нового вируса представлена в SEQ ID NO:19.
Генетическая организация нового вируса тесно связана с генетической организацией известных пестивирусов (см. фигуру 1). Геном пестивируса кодирует единственный полипротеин NH2-C-Erns-E1-E2-p7-NS2-NS3-NS4a-NS4b-NS5a-NS5b-COOH, который процессируется котрансляционно и посттрансляционно в оба структурных белка («Core» белок (C), и белки Erns, E1 и E2) и неструктурные (NS) белки. Аминоконцевая часть полипротеина расщепляется протеазами клеток-хозяев, и считается, что продукты ее расщепления, ядерный и оболочечный (Erns, E1 и E2) белки, являются основными составляющими частиц пестивируса (вирионов).
Структурный белок Erns, также известный как E0 или gp 44/48, является белком оболочки с уникальным свойством наличия РНКазной активности (12). Он секретируется из инфицированных клеток в относительно большом количестве (13). Однако еще большее количество остается связанным с мембраной (14). Одна из функций Erns, по-видимому, заключается в том, чтобы препятствовать иммунной системе хозяина путем ингибирования интерферонового ответа с применением РНКазной активности (15). По всей видимости, такая роль в вирулентности подтверждается тем фактом, что вирусные штаммы, у которых отсутствуют Erns, аттенуируются (16). E1 и E2, ранее известные как gp33 и gp55 (и ранее по неясной причине также как E1), соответственно, представляют собой два других оболочечных гликопротеина. Структурный белок E2 образует гомодимеры и гетеродимеры с E1 (17, 18). Для проникновения пестивирусов в их хозяина важны главным образом гетеродимеры белка E1 и E2, тогда как Erns для проникновения вируса, по-видимому, не требуется (19, 20). Нейтрализующие антитела в первую очередь нацелены на Erns и E2, и в меньшей степени на E1 (17, 21).
Ген, кодирующий оболочечный белок Erns, состоящий из 216 аминокислот, находится в позиции 1258-1899 SEQ ID NO:19, а ген, кодирующий белок оболочки Е2, состоящий из 211 аминокислоты, находится в позиции 2479-3111 из SEQ ID NO:19. Ген, кодирующий оболочечный белок E1, состоящий из 193 аминокислот, находится в позиции 1900-2478 SEQ ID NO:19.
Пример последовательности ДНК гена, кодирующего оболочечный белок Erns, представлен в SEQ ID NO:1. SEQ ID NO:2 представляет аминокислотную последовательность белка Erns.
Пример последовательности ДНК гена, кодирующего оболочечный белок Е2, представлен в SEQ ID NO:3. SEQ ID NO:4 представляет аминокислотную последовательность белка Е2.
Пример последовательности ДНК гена, кодирующего оболочечный белок Е1, представлен в SEQ ID NO:5. SEQ ID NO:6 представляет аминокислотную последовательность белка Е1.
Полные последовательности нового вируса использовали для создания филогенетических деревьев на основе метода максимального правдоподобия, модели поправки Пуассона и бутстрэп-анализа (500 повторов). Эти деревья были сделаны с использованием программы MEGA, версия 5, используя стандартные настройки. (MEGA5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Koichiro Tamura, Daniel Peterson, Nicholas Peterson, Glen Stecher, Masatoshi Nei and Sudhir Kumar. Mol. Biol. Evol. 28(10): 2731-2739. 2011 doi:10.1093/molbev/msr121 Advance Access publication May 4, 2011).
На фигуре 3 представлено филогенетическое древо, основанное на всей последовательности нового пестивируса. В точках пересечения указано процентное значение уровня поддержки бутсрепа. Поперечины указывают количество нуклеотидных замен на сайт.
Из фигуры 3 ясно, что при том, что пестивирусы, вирус пограничной болезни, пестивирус северных оленей, вирус классической чумы свиней, вирус диареи крупного рогатого скота, пестивирус жирафов и вирус Bungowannah, являются относительно близкородственными, новый вирус согласно изобретению состоит в более дальнем родстве с каждым из данных вирусов.
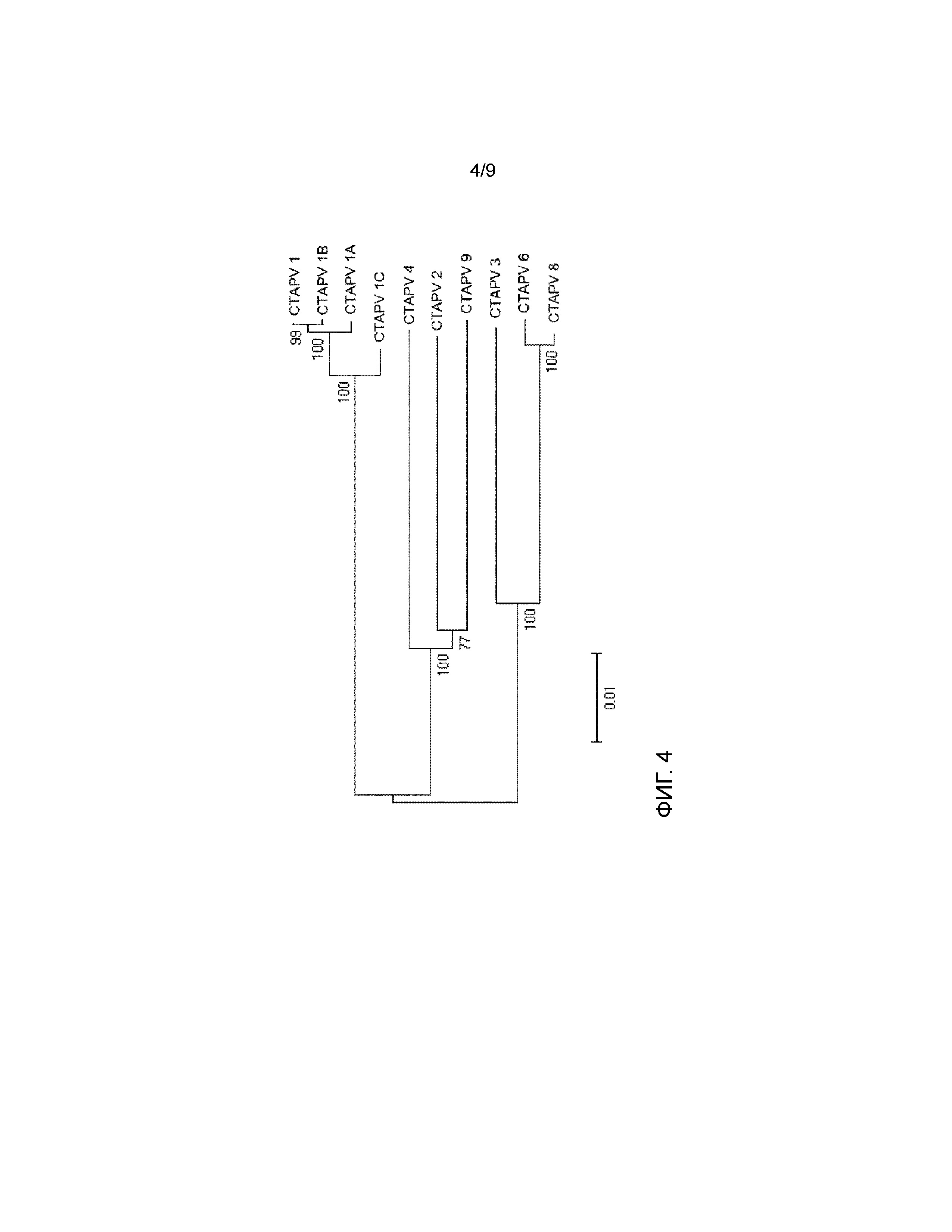
На фигуре 4 представлено филогенетическое древо, в котором сравниваются 10 различных изолятов вируса согласно изобретению.
Можно видеть, что изоляты M1, M1A, M1B и M1C (SEQ ID NO:19, 20, 21, 22), выделенные на той же ферме, но в течение трех лет, наиболее тесно связаны друг с другом. Изоляты с других ферм показывают несколько большее разнообразие. M2, M4 и M9 (SEQ ID NO:23, 25, 29) больше связаны друг с другом, чем с группой M1. То же самое справедливо для M3, M6 и M8 (SEQ ID NO:24, 26, 28). M7 (SEQ ID NO:27) не включен. Это указывает на то, что между изолятами имеются небольшие генетические изменения. Этого можно ожидать для РНК-вирусов, и это наблюдение соответствует тому, что наблюдается для других пестивирусов.
SEQ ID NO:1, 3 и 5 демонстрируют типичные примеры нуклеотидной последовательности генов, кодирующих Erns, E2 и E1 вируса в соответствии с изобретением, соответственно.
SEQ ID NO:2, 4 и 6 демонстрируют типичные примеры аминокислотной последовательности белка Erns, E2 и E1 вируса в соответствии с изобретением, соответственно.
Понятно, что для этих белков могут существовать естественные отклонения между отдельными представителями вируса, связанного с врожденным тремором группы А-II. Существуют генетические отклонения, приводящие к незначительным изменениям в аминокислотной последовательности, например, Erns, E2 и E1. Прежде всего, существует так называемое «колебание во втором и третьем основании», объясняющее, что могут произойти изменения нуклеотидов, которые остаются незамеченными в кодируемой ими аминокислотной последовательности: например, все триплеты TTA, TTG, TCA, TCT, TCG и TCC кодируют лейцин. Кроме того, небольшие отклонения между представителями нового пестивируса свиньи в соответствии с изобретением можно увидеть в аминокислотной последовательности. Эти отклонения могут быть отражены различием (различиями) в аминокислотах в общей последовательности либо делециями, заменами, инсерциями, инверсиями или дополнениями аминокислоты (аминокислот) в указанной последовательности. Замены аминокислот, которые существенно не изменяют биологическую и иммунологическую активности, описаны, например, Neurath с соавт. в «The Proteins» Academic Press New York (1979). Аминокислотные замещения между родственными аминокислотами или замещения, которые часто происходят в процессе эволюции, включают, среди прочего, Ser/Ala, Ser/Gly, Asp/Gly, Asp/Asn, Ile/Val (см. Dayhof, M.D., Atlas of protein sequence and structure, Nat. Biomed. Res. Found., Washington D.C., 1978, vol. 5, suppl. 3). Другие замещения аминокислот включают Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Thr/Phe, Ala/Pro, Lys/Arg, Leu/Ile, Leu/Val и Ala/Glu. Основываясь на этой информации, Lipman и Pearson разработали метод быстрого и чувствительного сравнения белков (Science 227, 1435-1441, 1985) и определения функционального сходства между гомологичными белками. Такие аминокислотные замены иллюстративных вариантов осуществления этого изобретения, а также отклонения, имеющие делеции и/или инсерции, входят в объем изобретения.
Это объясняет, почему Erns, E2 и E1, выделенные из разных представителей пестивируса свиньи согласно изобретению, могут иметь уровни гомологии, которые значительно ниже 100%, в то же время представляя Erns, E2 и E1 нового пестивируса согласно изобретению. Это четко отражено, например, в филогенетическом древе для пестивирусного гена Npro у Becher, P. et al.(49), где показано, что высокоспецифичные пестивирусы, тем не менее, имеют существенно отличающиеся общие геномные нуклеотидные последовательности, а также значительно отличающиеся нуклеотидные последовательности гена Npro.
Таким образом, первый вариант осуществления настоящего изобретения относится к изолированному вирусу, который является членом пестивирусов, причем вирус характеризуется тем, что а) вирус является возбудителем врожденного тремора группы А-II у свиней и б) вирус имеет вирусный геном, содержащий ген, кодирующий оболочечный белок Erns, ген, кодирующий оболочечный белок E2, и ген, кодирующий оболочечный белок E1, при этом нуклеотидная последовательность гена Erns имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:1, и/или нуклеотидная последовательность гена E2 имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, представленной в SEQ ID NO:3, и/или нуклеотидная последовательность гена Е1 имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:5.
Для целей настоящего изобретения уровень идентичности следует понимать, как процент идентичности между, например, последовательностью SEQ ID NO:1 и соответствующей областью, кодирующей Erns пестивируса, уровень идентичности которой следует определить.
Подходящей программой для определения уровня идентичности является nucleotide blast program (blastn) Basic Local Alignment Search Tool NCBI, применяющая опцию «выравнивания двух или более последовательностей» и стандартные настройки (http://blast.ncbi.nlm.nih.gov/Blast.cgi).
Для целей настоящего изобретения выделение означает: освобождение от ткани, с которой вирус связан в природе. Примером выделенного вируса является вирус, каким он присутствует в клеточной культуре.
Предпочтительная форма этого варианта осуществления относится к такому вирусу, который имеет ген Erns, который имеет уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности Erns, как показано в SEQ ID NO:1.
Другая предпочтительная форма этого варианта осуществления относится к такому вирусу, который имеет ген Е2, который имеет уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности гена Е2, как показано в SEQ ID NO:3.
Другая предпочтительная форма этого варианта осуществления снова относится к такому вирусу, который имеет ген Е1, который имеет уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности гена Е1, как показано в SEQ ID NO:5.
Более предпочтительная форма этого варианта осуществления относится к выделенному вирусу, который является членом пестивирусов, причем указанный вирус характеризуется тем, что: a) вирус является возбудителем врожденного тремора у свиней группы A-II и b) вирус имеет вирусный геном, содержащий ген, кодирующий оболочечный белок Erns, ген, кодирующий оболочечный белок E2, и ген, кодирующий оболочечный белок E1, при этом нуклеотидная последовательность гена Erns имеет уровень идентичности, составляющий по меньшей мере на 80% по отношению к нуклеотидной последовательности, такой как представлена в SEQ ID NO:1, и нуклеотидная последовательность гена E2 имеет уровень идентичности, составляющий по меньшей мере на 80% по сравнению с нуклеотидной последовательностью, как показано в SEQ ID NO:3, а нуклеотидная последовательность гена E1 имеет уровень идентичности, составляющий по меньшей мере на 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:5.
Другой альтернативный способ характеризации вируса согласно изобретению зависит от ПЦР-теста с использованием наборов праймеров, которые являются специфичными для последовательности гена NS5B или последовательности 5'UTR вируса в соответствии с изобретением.
Обзор различных праймеров и размер продуктов ПЦР, полученных с использованием этих праймеров, представлен в таблицах а и b.
Четыре различных набора праймеров, последовательность которых изображена в SEQ ID NO:7-8, SEQ ID NO:9-10, SEQ ID NO:11-12 и SEQ ID NO:13-14, были выбраны по их специфичности для области NS5B вируса.
ПЦР-тесты с использованием первого набора праймеров (SEQ ID NO:7-8), второго набора праймеров (SEQ ID NO:9-10) и комбинации праймеров и обратных праймеров, которые специфически реагируют с геном NS5B вируса, используют следующие две пары праймеров F1-R1, F2-R2, F1-R2 и F2-R1, соответственно.
Наборы праймеров SEQ ID NO:11-12 (PAN-FW и PAN-REV) и SEQ ID NO:13-14 (PANdeg-FW и PANdeg-REV) также специфически реагируют с NS5B. Набор с вырожденными праймерами SEQ ID NO:13-14 был разработан для увеличения вероятности нахождения вариантов CTAPV со слегка измененными последовательностями РНК.
ПЦР-тест с использованием набора праймеров (SEQ ID NO:15-16) специфически реагирует с 5'-UTR вируса и использует два праймера F3-R3.
ПЦР-тест с использованием набора праймеров (SEQ ID NO:17-18) также специфически реагирует с 5'-UTR вируса и использует два праймера F4-R4.
Тесты, которые более подробно описаны в разделе «Примеры», представляют собой стандартные тесты ПЦР на кДНК. (Само собой разумеется, что, поскольку вирус имеет РНК-геном, вирусную РНК сначала транскрибировали в кДНК в реакции с обратной транскриптазой. кДНК использовали для реакций ПЦР).
|
Таблица a
|
Таблица b
Если вирус характеризуется с использованием наборов праймеров, описанных выше, можно сказать следующее: если анализ продукта ПЦР, например, Набор праймеров F1-R1 обнаруживает продукт ПЦР из приблизительно 156 пар оснований, или если анализ продукта PCR, например, Набор праймеров F2-R2 обнаруживает продукт ПЦР из приблизительно 335 пар оснований, это однозначно показывает, что анализируемый вирус принадлежит вирусу согласно изобретению.
Лишь в качестве примера: продукт ПЦР из приблизительно 156 пар оснований, представляет собой продукт ПЦР с длиной от 156±10 до 156±10 пар оснований. Продукт ПЦР из приблизительно 335 пар оснований представляет собой продукт ПЦР с длиной между 335±10 и 335±10 парами оснований.
Таким образом, другая форма этого варианта осуществления настоящего изобретения относится к изолированному вирусу, который является членом пестивирусов, отличающемуся тем, что: a) вирус является возбудителем врожденного тремора у свиней группы A-II и b) кДНК, обратно транскрибированная из вирусного РНК-генома, реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:7 и 8, с получением продукта ПЦР из 156±10 пар оснований, и/или реагирует в ПЦР с праймером, как показано в SEQ ID NO:9 и 10, с получением продукта ПЦР из 335±10 пар оснований, и/или реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:11 и 12, с получением продукта ПЦР из 896±10 пар оснований, и/или реагирует в реакции с набором праймеров, как показано в SEQ ID NO:13 и 14, с получением продукта ПЦР из 896±10 парами оснований, и/или реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:15 и 16, с получением продукта ПЦР из 182±10 пар оснований, и/или реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:17 и 18, с получением продукта ПЦР из 182±10 пар оснований.
Предпочтительная форма этого варианта осуществления относится к вирусу согласно изобретению, при этом кДНК, обратно транскрибированная из вирусного РНК-генома, реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:7 и 8 с получением продукта ПЦР из 156±10 пар оснований и реагирует в реакции ПЦР с набором в SEQ ID NO:9 и 10 с получением продукта ПЦР из 335±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:11 и 12 с получением продукта ПЦР из 896±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:13 и 14 с получением продукта ПЦР из 896±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:15 и 16 с получением продукта ПЦР из 182±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:17 и 18 с получением продукта ПЦР из 182±10 пар оснований.
Более предпочтительная форма этого варианта осуществления относится к вирусу согласно изобретению, при этом вирус имеет вирусный геном, содержащий ген, кодирующий Erns, ген, кодирующий E2 и ген, кодирующий E1, при этом нуклеотидная последовательность гена Erns имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:1, и нуклеотидная последовательность гена E2 имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:3, и нуклеотидная последовательность гена E2 имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности, как показано в SEQ ID NO:5, и при этом кДНК вирусного генома реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:7 и 8, с получением продукта ПЦР из 156±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:9 и 10, с получением продукта ПЦР из 335±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:11 и 12, с получением продукта ПЦР из 896±10 пар оснований и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:13 и 14, с получением продукта ПЦР из 896±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:15 и 16, с получением продукта ПЦР из 182±10 пар оснований, и реагирует в реакции ПЦР с набором праймеров, как показано в SEQ ID NO:17 и 18, с получением продукта ПЦР из 182+/-10 пар оснований.
Вирус согласно изобретению может быть в живой, живой аттенуированной или инактивированной форме.
Как указано выше, теперь охарактеризованы последовательности ДНК генов, кодирующих Erns, белок E2 и E1 вируса. Идентификация этих генов очень полезна, поскольку теперь они могут быть использованы, среди прочего, в качестве основы для ДНК-вакцин, для применения при получении субъединичных вакцин на основе этих белков или в диагностических целях, как будет подробно объяснено ниже.
Таким образом, еще один вариант осуществления настоящего изобретения относится к гену, кодирующему белок Erns, отличающийся тем, что нуклеотидная последовательность данного гена имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности гена Erns, как показано в SEQ ID NO:1.
Предпочтительная форма этого варианта осуществления относится к этому гену, имеющему уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности гена Erns, как показано в SEQ ID NO:1.
Другой вариант осуществления настоящего изобретения относится к гену, кодирующему белок Е2, отличающийся тем, что нуклеотидная последовательность этого гена имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности гена E2, как показано в SEQ ID NO:3.
Предпочтительная форма этого варианта осуществления относится к этому гену, имеющему уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности гена E2, как показано в SEQ ID NO:3.
И еще один вариант осуществления настоящего изобретения относится к гену, кодирующему белок Е1, отличающийся тем, что нуклеотидная последовательность этого гена имеет уровень идентичности, составляющий по меньшей мере 80% по отношению к нуклеотидной последовательности гена E1, как показано в SEQ ID NO:5.
Предпочтительная форма этого варианта осуществления относится к этому гену, имеющему уровень идентичности, составляющий по меньшей мере 82%, более предпочтительно 84%, 86%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже 100%, в этом порядке предпочтения, по отношению к нуклеотидной последовательности гена E1, как показано в SEQ ID NO:5.
Еще один вариант осуществления настоящего изобретения относится к белку Erns, характеризующемуся тем, что этот белок Erns кодируется геном Erns согласно изобретению.
Эти белки Erns вируса согласно изобретению являются весьма подходящими, поскольку они, среди прочего, являются пригодными для применения в вакцинах, более конкретно в субъединичных вакцинах, их можно использовать для получения антител, и они делают возможным проведение диагностических тестов, как описано ниже.
Предпочтительная форма этого варианта осуществления относится к Erns, имеющему аминокислотную последовательность, как показано в SEQ ID NO:2.
Другой вариант осуществления настоящего изобретения относится к белку Е2, характеризующемуся тем, что этот белок Е2 кодируется геном Е2 в соответствии с изобретением.
Эти белки E2 вируса согласно изобретению являются весьма подходящими, поскольку они, среди прочего, являются пригодными для применения в вакцинах, более конкретно в субъединичных вакцинах, их можно использовать для получения антител, и они делают возможным проведение диагностических тестов, как описано ниже.
Предпочтительная форма этого варианта осуществления относится к белку E2, имеющему аминокислотную последовательность, как показано в SEQ ID NO:4.
И еще один вариант осуществления настоящего изобретения относится к белку Е1, характеризующемуся тем, что этот белок Е1 кодируется геном Е1 в соответствии с изобретением.
Эти белки E1 вируса согласно изобретению являются весьма подходящими, поскольку они, среди прочего, являются пригодными для применения в вакцинах, более конкретно в псевдочастицах и вакцине, содержащей данные псевдочастицы, как объяснено ниже.
Предпочтительная форма этого варианта осуществления относится к белку Е1, имеющему аминокислотную последовательность, как показано в SEQ ID NO: 6.
Одним из достоинств настоящего изобретения является то, что в настоящее время впервые возможно следить за ходом вирусной инфекции и анализировать присутствие или отсутствие нового вируса в различных органах и текучих средах организма свиней с подозрением на заражение новым вирусом согласно изобретению.
В разделе «Примеры» описано, что многие ткани и органы свиней, страдающих врожденным тремором группы А-II, теперь можно тестировать на наличие или отсутствие и на количество нового вируса.
Было обнаружено, что сыворотка, плазма, лейкоциты периферической крови, сердце, тонкая и толстая кишка, мозг, грудной отдел спинного мозга, поясничный отдел спинного мозга, печень, паховые лимфатические узлы, легкое, желчный пузырь, мочевой пузырь, почки, миндалины и селезенка, выделенные у свиней, страдающих врожденным тремором группы A-II, содержат новый вирус.
Это помогло получить больше информации о развитии болезни.
Другим достоинством настоящего изобретения является то, что теперь можно заразить здоровых свиней новым вирусом и исследовать путь вирусной инфекции. В примерах описано, как с этой целью был выделен и очищен органный материал животных с врожденным тремором группы А-II. Этот материал в последующем инъецировали здоровым поросятам-отъемышам для изучения репликации вируса in vivo в соответствии с методами, применяемыми Patterson (10-20% (в/о) гомогенаты вводили различными путями введения, перорально, назально, внутримышечно, подкожно).
Еще одним достоинством настоящего изобретения является то, что теперь можно заразить беременных молодых свиней новым вирусом с целью продемонстрировать, что вирус способен вызывать врожденный тремор группы A-II у поросят данных молодых свиней. Результаты данных экспериментов описаны в примерах.
В дополнение, этот материал был использован в качестве материала для испытаний при вакцинации/контрольных испытаниях, как описано ниже.
Также одним из достоинств настоящего изобретения является то, что, поскольку в настоящее время выделен новый пестивирус свиней, вирус и/или защитные субъединицы вируса могут быть использованы в качестве исходного материала с целями вакцинации.
Только в качестве примера: в разделе примеров, среди прочего, описано получение вакцин, содержащих бакуло-экспрессированный белок E2, введение цельноклеточных вакцин и очищенных E2-вакцин и последующую пробу с описанным выше материалом вирулентного заражения.
Таким образом, еще один вариант осуществления настоящего изобретения относится к вакцинам для борьбы с CT группы А-II у свиней, содержащим иммуногенно эффективное количество вируса в соответствии с изобретением и фармацевтически приемлемый носитель.
Борьба в этом отношении должна толковаться в широком смысле: считается, что борьба с CT группы А-II у свиней включает вакцинацию, чтобы предотвратить признаки заболевания, а также вакцинацию, чтобы уменьшить признаки заболевания, как указано выше.
Примерами фармацевтически приемлемых носителей, которые подходят для использования в вакцине согласно изобретению, являются стерильная вода, физиологический раствор, водные буферы, такие как PBS и тому подобное. Кроме того, вакцина в соответствии с изобретением может содержать другие добавки, такие как адъюванты, стабилизаторы, антиоксиданты и другие, как описано ниже.
Вакцина согласно изобретению может, например, среди прочего, содержать вирус согласно изобретению в аттенуированной живой или инактивированной форме.
Ослабленные живые вирусные вакцины, то есть вакцины, содержащие вирус по изобретению в живой аттенуированной форме, имеют преимущество перед инактивированными вакцинами в том, что они лучше всего имитируют естественный путь заражения. В дополнение, их способности к репликации позволяют проводить вакцинацию с помощью небольшого количества вирусов; их количество будет автоматически увеличиваться, пока не достигнет триггерного уровня иммунной системы. С этого момента иммунная система будет запущена и, наконец, устранит вирусы.
Живой аттенуированный вирус представляет собой вирус, который имеет пониженный уровень вирулентности по сравнению с вирусом, выделенным в поле. Вирусом, имеющим пониженный уровень вирулентности, считается вирус, который индуцирует защиту против CT группы А-II или, по меньшей мере, уменьшает симптомы CT по сравнению с симптомами CT, вызванными пестивирусом дикого типа согласно изобретению.
Вследствие этого, одна из предпочтительных форм этого варианта осуществления изобретения относится к вакцине, содержащей вирус согласно изобретению, при этом указанный вирус находится в живом аттенуированном виде.
Аттенуированные вирусы могут быть получены различными способами, известными в данной области. Например, они могут быть получены путем выращивания вируса согласно изобретению в присутствии мутагенного агента с последующим отбором вируса, который показывает снижение уровня потомства и/или скорости репликации. В данной области известны многие такие мутагенные агенты.
Другим часто используемым способом является серийный пассаж in vitro чувствительной клеточной линии. Затем вирусы адаптируются к клеточной линии с применением серийного пассажа, так что они ведут себя ослабленными, когда снова переносятся естественному хозяину в качестве вакцины.
Еще один способ получения аттенуированных вирусов заключается в том, что вирусы подвергаются росту при температурах, отклоняющихся от температуры их естественной среды обитания. В данной области хорошо известны методы селекции для чувствительных к температуре мутантов (Ts-мутантов). Эти способы включают выращивание вирусов, обычно в присутствии мутагена, с последующим ростом как при субоптимальной температуре, так и при оптимальной температуре, титрование потомства вируса на слоях клеток и визуальный отбор тех бляшек, которые при оптимальной температуре растут медленнее. Эти небольшие бляшки включают медленно растущие и, следовательно, желаемые живые аттенуированные вирусы.
Альтернативный способ получения живого аттенуированного пестивируса в соответствии с изобретением относится к преднамеренной модификации генома пестивируса. Этот подход имеет преимущество по сравнению с классическими методами ослабления, описанными выше, в том, что известен характер аттенуации. Для пестивирусов описаны многие живые аттенуированные штаммы вирусов, например, пестивирусы, вирус бычьей вирусной диареи и вирус классической чумы свиней, из которых, например, ген E2, ген Erns или ген Npro либо удаляются, либо модифицируются.
Примеры живых аттенуированных пестивирусов, более конкретно свиной пестивирус вирус классической чумы свиней (CSFV), имеющий Npro-делецию, описаны, среди прочих, в Патенте США US7572455 и у Mayer, D. et al(19).
Примеры живых аттенуированных пестивирусов, более конкретно свиной пестивирус, вирус классической чумы свиней, имеющий и Erns-модификацию, и Npro-делецию, описаны, среди прочих, в Патенте США US7572455.
Примеры живых аттенуированных пестивирусов, более конкретно вирус классической чумы свиней, имеющий модификацию в гене E2, среди прочего, описаны Risatti, G.R. et al.(22) и Risatti, G.R. et al.(23).
Вообще пестивирусные инфекции являются проблемой во многих странах, где выращивают свиней, жвачных животных или овец. В настоящее время различные подходы к борьбе с пестивирусными инфекциями в целом применяются в различных странах, где пестивирусы вызывают экономический ущерб. В некоторых странах для удаления вируса используются методы полного санитарного убоя, в то время как в других странах предпочтение отдается вакцинации. Факт, что данные разные подходы используют параллельно, однако, вызывает проблемы. Только в качестве примера: например, свиные пестивирусы циркулируют у свиней на фермах, но также у диких животных, таких как дикие кабаны, и, таким образом, они образуют резервуар, из которого вирус может перейти к домашним животным. Животных, которые были вакцинированы классической вакциной, нелегко отличить от крупного рогатого скота, зараженного в поле, поскольку в обоих случаях будут присутствовать антитела против вируса. Таким образом, большей частью неизвестно, животные, положительные на антитела к пестивирусу, являются антителоположительными вследствие инфекции (в случае этого они могут носить вирус) или вследствие вакцинации. Как следствие, такие животные не будут допущены к перевозке в страны, в которых для данного пестивируса выбран подход полного санитарного убоя.
Поскольку теперь идентифицирован новый пестивирус, вызывающий CT группы А-II, то это же можно применять в будущем для данного нового пестивируса.
Эта проблема может быть решена с помощью так называемых маркеров или вакцин DIVA (DIVA=дифференциация инфицированных и вакцинированных животных). Эти вакцины не содержат один или несколько иммуногенных вирусных белков или по меньшей мере один из иммуногенных эпитопов, в результате чего животные, вакцинированные маркером, не будут продуцировать антитела против всех иммуногенных вирусных белков/эпитопов. Различия в палитре антител между вакцинированными и инфицированными животными могут быть продемонстрированы с помощью диагностических тестов, разработанных для этой цели. Таким образом, такие тесты позволяют отличить вакцинированных животных от инфицированных.
Поскольку гены, кодирующие белок Erns, Npro, E1 и E2 нового пестивируса согласно изобретению являются хорошо известными, теперь для нового вируса можно применить известные методики маркерной вакцины, какие описаны, например, для свиного пестивируса CSFV. Примеры живых аттенуированных вакцин CSFV, которые также пригодны в качестве маркерных вакцин, описаны, например, у Van Gennip, H.G.P. et al(7)., Reimann, I. et al(8)., Beer, M. et al(9)., Wehrle, F. et al(10), by Dong, X.N. и Chen, Y.H.(11). и de Smit, A. J. et al.(24). В большинстве случаев сообщают о химерных вирусах, в которых ген E2 или Erns заменяли на соответствующий ген штамма гетерологичного вируса или другого пестивируса.
Возможным недостатком использования живых аттенуированных вирусов, однако, может быть то, что по сути существует определенный уровень вирулентности. Это не является реальным недостатком, если уровень вирулентности является приемлемым, т.е. до тех пор, пока вакцина по крайней мере предотвращает смерть свиней. Конечно, чем ниже оставшаяся вирулентность живой аттенуированной вакцины, тем меньше влияние вакцинации на увеличение веса во время/после вакцинации.
Альтернативой для использования живых аттенуированных вирусов является использование нетрансмиссивных вирусов. В данных вирусах основной ген удаляется и дополняется in trans в клеточной линии, которая используется для выращивания вируса. Как следствие, вирусное потомство представляет собой вирус, который, хотя способен заражать клетку-хозяина, не может реплицироваться в этой клетке-хозяине. Этот нетрансмиссивный вирус близко имитирует естественную инфекцию, и в то же время вирус не может распространяться. Вакцина, содержащая этот нетрансмиссивный вирус, весьма безопасна, и в дополнение, очень подходит в качестве маркерной вакцины. Эти вакцины описаны, например, для свиного пестивируса CSFV, среди прочих, Widjojoatmodjo, M.N. et al.(25) и Van Gennip, H.G. et al.(26).
Инактивированные вакцины, в отличие от их живых аттенуированных аналогов, по существу безопасны, поскольку нет остаточной вирулентности. Несмотря на то, что они обычно содержат несколько более высокую дозу вирусов по сравнению с живыми аттенуированными вакцинами, они могут, например, являться предпочтительной формой вакцины у свиней, которые уже страдают от других заболеваний. Свиньи, которые содержатся в субоптимальных условиях, таких как недостаточное питание или неоптимальное жилье, также получат пользу от инактивированных вакцин
Вследствие этого, другая предпочтительная форма данного варианта осуществления относится к вакцине, содержащей вирус согласно изобретению, при этом указанный вирус находится в инактивированной форме.
Эти инактивированные цельновирусные вакцины могут быть сделаны для нового пестивируса свиней согласно изобретению. Как и в случае известных пестивирусных вакцин для свиней, производство в основном включает стадии выращивания нового пестивируса свиней на восприимчивых клетках свиньи, сбора вируса, инактивации вируса и смешивания инактивированного вируса с фармацевтически приемлемым носителем.
Стандартным способом инактивации является классическая обработка формальдегидом. Другими известными методами для инактивации являются УФ-излучение, гамма-излучение, обработка бинарным этиленимином, тимеросалом и тому подобное. Квалифицированный специалист в данной области знает, как применять эти методы. Предпочтительно вирус инактивируют с помощью β-пропиолактона, глутаральдегида, этиленимина или формальдегида. Само собой разумеется, что другие способы инактивации вируса также реализованы в настоящем изобретении.
Как указано выше, вирус согласно изобретению можно выращивать в клеточной культуре на чувствительных свиных клетках или клеточных линиях.
Таким образом, еще один вариант осуществления изобретения относится к клеточной культуре, содержащей пестивирус в соответствии с настоящим изобретением. Примером такой клеточной линии является SK6.
Хотя целые инактивированные пестивирусы свиней согласно изобретению и нетрансмиссивные пестивирусы свиней согласно данному изобретению предоставляют хорошую основу для инактивированных вакцин, их производство может быть дорогостоящим, в зависимости, например, среди прочего, от типа используемых клеток-хозяев, субстрата и используемой клеточной культуральной среды.
В конкретном случае пестивирусов привлекательной альтернативой использованию целых инактивированных вирусов или нетрансмиссивных пестивирусов свиней согласно изобретению является использование субъединиц пестивирусов свиней, особенно белка Erns и E2.
Экспрессия этих субъединиц, особенно белка Erns и E2, известна в данной области и широко описана для пестивируса свиней CSFV как в бакуловирусных экспрессирующих системах, так и в клетках млекопитающих, Hulst, M.M. et al.(27), Bouma, A. et al.(28), Van Rijn, P.A. et al.(29), Moorman, R.J.M. et al.(30), Donofrio, G. et al.(31), Lutticken D. et al.(32) и Floegel-Niesmann et al.(33).
Экспрессия с высоким выходом Erns и E2 в системах экспрессии бакуловируса описана, например, в EP1049788.
Кроме того, бакуловирусные экспрессионные системы и векторы экспрессии бакуловируса в целом широко описаны в учебниках, таких как O'Reilly at al. (34) и Murhammer(35).
Системы экспрессии на основе бакуловируса также коммерчески доступны, например, от Invitrogen Corporation, 1600 Faraday Avenue, Carlsbad, California 92008, USA.
Альтернативой бакуловирусным системам экспрессии являются системы экспрессии на основе дрожжей. Дрожжевые системы экспрессии описаны, например, у Gellissen et al.(36).
Donofrio, G. et al., (31) описывают экспрессию BVDV E2 клеточной линии млекопитающих.
Готовые к использованию системы экспрессии являются коммерчески доступными, среди прочего, от Research Corp. Technologies, 5210 East Williams Circle, Suite 240, Tucson, AZ 85711-4410 USA. системы экспрессии на основе клеток дрожжей и насекомых также, например, являются коммерчески доступными от Clontech Laboratories, Inc. 4030 Fabian Way, Palo Alto, California 94303-4607, USA.
Экспрессия белков Erns и E2 в системах экспрессии на основе клеток млекопитающих, как описано у Donofrio, G. et al(31), хотя и является весьма подходящей, наиболее вероятно, будет более дорогостоящей для применения по сравнению с системами экспрессии на основе бакуловируса.
Таким образом, другая форма данного варианта осуществления относится к вакцине для уничтожения CT группы A-II у свиней, характеризующейся тем, что указанная вакцина содержит иммуногенно эффективное количество белка Erns и/или E2 и/или E1 согласно изобретению и фармацевтически приемлемый носитель.
Более предпочтительно, эти субъединицы находятся в форме так называемых псевдочастиц пестивируса.
Эти псевдочастицы представляют собой в основном вирусоподобные частицы, которые содержат белки Erns, E1 и E2.
Однако они отличаются от вируса дикого типа тем, что они не содержат целый пестивирусный геном, и поэтому они не способны к репликации в хозяине. Как следствие, псевдочастицы пестивируса не должны быть инактивированными перед применением в вакцине, и поэтому они имеют дополнительное преимущество в том, что они действительно безопасны.
Псевдочастицы пестивируса могут быть получены посредством экспрессии белков Erns, E1 и E2 в подходящей экспрессионной системе. Примеры псевдочастиц пестивируса и то, как получить данные псевдочастицы, описаны, среди прочего, в EP1454981 и EP1170367.
Таким образом, другой вариант осуществления относится к псевдочастицам, характеризующимся тем, что они содержат белок Erns согласно изобретению, белок E2 согласно изобретению и белок E1 согласно изобретению.
Количество псевдочастиц в вакцине и путь введения должны быть сопоставимыми с количеством и путем введения инактивированных целых вирусных частиц, поскольку в показателях иммуногенности и схожести капсида они сопоставимы с инактивированными целыми вирусными частицами.
Обычно количество, составляющее между 1 и 100 мкг псевдочастиц нового пестивируса свиней, бывает весьма подходящим в качестве дозы вакцины. С точки зрения затрат, предпочтительное количество должно находиться в диапазоне, составляющем 1-50 мкг псевдочастиц, более предпочтительно в диапазоне, составляющем 1-25 мкг.
Вакцина согласно изобретению, более конкретно вакцина на основании инактивированного целого вируса, субъединиц, таких как белок Erns и E2 или псевдочастицы, предпочтительно содержит адъювант. Общепринятыми адъювантами, хорошо известными в данной области техники, являются, например, полный адъювант Фрейнда и неполный адъювант Фрейнда, витамин E, неионные блок-полимеры, мурамил-дипептиды, Quill A(R), минеральное масло, например, Bayol(R) или Markol(R), растительное масло и Carbopol(R) (гомополимер), или Diluvac(R) Forte. Вакцина может также содержать так называемый «носитель». Носитель представляет собой соединение, к которому прилипает полипептид, не будучи ковалентно связанным с ним. Часто используемыми соединениями носителей являются, например, алюминия гидроксид, фосфат или оксид, диоксид кремния, каолин и бентонит.
В принципе, может быть достаточно ввести вакцину в соответствии с изобретением только один раз. Однако, особенно в случае инактивированных вакцин, будь это цельновирусные вакцины, субъединичные вакцины или вакцины из псевдочастиц, предпочтительно проводить также первую и, возможно, вторую бустерную вакцинацию. Первую бустерную вакцинацию проводят по меньшей мере через две недели после первой вакцинации. Весьма подходящим моментом для бустерной вакцинации является период между 3 и 16 неделями после первой вакцинации. Вторую бустерную вакцинацию, при необходимости, обычно следует давать между 4 и 50 неделями после первой бустерной вакцинации.
Альтернативным подходом инактивированному целому вирусу, субъединицам, таким как белок Erns, E2 и E1, или псевдочастицам является применение живых рекомбинантных векторных вирусов, у которых свиньи являются их животными-хозяевами, в качестве носителей нового гена Erns, E2 или E1 пестивируса свиней.
Среди подходящих рекомбинантных векторных вирусов, у которых свиньи являются их животными-хозяевами, некоторые векторные вирусы являются особенно подходящими в качестве носителей: вирус псевдобешенства (PRV), аденовирус свиней (PAV), поксвирус свиней (SPV) и вирус классической чумы свиней (CSFV). В дополнение, в качестве подходящего векторного вируса описан вирус коровьей оспы.
Применение этих рекомбинантных векторных вирусов в вакцинах имеет дополнительное преимущество в том, что вакцинированные животные наряду с этим становятся вакцинированными против как векторного вируса, так и нового пестивируса согласно изобретению.
Применение в качестве живого рекомбинантного векторного вируса для гена E2 пестивируса свиней CSFV вируса псевдобешенства (PRV) описано у van Zijl et al.(38) и Peeters et al.(39) для репликации дефектного рекомбинантного векторного вируса PRV.
Живой рекомбинантный векторный вирус аденовируса свиней (PAV) в качестве векторного вируса для гена E2 пестивируса свиней CSFV описан у Hammond et al.(40, 41).
Живой рекомбинантный векторный вирус поксвируса свиней (SPV) в качестве векторного вируса для гена E2 пестивируса свиней CSFV описан у Hahn et al.(42)
В дополнение, вирус коровьей оспы описан в качестве подходящего векторного вируса у Ruemenapf et al.,(37) который описывает экспрессию всех четырех структурных белков, и среди прочего, индуцирование защитного иммунитета у свиней, вакцинированных рекомбинантными векторами вируса коровьей оспы, экспрессирующих E2.
Живой аттенуированный вирус CSFV также является весьма подходящим в качестве живого рекомбинантного векторного вируса. Только в качестве примера: живой аттенуированный CSFV, из которого был удален ген Npro, описан у Mayer et al.(19) Этот живой аттенуированный вирус делает возможным, среди прочего, в сайте делеции гена Npro, вставку гена, кодирующего ген Erns или E2. Таким образом, этот живой рекомбинантный вирус CSFV в равной степени образует весьма подходящий векторный вирус для гена Erns или E2 нового пестивируса свиней.
Очень подходящие количества этого живого рекомбинантного векторного вируса должны находиться в диапазоне, составляющем от 105 TCID50 до 5×109 TCID50 векторного вируса на дозу вакцины, в зависимости от уровня аттенуации вируса.
Экспрессия гена Erns, E2 или E1 нового пестивируса свиней можно получить под контролем любого подходящего гетерологичного промотора, который функционален в клетке млекопитающего (см. ниже). Гетерологичный промотор представляет собой промотор, который не является промотором, ответственным за транскрипцию гена Erns, E2 или E1 нового пестивируса свиней форму нового пестивируса свиней дикого типа согласно изобретению.
Вследствие этого, другой вариант осуществления настоящего изобретения относится к фрагменту ДНК, содержащему ген, кодирующий ген Erns, E2 или E1 нового пестивируса свиней согласно изобретению, характеризующейся тем, что указанный ген находится под контролем функционального гетерологичного промотора.
Промотор, который является функциональным в клетке млекопитающего, представляет собой промотор, который способен к управлению транскрипцией гена, который локализован в клетке млекопитающего после промотора.
Примеры подходящих промоторов, которые являются функциональными в клетке млекопитающего, включают классические промоторы, такие как CAG промотор (Niwa, H. et al., Gene 108: 193-199 (1991), немедленно-ранний промотор цитомегаловируса (человека) (Seed, B. et al., Nature 329, 840-842, 1987; Fynan, E.F. et al., PNAS 90, 11478-11482,1993; Ulmer, J.B. et al., Science 259, 1745-1748, 1993), вирус саркомы Рауса LTR (RSV, Gorman, C.M. et al., PNAS 79, 6777-6781, 1982; Fynan et al., supra; Ulmer et al., supra), MPSV LTR (Stacey et al., J. Virology 50, 725-732, 1984), немедленно-ранний промотор SV40 (Sprague J. et al., J. Virology 45, 773,1983), промотор SV-40 (Berman, P.W. et al., Science, 222, 524-527, 1983), промотор металлотионеинов (Brinster, R.L. et al., Nature 296, 39-42, 1982), промотор теплового шока (Voellmy et al., Proc. Natl. Acad. Sci. USA, 82, 4949-53, 1985), главный поздний промотор Ad2 и промотор β-актина (Tang et al., Nature 356, 152-154, 1992). Регуляторные последовательности могут также включать терминирующие и полиаденилирующие последовательности. Среди последовательностей, которые можно применять, хорошо известными являются последовательность полиаденилирования бычьего гормона роста, полиаденирующая последовательность SV40, терминирующие и полиаденилирующие последовательности цитомегаловируса человека (hCMV).
Таким образом, настоящее изобретение также относится к живому рекомбинантному векторному вирусу, содержащему фрагмент ДНК, содержащий ген, кодирующий белок Erns и/или E2 и/или E1 согласно изобретению под контролем функционального промотора.
Другая форма варианта осуществления настоящего изобретения, которая относится к вакцинам, относится к вакцине для уничтожения CT группы A-II у свиней, характеризующейся тем, что указанная вакцина содержит живой рекомбинантный векторный вирус, содержащий фрагмент ДНК, содержащий ген, кодирующий белок Erns и/или E2 и/или E1, согласно изобретению под контролем функционального промотора, и фармацевтически приемлемый носитель.
Не вызывает сомнений, что живой рекомбинантный векторный вирус должен экспрессировать иммуногенно эффективное количество Erns и/или E2 и/или E1 и/или E.
Альтернатива для вакцинации инактивированной цельновирусной вакциной, вакциной псевдочастиц или живой рекомбинантным векторным вирусом, является применение ДНК-вакцинации.
Эта ДНК-вакцинация основана на введении животному-хозяину фрагмента ДНК, несущего ген, кодирующий белок Erns, E2 или E1 под контролем подходящего промотора. После того, как ДНК поглощается клетками хозяина, ген, кодирующий белок Erns, E2 или E1, транскрибируется, и транскрипт транслируется в белок Erns, E2 или E1 в клетках хозяина. Это близко имитирует процесс естественного инфицирования пестивирусом свиней.
Подходящими промоторами являются промоторы, которые являются функциональными в клетке млекопитающего, как проиллюстрировано выше.
Фрагмент ДНК, несущий ген, кодирующий белок Erns, E2 или E1 под контролем подходящего промотора, может представлять собой, например, плазмиду. Эта плазмида может быть в замкнутой или линейной форме.
Примером успешной ДНК-вакцинации у свиней является успешная вакцинация против вируса классической чумы свиней, как описано у Tian, D.Y. et al.(45), Sun, Y. et al.(46) и Sun, Y. et al.(47).
Другими примерами успешной ДНК-вакцинации у свиней являются, среди прочего, успешная вакцинация против болезни Ауески, как описано у Gerdts et al.(43). Они описывают ДНК-вакцину, в которой применяют фрагмент ДНК, который несет гликопротеин C под контролем главного немедленно-раннего промотора цитомегаловируса человека. Вакцинацию проводили четыре раза с двухнедельными интервалами в количестве, составляющим 50 мкг ДНК. У вакцинированных животных вырабатывались сывороточные антитела, которые распознавали соответствующий антиген в иммуноблоте и которые демонстрировали нейтрализующую активность.
Другой пример успешной ДНК-вакцинации у свиней приведен у Gorres et al.(44). Они описали успешную ДНК-вакцинацию свиней против как пандемического, так и классического свиного гриппа H1N1. Они вакцинировали первичной вакцинацией и 2 гомологичными бустерными вакцинациями на 3 и 6 неделях после примирования, ДНК-вакциной, содержащей ген HA гриппа H1N1 под контролем функционального промотора.
Поскольку белок E2 нового пестивируса согласно изобретению представляет собой основной иммуногенный белок, он является предпочтительным белком для применения в ДНК-вакцинах. Тем не менее, может быть необходимо использовать описанные выше способы ((45),(46),(47)) или полагаться на дополнительные меры, как описано в (9), с целью усиления иммуногенности ДНК-вакцины.
Таким образом, другая форма этого варианта осуществления относится к вакцине для уничтожения CT группы A-II у свиней, характеризующейся тем, что указанная вакцина содержит фрагмент ДНК, содержащий ген, кодирующий белок Erns, E2 или E1 согласно настоящему изобретению под контролем функционального промотора, и фармацевтически приемлемый носитель. Не вызывает сомнений, что ДНК фрагмент, содержащий ген, кодирующий белок Erns, E2 или E1, должен экспрессировать иммуногенно эффективное количество белка Erns, E2 или E1.
Что представляет собой «иммуногенно эффективное количество» для вакцины в соответствии с изобретением, которая основана на целом свином вирусе в соответствии с изобретением, псевдочастице согласно изобретению, живом рекомбинантном векторе или ДНК-вакцине в соответствии с изобретением, зависит от желаемого эффекта и от организма-мишени.
Термин «иммуногенно эффективное количество», как используется в рамках изобретения, относится к количеству CTAPV, псевдочастиц, живого рекомбинантного вектора или ДНК-вакцины, которое необходимо для индуцирования иммунного ответа у свиней в той мере, чтобы она уменьшала патологическое действие, вызванное инфекцией CT группы A-II пестивируса дикого типа, по сравнению с патологическим действием, вызванным инфекцией CT группы A-II пестивируса дикого типа у неиммунизированных свиней.
Вполне в компетенции квалифицированного специалиста в данной области определить, является ли обработка «иммунологически эффективной», например, посредством введения экспериментальной провокационной инфекции вакцинированным животным и последующего определения клинических признаков заболевания у животного-мишени, серологических параметров или путем измерения повторного выделения патогена, с последующим сравнением этих данных с данными, наблюдаемыми у свиней, инфицированных в поле.
Количество вводимого вируса будет зависеть от пути введения, наличия адъюванта и момента введения. Это иллюстрируется ниже и, кроме того, библиография, приведенная выше и ниже, относящаяся к вакцинам для других пестивирусных вакцин, предоставляет дополнительные рекомендации.
Предпочтительное количество живой вакцины, содержащей вирус согласно изобретению, выражается, например, в виде инфицирующей дозы тканевой культуры (TCID50). Например, для живого вируса можно преимущественно использовать диапазон доз между 10 и 109 TCID50 на дозу для животного, в зависимости от остаточной вирулентности вируса. Предпочтительно используют диапазон между 102 и 106 TCID50. Можно использовать много путей введения, которые все известны в данной области техники. Вакцины согласно изобретению предпочтительно вводят животному посредством инъекции (внутримышечной или посредством интраперитонеального пути) или через рот.
Протокол введения может быть оптимизирован в соответствии со стандартной практикой вакцинации. Во всех случаях введение посредством внутрикожного инъектора (IDAL) является предпочтительным способом введения.
Если вакцина содержит инактивированный вирус или псевдочастицы согласно изобретению, дозу также следует выражать в виде числа вводимых вирусных частиц. Доза обычно несколько выше по сравнению с введением живых вирусных частиц, поскольку живые вирусные частицы в определенной степени реплицируются у животного-мишени до того, как они будут удалены иммунной системой. Для вакцин на основании инактивированного вируса обычно является подходящим число вирусных частиц в диапазоне, составляющем приблизительно от 104 до 109 частиц, в зависимости от используемого адъюванта.
Если вакцина содержит субъединицы, например, белок Erns, E2 или E1 согласно изобретению, дозу также следует выражать в микрограммах белка. Для вакцин на основании субъединиц подходящая доза обычно находится в диапазоне между 5 и 500 микрограммов белка, вновь в зависимости от используемого адъюванта.
Если вакцина содержит фрагмент ДНК, содержащий ген, кодирующий белок Erns, E2 или E1, дозу следует выражать в микрограммах ДНК. Для вакцин на основании субъединиц подходящая доза обычно должна находиться в диапазоне между 5 и 500 микрограммов ДНК, среди прочего, в зависимости от эффективности экспрессии применяемой плазмиды. Во многих случаях количество, составляющее между 20 и 50 микрограммов плазмиды на животное, должно быть достаточным для эффективной вакцинации.
Вакцина согласно изобретению может принимать любую форму, пригодную для введения в контексте свиноводства, и которая соответствует желаемому пути введения и желаемому эффекту. Приготовление вакцины согласно изобретению производится с помощью средств, общепринятых для квалифицированного специалиста в области изготовления пестивирусной вакцины.
Пероральные пути являются предпочтительными, когда это касается простоты введения вакцины.
Для перорального введения вакцину предпочтительно смешивают с подходящим носителем для перорального введения, т.е. с целлюлозой, пищей или метаболизируемым веществом, таким как альфа-целлюлоза или различные масла растительного или животного происхождения.
На практике свиней вакцинируют против ряда различных патогенных вирусов или микроорганизмов.
Вследствие этого является весьма привлекательным как по практическим, так и по экономическим причинам комбинировать вакцину в соответствии с изобретением для свиней, например, с дополнительным иммуногеном вируса или микроорганизма, патогенного для свиней, или генетической информацией, кодирующей иммуноген указанного вируса или микроорганизма.
Таким образом, предпочтительная форма этого варианта осуществления относится к вакцине согласно изобретению, содержащей по меньшей мере один другой патогенный для свиней микроорганизм или патогенный для свиней вирус и/или по меньшей мере один другой иммуногенный компонент и/или генетический материал, кодирующий указанный другой иммуногенный компонент, указанного патогенного для свиней микроорганизма или патогенного для свиней вируса. Иммуноген или иммуногенный компонент представляет собой соединение, которое индуцирует иммунный ответ у животного. Он может представлять собой, например, целый вирус или бактерию, или белковый или сахарный компонент данного вируса или бактерии.
Наиболее распространенными патогенными вирусами и микроорганизмами, которые являются патогенными для свиней, являются Brachyspira hyodysenteriae, вирус африканской чумы свиней, вирус Нипах, цирковирус свиней, торко теновирус свиней, вирус псевдобешенства, вирус свиного гриппа, парвовирус свиней, вирус репродуктивно-респираторного синдрома свиней (PRRS), вирус эпизоотической диареи свиней (PEDV), вирус ящура, вирус трансмиссивного гастроэнтерита, ротавирус, Escherichia coli, Erysipelo rhusiopathiae, Bordetella bronchiseptica, Salmonella cholerasuis, Haemophilus parasuis, Pasteurella multocida, Streptococcus suis, Mycoplasma hyopneumoniae и Actinobacillus pleuropneumoniae.
Вследствие этого, более предпочтительная форма изобретения относится к вакцине согласно изобретению, при этом вирус или микроорганизм, патогенный для свиней, выбирают из группы Brachyspira hyodysenteriae, вируса африканской чумы свиней, вируса Нипах, цирковируса свиней, торко теновируса свиней, вируса псевдобешенства, вируса свиного гриппа, парвовируса свиней, вируса репродуктивно-респираторного синдрома свиней (PRRS), вируса эпизоотической диареи свиней (PEDV), вируса ящура, вируса трансмиссивного гастроэнтерита, ротавируса, Escherichia coli, Erysipelo rhusiopathiae, Bordetella bronchiseptica, Salmonella cholerasuis, Haemophilus parasuis, Pasteurella multocida, Streptococcus suis, Mycoplasma hyopneumoniae и Actinobacillus pleuropneumoniae.
Другой вариант осуществления относится к способу получения вакцины согласно изобретению, при этом способ включает смешивание вируса согласно изобретению и/или белка Erns согласно изобретению, и/или белка E2 согласно изобретению, и/или белка E1 согласно изобретению, и/или фрагмента ДНК согласно изобретению, и/или живого рекомбинантного векторного вируса согласно изобретению, и/или псевдочастицы согласно изобретению, и фармацевтически приемлемого носителя.
Еще один вариант осуществления настоящего изобретения относится к вирусу согласно изобретению, и/или белку Erns согласно изобретению, и/или белку E2 согласно изобретению, и/или белку E1 согласно изобретению, и/или фрагменту ДНК согласно изобретению, и/или живому рекомбинантному векторному вирусу согласно изобретению, и/или псевдочастице согласно изобретению, для применения в вакцине для уничтожения CT группы A-II у свиней.
Как указано выше, A-II CT обнаруживают часто, что означает, что важно знать, присутствует ли новый пестивирус согласно изобретению на ферме, а также в определенной популяции свиней перед тем, как проявляются первые клинические признаки. Таким образом, для эффективной защиты от заболеваний важным является быстрое и правильное выявление наличия нового пестивирус согласно изобретению.
Вследствие этого другая цель этого изобретения состоит в получении диагностических инструментов, пригодных для выявления нового пестивируса согласно изобретению.
Эти инструменты частично опираются на доступность антител к вирусу. Эти антитела, можно использовать, например, в диагностических тестах для нового пестивируса согласно изобретению.
Антитела или антисыворотку, содержащую антитела к новому пестивирусу согласно изобретению, можно быстро и легко получить посредством вакцинации, например, свиней, сельскохозяйственных птиц или, например, кроликов, вирусом согласно изобретению, за которой спустя приблизительно четыре недели, следует кровопускание, центрифугирование свернувшейся крови и сливание сыворотки. Эти способы хорошо известны в данной области техники.
Другие способы получения антител, выращенных к новому пестивирусу в соответствии с изобретением, которые могут быть поликлональными, моноспецифическими или моноклональными (или их производными), также хорошо известны в данной области. Если желательны поликлональные антитела, методики получения и обработки поликлональных сывороток хорошо известны в данной области в течение десятилетий, см., например, Mayer и Walter (35).
Моноклональные антитела, активные против вируса согласно изобретению, можно получить посредством иммунизации инбредных мышей посредством методик, также давно известных в данной области, см., например, Kohler и Milstein(36).
Таким образом, другой вариант осуществления настоящего изобретения относится к антителам или антисывороткам, которые реагируют с вирусом согласно изобретению.
Набор диагностических тестов, основанный на выявлении CTAPV, может содержать, например, стандартный тест ELISA. В одном примере данного теста стенки лунок планшета ELISA покрывают антителами, направленными против вируса. После инкубации с материалом, подлежащим тестированию, в лунки добавляют меченые антитела, взаимодействующие с вирусом. Если материал, подлежащий тестированию, действительно может содержать новый пестивирус согласно изобретению, данный вирус может связываться с антителами, покрывающими лунки ELISA. Меченые антитела, взаимодействующие с вирусом, которые можно в последующем добавить в лунки, могут, в свою очередь, связываться с вирусом, и тогда цветная реакция может выявить наличие антигенного материала вируса.
Вследствие этого, другой вариант осуществления настоящего изобретения относится к наборам диагностических тестов для выявления пестивируса свиней, ассоциированного с врожденным тремором группы A-II, которые содержат антитела, взаимодействующие с вирусом, согласно изобретению или с его антигенным материалом. Антигенный материал вируса следует интерпретировать в широком смысле. Он может представлять собой, например, вирус в дезинтегрированной форме, или материал оболочки вируса, содержащий белки наружной мембраны вируса. Если материал вируса реагирует с антисывороткой, индуцированной против вируса, материал считается антигенным материалом.
Набор диагностических тестов, основанный на выявлении в сыворотке антител, взаимодействующих с пестивирусом свиней, ассоциированным с врожденным тремором группы A-II, может также, например содержать стандартный тест ELISA. В этом тесте стенки лунок планшета ELISA, могут быть покрыты, например, вирусом согласно изобретению или его антигенным материалом. После инкубации с материалом, подлежащим тестированию, например, сывороткой животного с подозрением на инфицирование новым пестивирусом согласно изобретению, в лунки добавляют меченые антитела, взаимодействующие с вирусом согласно изобретению. Если антитела к новому пестивирусу согласно изобретению могут присутствовать в тестируемой сыворотке, эти антитела будут связываться с вирусами, покрывающими лунки ELISA. Как следствие, добавленные позднее меченые антитела, взаимодействующие с вирусом, могут не связываться, и цветная реакция может не обнаружиться. Отсутствие цветной реакции, таким образом, может выявить наличие антител, взаимодействующих с вирусом согласно изобретению.
Вследствие этого, другой вариант осуществления настоящего изобретения относится к наборам диагностических тестов для выявления антител, реагирующих с пестивирусом свиней, ассоциированным с врожденным тремором группы A-II, которые содержат вирус согласно изобретению или его антигенный материал.
Дизайн иммуноанализа может варьировать. Например, иммуноанализ может быть основан на конкурентной или прямой реакции. Более того, в протоколах можно использовать твердые подложки или могут использовать клеточный материал. Выявление комплекса антиген-антитело может задействовать применение меченых антител; метки могут представлять собой, например, ферменты, флуоресцентно-, хемолюминисцентно-, радиоактивные молекулы или молекулы красителей.
Подходящие способы выявления антител, взаимодействующих с вирусом согласно настоящему изобретению в образце включают, в дополнение к ELISA, указанному выше, реакцию иммунофлуоресценции (IFT) и вестерн-блоттинг.
Альтернативным, но быстрым и легким диагностическим тестом для диагностики наличия или отсутствия врожденного тремора группы A-II, ассоциированного с пестивирусом свиней, является ПЦР-тест, как отмечено выше, включающий набор праймеров для ПЦР, специфически взаимодействующих с геномом нового пестивируса согласно изобретению. Специфический в данном контексте обозначает характерный, например, для генома нового пестивируса согласно изобретению, т.е. не с геномом других пестивирусов.
Совершенно очевидно, что можно использовать больше праймеров, чем праймеров, идентифицированных выше. Настоящее изобретение впервые предоставляет уникальную последовательность генома нового пестивируса согласно изобретению. Это позволяет квалифицированному специалисту в данной области выбирать без каких-либо дополнительных усилий другие селективные праймеры. Посредством простого компьютерного анализа генома нового пестивируса согласно изобретению, последовательности гена, предоставленной настоящим изобретением, с известным геномом других пестивирусов, квалифицированный специалист в данной области способен разработать другие специфические ПЦР-праймеры для диагностических тестов для выявления нового пестивируса согласно изобретению и/или для дифференцировки между новым пестивирусом согласно изобретению и другими вирусными (свиными) патогенами.
Понятно, что ПЦР-праймеры, которые специфически реагируют с геномом нового пестивируса согласно изобретению, представляют собой такие праймеры, которые реагируют только с геномом нового пестивируса согласно изобретению, а не с геномом другого (свиного) патогенного вируса, или группой (свиных) патогенных вирусов.
Таким образом, другой вариант осуществления относится к набору диагностических тестов для выявления группы A-II врожденного тремора, ассоциированного с пестивирусом свиней, отличающемуся тем, что указанный набор тестов содержит набор праймеров для ПЦР, которые специфически взаимодействуют с геномом нового пестивируса согласно изобретению.
Предпочтительная форма этого варианта осуществления относится к набору диагностических тестов для выявления группы A-II врожденного тремора, ассоциированного с пестивирусом свиней, при этом указанный тест содержит набор праймеров, как показано в SEQ ID NO:15-16.
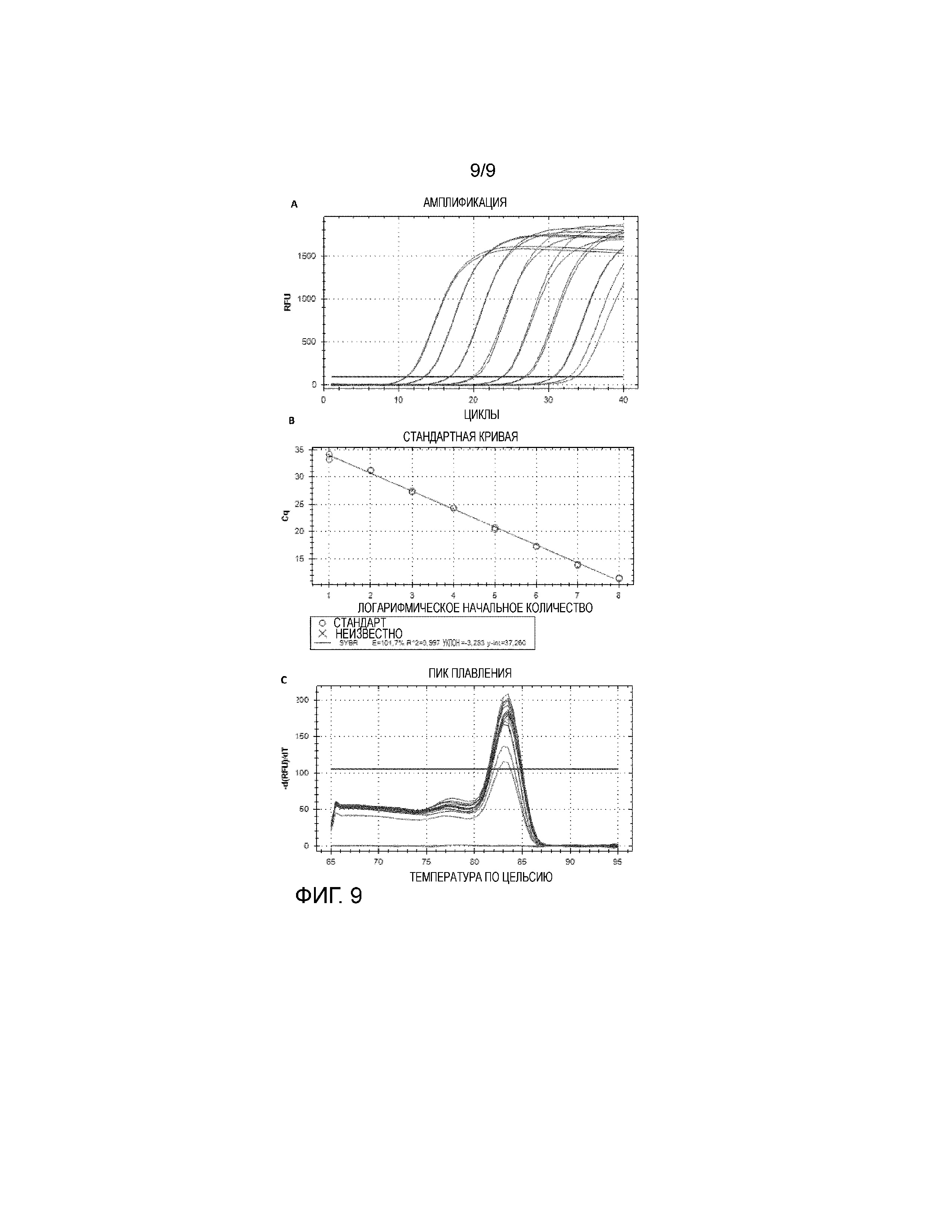
Особая форма диагностического теста представлена qRT-ПЦР-тестом, описанным более подробно в примере 10. Этот тест является весьма подходящим для количественного определения количества вируса, присутствующего в различных образцах, таких как образцы сыворотки, образцы семенной жидкости и образцы тканей. Эти тесты делают возможным, в дополнение к выявлению РНК вируса, быстрое и надежное количественное определение числа копий РНК, присутствующих в этих образцах.
В примере 10 описано, как РНК выделяли и подвергали реакциям с обратной транскриптазой, после чего олигонуклеотидные праймеры применяли для амплификации 5'-UTR-генома генома CTAPV. Эта часть вирусного генома была выбрана на основании консервативной нуклеотидной последовательности между 1-9 вариантами CTAPV (исходя из выравнивания нуклеотидных последовательностей). Праймерные последовательности, используемые в примере 10, были следующими: CTAPV-PAN2-F3-B: CGTGCCCAAAGAGAAATCGG (SEQ ID NO:35) и CTAPV-PAN2-R3-B (SEQ ID NO:36): CCGGCACTCTATCAAGCAGT. Специалисту в данной области, однако, должно быть понятно, что для выбора подходящих праймеров можно применять любую часть вирусного генома, которая демонстрирует консервативную нуклеотидную последовательность между вариантами CTAPV.
Пример 10 демонстрирует, как реакция qRT-ПЦР согласно изобретению была успешно использована для выявления вирусной РНК, например, в семенной жидкости хряков.
В примере 11 показано, с использованием этой диагностической методики, что молодой свиньи, не имеющие CTAPV, могут инфицироваться CTAPV через семенную жидкость инфицированных CTAPV кабанов.
Библиография
Maplesden, D.C. and G.C. Brown, Can J Comp Med Vet Sci, 2: 170-2 (1957).
Bolske, G., T. Kronevi, and N.O. Lindgren, Nord Vet Med, 30: 534-7 (1978).
White, M. http://www.nadis.org.uk/bulletins/congenital-tremor.aspx.
Ha, Y., K. Jung, and C. Chae, Vet Rec, 156: 383-4 (2005).
Stevenson, G.W., et al., J Vet Diagn Invest, 13: 57-62 (2001).
Kennedy, S., et al., Journal of Veterinary Diagnostic Investigation, 15: 151-156 (2003).
Van Gennip, H.G.P. et al(A)., Vaccine 19: 447-459 (2001)
Reimann, I. et al(B)., Virology 322: 143-157 (2004)
Beer, M. et al(C)., Vaccine 25: 5665-5670 (2007)
Wehrle, F. et al(D)., Journal of General Virology 88: 2247-2258 (2007)
Dong, X.N. and Chen, Y.H., Vaccine 25:205-230 (2007).
Moennig, V., G. Floegel-Niesmann, and I. Greiser-Wilke, The Veterinary Journal 165: 11-20 (2003).
Deregt, D. and K.G. Loewen, Can. Vet. J. 36: 371-8 (1995).
Viralzone-Expasy. Pestivirus. 2010 16-apr-2013; Доступны from: http://viralzone.expasy.org/all_by_species/39.html.
Lindenbach, B.D., H.-J. Thiel, and C. Rice, Flaviviridae: the viruses and their replication. Fields virology: 1101-1152 (2007).
Stark, R., et al., J. Virol., 67: 7088-95 (1993).
Rumenapf, T., et al., J. Virol., 72: 2544-2547 (1998).
Tratschin, J.D., et al., J. Virol., 72: 7681-7684 (1998).
Mayer, D., M.A. Hofmann, and J.D. Tratschin, Vaccine. 22: 317-328 (2004).
Heimann, M., et al., J. Virol. 80: 1915-21 (2006).
Schneider, R., et al., Science 261: 1169-1171 (1993).
Risatti, G.R. et al., Journ. of Virol. 79: 3787-3796 (2005).
Risatti, G.R. et al., Virology 364: 371-82 (2007).
de Smit, A. J. et al., Vaccine 19: 1467-1476 (2001).
Widjojoatmodjo, M.N. et al., J. Virol. 74: 2973-2980 (2000).
Van Gennip, H.G., Vaccine 20: 1544-56 (2002).
Hulst, M.M. et al., J. Virol. 67:54355442 (1993)
Bouma, A. et al., Vet. Microbiol. 66: 101-114 (1999)
Van Rijn, P.A. et al., Vaccine 17: 433-440 (1999)
Moorman, R.J.M. et al., Vet. Microbiol. 73: 209-219 (2000)
Donofrio, G. et al., Clinical and Vaccine Immunol. 13: 698-701 (2006)
Lutticken D. et al., Proc. of the OIE symposium on Classical Swine Fever, Birmingham UK, July 9-10, Summaries p. 17 (1998)
Floegel-Niesmann et al., Vet Microbiol. 96:367-384 (2003)
Baculovirus Expression Vectors, A Laboratory Manual. By David R. O'Reilly, Lois K. Miller, and Verne A. Luckow. Publisher: Oxford University Press, USA ISBN-10: 0195091310 (September 23, 1993), ISBN-13: 978-0195091311 (May 1994).
Baculovirus and Insect Cell Expression Protocols. In: Methods in Molecular Biology™, Объем 388 (2007). Editors: David W. Murhammer. ISBN: 978-1-58829-537-8 (Print) 978-1-59745-457-5 (Online)
Production of recombinant proteins: novel microbial and eukaryotic expression systems by Gerd Gellissen, ISBN: 3-527-31036-3
Ruemenapf, T. et al., J. Virol. 65: 589-597 (1991)
Van Zijl, M. et al., J. Virol. 65: 2761-2765 (1991)
Peeters, B. et al., J. Gen. Virol. 78: 3311-3315 (1997)
Hammond, J.M. et al., Vaccine 18: 1040-1050 (2000)
Hammond, J.M. et al., Archives of Virology 146: 1787-1793 (2001)
Hahn, J. et al., J. Virol Methods 93: 49-56 (2001)
Gerdts et al, Journal of General Virology 78: 2139-2146 (1997)
Gorres et al., Clinical Vaccine Immunology 18: 1987-1995 (2011)
Tian, D.Y. et al., Vaccine 30: 3587-3594 (2012)
Sun, Y. et al., Vaccine 29: 8364-8372 (2011)
Sun, Y. et al., Vet. Immunol. Immunopathol. 137: 20-27 (2010)
Done, J.T. et al., Br. Vet. Journ.142:145-150 (1986)
Becher, P. et al., Journal of General Virology 78: 1357-1366 (1997)
Patterson, D.S.P. et al., J. of Neurochem. 26: 481-485 (1976)
Легенды к фигурам
Фигура 1: Схематичный обзор праймеров, разработанных в гене РНК-полимеразы (NS5B) CTAPV, и ПЦР-продуктов.
Фигура 2: 400-кратное увеличение наиболее отчетливых аномалий в ткани головного мозга и спинного мозга с фиксацией в формалине и окрашиванием гематоксилином-эозином. (A) Поперечный срез мозжечка, который демонстрирует вакуолизацию клеток Пуркинье (слой крупных клеток между гранулярным слоем и белым веществом. Белая стрелка указывает на примеры вакуолизации в некоторых из клеток Пуркинье. (B) Вакуолизация белого вещества, показатель демиелинизации. Некоторые примеры демиелинизации аксонов в спинном мозге указаны белыми стрелками. (C) Накопление микроглии (окрашенное темно-фиолетовым), образующей узелок микроглии дегенерирующего нейрона (нейронофагия) в головном мозге. Нейрон указан белой стрелкой. (D) Периваскулярная инфильтрация в грудном отделе спинного мозга. Эозинофильные гранулоциты, окружающие кровеносные сосуд, который указан стрелками.
Фигура 3: Филогенетическое древо CTAPV 1 и других ранее идентифицированных пестивирусов, нуклеотидную последовательность которых поместили в Genbank (учетные номера, указанные в фигуре). Аминокислотные последовательности полипептида использовали в способе ближайших соседей. Планка в левом углу представляет среднее число нуклеотидных замещений/сайтов.
Фигура 4: Филогенетический анализ вариантов CTAPV. Аминокислотные последовательности использовали в способе ближайших соседей. Планка в левом углу представляет среднее число нуклеотидных замещений/сайтов. Анализ основан на первых 5000 нуклеотидах генома. CTAPV 7 типа не включен. CTAPV 5 идентичен CTAPV 8.
Фигура 5: Сравнение аминокислотных последовательностей участка Erns-E1-E2 CTAPV 1 и 1B. Последовательность белка E2 выделена курсивом. Белок Erns подчеркнута жирной линией, последовательность белка E1 подчеркнута тонкой линией.
Фигура 6: Сравнение аминокислотных последовательностей участка Erns-E1-E2 CTAPV 1B и 8. Последовательность белка E2 выделена курсивом. Белок Erns подчеркнут жирной линией, последовательность белка E1 подчеркнута тонкой линией.
Фигура 7: Антитела, продуцируемые у кроликов, специфически распознают белок Е2 CTAPV, экспрессируемый в экспрессионной системе бакуловирус/SF9. Маркерные полосы соответствуют (снизу вверх) 5, 10, 20, 25, 37, 50, 75, 100, 150 и 250 кДа.
Фигура 8: Указание локализации области, кодирующей белок Erns (подчеркнуто жирным), области, кодирующей белок E1 (подчеркнуто тонким) и области, кодирующей белок E2 (курсивом). Последовательность начинается в nt 1259 референсного генома.
Фигура 9: данные RT-qPCR образцов эталонной линии и образцов отрицательного контроля. Фигура 9A демонстрирует диаграмму со значениями Ct с циклами, нанесенными в зависимости от RFU, фигура 9B демонстрирует калибровочную кривую; значения Ct, нанесенные в зависимости логарифмически преобразованных концентраций серийных десятикратных (лог) разведений целевой нуклеиновой кислоты, а фигура 9C демонстрирует производную кривую плавления в реальном времени.
Примеры
Пример 1.
Открытие нового вируса, CTAPV 1, на свиноферме в Нидерландах
На свиноферме, находящейся в Нидерландах, вспышка врожденного тремора типа A-II диагностировали в начале 2012 года. Прежде всего, были поражены поросята, родившиеся у молодых свиней, впервые рожавших животных, но также изредка поражались многородящие свиноматки. Диагноз основывался на клинических наблюдениях и последующем исключении врожденного тремора типов A-I, A-III, A-IV и A-V, как возможной причины заболевания. Клинически пораженные поросята демонстрировали тремор различной степени вследствие чрезмерных мышечных сокращений во время активности. Симптомы уменьшались во время сна. Потеря поросят была вторичным эффектом, вызванным неспособностью пораженных животных питаться, особенно во время первой недели после рождения. Гистологически головной и спинной мозг характеризовались гипомиелинизацией. Как дополнительно описано ниже, не все пораженные животные выжили. У тех, кто выжил, тремор уменьшался и в итоге исчез, когда свиньи подросли.
Исходя из информации о вспышке, подозревали инфекционное происхождение заболевания. В первые 20 недель 2012 года из 231 пометов, рожденных всего у молодых свиней, с симптомами врожденного тремора у молодых свиней всего родилось 48 пометов. Это равно 21% всех пометов, рожденных у молодых свиней. На пике инфекции, через 8 недель после первичной вспышки, 85% пометов молодых свиней показали поросят с врожденным тремором типа A-II. Процент потери поросят (гибели поросят) до отнятия составил 26% в пораженных пометах, по сравнению с 11% в непораженных пометах. В пораженных пометах 60% гибели поросят объяснялось врожденным тремором. Общее количество поросят, рожденных на помет, не изменялось. Врожденный тремор поражал оба пола, и распространенность в пределах помета варьировала между <10% и 100%.
Перед вспышкой в 2012 году врожденный тремор наблюдали в нескольких пометах в ноябре 2009 года и декабре 2010 года.
Проблемы со вспышками врожденного тремора продолжились на данной ферме с 2012, и пораженных поросят получали в 2013 и 2014 гг. (см. ниже). Однако показатель частоты снижался.
Образцы плазмы крови были получены в марте 2012 года (6 образцов, все поросята с симптомами CT типа A-II) и апреле 2012 года (5 образцов, все поросята с симптомами CT типа A-II). Новый вирус CTAPV 1 определили в 11/11 образцов.
Больше образцов плазмы крови получили с той же фермы в июле 2012 года. Всего подвергли анализу 16 образцов сыворотки у поросят, родившихся у 2 свиноматок и 1 молодой свиньи. Ни один из данных поросят не продемонстрировал врожденного тремора. CTAPV был обнаружен в 1/16 образцов.
Новую вспышку заболевания диагностировали в январе 2013 года. Для вскрытия было получено четыре новорожденных преколостральных поросенка, все продемонстрировали CT типа A-II. Данный вирус назвали CTAPV 1A, поскольку он происходил с той же фермы, но между исходной вспышкой и появлением новых клинических проблем прошло значительное время. Новый вирус CTAPV 1A был определен у 4/4 поросят.
Новую вспышку заболевания диагностировали в марте 2013 года. Для вскрытия было получено три новорожденных преколостральных поросенка, все продемонстрировали CT типа A-II. Данный вирус назвали CTAPV 1B. Новый вирус CTAPV 1 был определен в 3/3 образцов.
Новую вспышку заболевания диагностировали в январе 2014 года. Было получено четыре новорожденных преколостральных поросенка (ректальные тампоны), все продемонстрировали CT типа A-II. Данный вирус назвали CTAPV 1C. Новый вирус CTAPV 1 был определен в 4/4 образцов. Вскрытие дополнительных 3 поросят выполнили в феврале 2014 года, вновь все 3 поросят продемонстрировали CT типа A-II, и CTAPV был определен в 3/3 образцов.
Проводили посмертное исследование поросят из вспышек в январе 2013 года, марте 2013 года и феврале 2014 года. Головной мозг и спинной мозг демонстрировали признаки демиелинизации (см. пример 2).
В качестве отрицательного контроля для ПЦР и для посмертного исследования использовали семь поросят (6 перед родами, последняя неделя гестации; 1 новорожденный) с фермы без врожденного тремора типа A-II в анамнезе. Все образцы плазмы были отрицательными на вирус CTAPV, и гастологических аномалий у этих поросят не наблюдалось.
Сбор образцов сыворотки и фекалий
Образцы фекалий и сыворотки были получены на фермах в Нидерландах, в которых имели место проблемы с CT типа A-II у новорожденных свиней. Кровь собирали в пробирку (тип: Vacuolette 8 мл Sep Clot Activator ref: 455071), а сыворотку выделяли посредством центрифугирования 20 минут при 3000 x g при 4°C. Фекалии собирали с применением сухой ватной палочки и помещали в стерильную пробирку, содержащую 2 мл фосфатно-буферного солевого раствора (PBS). Затем ватные палочки с фекалиями сильно встряхивали и выбрасывали. Образцы и сыворотки, и фекалий хранили при -70°C до анализа.
Выделение РНК вируса с необязательной обработкой ДНКазой
Для выделения РНК вируса применяли QIAamp Viral RNA mini Kit (Qiagen) в комбинации с не содержащим РНКазы набором ДНКазы (Qiagen).
Говоря кратко, приготовили 1% раствор носителя-RNA/AVE в буфере AVL. 560 мкл носителя-RNA/AVE в AVL смешали со 140 мкл образца и инкубировали 10 минут при комнатной температуре. Затем добавили 560 мкл этанола (>99%), и образцы перенесли в центрифужную колонку QIAamp mini. Колонки центрифугировали в течение 1 минуты при 6000 x g. Колонки промывали посредством добавления 250 мкл AW1, и колонки вращали 30 секунд при 6000 x g. Смесь ДНКаз получали посредством смешивания 10 мкл ДНКазы с 70 мкл буфера RDD на образец. 80 мкл смеси ДНКаз инкубировали на мембране в течение 15 минут при комнатной температуре. Промывание продолжали посредством помещения 250 мкл AW1 на колонку, и вращали его 30 секунд при 6000 x g с последующим добавлением 500 мкл AW2 в колонки и центрифугированием 3 минуты при 13000 x g. Пробирки для сбора образцов заменяли, а колонки центрифугировали в течение еще одной минуты. Центрифужные колонки переносили в 1,5 мл пробирку Eppendorf, куда на мембраны добавляли 65 мкл буфера AVE и центрифугировали 1 минуту при 6000 x g. Образцы RNA получали непосредственно перед обратнотранскриптазной реакцией.
Обратнотранскриптазная реакция
РНК транскрибировали в кДНК с применением SuperScript® III First-Strand Synthesis System for RT-PCR (Invitrogen). Протокол изготовителя сопровождался некоторыми незначительными изменениями. В общих словах, 1 мкл случайных гексамеров и 1 мкл 10 мМ dNTP смешивали с 8 мкл РНК. Сначала их инкубировали 5 минут при 65°С, затем охлаждали на льду. Затем в образцы добавляли 10 мкл смеси для синтеза кДНК, состоящей из 2 мкл 10x буфера RT, 4 мкл MgCl
2, 2 мкл DTT, 1 мкл РНaseOUT и 1 мкл Superscript®III RT. Образцы сначала инкубировали 10 минут при 25°C, затем 50 минут при 50°C с последующими 5 минутами при 85°C и в итоге охлаждали на льду. В образцы добавляли 1 мкл РНКазы H. и их инкубировали 20 минут при 37°C. Полученные образцы кДНК хранили при -20°C до применения.
ПЦР
A. Комбинация праймеров CTAPV-PAN2-F1R1, -F2R1, -F1R2, -F2R2, Таблица 1,2
Каждая реакция ПЦР включала 27 мкл WFI, 1 мкл Super Taq Plus 5 мкл 10x ПЦР-буфер Super Taq, 5мкл dNTP, 5 мкл прямого праймера и 5 мкл обратного праймера. Обзор используемых праймеров представлен в таблице 1. Программа ПЦР, применяемая для выявления CTAPV, состояла из 4-минутного этапа инициализации при 95°C. За ним следовало 35 циклов последовательно денатурации в течение 30 секунд при 95°C, отжига в течение 30 секунд при соответствующей температуре отжига для пары праймеров (см. таблицу 1) и удлинения в течение 30 секунд при 72°C. Итоговое удлинение при 72°C поддерживали в течение 10 минут. Все ПЦР-продукты подвергали анализу электрофорезом в 1,5% агарозном геле. См. фигуру 1.
B. Комбинация праймеров CTAPV-PAN-FW-RV, PANdeg-FW-PANdeg-REV, Таблица 1,2
Каждая реакция ПЦР включала 27 мкл WFI, 1 мкл Super Taq Plus 5 мкл 10x ПЦР-буфер Super Taq, 5мкл dNTP, 5 мкл прямого праймера и 5 мкл обратного праймера. Обзор используемых праймеров представлен в таблице 2. Программа ПЦР, применяемая для выявления CTAPV, состояла из 4-минутного этапа инициализации при 95°C. За ним последовательно следовало 35 циклов денатурации в течение 30 секунд при 95°C, отжига в течение 30 секунд при соответствующей температуре отжига для пары праймеров (см. таблицу 2) и удлинения в течение 30 секунд при 72°C. Итоговое удлинение при 72°C поддерживали в течение 10 минут. Все ПЦР-продукты подвергали анализу электрофорезом в 1,5% агарозном геле.
C. Комбинация праймеров CTAPV-PAN2-F3R3, -F4R4, Таблица 1,2
Каждая реакция ПЦР включала 27 мкл WFI, 1 мкл Super Taq Plus 5 мкл 10x ПЦР-буфер Super Taq, 5мкл dNTP, 5 мкл прямого праймера и 5 мкл обратного праймера. Обзор используемых праймеров представлен в таблице 1. Программа ПЦР, применяемая для выявления CTAPV, состояла из 4-минутного этапа инициализации при 95°C. За ним следовало 35 циклов последовательно денатурации в течение 30 секунд при 95°C, отжига в течение 30 секунд при соответствующей температуре отжига для пары праймеров (см. таблицу 1) и удлинения в течение 30 секунд при 72°C. Итоговое удлинение при 72°C поддерживали в течение 10 минут. Все ПЦР-продукты подвергали анализу электрофорезом в 1,5% агарозном геле.
Таблица 1: Обзор праймеров
|
Таблица 2: Обзор применяемых комбинаций праймеров и характеристики мишеней
|
D. Количественная ПЦР на основе SYBR Green
Стандартная линия количественного определения результатов qPCR
Для получения стандарта для количественной ПЦР, продукт ПЦР из 155 пар оснований последовательности CTAPV, содержащий целевую последовательность количественной ПЦР, клонировали в плазмидный вектор TOPO4 (Life Technologies) согласно инструкциям изготовителя. Продукт ПЦР из 155 пар оснований для клонирования был получен посредством выполнения ПЦР с праймерами CTAPV-PAN2-F1 и CTAPV-PAN2-R1, см. таблицу 3. В последующем продукт ПЦР подвергали анализу электрофорезом в 1,5% агарозном геле. Ленту из 155 пар оснований вырезали, и ДНК экстрагировали из агарозного геля перед клонированием в векторе TOPO4.
TOPO TA Cloning® Kit (Invitrogen) применяли для лигирования продукта ПЦР в вектор pCR®4-TOPO4® и для его трансформации в One Shot® TOP10 Chemically Competent E. Coli. В общих словах, 4 мкл ДНК смешивали с 1 мкл солевого раствор и 1 мкл вектора TOPO. Результат данного лигирования инкубировали в течение 5 минут при комнатной температуре, а затем помещали на лед. В One Shot® TOP10 Chemically Competent E. Coli добавляли 2 мкл лигационной смеси. После 30 минут инкубации на льду смесь подвергали тепловому шоку на водяной бане при температуре 42°C в течение 30 секунд и вновь помещали на лед. Далее добавляли 250 мкл теплой среды SOC, и смесь инкубировали 1 час при 37°C во встряхивателе-инкубаторе, после чего 100 мкл смеси наносили на планшет с агаром LB+100 мкг/мл ампициллина. Планшет инкубировали в течение ночи в инкубаторе при 37°C.
Правильно клонированные колонии идентифицировали с применением метода молекулярных колоний с применением праймеров M13 (см. таблицу 3 ниже; (SEQ ID NO:30 и 31)) в стандартных анализах ПЦР с последующим электрофорезом в геле. Правильные колонии выращивали в среде LBACF (MSD AH Media Production lot. No. 318781; среда Лурия-Бертани, не содержащая животных компонентов) с ампициллином, из которой выделяли плазмидную ДНК с применением QIAGEN® Plasmid Midi kit (Qiagen) согласно протоколу изготовителя. Для проверки мутаций плазмидную ДНК секвенировали с использованием праймеров M13.
Таблица 3: Обзор комбинаций праймеров, применяемых для анализа количественной ПЦР
|
Стандартные разведения целевой последовательности рассчитывали путем измерения концентраций плазмидной ДНК вектора. Формула для расчета плазмидных копий/мкл показана ниже (Формула 1). Концентрацию ДНК (нг/мкл) измеряли с применением спектрофотометрии. A, G, T и C представляют собой числа одноименных нуклеотидов в плазмиде. 6,02*1023 представляет собой число Авогадро. Умножение на 2 преобразует концентрацию ssDNA в концентрацию dsDNA, а умножение на 109 преобразует грамм в нанограмм. Для реакций количественной ПЦР было сделано восемь разведений, содержащих 108-101 копий/2 мкл.
Формула 1: Формула для подсчета плазмидных копий/мкл.
|
Количественная ПЦР
Количественная ПЦР была разработана на основе SYBR Green. Каждая реакция содержала мастер-микс 10 мкл KAPA SYBR Fast количественной ПЦР, 0,4 мкл 10 мкМ прямого праймера, 0,4 мкл 10 мкМ обратного праймера, 7,2 мкл WFI и 2 мкл матрицы. Применяли праймеры CTAPV-PAN-F1 и CTAPV-PAN-R1 (См. таблицу 4). Использовали следующую программу: 3 минуты при 95°C с последующими 39 циклами последовательно 10 секунд при 95°C, 10 секунд при 60°C и чтение планшета в системе Biorad CFX. Результаты анализировали с применением программного обеспечения Biorad CFX. Результаты сравнивали со стандартной линией, как описано выше; 10-кратное разбавление серии продукта CTAPV 155 пар оснований, клонированного в плазмиду TOPO4. В программу количественной ПЦР был включен анализ кривой плавления между 65°C --> 95°C; на 0,5°C 0,05 секунд.
Специфичность реакции количественной ПЦР была подтверждена гель-электрофорезом амплифицированного продукта ПЦР. Наклон калибровочной кривой и точка пересечения с осью у были рассчитаны программным обеспечением CFX. r2 составил >0,99. Эффективность ПЦР, рассчитанная по уклону, составляла 95-105%.
Таблица 4: Реакционная смесь для количественной ПЦР
|
Секвенирование нуклеиновой кислоты
Секвенирование по Сенгеру проводилось согласно способам, описанным в литературе. Последовательности анализировали с применением Sequencer 5.0 и Clone Manager 9.
Филогенетический анализ
Филогенетический анализ проводили для классификации CTAPV 1 как пестивируса.
Аминокислотные последовательности целого гена нового вируса использовали для создания филогенетических деревьев на основании метода максимального правдоподобия ближайшего связывания, модели коррекции Пуассона и бутстреп анализа (500 репликатов).
Три дерева создали с применением программы MEGA, version 5, с применением стандартных настроек. (MEGA5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Koichiro Tamura, Daniel Peterson, Nicholas Peterson, Glen Stecher, Masatoshi Nei and Sudhir Kumar. Mol. Biol. Evol. 28(10): 2731-2739. 2011 doi:10.1093/molbev/msr121 Advance Access publication May 4, 2011).
Пример 2.
Вирус CTAPV может быть обнаружен в органах и лейкоцитах периферической крови; Гистология указывает на демиелинизацию головного и спинного мозга
Анализ ПЦР следующих органов подвергнутых вскрытию преколостральных новорожденных поросят (CTAPV 1A/1B, 2013) с врожденным тремором типа A-II показал наличие вируса CTAPV.
CTAPV могли обнаружить в крови, сыворотке, плазме и PBL (лейкоцитах периферической крови), сердце, тонкой кишке, толстой кишке, головном мозге, грудном отделе спинного мозга, поясничном отделе спинного мозга, печени, паховом лимфатическом узле, легком, желчном пузыре, мочевом пузыре, почке, миндалине и селезенке. Наиболее высокие количества были обнаружены в сыворотке и миндалинах.
Те же органы были взяты в качестве образцов у контрольных поросят перед родами (последняя неделя гестации) с фермы с отсутствием в истории CT типа A-II. Все органы были отрицательны согласно ПЦР.
Головной и спинной мозг контрольных и инфицированных CTAPV поросят вскрывали, фиксировали в формалине и окрашивали гематоксилином-эозином. Гистологическое исследование выявило показатели демиелинизации исключительно у инфицированных CTAPV поросят (Фигура 2 A-D).
Разновидности CTAPV с ферм различных географических локализаций
Разновидности CTAPV 2-9 были получены со свиноферм в Нидерландах при вспышках в 2013 году и далее.
Таблица 5 демонстрирует число поросят, тестируемых на каждой ферме, и число CTAPV-положительных согласно ПЦР поросят (сыворотки/ректальные тампоны).
Таблица 5: Обзор разновидностей CTAPV с различных ферм в Нидерландах. Результаты анализа ПЦР CTAPV в сыворотке и/или ректальных образцах
|
Связи с заболеванием составляет 100% для поросят, демонстрирующих CT типа A-II. Вирус CTAPV был определен у всех поросят с врожденным тремором типа II, но не у контрольных образцов, взятых на ферме без CT типа A-II в истории.
CTAPV 1 был обнаружен у одного поросенка, который не демонстрировал врожденного тремора. Данного поросенка получили с фермы 1, фермы без CT типа A-II в истории.
CTAPV 4 был обнаружен у поросят, которые не демонстрировали врожденного тремора. CTAPV 4 был обнаружен на той же ферме, где был обнаружен CTAPV 3 (ферма 3). Таким образом, CTAPV 4 присутствовал на ферме с CT типа A-II в истории.
Всего было обнаружено 12 разновидностей из 8 различных географических локализаций.
Разновидности CTAPV 1, 1A, 1B, 1C происходили из одной и той же фермы в различные моменты времени.
Разновидности CTAPV 3 и 4 происходили из одной и той же фермы.
Хотя и были обнаружены в различных географических локализациях, разновидности CTAPV 5 и 8 являются идентичными на нуклеотидном уровне.
Таблица 6 демонстрирует рекативность пар праймеров.
|
Таблица 6: Реактивность пар праймеров.
Все разновидности могут быть определены с применением праймерной пары F3R3 для ПЦР
Все разновидности могут быть определены с применением одной из комбинаций праймеров F1R1, F1R2, F2R1, F2R2 для ПЦР, однако, разновидность CTAPV 9 не тестировали.
Определение последовательности генома
Последовательность полного генома CTAPV 1 была получена посредством секвенирования по Сенгеру.
Из других разновидностей были получены CTAPV 1A, 1B, 1C, 2, 3, 4, 6, 8 и 9, первые 5000 пар оснований которых содержат кодирующие последовательности для Erns, E1 и E2.
Только ограниченная нуклеотидная последовательность из 1073 нуклеотидов доступна для M7
Основываясь на определении последовательности генома, пришли к заключению, что CTAPV 5=CTAPV 8
Пример 3.
Филогенетический анализ разновидностей CTAPV и CTAPV
Филогенетическое древо CTAPV 1 и других известных пестивирусов представлено на фигуре 3. Процентное значение поддержки будстрэпа измеряется в узлах. Поперечина показывает число замещений нуклеотидов на сайт.
Филогенетическое древо 10 разновидности CTAPV, описанное в данной патентной заявке, представлено на фигуре 4. В данный анализ были включены только разновидности CTAPV 1, 1A, 1B, 1C, 2, 3, 4, 6, 8 и 9. В данный анализ была включена нуклеотидная последовательность 1-5000 пар оснований, которая включает кодирующие последовательности для Erns, E1 и E2.
CTAPV 7 не был включен, поскольку для M7 были доступны лишь 1073 нуклеотидов.
CTAPV 5 не включен, поскольку CTAPV 5=CTAPV 8
Пример 4.
Анализ спрогнозированного белка Е2/нуклеотидной последовательности демонстрирует, что белок Е2 CTAPV 1B=белок Е2 CTAPV 1. Белок CTAPV 8 демонстрирует 14 аминокислотных замещений по сравнению с CTAPV 1.
Органы, подвергнутые аутопсии, которые могли бы служить в качестве исходного материала для экспериментов по инфекции, были доступны для CTAPV 1B, но не для CTAPV 1. Авторы изобретения проанализировали нуклеотидную и аминокислотную последовательность генов/белков Erns-E1-E2 CTAPV 1 и 1B. Аминокислотная последовательность является идентичной на 100% (Фигура 5). Последовательность белка E2 выделена курсивом. Белок Erns подчеркнут жирной линией, последовательность белка E1 подчеркнута тонкой линией.
Органы, подвергнутые аутопсии, которые могли бы служить в качестве исходного материала для экспериментов по инфекции, были также доступны для CTAPV 8. Авторы изобретения проанализировали нуклеотидную и аминокислотную последовательность генов/белков Erns-E1-2 CTAPV 1B и 8 (сравнение аминокислот на фигуре 6). Аминокислотная последовательность является идентичной на 95%. Последовательность белка E2 выделена курсивом. Белок Erns подчеркнут жирной линией, последовательность белка E1 подчеркнута тонкой линией. CTAPV 8 имеет 14 аминокислотных замещений (идентичность 93,3%) по сравнению с CTAPV 1B, в котором положительными являются 9 (97,6% положительных).
Пример 5.
Приготовление провокационного материала
Провокационный материал был получен из органов, подвергнутых аутопсии (полевой материал) поросят, пораженных CTAPV 1B (2013) и CTAPV 8 (2014). Органы, подвергнутые аутопсии, хранили при -70°C до применения.
CTAPV 1B
Головной мозг 3 поросят пораженного помета объединили перед гомогенизацией.
Спинной мозг 3 поросят пораженного помета объединили перед гомогенизацией
Селезенки 3 поросят пораженного помета объединили перед гомогенизацией
Миндалины 3 поросят пораженного помета объединили перед гомогенизацией
CTAPV 8
Головной мозг 4 поросят пораженного помета объединили перед гомогенизацией
Спинной мозг 4 поросят пораженного помета объединили перед гомогенизацией
Селезенки 4 поросят пораженного помета объединили перед гомогенизацией
Миндалины 4 поросят пораженного помета объединили перед гомогенизацией
После оттаивания объединенные органы взвешивали. В дальнейшем в тканевой материал добавляли PBS или среду M6B8 с 10 мкМ HEPES (Sigma H3375-250G, CTAPV 8) в 9 раз больше массы тканей (CTAPV 1B). Ткань гомогенизировали с применением блендера, с последующим встряхиванием с маленькими стеклянными шариками в течение 5 минут. Во время гомогенизации превращенные в массу органы хранили на льду. Превращенные в массу органы центрифугировали 1 час при 3200 x g. Супернатант сначала пропускали через 0,45 мкМ фильтр, а в последующем через 0,22 мкМ фильтр. Фильтрованный гомогенат хранили при -70°C до применения.
Пример 6.
Эксперимент по инфекции с поросятами-отъемышами для получения инфекционного материала
Эксперименты по заражению с гомогенатами органов CTAPV 1B и CTAPV 8, полученных от полевых изолятов, проводились у 4-8-недельных SPF в возрасте отъема/поросят высокого качества потомства промышленной откормочной свиньи.
Во время размещения на опытной базе у животных были получены образцы крови CPDA (цитрат-фосфат-декстроза-аденин), ректальные тампоны, орофарингеальные тампоны и назальные тампоны. Животных разместили в двух отдельных экспериментальных комнатах: животные группы A 8 и животные группы B 8. Не было физического контакта или косвенного контакта через смотрителей животных между комнатами.
В группе A шесть животных были заражены гомогенатами CTAPV 1B через внутримышечный (IM), подкожный (SC), интраназальный (N) и пероральный (OR) пути.
Две свиньи получили инокулят от смеси гомогенатов селезенка+спинной мозг+головной мозг
Две свиньи получили инокулят от смеси гомогенатов селезенка+миндалина+головной мозг
Две свиньи получили инокулят от смеси гомогенатов головной мозг+спинной мозг
Две свиньи служили в качестве индикаторов контактов
Объемы IM, SC и N составили 1,0 мл на дозу, справа и слева. Пероральный объем составил 4 мл. Назальную дозу распыляли. Провокационные дозы приведены в таблице 7.
После заражения за всеми свиньями ежедневно наблюдали на предмет клинических признаков, но во время хода эксперимента животные оставались бессимптомными.
Кровь с CPDA, назальные тампоны, орофарингеальные тампоны и ректальные тампоны были взяты на день 0, день 3, день 7, день 10 и день 14 после заражения для мониторинга инфекции и выделения CTAPV 1B посредством количественного ПЦР анализа. Плазму получили из крови с CPDA с применением набора Leucosep® (Greiner Mat. no. 163 288). Результаты количественного ПЦР анализа образцов плазмы представлены в таблице 7.
Все зараженные животные показали положительный результат CTAPV в количественной ПЦР в плазме крови на день 10. Исходя из выделения вируса, животные были умерщвлены в различные временные точки для получения свежего инфицированного материала для последующих исследований in vitro и in vivo.
При вскрытии у животных брали головной мозг, спинной мозг, селезенка, миндалины и кровь.
Таблица 7: Провокационные дозы и результаты заражения CTAPV 1B
CTAPV 1B
|
n.d.: не определялось;
N/A: не анализировали (животное уже умерщвлено).
В группе B шесть свиней были заражены гомогенатами CTAPV 8 посредством внутримышечного (IM), подкожного (SC), интраназального (N) и перорального (OR) путей.
Две свиньи получили инокулят из гомогенатов селезенки+миндалины+головного мозга+спинного мозга
Две свиньи получили инокулят из гомогенатов селезенки+миндалины
Две свиньи получили инокулят из гомогенатов головного мозга+спинного мозга
Две свиньи служили в качестве индикаторов контакта.
Объемы IM, SC и N составили 2,0 мл на дозу, справа и слева. Пероральный объем составил 3 или 4 мл. Назальную дозу распыляли. Провокационные дозы даны в таблице 8.
После заражения за всеми свиньями ежедневно наблюдали на предмет клинических признаков, но во время хода эксперимента животные оставались бессимптомными.
Кровь с CPDA, назальные тампоны, орофарингеальные тампоны и ректальные тампоны были взяты на день 0, день 3, день 7, день 10 и день 14 после заражения для мониторинга инфекции и выделения CTAPV 8 посредством количественного ПЦР анализа. Плазму получили из крови с CPDA с применением набора Leucosep® (Greiner Mat. no. 163 288). Результаты количественного ПЦР анализа образцов плазмы представлены в таблице 8.
Все зараженные животные показали положительный результат CTAPV в количественной ПЦР в плазме крови на день 3 и/или день 7. Исходя из выделения вируса, животные были умерщвлены в различные временные точки для получения свежего инфицированного материала для последующих исследований in vitro и in vivo.
При вскрытии у животных брали головной мозг, спинной мозг, селезенку, миндалины и кровь.
Органные материалы применяли в качестве материала заражения в исследовании вакцинации-заражения, как описано в примере 8/9
Таблица 8: Провокационные дозы и результаты заражения CTAPV 8
CTAPV 8
|
n.d.: не определялось;
N/A: не анализировали (животное уже умерщвлено).
Пример 7.
Приготовление провокационного материала для эксперимента вакцинация-заражение
Провокационный материал был получен из примера 6.
CTAPV 1B
Головной мозг, спинной мозг, селезенка и миндалины 1 животного, подвергнутого вскрытию, примера 6, группа A
CTAPV 8
Головной мозг, спинной мозг, селезенка и миндалины 1 животного, подвергнутого вскрытию, примера 6, группа B
После оттаивания объединенные органы взвешивали. В дальнейшем в тканевой материал добавляли PBS (CTAPV 1B) или среду M6B8 с 10 мкМ HEPES (Sigma H3375-250G, CTAPV 8) в 9 раз больше массы ткани. Ткань гомогенизировали с применением блендера, с последующим встряхиванием с маленькими стеклянными шариками в течение 5 минут. Во время гомогенизации превращенные в массу органы хранили на льду. Превращенные в массу органы центрифугировали 1 час при 3200 x g. Супернатант сначала пропускали через 0,45 мкМ фильтр, а в последующем через 0,22 мкМ фильтр за исключением материала для перорального введения. Фильтрованный гомогенат хранили при -70°C до применения.
Пример 8.
Эксперимент вакцинация-заражение
Разработка вакцины: экспрессия белка Е2:
Анализировали аминокислотную последовательность вируса CTAPV 1. Начало и остановку гена E2 определяли с использованием выравнивания генома вируса CTAPV с белком Е2 вируса классической чумы свиней (CSF) (Genbank: AAS 20412.1) и белком Е2 вируса диареи крупного рогатого скота (BVDV) (Genbank: AGN03787.1), а предполагаемые участки расщепления белка E2 определяли с применением программного обеспечения SignalP4.1 (http://www.cbs.dtu.dk/services/SignalP/)
Предполагаемая аминокислотная последовательность E2 CTAPV 1 (SEQ ID NO:32):
SCHKRQDYYSIQLVVDGKTGVEKRSIVGKWTVITREGREPRLMEQISMVSNDSLSETYCY
NRLNTSSWGRQPARQRGCGQTVPFWPGDNVLEEQYYSTGYWVNATGGCQLREGVWLSRKG
NVQCQRNGSSLILQLAIKEENDTMEIPCDPVETESMGPVTQGTCVYSWAFAPRGWYYNRK
DGYWLQYVKKNDYQYWTKMPTASSATTMYRH
В последующем нуклеотидная последовательность E2 CTAPV для экспрессии белка Е2 CTAPV в бакуловирусной экспрессионной системе клетках насекомых была оптимизирована с применением алгоритма Genscript OptimumGene™ (www.genscript.com) (SEQ ID NO:33).
CGCGGATCCAAATATG
TCATGTCACAAGCGTCAAGACTACTACTCTATCCAACTGGTGGTGGACGGAAAAACTGGCGTGGAAAAGCGTTCT
ATCGTGGGCAAGTGGACGGTCATCACCAGGGAGGGCAGAGAACCGCGCCTAATGGAGCAAATTTCGATGGTATCT
AACGACTCTCTTTCAGAAACCTACTGCTATAACCGTCTCAATACTAGCTCTTGGGGTCGTCAACCTGCCCGTCAG
CGCGGATGTGGGCAAACCGTCCCCTTCTGGCCTGGTGACAACGTACTCGAGGAACAGTACTATAGCACCGGATAC
TGGGTTAACGCTACTGGCGGTTGCCAACTACGCGAGGGAGTTTGGTTATCTCGTAAGGGGAACGTGCAATGTCAG
CGTAATGGCTCATCGCTGATCCTTCAACTCGCTATTAAAGAGGAAAACGACACCATGGAAATCCCGTGCGATCCA
GTCGAGACTGAATCAATGGGCCCCGTTACTCAAGGCACGTGTGTGTACAGCTGGGCTTTCGCCCCTAGGGGATGG
TACTATAACCGTAAGGACGGCTACTGGCTTCAATACGTGAAGAAAAACGATTACCAGTACTGGACCAAAATGCCC
ACTGCATCCAGCGCGACCACTATGTACCGTCACCATCACCATCACCATCACTAAGAATTCTCGAG
Сайты рестрикции BamHI и EcoRI подчеркнуты. Стартовый кодон показан курсивом, а стоп-кодон указан полужирным шрифтом.
Трансформация и экспрессия:
Ген Е2 CTAPV был синтезирован в Genscript и непосредственно клонирован в плазмидный вектор (pFastbac1) с применением сайтов рестрикции BamHI и EcoRI. Плазмиду трансформировали в E. coli с применением стандартных методик трансформации, и в последующем плазмиду ДНК очистили и использовали для трансфекции клеток насекомых SF9. Трансфекцию выполняли следующим образом:
2 мл суспензии клеток, составляющей 5*105 клеток/мл, добавили в каждую лунку 6-луночного планшета. Клеткам дали прикрепиться к планшету в течение 1 часа при 27°C. Следующий раствор для трансфекции (200 мкл среды без антибиотиков, 5 мкл miniprep ДНК и 6 мкл целфектина (Invitrogen)) приготовили и инкубировали при комнатной температуре в течение 45 минут. Через 45 минут 0,8 мл среды добавили в раствор для трансфекции и добавили к прикрепившимся клеткам. Трансфицированные клетки инкубировали в течение 4 часов при 27°C. Через 5 часов к клеткам добавили еще один 1 мл среды (обогащенной гентамицином и натамицином). Клетки выращивали в течение 3 дней при 27°C. Супернатант хранили при -70°C в качестве запаса вируса P1.
Экспрессию белка Е2 CTAPV в культурах SF9 проверяли посредством электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Полученные образцы из культур SF9 разбавляли 1:1 буфером для проб Bio-Rad Laemmli с 5% β-меркаптоэтанола, и в последующем образцы нагревали до 99°C в течение 10 минут. Все образцы и маркер Precision Plus protein™ All Blue (Bio-Rad) загружали в готовый гель Bio-Rad Criterion™TGX™ (kD™) и подвергали электрофорезу при 200 В в течение 42 минут. Применяемым электрофорезным буфером был 1x Tris/Glycine/SDS. После электрофореза гель в течение 1 часа окрашивали в буфере для окрашивания белка InstantBlue™ (Expedeon).
Очистка:
После экспрессии в клетках SF9 белок E2 очищали двумя различными путями. Первый способ очистки был посредством создания цельноклеточного лизата. Культуру SF9, экспрессирующую E2 CTAPV, гранулировали, ресуспендировали в PBS и подвергали действию ультразвука с применением ультразвукового дезинтегратора Бронсона (2 раза по 30 пульсаций, мощность 5, рабочий цикл 55%). После воздействия ультразвуком лизат центрифугировали в течение 10 минут при 8000 об/мин. Гранулы, содержащие сверхэкспрессируемый E2, ресуспендировали в PBS. Другим путем очистки белка E2 был способ очистки с применением IMAC и анионных детергентов. Данный способ описан в BMC Biotechnology 2012, 12:95. (BMC Biotechnology 2012, 12:95; Use of anionic denaturing detergents to purify insoluble proteins after overexpression; Benjamin Schlager, Anna Straessle and Ernst Hafen). Для лизиса сверхэкспрессируемой культуры E2 применяли лизирующий буфер, содержащий анионный денатурирующий детергент (SDS). Перед аффинной очисткой избыток детергента удаляли посредством охлаждения и очистки.
Белки E2, экспрессируемые в клетках SF9 и очищенные, как описано выше, проверили в электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия вместе со стандартными альбуминами бычьей сыворотки с известной концентрацией белка. Концентрацию белка оценивали посредством сравнения интенсивности полос с применением программного обеспечения Genetools (Syngene version 3.08.07).
Готовая форма
Готовая форма итоговой вакцины была получена в эмульсии типа вода в масле на основе минерального масла. Соотношение вода:масло, исходя из массы, составило 45:55. Размер капель эмульсии составлял в основном менее 1 мкм, а вязкость составляла приблизительно 80-150 мПа.сек.
Вакцина 1: водная фаза состояла из очищенного белка Е2 (измеренная концентрация E2 60 мкг/мл)
Вакцина 2: водная фаза состояла из цельноклеточного лизата (измеренная концентрация E2 62 мкг/мл)
Бустерная вакцинация
Для данного эксперимента были доступны 48 поросят в возрасте отъема в возрасте 5 недель. 3×8 животных на группу разместили в хлеву 1, и 3 x животных на группу разместили в хлеву 2. Между животными не было возможных контактов между хлевами.
На группу из 8 животных 6 поросят проводили первичную вакцинацию вакциной 1, 2 других поросят в начале исследования не вакцинировали.
В t=21 день, 5 из 6 первично вакцинированных животных в каждой из групп получали бустерную вакцинацию вакциной 2.
Образцы крови собирали перед первичной вакцинацией, на 21 день после инфицирования перед первичной вакцинацией, и на 39 день перед заражением
Перед заражением, из каждой группы 4 животных, которые получали первичную и бустерную вакцинацию, плюс 2 невакцинированных животных были перемещены в помещения для заражения.
Из каждой группы 1 животное, которое получало первичную вакцинацию, и 1 животное, получавшее первичную и бустерную вакцинацию, находились под мониторным наблюдением две дополнительные недели.
Заражение
36 животных для данного эксперимента разместили в хлеву 3, разместили 3×6 животных на группу, группа 1-3, и в хлеву 4, 3×6 животных на группу, группа 4-6. Животные в хлеву 3 были получены из хлева 1, животные в хлеву 4 были получены из хлева 2.
Между животными не было возможных контактов между хлевами. Не был возможен физический контакт между животными различных групп в пределах хлева, но воздушный контакт был возможен.
Животных заражали живым вирусным материалом на 39 день после первичной вакцинации.
В хлеву 3 3×6 поросят (группа 1-3) заражали материалом CTAPV 1 (см. выше).
Группа 1: 10,0 мл перорально и 2×2.0 мл назально
Группа 2: 2×1,0 мл IM
Группа 3: 2×1,0 мл IM
В хлеву 4 3x 6 поросят (группа 4-6) заражали материалом CTAPV 8 (см. выше).
Группа 1: 10,0 мл перорально и 2×2,0 мл назально
Группа 2: 2×1,0 мл IM
Группа 3: 2×1,0 мл IM
Образцы сыворотки крови и назальные, ректальные и орофарингеальные тампоны собирали перед заражением, и на 3, 6, 9, 13, 16, 20, 23 и 27 дни после заражения для мониторного наблюдения за инфекцией и выделения вирусов CTAPV посредством анализа количественной ПЦР. Провели вскрытие трех животных (два вакцинированных, одно невакцинированное) на группу на 13 день после заражения, других 3 животных (двух вакцинированных, одно невакцинированное) вскрыли на день 27 после заражения. При вскрытии были взяты образцы паховых лимфатических узлов, брыжеечных лимфатических узлов и миндалин.
Пример 9.
Антитела к белку Е2 CTAPV
Экспрессия белка Е2 в E. Coli:
Анализировали аминокислотную последовательность вируса CTAPV 1. Начало и конец гена E2 определяли с использованием выравнивания генома вируса CTAPV с белком Е2 вируса классической чумы свиней (CSF) (Genbank: AAS 20412.1) и белком Е2 вируса диареи крупного рогатого скота (BVDV) (Genbank: AGN03787.1), а предполагаемые участки расщепления белка E2 определяли с применением программного обеспечения SignalP4.1 (http://www.cbs.dtu.dk/services/SignalP/)
Предполагаемая аминокислотная последовательность E2 CTAPV 1 (SEQ ID NO:32):
SCHKRQDYYSIQLVVDGKTGVEKRSIVGKWTVITREGREPRLMEQISMVSNDSLSETYCY
NRLNTSSWGRQPARQRGCGQTVPFWPGDNVLEEQYYSTGYWVNATGGCQLREGVWLSRKG
NVQCQRNGSSLILQLAIKEENDTMEIPCDPVETESMGPVTQGTCVYSWAFAPRGWYYNRK
DGYWLQYVKKNDYQYWTKMPTASSATTMYRH
Последовательность белка для экспрессии в E. Coli (содержит гистидиновую метку)
SCHKRQDYYSIQLVVDGKTGVEKRSIVGKWTVITREGREPRLMEQISMVSNDSLSETYCY
NRLNTSSWGRQPARQRGCGQTVPFWPGDNVLEEQYYSTGYWVNATGGCQLREGVWLSRKG
NVQCQRNGSSLILQLAIKEENDTMEIPCDPVETESMGPVTQGTCVYSWAFAPRGWYYNRK
DGYWLQYVKKNDYQYWTKMPTASSATTMYRHHHHHHH
В последующем нуклеотидная последовательность E2 CTAPV для экспрессии белка Е2 CTAPV в E. Coli была оптимизирована с применением алгоритма Genscript OptimumGene™ (www.genscript.com) (SEQ ID NO:34).
CATATGTCGTGTCACAAACGCCAAGATTATTATTCTATTCAACTGGTCGTGGATGGTAAAACGGGTGTCGAAAAACGCTCT
ATCGTCGGTAAATGGACCGTGATTACGCGTGAAGGCCGCGAACCGCGTCTGATGGAACAGATCAGTATGGTTTCC
AACGATAGCCTGTCTGAAACCTATTGCTACAACCGCCTGAATACGAGCTCTTGGGGTCGTCAGCCGGCACGTCAA
CGCGGCTGTGGTCAGACCGTCCCGTTTTGGCCGGGCGACAACGTGCTGGAAGAACAATATTACAGTACCGGTTAT
TGGGTGAATGCAACGGGCGGTTGCCAGCTGCGTGAAGGCGTTTGGCTGTCTCGTAAGGGTAACGTCCAGTGTCAA
CGCAATGGCAGTTCCCTGATTCTGCAACTGGCGATCAAAGAAGAAAACGATACCATGGAAATCCCGTGCGACCCG
GTCGAAACCGAATCAATGGGCCCGGTGACCCAGGGCACGTGTGTTTATTCGTGGGCATTCGCACCGCGCGGCTGG
TATTACAACCGTAAAGATGGTTATTGGCTGCAGTACGTGAAGAAAAACGACTATCAATACTGGACCAAAATGCCG
ACGGCATCATCGGCTACCACGATGTACCGTCATCACCATCACCATCACCATTAACTCGAG
Добавленные сайты рестрикции (жирным шрифтом) представляют собой NdeI и XhoI.
Трансформация и экспрессия:
Ген Е2 CTAPV был синтезирован в Genscript и непосредственно клонирован в плазмидный вектор (pET22b) с применением сайтов рестрикции NdeI и XhoI. Плазмиду трансформировали в E. coli BL21star+pLysS с применением стандартных методик трансформации, и индуцировали экспрессию.
Экспрессию получали путем выращивания экспрессирующих штаммов в автоиндуцирующих средах в течение 18 часов при 37°С. Экспрессию подтверждали посредством проведения электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия.
Было обнаружено, что E2 находится в нерастворимой фракции. Белок E2 очищали посредством применения способов очистки с применением IMAC и анионных детергентов. Данный способ описан в BMC Biotechnology 2012, 12:95. (BMC Biotechnology 2012, 12:95; Use of anionic denaturing detergents to purify insoluble proteins after overexpression; Benjamin Schlager, Anna Straessle and Ernst Hafen). Для лизиса сверхэкспрессируемой культуры E2 применяли лизирующий буфер, содержащий анионный денатурирующий детергент (SDS). Перед аффинной очисткой избыток детергента удаляли посредством охлаждения и очистки.
Очищенный белок проверяли с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, как описано в примере 8. Очищенный белок получали в виде готовой формы в GNE и применяли для инъекции кроликам для выработки антител. Оцененная концентрация белка в водной фазе составила 0,5 мг/мл.
Фигура 7 демонстрирует, что антитела, выращенные у кроликов (сыворотка t=4 недели после вакцинации), специфически распознают полосу приблизительно 25 кДа, которая соответствует белку E2 CTAPV, экспрессируемому в экспрессионной системе бакуловирус/SF9 (ряд 2). Ряд 1 содержит маркер, а ряд 3 содержит неродственный продукт экспрессии в экспрессионной системе бакуловирус/SF9.
Пример 10
Одностадийная количественная ПЦР в реальном времени на основе SYBR Green
Животные образцы
Образцы свиной сыворотки и селезенок собирали у экспериментально инфицированных и контрольных свиней. Собирали кровь (Vacuolette 8 ml Sep Clot Activator ref: 455071; Greiner Bio-one) и получали сыворотку посредством центрифугирования 20 минут при 3000 x g при 4°C. Образцы семенной жидкости получали от коммерческих животноводческих компаний и тестировали без предварительной обработки.
10% тканевые гомогенаты приготовили в PBS на льду. Гомогенизацию проводили в пробирках Gentle Macs M tubes с Gentle Macs Dissociator (Miltenyi Biotec). Затем данный гомогенизированный материал дважды центрифугировали, сначала при 3200 x g в течение 30 минут, и в последующем при 10000 x g в течение 10 минут. В последующем делали обработку ДНКазой: 24 мкл 10x Turbo ДНКазного буфера и 20 мкл Turbo ДНКазы (AMbion) добавляли к 250 мкл супернатанта, и данную смесь инкубировали при 37°C в течение 10 минут.
Экстракция РНК
РНК экстрагировали из данных образцов с помощью инструмента Magnapure 96 (Roche) с наружным лизисом. Данная система очищает ДНК, РНК и нуклеиновые кислоты вирусов с применением технологии частиц магнитного стекла. 200 мкл образца смешивали с 250 мкл лизирующего/связывающего буфера из набора magnapure для выделения общих нуклеиновых кислот, и экстракцию проводили в инструменте Magnapure с применением протокола наружного лизиса. Образцы РНУ хранили при -70°C до дополнительного применения.
Одностадийная количественная ПЦР в реальном времени на основе SYBR Green
Разработка специфического праймера
Олигонуклеотидные праймеры использовали для амплификации 5'-UTR-генома генома CTAPV. Данную часть вирусного генома выбрали на основании консервативной нуклеотидной последовательности между разновидностями CTAPV 1-9 (исходя из выравнивания нуклеотидных последовательностей). Праймерные последовательности были следующими: CTAPV-PAN2-F3-B: CGTGCCCAAAGAGAAATCGG (SEQ ID NO:35) и CTAPV-PAN2-R3-B (SEQ ID NO:36): CCGGCACTCTATCAAGCAGT.
Протокол количественной ПЦР в реальном времени
Одностадийная количественная ПЦР в реальном времени на основе SYBR Green была разработана с применением набора для одностадийной количественной ПЦР в реальном времени на основе SYBR Green Superscript III Platinum (ThermoFisher). Каждая реакция содержала 25 мкл 2x реакционной смеси SYBR Green, 1 мкл Superscript III RT/Platinum Taq Mix, 1 мкл 10 мкМ CTAPV-PAN2-F3-B primer, 1 мкл 10 мкМ CTAPV-PAN2-R3-B primer, 17 мкл воды, не содержащей РНКазу, и 5 мкл матрицы РНК. Все реакции проводили на BioRad CFX96 со следующими параметрами цикла; реакция в реальном времени при 55°C в течение 3 мин, преденатурация при 95°C в течение 5 мин и затем 40 циклов при 95°C в течение 15 сек, 60°C в течение 30 сек с последующей программой кривой плавления с 60°C до 95°C с 0,5°C/5 сек.
Создание эталонной линии
Для количественного определения выявленной РНК в одностадийной количественной ПЦР в реальном времени на основе SYBR Green была сконструирована стандартная линия, содержащая целевую последовательность для количественной ПЦР, стандартные разведения которой можно подсчитать. Была синтезирована последовательность длиной 177 пар оснований из части 5'UTR (162-338) генома CTAPV (Genscript) и лигирована в векторе pUC57 вектор, который затем трансфицировали в E. coli. Плазмида ДНК была выделена посредством midiprep.
Формула для подсчета плазмидных копий/мкл:
Плазмидных копий/мкл =
концентрация ДНК (нг/мкл)/((A x 328,4+G x 344,24+T x 303,22+C x 304,16)/(6,02×1023))x 2×109).
Концентрация ДНК плазмиды составила 100 нг/мкл. Было сделано восемь разведений, содержащих 108 до 101 копий/2 мкл.
Результаты
Подтверждение достоверности количественной ПЦР в реальном времени
Для подтверждения достоверности количественной ПЦР в реальном времени из эксперимента были исключены стандартная линия с восемью разведениями, содержащих 108 до 101 копий/5 мкл, и отрицательный контрольный образец. Фигура 1A демонстрирует диаграмму, в которой циклы количественной ПЦР нанесены в зависимости от относительных единиц флуоресценции в реальном времени. Каждый образец тестировали в двух параллельных анализах. Прямая линия на приблизительно 100 RFU представляет собой линию отсечки, прямая линия на 0 RFU представляет собой отрицательный контрольный образец. Продублированный образец с наибольшим количеством матриц представляет собой образец, который демонстрирует увеличение исходной интенсивности флуоресценции вокруг цикла 10 (108, с последующими 107 в цикле 12 и т.д.). Фигура 1B была подготовлена на основе тех же экспериментальных данных, но здесь логарифмическая стандартная кривая начального количества (o) нанесена в зависимости от количественного цикла. Стандартная линия имела эффективность 102% и R2 0,997, они находятся в диапазоне для специфической и количественной ПЦР, при которой эффективность должна составлять между 95% и 105%, а R2 должна быть выше 0,990. Фигура 1C демонстрирует кривые плавления образцов, показанные на панелях A и B. Все положительные образцы демонстрируют идентичные кривые и конкретную температуру плавления, которая обозначает, что конкретный фрагмент амплифицирован, и что фрагмент является идентичным в каждой из реакций.
Эти данные показали, что разработанная количественная ПЦР в реальном времени удовлетворяет требованиям для выявления и количественного определения CTAPV. Количественную ПЦР в реальном времени в последующем применяли для анализа предполагаемых CTAPV-положительных образцов и контрольных образцов. Интерпретация данных основана на RFU на цикл плюс на характеристиках кривой плавления. Девиантные кривые плавления могли бы указывать на неспецифичность ампликона.
Выявление и количественное определение РНК CTAPV в образцах сыворотки, селезенки и семенной жидкости
Сыворотку и селезенку у экспериментaльно инфицированных и от контрольных молодых свиней исследовали в двух параллельных анализах на наличие РНК CTAPV. Также исследовали образцы семенной жидкости. (Средние) результаты представлены в таблице 9. Считали, что в проведенных анализах стандартные линии находятся в пределах качественного диапазона для точной количественной ПЦР (Фигура 9B, см. выше). Также считали, что специфическая точка плавления CTAPV находится на кривых плавления всех данных образцов. Исходя из этих данных, авторы изобретения заключили, что количественная ПЦР в реальном времени подходит для выявления и количественного определения РНК CTAPV в образцах сыворотки, селезенки и семенной жидкости.
Таблица 9: Количественное определение РНК CTAPV в образцах сыворотки, селезенки и семенной жидкости свиней
|
*обозначение продублированных экспериментов; ND: не определялось; селезенка относится к 10% (в/о) гомогенатному образцу.
Колонка Копии РНК/5 мкл демонстрирует число копий вируса в 5 мкл образца экстрагированной РНК, полученного из 200 мкл исходного образца.
Колонка Копии РНК/мл демонстрирует число копий вируса в исходном образце (сыворотке, семенной жидкости) или 10% гомогенате (селезенке).
Пример 11
CTAPV-положительная семенная жидкость инфицирует молодых свиней и потомство
Животные
Было получено шесть молодых свиней из SPF/фермы с высоким уровнем здоровья животных. Для искусственного осеменения молодых свиней применяли семенную жидкость от CTAPV-положительного хряка.
Способы
Кровь брали у молодых свиней и потомства (Vacuolette 5/8 ml Sep Clot Activator ref: 455071; Greiner Bio-one), и сыворотку получали посредством центрифугирования 20 минут при 3000 x g при 4°C. Образцы семенной жидкости исследовали без предварительной обработки.
Экстракцию РНК и количественную ПЦР в реальном времени проводили, как описано в разделе «Одностадийная количественная ПЦР в реальном времени на основе SYBR Green» примера 10.
Результаты
До осеменения исследуемые молодой свиньи были серонегативными на CTAPV (количественная ПЦР в реальном времени). Семенная жидкость хряка была положительной на CTAPV, как проанализировано количественной ПЦР в реальном времени. В t=+4 недели после осеменения молодые свиньи 4 и 5 содержали определяемые уровни CTAPV в сыворотке. В день опороса молодые свиньи 1, 2 и 6 содержали определяемые уровни CTAPV в сыворотке. Поросята с определяемыми уровнями CTAPV в сыворотке родились от 5 из 6 молодых свиней (см. таблицу 10 для результатов). Поросята были здоровыми и не демонстрировали клинического тремора или увеличенной частоты других клинических симптомов, связанных с врожденным тремором типа AII, таких как раскинутые ноги.
Таблица 10: CTAPV-положительная семенная жидкость инфицирует молодых свиней и потомство
|
*колонка копии РНК демонстрирует число копий РНК вируса на мл в исходном образце (сыворотке);
**ND: не определялось ниже определяемого уровня.
Пример 12
Инфицирование беременных молодых свиней разновидностью 1B CTAPV, полученной от «дрожащих поросят», и действие на новорожденных поросят: CTAPV-положительная семенная жидкость
Животные
Было получено шесть молодых свиней из SPF/фермы с высоким уровнем здоровья животных. Молодых свиней осеменяли посредством искусственного осеменения CTAPV-положительной семенной жидкостью. Беременность подтверждали на день 28 гестации с применением ультразвука. Все молодой свиньи родили помет поросят на день 115 или день 116 гестации.
Инфицирование
Троих из молодых свиней инфицировали на 32 день после осеменения инокулятом CTAPV1B, состоящим из органного гомогената селезенки и головного мозга, полученного от вскрытой свиньи 371 на t=11 день после инфицирования инфекционным материалом CTAPV1B. Данный эксперимент был описан в примере 6/Таблица 7. Гомогенат приготовили следующим образом. К 14 граммам селезенки и 8 граммам головного мозга добавили среду M6B8 (MSD AH) с 10 мкМ HEPES (Sigma H3375-250G) в 9 раз больше массы ткани. Ткань гомогенизировали с применением блендера, с последующим встряхиванием с маленькими стеклянными шариками в течение 5 минут. Во время гомогенизации превращенные в массу органы хранили на льду. Превращенные в массу органы центрифугировали 1 час при 3200 x g при 4°C. Супернатант пропускали через 0,22 мкМ фильтр. Фильтрованный гомогенат хранили при -70°C до применения. Данные три молодой свиньи получили внутримышечную инъекцию 5 мл инокулята (две инъекции по 2,5 мл каждая в шею справа и слева).
Других трех молодых свиней инфицировали инокулятом сыворотки, полученной от той же свиньи во время вскрытия. Перед инъекцией сыворотку фильтровали через 0,22 мкм фильтр. Данные три молодые свиньи получили внутримышечную инъекцию 5 мл инокулята (две инъекции по 2,5 мл каждая в шею справа и слева).
Количественную величину CTAPV в инокулятах определяли посредством количественной ПЦР в реальном времени, как описано в примере 10.
Сбор сыворотки
Сыворотку собирали перед инфицированием молодых свиней и на t=10 день после осеменения. Сыворотку также собирали от новорожденных поросят в течение часов после рождения. Собирали кровь (Vacuolette 5/8 ml Sep Clot Activator ref: 455071; Greiner Bio-one), и получали сыворотку посредством центрифугирования 20 минут при 3000 x g при 4°C. Экстракцию РНК и количественную ПЦР в реальном времени проводили, как описано в разделе «Одностадийная количественная ПЦР в реальном времени на основе SYBR Green», пример 10.
Результаты
Смешанный гомогенат селезенки и головного мозга применяли для инфицирования первых трех молодых свиней, содержащих 4,5E+02 геномных копий на 5 мкл экстрагированной РНК. Это равно 2,3E+04 геномных копий на мл в гомогенате, который применяли для инфицирования молодых свиней.
Инокулят сыворотки применяли для инфицирования других трех молодых свиней, содержащих 1,2E+04 геномов на 5 мкл экстрагированной РНК, что равно 6,0E+05 геномных копий на мл в гомогенате, который применяли для инфицирования молодых свиней.
Таблица 11 представляет количественную величину (геномов на мл сыворотки) на 10 день после инфицирования, как определили результаты количественной ПЦР в реальном времени. Пять из шести молодых свиней родили поросят с тяжелым врожденным тремором типа A-II. Одна молодая свинья, молодая свинья с относительно низким количеством вируса в сыворотке на t=10 день после инфицирования, родила относительно здоровый помет, в котором наблюдали лишь 2 поросенка с умеренными симптомами. Информация о пометах после опороса представлена в таблице 11. Увеличенная частота раскинутых ног была ассоциирована с клиническим тремором, как описано M. White (http://www.nadis.org.uk/bulletins/congenital-tremor.aspx?altTemplate=PDF).
Наличие CTAPV у трех поросят на помет (поросята с тяжелым клиническим тремором, за исключением тех поросят, родившихся у молодых свиней 44, которая не продемонстрировала клинический тремор) исследовали посредством количественной ПЦР в реальном времени, описанной в примере 10. Количество CTAPV-положительных поросят отображено в таблице 11
Таблица 11: количественное определение РНК в образцах сыворотки молодых свиней на день 10 после заражения, и информация о помете
|
* обозначение продублированных экспериментов; Колонка Копии РНК/мл демонстрирует число копий вируса в исходном образце (сыворотке).
Пример 13
Инфицирование беременных молодых свиней разновидностью 1B CTAPV, полученной от «дрожащих поросят», и действие на новорожденных поросят: CTAPV-отрицательная семенная жидкость
Животные
Было получено шесть молодых свиней из SPF/фермы с высоким уровнем здоровья животных. Молодых свиней осеменяли посредством искусственного осеменения CTAPV-отрицательной семенной жидкостью. Беременность подтверждали на день 28 гестации с применением ультразвука. Все молодой свиньи родили помет поросят на день 114 или день 115 гестации.
Инфицирование
Троих молодых свиней инфицировали инокулятом сыворотки, полученной от свиньи 371 во время вскрытия (см. пример 12). Перед инъекцией сыворотку фильтровали через 0,22 мкм фильтр. Три получили внутримышечную инъекцию 5 мл инокулята (две инъекции по 2,5 мл каждая в шею справа и слева) в 32 дни гестации.
Количественную величину CTAPV в инокулятах определяли посредством количественной ПЦР в реальном времени, как описано в примере 10 и 12.
Сбор сыворотки
Сыворотку собирали перед инфицированием молодых свиней и на t=10 день после осеменения. Сыворотку также собирали от новорожденных поросят в течение часов после рождения. Собирали кровь (Vacuolette 5/8 ml Sep Clot Activator ref: 455071; Greiner Bio-one), и получали сыворотку посредством центрифугирования 20 минут при 3000 x g при 4°C. Экстракцию РНК и количественную ПЦР в реальном времени проводили, как описано в разделе «Одностадийная количественная ПЦР в реальном времени на основе SYBR Green», пример 10.
Результаты
Таблица 12 представляет количественную величину (геномов на мл сыворотки) в день 10 после инфицирования, как определили результаты количественной ПЦР в реальном времени. Две из трех молодых свиней родили поросят с умеренным врожденным тремором типа A-II. Одна молодая свинья, молодая свинья с относительно низким количеством вируса в сыворотке на t=10 день после инфицирования, родила относительно здоровый помет, в котором наблюдали лишь 2 поросят с умеренными симптомами. Информация о пометах после опороса представлена в таблице 11.
Наличие CTAPV у поросят с CT типа A-II было подтверждено посредством количественной ПЦР в реальном времени, описанном в примере 10. Количество CTAPV-положительных поросят отображено в таблице 12. Увеличенная частота раскинутых ног была ассоциирована с клиническим тремором.
Таблица 12: количественное определение РНК в образцах сыворотки молодых свиней на день 10 после заражения, и информация о помете.
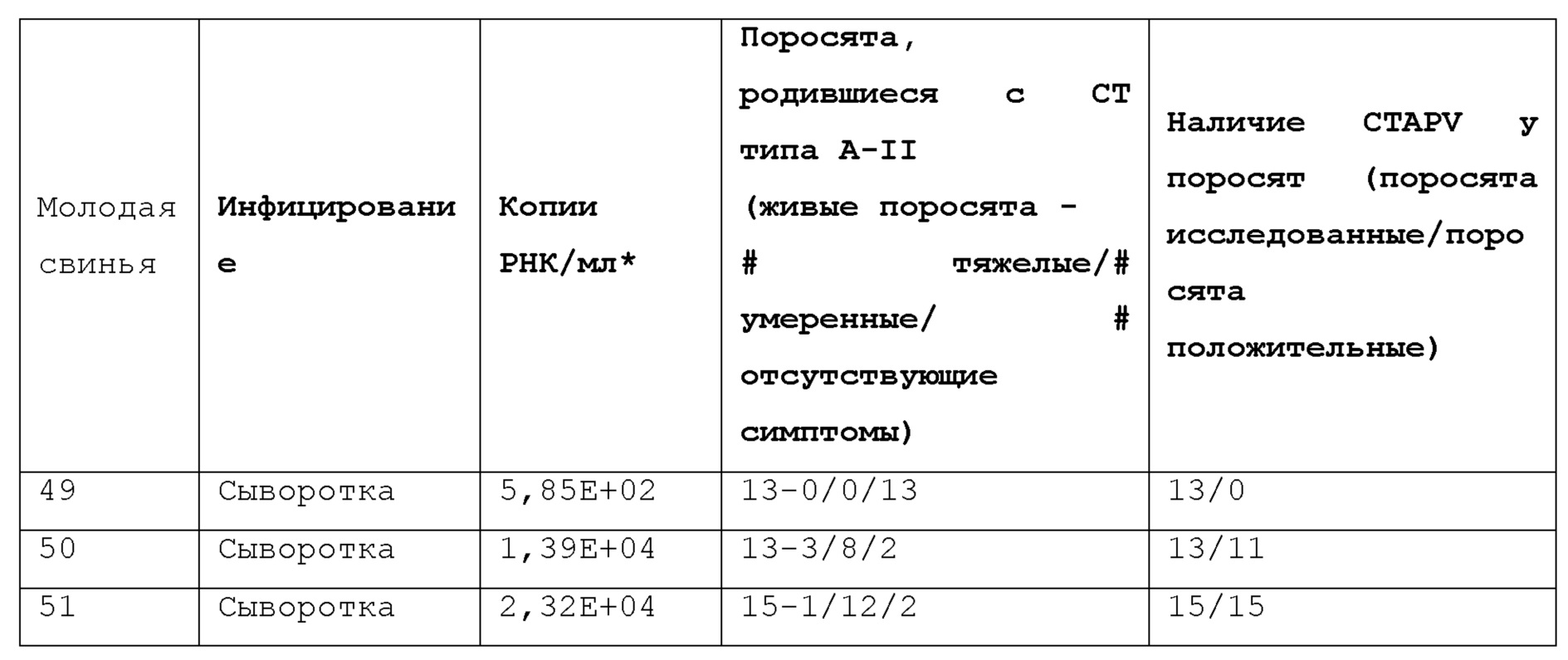
* обозначение продублированных экспериментов;
Колонка Копии РНК/мл демонстрирует число копий вируса в исходном образце (сыворотке).