Результат интеллектуальной деятельности: МЕТАПНЕВМОВИРУС ПТИЦ В ОНКОЛИЗИСЕ
Вид РИД
Изобретение
Настоящее изобретение относится к метапневмовирусу птиц (AMPV) для применения в терапии и к фармацевтическим композициям, содержащим метапневмовирус птиц (AMPV) для применения в терапии.
На протяжении нескольких десятилетий известно, что некоторые вирусы могут быть способны уничтожать опухоли. Такие вирусы общеизвестны как онколитические вирусы. Хотя число онколитических опухолей является относительно небольшим, их обнаруживают в нескольких родах вируса. Известны онколитические представители, в том числе следующих родов: аденовируса, вируса герпеса, полиомавируса, поксвируса, парвовируса, реовируса, ортомиксовируса, парамиксовируса, рабдовируса, коронавируса, пикорнавируса, тогавируса и ретровируса. В недавнем небольшом обзоре Vaha-Koskela M. et al. приведен обзор онколитических вирусов в терапии злокачественных опухолей (Cancer Letters 254: 178-216 (2007)).
Проблема, с которой сталкиваются со всеми онколитическими вирусами, заключается в том, что после введения первой дозы начинает развиваться иммунитет против используемого вируса. Кроме того, принимая во внимание непредсказуемые пути дифференцировки и дедифференцировки в опухолевых клетках, вполне вероятно, что некоторые отдельные опухолевые клетки определенной массы опухоли станут резистентными по отношению к онколитическому вирусу, используемому в терапии злокачественной опухоли. Например, это может быть обусловлено тем фактом, что такие опухолевые клетки теряют рецептор для такого онколитического вируса.
Хотя бы по этим причинам существует необходимость в новых онколитических вирусах, которые можно использовать при начале терапии злокачественных опухолей или как альтернативный вариант, когда другие онколитические вирусы оказываются неэффективными при терапии злокачественных опухолей.
В настоящее время неожиданно выявили, что живой вирус птиц, вирус ринотрахеита индеек, в настоящее время так же известный, как метапневмовирус птиц (AMPV), неожиданно обладают онколитическим действием на клетки млекопитающих.
Вирус ринотрахеита индеек (TRT) или метапневмовирус птиц является представителем рода метапневмовирусов в семействе вирусов Paramyxoviridae. Метапневмовирусы содержат одноцепочечный несегментированный геном РНК антисмысловой полярности.
В семействе Paramyxoviridae до настоящего времени известно, что четыре рода вирусов содержат онколитический представитель: один член в роде Avulavirus (вирус болезни Ньюкасла), один в роде Morbillivirus (конкретные штаммы кори), один в роде Respirovirus (вирус Сендай) и один в роде Rubulavirus (вирус эпидемического паротита).
До настоящего времени не было известно или не предполагалось, что род метапневмовирусов семейства Paramyxoviridae содержит член, обладающий онколитическими свойствами.
Род метапневмовирусов содержит два представителя, один из которых представляет собой указанный выше AMPV, другой представитель представляет собой метапневмовирус человека (HMPV). Оба вируса вызывают заболевание дыхательных путей, HMPV у люди и AMPV у птиц.
Именно слитый белок (F) метапневмовирусов обуславливает различие в тропизме. De Graaf et al. убедительно продемонстрировали, что HMPV не способен инфицировать птиц. И, наоборот, никогда не сообщалось, что AMPV вызывает заболевание или даже какие-либо клинические симптомы у млекопитающих. (De Graaf M. et al., J. Gen. Virol., 90:1408-1416 (2009)).
Кроме того, ни для HMPV, ни для AMPV не описано какое-либо противоопухолевое действие.
Живой AMPV избирательно вызывает гибель опухолевых клеткок млекопитающих, но не нормально дифференцированных клеток млекопитающих и нормально пролиферирующие млекопитающих клеток в той же дозе. Эту характеристику избирательно вызывать гибель опухолевых клеток млекопитающих в дальнейшем обозначают как противоопухолевое действие.
Противоопухолевое действие означает, что вирус вызывает гибель отдельных клеток опухоли независимо от механизма действия. Например, вирусы обладают противоопухолевым действием на клетки вследствие того, что они являются литическими для этих клеток: предполагают, что литические штаммы вирусов повреждают плазматическую мембрану инфицированных клеток. Другую форму противоопухолевого действия, например, выявляют для нелитических вирусов, вероятно, они нарушают метаболизм клетки и вызывают гибель клетки, обусловленную этим механизмом действия. Противоопухолевое действие AMPV делает вирус очень пригодным для использования в терапии злокачественных опухолей.
Таким образом, первый вариант осуществления настоящего изобретения относится к живому метапневмовирусу птиц (AMPV) для применения в терапии злокачественных опухолей у млекопитающего.
Предпочтительно AMPV используют в терапии злокачественных опухолей против рака молочной железы, легкого, предстательной железы, глиобластомы, фибросаркомы, рака яичника, рака шейки матки, мочевого пузыря или рака толстого кишечника или против меланомы.
Более предпочтительно AMPV используют в терапии злокачественных опухолей против рака толстого кишечника.
Для получения противоопухолевого действия необходимо вводить вирус AMP в количестве, которое является цитотоксическим для опухолевых клеток. Это количество обозначают как цитотоксическое количество. Таким образом, цитотоксическое количество AMPV представляет собой количество вируса, необходимое для индукции гибели опухолевых клеток.
Рассуждая теоретически, один AMPV может инфицировать и вызывать гибель одной опухолевой клетки. Таким образом, цитотоксическое количество AMPV, необходимое для индукции гибели опухолевых клеток, представляет собой один вирус на клетку. С практической точки зрения, однако, необходимо вводить количество, которое представляет собой совокупность количества опухолевых клеток, которые необходимо инфицировать.
Несмотря на это для индукции противоопухолевого эффекта необходимы очень небольшие количества вирус. Количества 103 бляшкообразующих единиц (БОЕ) вируса на дозу уже являются достаточными для атаки небольших количеств опухолевых клеток. Таким образом, для многих практических целей такое небольшое количество вируса как 103 БОЕ уже можно расценивать, как являющееся цитотоксическим количеством.
Однако следует понимать, что если количество вводимого вируса является таким небольшим, что только несколько опухолевых клеток инфицируются, пройдет некоторый период времени, прежде чем первый цикл инфекции приведет к новому поколению вируса, который способен инфицировать в дальнейшем опухолевые клетки. Аналогичную ситуацию наблюдают в отношении последующих циклов репликации, и в этот момент времени возникает иммунный ответ против вируса и препятствует вирусу. Таким образом, предпочтительно однократно вводить большие количества вируса. В этом случае многие опухолевые клетки становятся инфицированными в одно и то же время, и, таким образом, многие опухолевые клетки становятся инфицированными до возникновения иммунитета против вируса.
Очень умеренные или даже отсутствующие эффекты вируса в отношении неопухолевых клеток у млекопитающих обеспечивают возможность введения таких относительно высоких доз. Таким образом, хотя приемлемыми дозами являются дозы в широком диапазоне от 103 до 1012 БОЕ, для многих применений предпочтительные дозы представляют собой дозы в диапазоне от 106 до 1012 БОЕ, которые оказывают благоприятное действие вследствие большого количества вируса. Более предпочтительными являются дозы в диапазоне от 109 до 1012 БОЕ.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции для применения в терапии злокачественных опухолей у млекопитающего, отличающейся тем, что указанная фармацевтическая композиция содержит цитотоксическое количество живого метапневмовируса птиц (AMPV) и фармацевтически приемлемый носитель.
Понятие "фармацевтически приемлемый носитель" объяснено ниже.
В частности, когда опухоль представляет собой массивную опухоль, которая достигает в толщину нескольких слоев клеток, внутренние слои могут не подвергаться воздействию вируса. В частности, это относится к опухолям с низким уровнем васкуляризации. Таким образом, важно, чтобы вирус потомства, происходящий из убитых опухолевых клеток, или только что введенный вирус являлся доступным для инфицирования более глубоких слоев клеток в опухоли после того, как верхние слои клеток погибают.
По этой причине и в виду того факта, что против AMPV возникает ранний или поздний иммунный ответ, целесообразным может являться введение иммуносупрессирующих средств пациенту до и/или во время лечения с использованием AMPV. Это приводит к задержке возникновения или подавлению иммунного ответа против вируса, таким образом, что последующие циклы инфекции могут проходить до того, как все чувствительные опухолевые клетки погибают. В данной области широко известны иммуносупрессирующие средства. Примеры таких иммуносупрессирующих средств представляют собой, в том числе, ингибирующие глюкокортикоиды гены, кодирующие интерлейкины и TNF-γ; цитостатики, такие как метотрексат и азатиоприн; антитела, направленные против CD25 и CD3, такие как дактиномицин; лекарственные средства, действующие на иммунофилины, такие как циклоспорин и такролимус, и другие лекарственные средства, такие как интерфероны, опиоиды, связывающие TNF белки, микофенолат и низкомолекулярные биологические средства, такие как финголимод и мириоцин. Применение таких иммуносупрессирующих средств описано поставщиками этих средств.
Таким образом, предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что указанная композиция дополнительно содержит иммуносупрессирующее средство.
Иммуносупрессирующие средства можно вводить однократно, а также их можно вводить в многократных дозах в течение длительного периода времени, например, для поддержания иммуносупрессирующего эффекта в течение продолжительного периода времени.
Таким образом, фармацевтическую композицию по изобретению, независимо от того содержит она иммуносупрессирующее средство или не содержит, предпочтительно вводить млекопитающим, которых подвергают лечению иммуносупрессивным средством.
Как указано выше, без введения иммуносупрессирующих средств раньше или позже возникает иммунный ответ против AMPV, который оказывает негативные последствия на возможность инфицировать клетки, которые не были инфицированы вирусами при первом цикле инфекции. Этой проблемы можно избежать в альтернативном пути посредством введения другого (теперь не АМФ) вируса, обладающего противоопухолевым действием (например, см. выше). Такие вирусы не ингибируются иммунным ответом против AMPV.
Предпочтительно период времени между введением AMPV и не AMPV (или не AMPV и AMPV, см. ниже) составляет от 2 до 56 недель. Период 2-56 недель между введением первого и второго вируса имеет следующее обоснование: некоторые опухоли являются быстрорастущими, тогда как другие опухоли или даже метастазирующие опухолевые клетки могут быть медленнорастущими или даже являться "дремлющими" в течение определенного периода времени. Таким образом, в зависимости от характеристик опухоли благоприятным может являться введение второго вируса раньше или позже по времени. Во многих случаях период времени между введением первого и второго вируса является более коротким, вследствие того, что период времени "покоя" составляет менее 56 недель. Кроме того, желательной может являться возможность устранения риска раннего разрастания клеток. Таким образом, предпочтительный период времени составляет от 2 до 28 недель, более предпочтительно 2-20, 2-16, 2-12 или даже 2-8 недель в таком порядке предпочтения.
Таким образом, другая форма этого варианта осуществления относится к фармацевтической композиции для применения в терапии злокачественных опухолей у млекопитающего по изобретению, отличающейся тем, что указанная терапия злокачественных опухолей включает этап введения цитотоксического количества живого AMPV указанному млекопитающему с последующим этапом введения цитотоксического количества не AMPV указанному млекопитающему через 2-56 недель после указанного введения цитотоксического количества живого AMPV.
Следует понимать, что такое использование в терапии злокачественных опухолей с необходимыми изменениями также можно применять у животных, которые раньше получали лечение не AMPV. Такое использование применяют к терапии, которая включает этап введения цитотоксического количества живого AMPV через 2-56 недели после введения цитотоксического количества не AMPV.
Таким образом, еще одна другая форма этого варианта осуществления относится к фармацевтической композиции для применения в терапии злокачественных опухолей у млекопитающего по изобретению, отличающейся тем, что указанная терапия злокачественных опухолей включает этап введения цитотоксического количества живого AMPV указанному млекопитающему через 2-56 недель после этапа введения цитотоксического количества не AMPV указанному млекопитающему.
Из указанных выше онколитических не являющихся AMP вирусов наиболее часто используемый в терапии злокачественных опухолей вирус представляет собой другой цитотоксический парамиксовирус - вирус болезни Ньюкасла (NDV). Подробное руководство по использованию NDV представлено ниже.
Таким образом, в предпочтительном варианте осуществления не AMPV представляет собой NDV.
Наряду с использованием иммуносупрессирующих средств и использованием других цитотоксических (не AMPV) вирусов до или совместно с использованием AMPV существует несколько подходов повышения доставки вируса в опухолевые клетки. Один из подходов заключается в предварительной обработке ткани опухоли соединениями, такими как протеолитические ферменты, например, гиалуронидаза2 и коллагеназа (McKee T.D. et al., Cancer Res., 66:2509-2513 (2006), Cairns R. et al., Mol. Cancer Res., 4:61-70 (2006), Minchinton A.I. et al., Nat. Rev. Cancer, 6: 583-592 (2006)).
Другой подход повышения проницаемости кровь-опухоль заключается посредством введения вазоактивных или сосудонормализующих соединений, таких как брадикинин, паклитаксел или лейкотриены.
Использование таких соединений описано поставщиками соединений.
Такая обработка способствует проникновению вируса и таким образом доставке вируса в опухолевые клетки. Такие соединения в дальнейшем обозначают, как соединения, которые повышают доставку вируса.
Таким образом, другая предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что указанная композиция дополнительно содержит соединение, которое повышает доставку вируса.
Кроме того, способы, основанные на физических способах, которые повышают доставку вируса, например, посредством увеличения оксигенации опухолей, были предложены в качестве способа повышения проницаемости кровь-опухоль. Такие способы, например, основаны на ингаляции гипероксической смесью газов или местной гипертермии. Такие способы в дальнейшем обозначают как способы, которые повышают доставку вируса.
Соединения, которые повышают доставку вируса, можно вводить однократно, а также их можно вводить в многократных дозах в течение длительного периода времени, например, для поддержания эффекта в течение продолжительного времени.
Таким образом, фармацевтическую композицию по изобретению, независимо от того содержит она соединение, которое повышает доставку вируса или не содержит, предпочтительно вводить млекопитающим, которых подвергают лечению соединением, которое повышает доставку вируса.
Аналогично, для животного можно применять способы, которые повышают доставку вируса, для увеличения периода времени.
Таким образом, фармацевтическую композицию по изобретению, независимо от того содержит она соединение, которое повышает доставку вируса или не содержит, предпочтительно вводить млекопитающим, которых подвергают лечению способом, который повышает доставку вируса.
Другой подход, который можно успешно применять в комбинации с лечением AMPV по изобретению, представляет собой в большей степени классический подход использования цитостатических соединений. Такие соединения хорошо известны в данной области, и они включают алкилирующие средства, такие как хлорамбуцил и ифосфамид, антиметаболиты, такие как меркаптопурин, растительные алкалоиды и терпеноиды, такие как винкристин, подофиллотоксин и танины, и ингибиторы топоизомеразы, такие как иринотекан и амсакрин. И, таким образом, в отношении указанных выше иммуносупрессирующих средств, ферментов и соединений использование таких ферментов или соединений описано поставщиками цитостатических соединений.
Таким образом, еще одна предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что указанная композиция дополнительно содержит цитостатическое соединение.
Цитостатические средства можно вводить однократно, а также их можно вводить в многократных дозах в течение длительного периода времени, например, для поддержания цитостатического эффекта в течение продолжительного периода времени.
Таким образом, фармацевтическую композицию по изобретению, независимо от того содержит она цитостатическое средство или не содержит, предпочтительно вводить млекопитающим, которых подвергают лечению цитостатическим соединением.
В зависимости от природы млекопитающего можно сказать следующее: не требует доказательств, что применение по настоящему изобретению терапии злокачественных опухолей является очень подходящим для людей. Применение у неявляющихся человеком млекопитающих, т.е. для ветеринарного применения, в том числе по экономическим причинам, является особенно приемлемым у животных-компаньонов, таких как лошади, виды собачьих или кошачьих.
Таким образом, другой предпочтительный вариант осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что млекопитающее принадлежит к человеку, лошади, видам собачьих или кошачьих.
В зависимости от пути или участка введения по существу вирус можно вводить перорально, посредством ингаляции и системного применения. Системное применение включает внутримышечное, интраперитонеальное, подкожное, внутривенное и внутриопухолевое или перитуморальное введение.
Для опухоли в дыхательных путях внутривенный путь и ингаляционный путь являются предпочтительными путями.
Для многих других опухолей внутривенное и/или внутриопухолевое и/или перитуморальное введение представляет собой предпочтительный способ выбора.
Таким образом, другая предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что участок введения указанной фармацевтической композиции является внутриопухолевым. Внутриопухолевое введение представляет собой введение в массу опухоли. Еще одна другая предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что участок введения указанной фармацевтической композиции является перитуморальным. Перитуморальное введение представляет собой введение вокруг массы опухоли.
Также другая предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что участок введения указанной фармацевтической композиции является внутривенным.
Еще одна другая предпочтительная форма этого варианта осуществления относится к фармацевтической композиции по изобретению, отличающейся тем, что путь введения указанной фармацевтической композиции является таким, как посредством ингаляции.
Существующие в данной области обширные знания в отношении введения другого цитотоксического парамиксовируса, вируса болезни Ньюкасла (NDV) также предоставляют специалисту подробное руководство. Следующие ниже обзоры приведены только в качестве примеров данной области:
В исследованиях на животных инфекцию NDV проводят, в том числе внутриопухолевым, интраперитонеальным и внутривенным путем, как описано у Schirrmacher V., Griesbach A., Ahlert T., Int. J. Oncol., 18: 945-52, 2001. Инфекция NDV внутримышечным или подкожным путем, в том числе описана Heicappell R., Schirrmacher V., von Hoegen P. et al., Int. J. Cancer, 37: 569-577 (1986). В исследованиях на людях в случаях, когда пациентов инфицировали литическим штаммом NDV, применяли внутриопухолевую, внутривенную или внутримышечную инъекцию (Cassel W.A., Garrett R.E., Cancer, 18: 863-868 (1965), Csatary L.K., Moss R.W., Beuth J. et al., Anticancer Res., 19:635-638 (1999), Pecora A.L., Rizvi N., Cohen G.I. et al., J. Clin. Oncol., 20: 2251-2266 (2002), Csatary L.K., Bakacs T., JAMA, 281:1588-1589 (1999), Wheelock E.F., Dingle J.H., N. Engl. J. Med., 271: 645-651 (1964), Csatary L.K., Lancet, 2 (7728):825 (1971). Также используют следующие пути: ингаляцию и прямую инъекцию в толстую кишку (т.е. через открытие колостомы) (Csatary L.K., Moss R.W., Beuth J. et al., Anticancer Res., 19:635-638 (1999), Csatary L.K., Eckhardt S., Bukosza I. et al., Cancer Detect. Prev., 17: 619-27 (1993)).
Фармацевтическая композиция по изобретению должна по существу содержать AMPV в фармацевтически приемлемом носителе для обеспечения возможности введения AMPV.
Предполагается, что "фармацевтически приемлемый носитель" способствует эффективному введению соединения, не оказывая (тяжелых) неблагоприятных воздействий на здоровье животного, которому его вводят. Фармацевтически приемлемый носитель может представлять собой, например, стерильную воду или стерильный физиологический солевой раствор. В более сложной форме носитель может представлять собой, например, буфер, который может содержать дополнительные добавки, такие как стабилизаторы или консерванты. Природа носителя зависит, в том числе, от пути введения. Если способ введения является таким, как введение посредством ингаляции, носитель может являться таким простым, как стерильная вода, физиологический солевой раствор или буфер. Если инъекция представляет собой предпочтительный путь, носитель предпочтительно должен являться изотоническим и ограниченным по pH, что делает его подходящим для инъекции. Тем не менее такие носители широко известны в данной области.
Подробные описания и примеры описаны, например, в хорошо известных справочниках, например, таких как: "Remington: the science and practice of pharmacy" (2000, Lippincot, USA, ISBN: 683306472). Примеры пригодных в настоящем изобретении фармацевтически приемлемых носителей включают стабилизаторы, такие как SPGA, углеводы (например, сорбит, маннит, крахмал, сахарозу, глюкозу, декстран), белки, такие как альбумин или казеин, содержащие белок средства, такие как телячья сыворотка или обезжиренное молоко, и буферы (например, фосфатный буфер). Предпочтительно стабилизатор представляет собой свободные соединения животного происхождения или даже химически определенные, как описано в WO 2006/094974. В частности, когда такие стабилизаторы добавляют в фармацевтическую композицию, фармацевтическая композиция является очень подходящей для лиофилизации. Лиофилизация представляет собой очень подходящий способ предохранения AMPV от инактивации. Таким образом, в более предпочтительной форме фармацевтические композиции по изобретению находятся в лиофилизированной форме.
Подписи к чертежам:
Фигура 1: Проявления лизиса клеток после инфекции TRT.
Репрезентативные изображения популяций клеток.
Изображение a-c: Клетки CIPp, изображение получено через 7 суток после инфекции.
Изображение d-f: Клетки HMPOS, изображение получено через 3 суток после инфекции.
Изображение g-i: Клетки Mel-T4, изображение получено через 3 суток после инфекции.
Клетки на a, d, g являлись ложноинфицированными, клетки на b, e инфицировали при множественности заражения (MOI) 0,1, клетки на c, f, I инфицировали при MOI 1.
Примеры
Пример 1
Клеточная культура
Клеточную линию рака толстого кишечника человека LS 174T с серийным номером ATCC CL188 выращивали согласно поставляемым ATCC инструкциям до полуконфлюэнтного состояния.
Предварительная обработка вирусом:
Инфицирования проводили с использованием суспензии вируса TRT в среде для культивирования клеток, которые предварительно обрабатывали трипсином, как указано ниже: к суспензиям вируса добавляли трипсин 10 USP трипсиновых ед./мл и инкубировали смесь в течение 30 минут. Для ингибирования активности трипсина к суспензии вируса добавляли 10% FBS (Biochrome AG).
Инфекция клеточной линии рака толстого кишечника человека LS 174T:
Из клеток CL 188 удаляли среду для культивирования и добавляли 1 мл суспензий вируса при множественности заражения (MOI) 0,1 и MOI 0,01. Через 1 час инкубации в условиях культивирования тканей (37°C, 5% CO2) добавляли 4 мл полной среды для культивирования ткани, содержащей 10% эмбриональную телячью сыворотку, стандартные количества неомицина, пимафуцина и тилозина, как общепринято используют в клеточной культуре, и добавляли 2 мкг/мл фунгизона (Gibco), и поддерживали клетки в условиях культивирования тканей в течение 3 суток. Затем собирали клеточный супернатант и хранили при -70°C. К клеткам добавляли свежую полную среду для культивирования тканей и собирали клеточные супернатанты на 7 сутки после инфекции. Затем добавляли 1 мл PBS-красного к клеткам, которые затем соскабливали для того, чтобы вызвать их открепление от поверхности для культивирования клеток. В заключении определяли титры вируса (Log10 TCID50/мл) инокулята, сборов клеточных супернатантов и собранных клеток.
Результаты
В таблице 1 продемонстрированы титры TRT (Log10 TCID50/мл) инокулятов, клеточных супернатантов на 3 и 7 сутки после инфекции и собранных клетках.
|
Титры вируса затем использовали для определения, проходила ли репликация вируса во время инфекции. Для этой цели рассчитывали абсолютные количества содержащегося в инокуляте вируса, в клеточных супернатантах и собранных клетках. Для клеточных супернатантов это количество корректировали на объем супернатантов (5 мл). Сумма количеств вируса в клеточных супернатантах на 3 и 7 сутки после инфекции составляла количество вируса в клетках на 7 сутки после инфекции. Это общее количество вируса делили на количество вируса в инокуляте. Фактор репликации >1 свидетельствует о том, что проходила репликация вируса (таблица 2).
|
Заключение
Инфекция клеток рака толстого кишечника человека CL188 TRT при MOI 0,01 приводит к репликации вируса. Инфекция при MOI 0,1 не обеспечивает репликации вируса.
Пример 2
Для исследования цитолитического действия вируса ринотрахеита индеек (TRT) на опухолевые клетки собаки инфицировали TRT три клеточные линии при двух величинах множественности заражения (MOI). Неинфицированные клетки служили в качестве отрицательного контроля. Наблюдали за возникновением лизиса клеток и оценивали его посредством микроскопии, начиная с 3 суток после инфекции в течение 5 последующих суток.
Вещества
Клеточные линии
CIPp: Клетки карциномы молочной железы собаки, получаемые после первичного поражения, поддерживаемые в DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки (FBS), пирувата натрия и L-глутамина. Происхождение: Prof. Nobuo Sasaki, Laboratory of Veterinary Surgery, Graduate School of Agricultural and Life Sciences, University of Tokyo, Japan.
HMPOS: Высокометастазирующие клетки остеосаркомы собаки, поддерживаемые в RPMI1640 с добавлением 10% FBS и пирувата натрия. Происхождение: Prof. dr. Jolle Kirpensteijn, Faculty of Veterinary Medicine, University of Utrecht, The Netherlands.
Mel-T4: Клетки меланомы собаки, поддерживаемые в M199/F10 с добавлением 10% FBS и пирувата натрия. Происхождение: MSD Animal Health, Boxmeer, The Netherlands.
Вирус: Вирус ринотрахеита индеек (TRT), штамм 1194 5,8610log TCID50/флакон.
Способы
Клетки высевали в 96-луночные планшеты для культивирования тканей при 6000 клеток на лунку (CIPp) или 15000 клеток на лунку (HMPOS, Mel-T4). Клетки оставляли до прикрепления к планшету для культивирования тканей, а затем инфицировали разбавленным в PBS TRT при MOI 1 или MOI 0,1. Неинфицированные клетки служили в качестве отрицательного контроля. Через 30 минут во все лунки добавляли среду (с добавлением 4% ЭТС), что приводило к конечной концентрации ЭТС 2%. Клетки инкубировали при 37°C, 5% CO2. На 3 сутки после инфекции клетки визуально изучали в течение 5 последующих суток в отношении возникновения лизиса клеток с использованием инвертированного фазово-контрастного микроскопа Olympus CKX41.
Результаты
Лизиз клеток можно было наблюдать во всех инфицированных клеточных линиях, хотя при различных проявлениях и в различной степени. В инфицированных популяциях CIPp наблюдали округленные клетки. Инфицированные клетки HMPOS росли в кластерах, оставляя пропуски в монослое. Отдельные клетки были округленными. Предпочтительный рост в кластерах и обширное нарушение монослоя также наблюдали в инфицированных популяциях Mel-Т4 (фигура 1).
Наблюдали, что уровень лизиса клеток и время его начала зависят от клеточной линии и MOI. Уровень лизиса клеток с течением времени увеличивался. Как видно из таблицы 1, клетки CIPp являются наиболее устойчивыми к инфекции TRT. На сутки 5 (MOI 1) или сутки 6 (MOI 0,1) становились видимыми первые признаки лизиса клеток. Онколитическое действие TRT на клетки HMPOS наблюдают уже на 3 сутки после инфекции при MOI 1. В противоположность этому, инфекция при MOI 0,1 не приводит к лизису клеток. Клетки Mel-Т4 являются наиболее чувствительными к инфекции TRT. Лизис клеток наблюдали не позже 3 суток после инфекции при MOI 1. Для клеток, инфицированных MOI 0,1, этот эффект был отсрочен на одни сутки.
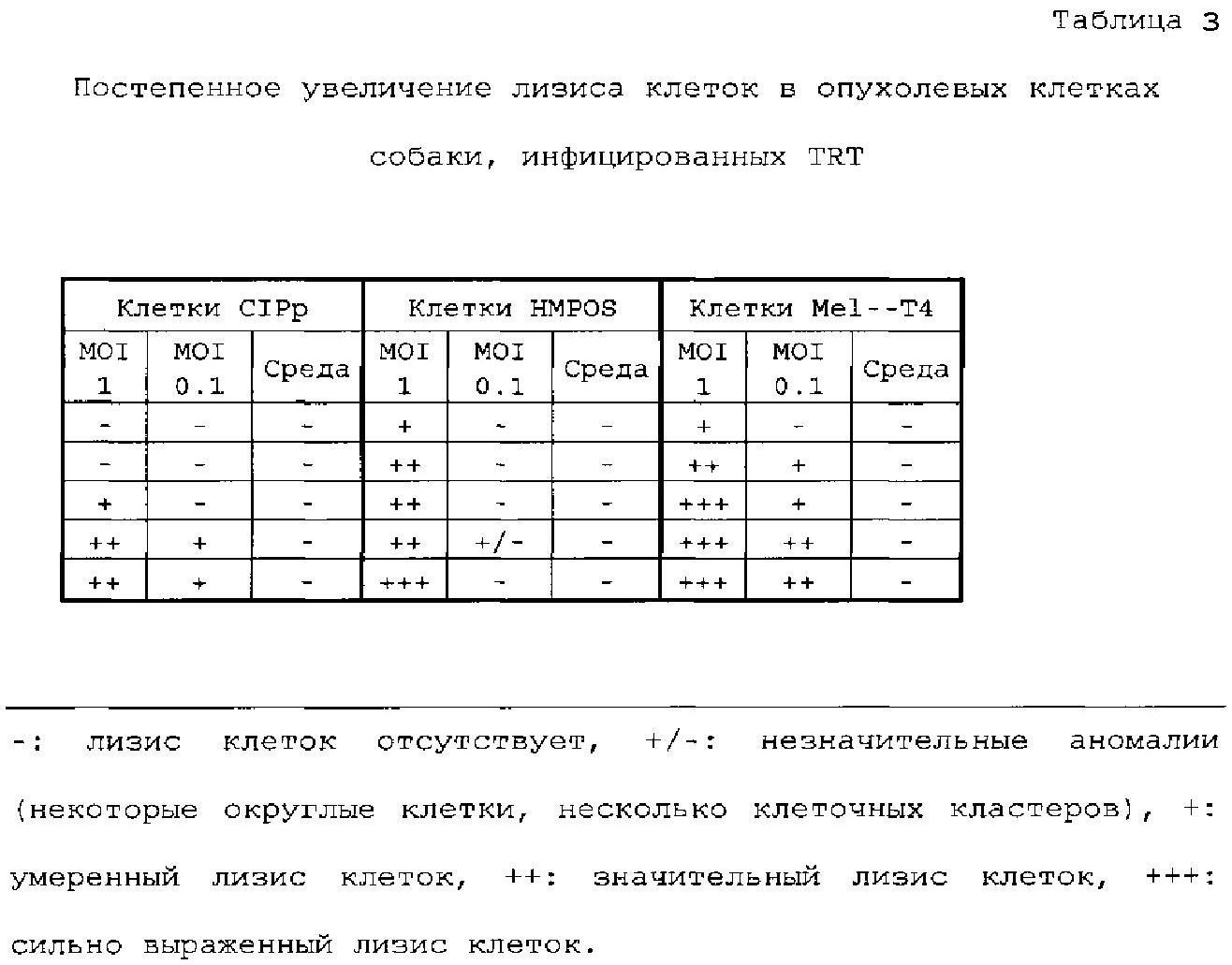
Заключение
TRT обладает выраженным цитолитическим действием на клеточные линии опухоли собаки CIPp, HMPOS и Mel-T4. Уровень и время возникновения лизиса клеток зависят от рассматриваемой клеточной линии и применяемой MOI.


