Результат интеллектуальной деятельности: Способ получения цитогенетических препаратов клеток эпителия для проведения реакции флуоресцентной in situ гибридизации
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к онкологии, и используется при проведения интерфазной флуоресцентной in situ гибридизации.
В настоящее время метод флуоресцентной in situ гибридизации (FISH) активно используется в клинической практике для диагностики, выбора тактики лечения и оценки прогноза течения заболевания, а также в научных исследованиях для получения знаний в области биологии злокачественных опухолей. Поскольку этот метод имеет высокую себестоимость и трудоемкость, то этапы фиксации биологического материала и получения препаратов становятся ключевыми моментами для успешного проведения FISH-исследования с использованием коммерческих ДНК-зондов. При использовании в клинической практике для достижения достоверности FISH-исследования результат гибридизации можно считать успешным, если флуоресцентные сигналы от гибридизированных участков ДНК являются яркими, т.е. контрастно визуализируются по отношению к фоновой флуоресценции и их количество может быть подсчитано достоверно. Кроме этого требуется, чтобы на препарате клетки лежали отдельно друг от друга, их границы четко определялись, а количество их в гибридизированной области было достаточным для получения статистически достоверных результатов. При злокачественных опухолях эпителиального происхождения, таких как рак слизистой оболочки полости рта, рак шейки матки, FISH-исследования выполняют на мазках, с последующей их фиксацией, или на препаратах, полученных при нанесении суспензии предварительно зафиксированных клеток (Метод жидкостной цитологии в диагностике заболеваний шейки матки: учебно-методическое пособие. - М: РМАПО. - 2012. 23 с.). Постоянно увеличивающийся спрос на FISH-исследования обуславливает потребность в малозатратных способах фиксации биологического материала и его длительного хранения.
Известен способ, при котором FISH-реакцию проводят на традиционном мазке из шейки матки (мазок Папаниколау), представленный в статье Heselmeyer-Haddad K. и соавт. (Heselmeyer-Haddad K., Sommerfeld K., White N.M. et al. Genomic amplification of the Human Telomerase Gene (TERC) in Pap smears predicts the evelopment of cervical cancer/American Journal of Pathology, 2005, Vol. 166, №. 4, p. 1229-1238, doi: 10.1016/S0002-9440(10)62341-3). В способе сначала выполняют цитологическое исследование, для чего все мазки фиксируют, окрашивают согласно стандартным процедурам и заливают специальным клеем под покровное стекло. Когда препараты подготавливают для выполнения FISH, то покровные стекла удаляют путем инкубации препаратов в ксилоле в течение 2-4 дней, затем препараты дважды промывают в ксилоле, дегидратируют и обесцвечивают в смеси 0,5% HCl и 70% этанола в течение 1-2 часов.
Недостатки способа заключаются в неравномерном распределении клеток на предметном стекле, многослойности, потере клеток при фиксации, наличии элементов, приводящих к высокой фоновой флуоресценции.
Известен способ «Стандартизированная аналитическая технология «метод жидкостной цитологии» (Шабалова И.П., Джангирова Т.В. Никитина Л.В. и др. Проблемы стандартизации в здравоохранении, 2012, №7-8, стр. 48-58). В способе биологический материал помещают и хранят в специальной транспортной среде, цитологический препарат готовят осаждением клеток на предметное стекло посредством центрифугирования клеточного материала на цитоцентрифуге, а фиксацию мазков выполняют либо как предварительный этап перед окрашиванием, либо одновременно с окрашиванием.
Недостатком способа является малая доступность и дороговизна ввиду применения только уникальных стандартизированных реактивов, расходных материалов и необходимости дорогостоящего импортного оборудования, отсутствие возможности наносить на одно стекло суспензии клеток нескольких человек.
Известен «Усовершенствованный способ приготовления препаратов фиксированных клеток для флуоресцентной in situ гибридизации» (патент RU 2490635), при котором суспензии фиксированных клеток в объеме 5 мкл наносят на дно лунок, сформированных поверхностью предметного стекла и 8 круглыми отверстиями диаметром 9 мм в герметично приклеенной к стеклу полоске парафильма размерами 26×56 мм2. Прилепляют полоску парафильма к предметному стеклу, нагревая стекло с парафильмом при температуре 60°С и одновременно раскатывая валиком в течение 3-5 сек. Впоследствии указанную полоску вместе с предметным стеклом нагревают при 95°С в течение 2 мин и затем сдирают ее со стекла.
Недостатком способа является трудоемкость, а также то, что в пределах одной лунки у исследователя нет возможности выбрать лучшую область для гибридизации.
Прототипом предлагаемого изобретения является способ получения, фиксации и приготовления препарата слущенных с цервикального канала клеток эпителия, изложенный в статье Li Т. et al. (Li Т, Tang L, Bian D, Jia Y, Huang X, Zhang X. Detection of hTERC and C-MYC genes in cervical epithelial exfoliated cells for cervical cancer screening. Int J Mol Med. 2014 May; 33(5):1289-97. doi: 10.3892/ijmm. 2014.1699.). Способ реализуют в следующей последовательности:
1. При помощи цервикальной щетки (Pap Brush; Beijing ТСТ Medical Technology Company, Ltd., Beijing, China) слущивают эпителиальные клетки.
2. Помещают слущенные клетки в фосфатно-солевой буфер (PBS) и хранят при 4°С до выполнения FISH-исследования.
3. Примерно 5-10 мл PBS, содержащего слущенные клетки, помещают в центрифужную пробирку, добавляют 3 мл коллагеназы и центрифугируют при 1300 об/мин в течение 10 мин и удаляют надосадочную жидкость.
4. Ресуспендируют осадок, добавляют воду и инкубируют при 37°С в течение 20-30 мин.
5. Полученную клеточную суспензию центрифугируют при 1300 об / мин в течение 10 мин и удаляют супернатант.
6. Ресуспендируют осадок, добавляют 5 мл воды и инкубируют при 37°С в течение 20 мин.
7. Добавляют 2 мл фиксирующего раствора, входящего в набор для отмывки (состав является коммерческой тайной), центрифугируют при 1300 об/мин в течение 10 мин и удаляют надосадочную жидкость.
8. Затем добавляют 5 мл фиксирующего раствора, центрифугируют при 1300 об/мин в течение 10 мин и удаляют надосадочную жидкость.
9. Еще раз добавляют 5 мл фиксирующего раствора, центрифугируют при 1300 об/мин в течение 10 мин и удаляют надосадочную жидкость.
10. Осадок ресуспендируют и раскапывают на предметные стекла, которые оставляют для высыхания на воздухе в течение ночи при комнатной температуре.
Недостатки способа - непродолжительный срок хранения биологического материала, затратная по времени процедура фиксации (90-100 мин), малое количество клеток в области гибридизации, неизвестный состав фиксирующего раствора.
Технический результат предлагаемого изобретения заключается в увеличении длительности хранения образцов биологического материала, обеспечении возможности контроля плотности клеток в области гибридизации ДНК зондов, увеличении яркости флуоресцентного сигнала, уменьшении расхода реактивов и увеличении производительности труда.
Сущность предлагаемого решения, включает слущивание цитощеткой клеток эпителия, помещение их в пробирку с фосфатно-солевым буфером, центрифугирование полученной смеси в течение 10 мин с последующим удалением надосадочной жидкости и добавлением к осадку фиксирующего раствора, состоящего из смеси метанола и уксусной кислоты в соотношении 3:1, двукратное очищение полученной суспензии путем центрифугирования в течение 15 мин при 1000 об/мин, удаления надосадочной жидкости с добавлением фиксирующего раствора и хранением суспензии клеток в условиях -20°С, при использовании их повторно очищают, ресуспендируют и наносят на зонированные предметные стекла с контролем плотности клеток, для увеличения яркости флуоресцентных сигналов их обрабатывают 2% раствором Carbowax в течение 2-20 часов при 4°С.
Перечень фигур.
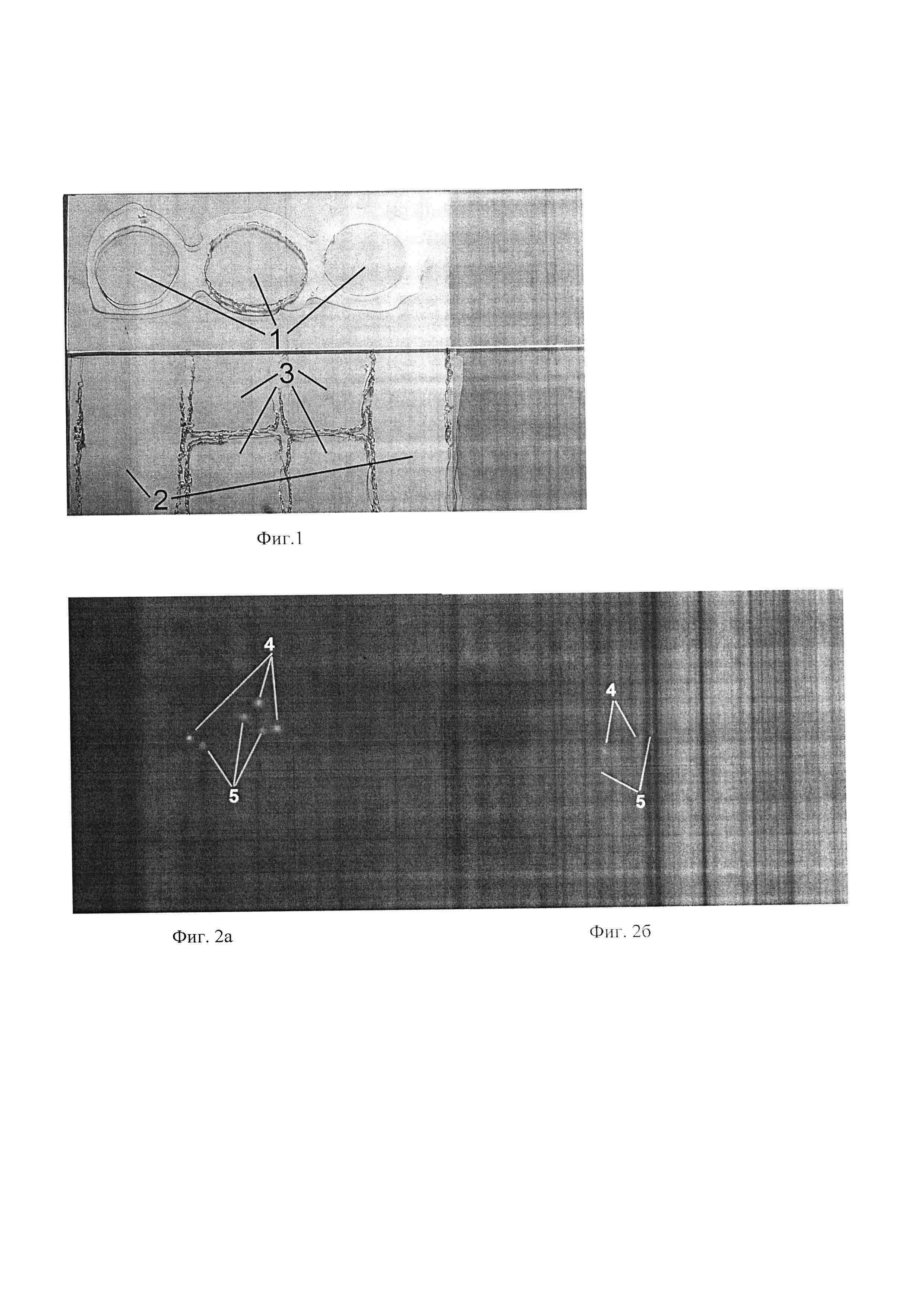
Фиг. 1. Примеры зонирования предметного стекла: 1 - круги, 2 - прямоугольники, 3 - квадраты.
Фиг. 2а. Фото клеток слущенного эпителия после обработки раствором Carbowax: яркие (контрастные по отношению к фоновой флуоресценции) флуоресцентные сигналы 4 - зеленые, 5 - красные.
Фиг. 2б. Фото клеток слущенного эпителия без обработки раствором Carbowax: неяркие (неконтрастные по отношению к фоновой флуоресценции) флуоресцентные сигналы 4 - зеленые, 5 - красные.
Порядок реализации способа.
1. Эпителиальные клетки слущивают с помощью одноразовой цервикальной щетки (Зонд урогенитальный однаразовый стерильный Тип D модель 2, Jiangsu SUYUN Medical Materials Co., Ltd, China).
2. Сразу после забора материала щетку помещают в центрифужную пробирку с 10 мл фосфатно-солевого буфера (PBS) (рН=7.0-7.2) (при необходимости этот материал можно хранить при 4°С, но не более 3 суток).
3. Клетки со щетки смывают на лабораторном вортексе, держа ее при помощи пинцета, в течение 15 сек, затем щетку удаляют из пробирки.
4. Слущенные клетки центрифугируют 15 мин при 1000 об/мин. После центрифугирования удаляют надосадочную жидкость.
5. К ресуспендированному осадку аккуратно, постоянно перемешивая, добавляют по каплям 1 мл свежеприготовленного фиксирующего раствора (фиксатор) (метанол и уксусная кислоты в соотношении 3:1), а затем доливают фиксатор до 10 мл, центрифугируют 15 мин при 1000 об/мин и удаляют надосадочную жидкость.
6. Ресуспендируют осадок, доливают фиксатор до 10 мл, центрифугируют 15 мин при 1000 об/мин и удаляют надосадочную жидкость.
7. Ресуспендируют осадок, доливают фиксатор до 10 мл и помещают в морозильную камеру (-20°С) минимум на 8 часов для завершения фиксации клеток или на хранение. В фиксаторе суспензию зафиксированных клеток можно хранить длительно (минимум 5 лет) при -20°С.
8. Помещают чистое предметное стекло (Menzel-Glaser, Thermo Fisher Scientific, артикул AA00000112E) на термостолик (30°С) и зонируют его посредством нанесения полосок резинового клея (Fixogam Rubber Cement, Kreactech (кат.номер LK-071A) или любой другой резиновый клей из натурального каучука), ограничивающих площадь, необходимую для нанесения клеточной суспензии и ждут полного высыхания клея.
9. Пробирку с клеточной суспензией центрифугируют 15 мин при 1000 об/мин, удаляют надосадочную жидкость, оставляя 0,2-1,0 мл и осадок ресуспендируют.
10. На предметное стекло, лежащее на термостолике (30°С), в область, ограниченную полосками клея, наносят клеточную суспензию по 5-30 мкл.
11. Оценивают плотность клеток под световым микроскопом и, если она недостаточная, то добавляют еще клеточной суспензии до достижения необходимой плотности клеток в предполагаемой области гибридизации.
12. После полного высыхания цитогенетического препарата с него удаляют полоски клея при помощи пинцета.
13. Затем препарат помещают в стакан с 2% раствором Carbowax (2 мл полиэтиленгликоля (Sigma-Aldrich, кат.номер. Р 5402) и 98 мл смеси 95% этанола и дистиллированной воды в соотношении 1:1) на 2-20 часов при 4°С.
14. Вынимают препарат из раствора Carbowax, аккуратно стряхивают излишки жидкости и помещают его в термостат (37°С) на 16-20 часов для дегидратации.
Примеры реализации способа.
Пример 1.
С использованием представленного способа у 32 больных раком слизистой оболочки полости рта, поступивших на лечение в МРНЦ им. А.Ф. Цыба в 2014-2019 гг, с опухоли был осуществлен забор эпителиальных клеток и их фиксация. Сроки хранения образцов до выполнения FISH-реакции колебались от 0 до 5 лет (медиана 3 года). В соответствии с предлагаемым способом были приготовлены цитогенетические препараты. Суспензии клеток были нанесены на 8 предметных стекол, каждое из которых зонировано на восемь квадратных частей (фиг. 1), т.е. на каждое предметное стекло раскапывалась суспензия клеток 4 человек. Под световым микроскопом в предполагаемых областях гибридизации осуществляли контроль плотности клеток. При недостаточной плотности клеток добавляли клеточной суспензии. Цитогенетические препараты прошли обработку 2% раствором Carbowax и дегидратацию в термостате при 37°С в течение 16 часов. Пред- и пост-гибридизационные отмывки цитогенетических препаратов выполнялись в соответствии с протоколом фирмы-изготовителя ДНК-зондов (Kreatech Biotechnology, Голландия). Каждую из процедур пред- и пост-гибридизационных отмывок выполняли одновременно для 4 цитогенетических препаратов (т.е. для 16 человек или 32 областей гибридизации). Таким образом при выполнении пред- и пост-гибридизационных отмывок для каждого пациента в 4 раза снизился расход отмывочных реактивов и время, затрачиваемое на их выполнение. Для каждого пациента было исследовано по два набора коммерческих ДНК-зондов, окрашенных одинаковыми флуорохромами: ген CCND1 с центромерой хромосомы 11 (флуорохромы красный и зеленый соответственно) и ген EGFR с центромерой хромосомы 7 (флуорохромы красный и зеленый соответственно). ДНК-зонды объемом по 2,2 мкл для каждого изучаемого гена наносили на предварительно выбранную в пределах зонирования область и закрывали круглым покровным стеклом диаметром 10 мм. Гибридизация была успешной во всех случаях, т.е. флуоресцентные сигналы гибридизированных участков ДНК были контрастными по отношению к фоновой флуоресценции (фиг. 2а). Следовательно, предлагаемое решение дает возможность увидеть квазичастицы живого вещества, анализировать их структуру, а также изучать физико-химические и функциональные особенности.
Для каждого пациента анализировали не менее 100-200 клеток (в зависимости от доли клеток с нарушениями) для каждого изучаемого гена, что свидетельствует о высокой плотности эпителиальных клеток в области гибридизации. При этом вследствие уменьшения площади гибридизации расход дорогостоящих ДНК-зондов снизился в 4 раза (с рекомендованных фирмой-изготовителем 10 мкл до 2,2 мкл).
Пример 2.
С использованием представленного способа у 8 больных раком слизистой оболочки полости рта, поступивших на лечение в МРНЦ им. А.Ф. Цыба в 2014 г. с опухоли был осуществлен забор эпителиальных клеток, их фиксация, хранение (1 год) и нанесение на 4 зонированных предметных стекла. Каждое предметное стекло было зонировано резиновым клеем на 4 прямоугольные области (фиг. 1), в которые наносились суспензии клеток в виде капель, т.е. на каждое предметное стекло помещали суспензию 2 человек в 2 области на каждого. Одна область предназначалась для выполнения гибридизации с ДНК-зондами гена CCND1 и центромерой хромосомы 11, вторая - гена EGFR с центромерой хромосомы 7. Пред- и пост-гибридизационные отмывки цитогенетических препаратов выполнялись в соответствии с протоколом фирмы-изготовителя ДНК-зондов (Kreatech Biotechnology, Голландия). Обработка препаратов 2% раствором Carbowax не проводилась. Каждую из процедур пред- и посттибридизационных отмывок выполняли одновременно для 4 цитогенетических препаратов. Во всех случаях гибридизацию нельзя было считать успешной, поскольку флуоресцентные сигналы (особенно зеленые) были неконтрастными по отношению к фоновой флуоресценции (фиг.26) и это не позволяло достоверно определять количество флуоресцентных сигналов в исследуемых клетках.
Пример 3.
С использованием представленного способа у 12 больных раком шейки матки, поступивших на лечение в МРНЦ им. А.Ф. Цыба в 2013-2015 гг, был осуществлен забор эпителиальных клеток, их фиксация и консервация. Срок хранения образцов до выполнения FISH-реакции колебался от 3 до 6 лет (медиана 4 года). В соответствии с представленным способом суспензии клеток были нанесены на 4 зонированных на 3 круглые области (фиг. 1) предметного стекла, т.е. на каждое предметное стекло раскапывалась суспензия 3 человек. Цитогенетические препараты прошли обработку 2% раствором Carbowax и дегидратацию в термостате при 37°С в течение 16 часов. Пред- и пост-гибридизационные отмывки цитогенетических препаратов выполнялись в соответствии с протоколом фирмы-изготовителя ДНК-зондов (Abbott Molecular, США). Каждую из процедур пред- и посгибридизационных отмывок выполняли одновременно для 4 предметных стекол (т.е. для 12 человек или 12 областей гибридизации), таким образом для каждого пациента в 3 раза снизился расход отмывочных реактивов и время, затрачиваемое на их выполнение. Для каждого пациента было исследовано по 2 коммерческих ДНК-зонда: ген TERC (красный флуорохром), СЕР3 (зеленый флуорохром). Гибридизация была успешной во всех случаях, т.е. флуоресцентные сигналы гибридизированных участков ДНК были контрастными по отношению к фоновой флуоресценции (фиг. 2а). Для каждого пациента анализировали не менее 100-200 клеток (в зависимости от доли клеток с нарушениями) для каждого изучаемого гена, что свидетельствует о высокой плотности эпителиальных клеток в области гибридизации. При этом вследствие уменьшения площади гибридизации расход дорогостоящих ДНК-зондов снизился в 4 раза (с рекомендованных фирмой-изготовителем 10 мкл до 2,2 мкл).
Подтверждение достижения технического результата.
На цитогенетических препаратах, полученных с использованием представленного способа, выполнено FISH-исследование для 32 больных раком слизистой оболочки полости рта и 12 больных раком шейки матки. Во всех случаях гибридизация была успешной, т.е. флуоресцентные сигналы гибридизированных участков ДНК контрастно визуализировались по отношению к фоновой флуоресценции, что позволило достоверно определять количество флуоресцентных сигналов, в то время как на препаратах, которые были получены без обработки раствором Carbowax, гибризизацию нельзя было считать успешной. На препаратах, полученных в соответствии с предлагаемым способом, для всех больных было проанализировано такое количество клеток, которое было необходимо для получения достоверных результатов. Предлагаемое изобретение при использовании обеспечивает следующий технический эффект: благодаря фиксации клетки эпителия длительно (5-6 лет) сохраняют ДНК пригодной для прохождения гибридизации с ДНК-зондами при хранении их в условиях -20°С. Проведение предварительной обработки препаратов раствором Carbowax создает хорошие условия для прохождения гибризации, что наблюдается в виде увеличения яркости флуоресцентного сигнала по сравнению с яркостью флуоресцентных сигналов без такой обработки: зонирование позволяет наносить на одно предметное стекло суспензии клеток нескольких человек, что приводит к значительному (в 3-4 раза) снижению расхода пред- и пост-гибридизационных отмывочных растворов, а также увеличивает производительность труда. Возможность контроля плотности клеток позволяет уменьшить площадь гибридизации, что в свою очередь ведет к уменьшению в несколько раз расхода дорогостоящих ДНК-зондов.
Способ получения цитогенетических препаратов клеток эпителия для проведения реакции флуоресцентной in situ гибридизации, включающий слущивание цитощеткой клеток эпителия, помещение их в пробирку с фосфатно-солевым буфером, центрифугирование полученной смеси в течение 10 мин с последующим удалением надосадочной жидкости, отличающийся тем, что к осадку добавляют фиксирующий раствор, состоящий из смеси метанола и уксусной кислоты в соотношении 3:1, хранят суспензии клеток при температуре -20°С, цитогенетические препараты готовят нанесением клеток на зонированные предметные стекла при контроле их плотности, для увеличения яркости флуоресцентных сигналов клетки обрабатывают 2% раствором Carbowax в течение 2-20 часов при 4°С.