Результат интеллектуальной деятельности: Пептид, проявляющий антибактериальные и противоопухолевые свойства
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и может быть использовано в медицине и ветеринарии. Инфекции, вызванные резистентными к антибиотикам патогенами, и онкологические заболевания являются ключевыми проблемами здравоохранения в XXI веке. Во всем мире инфекционные заболевания являются основной причиной смерти людей младше 60 лет, причем около 17 млн. человек ежегодно умирают в результате заражения бактериальными инфекциями. Согласно данным Всемирной организации здравоохранения (ВОЗ), ежегодно около 700 тыс. смертельных случаев связано с резистентными к антибиотикам патогенами, при этом прогнозируется рост данного показателя до 10 млн. к 2050 году в случае сохранения существующих темпов распространения устойчивости. В свою очередь, онкологические заболевания являются одной из основных причин смертности людей старшего возраста. В мире наблюдается тенденция к повышению уровня смертности от развития злокачественных новообразований: в 2002 г. он составил 6,7 млн. человек, в 2008 г. - 7,6 млн., в 2012 г. - 8,2 млн., в 2015 г. - 8,7 млн. В 2002 г. рак был диагностирован у 10,9 млн. человек, в 2008 году этот показатель возрос до 12,7 млн., в 2012 г. - до 14,1 млн. [Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. // Int. J. Cancer. 2015. V. 136. №5. P. E359-386.; Parkin D.M., Bray F., Ferlay J., Pisani P. // CA Cancer J. Clin. 2005. V. 55. №2. P. 74-108.]. По оценкам ВОЗ, при сохранении текущих тенденций к 2030 г. онкологические заболевания будут уносить ежегодно около 13 млн. человеческих жизней. Среди кандидатов на роль антибактериальных и противоопухолевых средств нового поколения рассматриваются белки и пептиды системы врожденного иммунитета человека и животных, относящиеся к числу наиболее значимых компонентов иммунной системы. Предполагается, что весьма перспективными в этом отношении могут оказаться эндогенные антимикробные пептиды (АМП). В настоящее время известно несколько тысяч природных АМП [Fan L., Sun J., Zhou M., Zhou J., Lao X., Zheng H., Xu H. // Sci. Rep. 2016. V. 6. P. 24482.], большинство из которых - рибосомально синтезируемые молекулы, состоящие из 12-50 а. о., отличающиеся высоким содержанием  остатков аргинина и лизина и обладающие амфифильными свойствами. По своей структуре АМП условно подразделяют на три группы: цистеин-содержащие пептиды, стабилизированные внутримолекулярными дисульфидными связями; линейные α-спиральные пептиды; линейные пептиды, обогащенные остатками определенных аминокислот [Boman H.G. // Annu. Rev. Immunol. 1995. V. 13. P. 61-92.]. Механизм прямого антибиотического действия, как правило, связан с нарушением целостности мембраны клетки-мишени, однако в ряде случаев он основан на специфическом взаимодействии с отдельными молекулами и молекулярными комплексами на поверхности или внутри клетки-мишени. Помимо инактивации микроорганизмов, в том числе бактерий, грибков, простейших, вирусов, а также опухолевых клеток, АМП как молекулярные факторы системы врожденного иммунитета участвуют в регуляции иммунных реакций организма [Hilchie A.L., Wuerth K., Hancock R.E.W. Immune modulation by multifaceted cationic host defense (antimicrobial) peptides // Nat. Chem. Biol. 2013. Vol. 9, №12. P. 761-768.].
остатков аргинина и лизина и обладающие амфифильными свойствами. По своей структуре АМП условно подразделяют на три группы: цистеин-содержащие пептиды, стабилизированные внутримолекулярными дисульфидными связями; линейные α-спиральные пептиды; линейные пептиды, обогащенные остатками определенных аминокислот [Boman H.G. // Annu. Rev. Immunol. 1995. V. 13. P. 61-92.]. Механизм прямого антибиотического действия, как правило, связан с нарушением целостности мембраны клетки-мишени, однако в ряде случаев он основан на специфическом взаимодействии с отдельными молекулами и молекулярными комплексами на поверхности или внутри клетки-мишени. Помимо инактивации микроорганизмов, в том числе бактерий, грибков, простейших, вирусов, а также опухолевых клеток, АМП как молекулярные факторы системы врожденного иммунитета участвуют в регуляции иммунных реакций организма [Hilchie A.L., Wuerth K., Hancock R.E.W. Immune modulation by multifaceted cationic host defense (antimicrobial) peptides // Nat. Chem. Biol. 2013. Vol. 9, №12. P. 761-768.].
Стоит отметить, что механизмы развития резистентности к традиционным противоопухолевым средствам и цитостатикам сходны с механизмами, обеспечивающими устойчивость микроорганизмов к антибиотикам. Таким образом, в наши дни актуальной является проблема разработки антимикробных и противоопухолевых препаратов селективного действия, не вызывающих формирования резистентности со стороны клеток-мишеней. Селективность действия катионных АМП в отношении бактерий и опухолевых клеток определяется их физиологическими отличиями от нормальных клеток млекопитающих, в первую очередь - наличием отрицательного заряда на поверхности клетки-мишени [Yeaman M.R., Yount N.Y. Mechanisms of antimicrobial peptide action and resistance // Pharmacol. Rev. 2003. Vol. 55, №1. P. 27-55.]. Развитие резистентности клеток-мишеней к АМП маловероятно, поскольку требует внесения существенных изменений в структуру и электрофизиологические свойства клеточной мембраны. Тем не менее, для снижения чувствительности к АМП некоторые патогенные микроорганизмы предпринимают временные меры собственной защиты. В отличие от традиционных антибиотиков при снятии селектирующего давления чувствительность к АМП быстро возвращается на прежний уровень [Habets M.G.J.L., Brockhurst М.А. Therapeutic antimicrobial peptides may compromise natural immunity // Biol. Lett. 2012. Vol. 8, №3. P. 416-418.], что наводит на мысль о высокой нагрузке на метаболизм клетки, находящейся в состоянии повышенной устойчивости к катионным пептидам.
Заявляемое изобретение относится к свойствам пептида из лейкоцитов козы домашней Capra hircus, обозначенного ChMAP-28 (Capra hircus Myeloid Antimicrobial Peptide). Наиболее близкими аналогами заявляемого пептида ChMAP-28 являются ранее открытые антимикробные пептиды, относящиеся к семейству α-спиральных кателицидинов млекопитающих, в наибольшей степени - пептиды ВМАР-27 и ВМАР-28 из лейкоцитов коровы Bos taurus taurus [Skerlavaj В., Gennaro R., Bagella L., Merluzzi L., Risso A., Zanetti M. Biological characterization of two novel cathelicidin-derived peptides and identification of structural requirements for their antimicrobial and cell lytic activities // J. Biol. Chem. 1996. Vol. 271, 28375-28381.]. Оба АМП также проявляют высокую антибактериальную активность в микромолярном диапазоне концентраций (значения минимальной ингибирующей концентрации (МИК) от 0,5 до 4 мкМ). Среди всех известных гомологичных пептиду ChMAP-28 кателицидинов только пептид ВМАР-28 имеет сопоставимую противоопухолевую активность, однако последний более токсичен в отношении эритроцитов (IC50 15 мкМ) и фибробластов (IC50 4 мкМ) [Risso A., Zanetti М., Gennaro R. Cytotoxicity and apoptosis mediated by two peptides of innate immunity // Cell. Immunol. 1998. Vol. 189, 107-115.; Ahmad A., Asthana N., Azmi S., Srivastava R.M., Pandey B.K., Yadav V., Ghosh J.K. Structure-function study of cathelicidin-derived bovine antimicrobial peptide BMAP-28: design of its cell-selective analogs by amino acid substitutions in the heptad repeat sequences // Biochim. Biophys. Acta 2009. Vol. 1788, 2411-2420.].
Изобретение решает задачу расширения ассортимента пептидов, обладающих антибактериальным и противоопухолевым эффектом. Заявляемый пептид имеет аминокислотную последовательность SEQ ID No. 1. Заявляемый пептид проявляет высокую активность в отношении широкого спектра бактериальных возбудителей инфекционных заболеваний (значения МИК от 0,125 до 1 мкМ) и опухолевых клеточных линий (значения IC50 от 3,4 до 6,5 мкМ). Заявляемый пептид характеризуется низкой гемолитической активностью (IC50 100 мкМ) в диапазоне концентрации, при которых проявляется антибактериальный и противоопухолевый эффект. Техническим результатом изобретения является выраженная антибактериальная противоопухолевая активность заявляемого пептида. Заявляемый пептид состоит из 27 аминокислотных остатков и приобретает преимущественно α-спиральную конформацию в мембраноимитирующих средах. Заявляемый пептид может быть получен путем гетерологической экспрессии в бактериальной системе на основе клеток Е. coli, а также с помощью химического синтеза.
Изобретение иллюстрируют графические материалы:
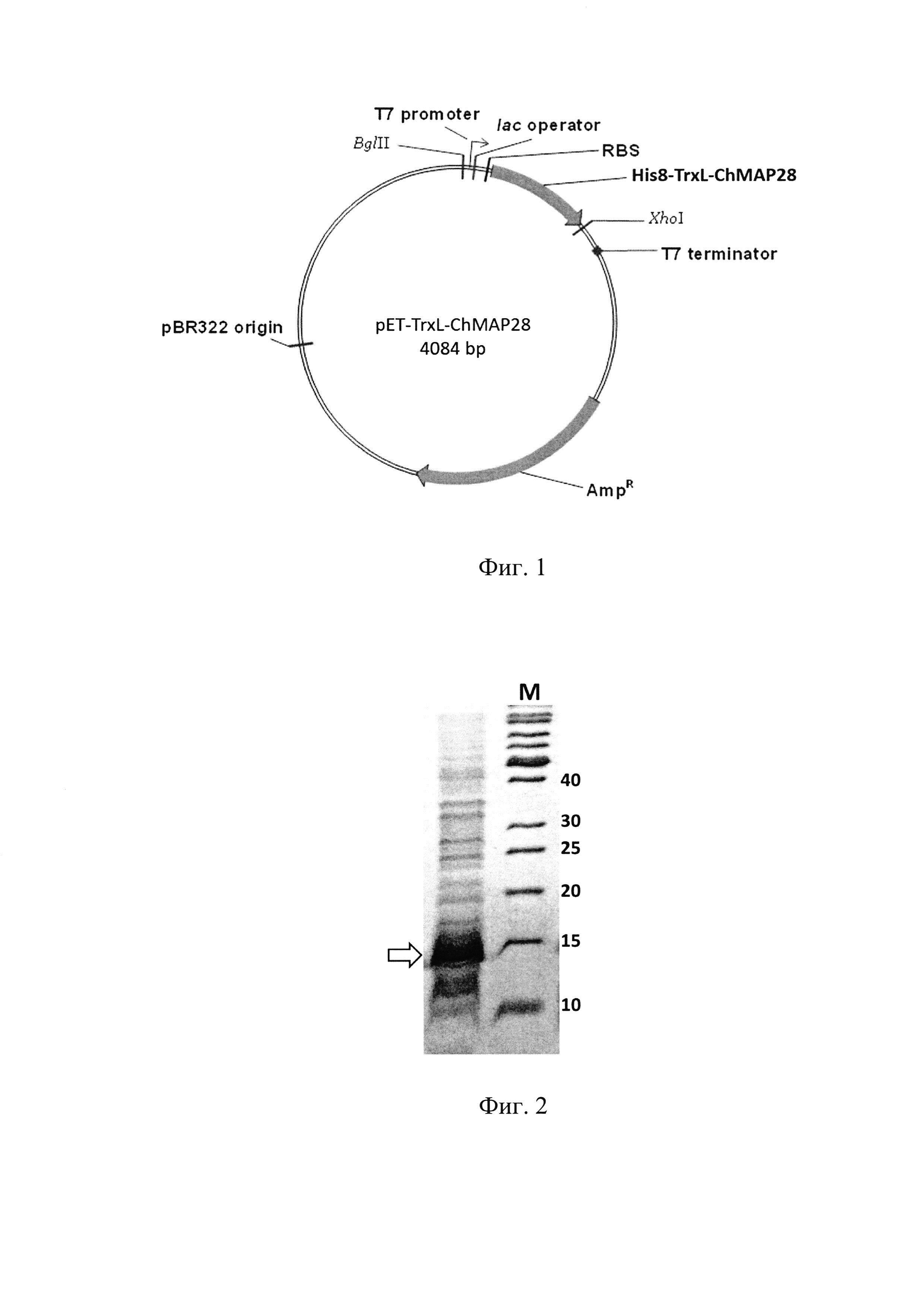
Фиг. 1. Физическая карта плазмидного вектора для экспрессии пептида ChMAP-28: BglII, XhoI - сайты рестрикции с указанием координат; pBR322 origin - участок инициации репликации плазмиды; AmpR - ген устойчивости к β-лактамным антибиотикам; Т7 promoter - промотор транскрипции; Т7 terminator - терминатор транскрипции; lac operator - сайт связывания lac-репрессора; RBS - сайт связывания рибосомы; His8-TrxL-ChMAP-28 - последовательность, кодирующая гибридный белок, содержащий целевой пептид.
Фиг. 2. Электрофоретический анализ суммарного клеточного лизата после экспрессии рекомбинантного гена, кодирующего гибридный белок His8-TrxL-ChMAP-28. М - стандарт М.м. (значения указаны в кДа). Молекулярная масса гибридного белка - 16,5 кДа (отмечена стрелкой).
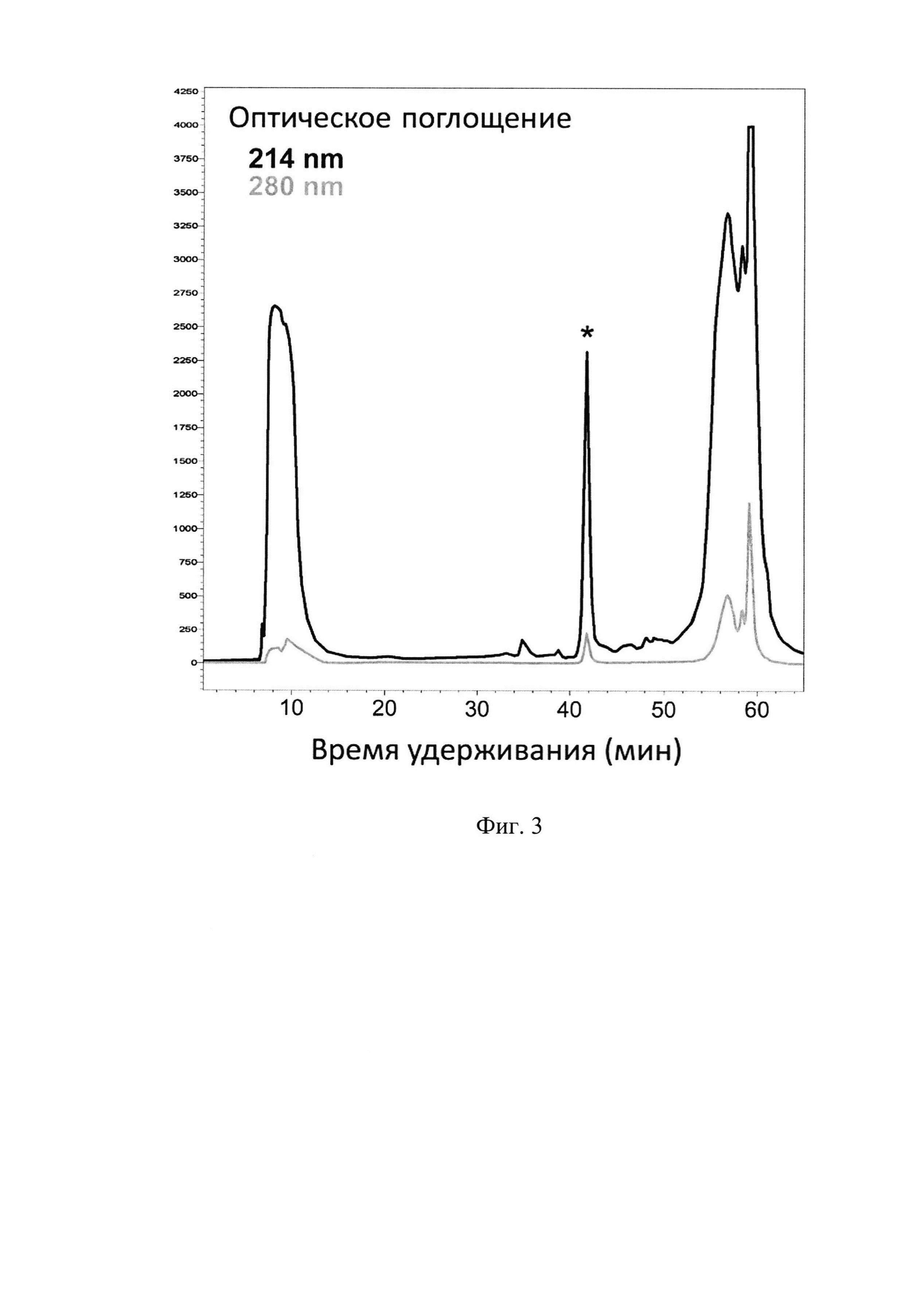
Фиг.3. Хроматограмма очистки рекомбинантного пептида ChMAP-28 (SEQ ID No. 1) методом обращенно-фазовой ВЭЖХ. Пик, соответствующий целевому пептиду, отмечен звездочкой.
Фиг. 4. МАЛДИ масс-спектр пептида ChMAP-28 (SEQ ID No. 1), полученного генно-инженерным способом.
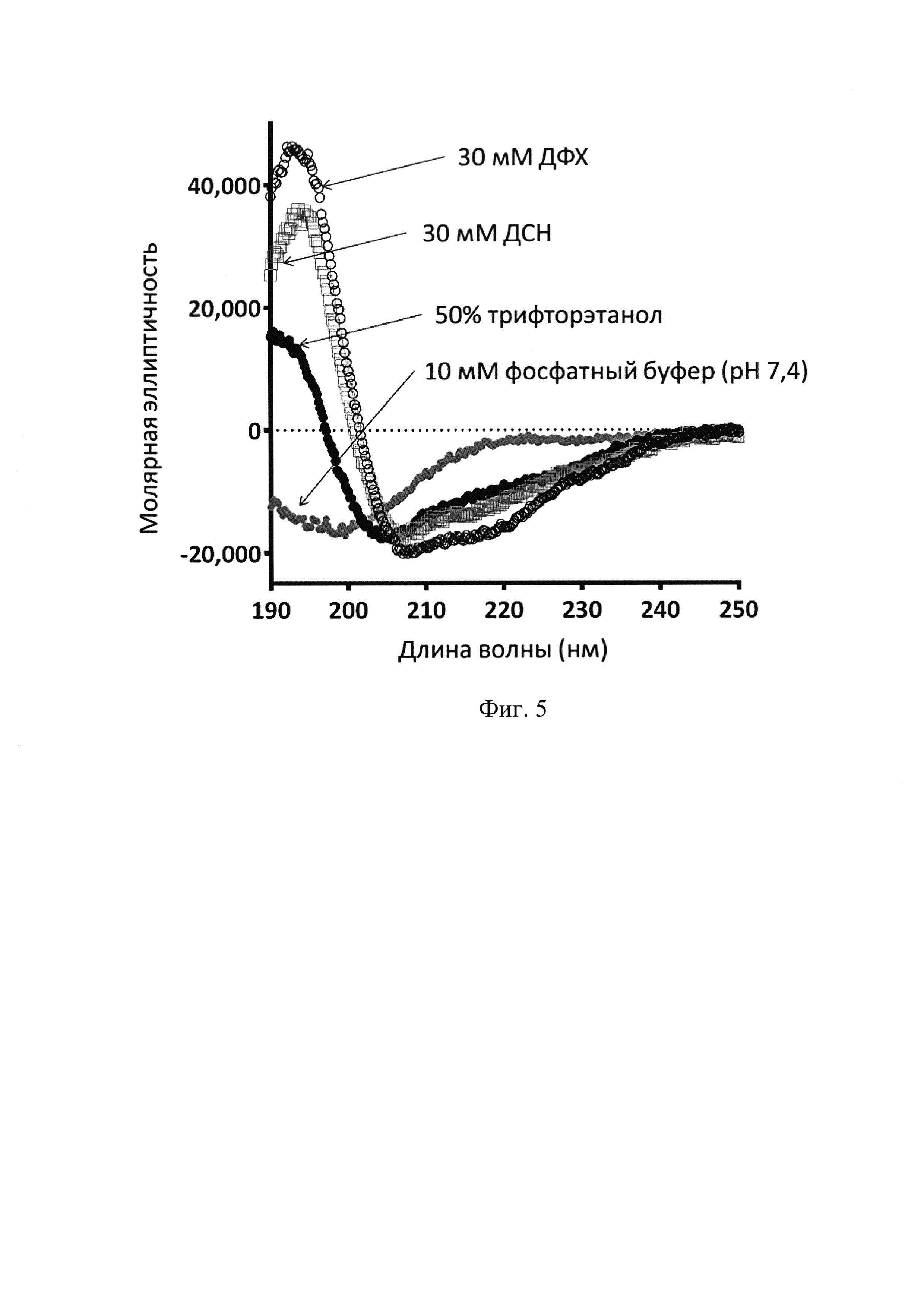
Фиг. 5. Спектры кругового дихроизма пептида ChMAP-28 (SEQ ID No. 1).
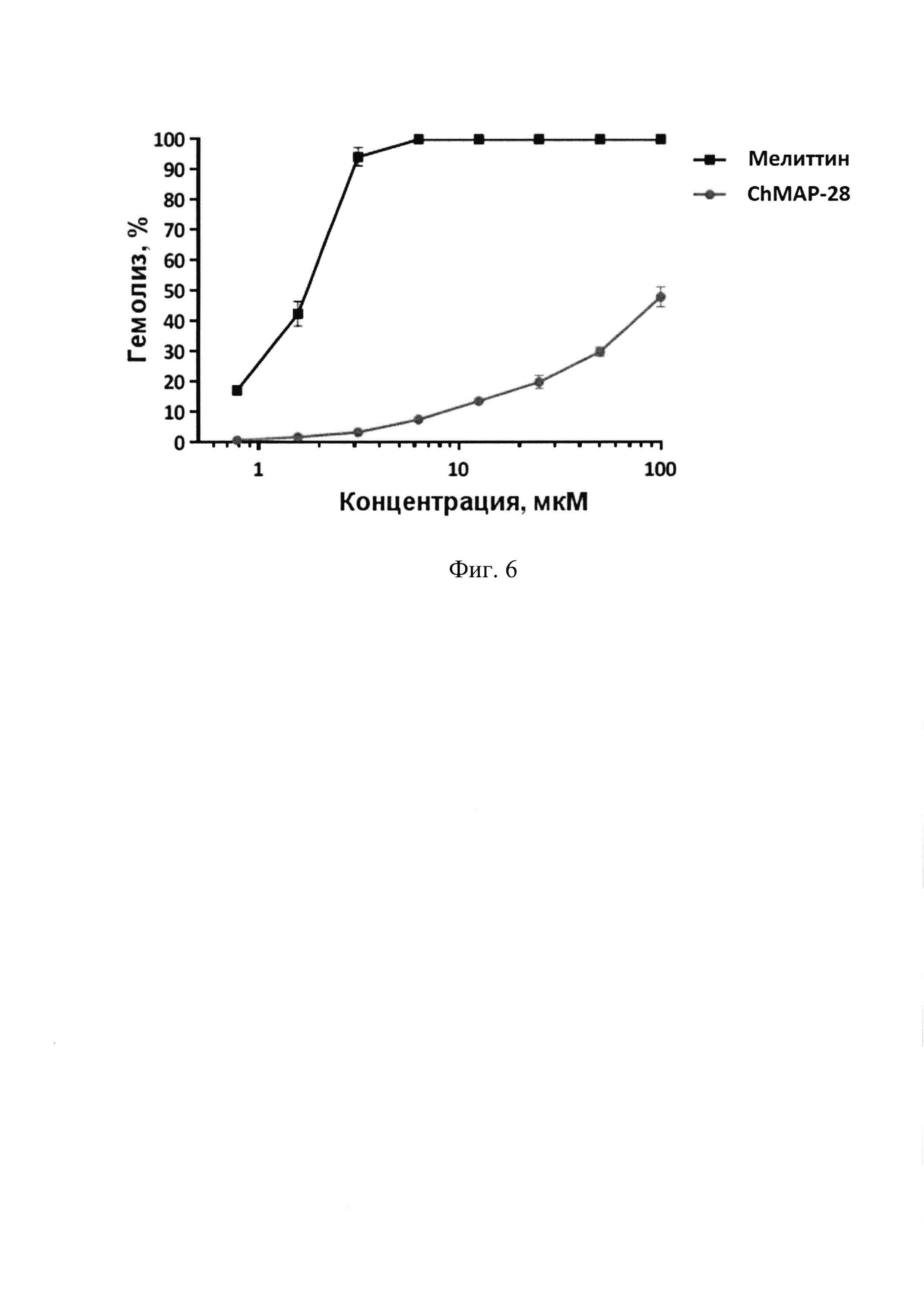
Фиг. 6. Гемолитическая активность пептида ChMAP-28 (SEQ ID No. 1) и мелиттина в отношении человеческих эритроцитов.
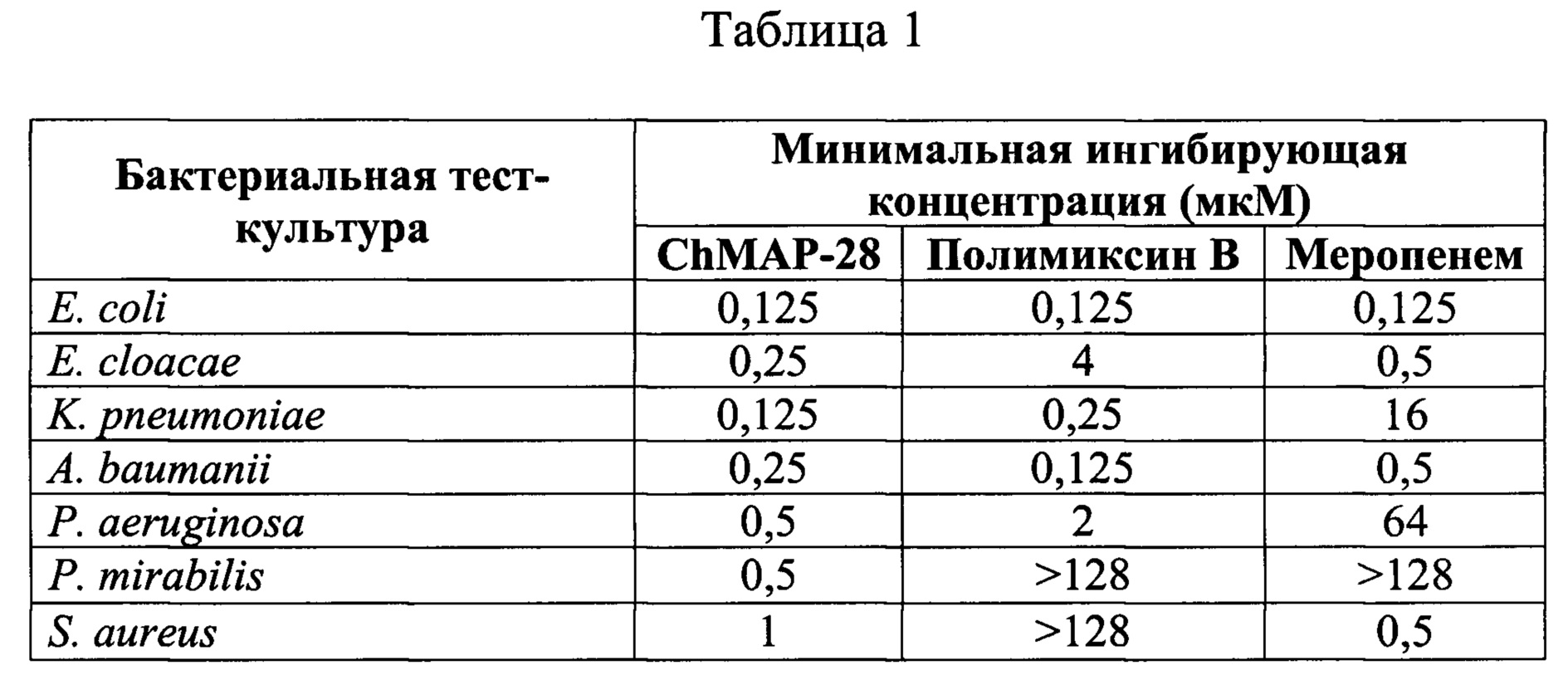
Таблица 1. Антибактериальная активность пептида ChMAP-28 (SEQ ID No. 1), полимиксина В и меропенема.
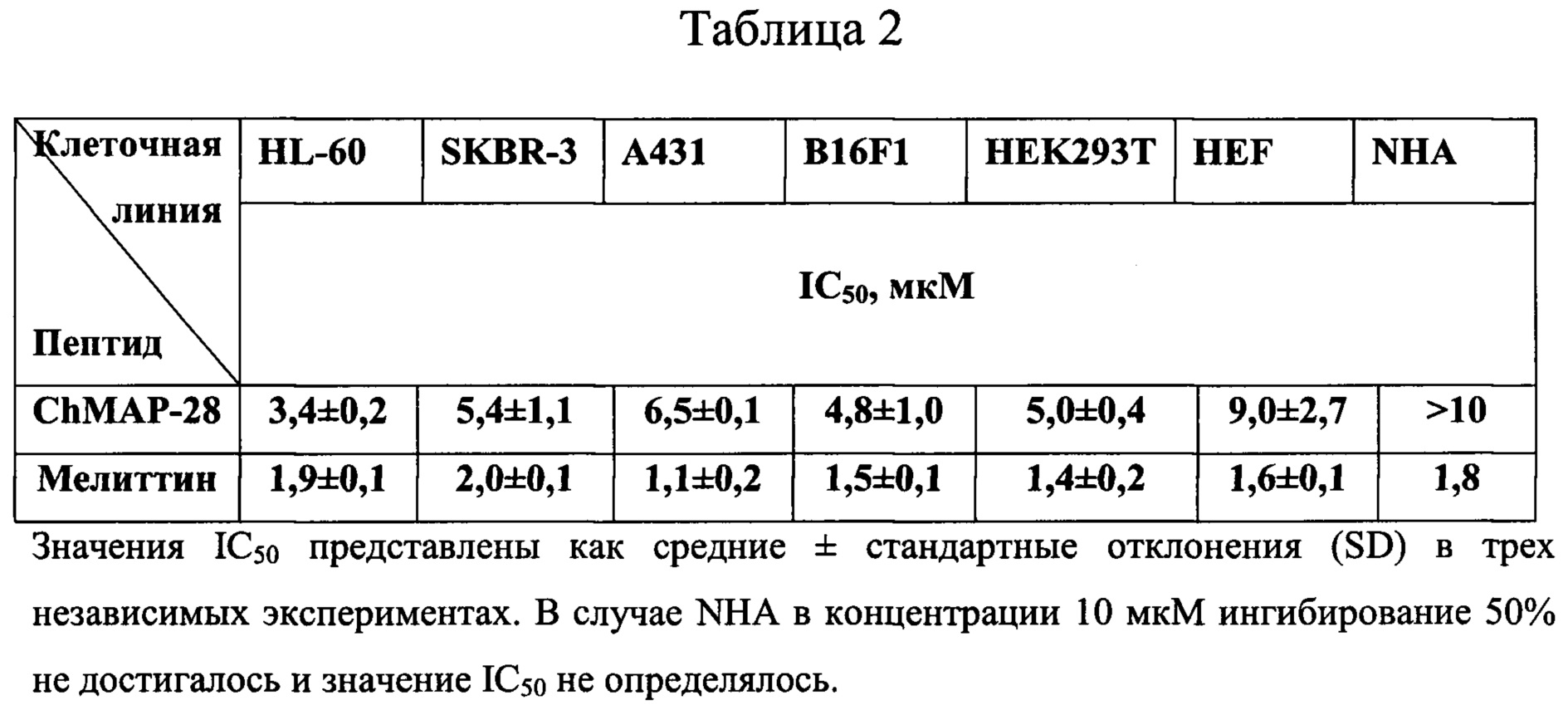
Таблица 2. Цитотоксическое действие пептида ChMAP-28 (SEQ ID No. 1) и мелиттина.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование плазмидного вектора pET-TrxL-ChMAP-28
Нуклеотидную последовательность SEQ ID No. 2, содержащую промотор транскрипции Т7 РНК-полимеразы, lac оператор, участок связывания рибосомы и участок, кодирующий гибридный белок (последовательно связанные гистидиновый октамер, тиоредоксин с заменой M37L, сайт расщепления бромцианом и аминокислотную последовательность пептида ChMAP-28), получают химико-ферментативным синтезом с помощью ПЦР. Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфорамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфорамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Фрагмент ДНК, кодирующий белок-носитель тиоредоксин (M37L), получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду рЕТ32а(+), содержащую ген тиоредоксина. Фрагмент ДНК, кодирующий пептид ChMAP-28, получают с помощью ПЦР с использованием четырех перекрывающихся праймеров. В ходе дизайна праймеров используют кодоны, предпочтительные для экспрессии в Е. coli. Остальные участки последовательности pET-TrxL-ChMAP-28 получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов. На завершающей стадии синтеза последовательность амплифицируют с помощью праймеров, несущих на 5'-концах сайты узнавания рестриктаз BglII и XhoI. Продукт амплификации гидролизуют указанными рестриктазами, очищают электрофорезом в 1% агарозном геле, целевую полосу ДНК выделяют из геля с помощью колонки с силикагелем и лигируют с фрагментом ДНК размером 3,5 тыс. п. н., полученным в результате обработки плазмиды рЕТ-20b(+) рестриктазами BglII и XhoI. В результате лигазной реакции получают кольцевую ковалентно замкнутую ДНК размером 4084 п. н. (Фиг. 1). Продуктами лигазной реакции трансформируют компетентные клетки Е. coli DH10B, приготовленные с помощью 0,1 М хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 45 мин при 37°С и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов». Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидную ДНК, которую анализируют на наличие вставки с помощью секвенирования по Сэнгеру. По данным секвенирования отбирают плазмиду со вставкой, нуклеотидная последовательность которой полностью соответствует запланированной (SEQ ID No. 2).
Пример 2.
Получение рекомбинантного пептида
Проводят трансформацию компетентных клеток Е. coli BL21(DE3), приготовленных с помощью 0,1 М хлорида кальция, плазмидным вектором, сборка которого описана в примере 1. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина и 0,02 М глюкозы. Чашки инкубируют при 37°С в течение 18 ч.
Бактериологической петлей переносят выросшие колонии в 10 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, растят в течение 18 ч на термостатируемой качалке со скоростью вращения 220 об⋅мин-1 при температуре 37°С. Полученную культуру засевают в жидкую питательную среду LB, содержащую 0,02 М глюкозы, 100 мкг/мл ампициллина, 1 мМ MgSO4 и 0,1 мМ CaCl2 при этом начальная OD600 составляет 0,05. Индукцию биосинтеза гибридного белка осуществляют путем добавления изопропилтио-β-D-галактопиранозида (IPTG) к культуре клеток с оптической плотностью 1,0 до конечной концентрации 0,3 мМ. Культуру растят в течение 5 ч при температуре 30°С на термостатируемой качалке со скоростью вращения 220 об⋅мин-1. Контроль уровня экспрессии гибридного белка осуществляют методом денатурирующего SDS-электрофореза в полиакриламидном геле. Расчетная молекулярная масса гибридного белка (SEQ ID No. 3) составляет 16,5 кДа (Фиг. 2).
После экспрессии клетки осаждают центрифугированием, ресуспендируют в фосфатном буфере (рН 7.8) с добавлением 6М гуанидин гидрохлорида и 20 мМ имидазола при помощи стеклянного гомогенизатора и разрушают путем ультразвуковой обработки. Лизат клеток центрифугируют при 25000 g в течение 40 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Очистку гибридного белка, содержащего в качестве аффинной метки октагистидиновую последовательность, осуществляют с помощью металлохелатной хроматографии на препаративной колонке с Ni-NTA агарозой в денатурирующих условиях. Элюцию проводят повышением концентрации имидазола в буфере до 0,5 М. Собранную после очистки с помощью металлохелатной хроматографии фракцию, содержащую гибридный белок, титруют концентрированной соляной кислотой до значения рН 1,0, после чего добавляют равную массу бромциана (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте в течение 20 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего упаривают образцы на вакуумной центрифуге до исходного объема раствора и титруют до нейтрального значения рН. Финальную стадию очистки пептида проводят методом обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ) на колонке Reprosil-Pur C18-AQ в системе водных буферов, содержащих ацетонитрил и 0,1% ТФУ. Разделение происходит в линейном градиенте ацетонитрила от 5% до 80% за 60 мин. Выход пептидов детектируют по изменению оптического поглощения при двух длинах волн: 214 и 280 нм (Фиг. 3). Концентрацию водного раствора очищенного пептида ChMAP-28 определяют методом спектрофотометрии по поглощению при 280 нм и расчета на основе коэффициентов экстинкции.
Пример 3.
Определение молекулярной массы пептида
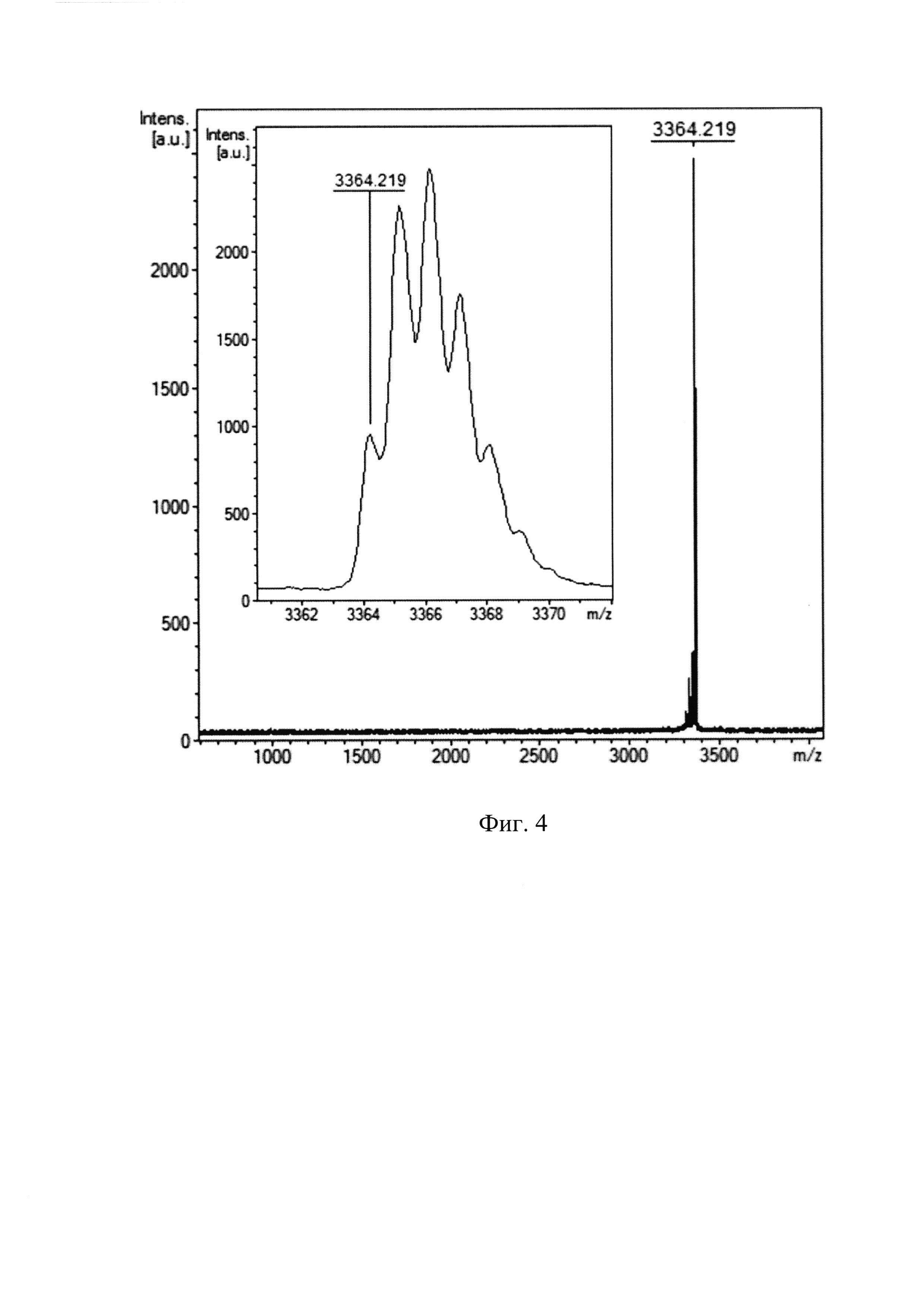
Соответствие относительной молекулярной массы полученного рекомбинантного пептида расчетному значению, а также его химическую чистоту оценивают с помощью масс-спектрометрического анализа на приборе Reflex III (Bruker Daltonics), оснащенном УФ-лазером с длиной волны 336 нм, с регистрацией положительных ионов в рефлекторном режиме. В качестве матрицы используют 2,5-дигидроксибензойную кислоту в смеси, содержащей 20% ацетонитрил и 0,1% трифторуксусную кислоту. Пик с m/z 3364,22 (Фиг. 4) соответствует молекулярному иону пептида ChMAP-28 (SEQ ID No. 1) (расчетная молекулярная масса 3364,0), что свидетельствует о получении целевого пептида.
Пример 4.
Получение спектров кругового дихроизма пептида
Спектры кругового дихроизма (КД) измеряют с помощью спектрополяриметра J-810 (Jasco) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Конформацию пептида исследуют в 10 мМ фосфатном буфере (рН 7,4), 50% растворе трифторэтанола в воде, а также в мицеллах детергентов - 30 мМ додецилсульфата натрия и 30 мМ додецилфосфохолина. Содержание элементов вторичной структуры ChMAP-28 в данных средах составляет 7, 35, 54 и 64%, соотвественно. Оценку содержания элементов вторичной структуры проводят с использованием программы CONTINLL [Provencher, S.W., and Glockner, J. (1981). Estimation of globular protein secondary structure from circular dichroism. Biochemistry 20, 33-37.]. Анализ полученных спектров показывает, что в водной среде пептид ChMAP-28 не склонен к образованию упорядоченной структуры, а в мембраноимитирующей среде пептид принимает α-спиральную конформацию, что характерно для мембраноактивных катионных АМП.
Пример 5.
Тестирование антибактериальной активности пептида
Антибактериальную активность ChMAP-28 определяют методом двукратных серийных разведений в 96-луночных планшетах в жидкой питательной среде Мюллера-Хинтона (МНВ) в присутствии 0,9% NaCl и инкубации с грамположительными {Staphylococcus aureus) и грамотрицательными {Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Acinetobacter baumanii, Enterobacter cloacae, Klebsiella pneumoniae) тест-культурами бактерий. В качестве антибактериальных соединений сравнения используют антибиотики «последней линии» полимиксин В и меропенем. Тест-культуры высевают из консерва в 10 мл жидкой среды МНВ без антибиотика и растят в течение 18 ч при 37°С и 220 об⋅мин-1. После этого аликвоту культуры объемом 300 мкл добавляют к 6 мл среды МНВ и инкубируют в термостатируемой качалке при 37°С до достижения культурой оптической плотности OD600 1,0. Аликвоты тест-культуры объемом 50 мкл, содержащие по 105 КОЕ, добавляют к 50 мкл растворов пептидов, предварительно разведенных от 128 до 0,062 мкМ в пересчете на конечную концентрацию в лунке с помощью стерильного 0,1% раствора бычьего сывороточного альбумина. После добавления культуры, планшет инкубируют в течение 24 часов при 37°С и интенсивном перемешивании (1000 об⋅мин-1). Значения минимальных ингибирующих концентраций (МИК) определяются визуально и спектрофотометрически, как минимальная концентрация пептида, при которой отсутствует рост культуры. Эксперименты проводятся в течение трех раз в трехкратной повторности, причем итоговую МИК рассчитывают как медиану девяти полученных значений. Полученные данные представлены в Таблице 1. В отличие от полимиксина В и меропенема пептид ChMAP-28 проявляет высокую активность (МИК≤1 мкМ) в отношении всех протестированных бактерий.
Пример 6.
Тестирование гемолитической активности пептида
Для тестирования гемолитической активности пептида используют свежевыделенные человеческие эритроциты. Для предотвращения свертывания к цельной крови добавляют цитратный буфер. Кровь центрифугируют в растворе фиколла и урографина плотностью 1,077 г/мл в течение 15 мин при 1500 об⋅мин-1. Фракцию эритроцитов отбирают со дна и трижды промывают двадцатью объемами изотонического натрий-фосфатного буфера (рН 7,4), последовательно осаждая эритроциты путем центрифугирования при 2000 об⋅мин-1 в течение 10 мин. После отмывки готовят 8% суспензию эритроцитов в изотоническом натрий-фосфатном буфере.
Для теста в 96-луночном планшете готовят серии двойных разведений исследуемого пептида от 100 до 0,8 мкМ (в пересчете на конечную концентрацию) объемом 50 мкл. После этого к раствору пептида добавляют по 50 мкл 8% суспензии эритроцитов. Планшет инкубируют в течение 1,5 ч при 37°С и перемешивании 1000 об⋅мин-1. После инкубации планшеты центрифугируют в течение 15 мин при 3000 об⋅мин-1 для осаждения интактных эритроцитов. Далее аликвоты супернатанта переносят в другой планшет для измерения количества свободного гемоглобина. Определение количества гемоглобина в растворе осуществляют по поглощению раствора при 405 нм. В качестве отрицательного контроля (K-) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в растворе натрий-фосфатного буфера без добавления пептидов. В качестве положительного контроля (K+) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в 0,1% водном растворе неионогенного детергента Triton Х-100, вызывающего их полный лизис. Эксперименты проводят дважды с кровью одного и того же человека в трехкратной повторности. Процент гемолиза рассчитывают по формуле:
гемолиз (%)=(OD405 пробы - OD405 «K-»)×100%/(OD405 «K+» - OD405 «K-»)
Результаты тестирования свидетельствуют о том, что в отличие от контрольного пептида мелиттина (SEQ ID No. 4), который является сильным цитолитиком, пептид ChMAP-28 (SEQ ID No. 1) обладает умеренной гемолитической активностью. Пептид ChMAP-28 вызывает лизис 50% эритроцитов лишь при концентрации 100 мкМ.
Пример 7.
Тестирование цитотоксического действия пептида
Тестирование цитотоксического действия пептида в отношении астроцитов и опухолевых клеточных линий проводят с помощью МТТ-теста. Методика основана на способности дегидрогеназ живых клеток восстанавливать 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолий бромид (МТТ-реагент) до нерастворимого в воде фиолетового кристаллического формазана. Для оценки цитотоксического эффекта ChMAP-28 используют панель из четырех опухолевых (HL-60, SKBR-3, А431, B16F1), одной трансформированной (НЕК293Т) и двух нормальных клеточных линий человека - фибробластов (HEF) и астроцитов (NHA). Клеточные линии высаживают в 96-луночные планшеты (по 10000 клеток в каждую лунку) и растят в среде DMEM/F-12 в течение 24 ч при 37°С в СО2-инкубаторе (5% СО2 в воздухе). Далее культуральную жидкость заменяют свежей средой, в которой предварительно растворяют тестируемый пептид. После инкубации в течение 48 ч в приведенных выше условиях в каждую лунку добавляют по 20 мкл раствора МТТ в забуференном физиологическом растворе (5 г/л), после чего продолжают инкубацию в течение 4 ч. Аккуратно удаляют среду, добавляют в лунки по 100 мкл смеси диметилсульфоксида и этилового спирта (1:1) для растворения кристаллов формазана и измеряют оптическую плотность растворов при 570 нм с помощью планшетного спектрофотометра. Долю живых клеток определяют по формуле:
выживаемость (%)=[(OD570 пробы - OD570 «K-»)×100%/(OD570 клетки без пептида - OD570«K-»)],
где «K-» - фоновое поглощение лунки с растворителем. Эксперименты проводят дважды в трехкратной повторности. С помощью математической модели нелинейной регрессии строят графики сглаживающих кривых для экспериментальных значений выживаемости клеток. С использованием уравнений полученных кривых и программного обеспечения GraphPad PRISM 6.0 рассчитывают значения IC50. Полученные данные о цитотоксической активности представлены в Таблице 2. Анализ данных показывает, что ChMAP-28 проявляет сильную цитотоксическую активность в отношении опухолевых и трансформированных клеточных линий и оказывает меньшее влияние на нормальные клетки. Наиболее значимый цитотоксический эффект наблюдается для суспензионных клеток HL-60 (IC50 3,4 мкМ). Нормальные клетки астроцитов NHA и фибробласты HEF оказались менее чувствительными к ChMAP-28 по сравнению с опухолевыми. Для клеток HEF концентрация IC50 составила 9,0 мкМ, а для NHA 50% ингибирование не достигается, поэтому значение IC50 не определено. Поскольку концентрация IC50 мелиттина для всех клеточных линий находится в диапазоне 1-2 мкМ, пептид действует неселективно по отношению к опухолевым и нормальным, а также к суспензионным и адгезионным клеточными линиями. Полученные результаты указывают на наличие селективности при действии пептида ChMAP-28 (SEQ ID No. 1) на опухолевые клеточные линии по сравнению с мелиттином (SEQ ID No. 4).