Результат интеллектуальной деятельности: Аллерген гороха Pis s 3 для диагностики и терапии пищевой аллергии и способ его выделения из природного сырья
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области аллергологии, а именно к идентификации нового пищевого аллергена, способу его получения из природного сырья и использования для диагностики пищевой аллергии и терапии аллергических заболеваний.
Уровень техники
Для проведения аллергодиагностики традиционно используются суммарные аллергенные экстракты, часто дающие ложные и плохо воспроизводимые результаты. Причиной этого является сложность стандартизации суммарных экстрактов, вариабельность их состава и изменение содержания в них различных белков и небелковых компонентов, способных вызывать аллергическую реакцию. Нередко мажорный аллерген присутствует в экстракте лишь в небольших количествах, и его биологическая активность сильно зависит от других компонентов экстракта. Кроме того, аллергодиагностика с использованием суммарных экстрактов не позволяет выявить индивидуальные аллергены, вызывающие развитие аллергических реакций. Существенную проблему при серологической диагностике аллергии представляют также перекрестные аллергические реакции.
Современным направлением развития аллергодиагностики является замена суммарных экстрактов индивидуальными аллергенами, хорошо охарактеризованными как биохимически, так и иммунологически. Индивидуальные аллергены могут быть использованы для составления молекулярного профиля чувствительности пациента, изучения перекрестной реактивности, а также для проведения безопасной и эффективной аллерген-специфической иммунотерапии (АСИТ). Использование индивидуальных аллергенов снижает риск возникновения перекрестных аллергических реакций.
Горох Pisum sativum - основная зернобобовая продовольственная культура, используемая также в виде фуражного зерна, зеленого корма для сельскохозяйственных животных, силоса и сена. Широкое распространение гороха обусловлено высоким содержанием белка в зерне (в среднем 20-27%), сбалансированностью его аминокислотного состава, отличными вкусовыми качествами и хорошей урожайностью в зонах возделывания. Однако массовое пищевое применение гороха ограничено его сравнительно высокой аллергизирующей способностью. В настоящее время идентифицировано и охарактеризовано всего два аллергена (вицилин и конвицилин) данной продовольственной культуры, являющихся фрагментами одного белка-предшественника, которые занесены в международную базу данных по аллергенам Международного союза иммунологических обществ (WHO/IUIS) (www.allergen.org) [Sanchez-Monge R.,  G., Pascual C.Y., Varela J., Martin-Esteban M., Salcedo G. Vicilin and convicilin are potential major allergens from pea // Clin. Exp. Allergy. - 2004. - Vol. 34 (11). - P. 1747-1753]. Однако данные аллергены являются источниками развития аллергических реакций лишь у части пациентов с пищевой аллергией на горох. Для разработки универсальной тест-системы для компонентной аллергодиагностики нового поколения и последующего лечения аллергии, опосредованной антителами класса IgE, необходимо использование всей панели аллергенов данной продовольственной культуры. Настоящее изобретение решает задачу расширения ассортимента аллергенных белков, предназначенных, главным образом, для применения в диагностике и терапии аллергии за счет выделения и характеристики нового пищевого аллергена гороха посевного.
G., Pascual C.Y., Varela J., Martin-Esteban M., Salcedo G. Vicilin and convicilin are potential major allergens from pea // Clin. Exp. Allergy. - 2004. - Vol. 34 (11). - P. 1747-1753]. Однако данные аллергены являются источниками развития аллергических реакций лишь у части пациентов с пищевой аллергией на горох. Для разработки универсальной тест-системы для компонентной аллергодиагностики нового поколения и последующего лечения аллергии, опосредованной антителами класса IgE, необходимо использование всей панели аллергенов данной продовольственной культуры. Настоящее изобретение решает задачу расширения ассортимента аллергенных белков, предназначенных, главным образом, для применения в диагностике и терапии аллергии за счет выделения и характеристики нового пищевого аллергена гороха посевного.
Сущность изобретения
Настоящее изобретение по сравнению с предшествующим уровнем техники, по меньшей мере, частично удовлетворяет потребность в расширении ассортимента известных пищевых аллергенов, так как касается нового аллергена гороха для применения в диагностике и лечении IgE-опосредованной аллергии у людей, а также способа его выделения из природного сырья.
В первом аспекте изобретение относится к полипептиду, представляющему собой новый пищевой аллерген Pis s 3 гороха, а также к его фрагментам или аналогам, имеющим эпитопы, распознаваемые антителами на этот пищевой аллерген. Аллерген Pis s 3 представляет собой полипептид, содержащий аминокислотную последовательность SEQ ID No. 1.
Во втором аспекте изобретение относится к способу выделения полипептида, содержащего аминокислотную последовательность SEQ ID No. 1, из природного сырья, включающему гомогенизацию семян гороха и экстракцию полипептида из семян гороха буферным раствором, осветление полученного экстракта центрифугированием, термическую обработку экстракта, диализ, последовательную ультрафильтрацию, катионообменную и высокоэффективную жидкостную хроматографии.
В третьем аспекте изобретение относится к полипептиду, обладающему идентичностью с SEQ ID No. 1 либо антигенными детерминантами, присущими SEQ ID No. 1, для применения в терапии или диагностике, предпочтительно в терапии или диагностике IgE-опосредованной аллергии, такой как пищевая аллергия на горох.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей полипептид, обладающий идентичностью с SEQ ID No. 1 либо антигенными детерминантами, присущими SEQ ID No. 1, или к его гипоаллергенной форме, модифицированной для того, чтобы отменить или ослабить связывание с IgE-антителами. Гипоаллергенная форма полипептида, обладающего идентичностью с SEQ ID No. 1 либо антигенными детерминантами, присущими SEQ ID No. 1, может быть получена посредством фрагментации, укорочения молекулы или делеции ее внутренних участков, перестановки доменов, замены аминокислотных остатков, разрушения дисульфидных мостиков, образования олигомерных и гибридных молекул и др.
Изобретение, кроме того, относится к способу in vitro диагностики аллергии, опосредованной антителами класса IgE, включающему стадии анализа образца физиологической жидкости, например крови, плазмы или сыворотки человека, у которого предполагается наличие IgE-опосредованной аллергии, такой как пищевая аллергия на горох, путем контакта с полипептидом, обладающим идентичностью с SEQ ID No. 1 либо антигенными детерминантами, присущими SEQ ID No. 1, и выявления присутствия в образце IgE-антител, которые специфично связываются с полипептидом, его фрагментами или аналогами, защищаемыми формулой изобретения. Присутствие таких антител, специфично связывающихся с полипептидом, его фрагментами или аналогами, обладающим идентичностью с SEQ ID No. 1 либо антигенными детерминантами, присущими SEQ ID No. 1, является показателем IgE-опосредованной аллергии.
В следующем аспекте изобретение относится к способу лечения IgE-опосредованной аллергии у человека, такой как пищевая аллергия на горох. В одном варианте способ включает введение пациенту, чувствительному к такому лечению, полипептида, обладающего идентичностью с SEQ ID No. 1, либо его фрагмента, или аналога, обладающего антигенными детерминантами, присущими SEQ ID No. 1 Другой вариант способа лечения включает введение пациенту, чувствительному к такому лечению, фармацевтической композиции согласно одному из предыдущих аспектов.
Определения
Следует считать, что аналоги и фрагменты полипептида, защищенного формулой изобретения, означают белки или пептиды разной длины, идентичные по аминокислотной последовательности с указанным полипептидом, или гомологичные ему по меньшей мере на 80%, а в случае укороченных вариантов по меньшей мере на 80% совпадающие по первичной структуре с соответствующими фрагментами пептида с последовательностью SEQ ID No. 1.
Модифицированный аналог полипептида в контексте настоящего изобретения следует толковать как полипептид, который был химически или генетически модифицирован для того, чтобы изменить его иммунологические свойства, например, чтобы отменить или ослабить связывание с IgE-антителами.
Аналоги или фрагменты полипептида, имеющие общие с указанным полипептидом эпитопы, распознаваемые антителами на этот пищевой аллерген, следует толковать как такие фрагменты и аналоги, связывание которых с IgE-антителами из образца сыворотки пациента, сенсибилизированного пищевыми аллергенами гороха, может быть в значительной степени ингибировано полипептидом с последовательностью SEQ ID No. 1.
Гипоаллергенный модифицированный полипептид или его аналог или фрагмент полипептида следует толковать как модифицированный полипептид или его аналог или фрагмент полипептида, который не способен или обладает значительно менее выраженной способностью связывать антитела класса IgE, реактивные к указанному полипептиду, из образца сыворотки пациента, сенсибилизированного пищевыми аллергенами гороха, либо не проявляет или проявляет гораздо более низкую аллергизирующую способность, которую определяют с использованием анализа активации клеток, например анализа высвобождения гистамина базофилами.
Изобретение иллюстрируют следующие фигуры.
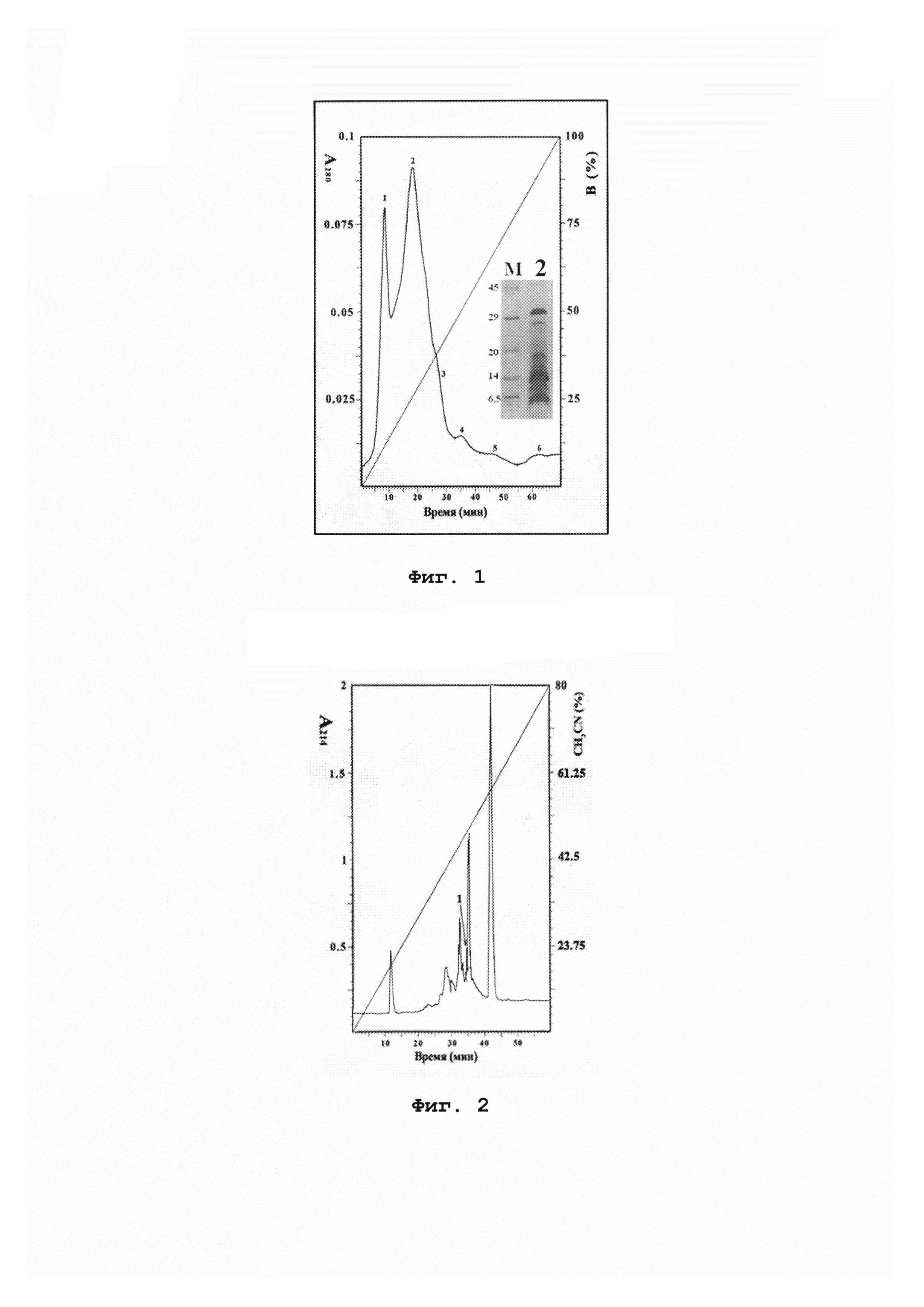
На фиг. 1 отображена хроматограмма разделения белков из экстракта семян гороха Pisum sativum на катионообменной колонке HiTrap SP FF и электрофореграмма фракции 2 после катионообменной хроматографии; М - смесь белков-стандартов молекулярных масс.
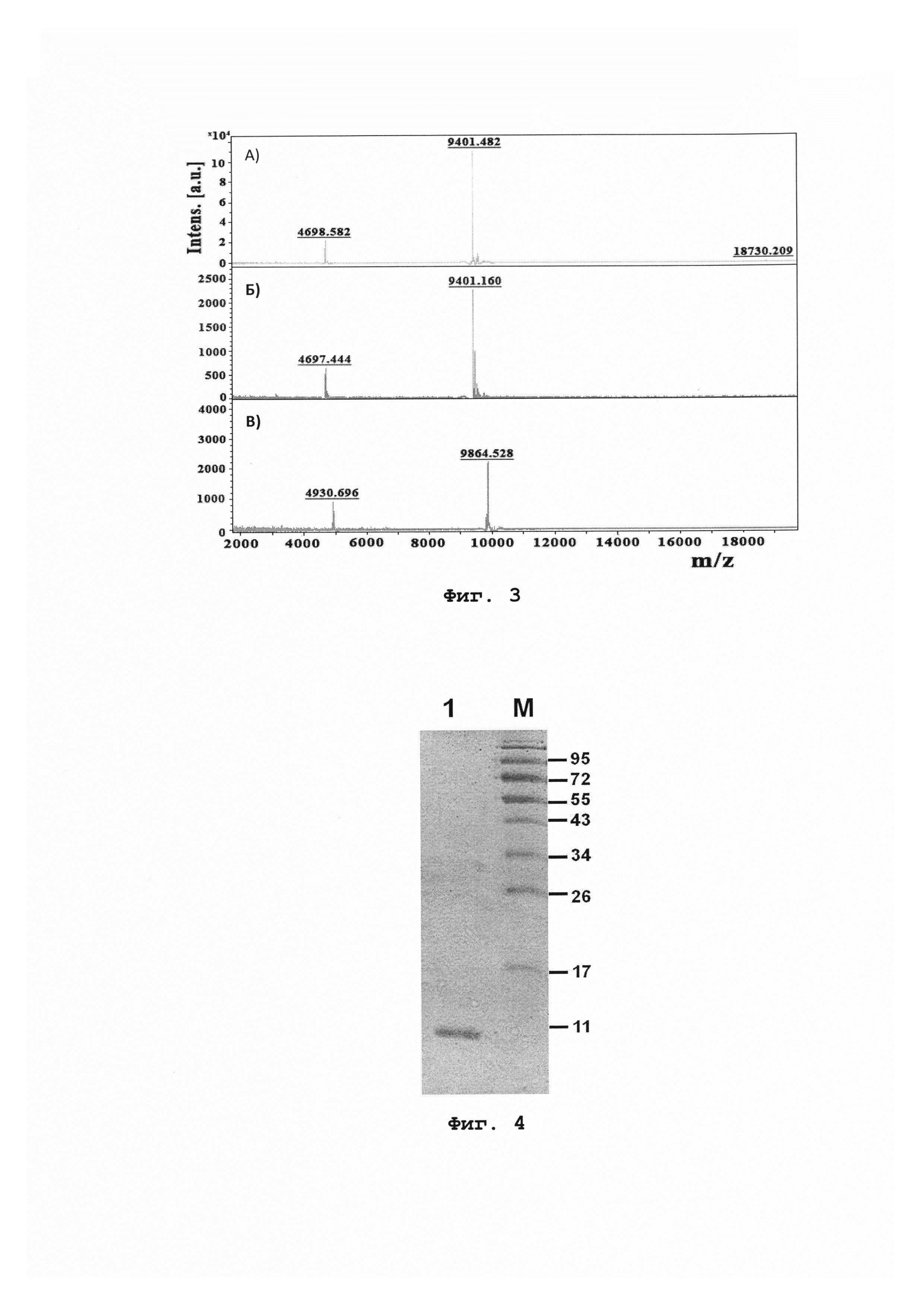
На фиг. 2 отображена хроматограмма ОФ-ВЭЖХ очистки Pis s 3 на колонке Vydac С4 (Pis s 3 присутствует в пике 1).
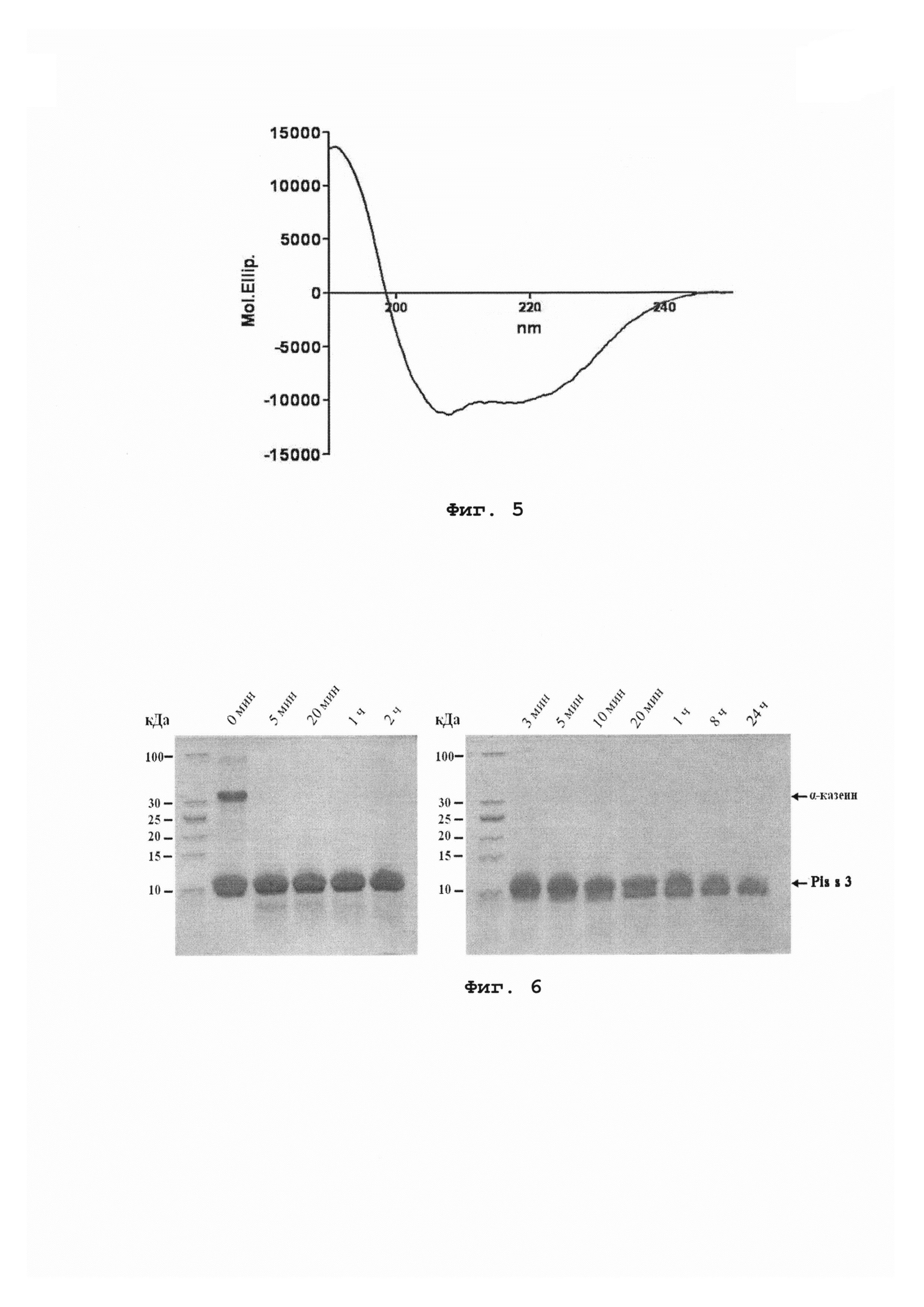
Фиг. 3 иллюстрирует масс-спектрометрический анализ: (А) - Pis s 3; (Б) - Pis s 3 в присутствии йодацетамида; (В) - восстановленный Pis s 3 в присутствии йодацетамида.
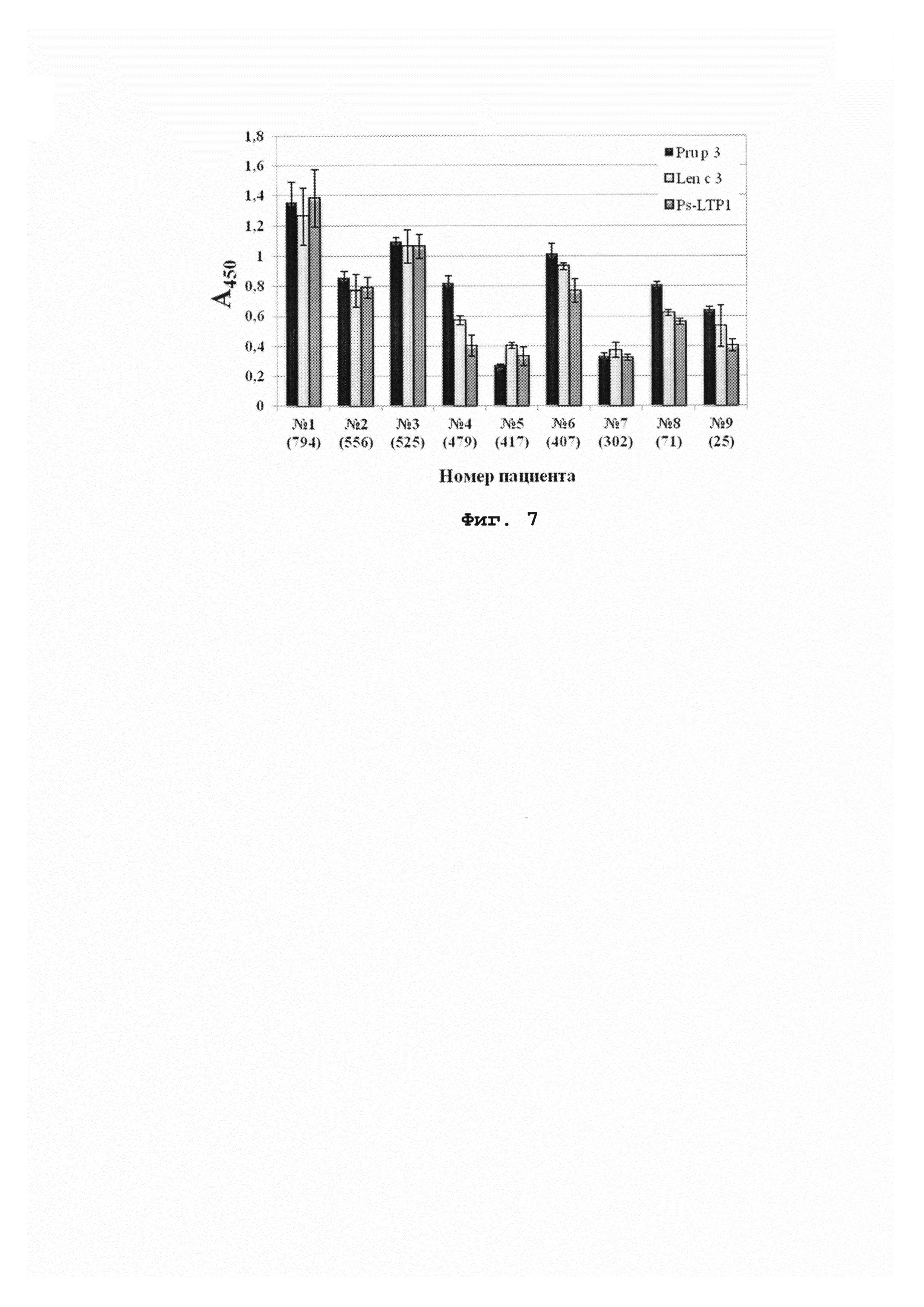
На фиг. 4 отображена электрофореграмма очищенного природного Pis s 3.
Фиг. 5 отображает спектр КД природного Pis s 3 из семян гороха Pisum sativum.
Фиг. 6 иллюстрирует моделирование расщепления Pis s 3 в желудочно-кишечном тракте под действием пищеварительных ферментов: желудочного пепсина (слева), кишечных трипсина и химотрипсина (справа).
Фиг. 7 отображает результаты ELISA с использованием сывороток пациентов с пищевой аллергией (разведение 1:2); в скобках под номерами сывороток указано значение общего уровня IgE (kU/L)
Изобретение иллюстрируют следующие примеры:
Пример 1.
Выделение природного аллергена Pis s 3 из семян гороха посевного Pisum sativum.
100 г сортовых семян гороха (сорт «Сахарный 2», семена ГОСТ 3 52171-2003) гомогенизируют в 300 мл буферного раствора [0,15 М ацетат аммония, 0,2 М NaCl, 2 мМ ЭДТА, 1,5% поливилполипирролидон, коктейль ингибиторов протеаз (Sigma)] и проводят экстракцию при температуре 4°С в течение 2 ч при постоянном перемешивании. Осветленный методом центрифугирования (40000 g, 50 мин, 4°С) экстракт подвергают тепловой обработке в течение 20 мин при 80°С в твердотельном термостате. Выпавший осадок отделяют центрифугированием (15000 g, 20 мин). После повторного центрифугирования полученный экстракт подвергают диализу (Spectra/Por 1 Dialysis Tubing) против 100-кратного объема 50 мМ ацетата аммония (рН 5,3) в течение ночи при 4°С при постоянном перемешивании. Полученный диализат фильтруют через фильтр TYPE GVPP 0,22 мкм и проводят ультрафильтрацию полученного фильтрата в среде инертного газа (Amicon 0850). Сначала ультрафильтрацию осуществляют с использованием мембраны YM100 (Millipore), а затем с помощью РМ30 (Millipore). Полученный фильтрат наносят на катионообменную колонку нормального давления HiTrap SP FF (GE Healthcare), уравновешенную 50 мМ ацетатом аммония (рН 5,3). Элюцию проводят, используя линейный градиент концентрации NaCl от 0 до 500 мМ за 72 мин при скорости потока 0,7 мл/мин. Детектирование ведут при длине волны 280 нм (фиг. 1). Очистку Pis s 1 проводят методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) на колонке Vydac С4 (Grace) при скорости потока 0,5 мл/мин, используя градиент концентрации ацетонитрила от 5 до 65% за 45 мин в присутствии 0,1% ТФУ. Детектирование ведут при длине волны 214 нм (фиг. 2). Степень очистки полипептида может быть повышена путем повторной хроматографии методом обращенно-фазовой ВЭЖХ. Гомогенность полученного полипептида устанавливают методами МАЛДИ-времяпролетной масс-спектрометрии (фиг. 3А) и SDS-электрофореза в ПААГ (фиг. 4). Спектры кругового дихроизма измеряют при комнатной температуре с помощью спектрополяриметра J-810 (Jasco) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 180-250 нм с шагом 1 нм. Исследуют конформацию полипептида, растворенного в воде в концентрации 1 мг/мл (фиг. 5).
Пример 2.
Определение числа цистеиновых остатков и дисульфидных связей в Pis s 3.
Число цистеиновых остатков и дисульфидных связей в Pis s 3 определяют с помощью реакции алкилирования йодацетамидом до и после восстановления белка дитиотреитолом (ДТТ). Навески Pis s 3 (по 10 мкг) растворяют в 90 мкл буфера 50 мМ NH4HCO3, рН 8,0 с добавлением 2 мМ ДТТ и без него, после чего пробирки с образцами инкубируют в течение 2 ч при 37°С. Затем в каждый образец добавляется по 10 мкл йодацетамида до конечной концентрации 20 мМ, после чего реакционные смеси инкубируют без доступа света при комнатной температуре в течение 1 ч. Затем образцы подвергают ОФ-ВЭЖХ очистке и исследуют методом МАЛДИ-времяпролетной масс-спектрометрии (фиг. 3Б, В).
Алкилирование Pis s 3 йодацетамидом после предварительного восстановления приводит к изменению молекулярной массы белка на 464 Да, что свидетельствует о наличии 8 остатков цистеина. Алкилирование полипептида без предварительного восстановления не приводит к изменению его молекулярной массы и свидетельствовует о том, что 8 остатков цистеина в Pis s 3 вовлечены в образование 4 дисульфидных связей.
Пример 3.
Моделирование переваривания Pis s 3 in vitro ферментами пищеварительного тракта.
Для моделирования пищеварения в желудке используют пепсин (Sigma) при соотношении фермент-субстрат 1:20 (w/w). Ферментативную реакцию проводят в 0,1 М HCl (рН 2,0) при 37°С в течение 2 ч. Затем рН смеси доводят до 8,0 с помощью NH4HCO3, добавляют 2,5 нг трипсина (Promega) и 10 нг α-химотрипсина (Sigma) на каждый мкг субстрата и продолжают инкубировать в течение следующих 24 ч, моделируя кишечное пищеварение. В качестве контроля расщепления используют чувствительный к протеолизу субстрат - α-казеин коровьего молока (Sigma-Aldrich), который полностью расщепляется в первые 5 мин обработки пепсином. Pis s 3 обладает очень высокой устойчивостью к перевариванию желудочным пепсином (расщепление на ~19% за 2 ч) и смесью кишечных ферментов (расщепление на ~47% после инкубирования в течение еще 24 ч) (фиг. 6).
Пример 4.
Определение уровня специфических к Pis s 3 антител класса IgE в сыворотках пациентов с пищевой аллергией методом ELISA.
Для определения уровня специфических к Pis s 3 антител класса IgE белок-антиген (0,5 мкг) вносят в ячейки 96-луночного планшета (Costar) в 50 мкл трис-солевого буферного раствора (TBS) и инкубируют в течение 1 ч при 37°С. После промывки тем же буферным раствором, содержащим твин-20 (TBST), планшет инкубируют в течение 2 ч при 37°С с 1% раствором бычьего сывороточного альбумина (BSA) в TBS. Далее планшет инкубируют в течение 2 ч при 37°С с серийными разведениями сывороток пациентов с аллергией (1:2-1:16) в TBS. После промывки TBST в лунки вносят раствор конъюгированных с пероксидазой хрена козьих антивидовых антител к IgE человека (Sigma) и инкубируют планшет при температуре 37°С в течение 1 ч. Детектирование связавшихся антител проводят после промывки лунок TBST, используя 3,3',5,5'-тетраметилбензидин для ИФА (Sigma). Ферментативную реакцию останавливают добавлением 4 н H2SO4 и измеряют оптическую плотность в лунках при 450 нм. В исследовании использовали сыворотки 20 пациентов с пищевой аллергией на фрукты, орехи и бобовые, из числа которых в 9 сыворотках (45%) пациентов присутствовали специфические антитела, способные связываться с Pis s 3, а следовательно, вызывать аллергические реакции при попадании Pis s 3 в организм сенсибилизированных пациентов (фиг. 7).
Аминокислотная последовательность
SEQ ID No. 1