Результат интеллектуальной деятельности: Определение чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути
Вид РИД
Изобретение
Изобретение относится к клинической иммунологии и гемостазиологии и касается определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути
Тромбин (3.4.21.5.) - сериновая протеиназа трипсиноподобного действия - является ключевым ферментом сложного каскада реакций, вызывающих свертывание крови. Участие тромбина в гемостазе не ограничено только расщеплением фибриногена. Тромбин взаимодействует различными звеньями многоступенчатого процесса свертывания крови: с тромбоцитами, факторами свертывания плазмы и компонентами стенок сосудов [Струков А.И., Струкова С.Н. Структурно-функциональные основы гемостаза и его патология // Арх. патологии, 1980, 42,№ 9: 26-45], ускоряя или замедляя тромбогенез. Более того, установлено участие тромбина в биохимических процессах, непосредственно не связанных со свертыванием крови: в активации системы комплемента [Huber-Lang M., Sarma J.V., Zetoune F.S., Rittirsch D et al. Generation of C5a in the absence of C3: a new complement activation pathway // Nature Medicine, 2006, V. 12, № 6: 682-687; doi: 10.1038/nm1419]; стимуляции роста клеток [Gandossi E., Lunven C., Berry C.N. Role of clot-assosiated (-derived) thrombin in cell proliferation induced by fibrin clots in vitro // British Journal of Pharmacology (2000) 129, 1021-7]. Все это свидетельствует о том, что тромбин следует рассматривать как важнейшую биорегуляторную протеиназу.
Традиционно системы комплемента и коагуляции рассматривают как отдельные каскадные системы в организме человека и животных. Оба протеолитических каскада состоят из сериновых протеаз с общими структурными характеристиками как высоко консервативные каталитические участки, содержащие аминокислотные остатки серина, гистидина и аспартата [Krem M.M., Di Cera E.(2002) Nrends Biochem. Sci. 27: 67-74; Esmon C.T. (2004) Tromb. Res. 114: 321-327]. Кроме того, обе системы принадлежат к общей воспалительной сети [Rittirch D., Flier M.F., Ward P. A. (2008) Nat. Rev. Immunol. 8: 776-787] и проявляют некоторые подобные характеристики, соответствующие специализированным функциям их активаторов и ингибиторов. В частности, фактор свертывания XII может активировать C1r и, таким образом, инициирует классический путь активации системы комплемента. В свою очередь С1-ингибитор подавляет не только три пути активации комплемента (классический, альтернативный и лектиновый), но также внутренний коагуляционный путь активации гемостаза (калликреин, фактор XIIа) [Davis A.E. III, Mejia P., Lu F. (2008) Mol. Immunol. 45: 4057-4063; Ghebrehiwet B., Silverberg M., Kaplan A.P. (1981) J. Exp. Med. 153:665-676]. В работе Clark и соавт. (2008) показано, что тромбин и плазмин могут участвовать в нетрадиционной активации системы комплемента при регенерации печени даже в отсутствие компонента С4 классического пути и при ингибировании фактора В альтернативного пути активации системы комплемента [Clark A., Weymann A., Hartman E., Turmelle Y., Carroll M., Thurman J.M. et al. (2008) Vol. Immunol. 45: 3125-3132.]. При системной воспалительной реакции активация коагуляционного каскада сопровождается глубокой активацией системы комплемента, которая приводит к генерации анафилатоксинов С3а и С5а [Levi M., van der Poll., Buller H.U (2004) Circulation 109: 2698-2704]. Также С5а индуциирует активность тканевого фактора в человеческих эндотелиальных клетках [Ikeda K., Nagasawa K., Horiuchi T., Nishizaka H., Niho Y. (1997) Thromb. Haemost. 77: 394-398] и поэтому вовлекается в активацию внешнего коагуляционного пути гемостаза. Кроме того, С5а стимулирует экспрессию тканевого фактора на нейтрофилах через С5а-рецептор, который связан с высокой прокоагулянтной активностью [Ritis K., Doumas M., Mastellos D., Micheli A., Giglis S., Magotti P., et al. (2006). J. Immunol. 177:4794-4802]. Новые доказательства про-коагулянтных эффектов комплемента получены и представлены в недавних исследованиях, где показано, что in vitro маннан-связывающий лектин-ассоциированная протеаза-2 лектинового пути активации комплемента способна запускать потребление (активацию) фибриногена с помощью превращения протромбина в тромбин [Krarup A., Wallis R., Presanis S., Gal P., Sim R.B. (2007). Plos ONE 2:e623]. Еще в 1986 году Wiedmer и соавт. показали, что терминальный комплементный комплекс (ТКК), С5b-9, может катализировать расщепление протромбина в тромбин даже в отсутствие фактора V, тем самым специфически повышать тромбоцитарную протромбиназную активность [Wiedmer T., Esmon C.T., Sim P.J. (1986). Blood. 68: 875-880]. С другой стороны, С5а оказывает фибринолитический эффект с помощью подавления экспрессии ингибитора-1 плазминогенового активатора в человеческих тучных клетках [Wojta J., Kaun C., Zorn G., Ghannadan M., Hauswirth A.W., Sperr W.R., et aj. (2002) Blood 100: 517-523].
Таким образом, в настоящее время становится очевидным то, что обе каскадные системы могут взаимодействовать более широко, чем ранее предполагалось [Markiewski M.M., Nilsson D., Ekdahl K.N., Mollnes T.E., Lambris J.D. (2007) Trends Immunol. 28: 184-192].
В процессе свертывания тромбин адсорбируется на фибрине [Lui C.y., Nossel H.L., Kaplan K.L (1979) J. Biol. Chem. 254: 10421-5; Hogg P.J., Jackson C.M. Fibrin monomer protects thrombin from inactivation by heparin-antithrombin III: Implication for heparin efficacy / Proc Natl Acad Sci USA 1989; 86: 3619-3623]. Связанный с фибриновым сгустком тромбин сохраняет каталитическую активность, как было показано с освобождением пептида А (ФПА) от фибриногена [Weitz J.I., Hudoba M., Massel D., Maranore J., Hirsh J. (1990). J Clin Invest. 86: 385-391], при гидролизе хромогенного субстрата и укорочением времени коагуляции плазмы крови [Bendayan P., Baccalon H., Dupouy D., Boneu B. (1994) Thromb Haemost. 71: 576-580]. Фибриновый сгусток, таким образом, ведет себя как резервуар активного тромбина. Оказалось, что связанный с фибрином тромбин не чувствителен к действию антитромбина III в отличие от жидкофазного тромбина [Weitz J.I., Leslic B., Hudoba M. (1998). Circulation 97: 544-552]. Показано [Beguin S., Kessels H., Hemker H.C. (1993) Thromb Haemost. 69: 811; Kumar N., Beguin S., Hemker H.C. (1994). Thromb Haemost. 72(5): 713-721], что фибрин-связанный тромбин может усиливать образование дополнительно тромбина за счет активации плазменных кофакторов, белков V и VIII. Авторы также показали, что тромбоцит-богатая плазма в присутствии фибрин-связанного тромбина свертывается значительно быстрее за счет укорочения лаг-фазы, предшествующей взрыву при генерации тромбина. Данный факт свидетельствует о том, что тромбоциты находятся в «пред»-активированом состоянии под действием тромбина, связанного с фибриновым сгустком.
Тромбин - белок коагуляционной системы с многогранным воздействием при онкологических заболеваниях с метастазированием. В настоящее время связь между коагуляцией и развитием рака хорошо установлена. Тромбин может также запускать клеточные процессы через протеаза-активируемые рецепторы (ПАР-1 и ПАР-4), приводящие к прогрессированию рака. Получены доказательства участия тромбина в метастазировании рака путем повышения адгезивного потенциала злокачественных клеток. Существуют доказательства участия тромбина на каждой стадии диссеминирования рака: 1) распространение раковых клеток путем отрыва от первичной опухоли, миграция; 2) поступление в кровяное русло; 3) циркуляция в кровяном русле; 4) выход из кровотока; 5) имплантация в органы и ткани. Недавние исследования добавили новые молекулярные данные о генерации тромбина у раковых больных и механизмы, при помощи которых тромбин участвует в трансэндотелиальной миграции, взаимодействии тромбоцитов с опухолевыми клетками, ангиогенезе и других процессах. Хотя отлично известно о роли тромбина в распространении рака, появляются все новые данные о тромбин-опосредованных процессах, которые требуют дальнейших комплексных исследований [Wojtukiewicz M.Z., Hempel D., Sierko E., Tucker S., Honn K.V. (2016) Cancer Metastasis Rev. 35: 213-233].
Другим аспектом роли тромбина при патологических состояниях является ожирение. Ожирение способствует развитию хронического воспалительного и гиперкоагуляционного состояния, которое приводит к сердечно-сосудистым заболеваниям, диабету 2 типа, ожирению печени. Повышенная активность тромбина лежит в основе связанных с ожирением тромбоэмболических событий, но прямые связи между тромбином/фибрином и патологиями, связанными с ожирением, не полностью понятны. В работе Kopec A.K. с соавт. [Kopec A.K., Abrahams S.R., Thornton S., Joseph S. Palumbo J.S., Mullins E.S., Divanovic S. Thrombin promotes diet-induced obesity through fibrin-driven inflammation // J Clin Invest. 2017;127(8):3152-3166. doi.10.1172/JCI92744] иммуногистохимическими методами выявлены внесосудистые отложения фибрина в пределах белой жировой ткани и в печени у мышей, получавших рацион с высоким содержанием жиров, а также у пациентов с ожирением. Мыши, несущие мутантные формы фибриногена (Fibγ390-396А), неспособные связывать лейкоцитарный αМβ2-интегрин, были защищены от вызванного рационом с высоким содержанием жиров увеличения веса и ожирения. У мышей Fibγ390-396А заметно ниже системное, жировое и печеночное воспаление с меньшим количеством макрофагов в пределах белой жировой ткани, а также почти полная защита от развития жировой болезни печени и нарушения метаболизма глюкозы. Гомозиготные же тромбомодулин-мутантные мыши ThbdPro, у которых повышена функция тромбина, отличались заметным увеличением в весе и воспалительной реакцией при ожирении по сравнению с дикими мышами. Лечение дабигатраном, прямым ингибитором тромбина, ограничивало развитие ожирения, вызванное диетой с высоким содержанием жиров, и подавляло прогрессирование осложнений у мышей с ожирением. В совокупности эти данные подтверждают роль тромбина и фибрина как маркеров системной воспалительной реакции при ожирении [Kopec A.K., Abrahams S.R., Thornton S., Joseph S. Palumbo J.S., Mullins E.S., Divanovic S. Thrombin promotes diet-induced obesity through fibrin-driven inflammation // J Clin Invest. 2017;127(8):3152-3166. doi.10.1172/JCI92744].
Таким образом, роль тромбина, связанного с растворимыми фибрин-мономерными комплексами, остается до конца не исследованным из-за отсутствия методик определения данной формы тромбина, как маркера внутрисосудистой активации свертывающей системы и системы комплемента.
Биохимические методы определения активности тромбина можно разбить на две группы. В первой группе применяются низкомолекулярные пептидные субстраты, которые расщепляются ферментом с образованием окрашенного продукта. Примерами таких субстратов служат H-D-Phe-Pro-Arg-п-нитроанилид (FPR) [Whitton C., Sands D., Lee T., Chang A., Longstaff C. Thromb Haemost. - 2005. - V. 93. - P. 261-266], h-D-Phe-Pro-Phe-п-нитроанилид (FpF) [Bush L.A., Nelson R.W., Di Cera E. (2006). J. Biol. Chem., 281, 7183-7188]. Данная реакция характеризует активность только каталитического центра тромбина, поэтому корректнее использовать методы второй группы.
Ко второй группе относятся методы, учитывающие эффективность как работы каталитической триады, так и связывания природных субстратов с распознающим участком протеазы. Активность тромбина можно определеить исходя из кривых накопления продуктов реакции PAR1, PAR4, протеина С или фибриногена [Nieman M.T., Schmaier A.H. (2007). Biochemistry, 46, 8603-8610; Mullin J.L., Gorkun O.V., Binnie C.G., Lord S.T. (2000). J. Biol. Chem., 275, 25329-25246; Pineda A.O., Cantwell A.M., Bush L.A., Rose T., Di Cera E. (2002). J. Biol. Chem., 97, 807-813.]. Отщепляемые пептиды от фибриногена при активации тромбином определяют хроматографическими методами. При определении фибрина, продукта протеолиза фибриногена тромбином, используются оптико-механические или спектрофотометрические методы тестирования.
Суть оптико-механического метода состоит в перемешивании реакционной смеси магнитной мешалкой, что приводит к наматыванию на нее фибриновых нитей, которые тормозят вращению мешалки вплоть до полной остановки. Время остановки мешалки фиксируется как время сворачивания плазмы. Несмотря на некоторую условность получаемой величины и отсутствии корреляции с кинетическими параметрами, стандартизация реагентов и условий реакции делают время сворачивания хорошо воспроизводимы параметром. Оптико-механический метод, в основном, находит применение в клинических лабораториях, что объясняется небольшим диапазоном определяемой активности тромбина (0,3-0,6 IU на 300 мкл пробы), значительной погрешностью результатов (до 50%) и потребностью в узкоспециализированном оборудовании. [Спиридонова В.А., Рог У.В., Баранов Ю.В., Дугина Т.Н., Струкова С.М., Копылов А.М. (2003). Биоорг. Химия. 29, 1-4.]. Результаты оптико-механического метода недостоверно отражают степень агрегации фибрина в случае некоторых мутаций, поэтому более предпочтительно использование спектрофотометрических методов исследования агрегированного фибрина [Lefkowitz J.B., DeBoom T., Weller A., Clarke S., Lavrinets D. (2000). Am J Hematol., 63, 149-155.].
В спектрофотометрических методах определения активности тромбина не используется перемешивание раствора во время реакции. На начальных этапах протеолиза раствор агрегирующего фибрина ведет себя подобно коллоидному раствору, который с течением реакции переходит в гель, образованный трехмерным каркасом агрегированного фибрина и раствора низкомолекулярных соединений, удерживаемого им. Протекание реакции сопровождается помутнением и увеличением вязкости, соответственно для наблюдения можно использовать нефелометрию, турбидиметрию, вискозиметрию.
Тест генерации тромбина является одним из «глобальных» тестов, разработанных в 2001 г. [Hemker H.C., Giesen P., Al Dieri R., Regnault V., de Smedt E., Wagenvoord R., Lecompte T., Béguin S. (2003) Calibrated automated thrombin generation measurement in clotting plasma. Pathophysiol. Haemost. Thromb., 33, 4-15.]. Принцип метода заключается в использовании специфического к тромбину флуорогенного субстрата. После предварительной инкубации тромбоцит-богатой плазмы крови в нее вносят буфер, содержащий ионизированный кальций и флуорогенный субстрат. Образующийся тромбин расщепляет субстрат, в результате высвобождается молекула флуорофора, излучение которого автоматически регистрируется флуориметром через равные промежутки времени. Интенсивность свечения пропорциональна концентрации образовавшегося тромбина. На основании измерений с помощью программного обеспечения выстраивается кривая генерации тромбина. В ходе исследования оцениваются: время задержки образования тромбина (лаг-период), максимальная скорость образования тромбина (пик), время достижения максимальной скорости (время пик), количество образовавшегося тромбина (площадь под кривой, эндогенный тромбиновый потенциал) и некоторые другие параметры.
Известен также способ определения генерации анафилатоксина С5а тромбином в отсутствие компонента С3 комплемента у мышей [Huber-Lang M., Sarma J.V., Zetoune F.S., Rittirsch D., Neff T.A., McGuire S.R. et al. (2005). Nature Medicine, 12 (6). doi: 10.1038/nm1419]. Авторами было показано образование активного С5а анафилатоксина при инкубации компонента С5 комплемента человека с тромбином. Генерацию анафилатоксина С5а в данной работе тестировали методом иммуноферментного анализа.
Задачей настоящего изобретения является расширение арсенала лабораторных тестов для определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути.
Технический результат заявленного изобретения заключается в принципиально новом подходе для определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути.
Технический результат достигается тем, что для определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути используют цитратную плазму с высокой активностью тромбина, связанного с фибрином. Для ингибирования активации комплемента по одному из известных трех путей (классическому, альтернативному или лектиновому) используют цитрат натрия в качестве хелатора для связывания Са2+ и Mg2+. В присутствии высокой активности тромбина, связанного с фибрином активируется компонент С5 и формируется мембрано-атакующий комплекс, который определяют по лизису эритроцитов человека. Степень лизиса эритроцитов человека (ЭЧ) определяют по калибровочному графику, где 100% лизис представляет собой полный лизис эритроцитов человека при добавлении воды, а контроль эритроцитов на спонтанный лизис - 0% лизиса. Далее определяют группу крови по эритроцитам человека с использованием стандартных гипериммунных анти-сывороток к эритроцитам группы крови А и В. Наиболее чувствительными к лизису являются эритроциты группы А, далее группы АВ и В. Эритроциты группы 0 устойчивы к лизису при активации комплемента по тромбиновому пути.
Способ осуществляют следующим образом. Проводят стандартный забор крови в раствор 3,8% цитрата натрия в соотношении 9:1, готовят тромбоцит-обедненную плазму путем центрифугирования при 3000 об/мин в течение 20 мин. Затем отбрасывают плазму и осадок эритроцитов отмывают 3 раза 0,15 М раствором NaCl центрифугированием в течение 10 минут при 2500об/мин. Из отмытых эритроцитов готовят 1% суспензию и используют в тесте определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути. Для этого в лунки иммунологических планшет с плоским дном предварительно вносят 25 мкл цитратной плазмы с высокой активностью тромбина, связанного с фибрином, 50 мкл вероналового буфера и 25 мкл 1% суспензии эритроцитов человека (ЭЧ). В качестве контролей используют: контроль на полный лизис ЭЧ (25 мкл ЭЧ + 75 мкл Н2О) и контроль на спонтанный лизис ЭЧ (25 мкл ЭЧ + 75 мкл вероналового буфера). Пробы тщательно перемешивают и инкубируют при перемешивании в термостате для иммунологических 96-ти луночных планшет при 37°С в течение 10 мин. После инкубации измеряют оптическую плотность проб на фотометре для иммуноферментного анализа при 620 нм. Степень лизиса ЭЧ определяют с использованием калибровочного графика, где 100% лизис представляет собой полный лизис ЭЧ при добавлении воды, а контроль ЭЧ на спонтанный лизис - 0% лизиса. Затем определяют группу крови во всех тестированных эритроцитах.
Изобретение поясняется следующими фигурами:
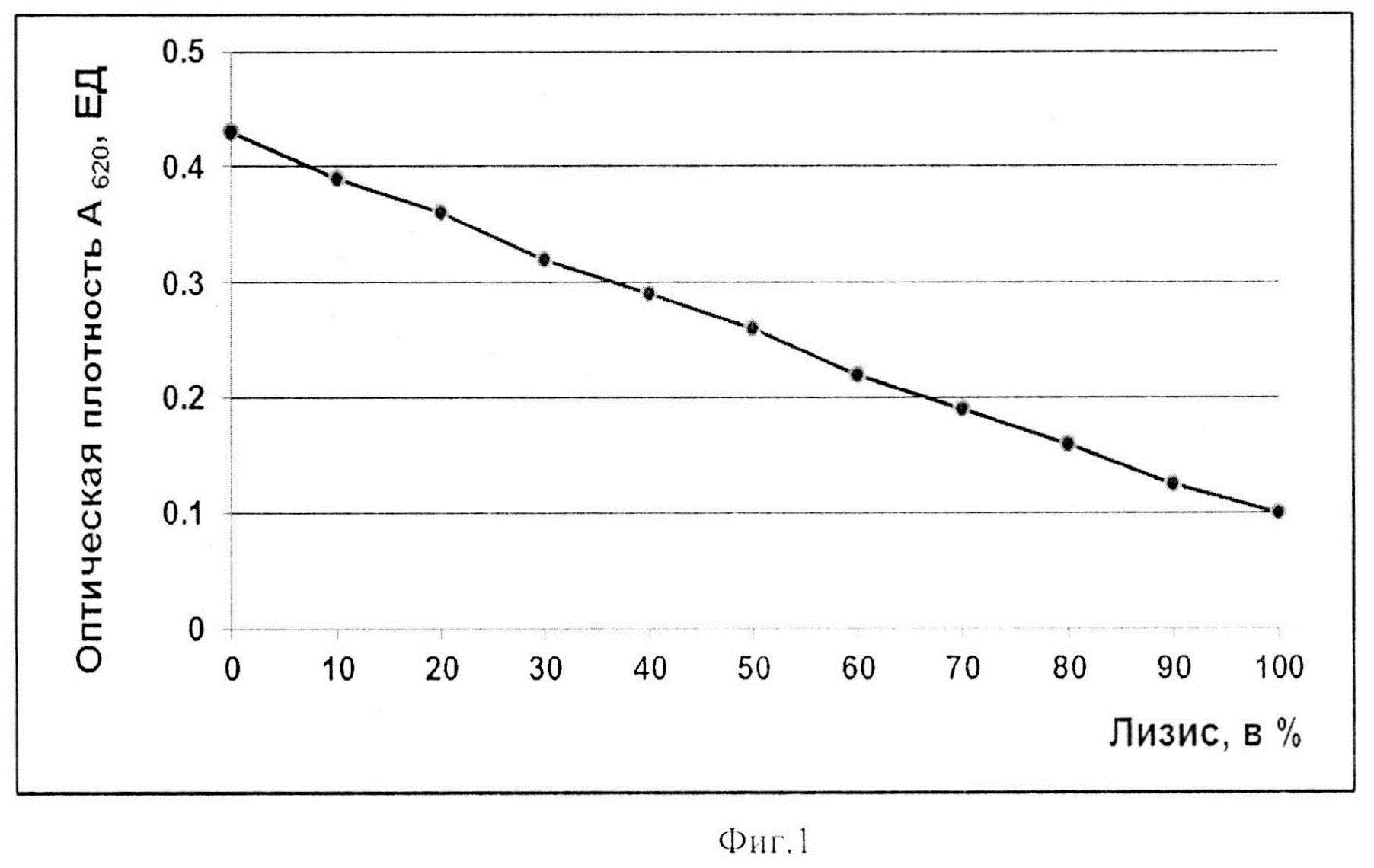
Фиг. 1. Калибровочный график для определения степени лизиса эритроцитов барана по оптической плотности при длине волны 620 нм.
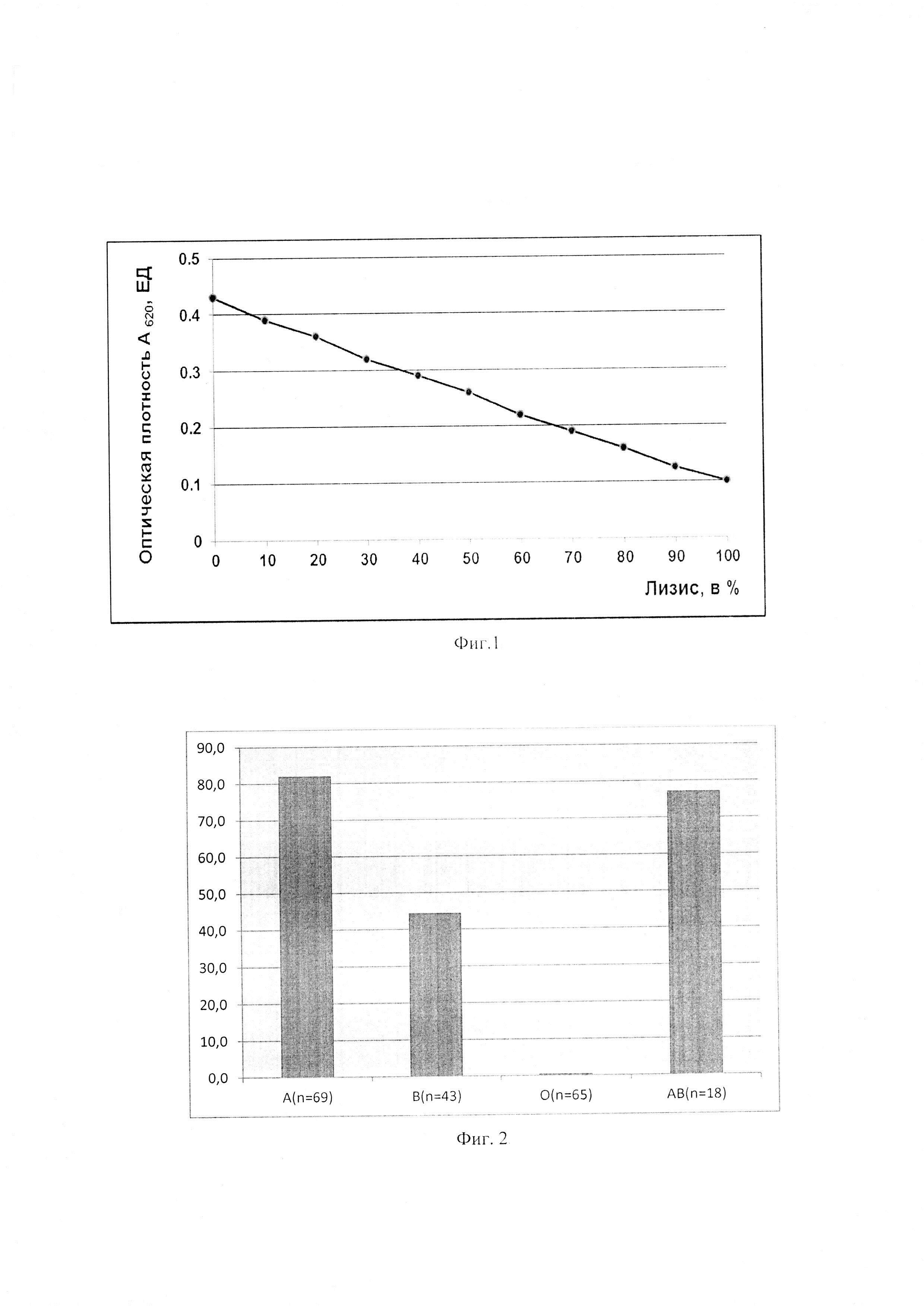
Фиг. 2. Чувствительности ЭЧ к лизису при активации системы комплемента по тромбиновому пути в зависимости от группы крови человека
Пример 1. Определение оптимальной концентрации эритроцитов барана для определения активности циркулирующего тромбина. Эритроциты барана (ЭБ) 3 раза отмывают 0,15 М раствором NaCl центрифугированием в течение 10 мин при 2500 об/мин. Строят график зависимости оптической плотности суспензии эритроцитов (при длине волны 620 нм) от концентрации эритроцитов. Для этого 1% суспензию эритроцитов прогрессивно разводят в плоскодонной 96-ти луночной иммунологической планшете в объеме 25 мкл 0,15М NaCl, добавляют 75 мкл вероналовый буфер, тщательно перемешивают и измеряют на фотометре для иммуноферментного анализа при длине волны 620 нм. Результаты представлены в таблице 1.
Таблица 1
Зависимость оптической плотности 1% суспензии эритроцитов барана (ЭБ) при длине волны 620 нм (А620) от концентрации
|
Как видно из данных, представленных в таблице 1, наблюдается линейная зависимость оптической плотности суспензии от концентрации ЭБ в растворе до А620 равной 0,56 ЕД. Свыше 0,56 ЕД при А620 данная зависимость - нелинейная. Поэтому для теста определения активности циркулирующего тромбина нами выбрана концентрация суспензии ЭБ, которая в объеме 100 мкл в 96-луночных планшетах дает оптическую плотность, равную 0,40-0,56 ЕД. Для определения степени лизиса эритроцитов нами предложен калибровочный график, в котором динамику лизиса эритроцитов оценивают по снижению оптической плотности при длине волны 620 нм. За 0% лизиса принимают оптическую плотность контроля эритроцитов на спонтанный лизис (25 мкл ЭБ + 75 мкл вероналового буфера), соответственно за 100% лизис принимают оптическую плотность контроля на полный лизис (25 мкл ЭБ + 75 мкл Н2О) (фиг.1). Определяют мутность эритроцитов турбидиметрически при длине волны 620 нм после 10 мин инкубации при 37°С и по калибровочному графику определяют степень лизиса (фиг. 1).
Как видно из фиг. 1, калибровочный график позволяет определять степень лизиса эритроцитов в процентах по оптической плотности пробы без стадии центрифугирования и измерения гемоглобина в супернатанте и последующего расчета степени лизиса эритроцитов по формуле, что существенно упрощает регистрацию результатов анализа активности циркулирующего тромбина по лизису ЭБ в рутинных исследованиях.
Пример 2. Определение активности циркулирующего тромбина по лизису эритроцитов барана. Тест проводят в 96-луночных плоскодонных иммунологических планшетах. Вначале по 25 мкл цитратной плазмы вносят в лунки, затем последовательно добавляют по 50 мкл вероналового буфера и 25 мкл суспензии стандартизованных (А620 =0,56 оптических единиц) в этом же буфере ЭБ. Параллельно ставят контроли: 3 контроля на полный лизис (25 мкл ЭБ + 75 мкл Н2О); 3 контроля на спонтанный лизис эритроцитов (25 мкл ЭБ + 75 мкл вероналового буфера). Тщательно перемешивают и сразу измеряют оптическую плотность на фотометре для иммуноферментного анализа при длине волны 620 нм (бланк устанавливают против воздуха). После измерения планшеты инкубируют при 37°С в течение 10 мин при постоянном перемешивании. После 10-ти мин инкубации измеряют оптическую плотность при тех же условиях, что описано выше. Проведено исследование циркулирующего тромбина в тесте активации комплемента в 40 пробах цитратной плазмы крови пациентов ФГБУ «НМИЦ ПМ» Минздрава России. Полученные результаты представлены в таблице 2.
Таблица 2
Тромбиновая активность цитратных плазм (ТАЦП) в тесте активации комплемента и лизиса эритроцитов барана (ЭБ)
|
Как видно из данных, представленных в таблице 2, в 14 пробах наблюдается лизис эритроцитов барана более 10%, что составляет 35% из тестированных 40 проб.
Таким образом, инкубация ЭБ с цитратными плазмами приводит к активации компонента С5 циркулирующим тромбином, генерированным в условиях in vivo, формированию мембрано-атакующего комплекса и лизису ЭБ. Присутствие цитрата натрия в пробе обеспечивает ингибирование активации по классическому пути начиная с С1 комплекса, активация которого иммунными комплексами зависит от присутствия ионов кальция. Отсутствие в среде ионов магния ингибирует формирование и активацию С3-конвертазы, а отсутствие С3-конвертазы также ингибирует формирование С5-концертазы классического пути активации системы комплемента. Полученные результаты убедительно доказывают четвертый путь активации системы комплемента - тромбиновый путь активации и формирования мембрано-атакующего комплекса и лизиса ЭБ.
Пример 3. Определение связывания тромбина с растворимыми фибрин-мономерными комплексами. Для подтверждения образования комплекса тромбина с растворимыми фибрин-мономерными комплексами были проведены следующие исследования. В опытных пробах цитратную плазму инкубировали 5 мин при 56°С для термокоагуляции фибриногена и растворимых фибрин-мономерных комплексов. Далее коагулированный фибриноген осаждали центрифугированием при 8000 об/мин. В супернатанте определяли тромбиновую активность в тесте активации комплемента по лизису ЭБ, как описано выше. В качестве контроля использовали исходные цитратные плазмы без термокоагуляции фибриногена. Полученные результаты представлены в таблице 3.
Таблица 3
Тромбиновая активность супернатанта цитратной плазмы после термокоагуляции фибриногена и исходной плазмы в тесте активации комплемента и лизиса ЭБ
|
Как видно из данных, представленных в таблице 3, тромбин полностью осаждается вместе с термокоагулированным фибриногеном/фибрином. Таким образом, полученные данные полностью подтверждают данные, полученные с тромбином, связанным с фибриновым сгустком, описанным в работе Waitz J.I.и соавт. (1998). Дополнительно были проведены исследования амидолитической активности исходных цитратных плазм (контроль) и супернатанта (опыт) после осаждения термокоагулированного фибриногена с использованием хромогенного субстрата тромбина и плазмина. Полученные результаты представлены в таблице 4.
Таблица 4
Амидолитическая активность тромбина и плазмина по гидролизу хромогенных субстратов в супернатанте (опыт) и в исходной плазме (контроль)
|
Как видно из данных, представленных в таблице 4, амидолитическая активность плазмина и тромбина в отличие от тромбиновой активности плазмы в тесте активации комплемента по лизису ЭБ существенно не меняется в супернатанте по сравнению с амидолитической активностью исходной цитратной плазмы. Интересные данные получены по амидолитической активности плазмина в супернатанте, где почти в 2 раза активность выше, чем в исходной плазме крови. При термокоагуляции фибриногена/фибрина, видимо, происходит диссоциация плазмина от фибриногена/фибрина и за счет этого возрастает амидолитическая активность плазмина в опытных пробах.
Пример 4. Определение чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути. Предварительно осадок эритроцитов человека 2 раза отмывали физ. раствором путем центрифугирования. Затем готовили 1% суспензию ЭЧ в физ. растворе. Тест проводят следующим образом. В опытную пробу добавляют 25 мкл цитратной плазмы с высокой активностью тромбина, связанного с фибрином, 50 мкл вероналового буфера и 25 мкл 1% суспензии ЭЧ. Параллельно ставят два контроля: контроль ЭЧ на спонтанный лизис (25 мкл 1% суспензии ЭЧ + 75 мкл вероналового буфера); контроль ЭЧ на полный лизис (25 мкл 1% суспензии ЭЧ + 75 мкл дистиллированной воды). Пробы инкубируют в течение 10 мин при 37°С при постоянном перемешивании. После инкубации определяют степень лизиса турбидиметрически при длине волны 620 нм. По калибровочному графику определяют степень лизиса в процентах.
Пример 5. Определение группы крови в тестированных эритроцитах человека. Во всех пробах ЭЧ (195 проб) определяют группу крови с использованием «Набора реагентов для определения групп крови человека систем АВО» (Цоликлон анти-А - моноклональные IgM к антигену А; Цоликлон анти-В - моноклональные IgM к антигену В) фирмы «Медиклон», Российская Федерация. Полученные результаты представлены на фиг. 2.
Как видно из данных, представленных на фиг.2, самыми чувствительными к лизису при активации системы комплемента оказались эритроциты группы А (в среднем 81,9% лизиса), на втором месте эритроциты группы крови АВ (в среднем 77,0% лизиса), на третьем месте эритроциты группы крови В (в среднем 44,3% лизиса). Наиболее устойчивыми к лизису оказались эритроциты группы крови 0 (в среднем 0,3%). Известно, что устойчивость ЭЧ к комплемент-опосредованному лизису обеспечивает в основном ингибитор мембрано-атакующего комплекса - CD59, который экспрессирован на клеточным мембранах органов и тканей, в частности, эритроцитов. Полученные результаты вносят весомый вклад для прогнозирования предрасположенности человека к реперфузионным повреждениям при сосудистых катастрофах.
Таким образом, разработан принципиально новый тест определения чувствительности ЭЧ к лизису при активации системы комплемента по тромбиновому пути. Тест может быть использован для прогнозирования определенных заболеваний в зависимости от устойчивости органов и тканей к комплемент-опосредованным повреждениям при высокой активности циркулирующего тромбина, связанного с фибрин-мономерными комплексами, а также для выбора тактики лечения при данных патологических состояниях.
Определение чувствительности эритроцитов человека (ЭЧ) к лизису при активации системы комплемента по тромбиновому пути, включающее использование цитратной плазмы с высокой активностью тромбина, связанного с фибрином, для этого в лунки иммунологических планшет с плоским дном предварительно вносят 25 мкл цитратной плазмы с высокой активностью тромбина, связанного с фибрином, 50 мкл вероналового буфера и 25 мкл 1% суспензии ЭЧ, в качестве контролей используют: контроль на полный лизис ЭЧ (25 мкл ЭЧ + 75 мкл НО) и контроль на спонтанный лизис ЭЧ (25 мкл ЭЧ + 75 мкл вероналового буфера), затем пробы тщательно перемешивают и инкубируют при перемешивании в термостате для иммунологических 96-ти луночных планшет при 37°С в течение 10 мин, после инкубации измеряют оптическую плотность проб на фотометре для иммуноферментного анализа при 620 нм, а степень лизиса ЭЧ определяют с использованием калибровочного графика, где 100% лизис представляет собой полный лизис ЭЧ при добавлении воды, а контроль ЭЧ на спонтанный лизис - 0% лизиса, далее определяют группу крови по ЭЧ с использованием стандартных гипериммунных анти-сывороток к эритроцитам группы крови А и В, где наиболее чувствительными ЭЧ являются ЭЧ группы А, на втором месте - АВ, на третьем месте - В и наименее чувствительными к лизису являются ЭЧ с группой крови 0.