Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА VP3 ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ
Вид РИД
Изобретение
Изобретение относится к ветеринарии, биотехнологии и генной инженерии и представляет собой способ получения белка VP3 вируса инфекционной бурсальной болезни (IBDV/infectious bursal disease virus).
Инфекционная бурсальная болезнь цыплят является одной из основных проблем в промышленном птицеводстве. Появление в конце 80-х гг. ХХ века высоковирулентных штаммов IBDV - возбудителя этой инфекции - привело к увеличению показателей смертности при вспышках бурсальной болезни до 90% в поголовье [1]. Важным моментом в контроле данного заболевания является выбор времени вакцинации молодых цыплят. Первые 2 недели после вылупления их защищают материнские антитела, и преждевременное введение вакцинного штамма может привести к нейтрализации вируса и низкой эффективности вакцинации [2]. Поэтому скрининг цыплят на иммунный статус до и после введения вируса крайне важен, а разработка эффективных тест-систем на основе иммуноферментного анализа остается актуальным вопросом.
Белок VP3 - это структурный компонент вириона IBDV, выполняющий роль каркасного белка при сборке капсида, а также связывающий геномную двухцепочечную РНК и РНК-зависимую РНК-полимеразу вируса [3]. Известно, что первые антитела, которые появляются у цыплят после заражения IBDV, направлены к белку VP3. И хотя существующие на настоящее время ИФА тест-системы на антитела к IBDV используют в качестве сорбированного антигена капсидный белок VP2, тесты на основе VP3 рассматриваются как потенциально более эффективные и менее дорогие в производстве [4].
Ближайшим аналогом (прототипом) заявляемого способа является способ получения рекомбинантных белков IBDV в клетках бактерии E.coli и в культуре растительных клеток согласно патенту US20020015708 A1 [5]. Однако, данный способ имеет ряд недостатков. В частности, фолдинг белка, функционирующего в норме в клетках животных, в бактериальных и растительных клетках может осуществляться неправильно. Также в гетерологичных системах отсутствуют условия для корректных посттрансляционных модификаций, что может влиять на иммуногенность белка.
Задачей заявляемого изобретения является решение актуальной проблемы - получение правильно фолдированного и высокоиммуногенного белка VP3.
Поставленная задача решается за счет использования в заявляемом способе для получения рекомбинантного белка VP3 клеток эмбриональной почки человека (линия Expi293F). В культурах клеток животных и, в частности, человеческих клеточных линиях, обеспечивается более правильный фолдинг целевого белка, облегчающий его получение в растворимой и активной форме, а также создаются условия для корректных посттрансляционных модификаций.
Сведений о получении стабильных линий клеток человека, продуцирующих рекомбинантный VP3, в доступных источниках информации не обнаружено.
Поставленную задачу решают путем:
- конструирования рекомбинантной плазмидной ДНК pEG-VP3-His, содержащей немедленно-ранний промотер цитомегаловируса и нуклеотидную последовательность, кодирующую зрелый белок VP3 с 6-гистидиновым участком на С-конце и стоп-кодоном (нуклеотидная последовательность гена VP3-His - SEQ ID № 1);
- либо конструирования рекомбинантной плазмидной ДНК pMC-IgL-VP3-His, содержащей немедленно-ранний промотер цитомегаловируса, нуклеотидную последовательность, кодирующую сигнальный пептид легкой цепи иммуноглобулина человека и нуклеотидную последовательность, кодирующую зрелый белок VP3 с 6- гистидиновым участком на С-конце и стоп-кодоном (нуклеотидная последовательность гена IgL-VP3-His - SEQ ID № 2);
- создания стабильной линии Expi293F/VP3-His, для чего проводят трансфекцию клеток линии Expi293F плазмидой pEG-VP3-His, отбирают клоны, растущие на селективном маркере G-418, анализируют клоны на продукцию рекомбинатного VP3 с помощью вестерн-блоттинга с окраской моноклональными антителами на гистидиновый тэг, переводят клетки целевого клона в суспензионную культуру и культивируют клеточную суспензию до высокой плотности;
- либо создания стабильной линии Expi293F/IgL-VP3-His, для чего проводят трансфекцию клеток линии Expi293F плазмидой pMC-IgL-VP3-His, отбирают клоны, растущие на селективном маркере G-418, анализируют клоны на продукцию рекомбинатного VP3 с помощью вестерн-блоттинга с окраской моноклональными антителами на гистидиновый тэг, переводят клетки целевого клона в суспензионную культуру и культивируют клеточную суспензию до высокой плотности.;
- получения цитоплазматической фракции клеток линии Expi293F/VP3-His и выделения из нее рекомбинантного белка VP3 с помощью аффинной хроматографии на колонке с сорбентом Ni-NTA-сефарозой;
- либо получения цитоплазматической фракции клеток линии Expi293F/IgL-VP3-His и выделения из нее рекомбинантного белка VP3 с помощью аффинной хроматографии на колонке с сорбентом Ni-NTA-сефарозой;
- анализа антигенной активности выделенного рекомбинантного VP3, для чего раствор белка гомогенизируют с масляным адъювантом АБ-4М, иммунизируют полученной эмульсией цыплят (по 7 голов в каждой опытной группе), в течение месяца с интервалом в 14 дней отбирают кровь, выделяют сыворотку и оценивают титры антител к вирусному белку с помощью диагностического ИФА-набора на IBDV (BioChek).
Заявляемое изобретение иллюстрируется следующими чертежами.
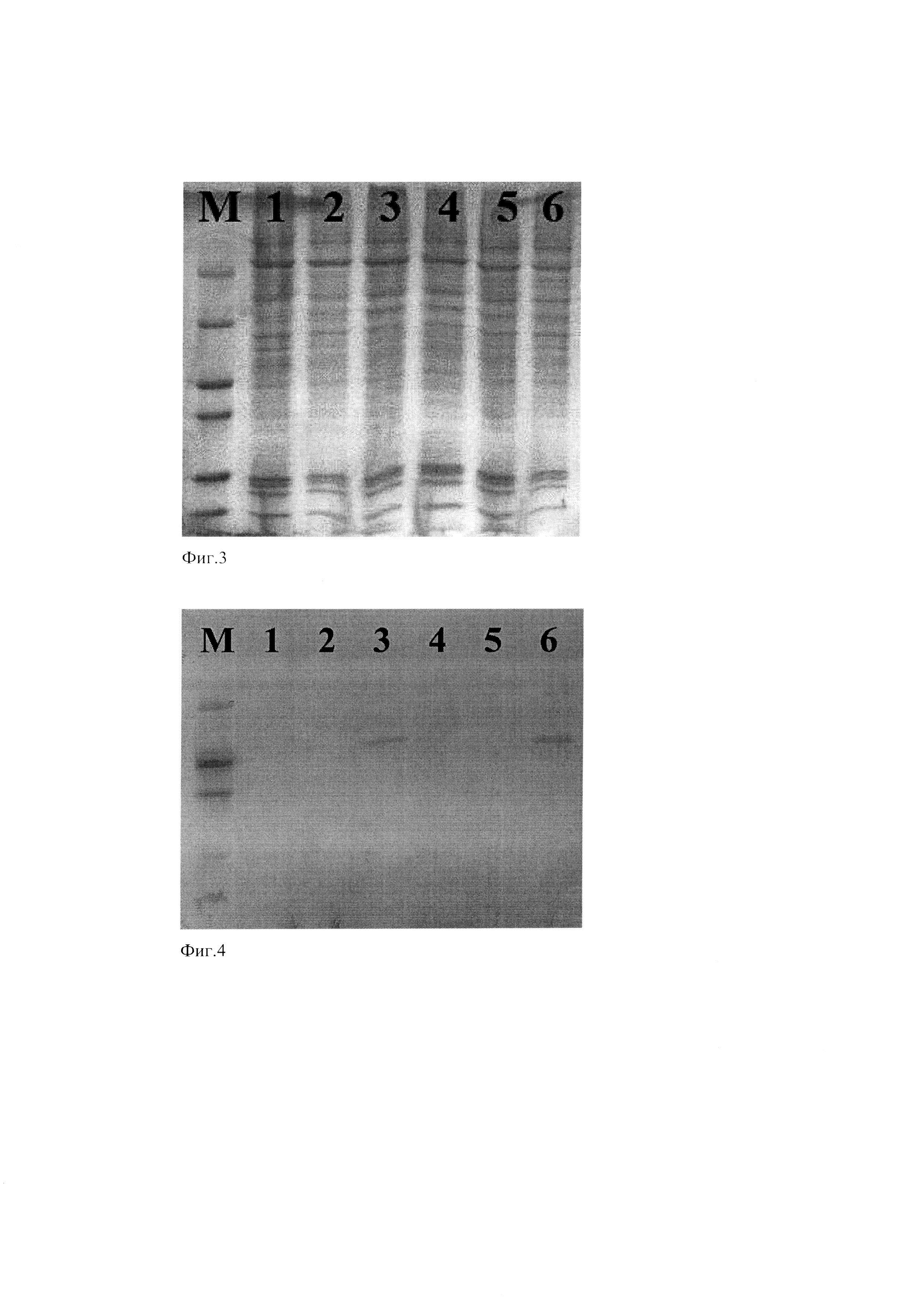
Фиг. 1. Физико-генетическая карта рекомбинантной плазмиды pEG-VP3-His.
Условные обозначения: VP3 - последовательность, кодирующая зрелую часть белка VP3 штамма DD1 IBDV, CMV IE-promoter - промотер немедленно-ранних генов цитомегаловируса, NeoR/KanR - ген, обеспечивающий устойчивость к неомицину и канамицину, SV40-promoter - промотер ранних генов вируса SV40, HindIII и BamHI - сайты рестрикции.
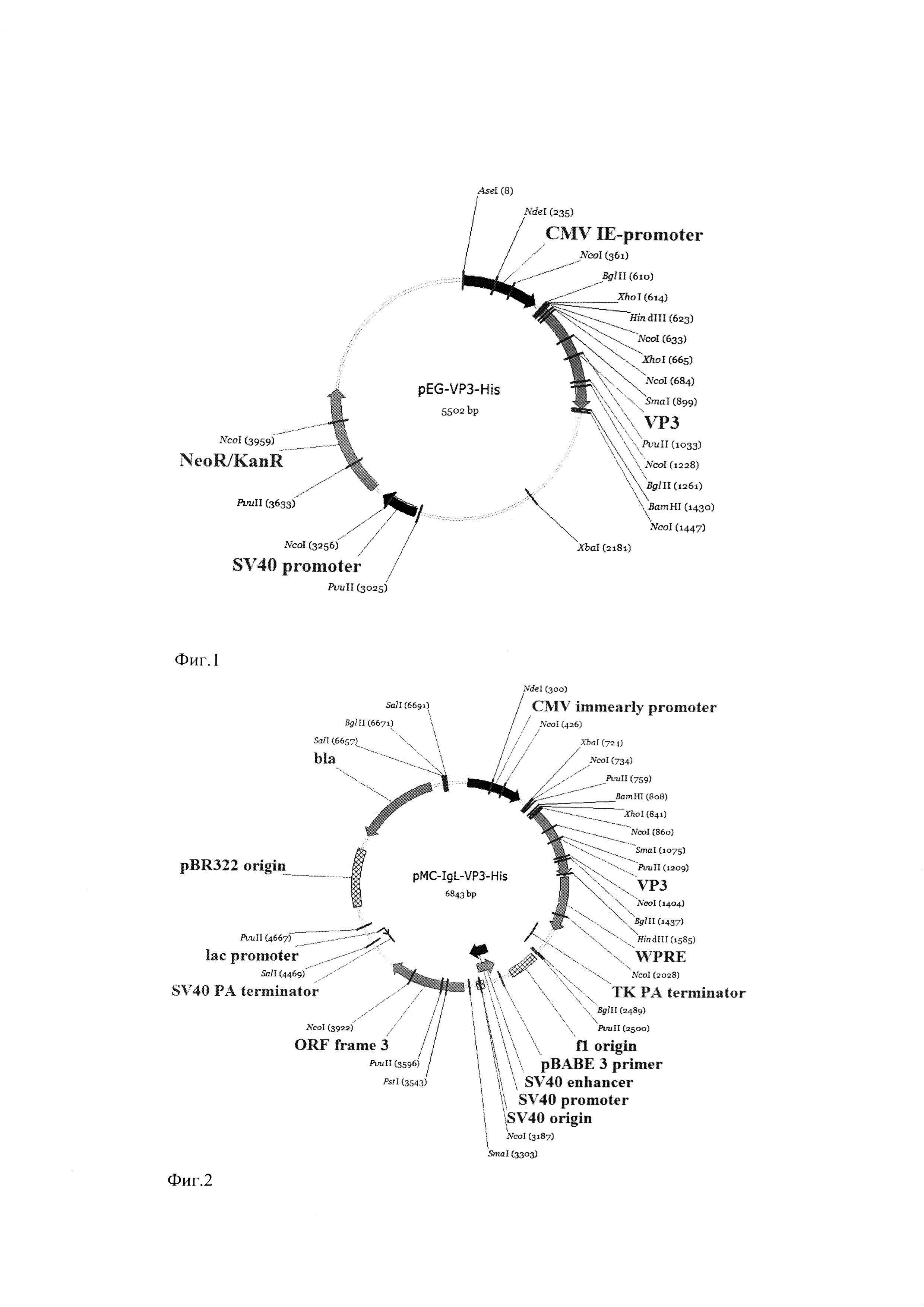
Фиг. 2. Физико-генетическая карта рекомбинантной плазмиды pMC-IgL-VP3-His.
Условные обозначения: VP3 - последовательность, кодирующая зрелую часть белка VP3 штамма DD1 IBDV, CMV immearly promoter - промотер немедленно-ранних генов цитомегаловируса, bla - ген бета-лактамазы, обеспечивающий устойчивость к ампициллину, BamHI и HindIII - сайты рестрикции.
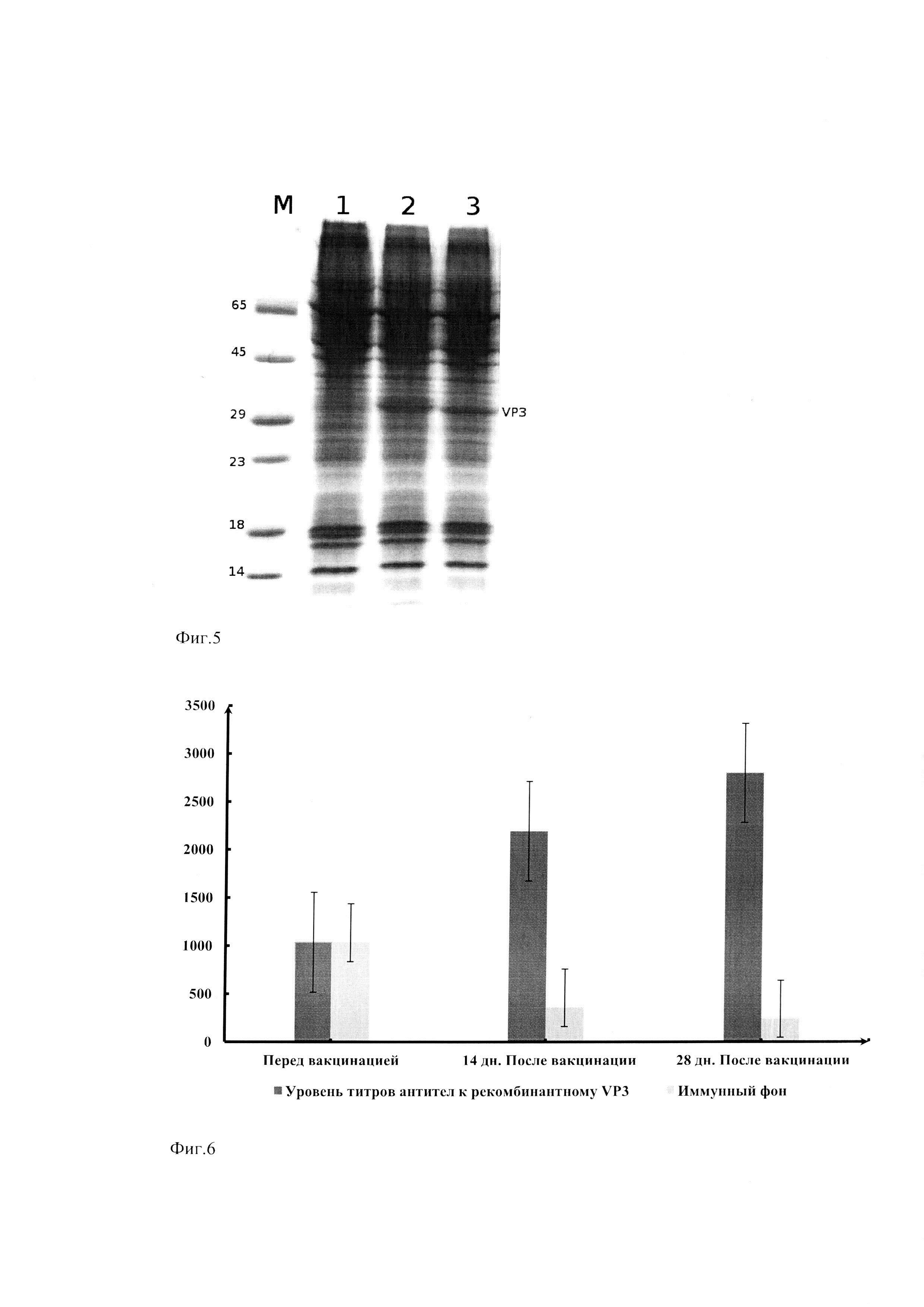
Фиг. З. Электрофоретическое разделение в денатурирующем 14% ПААГ белков клеточных фракций клонов линии Expi293F/VP3-His.
Условные обозначения: М - белковый маркер молекулярных масс (сверху вниз: 65 kDa, 45 kDa, 29 kDa, 23 kDa, 18 kDa, 14 kDa), 1-6 - клеточные фракции клонов линии Expi293F/VP3-His.
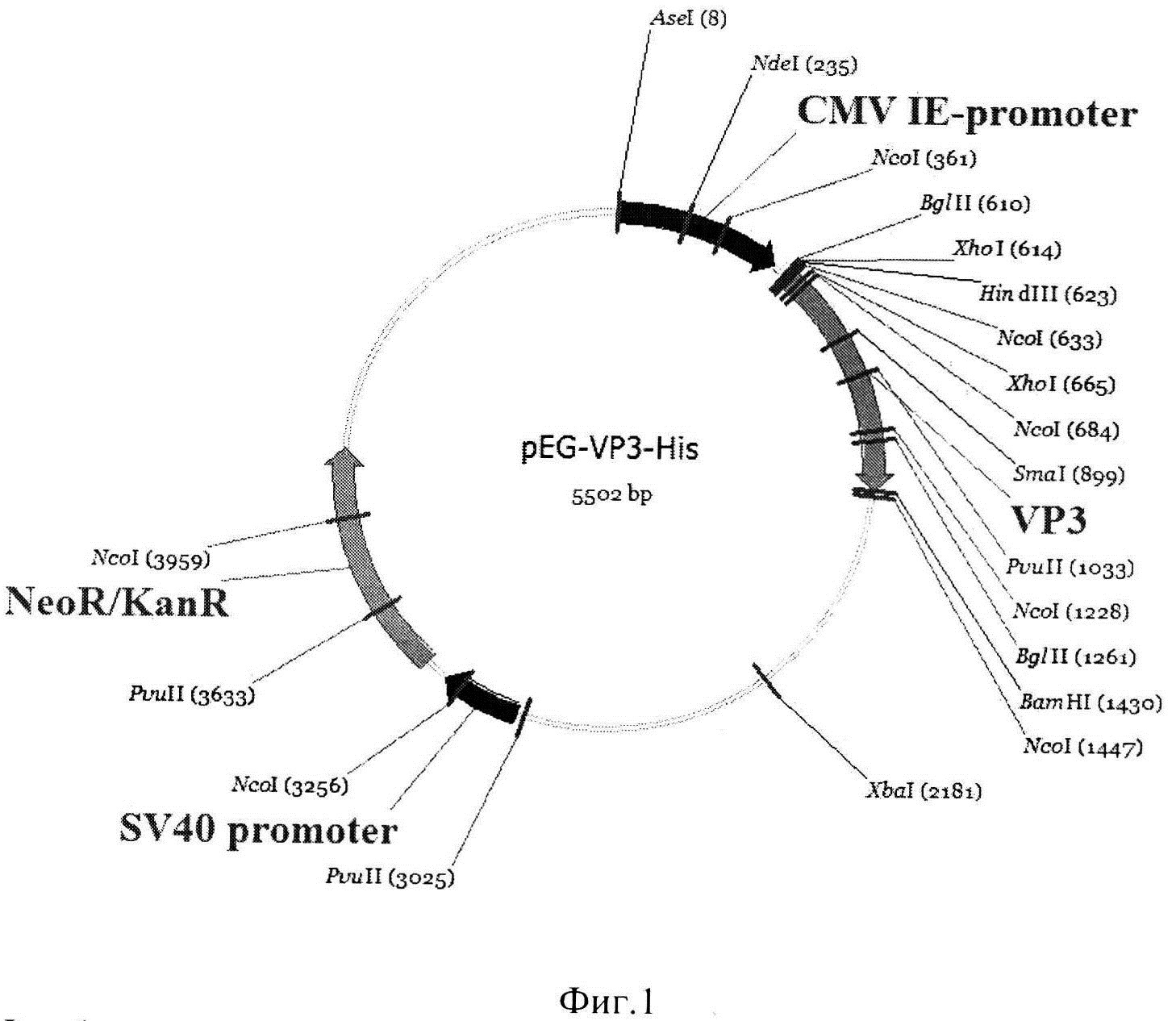
Фиг. 4. Результаты вестерн-блоттинга белков клеточных фракций клонов линии Expi293F/VP3.
Условные обозначения: М - белковый маркер молекулярных масс (сверху вниз окрашены: 45 kDa, 29 kDa, 23 kDa), 1-6 - клеточные фракции клонов линии Expi293F/VP3- His. Окрашены участки мембраны, соответствующие рекомбинантному VP3 в клонах 3 и 6. Перенос осуществляли на поливинилиденфторидовую мембрану (PVDF). Первичные антитела: мышиные моноклональные антитела к гистидиновому тэгу (Clontech). Вторичные антитела: анти-мышиные овечьи IgG, конъюгированные с пероксидазой хрена (Amersham). Проявление тетраметилбензидином (TMB).
Фиг. 5. Электрофоретическое разделение в денатурирующем 13,5% ПААГ белков клеточных фракций линий Expi293F/VP3-His и Expi293F/IgL-VP3-His.
Условные обозначения: 1. Клетки Expi293F. 2. Клетки Expi293F/IgL-VP3-His. 3. Клетки Expi293F/VP3-His.
Фиг. 6. Оценка антигенной активности рекомбинантного VP3.
Условные обозначения: Титры антител к IBDV (отложены по оси ординат) в сыворотке цыплят опытной (темно-серый цвет) и контрольной (светло-серый цвет) групп.
Ниже приведены примеры осуществления изобретения.
Пример 1. Конструирование рекомбинантной плазмиды pEG-VP3-His.
РНК вируса инфекционной бурсальной болезни выделяют из гомогената фабрициевых сумок цыплят, инфицированных высоковирулентным штаммом IBDV DD1, циркулирующим на территории России, с помощью набора ExtractRNA (Евроген, Россия). Перед выделением РНК гомогенат предварительно обрабатывают протеиназой К 1.5 часа при +45°С (конечные концентрации: протеиназа К - 0.5 мг/мл, SDS - 0.5%). Далее проводят реакцию обратной транскрипции с использованием праймеров, специфичных к 5'- и 3'- областям нуклеотидной последовательности, кодирующей VP3 (HiKoVP3f: 5'- gatcaagcttgccaccatggcatcagagttcaaagatacc /подчеркнут сайт рестрикции HindIII, жирным шрифтом выделен старт-кодон/ и BSH6VP3r: 5'-acgtggatectcaatggtgatggtgatgatgctcaaggtcctcatcagag /подчеркнут сайт рестрикции BamHI, жирным шрифтом выделен участок, кодирующий стоп-кодон, курсивом - последовательность, кодирующая 6 гистидинов/). Состав реакционной смеси: РНК IBDV - 100 нг, олигонуклеотид HiKoVP3f - 20 пкмоль, олигонуклеотид BSH6VP3r - 20 пкмоль, буфер для обратной транскрипции (конечная концентрация 50 mM Tris-HCl (pH 8.3 при +25°C), 50 mM KCl, 4 mM MgCl2, 10 mM DTT), ингибитор рибонуклеаз - 20 единиц, смесь dNTP - 1 mM каждого, M-MuLV обратная транскриптаза (Thermo Scientific) - 40 единиц. Смесь инкубируют 1 час при +42°C, после чего инактивируют фермент обратную транскриптазу прогревом до +70°C в течение 10 минут. Полученную кДНК используют в ПЦР для амплификации нуклеотидной последовательности, кодирующей VP3. Состав реакционной смеси: 1х Phusion HF буфер (Thermo Scientific), содержащий 1.5 mM MgCl2, смесь dNTP - 200 mkM каждого, олигонуклеотид HiKoVP3f - 100 пкмоль,
олигонуклеотид BSH6VP3r - 100 пкмоль, кДНК - 10 нг, Phusion High-Fidelity Taq- полимераза (Thermo Scientific) - 4 единицы активности на реакцию, mQ H2O (деионизованная) - до 200 мкл. Амплификацию проводят в условиях: предварительная денатурация +98°С - 30 сек, 30 циклов (денатурация +98°С - 10 сек, отжиг праймеров +60°С - 20 сек, элонгация +72°С - 1 мин.), заключительная элонгация +72°С - 5 мин. Полученную в ходе ПЦР ДНК наносят на 1% агарозный гель, проводят электрофорез, фрагмент, соответствующий размерам последовательности VP3, вырезают и очищают с помощью набора для выделения (Thermo Scientific).
Далее ампликон VP3 и плазмиду pEGFP-N1 обрабатывают эндонуклеазами рестрикции HindIII и BamHI. Состав реакционной смеси рестрикции: ампликон VP3 - 900 нг (или плазмида pEGFP-N1 - 500 нг), 10х буфер Tango Yellow+ (Fermentas (Литва); конечная концентрация в смеси: 33 mM Tris-acetate, pH 7.9, 10 mM Mg-acetate, 66 mM K- acetate, 0.1 мг/мл BSA) - 2 мкл, рестриктаза HindIII - 1 мкл (10 ед.акт.), рестриктаза BamHI - 1 мкл (10 ед.акт.), mQ H2O - до 20 мкл. Далее рестрицированную плазмиду и ампликон осаждают 2.5 объемами 96% этанола с добавлением 1/10 по объему ЗМ ацетата натрия (pH 5.0) в течение 30 минут на -70°C. Осадившуюся ДНК откручивают на центрифуге при 16000g в течение 10 минут, промывают 70% этанолом, центрифугируют еще 10 минут при 16000g и высушивают на вакуумном концентраторе. Далее плазмиду и нуклеотидный фрагмент растворяют в деионизованной воде, анализируют в агарозном геле и объединяют в молярном соотношении 1: 5 (плазмида:вставка) для лигирования. Полученную смесь расщепленных гена и плазмиды лигируют в течение 1 часа при +20°C. Состав реакционной смеси лигирования: 10х буфер для лигирования (Fermentas (Литва); конечная концентрация в смеси: 40 mM Tris-HCl, 10 mM MgCl2, 10 mM DTT, 2.5 mM АТР (pH 7.8 при +25°C)) - 2 мкл, рестрицированная плазмида pEGFP-N1 - 300 нг, рестрицированный фрагемент VP3 - 250 нг, Т4-лигаза - 1 мкл (5 ед.акт.), mQ H2O - до 20 мкл. Полученную лигазную смесь осаждают 2.5 объемами 96% этанола с добавлением 1/10 по объему ЗМ ацетата натрия (pH 5.0) в течение 30 минут на -70°C. Далее осажденную ДНК центрифугируют при 16000g в течение 10 мин, промывают 70% этанолом, центрифугируют еще 10 минут при 16000g и высушивают на вакуумном концентраторе. Далее лигазной смесью трансформируют компетентные клетки E.coli Top10 и рассевают на чашке Петри со средой LB с агаром, содержащей 150 мкг/мл ампициллина. Трансформацию проводят химическим методом: лигазную смесь добавляют в компетентные клетки, 30 минут инкубируют на ледяной бане, далее инкубируют 2 минуты при +42°C, потом добавляют 1 мл среды LB, 30 минут инкубируют при +37°C и рассевают клетки по чашке. Чашки инкубируют при +37°C в течение ночи.
На следующий день с чашек отбирают клоны на скрининг. Скрининг осуществляют с помощью ПЦР с использованием праймера, специфичного к вставке - HiKoVP3f (последовательность см. выше) и праймера, специфичного к плазмиде - EGFPNrev (5'-cggacacgctgaacttgtg). Состав реакционной смеси: 10х буфер для ПЦР (конечная концентрация в смеси: 75 mM Tris-HCl (pH 8.8 при +25°C), 20 mM (NH4)2SO4,
0. 01% (v/v) Tween 20) - 2 мкл, 25 mM MgCl2 (конечная концентрация - 2.5 mM) - 2 мкл, 1.25 mM dNTP (конечная концентрация - 0.125 mM) - 2 мкл, праймеры - по 5 pmol на реакцию каждого, клетки с колонии - 1 мкл на реакцию, Taq-полимераза - 5 ед.акт. на реакцию, mQ Н2О - до 20 мкл. ПЦР-положительные клоны рассевают на чашке Петри с агаризованной средой LB, содержащей 150 мкг/мл ампициллина. На следующий день моноклон с чашки пересевают в колбу со 150 мл жидкой среды LB с ампициллином (150 мкг/мл) и культивируют в течение ночи при +37°C. Из полученной культуры выделяют плазмиду с помощью набора для выделения QIAGEN Plasmid Maxi Kit (Qiagen). В результате получают плазмиду pEG-VP3-His в количестве 750 мкг. Соответствие структуры полученной плазмиды ожидаемой подтверждают путем секвенирования по методу Сэнгера с использованием капиллярного секвенатора AbiPrism 3730xl (Applied Biosystems, США)
Пример 2. Трансфекция линии Expi293F плазмидой pEG-VP3-His и получение стабильной линии, продуцирующей рекомбинантный VP3.
Клетки линии Expi293F культивируют в колбах Эрленмейера объемом 125 мл в 30 мл среды Expi293 Expression Medium (Gibco) на орбитальном шейкере Multitron Cell (Infors) с орбитой 2.5 см со скоростью 125 об/мин при 37°С в атмосфере 8% CO2 до достижения плотности культуры 3×106 клеток/мл. Жизнеспособность культуры, которая должна составлять не менее 95% живых клеток, контролируют с использованием автоматического счетчика клеток Luna-II (Logos Biosystems). Клетки рассевают так, чтобы в объеме 25.5 мл среды находилось 7.5×10 клеток. Для проведения трансфекции плазмидой pEG-VP3-His в одной пробирке к 1.5 мл среды Opti-MEM (Gibco) добавляют 30 мкг плазмиды. В другой пробирке к 1.5 мл среды Opti-MEM (Gibco) добавляют 80 мкл реагента ExpiFectamine™ 293 (Gibco) и инкубируют 5 мин при комнатной температуре. Далее к раствору ExpiFectamine™ 293 добавляют раствор плазмидной ДНК, аккуратно перемешивают и инкубируют 20 минут при комнатной температуре, после чего добавляют к клеткам и инкубируют 48-120 часов, контролируя наличие целевого белка при помощи денатурирующего электрофореза в полиакриламидном геле.
Для получения стабильной линии Expi293F, продуцирующей рекомбинантный VP3, через 48 часов после трансфекции клеток плазмидой pEG-VP3-His 100 мкл суспензии клеток добавляют в 10 см чашку Петри и культивируют в среде DMEM, содержащей 10% сыворотки эмбрионов коров и 250 мкг/мл антибиотика G-418 (Gibco). Через 7-10 дней отдельные клоны рассеивают в 12-ти луночные планшеты (Nunc) в 1 мл среды Expi293 Expression Medium (Gibco), содержащей 250 мкг/мл антибиотика G-418 и инкубируют, как описано выше, на орбитальном шейкере Multitron Cell (Infors). Через 120 часов проверяют наличие целевого белка при помощи денатурирующего электрофореза в полиакриламидном геле и последующего вестерн-блоттинга, отбирая клоны с высокой продукцией. Клон с наибольшей продукцией рекомбинантного VP3 засевают в колбу Эрленмейера объемом 125 мл в 30 мл среды Expi293 Expression Medium, растят 48 часов на орбитальном шейкере Multitron Cell (Infors) с орбитой 2.5 см со скоростью 125 об/мин при 37°С в атмосфере 8% CO2, после чего масштабируют препаративный нарост культуры клеток линии Expi293F/VP3 пересевом в 4 колбы Эрленмейера объемом по 500 мл со 125 мл среды Expi293 Expression Medium, содержащей 250 мкг/мл антибиотика G-418, в которых клетки растут 1 неделю до достижения необходимой плотности.
Пример 3. Выделение рекомбинантного VP3 из клеток линии Expi293F/VP3.
Клеточную массу осаждают из культуры путем центрифугирования при ускорении 500g и температуре +4°C в течение 10 минут. Супернатант отбрасывают, а осадок ресуспендируют в буферном растворе (20 мМ гидрофосфат натрия, 500 мМ хлорид натрия, 10 мМ имидазол, pH 7.5). Полученную суспензию подвергают обработке ультразвуковым излучением до разрушения клеток, регистрируемого визуально. Лизат центрифугируют при ускорении 15000g и температуре +4°C в течение 20 минут. Далее раствор наносят на хроматографическую колонку Tricorn 5/50 с сорбентом Ni Sepharose High Performance (GE Healthcare, США), уравновешенную буфером того же состава. После нанесения, колонку промывают и элюируют буфером с имидазолом (20 мМ гидрофосфат натрия, 500 мМ хлорид натрия, 500 мМ имидазол, pH 7.5). Контроль процесса осуществляют с помощью проточного измерения оптической плотности при длине волны 280 нм и электропроводности раствора, сходящего с колонки. Далее фракции выделенного белка анализируют в 13,5% ПААГ по Лэммли и измеряют концентрацию полученного рекомбинантного VP3 с помощью метода Брэдфорда. Количественный выход очищенного рекомбинантного VP3 с 1 литра культуры клеток - 20 мг/л. Соответствие аминокислотной последовательности полученного белка ожидаемой подтверждают путем анализа методом MALDI-TOF масс-спектрометрии.
Пример 4. Проверка антигенной активности рекомбинантного VP3.
Образцы для иммунизации получают в виде эмульсии методом гомогенизации водного (содержащего рекомбинантный VP3) и масляного компонентов с помощью гомогенизатора Ultra-Turrax T-25, соотношение водной и масляной фаз составляет 30:70.
Цыплят в количестве 14 голов разделяют на 2 группы (в каждой группе по 7 голов). Цыплят первой группы иммунизируют эмульсией рекомбинантного VP3, цыплят второй группы оставляют в качестве чистого контроля. Цыплят вакцинируют подкожно в среднюю часть шеи, доза введения препарата составляет 1,0 см . Перед иммунизацией, а также через 14 и 28 дней после иммунизации от цыплят берут кровь, получают пробы сывороток и оценивают антигенную активность по титрам антител в ИФА в соответствии с инструкцией по применению набора (BioChek) для выявления антител к вирусу IBDV. Образец считают антигенно активным, если через 28 суток после вакцинации при исследовании в ИФА титры поствакцинальных антител у 80% привитых цыплят не менее чем в 2 раза превышают минимальный положительный титр, указанный в инструкции по применению диагностикума. При этом прирост титров антител у цыплят контрольной группы за период опыта не должен наблюдаться.
Пример 5. Конструирование рекомбинантной плазмиды pMC-IgL-VP3-His.
Конструирование рекомбинантной плазмиды pMC-IgL-VP3-His проводят согласно примеру 1 за следующими исключениями: 1) для получения в ПЦР нуклеотидного фрагмента, кодирующего последовательность IgL-VP3-His используют пару праймеров: 52VP3eF (5'-acgtggatccgcatcagagttcaaagatacc, подчеркнут сайт рестрикции BamHI) VP3trH6R (5'-gatcaagcttctcaaggtcctcatcagagac, подчеркнут сайт рестрикции HindIII); 2) в реакциях рестрикции и лигирования используют плазмиду pHum-IgL-His и фрагмент IgL- VP3-His.
Пример 6. Трансфекция линии Expi293F плазмидой pMC-IgL-VP3-His и получение стабильной линии, продуцирующей рекомбинантный VP3.
Получение стабильной линии Expi293F/IgL-VP3-His проводят согласно примеру 2 за следующим исключением: вместо плазмиды pEG-VP3-His для трансфекции клеток Expi293F используют плазмиду pMC-IgL-VP3-His.
Этапы выделения рекомбинантного VP3 из клеток стабильной линии Expi293F/IgL- VP3-His и проверки его антигенной активности проводят согласно примерам 3 и 4.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Mahgoub H.A. An overview of infectious bursal disease. Arch. Virol., 2012, 157:2047-2057.
2. Muller H. et al. Current status of vaccines against infectious bursal disease. Avian Pathology, 2012, 41(2), 133-139.
3. Qin Y. & Zheng S.J. Infectious bursal disease virus-host interactions: multifunctional viral proteins that perform multiple and differing jobs. Int. J. Mol. Sci., 2017, 18, 161.
4. Wang M.-Y. et al. Development of an enzyme-linked immunosorbent assay for detecting infectious bursal disease virus (IBDV) infection based on the VP3 structural protein. Vet. Microbiol., 2008, 131, 229-236.
5. Патент США № 20020015708 A1.
Перечень последовательностей.
>> SEQ ID № 1
>> нуклеотидная последовательность VP3-His
>> длина 795 нук.
>> нук.1-3: старт-кодон
>> нук.4-774: последовательность, кодирующая зрелую часть VP3 IBDV DD1
>> нук.775-792: последовательность, кодирующая 6-гистидиновый тэг
>> нук.793-795: стоп-кодон

>> SEQ ID № 2
>> нуклеотидная последовательность IgL-VP3-His
>> длина 876 нук.
>> нук.1-3: старт-кодон
>> нук.4-78: последовательность, кодирующая сигнальный пептид легкой цепи иммуноглобулина человека
>> нук.79-855: последовательность, кодирующая зрелую часть VP3 IBDV DD1
>> нук.856-873: последовательность, кодирующая 6-гистидиновый тэг
>> нук.874-876: стоп-кодон