Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ НИОСОМАЛЬНОЙ ФОРМЫ ЦЕФОТАКСИМА
Вид РИД
Изобретение
Изобретение относится к медицине и биотехнологии, в частности к способу микрокапсулирования антимикробных препаратов в ниосомы. Может быть использовано в медицинской и ветеринарной практике при применении антибиотиков в составе ниосом, что снижает степень их инактивации и позволяет оптимизировать антимикробное действие за счет концентрации микровезикул на основе неионных ПАВ.
Известна система доставки биологически активных веществ с помощью ниосом, заключающаяся в интенсивном механическом перемешивании при комнатной температуре в течение 5 мин смеси ПЭГ-12 диметикона, масла авокадо, экстракта стволовых клеток и гиалуроновой кислоты. Недостатком данного способа является отсутствие сведений об эффективности включения действующих веществ в соответствующих препаратах [1].
Известна модификация способа получения ниосом с использованием обращенно-фазной отгонки, предложенная Luciani с соавт. Согласно этому способу смесь Span 60, Solulan С-24, стеарилового эфира поли-100-оксиэтилена, холестерина, N-пальмитоилглюкозамина диспергируется в водном растворе включаемого вещества (гадобенат димеглюмина). Затем полученный раствор нагревают на водяной бане при 90°C в течение 30 мин и подвергают воздействию ультразвукового дезинтегратора в течение 5 мин (амплитуда 10 мкм). Среднее значение размеров частиц дисперсии при этом составило 163-268 нм в зависимости от соотношения компонентов препарата. Эффективность включения действующего вещества в микровезикулы, определенная методом спектрофотометрии, находилась в пределах 4,6-8% от общего количества гадобенат димеглюмина (в молях), содержащегося в препарате. Недостатком данного способа является низкая эффективность включения действующего вещества в микровезикулы [2].
Известен способ получения ниосомальных препаратов, в соответствии с которым смесь сорбитана моностеарата, холестерина и дицетилфосфата (молярное соотношение 47,5:47,5:5 соответственно) растворяют в 15 мл Диэтилового эфира и эмульгируют в присутствии 2 мл водной фазы, содержащей действующее вещество (диклофенак натрия) в концентрации 5 мг/мл. Органический растворитель удаляют при пониженном давлении при комнатной температуре. Полученный гель затем гидратируют в присутствии 3 мл фосфатно-солевого буфера (pH 7,4). Смесь выдерживают при пониженном давлении до завершения гидратации. Эффективность включения действующего вещества составила 47,01±1,83% [3].
Рассмотренный способ имеет ряд существенных недостатков. В частности, в качестве органической фазы используется диэтиловый эфир, имеющий низкую температуру кипения, а также способный образовывать взрывоопасные смеси с воздухом и при хранении - нестойкие пероксиды, которые могут быть причиной самовоспламенения при комнатной температуре. В этом способе также отсутствует описание стандартизованных параметров температуры и времени этапа гидратации ниосомального геля, что может приводить к получению серий ниосомальных препаратов с разными показателями качества.
Наиболее близким изобретением к описываемому способу по технической сущности является способ получения ниосомальной формы офлоксацина путем обращенно-фазовой отгонки. Хлороформенный раствор сорбитана моностеарата, холестерина, полиэтиленгликоля-4000 и дицетилфосфата в молярном соотношении 35:27:1:5 соответственно, смешивают с 0,025 М раствором калия фосфорнокислого, содержащего офлоксацин в соотношении 5:1 по объему и эмульгируют с помощью ультразвукового дезинтегратора в течение 5 мин. Затем удаляют хлороформ путем отгонки при пониженном давлении с использованием роторного испарителя, к полученному ПАВ-липидному гелю добавляют 20% от первоначального объема водной фазы и проводят гидратацию геля в течение 1 ч при (50±1)°C, после чего дисперсию ниосом выдерживают при температуре (22±2)°С в течение 12 ч. Эффективность включения антибиотика составила 71,2% [4].
Рассмотренный способ имеет ряд недостатков, основными из которых является отсутствие стандартных условий обращенно-фазной отгонки и низкая эффективность включения для гидрофильных соединений, таких как антибиотики цефалоспоринового ряда.
Целью изобретения является разработка способа получения ниосомальной формы цефотаксима на основе неионных ПАВ.
Технический результат предлагаемого изобретения достигается путем оптимизации технологии конструирования ниосом, состава и соотношения структурообразующих компонентов. Применение в качестве основных структурных компонентов сложных эфиров стеариновой и олеиновой кислот в количестве до 60 мол. %, обеспечивает устойчивость дисперсии к окислению и высокую эффективность включения цефотаксима, а также биосовместимость и низкую токсичность. Введение в состав дисперсии дицетилфосфата индуцирует отрицательный заряд на поверхности ниосом, что препятствует агрегации везикул при хранении. Наличие в составе ниосом полиэтиленгликоля позволяет повысить эффективность включения антибактериальных препаратов в ниосомы и создает стерические препятствия для взаимодействия с белками in vivo, что способствует увеличению времени циркуляции ниосом в организме. Проведение трехэтапной обращенно-фазной отгонки позволяет эффективно и воспроизводимо удалить хлороформ из готового препарата, без неконтролируемого вскипания смеси.
Заявляемый способ обладает следующими отличительными от прототипа признаками:
- Стандартизованные условия обращенно-фазной отгонки;
- Контролируемое и полное удаление хлороформа из готового препарата;
- Поддержание постоянного pH препарата за счет использования буферного раствора в качестве водной фазы;
- Повышенная эффективность включения гидрофильных соединений;
- Высокая гомогенность ниосомальной дисперсии.
Способ осуществляется следующим образом.
Сорбитан моностеарата (Span 60), холестерин, полиэтиленгликоль-4000 и дицетилфосфат в молярном соотношении 60:34:5:1 растворяли при перемешивании в хлороформе (38 ммоль компонентов на 50 мл хлороформа). К смеси добавляли раствор цефотаксима (3 мг/мл) в 0,01 М фосфатно-солевом буфере pH 7,40, соотношение органической и водной фаз составляет 5:1. Смесь подвергают воздействию ультразвукового дезинтегратора (Soniprep 150, США) в течение 5 минут, амплитуда 7,5 мкм, частота 20 кГц. Эмульсию перемещают в круглодонную колбу с тефлоновой мешалкой и отгоняют хлороформ на роторном испарителе в режиме в течение 20 минут при давлении 0,175 Бар, температуре (26±1)°С и 150 оборотах в минуту, затем 25 минут при давлении 0,175 Бар, температуре (55±1)°С, 200 оборотах в минуту. Далее к смеси добавляют 20% первоначального объема водной фазы и продолжают отгонку в течение 45 минут при давлении 0,175 Бар, температуре (26±1)°С и 140 оборотах в минуту. Препарат переносят в чистую посуду и оставляют при (20±5)°С на 12 ч.
Определение эффективности включения препарата в ниосомы осуществляли по следующей методике.
К навеске ниосом с включенным в них цефотаксимом добавляют 4-кратный объем изопропилового спирта, выдерживают в течение 15 минут и тщательно перемешивали. Затем фильтровали через фильтр с размером пор 0,22 мкм и центрифугировали при 2700 g в течение 10 минут. Супернатант использовали для количественного анализа содержания цефотаксима. Количественный анализ на содержание антибиотика проводили методом обращенно-фазовой высокоэффективной жидкостной хроматографией и использованием калибровочных растворов цефотаксима в качестве стандарта. Проводят не менее пяти измерений для каждого раствора. Эффективность включения антибиотика определяют относительно исходной концентрации по формуле:
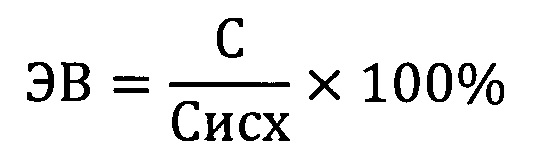
где ЭВ - эффективность включения цефотаксима в ниосомы, %; С - концентрация антибиотика в супернатанте, мг/мл; Сисх - исходная концентрация антибиотика в растворе, мг/мл.
Визуализация частиц в составе препарата проводится методом сканирующей зондовой микроскопии в электронном микроскопе для биологических исследований «EVO LS 10» («Carl Zeiss», NTS Германия).
Для получения препаратов пригодных к изучению в электронном микроскопе взвесь везикул разводили в дистиллированной воде по стандарту мутности Государственного НИИ стандартизации и контроля медицинских и биологических препаратов (ГИСК) им. Л.А. Тарасевича. За единицу мутности была принята мутность суспензии живых клеток бактерий-возбудителей тифа в физиологических растворах, содержащих в 1 мл 100 млн клеток. Полученный раствор соответствующей мутности затем разводили водой I типа в соотношении 1:50 по объему. На двухсторонний углеродный диск наносили 1 мкл полученной взвеси, равномерно распределяя по поверхности. Полученные препараты высушивали на воздухе и сканировали в электронном микроскопе для определения формы и размера микрочастиц.
Расчет индекса полидисперсности определяли по формуле:
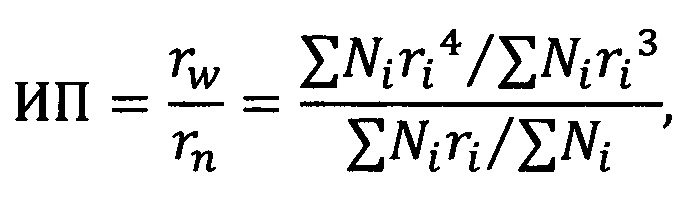
где rw - среднемассовый радиус, rn - среднечисленный радиус, Ni - общее количество измеренных микровезикул, ri - результат отдельного измерения радиуса частицы.
Исследование гомогенности дисперсий с помощью проточной цитометрии проводили на приборе «Attune». Параметры измерения: объем пробы - 300 мкл, скорость потока - 100 мкл/мин. Условия прекращения регистрации: 10000 частиц, 5 мин. Для анализа результатов выбирают следующие оси соответствующих гистограмм: VL1-H - VL2-H.
Возможность практического применения заявленного способа подтверждается примерами его конкретного выполнения с использованием совокупности заявляемых признаков.
Пример 1.
В 50 мл хлороформа растворяли при перемешивании 0,4902 г сорбитана моностеарата (Span 60), 0,2567 г холестерина, 0,2567 г полиэтиленгликоля PEG-4000 и 0,2567 г дицетилфосфата в молярном соотношении составляют 60:34:5:1 соответственно. К смеси добавляли 10 мл раствор цефотаксима (3 мг/мл) в 0,01 М фосфатно-солевом буфере pH 7,40. Смесь подвергают воздействию ультразвукового дезинтегратора (Soniprep 150, США) в течение 5 минут, амплитуда 7,5 мкм, частота 20 кГц. Эмульсию перемещают в круглодонную колбу с тефлоновой мешалкой и отгоняют хлороформ на роторном испарителе в режиме в течение 20 минут при давлении 0,175 Бар, температуре (26±1)°С и 150 оборотах в минуту, затем 25 минут при давлении 0,175 Бар, температуре (55±1)°С, 200 оборотах в минуту. Далее к смеси добавляют 2 мл воды I типа и продолжают отгонку в течение 45 минут при давлении 0,175 Бар, температуре (26±1)°С, 140 оборотах в минуту. Препарат переносят в чистую посуду и оставляют при (20±5)°С на 12 ч.
Эффективность включения цефотаксима составила 63,7±1,2%. Опытные препараты ниосом содержат сферические или овальные микровезикулы со средним размером частиц 280±45 нм. Индекс полидисперсности препаратов составил 0,21; частицы на гистограмме VL1-H - VL2-H формируют одну субпопуляцию.
Пример 2.
Отличается от примера 1 тем, что молярное соотношение сорбитана моностеарата, холестерина, ПЭГ-4000 и дицетилфосфата было 50:44:5:1.
Эффективность включения цефотаксима составила 55,3±1,5%. Опытные препараты ниосом содержат сферические или овальные микровезикулы со средним размером частиц 248±50 нм. Индекс полидисперсности препаратов составил 0,20; частицы на гистограмме VL1-H - VL2-H формируют одну субпопуляцию.
Пример 3.
Отличается от примера 1 тем, что молярное соотношение сорбитана моностеарата, холестерина, ПЭГ-4000 и дицетилфосфата было 40:54:5:1.
Эффективность включения цефотаксима составила 49,2±1,3%. Опытные препараты ниосом содержат сферические или овальные микровезикулы со средним размером частиц 275±48 нм. Индекс полидисперсности препаратов составил 0,22; частицы на гистограмме VL1-H - VL2-H формируют одну субпопуляцию.
Пример 4.
Отличается от примера 1 тем, что вместо сорбитана моностеарата (Span 60) использовали сорбитан моноолеат (Span 80).
Эффективность включения цефотаксима составила 51,1±2,2%. Опытные препараты ниосом содержат сферические или овальные микровезикулы со средним размером частиц 288±42 нм. Индекс полидисперсности препаратов составил 0,19; частицы на гистограмме VL1-H - VL2-H формируют одну субпопуляцию.
Пример 5.
Отличается от примера 1 тем, что вместо сорбитана моностеарата (Span 60) использовали Tween 60.
Эффективность включения цефотаксима составила 25,7±1,4%. Опытные препараты ниосом содержат сферические или овальные микровезикулы со средним размером частиц 252±55 нм. Индекс полидисперсности препаратов составил 0,21; частицы на гистограмме VL1-H - VL2-H формируют одну субпопуляцию.
Таким образом, была разработана методика получения ниосомальной формы цефотакима путем обращенно-фазовой отгонки с высокой эффективностью инкапсуляции действующего вещества ((до 63,7±1,2%)).
Используемая литература
1. Патент РФ №2320323. Опубликован 27.03.2008 Бюл. №9.
2. Luciani A., Olivier J.-C, Clement О., Siauve N., Brillet P.-Y., Bessoud В., Gazeau F., Uchegbu I., Kahn E., Frija G., Cuenod C. Glucose-Receptor MR imaging of tumors: study in mice with PEGylated paramagnetic niosomes // Radiology - 2004. - V. 231 (1). - P. 135-142.
3. Marwa A., Omaima S., Hanaa E.-G., Mohammed A.-S. Preparation and in-vitro evaluation of diclofenac sodium niosomal formulations // IJPSR - 2013. - V. 4 (5). - P. 1757-1765.
4. Патент РФ №2583135. Опубликован 10.05.2016 Бюл. №13.
Способ получения ниосомальной формы цефатоксима путем обращенно-фазовой отгонки, отличающийся тем, что хлороформенный раствор сорбитана моностеарата (Span 60), холестерина, полиэтиленгликоля-4000 и дицетилфосфата в молярном соотношении 60:34:5:1 соответственно (38 ммоль компонентов на 50 мл хлороформа) смешивали с раствором цефотаксима (3 мг/мл) в 0,01 М фосфатно-солевом буфере pH 7,4 в соотношении органической и водной фаз 5:1, затем смесь подвергают воздействию ультразвукового дезинтегратора течение 5 минут, амплитуда 7,5 мкм, частота 20 кГц, эмульсию перемещают в круглодонную колбу с тефлоновой мешалкой и отгоняют хлороформ на роторном испарителе в течение 20 минут при давлении 0,175 Бар, температуре (26±1)°C и 150 оборотах в минуту, затем 25 минут при давлении 0,175 Бар, температуре (55±1)°C, 200 оборотах в минуту, далее к смеси добавляют 20% первоначального объема водной фазы и продолжают отгонку в течение 45 минут при давлении 0,175 Бар, температуре (26±1)°C и 140 оборотах в минуту, препарат переносят в чистую посуду и оставляют при (20±5)°C на 12 ч.
