Результат интеллектуальной деятельности: СОКРИСТАЛЛЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки США под номером 61/892002, зарегистрированной 17 октября 2013 г., которая включена во всей ее полноте в данный контекст путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к со-кристаллам ингибиторов ДНК-зависимой протеинкиназы (DNA-PK). Данное изобретение также относится к включающим их фармацевтическим композициям и способам использования со-кристаллов и композиций при лечении ракового заболевания.
Предпосылки создания изобретения
Ионизирующее излучение (IR) вызывает множество повреждений ДНК, из которых двухцепочечные разрывы (DSBs) являются наиболее цитотоксическими. Эти DSBs могут приводить к гибели клетки путем апоптоза и/или митотической катастрофы, если быстро и полностью не подвергаются репарации. В дополнение к IR, некоторые химиотерапевтические агенты, включающие ингибиторы топоизомеразы II, блеомицин и доксорубицин, также провоцируют DSBs. Эти ДНК-повреждения инициируют комплексный набор сигналов через посредство сети ответных реакций на ДНК-повреждение, которая действует на репарацию поврежденной ДНК и поддерживание жизнеспобности клетки и геномной стабильности. В случае клеток млекопитающих, доминирующий путь репарации DSBs представляет собой путь соединения негомологичных концов (NHEJ). Этот путь действует независимо от фазы клеточного цикла и не требует матрицы для повторного лигирования концов разорванной ДНК. NHEJ требует координации многих белков и путей передачи сигналов. Коровая структура NHEJ состоит из гетеродимера Ku70/80 и каталитической субъединицы ДНК-зависимой протеинкиназы (DNA-PKcs), которые вместе охватывают активный комплекс DNA-PK-фермент. DNA-PKcs представляет собой член фосфатидилинозитол-3-киназа-зависимой киназы (PIKK) семейства серин/треонинпротеинкиназ, которое также включает мутированную ataxia telangiectasia (ATM), ataxia telangiectasia и Rad3-зависимую ataxia telangiectasia (ATR), mTOR и четыре изоформы PI3K. Однако, так как DNA-PKcs находится в том же самом семействе протеинкиназ, как АТМ и АТR, эти последние киназы действуют на репарацию ДНК-повреждения через посредство пути гомологичной рекомбинации (HR) и ограничены для фаз S и G2 клеточного цикла. Тогда как АТМ также рекрутируется на участки DSBs, ATR рекрутируется на участки разрывов одноцепочечной ДНК.
Полагают, что NHEJ действует через посредство трех ключевых стадий: распознавание DSBs, процессинг ДНК для удаления нелигируемых концов или других форм повреждения у концов, и, в заключение, лигирование ДНК-концов. Распознавание DSB осуществляется путем связывания Ku-гетеродимера с оборванными концами ДНК с последующим рекрутментом двух молекул DNA-PKs на соседние участки DSB; это служит для защиты концов разрывов до рекрутирования дополнительных процессинг-ферментов. Недавно полученные данные подтверждают гипотезу, что DNA-PKcs фосфорилирует процессинг-фермент, Artemis, так же как сама по себе, до получения ДНК-концов для дополнительного процессинга. В некоторых случаях ДНК-полимераза может быть необходима для синтеза новых концов до стадии лигирования. Полагают, что автофосфорилирование DNA-PKcs вызывает конформационное изменение, которое открывает центральную ДНК-связывающую полость, освобождает DNA-PKcs от ДНК и облегчает окончательное повторное лигирование концов ДНК.
В течение некоторого времени известно, что DNA-PK-/--мыши являются гиперчувствительными к воздействиям IR и что некоторые неселективные, имеющие небольшую молекулу, ингибиторы DNA-PKcs могут радиосенсибилизировать множество типов опухолевых клеток через широкий набор генетических фонов. Тогда как полагают, что ингибирование DNA-PK в некоторой мере радиосенсибилизирует нормальные клетки, это наблюдают в меньшей степени, чем в случае опухолевых клеток, вероятно, вследствие того факта, что опухолевые клетки обладают более высокими базальными уровнями эндогенного репликационного стресса и ДНК-повреждения (онкогенно-индуцированный репликационный стресс) и механизмы ДНК-репарации являются менее эффективными в опухолевых клетках. Наиболее важно, улучшенный терапевтический интервал с более сильным сохранением нормальной ткани должен быть получен от комбинации DNA-PK-ингибитор вместе с новыми улучшениями в отношении точной подачи сфокусированного IR, включая направленную на «образ» радиотерапию (IGRT) и модулированную по интенсивности радиотерапию (IMRT).
Ингибирование DNA-PK-активности индуцирует эффекты как в циклирующих клетках, так и также в нециклирующих клетках. Это очень важно, так как большинство клеток в солидной опухоли не является активно реплицирующим в любой данный момент, что ограничивает эффективность многих агентов, нацеливаемых на клеточный цикл. Равным образом представляют интерес недавние сообщения, которые наводят на мысль о сильной связи между ингибированием NHEJ-пути и способностью нейтрализовать радиорезистентные раковые стволовые клетки (CSCs). В случае некоторых опухолевых клеток показано, что DSBs в «дремлющих» CSCs преобладающе активируют репарацию ДНК через посредство NHEJ-пути; полагают, что CSCs обычно присутствуют в неподвижной фазе клеточного цикла. Это может объяснять тот факт, почему часть пациентов с раковым заболеванием может испытывать локальный или отдаленный рецидив опухоли вопреки лечению, так как текущие стратегии неспособны эффективно нацеливаться на CSCs. DNA-PK-ингибиторы могут обладать способностью сенсибилизировать эти потенциальные метастатические клетки-предшественники к воздействиям IR и подбирать DSB-индуцирующие химиотерапевтические агенты.
В отношении вовлечения DNA-PK в процессы репарации ДНК, ингибирующие DNA-PK лекарственные средства могут действовать как агенты, которые усиливают эффективность как противораковой химиотерапии, так и радиотерапии. Настоящее изобретение относится к кристаллическим композициям ингибиторов DNA-PK вместе с образователями со-кристаллов (CCF), то есть, со-кристаллам. По сравнению с их свободной(ыми) формой(ами), со-кристаллы согласно настоящему изобретению являются полезными, так как эти соединения обладают улучшенным растворением, более высокой растворимостью в воде и более высокой физической стабильностью в твердом состоянии, чем аморфные дисперсии. Со-кристаллы, описанные в данном контексте, также обеспечивают уменьшенный объем лекарственной формы и, следовательно, меньшую массу таблеток, так как эти со-кристаллы также проявляют более высокие объемные плотности по отношению к аморфным формам. Далее, со-кристаллы согласно данному изобретению обеспечивают преимущества получения по отношению к аморфным формам, которые требуют сушки распылением, лиофилизации или преципитации.
Краткое описание графического материала
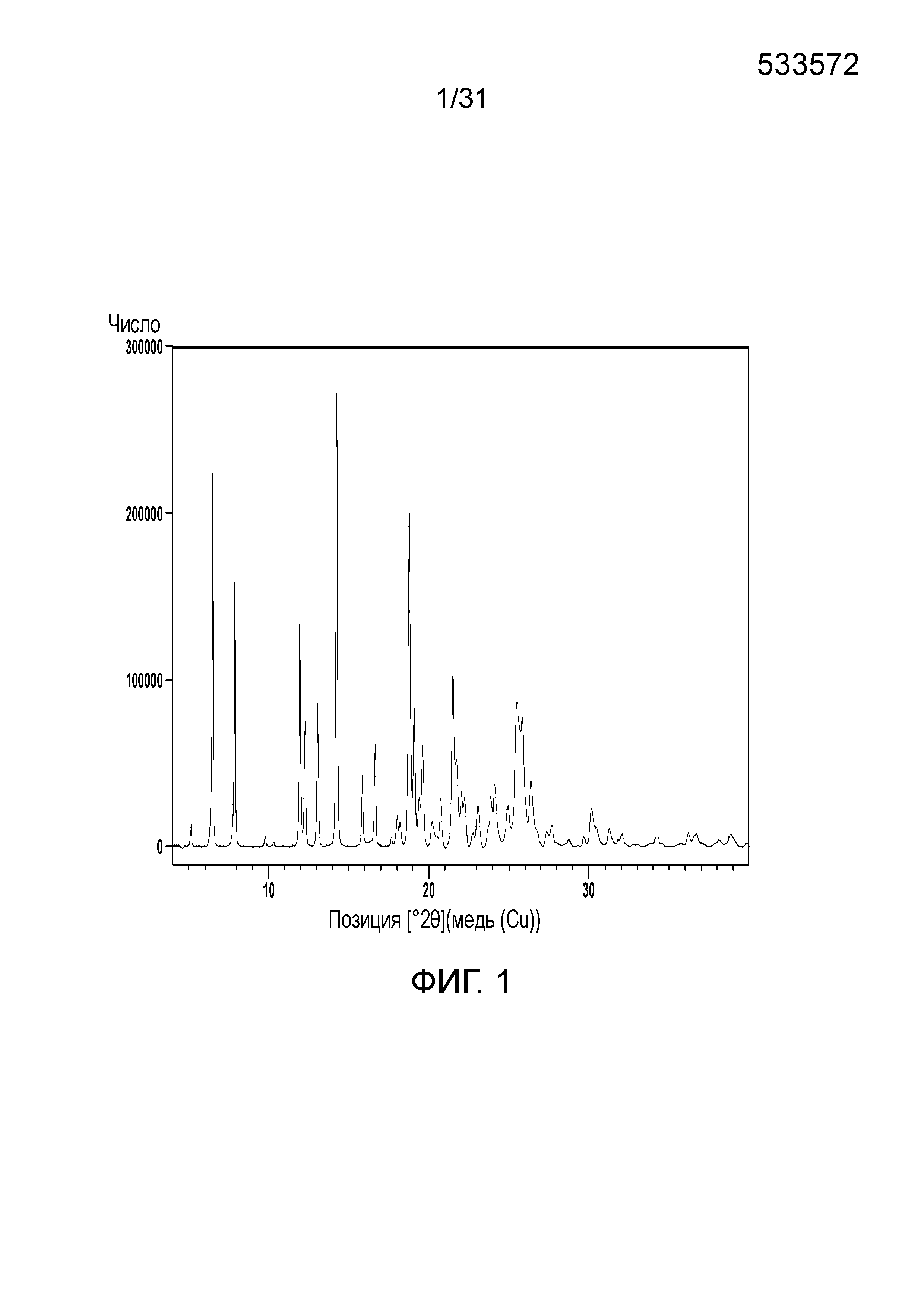
На фиг.1 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и адипиновой кислотой (АА).
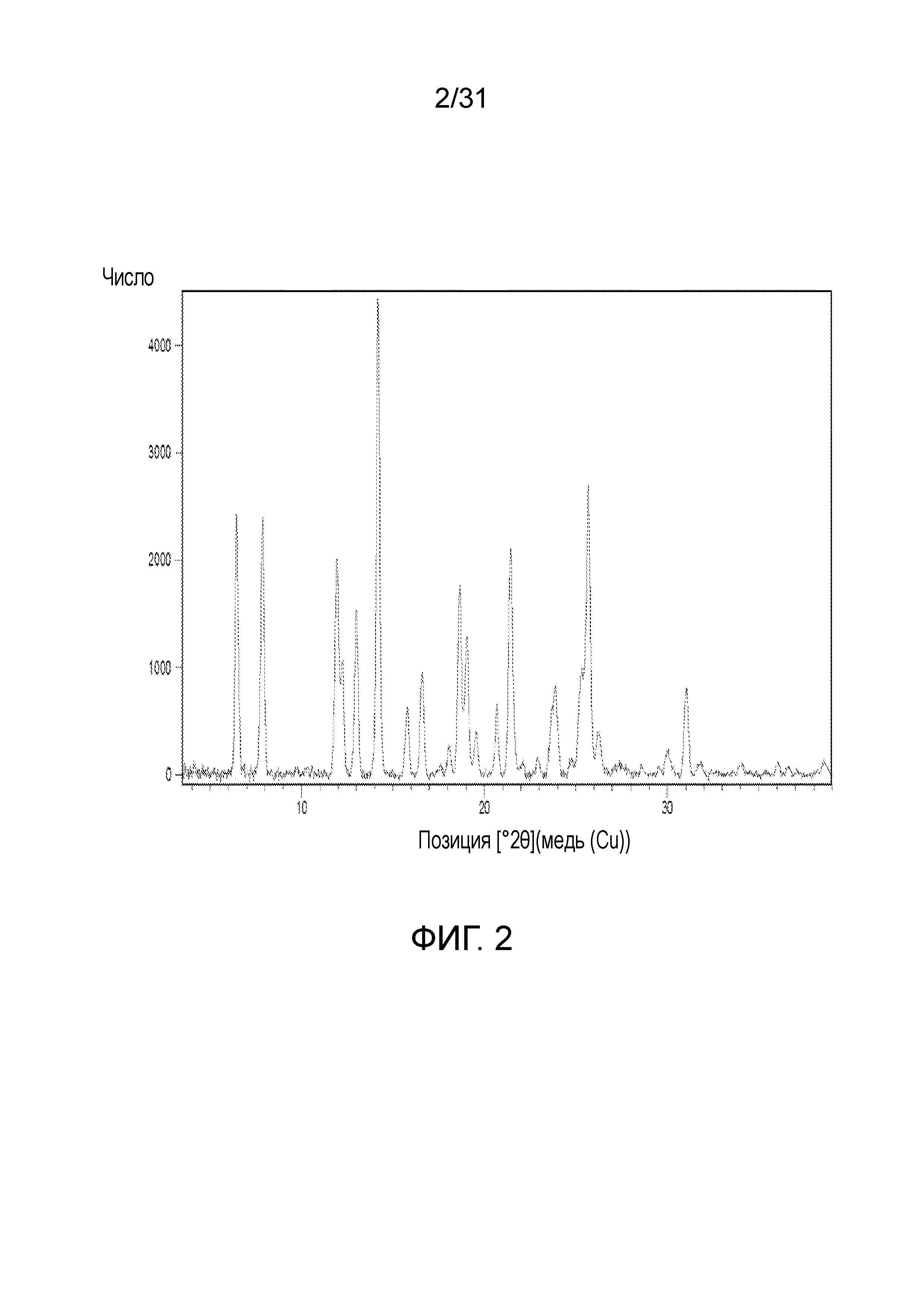
На фиг.2 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 2 и адипиновой кислотой.
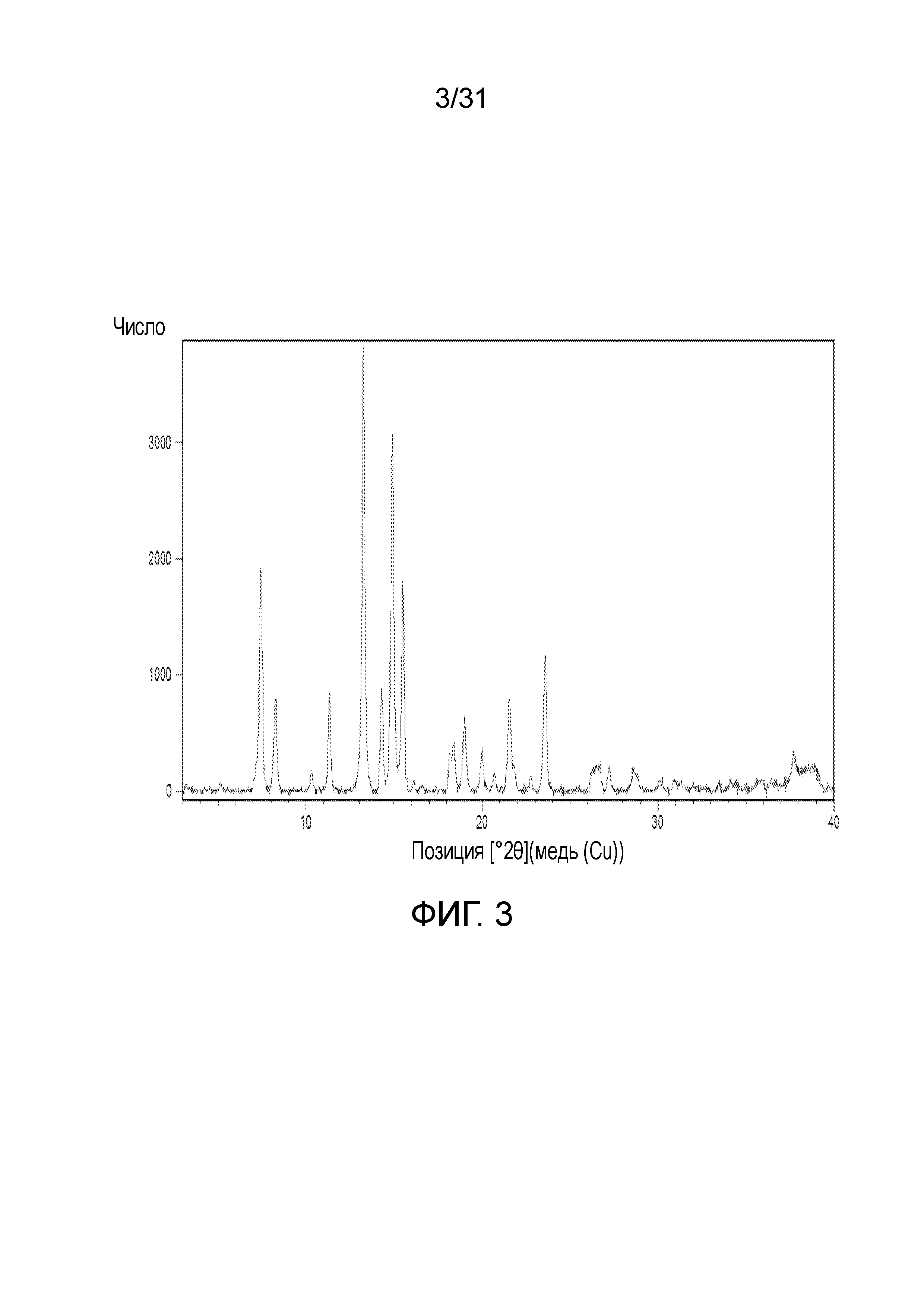
На фиг.3 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и лимонной кислотой.
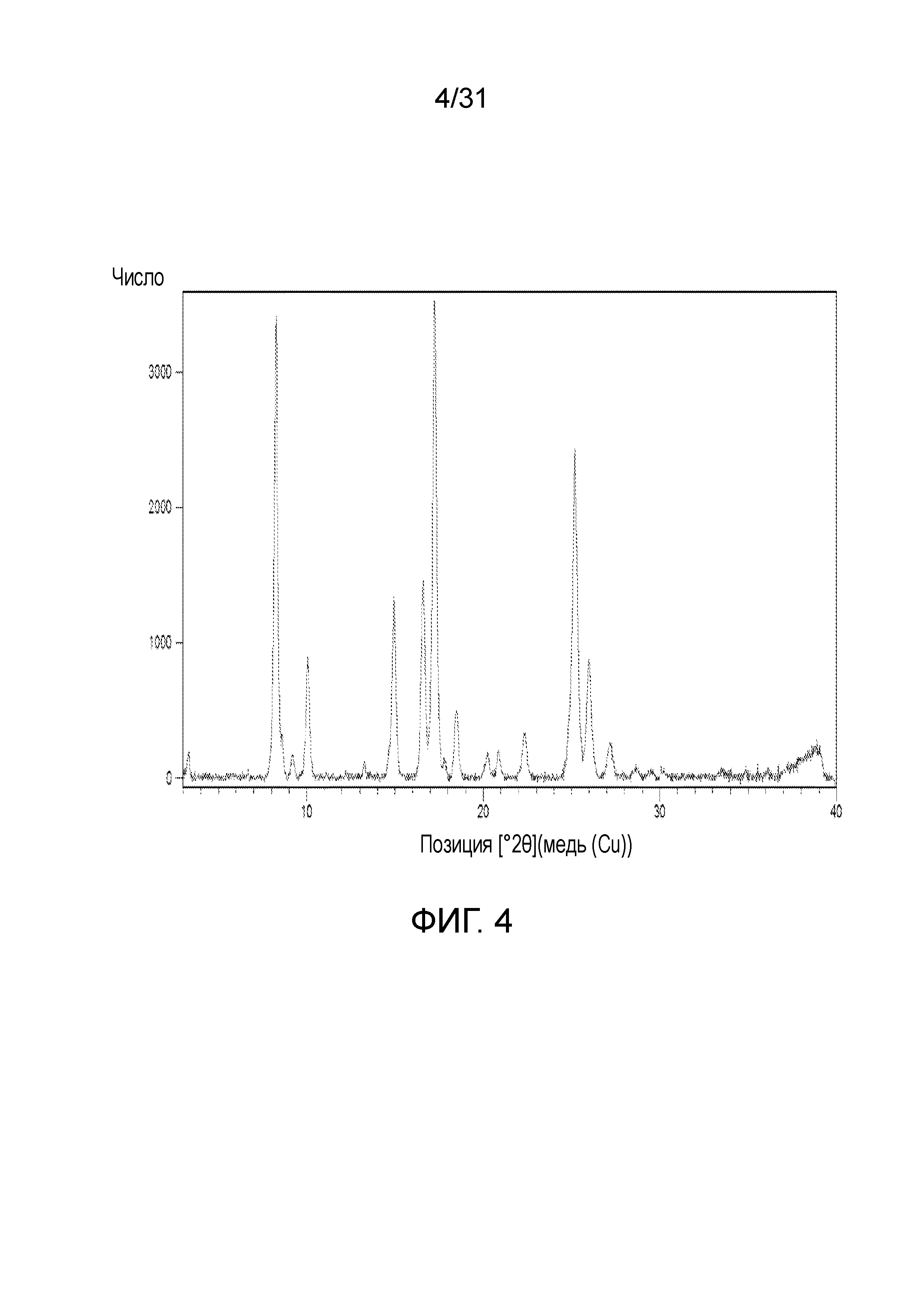
На фиг.4 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и фумаровой кислотой.
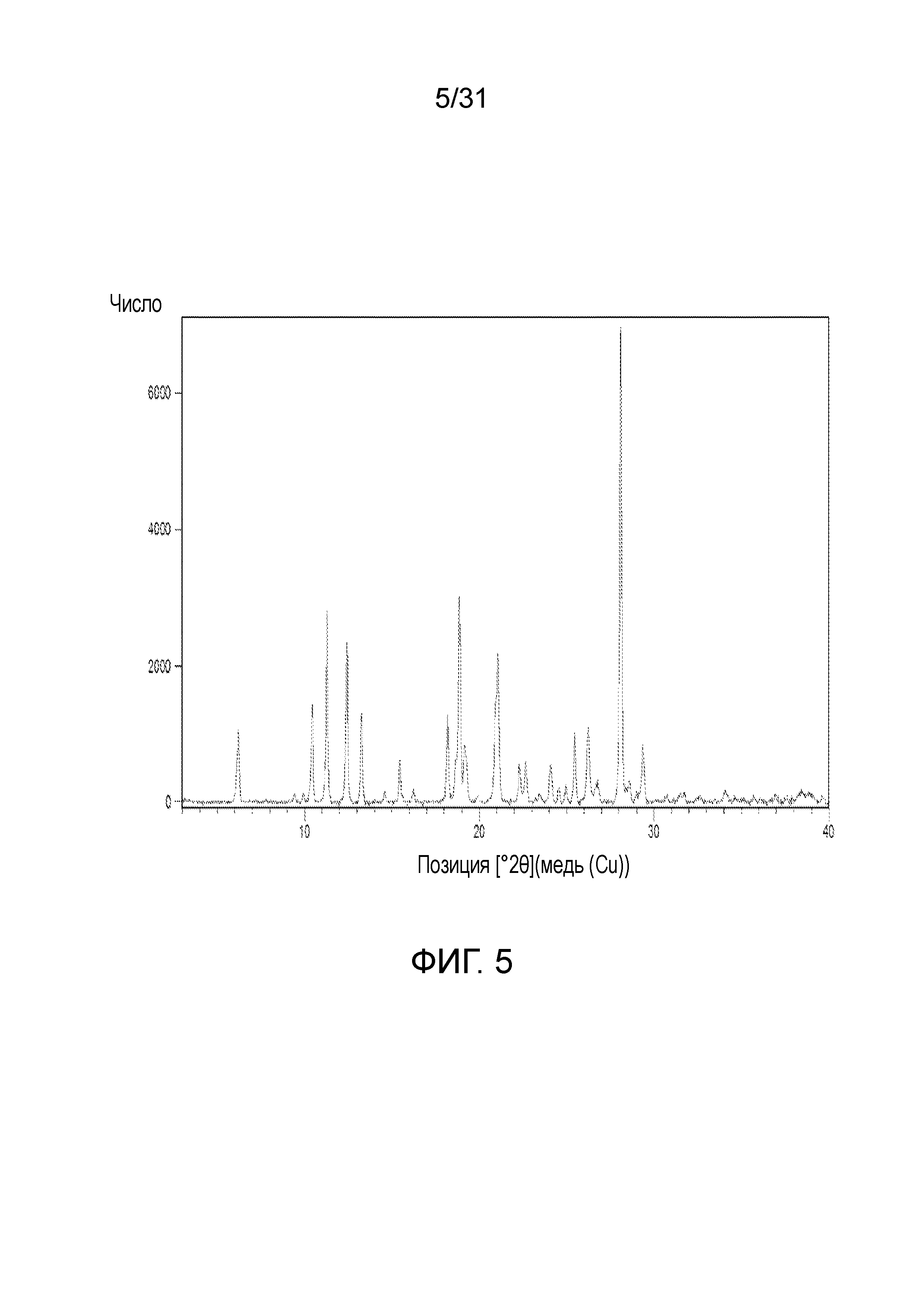
На фиг.5 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и малеиновой кислотой.
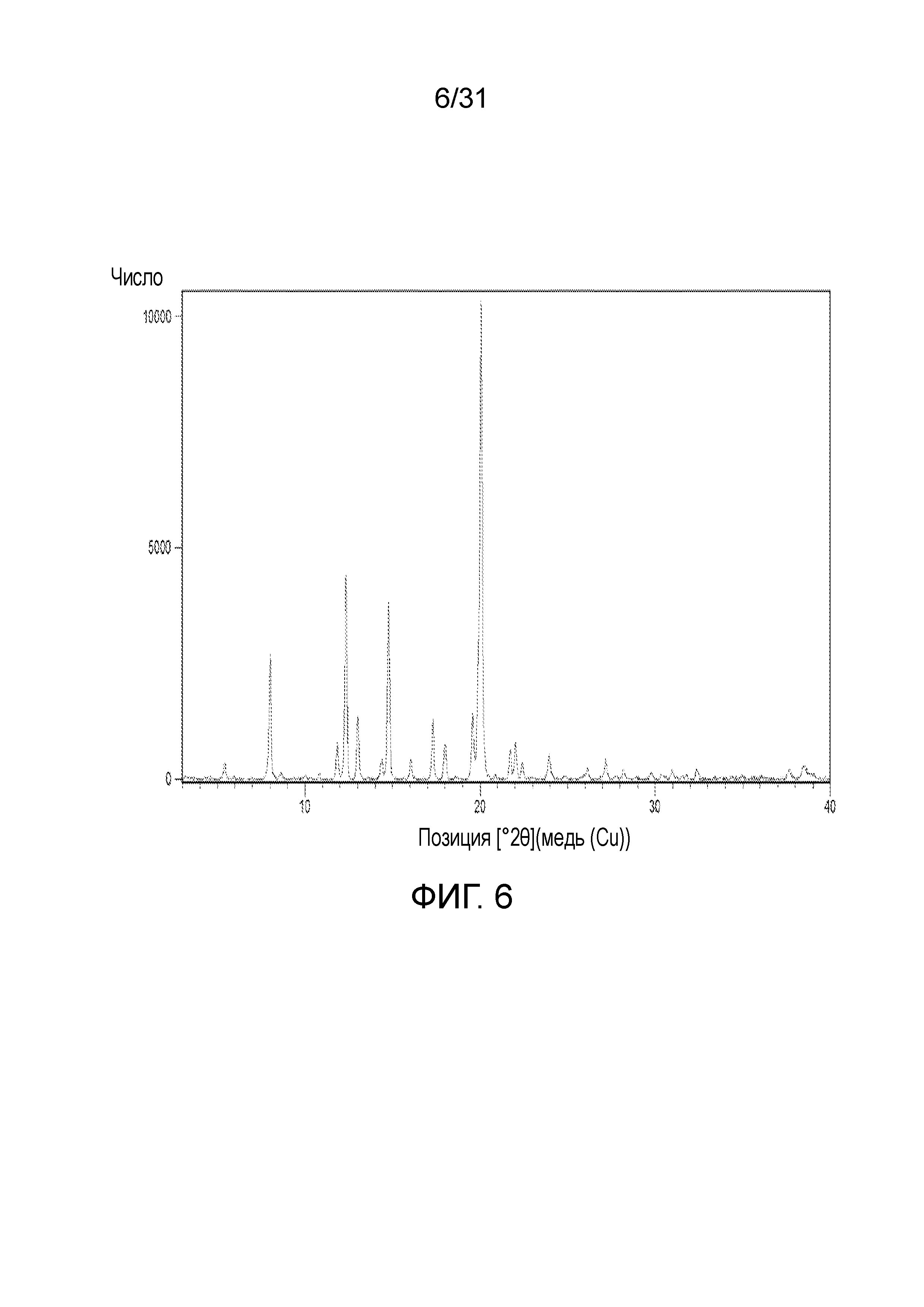
На фиг.6 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и янтарной кислотой.
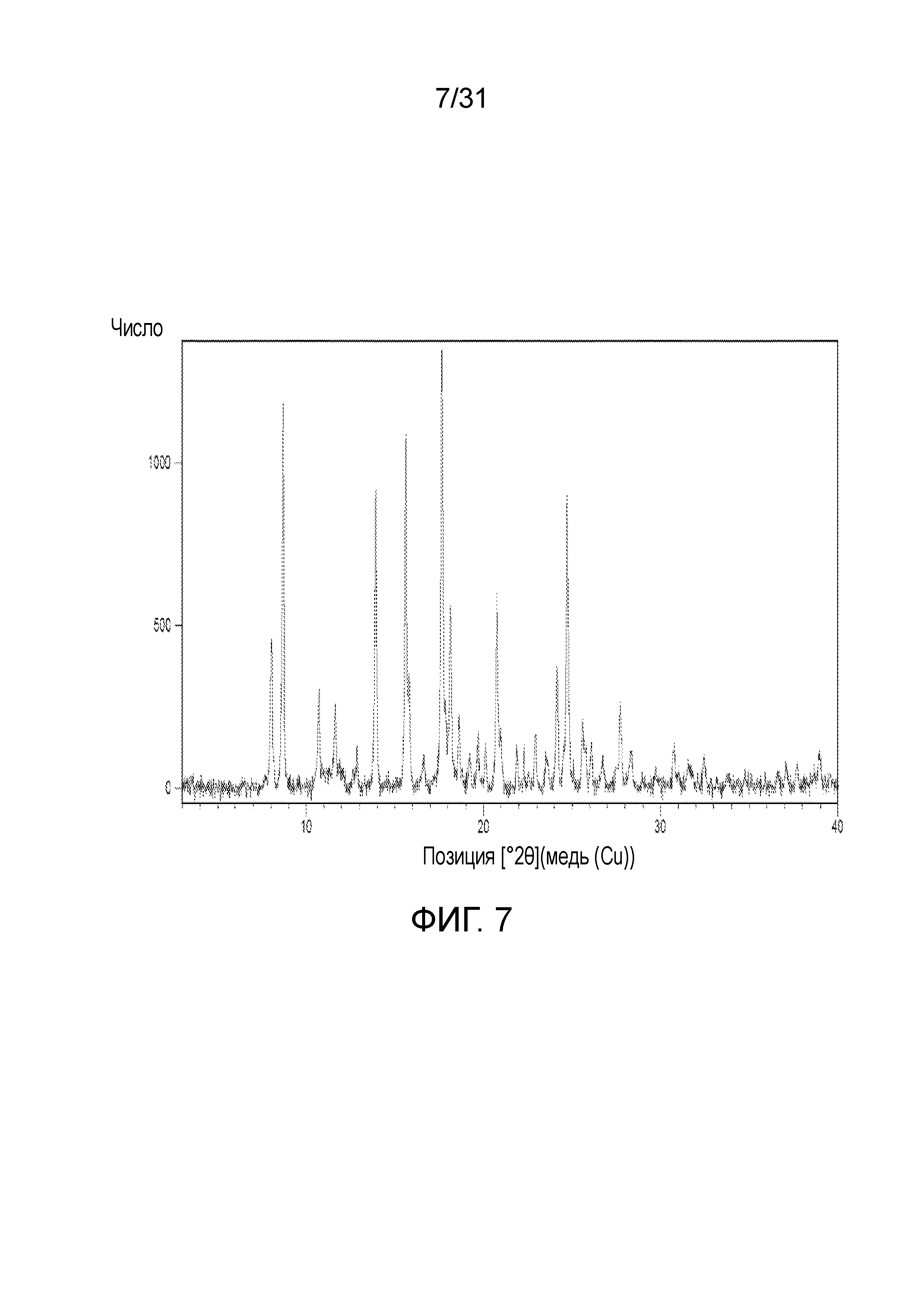
На фиг.7 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и бензойной кислотой.
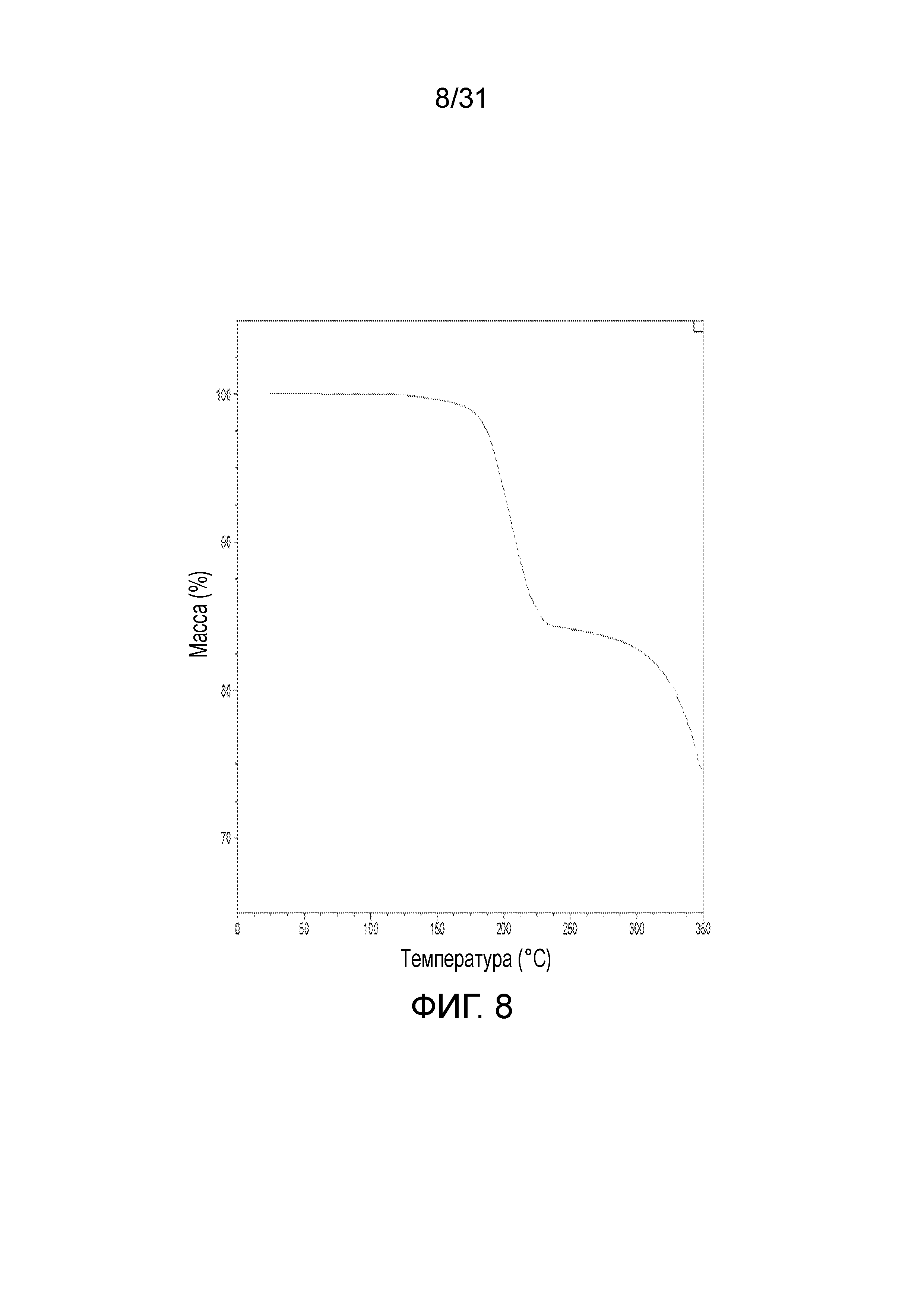
На фиг.8 представлена термограмма термогравиметрического анализа со-кристалла, образованного между соединением 1 и адипиновой кислотой.
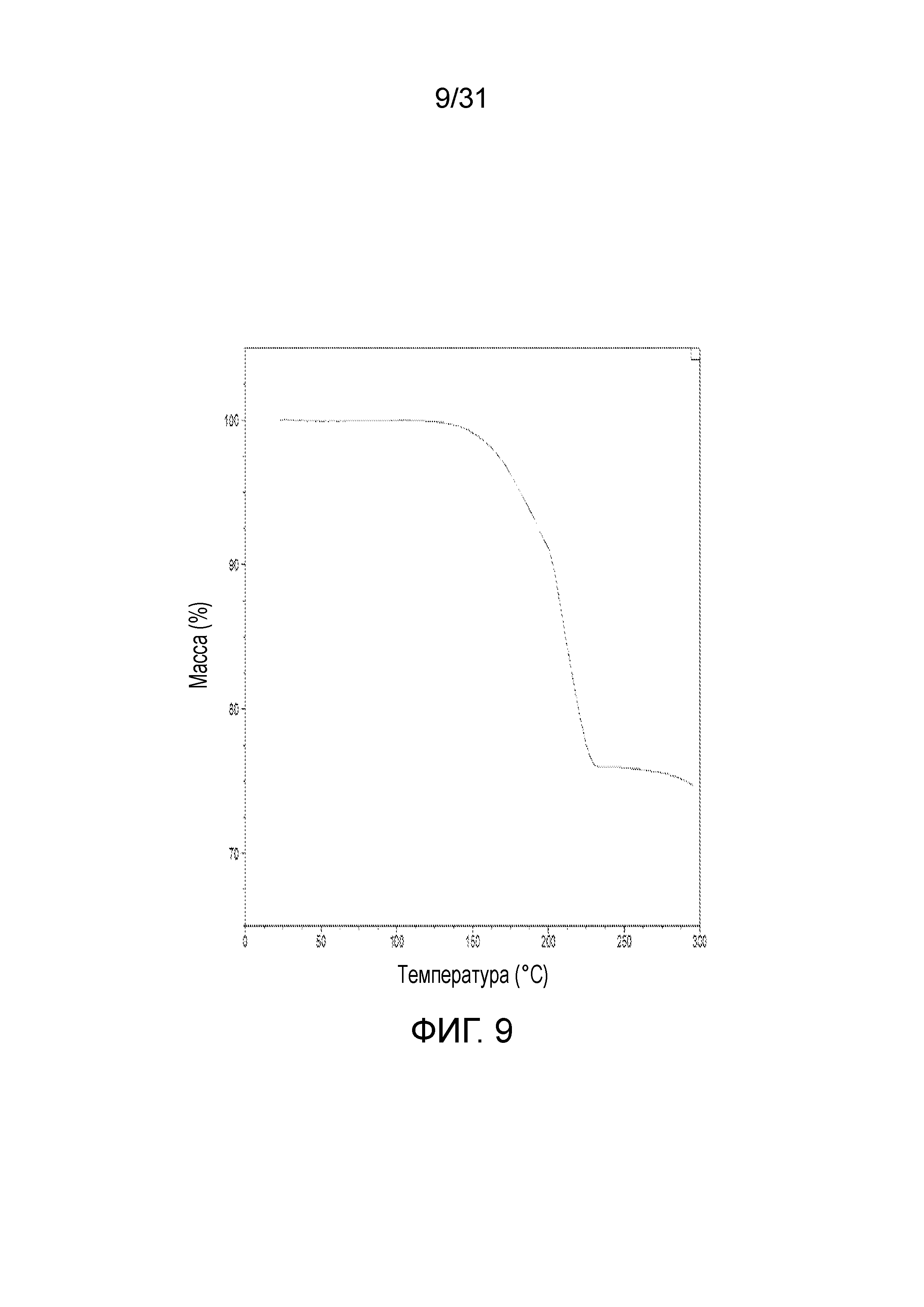
На фиг.9 представлена термограмма термогравиметрического анализа со-кристалла, образованного между соединением 2 и адипиновой кислотой.
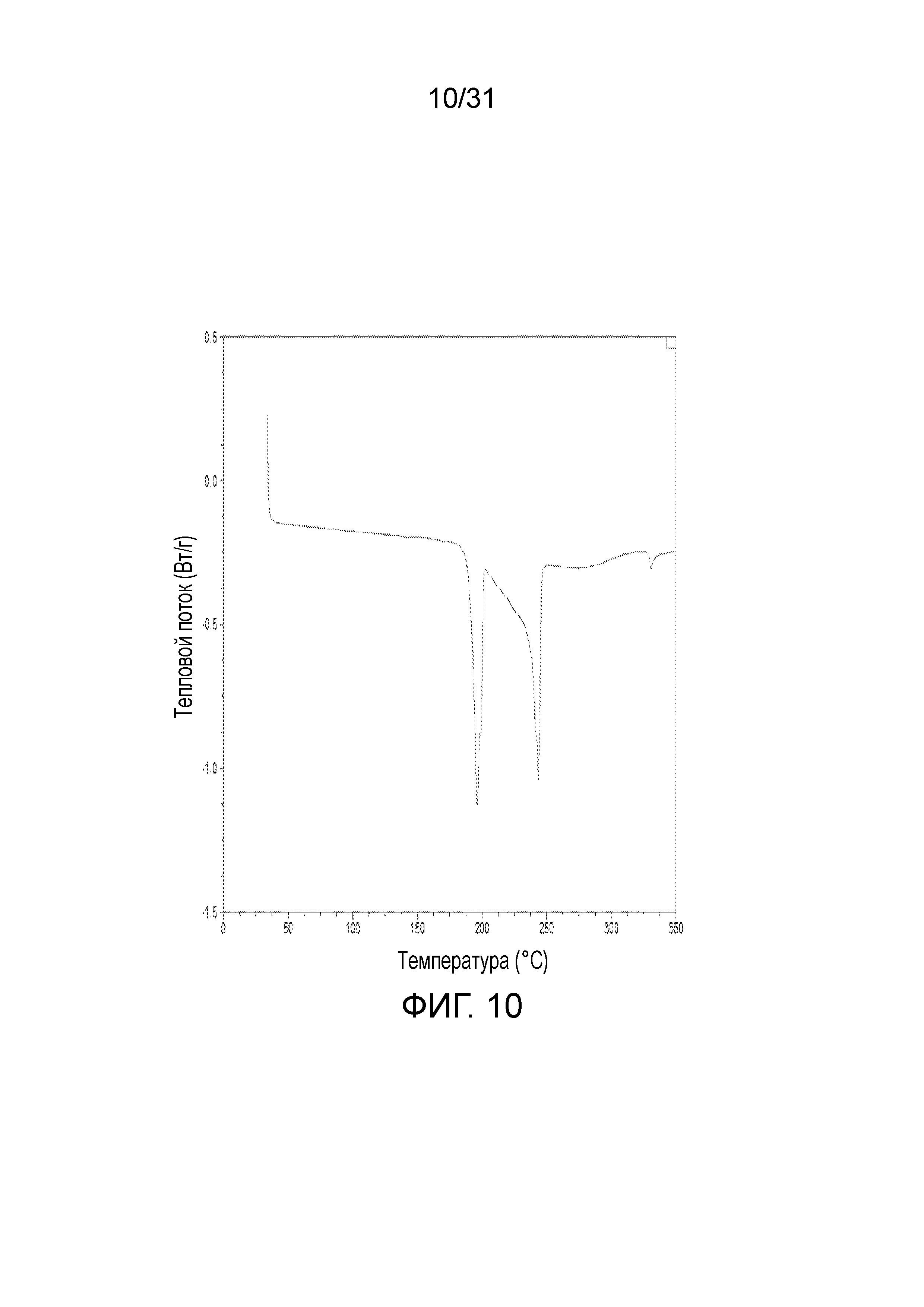
На фиг.10 представлена термограмма дифференциальной сканирующей калориметрии со-кристалла, образованного между соединением 1 и адипиновой кислотой.
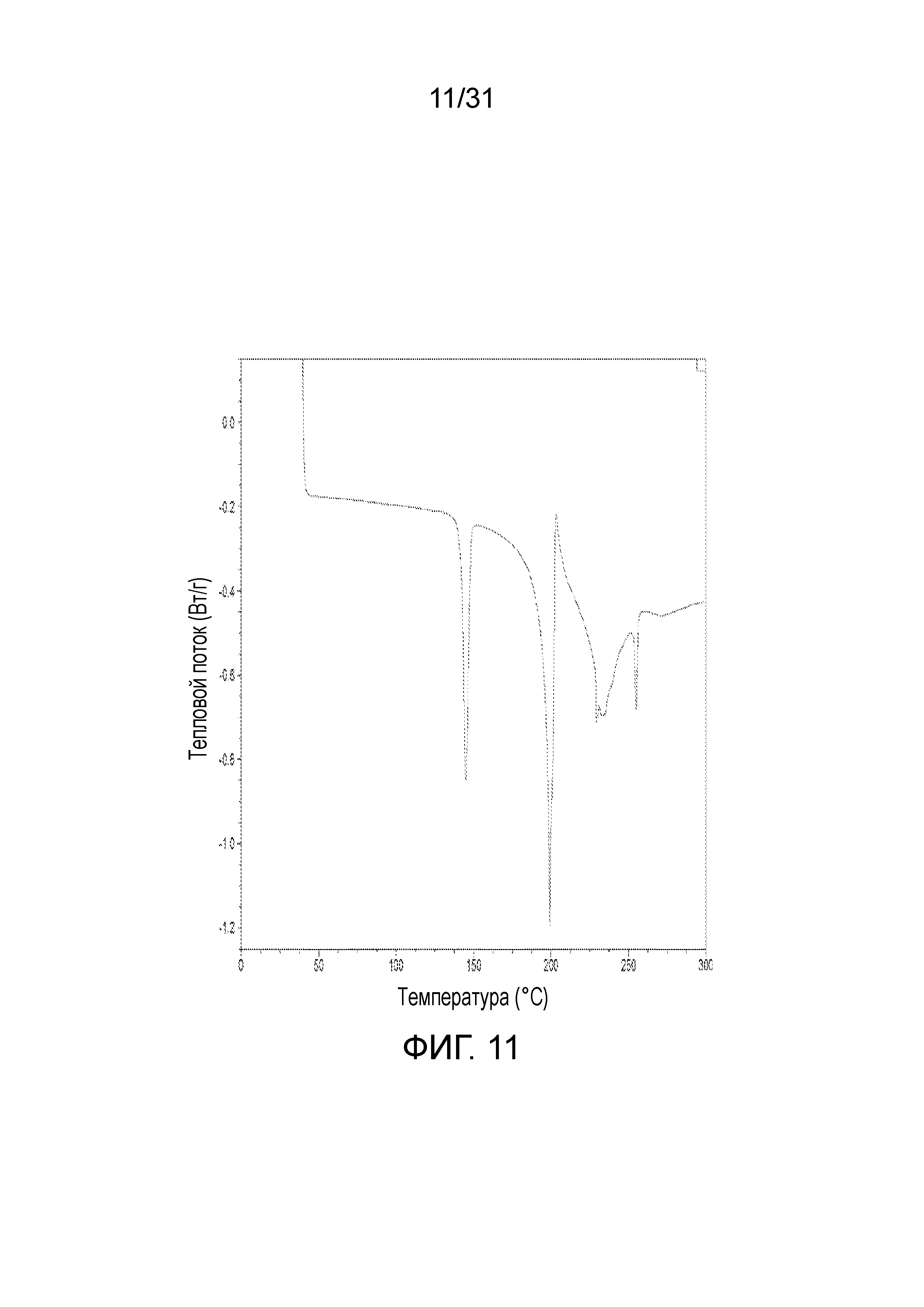
На фиг.11 представлена термограмма дифференциальной сканирующей калориметрии со-кристалла, образованного между соединением 2 и адипиновой кислотой.
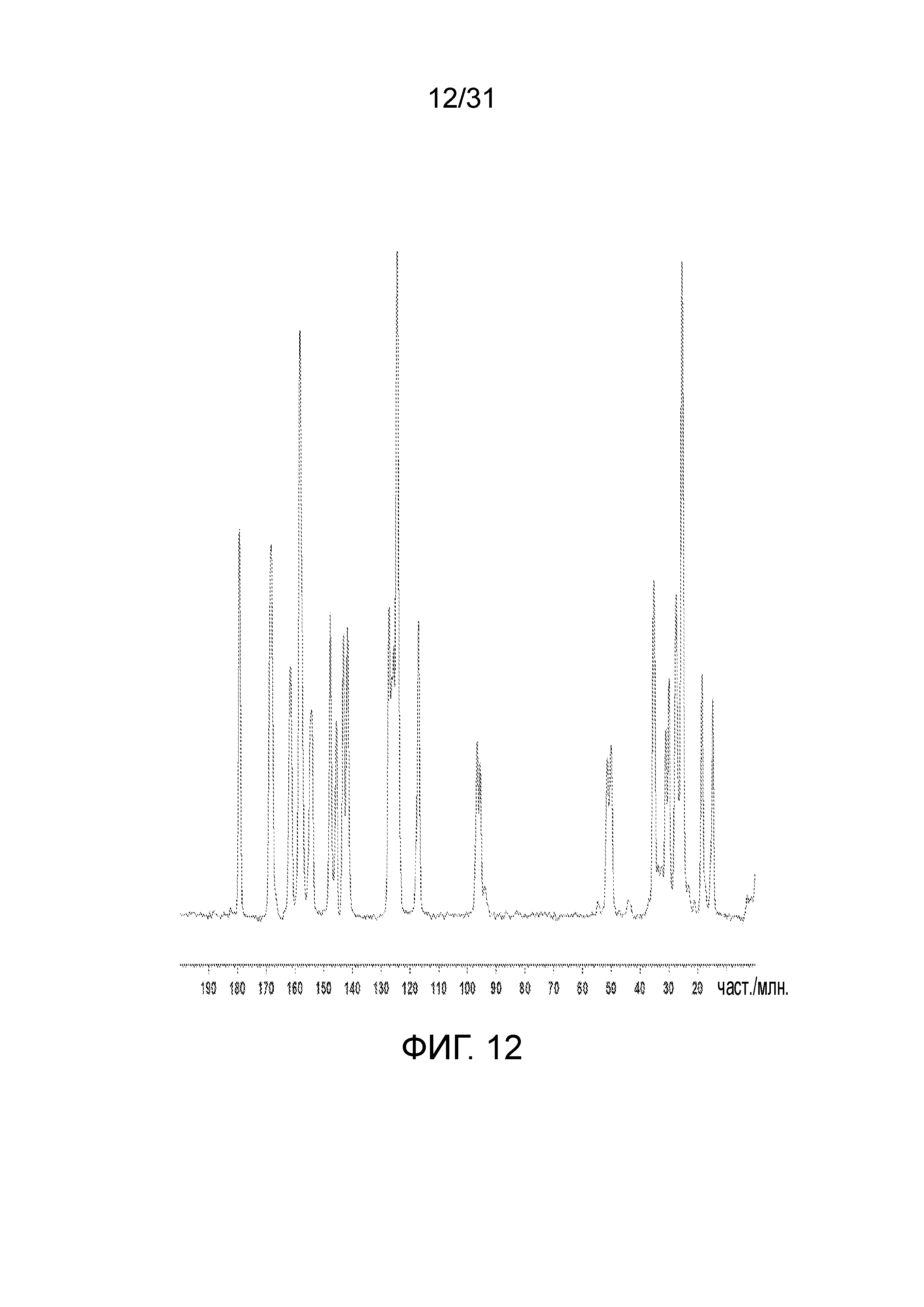
На фиг.12 представлен ЯМР-спектр со-кристалла в твердом состоянии, образованного между соединением 1 и адипиновой кислотой.
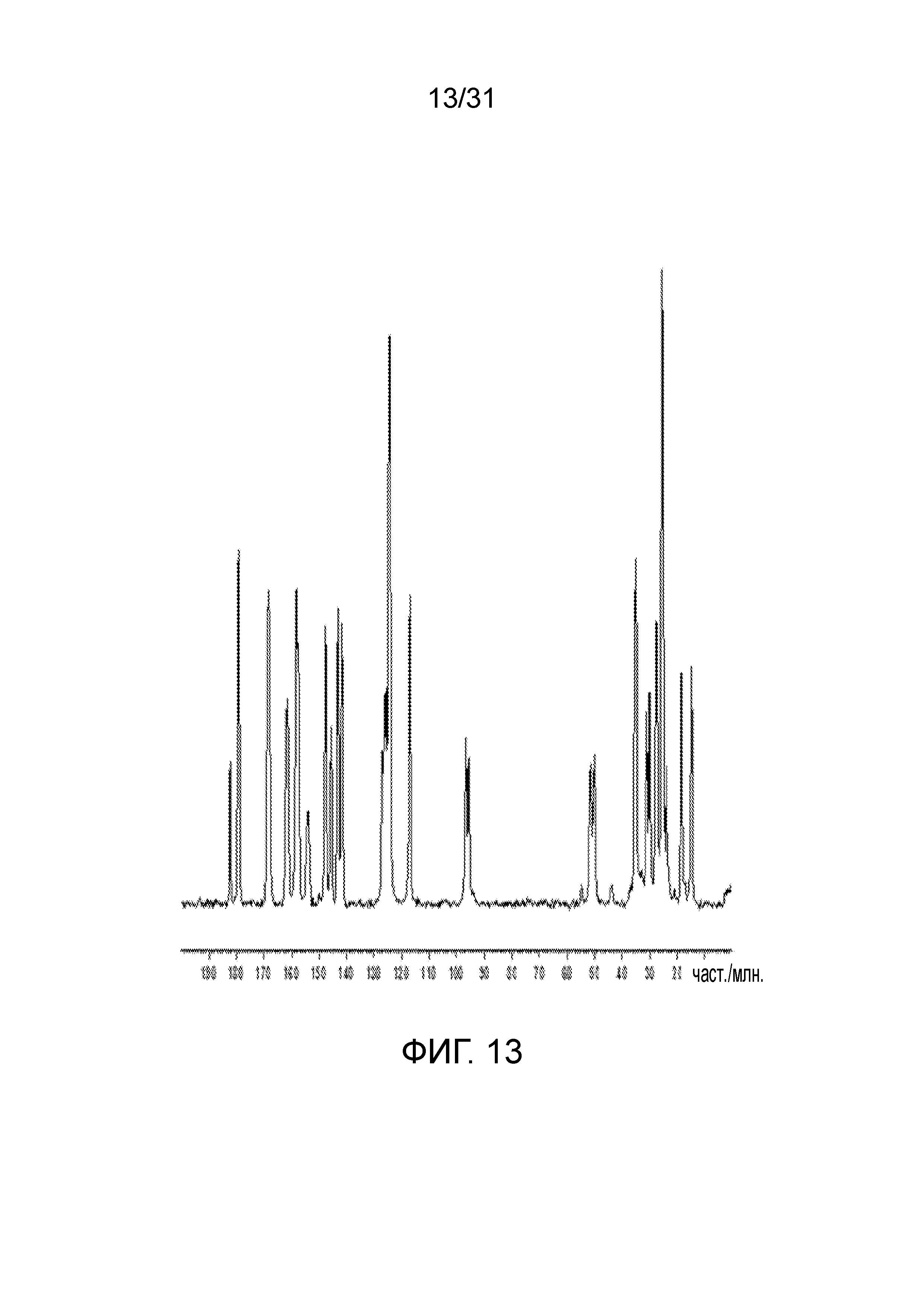
На фиг.13 представлен ЯМР-спектр со-кристалла в твердом состоянии, образованного между соединением 2 и адипиновой кислотой.
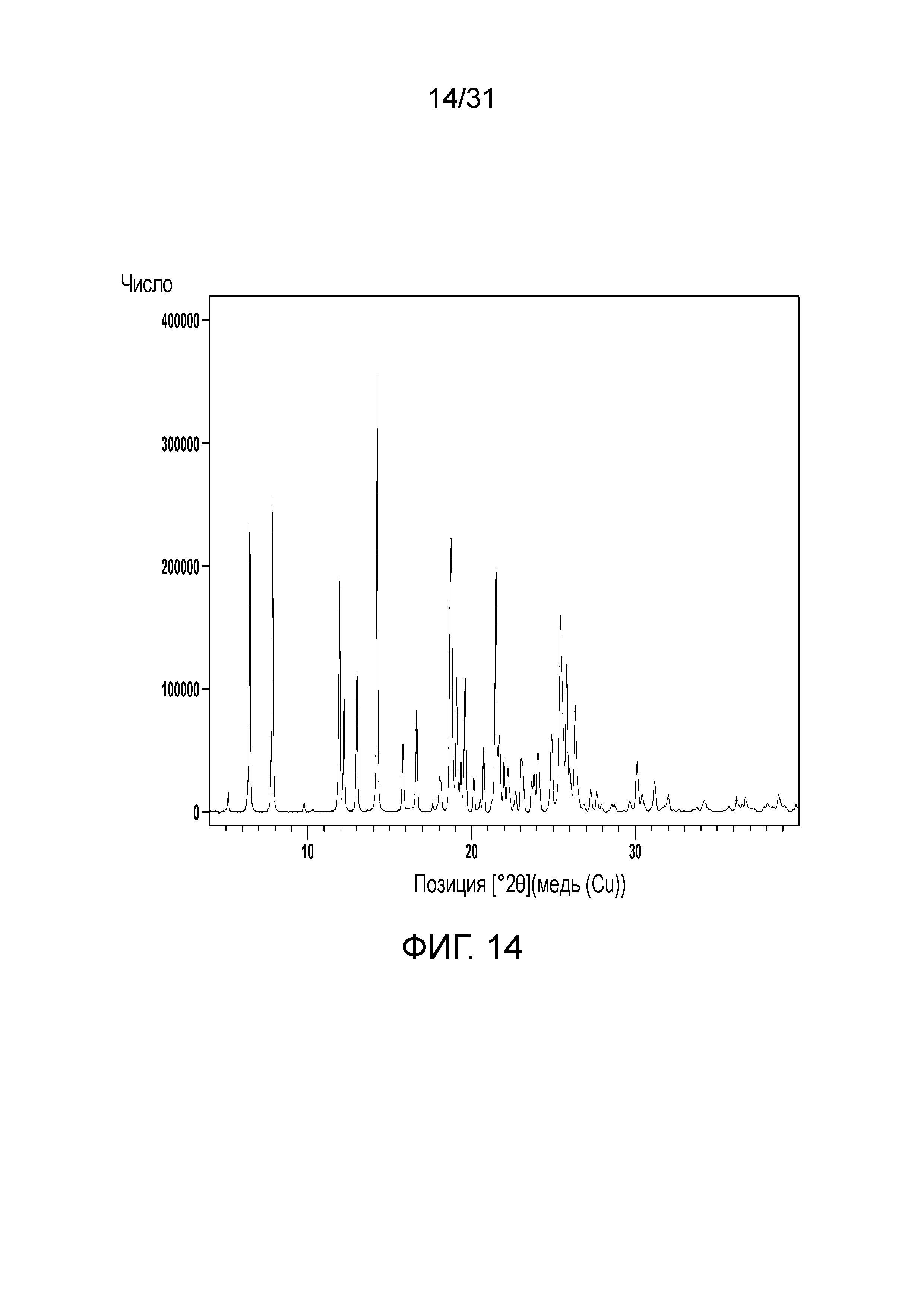
На фиг.14 представлена порошковая рентгенограмма полиморфной формы А сокристалла, образованного между соединением 1 и адипиновой кислотой.
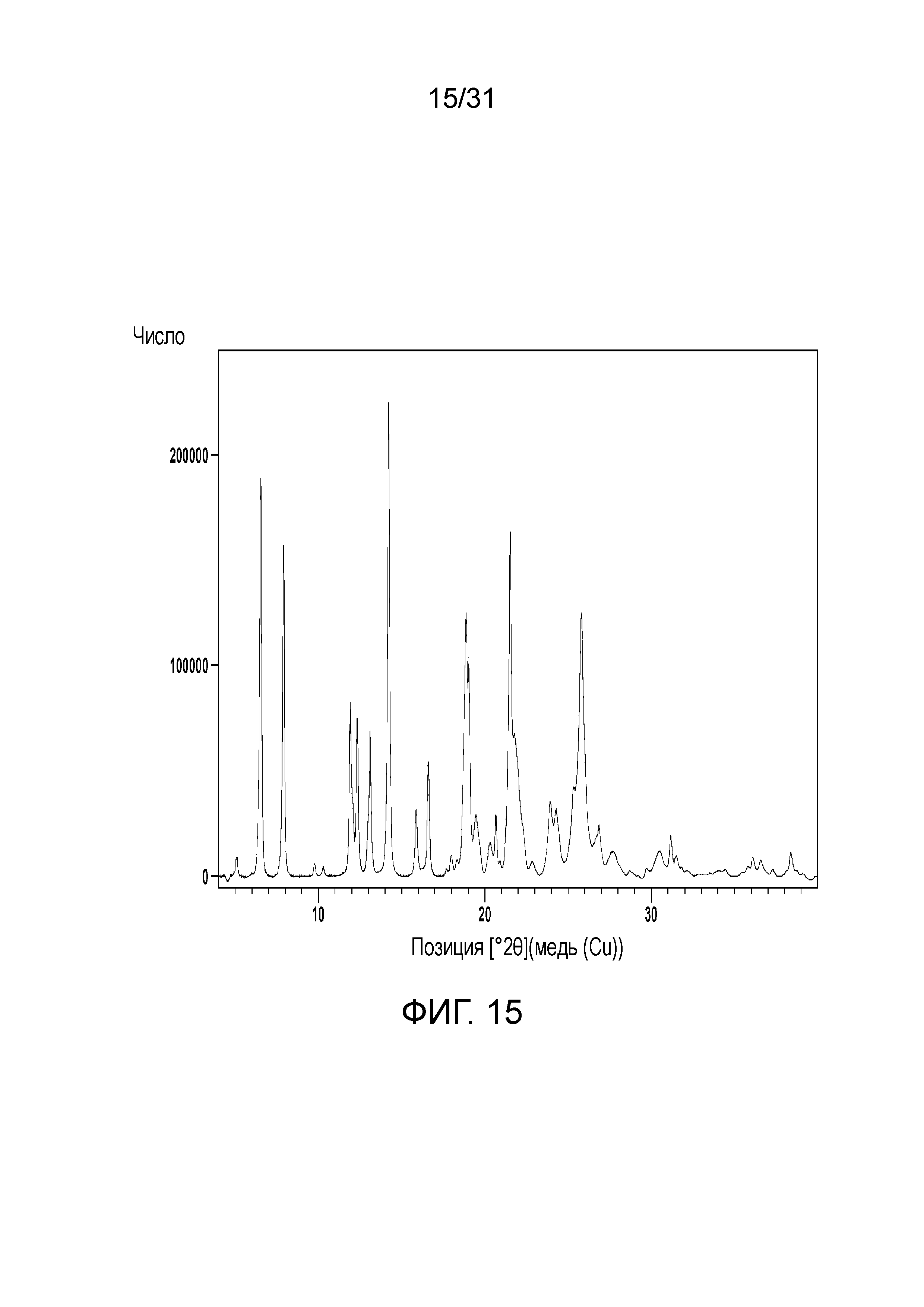
На фиг.15 представлена порошковая рентгенограмма полиморфной формы А сокристалла, образованного между соединением 2 и адипиновой кислотой.
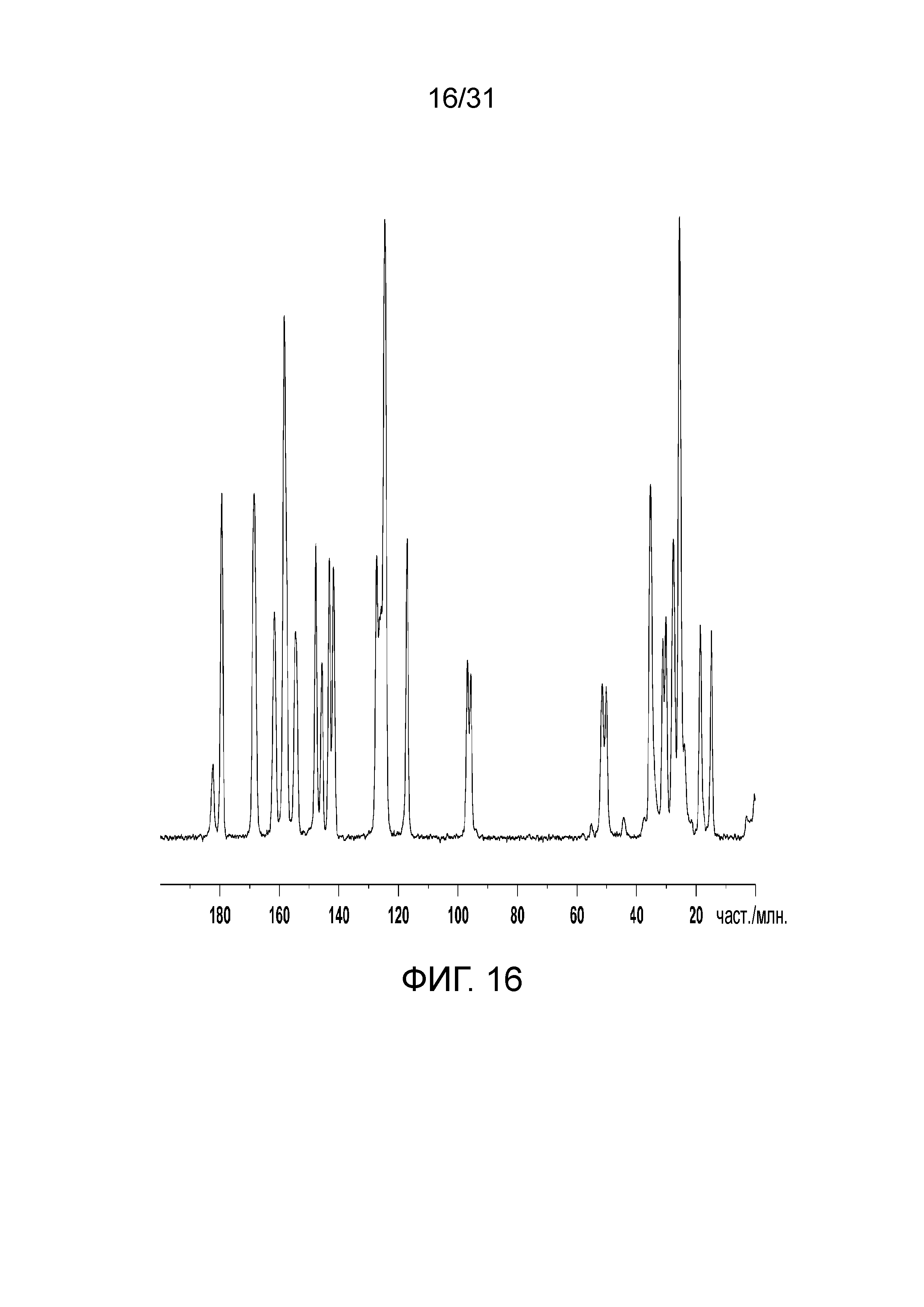
На фиг.16 представлен ЯМР-спектр полиморфной формы А со-кристалла в твердом состоянии, образованного между соединением 1 и адипиновой кислотой.
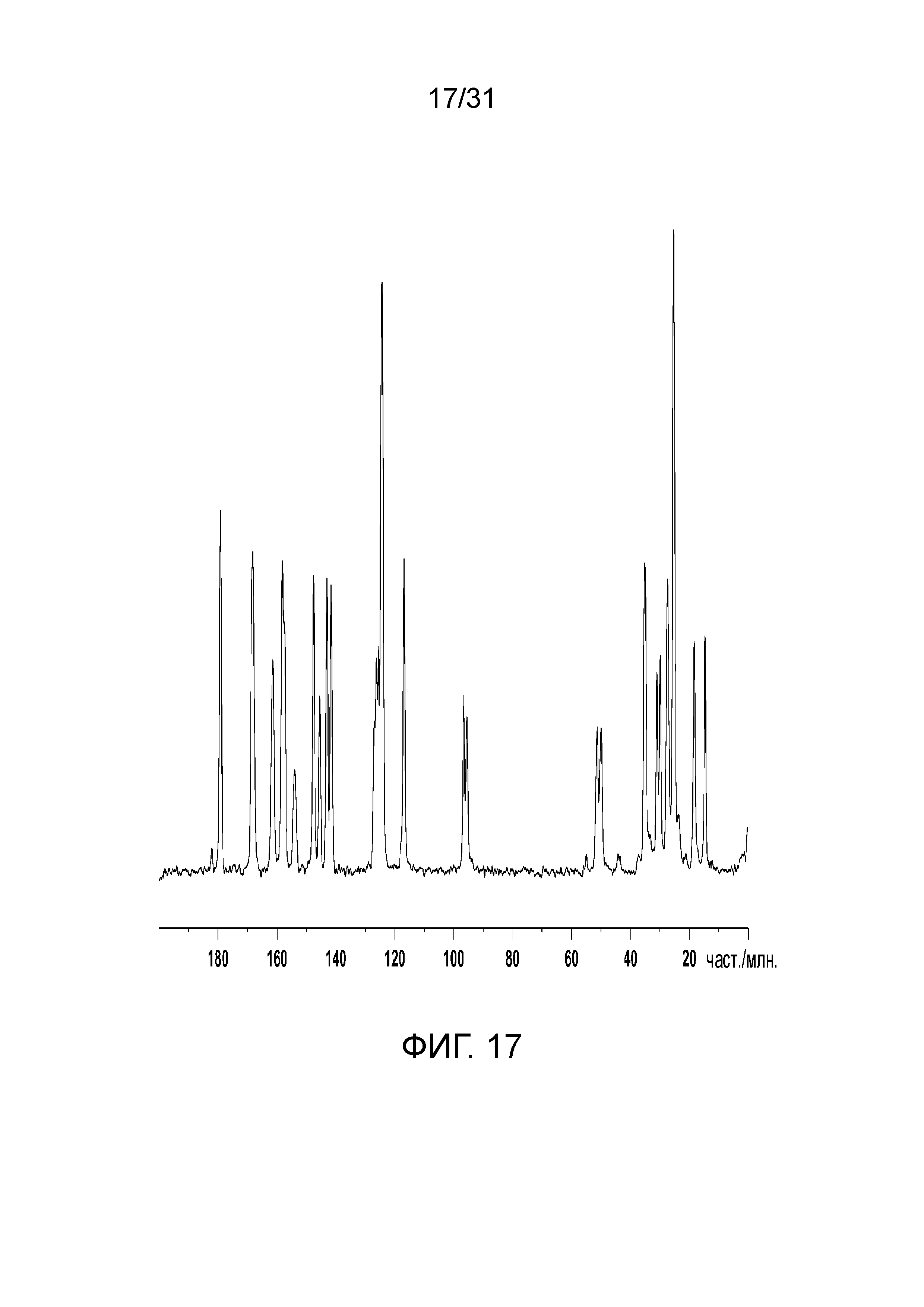
На фиг.17 представлен ЯМР-спектр полиморфной формы А со-кристалла в твердом состоянии, образованного между соединением 2 и адипиновой кислотой.
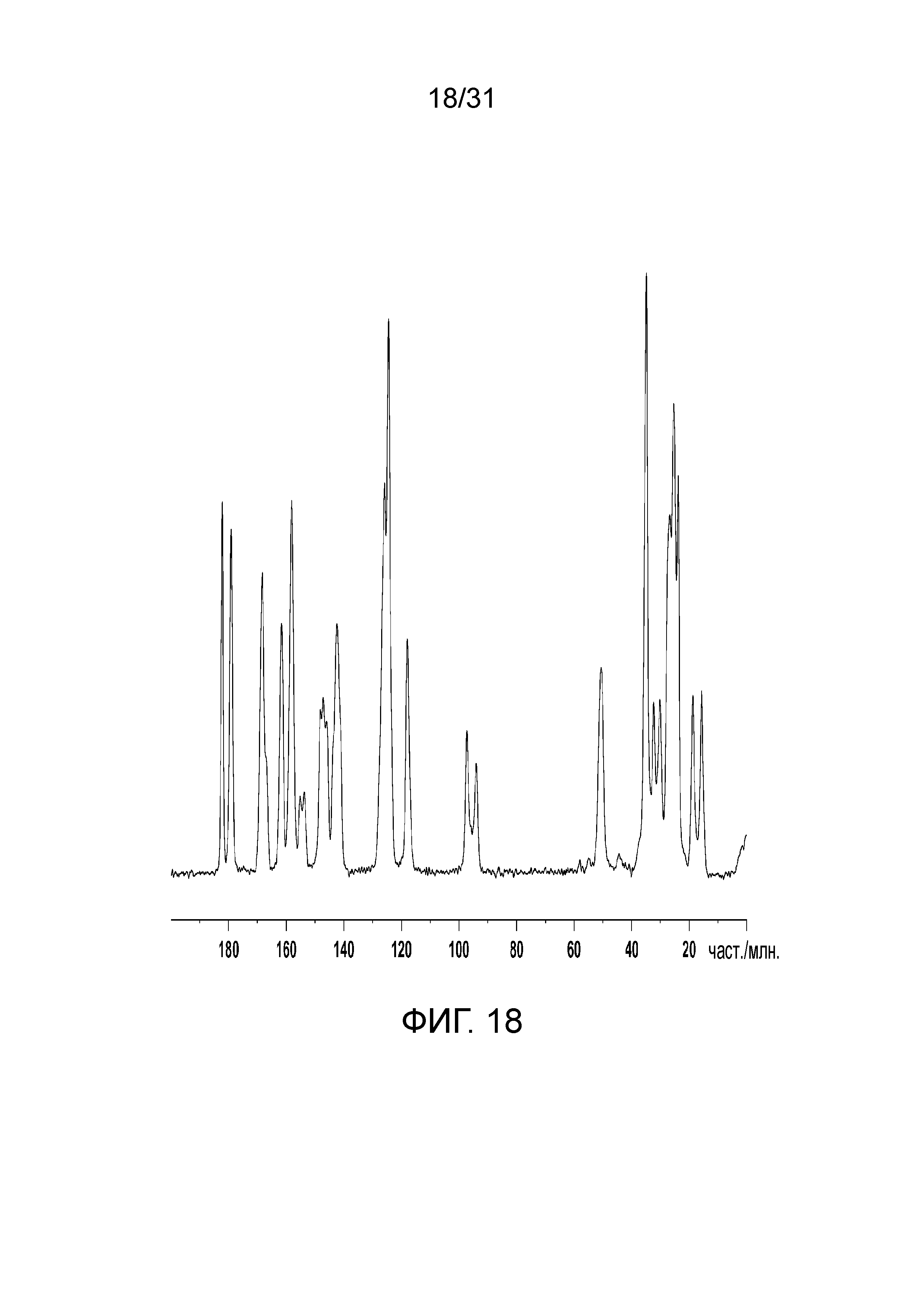
На фиг.18 представлен ЯМР-спектр полиморфной формы В со-кристалла в твердом состоянии, образованного между соединением 2 и адипиновой кислотой.
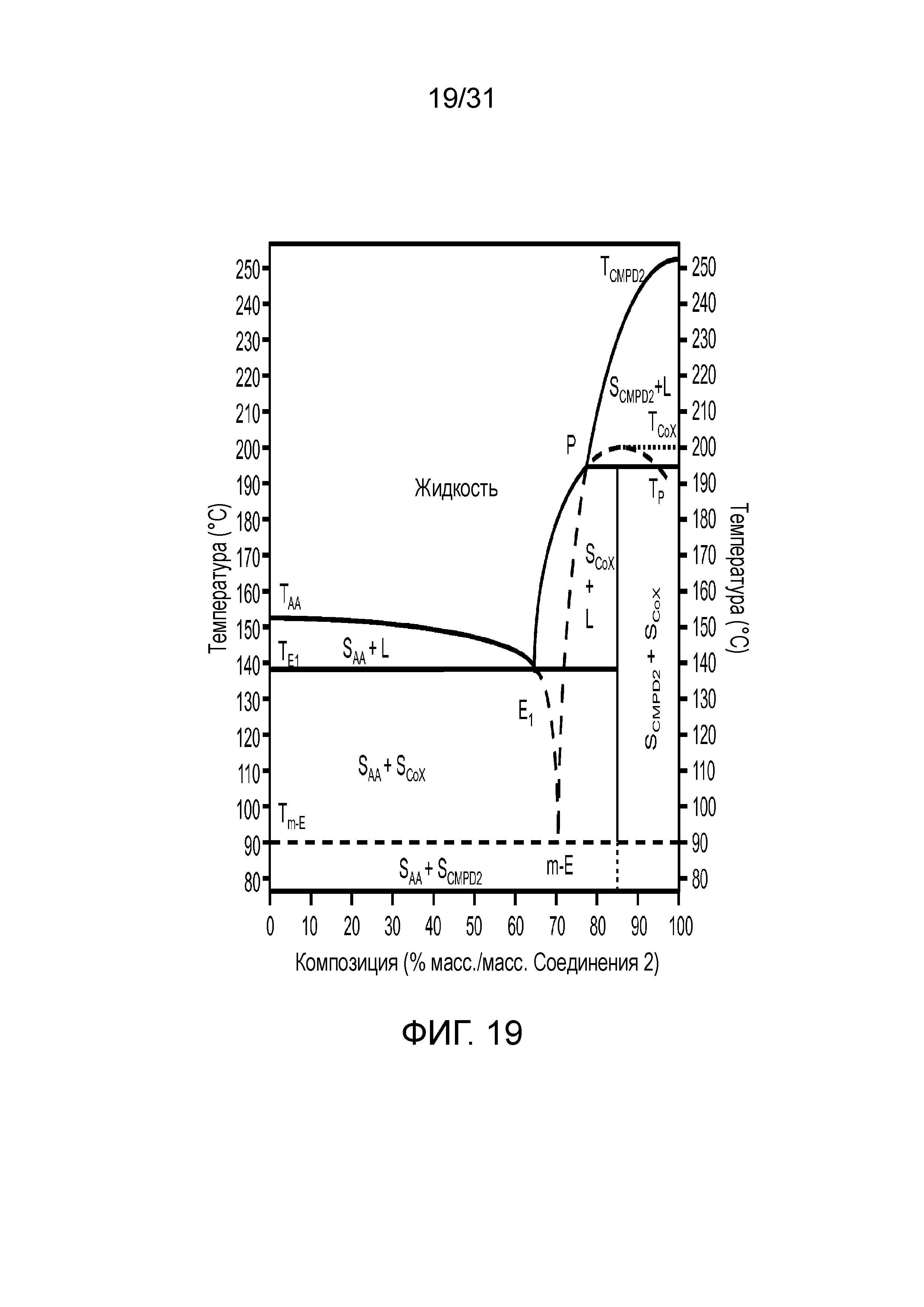
На фиг.19 представлена диаграмма бинарной фазы соединения 2 и адипиновой кислоты.
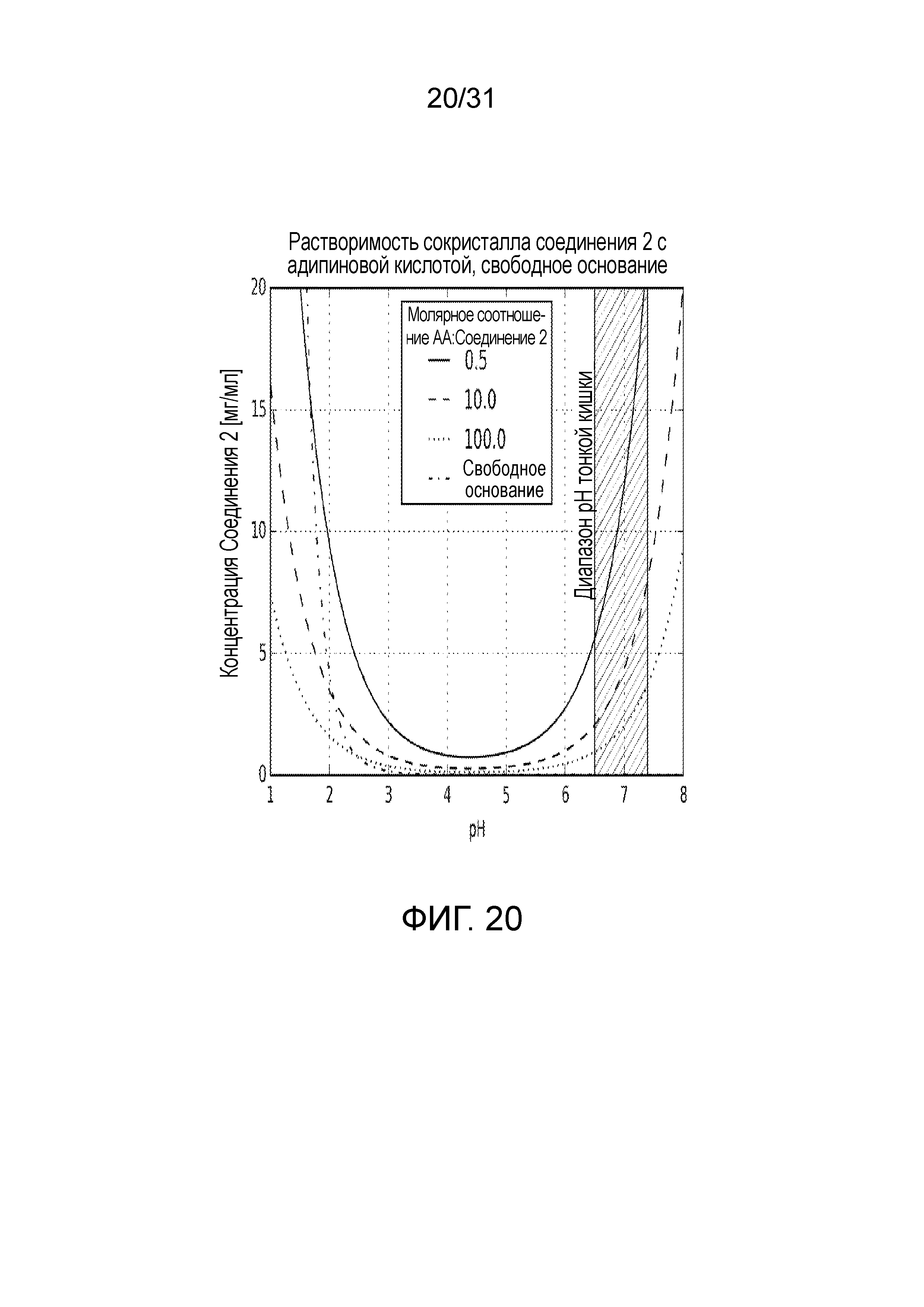
На фиг.20 представлена диаграмма растворимости при рассчитанном значении рН со-кристалла, образованного между соединением 2 и адипиновой кислотой (при избыточном содержании адипиновой кислоты), и соединения 2 в свободной форме.
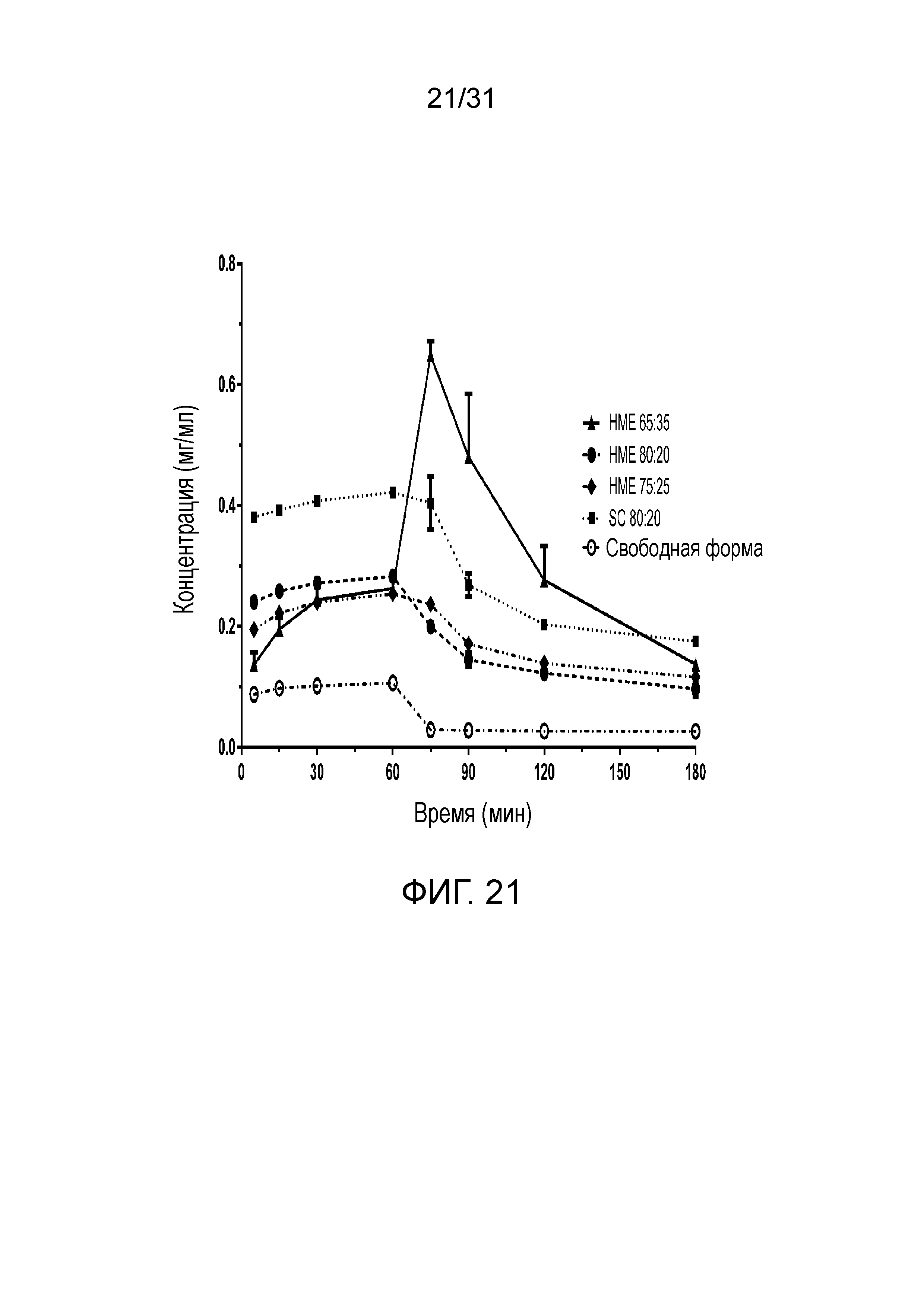
На фиг.21 представлены профили двухфазного растворения для: i) со-кристалла соединение 1:адипиновая кислота, полученного путем экструзии из расплава (НМЕ) и кристаллизации из суспензии (SC); ii) НМЕ 65:35: со-кристалла соединение 1:адипиновая кислота, полученного путем использования экструзии из расплава, с 65% масс. соединения 1 и 35% масс. адипиновой кислоты; iii) НМЕ 75:25: со-кристалла соединение 1:адипиновая кислота, полученного при использовании экструзии из расплава, с 75% масс. соединения 1 и 25% масс. адипиновой кислоты; iv) НМЕ 80:20: со-кристалла, полученного при использовании экструзии из расплава, с 80% масс. соединения 1 и 20% масс. адипиновой кислоты; v) SC 80:20: кристаллизованного из суспензии со-кристалла соединение 2:адипиновая кислота с конечным содержанием соединения 2 79% масс. и 21% масс. адипиновой кислоты; и vi) свободная форма: свободной формы соединения 2.
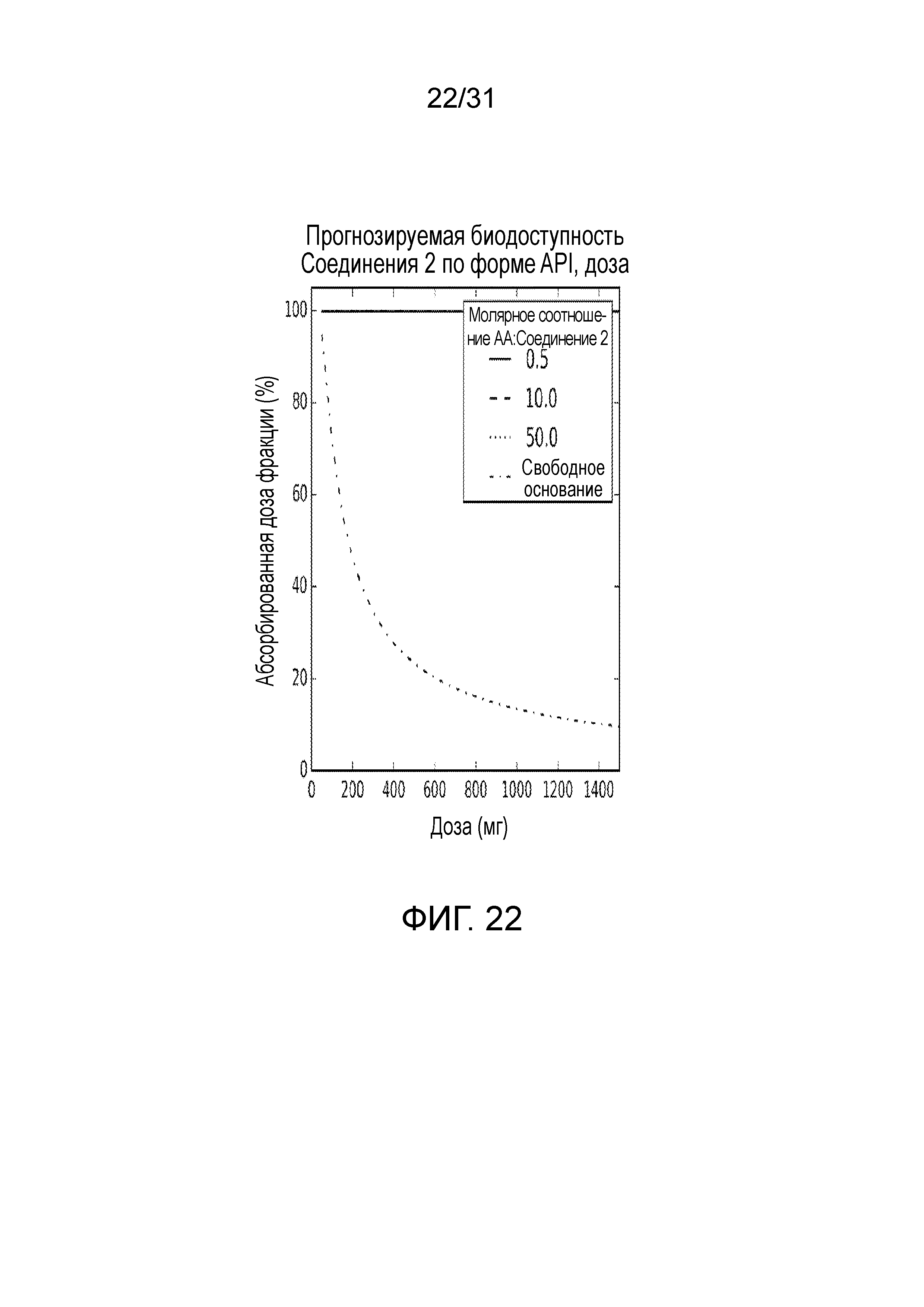
На фиг.22 представлена прогнозируемая доля, абсорбированная на со-кристалле, образованном между соединением 2 и адипиновой кислотой, и свободной форме соединения 2.
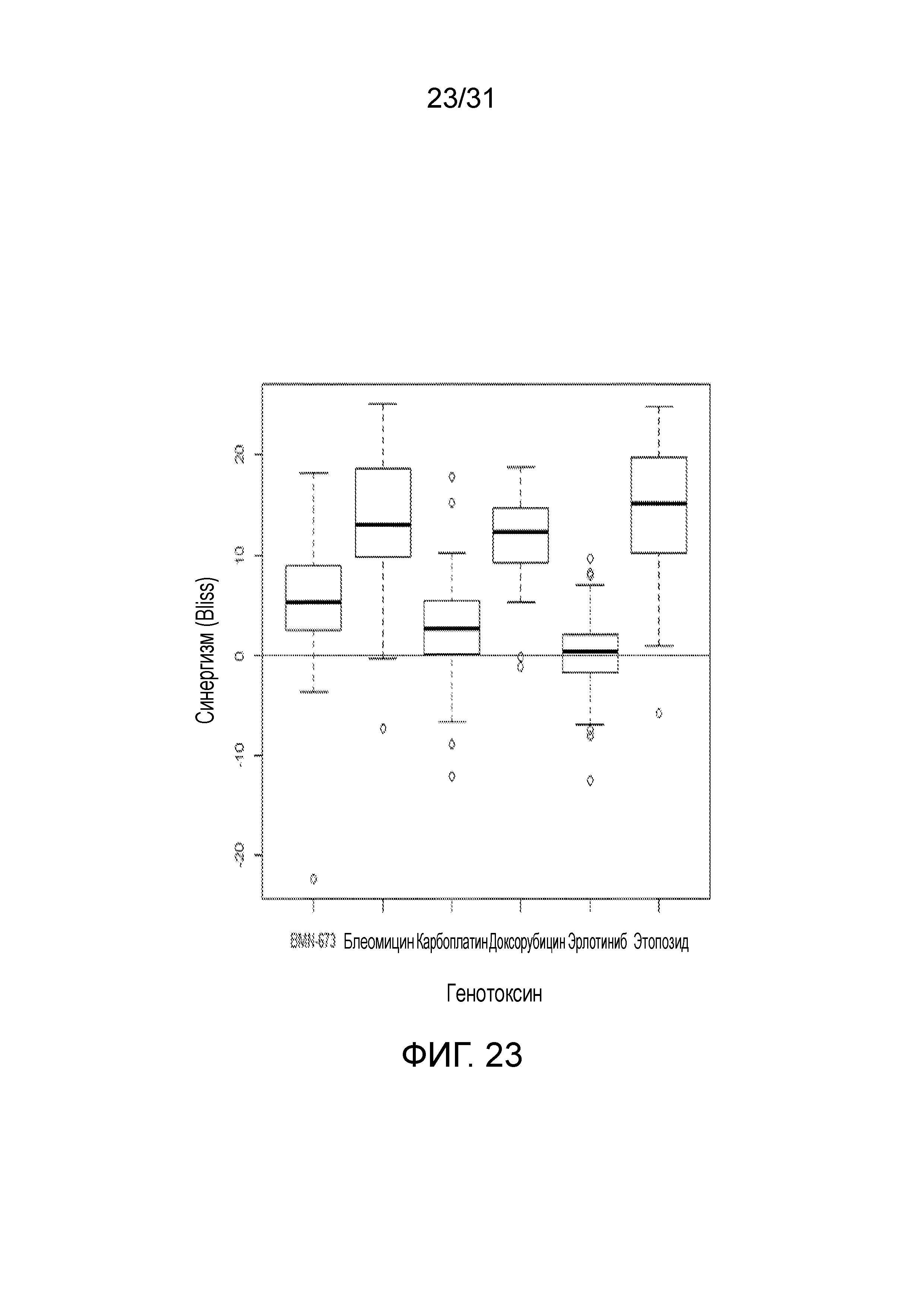
На фиг.23 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с набором цитотоксических и не являющихся цитотоксическими агентов.
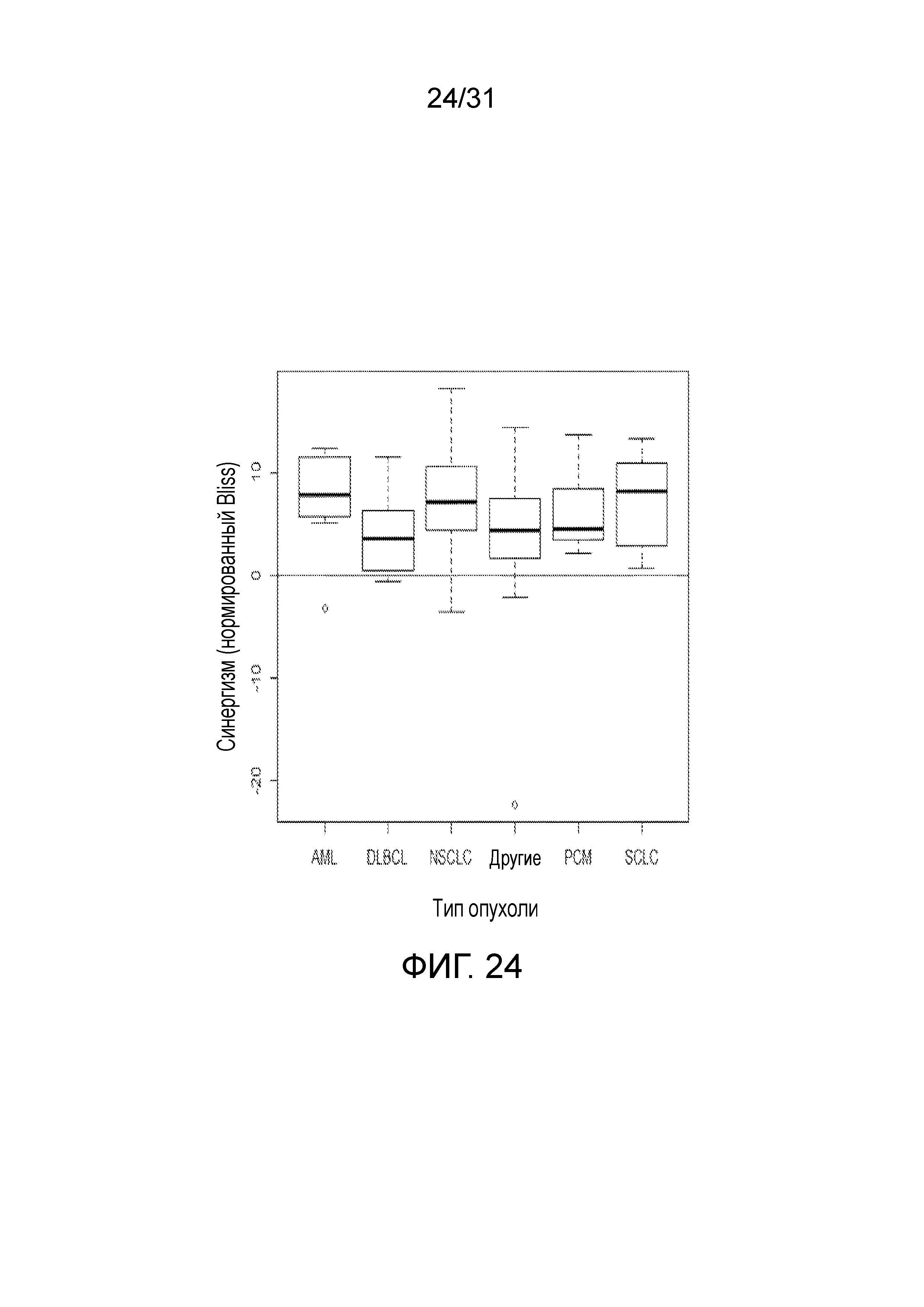
На фиг.24 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с BMN-673 согласно типу опухоли.
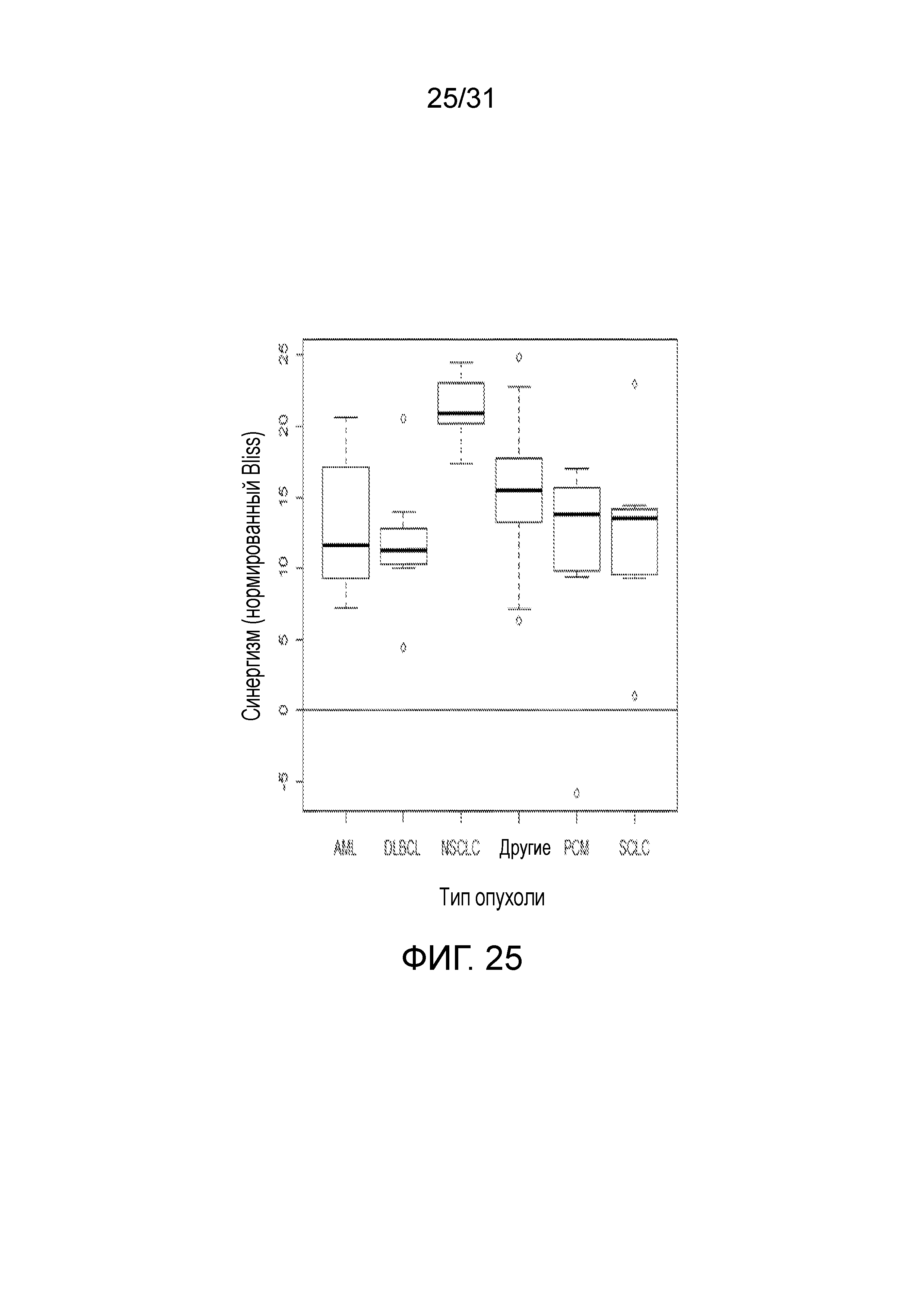
На фиг.25 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с этопозидом согласно типу опухоли.
На фиг.26 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с блеомицином согласно типу опухоли.
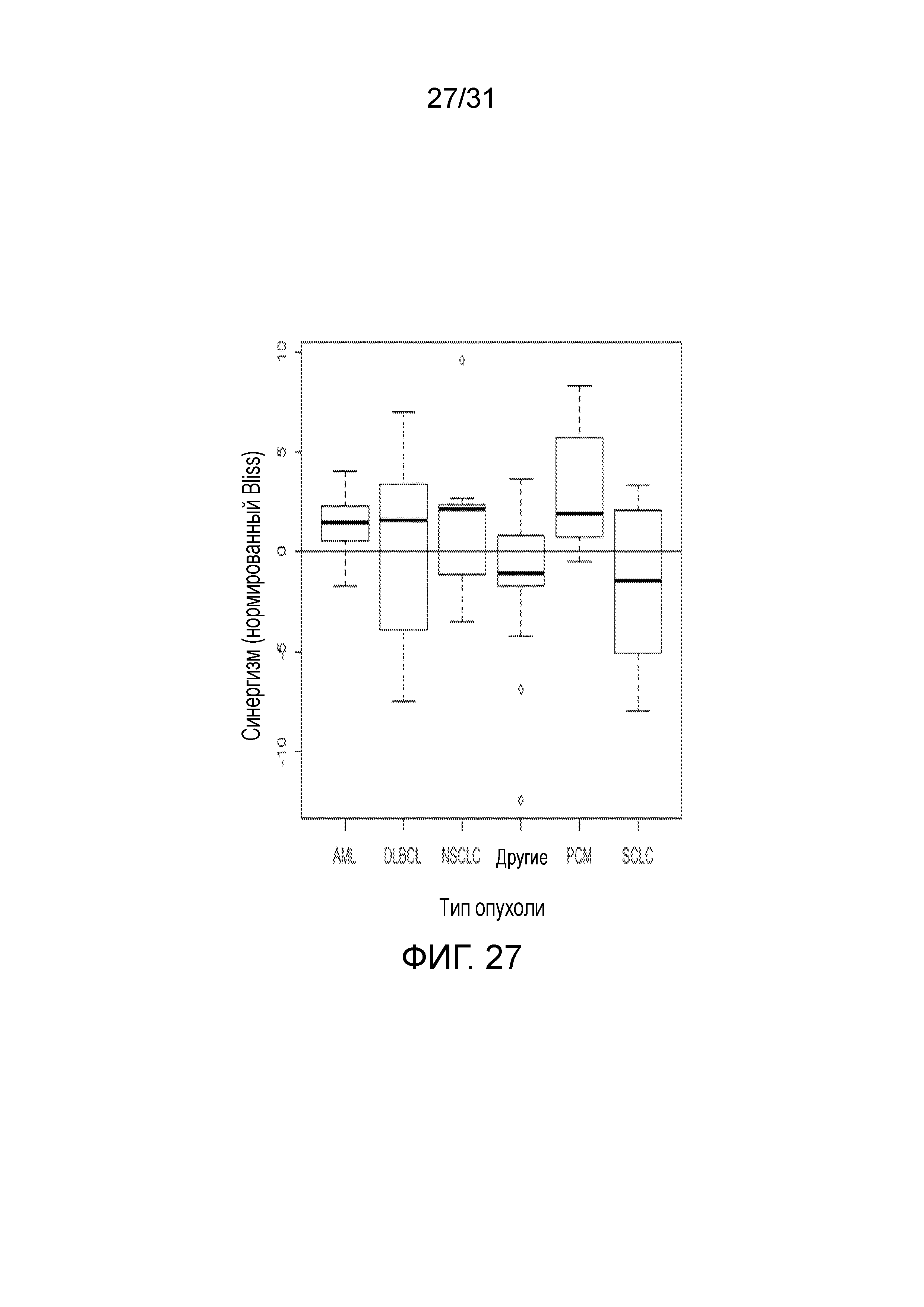
На фиг.27 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с эрлотинибом согласно типу опухоли.
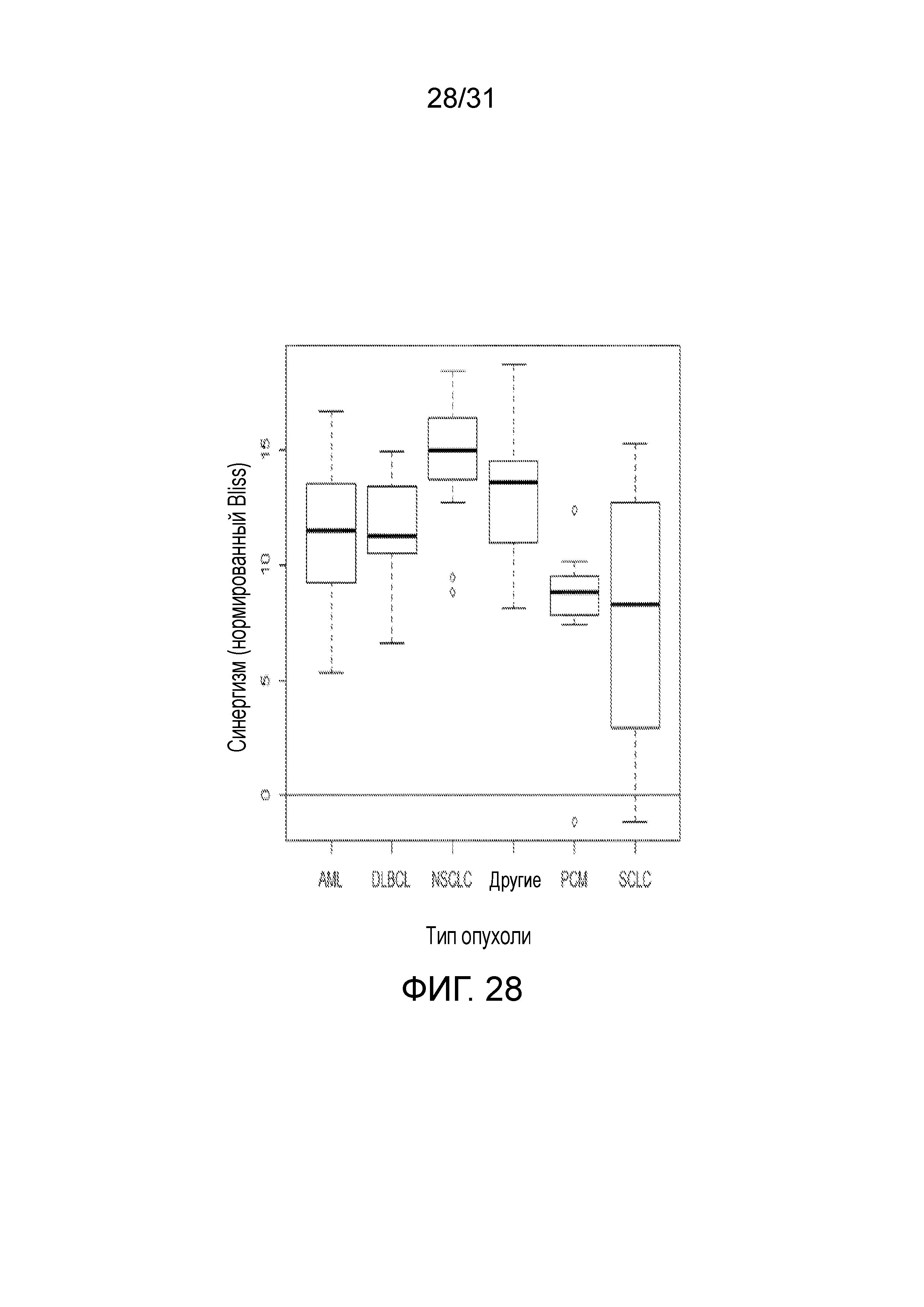
На фиг.28 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с доксорубицином согласно типу опухоли.
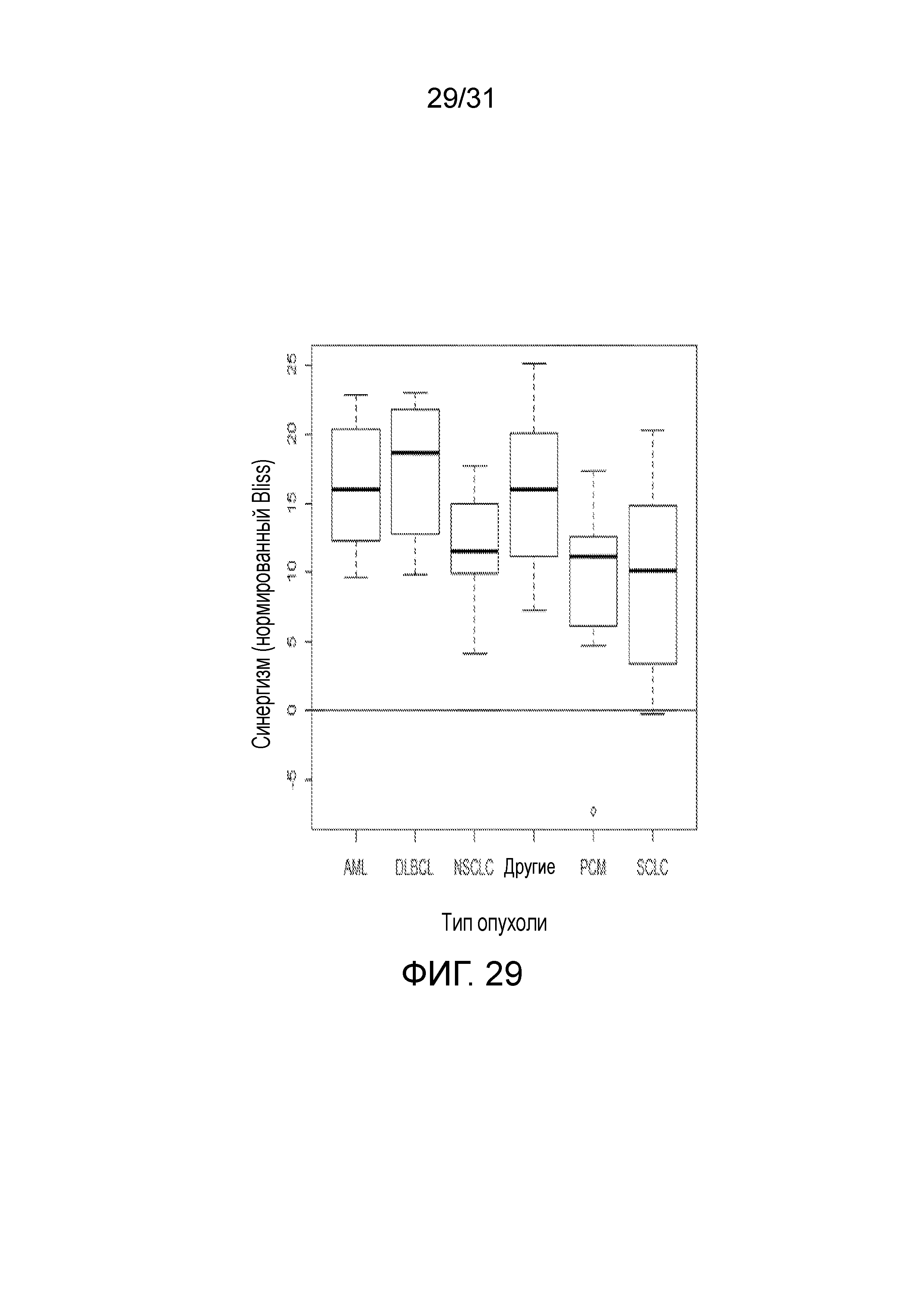
На фиг.29 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с блеомицином согласно типу опухоли.
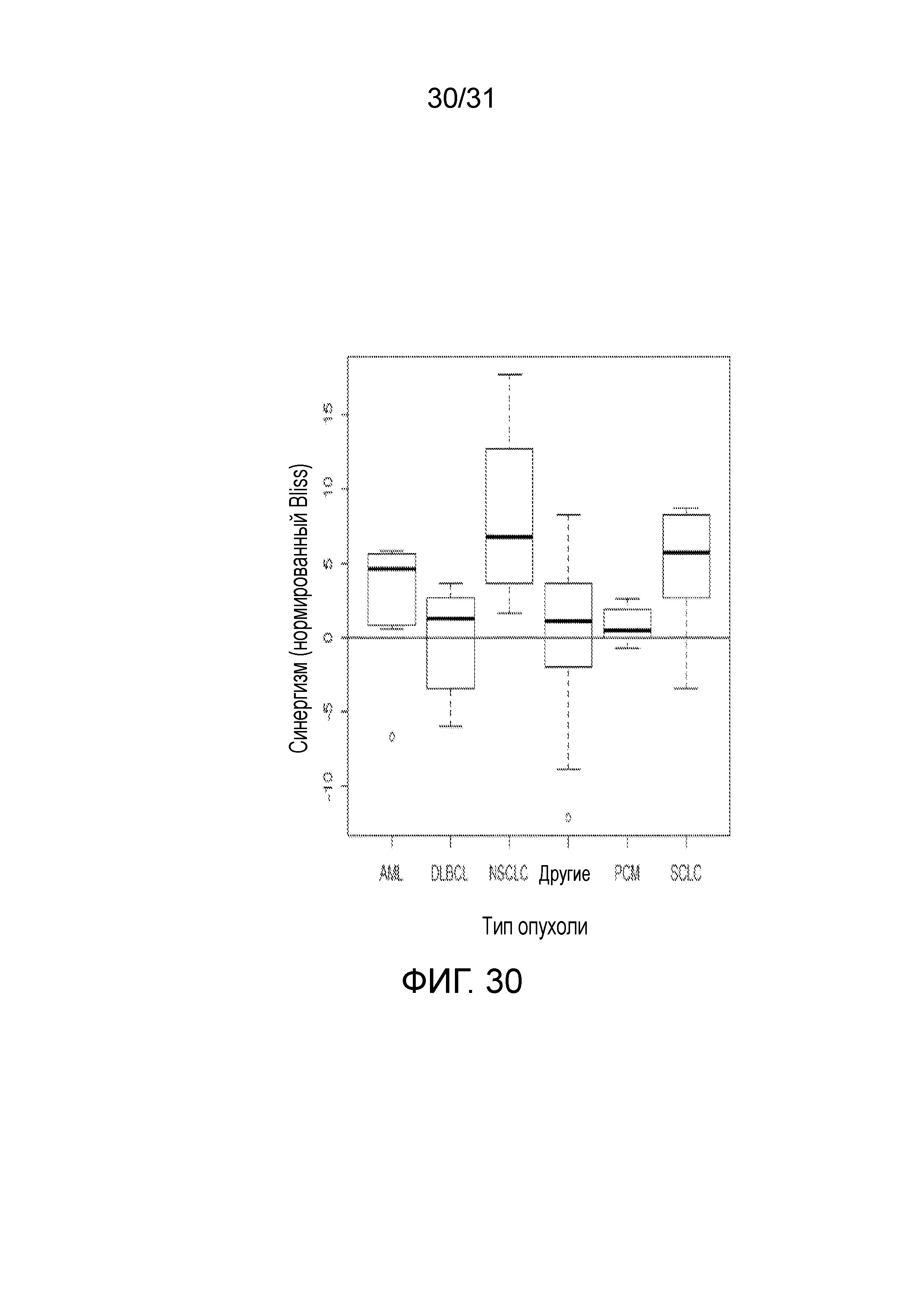
На фиг.30 представлена диаграмма, суммирующая Bliss-анализ соединения (2) в комбинации с карбоплатином согласно типу опухоли.
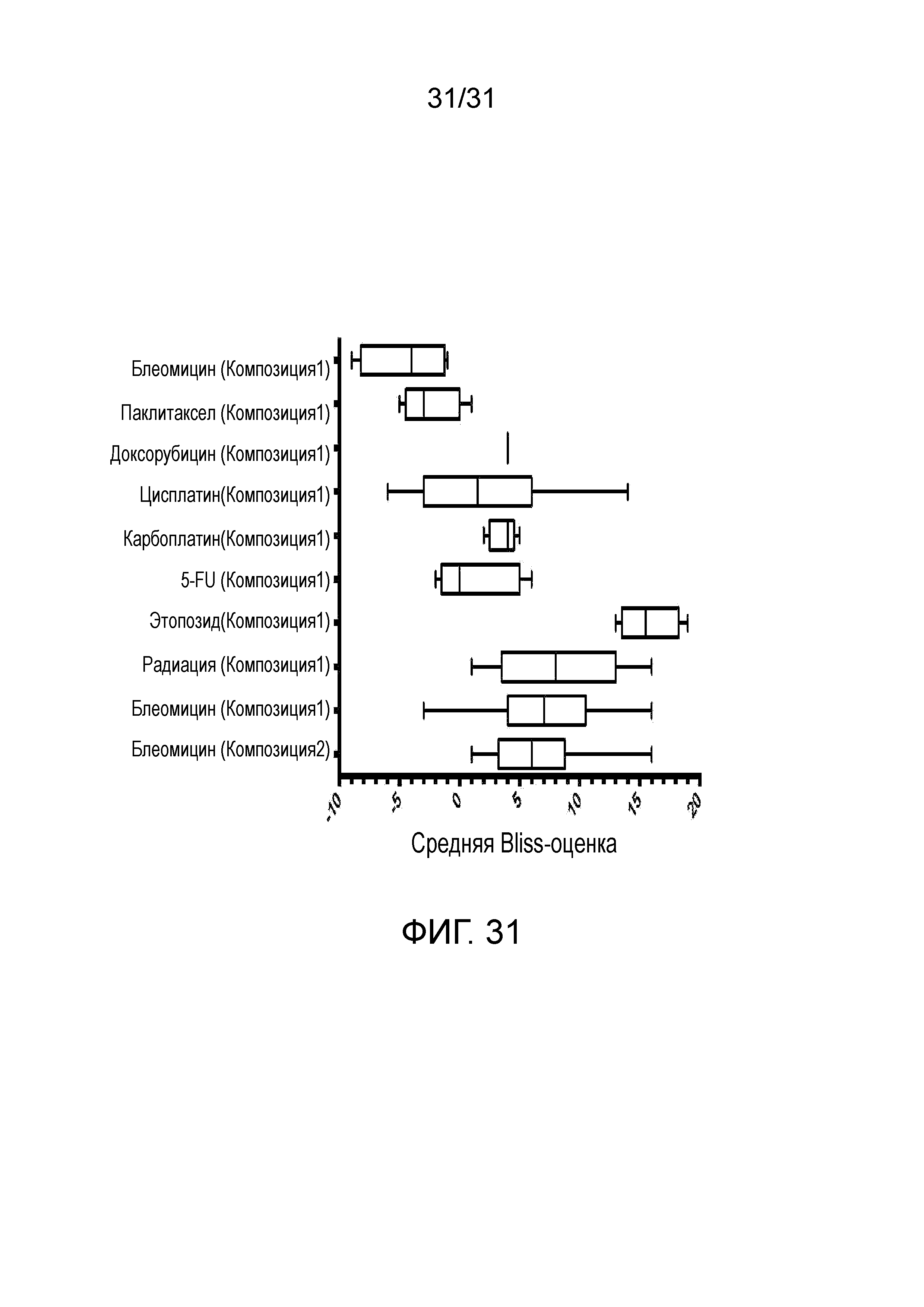
На фиг.31 представлена диаграмма, суммирующая Bliss-анализ соединения 1 или соединения 2 и стандарта представляющих интерес комбинаций в тестах на чувствительность к химиотерапевтическим препаратам первичной опухоли у человека.
Краткое изложение сущности изобретения
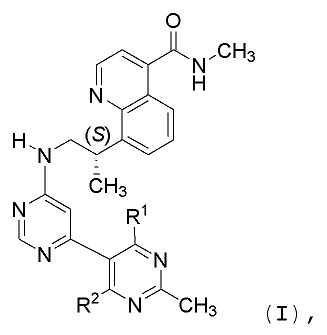
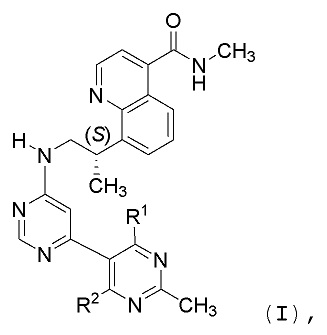
В первом аспекте, данное изобретение относится к со-кристаллу, содержащему соединение формулы I:
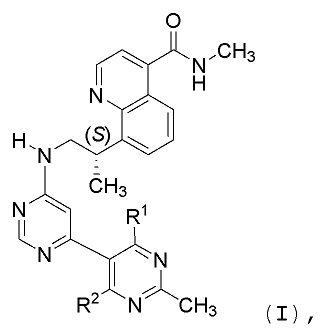
и образователь со-кристалла (CCF), выбираемый из группы, состоящей из адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты, где каждый из R1 и R2 означает водород или дейтерий.
В другом аспекте, данное изобретение относится к фармацевтической композиции, которая включает со-кристалл соединения формулы I, описанный выше. В одном воплощении, фармацевтическая композиция, далее, включает разбавитель, растворитель, эксципиент или носитель.
Еще в другом аспекте, данное изобретение относится к эвтектической твердой композиции, включающей: (а) со-кристалл, содержащий соединение формулы (I) и образователь со-кристалла, выбираемый из адипиновой кислоты, где каждый из R1 и R2 означает водород или дейтерий и где молярное соотношение соединения формулы I к адипиновой кислоте составляет от примерно 2 до 1; и (b) адипиновую кислоту. Еще в другом аспекте, данное изобретение относится к фармацевтической композиции, включающей такую эвтектическую твердую композицию. В одном воплощении, фармацевтическая композиция, далее, включает разбавитель, растворитель, эксципиент или носитель.
Другой аспект данного изобретения относится к способу получения со-кристалла из соединения формулы I и адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты. В одном воплощении, способ включает: получение соединения формулы I; получение образователя со-кристалла; измельчение, нагревание, со-сублимирование, со-расплавление или введение в контакт в растворе соединения формулы I с образователем со-кристалла, при условиях кристаллизации, с тем, чтобы образовать со-кристалл в твердой фазе; и затем, необязательно, выделение образованного таким образом со-кристалла. В другом воплощении, способ включает смешивание соединения формулы (I) с адипиновой кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой, янтарной кислотой или бензойной кислотой, при повышенной температуре, до образования со-кристалла. В некоторых воплощениях, получение со-кристалла из соединения формулы I и CCF включает предусмотрение соединения формулы I и адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты в молярном соотношении от примерно 1-1,2 до примерно 1-3,6, соответственно.
Еще в другом аспекте, данное изобретение относится к способу модулирования представляющих интерес химических или физических свойств (таких как температура плавления, растворимость, разжижение, гигроскопичность и биодоступность) со-кристалла, содержащего соединение формулы I и адипиновую кислоту, лимонную кислоту, фумаровую кислоту, малеиновую кислоту, янтарную кислоту или бензойную кислоту. Данный способ включает стадии измерения представляющих интерес химических или физических свойств соединения формулы I и CCF; определение молярной доли соединения формулы I и ССF, которая приводит, в результате, к желательному модулированию представляющих интерес химических или физических свойств; и получение со-кристалла с молярной долей, как определено.
Композиции и со-кристаллы согласно данному изобретению можно применять для лечения заболеваний, причастных к ингибированию или связанных с ингибированием DNA-РК. В особенности, данное изобретение относится к способу повышения чувствительности клетки к агенту, который вызывает повреждение ДНК, включающему введение в контакт клетки с со-кристаллом согласно данному изобретению или содержащей его фармацевтической композицией.
Данное изобретение, далее, относится к способам потенцирования лечебной схемы для лечения ракового заболевания, включающей введение индивидууму, нуждающемуся в этом, эффективного количества со-кристалла согласно данному изобретению или содержащей его фармацевтической композиции. В одном воплощении, лечебная схема для лечения ракового заболевания включает лучевую терапию.
Настоящее изобретение также относится к способам лечения ракового заболевания у животного, которые включают введение животному эффективного количества со-кристалла или фармацевтической композиции согласно данному изобретению. Данное изобретение, далее, относится к способам ингибирования роста раковых клеток, включая процессы клеточной пролиферации, инвазивность и метастазирование в биологических системах. Эти способы включают применение такого со-кристалла или фармацевтической композиции для ингибирования роста раковых клеток.
Данное изобретение относится к способу ингибирования активности DNA-PK в биологическом образце, который включает введение в контакт биологического образца с со-кристаллом или фармацевтической композицией согласно данному изобретению.
Также, в рамки данного изобретения входит способ лечения заболеваний, раскрытых в данном контексте, как например раковое заболевание, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества со-кристалла согласно данному изобретению или композиции согласно данному изобретению.
Подробное описание данного изобретения
В одном аспекте, данное изобретение относится к со-кристаллам, включающим соединение формулы I:

и образователь со-кристалла (CCF), выбираемый из группы, состоящей из адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты, где каждый из R1 и R2 означает водород или дейтерий.
В одном воплощении, соединение формулы I представляет собой (S)-N-метил-8-(1-((2’-метил-[4,5’-бипиримидин]-6-ил)амино)пропан-2-ил)хинолин-4-карбоксамид (Соединение 1).
В другом воплощении, соединение формулы I представляет собой (S)-N-метил-8-(1-((2’-метил-4’,6’-дидейтеро-[4,5’-бипиримидин]-6-ил)амино)пропан-2-ил)хинолин-4-карбоксамид (Соединение 2).
В одном воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и адипиновую кислоту в качестве CCF. В дальнейшем воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 6,46, 7,91, 11,92, 12,26, 12,99, 14,19, 18,68 и 19,07-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.1. Еще в другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.2. Еще в другом дальнейшем воплощении, термограмма дифференциальной сканирующей калориметрии (DSC) этого кристалла показывает температуры плавления, составляющие примерно 195°С и примерно 245°С.
В одном воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и лимонную кислоту в качестве CCF. В одном воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 7,44, 8,29, 11,35, 13,26, 15,49, 21,55 и 23,57-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.3. Еще в другом воплощении, соединение формулы I и CCF находятся как в твердом состоянии (например, кристаллическом), так и нековалентно связаны (то есть, путем водородной связи).
В одном воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и фумаровую кислоту в качестве CCF. В одном воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 8,26, 10,11, 14,97, 16,61, 17,22, 25,20 и 26,01-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.4. Еще в другом воплощении, соединение формулы I и CCF находятся как в твердом состоянии (например, кристаллическом), так и нековалентно связаны (то есть, путем водородной связи).
В одном воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и малеиновую кислоту в качестве CCF. В одном воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 6,21, 10,43, 11,28, 12,41, 13,26, 18,87 и 21,08-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.5. Еще в другом воплощении, соединение формулы I и CCF находятся как в твердом состоянии (например, кристаллическом), так и нековалентно связаны (то есть, путем водородной связи).
В одном воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и янтарную кислоту в качестве CCF. В одном воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 8,02, 12,34, 14,78, 17,32, 19,56 и 20,06-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.6. В другом воплощении, соединение формулы I и CCF находятся как в твердом состоянии (например, кристаллическом), так и нековалентно связаны (то есть, путем водородной связи).
Еще в другом воплощении, данное изобретение относится к со-кристаллу, который включает соединение формулы I и бензойную кислоту в качестве CCF. В одном воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения при примерно 8,70, 13,90, 15,62, 17,65, 18,15, 20,77 и 24,72-θ. В другом воплощении, порошковая рентгенограмма этого со-кристалла показывает пики отражения, как показано на фиг.7. В другом воплощении, соединение формулы I и CCF находятся как в твердом состоянии (например, кристаллическом), так и нековалентно связаны.
В одном воплощении, данное изобретение относится к со-кристаллам формулы (Соединение 1)n:(AA)m, где n означает 1 и m означает между 0,4 и 2,1. В одном воплощении, n означает 1 и m означает между 0,9 и 3,1. В одном воплощении, для со-кристаллов, содержащих адипиновую кислоту, n означает примерно 2 и m означает примерно 1. В одном воплощении, для со-кристаллов, содержащих адипиновую кислоту, n означает примерно 2 и m означает примерно 1.
В другом воплощении, данное изобретение относится к со-кристаллам формулы (Соединение 2)n:(AA)m, где n означает 1 и m означает между 0,4 и 2,1. В одном воплощении, для со-кристаллов, содержащих адипиновую кислоту, n означает примерно 2 и m означает примерно 1.
В другом воплощении, данное изобретение относится к со-кристаллу из соединения формулы I и CCF в виде адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты, где со-кристалл находится в твердом состоянии при комнатной температуре и соединение формулы I и CCF взаимодействуют посредством нековалентных связей. В некоторых воплощениях, взаимодействия посредством нековалентной связи между соединением формулы I и CCF включают водородную связь и силы ван-дер-Ваальса. В одном воплощении, CCF представляет собой адипиновую кислоту.
В одном воплощении, данное изобретение относится к со-кристаллу из соединения (1) и адипиновой кислоты в качестве CCF, где молярное соотношение соединения (1) к адипиновой кислоте составляет примерно 2:1.
В другом воплощении, данное изобретение относится к со-кристаллу из соединения (2) и адипиновой кислоты в качестве CCF, где молярное соотношение соединения (2) к адипиновой кислоте составляет примерно 2:1.
В другом воплощении, со-кристалл из соединения (2) и адипиновой кислоты в качестве CCF (со-кристалл адипиновой кислоты с соединением (2)) находится в полиморфной форме А или В. Полиморфные формы А и В представляют собой два конформационных полиморфа со-кристалла адипиновой кислоты с соединением (2). Еще в другом воплощении, со-кристалл из соединения (1) и адипиновой кислоты в качестве CСF (со-кристалл адипиновой кислоты с соединением (1)) находится в полиморфной форме А или В. Полиморфные формы А и В представляют собой два конформационных полиморфа со-кристалла адипиновой кислоты с соединением (1) и их, в твердом состоянии, 13С-спектры ядерного магнитного резонанса, по существу, являются такими же, как таковые для полиморфных форм А и В соединения (2).
В одном конкретном воплощении, полиморфная форма А характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 117,1, 96,8, 95,7, 27,6, 14,8 част./млн. В другом конкретном воплощении, полиморфная форма А характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 161,6, 154,5, 117,1, 96,8, 95,7, 51,5, 50,2, 27,6, 25,6, 18,5 и 14,8 част./млн. Еще в другом конкретном воплощении, полиморфная форма А характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 179,4, 168,4, 161,6, 158,3, 154,5, 147,8, 145,7, 143,2, 141,8, 124,6, 117,1, 96,8, 95,7, 51,5, 50,2, 31,2, 30,1, 27,6, 25,6, 18,5 и 14,8 част./млн. Еще в другом конкретном воплощении, полиморфная форма А характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела, как показано на фиг.16 или 17.
В одном конкретном воплощении, полиморфная форма В характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 117,9, 97,3, 94,0, 26,7 и 15,7 част./млн. В другом конкретном воплощении, полиморфная форма В характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 161,7, 153,8, 117,9, 97,3, 94,0, 50,7, 25,3, 26,7, 18,8 и 15,7 част./млн. Еще в другом конкретном воплощении, полиморфная форма В характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела при примерно 179,1, 168,3, 158,1, 147,2, 142,4, 125,8, 124,5, 117,9, 97,3, 94,0, 32,3, 30,1, 26,7 и 15,7 част./млн. Еще в другом конкретном воплощении, форма В характеризуется посредством пиков 13С-спектроскопии ядерного магнитного резонанса твердого тела, как показано на фиг.17.
Еще в другом воплощении, со-кристалл из соединения (2) и CCF в виде адипиновой кислоты (со-кристалл адипиновой кислоты с соединением (2)) представляет собой смесь полиморфных форм А и В. Еще в другом воплощении, со-кристалл из соединения (1) и CCF, в виде адипиновой кислоты (со-кристалл адипиновой кислоты с соединением (1)) представляет собой смесь полиморфных форм А и В.
Настоящее изобретение охватывает со-кристаллы из соединения формулы I и CCF, описанные выше, в выделенной чистой форме или в виде смеси, в качестве твердой композиции, когда смешаны с другими веществами, как, например, свободная форма соединения формулы I или свободная форма CCF. В одном воплощении, данное изобретение относится к фармацевтически приемлемым композициям, включающим со-кристаллы из соединения формулы I и CCF, описанные выше, и дополнительный свободный CCF. В одном конкретном воплощении, композиции включают со-кристаллы из соединения (1) или (2) и адипиновой кислоты в качестве CCF, как описано выше, и дополнительную адипиновую кислоту. В некоторых конкретных воплощениях, общее молярное соотношение соединения формулы I к CCF (как часть со-кристаллов, так и свободный CCF, например, адипиновая кислота в со-кристаллах и свободная адипиновая кислота) в таких композициях находится в диапазоне от примерно 1:0,55 до примерно 1:100. В других конкретных воплощениях, общее молярное соотношение соединения формулы I к CCF в таких композициях находится в диапазоне от примерно 1:0,55 до примерно 1:50. В других конкретных воплощениях, общее молярное соотношение соединения формулы I к CCF в таких композициях находится в диапазоне от примерно 1:0,55 до примерно 1:10. В некоторых конкретных воплощениях, общее массовое соотношение соединения формулы I к CCF в таких композициях находится в диапазоне от примерно 85% масс.:15% масс. до примерно 60% масс.:40% масс. В других конкретных воплощениях, общее массовое соотношение соединения формулы I к CCF в таких композициях находится в диапазоне от примерно 70% масс.:30% масс. до примерно 60% масс.:40% масс. Еще в других воплощениях, общее массовое соотношение соединения формулы I к CCF в таких композициях составляет примерно 65% масс.:35% масс.
В другом воплощении, данное изобретение относится к эвтектическим твердым композициям, включающим: (а) со-кристалл, содержащий соединение формулы (I) и CCF, выбираемый из адипиновой кислоты, где каждый из R1 и R2 означает водород или дейтерий и где молярное соотношение соединения формулы I к адипиновой кислоте составляет примерно от 2 до 1; и (b) адипиновую кислоту. Как используется в данном контексте, термин «эвтектическое твердое вещество» означает твердое вещество, проистекающее от эвтектической реакции, известной в данной области. Без привязки к конкретной теории, эвтектическую реакцию определяют следующим образом:
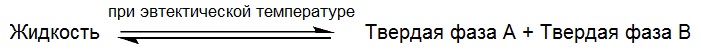
При эвтектической реакции, одна жидкая фаза и две твердых фазы, все, сосуществуют в одно и то же время и находятся в химическом равновесии. После охлаждения образуется сверхрешетка или микроструктура, из которой одновременно высвобождаются все ее компоненты в жидкой смеси (расплавы) при конкретной температуре (эвтектическая температура).
В одном воплощении, общее массовое соотношение соединения формулы I к адипиновой кислоте в эвтектических твердых композициях находится в диапазоне от примерно 70% масс.:30% масс. до примерно 60% масс.:40% масс. Еще в другом воплощении, общее массовое соотношение соединения формулы I к адипиновой кислоте находится в диапазоне примерно 65% масс.:35% масс. Еще в другом воплощении, молярное соотношение в со-кристалле соединения формулы I к адипиновой кислоте составляет примерно от 1 до 1,03.
Чистая форма означает, что конкретный со-кристалл или полиморфная форма включает выше 95% (масс./масс.), например, выше 98% (масс./масс.), выше 99% (масс./масс.), выше 99,5% (масс./масс.) или выше 99,9% (масс./масс.).
Более конкретно, настоящее изобретение также относится к фармацевтически приемлемым композициям, где каждый из со-кристаллов или полиморфных форм представлен в форме композиции или смеси полиморфной формы с одной или более другой(ими) кристаллической(ими) формой(ами), сольватом(ами), аморфным(и) веществом(ами) или другими полиморфными формами или их комбинациями. Например, в одном воплощении, композиции включают форму А со-кристалла адипиновой кислоты и соединения (2) вместе с одной или более другой(ими) полиморфной(ыми) формой(ами) соединения (2), как например аморфные формы, гидраты, сольваты и/или другие формы или их комбинации. В одном конкретном воплощении, композиции содержат форму А со-кристалла адипиновой кислоты и соединения (2) вместе с формой В со-кристалла адипиновой кислоты и соединения (2). Более конкретно, композиция может содержать от следовых количеств вплоть до 100% конкретной полиморфной формы, или любое количество, например, в диапазоне от 0,1% масс. до 0,5% масс., от 0,1% масс. до 1% масс., от 0,1% масс. до 2% масс., от 0,1% масс. до 5% масс., от 0,1% масс. до 10% масс., от 0,1% масс. до 20% масс., от 0,1% масс. до 30% масс., от 0,1% масс. до 40% масс., от 0,1% масс. до 50% масс., от 1% масс. до 50% масс. или от 10% масс. до 50% масс., в расчете на общее количество соединения формулы I в композиции. Альтернативно, композиция может содержать, по меньшей мере, 50% масс., 60% масс., 70% масс., 80% масс., 90% масс., 95% масс., 97% масс., 98% масс., 99% масс., 99,5% масс. или 99,9% масс. конкретной полиморфной формы, в расчете на общее количество соединения формулы I в композиции.
В одном воплощении, соединения согласно настоящему изобретению получают в форме индивидуального энантиомера, по меньшей мере, на 95%, по меньшей мере, на 97%, и, по меньшей мере, на 99% свободного от соответствующего энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (+)-энантиомера, по меньшей мере, на 95% свободного от соответствующего (-)-энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (+)-энантиомера, по меньшей мере, на 97% свободного от соответствующего (-)-энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (+)-энантиомера, по меньшей мере, на 99% свободного от соответствующего (-)-энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (-)-энантиомера, по меньшей мере, на 95% свободного от соответствующего (+)-энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (-)-энантиомера, по меньшей мере, на 97% свободного от соответствующего (+)-энантиомера.
В дальнейшем воплощении, соединения согласно настоящему изобретению находятся в форме (-)-энантиомера, по меньшей мере, на 99% свободного от соответствующего (+)-энантиомера.
Настоящее изобретение также относится к способам получения со-кристаллов, описанных выше. В одном воплощении, способы включают измельчение, нагревание, со-сублимирование, со-расплавление или контактирование, или (S)-N-метил-8-(1-((2’-метил-[4,5’-бипиримидин]-6-ил)амино)пропан-2-ил)хинолин-4-карбоксамида или (S)-N-метил-8-(1-((2’-метил-4’,6’-дидейтеро-[4,5’-бипиримидин]-6-ил)амино)пропан-2-ил)хинолин-4-карбоксамида с образователем со-кристалла, при условиях кристаллизации, для того, чтобы образовать со-кристалл в твердой фазе, где образователь со-кристалла выбирают из группы, состоящей из адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты.
В другом воплощении, способы включают смешивание соединения формулы (I) с CCF, выбираемом из группы, состоящей из адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты, при повышенной температуре, для образования со-кристалла. Соединение формулы (I) можно смешивать с CCF до образования смеси соединения и CCF, и затем смесь из соединения и CCF нагревают при повышенной температуре до образования со-кристалла. Альтернативно, стадии смешивания и нагревания можно осуществлять одновременно.
В одном конкретном воплощении, CCF представляет собой адипиновую кислоту и соединение формулы (I) смешивают с адипиновой кислотой при повышенной температуре, в диапазоне от примерно 110°С до примерно 195°С, до образования со-кристалла. В другом конкретном воплощении, повышенная температура находится в диапазоне от примерно 130°С до примерно 180°С или в диапазоне от примерно 140°С до примерно 160°С.
В другом конкретном воплощении, CCF представляет собой адипиновую кислоту и смешивают от 10% масс. до примерно 85% масс. соединения (I) и от примерно 90% масс. до 15% масс. адипиновой кислоты. Еще в другом конкретном воплощении, соединение (I) составляет от примерно 30% масс. до примерно 80% масс. и адипиновая кислота составляет от примерно 70% масс. до примерно 20% масс.. Еще в другом конкретном воплощении, соединение (I) составляет от примерно 50% масс. до примерно 80% масс. и адипиновая кислота составляет от примерно 50% масс. до примерно 20% масс. Еще в другом конкретном воплощении, соединение (I) составляет от примерно 60% масс. до примерно 70% масс. и адипиновая кислота составляет от примерно 40% масс. до примерно 30% масс. Еще в другом конкретном воплощении, соединение (I) составляет примерно 65% масс. и адипиновая кислота составляет примерно 35% масс.
Еще в другом воплощении, способы включают: предусмотрение соединения формулы I; предусмотрение образователя со-кристалла; измельчение, нагревание, со-сублимирование, со-расплавление или введение в контакт в растворе соединения формулы I с образователем со-кристалла, при условиях кристаллизации, для того, чтобы образовать со-кристалл в твердой фазе; и затем, необязательно, выделение образованного таким образом со-кристалла. В некоторых конкретных воплощениях, получение со-кристалла из соединения формулы I и CCF включает предусмотрение соединения формулы I и адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты в молярном соотношении от примерно 1-0,55 до примерно 1-3,6, соответственно. В некоторых конкретных воплощениях, получение со-кристалла из соединения формулы I и CCF включает предусмотрение соединения формулы I и адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты в молярном соотношении от примерно 1-1,2 до примерно 1-3,6, соответственно.
Еще в другом воплощении, данное изобретение относится к способам модулирования представляющих интерес химических или физических свойств (таких как температура плавления, растворимость, разжижение, гигроскопичность и биодоступность) со-кристалла, содержащего соединение формулы I и адипиновую кислоту, лимонную кислоту, фумаровую кислоту, малеиновую кислоту, янтарную кислоту или бензойную кислоту. Эти способы включают: определение представляющих интерес химических или физических свойств соединения формулы I и CCF; определение молярной доли соединения формулы I и ССF, которая приводит, в результате, к желательному модулированию представляющих интерес химических или физических свойств; и получение со-кристалла с молярной долей, как определено.
Как используется в данном контексте, используют следующие определения, за исключением иначе указанного. Для целей данного изобретения, химические элементы идентифицируют в соответствии с Периодической Таблицей Элементов, версия CAS, и Handbook of Chemistry and Physics, 75-ое изд., 1994. Дополнительно, общие принципы органической химии описаны в “Organic Chemistry,” Thomas Sorrell, University Science Books, Sausalito: 1999, и “March’s Advanced Organic Chemistry,” 5-ое изд., Smith, M.B. and March, J., изд. John Wiley & Sons, New York: 2001, полное содержание которых включено в данный контекст путем ссылки.
Для обозначений пиков отражения порошковой рентгенограммы, термин «примерно» означает диапазон +/- 0,2 относительно установленного значения. Для 13С-ЯМР-спектров ядерного магнитного резонанса твердого тела, под термином «примерно» подразумевают диапазон +/- 0,1 относительно установленного значения. Иным образом, под термином «примерно» подразумевают значение +/- 10% от установленного значения. Когда этот термин относится к ряду числовых значений, то применим к каждому из значений в этом ряду.
Для соединений согласно данному изобретению, в которых R1 или R2 означает дейтерий, соотношение дейтерия к водороду составляет, по меньшей мере, 5 к 1. В некоторых воплощениях, соотношение дейтерия к водороду составляет, по меньшей мере, 9 к 1. В других воплощениях, соотношение дейтерия к водороду составляет, по меньшей мере, 19 к 1.
Способы получения и охарактеризовывания со-кристалла хорошо документированы в литературе. См., например, Trask и др., Chem. Commun., 2004, 890-891; и О. Almarsson and M.J. Zaworotko, Chem. Commun., 2004, 1889-1896. Вообще, эти способы также являются пригодными для получения и охарактеризовывания со-кристаллов согласно данному изобретению.
Примеры получения со-кристаллов с активным фармацевтическим ингредиентом и CCF включают экструзию из расплава, размол на шаровой мельнице, плавление в реакционном блоке, выпаривание растворителя, конверсию в суспензию, смешивание, сублимирование или формование. В случае способа размола на шаровой мельнице, некоторые молярные соотношения компонентов со-кристалла (например, представляющее интерес соединение, как например соединение формулы I согласно данному изобретению и CCF) смешивают и размалывают с помощью шаровой мельницы. Необязательно, к смеси, размалываемой с помощью шаровой мельницы, можно добавлять растворитель, такой как метилэтилкетон, хлороформ и/или воду. После размалывания, смесь можно высушивать в вакууме или при комнатной температуре или при условиях нагревания, при которых обычно получают порошкообразный продукт. При способе плавления, смешивают компоненты со-кристалла (например, CCF и соединение формулы I), необязательно с растворителем, таким как ацетонитрил. Смесь затем помещают в реакционный блок с закрываемой крышкой и потом нагревают до эндотермической реакции. Полученную смесь затем охлаждают и растворитель, если используется, удаляют. В случае способа выпаривания растворителя, каждый компонент со-кристалла сначала растворяют в растворителе (например, смешанный растворитель, такой как азеотропная смесь метанола и дихлорметана или толуола и ацетонитрила (например, 50/50 по объему)), и растворы затем смешивают вместе. Смесь потом оставляют отстаиваться и растворитель выпаривают досуха до получения со-кристалла. В случае способа экструзии из расплава (НМЕ), новый продукт (экструдат) получают путем экструзии расплава через отверстие или головку (экструдер), при контролируемых условиях, таких как температура, смешивание, скорость подачи и давление. Экструдер обычно включает платформу, которая поддерживает движущийся механизм, цилиндр экструдера, вращающийся винт, расположенный на вале винта, и головку экструдера для придания продукту определенной формы. Альтернативно, головку экструдера можно удалять и продукт можно формировать другими способами. Типично, параметры процесса контролируют посредством связи с центральным электронным блоком управления. Движущийся механизм экструдера обычно включает мотор, коробку передач, сцепление и опорную часть, где барабан и винт, как правило, используют в блочно-модульной конфигурации. В случае данного изобретения можно использовать любые подходящие технологии НМЕ, известные в данной области, например, Gavin P. Andrews и др., “Hot-melt extrusion: an emerging drug delivery technology”, Pharmaceutical Technology Europe, том 21, Issue 1 (2009). В одном воплощении, со-кристаллы согласно данному изобретению получают посредством экструзии из расплава.
Примеры способов охарактеризовывания включают термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), порошковую рентгенографию (XRPD), спектроскопию ядерного магнитного резонанса твердого тела (ss-NMR), анализы растворимости, динамическую сорбцию паров, анализ поглощения инфракрасного излучения и стабильность суспензии. TGA можно использовать для исследования присутствия остаточных растворителей в образце со-кристалла и для идентификации температуры, при которой происходит деструкция каждого образца со-кристалла. DSC можно использовать для отслеживания термоперехода, происходящего в образце со-кристалла, в виде функции температуры, и определения точки плавления каждого образца со-кристалла. Порошковую рентгенографию можно использовать для структурной характеристики со-кристалла. Анализ растворимости можно осуществлять по отражению изменений в физическом состоянии каждого образца со-кристалла. Анализ стабильности суспензии можно использовать для определения химической стабильности образца со-кристалла в растворителе.
Фармацевтически приемлемые соли
Настоящее изобретение также охватывает со-кристаллы, образованные с фармацевтически приемлемыми солями соединений формулы I. Также, комбинированная терапия согласно данному изобретению, обсуждаемая ниже, включает введение соединений формулы I, и их фармацевтически приемлемых солей, и их со-кристаллов, описанных в данном контексте. Для лечения, соединения формулы I могут существовать в свободной форме или, если подходит, в виде фармацевтически приемлемой соли.
Фраза «фармацевтически приемлемая соль» означает любую нетоксичную соль соединения согласно данному изобретению, которая, после введения реципиенту, способна обеспечивать, или прямо или косвенно, доставку соединения согласно данному изобретению или ингибирующего активного метаболита или его остатка. Как используется в данном контексте, термин «ингибирующий активный метаболит или его остаток» означает, что метаболит или его остаток также представляет собой ингибитор DNA-РК.
Фармацевтически приемлемые соли являются хорошо известными в данной области. Например, S.M. Berge и др. описывают фармацевтически приемлемые соли более детально в статье в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенной в данный контекст путем ссылки. Фармацевтически приемлемые соли соединений согласно данному изобретению включают таковые, полученные с подходящими неорганическими и органическими кислотами и основаниями. Эти соли можно получать in situ, во время заключительного выделения и очистки соединений. Аддитивные соли с кислотами можно получать 1) путем введения во взаимодействие очищенного соединения в его форме свободного основания с подходящей органической или неогранической кислотой и 2) путем выделения таким образом полученной соли.
Примерами фармацевтически приемлемых нетоксичных аддитивных солей с кислотами являются соли аминогруппы, образованные с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или путем применения других способов, используемых в данной области, таких как ионный обмен.
Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, гликолят, глюконат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п.
Аддитивные соли с основаниями можно получать 1) путем введения во взаимодействие очищенного соединения в его кислотной форме с подходящим органическим или неорганическим основанием и 2) путем выделения таким образом полученной соли. Соли, полученные с соответствующими основаниями, включают соли щелочных металлов (как, например, натрий, литий и калий), соли щелочноземельных металлов (как, например, магний и кальций), аммониевые соли и соли N+(C1-4-алкил)4. Данное изобретение также охватывает кватернизацию любых основных, содержащих азот, групп соединений, раскрытых в данном контексте. Растворимые или диспергируемые в воде или масле продукты можно получать с помощью подобной кватернизации.
Далее, фармацевтически приемлемые соли включают, если соответствует, нетоксичные катионы аммония, четвертичного аммония и амина, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, (низший алкил)сульфонат и арилсульфонат. Другие кислоты и основания, когда сами фармацевтически неприемлемы, можно использовать для получения солей, пригодных в качестве промежуточных продуктов при получении соединений согласно данному изобретению и их фармацевтически приемлемых аддитивных солей с кислотами или основаниями.
Применение со-кристаллов и фармацевтических композиций согласно данному изобретению
Эффективное количество со-кристалла или фармацевтической композиции согласно данному изобретению можно использовать для лечения заболеваний, причастных к раковому заболеванию или связанных с ним. Эффективное количество представляет собой количество, которое требуется для предоставления терапевтического эффекта подвергаемому лечению субъекту, например, пациенту. Как используется в данном контексте, термины «субъект» и «пациент» используются взаимозаменяемо. Термины «субъект» и «пациент» относятся к животному (например, птица, такая как курица, перепелка или индюшка, или млекопитающее), в особенности, «млекопитающее» включает не приматов (например, корова, свинья, лошадь, овца, кролик, морская свинка, крыса, кошка, собака и мышь) и приматов (например, обезьяна, шимпанзе и человек), и, более конкретно, человека. В одном воплощении, субъект представляет собой не являющееся человеком животное, такое как сельскохозяйственное животное (например, лошадь, корова, свинья или овца) или домашнее животное (например, собака, кошка, морская свинка или кролик). В предпочтительном воплощении, субъект означает «человек».
Точное количество соединения, вводимое субъекту, зависит от способа введения, типа и тяжести ракового заболевания и характеристик субъекта, как например общее состояние здоровья, возраст, половой признак, масса тела и переносимость лекарственных средств. Квалифицированный врач должен быть способен определять соответствующие дозировки в зависимости от этих и других факторов. Когда осуществляют совместное введение с другими агентами, например, когда вводят совместно с противораковым лекарственным препаратом, «эффективное количество» второго агента зависит от типа используемого лекарственного средства. Подходящие дозировки являются известными для одобренных для применения агентов и могут быть установлены квалифицированным врачом в соответствии с состоянием субъекта, типом(ами) состояния(ий), которое(ые) подвергают лечению, и количеством используемого соединения, раскрытого в данном контексте. В случаях, где количество точно не указано, должно быть предположено эффективное количество. Как правило, схему приема лекарственного средства можно выбирать в соответствии с множеством факторов, включая нарушение, которое подвергают лечению, и тяжесть нарушения; активность используемого конкретного соединения; используемую конкретную композицию; возраст, массу тела, общее состояние здоровья, половой признак и диету пациента; время введения, путь введения и скорость экскреции используемого конкретного соединения; функцию почек и печени субъекта; и используемое конкретное соединение, или его соль, продолжительность лечения; лекарственные средства, используемые в комбинации или сочетаемые с используемым конкретным соединением, и тому подобные факторы, хорошо известные в медицинской практике. Квалифицированный врач может без труда определять и назначать эффективное количество соединений, раскрытых в данном контексте, требующееся для лечения, предупреждения, ингибирования (полностью или частично) или замедления прогрессирования заболевания.
Эффективное количество со-кристалла или фармацевтической композиции согласно данному изобретению составляет от примерно 0,1 мг/кг до примерно 200 мг/кг массы тела в сутки. В одном воплощении, эффективное количество со-кристалла или фармацевтической композиции согласно данному изобретению составляет от примерно 1 мг/кг до примерно 50 мг/кг массы тела в сутки. В другом воплощении, эффективное количество со-кристалла или фармацевтической композиции согласно данному изобретению составляет от примерно 2 мг/кг до примерно 20 мг/кг массы тела в сутки. Эффективные дозы также могут варьироваться, как известно квалифицированному специалисту в данной области, в зависимости от пути введения, используемого эксципиента и возможности совместного использования с другими терапиями, включая применение других терапевтических агентов и/или другой терапии.
Со-кристаллы или фармацевтические композиции согласно данному изобретению можно вводить субъекту, нуждающемуся в этом (например, клетки, ткань или пациент (включая животное или человека)), посредством любого способа, который позволяет осуществлять доставку соединения формулы I, например, перорально, внутривенно или парентерально. Например, эти композиции можно вводить посредством пилюль, таблеток, капсул, аэрозолей, суппозиториев, жидких готовых лекарственных форм для проглатывания или инъекции.
Как описано выше, фармацевтически приемлемые композиции согласно настоящему изобретению дополнительно содержат фармацевтически приемлемый носитель, вспомогательное вещество или наполнитель, который, как используется в данном контексте, включает любой и все растворители, разбавители или другой жидкий наполнитель, вспомогательные для диспергирования или суспендирования вещества, поверхностно-активные агенты, изотонические агенты, загустители или эмульгирующие агенты, консерванты, твердые связующие агенты, смазочные вещества и т.п., которые подходят для желательной конкретной лекарственной формы. В руководствах Remington: The Science and Practice of Pharmacy, 21-ое изд., 2005, изд. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia, и Encyclopedia of Pharmaceutical Technology, изд. J. Swarbrick and J.C. Boylan, 1988-1999, Marcel Dekker, New York, содержания каждого из которых включены в данный контекст путем ссылки, раскрыты различные носители, используемые в готовых фармацевтически приемлемых композициях, и известные способы их получения. За исключением случаев, когда какая-либо стандартная среда-носитель является несовместимой с соединениями согласно данному изобретению, как например за счет продуцирования какого-либо нежелательного биологического эффекта или в других отношениях взаимодействия вредоносным образом с любым(и) другим(и) компонентом(ами) фармацевтически приемлемой композиции, ее использование рассматривается в рамках данного изобретения.
Фармацевтически приемлемый носитель может содержать инертные ингредиенты, которые не ингибируют чрезмерно биологическую активность соединений. Фармацевтически приемлемые носители должны быть биосовместимыми, например, нетоксичными, невоспалительными, неиммуногенными или лишенными других нежелательных реакций или побочных эффектов после введения субъекту. Можно использовать стандартные способы получения фармацевтических композиций.
Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваясь этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки (такие как человеческий сывороточный альбумин), забуферивающие вещества (такие как Twin 80, фосфаты, глицин, сорбиновая кислота или сорбат калия), смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты (такие как протаминсульфат, динатрийгидрофосфат, гидрофосфат калия, хлорид натрия или соли цинка), коллоидный кремнезем, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блокполимеры полиэтилена и полиоксипропилена, метилцеллюлозу, гидроксипропилметилцеллюлозу, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозитория; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; непирогенную воду; изотонический раствор хлорида натрия; раствор Рингера; этиловый спирт и растворы фосфатного буфера, а также другие нетоксичные совместимые смазочные вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивы, покровные агенты, подсластители, агенты для придания вкуса и ароматизирующие добавки, консерванты и антиоксиданты также могут присутствовать в этой композиции, в соответствии с установленной рецептурой.
В одном конкретном примере, фармацевтически приемлемые композиции согласно данному изобретению содержат метилцеллюлозу, как например около 0,5% масс. метилцеллюлозы. В другом конкретном примере, фармацевтически приемлемые композиции согласно данному изобретению содержат метилцеллюлозу и бензойную кислоту, как например около 0,5% масс. метилцеллюлозы и около 0,2% масс. бензойной кислоты. В другом конкретном примере, фармацевтически приемлемые композиции содержат метилцеллюлозу и бензойную кислоту, как например около 0,5% масс. метилцеллюлозы, около 0,1% масс. бензойной кислоты, около 0,1% масс. бензоата натрия. В некоторых воплощениях, фармацевтические композиции, далее, содержат свободную адипиновую кислоту (свободный CCF, который не является CCF со-кристаллов согласно данному изобретению). Такая адипиновая кислота находится в концентрации, например, от примерно 5 мг/[г наполнителя] до примерно 10 мг/[г наполнителя], как, например, около 8,8 мг/[г наполнителя].
Любую перорально приемлемую лекарственную форму, включая, но не ограничиваясь этим, капсулы, таблетки, водные суспензии или растворы, можно использовать для перорального введения. В случае таблеток для перорального применения, обычно используемые носители включают, но не ограничиваясь этим, лактозу и кукурузный крахмал. Обычно также добавляют смазочные агенты, такие как стеарат магния. Для перорального введения в форме капсулы, пригодные разбавители включают лактозу и сухой кукурузный крахмал. Когда требуются водные суспензии для перорального применения, активный ингредиент комбинируют с эмульгирующими и суспендирующими агентами. Если желательно, также можно добавлять некоторые подсластители, агенты для придания вкуса или красители.
Жидкие лекарственные формы для перорального введения включают, но не ограничиваясь этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в особенности, хлопковое масло, арахисовое масло, кукурузное масло, семечковое масло, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сорбитановые эфиры жирных кислот, и их смеси. По сравнению с инертными разбавителями, пероральные композиции также могут включать вспомогательные агенты, такие как смачивающие вещества, эмульгаторы и суспендирующие агенты, подсластители, агенты для придания вкуса и ароматизирующие добавки.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах, активное соединение смешано, по меньшей мере, с одним инертным, фармацевтически приемлемым эксципиентом или носителем, как, например, цитрат натрия или дикальцийфосфат и/или а) с наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит или кремниевая кислота, b) со связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и гуммиарабик, с) с увлажнителями, такими как глицерин, d) с дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, е) с замедляющими растворение агентами, такими как парафин, f) с ускорителями абсорбции, такими как соединения четвертичного аммония, g) со смачивающими веществами, такими как, например, цетиловый спирт и глицерилмоностеарат, h) с абсорбентами, такими как каолиновая и бентонитовая глины, и i) со смазочными веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль, лекарственная форма также может содержать забуферивающие агенты.
Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, также как полиэтиленгликоли с высокой молекулярной массой и т.п. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул можно получать с нанесенными покрытиями и оболочками, как например энтеросолюбильные покрытия и другие покрытия, хорошо известные в области получения готовых лекарственных форм. Они необязательно могут содержать опалесцирующие агенты и также могут быть такого состава, что они высвобождают активный(е) ингредиент(ы) только, или, предпочтительно, в определенной части желудочно-кишечного тракта, необязательно, пролонгированным образом. Примеры заливочных составов, которые можно использовать, включают полимерные вещества и воски. Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и т.п.
Микроинкапсулированные формы с одним или более эксципиентом(ами), как указано выше, также можно использовать согласно данному изобретению. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия с контролируемым высвобождением и другие покрытия, хорошо известные в данной области получения готовых лекарственных форм. В таких твердых лекарственных формах активное соединение может быть смешано, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также могут содержать, как это имеет место в обычной практике, дополнительные вещества, другие, чем инертные разбавители, например, смазочные вещества для таблетирования и другие вспомогательные для таблетирования вещества, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы также могут содержать забуферивающие агенты. Они необязательно могут содержать опалесцирующие агенты и также могут быть такого состава, что они высвобождаются активный(е) ингредиент(ы) только, или предпочтительно, в определенной части желудочно-кишечного тракта, необязательно, пролонгированным образом. Примеры заливочных составов, которые можно использовать, включают полимерные вещества и воски.
Готовые лекарственные формы для инъекций, например, стерильные водные или масляные суспензии для инъекций, можно получать в соответствии с известным уровнем техники, используя подходящие диспергирующие или смачивающие агенты и суспендирующие агенты. Стерильные готовые лекарственные формы для инъекций также могут представлять собой стерильный(ную) инъецируемый(мую) раствор, суспензию или эмульсию, в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых разбавителей и растворителей, которые можно использовать, находятся вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. В дополнение, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели, можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. В дополнение, жирные кислоты, такие как олеиновая кислота, используют для получения растворов для инъекций.
Готовые лекарственные формы для инъекций можно стерилизовать, например, путем фильтрации через удерживающий бактерии фильтр или путем включения стерилизующих агентов, в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной среде для инъекций, перед использованием.
Стерильные формы для инъекций могут представлять собой водную или масляную суспензию. Эти суспензии можно получать в соответствии со способами, известными в данной области, используя подходящие диспергирующие или смачивающие агенты и суспендирующие агенты. Стерильные готовые лекарственные формы для инъекций также могут представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых разбавителей и растворителей, которые можно использовать, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели, можно использовать любое смешивающееся нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны для получения препаратов для инъекций, в виде натуральных фармацевтически приемлемых масел, таких как оливковое масло или касторовое масло, в особенности, в их полиоксиэтиленированных версиях. Эти масляные растворы или суспензии также могут содержать разбавитель на основе спирта с длинной цепью или диспергирующий агент, такой как карбоксиметилцеллюлоза, или подобные диспергирующие агенты, которые обычно используют при получении фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Также, для целей получения готовых лекарственных форм, можно использовать другие обычно используемые поверхностно-активные вещества, такие как Tweens, Spans, и другие эмульгирующие агенты или биодоступные усиливающие агенты, которые обычно используют при получении фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Для того, чтобы пролонгировать эффект вводимых активных соединений, часто является желательным замедление абсорбции соединения из подкожной или внутримышечной инъекции. Этого можно достигать путем использования жидкой суспензии из кристаллического или аморфного вещества с плохой растворимостью в воде. Скорость абсорбции соединения затем зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленной абсорбции парентерально вводимой формы соединения достигают путем растворения или суспендирования соединения в масляном разбавителе. «Депо»-формы для инъекций получают путем формования микроинкапсулированных матриц активного соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения активного соединения к полимеру и природы конкретного используемого полимера, скорость высвобождения соединения можно контролировать. Примеры других биоразлагаемых полимеров включают поли(сложные ортоэфиры) и поли(ангидриды). Замедленно всасываемые инъецируемые готовые лекарственные формы также получают путем захвата соединения липосомами или микроэмульсиями, которые являются совместимыми с тканями организма.
Если желательно, можно использовать вышеописанные готовые лекарственные формы, адаптированные к замедленному высвобождению активного ингредиента.
Композиции для ректального или вагинального введения представляют собой специфические суппозитории, которые можно получать путем смешивания активного соединения с подходящими, не вызывающими раздражение, эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозитория, который является твердым при температуре окружающей среды, но жидким при температуре тела, и, следовательно, расплавляется в прямой кишке или вагинальной полости и высвобождает активное соединение.
Лекарственные формы для местного или трансдермального введения включают мази, пасты, крема, лосьоны, гели, порошки, растворы, спреи, средства для ингаляции или пластыри. Активный компонент смешивают, в стерильных условиях, с фармацевтически приемлемым носителем и любым необходимым консервантом или буфером, если требуется. Офтальмические готовые лекарственные формы, капли для ушей и капли для глаз также рассматриваются в рамках данного изобретения. Дополнительно, также можно использовать трансдермальные пластыри, которые имеют дополнительное преимущество для обеспечения контроля доставки соединения в организм. Такие лекарственные формы можно получать путем растворения или распределения соединения в подходящей среде. Усилители абсорбции также можно использовать для увеличения потока соединения через кожу. Скорость можно контролировать или путем обеспечения контролируемой скорости через мембрану или путем диспергирования соединения в полимерной матрице или геле.
Альтернативно, активные соединения и содержащие их фармацевтически приемлемые композиции также можно вводить с помощью назального аэрозоля или ингаляции. Такие композиции получают в соответствии со способами, хорошо известными в области получения готовых лекарственных форм, и их можно получать в виде растворов в физиологическом растворе, при использовании бензилового спирта или других подходящих консервантов, активаторов абсорбции для усиления биодоступности, фторуглеродов и/или других стандартных солюбилизирующих или диспергирующих агентов.
Со-кристаллы или фармацевтические композиции согласно данному изобретению также можно доставлять путем имплантации (например, хирургическим путем), с помощью устройства для имплантации. Примеры устройств для имплантации включают, но не ограничиваясь этим, стенты, нагнетательные насосы, имплантируемые в кровеносные сосуды фильтры, и контроль за высвобождением композиций во время имплантации. Любое устройство для имплантации можно использовать для доставки соединения формулы I, в качестве активного ингредиента в со-кристаллах или в фармацевтических композициях согласно данному изобретению, при условии, что 1) устройство, соединение формулы I и любая фармацевтическая композиция, включая данное соединение, являются биосовместимыми, и 2) что устройство может доставлять или высвобождать эффективное количество соединения, для предоставления терапевтического эффекта подвергающемуся лечению пациенту.
Доставка терапевтических агентов посредством стентов, нагнетательные насосы (например, осмотические мини-насосы) и другие устройства для имплантации, являются известными в данной области. См., например, статью "Recent Developments in Coated Stents", Hofma и др., опубликовано в Current Interventional Cardiology Reports, 2001, 3: 28-36, полное содержание которой, включая указанные там ссылки, включено в данный контекст путем ссылки. Другие описания устройств для имплантации, таких как стенты, можно найти в патентах США под номерами 6569195 и 6322847, и в Международных заявках PCT под номерами WO 04/0044405, WO 04/0018228, WO 03/0229390, WO 03/0228346, WO 03/0225450, WO 03/0216699 и WO 03/0204168, каждый(ая) из которых (а также другие публикации, указанные там), во всей его(ее) полноте включен(а) в данный контекст путем ссылки.
Активные соединения и содержащие их фармацевтически приемлемые композиции могут быть использованы для получения лекарственных средств, в виде унифицированных лекарственных форм. Термин «унифицированная лекарственная форма» относится к физически дискретным единицам, подходящим в качестве однократной дозы для субъектов, подвергающихся лечению, с каждой единицей, содержащей предварительно определенное количество активного вещества, рассчитанное для получения желательного терапевтического эффекта, необязательно, в сочетании с подходящим фармацевтическим носителем. Унифицированная лекарственная форма может представлять собой разовую суточную дозу или одну из множественных суточных доз (например, примерно 1-4 или более раз в сутки). Когда используют множественные суточные дозы, унифицированная лекарственная форма может быть одинаковой или различной для каждой дозы. Количество активного соединения в унифицированной лекарственной форме варьируется в зависимости, например, от подвергаемого лечению хозяина и конкретного пути введения, например, от примерно 0,1 мг/кг до примерно 200 мг/кг массы тела, в сутки.
В одном воплощении, данное изобретение относится к способам потенцирования терапевтического режима при лечении ракового заболевания. Эти способы включают стадию введения индивидууму, нуждающемуся в этом, эффективного количества со-кристалла согласно данному изобретению или содержащей его фармацевтической композиции. Соединения формулы I и их со-кристаллы, без привязки к конкретной теории, могут ингибировать DNA-РК. DNA-РК играет важную роль в выживаемости клеток, например, раковых клеток, после повреждения ДНК, за счет ее активности в отношении репарации двухцепочечных разрывов (DSBs), путем соединения негомологичных концов (NHEJ). Нацеливание на DNA-РК, следовательно, может улучшать результаты, в случае пациента с раковым заболеванием, в особенности, у пациентов с раковым заболеванием, которые получают терапии для индуцирования DSBs в опухолевых клетках, так как DSBs в опухолевых клетках не могут восстанавливаться и быстро приводят к гибели клеток. В некоторых воплощениях, способы согласно данному изобретению потенцируют терапевтический режим для индуцирования DSBs. Примеры таких терапий включают радиотерапию (RT) и некоторые химиотерапии, такие как ингибиторы топоизомеразы I (например, топотекан, иринотекан/SN38, рубитекан и другие производные), ингибиторы топоизомеразы II (например, этопозид и доксил), интеркаляторы ДНК (например, доксорубицин или эпирубицин), радиомиметики (например, блеомицин), ингибиторы PARP (например, BMN-673), ингибиторы репарации ДНК (например, карбоплатин), кросс-линкеры ДНК (например, цисплатин), ингибиторы тимидилатсинтазы (например, фторурацил (5-FU)), митотические ингибиторы (например, паклитаксел), ингибиторы EGFR (например, эрлотиниб) и моноклональные антитела EGFR (например, цетуксимаб).
В одном конкретном воплощении, вышеуказанный потенцированный терапевтический режим для лечения ракового заболевания включает, по меньшей мере, одну химиотерапию, выбираемую из группы, состоящей из ингибитора топоизомеразы I, ингибитора топоизомеразы II, интеркалятора ДНК, радиомиметика, ингибитора PARP, ингибитора репарации ДНК, кросс-линкеров ДНК, ингибитора тимидилатсинтазы, митотического ингибитора, ингибитора EGFR, моноклонального антитела EGFR или облучения. В другом конкретном воплощении, терапевтический режим для лечения ракового заболевания включает радиотерапию. Со-кристаллы или фармацевтические композиции согласно данному изобретению являются пригодными в случаях, когда радиотерапия показана для увеличения терапевтической пользы такого лечения. В дополнение, радиотерапия часто показана как вспомогательная для хирургии при лечении ракового заболевания. Вообще, задачей радиотерапии, при вспомогательном регулировании, является снижение риска повторения и увеличение безрецидивной выживаемости, когда контролируют первичную опухоль. Например, вспомогательная радиотерапия показана при раковых заболеваниях, включая, но не ограничиваясь этим, рак молочной железы, рак прямой кишки, рак желудка, фибросаркому, глиобластому, гепатоцеллюлярную карциному, карциному сквамозных клеток головы и шеи, меланому, рак легких, рак поджелудочной железы и рак предстательной железы, как описано ниже. Еще в другом отдельном воплощении, терапевтический режим при лечении ракового заболевания включает как радиотерапию, так и химиотерапию, по меньшей мере, одним из химиотерапевтических агентов, выбираемым из группы, состоящей из ингибиторов топоизомеразы I, ингибиторов топоизомеразы II, интеркаляторов ДНК, радиомиметиков, ингибиторов PARP, ингибиторов репарации ДНК, кросс-линкеров ДНК, ингибиторов тимидилатсинтазы, митотических ингибиторов, ингибиторов EGFR или моноклональных антител EGFR.
В другом воплощении, данное изобретение относится к способам ингибирования или предупреждения репарации повреждений ДНК путем гомологичной рекомбинации в раковых клетках. Другое воплощение относится к способам промотирования гибели клеток в случае раковых клеток. Еще другое воплощение относится к способам или предупреждению репарации клеток при повреждении ДНК в случае раковых клеток.
Данное изобретение, далее, относится к сенсибилизации (например, радиосенсибилизация) клеток опухоли путем использования со-кристалла или фармацевтической композиции согласно данному изобретению. Соответственно, такой со-кристалл или фармацевтическая композиция может «радиосенсибилизировать» клетку, когда вводят животным в терапевтически эффективном количестве для увеличения чувствительности клеток к электромагнитному излучению и/или для способствования лечению заболеваний, которые поддаются лечению с помощью электромагнитного излучения (например, рентгеновские лучи). Заболевания, которые поддаются лечению с помощью электромагнитного излучения, включают новообразования, доброкачественные и злокачественные опухоли и раковые клетки. В некоторых воплощениях, данное изобретение, далее, относится к сенсибилизации клеток опухоли с помощью повреждающих ДНК агентов.
Настоящее изобретение также относится к способам лечения ракового заболевания у животных, которые включают введение этому животному эффективного количества соединения формулы (I) или его со-кристалла, или фармацевтической композиции согласно данному изобретению. Данное изобретение, далее, относится к способам ингибирования роста раковых клеток, включая процессы клеточной пролиферации, инвазивность и метастазирование в биологических системах. Эти способы включают применение такого со-кристалла или фармацевтической композиции для ингибирования роста раковых клеток. Предпочтительно, эти способы применяют для ингибирования или снижения роста раковых клеток, инвазивности, метастазирования или степени роста опухоли у живых животных, таких как млекопитающие. Способы согласно данному изобретению также без труда можно адаптировать к применению при анализах систем, например, анализ роста раковых клеток и их свойств, а также для идентификации соединений, которые наносят вред росту раковых клеток.
Опухоли или новообразования включают рост клеток ткани, при котором увеличение количества клеток является неконтролируемым и прогрессирующим. Некоторый такой рост является доброкачественным, но другой тип роста называют термином «злокачественный» и он может приводить к гибели организма. Злокачественные новообразования или «раковые заболевания» отличаются от доброкачественного роста тем, что, в дополнение к проявлению агрессивной клеточной пролиферации, они могут поражать ближайшие ткани и образовывать метастазы. Кроме того, злокачественные новообразования характеризуются тем, что они показывают более сильную потерю дифференцировки (более сильное, чем «дедифференцировка») и их организацию одних относительно других и окружающих их тканей. Это свойство также называют «анаплазия».
Новообразования, подвергаемые лечению согласно настоящему изобретению, также включают солидные опухоли, то есть, карциномы и саркомы.
Карциномы включают такие злокачественные новообразования, происходящие от эпителиальных клеток, которые проникают (внедряются) в окружающие ткани и дают начало метастазам. Аденокарциномы представляют собой карциномы, происходящие от железистой ткани или от тканей, которые образуют распознаваемые железистые структуры. Другая обширная категория раковых заболеваний включает саркомы, которые являются опухолями, клетки которых внедряются в фибриллярное или гомогенное вещество, подобное эмбриональной соединительной ткани. Данное изобретение также делает возможным лечение раковых заболеваний миелоидных или лимфоидных систем, включая лейкоз, лимфомы и другие раковые заболевания, которые обычно не присутствуют в виде опухолевой массы, но распределены в сосудистой или лимфоретикулярной системах.
Активность DNA-РК может быть связана с различными формами ракового заболевания, например, онкология у взрослых и педиатрическая онкология, рост солидных опухолей или злокачественных образований, миксоидный и круглоклеточный рак, локальные прогрессирующие опухоли, метастатический рак, саркома мягких тканей человека, включая саркому Эвинга, метастазы при раковом заболевании, включая метастазы в лимфоузлах, карциному сквамозных клеток, в особенности, головы и шеи, карциному сквамозных клеток пищевода, карциному ротовой полости, злокачественные образования в клетках крови, включая множественную миелому, лейкоз, включая острый лимфоцитный лейкоз, острый нелимфоцитный лейкоз, хронический лимфоцитный лейкоз, хронический миелоцитный лейкоз и лейкоз ворсистых клеток, первичную выпотную лимфому (лимфома в полости тела), лимфому тимуса, рак легких, включая мелкоклеточную карциному, кожную Т-клеточную лимфому, лимфому Ходжкина, лимфому, не относящуюся к лимфоме Ходжкина, рак коры надпочечников, опухоли, происходящие от АСТН, немелкоклеточный рак, рак молочной железы, включая мелкоклеточную карциному и карциному из эпителия протоков, рак желудочно-кишечного тракта, включая рак желудка, рак толстой кишки, колоректальный рак, полипы, связанные с колоректальной неоплазией, рак поджелудочной железы, рак печени, рак урологической системы, включая рак мочевого пузыря, включая первичную поверхностную опухоль мочевого пузыря, инвазивный переходно-клеточный рак мочевого пузыря и мышечно-инвазивный рак мочевого пузыря, рак предстательной железы, злокачественные опухоли половых путей у женщин, включая рак яичников, первичные перитонеальные эпителиальные новообразования, карцинома шеи, эндометриальный рак матки, рак влагалища, рак вульвы, рак матки и солидные опухоли в яичниковых фолликулах, злокачественные опухоли половых путей у мужчин, включая тестикулярный рак и рак мужского полового члена, рак почек, включая почечно-клеточную карциному, рак головного мозга, включая внутренние опухоли головного мозга, нейробластому, астроцитные опухоли головного мозга, глиомы, метастатические опухоли инвазивных клеток в центральной нервной системе, рак костей скелета, включая остеомы и остеосаркомы, рак кожи, включая злокачественную меланому, прогрессирующую опухоль кератиноцитов кожи человека, рак сквамозных клеток, рак щитовидной железы, ретинобластому, нейробластому, перитонеальный выпот, злокачественный плевральный выпот, мезотелиому, опухоли Вильмса, рак желчного пузыря, трофобластические новообразования, гемангиоперицитому и саркому Капоши. Таким образом, также в рамки данного изобретения входит способ лечения таких заболеваний, который включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества со-кристалла согласно данному изобретению или фармацевтической композиции согласно данному изобретению.
В некоторых воплощениях, данное изобретение применяют для лечения рака легких (например, немелкоклеточный рак легких (NSCLC), мелкоклеточный рак легких (SCLC) или обширный мелкоклеточный рак легких (ED-SCLC)), рака молочной железы (например, трижды негативный рак молочной железы), рака предстательной железы, злокачественных образований в небелковой части гемоглобина (например, острый миелоидный лейкоз (AML)), миеломы (например, плазмоклеточная миелома (РСМ)), желудочно-пищеводного рака (GEJ), рака яичников, рака толстой кишки, рака глотки, рака поджелудочной железы, рака желудка, рака пищевода, лимфомы (например, диффузная крупноклеточная В-клеточная лимфома (DLBL)) или фибробласта легких. В некоторых конкретных воплощениях, данное изобретение применяют для лечения рака легких (например, немелкоклеточный рак легких (NSCLC), мелкоклеточный рак легких (SCLC) или обширный мелкоклеточный рак легких (ED-SCLC)), рака молочной железы (например, трижды негативный рак молочной железы), рака предстательной железы, острого миелоидного лейкоза, миеломы, желудочно-пищеводного рака (GEJ) или рака яичников. В некоторых конкретных воплощениях, данное изобретение применяют для лечения рака легких, такого как немелкоклеточный рак легких (NSCLC) или мелкоклеточный рак легких, такой как обширный мелкоклеточный рак легких (ED-SCLC). В некоторых конкретных воплощениях, данное изобретение применяют для лечения рака молочной железы, такого как трижды негативный рак молочной железы. В некоторых конкретных воплощениях, данное изобретение применяют для лечения желудочно-пищеводного рака (GEJ). В некоторых конкретных воплощениях, данное изобретение применяют для лечения острого миелоидного лейкоза (AML).
Данное изобретение также относится к способу ингибирования активности DNA-РК в биологическом образце, которое включает контактирование биологического образца с со-кристаллом или фармацевтической композицией согласно данному изобретению. Термин «биологический образец», как используется в данном контексте, означает образец наружной части живого организма и включает, без ограничения, культуры или экстракты клеток этого организма; подвергнутый биопсии материал, полученный от млекопитающего, или его экстракты; и кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости организма или его экстракты. Ингибирование активности киназы, в особенности, активности DNA-РК, в биологическом образце, является пригодным для множества целей, известных квалифицированному специалисту в данной области. Пример включает, но не ограничиваясь этим, ингибирование DNA-РК в биологическом тесте. В одном воплощении, способ ингибирования активности DNA-РК в биологическом образце является ограниченным для нетерапевтических способов.
Термин «биологический образец», как используется в данном контексте, включает, без ограничения, культуры или экстракты клеток организма; подвергнутый биопсии материал, полученный от млекопитающего, или его экстракты; кровь, слюну, мочу, фекалии, сперму, слезы или другие жидкости организма или его экстракты.
Комбинированные терапии
Настоящее изобретение также относится к комбинации химиотерапии с соединением или композицией согласно данному изобретению, или с комбинацией другой противораковой терапии, такой как противораковый агент или рентгенотерапия (или радиотерапия). В некоторых воплощениях, соединения формулы I и их со-кристаллы используют в комбинации с другой противораковой терапией, такой как противораковое лекарственное средство или радиотерапия. Как используется в данном контексте, термины «в комбинации» или «со-введение» можно использовать взаимозаменяемо, для ссылки на применение более, чем одной, терапии (например, один или более профилактический(их) и/или терапевтический(их) агент(ов)). Использование терминов не является ограниченным порядком, при котором терапии (например, профилактический(ие) и/или терапевтический(ие) агент(ы)) вводят субъекту.
В некоторых воплощениях, вышеуказанная другая противораковая терапия представляет собой противораковый агент. В других воплощениях, вышеуказанная другая противораковая терапия представляет собой повреждающий ДНК агент. Еще в других воплощениях, вышеуказанную другую противораковую терапию выбирают из радиотерапии. В другом конкретном воплощении, радиотерапия представляет собой ионизирующее излучение.
Примеры повреждающих ДНК агентов, которые можно использовать в комбинации с соединениями формулы I и их со-кристаллами включают, но не ограничиваясь этим, платинированные агенты, такие как карбоплатин, недаплатин, сатраплатин и другие производные; ингибиторы топоизомеразы I, такие как топотекан, иринотекан/SN38, рубитекан и другие производные; антиметаболиты, такие как семейство фолиевой кислоты (метотрексат, пеметрексед и близкие формы); антагонисты пурина и антагонисты пиримидина (тиогуанин, флударабин, кладрибин, цитарабин, гемцитабин, 6-меркаптопурин, 5-фторурацил (5-FU) и близкие формы); алкилирующие агенты, такие как азотистые иприты (циклофосфамид, мелфалан, хлорамбуцил, мехлоретамин, ифосфамид и близкие формы); нитрозомочевины (например, кармустин); триазины (дакарбазин, темозоломид); алкилсульфонаты (например, бисульфан); прокарбазин и азиридины; антибиотики, такие как гидроксимочевина, антрациклины (доксорубицин, даунорубицин, эпирубицин и другие производные); антрацендионы (митоксантрон и близкие формы); семейство Streptomyces (блеомицин, митомицин С, актиномицин); и ультрафиолетовое излучение.
Другие терапии или противораковые агенты, которые можно использовать в комбинации с агентами согласно настоящему изобретению, включают хирургию, радиотерапию (но, в некоторых примерах, ионизирующее излучение (IR), гамма-излучение, нейтронно-лучевую радиотерапию, электронно-лучевую радиотерапию, протонную терапию, брахитерапию и системные радиоактивные изотопы, это лишь названия некоторых), эндокринную терапию, модификаторы биологического отклика (интерфероны, интерлейкины и фактор некроза опухоли (TNF), это лишь названия некоторых), гипертермию и криотерапию, агенты для ослабления любых неблагоприятных эффектов (например, противорвотные средства) и другие одобренные химиотерапевтические лекарственные средства, включая, но не ограничиваясь этим, повреждающие ДНК агенты, перечисленные в данном контексте, «веретенные яды» (винбластин, винкристин, винорелбин, паклитаксел), подофиллотоксины (этопозид, иринотекан, вопотекан), нитрозомочевины (вармустин, ломустин), неорганические ионы (цисплатин, карбоплатин), ферменты (вспарагиназа) и гормоны (тамоксифен, леупролид, флутамид и мегестрол), Gleevec™, адриамицин, дексаметазон и циклофосфамид.
Дополнительные примеры терапевтических агентов для совместной терапии согласно данному изобретению включают: абареликс (Plenaxis depot®); алдеслейкин (Prokine®); алдеслейкин (Proleukin®); алемтузумаб (Campath®); алитретиноин (Panretin®); аллопуринол (Zyloprim®); алтретамин (Hexalen®); амифостин (Ethyol®); анастрозол (Arimidex®); триоксид мышьяка (Trisenox®); аспарагиназу (Elspar®); азацитидин (Vidaza®); бевацизумаб (Avastin® ); бексаротен в капсулах (Targretin®); бексаротен-гель (Targretin®); блеомицин (Blenoxane®); бортезомиб (Velcade®); бусульфан внутривенно (Busulfex®); бусульфан перорально (Myleran®); калустерон (Methosarb®); капецитабин (Xeloda®); карбоплатин (Paraplatin®); кармустин (BCNU®, BiCNU®); кармустин (Gliadel®); кармустин с полифепросаном 20 Implant (Gliadel Wafer®); целекоксиб (Celebrex®); цетуксимаб (Erbitux®); хлорамбуцил (Leukeran®); цисплатин (Platinol®); кладрибин (Leustatin®, 2-CdA®); клофарабин (Clolar®); циклофосфамид (Cytoxan®, Neosar®); циклофосфамид (Cytoxan Injection®); циклофосфамид (Cytoxan Tablet®); цитарабин (Cytosar-U®); цитарабин липосомный (DepoCyt®); дакарбазин (DTIC-Dome®); дактиномицин, актиномицин D (Cosmegen®); дарбэпоэтин альфа (Aranesp®); даунорубицин липосомный (DanuoXome®); даунорубицин, дауномицин (Daunorubicin®); даунорубицин, дауномицин (Cerubidine®); денилейкин-дифтитокс (Ontak®); дексразоксан (Zinecard®); доцетаксел (Taxotere®); доксорубицин (Adriamycin PFS®); доксорубицин (Adriamycin®, Rubex®); доксорубицин (Adriamycin PFS Injection®); доксорубицин липосомный (Doxil®); дромостанолонпропионат (dromostanolone®); дромостанолонпропионат (masterone injection®); раствор B Эллиота (Elliott's B Solution®); эпирубицин (Ellence®); эпоэтин альфа (epogen®); эрлотиниб (Tarceva®); эстрамустин (Emcyt®); этопозидфосфат (Etopophos®); этопозид, VP-16 (Vepesid®); эксеместан (Aromasin®); филграстим (Neupogen®); флоксуридин (внутриартериально) (FUDR®); флударабин (Fludara®); фторурацил, 5-FU (Adrucil®); фулвестрант (Faslodex®); гефитиниб (Iressa®); гемцитабин (Gemzar®); гемтузумаб-озогамицин (Mylotarg®); гозерелинацетат (Zoladex Implant®); гозерелинацетат (Zoladex®); гистрелинацетат (Histrelin implant®); гидроксимочевину (Hydrea®); ибритумомабтиуксетан (Zevalin®); идарубицин (Idamycin®); ифосфамид (IFEX®); иматинибмезилат (Gleevec®); интерферон альфа 2a (Roferon A®); интерферон альфа 2b (Intron A®); иринотекан (Camptosar®); леналидомид (Revlimid®); летрозол (Femara®); лейковорин (Wellcovorin®, Leucovorin®); леупролидацетат (Eligard®); левамизол (Ergamisol®); ломустин, CCNU (CeeBU®); мехлоретамин, азотистый иприт (Mustargen®); мегестролацетат (Megace®); мелфалан, L-PAM (Alkeran®); меркаптопурин, 6-MP (Purinethol®); месна (Mesnex®); месна (Mesnex tabs®); метотрексат (Methotrexate®); метоксален (Uvadex®); митомицин C (Mutamycin®); митотан (Lysodren®); митоксантрон (Novantrone®); нандролонфенпропионат (Durabolin-50®); неларабин (Arranon®); нофетумомаб (Verluma®); опрелвекин (Neumega®); оксалиплатин (Eloxatin®); паклитаксел (Paxene®); паклитаксел (Taxol®); связанные с белком частицы паклитаксела (Abraxane®); палифермин (Kepivance®); памидронат (Aredia®); пегадемаза (Adagen (Pegademase Bovine)®); пегаспаргазу (Oncaspar®); пегфилграстим (Neulasta®); пеметрексед динатрия (Alimta®); пентостатин (Nipent®); пипоброман (Vercyte®); пликамицин, митрамицин (Mithracin®); порфимер натрия (Photofrin®); прокарбазин (Matulane®); квинакрин (Atabrine®); расбуриказа (Elitek®); ритуксимаб (Rituxan®); сарграмостим (Leukine®); сарграмостим (Prokine®); сорафениб (Nexavar®); стрептозоцин (Zanosar®); сунитинибмалеат (Sutent®); тальк (Sclerosol®); тамоксифен (Nolvadex®); темозоломид (Temodar®); тенипозид, VM-26 (Vumon®); тестолактон (Teslac®); тиогуанин, 6-TG (Thioguanine®); тиотепа (Thioplex®); топотекан (Hycamtin®); торемифен (Fareston®); тозитумомаб (Bexxar®); тозитумомаб/I-131 тозитумомаб (Bexxar®); трастузумаб (Herceptin®); третиноин, ATRA (Vesanoid®); урациловый иприт (Uracil Mustard Capsules®); валрубицин (Valstar®); винбластин (Velban®); винкристин (Oncovin®); винорелбин (Navelbine®); золедронат (Zometa®) и вориностат (Zolinza®).
Для всестороннего обсуждения модифицированных способов лечения ракового заболевания, см., nci.nih.gov, перечень FDA (Управление контроля качества продуктов и лекарственных средств США) утвержденных онкологических лекарственных средств на fda.gov/cder/cancer/druglistframe.htm, и The Merck Manual, 17-ое изд., 1999.
Некоторые воплощения включают введение вышеуказанному пациенту дополнительного терапевтического агента, выбираемого из повреждающего ДНК агента, где вышеуказанный дополнительный терапевтический агент подходит для заболевания, которое подвергают лечению, и вышеуказанный дополнительный терапевтический агент вводят вместе с вышеуказанным соединением, в виде одной лекарственной формы, или отдельно от вышеуказанного соединения, в виде части множественной лекарственной формы.
В некоторых воплощениях, вышеуказанный повреждающий ДНК агент выбирают, по меньшей мере, из одного из радиационного излучения (например, ионизирующее излучение), радиомиметического неокарциностатина, платинирующего агента, ингибитора топоизомеразы I, ингибитора топоизомеразы II, антиметаболита, алкилирующего агента, алкилсульфонатов, антиметаболита, ингибитора PARP или антибиотика. В других воплощениях, вышеуказанный повреждающий ДНК агент выбирают, по меньшей мере, из одного из ионизирующего излучения, платинирующего агента, ингибитора топоизомеразы I, ингибитора топоизомеразы II, ингибитора PARP или антибиотика.
Примеры платинирующих агентов включают цисплатин, оксалиплатин, карбоплатин, недаплатин, сатраплатин и другие производные. Другие платинирующие агенты включают лобаплатин и триплатин. Другие платинирующие агенты включают тетранитрат, пикоплатин, сатраплатин, пролиндак и ароплатин.
Примеры ингибиторов топоизомеразы I включают камптотецин, топотекан, иринотекан/SN38, рубитекан и другие производные. Другие ингибиторы топоизомеразы I включают белотекан.
Примеры ингибиторов топоизомеразы II включают этопозид, даунорубицин, доксорубицин, митоксантрон, акларубицин, эпирубицин, идарубицин, амрубицин, амсакрин, пирарубицин, валрубицин, зорубицин и тенипозид.
Примеры антиметаболитов включают члены семейства фолиевой кислоты, семейства пурина (антагонисты пурина) или семейства пиримидина (антагонисты пиримидина). Примеры семейства фолиевой кислоты включают метотрексат, пеметрексед и близкие формы; примеры семейства пурина включают тиогуанин, флударабин, кладрибин, 6-меркаптопурин и близкие формы; примеры семейства пиримидина включают цитарабин, гемцитабин, 5-фторурацил (5FU) и близкие формы.
Некоторые другие конкретные примеры антиметаболитов включают аминоптерин, метотрексат, пеметрексед, ралтитрексед, пентостатин, кладрибин, клофарабин, флударабин, тиогуанин, меркаптопурин, фторурацил, капецитабин, тегафур, кармофур, флоксуридин, цитарабин, гемцитабин, азацитидин и гидроксимочевину.
Примеры алкилирующих агентов включают азотистые иприты, триазены, алкилсульфонаты, прокарбазин и азиридины. Примеры азотистых ипритов включают циклофосфамид, мелфалан, хлорамбуцил и близкие формы; примеры нитрозомочевин включают кармустин; примеры триазенов включают дакарбазин и темозоломид; примеры алкилсульфонатов включают бусульфан.
Другие конкретные примеры алкилирующих агентов включают мехлоретамин, циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил, мелфалан, преднимустин, бендамустин, урамустин, эстрамустин, кармустин, ломустин, семустин, фотемустин, нимустин, ранимустин, стрептозоцин, бусульфан, манносульфан, треосульфан, карбоквион, тиотепа, триазиквион, триэтиленмеламин, прокарбазин, дакарбазин, темозоломид, алтретамин, митобронитол, актиномицин, блеомицин, митомицин и пликамицин.
Примеры антибиотиков включают митомицин, гидроксимочевину; антрациклины, антрацендионы, семейство Streptomyces.
Примеры антрациклинов включают доксорубицин, даунорубицин, эпирубицин и другие производные; примеры антрацендионов включают митоксантрон и близкие формы; примеры семейства Streptomyces включают блеомицин, митомицин С и актиномицин.
Примеры ингибиторов PARP включают ингибиторы PARP1 и PARP2. Конкретные примеры включают олапариб (также называемый как AZD2281 или KU-0059436), инипариб (также называемый как BSI-201 или SAR240550), велипариб (также называемый как АВТ-888), рукапариб (также называемый как PF-01367338), СЕР-9722, INO-1001, MK-4827, E7016, BMN-673 или AZD2461. В других воплощениях, агент, который ингибирует или модулирует PARP1 и PARP2, представляет собой велипариб (также называемый как АВТ-888) или рукапариб. В других воплощениях, агент, который ингибирует или модулирует PARP1 и PARP2, представляет собой BMN-673.
В некоторых воплощениях, вышеуказанный платинирующий агент представляет собой цисплатин или оксалиплатин; вышеуказанный ингибитор топоизомеразы I представляет собой камптотецин; вышеуказанный ингибитор топоизомеразы II представляет собой этопозид; и вышеуказанный антибиотик представляет собой митомицин. В других воплощениях, вышеуказанный платинирующий агент выбирают из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, недаплатина или сатраплатина; вышеуказанный ингибитор топоизомеразы I выбирают из группы, состоящей из камптотецина, топотекана, иринотекан/SN38, рубитекана; вышеуказанный ингибитор топоизомеразы II выбирают из этопозида; вышеуказанный антиметаболит выбирают из группы, состоящей из семейства фолиевой кислоты, семейства пурина или семейства пиримидина; вышеуказанный алкилирующий агент выбирают из группы, состоящей из азотистых ипритов, нитрозомочевин, триазенов, алкилсульфонатов, прокарбазина или азиридинов; и вышеуказанный антибиотик выбирают из группы, состоящей из гидроксимочевины, антрациклинов, антрацендионов или семейства Streptomyces.
В некоторых воплощениях, дополнительный терапевтический агент представляет собой радиационное излучение (например, ионизирующее излучение). В других воплощениях, дополнительный терапевтический агент представляет собой цисплатин или карбоплатин. Еще в других воплощениях, дополнительный терапевтический агент представляет собой этопозид. Еще в других воплощениях, дополнительный терапевтический агент представляет собой темозоломид.
В некоторых воплощениях, дополнительные терапевтические агенты выбирают из таковых, которые ингибируют или модулируют белок репарации эксцизии основания. В конкретном воплощении, белки репарации эксцизии основания выбирают из группы, состоящей из UNG, SMUG1, MBD4, TDG, OGG1, MYH, NTH1, MPG, NEIL1, NEIL2, NEIL3 (ДНК-гликозилазы); АРЕ1, АРЕХ2 (АР-эндонуклеазы); LIG1, LIG3 (ДНК-лигазы I и III); XRCC1 (дополнительный LIG3); PNK, PNKP (полинуклеотидкиназа и фосфатаза); PARP1, PARP2 (поли(ADP-рибоза)полимеразы); PolB, PolG (полимеразы); FEN1 (эндонуклеаза) и апратаксин. В другом конкретном воплощении, белок репарации эксцизии основания выбирают из PARP1, PARP2 или PolB. Еще в другом воплощении, белок репарации эксцизии основания выбирают из PARP1 или PARP2.
В некоторых воплощениях, этот способ применяют к раковой клетке, имеющей дефекты в АТМ сигнальном каскаде. В некоторых воплощениях, вышеуказанный дефект изменяет экспрессию или активность одного или более из следующего: АТМ, р53, СНК2, MRE11, RAD50, NBS1, 53BP1, MDC1, H2AX, MCPH1/BRIT1, CTIP или SMC1. В других воплощениях, вышеуказанный дефект изменяет экспрессию или активность одного или более из следующего: ATM, p53, CHK2, MRE11, RAD50, NBS1, 53BP1, MDC1 или H2AX. В другом воплощении, клетка представляет собой раковую клетку, экспрессирующую повреждающие ДНК онкогены. В некоторых воплощениях, вышеуказанная раковая клетка изменяет экспрессию или активность одного или более из следующего: K-Ras, N-Ras, H-Ras, Raf, Myc, Moc, E2F, Cdc25A, CDC4, CDK2, циклин Е, циклин А и Rb.
В соответствии с другим воплощением, способ применяют к раковому заболеванию, раковой клетке или клетке, имеющей дефект в белке, вовлеченном в репарацию эксцизии основания («белок репарации эксцизии основания»). Существует множество способов, известных в данной области, для определения, имеет ли дефект опухоль при репарации эксцизии основания. Например, секвенирование или геномной ДНК или продуктов мРНК каждого гена репарации эксцизии основания (например, UNG, PARP1 или LIG1) можно осуществлять на образце опухоли для установления, имеются ли мутации, предполагаемые для модуляции функции или экспрессии ген-продукта (Wang и др., Cancer Research 52:4824 (1992)). В дополнение к мутационной инактивации, клетки опухоли можно модулировать с помощью гена репарации ДНК путем сверхметилирования его промоторной области, приводящего к снижению экспрессии гена. Это в большинстве случаев оценивают, используя специфичную для метилирования полимеразную цепную реакцию (PCR), для определения уровней метилирования в случае промоторов представляющих интерес генов репарации эксцизии основания. Анализ промотора гена репарации эксцизии основания является коммерчески доступным (например, sabiosciences.com/dna_methylation_product/HTML/MEAH-421A).
Уровни экспрессии генов репарации эксцизии основания можно оценивать по непосредственно определяющим количество уровням мРНК и белковым продуктам каждого гена, используя стандартные способы, как например количественная, связанная с обратной транскриптазой, полимеразная цепная реакция (RT-PCR) и иммуногистохимия (IHC), соответственно (Shinmura и др., Carcinogenesis 25: 2311 (2004); Shinmura и др., Journal of Pathology 225:414 (2011)).
В некоторых воплощениях, белок репарации эксцизии основания представляет собой UNG, SMUG1, MBD4, TDG, OGG1, MYH, NTH1, MPG, NEIL1, NEIL2, NEIL3 (ДНК-гликозилазы); АРЕ1, АРЕХ2 (АР-эндонуклеазы); LIG1, LIG3 (ДНК-лигазы I и III); XRCC1 (дополнительный LIG3); PNK, PNKP (полинуклеотидкиназа и фосфатаза); PARP1, PARP2 (поли(ADP-рибоза)полимеразы); PolB, PolG (полимеразы); FEN1 (эндонуклеаза) и апратаксин.
В некоторых воплощениях, белок репарации эксцизии основания представляет собой PARP1, PARP2 или PolB. В других воплощениях, белок репарации эксцизии основания представляет собой PARP1 или PARP2.
В определенных воплощениях, дополнительный терапевтический агент выбирают из одного или более из следующего: цисплатин, карбоплатин, гемцитабин, этопозид, темозоломид или ионизирующее излучение.
В других воплощениях, дополнительные терапевтические агенты выбирают из одного или более из следующего: гемцитабин, цисплатин или карбоплатин, и этопозид. Еще в других воплощениях, дополнительные терапевтические агенты выбирают из одного или более из следующего: цисплатин или карбоплатин, этопозид и ионизирующее излучение. В некоторых воплощениях, раковое заболевание представляет собой рак легких. В некоторых воплощениях, рак легких представляет собой немелкоклеточный рак легких или мелкоклеточный рак легких.
В некоторых воплощениях, противораковые терапии для комбинированной терапии согласно данному изобретению включают повреждающие ДНК агенты, такие как ингибиторы топоизомеразы (например, этопозид и доксил), интеркаляторы ДНК (например, доксорубицин, даунорубицин и эпирубицин), радиомиметики (например, блеомицин), ингибиторы PARP (например, BMN-673), ингибиторы репарации ДНК (например, карбоплатин), кросс-линкеры ДНК (например, цисплатин), ингибиторы тимидилатсинтазы (например, фторурацил (5-FU)), митотические ингибиторы (например, паклитаксел), ингибиторы EGFR (например, эрлотиниб) и моноклональные антитела EGFR (например, цетуксимаб) и облучение (например, ионизирующее излучение). Конкретные примеры включают этопозид, доксил, гемцитабин, паклитаксел, цисплатин, карбоплатин, 5-FU, этопозид, доксорубицин, даунорубицин, эпирубицин, блеомицин, BMN-673, карбоплатин, эрлотиниб, цисплатин, карбоплатин, фторурацил, цетуксимаб и облучение (например, ионизирующее излучение). В некоторых воплощениях, соединения формулы I и их со-кристаллы используют в комбинации, по меньшей мере, с одним противораковым лекарственным средством, выбираемым из группы, состоящей из этопозида, доксила, гемцитабина, паклитаксела, цисплатина, карбоплатина, 5-FU, этопозида, доксорубицина, даунорубицина, эпирубицина, блеомицина, BMN-673, карбоплатина, эрлотиниба, цисплатина, карбоплатина, фторурацила или цетуксимаба, и вместе или без радиационного излучения. В некоторых отдельных воплощениях, соединения формулы I и их со-кристаллы используют в комбинации с этопозидом и цисплатином, вместе с или без радиационного излучения (например, ионизирующее излучение). В некоторых конкретных воплощениях, соединения формулы I и их со-кристаллы используют в комбинации с паклитакселом и цисплатином, вместе с или без радиационного излучения (например, ионизирующее излучение). В некоторых конкретных воплощениях, соединения формулы I и их со-кристаллы используют в комбинации с паклитакселом и карбоплатином, вместе с или без радиационного излучения (например, ионизирующее излучение). В некоторых конкретных воплощениях, соединения формулы I и их со-кристаллы используют в комбинации с цисплатином и 5-FU, вместе с или без радиационного излучения (например, ионизирующее излучение).
Конкретные примеры раковых заболеваний для комбинированной терапии являются такими, как описано выше. В некоторых воплощениях, данное изобретение применяют для лечения рака легких (например, немелкоклеточный рак легких (NSCLC), обширный мелкоклеточный рак легких (ED-SCLC)), рака молочной железы (например, трижды негативный рак молочной железы), рака предстательной железы, острого миелоидного лейкоза, миеломы, рака пищевода (например, желудочно-пищеводного рака (GEJ)), рака яичников, рака толстой кишки, рака глотки, рака поджелудочной железы, фибробласта легких и рака желудка. В некоторых конкретных воплощениях, данное изобретение применяют для лечения рака легких (например, немелкоклеточный рак легких (NSCLC), обширный мелкоклеточный рак легких (ED-SCLC)), рака молочной железы (например, трижды негативный рак молочной железы), рака предстательной железы, острого миелоидного лейкоза, миеломы, желудочно-пищеводного рака (GEJ), рака поджелудочной железы и рака яичников.
В некоторых конкретных воплощениях, данное изобретение относится к совместной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации со стандартным терапевтическим агентом (например, доксорубицин, этопозид, паклитаксел и/или карбоплатин), вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака легких, такого как немелкоклеточный рак легких (NSCLC) или обширный мелкоклеточный рак легких (ED-SCLC).
В некоторых конкретных воплощениях, данное изобретение относится к совместной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации со стандартным терапевтическим агентом (например, цисплатин, 5-FU, карбоплатин, паклитаксел и/или этопозид), вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения желудочно-пищеводного рака (GEJ).
В некоторых конкретных воплощениях, данное изобретение относится к совместной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации со стандартным терапевтическим агентом (например, доксорубицин и/или винкристин), вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения острого миелоидного лейкоза или хронического лимфоцитарного лейкоза.
В некоторых конкретных воплощениях, данное изобретение относится к совместной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации со стандартным терапевтическим агентом (например, доксорубицин и/или эпирубицин), вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака молочной железы, как, например, трижды негативный рак молочной железы.
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации с радиационным излучением (или ионизирующим излучением); цисплатином, этопозидом, паклитакселом, доксорубицином или цетуксимабом, вместе с или без радиационного излучения (например, ионизирующее излучение); цисплатином и этопозидом, вместе с или без радиационного излучения (например, ионизирующее излучение); или цисплатином и паклитакселом, вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака легких, такого как немелкоклеточный рак легких (NSCLC), мелкоклеточный рак легких или обширный мелкоклеточный рак легких (ED-SCLC).
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации с радиационным излучением (или ионизирующим излучением); цисплатином, вместе с или без радиационного излучения (например, ионизирующее излучение); этопозидом, вместе с или без радиационного излучения (например, ионизирующее излучение); карбоплатином, вместе с или без радиационного излучения (например, ионизирующее излучение); 5-FU, вместе с или без радиационного излучения (например, ионизирующее излучение); цисплатином и паклитакселом вместе с или без радиационного излучения (например, ионизирующее излучение); цисплатином и 5-FU вместе с или без радиационного излучения (например, ионизирующее излучение); или карбоплатином и паклитакселом вместе с или без радиационного излучения (например, ионизирующее излучение); для лечения желудочно-пищеводного рака (GEJ).
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации с доксорубицином или эпирубицином, вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака молочной железы, такого как трижды негативный рак молочной железы.
Другое воплощение относится к способу лечения рака молочной железы с помощью соединений формулы I и их со-кристаллов, в комбинации с платинирующим агентом, вместе с или без радиационного излучения (например, ионизирующее излучение). В некоторых воплощениях, рак молочной железы представляет собой трижды негативный рак молочной железы. В других воплощениях, платинирующий агент представляет собой цисплатин.
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации с цетуксимабом, вместе с или без радиационного излучения (например, ионизирующее излучение); или цисплатином вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака глотки.
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации: с цисплатином вместе с или без радиационного излучения (например, ионизирующее излучение); с этопозидом, вместе с или без радиационного излучения (например, ионизирующее излучение); с цисплатином и 5-FU вместе с или без радиационного излучения (например, ионизирующее излучение); или с паклитакселом вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения фибробласта легких.
В некоторых конкретных воплощениях, данное изобретение относится к комбинированной терапии при использовании соединений формулы I и их со-кристаллов, в комбинации: с радиационным излучением (например, ионизирующее излучение); с блеомицином, доксорубицином, цисплатином, карбоплатином, этопозидом, паклитакселом или 5-FU, вместе с или без радиационного излучения (например, ионизирующее излучение), для лечения рака легких, такого как NSCLC, рака поджелудочной железы, рака пищевода или рака желудка.
Другое воплощение относится к способам лечения рака поджелудочной железы путем введения соединения, описанного в данном контексте, в комбинации с другим известным лечением рака поджелудочной железы. Один аспект данного изобретения включает введение соединения, описанного в данном контексте, в комбинации с гемцитабином.
Совместное введение в случае комбинированных терапий охватывает введение первого и второго количеств соединений/терапий при совместном введении, по существу, одновременно (как, например, в виде одной фармацевтической композиции, например, капсулы или таблетки, имеющей фиксированное соотношение первого и второго количеств, или многократно, в виде раздельных капсул или таблеток для каждого введения), или последовательно, в любом порядке.
Когда совместное введение включает раздельное введение первого количества соединения согласно данному изобретению и второго количества дополнительного терапевтического агента/терапии, то их вводят достаточно близко по времени, для достижения желательного терапевтического эффекта. Данное изобретение также можно применять на практике путем включения другого противоракового химиотерапевтического агента в терапевтический режим для лечения ракового заболевания, вместе с или без радиационной терапии. Комбинация со-кристалла или фармацевтической композиции согласно данному изобретению с такими другими агентами может потенцировать химиотерапевтический протокол. Например, соединение-ингибитор согласно данному изобретению можно вводить с этопозидом, блеомицином, доксорубицином, эпирубицином, даунорубицином или их аналогами, агентами, известными по причине разрыва цепи ДНК.
В некоторых воплощениях, соединения формулы I и их со-кристаллы используют, в комбинации с повреждающим ДНК агентом (например, этопозид, радиационное излучение) и соединения формулы I и их со-кристаллы вводят после введения повреждающей ДНК терапии. Конкретные примеры повреждающих ДНК агентов описаны выше.
В некоторых воплощениях, вышеупомянутый(е) один или более дополнительный(е) противораковый(е) агент(ы) или терапию(ии) применяют с соединением (1) или его фармацевтически приемлемой солью. В некоторых воплощениях, вышеупомянутый(е) один или более дополнительный(е) противораковый(е) агент(ы) или терапию(ии) применяют с соединением (2) или его фармацевтически приемлемой солью. В некоторых воплощениях, вышеупомянутый(ную) один или более дополнительный(ную) противораковый(вую) агент или терапию применяют вместе с со-кристаллом адипиновой кислоты и соединения (1) (например, в соотношении 2:1, соединения (1) к адипиновой кислоте). В некоторых воплощениях, вышеупомянутый(тую) один или более дополнительный(ную) противораковый(вую) агент или терапию применяют вместе с со-кристаллом адипиновой кислоты и соединения (2) (например, в соотношении 2:1, соединения (2) к адипиновой кислоте).
В некоторых воплощениях, вышеупомянутый(ую) один или более дополнительный противораковый агент или терапию применяют вместе с фармацевтическими композициями согласно данному изобретению, описанными выше.
Ниже описаны примеры получения и характеристика со-кристаллов согласно данному изобретению, которые предназначены только для иллюстрации и не ограничивают данное изобретение никаким образом.
Пример 1: Получение соединений согласно данному изобретению
Как используется в данном контексте, все аббревиатуры, символы и условия согласуются с таковыми, используемыми в современной научной литературе. См., например, Janet S. Dodd, изд., The ACS Style Guide: A Manual for Authors and Editors, 2-ое изд., Washington, D.C.: American Chemical Society, 1997. Следующие определения раскрывают термины и аббревиатуры, используемые в данном контексте:
|
Пример А. Получение 2-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидина-4,6-d2 (Соединение 1003 )
Схема 1
Как показано на стадии 1-i Схемы 1, к перемешиваемому раствору 4,6-дихлор-2-метилпиримидин-5-амина (14,04 г, 78,88 ммоль), в метаноле-d4 (140,4 мл), добавляют муравьиную кислоту-d2 (7,77 г, 161,7 ммоль) и палладиевую чернь (765 мг, 7,19 ммоль, смоченные в метаноле-d4), затем триэтиламин (16,36 г, 22,53 мл, 161,7 ммоль). Реакционную смесь герметично закрывают в пробирке и перемешивают при комнатной температуре, в течение ночи. Смесь потом отфильтровывают и концентрируют при пониженном давлении. Добавляют Et2O (250 мл) и смесь перемешивают в течение 1 часа, при комнатной температуре. Полученные твердые вещества отфильтровывают и промывают с помощью Et2O (2 раза). Фильтрат концентрируют при пониженном давлении, получая 4,6-дидейтеро-2-метилпиримидин-5-амин (Соединение 1001, 5,65 г, выход 65%), в виде твердого вещества светло-желтого цвета. 1H-ЯМР (300 МГц, ДМСО-d6): δ 5,25 (с, 2H), 2,40 (с, 3H). Это соединение используют на последующих стадиях, без дальнейшей очистки.
Как показано на стадии 1-ii Схемы 1, к 4,6-дидейтеро-2-метилпиримидин-5-амину (5,35 г, 48,14 ммоль), в CH3CN (192,5 мл), добавляют дибромид меди (16,13 г, 3,38 мл, 72,21 ммоль), затем трет-бутилнитрит (8,274 г, 9,54 мл, 72,21 ммоль). Спустя 1 час, реакционную смесь отфильтровывают через диатомовую землю вместе с дихлорметаном. Фильтрат промывают смесью вода/насыщенный раствор хлорида натрия (1:1), органический слой отделяют, водный слой экстрагируют дихлорметаном (2 раза) и комбинированные органические слои отфильтровывают через диатомовую землю и концентрируют при пониженном давлении. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, при среднем давлении (0-10% EtOAc/гексаны), получая 5-бром-4,6-дидейтеро-2-метилпиримидин (Соединение 1002, 4,1 г, выход 49%). 1H-ЯМР (300 МГц, метанол-d4): δ 2,64 (с, 3Н).
Как показано на стадии 1-iii Схемы 1, смесь 5-бром-4,6-дидейтеро-2-метилпиримидина (8,5 г, 48,57 ммоль), бис(пинаколато)дибора (13,57 г, 53,43 ммоль) и КОАс (14,30 г, 145,7 ммоль), в 2-метилтетрагидрофуране (102,0 мл), дегазируют путем продувки азотом. К этой смеси добавляют дихлорбис(трициклогексилфосфоранил)палладий (PdCl2[P(cy)3]2, 1,01 г, 1,364 ммоль) и реакционную смесь перемешивают в герметично закрытой пробирке в течение ночи, при температуре 100°С. Смесь отфильтровывают и фильтрат перемешивают с диоксидом кремния Silabond® DMT (SiliCycle, Inc., 0,58 ммоль/г, 3,53 г), в течение 1 часа. Смесь отфильтровывают и концентрируют при пониженном давлении, получая 2-метил-4,6-дидейтеро-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин (Соединение 1003, 13,6 г, чистота 72%, основным загрязнителем является пинакол), в виде масла светло-желтого цвета. 1H-ЯМР (300 МГц, CDCl3): δ 2,75 (с, 3Н), 1,30 (с, 12Н). Это соединение используют на последующих стадиях без дальнейшей очистки.
Пример В. Получение (S)-8-(1-((6-хлорпиримидин-4-ил)амино)пропан-2-ил)-N-метилхинолин-4-карбоксамида (Соединение 1013 )
Схема 2
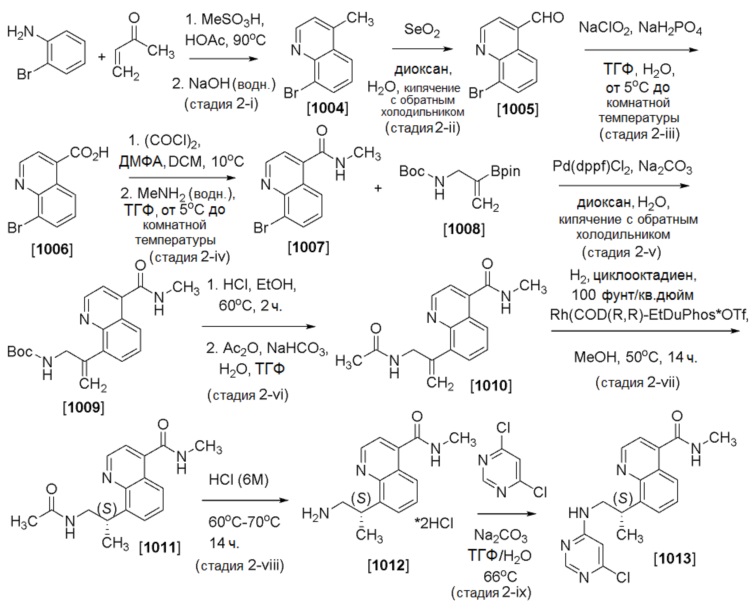
Как показано на стадии 2-i Схемы 2, 2-броманилин (520 г, 3,02 моль) расплавляют при температуре 50°С, в термостате, и затем вводят в реакционный сосуд, содержащий перемешиваемую уксусную кислоту (3,12 л). Потом, в течение 15 минут, добавляют метансульфоновую кислоту (871,6 г, 588,5 мл, 9,07 моль). Реакционную смесь нагревают до температуры 60°С и, в течение 5 минут, добавляют метилвинилкетон (377 мл, 1,5 экв.) и реакционную смесь перемешивают в течение 1 часа, при температуре 90°С. По истечении этого времени, добавляют другие 50 мл (0,2 экв.) метилвинилкетона и реакционную смесь перемешивают в течение дополнительных 16 часов. Полученный раствор темно-коричневого цвета охлаждают на бане льда с водой и, в виде порций, выливают в перемешиваемый водный раствор из 50% масс./масс. NaOH (3,894 л, 73,76 моль) и льда (1 кг), также охлаждают с помощью бани льда с водой. Добавляют дополнительное количество льда, если требуется, во время добавления, для того, чтобы поддерживать реакционную температуру ниже 25°С. После завершения добавления, реакционную смесь (рН > 10) перемешивают в течение 30 минут, пока охлаждают на бане со смесью лед/вода. Образуется осадок, который собирают путем фильтрации, промывают водой (3 раза по 2 л) и растворяют в DCM (4 л). Органические продукты промывают водой (2 л) и водную фазу снова экстрагируют с помощью DCM (1 л). Объединенные органические продукты сушат над Na2SO4, отфильтровывают через слой силикагеля (примерно 2 л), элюируют с помощью DCM и затем с помощью 3%-ой смеси EtOAc/DCM, до тех пор, пока весь продукт не пройдет через слой силикагеля. Летучие вещества из фильтрата удаляют при пониженном давлении и остаток растирают в гексанах (примерно 500 мл). Полученное твердое вещество собирают путем фильтрации, промывают гексанами (4 раза по 500 мл) и высушивают в вакууме, получая 8-бром-4-метилхинолин (Соединение 1004, 363 г, выход 54%), в виде твердого вещества светлого желто-коричневого цвета. LC-MS = 222,17 (М+Н); 1H-ЯМР (300 МГц, CDCl3): δ 8,91 (д, J=4,3 Гц, 1H), 8,06 (д, J=7,4 Гц, 1H), 7,99 (д, J=8,4 Гц, 1H), 7,42 (т, J=7,9 Гц, 1H), 7,30 (д, J=4,2 Гц, 1H), 2,73 (с, 3H).
Как показано на стадии 2-ii Схемы 2, диоксид селена (764,7 г, 6,754 моль) растворяют в 3,25 л диоксана и 500 мл воды. Перемешиваемый раствор нагревают до температуры 77°С и, в виде одной порции, добавляют 8-бром-4-метилхинолин (Соединение 1004, 500 г, 2,251 моль). Реакционную смесь перемешивают при кипячении с обратным холодильником, в течение 30 минут, и затем охлаждают на бане с водой до температуры примерно 45°С, при которой наблюдают выпадение осадка. Суспензию отфильтровывают через диатомовую землю, которую затем промывают горячим ТГФ для растворения каких-либо остаточных твердых веществ. Фильтрат концентрируют до минимального объема при пониженном давлении и добавляют 2 М раствор NaOH (2,81 л, 5,63 моль) для достижения рН=8-9. Реакционную смесь перемешивают при этом значении рН в течение 30 минут. Образуется осадок, который собирают путем фильтрации и высушивают на воздухе в течение ночи, до получения 8-бромхинолин-4-карбальдегида (Соединение 1005), в виде твердого вещества желтоватого цвета. LC-MS = 236,16 (М+Н); 1H-ЯМР (300 МГц, CDCl3): δ 10,52 (с, 1H), 9,34 (д, J=4,2 Гц, 1H), 9,05 (дд, J=8,5, 1,2 Гц, 1H), 8,18 (дд, J=7,5, 1,3 Гц, 1H), 7,88 (д, J=4,2 Гц, 1H), 7,60 (дд, J=8,5, 7,5 Гц, 1H). Этот продукт используют в последующих реакциях.
Как показано на стадии 2-iii Схемы 2, к перемешиваемой суспензии 8-бромхинолин-4-карбальдегида (531,4 г, 2,25 моль), в ТГФ (4,8 л), добавляют воду (4,8 л) и мононатрийфосфат (491,1 г, 4,05 моль). Смесь охлаждают до температуры 5°С и, поддерживая реакционную температуру ниже 15°С, в виде порций, медленно добавляют хлорит натрия (534,4 г, 4,727 моль), в виде твердого вещества, в течение примерно 1 часа. После завершения добавления, реакционную смесь перемешивают при температуре 10°С, в течение 1 часа, затем, в виде порций, добавляют 1 н раствор Na2S2O3 (1,18 л), пока поддерживают температуру ниже 20°С. Реакционную смесь перемешивают при комнатной температуре, потом удаляют ТГФ при пониженном давлении. Полученный водный раствор, содержащий осадок, обрабатывают насыщенным раствором NaHCO3 (примерно 1 л), до достижения рН=3-4. Эту смесь перемешивают в течение дополнительных 15 минут и твердое вещество собирают путем фильтрации, промывают водой (2 раза по 1 л), промывают трет-бутилметиловым эфиром (2 раза по 500 мл) и высушивают в конвекционной печи при температуре 60°С, в течение 48 часов. Осуществляют дополнительную сушку в высоком вакууме, получая 8-бромхинолин-4-карбоновую кислоту (Соединение 1006, 530,7 г, выход 94% в расчете на соединение 1004), в виде твердого вещества желтовато-коричневого цвета. LC-MS = 252,34 (М+Н); 1H-ЯМР (300 МГц, ДМСО-d6): δ 14,09 (с, 1H), 9,16 (д, J=4,4 Гц, 1H), 8,71 (дд, J=8,6, 1,2 Гц, 1H), 8,25 (дд, J=7,5, 1,2 Гц, 1H), 8,03 (д, J=4,4 Гц, 1H), 7,64 (дд, J=8,6, 7,5 Гц, 1H).
Как показано на стадии 2-iv Схемы 2, к суспензии 8-бромхинолин-4-карбоновой кислоты (Соединение 1006, 779,4 г, 3,092 моль), в DCM (11,7 л), добавляют безводный ДМФА (7,182 мл, 92,76 ммоль). Реакционную смесь охлаждают до температуры 10°С и, по каплям, добавляют оксалилхлорид (413 мл, 4,638 моль) в течение 30 минут. Реакционную смесь перемешивают в течение дополнительных 30 минут, после завершения добавления, переносят в колбу для выпаривания и летучие вещества удаляют при пониженном давлении. Добавляют безводный ТГФ (2 л) и летучие вещества еще раз удаляют при пониженном давлении, для того, чтобы удалить какой-либо остаточный оксалилхлорид. К остатку добавляют безводный ТГФ, в атмосфере азота, и полученную суспензию промежуточного хлорангидрида 8-бромхинолин-4-карбоновой кислоты хранят для дальнейшего использования.
В отдельности, исходную реакционную колбу основательно продувают газообразным азотом, для удаления какого-либо оставшегося оксалилхлорида и в колбу вводят безводный ТГФ (1,16 л). После охлаждения до температуры 5°С, добавляют водный раствор метиламина (2,14 л 40% масс./масс. MeNH2/вода, 24,74 моль), затем добавляют дополнительное количество ТГФ (1,16 л). К этому раствору, в виде порций, в течение 1 часа, добавляют суспензию промежуточного хлорангидрида кислоты, поддерживая во время добавления температуру реакционной смеси ниже 20°С. Сосуд для выпаривания, используемый для хранения хлорангидрида кислоты, ополаскивают безводным ТГФ и водным раствором MeNH2 (500 мл) и эти, используемые для ополаскивания, жидкости добавляют к реакционной смеси, которую оставляют отстаиваться при комнатной температуре в течение 16 часов. Органические летучие вещества удаляют при пониженном давлении и остающуюся большей частью водную суспензию разбавляют водой (1,5 л). Твердые вещества собирают путем фильтрации, промывают водой до тех пор, пока значение рН фильтрата не достигнет значения менее, чем 11, промывают с помощью МТВЕ (2 раза по 800 мл) и высушивают в конвекционной печи при температуре 60°С, получая 8-бром-N-метилхинолин-4-карбоксамид (Соединение 1007, 740,4 г, выход 90%), в виде твердого вещества светло-коричневого цвета. LC-MS = 265,04 (М+Н); 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,08 (д, J=4,3 Гц, 1H), 8,78 (д, J=4,7 Гц, 1H), 8,21 (дд, J=7,5, 1,2 Гц, 1H), 8,16 (дд, J=8,5, 1,3 Гц, 1H), 7,65 (д, J=4,3 Гц, 1H), 7,58 (дд, J=8,5, 7,5 Гц, 1H), 2,88 (д, J=4,6 Гц, 3H).
Как показано на стадии 2-v Схемы 2, 8-бром-N-метилхинолин-4-карбоксамид (Соединение 1007, 722 г, 2,723 моль) и трет-бутил-N-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)аллил]карбамат (Соединение 1008, 925,4 г, 3,268 моль) объединяют в реакционной колбе. Добавляют Na2CO3 (577,2 г, 5,446 моль), затем добавляют воду (2,17 л). Смесь перемешивают в течение 5 минут, добавляют 1,4-диоксан (5,78 л) и смесь подвергают дезоксигенированию путем барботирования тока азота в течение 30 минут. Добавляют Pd(dppf)Cl2/DCM (44,47 г, 54,46 ммоль) и продолжают дезоксигенирование, как и ранее, в течение дополнительных 30 минут. Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 16 часов, оставляют охлаждаться до температуры 70°С и добавляют воду (5,42 л). Смесь далее охлаждают на бане льда с водой и продолжают перемешивать при температуре <10°С, в течение 2 часов. Образуется осадок, который собирают путем фильтрации, промывают водой (3 раза по 1 л) и промывают с помощью ТВМЕ (2 раза по 1 л). Полученный в результате осадок на фильтре делят на две одинаковые порции. Каждую порцию растворяют в смеси ТГФ/DCM (4 л) и выливают на слой Florisil® (3-х литровая воронка для фильтрации с примерно 1,5 л Florisil, при использовании DCM для смачивания слоя). Этот слой затем промывают с помощью МеТHF до тех пор, пока не определят с помощью анализа при использовании тонкослойной хроматографии, что в фильтрате не осталось продукта. Фильтраты из обеих порций осадка на фильтре объединяют и концентрируют при пониженном давлении, получая твердое вещество оранжевого цвета. Добавляют ТВМЕ (1 л) и полученную суспензию отфильтровывают. Собранное твердое вещество промывают с помощью 800 мл ТВМЕ и высушивают в высоком вакууме в течение ночи, получая трет-бутил(2-(4-(метилкарбамоил)хинолин-8-ил)аллил)карбамат (Соединение 1009, 653 г, выход 70%), в виде не совсем белого цвета твердого вещества. LC-MS = 342,31 (М+Н); 1H-ЯМР (300 МГц, CDCl3): δ 8,93 (д, J=4,3 Гц, 1H), 8,17 (дд, J=8,4, 1,6 Гц, 1H), 7,68-7,53 (м, 2H), 7,41 (д, J=4,3 Гц, 1H), 6,09 (уш.с, 1H), 5,54 (с, 1H), 5,28 (с, 1H), 5,10 (уш.с, 1H), 4,33 (д, J=6,0 Гц, 2H), 3,11 (д, J=4,8 Гц, 3H), 1,38 (с, 9H). Дополнительный продукт (34,9 г, общий выход 74%) получают путем концентрирования фильтрата при пониженном давлении, растворения остатка в ТГФ, фильтрования раствора через слой Florisil®, как ранее, промывки слоя с помощью МеТHF, концентрирования фильтрата при пониженном давлении, добавления 250 мг ТВМЕ, перемешивания в течение 0,5 часов, сбора полученного осадка после фильтрации, промывки твердого вещества с помощью EtOAc (40 мл), ацетонитрила (50 мл), и высушивания твердого вещества в высоком вакууме в течение ночи.
Как показано на стадии 2-vi Схемы 2, к перемешиваемой суспензии трет-бутил(2-(4-(метилкарбамоил)хинолин-8-ил)аллил)карбамата (Соединение 1009, 425 г, 1,245 моль), в EtOH (4,25 л), добавляют 5,5 М раствор HCl в iPrOH (1,132 л, 6,225 моль). Реакционную смесь перемешивают при кипячении с обратным холодильником (внутренняя температура составляет 76°С), в течение 30 минут, и затем оставляют стоять в течение 90 минут, для охлаждения до температуры 40°С. Добавляют EtOAc (2,1 л) и смесь перемешивают в течение дополнительных 2 часов. Твердое вещество собирают путем фильтрации, промывают с помощью EtOAc и высушивают в высоком вакууме, получая 8-(3-ацетамидопроп-1-ен-2-ил)-N-метилхинолин-4-карбоксамид (Соединение 1010, 357,9 г, выход 91%), в виде твердого вещества желто-коричневого цвета. LC-MS = 242,12 (М+Н); 1H-ЯМР (300 МГц, метанол-d4): δ 9,07 (д, J=4,6 Гц, 1H), 8,27 (дд, J=8,5, 1,5 Гц, 1H), 7,89 (дд, J=7,2, 1,5 Гц, 1H), 7,81-7,72 (м, 2H), 5,85 (с, 1H), 5,75 (с, 1H), 4,05 (с, 2H), 3,04 (с, 3H).
Как показано на стадии 2-vii Схемы 2, в атмосфере азота, 8-(3-ацетамидопроп-1-ен-2-ил)-N-метилхинолин-4-карбоксамид (12,4 г, 43,77 ммоль) и циклоокта-1,5-диен/(2R,5R)-1-[2-[(2R,5R)-2,5-диэтилфосфолан-1-ил]фенил]-2,5-диэтилфосфолан: катион родия (+1) - трифторметансульфонат (Ph(COD)(R,R)-Et-DuPhos-OTf, 316,3 мг, 0,4377 ммоль) комбинируют в метаноле (372,0 мл) и нагревают до температуры 35-40°С, пока твердые вещества не растворятся. Реакционную смесь вводят в аппарат для гидрирования, заменяют атмосферу водородом и смесь встряхивают при давлении водорода, составляющем 100 фунт/кв.дюйм, при температуре 50°С, в течение 14 часов. После охлаждения до комнатной температуры, смесь отфильтровывают через слой Florisil®, который затем промывают с помощью МеОН (2 раза по 50 мл). Фильтрат концентрируют при пониженном давлении и какие-либо следовые количества воды удаляют посредством азеотропной перегонки с DCM, при пониженном давлении. Остаток растирают при использовании 20% DCM в ТВМЕ (2 раза по 100 мл), получая (S)-8-(1-ацетамидопропан-2-ил)-N-метилхинолин-4-карбоксамид (Соединение 1011, 11,0 г, выход 88%, 96% е.е.), в виде не совсем белого цвета твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6): δ 8,97 (д, J=4,3 Гц, 1H), 8,67 (д, J=4,7 Гц, 1H), 7,97 (дд, J=8,1, 1,5 Гц, 1H), 7,88 (т, J=5,6 Гц, 1H), 7,73-7,54 (м, 2H), 7,52 (д, J=4,3 Гц, 1H), 4,31 (дд, J=14,3, 7,1 Гц, 1H), 3,55-3,32 (м, 3H), 2,86 (д, J=4,6 Гц, 3H), 1,76 (с, 3H), 1,28 (д, J=7,0 Hz, 3H). Энантиомерный избыток (е.е.) определяют с помощью хиральной ВЭЖХ (ChiralPac IC, 0,46 см × 25 см), объемная скорость потока составляет 1,0 мл/мин, в течение 20 минут, при температуре 30°С (20:30:50, метанол/этанол/гексаны и 0,1% диэтиламина), при времени удерживания для (R)-энантиомера, составляющем 5,0 минут, а для (S)-энантиомера, составляющем 6,7 минут.
Как показано на стадии 2-viii Схемы 2, (S)-8-(1-ацетамидопропан-2-ил)-N-метилхинолин-4-карбоксамид (11,0 г, 38,55 ммоль), в 6 М водном растворе HCl (192,7 мл, 1,156 моль), нагревают до температуры 60°С. После перемешивания в течение 2 суток при этой температуре, реакционную смесь охлаждают и добавляют дополнительные 20 мл 6 М водного раствора HCl. Продолжают перемешивать в течение дополнительных 2 суток, при температуре 70°С. Реакционную смесь охлаждают на бане со льдом и доводят рН до значения примерно 11, с помощью 6 М раствора NaOH (водн.). Водную смесь экстрагируют, с помощью смеси 5% МеОН/DCM, и объединенные органические экстракты промывают водой (60 мл), насыщенным раствором хлорида натрия (100 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют при пониженном давлении, получая сырой продукт, в виде твердого вещества желто-коричневого цвета. Это твердое вещество суспендируют в EtOAc (200 мл), охлаждают до температуры 3°С, на бане со льдом, и добавляют, в виде порций, 6 М HCl/i-PrOH (30 мл), до получения осадка белого цвета, который собирают путем фильтрации. Твердое вещество промывают с помощью EtOAc (100 мл) и высушивают в высоком вакууме, получая (S)-8-(1-аминопропан-2-ил)-N-метилхинолин-4-карбоксамиддигидрохлорид [Соединение 1012, 7,8 г, выход 61%, чистота 95% (5% соединения 1011)], в виде твердого вещества белого цвета. Этот продукт используют в последующих реакциях.
Как показано на стадии 2-ix Схемы 2, 8-[(1S)-2-амино-1-метилэтил]-N-метилхинолин-4-карбоксамидгидрохлорид (Соединение 1012, 24,0 г, 72,86 ммоль) растворяют в ТГФ (230 мл) и воде (40 мл) и перемешивают в течение 5 минут. Добавляют карбонат натрия (15,44 г, 145,7 ммоль), в 100 мл воды, и реакционную смесь перемешивают в течение 10 минут. Добавляют 4,6-дихлорпиримидин (12,18 г, 80,15 ммоль) и реакционную смесь кипятят с обратным холодильником при температуре 66°С, в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют с помощью 200 мл EtOAc, органический слой отделяют, а водный слой экстрагируют с помощью 100 мл EtOAc. Объединенные органические слои промывают водой (60 мл), насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, отфильтровывают через слой силикагеля (100 г) и концентрируют при пониженном давлении. Оставшийся сырой продукт растирают при использовании 20% DCM в МВТЕ (200 мл), затем МВТЕ (200 мл), получая (S)-8-(1-((6-хлорпиримидин-4-ил)амино)пропан-2-ил)-N-метилхинолин-4-карбоксамид (Соединение 1013, 23,15 г, выход 88%), в виде твердого вещества белого цвета. 1H-ЯМР (300 МГц, ДМСО-d6, 70°С): δ 8,97 (д, J=4,3 Гц, 1H), 8,38 (с, 1H), 8,20 (с, 1H), 8,03 (д, J=8,5 Гц, 1H), 7,71 (д, J=6,8 Гц, 1H), 7,66-7,55 (м, 1H), 7,52 (д, J=4,2 Гц, 2H), 6,63 (с, 1H), 4,46 (дд, J=14,1, 7,1 Гц, 1H), 3,67 (с, 2H), 2,90 (д, J=4,6 Гц, 3H), 1,40 (д, J=7,0 Гц, 3H); [α]D24 = 44,77 (c=1,14, MeOH).
Пример С. Получение (S)-N-метил-8-(1-((2’-метил-[4,5’-бипиримидин]-6-ил-4’,6’-d2)амино)пропан-2-ил)хинолин-4-карбоксамида (Соединение 2 )
Схема 3
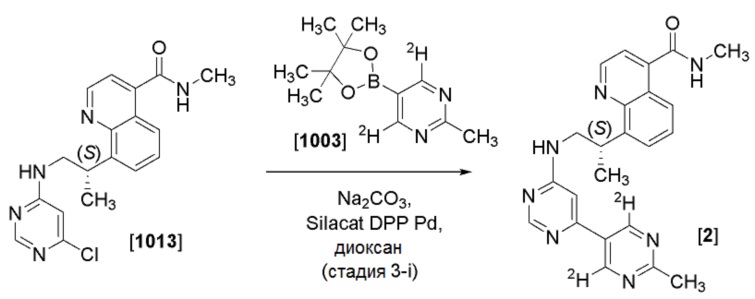
Как показано на стадии 3-i Схемы 3, (S)-8-(1-((6-хлорпиримидин-4-ил)амино)пропан-2-ил)-N-метилхинолин-4-карбоксамид (Соединение 1013, 2,542 г, 7,146 ммоль), 2-метил-4,6-дидейтеро-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин (Соединение 1003, 2,204 г, 7,146 ммоль, 72% масс.), Na2CO3 (10,72 мл 2 М водный раствор, 21,44 ммоль) и Silacat® DPP Pd (SiliCycle, Inc., 1,429 г, 0,3573 ммоль) растворяют в диоксане (30,00 мл), раствор продувают газообразным азотом в течение 5 минут и реакционную смесь перемешивают при температуре 90°С, в течение 16 часов. Смесь отфильтровывают через диатомовую землю, концентрируют при пониженном давлении, растворяют в ДМСО и очищают с помощью хроматографии с обращенными фазами (10-40% CH3CN/H2O, 0,1% ТФУК). Фракции продукта объединяют и добавляют DCM и МеОН, затем 1 н раствор NaOH, до тех пор, пока рН не достигнет значения более, чем 7. Раствор продукта экстрагируют с помощью DCM (2 раза) и объединенные экстракты сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая (S)-N-метил-8-(1-((2’-метил-4’,6’-дидейтеро-[4,5’-бипиримидин]-6-ил)амино)пропан-2-ил)хинолин-4-карбоксамид (Соединение 2, 181 мг, выход 28%), в виде не совсем белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6, 70°С): δ 8,95 (д, J=4,2 Гц, 1H), 8,47 (с, 1H), 8,35 (с, 1H), 8,01 (д, J=8,4 Гц, 1H), 7,74 (д, J=7,1 Гц, 1H), 7,59 (т, J=7,8 Гц, 1H), 7,50 (д, J=4,3 Гц, 1H), 7,30 (с, 1H), 7,03 (с, 1H), 4,51 (г, J=7,2 Гц, 1H), 3,78 (м, 2H), 2,88 (д, J=4,6 Гц, 3H), 2,68 (с, 3H), 1,41 (д, J=7,0 Гц, 3H). Когда 2-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин используют в этой реакции вместо дейтерированного Соединения 1003, то получают Соединение 1: LCMS = 414,40 (М+Н); 1H-ЯМР (300 МГц, ДМСО-d6, 70°С): δ 9,14 (с, 2H), 8,95 (д, J=4,3 Гц, 1H), 8,47 (с, 1H), 8,34 (уш.с, 1H), 8,02 (д, J=8,4 Гц, 1H), 7,74 (д, J=7,3 Гц, 1H), 7,59 (т, J=7,8 Гц, 1H), 7,50 (д, J=4,3 Гц, 1H), 7,28 (уш.с, 1H), 7,04 (с, 1H), 4,52 (г, J=7,0 Гц, 1H), 3,83-3,66 (м, 2H), 2,88 (д, J=4,4 Гц, 3H), 2,68 (с, 3H), 1,42 (д, J=6,9 Гц, 3H).
Пример 2: Общий способ получения со-кристаллов соединения формулы I и CCF, выбираемого из группы, состоящей из адипиновой кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты или бензойной кислоты
Вообще, со-кристаллы согласно данному изобретению можно получать путем кристаллизации из суспензии или кристаллизации из НМЕ.
В одном конкретном примере, или Соединение 1 или Соединение 2 взвешивали в пробирках и смешивали с CCF в соотношении примерно 1:1,2, соответственно, и перемешивали в подходящем растворителе, в течение 2 недель. По окончании этого времени, анализ посредством порошковой рентгенографии показал новые кристаллические структуры. В таблице 1 суммированы соотношения соединений и концентраций для образования со-кристаллов Соединения 1.
|
Пример 3: Получение со-кристалла из соединений 1 и 2 и адипиновой кислоты
В сосуд с кожухом емкостью 1 л (с верхним перемешиванием) вводят соединение 1 (36,04 г, 0,087 моль, 1,000 экв.), адипиновую кислоту (16,65 г, 0,114 моль, 2,164 экв.), 1-пропанол (321,00 г, 5,342 моль, 122,564 экв.) и суспензию перемешивают со скоростью 750 об/мин. Добавляют затравку со-кристалла (затравка со-кристалла 0,5%) и реакционную смесь перемешивают при температуре 25°С. Образование со-кристалла контролируют путем отбора аликвот и анализа с помощью Раман-спектроскопии. Спустя 114 часов, определяют, что образование со-кристалла завершено. Суспензию отфильтровывают, используя воронку с пористой стеклянной пластинкой средней пористости емкостью 600 мл, пока уровень растворителя не станет одинаковым, с влажным осадком на фильтре. Маточный раствор отделяют, индексируют и анализируют в отношении содержания. Влажный осадок на фильтре затем промывают 1-пропанолом (270,0 мл, 7,49 об.). Твердые вещества влажного осадка на фильтре взвешивают и высушивают в вакуумном шкафу, при температуре 50°С. Конечный выход со-кристалла соединения 1 и адипиновой кислоты составляет 21,7 г. Подобную процедуру также проводят в отношении со-кристалла из соединения 2 и адипиновой кислоты. ВЭЖХ-Анализы показывают стехиометрию примерно 2:1 для Соединения 1 или Соединения 2 по отношению к адипиновой кислоте.
Альтернативно, со-кристаллы из адипиновой кислоты и соединения (1) также получают путем НМЕ-кристаллизации. НМЕ-кристаллизацию осуществляют по шкале 20 г, на 16 мм экструдере. Соединение (1) в свободной форме и чистую адипиновую кислоту экструдируют при перемешивании с высокой скоростью сдвига и при повышенных температурах (например, 144°С или 155°С), до образования со-кристалла.
Некоторые физические свойства соединения (2) в форме свободного основания и его со-кристалла с адипиновой кислотой суммированы в нижеприводимой таблице 2.
|
Пример 4: Характеристика порошковой рентгенограммы
Спектры порошковой рентгенографии для со-кристаллов согласно данному изобретению (см. фигуры 1-7) регистрировали при комнатной температуре, по способу отражения, используя дифрактометр Bruker D8 Advance, снабженный запаянным в трубку Cu-источником и детектором Vantec PSD (Bruker AXS, Madison, WI). Генератор рентгеновсокого излучения работал при напряжении 40 кВ и силе тока 40 мА. Порошкообразный образец помещали на силиконовый или РММ держатель. Данные регистрировали в диапазоне 4° - 45° 2θ, с размером шага 0,0140° и временем пребывания 1 сек. на шаг. Использовали фиксированные щели отклонения 0,2 мм.
Порошковые рентгенограммы для со-кристаллов формы А и формы В согласно данному изобретению (см. фигуры 14 и 15) регистрировали при комнатной температуре, по способу трансмиссии, используя PANanalytical Empyrean дифрактометр, снабженный запаянным в трубку Cu-источником и детектором PIXCel 1D. Генератор рентгеновсокого излучения работал при напряжении 45 кВ и силе тока 40 мА. Порошкообразный образец помещали на держатель для трансмиссии и удерживали с помощью тонкослойных пленок Mylar. Данные регистрировали в диапазоне 4° - 40° 2θ, с размером шага 0,007° и временем пребывания 1549 сек. на шаг. Дифрактометр представлял собой устройство с 0,02° солнечными щелями, фиксированными 1/2° противорассеивающими щелями относительно падающего луча и 1/4° противорассеивающими щелями относительно дифрагированной стороны. Два сканирования аккумулировали.
На фиг.1 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и адипиновой кислотой. Порошковая рентгенограмма показывает, что со-кристалл представляет собой смесь форм А и В. Некоторые конкретные пики отражения спектра порошковой рентгенограммы суммированы ниже.
|
На фиг.2 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 2 и адипиновой кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
На фиг.3 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и лимонной кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
На фиг.4 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и фумаровой кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
На фиг.5 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и малеиновой кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
На фиг.6 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и янтарной кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
На фиг.7 представлена порошковая рентгенограмма со-кристалла, образованного между соединением 1 и бензойной кислотой. Некоторые конкретные пики отражения порошковой рентгенограммы суммированы ниже.
|
Пример 5: Термогравиметрический анализ
Термогравиметрические анализы (TGA) проводили на термогравиметрическом анализаторе модели Q5000 TA Instruments. Приблизительно 1-4 мг твердого образца помещали в платиновую чашку для образца и нагревали до 300°С, по 10°С /мин., в токе азота 90 мл/мин. Все термограммы анализировали, используя программное обеспечение V4.4A TA Instruments Universal Analysis 2000.
Кривые термогравиметрического анализа для со-кристаллов соединения (1) и адипиновой кислоты и для со-кристаллов соединения (2) и адипиновой кислоты представлены на фигурах 8 и 9, соответственно. На фигурах представлена потеря адипиновой кислоты, начиная примерно с температуры 150°С, для обоих со-кристаллов.
Пример 6: Дифференциальная сканирующая калориметрия
Дифференциальную сканирующую калориметрию (DSC) осуществляли на калориметрическом анализаторе модели Q2000 TA Instruments. Примерно 1-4 мг твердого образца помещали в чашку из гофрированного алюминия с точечным отверстием и нагревали до 300°С, по 10°С/мин., в токе азота 50 мл/мин. Все данные анализировали, используя программное обеспечение V4.4A TA Instruments Universal Analysis 2000.
Типичные термограммы дифференциальной сканирующей калориметрии представлены на фиг.10 и фиг.11 для со-кристаллов соединения (1) и адипиновой кислоты и для со-кристаллов соединения (2) и адипиновой кислоты, соответственно.
Пример 7: Спектроскопия ядерного магнитного резонанса твердого тела
ЯМР-спектры твердого тела (ss-NMR) получали на спектрометре Bruker-Biospin, Advance III, 400 МГц, снабженном головкой HFX 4 мм. Приблизительно 70 мг каждого образца уплотняли до полного объема ZrO2-роторов 4 мм Bruker-Biospin. Применяли быстроту вращения под магическим углом (MAS), типично, при 12,5 кГц. Температура измерительной головки составляла до 275°К, для минимизации эффекта фрикционного нагрева во время вращения. Замедление релаксации на 30 секунд использовали для всех экспериментов. Время СР-контакта 13С-СРМАS-эксперимента составляло до 2 миллисекунд. Использовали СР-протонный импульс с линейным уклоном (от 50% до 100%). Соответствие по Hartmann-Hahn оптимизировали по внешнему эталонному образцу (глицин). Использовали расщепление SPINAL 64, с напряженностью поля приблизительно 100 кГц. Химический сдвиг соотносили к внешнему стандарту адамантану, с его направленным в область сильного поля резонансом, установленным при 29,5 част./млн.
После промывки растворителем, ss-NMR использовали для изучения со-кристаллических комплексов соединения 1 и соединения 2 с адипиновой кислотой. См. фигуры 12 и 13, соответственно. Отсутствие пиков отражения, типичных для свободного соединения 1, соединения 2 или адипиновой кислоты, указывает на чистый со-кристалл.
Пример 8: Получение полиморфных форм А и В со-кристаллов адипиновой кислоты и соединений ( 1 ) и ( 2 )
А. Получение полиморфной формы А со-кристалла адипиновой кислоты и соединения ( 1 )
Полиморфную форму А сокристалла адипиновой кислоты и соединения (1) можно получать путем экструзии из расплава соединения (1) и адипиновой кислоты. Конкретный пример получения формы А путем экструзии из расплава описан ниже.
Адипиновую кислоту измельчали на струйной мельнице, используя Jet-O-Mizer Fluid Energy Model 00, применяя следующие установки:
|
Соединение (1) просеивали через сито № 18 меш. Соединение (1) и размолотую на струйной мелице адипиновую кислоту взвешивали для приготовления бинарных смесей с примерно 80% масс., 75% масс. и 65% масс. : масса соединения (1). Исходные смеси приготовляли путем пропускания через сито № 30 и последующего смешения в цилиндрическом смесителе, в течение 5 минут.
Смеси экструдировали, используя сдвоенный шнековый экструдер Leistritz Nano 16 с тремя температурными зонами и снабженный плунжерным дозатором. Шнековая конструкция содержала конвейерную доставку, помпаж и 30° и 60° пластицирующие элементы. Все эксперименты осуществляли вне головки, установленной на экструдере. Температура, скорость шнека и температура перечислены в нижеприводимой таблице. Температуру устанавливали и контролировали при одном и том же значении для всех трех нагревательных элементов. Во время экструзии контролировали вращающий момент и скорость шнека увеличивали, когда шнеку грозило «заедание».
|
Трансмиссия порошковой рентгенограммы и 13С-ЯМР-спектр формы А со-кристалла адипиновой кислоты и соединения (1) представлены на фигурах 14 и 16, соответственно. Некоторые пики, наблюдаемые в 13С-ЯМР-спекте, суммированы ниже.
|
В. Получение полиморфной формы А со-кристалла адипиновой кислоты и соединения ( 2 )
Форму А со-кристалла адипиновой кислоты и соединения (2) получали посредством суспендирования в ацетоне. 322 мг Смеси формы А и формы В со-кристалла соединение 2:адипиновая кислота, полученного как описано в примере 3, и 221 мг адипиновой кислоты перемешивали в 9,8 г ацетона, при температуре от 20°С до 30°С, в течение 30 суток. Приблизительно 50 мг твердого вещества выделяли посредством фильтрующего центрифугирования через мембранный фильтр, используя центробежное фильтрующее устройство, и высушивали в вакууме при температуре от 20°С до 30°С, в течение приблизительно 2 часов. ЯМР-спектры твердого тела получали, как описано в примере 7, за исключением того, что количество образца составляло приблизительно 50 мг и замедление релаксации составляло до 5 секунд. 13С-ЯМР-Спектр формы А со-кристалла адипиновой кислоты и соединения (2) (см. фигуру 17) по существу является таким же, как таковой формы А со-кристалла адипиновой кислоты и соединения (1). Некоторые пики, наблюдаемые в 13С-ЯМР-спектре, суммированы ниже.
|
С. Получение полиморфной формы В со-кристалла адипиновой кислоты и соединения ( 2 )
Полиморфную форму В со-кристалла адипиновой кислоты и соединения (2) можно получать путем использования распылительной сушки. Конкретный пример описан ниже.
Растворяющую смесь для распылительной сушки получают путем взвешивания 50 г метанола и 117,5 г дихлорметана в стеклянной колбе и встряхивания. Смесь из 500 мг соединения (2), 176,2 мг адипиновой кислоты и 19,3 г смеси метанола с дихлорметаном взвешивают в флаконе из прозрачного стекла и перемешивают до тех пор, пока все твердые вещества не растворятся. Раствор подвергают распылительной сушке, используя распылительную мини-сушилку Buchi В-290, применяя следующую установку:
|
Выделенное вещество полностью перекристаллизуется в течение 2 месяцев, при комнатной температуре, до формы В со-кристалла соединение (2):адипиновая кислота.
Порошковая рентгенограмма и 13С-ЯМР-спектр формы В со-кристалла адипиновой кислоты и соединения (2) представлены на фигурах 15 и 18, соответственно. Некоторые пики, наблюдаемые в 13С-ЯМР-спектре, суммированы ниже.
|
Пример 9: Диаграмма бинарной фазы со-кристалла соединение ( 2 )/адипиновая кислота
На фиг.18 представлена приблизительная фазовая диаграмма, согласующаяся с температурными данными: ТАА: температура плавления адипиновой кислоты, ТСоХ: температура плавления со-кристалла соединение (2):адипиновая кислота, ТР: перитектическая температура, ТCMPD2: температура плавления соединения 2, ТЕ1: эвтектическая температура расплава, Р: перитектическая точка, Е1: эвтектическая точка, SAA: твердая адипиновая кислота, L: жидкость, SСoX: твердый со-кристалл соединение (2):адипиновая кислота, SCMPD2: твердое соединение (2), Тm-E: метастабильная эвтектическая температура расплава, m-E: метастабильная эвтектическая точка.
Диаграмму бинарной фазы исследовали, используя дифференциальную сканирующую калориметрию относительно смесей соединения (2) и адипиновой кислоты и смесей соединение (2):адипиновая кислота и со-кристалла. Стехиометрический состав со-кристалла в % масс.:масс соединения (2) рассчитывали из молярной стехиометрии. Типичная термограмма дифференциальной сканирующей калориметрии представлена на фиг.11. Термограмма со-кристалла соединение (2):адипиновая кислота показывает эндотерму плавления при 196°С ± 2°С, последующую экзотерму перекристаллизации, за которой следует широкая эндотерма растворения. Плавление соединения (2) наблюдали при температуре 256°С ± 2°С, когда адипиновая кислота полностью разлагается и улетучивается. Наблюдаемая термограмма дифференциальной сканирующей калориметрии зависит от композиции, то есть, твердых фаз, которые присутствуют в веществе, и объясняется посредством диаграммы бинарной фазы. Кроме того, она зависит от других экспериментальных деталей. Эвтектическую эндотерму расплава наблюдали, когда присутствовал избыток адипиновой кислоты в дополнение к со-кристаллу, при температуре 138°С ± 2°С. Диаграмма бинарной фазы соединения (2) и адипиновой кислоты согласуется с наблюдаемыми кривыми дифференциальной сканирующей калориметрии относительно со-кристалла соединение 1:адипиновая кислота и смесей соединение 1:адипиновая кислота с адипиновой кислотой; пример представлен на фиг.10.
Некоторые измеренные точки фазовой диаграммы фиг.19 суммированы ниже:
|
Пример 9: Биофармацевтический анализ
Кривую рН-растворимости для соединения (2), со-кристалла соединение (2):адипиновая кислота и со-кристалла соединение (2):адипиновая кислота в присутствии избыточной адипиновой кислоты рассчитывали из значений pKa соединения (2) и адипиновой кислоты, значения Ksp со-кристалла соединение (2):адипиновая кислота, константы связывания соединения (2) и адипиновой кислоты в водном буфере и константы самоассоциации соединения (2) в водном буфере и растворимости свободной формы соединения (2). Растворимость со-кристалла адипиновой кислоты и соединения (2) являлась зависимой от значения рН и концентрации избыточной адипиновой кислоты. Вообще, когда концентрация адипиновой кислоты увеличивалась, кажущаяся растворимость со-кристалла уменьшалась. При низком значении рН растворимость со-кристалла была меньше, чем соединения (2) в форме свободного основания, однако, в пределах диапазона значений рН тонкой кишки воздерживающегося от еды человека, со-кристалл гораздо более растворим, чем соединение (2) в свободной форме (или в форме свободного основания), как показано на фиг.20. Имитации перорального дозирования показали приведение к почти полной абсорбции со-кристалла адипиновой кислоты при дозах вплоть до 1,5 г, а при дозах, превышающих 800 мг, негативное воздействие адипиновой кислоты на растворимость со-кристалла незначительно уменьшало экспозицию (данные не представлены).
Пример 10. Анализ в отношении растворения
Эксперименты в отношении in vitro двухфазового растворения, используя имитированные кишечные и желудочные жидкости, использовали для оценки и прогнозирования in vivo воздействия соединений (1) и(2) и их со-кристаллов с адипиновой кислотой. Наиболее обычно, абсорбция лекарственного средства может происходить в верхней части кишечника и высокая растворимость обычно указывает на высокую in vivo биодоступность после добавления имитированной кишечной жидкости в двухфазовых экспериментах для лекарственных средств с ограничиваемой растворимостью биодоступностью. На фиг.21 представлены профили двухфазового растворения для: i) со-кристалла соединение 1:адипиновая кислота, полученного посредством экструзии из расплава (НМЕ) и кристаллизации из суспензии (SC); ii) НМЕ 65:35: со-кристалла соединение 1:адипиновая кислота, полученного путем использования экструзии из расплава, с 65% масс. соединения 1 и 35% масс. адипиновой кислоты; iii) НМЕ 75:25: со-кристалла соединение 1:адипиновая кислота, полученного при использовании экструзии из расплава, с 75% масс. соединения 1 и 25% масс. адипиновой кислоты; iv) НМЕ 80:20: со-кристалла, полученного при использовании экструзии из расплава, с 80% масс. соединения 1 и 20% масс. адипиновой кислоты; v) SC 80:20: кристаллизованного из суспензии со-кристалла соединение 2:адипиновая кислота с конечным содержанием соединения 2 79% масс. и 21% масс. адипиновой кислоты; и vi) свободная форма: свободной формы соединения 2. Как представлено на фиг.21, данные двухфазового растворения относительно со-кристалла соединение 1:адипиновая кислота и со-кристалла соединение 2:адипиновая кислота показали более высокие концентрации соединения 1 и соединения 2, чем соединение 1 или соединение 2 в свободной форме, соответственно. Также, концентрация соединения 1, в случае со-кристалла соединение 1:адипиновая кислота, полученного посредством экструзии из расплава из соединения 1 и адипиновой кислоты, с 65% масс. и 35% масс., оказалась выше, чем в случае кристаллизованного из суспензии со-кристалла соединение 2:адипиновая кислота или со-кристалла соединение 1:адипиновая кислота, полученного посредством экструзии из расплава из соединения 1 и адипиновой кислоты, с 75% масс. и 25% масс., и со-кристалла соединение 1:адипиновая кислота, полученного посредством экструзии из расплава из соединения 1 и адипиновой кислоты, с 80% масс. и 20% масс., соответственно. Без привязки к конкретной теории, это возможно вследствие микроструктуры, которая получена для эвтектического твердого вещества.
Эксперименты в отношении двухфазового растворения осуществляли, по меньшей мере, в двух повторениях. Имитированную в состоянии воздержания от еды желудочную жидкость (FaSSGF) уравновешивали в течение 30 минут при перемешивании и при температуре 37°С, в прозрачном стеклянном флаконе емкостью 100 мл, используя водяную баню, состоящую из покрытого кожухом резервуара с контролируемой температурой. Добавляли со-кристалл соединение 1:адипиновая кислота и со-кристалл соединение 2:адипиновая кислота и суспензию перемешивали со скоростью примерно 130 об./мин. и при температуре 37°С, соответственно. Аликвоты (0,5 мл) отбирали в моменты времени 5, 15, 30 и 60 мин. Твердые вещества отделяли посредством фильтрующего центрифугирования, используя центробежные фильтровальные установки с 0,45 мкм мембраной и вращение со скоростью 5000 об./мин. в течение 5 мин, на центрифуге Eppendorff, модель 5418. Значение рН растворяемых образцов измеряли после их отбора в моменты времени 15 мин и 60 мин. Супернатанты отфильтрованных образцов 10-кратно разводили с помощью разбавителя для ВЭЖХ-анализа. В момент времени 65 мин, имитированную в состоянии воздержания от еды кишечную жидкость добавляли к суспензии и суспензию продолжали перемешивать со скоростью 130 об/мин. Аликвоты (0,5 мл) отбирали в моменты времени 75, 90, 120 и 180 мин. Твердые вещества отделяли посредством фильтрующего центрифугирования, используя центробежные фильтровальные установки с 0,45 мкм мембраной и вращение со скоростью 5000 об./мин., в течение 5 мин, на центрифуге Eppendorff, модель 5418. Значение рН растворенных образцов измеряли после их отбора в моменты времени 75, 90 и 180 мин. Супернатанты отфильтрованных образцов 10-кратно разводили с помощью разбавителя для ВЭЖХ-анализа. Количества вещества и используемые имитированные жидкости суммированы ниже:
|
Концентрации соединений 1 и 2 измеряли, используя следующий ВЭЖХ-метод, соответственно:
|
Типичные препараты имитированной жидкости использовали для экспериментов двухфазового растворения: FaSSIF получали путем добавления примерно 1,80 г гранул гидроксида натрия, 2,45 г малеинового ангидрида, 6,37 г хлорида натрия, 1,61 г таурохолята натрия и 618, 8 мг лецитина к 800 мл воды. Раствор перемешивали до тех пор, пока все вещества полностью не растворялись. Затем значение рН устанавливали равным 6,5, используя 1,0 н HCl и 50%-ный раствор NaOH, в то время как раствор перемешивали. Добавляли воду до конечного объема 1 л.
FaSSGF получали путем добавления 50,0 мл 1,0 н HCl, около 1,0 г “800-2500 Ед/мг” пепсина, 43 мг таурохолята натрия, 2,0 г хлорида натрия (NaCl) к 800 мл воды. Добавляли воду до конечного объема 1 л. Конечное значение рН типично составляло 1-2.
Пример 12. Биодоступность со-кристаллов согласно данному изобретению
Пероральную биодоступность со-кристалла соединение 2:адипиновая кислота и свободной формы соединения 2, в случае людей, прогнозировали, базируясь на кривых растворимости при рассчитанном значении рН, представленных на фиг.20, используя программное обеспечение GastroOlus, версия 8.5.0002 Simulations Plus, Inc. Использовали проницаемость тонкой кишки 1,67е-4 см/с и радиус частицы, равный 10 микрон. Все другие параметры являлись установленными по умолчанию в программном обеспечении. Имитации прогнозируют 100% долю, абсорбируемую в случае пероральных доз, вплоть до 1500 мг со-кристалла соединение 2:адипиновая кислота и со-кристалла соединение 2:адипиновая кислота с присутствием дополнительной адипиновой кислоты, тогда как прогнозируемая абсорбируемая пероральная доля соединения 2 резко уменьшается с возрастающими дозами. Как представлено на фиг.22, имитации показывают, что со-кристалл соединение 2:адипиновая кислота обладает превосходной пероральной биодоступностью, по сравнению со свободной формой соединения 2, при достижении достаточной экспозиции, согласно исследованиям безопасности человека, для доз вплоть до, но не ограничиваясь этим, 1500 мг, и, в результате, это может приводить к более широким пределам безопасности в отношении соединения 2. Кроме того, высокая пероральная биодоступность может снижать пероральную дозу, которая необходима для достижения эффективных уровней в крови. Подобных результатов ожидают для соединения 1, базируясь на сходстве наблюдаемых физических свойств соединения 1 и соединения 2.
Пример 13. Биологическая эффективность со-кристалла соединение 2/адпипиновая кислота
Пример А. Тест в отношении ингибирования ДНК-PK-киназы.
Со-кристалл из адипиновой кислоты и соединения 2 подвергали скринингу, в отношении его способности ингибировать DNA-PK, используя стандартный радиометрический анализ. Вкратце, в этом тесте в отношении киназы исследуют перенос концевого 33Р-фосфата в 33Р-АТФ на пептидный субстрат. Тест осуществляли на 384-луночных планшетах с конечным объемом 50 мкл на лунку, содержащих приблизительно 6 нМ DNA-РK, 50 мкм HEPES (рН = 7,5), 10 мМ MgCl2, 25 мМ NaCl, 0,01% DSA, 1 мМ DTT, 10 мкг/мл фрагментированной двухцепочечной ДНК (получаемой от фирмы Sigma), 0,8 мг/мл DNA-PK-пептида (Glu-Pro-Pro-Leu-Ser-Gln-Glu-Ala-Phe-Ala-Asp-Leu-Trp-Lys-Lys-Lys, получаемого от фирмы American Peptide) и 100 мкМ АТФ. Соответственно, соединения согласно настоящему изобретению растворяли в ДМСО, для получения исходных 10 мМ растворов. Затем осуществляли последовательные разведения в ДМСО, для получения конечных растворов для тестирования. Аликвоту 0,75 мкл ДМСО или ингибитора в ДМСО добавляли в каждую лунку, затем добавляли раствор АТФ-субстрата, содержащий 33Р-АТФ (получаемый от фирмы Perkin Elmer). Реакцию инициировали путем добавления DNA-PK, пептида и ds-DNA. Спустя 45 минут, реакционную смесь гасили с помощью 25 мкл 5%-ной фосфорной кислоты. Реакционную смесь переносили на 384-луночные РН-планшеты MultiScreen HTS (получаемые от фирмы Millipore), оставляли связываться в течение одного часа и промывали три раза с помощью 1%-ной фосфорной кислоты. После добавления 50 мкл высокоэффективного сцинциллятора Ultima GoldTM (получаемого от фирмы Perkin Elmer) образцы подвергали подсчитыванию импульсов на микропланшетном счетчике сцинтилляции и люминесценции Packard TopCount NXT (Packard BioScience). Значения Ki рассчитывали, используя программу Microsoft Excel Solver macros, для подгонки данных к кинетической модели для ингибирования конкурирующего плотного связывания. Со-кристалл адипиновой кислоты и соединения (2) имеет Ki примерно 2 нМ.
Пример В: Эффективность соединений ( 1 ) и ( 2 ) в комбинации с тотальным облучением организма.
Эффективности in vivo соединений (1) и (2) в комбинации с тотальным облучением организма исследовали на ксенографт-модели OD26749 первичного NSCLC (немелкоклеточный рак легких) и на кснографт-моделях клеточной линии OE-19 GEJ. Результаты суммированы в таблицах 14 и 15. При этих исследованиях, соединения (1) и (2) смешивали с 16% каптизола, 1% поливинилпирролидона, 1% гидроксипропилметилцеллюлозы Е5, рН 2.
В.1. Эффективность соединения ( 1 ) в комбинации с облучением на ксенографт-модели OD26749 NSCLC.
Эффективность in vivo соединения (1) оценивали на подкожной ксенографт-модели OD26749 первичного NSCLC. Соединение (1), вводимое по 100 мг/кг три раза в день, в день 1 значительно усиливало эффект облучения от единичной дозы 2 Gy тотального облучения организма на этой модели (% Т/С 26 для комбинации по сравнению с % Т/С 80 для одного облучения, Р<0,001). Эффективность оценивали, используя режимы, при которых тотальное облучение организма дозой 2 Gy проводили дважды, с разрывом в одну неделю. Соединение (1) вводили перорально (три раза в день в моменты времени 0, 3 и 7 часов), в количестве 100 мг/кг, индивидуально или вместе с одной дозой 2 Gy тотального облучения организма, около 3,25 часа. Спустя семь дней, повторяли те же самые режимы. Соединение (1), в комбинации с тотальным облучением организма дозой 2 Gy, индуцировали значительную регрессию опухоли (% Т/Тi -75; Р<0,01) по сравнению с одним облучением.
Соединение (1) индивидуально и облучение индивидуально не вызывали значительного (Р>0,05) ингибирования роста опухоли по сравнению со средами-контролями (% Т/С 74 и 64, соответственно). На этой модели первичной опухоли, обе группы показывали некоторую степень потери массы тела (максимальная потеря 6,7% и 8,7% в день 2 или в день 9, для одного облучения и комбинированной группы, соответственно), которая повторялась в течение курса исследования. Добавление второго проведения облучения дозой 2 Gy, в комбинации с соединением (1) приводило к значительному увеличению во времени до удвоения опухоли (TTD), c суточным 33,4 TTD в комбинированной группе по сравнению с только двумя-тремя сутками для групп из одного агента: среда, облучение и соединение (1).
В.2. Обобщающее исследование: соединения ( 1 ) и ( 2 ) в комбинации с двумя циклами тотального облучения организма на ксенографт-модели первичного NSCLC (OD26749) у голых мышей
Эффективности соединений (1) и (2), в комбинации с тотальным облучением организма (2 Gy), оценивали на ксенографт-модели OD26749 первичного NSCLC, при уровне дозы соединения (1), равное 100 мг/кг, перорально, два раза в день (моменты времени 0 и 4 часа) и уровнях дозы соединения (2), равной 50 мг/кг и 100 мг/кг, перорально, два раза в день (моменты времени 0 и 4 часа). Два цикла тотального облучения организма (2 Gy) проводили спустя 15 минут после введения первого соединения (0,25 часа). Контрольным животным вводили наполнитель перорально, два раза в день (моменты времени 0 и 4 часа). Два цикла обработки осуществляли в день 0 и день 7.
Два цикла тотального облучения организма (2 Gy) индивидуально не ингибировали рост опухоли по сравнению с опухолями, обработанными наполнителем (% Т/С = 106). Однако, эффективность значительно усиливалась, когда соединения (1) и (2) комбинировали с облучением, так как средние объемы опухоли в случае всех комбинированных групп были значительно меньше, чем таковые в группе только облучения (Р<0,001). В дополнение, комбинированные с соединениями (1) и (2) (100 мг/кг два раза в день) группы демонстрировали очень похожую противоопухолевую активность (% Т/С = 4,80 и 7,80, соответственно), экспозицию в крови (AUC 65,8 и 58,2 мкг*час/мл) и толерабельность (максимальное изменение массы тела -2,4% и 2,70%). В дополнение, средний объем опухоли в случае комбинированной группы, в дозе 50 мг/кг, статистически был другим, чем таковые в случае комбинированных с соединениями (1) и (2), в дозе 100 мг/кг групп (Р<0,001).
В.3. Эффективность соединений ( 1 ) и ( 2 ), в комбинации с облучением на ксенографт-модели гастроэзофагиального рака (GEJ) ОЕ-19
Ксенографт-модель клеточной линии ОЕ-19 использовали для оценки эффективности соединений (1) и (2), индивидуально и в комбинации с облучением. Два цикла обработки проводили (день 0 и день 7), как осуществляли выше в случае модели OD26749. Циклы тотального облучения организма (2 Gy) индивидуально показывали минимальное воздействие на рост опухоли по сравнению со наполнителем-контролем (% Т/С = 60,0), указывая на то, что эта модель опухоли является относительно резистентной к облучению. В противоположность, комбинация соединения (2) и дозы 2 Gy тотального облучения организма приводила к значительному ингибированию роста опухоли по сравнению с наполнителем-контролем с % Т/С = 8,00 (Р<0,001). Комбинированная группа также показала значительное ингибирование роста опухоли по сравнению с группой только облучения (Р<0,001). Соединение (1) в комбинации с тотальным облучением в дозе 2 Gy также значительно ингибировало рост опухоли в случае этой модели.
В.4. Эффективность соединений ( 1 ) и ( 2 ) на ксенографт-модели первичного NSCLC
Эффективности in vivo соединений (1) и (2) оценивали индивидуально и в комбинации с тремя последовательными днями сфокусированного облучения на подкожной ксенографт-модели первичного NSCLC LU-01-0030. Зависимую от дозы противоопухолевую активность соединения (2), индивидуально и в комбинации с сфокусированным лучом ионизирующего излучения, оценивали на модели LU-01-0030. На этой модели, обработка ионизирующим излучением индивидуально приводила к значительной регрессии опухоли, однако, возобновление роста опухоли наблюдалось спустя приблизительно 20 дней после последнего дня обработки. В день 34, комбинированные с соединением (2) группы продемонстрировали статистически значительную (Р<0,001) противоопухолевую активность по сравнению с наполнителем и группами только облучения, с % Т/Тi-значениями -96,3, -67,1, -96,9, и 1,6%, для групп с дозами 50 мг/кг и 25 мг/кг, два раза в день, и 50 мг/кг и 25 мг/кг, каждый день. Мышей в группах комбинированной обработки контролировали (мыши без обработки) вплоть до 90 дней, так как в случае некоторых мышей не подтверждалось обременение опухолью. В случае всех экспериментальных групп, обработки обычно были хорошо переносимыми, что подтверждалось максимальными потерями массы в диапазоне от -1,11% до -6,93%, в дни с 1 по 9 после начала обработки.
В.5. Эффективность соединений ( 1 ) и ( 2 ), в комбинации с облучением в случае ксенографт-модели первичного рака GEJ
Активности in vivo соединений (1) и (2) сравнивали в комбинации с сфокусированным лучом ионизирующего излучения, в случае подкожной ксенографт-модели первичного рака желудка. На модели ST 02 0004, сфокусированное ионизирующее излучение вводили в три последовательных дня индивидуально и в комбинации с соединением (1) или (2). Обработка облучением индивидуально приводила к небольшому замедлению роста опухоли, спустя приблизительно 7 дней после последнего дня обработки. Комбинированные с соединениями (1) и (2) группы продемонстрировали статистически значительную (Р<0,001) противоопухолевую активность по сравнению с наполнителем и группами только облучения с %Т/Тi-значением -2,8%, для комбинированной с соединением (1), в дозе 100 мг/кг группы и %Т/С-значениями 9,2 и 17,4 для комбинированных с соединением (2) в дозе 100 мг/кг и 25 мг/кг, соответственно, групп. В случае всех экспериментальных групп, обработка обычно была хорошо переносима, что подтверждалось максимальными потерями массы в диапазоне от -8,06% до -10,0%, в дни с 10 по 48 после начала обработки.
Противоопухолевую активность соединения (2), в комбинации с сфокусированным ионизирующим излучением и стандартом из используемых для лечения агентов, паклитакселом и карбоплатином, также оценивали на модели ST 02 0004. Обработку с помощью паклитаксела, карбоплатина и облучения проводили один раз в неделю, в течение трех недель, индивидуально или в комбинации с соединением (2). Обработка паклитакселом/карбоплатином не оказывала влияния на рост опухоли, также как обработка комбинацией паклитаксел/карбоплатин и 50 мг/кг соединения (2). Однако, в день 45, 25 мг/кг и 50 мг/кг соединения (2), в комбинации с паклитакселом/карбоплатином и облучением, продемонстрировали статистически значительное различие (Р<0,001) в противоопухолевой активности по сравнению с группой с наполнителем с %Т/С-значениями 2,5 и 11,1, для групп комбинации соединения (2), в дозе 50 мг/кг и 25 мг/кг, паклитаксел/карбоплатин, облучение. Далее, группы комбинации 50 мг/кг и 25 мг/кг соединения (2), паклитаксел/карбоплатин, облучение были статистически отличны (Р<0,05) от групп паклитаксел/карбоплатин, паклитаксел/карбоплатин/50 мг/кг соединения (2) и паклитаксел/карбоплатин/облучение. Экспозиции в крови соединения (2) составляли 9,3 и 27 мкг*час/мл для групп с дозой 25 мг/кг и 50 мг/кг соединения (2), два раза в день, соответственно.
В таблицах 14 и 15, например, указания РО bid (0,4h) означают, что соединение (2) вводят дважды (два раза в день) в момент времени 0 и затем спустя 4 часа; указания IR (0,25h) qdx3 означают, что облучение проводят спустя 15 минут (0,25 часа) после введения соединения (2) (0 часов) и один раз в день, в течение 3 дней (qdx3); указания q7dx2 означают один раз в неделю, в течение двух недель; указания qod означают дважды, в каждый другой день (например, день 1 и день 3); и указания паклитаксел q7dx3 (-0,25h), карбоплатин q7dx3 (-0,25h) означают введение паклитаксела и карбоплатина за 15 минут до введения соединения (2), с последующим введением соединения (2), спустя 4 часа после первого введения соединения (2). В одном конкретном примере, указания “5 mg/kg paclitaxel q7dx3 (-0,25h), 25 mg/kg carboplatin q7dx3 (-0,25h), 2 Gy IR qdx3 (0,25h), PO 50 mg/kg bid (0,4h) qdx3” означают, что 5 мг/кг паклитаксела и 25 мг/кг карбоплатина вводят за 15 минут до первого введения соединения (2); осуществляют первое введение соединения (2); облучение проводят спустя 15 минут после первого введения соединения (2); и затем осуществляют второе введение соединения (2), спустя 4 часа после первого введения соединения (2).
|
|
Пример 11. Комбинация соединения ( 1 ) или соединения ( 2 ) со стандартными лекарственными средствами или облучением, в случае раковых клеточных линий
Базирующиеся на клетках эксперименты и анализы осуществляли с каждой молекулой, но не всегда с обеими. Соединения (1) и (2) обычно очень похожи в этих анализах и экспериментах. Анализ экспериментов по комбинированию осуществляли, используя два метода: метод модели Bliss-аддитивности и метод составления смесей для определения степени синергизма, аддитивности или антагонизма. По Bliss-методу, матрицу Bliss-оценок создавали для каждой клеточной линии и обработки и сумму Bliss-значений рассчитывали относительно ряда тестируемых концентраций комбинации. Среднюю Bliss-оценку (Bliss-сумма, разделенная на число точек всех данных) затем использовали для категоризации клеточной линии и обработки следующим образом: больше, чем 10, означает сильный синергизм, больше, чем 5, означает синергизм, между 5 и -5 означает аддитивность, менее, чем -5, означает антагонизм и менее, чем -10, означает сильный антагонизм. Более значительные Bliss-величины означают более сильную достоверность в сообщаемом синергизме, а более незначительные оценки означают более сильную достоверность в сообщаемом антагонизме. В случае метода составления смесей, комбинируемые компоненты добавляли в диапазоне оптимальных соотношений, используя программное обеспечение постановки эксперимента (DOE) (DX-8 от STAT-EASE); клетки облучали с помощью дозы 2 Gy, как требовалось. Синергизм определяли, используя статистический анализ данных (ANOVA) для указания линейных (аддитивность) или статистически значительных (р<0,1) нелинейных (антагонизм или синергизм) смесей комбинируемых компонентов.
Некоторые раковые клеточные линии и типы их опухолей перечислены в таблице 16.
|
А. Двойные комбинации
Соединение (2) тестировали против панели из 60 раковых клеточных линий (см. таблицу 16,) индивидуально и в комбинации с панелью цитотоксических и не являющихся цитотоксическими SOC агентов. 60 Раковых клеточных линий представляют собой линии, происходящие от рака молочной железы, рака предстательной железы, острого миелоидного лейкоза (АМL), миеломы и других раковых заболеваний. Клетки удаляли из хранилища с жидким азотом, оттаивали и увеличивали в объеме в соответствующих питательных средах. Как только они увеличились в объеме, клетки высевали на 384-луночные, обработанные тканевой культурой, планшеты по 500 клеток на лунку. Спустя 24 часа клетки обрабатывали в течение или 0 часов или обрабатывали в течение 144 часов соединением (2), в комбинации с генотоксин:блеомицин (радиомиметик), доксорубицином (ингибитор топоизомеразы II), этопозидом (ингибитор топоизомеразы II), карбоплатином (кросс-линкер ДНК), BMN-673 (ингибитор PARP) и тарсева (ингибитор EGFR). В конце или 0 часов или 144 часов, клеточный статус анализировали, используя ATPLite (Perkin Elmer), для оценки биологического ответа клеток на комбинации лекарственных средств.
Соединение (2) показало сильный синергизм с некоторыми тестируемыми агентами: этопозид (ингибитор топоизомеразы), доксорубицин (интеркалятор ДНК) и блеомицин (радиомиметик) (фигура 23). Некоторый синергизм наблюдали в случае комбинации с BMN-673 (ингибитор PARP) и карбоплатином (ингибитор репарации ДНК). Аддитивность наблюдали с эрлотинибом (ингибитор EGFR) (фигура 23). Когда анализировали cогласно типу раковой клеточной линии, соединение (2) и BMN-673 показали в высшей мере огромную активность против AML. Комбинация соединения (2) и этопозида, несмотря на то, что высокоактивна против большинства линий, была особенно активна против линий немелкоклеточного рака легких, как соединение (2) и доксорубицин (см. ниже). Bliss-данные по синергизму соединения (2), в случае различных типов опухолей (острый миелоидный лейкоз (AML), диффузная большая В-клеточная лимфома (DLBCL), немелкоклеточный рак легких (NSCLC), множественная миелома (РСМ), крупноклеточный рак легких (SCLC)) представлены на фиг.24-30:
комбинация соединения (2) с BMN-673 на фиг.24;
комбинация соединения (2) с этопозидом на фиг.25;
комбинация соединения (2) с блеомицином на фиг.26;
комбинация соединения (2) с эрлотинибом на фиг.27;
комбинация соединения (2) с доксорубицином на фиг.28;
комбинация соединения (2) с блеомицином на фиг.29;
комбинация соединения (2) с карбоплатином на фиг.30.
Комбинации соединения (2) и доксорубицина или эпирубицина (интеркалятор ДНК) тестировали против клеточных линий рака молочной железы (таблицы 17 и 18), со сравнением между линиями дикого типа и мутантными линиями, которые находятся в фокусе исследования. Независимо от плотности посева, чувствительности к доксорубицину индивидуально или статусу BRCA, комбинация доксорубицина и соединения (2) была сильно синергической, в случае всех пяти клеточных линий и при обеих тестируемых концентрациях соединения (2) (Bliss-анализ). Более, чем трехкратное изменение по IC50 комбинации доксорубицина и соединения (2), по сравнению с доксорубицином, индивидуально, также указывает на высокую степень синергизма. Подобный эксперимент при использовании доксорубицина или эпирубицина, в комбинации с соединением (2), в случае линии рака молочной железы DU4475, показал сильный синергизм (Bliss-анализ) (таблица 18).
Комбинация соединения (2) и доксорубицина или эпирубицина была сильно синергической, в случае всех оцениваемых трижды негативных клеточных линий рака молочной железы, независимо от статуса BRCA или плотности посева.
|
|
В. Двойные и тройные комбинации с облучением (2 Gy) или без облучения
Следующие SOC-агенты тестировали в двойных комбинациях с соединением (1): этопозид (ингибитор топоизомеразы, который индуцирует DSBs), цисплатин (кросс-линкер ДНК), карбоплатин (кросс-линкер ДНК), фторурацил (5-Fu, антиметаболит, который ингибирует тимидилатсинтазу), паклитаксел (митотический ингибитор, который связывается с тубулином), цетуксимаб (моноклональное антитело EGFR) и облучение. Другое, чем комбинация облучения и соединения (1), наиболее сильное взаимодействие, в случае изучений двойной комбинации, проявляла комбинация этопозида и соединения (1) в А549-клетках (таблица 19) и соединения (1) и этопозида в ESJ26 (таблица 20). Эти обнаружения подтверждали использование модели Bliss-аддитивности (таблица 21). Другие комбинации продемонстрировали аддитивность с редкими примерами антагонизма. Тогда как нет полного соглашения по различным тестируемым линиям (как детализировано в других разделах), достигнутые соглашения и заключения являются общими для каждого случая. Такой же эксперимент, осуществляемый при использовании клеток ОЕ19, показал более сложные картины взаимодействия в отсутствие облучения. Значительно усиленный эффект наблюдали, когда к комбинациям добавляли облучение, усиливающее сильную взаимосвязь между повреждением ДНК (DSB и SSB) и ингибированием DNA-PK. В таблице 19 указаны раковые клеточные линии: ESO26 - гастроэзофагиальный рак, OE19 - гастроэзофагиальный рак, DMS-53- SCLC, A549 -рак легких, colo205 - рак ободочной кишки, Н460 - рак легких, Н2009 - рак легких, FaDu - рак глотки, Mipaca2 -рак поджелудочной железы, HEL1 - человеческий фетальный фибробласт легких.
Комбинация соединения (2) и доксорубицина или эпирубицина являлась сильно синергической во всех трех оцениваемых трижды негативных раковых клеточных линиях, независимо от статуса BRCA или плотности посева.
В экспериментах по тройной SOC комбинации, синергизм проявился в случае комбинации этопозида, цисплатина и соединения (1) в клеточных линиях DMS-53 и А549. Значительным драйвером для этого синергизма была комбинация этопозида с соединением (1). Комбинация паклитаксела, цисплатина и соединения (1) была аддитивной в случае клеточной линии А549, тогда как комбинация цисплатина, 5-Fu и соединения (1) была синергической, в случае клеточной линии Colo205. Весьма значительное уменьшение в отношении клеточной жизнеспособности наблюдали после добавления облучения к этим комбинациям, главным образом, происходящее за счет вклада соединения (1). Соединение (2) продемонстрировало такие же результаты комбинации в отношении клеточной жизнеспособности с SOC-компонентами комбинации (используя меньший набор раковых клеточных линий), по сравнению с соединением (1).
|
|
Базируясь на IC50, для 20 мкМ соединения 2, 50 мкМ карбоплатина, 1,5 мкМ цисплатина, 3 мкМ паклитаксела, 0,6 мкМ этопозида и 20 мкМ 5-FU. Не применимо: этопозид является радиомиметиком.
|
С. Воздействие комбинации соединения ( 1 ) или ( 2 ) и SOC в тестах на чувствительность к химиотерапии первичной опухоли (ТСА)
Тестируемые in vitro первичные опухоли у человека могут служить лучшим показателем эффективности ингибирования DNA-PK, чем иммортализованные раковые клеточные линии, вследствие их повышенной гетерогенности и более тесной близости к опухоли пациента, от которой они произошли. Набор первичных человеческих опухолей (NSCLC, панкреатическая, пищеводная, желудочная, и т.д.) тестировали при использовании соединения (1), для определения эффективности ингибирования ДНК-PK, в комбинации с облучением, блеомицином (радиомиметик, который вызывает DSBs), доксорубицином (интеркалятор ДНК), цисплатином, карбоплатином, этопозидом, паклитакселом или 5-FU.
Соединение (1) (10х и 30х IC50) вводили в комбинации с диапазоном доз блеомицина или облучения. Диссоциированные клетки из пассивированных мышиных опухолей культивировали в течение 6 суток после подвергания воздействию комбинации и затем оценивали на жизнеспособность, используя тест Cell Titer-Glo. Статистическую модель Bliss-аддитивности использовали для определения степени синергизма, аддитивности или антагонизма относительно обработки каждой комбинацией.
Комбинация соединения (1) и блеомицина или облучения была аддитивной или синергической в случае всех тестируемых опухолей (29/29) (см. фиг.31). В дополнение, сильный синергизм наблюдали приблизительно в третьей из двух опухолей, обработанных блеомицином (9/29) и облучением (3/8), в комбинации с соединением (1). Подобным образом, соединение (2) тестировали в комбинации с диапазоном доз блеомицина, в меньшей субпопуляции опухолей (желудочная, панкреатическая). Комбинация соединения (2) и блеомицина была аддитивной или синергической, в случае всех тестируемых опухолей (20/20) и сильно синергической в их субпопуляции (3/20) (см. фиг.31). Эти данные наводят на мысль, что ингибитор ДНК-PK в комбинации с радиотерапией может быть более широко эффективным, чем лечение только стандартом.
Набор первичных опухолей также подвергали обработке соединением (1), в комбинации со множеством химиотерапевтических агентов (гемцитабин, паклитаксел, цисплатин, карбоплатин, 5-FU, этопозид), обычно используемых при обработке тестируемых типов опухолей. Аддитивность наблюдали в случае наибольшего количества опухолей, обработанных соединением (1) и либо гемцитабином (2/4), паклитакселом (1/5), 5-FU (5/5), либо доксорубицином (1/1). Однако, наблюдали антагонизм в случае тех же опухолей, при использовании демцитабина (2/4) и паклитаксела (1/5). Синергизм или аддитивность наблюдали в случае почти всех опухолей, при использовании как карбоплатина (5/5), так и цисплатина (9/10), однако, одна опухоль показала антагонизм с цисплатином. Комбинация соединения (1) и этопозида показала сильный синергизм, в случае всех тестируемых опухолей (4/4). Эти ТСА-результаты согласовались с данными комбинации, получаемыми при использовании раковых клеточных линий. Вообще, эти данные наводят на мысль, что селективный ингибитор ДНК-PK может обеспечивать дополнительную пользу пациентам с раковым заболеванием, получающим лечение только стандартом, в случае множества клинических применений.
Пример 14: Воздействие соединения ( 1 ) на имеющее клональное происхождение выживание подвергнутых облучению раковых клеточных линий
Тест на имеющее клональное происхождение клеточное выживание определяет способность клеток бесконечно пролиферировать, сохраняя таким образом свою самовосстанавливающуюся способность к образованию колоний (то есть, клона). Этот тест являлся главной основой в радиационной онкологии в течение десятилетий и его использовали для определения воздействия соединения (1) на клональное происхождение набора клеточных линий, через последующее облучение многочисленных типов опухолей. Обнаружено, что соединение (1) в комбинации с облучением является очень эффективным в отношении уменьшения клонального происхождения всех раковых клеточных линий, тестируемых с факторами усиления дозы (DEF, разница в числе колоний при доле выживания 0,1), изменяющимися от 2,5 до >5. Клетки Miapaca2 показали самый низкий DEF (2,5), тогда как, в случае клеток FaDu, комбинация соединения (1) и облучение полностью ликвидировали образования колоний при небольшой дозе облучения, как, например, 0,5 Gy, и показали DEF >8. DEF более, чем 1,5, обычно рассматривается как клинически значимый; следовательно, посредством этих стандартов соединение (1) должно быть охарактеризовано как сильный радиоусиливающий агент. Эти данные согласуются с предыдущими данными в отношении клеточной жизнеспособности, что наводит на мысль, что широкая респондер-популяция может быть ожидаема у пациентов с раковым заболеванием, подвергаемых лечению с помощью соединения (1) в комбинации с облучением.
Хотя вышеупомянутое изобретение было описано в значительной степени подробно путем иллюстрирования и приведения примеров для целей ясности понимания, квалифицированному специалисту в данной области, в свете указаний настоящего изобретения, должно быть без труда видно, что, кроме того, могут быть сделаны некоторые изменения и модификации, не выходя за пределы объема или сущности прилагаемой формулы изобретения.
Все ссылки, приведенные в данном контексте, включены во всей их полноте в данный контекст путем ссылки. Как используется в данном контексте, все аббревиатуры, символы и конвенции совпадают с таковыми, используемыми в современной научной литературе. См., например, руководство под ред. Janet S. Dodd “The ACS Style Guide: A Manual for Authors and Editors”,2-е издание, Washington, D.C.: American Chemical Society, 1997.