Результат интеллектуальной деятельности: СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ИСХОДА МЕСТНОРАСПРОСТРАНЕННЫХ ФОРМ РАКА ШЕЙКИ МАТКИ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области медицины, а именно к онкогинекологии, и может быть использовано для прогнозирования клинического исхода местнораспространенного рака шейки матки (II-III стадии).
Рак шейки матки (РШМ) по частоте встречаемости продолжает занимать одну из ведущих позиций среди злокачественных новообразований репродуктивной системы (Состояние онкологической помощи населению России в 2015 году // Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой, Москва, 2016 - 235 с.).
Выявление факторов прогноза первичного РШМ до начала специализированной терапии неуклонно интегрируется в лечебно-диагностический процесс. Традиционно наиболее используемыми критериями являются объем и линейные размеры опухоли, степень распространения опухолевого процесса, поражение регионарных лимфатических узлов, степень дифференцировки опухоли, а также сопутствующие изменения периферической крови (показатель гемоглобина) в сочетании с нарушениями функции органов мочевыделительной системы, возраст, продолжительность курса лечения и др. (Крикунова Л.И. Лучевая терапия рака шейки матки // Практ. онкология. - 2002. - Т. 3, №3. - С. 194-199; Урманчеева А.Ф. Эпидемиология и диагностика рака шейки матки // Акушерство и гинекология. - 2001. - №1. - С 80-86; Кайрбаев М.Р. Факторы прогноза местнораспространенного рака шейки матки // Сиб. онкол. журн. - 2009. - №4(34). - С. 32-35).
Высокий процент выявления местнораспространенных форм заболевания (II-III стадия) с большими линейными размерами первичного очага и/или наличием регионарного метастазирования опухолевого процесса диктует необходимость поиска новых диагностических критериев, которые позволят выбрать адекватную тактику специализированного лечения, оптимально используя все возможные компоненты противоопухолевого воздействия.
Известен способ оценки эффективности противоопухолевой терапии для прогнозирования эффективности противоопухолевых воздействий и их коррекции во время лечения злокачественных опухолей шейки матки RU 2151399 С1. Способ заключается в том, что в нейтрофилах периферической крови больного до и в процессе лечения определяют уровень активности кислой и щелочной фосфатаз и их соотношение, изменение которого по сравнению с исходным дает возможность прогнозировать эффективность проводимого лечения, а снижение и отсутствие изменения в соотношении показателей является сигналом необходимости коррекции проводимой терапии.
Известен способ прогнозирования периода безрецидивной выживаемости при раке шейки матки путем определения активности каталазы в плазме крови RU 2483308. Прогнозирование периода безрецидивной выживаемости при местноограниченном раке шейки матки (Ib-IIa стадии по FIGO) осуществляют путем определения активности каталазы в плазме крови. При активности каталазы в плазме крови от 0,041 до 0,113 ммоль/мин/л у пациента прогнозируют 18-ти месячный период безрецидивной выживаемости (ПБВ) с вероятностью 50%, а при активности от 0,008 до 0,035 ммоль/мин/л - с вероятностью 80%.
Известен способ прогнозирования неблагоприятного течения местнораспространенных форм рака шейки матки, ассоциированного с вирусом папилломы человека RU 2504326 С1. В этом способе в качестве дополнительных прогностических факторов эффективности лечения ВПЧ-ассоцированных местнораспространенных форм рака шейки матки используют иммунологические критерии - абсолютное количество лимфоцитов (лим_аб), TNFα (TNFα_к) и IL-10 (IL-10_к) в периферической крови, а также TNFα (TNFα_c) и IL-4 (IL-4_c) в цервикальной слизи. На основании полученных данных вычисляют показатель F(x): F(x)=9,265+1,749×(лим_аб)+0,013×(IL-4_c)+0,005×(IL-10_к)-0,410×(TNFα_к)-0,206×(TNFα_c). При значении F(x) больше 0,555 прогнозируют неблагоприятное течение опухолевого процесса, а если меньше - благоприятное течение.
Общими недостатками всех вышеперечисленных способов прогноза эффективности противоопухолевого лечения является использование гематологических, биохимических и иммунологических показателей, которые могут изменяться при наличии любого воспалительного процесса в организме, в том числе обусловленного и химиолучевым воздействием. Интоксикационный синдром, диспепсические явления, лучевые реакции со стороны кишечника и мочевыводящих путей, неизменно сопутствующие противоопухолевому лечению, могут вызывать значительные колебания показателей крови, что снижает эффективность их использования для оценки динамики развития рака шейки матки и прогноза прогрессирования заболевания.
Известен способ прогнозирования на основе модели интеграции ДНК вируса папилломы человека US 2016201149 A1 (US 20160201149 A1 Joo-Young Kim, Hye-Jin SHIN, Jung Nam Joo, Bo Ram PARK «Method for prediction of prognosis by human papillomavirus DNA integration pattern», 2016 («Способ прогнозирования на основе модели интеграции ДНК вируса папилломы человека»). Способ заключается в прогнозировании клинического исхода РШМ на основе сведений об интеграции ДНК вируса папилломы человек (ВПЧ) в геном опухолевых клеток до лучевого или химиолучевого лечения. При этом проводят оценку внутриклеточной локализации вируса на срезах опухолевой ткани ШМ методом гибридизации in situ. Для этого подготовленные срезы опухолевой ткани инкубируют с ДНК-зондами, специфичными к консервативной зоне ДНК ВПЧ; далее обрабатывают соответствующими реактивами, позволяющими визуально идентифицировать полученные ДНК-ДНК гибриды по темной окраске. По интенсивности и характеру окраски оценивают наличие или отсутствие вируса в клетке и его внутриклеточную локализацию. В зависимости от внутриклеточной локализации различают ВПЧ с разными вариантами интеграции вирусной ДНК в клеточный геном и эписомальную форму ВПЧ (интеграция ДНК ВПЧ в геном клетки отсутствует). Далее в соответствии с этими показателями вируса формируют группы повышенного риска неблагоприятного исхода заболевания.
Основным недостатком способа является субъективная оценка результатов лишь по визуальным критериям. Кроме того, использование высокоинвазивной процедуры получения образцов опухолевой ткани (биопсия шейки матки) может приводить к попаданию опухолевых клеток в кровяное русло и повысить вероятность метастазирования, что является дополнительным ятрогенным фактором плохого прогноза. При этом относительный риск неблагоприятного клинического исхода заболевания рассчитан только на сроке 2 года.
Прототипом предлагаемого изобретения является работа «Физический статус вируса папилломы человека связан с клиническим исходом радиотерапии больных раком шейки матки», в котором риск неблагоприятного клинического исхода РШМ оценивают по соотношению пороговых циклов вирусных генов Е2 и Е6 (Hye-Jin Shin, Jungnam Joo, Ji Hyun Yoon et al. Physical Status of Human Papillomavirus Integration in Cervical Cancer Is Associated with Treatment Outcome of the Patients Treated with Radiotherapy // PLOS ONE. - 2014. - Vol. 9(1). - e78995.), при этом:
- выделяют ДНК ВПЧ из биопсийного материала опухолей больных РШМ II-IV стадий;
- проводят полимеразную цепную реакцию (ПЦР) в режиме реального времени и амплифицируют Е2, Е6 - гены ВПЧ 16, 18 и 58 типа;
- оценивают величины пороговых циклов амплификации (Ct) гена Е2 и гена Е6;
- по соотношению величин пороговых циклов амплификации Ct формируют 4 группы больных с различным физическим статусом вирусной ДНК: 1 группа - ДНК ВПЧ частично интегрирована в геном клетки-хозяина (Ct(E2)/Ct(E6) значимо >1); 2 группа - ДНК ВПЧ находится в интегрированной форме без эписомальных компонентов (Ct(E2)/Ct(E6)=0); 3 группа - мультикопийная тандемно повторяющаяся интеграция ДНК ВПЧ ((Ct(E2)/Ct(E6) близко к единице); 4 группа - вирусные гены Е2 и Е6 не выявляется (ВПЧ-отрицательные пациентки);
- из перечисленных 4-х групп формируют 3 группы, при этом вышеупомянутые группы 2 и 3 объединяют, группы 1 и 4 оставляют без изменений;
- оценивают безрецидивную выживаемость на сроке 2 года после окончания лечения;
- по результатам анализа выявляют значимое снижение показателей безрецидивной выживаемости больных в ряду 1 группа  2+3 группы
2+3 группы  4 группа;
4 группа;
- на основании полученных результатов делают вывод о возможности использования сведений о физическом статусе вируса для прогноза клинического исхода РИТМ.
К недостаткам данного способа относится:
- включение в исследуемую группу больных с IV стадией РШМ, при которой определяющее значение для клинического исхода имеет именно распространенность процесса, независимо от других факторов прогноза. В связи с этим, объединение больных местнораспространенным РШМ (II и III стадии) и РШМ IV стадии может привести к некорректной трактовке результатов анализа;
- оценка физического статуса ВПЧ по соотношению пороговых циклов амплификации вирусных генов Е6 и Е2 может приводить к неточным результатам. Пороговый цикл отражает наличие гена, но не его количество. Количество необходимо рассчитывать по стандартной калибровочной кривой для каждого гена;
- выявление одинакового числа копий генов Е2 и Е6 (т.е. соотношение Ct(E2)/Ct(E6)=1) в группе 3 интерпретируется исключительно как наличие мультикопийной тандемно повторяющейся интеграции ДНК вируса, хотя это может трактоваться и как отсутствие интеграции (эписомальная форма вируса) (Maelle Saunier, Sylvain Monnier-Benoit, Frederic Mauny et al. Analysis of Human Papillomavirus Type 16 (HPV16) DNA Load and Physical State for Identification of HPV16-Infected Women with High-Grade Lesions or Cervical Carcinoma // J Clin Microbiol. - 2008. - Vol. 46(11). - P. 3678-3685; Wei Li, Wei Wang, Mani Si. et al. The physical state of HPV16 infection and its clinical significance in cancer precursor lesion and cervical carcinoma // J Cancer Res Clin Oncol. - 2008. - Vol. 134. - P. 1355-1361);
- относительный риск неблагоприятного клинического исхода заболевания рассчитан только на сроке 2 года.
Технический результат предлагаемого изобретения заключается в повышении точности оценки клинического исхода местнораспространенного РШМ (II и III стадии) до проведения специализированного радикального лечения.
Указанный технический результат при осуществлении заявляемого способа изобретения достигается за счет того, что так же как и в известном способе делают забор эпителиальных клеток из цервикального канала и наружной поверхности шейки матки, полученные образцы исследуют на наличие ДНК ВПЧ высокого канцерогенного риска (ВКР) и определяют его генотип методом ПЦР.
Особенность заявляемого способа заключается в том, что отбирают биологические образцы с ВПЧ-отрицательным, ВПЧ 16- и ВПЧ18-позитивным РШМ II-III стадии, в ВПЧ 16/18-позитивных образцах определяют количество вирусных генов Е7 и Е2 и параллельно оценивают количество ДНК b-глобина человека: анализ проводят методом полимеразной цепной реакции в режиме реального времени, в каждом опыте одновременно амплифицируют в нескольких повторах клинические образцы и стандартные образцы с известной концентрацией ДНК ВПЧ и ДНК β-глобина человека, необходимые для построения калибровочных кривых, определяют количество ДНК вирусных генов Е7, Е2 и клеточного гена β-глобина по калибровочным кривым, оценивают наличие интеграции ДНК вируса в геном клетки-хозяина по величине среднего значения соотношения количества гена Е7 к количеству гена Е2 (Е7/Е2) для нескольких повторов с учетом коэффициента вариации (CV) и стандартного отклонения (SD), далее методом ROC-анализа устанавливают дискриминационный уровень, разделяющий опухоли на две группы:
I - объединяет РШМ, у которых выявлено наличие интеграции ДНК ВПЧ 16 или 18 типа и ВПЧ-отрицательные РШМ,
II - ВПЧ 16- и ВПЧ18-позитивые РШМ, у которых наличие интеграции ДНК вируса не выявлено, после чего классифицируют пациенток в зависимости от наличия или отсутствия вируса, наличия или отсутствия интеграции ДНК в ВПЧ 16- или ВПЧ 18-позитивных образцах, и если:
- ВПЧ ВКР не обнаружен, то прогнозируют неблагоприятный клинический исход заболевания;
- соотношение вирусных генов Е7/Е2≥1,3 при CV≤10% или (Е7/Е2-2,5SD)≥1 при CV>10% у ВПЧ16/18-позитивных пациенток, что соответствует наличию интеграции ДНК вируса в клеточный геном, то прогнозируют неблагоприятный клинический исход заболевания;
- соотношение вирусных генов Е7/Е2<1,3 при CV≤10% - у ВПЧ16/18-позитивных пациенток, что соответствует отсутствию интеграции ДНК вируса в клеточный геном, то прогнозируют благоприятный клинический исход заболевания.
Изобретение поясняется подробным описанием, клиническими примерами, таблицами и иллюстрациями на которых изображено:
Фиг. 1. Сравнительное исследование количества и степени интеграции ДНК ВПЧ16/18 в образцах с наличием интегрированной формы вируса.
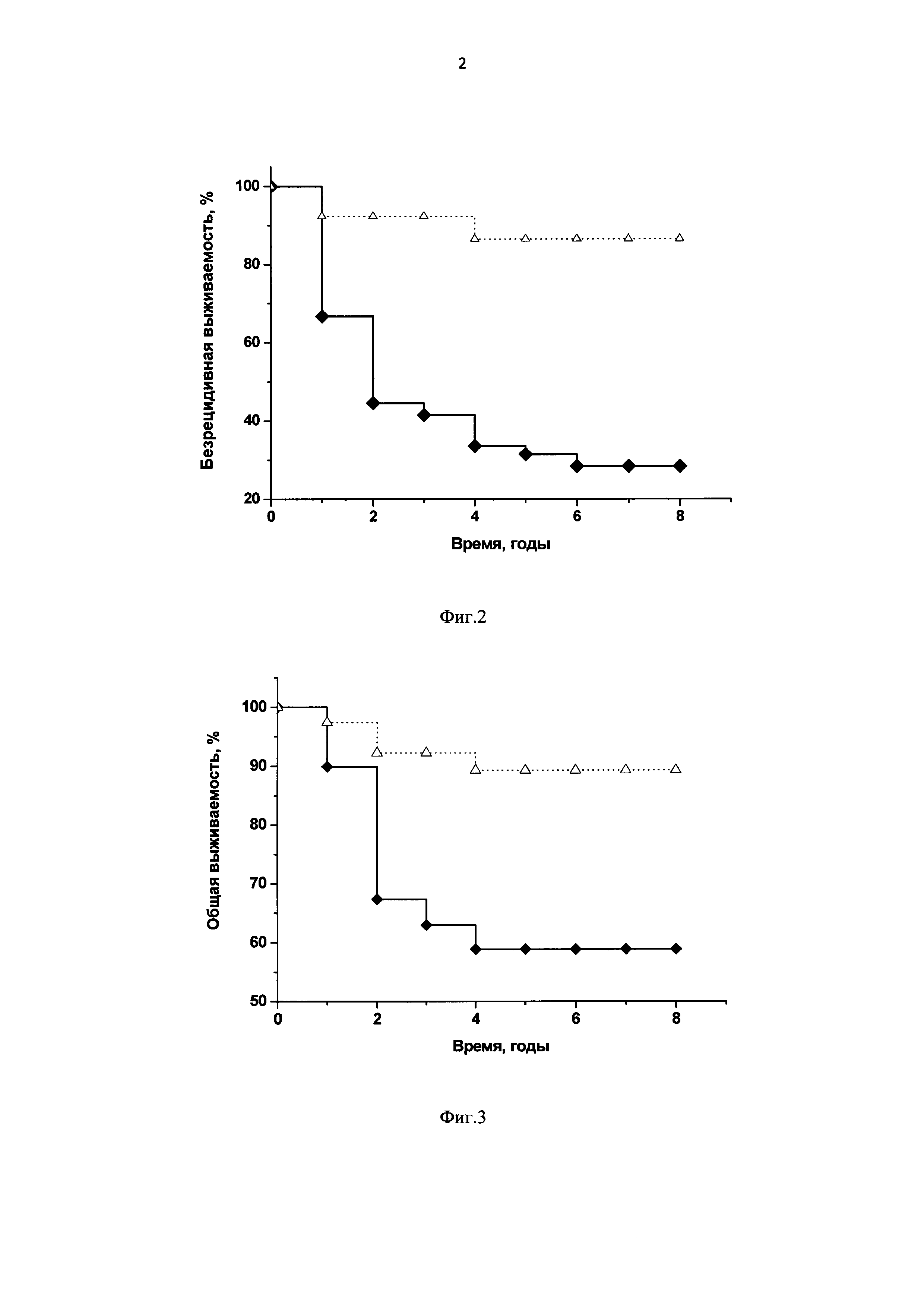
Фиг. 2. Диаграмма: безрецидивная выживаемость больных РШМ II-III стадии по тестам Каплан-Мейер и log-rank, р<0,00001;
 ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
Фиг. 3. Диаграмма: общая выживаемость больных РШМ II-III стадии по тестам Каплан-Мейер и log-rank, р<0,0001;
 ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
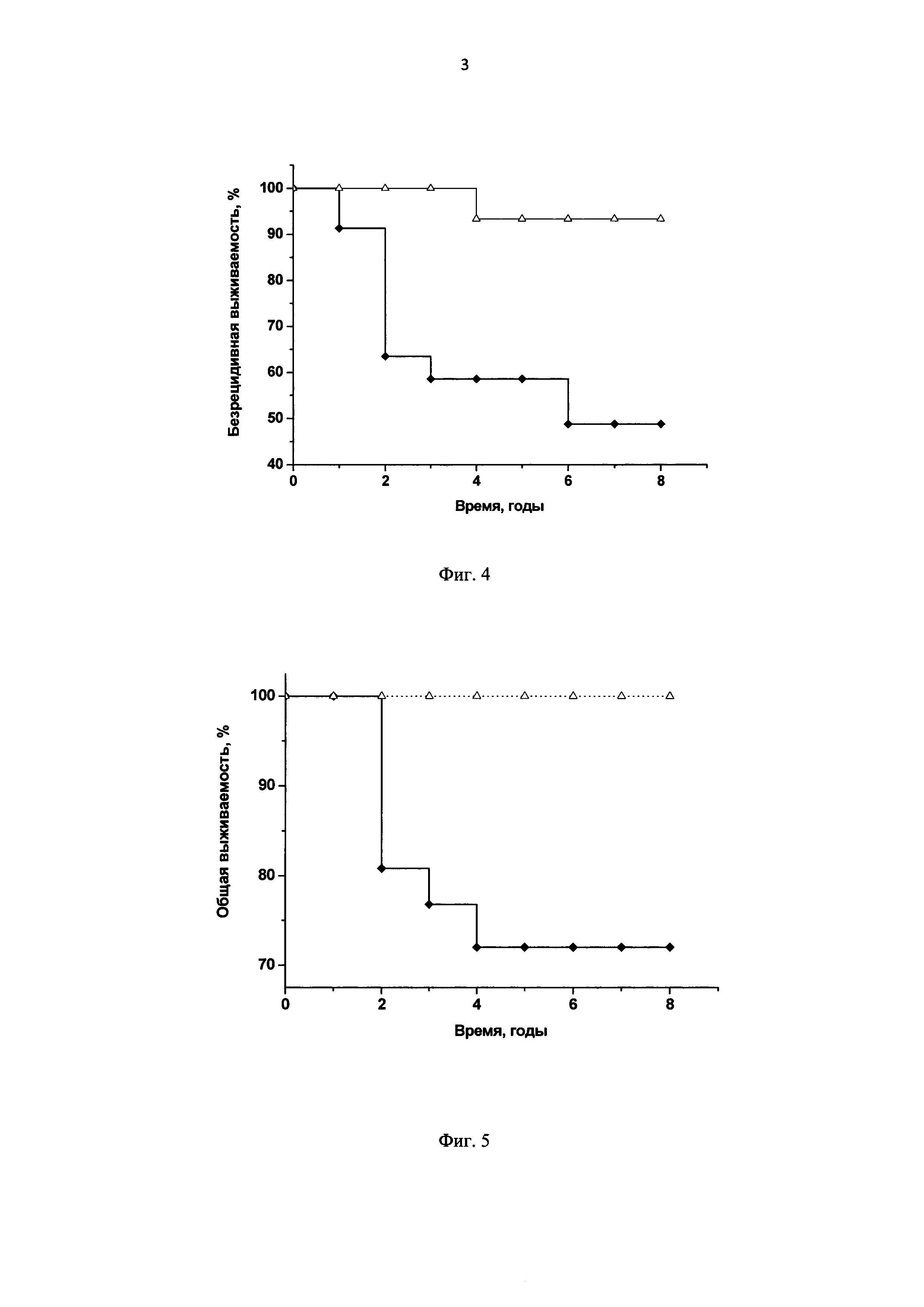
Фиг. 4. Диаграмма: безрецидивная выживаемость больных РШМ II стадии по тестам Каплан-Мейер и log-rank, р=0,003;
 ВПЧ 16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ 16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
Фиг. 5. Диаграмма: общая выживаемость больных РШМ II стадии по тестам Каплан-Мейер и log-rank, р=0,005;
 ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
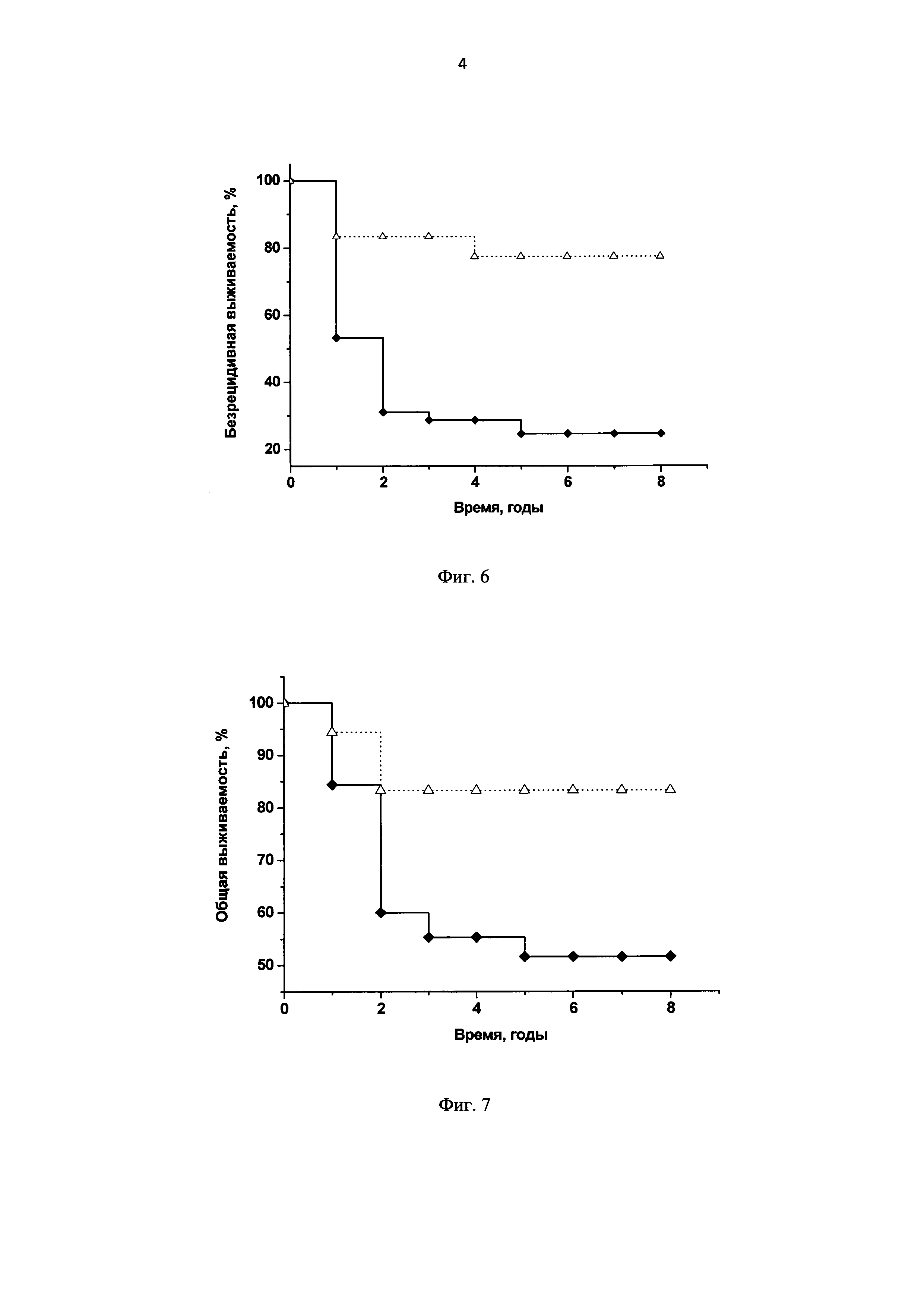
Фиг. 6. Диаграмма: безрецидивная выживаемость больных РШМ III стадии по тестам Каплан-Мейер и log-rank, р<0,0001;
 ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
Фиг. 7. Диаграмма: общая выживаемость больных РШМ III стадии по тестам Каплан-Мейер и log-rank, р=0,004;
 ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
ВПЧ16/18-позитивные больные с наличием интеграции ДНК вируса + ВПЧ-отрицательные больные (невыявление вируса);
 ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
ВПЧ16/18-позитивные больные с отсутствием интеграции ДНК вируса.
Способ осуществляют следующим образом:
1. Подготавливают биологический материал: у больных РШМ цитощеткой берут совместный соскоб эпителиальных клеток из цервикального канала и наружной поверхности шейки матки.
2. Из полученного биологического материала выделяют ДНК сорбентным методом с применением наборов, например «ДНК-сорб АМ» (ФГУН ЦНИИ Эпидемиологии Роспотребнадзора (ФГУН ЦНИИЭ), Россия) или аналогичных наборов других фирм.
3. Полученные образцы исследуют на наличие ДНК 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) вируса высокого канцерогенного риска (ВКР) и определяют его генотип методом полимеразной цепной реакции (ПЦР) с использованием комплекта реагентов, например «АмплиСенс ВПЧ ВКР скрин-титр-FL» и «АмплиСенс ВПЧ ВКР генотип-титр FL» ФГУН ЦНИИЭ или аналогичных наборов других фирм.
4. Отбирают образцы с отрицательными результатами на наличие вируса - ВПЧ-отрицательные образцы.
5. Отбирают образцы с ВПЧ16- или ВПЧ-18-положительными результатами;
6. В ВПЧ16/18-позитивных образцах методом мультиплексной ПЦР в режиме реального времени определяют количество ДНК вирусных генов Е7 и Е2. Параллельно оценивают количество ДНК b-глобина человека - внутреннего контроля реакции амплификации.
7. Все три мишени - Е7, Е2 и β-глобин амплифицируют в одной пробирке. Одновременно в каждом опыте амплифицируют стандартные образцы с известной концентрацией ДНК ВПЧ и ДНК β-глобина человека.
8. Каждый клинический образец и стандартные образцы исследуют в нескольких повторах, анализ проводят на амплификаторе, например, "Rotor Gene" ("Corbett Research", Австралия) или аналогичных приборах других фирм.
9. Количество ДНК вирусных генов Е7, Е2 и клеточного гена β-глобина определяют по калибровочным кривым. Калибровочные кривые получают на стандартных образцах (п. 6) в соответствии с программой амплификатора ("Rotor Gene" или аналогичных приборов других фирм).
10. Наличие интеграции ДНК вируса в геном клетки-хозяина оценивают по величине среднего значения соотношения количества гена Е7 к количеству гена Е2 (Е7/Е2) для нескольких повторов (известно, что ген Е7 сохраняется интактным и при наличии интеграции ДНК ВПЧ в геном клетки, и при ее отсутствии, а ген Е2 при интеграции ДНК ВПЧ разрушается и выявляется только при ее отсутствии).
11. Методом ROC-анализа устанавливают дискриминационный уровень разделяющий опухоли на две группы: 1-ая объединяет РШМ, у которых выявлено наличие интеграции ДНК ВПЧ 16 или 18 типа и ВПЧ-отрицательные РШМ; 2-ая - ВПЧ 16- и ВПЧ18-позитивые РШМ, у которых наличие интеграции ДНК вируса не выявлено;
12. Классифицируют пациенток в зависимости от наличия или отсутствия вируса, наличия или отсутствия интеграции ДНК в ВПЧ 16- или ВПЧ 18-позитивных образцах.
13. Выявляют пациенток с неблагоприятным прогнозом, у которых ВПЧ ВКР не обнаружен (ВПЧ-отрицательные) или присутствует ВПЧ 16/18 с наличием интеграции ДНК вируса в клеточный геном.
14. Выявляют пациенток с благоприятным прогнозом, у которых обнаружен ВПЧ 16/18 с отсутствием ДНК вируса в клеточный геном.
Примеры конкретного использования предлагаемого способа.
Пример 1. Выявление пациенток с ВПЧ-отрицательным, ВПЧ16/18-позитивными РШМ.
У 194 первичных больных отделения лучевых и комбинированных методов лечения гинекологических заболеваний МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России с морфологически верифицированным РШМ I-IV стадий до лечения брали соскобы из цервикального канала и наружной поверхности ШМ. Из полученных образцов выделяли ДНК с использованием тест-наборов, описанных выше. Методом ПЦР в режиме реального времени на "Rotor Gene" ("Corbet Research", Австралия) проводили исследование на наличие ВПЧ ВКР и генотипирование ДНК вируса с использованием тест-наборов в соответствии с заявляемой методикой, подробно описанной выше.
У 24 пациенток выявлен ВПЧ-отрицательный РШМ, у 170 - ВПЧ-позитивный. При анализе результатов согласно стадиям заболевания обнаружено, что при РШМ II стадии: ВПЧ-отрицательный наблюдался у 3-х больных, ВПЧ16-позитивный - у 40, ВПЧ 18-позитивные - у 11; и при РШМ III стадии: ВПЧ-отрицательный - у 16, ВПЧ16-позитивный - у 45 и ВПЧ 18-позитивный - у 7 пациенток.
Пример 2. Анализ количества ДНК ВПЧ 16 или 18 типа и наличия интеграции ДНК ВПЧ 16/18 в биологических образцах.
У 135 больных РШМ II-III стадии с выявленной ВПЧ 16/18 инфекцией (109 - ВПЧ 16, 26 - ВПЧ 18) проведено исследование количества ДНК и физического статуса вируса (наличие или отсутствие интеграции вирусной ДНК в клеточный геном). В соответствии с заявляемым способом (п. 9) число копий ДНК ВПЧ в клетке оценивали по соотношению количества гена Е7 вируса и β-глобина клетки (Е7/β-глобин) и нормировали эту величину на 100 тыс. клеток (1 клетка содержит 2 β-глобина). Наличие интеграции ДНК вируса в геном клетки-хозяина оценивали в соответствии с заявляемым способом (п. 10) по соотношению количества вирусных генов Е7/Е2 с учетом коэффициента вариации (CV) и стандартного отклонения (SD) для трех повторов согласно разработанному алгоритму. При CV≤10% и Е7/Е2≥1,3 - интеграция обнаружена, если Е7/Е2<1,3 - интеграция не обнаружена. При CV>10% образец характеризуется наличием интеграции только в случае, когда (Е7/Е2-2,5 SD)≥1. Если (Е7/Е2-2,5 SD)<1, результат - неопределенный, требуется повторный анализ.
Наличие интеграции ДНК ВПЧ 16/18 обнаружено у 26 больных РШМ II стадии и у 28 - III стадии. У 24 больных РШМ II стадии и у 26 - III стадии интеграция ДНК ВПЧ 16/18 не выявлена.
Пример 3. Сравнительное исследование количества ДНК ВПЧ 16 и 18 типа, наличия интеграции ДНК вируса и ее степени у ВПЧ 16/18-позитивных больных.
Проведено сравнение данных по количеству и степени интеграции ДНК ВПЧ 16/18 в образцах биоматериала больных с интегрированной формой вируса (98 человек), полученных в соответствии с заявляемым способом.
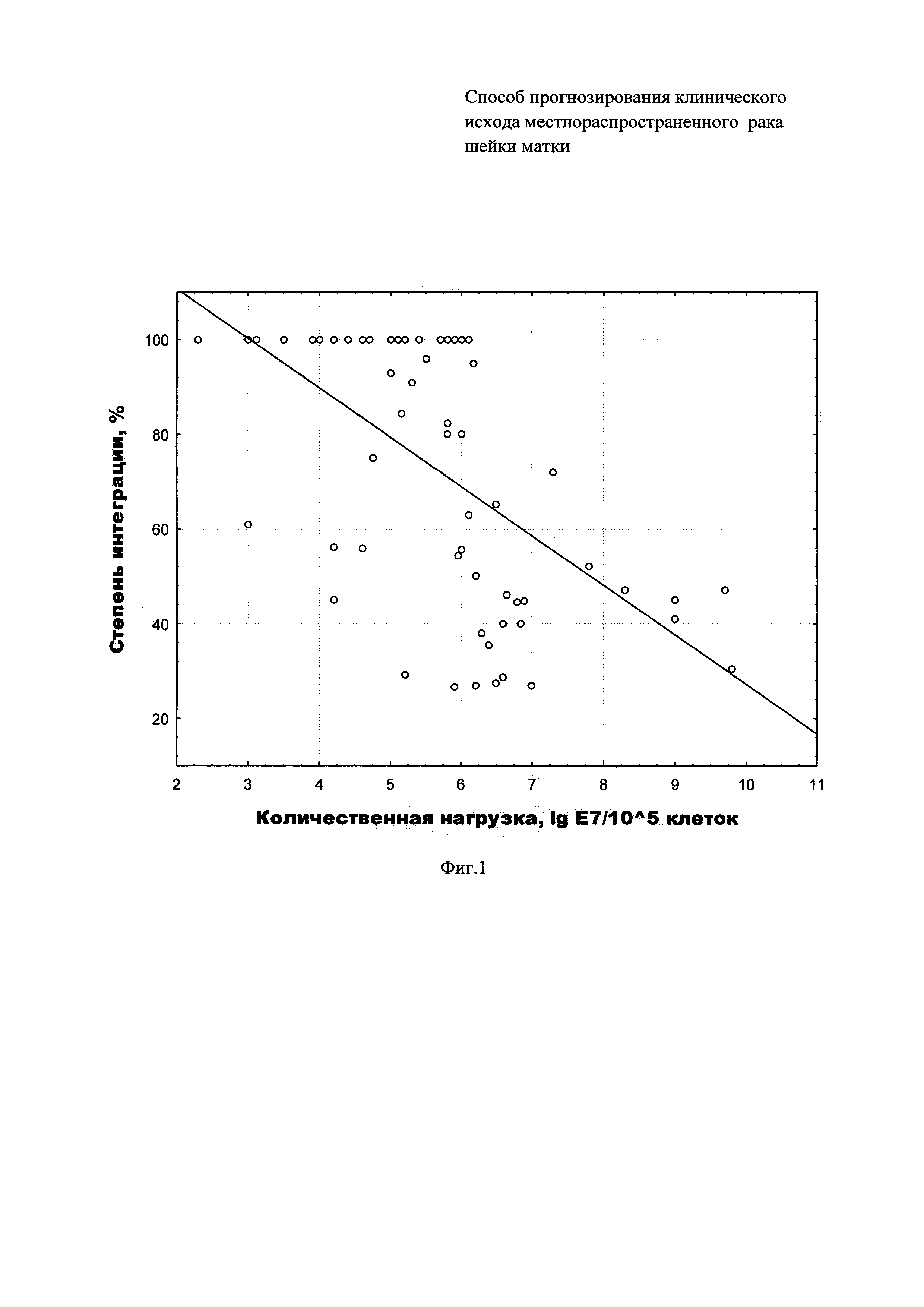
Коэффициент корреляции R=-0,67 при уровне значимости р<0,000001, n=98 (Фиг. 1). Корреляционный анализ проведен с использованием пакета программ "Statistica-10".
Выраженная обратная корреляция количества ВПЧ 16/18 со степенью интеграции ДНК вируса свидетельствует о том, что одной из причин невыявления ВПЧ (ВПЧ-отрицательные образцы, п. 4) может быть очень низкое количество его копий (ниже порога чувствительности определения) при высокой степени интеграции вируса. Подобные ситуации неоднократно обсуждались в литературе [Kim JY, Park S, Nam BH et al. Low Initial Human Papilloma Viral Load Implicates Worse Prognosis in Patients With Uterine Cervical Cancer Treated With Radiotherapy // J. of Clinical Oncology. - 2009. - Vol. 27(30). - P. 5088-5093; Rodriguez-Carunchio L, Soveral I, Steenbergen RDM et al. HPV-negative carcinoma of uterine cervix: a distinct type of cervical cancer with poor prognosis // BJOG. - 2015. - V. 122(1). - P. 119-127). Известно, что при интеграции ДНК ВПЧ в клеточный геном нарушается репликация вируса, и его количество может очень сильно снижаться (Vozenin МС, Lord HK, Hart D et al. Unrevelling the biology papillomavirus (HPV) related tumours to enhance their radiosensitivity. // Cancer Treatment Review. - 2010. - V. 36. - P. 629-636).
Полученные данные являются основанием для объединения образцов с интегрированной ДНК ВПЧ16/18 и ВПЧ-отрицательных в одну группу.
Пример 4. Сравнительное исследование клинического исхода заболевания РШМ II-III стадии у пациенток с интегрированной ДНК ВПЧ16/18 и ВПЧ-отрицательных.
Проведено сравнение данных по клиническому исходу заболевания у пациенток с интегрированной ДНК ВПЧ16/18 и пациенток, у которых вирус не выявлен (ВПЧ-отрицательных), полученных согласно заявляемому способу и приведенных в примерах 2 и 1, соответственно. Больные получали специализированное лечение по радикальным программам - лучевую или химиолучевую терапию.
Оценка частоты неблагоприятного клинического исхода проводилась по фактору прогрессирования заболевания и изучалась на сроках 2 г, 3 г, 5 л и 8 л после лечения. Анализ результатов показал отсутствие значимых отличий: согласно критерию Фишера (пакет программ «Statistica-10») р=0,71; 0,61; 0,43 и 0,80 соответственно при II стадии, р=0,22; 0,29; 0,62 и 0,73 - при III стадии РШМ.
Полученные данные являются основанием для объединения образцов с наличием интеграции ДНК ВПЧ16/18 типа и ВПЧ-отрицательных в одну группу.
Пример 5. Относительный риск (relative risk - RR) плохого клинического исхода заболевания в группе больных РШМ II-III стадии.
В соответствии с заявляемым способом 123 первичных больных с морфологически верифицированным РШМ II-III стадии были разделены на группы с относительно благоприятными (ВПЧ16/18-позитивный с отсутствием интеграции вируса) и неблагоприятными (ВПЧ-отрицательный (невыявление вируса) или ВПЧ16/18-позитивный с наличием интеграции ДНК вируса) факторами. Больным проводились радикальные курсы химиолучевого или лучевого лечения. На сроках 2 г, 3 г, 5 л и 8 л после окончания лечения в указанных группах проводили оценку эффективности проведенной терапии по показателям прогрессирования заболевания в соответствии с критерием Фишера (пакет программ «Statistica-10", Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета программ "Statistica 6.0" // МедиаСфера, Москва 2006). Рассчитывали величину и доверительный интервал относительного риска (RR) плохого клинического исхода заболевания, величину и доверительный интервал AUC - интегрального показателя, объединяющего такие характеристики как чувствительность и специфичность теста [пакет программ «MedCalc», Рубанович А.В., Хромов-Борисов Н.Н. Теоретический анализ показателей предсказательной эффективности бинарных генетических тестов // Экологическая генетика. - 2013. - Т. 11. - №1. - С. 77-90).
В соответствии с полученными результатами относительный риск (RR) плохого клинического исхода заболевания в несколько раз выше у больных с неблагоприятными факторами: невыявление вируса или наличие интеграции ДНК ВПЧ16/18 типа в клеточный геном при ВПЧ16/18-позитивных формах РШМ (см. таблицу 1).
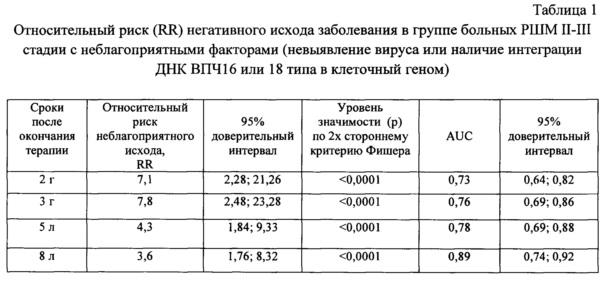
Высокий уровень показателя AUC на всех сроках наблюдения после лечения свидетельствует о высокой прогностической эффективности выбранного биомаркера - невыявление вируса или наличие интеграции ДНК ВПЧ16/18 в геном клетки-хозяина.
Пример 6. Относительный риск (relative risk - RR) плохого клинического исхода заболевания в группе больных РШМ II стадии с неблагоприятными факторами.
В соответствии с заявляемым способом больные РШМ II стадии (53 человека) были разделены на группы с относительно благоприятными (отсутствие интеграции ДНК вируса у ВПЧ16/18-позитивных пациенток) и неблагоприятными (невыявление вируса или наличие интеграции ДНК вируса у ВПЧ16/18-позитивных пациенток) факторами. На сроках 2 г, 3 г, 5 л и 8 л после окончания химиолучевого или лучевого лечения в указанных группах проводили сравнение частоты прогрессирования заболевания, рассчитывали величину и доверительный интервал относительного риска (RR) плохого клинического исхода заболевания, величину и доверительный интервал AUC по той же схеме, что и в примере 5 (см. таблицу 2).
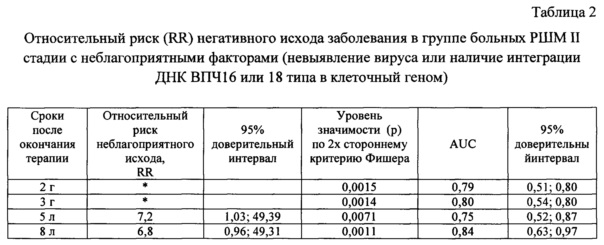
* Рассчитать относительный риск неблагоприятного исхода заболевания на сроках 2 и 3 г у больных с РШМ II стадии не представляется возможным, поскольку в знаменатель формулы расчета попадает ноль из-за отсутствия в группе с благоприятными факторами случаев прогрессирования заболевания.
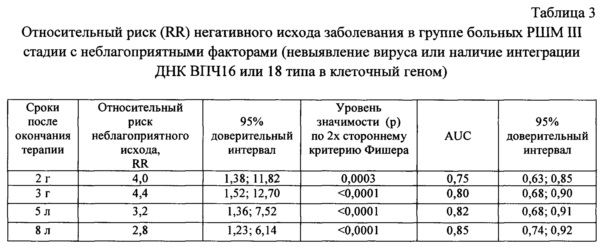
Пример 7. Относительный риск (relative risk - RR) плохого клинического исхода заболевания в группе больных РШМ III стадии.
В соответствии с заявляемым способом 70 больных РШМ III стадии были разделены на группы с относительно благоприятными (ВПЧ16/18-позитивные с отсутствием интеграции вируса) и неблагоприятными (ВПЧ-отрицательные (невыявление вируса) или ВПЧ16/18-позитивные с наличием интеграции ДНК вируса) факторами. На сроках 2 г, 3 г, 5 л и 8 л после окончания химиолучевого или лучевого лечения в указанных группах проводили сравнение частоты прогрессирования заболевания, рассчитывали величину и доверительный интервал относительного риска (RR) плохого клинического исхода заболевания, величину и доверительный интервал AUC по той же схеме, что и в примере №5 и 6 (см. таблицу 3).
Пример 8. Безрецидивная и общая выживаемость больных РШМ II-III стадии.
В соответствии с заявляемым способом (п. 11) пациентки с РШМ II-III стадии были разделены на группы с относительно благоприятными факторами (ВПЧ16/18-позитивные с отсутствием интеграции вируса) и неблагоприятными факторами (ВПЧ-отрицательные - невыявление вируса) или ВПЧ16/18-позитивные с наличием интеграции ДНК вируса). В этих группах проводили сравнительную оценку выживаемости больных методом Каплан-Мейера и log-rank теста на сроках 1, 2, 3, 4, 5, 6, 7 и 8 лет после лечения (Фиг. 2, 3). Установлено, что вероятность прожить до 8 лет без прогрессирования заболевания у пациенток прогностически благоприятной группы (безрецидивная выживаемость) статистически значимо выше, чем в прогностически неблагоприятной (р<0,00001, log-rank). Вероятность летального исхода (общая выживаемость) на момент окончания наблюдения (8 лет) в прогностически благоприятной группе значимо ниже, чем в прогностически неблагоприятной (р<0,0001, log-rank).
Пример 9. Безрецидивная и общая выживаемость больных РШМ II стадии.
В соответствии с заявляемым способом (п. 11) пациентки с РШМ II стадии были разделены на группы с относительно благоприятными факторами (ВПЧ16/18-позитивные с отсутствием интеграции вируса) и неблагоприятными факторами (ВПЧ-отрицательные - невыявление вируса) или ВПЧ16/18-позитивные с наличием интеграции ДНК вируса). В этих группах проводили сравнительную оценку выживаемости больных методом Каплан-Мейера и log-rank теста на сроках 1, 2, 3, 4, 5, 6, 7 и 8 лет после лечения (Фиг. 4, 5). Установлено, что вероятность прожить до 8 лет без прогрессирования заболевания у пациенток прогностически благоприятной группы (безрецидивная выживаемость) статистически значимо выше, чем в прогностически неблагоприятной (р=0,003, log-rank). Вероятность летального исхода (общая выживаемость) на момент окончания наблюдения (8 лет) в прогностически благоприятной группе значимо ниже, чем в прогностически неблагоприятной (р=0,005, log-rank).
Пример 10. Безрецидивная и общая выживаемость больных РШМ III стадии.
В соответствии с заявляемым способом (п. 11) пациентки с РШМ III стадии были разделены на группы с относительно благоприятными факторами (ВПЧ16/18-позитивные с отсутствием интеграции вируса) и неблагоприятными факторами (ВПЧ-отрицательные - невыявление вируса) или ВПЧ16/18-позитивные с наличием интеграции ДНК вируса). В этих группах проводили сравнительную оценку выживаемости больных методом Каплан-Мейера и log-rank теста на сроках 1, 2, 3, 4, 5, 6, 7 и 8 лет после лечения (Фиг. 6, 7).
Установлено, что вероятность прожить до 8 лет без прогрессирования заболевания у пациенток прогностически благоприятной группы (безрецидивная выживаемость) статистически значимо выше, чем в прогностически неблагоприятной (р<0,0001, log-rank). Вероятность летального исхода (общая выживаемость) на момент окончания наблюдения (8 лет) в прогностически благоприятной группе значимо ниже, чем в прогностически неблагоприятной (р=0,004, log-rank).
Все вышеперечисленные примеры подтверждают достижение технического результата:
Пример 1 - свидетельствует о доле больных РШМ II и III стадии, инфицированных ВПЧ 16 или 18 типа, и «ВПЧ-отрицательных» (ВПЧ ВКР не выявлен), к которым применяется заявляемый способ прогнозирования клинического исхода заболевания.
Пример 2 - свидетельствует о доле больных РШМ II и III стадии с наличием интегрированной ДНК ВПЧ16 или 18 типа и больных, у которых интеграция ДНК вируса не обнаружена, к которым применяется заявляемый способ прогнозирования клинического исхода заболевания.
Пример 3 - демонстрирует возможную причину невыявления вируса (ВПЧ-отрицательные образцы) - очень низкое количество копий вируса (ниже порога чувствительности определения) при высокой степени интеграции ДНК ВПЧ в клеточный геном, тем самым обосновывая объединение ВПЧ-отрицательных образцов и образцов с высокоинтегрированной ДНК ВПЧ16 или 18 в одну группу.
Пример 4 - свидетельствует об отсутствии значимых различий по клиническому исходу заболевания у пациенток с наличием интеграции ДНК ВПЧ16/18 и ВПЧ-отрицательных, обосновывая объединение ВПЧ-отрицательных случаев и случаев с интегрированной ДНК ВПЧ16 или 18 в одну группу.
Пример 5 - проспективно доказывает эффективность заявляемого способа раннего выявления больных местнораспространенным РШМ (II-III стадии) с высоким риском плохого клинического исхода. Установлены критерии, соответствующие плохому клиническому исходу заболевания: невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном.
Пример 6 - проспективно доказывает эффективность заявляемого способа раннего выявления больных РШМ II стадии с высоким риском плохого клинического исхода. Установлены критерии, соответствующие плохому клиническому исходу заболевания: невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном. Пример 6 доказывает, что установленные критерии являются фактором прогноза плохого клинического исхода независимо от стадии заболевания.
Пример 7 - проспективно доказывает эффективность заявляемого способа раннего выявления больных РШМ III стадии с высоким риском плохого клинического исхода. Установлены критерии, соответствующие плохому клиническому исходу заболевания: невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном. Пример 7 доказывает, что установленные критерии являются фактором прогноза плохого клинического исхода независимо от стадии заболевания.
Пример 8 - доказывает эффективность заявляемого способа раннего выявления больных местнораспространенным РШМ (II-III стадии) с высоким риском плохого клинического исхода заболевания. В соответствии с установленными критериями неблагоприятного прогноза (невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном) в группе пациенток с плохим прогнозом статистически значимо ниже как безрецидивная, так и общая выживаемость на сроках до 8 лет.
Пример 9 - доказывает эффективность заявляемого способа раннего выявления больных РШМ II стадии с высоким риском плохого клинического исхода заболевания. В соответствии с установленными критериями неблагоприятного прогноза (невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном) в группе пациенток с плохим прогнозом статистически значимо ниже как безрецидивная, так и общая выживаемость на сроках до 8 лет. Пример 9 доказывает, что установленные критерии являются фактором прогноза плохого клинического исхода независимо от стадии заболевания.
Пример 10 - доказывает эффективность заявляемого способа раннего выявления больных РШМ III стадии с высоким риском плохого клинического исхода заболевания. В соответствии с установленными критериями неблагоприятного прогноза (невыявление ВПЧ ВКР или наличие интеграции ДНК ВПЧ16 или 18 типа в клеточный геном) в группе пациенток с плохим прогнозом статистически значимо ниже как безрецидивная, так и общая выживаемость на сроках до 8 лет. Пример 10 доказывает, что установленные критерии являются фактором прогноза плохого клинического исхода независимо от стадии заболевания.
Использование в клинической практике заявляемого способа позволяет сформировать среди больных местнораспространенным РШМ группы повышенного риска плохого клинического исхода заболевания. Заявленный способ применим и доступен в лабораториях обычных клиник, несложен в исполнении и имеет медицинский, экономический и социальный эффект.