Результат интеллектуальной деятельности: Способ получения питательной среды для выделения гемокультуры при диагностике инфекции кровотока
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к лабораторным методам исследования, клинической микробиологии, а именно, микробиологическому исследованию крови, и биотехнологии, а именно, к способу приготовления питательной среды. Изобретение может быть использовано для диагностики инфекции кровотока путем выделения широкого спектра возбудителей, циркулирующих в кровотоке при микробиологическом исследовании. Использование предлагаемой среды позволяет получить из крови и культивировать чистую культуру аэробных, микроаэрофильных и анаэробных микроорганизмов - возбудителей инфекции кровотока в клинико-диагностических лабораториях лечебно-профилактических учреждений.
Питательные среды считаются ведущей составляющей в микробиологическом исследовании любого клинического материала. Соответствующий подбор состава питательной среды обеспечивает выделение широкого спектра микроорганизмов и способствует диагностике инфекционного заболевания.
В качестве питательных сред в микробиологии используют смеси, состоящие из различных соединений, способствующие размножению микроорганизмов в искусственных условиях. В связи с этим, любая питательная среда должна быть полноценной и содержать все необходимые для микроорганизмов вещества: белковый гидролизат, углеводы, хлористый натрий, минеральные соли. Ведущими питательными компонентами являются гидролизаты мяса (пептоны), казеина, рыбных продуктов и растительных белков.
В России научные разработки по созданию питательных сред начали проводить с 1980 года [1]. Панкреатический гидролизат рыбной муки, как полноценный пептон, был положен в основу питательных сред в России. До настоящего времени панкреатический гидролизат рыбной муки является основой более половины питательных сред промышленного отечественного производства [2].
Отечественными производителями выпускаются среды с номенклатурой более 400 наименований. Одновременно на российский рынок для практического здравоохранения поступают дорогостоящие импортные среды, различных зарубежных фирм (Becton Dickinson - США, Merck - Германия, Oxoid - Англия, Bio-Meriux - Франция, Pronadisa - Испания, Hi-Media - Индия).
Среды, приготовленные на натуральных природных субстратах, имеют все необходимые компоненты, поэтому на них хорошо растет большинство микроорганизмов, включая самые требовательные. Эти среды используют с диагностической целью.
Среды специального назначения, пригодные для выделения микроорганизмов из крови, готовят на сердечно-мозговом экстракте [3].
Диагностика инфекции в крови предусматривает выделение возбудителя из крови, получение его в виде колоний в качестве чистой культуры, проведение идентификации возбудителя и определение его антимикробной резистентности к антибиотикам. С этой целью в мировой практике используют высоко питательную плотную среду в виде сердечно-мозговой агаровой среды на чашке Петри. В России сердечно-мозговая жидкая и плотная среды промышленным способом не производятся.
В связи с этим отечественные лаборатории используют или эритрит-агар, как наиболее эффективный из всех имеющихся на нашем рынке отечественных плотных сред, или закупают дорогостоящие импортные агары [4].
Действующий до настоящего времени приказ МЗ СССР №535 от 1985 года [5] предлагает в качестве плотной среды использовать мясо-пептонный агар с добавлением 5% цельной крови для получения роста персистирующих бактерий и бактерий в L-форме, что теоретически и практически не эффективно. Рост возбудителей на плотном агаре позволяет исследовать биологические характеристики микроорганизма, готовить мазки для оценки их морфологических и тинкториальных свойств. Определение грамвариабельности микроорганизма (окрашивание мазков по Граму) позволяет врачу-клиницисту назначить целевую антибактериальную терапию.
При приготовлении мясной воды фарш заливают водой в соотношении 1:1, оставляют в условиях холодильника на 18-24 часа для экстракции и на следующий день смесь кипятят в течение 1 часа. Мясная вода содержит по отношению к массе: 0,3% общего азота, 0,07%аминного азота, 2,8% сухих веществ и 0,45% белка.
Для приготовления мясо-пептонного агара (МПА) к такой мясной воде добавляют 1% пептона, 0,5% хлорида натрия и 1,5-2,0% агар-агара. Для требовательных микроорганизмов дополнительно вводят в среду кровь, сыворотку, сахар и яичный желток.
Мясной экстракт получают идентично приготовлению мясной воды, при этом кипячение заменяется выпаркой мясного бульона до образования пастообразного продукта в автоклаве. Экстракт содержит: 18% воды, 61% органических веществ, 21% минеральных веществ, поэтому производство выпускает их в виде сухих порошков с содержанием: 12% общего азота, 1,1% аминного азота, 15,6% минеральных веществ.
Пептоны, как продукты ферментативного гидролиза белков мяса являются важным компонентом среды. Пепсинные пептоны содержат большое количество полипептидов, продуктов неглубокого гидролиза белка, а панкреатические пептоны - это смесь продуктов глубокого гидролиза белка и состоят из простых полипептидов, аминокислот с высоким содержанием аминного азота (1200 мг %). Пептоны обладают высокой питательной ценностью [6].
МПА, как базовая среда, используется в микробиологии более 80 лет для выделения из биологического материала наиболее распространенных аэробных, не требовательных к питанию, микроорганизмов (стафилококки, стрептококки, грамотрицательные палочки кишечной группы).
МПА имеет следующий состав:
|
В настоящее время существуют различные композиции, включающие в МПА кровь, сыворотку крови, яичный желток, селективные факторы, глюкозу и другие ингредиенты в зависимости от цели исследования.
Для выделения и культивирования возбудителей из крови используется 5% мясо-пептонный кровяной агар, регламентированный приказом МЗ СССР №535 от 1985 г [5].
5% Мясо-пептонный кровяной агар по упомянутому приказу имеет следующий состав:
|
Однако среда не способна выделять высоко требовательные к питанию микроорганизмы (не содержит факторы роста и высоко питательные вещества), облигатные анаэробы (отсутствует цистеин для регулирования определенного ОВП и отсутствует анаэробная техника культивирования) и микроаэрофилов (отсутствует техника культивирования микроаэрофилов).
В среде отсутствуют необходимые питательные вещества, ростовые факторы и нет питательной основы среды - сердечно-мозговой экстракта, обеспечивающего рост большинства клинически значимых возбудителей инфекции кровотока.
К облигатным (строгим) анаэробным микроорганизмам относится группа микроорганизмов с анаэробным типом дыхания, требующая для роста высокопитательные среды и отрицательный окислительно-восстановительный потенциал среды (ОВП). В эти среды дополнительно вводят факторы роста и восстановители для создания определенного ОВП.
Согласно рекомендациям Научно-методического центра по клинической лабораторной диагностике [7] в качестве базовой питательной среды был предложен анаэробный гемагар на основе эритрит-агара следующего состава на литр среды:
|
Другой вариант обогащенной питательной среды был предложен на основе промышленной среды «Контроля стерильности» (тиогликолевая среда) с добавлением в среду: пептона (5,0 г), экстракта кормовых дрожжей (2,5 г), натрия хлористого (1,8 г), аммония сернокислого (0,4 г), крахмала растворимого (1,0 г), гемина раствора 1% (1,0 мл), агар-агара (16,0 г), витамина К1 (1,0 мл 1% раствора) и 50 мл лизированной крови.
Для культивирования клинически значимых неспорообразующих облигатно-и факультативно анаэробных бактерий, имеющих высокие требования к составу питательной среды, зарубежные авторы используют сердечно-мозговой агар (ВHI-agar) в качестве среды общего назначения, обогащенную гемином и витамином К («Clinical Microbiology Procedures Hadbook», 1995 г.) [3].
В зарубежной практике для выделения и культивирования неспорообразующих облигатно анаэробных бактерий в качестве базовых питательных сред также применяют агар Шедлера (Schaedler agar), среду для бруцелл, обогащенные витамином К и гемином.
Таким образом, более «богатые» прописи содержат L-цистеин, гемин, витамин К1 [8].
Сегодня в нашей стране выпускают общеупотребительные среды на основе панкреатического гидролизата кильки - питательный агар (СПА) для микробиологической практики [9].
Учитывая все выше приведенное, при разработке сред необходимо учитывать следующее:
- среды должны содержать все необходимые источники питания и факторы роста;
- среды должны иметь определенный уровень рН (7,0-7,4) и окислительно-восстановительного потенциала (Eh);
- среды должны быть стерильными.
В качестве прототипа выбран способ получения питательной среды фирмы HIMedia Laboratories (Индия) - Brain Heart Infusion Agar (HIMEDIA) M211. Среда поступила на отечественный рынок более 10 лет назад и использовалась для получения гемокультур. Преимущество этой среды по сравнению с подобными других иностранных фирм - цена, которая была доступна.
Авторы рекомендуют использовать эту среду для культивирования высоко требовательных патогенных микроорганизмов: бактерий, истинных и дрожжеподобных грибов.
Этот агар относится к высоко питательным и обеспечивает рост разнообразных микроорганизмов. Он может быть в дальнейшем обогащен 5-10% стерильной дефибринированной кровью.
Главное назначение среды, по мнению авторов, - первичное выделение аэробных бактерий из крови. Добавление 50 мг/л хлорамфеникола (левомицетина) или 40 мг/л стрептомицина или смеси из 50 мг/л гентамицина и 50 мг/л хлорамфеникола авторами рекомендуется для выделения патогенных грибов, так как антибиотики подавляют рост бактерий.
Питательная среда-прототип имеет следующий состав ингредиентов в г/л на 1000 мл дистиллированной воды:
|
По мнению авторов, протеозный пептон и экстракты в среде служат источниками углерода, азота, витаминов, аминокислот наряду с основными факторами роста. Декстроза - источник энергии. Хлорид натрия удерживает осмотический баланс среды и двунатриевый фосфат является буфером среды. Добавленная к среде дефибринированная кровь обеспечивает основу факторов роста для большинства требовательных к питанию микроорганизмов.
Включенные в состав данной среды сердечный и мозговой экстракты обеспечивают среду факторами роста для микроорганизмов. Использование протеозного пептона (триптический гидролизат животной ткани) обеспечивает среду триптонами и аминокислотами. Хлорид натрия и двунатриевый фосфат обеспечивают буферный баланс среды, который необходим для полноценного роста микроорганизмов.
Сердечно-мозговой агар фирмы HIMEDIA (М-211) поступает на отечественный рынок в виде светло-желтого порошка. В лаборатории готовят по прописи среду. Образуется среда, соответствующая по плотности 1,5%-ному агару.
Способ приготовления:
Размешать 52,0 г порошка М211 в 1000 мл дистиллированной воды. Прокипятить для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 15 мин. Перед розливом тщательно перемешать. При необходимости приготовления селективной среды для грибов можно добавить к ней до 20 единиц/мл пенициллина и до 40 мкг/мл стрептомицина.
Данный сердечно-мозговой агар служит средой общего назначения для первичного выделения аэробных бактерий из клинического материала. Для подавления бактерий и выделения возбудителей системных микозов часто в среду, помимо стерильной дефибринированной крови (до 5-10%), рекомендуют добавлять хлорамфеникол (до 50 мкг/мл), стрептомицин (40 мкг/мл) или смесь гентамицина и хлорамфеникола (по 50 мкг/мл). Для селективного выделения патогенных грибов используют также добавление смеси циклогексимида (0,5 г на 1 литр) и хлорамфеникола (0,05 г на 1 литр). В этом случае инкубирование ведут при 25-30°С в течение 1-2 недель (3). На этой среде с добавлением 10% бараньей крови, гентамицина и хлорамфеникола рост некоторых грибов может быть подавлен.
Среда имеет светло-янтарную окраску, прозрачна или слегка опалесцирует при затвердевании. После добавления стерильной дефибринированной крови (до 5% вес/об) среда имеет вишнево-красный цвет и опалесцирует, если в чашках Петри формируется гель. Среда имеет рН 7,4±0,2.
Однако данная сердечно-мозговая среда предназначена для выделения только аэробных возбудителей из крови, что значительно ограничивает микробиологическую диагностику инфекции в крови.
Кроме того, она не обеспечивает микроорганизмы необходимыми факторами роста, витаминами. Данная среда не способна обеспечить рост клинически значимых неспорообразующих анаэробных микроорганизмов, играющих патогенетическую роль в современных воспалительных заболеваниях.
Техническая проблема заключается в создании стабильной, доступной, простой в изготовлении питательной среды, позволяющей выделять аэробные, микроаэрофильные и анаэробные возбудители из крови, изучать их биологические, морфологические и тинкториальные свойства, идентифицировать их и определять у них антимикробную резистентность в антибиотикам, что является неотъемлемым этапом в диагностике инфекции кровотока и любого патологического состояния при циркуляции микроорганизмов в кровотоке.
Технический результат, достигаемый при осуществлении патентуемого изобретения, состоит:
- в увеличении спектра выделяемых из крови клинически значимых микроорганизми, включая аэробные, микроаэрофильные и анаэробные возбудителей, за счет повышения питательности среды путем качественного подбора составляющих ее компонентов с включением факторов роста и витаминов;
- в обеспечении простоты, доступности получения твердой агаровой сердечно-мозговой питательной среды, обогащенной широким набором питательных веществ и витаминов, позволяющей эффективно выделять гемокультуры при диагностике инфекции кровотока;
- в повышении эффективности диагностики инфекции кровотока за счет возможности выделения грамположительных и грамотрицательных аэробных, микроаэрофильных и анаэробных микроорганизмов, включая высоко требовательные к питанию возбудители инфекции кровотока.
Включение L-глютамин, который рассматривается как незаменимая аминокислота и ключевой фактор роста, повышает питательность среды.
Достоинством среды является также включение в нее L-цистина и цистеина - важных аминокислот, содержащих серу. Они «взаимопревращаются», так как тесно связаны между собой и являются важнейшими факторами роста.
Никотинамид, включенный в состав предлагаемой питательной является важным компонентом кодегидрогеназы и участвует в окислительно-восстановительных процессах, входит в состав окислительно-восстановительных ферментов для энергетического обмена.
Азотнокислый калий включен в среду, как обязательный компонент искусственных сред, являющийся пищевым фактором роста. Гемин, один из важнейших факторов роста, предназначен для получения роста особо требовательных к питанию микроорганизмов (лейшмании, хеликобактер, анаэробы). Менадион (витамин К1) обеспечивает рост и выделение анаэробных микроорганизмов.
Сущность предлагаемого изобретения заключается в следующем.
Способ приготовления питательной среды включает следующие этапы.
Готовят сердечный и мозговой экстракты раздельно после измельчения сердца и мозгов крупного рогатого скота.
Отдельно готовят смесь №1, для чего в 50 мл дистиллированной воды растворяют 100 мг L-глютамина, 1 мг аденина, 200 мг парааминобензойной кислоты, 11 мг L-цистина, 2,5 мг никотинамида, 260,0 мг солянокислого цистеина, 500,0 мг азотнокислого калия.
Затем в 700 мл дистиллированной воды растворяют 15,0 г агар-агара, добавляют 10,0 г пептона, 2,0 г глюкозы, 5,0 г хлористого натрия, 2,5 г фосфорнокислого двухзамещенного натрия, получая смесь №2, которую кипятят в течение 5-10 минут. После чего к смеси №2 добавляют, смесь №1, 100 мл мозгового и 150 мл сердечного экстрактов и 4 мл 1% раствора гемина. Доводят рН полученного сердечно-мозгового агара до 7,2-7,6. Разливают полученный состав по флаконам (200 мл или 500 мл), которые закрывают резиновыми пробками, завальцовывают алюминиевыми колпачками и стерилизуют.
Для приготовления чашек Петри расплавляют приготовленный сердечно-мозговой агар во флаконе на водяной бане, остужают его до t°=+50°C, добавляют к агару 1% раствор менадиона и гемолизированную кровь из расчета объема среды во флаконе: на 100 мл сердечно-мозгового агара во флаконе - 0,1 мл раствора менадиона и 5 мл гемолизированной крови. Флакон перемешивают и разливают по чашкам Петри.
Приготовление сердечно-мозговой питательной среды по предлагаемому способу выполняют следующим образом: сначала готовят сердечный и мозговой экстракты раздельно, а затем производят сборку самой среды.
1. Приготовление сердечного и мозгового экстрактов.
Первый день.
Раздельно сердце и мозги крупного рогатого скота очищают от пленок, сосудов, оболочек, жира, измельчают при помощи мясорубки. Далее полученный материал заливают одинарным количеством водопроводной воды (на 1 кг ткани - 1 л воды) и оставляют на ночь в холодильнике при t° +4°С.
Второй день:
Настои при помешивании доводят до кипения и кипятят 5-10 минут. Горячие экстракты профильтровывают вначале через 3 слоя марли и затем через ватно-марлевый фильтр, затем разливают по флаконам емкостью: мозговой экстракт по 100 мл и сердечный - по 150 мл. Заполненные флаконы закрывают резиновыми пробками и завальцовывают металлическими колпачками, после чего автоклавируют 15 минут при 0,7 атмосферы. Готовые экстракты хранят в холодильнике при t° +4°C в течение 6 месяцев.
Приготовление сердечно-мозговой среды.
1 этап.
Приготовление смеси №1.
В 50,0 мл дистиллированной воды растворяют 100 мг L-глютамина, 1 мг аденина, 200 мг парааминобензойной кислоты, 11 мг L-цистина, 2,5 мг никотинамида, 260 мг солянокислого цистеина, 500 мг азотнокислого калия.
2 этап.
Приготовление сердечно-мозгового агара.
В 700 мл дистиллированной воды растворяют 15 г агар-агара, добавляют 10 г пептона. 2 г глюкозы, 5 г хлористого натрия, 2,5 г двухзамещенного фосфорнокислого натрия. Полученную смесь кипятят в течение 5-10 минут. Добавляют в горячую массу приготовленную смесь №1, 100 мл полученного мозгового экстракта, 150 мл сердечного экстракта, 4 мл 1% раствора гемина. Доводят рН приготовленной среды до 7,2-7,6 раствором 8 N NaOH. Приготовленную среду разливают по флаконам удобным для работы объемом, которые закрывают резиновыми пробками и завальцовывают алюминиевыми колпачками. Стерилизацию проводят автоклавированием при 0,5-0,6 атмосферы в течение 20 минут.
Агаровая сердечно-мозговая среда во флаконах может храниться в условиях холодильника (+4°С) в течение года.
Приготовление чашек Петри с предлагаемой твердой агаровой сердечно-мозговой средой производят непосредственно перед посевом крови.
Этап 1.
Приготовление гемолизированной крови.
Цельную кровь разливают по пробиркам объемом 10 мл и помещают в наклонном положении в морозильную камеру для замораживания. Перед добавлением в среду пробирки с кровью из расчета 5 мл крови на 100 мл агара помещают в водяную баню для оттаивания, при этом кровь гемолизуруется и приобретает темный цвет.
Этап 2.
Приготовление чашек Петри с предлагаемой твердой агаровой сердечно-мозговой средой производят непосредственно перед посевом крови.
Помещают флакон с полученной агаровой средой в водяную баню для расплавления агара. Расплавленный агар остужают до t° +50°С и добавляют 1% раствор менадиона и гемолизированную кровь из расчета на объем среды во флаконе: на 100 мл сердечно-мозгового агара во флаконе - 0,1 мл раствора менадиона и 5 мл гемолизированной крови. После добавления менадиона и крови все содержимое тщательно перемешивают и разливают по чашкам Петри по 15 мл. После застывания агара в чашках, среду подсушивают и используют для прямого посева крови или для субкультивирования "кровь-среда", т.е. подросшей крови в жидкой сердечно-мозговой среде.
Свежеприготовленный сердечно-мозговой гемагар в чашках Петри используют для аэробного, микроаэрофильного и анаэробного культивирования крови. Чашки с засеянной кровью помещают в термостат в аэробные условия, в эксикатор - для микроаэрофильного и в микроанаэростат - для анаэробного культивирования.
Приготовленные чашки хранят в условиях холодильника (+4°С) в течение 1-2 недель для аэробного и микрофэрофильного культивирования и в условиях микроанаэростата - для анаэробного.
Свежеприготовленный гемагар на чашках, оставленный при комнатной температуре на 2 часа с момента разлива среды и также хранившийся в микроанаэростате является пригодным для культивирования строгих анаэробов.
Выросшие колонии возбудителя идентифицируют, изучают биохимические свойства и определяют резистентность к антимикробным препаратам.
Для доказательств возможности реализации назначения предлагаемого изобретения и достижения указанного технического результата приводим следующие данные.
Были сопоставлены результаты выделения микроорганизмов из крови при инокуляции цельной крови на две различные агаровые среды.
Среда №1 - среда прототип - Brain Heart Infusion Agar (HIMEDIA) M211.
Среда №2 - предлагаемый «сердечно-мозговой гемагар».
Исследование проводилось на пробах крови терапевтических пациентов кардиологического профиля с диагнозами: инфекционный эндокардит, ревматизм, врожденный порок сердца, и лихорадочное состояние. Пробы крови отбирались при венопункции с соблюдением правил асептики.
Среды №1 и №2 были приготовлены в соответствии с их рецептурой, разлиты по чашкам Петри для аэробного, микроаэрофильного и анаэробного культивирования.
Всего было исследовано 220 проб крови. В таблице представлены результаты выделения микроорганизмов из крови на среде №1 и №2.
Таблица
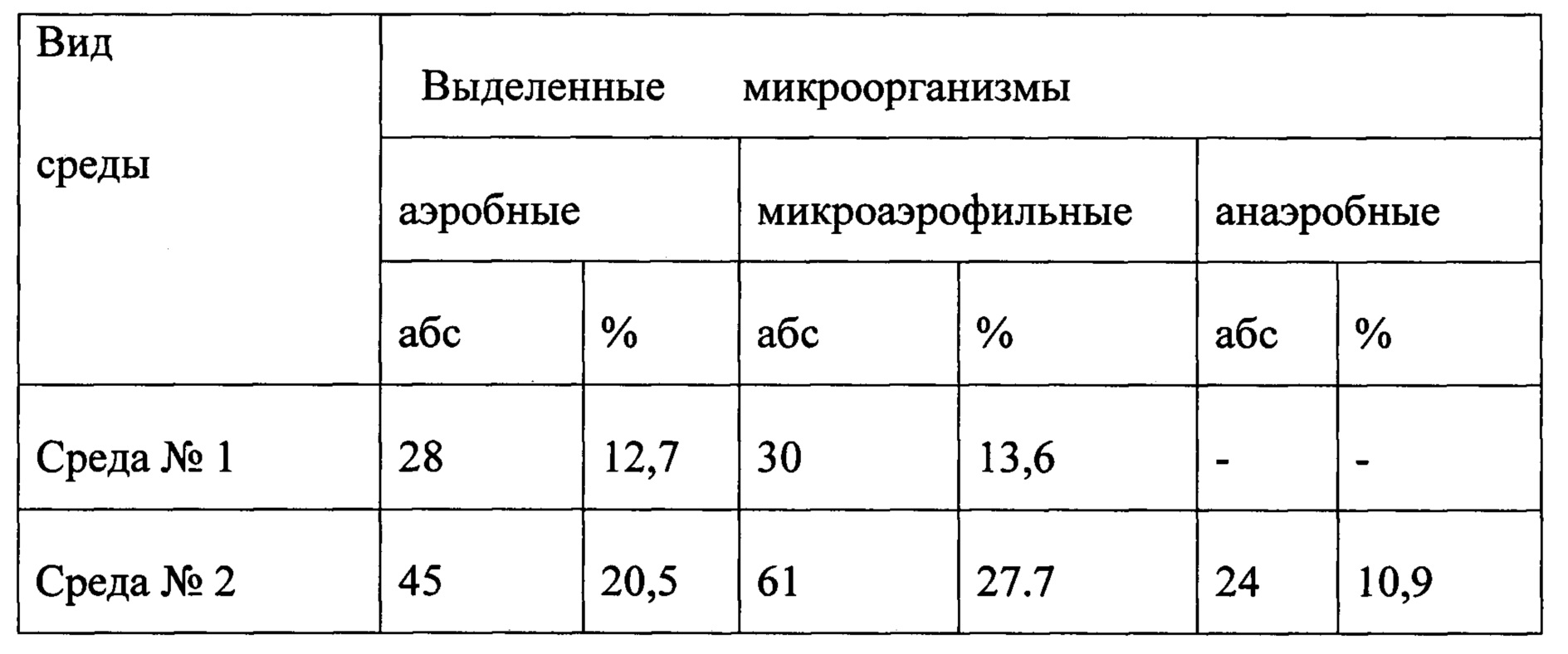
После посева крови на агар среды №1 получили 58 случаев выделения микроорганизмов, что составило 26,4% лабораторной эффективности. На среде №2 получили 130 случаев выделения микроорганизмов, что составило 59,1% случаев эффективности выделения возбудителя из крови, что в 2,2 раза превышало показатели эффективности среды №1.
Необходимо отметить, что анаэробные микроорганизмы не были получены на среде-прототипе, так как она предназначена для роста только аэробных микроорганизмов. В среду прототипа не включены факторы роста, необходимые анаэробным микроорганизмам. Среда-прототип включает дефибринированную кровь, а предлагаемая среда - гемолизированную, которая дополнительно обогащает среду витаминами.
Таким образом, разработанная нами твердая агаровая сердечно-мозговая среда является оптимальной средой для микробиологического исследования крови при диагностике инфекции кровотока, так как она способна обеспечить рост аэробных, микроаэрофильных и анаэробных возбудителей, включая высоко требовательных к питанию.
Предлагаемая питательная среда способна создать необходимые условия для хорошего роста широкого спектра клинически важных микроорганизмов. При условии культивирования в анаэробных условиях имеется возможность получить рост анаэробных и факультативно-анаэробных возбудителей из крови. Специальные ростовые добавки гарантируют рост высоко требовательных к питанию аэробных, микроаэрофильных и анаэробных микроорганизмов в гемокультурах при диагностике инфекции кровотока.
Существенным отличием разработанной нами среды является то, что предлагаемая агаровая сердечно-мозговая среда имеет в своем составе полноценный набор питательных веществ и витаминов для обеспечения роста широкого спектра клинически значимых возбудителей инфекции кровотока, включая аэробные, микроаэрофильные и анаэробные микроорганизмы. Обогащение агаровой среды цистином, цистеином, гемином, менадионом и гемолизированной кровью позволяет ее использовать для выделения не только аэробных возбудителей, но и анаэробных.
Плотная агаровая сердечно-мозговая среда в чашке Петри позволяет также выполнить этап субкультивирования при получении гемокультуры. Этот этап предусматривает высев «кровь-среда» на агар с целью получения чистой культуры возбудителя инфекции в крови. Выросшие колонии подвергаются изучению морфологических, тинкториальных, биохимических особенностей выделенного микроорганизма и постановки определения резистентности к антибиотикам.
Качественный подбор состава питательной среды обеспечивает выделение микроорганизма, получение его чистой культуры, изучение морфологических и тинкториальных особенностей, идентификацию его и определение антимикробной резистентности к антибиотикам. Все это в совокупности способствует правильной диагностике инфекции в крови и выбору целевой антимикробной терапии.
Предлагаемая агаровая среда проста в изготовлении и может быть получена в промышленном масштабе.
Литература
1. Поляк М.С., Сухаревич В.И., Сухаревич М.Э., книга «Питательные среды для медицинской микробиологии», Санкт-Петербург, 2002.
2. Шепелин А.П., Дятлов И.А., Марчихина И.И., Миронова Е.Н., Разработка технологии приготовления панкреатического гидролизата рыбной муки - белковой основы бактериологических питательных сред, Клиническая лабораторная диагностика, 2011, 9, 48-49.
3. Washington JA., 2nd Blood cultures: Principles and techniques. Mayo Clin Proc. 1975; 50:91-8.
4. Багирова H.C. Диагностика бактериемии, Consilium Medicum, 2002, t. 4 (1).
5. Приказ МЗ СССР №535 от 22.04.1985 г.приложение 1 к приказу «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений, Москва, стр. 5-10.
6. Меджидов М.М., Справочник по микробиологическим питательным средам, Москва, 2003.
7. Кочеровец В.И., Михайлова B.C. и др., Методы микробиологического анализа неспорообразующих анаэробных бактерий, Москва, 1996.
8. A. Papastathopoulou, E. Bezirtzoglou, N. Legakis, A new selective and differentiative medium for the isolation of Bacteroides fragilis, Microbial Ecology in Health and Disease, 1998, vol. 10, 110-113.
9. Шепелин А.П., Дятлов И.А., Современное состояние и тенденции в производстве питательных сред, Лаборатория, 2011, 2, 17-18.
Способ получения питательной среды для выделения гемокультуры при диагностике инфекции кровотока, в котором готовят сердечный и мозговой экстракты после измельчения сердца и мозгов крупного рогатого скота, далее готовят смесь №1, для чего растворяют в 50 мл дистиллированной воды 100 мг L-глютамина, 1 мг аденина, 200 мг парааминобензойной кислоты, 11 мг L-цистина, 2,5 мг никотинамида, 260,0 мг солянокислого цистеина, 500,0 мг азотнокислого калия; затем в 700 мл дистиллированной воде растворяют 15,0 г агар-агара, добавляют к растворенному агар-агару 10,0 г пептона, 2,0 г глюкозы, 5,0 г хлористого натрия, 2,5 г фосфорнокислого двухзамещенного натрия, получая смесь №2; после чего смесь №2 кипятят в течение 5-10 минут и добавляют в нее смесь №1, 100 мл мозгового и 150 мл сердечного экстрактов, 4 мл 1% раствора гемина, доводят рН полученного сердечно-мозгового агара до 7,4±0,2, разливают полученный состав по флаконам, которые закрывают резиновыми пробками, завальцовывают алюминиевыми колпачками и стерилизуют, для приготовления чашек Петри расплавляют агар-агар полученного состава, добавляют к его содержимому 1% раствор менадиона и гемолизированную кровь из расчета объема среды во флаконе: на 100 мл сердечно-мозгового агара - 0,1 мл 1% раствора менадиона и 5 мл гемолизированной крови.
