Результат интеллектуальной деятельности: ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО ИНГИБИТОРАМИ ATR
Вид РИД
Изобретение
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рак поджелудочной железы занимает десятое место среди всех вновь выявляемых злокачественных опухолей любой локализации и является причиной 6% всех смертей от онкологических заболеваний. Пятилетняя выживаемость составляет менее 5%. Современные методы лечения включают в себя либо неоадъювантную терапию (например, с помощью гемцитабина) и/или лучевую терапию, либо оперативное удаление с последующей адъювантной химиотерапией (например, гемцитабином) или лучевой терапией. Хотя при терапии гемцитабином пятилетняя выживаемость увеличивается с 10 до 20%, все еще существует острая потребность в более эффективных методах лечения рака поджелудочной железы.
Несколько способов лечения прошли испытания в фазе II и фазе III клинических исследований, хотя результаты оказались не слишком многообещающими. Типифарниб, ингибитор фарнезилтрансферазы для приема внутрь, не вызвал значимого улучшения общей выживаемости в сочетании с гемцитабином. Аналогичным образом, цетуксимаб, связывающийся с рецепторами эпидермального фактора роста (РЭФР), также не обеспечил клинического преимущества в сочетании с гемцитабином. Отмечено лишь небольшое повышение общей выживаемости (6,24 месяца против 5,91 месяца).
Рак легких является второй наиболее распространенной формой рака и является ведущей причиной онкологической смертности. Немелкоклеточный рак легкого (НМРЛ) представляет собой наиболее распространенную форму рака легких, на его долю приходится примерно 85% всех случаев рака легких. У большинства пациентов, у которых НМРЛ выявляется на поздней III или IV стадии, пятилетняя выживаемость составляет 24% и 4% соответственно. В связи с тем что заболевание выявлено на поздней стадии, оперативное удаление часто представляется невозможным. Для большинства пациентов лечение включает в себя химиотерапию и/или лучевую терапию. Выбор химиотерапии включает много вариантов, в зависимости от стадии заболевания, физического состояния пациента и предпочтений, связанных с географическим положением. В большинстве случаев химиотерапия основана на введении двух компонентов, включающих производное платины, такое как цисплатин или карбоплатин, и второй цитотоксический препарат, такой как гемцитабин, этопозид или таксотер. Для небольшого количества пациентов лечение может включать в себя терапию препаратами, направленно воздействующими на определенные белки, которые мутировали или регулируются неправильно, такие как ALK и РЭФР (например, кризотиниб, гефитиниб и эрлотиниб). Выбор пациентов для таких видов таргетной терапии обусловлен генетическими или протеомными маркерами. Эффективность большого количества лекарственных препаратов оценивали в клинических исследованиях НМРЛ, однако в большинстве случаев отмечено незначительное преимущество по сравнению с видами лечения, основанными на химиотерапии, со срединным значением общей выживаемости, составляющим обычно менее 11 месяцев.
Таким образом, существует настоятельная потребность в новых стратегиях для улучшения лечения рака поджелудочной железы и немелкоклеточного рака легкого.
ATR («ATM и Rad3-связанная») киназа представляет собой протеинкиназу, участвующую в клеточных ответах на некоторые формы повреждения ДНК (например, двухцепочечные разрывы и напряжение, создаваемое репликацией). ATR киназа действует с ATM («атаксия-телеангиэктазия-мутантная») киназой многими другими белками в регуляции клеточного ответа на двухцепочечные разрывы ДНК и напряжение, создаваемой репликацией, обычно именуемого ответ на повреждение ДНК («DDR»). DDR стимулирует репарацию ДНК, способствует выживанию клеток и останавливает клеточный цикл, воздействуя на сверочные точки клеточного цикла, что обеспечивает время для репарации. Без DDR клетки оказываются гораздо более чувствительными к повреждению ДНК и быстро погибают от повреждений ДНК, обусловленных эндогенными клеточными процессами, такими как репликация ДНК, или экзогенными повреждающими ДНК агентами, часто применяемыми при лечении рака.
Здоровые клетки могут использовать для репарации ДНК множество различных белков, в том числе киназы клеточного ответа киназы (DDR) - ATR-киназу и ATM-киназу. В некоторых случаях эти белки могут восполнять недостатки друг друга путем активации функционально избыточных процессов репарации ДНК. С другой стороны, многие раковые клетки сохраняют дефекты в ходе некоторых из процессов репарации своей ДНК, таких как ATM-сигнализация, и поэтому в большей степени зависят от оставшихся неповрежденными белков репарации ДНК, включающих ATR.
Кроме того, многие раковые клетки экспрессируют активированные онкогены, или в них имеется недостаточно ключевых опухолевых супрессоров, в результате чего раковые клетки могут быть подвержены нарушению регуляции фаз репликации ДНК, что, в свою очередь, приводит к повреждению ДНК. Предполагается, что ATR является ключевым компонентом в ответе DDR на нарушение репликации ДНК. В результате, выживание этих раковых клеток в большей степени зависит от активности ATR, чем выживание здоровых клеток. Соответственно, ингибиторы ATR могут применяться для лечения рака, либо самостоятельно, либо в комбинации с повреждающими ДНК агентами, поскольку они отключают механизм репарации ДНК, который более важен для выживания многих раковых клеток, чем для выживания нормальных здоровых клеток.
В действительности отмечено, что нарушение работы ATR (например, путем делеции гена) способствует гибели раковых клеток как в присутствии, так и в отсутствие повреждающих ДНК агентов. Это указывает, что ингибиторы ATR могут быть эффективны как в качестве самостоятельных агентов, так и в качестве сильнодействующих сенсибилизаторов лучевой терапии или генотоксической химиотерапии.
Более того, солидные опухоли часто содержат участки, которые являются гипоксическими (низкие уровни кислорода). Это является значимым, поскольку известно, что гипоксические раковые клетки являются резистентными к терапии, прежде всего к ИК-терапии, и являются в высшей степени агрессивными. Одной из причин такого наблюдения является то, что компоненты DDR могут быть активированы в условиях гипоксии, и также отмечено, что выживание гипоксических клеток в большей степени зависит от компонентов DDR.
По этой причине существует необходимость в разработке сильнодействующих и селективных ингибиторов ATR для лечения рака поджелудочной железы, для лечения рака легких, а также в разработке агентов, эффективных против как гипоксических и нормоксических раковых клеток.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Это изобретение относится к ингибиторам ATR, предназначенным для лечения рака поджелудочной железы и немелкоклеточного рака легкого. В отношении рака поджелудочной железы это изобретение относится к способам лечения рака поджелудочной железы у пациента (например, человека) с помощью ингибитора ATR в сочетании с гемцитабином и/или лучевой терапией. Заявители продемонстрировали синергическую эффективность ингибиторов ATR в сочетании с гемцитабином и/или лучевой терапией в ходе оценки клоногенности и выживаемости на клеточных линиях рака поджелудочной железы (например PSN-1, MiaPaCa-2 и Panc-1), а также на клеточной линии первичной опухоли (например, Panc-М). Прерывание активности ATR измеряли посредством оценки повреждения ДНК, обусловленного фосфорилированием Chk1 (Ser 345), и посредством оценки фокусов поражения ДНК и фокусов RAD51 после облучения.
В отношении немелкоклеточного рака легкого это изобретение относится к способам лечения немелкоклеточного рака легкого с помощью ингибитора ATR в сочетании с цисплатином или карбоплатином, этопозидом и ионизирующим излучением. Заявители продемонстрировали синергическое воздействие ингибиторов ATR в сочетании с цисплатином, этопозидом, гемцитабином, оксаплатином и иринотеканом в ходе оценки жизнеспособности на панели из 35 клеточных линий рака легкого человека, а также продемонстрировали это воздействие в испытаниях эффективности в условиях in vivo на мышиной модели рака легкого мыши в сочетании с цисплатином.
КРАТКОЕ ОПИСАНИЕ ФИГУР
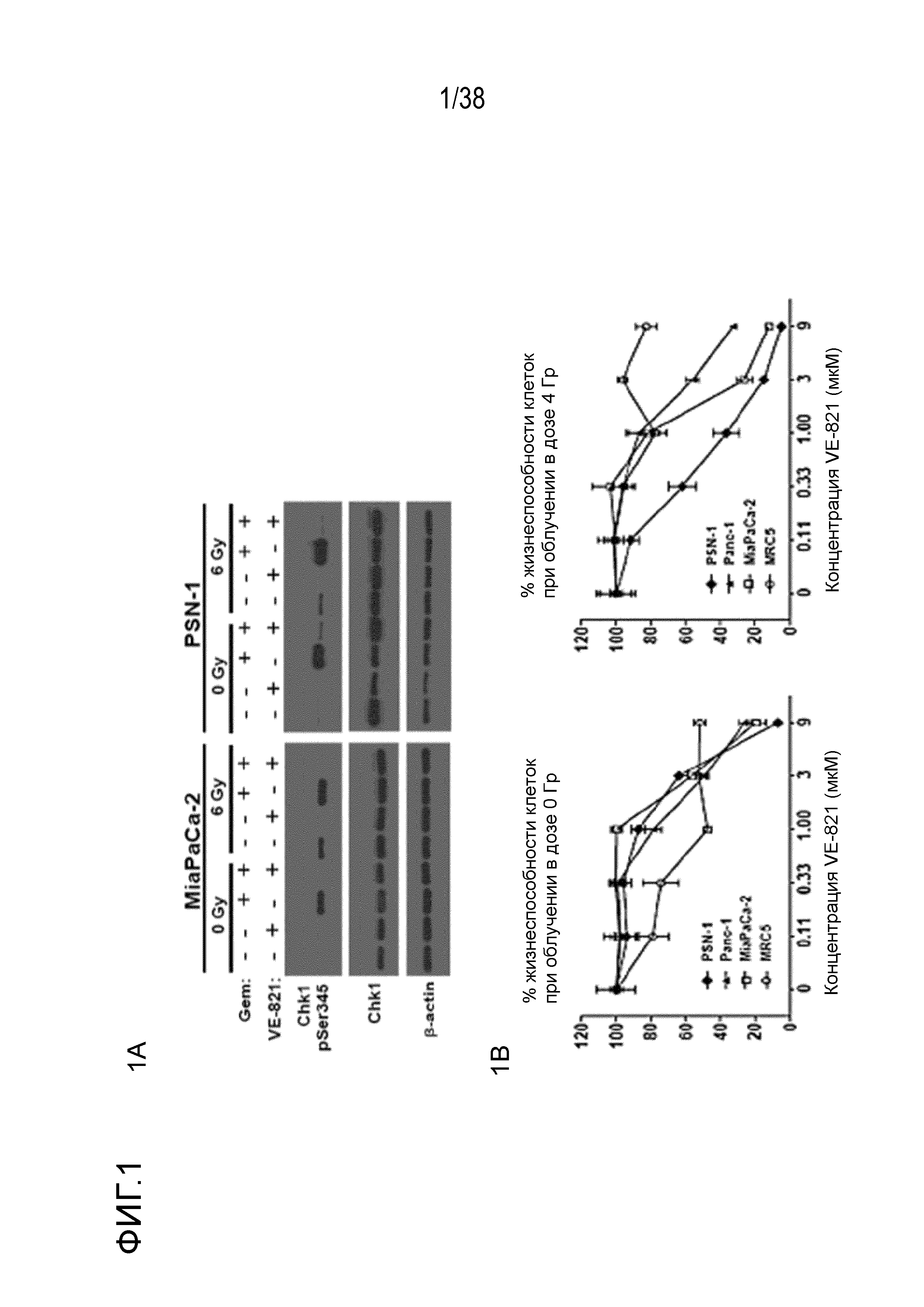
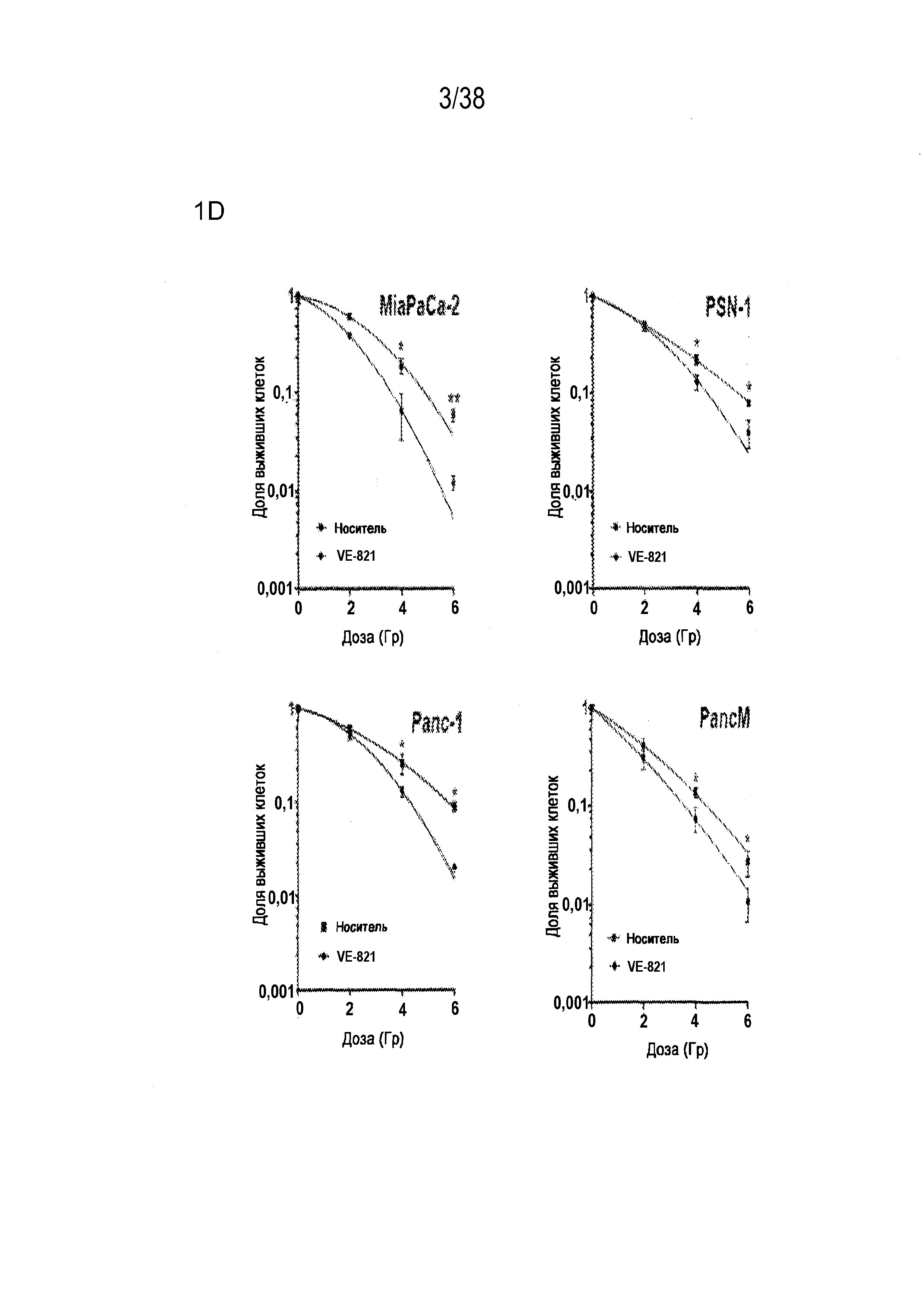
Фигура 1. VE-821 радиосенсибилизирует клетки опухоли поджелудочной железы.
A) Иммуноблоттинг ингибирования Chk1.
Клетки обрабатывали 100 нМ гемцитабина в течение 1 часа, через 1 час прибавляли 1 мкМ VE-821, и клетки подвергали облучению в дозе 6 Гр 1 час спустя. Препараты оставляли на протяжении всего эксперимента, через 2 час после облучения клетки лизировали и подвергали иммуноблоттингу.
B) VE-821 радиосенсибилизирует клетки опухоли поджелудочной железы, но не оказывает такого воздействия на нормальные фибропласты.
Через 1 час после прибавления VE-821 клеточные линии рака поджелудочной железы PSN-1, Panc-1, MiaPaCa-2 и фибропласты MRC5 обрабатывали возрастающими концентрациями VE-821 в течение 96 час в сочетании с облучением в дозе 4 Гр или без него. Жизнеспособность клеток измеряли через 8 суток, уровень указывали как нормированный по отношению к клетками, обработанным ДМСО.
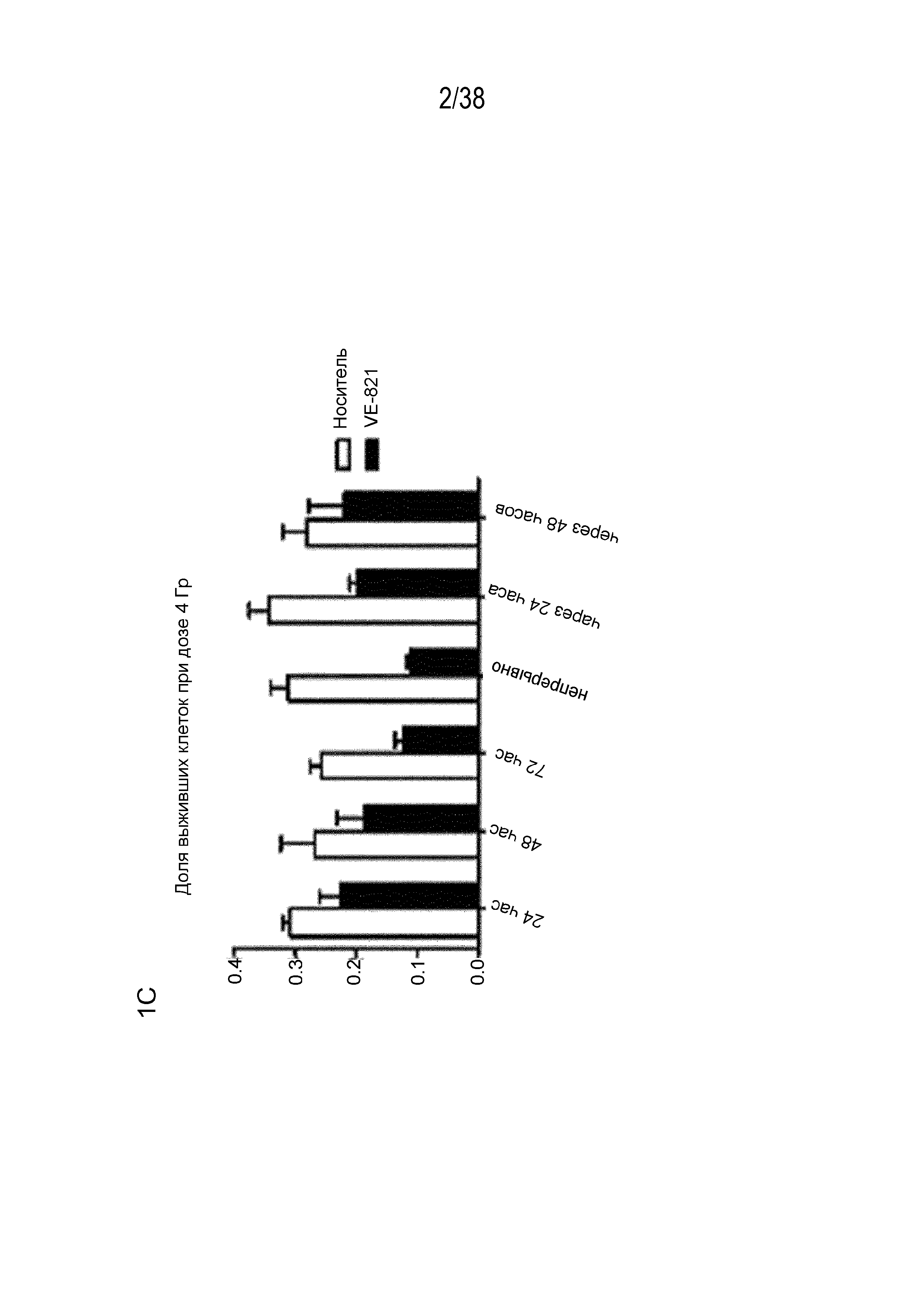
C) Время введения VE-821 оказывает влияние на радиосенсибилизацию.
Клетки PSN-1 высевали как единичные клетки, обрабатывали 1 мкМ VE-821 в различные моменты времени по отношению к облучению в дозе 4 Гр и через 10 суток оценивали колониеобразование. Определяли долю выживших клеток при воздействии дозы 4 Гр для каждого режима обработки с учетом соответствующей эффективности посева необлученных клеток.
D) Клоногенная клеточная выживаемость поджелудочной железы в результате воздействия клеток рака ингибирования ATR. Клетки обрабатывали 1 мкМ VE-821 через 4 час после посева и за 1 час до облучения. Через 72 час препарат удаляли и через 10-21 сутки оценивали колониеобразующую способность. (n=3). *, P<0,05; **, P<0,01 по сравнению с контрольным образцом, обработанным ДМСО.
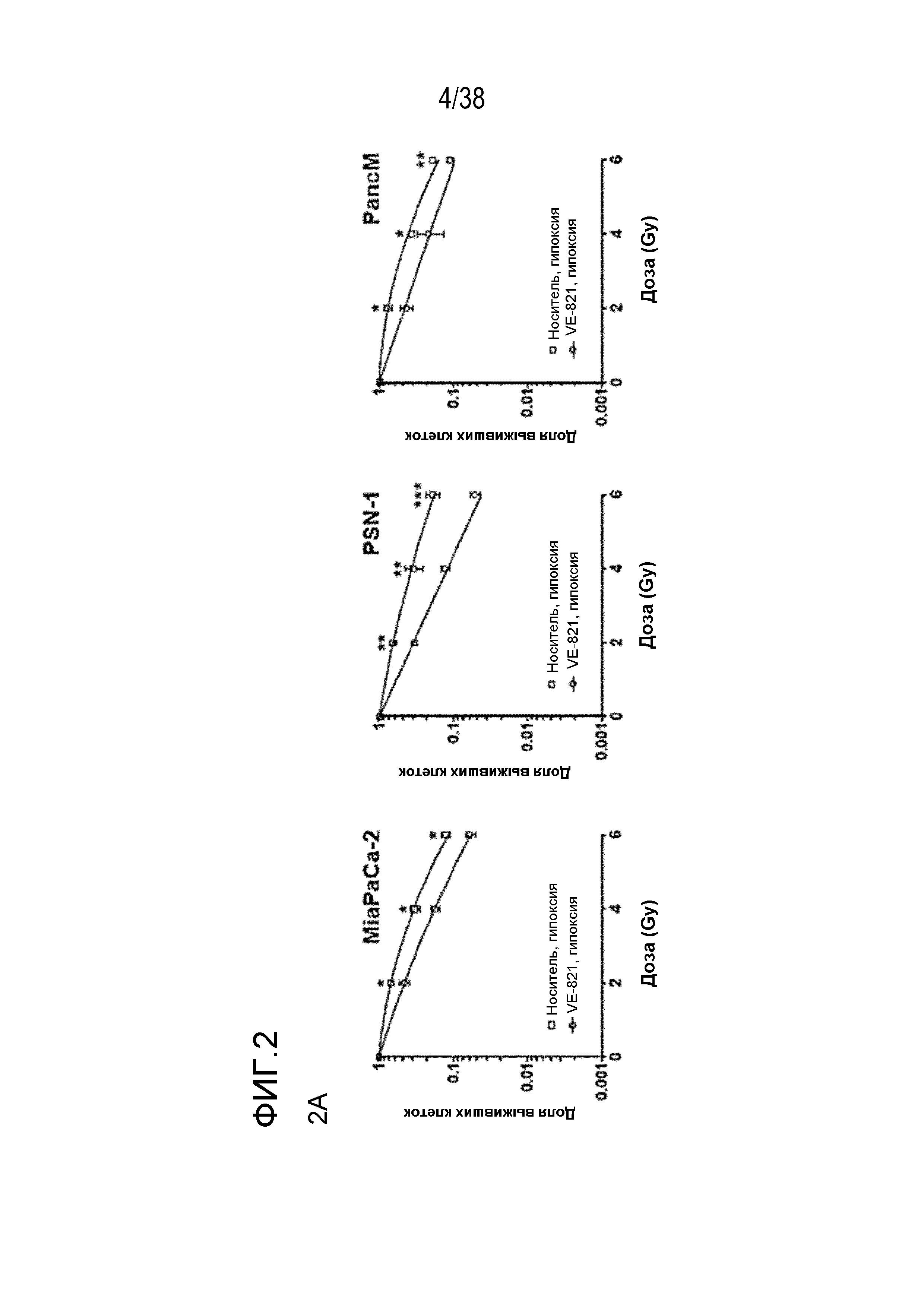
Фигура 2. VE-821 радиосенсибилизирует клетки опухоли поджелудочной железы в условиях гипоксии.
A) кривые клоногенной выживаемости клеток, обработанных 1 мкМ VE-821 и облучением в условиях гипоксии. Высеянные клетки переносили в условия гипоксии (0,5% O2) и оставляли для акклиматизации на 6 час. Затем прибавляли VE-821 (1 мкМ) за 1 час до облучения и оставляли на 72 час, после чего заменяли среду. Через 1 час после облучения клетки переносили в условия нормоксии.
B) клоногенная выживаемость клеток после облучения в дозе 6 Гр и обработки 1 мкМ VE-821 в условиях насыщения кислородом и условиях гипоксии (0,5% O2), как описано выше на фиг. 1 (n=3). *, P<0,05; **, P<0,01; ***, P<0,001 по сравнению с контрольным образцом, обработанным ДМСО.
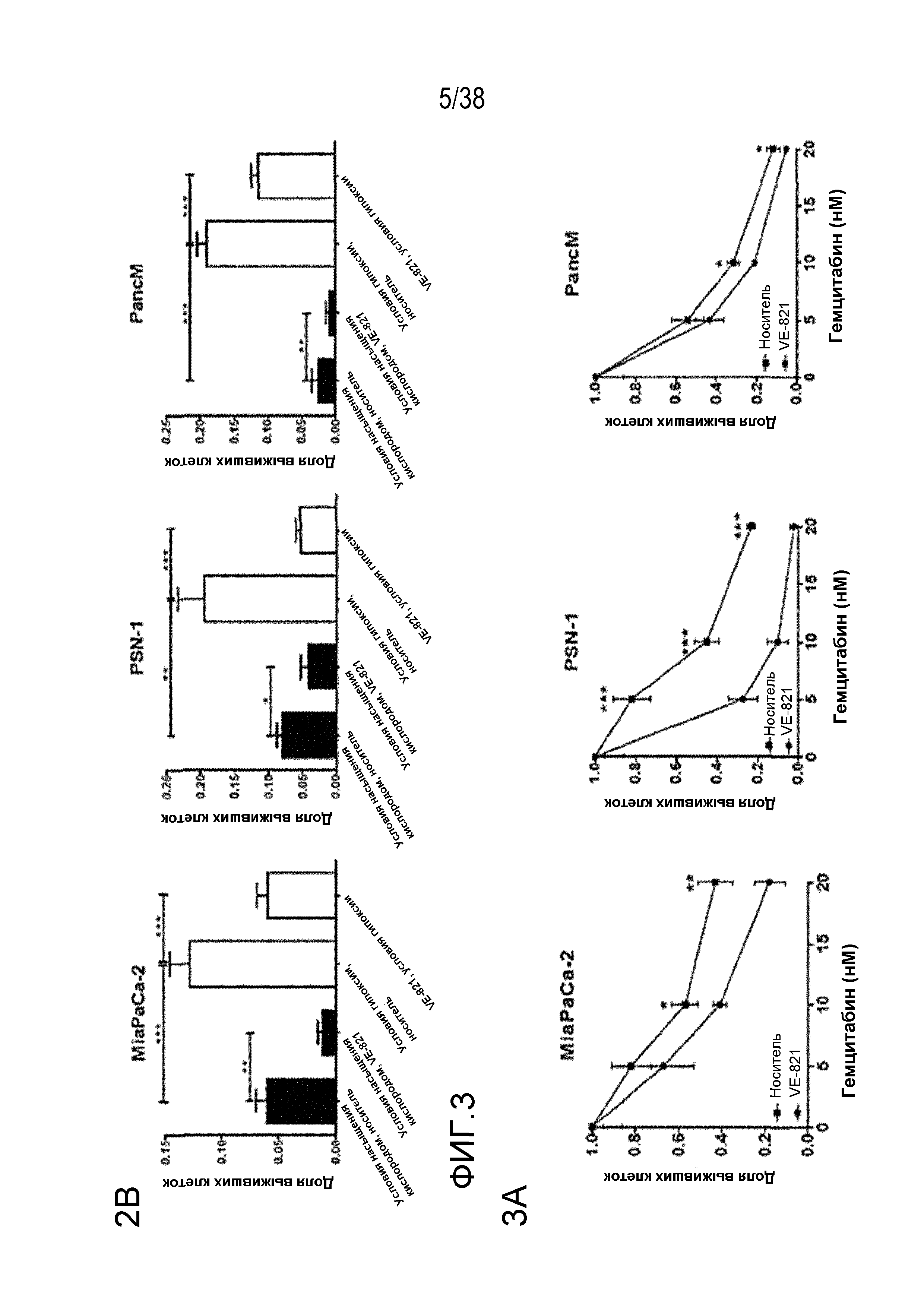
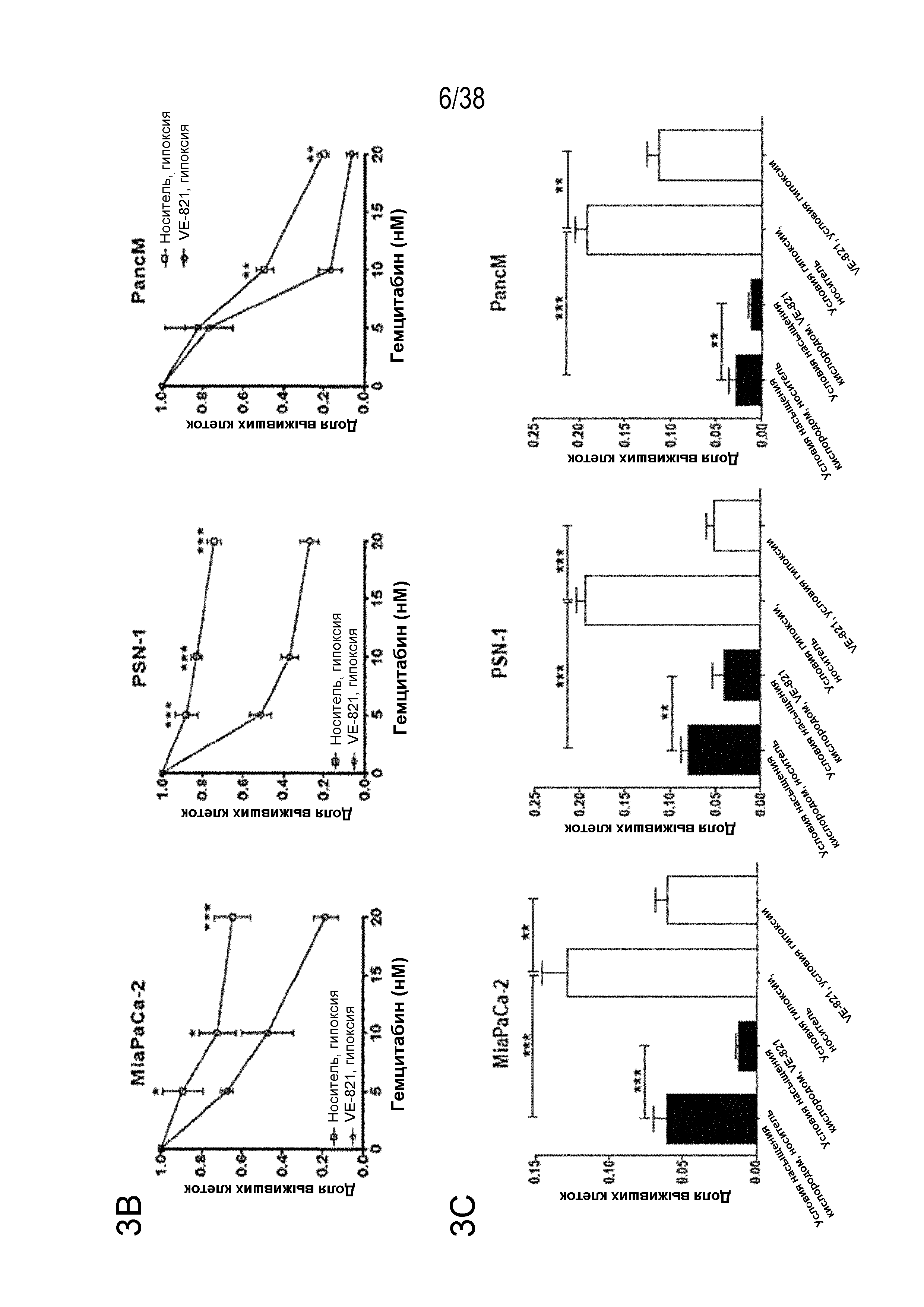
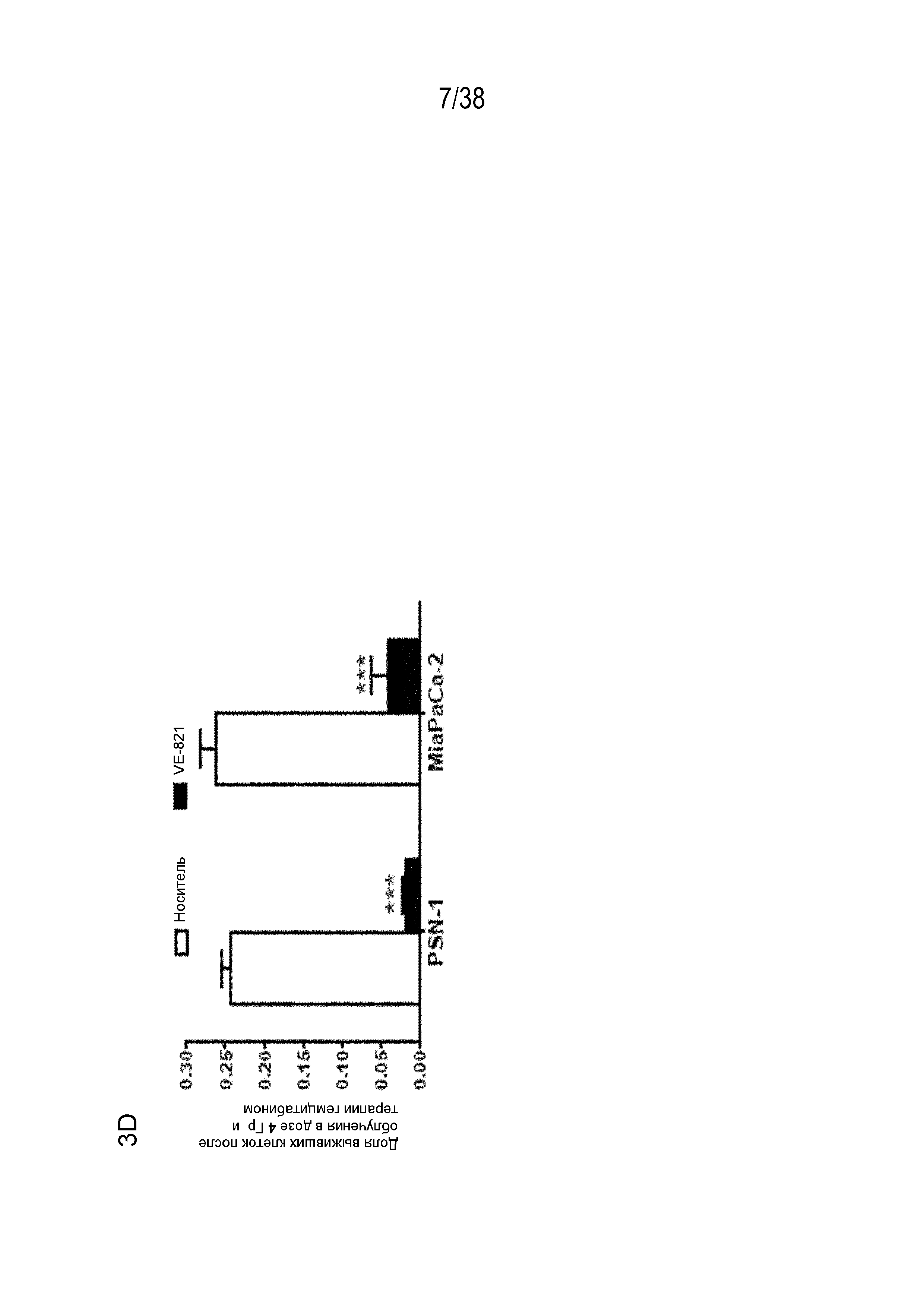
Фигура 3. VE-821 повышает чувствительность раковых клеток поджелудочной железы к терапии гемцитабином.
A) клоногенная выживаемость клеток, обработанных гемцитабином и 1 мкМ VE-821. Клетки обрабатывали возрастающими концентрациями гемцитабина в течение 24 час с последующей обработкой 1 мкМ VE-821 в течение 72 час. Через 10-21 суток оценивали способность к колониеобразованию.
B) клоногенная выживаемость клеток, обработанных гемцитабином в условиях гипоксии. Высеянные клетки переносили в условия гипоксии (0,5% O2) и оставляли для акклиматизации на 6 час. Затем клетки обрабатывали возрастающими концентрациями гемцитабина в течение 24 час с последующей обработкой 1 мкМ VE-821 в течение 72 час. Гипоксические клетки переносили в условия нормоксии через 1 час после прибавления VE-821.
C) клоногенная выживаемость после обработки 20 нМ гемцитабина и VE-821 в условиях насыщения кислородом и условиях гипоксии (0,5% O2), как описано выше.
D) клоногенная выживаемость клеток, обработанных гемцитабином и облучением. Клетки PSN-1b MiaPaCa-2 обрабатывали 5 нМ или 10 нМ гемцитабина соответственно, в течение 24 час, затем среду заменяли и прибавляли 1 мкМ VE-821 в период от 1 час до облучения в дозе 4 Гр до 72 час после облучения в дозе 4 Гр. Через 10-21 суток оценивали способность к колониеобразованию (n=3). *, P<0,05; **, P<0,01; ***, P<0,001 по сравнению с контрольным образцом, обработанным ДМСО.
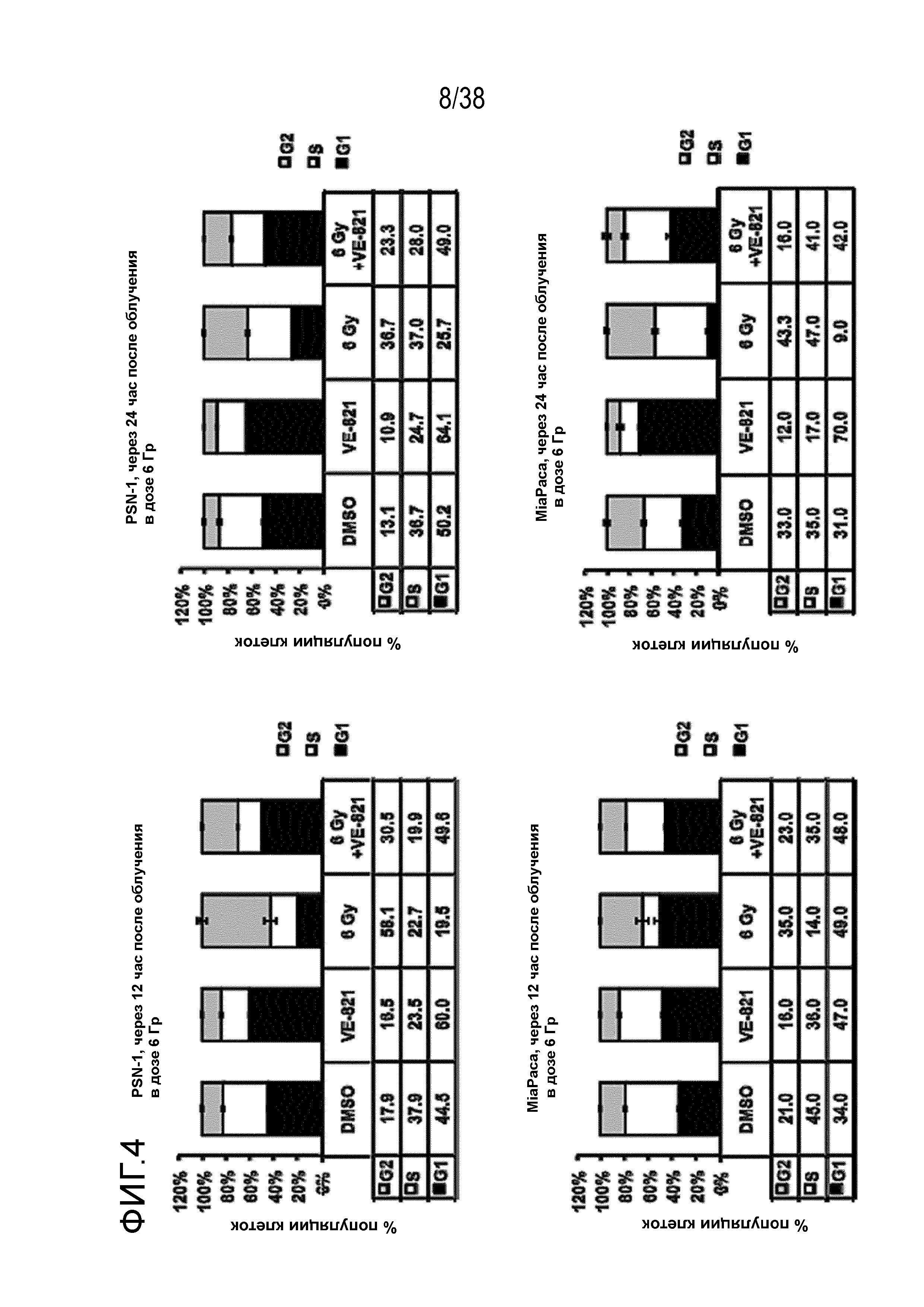
Фигура 4. VE-821 нарушает обусловленную облучением сверочную точку клеточного цикла в клетках рака поджелудочной железы.
За 1 час до облучения в дозе 6 Гр прибавляли VE-821 (1 мкМ) и оставляли на протяжении всего эксперимента. Клетки поднимали и фиксировали через 12 час или 24 час после облучения, окрашивали пропидиум иодидом и проводили анализ распределения клеток по фазам клеточного цикла методом проточной цитометрии (n=3)
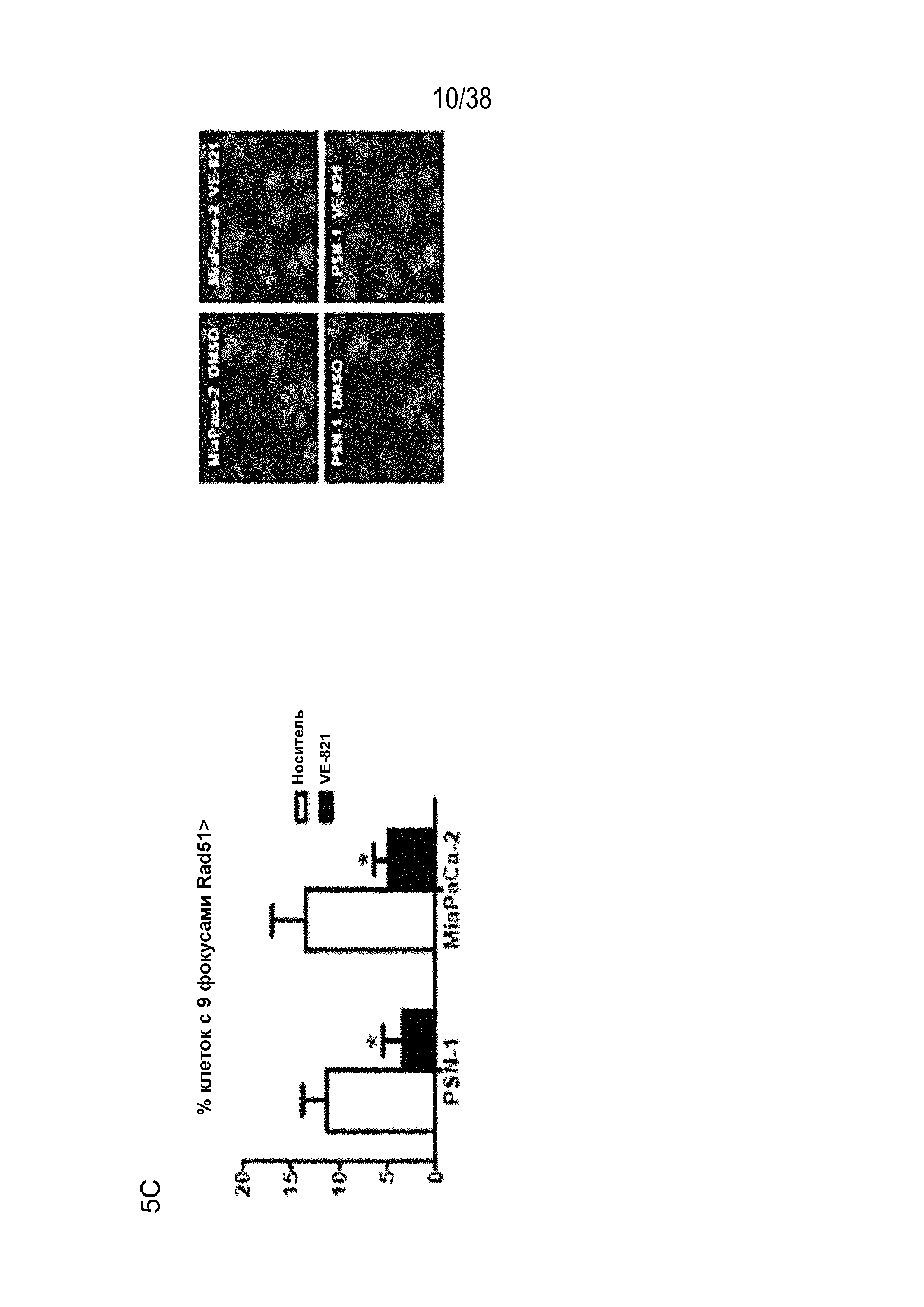
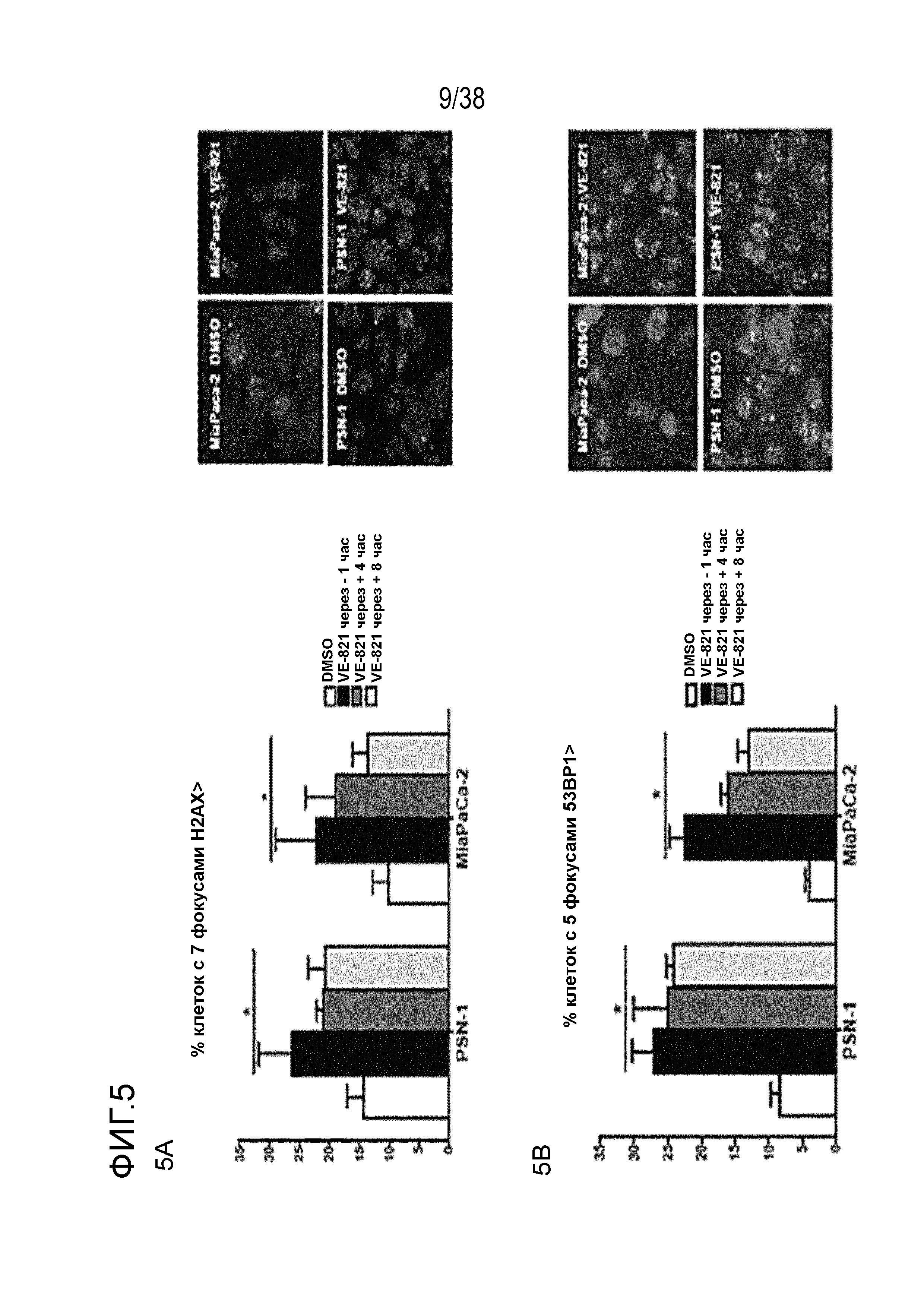
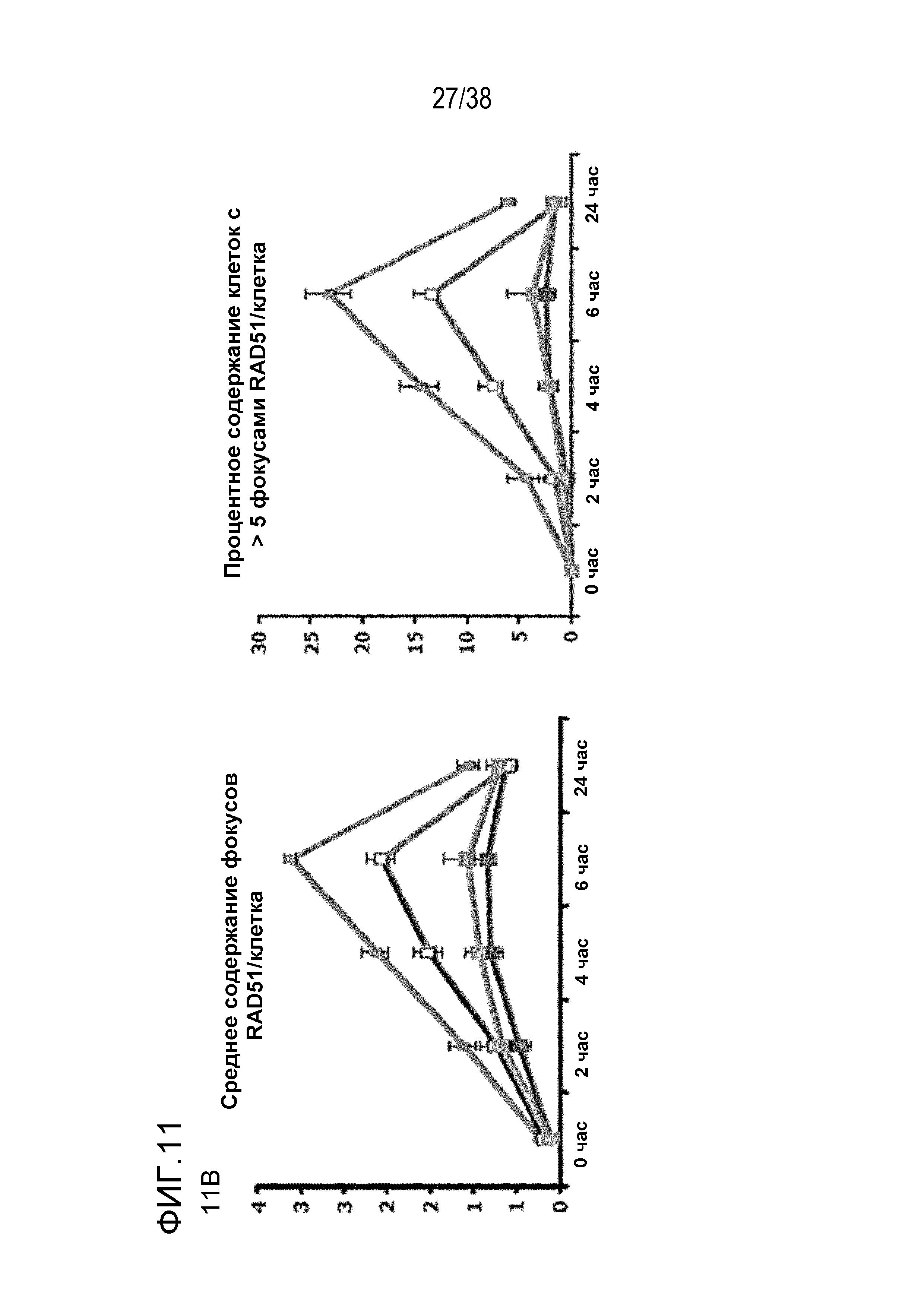
Фигура 5. VE-821 увеличивает количество фокусов 53BP1 и γΗ2ΑΧ и снижает формирование фокусов RAD51.
Клетки обрабатывали 1 мкМ VE-821 в различные моменты времени по отношению к облучению в дозе 6 Гр, как указано, и фиксировали через 24 час после облучения. Затем клетки окрашивали для выявления фокусов (Α) γΗ2ΑΧ и (В) 53BP1 и подсчитывали процентное содержание клеток, содержащих более 7 и 5 фокусов на одну клетку соответственно. Для проведения анализа образования фокусов Rad51 клетки фиксировали через 6 час после облучения и подсчитывали процентное содержание клеток, содержащих более 9 фокусов на одну клетку. Справа представлены репрезентативные изображения (n=3). *, P<0,05
Дополнительные фигуры.
фиг 6. Действие времени инкубации VE-821 на эффективность посева.
Клетки PSN-1 высевали как единичные клетки, обрабатывали 1 мкМ VE-821 через различные временные периоды и оценивали колониеобразование через 10 суток.
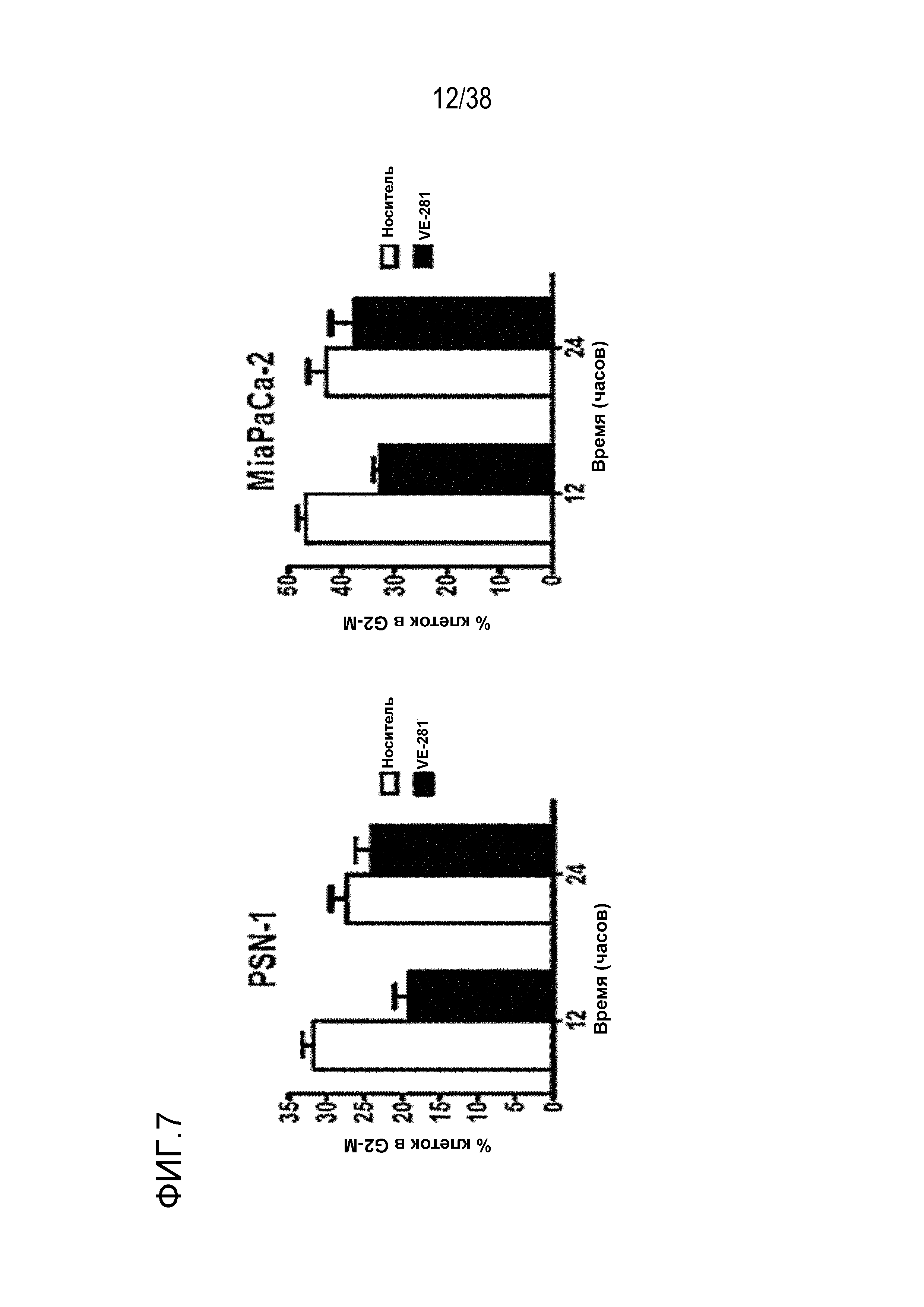
фиг. 7.
VE-821 нарушает сверочные точки G2/M, обусловленные облучением, в клетках рака поджелудочной железы в условиях гипоксии.
Клетки были проинкубированы в условиях гипоксии (0,5% O2) в течение 6 час, и за 1 час до облучения в дозе 6 Гр прибавляли 1 мкМ VE-821. Клетки переносили в условия нормоксии через 1 час после облучения и поднимали и фиксировали через 12 час или 24 час после облучения, окрашивали пропидиум иодидом и проводили анализ распределения клеток по фазам клеточного цикла методом проточной цитометрии (n=3).
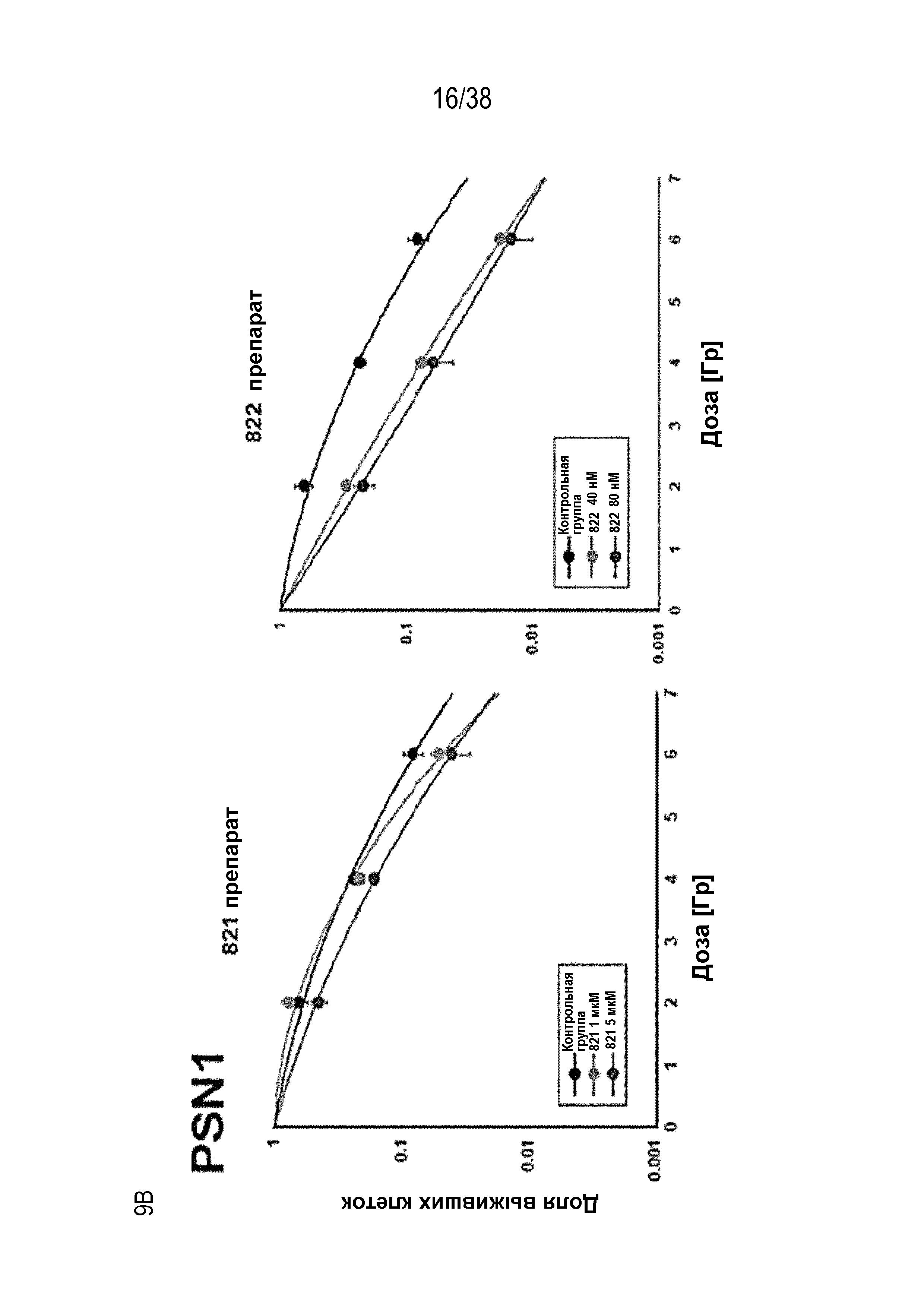
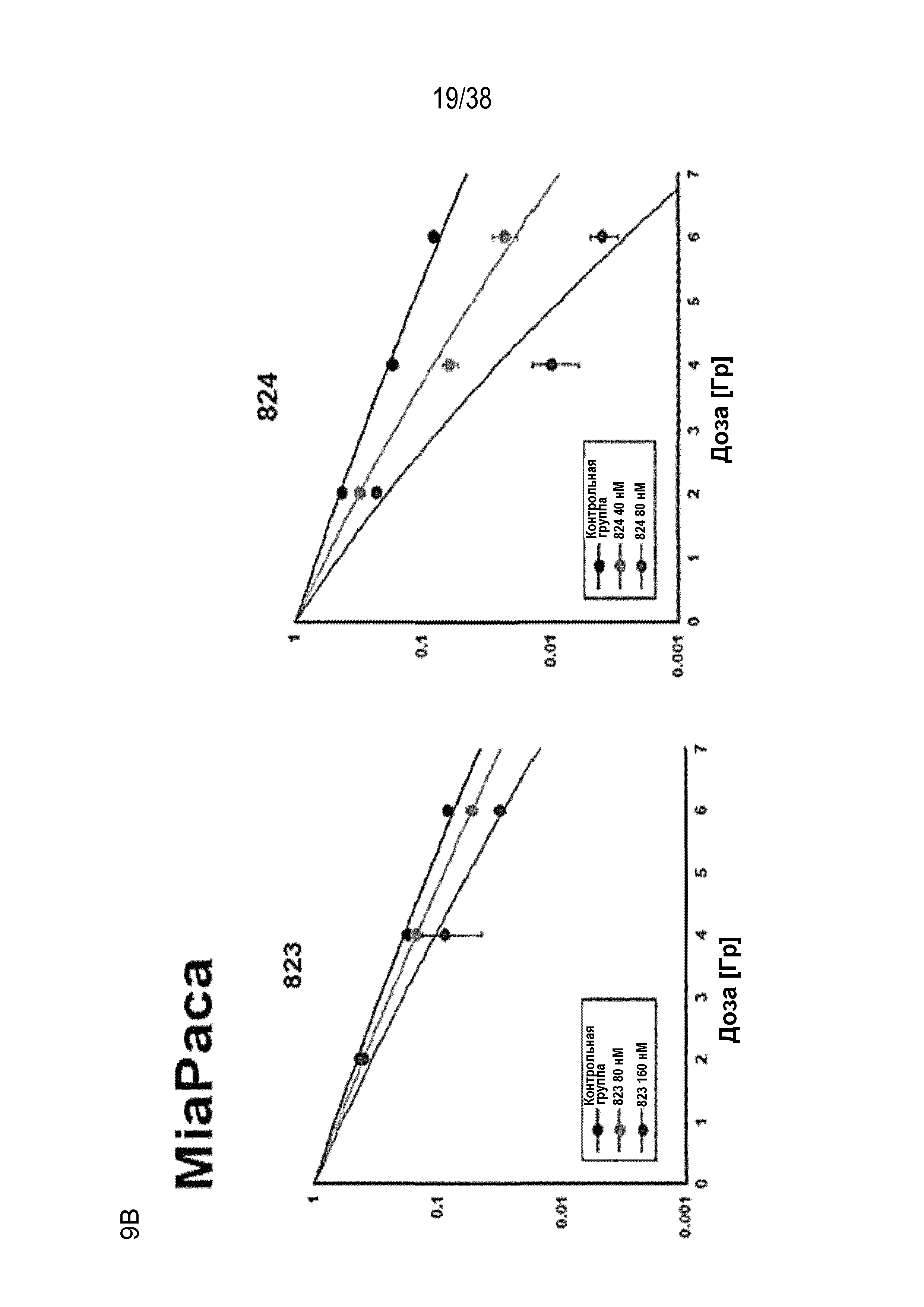
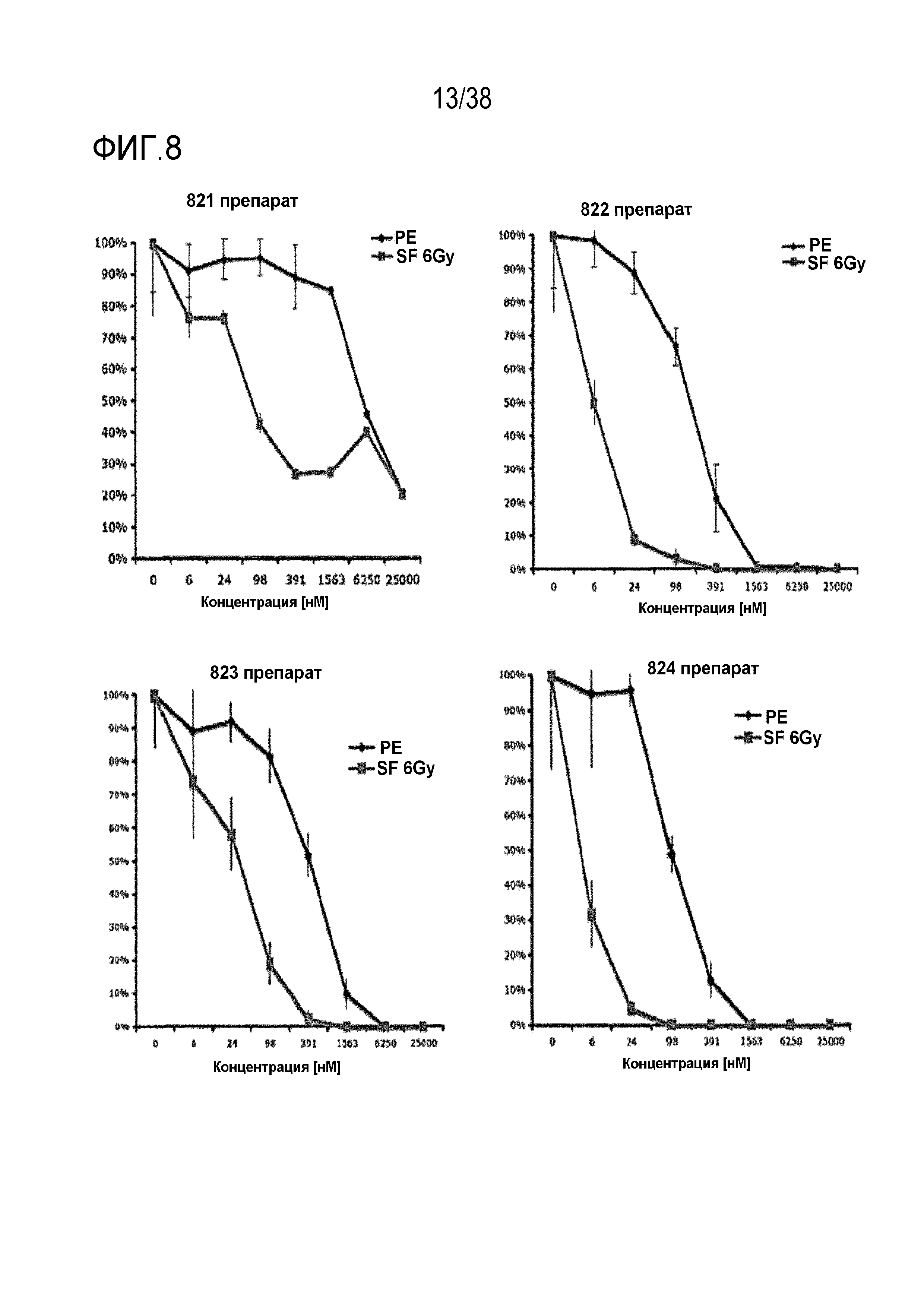
Фиг. 8. Зависимость доза - ответ для радиосенсибилизации, обусловленной соединениями 821, 822, 823 и 824.
Проводили мелкомасштабную оценку клоногенной выживаемости клеток HeLa, обработанных различными ингибиторами ATR в возрастающих концентрациях с последующим облучением в дозе 6 Гр. По данным строили график как снижение клоногенной выживаемости относительно клеток, обработанных ДМСО, как для облученных клеток (SF 6 Гр, линия розового цвета), так и не облученных клеток (эффективность посева, PE; линия синего цвета). Можно отметить высокую степень увеличения радиосенсибилизации, поскольку значительное снижение выживаемости после облучения сопровождалось незначительным снижением выживаемости необлученных клеток при определенных концентрациях препарата.
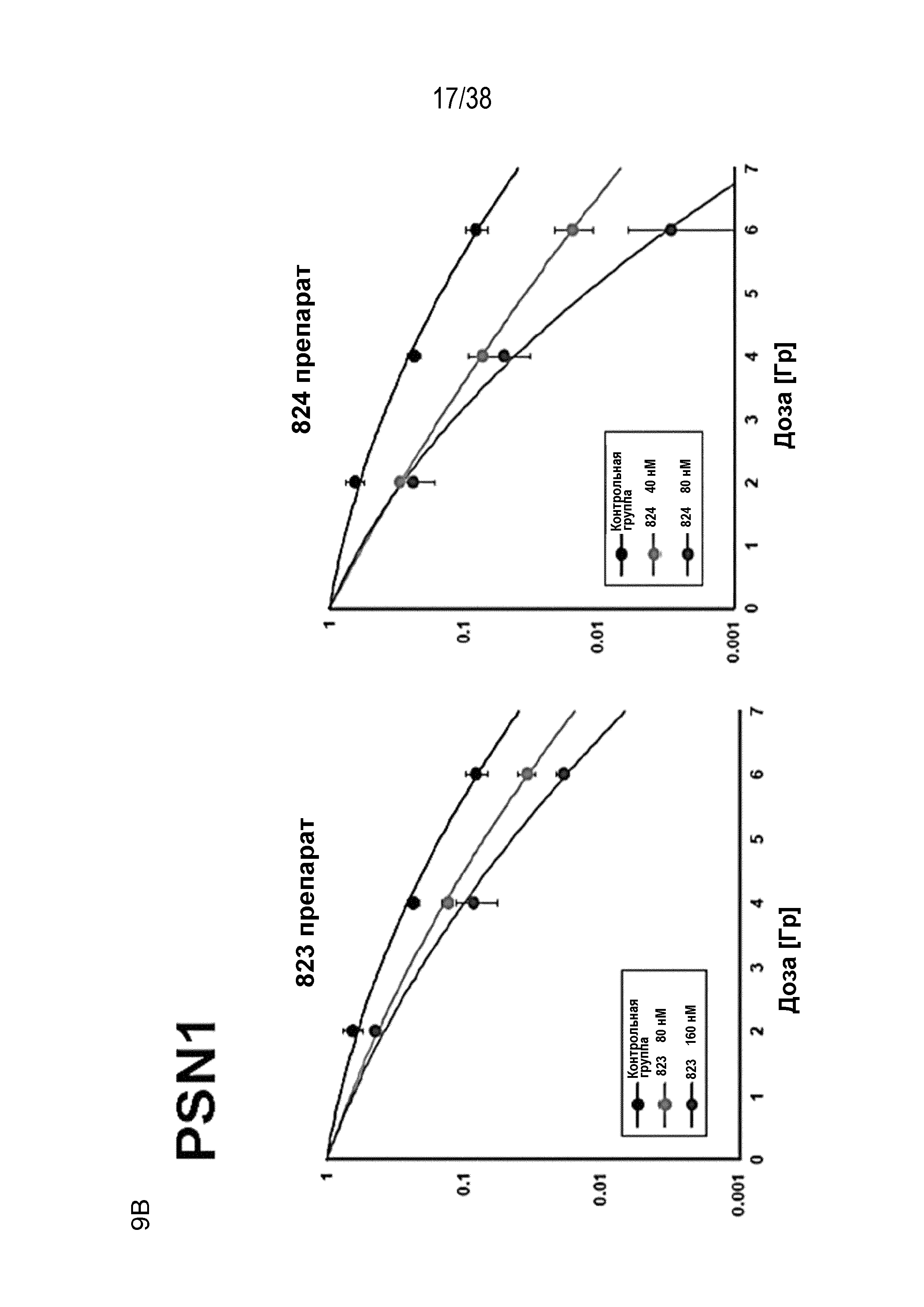
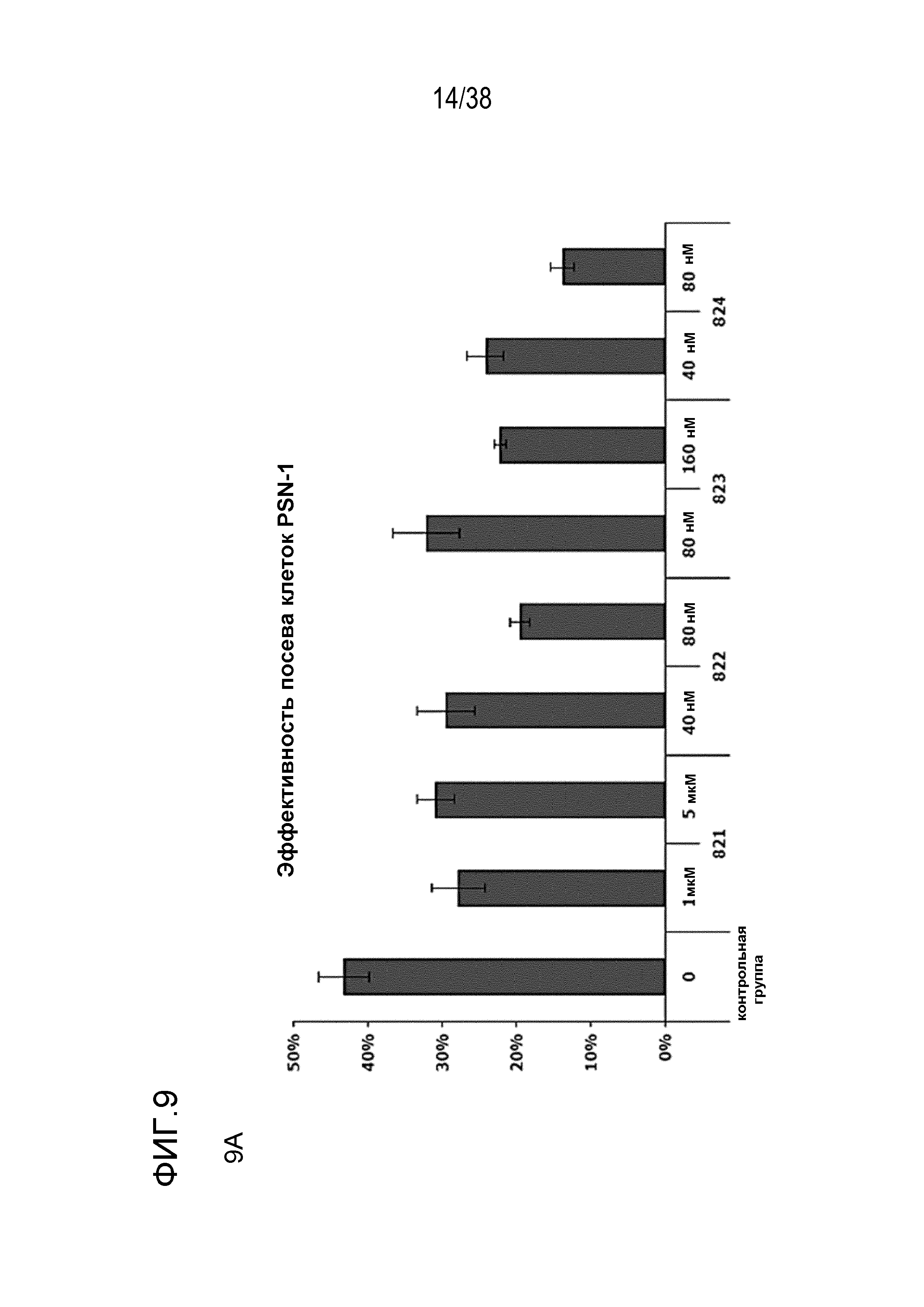
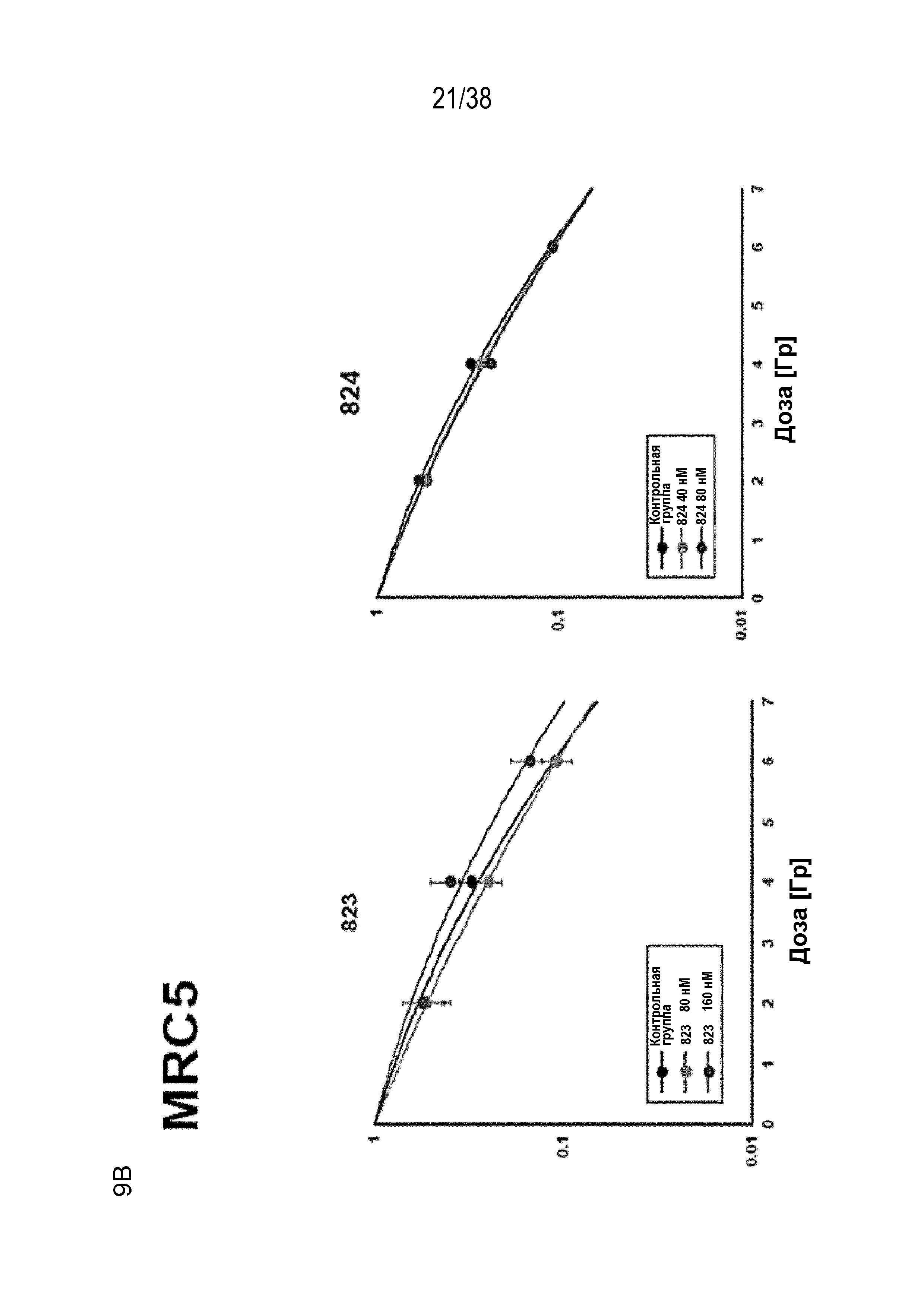
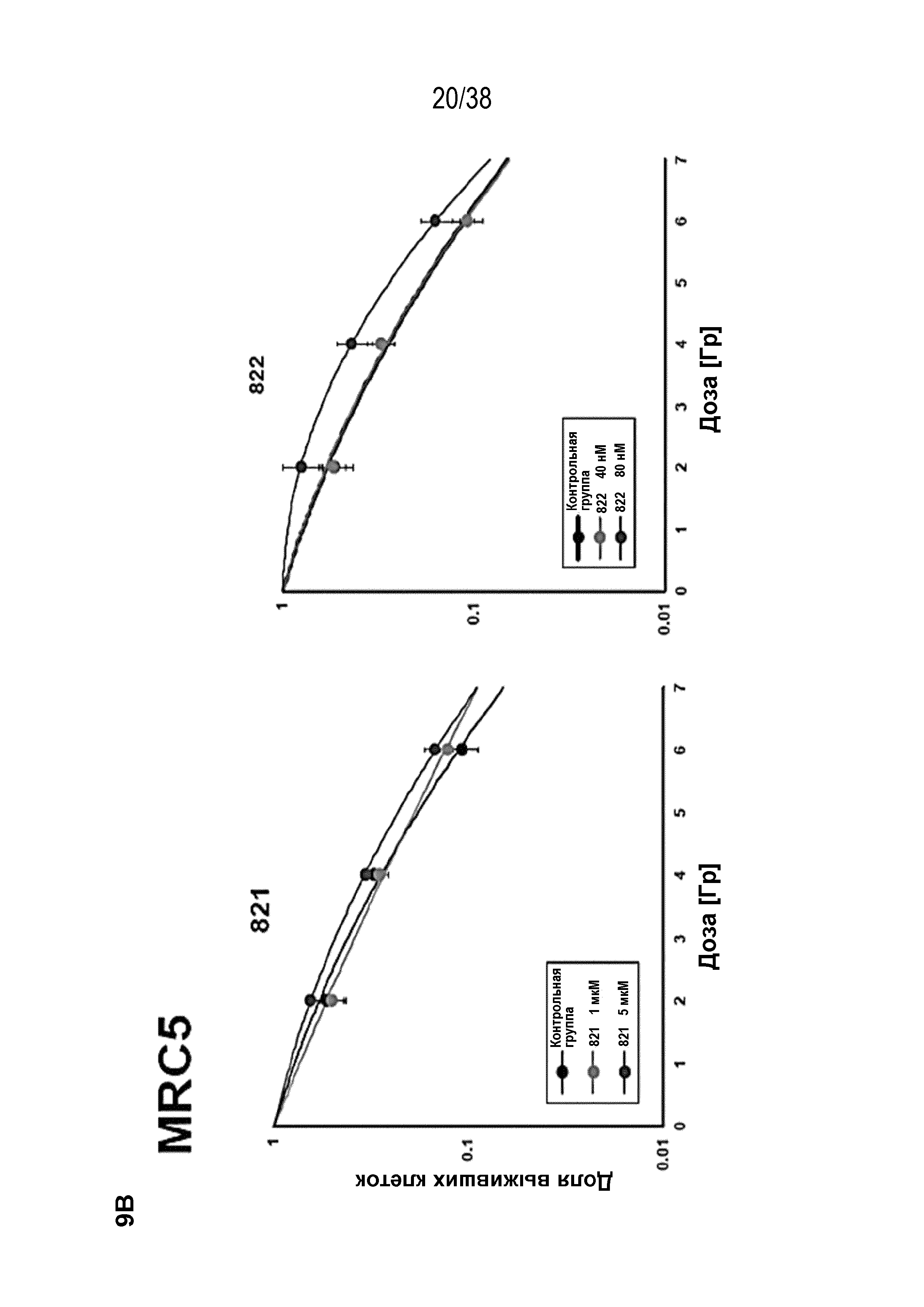
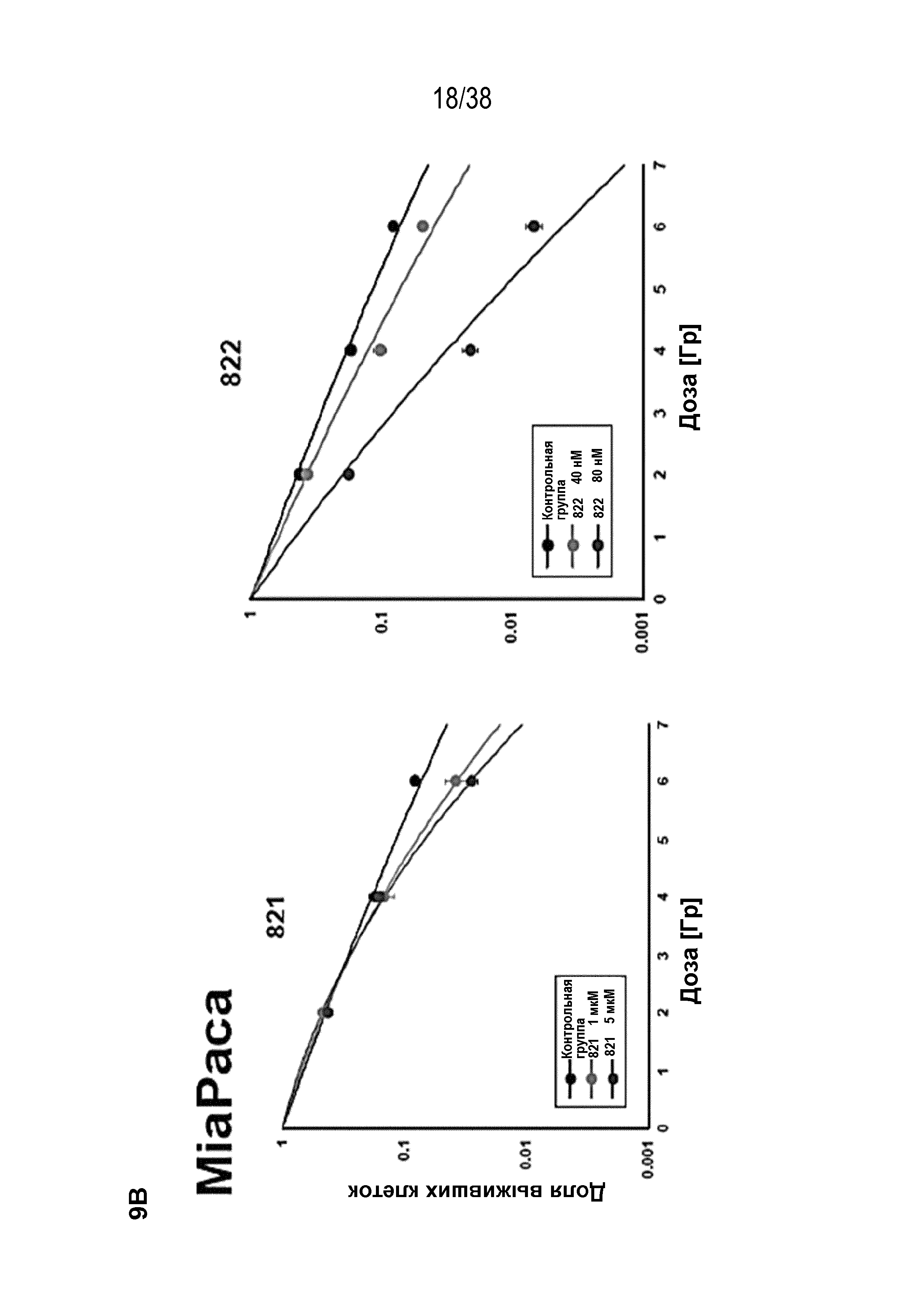
Фиг. 9. Оценка радиосенсибилизации в опухолевых клетках и нормальных клетках.
A) Клоногенная выживаемость после обработки препаратом в отсутствие облучения. Высевали клетки PSN1 и MiaPaca с низкой плотностью, обрабатывали указанными препаратами и оценивали клоногенную выживаемость.
B) Клоногенная выживаемость клеток PSN1, MiaPaca и MRC5, предварительно обработанных лекарственными соединениями 821, 822, 823 и 824 с последующим облучением. Высевали клетки с низкой плотностью, обрабатывали указанными препаратами и оценивали клоногенную выживаемость за 1 час до облучения.
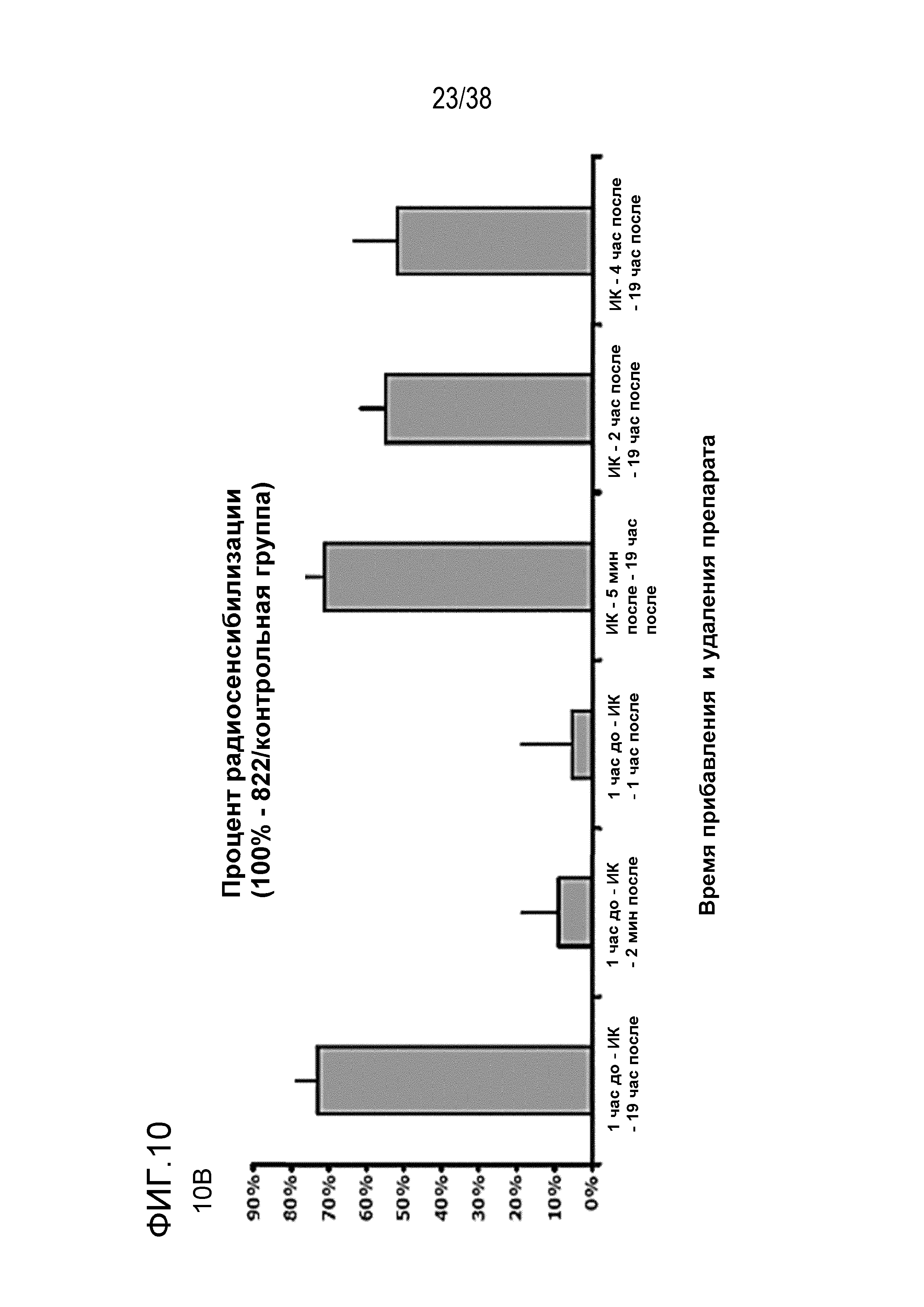
Фиг. 10. Оценка зависимости радиосенсибилизации от времени прибавления и удаления препарата.
Клетки MiaPaca высевали с низкой плотностью и прибавляли препарат в различные моменты времени по отношению к времени обработки облучением в дозе 4 Гр: за 1 час до ИК-терапии, 5 мин после ИК-терапии, через 2 час или 4 час после ИК-терапии; и удаляли в различные моменты времени: через 5 мин после, через 1 час после или через 19 час после ИК-терапии. Клоногенную выживаемость оценивали через 14 суток. Результаты показаны как доля выживших клеток при дозе 4 Гр (верхнее поле) (фиг. 10A) или процент радиосенсибилизации (среднее поле) (фиг. 10B) по сравнению с клетками, обработанными ДМСО. Разные временные режимы обработки не вызывали различий в эффективности посева (нижнее поле) (фиг. 10C).
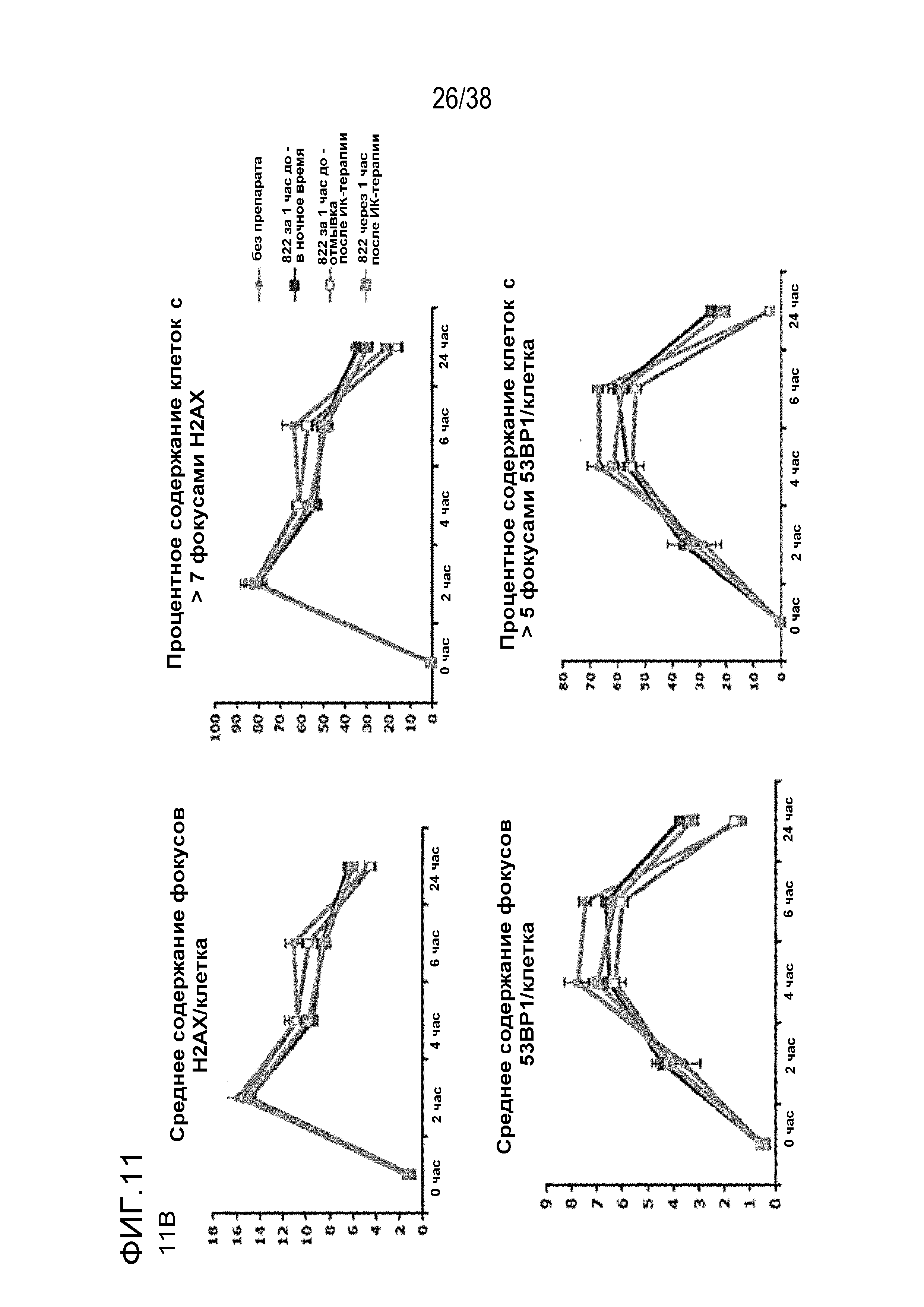
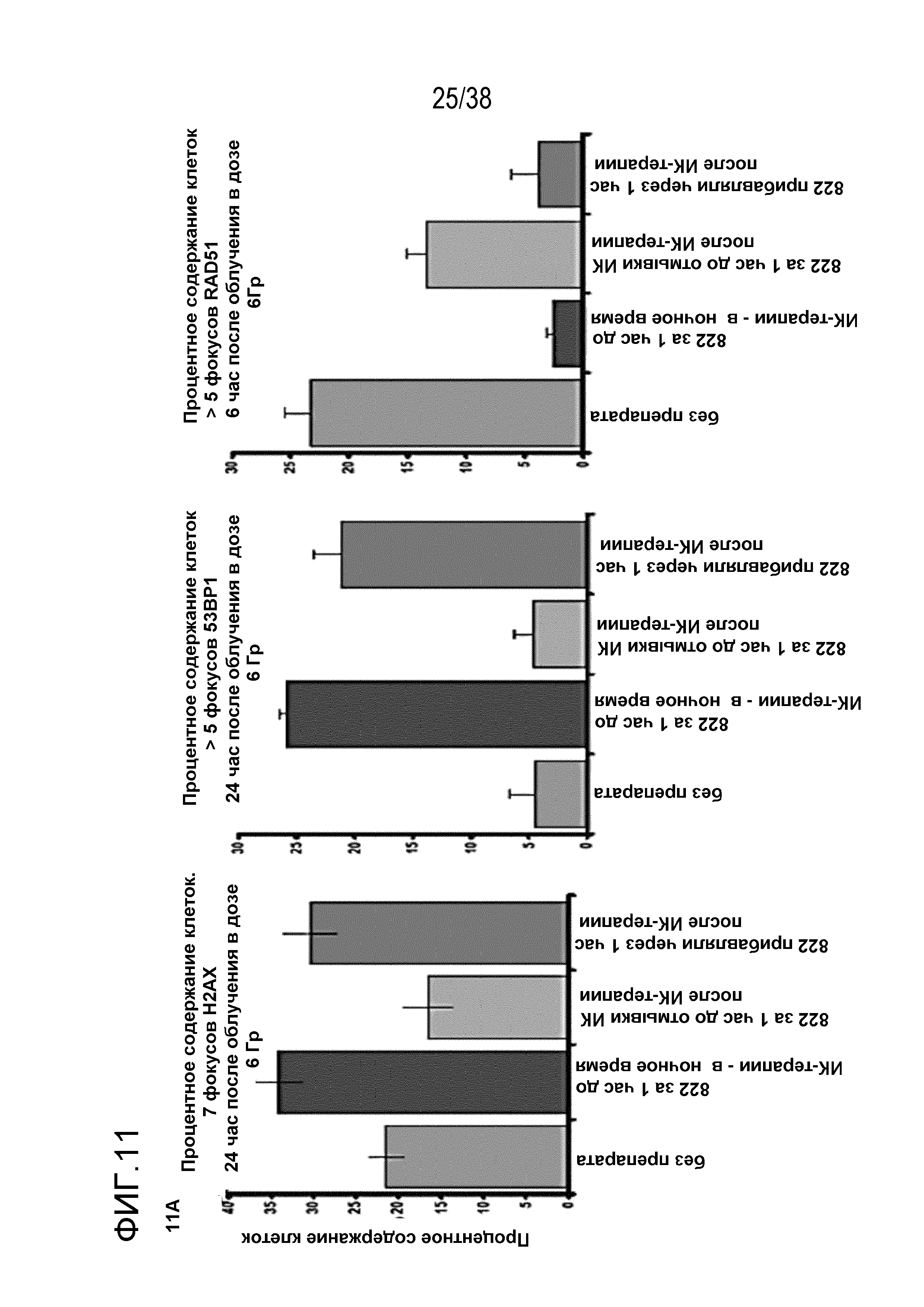
Фиг. 11. Анализ повреждения ДНК после обработки соединением 822 и облучения.
A) Оценка фокусов gH2AX, 53BP1 через 24 час после ИК-терапии в дозе 6 Гр и фокусов RAD51 через 6 час после ИК-терапии. Клетки MiaPaca обрабатывали 80 нМ соединения 822 за 1 час или через 1 час после облучения, препарат вымывали через 5 мин после или 1 час после ИК-терапии. Клетки фиксировали через 6 час (для фокусов RAD51) или через 24 час (для фокусов gH2AX и 53BP1). Подсчитывали процентное содержание клеток, содержащих более определенного количества фокусов.
B) Период действия фокуса повреждения ДНК. Клетки обрабатывали, как описано в пункте A, и фиксировали в указанные моменты времени с последующим окрашиванием для выявления фокусов gH2AX, 53BP1 и RAD51. Данные представлены как среднее количество фокусов в определенный момент времени (верхние поля) или процент клеток, содержащих более определенного количества фокусов (нижние поля).
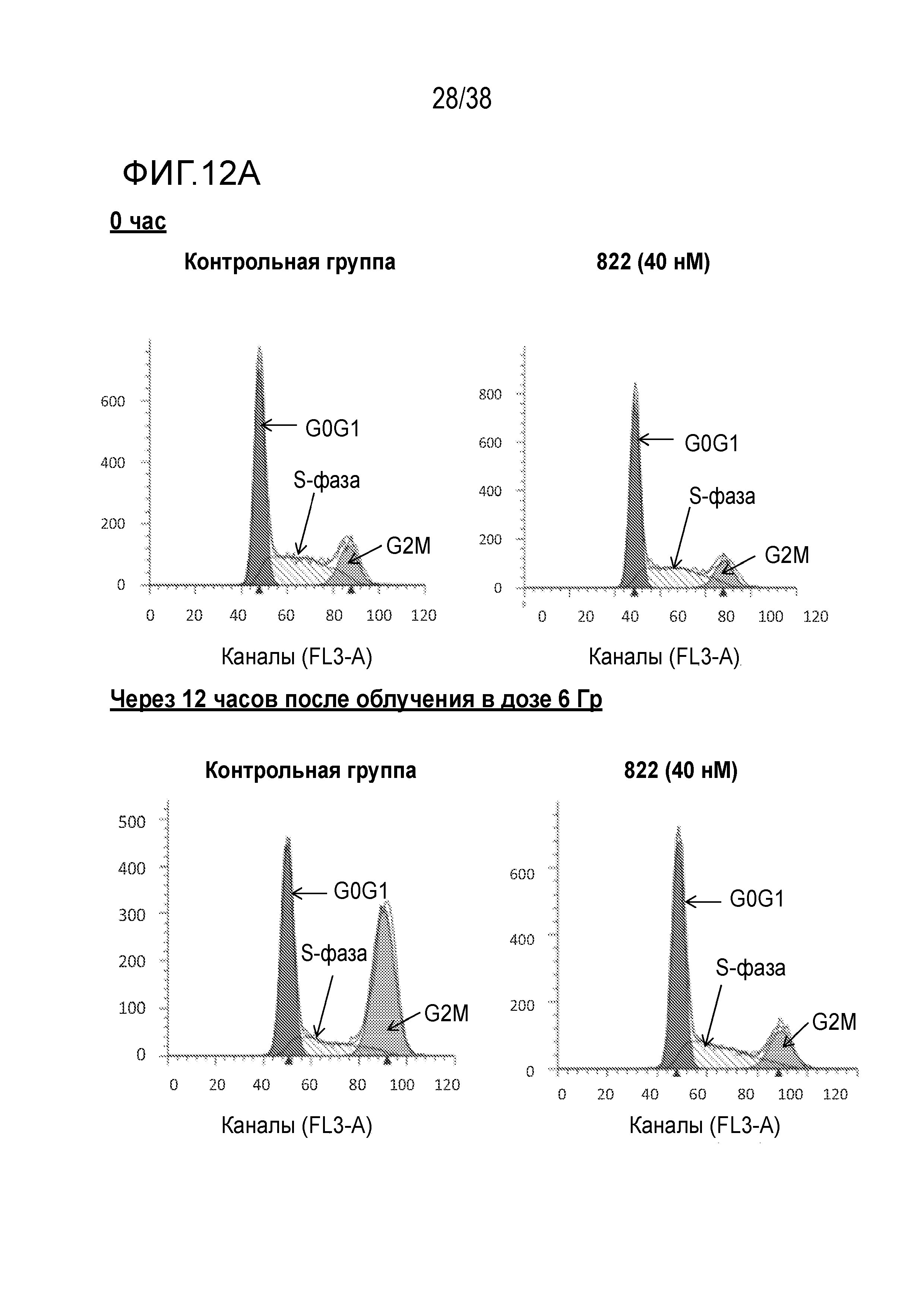
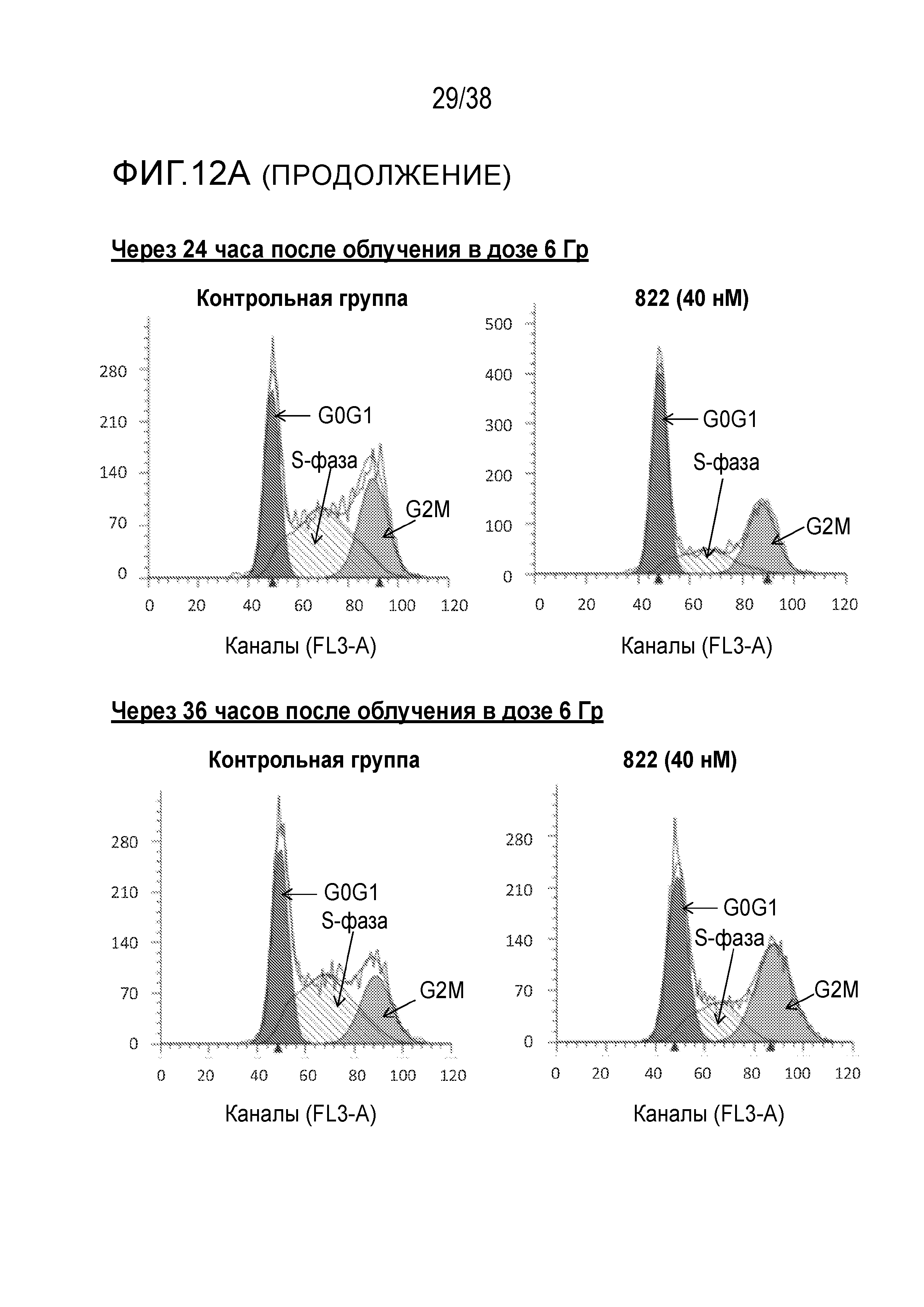
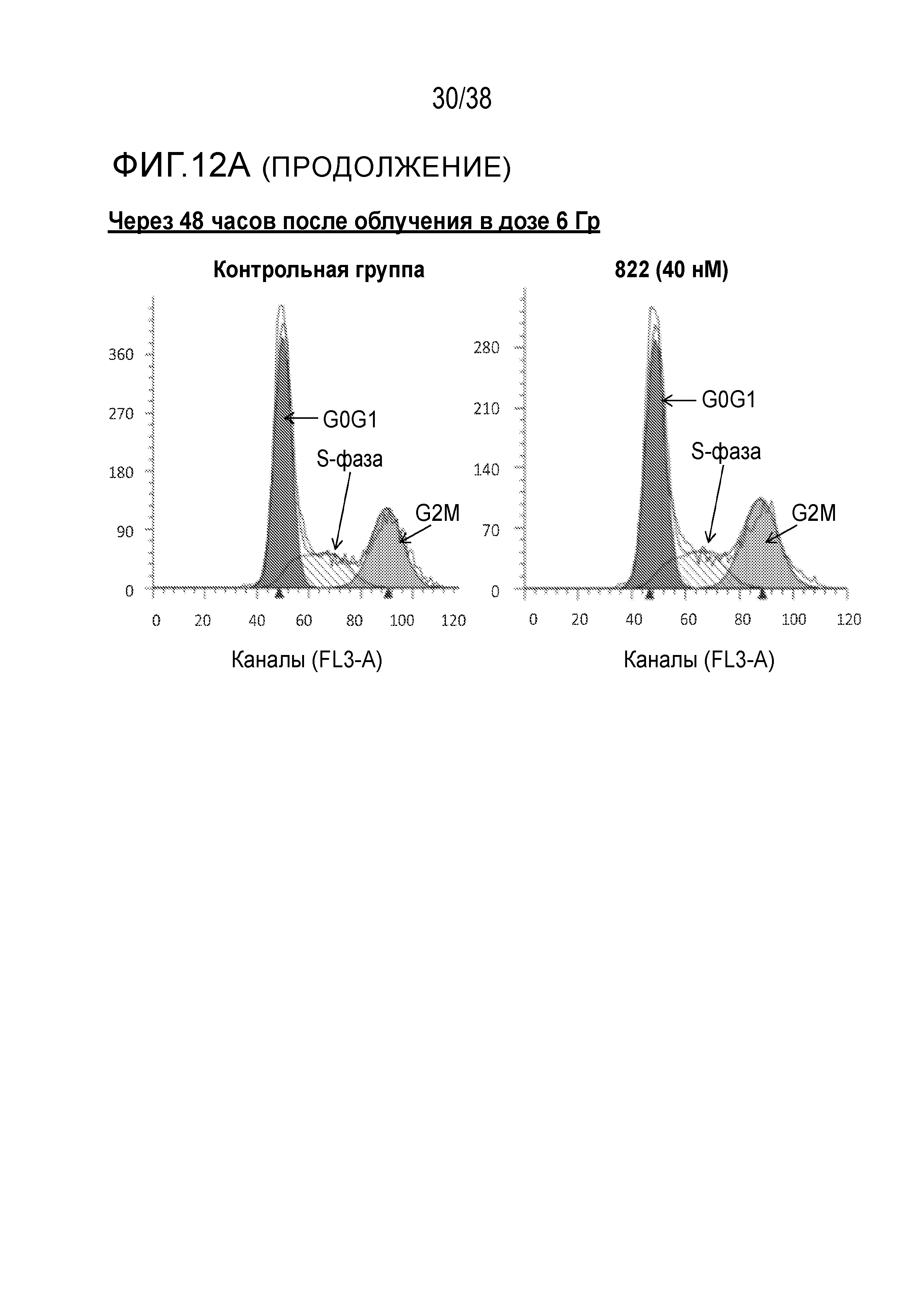
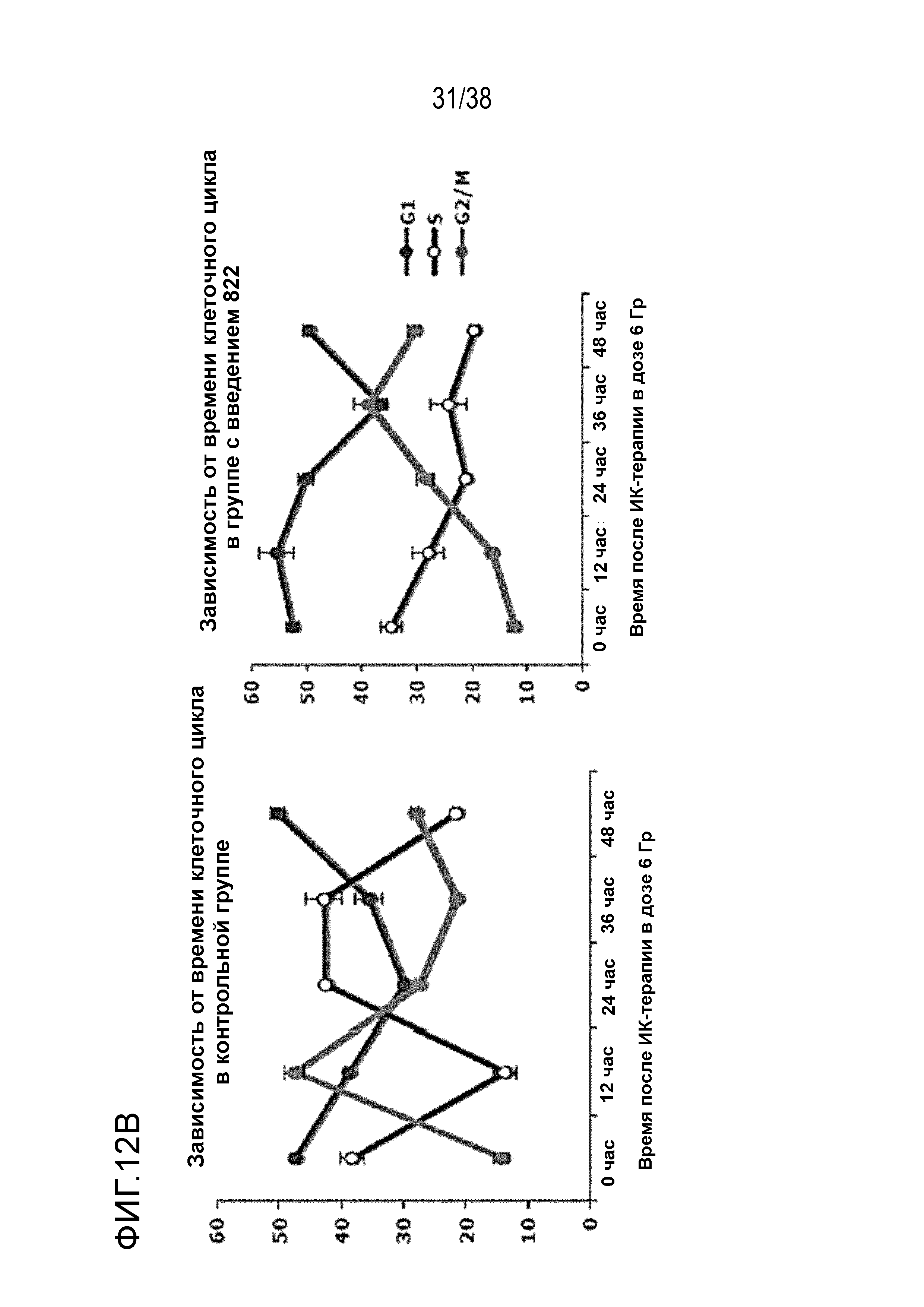
Фиг. 12. Анализ клеточного цикла клеток, обработанных соединением 822 после облучения в дозе 6 Гр.
Клетки PSN1 обрабатывали 40 нМ соединения 822 за один час до облучения в дозе 6 Гр в трех лунках. Клетки поднимали и фиксировали в нескольких моментах времени после ИК-терапии, окрашивали пропидиум иодидом и проводили анализ методом проточной цитометрии.
A) Гистограммы клеточного цикла. Согласующиеся пики окрашены красным цветом для фазы G1, затенены для фазы S и окрашены зеленым цветом для фазы G2/M. Для каждого момента времени и вида обработки показана одна из трех лунок.
B) Средний процент клеточного цикла в зависимости от времени. Процентные значения клеточного цикла были получены из согласующихся гистограмм (n=3), графики были построены для контрольных клеток и клеток, обработанных соединением 822.
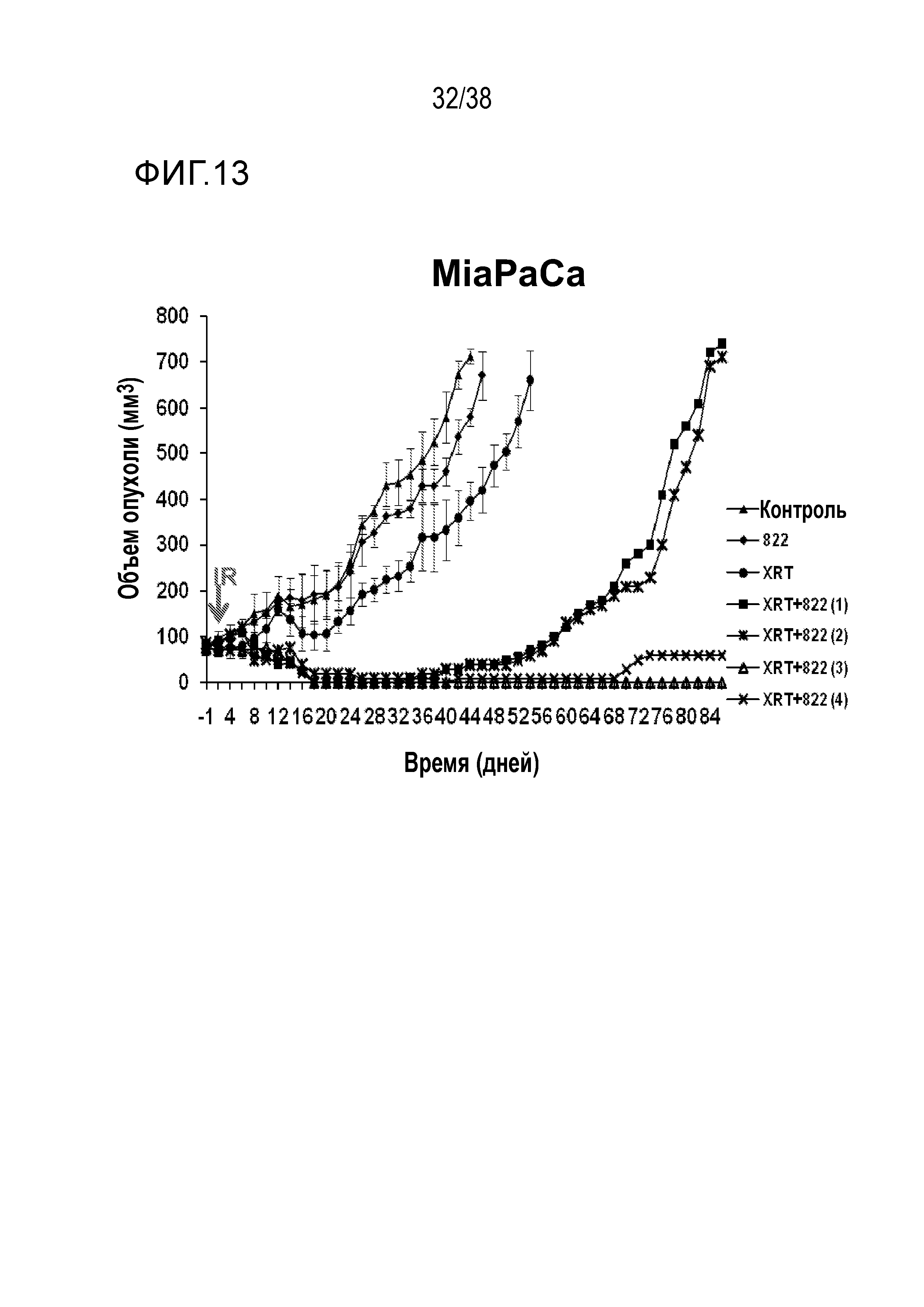
Фигура 13. Объем опухоли MiaPaCa в зависимости от времени для соединения 822.
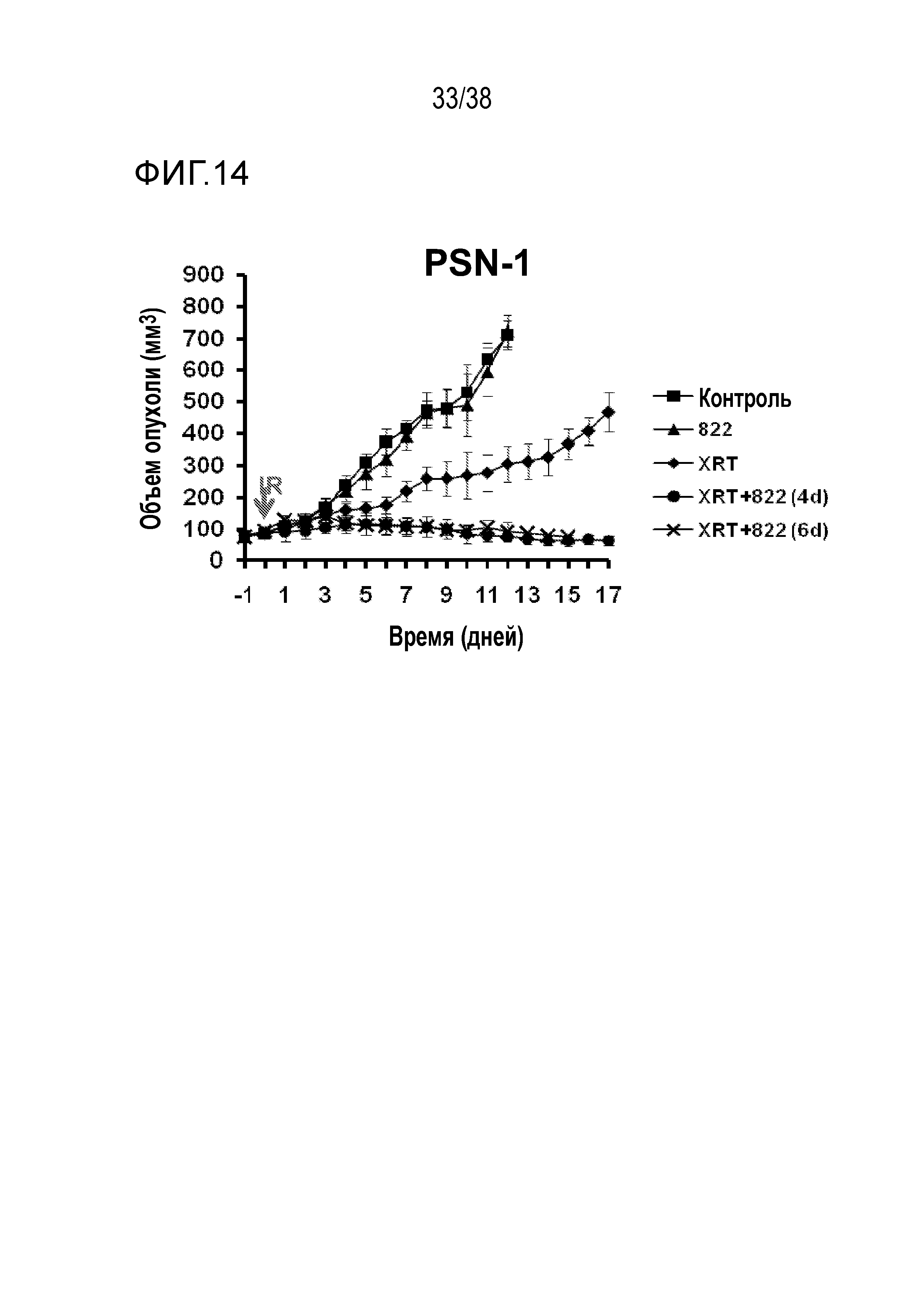
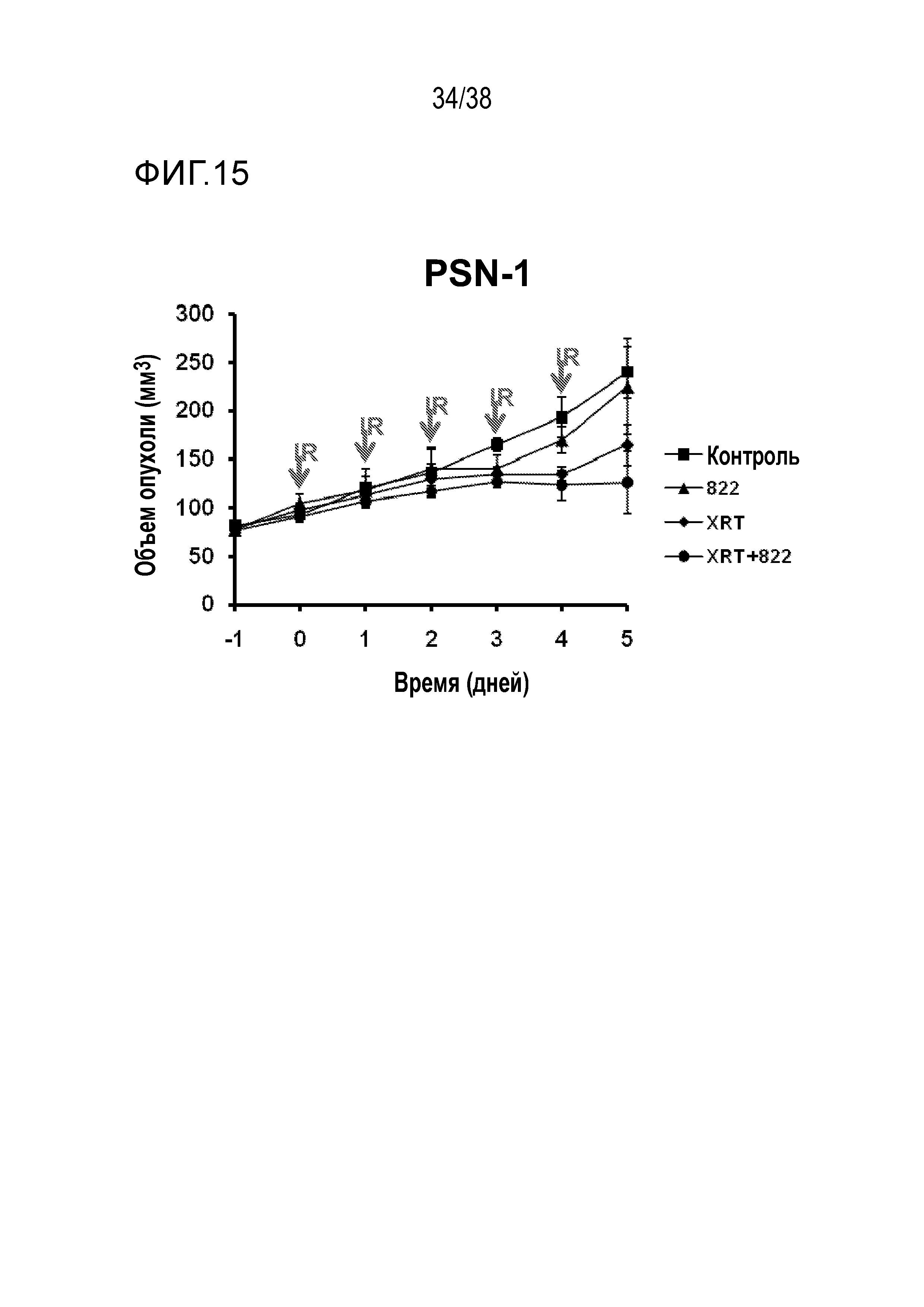
Фигуры 14 и 15. Объем опухоли PSN-1 в зависимости от времени для соединения 822.
Фигура 16. Тест клеток рака легких: При взаимодействии с препаратами химиотерапии VE-822 усиливает воздействие при тестировании панели клеточных линий рака легкого при оценке жизнеспособности клеток легкого.
Фигура 17. Тест клеток рака легких: При взаимодействии с препаратами химиотерапии VE-822 усиливает более чем 3 раза воздействие на клеточные линии рака легкого при оценке жизнеспособности клеток.
Фигура 18. Тест клеток рака поджелудочной железы: При взаимодействии с цисплатином и гемцитабином VE-822 усиливает воздействие на клеточные линии рака поджелудочной железы при оценке жизнеспособности клеток.
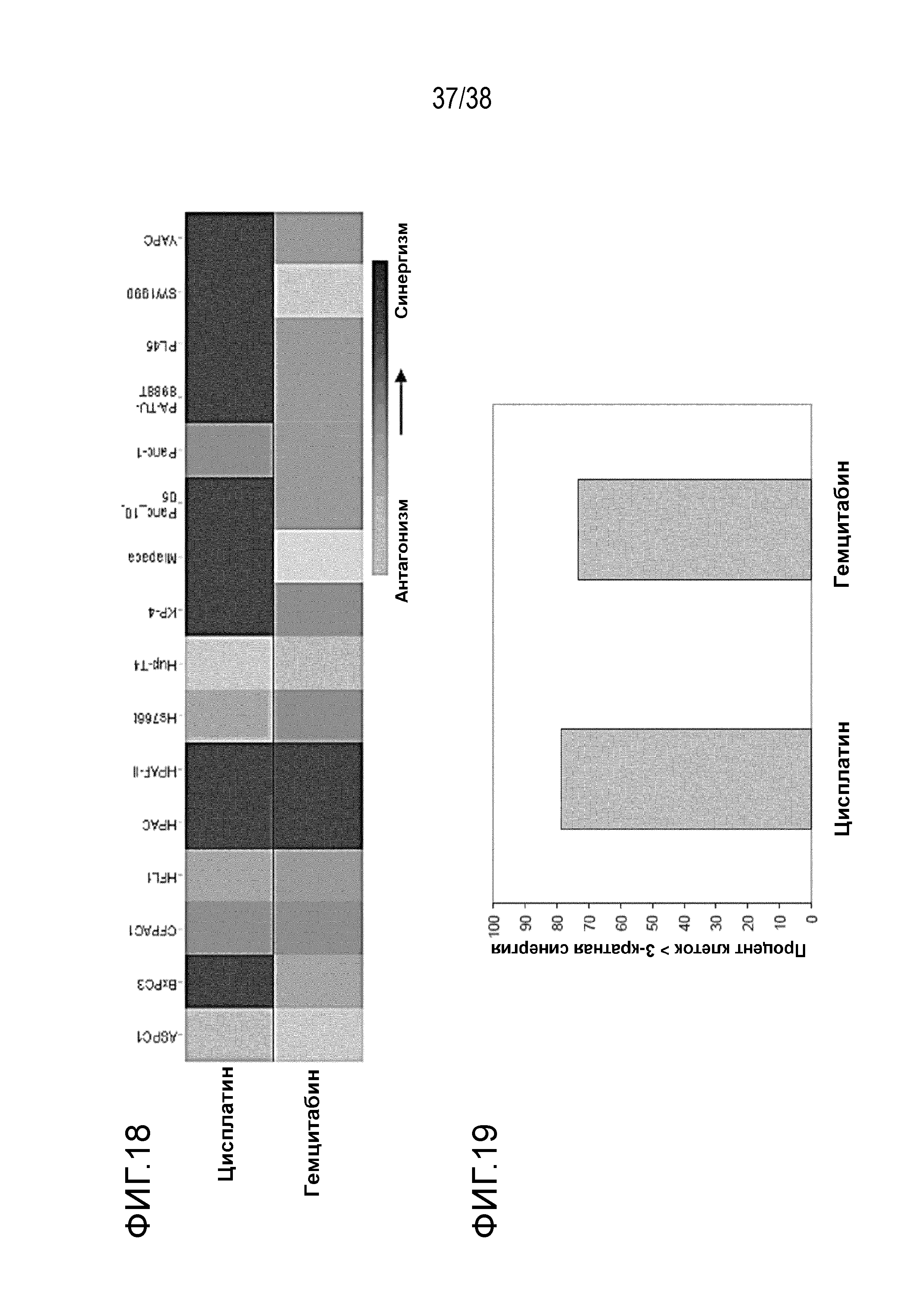
Фигура 19. Тест клеток рака поджелудочной железы: При взаимодействии с препаратами химиотерапии VE-822 усиливает более чем раза воздействие на клеточные линии рака поджелудочной железы при оценке жизнеспособности клеток.
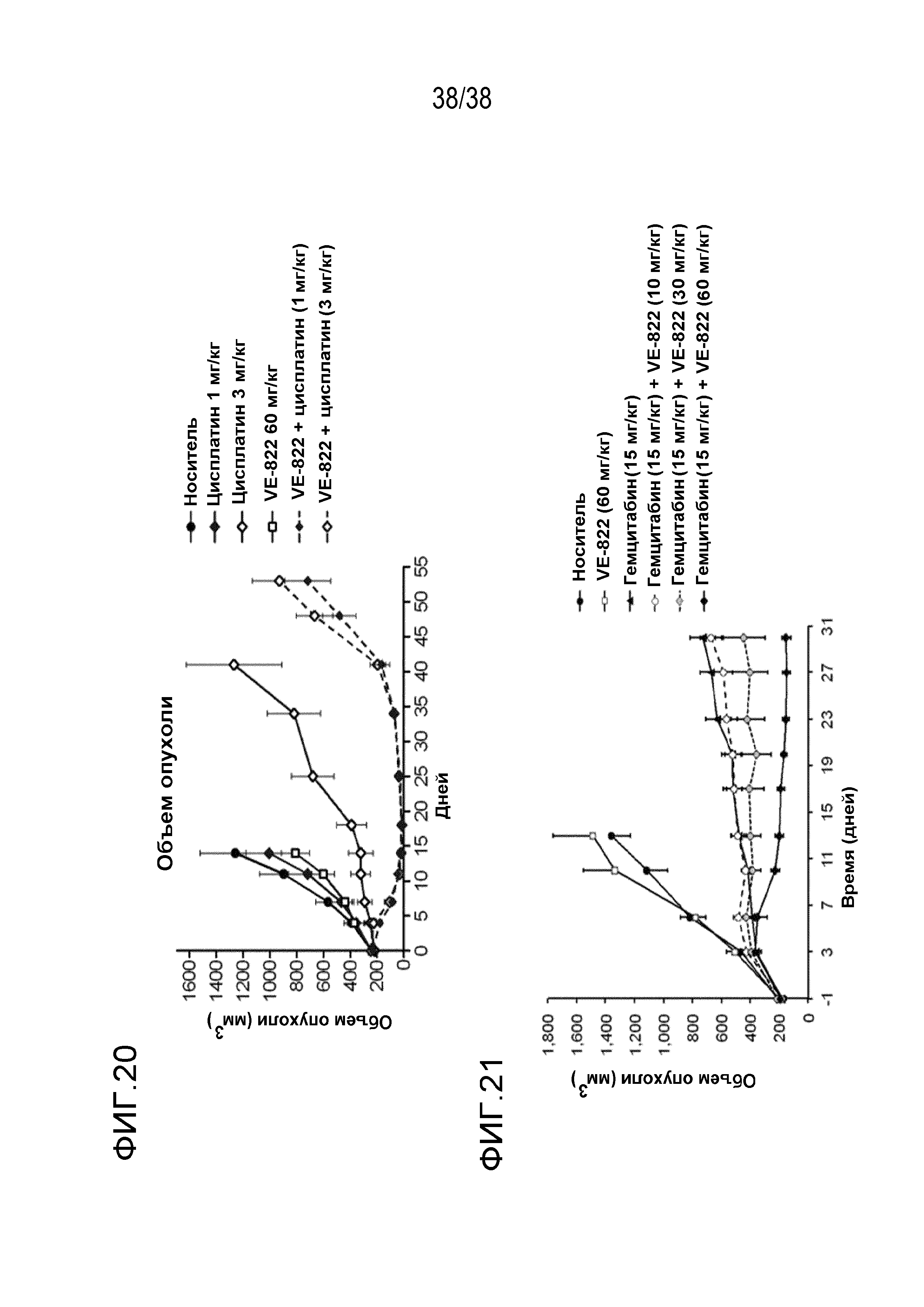
Фигура 20. Действие VE-822 и цисплатина на объем опухоли и массу тела у мышей линии SCID с ксенотрансплататом первичной аденокарциномы легкого НМРЛ.
Фигура 21: Действие VE-822, вводимого перорально через день в дозе 10, 30 или 60 мг/кг в сочетании с гемцитабином (15 мг/кг, в/б, каждые 3 дня), на объем опухоли у мышей с ксенотрансплантатами клеток рака поджелудочной железы PSN1.
Подробное описание изобретения
В одном аспекте этого изобретения представлены способы лечения рака поджелудочной железы у пациента посредством введения пациенту ингибитора ATR в сочетании с другим известным видом лечения рака поджелудочной железы. Один аспект изобретения включает в себя введение ингибитора ATR в сочетании с гемцитабином. В некоторых вариантах осуществления рак поджелудочной железы содержит одну из следующих клеточных линий: PSN-1, MiaPaCa-2 или Panc-1. В соответствии с другим аспектом рак содержит линию клеток первичной опухоли Panc-М.
В другом аспекте изобретения представлены способы лечения рака (например, рака поджелудочной железы или немелкоклеточного рака легкого) у пациента посредством введения пациенту ингибитора ATR в сочетании с лучевой терапией.
В другом аспекте изобретения представлены способы лечения немелкоклеточного рака легкого у пациента посредством введения пациенту ингибитора ATR в сочетании с цисплатином или карбоплатином, этопозидом и/или ионизирующим излучением. Заявители продемонстрировали синергическое воздействие ингибиторов ATR в сочетании с цисплатином, этопозидом, гемцитабином, оксаплатином и иринотеканом в ходе оценки жизнеспособности на панели из 35 клеточных линий рака легкого человека, а также продемонстрировали это воздействие в испытаниях эффективности в условиях in vivo на мышиной модели рака легкого мыши в сочетании с цисплатином. Это изобретение также относится к использованию ингибиторов ATR в сочетании с цисплатином или карбоплатином, этопозидом и/или ионизирующим излучением для лечения немелкоклеточного рака легкого. Примеры ингибиторов ATR представлены в таблице 1 ниже:
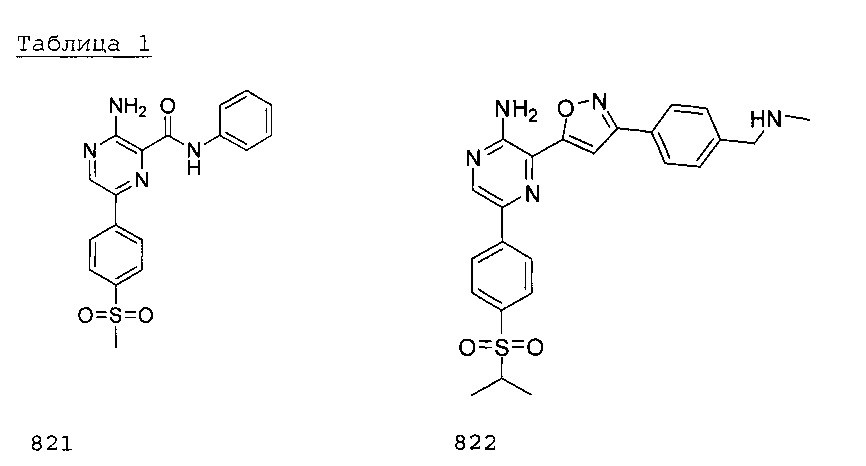
Термины, обозначающие соединения 821 и 822, используются взаимозаменяемо с терминами VE-821 и VE-822 соответственно.
В другом аспекте представлен способ лечения рака поджелудочной железы посредством введения в клетки рака поджелудочной железы ингибитора ATR, выбранного из соединения в таблице 1 в сочетании с одним или более видов противоопухолевой терапии. В некоторых вариантах осуществления ингибитор ATR применяется в сочетании с химиолучевой терапией, химиотерапией и/или лучевой терапией. Специалисту в данной области вполне понятно, что химиолучевая терапия означает способ лечения, включающий в себя как химиотерапию (такую как терапия гемцитабином), так и облучение. В некоторых вариантах осуществления химиотерапия представляет собой терапию гемцитабином.
В еще одном аспекте предложен способ повышения чувствительности клеток рака поджелудочной железы к противоопухолевой терапии, выбранной из гемцитабина или лучевой терапии, путем введения ингибитора ATR, выбранного соединения, описанного в таблице 1, в сочетании с противоопухолевой терапией.
В некоторых вариантах осуществления противоопухолевая терапия представляет собой терапию гемцитабином. В других вариантах осуществления противоопухолевая терапия представляет собой лучевую терапию. В еще одном варианте осуществления противоопухолевая терапия представляет собой химиолучевую терапию.
В другом аспекте представлен метод ингибирования фосфорилирования Chk1 (Ser 345) в клетках рака поджелудочной железы, содержащий введение ингибитора ATR, выбранного из соединения в таблице 1, в клетки рака поджелудочной железы после терапии гемцитабином (например, в дозе 100 нМ) и/или облучения (например, в дозе 6 Гр).
В другом аспекте представлен способ радиосенсибилизации гипоксических опухолевых клеток PSN-1, MiaPaCa-2 или PancM посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в опухолевые клетки в сочетании с лучевой терапией.
Еще в одном аспекте представлен способ повышения чувствительности гипоксических опухолевых клеток PSN-1, MiaPaCa-2 или PancM посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в опухолевые клетки в сочетании с терапией гемцитабином.
В другом аспекте представлен способ повышения чувствительности опухолевых клеток PSN-1 и MiaPaCa-2 к химиолучевой терапии посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в опухолевые клетки в сочетании с химиолучевой терапией.
В другом аспекте представлен способ прерывания клеточного цикла, обусловленного повреждением, в сверочных точках посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в клетки рака поджелудочной железы в сочетании с лучевой терапией.
В другом аспекте предложен способ ингибирования репарации поврежденной ДНК посредством гомологичной рекомбинации в клетке рака поджелудочной железы посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в сочетании с одной или более из следующих видов терапии: химиолучевая терапия, химиотерапия и лучевая терапия.
В некоторых вариантах осуществления химиотерапия представляет собой терапию гемцитабином.
В другом аспекте предложен способ ингибирования репарации поврежденной ДНК посредством гомологичной рекомбинации в клетке рака поджелудочной железы посредством введения ингибитора ATR, выбранного из соединения в таблице 1, в сочетании с гемцитабином или лучевой терапией.
В некоторых вариантах осуществления клетки рака поджелудочной железы получены из линии клеток поджелудочной железы, выбранной из PSN-1, MiaPaCa-2 или Panc-1.
В других вариантах осуществления клетки рака поджелудочной железы находятся в организме онкологического больного. В других вариантах осуществления раковые клетки являются частью опухоли.
В другом варианте осуществления представлены способы лечения немелкоклеточного рака легкого у пациента посредством введения пациенту ингибитора ATR в сочетании с другими известными видами лечения немелкоклеточного рака легкого. Один аспект изобретения включает введение пациенту ингибитора ATR в сочетании с цисплатином или карбоплатином, этопозидом и/или ионизирующим излучением.
В другом аспекте представлен способ лечения немелкоклеточного рака легкого посредством введения пациенту ингибитора ATR, выбранного из соединения в таблице 1 в сочетании с одним или более видов противоопухолевой терапии. В некоторых вариантах осуществления ингибитор ATR применяется в сочетании с химиолучевой терапией, химиотерапией и/или лучевой терапией. Следует понимать, что химиолучевая терапия означает способ лечения, включающий в себя как химиотерапию (такую как терапия цисплатином, карбоплатином или этопозидом), так и лучевую терапию. В некоторых вариантах осуществления химиотерапия содержит терапию цисплатином или карбоплатином, а также этопозидом.
Еще в одном аспекте представлен способ повышения чувствительности клеток немелкоклеточного рака легкого к противоопухолевой терапии, выбранной из терапии цисплатином или карбоплатином, этопозидом и ионизирующим излучением, посредством введения пациенту ингибитора ATR, выбранного из соединения в таблице 1, в сочетании с одним или более видов противоопухолевой терапии.
В некоторых вариантах осуществления противоопухолевая терапия представляет собой терапию цисплатином или карбоплатином. В других вариантах осуществления противоопухолевая терапия представляет собой лучевую терапию. В еще одном варианте осуществления противоопухолевая терапия представляет собой терапию этопозидом.
В некоторых вариантах осуществления противоопухолевая терапия представляет собой сочетание цисплатина или карбоплатина, этопозида и ионизирующего излучения. В некоторых вариантах осуществления противоопухолевая терапия представляет собой терапию цисплатином или карбоплатином и этопозидом. В других вариантах осуществления противоопухолевая терапия представляет собой терапию цисплатином или карбоплатин и этопозидом, а также ионизирующее излучение. В еще одном варианте осуществления противоопухолевая терапия представляет собой терапию цисплатином или карбоплатином и ионизирующее излучение.
В другом аспекте представлен способ ингибирования фосфорилирования Chk1 (Ser 345) клетке немелкоклеточного рака легкого, содержащий введение пациенту ингибитора ATR, выбранного из соединения в таблице 1. В некоторых вариантах осуществления ингибитор ATR вводят в клетки немелкоклеточного рака легкого в сочетании с гемцитабином (например, 100 нМ), цисплатином или карбоплатином, этопозидом, ионизирующим излучением или лучевой терапией (например, в дозе 6 Гр).
В других вариантах осуществления клетки немелкоклеточного рака легкого находятся в организме онкологического пациента.
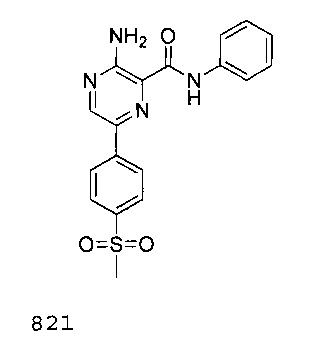
В некоторых вариантах осуществления ингибитор ATR представляет собой
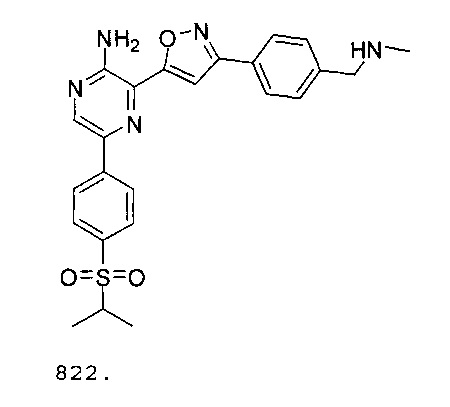
В других вариантах осуществления ингибитор ATR представляет собой
Области применения
В другом аспекте представлено применение ингибитора ATR, выбранного из соединения в таблице 1, в сочетании с гемцитабином и лучевой терапией для лечения рака поджелудочной железы.
В другом аспекте представлено применение ингибитора ATR, выбранного из соединения в таблице 1 в сочетании с цисплатином или карбоплатином, этопозидом и ионизирующим излучением для лечения немелкоклеточного рака легкого.
В некоторых вариантах осуществления ингибитор ATR представляет собой соединение VE-821. В других вариантах осуществления ингибитор ATR представляет собой соединение VE-822.
Производство лекарственных средств
В другом аспекте представлено применение ингибитора ATR, выбранного из соединения в таблице 1, в сочетании с гемцитабином и лучевой терапией для изготовления лекарственного средства для лечения рака поджелудочной железы.
В другом аспекте представлено применение ингибитора ATR, выбранного из соединения в таблице 1 в сочетании с цисплатином или карбоплатином, этопозидом и ионизирующим излучением для изготовления лекарственного средства для лечения немелкоклеточного рака легкого.
В некоторых вариантах осуществления ингибитор ATR представляет собой соединение VE-821. В других вариантах осуществления ингибитор ATR представляет собой соединение VE-822.
Описание примеров
Примеры приводятся только в целях иллюстрации и не могут быть рассмотрены как ограничивающие каким-либо образом объем настоящего изобретения.
Оценка жизнеспособности клеток
Клетки MiaPaCa-2, PSN-1, Panel и MRC5 (5 × 104) высевали в 96-луночные планшеты и через 4 час обрабатывали возрастающими концентрациями VE-821 за 1 час перед облучением в однократной дозе 6 Гр. Через 96 час после облучения среду заменяли, в этот момент времени измеряли жизнеспособность с помощью анализа с использованием аламарового синего (субстрат резазурина, «SIGMA»). Клетки оставляли для пролиферации и повторно измеряли жизнеспособность клеток на 8 день в условиях применения различных видов терапии. Долю жизнеспособности и выживаемости нормализовывали относительно группы без обработки (контрольной группы).
Оценка клоногенной выживаемости
Логарифмически растущие клетки высевали в трех экземплярах в 6-луночные планшеты для культивирования ткани в условиях насыщения кислородом (21% O2) или условиях гипоксии (0,5% O2) с использованием камеры InVivo2 300 (компания «Ruskinn Technology», Великобритания). В течение 6 часов перед облучением клетки инкубировали в условиях насыщения кислородом или гипоксии в герметично закрытых камерах. Целевой уровень содержания O2 был достигнут в течение 6 час наполнения газом и поддерживался в течение облучения, как подтверждено с помощью датчика кислорода OxyLite (компания «Oxford Optronix»). Клетки, облученные в условиях гипоксии, подвергали воздействию условий нормоксии через 1 час после облучения. В качестве стандарта, за 1 час до облучения (6 Гр) прибавляли VE-821 (1 мкМ) и через 72 час после облучения его вымывали. В экспериментах химиотерапии клетки первоначально подвергали воздействию возрастающих концентраций гемцитабина (5, 10 и 20 нМ) в течение 24 час перед прибавлением VE-821 (1 μM) в течение других 72 час. Изучали также действие тройной комбинации облучения с VE-821 и гемцитабином. Клетки инкубировали в течение 10-21 суток, пока колонии не окрашивались 0,5% кристаллического фиолетового, их количество подсчитывали с помощью автоматического счетчика колоний CellCount (компания «Oxford Optronix»). Рассчитывали клоногенную выживаемость, данные описывались с помощью GraphPad Prism 4.0 (компания «GraphPad Software», Калифорния).
Иммуноблоттинг
Клетки MiaPaCa-2 и PSN-1 подвергали воздействию гемцитабина и/или 1 мкМ препарата VE-821 за 1 час до облучения в однократной дозе 6 Гр. Клетки лизировали в буфере RIPA через 2 час после облучения и подвергали электрофорезу ДСН-ПААГ и проводили иммуноблоттинг. Для обнаружения связывания антител использовали метод хемолюминесценции (SuperSignal, «Millipore») и экспонирования на пленку. Экспонированную пленку подвергали цифровой обработке, изображения компоновали с помощью Microsoft PowerPoint.
Анализ ядерных фокусов
Клетки, выращенные в 96-луночных планшетах, обрабатывали 1 мкМ препарата VE-821 за 1 час до облучения в дозе 6 Гр и фиксировали 3% формальдегиде в несколько моментов времени. Затем клетки пермеабилизировали и блокировали в ЗФР с 0,1% Triton в 1% БСА (масса/объем). Клетки инкубировали с первичным антителом в течение ночи при температуре 4°C и затем отмывочный ЗФР инкубировали с флуоресцентно меченым вторичным антителом с последующей отмывкой ЗФР и окрашиванием ядер с помощью реактива DAPI. Получали изображения, подсчитывали количество фокусов с помощью автоматического эпифлуоресцентного микроскопа IN Cell Analyzer 1000 и аналитического программного обеспечения (компания «GE Healthcare», Чалфонт-Сент-Джайлс, Великобритания).
Анализ клеточного цикла
Клетки, выращенные в 6-луночных планшетах, обрабатывали 1 мкМ препарата VE-821 за 1 час до облучения в дозе 6 Гр. За 6 часов до обучения клетки инкубировали в условиях насыщения кислородом (21% O2) или условиях гипоксии (0,5% O2) с использованием герметично закрытых камер. В несколько моментов времени клетки поднимали в трипсине, фиксировали в 70% этаноле и хранили при температуре 4°C. Клетки инкубировали с пропидиум иодидом (50 мкг/мл в ЗФР, содержащем 200 мкг/мл РНКазы) в течение 1 час при комнатной температуре и проводили анализ методом проточной цитометрии (FACSort, «Becton Dickinson»). Клеточный цикл рассчитывали с помощью программного обеспечения для анализа клеточного цикла ModFit.
Клеточный посев и прибавление соединения для теста клеток легкого
Все клеточные линии засевали в 30 мкл среды для культивирования ткани, содержащей 10% эмбриональной бычьей сыворотки, в 384-луночных планшетах со светонепроницаемым дном. Плотность засева основывалась на логарифмической скорости роста в каждой клеточной линии. Через 24 часа в каждую лунку прибавляли базовые растворы соединения для получения матрицы, состоящей из 5 концентраций для VE-822 и 6 концентраций для препарата химиотерапии. Каждая лунка содержит или один агент, или комбинацию обоих агентов. Окончательный диапазон концентраций для VE-822 составил 25 нМ-2 мкМ. Диапазоны концентраций для препаратов химиотерапии соответствовали следующему: этопозид, 10 нМ-10 мкМ; гемцитабин, 0,16 нМ -160 нМ; цисплатин, 20 нМ-20 мкМ; оксалиплатин, 40 нМ-40 мкМ; иринотекан (SN-38), 0,12 нМ-120 нМ. Затем клетки инкубировали в течение 96 часов при температуре 37°C в атмосфере с 5% CO2 и уровнем влажности 95%.
Клеточный посев и прибавление соединения для теста клеток рака поджелудочной железы
Все клеточные линии засевали в 30 мкл среды для культивирования ткани, содержащей 10% эмбриональной бычьей сыворотки, в 384-луночных планшетах со светонепроницаемым дном. Плотность засева основывалась на логарифмической скорости роста в каждой клеточной линии. Через 24 часа в каждую лунку прибавляли базовые растворы соединения для получения матрицы, состоящей из 9 концентраций для VE-822 и 7 концентраций для гемцитабина и цисплатина. Каждая лунка содержит или один агент, или комбинацию обоих агентов. Диапазоны концентраций соответствовали следующему: VE-822, 0,3 нМ-2 мкМ; гемцитабин, 0,3 нМ-0,22 мкМ; цисплатин, 30 нМ-20 мкМ. Клетки затем инкубировали в течение 96 часов при температуре 37°C в атмосфере 5% CO2 и уровне влажности 95%.
Оценка жизнеспособности клеток
С помощью этого анализа измеряют количество жизнеспособных клеток в культуре на основе количественного измерения АТФ, присутствующей в метаболически активных клетках.
Готовили реагент CellTiter-Glo (компания «Promega», Мадисон, Висконсин, США) в соответствии с инструкциями производителя и прибавляли его через 96 часов после прибавления соединения (25 мкл/лунка) для измерения жизнеспособности клеток. Люминесцентный сигнал измеряли с помощью автоматического микропланшетного ридера PHERAStarFS (компания «BMG Labtech», Кэри, Северная Каролина, США). Тестирование всех клеточных линий проводили по два раза.
Необработанные величины CellTiter-Glo (CTG), полученные в ходе люминесцентного анализа, нормализовывали до средней величины CTG для образцов отрицательного контроля, обработанных ДМСО, для каждого микропланшета. Величины ИК50 только для препаратов химиотерапии рассчитывали с использованием величин выживаемости клеток, нормализованных по ДМСО, для образцов, обработанных только соединением химиотерапии. Для определения доли выживших клеток в присутствии VE-822 необработанные величины CTG нормализовывали до средней величины CTG для образцов, обработанных той же концентрацией VE-822 в отсутствие соединения химиотерапии. Величины ИК50 для образцов, обработанных VE-822 и препаратом химиотерапии, рассчитывали с использованием величин выживаемости клеток для всех образцов, обработанных препаратом химиотерапии в заданной концентрации VE-822, нормализованных по VE-822. Трехкратное сокращение или более чем трехкратное сокращение ИК50 использовалось для идентификации выраженного синергического эффекта между VE-822 и препаратами химиотерапии.
Модель с ксенотрансплантатом первичной аденокарциномы легких НМРЛ
У пациента со слабо дифференцированной аденокарциномой вырезали опухолевую ткань. Эту опухолевую ткань имплантировали под кожу мыши линии SCID в подвздошную область и перевивали дважды перед тестированием соединения. Для тестирования соединения опухолевую ткань второго пассажа имплантировали под кожу мыши линии SCID в подвздошную область, опухоли росли до достижения объема около 200 мм3. Вводили только один цисплатин в дозе 1 или 3 мг/кг внутрибрюшинно один раз в неделю (в/б один раз в 7 дней, на 2 день каждой недели) в течение двух недель. Вводили только один VE-822 в качестве раствора в дозе 60 мг/кг перорально в течение 4 последовательных дней на недельной основе (каждый день в течение 4 дней, при введении на 1, 2, 3 и 4 день каждой недели). В двух группах с введением комбинации препаратов вводили цисплатин в дозе 1 или 3 мг/кг плюс VE-822 в дозе 60 мг/кг перорально в соответствии с тем же графиком введения, что и в группе с введением одного агента. В контрольной группе вводили только один носитель (10% витамин Ε токоферилполиэтиленгликольсукцинат в воде, перорально один раз в 4 дня). Введение всех препаратов прекратили на 28 день. Мышей из группы с введением носителя, цисплатина (1 мг/кг) и VE-822 (60 мг/кг) умерщвляли, оставшихся наблюдали еще в течение 40 дней для оценки восстановления роста опухоли.
Модель ксенотрансплантата рака поджелудочной железы PSN1
Клетки PSN1 (1 × 106 клеток на каждую мышь) имплантировали в качестве смеси в Matrigel (100 мкл на каждую мышь) в подвздошную область самки голой мыши линии MF1 и выращивали до объема примерно 200 мм3 до введения соединения. Вводили только один гемцитабин в дозе 15 мг/кг в/б, каждые три дня (в/б, один раз в 3 дня) в растворе 0,5% метилцеллюлозы в воде, максимум, в 10 циклов. Вводили только один VE-822 в качестве суспензии в растворе 0,5% метилцеллюлозы в воде в дозе 10, 30 или 60 мг/кг перорально через день в течение 28 дней (перорально каждые 2 дня). Три группы с введением комбинации агентов получали гемцитабин в дозе 15 мг/кг плюс VE-822 в дозе 10, 30 или 60 мг/кг перорально соответствии с тем же графиком введения, что и в группах с введением одного агента. Контрольная группа A получала только один носитель (0,5% метилцеллюлоза в/б один раз в 3 дня). Введение всех препаратов прекратили на 30 день. Животных групп с введением носителя и VE-822 умерщвляли на 13 сутки в связи с избыточным объемом опухоли.
РЕЗУЛЬТАТЫ
Соединения VE-821 и VE-822 повышают чувствительность клеток рака поджелудочной железы к лучевой терапии
Соединение VE-821 ингибирует фосфорилирование Chk1 (Ser 345) после терапии гемцитабином (100 нМ), облучения (6 Гр) или обоих (см. фиг. 1А). Соединение VE-821 радиосенсибилизирует клетки опухоли поджелудочной железы, но не оказывает влияния на нормальные клетки. При облучении клеток в присутствии соединения VE-821 отмечено снижение доли выживания, и этот эффект радиосенсибилизации повышается с удлинением времени инкубирования препарата после облучения (см. фигуру 1C). Соединение VE-821 радиосенсибилизирует опухолевые клетки PSN-1, MiaPaCa-2 и PancM в условиях гипоксии (см. фигуры 2A-B). Соединение VE-821 также повышает чувствительность нормоксических и гипоксических опухолевых клеток к гемцитабину (см. фигуры 3B-C). Соединение VE-821 усиливает эффект химиолучевой терапии как в раковых клетках PSN-1, так и MiaPaCa-2 (см. фигуру 3D). Соединение VE-821 прерывает клеточный цикл, обусловленный повреждением, в сверочных точках (см. фигуру 6). Соединение VE-821 ингибирует репарацию поврежденной ДНК с помощью гомологической рекомбинации (см. фигуры 5A, 5B и 5C).
Результаты для соединений 821 и 822 представлены в фигурах с 8 по 15 и с 16 по 21. VE-821 и VE-822 повышают чувствительность раковых клеток к лучевой терапии (см. фигуры 8-12).
VE-822 улучшает противоопухолевое действие терапии против рака в моделях с ксенотрансплантатом
VE-822 улучшает противоопухолевое действие ионизирующего излучения в модели с ксенотрансплантатом клеток рака поджелудочной железы MiaPaCa (см. фигуру 13) и в модели с ксенотрансплантатом клеток рака поджелудочной железы PSN-1 (см. фигуры 14 и 15). VE-822 улучшает противоопухолевой действие цисплатина в модели с ксенотрансплантатом первичной аденокарциномы легкого НМРЛ. На фигуре 20 показано действие VE-822 и цисплатина на объем опухоли и массу тела у мышей линии SCID с ксенотрансплантатом первичной аденокарциномы легкого НМРЛ. Данные представлены как среднее ± средняя ошибка среднего, n=9-10. Сплошные круги черного цвета обозначают введение носителя; сплошные ромбы красного цвета обозначают ведение цисплатина (1 мг/кг, один раз в 7 дней); сплошные ромбы синего цвета обозначают ведение цисплатина (3 мг/кг, один раз в 7 дней); сплошные квадраты зеленого цвета обозначают введение VE-822 (60 мг/кг, каждые 4 дня); незаполненные треугольники зеленого цвета обозначают введение цисплатина (1 мг/кг) и VE-822 (60 мг/кг, каждые 4 дня); незаполненные треугольники синего цвета обозначают введение цисплатина (3 мг/кг) и VE-822 (60 мг/кг, каждые 4 дня) (см. фигура 20).
VE-822 также улучшает противоопухолевое действие гемцитамина в модели с ксенотрансплантатом клеток рака поджелудочной железы PSN1. На фигуре 21 показано действие VE-822, введенного перорально один раз в 2 дня в дозе 10, 30 или 60 мг/кг в сочетании с гемцитабином (15 мг/кг, в/б, один раз в 3 дня), на объем опухоли мышей, которым имплантировали ксенотрансплантаты клеток рака поджелудочной железы PSN1. Представленные данные являются средним значением объема опухоли □ средняя ошибка среднего (n=8 на каждую группу). Сплошные круги красного цвета обозначают терапию VE-822; сплошные квадраты черного цвета обозначают введение носителя; сплошные круги зеленого цвета обозначают терапию гемцитабином; сплошные круги синего цвета обозначают терапию гемцитабином и VE-822 (10 мг/кг); сплошные круги красного цвета обозначают терапию гемцитабином и VE-822 (30 мг/кг); сплошные круги розового цвета обозначают терапию гемцитабином и VE-822 (60 мг/кг);
При взаимодействии с препаратами химиотерапии VE-822 усиливает воздействие при тестировании панели клеточных линий рака легкого
Тепловая карта представляет максимальный сдвиг ИК50 каждого препарата химиотерапии, полученного при введении в сочетании с VE-822 в течение 96 часов. Цвета представляют диапазон сдвига ИК50 от -10 (антагонизм, синий) до 10 (синергизм, красный) (см. фигура 16). VE-822 усиливает более чем в 3 раза воздействие при введении с цисплатином, этопозидом, гемцитабином, оксаплатином и иринотеканом в клеточных линиях рака легкого (см. фигура 17).
При взаимодействии с цисплатином и гемцитабином VE-822 усиливает воздействие на клеточные линии рака поджелудочной железы.
Тепловая карта представляет максимальный сдвиг ИК50 каждого препарата химиотерапии, полученного при введении в сочетании с VE-822 в течение 96 часов. Цвета представляют диапазон сдвига ИК50 от -10 (антагонизм, синий) до 10 (синергизм, красный) (см. фигура 18).
Хотя мы описали множество вариантов осуществления настоящего изобретения, очевидно, что наши базовые примеры могут быть изменены для создания других вариантов осуществления изобретения, в которых будут использоваться соединения, способы и процессы, раскрываемые в настоящем изобретении. Поэтому должно быть ясно, что объем настоящего изобретения определяется прилагаемыми пунктами формулы изобретения, а не конкретными вариантами осуществления изобретения, которые приведены в настоящем документе в качестве примеров.