Результат интеллектуальной деятельности: Композиционное полимерное раневое покрытие на основе нановолокон
Вид РИД
Изобретение
Изобретение относится к химии высокомолекулярных соединений, точнее к композиционному полимерному раневому покрытию на основе нановолокон.
Изобретение предназначено для использования в медицине, ветеринарии и фармакологии в качестве раневых покрытий. Изобретение может найти применение в тканевой инженерии в качестве матриц для клеточных технологий, а также в регенеративной медицине.
Современные требования к материалам, используемым для лечения раневых поверхностей различной этиологии, а также к матрицам для тканевой инженерии сформулированы в монографии [Полимерные матрицы для тканевой инженерии. И.П. Добровольская, В.Е. Юдин, П.В. Попрядухин, Е.М. Иванькова. СПб.: Издательско-полиграфическая ассоциация университетов России. 2016. 224 с.]. Среди них:
- материал должен характеризоваться биосовместимостью, высокой пролиферативной активностью стволовых и соматических клеток на его поверхности;
- пористый пленочный материал должен обладать прочностными и эластическими характеристиками, позволяющими его использовать в качестве раневого покрытия в биологически активных средах;
- пористая структура должна обеспечивать паро- и газообмен в течение всего времени контакта с раневой поверхностью;
- снятие повязки не должно нарушать клеточную структуру, образовавшуюся в процессе грануляции и эпителизации раны (атравматичность покрытия);
- слой материала, непосредственно контактирующий с раневой поверхностью, должен подвергаться полной биорезорбции в живом организме в течение нескольких недель;
- продукты резорбции материала должны быть биосовместимы.
Известны пористые полимерные материалы, в той или иной степени удовлетворяющие указанному комплексу требований к раневым повязкам, например, на основе алифатических сополиамидов, полученные методом разделения фаз [I.P. Dobrovolskaya, P.V. Popryadukhin, V.E. Yudin, Е.М. Ivan'kova, V. Yu. Elokhovskiy, Z. Weishauptova, K. Balik. Structure and properties of porous films based on aliphatic copolyamide developed for cellular technologies. J. Mat. Sci.: Mat. Med. 2015. V. 26. P. 46], лиофилизацией раствора хитозана в уксусной кислоте [Е.М. Ivan'kova, I.P. Dobrovolskaya, P.V. Popryadukhin, A.E. Kryukov, V.E. Yudin, P. Morganti. In-situ cryo-SEM investigation of porous structure formation of chitosan sponges. Polym. Testing, 2016. V. 52. P. 41-45; Патент ЕР 1401352 B1, МПК A61F 2/00. Опубл. 23.03.2012], барботированием раствора хитозана воздухом или углекислым газом с последующей лиофилизацией [заявка US 2011/0274726 А1, МПК А61К 9/70, А61Р 17/02, А61Р 31/12. Опубл. 10.11.2011]. Для получения пористой структуры полимерные пленки из плиэтилентерефталата облучают α-частицами с последующим травлением их в щелочи [Г.Н. Флеров, B.C. Барашенков. Практические применения пучков тяжелых ионов, Успехи физических наук, 1974, т. 114, вып. 2, с. 361].
В процессе получения пористых пленочных материалов методом разделения фаз, а также облучением тяжелыми ионами поры имеют размеры 1-10 мкм. При барботировании раствора полимера и последующей его лиофилизации размер пор варьируется в широком диапазоне от микрометров до миллиметров. Вместе с тем, известно, что оптимальные размеры пор для эффективной адгезии и пролиферации стволовых и соматических клеток составляют 100-500 мкм. Именно такая пористая структура соответствует большинству тканей животных и человека, основой которых является каркас из коллагеновых волокон диаметром десятки-сотни нанометров. Только структура, максимально приближенная к нативной, обеспечит протекание клеточных процессов, паро- и газообмен, сможет изолировать раневую поверхность от патогенной внешней среды. Создание материала с такой структурой является важной технологической проблемой.
Способы получения раневых покрытий с использование гелей и порошков описаны в заявке [WO 2014065772 A1, МПК A61P17/02. Опубл. 01. 05. 2014] и в патенте [RU 2509091, МПК B82B 3/00. Опубл. 10.03.2014], где приводятся основные характеристики материалов на основе биорезорбируемого полимера - хитозана, который обладает бактерицидными свойствами, способствует процессам образования покровных тканей. Однако известные гели, пленки, губки и порошки на основе хитозана не обладают достаточными механической прочностью и эластичностью, которые необходимы для их эффективного использования в медицинской практике. Путем комбинации гидрогелевого препарата на основе хитозана (нижний слой, предназначенный для непосредственного контакта с раной) и пленки из хитозана, обработанной раствором щелочи (верхний слой), было получено двухслойное раневое покрытие [заявка WO 2014065772]. В этой же заявке описано трехслойное покрытие, которое получено комбинацией ксерогеля (нижний слой), перфорированной пленки из хитозана (верхний слой) и йодида хитозана (внутренний слой). Оказалось, что указанные материалы очень сложно снять с раневой поверхности, не нарушив клеточных процессов, сопровождающих грануляцию и эпителизацию раны. Вторым недостатком, ограничивающим их применение при лечении ран различной этиологии, является существенное снижение паро- и газопроницаемости материалов после их нанесения на раневую поверхность, так как в водных средах (кровь, эксудат) пористые губки, пленки и порошки из хитозана набухают ввиду высокой гидрофильности этого полимера.
Материалы на основе нановолокон, диаметр которых составляет десятки-сотни нанометров, характеризуются высокой пористостью, достигающей 90 об. %, с размером пор десятки-сотни микрометров [Schiffman J.D., Schauer C.L. A review: electrospinning of biopolymer nanofibers and their applications. Polymer Reviews. 2008. V. 48. P. 317-352]. Такие материалы могут быть использованы в тканевой инженерии. Поэтому, как следует из патента [RU 2568848, МПК A61F2/04. Опубл.20.11.2015] и статьи [Popryadukhin P.V., Popov G.I., Dobrovolskaya I.P., Yudin V.E., Vavilov V.N., Yukina G.Yu., Ivan’kova E.M., Lebedeva I.O. Vascular prostheses based on nanofibers from aliphatic copolyamide. J. Cardiovascular Engineering and Technology. 2016. V.7 №1. Р.78-86], материалы на основе нановолокон из биосовместимых полимеров используют в трансплантологии в качестве матриц для тканевой инженерии. Пленочные материалы на основе нановолокон могут быть использованы в качестве матриц для адгезии и эффективной пролиферации фиброфластов, формирования покровных тканей человека или животного.
В патенте [US 9198928, МПК A61K31/7008. Опубл. 01.12.2015] приводится описание раневых повязок на основе нановолокон из поли-N-ацетилглюкозамина и его производных, обладающих антибактериальными свойствами. Нановолокна длиной около 15 мкм и диаметром 0,005-0,7 мкм получали методом воздействия на исходный порошок или пленку ионизирующего излучения высокой мощности. Как следует из описания патента, материал обладает хорошими бактерицидными свойствами, однако не пригоден для атравматичных раневых покрытий, т.к. основной компонент повязки состоит из мелкодисперных волокон и не обеспечивает необходимых прочностных характеристик материала. Это препятствует замене или снятию покрытия с поверхности раны без нарушения образовавшейся клеточной структуры.
Изобретение, которое относится к способу получения растворов для формования биополимерных нановолокон из хитозана, описано в патенте [RU 2468129, МПК D01F4/00, A61L15/22, A61L15/28, опубл. 27.11.12]. В нем приведены условия получения биополимерных волокон и нетканых волокнисто-пористых материалов из хитозана методом электроформования, а также раневых повязок на их основе, предназначенных для лечения ран различной этиологии, которые позволяют ускорить процесс заживления, создать оптимальную среду для регенерации ткани, защитить рану от возникновения инфекционного процесса и травматизации, предотвратить образование грубых рубцов. Для получения нановолокон методом электроформования используют растворы хитозана, содержащие такие водорастворимые полимеры, как полиэтиленоксид (ПЭО), поливиниловый спирт (ПВС), поливинилпирролидон (ПВП). Указанные водорастворимые полимеры вводят в раствор хитозана в количестве до 30-40 мас.% для формирования волокнистых структур в электрическом поле высокого напряжения. Содержание этих полимеров в композиционных волокнах на основе хитозана уменьшает водостойкость пленочного материала, снижает прочность в водных средах, увеличивает набухание, что приводит к изменению пористой структуры, в частности, к частичному схлопыванию пор и как следствие, уменьшению паро- и газопроницаемости материала.
Пленки на основе нановолокон из биорезорбируемых полимеров обладают невысокими прочностными характеристиками, которые снижаются в активной биологической среде, содержащей ферменты и макрофаги, под действием которых происходит частичное или полное биоразложение материала при контакте с раневой поверхностью. Замена или снятие такой пленки с раны крайне сложно.
Известен патент [US 9101508, МПК B32B7/00. Опубл. 11.08.2015], в котором описано полимерное трехслойное раневое покрытие на основе нановолокон (устройство-прототип). Верхний слой покрытия состоит из нановолокон, полученных методом электроформования растворов гидрофобных полимеров, таких как полиакрилонитрил, полиамид, полилактид, полигликолид. Средний слой состоит из нановолокон на основе гидрофильных или гидрофобных полимеров, сшитых агликоном иридоидного гликозида природного происхождения - генипином (C11H14O5); слой содержит также экстракт донника. Нижний слой, предназначенный для непосредственного контакта с раневой поверхностью, сформован из растворов гидрофильных полимеров, таких как хитозан, ПЭО, ПВС, коллаген. Следует отметить, что для получения растворов гидрофобных полимеров, из которых формуют внешний слой покрытия, используют апротонные растворители и муравьиную кислоту высокой концентрации, что негативно сказывается на адгезии стволовых клеток и их пролиферации на таких покрытиях, т.к. указанные растворители цитотоксичны даже в следовых концентрациях. Слой, непосредственно контактирующий с раной, состоит из нановолокон гидрофильных водорастворимых полимеров, которые при контакте с активной биологической средой набухают и препятствуют газо- и парообмену, необходимым для нормального протекания процессов грануляции и эпителизации. Все приведенные в указанном патенте полимеры, используемые для формирования этого слоя, за исключением хитозана, не относятся к биорезорбируемым и, следовательно, они не могут активно способствовать процессам пролиферации и дифференцировки стволовых или соматических клеток, что приводит к недостаточной скорости заживления глубоких поражений покровной ткани человека или животного.
Следует отметить, что известные подходы к получению многослойных полимерных раневых покрытий на основе нановолокон сводятся к попыткам применения гидрофобных (верхний слой) и гидрофильных (нижний слой) полимеров, что, безусловно, приводит к улучшению функциональности раневых покрытий, однако не устраняет недостатков полимерных слоев, обусловленных их природой. Для верхнего слоя - это невозможность избавиться от следовых количеств растворителя и, следовательно, цитотоксичности, для нижнего слоя - чрезмерное набухание и, следовательно, нарушение газо- и парообмена.
Из уровня техники известен патент, полученный авторами изобретения ранее, в котором описан способ получения нановолокон из алифатического сополиамида [RU № 2447207 С1, МПК D01F6/80, B82B3/00. Опубл.10.04.2012]. Нановолокна получали методом электроформования растворов алифатического сополиамида в спирто-водной смеси. Пористый пленочный материал, полученный описанным способом, не может быть использован в качестве эффективного раневого покрытия, отвечающего требованиям, предъявляемым к таким материалам, т.к. не включает в свой состав биорезорбируемого полимера.
Известен также патент авторов изобретения [RU № 2568848 С1, МПК A61F2/06. Опубл. 22.10.2015], где описан трубчатый имплантат органов человека или животного, выполненный из нетканого пористого полимерного материала, сформированного из нано- и/или микроволокон диаметром 50-8000 нм из алифатического спирторастворимого сополиамида с внутренним диаметром трубки 0,2-40 мм, толщиной стенки 0,05-5 мм, диаметром пор 0,1-500 мкм. Известный материал может содержать в своем объеме нано- или микроволокна хитозана и хитина в качестве добавок биорезорбируемого полимера. Однако форма материала, в виде полых трубок различного диаметра, а также структура стенок трубок, в которых волокна расположены параллельно, или перпендикулярно оси трубки, или произвольно, или послойно с разными видами ориентации, не позволяет эти материалы использовать в качестве раневых покрытий для лечения поражений большой площади кожных покровов.
Таким образом, создание качественного полимерного раневого покрытия остается актуальной проблемой.
Технической проблемой заявляемого изобретения является создание эффективного раневого покрытия, которое характеризуется высокой скоростью заживления глубоких поражений покровной ткани человека или животного, определяемой по скорости уменьшения площади раневой поверхности.
Заявляемое раневое покрытие обладает следующей совокупностью существенных признаков: композиционное полимерное раневое покрытие на основе нановолокон, характеризующееся тем, что оно состоит из двух слоев, верхний из которых представляет собой пористый пленочный материал с размером пор 10-1000 мкм, толщиной 0,1-1 мм на основе нановолокон диаметром 0,1-1 мкм из нерезорбируемого сополимера ε-капролактама и гексаметилендиаминадипината с соотношением мономерных звеньев от 60:40 до 40:60 мас. %, а нижний слой, предназначенный для непосредственного контакта с раной, толщиной 0,1-1 мм с размером пор 10-500 мкм выполнен на основе композиционных нановолокон диаметром 0,1-0,5 мкм из резорбируемого полимера хитозана со степенью деацетилирования 70-95 %, молекулярной массой 150-400 кДа, содержащих в качестве наполнителя 0,1-30 мас. % резорбируемых нанофибрилл хитина с поперечным размером 15-20 нм и продольным 400-500 нм.
Совокупность существенных признаков заявляемого раневого покрытия обеспечивает получение технического результата - эффективности покрытия, в том числе характеризуемой высокой скоростью заживления глубоких поражений покровной ткани человека или животного. Эффективность раневого покрытия определяется следующим. Созданный материал обладает биосовместимостью, пористой структурой, которая сохраняет форму и размеры пор в жидких биологических средах. Механические характеристики материала позволяют манипуляции с ним как в сухом, так и во влажном состоянии. При наложении на рану нижний слой, состоящий из композиционных нановолокон на основе резорбируемых полимеров природного происхождения - хитозана и хитина и непосредственно контактирующий с поврежденной поверхностью, под действием биологически активной среды резорбирует. Хитин, хитозан и продукты их биоразложения оказывают на рану бактерицидное действие, препятствуют развитию воспалительных процессов, тем самым способствует процессам грануляции и эпителизации раны.
Верхний слой покрытия, который состоит из нановолокон на основе нерезорбируемого полимера, обладает прочностными и эластическими характеристиками, достаточными для манипуляций в биологически активных средах. Двуслойное раневое покрытие позволяет не нарушать процессы грануляции и эпителизации раны при замене или снятии повязки за счет возможности отделения верхнего прочного нерезорбируемого слоя. Менее прочный нижний слой, состоящий из композиционных нановолокон резорбируемых полимеров хитина и хитозана, остается на поверхности раны вплоть до его полной резорбции.
Заявляемое раневое покрытие отличается от известного устройства-прототипа наличием двух слоев на основе нановолокон, верхнего из нерезорбируемого полимера и нижнего, предназначенного для непосредственного контакта с раной, на основе композиционных нановолокон из резорбируемого полимера, а также полимерным составом резорбируемых композиционных нановолокон, которые состоят из хитозана и наполнителя из анизодиаметричных наночастиц.
Материалы слоев не содержат вредных примесей, т.к. получены методом электроформования из растворов в неагрессивных растворителях - смеси спирт-вода (в отличие от устройства-прототипа, где используется муравьиная кислота), которые не оставляют токсичных для клеток следов.
Анализ известного уровня техники не позволил обнаружить решение, полностью совпадающее по совокупности существенных признаков с заявляемым, что может указывать на новизну композиционного полимерного раневого покрытия на основе нановолокон.
Только совокупность существенных признаков заявляемого раневого покрытия - двухслойность, полимерный состав слоев и характеристики структуры, позволяет достичь указанного технического результата. Неочевидным из уровня техники является факт, что в процессе получения раневого покрытия формируется нановолоконная структура из хитозана на слое нановолокон из сополиамида и в целом слои образуют однородный по структуре материал. При этом важно, что манипуляции с раневым покрытием при его упаковке, стерилизации, наложении на рану не приводят к расслоению материала. Конструкция обладает достаточными прочностными свойствами для покрытия раны и снятия с ее поверхности через определенный срок нерезорбируемого слоя. Эластические характеристики материала позволяют полностью воспроизвести рельеф раневой поверхности. Высокая адгезиия материала к поверхности раны не требует его дополнительной фиксации клеем или шовными нитями. Пористая структура материала не нарушается при его контакте с влажной средой поверхности раны, что обеспечивает необходимый для клеточных процессов газо- и парообмен. Значимой для повышения скорости заживления является атравматичность раневого покрытия, которая проявляется в сохранении образовавшихся клеточных структур на стадиях грануляции и эпителизации, при его замене или снятии.
Ни в одном из аналогов не удалось непосредственно из полимера и даже при комбинации полимерных слоев получить результат заявляемого изобретения. Это позволяет утверждать о соответствии заявляемого раневого покрытия условию патентоспособности «изобретательский уровень».
Графические материалы
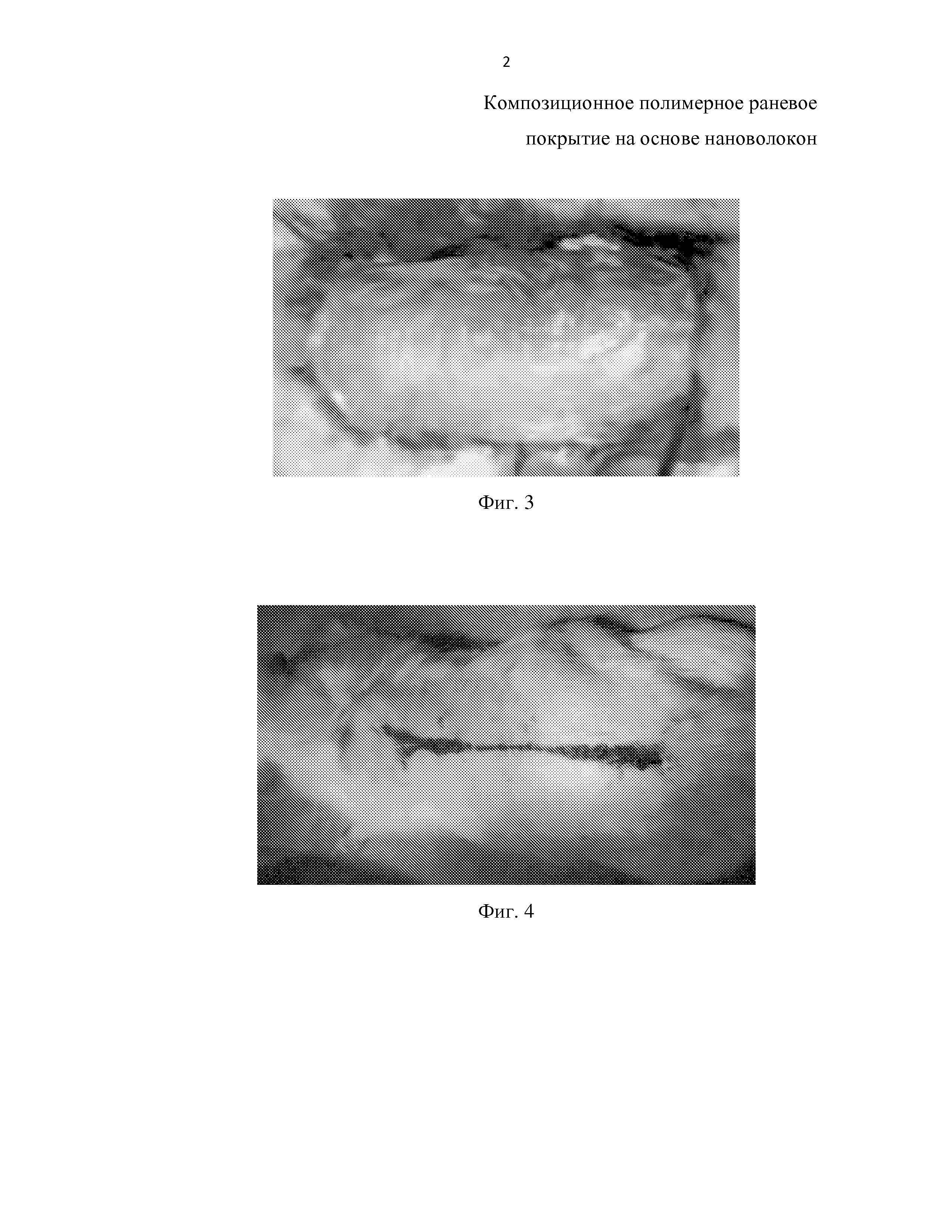
На фиг.1 приведена микрофотография верхнего слоя на основе нановолокон из сополиамида (СПА) композиционного раневого покрытия.
На фиг. 2 приведена микрофотография предназначенного для непосредственного контакта с раной нижнего слоя композиционного раневого покрытия на основе нановолокон из хитозана, содержащих 20 мас.% нанофибрилл хитина.
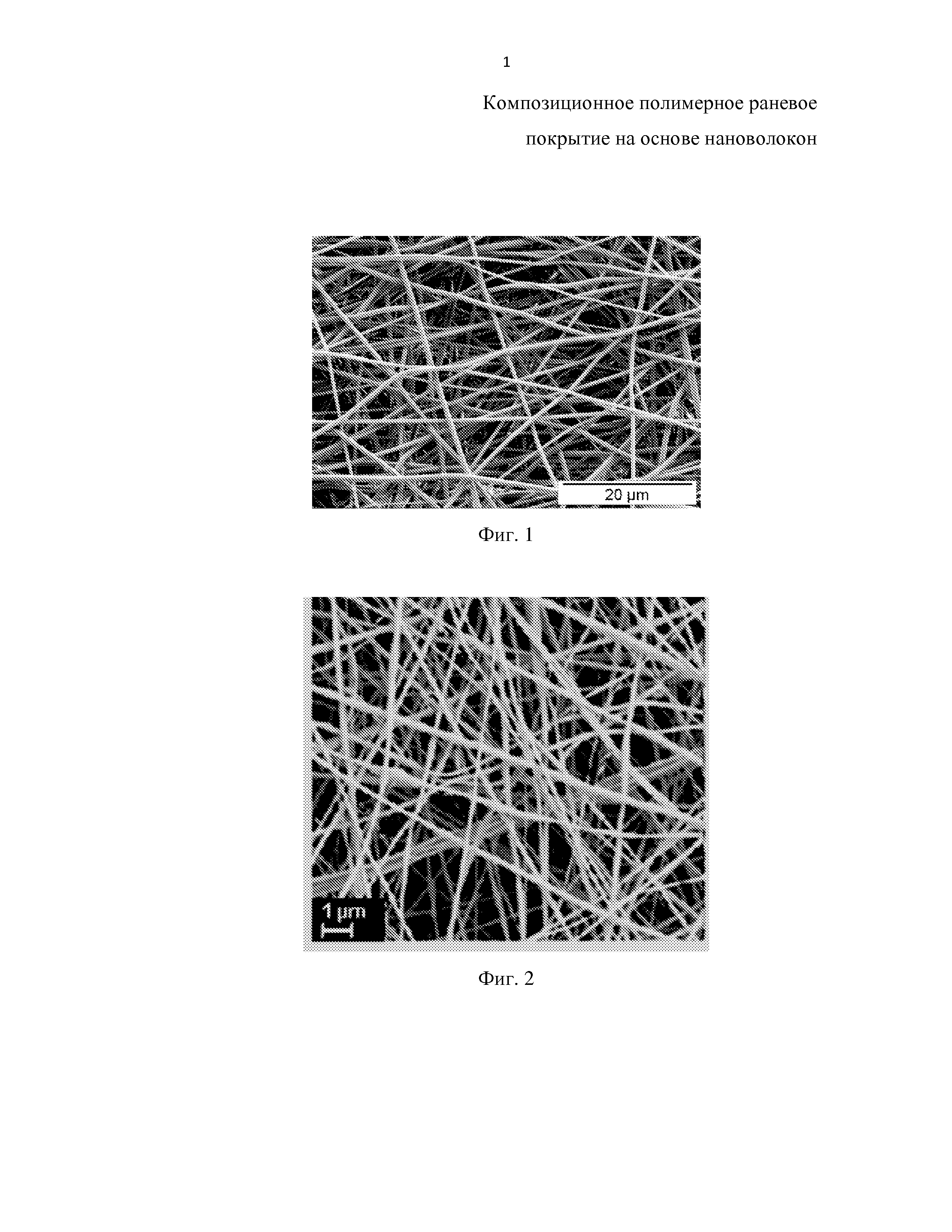
На фиг. 3 приведена фотография аппликации на поверхность ожога кожи III степени композиционного раневого покрытия на основе нановолокон из алифатического сополиамида и хитозана.
На фиг. 4 приведена фотография раневой поверхности после лечения раневым покрытием на основе нановолокон, 21 день наблюдения.
Сущность изобретения и подтверждение возможности его осуществления наиболее полно раскрываются в примерах получения раневых покрытий на основе нановолокон и их применения для лечения глубоких поражений покровных тканей.
Пример 1.
Для получения композиционного раневого покрытия на основе полимерных нановолокон использовали сополиамид (СПА) на основе поли-ε-капролактама и полигексаметиленадипинамида производства ООО «АНИД», г. Екатеринбург, хитозан производства ЗАО «Биопрогресс», г. Москва и нанофибриллы хитина производства SRL"Mavi Sud" (Италия).
Приготовление раствора СПА с соотношением поли-ε-капролактама и полигексаметиленадипинамида 60:40 %. В растворитель, состоящий из смеси этилового спирта и воды с соотношением компонентов 80:20 об.%, вводят навеску, соответствующую 18 мас.% СПА в растворе. Растворение СПА проводят при Т 80°С в режиме перемешивания со скоростью 150 об/мин в течение 2 часов. Раствор охлаждают до комнатной температуры.
Приготовление смесевого раствора хитозана. В воду добавляют хитозан, ММ=150 кДа, степень деацетилирования 95%, в количестве, обеспечивающем 4,0 мас.% концентрацию хитозана в растворе, и нанофибриллы хитина с поперечным размером 15-20 нм и продольным размером 400-500 нм в количестве 20 % от массы хитозана. Смесь перемешивают со скоростью 500 об/мин в течение 10 мин. После чего при постоянном перемешивании со скоростью 1000 об/мин вводят ледяную уксусную кислоту, доводя концентрацию кислоты в растворителе до 70%. Раствор перемешивают в течение 60 мин со скоростью 700 об/мин. Готовый раствор выдерживают в течение 3 суток при Т 4°C.
Раствор СПА помещают в шприцевой дозатор, оснащенный металлической фильерой длиной 20 мм и диаметром 0,5 мм, после чего со скоростью 1,5 мл/ч подают в электрическое поле напряжением 20 кВ при расстоянии между катодом и анодом l = 0,15 м. Осаждение нановолокон происходит на аноде. Для равномерного распределения нановолокон на приемном электроде фильера совершает возвратно-поступательное движение на расстоянии 15 см параллельно плоскости анода со скоростью 1 см/с. Время формования слоя нановолокон СПА составляет 30 мин.
Пористый пленочный материал из СПА, осажденный на аноде, имеет толщину 0,1-0,5 мм, состоит из волокон диаметром 0,1-0,6 мкм, характеризуется размером пор 10-500 мкм (фиг. 1), его прочностные и деформационные характеристики в сухом и мокром состояниях представлены в табл. 1.
Таблица 1.
Свойства верхнего слоя на основе нановолокон из СПА композиционного раневого покрытия.
|
Раствор хитозана, содержащий нанофибриллы хитина, помещают в шприцевой дозатор, аналогичный для формования СПА нановолокон. Осаждение композиционных нановолокон на основе хитозана происходит на том же аноде, на который предварительно нанесен слой нановолокон из СПА. Скорость подачи полимера 0,4 мл/ч. Время формования слоя композиционных нановолокон на основе хитозана и нанофибрилл хитина составляет 120 мин. Остальные параметры электроформования композиционных нановолокон идентичны параметрам электроформования нановолокон из СПА.
Полученный таким образом слой имеет толщину 0,1-0,5 мм, состоит из волокон диаметром 0,1-0,5 мкм, характеризуется размером пор 50-500 мкм (фиг. 2).
Полученный материал характеризуется двухслойной структурой. Верхний слой состоит из нановолокон нерезорбируемого полимера, СПА, и обладает механическими характеристиками в сухом и мокром состояниях, достаточными для хирургических манипуляций. Нижний слой состоит из композиционных нановолокон из биорезорбируемых полимеров - хитозана и хитина в виде наночастиц (нанофибрилл).
Материал в целом обладает механическими характеристиками, позволяющими его использовать в качестве раневого покрытия, не расслаивается при хранении и эксплуатации.
Полученный материал исследовали in vivo в качестве раневого покрытия для лечения ожога кожи III степени (МКБ-10). Эксперимент проводили на самцах крыс линии «Wistar-Kyoto» весом 200-250 г. Животные были разделены на три группы: экспериментальную, сравнения и контрольную, по 9 животных в каждой.
Воспроизведение ожога кожи III степени (МКБ-10) проводили с помощью нагретой до 95-97°С пластины, время экспозиции составляло 10 с. Площадь ожога составляла 32 см2 (20% поверхности крысы). Спустя 60 мин после травмы под общим ингаляционным наркозом выполняли радикальную некрэктомию до фасции. В экспериментальной группе на раневую поверхность накладывали композиционный материал - заявляемое раневое покрытие (фиг. 3). В группе сравнения раневую поверхность замещали покрытием G-DERM на основе гидрогеля гиалуроновой кислоты, фиксируя на ране кожным клеем Dermabond. В контрольной группе животных раневая поверхность ожога не подвергалась лечебному воздействию. Наблюдение за животными осуществляли в течение четырёх недель. Внешний вид раны после лечения заявляемым раневым покрытием в течение 21 суток приведен на фиг. 4.
В табл. 2 приведены значения площади раневой поверхности ожога III степени после применения заявляемого раневого покрытия, покрытия G-DERM и контрольной группы животных.
Таблица 2.
Площадь раневой поверхности ожога III степени после применения заявляемого раневого покрытия, покрытия G-DERM и контрольной группы животных.
|
Исследование in vivo показало существенно более высокую скорость уменьшения площади раневой поверхности при использовании композиционного полимерного раневого покрытия на основе нановолокон по сравнению с контрольной группой животных и при использовании раневого покрытия G-DERM. Площадь поверхности раны после применения заявленного раневого покрытия в течение 21 дня более чем в 5 раз меньше, чем при использовании стандартного покрытия G-DERM.
Пример 2.
Раствор СПА с соотношением компонентов 40:60 мас. % готовили и формовали из него нановолокна способом, описанным в примере 1. Пористый пленочный материал из СПА имеет толщину 0,5-1,0 мм, состоит из волокон диаметром 0,6-1,0 мкм, характеризуется размером пор 100-700 мкм.
Для формирования слоя, предназначенного для непосредственного контакта с раной, готовили смесевой раствор хитозана со степенью деацетилирования 82 %, ММ=220 кДа, содержащий 0,1 мас.% нанофибрилл хитина, и формовали из него нановолокона способом, описанном в примере 1.
Полученный таким способом слой имеет толщину 0,3-0,6 мм, состоит из волокон диаметром 0,1-0,5 мкм, характеризуется размером пор 10-300 мкм.
Композиционный материал характеризуется двухслойной структурой, не расслаивается при хранении и эксплуатации, обладает механическими характеристиками, позволяющими его использовать в качестве раневого покрытия.
Испытания раневого покрытия, полученного по примеру 2, при лечении ожогов показали результаты, аналогичные примеру 1.
Пример 3.
Раствор СПА с соотношением компонентов 60:40 мас. % готовили и формовали из него нановолокна способом, описанным в примере 1.
Пористый пленочный материал из СПА имеет толщину 0,5-1,0 мм, состоит из волокон диаметром 0,6-1,0 мкм, характеризуется размером пор 700-1000 мкм.
Для формирования слоя, предназначенного для непосредственного контакта с раной, готовили смесевой раствор хитозана со степенью деацетилирования 82 %, ММ=220 кДа, содержащий 30 мас.% нанофибрилл хитина, и формовали из него нановолокона способом, описанном в примере 1. Полученный таким образом слой имеет толщину 0,8-1,0 мм, состоит из волокон диаметром 0,3-0,5 мкм, характеризуется размером пор 50-500 мкм.
Композиционный материал характеризуется двухслойной структурой, не расслаивается при хранении и эксплуатации, обладает механическими характеристиками, позволяющими его использовать в качестве раневого покрытия. Испытания раневого покрытия, полученного по примеру 3, при лечении ожогов показали результаты, аналогичные примеру 1.
Пример 4.
Раствор СПА с соотношением компонентов 40:60 мас. % готовили и формовали из него нановолокна способом, описанным в примере 1. Пористый пленочный материал из СПА имеет толщину 0,2-0,5 мм, состоит из волокон диаметром 0,3-0,6 мкм, характеризуется размером пор 20-200 мкм.
Для формирования слоя, предназначенного для непосредственного контакта с раной, готовили смесевой раствор хитозана со степенью деацетилирования 70 %, ММ=400 кДа, содержащий 30 мас.% нанофибрилл хитина, и формовали из него нановолокона способом, описанным в примере 1. Полученный таким образом слой имеет толщину 0,8-1,0 мм, состоит из волокон диаметром 0,3-0,5 мкм, характеризуется размером пор 50-500 мкм.
Композиционный материал характеризуется двухслойной структурой, не расслаивается при хранении и эксплуатации, обладает механическими характеристиками, позволяющими его использовать в качестве раневого покрытия. Испытания раневого покрытия, полученного по примеру 4, при лечении ожогов показали результаты, аналогичные примеру 1.
Пример 5.
Раствор СПА с соотношением компонентов 40:60 мас. % готовили и формовали из него нановолокна способом, описанным в примере 1. Пористый пленочный материал из СПА имеет толщину 0,2-0,5 мм, состоит из волокон диаметром 0,3-0,6 мкм, характеризуется размером пор 20-200 мкм.
Для формирования слоя, предназначенного для непосредственного контакта с раной, готовили смесевой раствор хитозана со степенью деацетилирования 70 %, ММ=200 кДа, содержащий 35 мас.% нанофибрилл хитина. Высокая вязкость смеси раствора хитозана и нанофибрилл хитина препятствует продавливанию смеси через фильеру. Электроформование композиционных нановолокон невозможно.
Пример 6.
Раствор СПА с соотношением компонентов 40:60 мас. % готовили и формовали из него нановолокна способом, описанным в примере 1. Пористый пленочный материал из СПА имеет толщину 0,2-0,5 мм, состоит из волокон диаметром 0,3-0,6 мкм, характеризуется размером пор 20-200 мкм.
Для формирования слоя, предназначенного для непосредственного контакта с раной, готовили раствор, содержащий 3,0 мас.% хитозана со степенью деацетилирования 70 %, ММ=200 кДа, не содержащий нанофибрилл хитина. На выходе из фильеры образуются капли, которые осаждаются на приемном электроде. Электроформование нановолокон невозможно.
Реализация заявляемого изобретения не исчерпывается приведенными примерами.
Выход за рамки верхних и нижних границ заявляемых интервалов приводит к невозможности его получения либо к резкому снижению качества заявляемого раневого покрытия, о чем свидетельствуют данные, приведенные в примерах №№ 5, 6.
Данные, приведенные в примерах №№ 1-4, свидетельствуют о том, что в результате реализации заявляемого изобретения получены полимерные раневые покрытия, отвечающие основным требованиям, предъявляемым к изделиям такого назначения. Исследование in vivo на примере лечения ожога кожи III степени (МКБ-10), составлявшего 20% поверхности животного, показало высокую эффективность его использования при лечении глубоких поражений кожных покровов.
Композиционное полимерное раневое покрытие на основе нановолокон, характеризующееся тем, что оно состоит из двух слоев, верхний из которых представляет собой пористый пленочный материал с размером пор 10-1000 мкм, толщиной 0,1-1 мм, на основе нановолокон диаметром 0,1-1 мкм из нерезорбируемого сополимера ε-капролактама и гексаметилендиаминадипината с соотношением мономерных звеньев от 60:40 до 40:60 мас.%, а нижний предназначенный для непосредственного контакта с раной слой толщиной 0,1-1 мм с размером пор 10-500 мкм выполнен на основе композиционных нановолокон диаметром 0,1-0,5 мкм из резорбируемого полимера хитозана со степенью деацетилирования 70-95%, молекулярной массой 150-400 кДа, содержащих в качестве наполнителя 0,1-30 мас.% резорбируемых нанофибрилл хитина с поперечным размером 15-20 нм и продольным 400-500 нм.