Синтетические олигонуклеотидные праймеры для идентификации штаммов и изолятов бактерии Acinetobacter и определения устойчивости к бета-лактамным антибиотикам и способ их применения
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к медицинской микробиологии, и может быть использовано для идентификации патогенных для человека бактерий рода Acinetobacter с одновременным определением устойчивости анализируемого штамма к антибактериальным препаратам бета-лактамного ряда карбапенемам и способу их применения.
Бактерии рода Acinetobacter являются распространенными возбудителями внутри-больничных инфекций, вызывая у госпитализированных пациентов инфекции дыхательных путей (синусит, трахеобронхит, пневмония), кровотока (сепсис, эндокардит), мочевыводящих путей, раневой и хирургической инфекций, инфекций кожи и мягких тканей (включая некротизирующий фасциит), нервной системы (менингит, вентрикулит, абсцесс мозга), интраабдоминальные (абсцессы различной локализации, перитонит), опорно-двигательного аппарата (остеомиелит, артрит).
Наиболее значимым клинически видом рода Acinetobacter является Acinetobacter baumannii, который вызывает 2-10% грамотрицательных инфекций в Европе и США и до 1% всех нозокомиальных инфекций (1). Карбапенемы являются наиболее эффективными антибиотиками при лечении инфекций, вызванных ацинетобактериями. Однако в последние годы наблюдается существенный рост устойчивости клинических штаммов Acinetobacter к препаратам этой группы антибиотиков. Поэтому диагностика, направленная на видовое определение бактерий Acinetobacter с одновременным определением их устойчивости к карбапенемам, является крайне важным мероприятием в реализации лечебного процесса.
Известны несколько способов идентификации бактерий Acinetobacter.
Известен способ видового определения Acinetobacter по совокупности фенотипических признаков (2). Способ реализуется за счет исследования спектра биохимической активности ацинетобактерий в определенных условиях окружающей среды, т.е. в способности ферментировать определенный набор органических соединений (сахаров).
Недостаток способа заключается в том, что видовая идентификация затруднена из-за высокого сходства различных представителей рода Acinetobacter не только внутри рода, но и с представителями других родов и таксонов более высокого ранга по таким признакам, как: окисление глюкозы, разжижение желатина, температурные оптимумы роста, ассимиляция L-гистидина, малоната, гистамина, цитрата, DL-4- амино- бутирата, L-фенилаланина. Описанный способ не позволяет провести полноценную видовую идентификацию ацинетобактерий, позволяя лишь определить принадлежность изолята к одному из трех комплексов: A. calcoaceticus-baumannii, A. lwqffii или A. haemolyticus-комплексы. Кроме того, способ неприменим для обнаружения устойчивости штаммов рода Acinetobacter к бета-лактамным препаратам (карбапенемам).
Известен способ молекулярно-биологического анализа последовательности гена rpoB методом полимеразной цепной реакции (ПЦР) (3). Способ основан на секве-нировании участка хромосомы, соответствующего гену rpoB, при котором определяется последовательность азотистых оснований в составе данного гена. На основании соответствия полученной в результате исследования последовательности известным последовательностям гена rpoB бактерий Acinetobacter, делается вывод о видовой принадлежности изучаемого микроорганизма.
Недостаток способа обусловлен тем, что последовательность гена rpoB консервативна не только внутри рода Acinetobacter, но и внутри более крупных таксонов, из-за чего в процессе определения регистрируются частые ложноположительные результаты. Способ неприменим для оценки устойчивости бактерий Acinetobacter к бета-лактамным антибиотикам карбапенемам.
Для обнаружения штаммов рода Acinetobacter, устойчивых к бета-лактамным препаратам (карбапенемам), применяется ряд молекулярно-биологических способов, позволяющих прямо или косвенно обнаружить гены карбапенемаз, экспрессирующих ферменты с карбапенемазной активностью.
Наиболее близким аналогом, принятым за прототип, является способ, основанный на специализированных олигонуклеотидных микрочипах (4).
Из биологического материала (кровь, гной, моча, ликвор, экссудат, аспират и т.д.), полученного от пациента, производится экстракция ДНК. В результате этой манипуляции ДНК выделяется из разрушенных бактериальных клеток. На 2-м этапе производится накопление ампликонов, которые представляют собой участки одноцепочечной флуоресцентно-меченой ДНК целевых видоспецифичных генов и генов, отвечающих за продукцию β-лактамаз. Накопление реализуется при помощи полимеразной цепной реакции. Полученные амликоны наносятся на специальный биочип, имеющий на своей поверхности олигонуклеотидные участки, комплементарные генам нескольких бета-лактамаз - СТХ-М, CHV, VIM-19, ТЕМ-1. Наличие флуоресценции в целевых точках поверхности биочипа свидетельствует о наличии у исследуемых штаммов целевых генов, отвечающих за устойчивость бактерий к бета-лактамным антибиотикам. Отрицательные результаты, отражающие отсутствие возбудителя в исследуемом образце, подтверждаются на основе отсутствия флуоресценции поверхности чипа в целевых точках.
Недостатками способа является то, что он не обеспечивает высокоспецифичной идентификации карбапенемаз, требует дорогостоящего специализированного оборудования, неприменим для видовой идентификации представителей рода Acinetobacter. Способ длителен в исполнении, как правило, выполняется в течение 24 и более часов.
Задачей изобретения является разработка синтетических олигонуклеотидных праймеров для идентификации штаммов и изолятов бактерии рода Acinetobacter с одновременным определением устойчивости к бета-лактамным антибиотикам и способа их применения.
Поставленная задача решается тем, что подобран и синтезирован набор синтетических олигонуклеотидных праймеров для идентификации бактерий рода Acinetobacter с одновременным определением устойчивости к бета-лактамным противомикробным препаратам.
Задача решается также тем, что в способе идентификации штаммов и изолятов бактерии Acinetobacter используют оригинальный набор синтетических олигонуклеотидных праймеров.
Сущность изобретения заключается в том, что при проведении полимеразной цепной реакции используют специальный оригинальный набор олигонуклеотидных праймеров для видовой идентифиации патогенных для человека бактерий рода Acinetobacter по специфичным маркерным генам с одновременным определением устойчивости к бета-лактамным противомикробным препаратам, для проведения реакции амплификации с последующим разделением продуктов реакции амплификации при помощи электрофореза в агарозном геле, анализе электрофоретической картины разделения продуктов амплификации и интерпретации результатов.
Согласно предлагаемому способу осуществляется идентификация трех клинически значимых штаммов и изолятов рода Acinetobacter (A. baumannii, A. calcoaceticus и А. lwoffii) с применением высокоспецифичных праймеров к генам rpoB и оха-51 с одновременным определением его устойчивости к бета-лактамным препаратам (карбапенемам) по наличию генов оха-23 и оха-40, кодирующих карбапенемазы так называемого ОХА-типа.
Праймеры, входящие в набор, отличаются от известных из уровня техники тем, что имеют оригинальные олигонуклеотидные последовательности и позволяют
специфическим образом идентифицировать гены rpoB и оха-51, по которым осуществляется идентификация определенного штамма, т.е. набор праймеров является видоспецифичным.
Кроме того, набор содержит праймеры, специфичные к последовательностям генов оха-23 и оха-40, по которым осуществляется определение устойчивости анализируемого штамма к антибактериальным препаратам бета-лактамного ряда (карбапенемам).
Изобретение иллюстрируется следующими примерами.
Получение синтетических олигонуклеотидных праймеров.
Поиск специфических синтетических олигонуклеотидных праймеров осуществляют на основе анализа полного генома штамма Acinetobacter baumannii АТСС 19606, представленного в базе данных GenBank http://www.ncbi.nlm.nih.gov/GenBank/GenBankSearch.html), при помощи пакета программного обеспечения «Lasergen». Полученные последовательности нескольких пар праймеров дополнительно тестируют на специфичность с помощью моделирования ПЦР в программе «Vector NTI Suite» с последовательностями геномов штаммов других видов рода Acinetobacter, представителей других семейств бактерий из группы грамнегативных палочек, представленных в базе данных GenBank. Окончательный выбор праймеров основывают на следующих критериях: высокий индекс сходства фрагмента и ДНК различных штаммов Acinetobacter baumannii АТСС 19606, высокая температура отжига (GC-метод), большая длина консенсусов, отсутствие гетеродуплексов. Химический синтез праймеров осуществляют амидофосфитным методом на автоматическом синтезаторе ASM-102U. Концентрацию синтетических олигонуклеотидных праймеров в маточном растворе определяют спектрометрическим методом. Таким образом, были выбраны синтетические олигонуклеотидные праймеры, комплементарные высококонсервативной области генома Acinetobacter участка генов rpoB и оха-51.
Способ идентификации штаммов и изолятов бактерии Acinetobacter и определения устойчивости к бета-лактамным антибиотикам осуществляют следующим образом. В качестве объекта исследования был использован биоматериал мазок из зева от больного человека. Способ осуществляют в несколько этапов.
Этап 1. В пробирки добавляют 20 мкл универсального сорбента (набор "ДНК-сорб-АМ", ЦНИИ Эпидемиологии Федеральной службы Роспотребнадзора, Россия), после чего вносят по 300 мкл лизирующего раствора, затем вносят по 100 мкл исследуемого образца. Содержимое пробирок тщательно перемешивают на вортексе и инкубируют в течение 5 мин при температуре 65°С в термостате. После окончания инкубации пробирки повторно перемешивают на вортексе и оставляют при комнатной температуре на 2 мин.
Осаждают сорбент в пробирках с помощью центрифугирования при 10000 об/мин в течение 30 секунд. Не захватывая сорбент, удаляют надосадочную жидкость. К осадку добавляют по 1 мл отмывочного раствора и перемешивают на вортексе до полного ресуспендирования сорбента. Помещают пробирки с открытой крышкой в термостат с температурой 65°С на 5-10 мин для подсушивания сорбента. В пробирки добавляют по 100 мкл ТЕ-буфера (10 мМ Трис-НСl, 1 мМ ЭДТА), рН 8,0 для элюции ДНК. Перемешивают пробирки на вортексе до полного ресуспендирования сорбента. Центрифугируют пробирки при 12000 об/мин в течение 1 мин. Надосадочную жидкость используют для проведения ПЦР.
Этап 2. Проведение полимеразной цепной реакции (ПЦР) для амплификации фрагментов родо- и видоспецифичных маркерных генов (совокупность фрагментов генов rpoB и оха-51) и фрагментов генов, ответственных за устойчивость возбудителя к бета-лактамным противомикробным препаратам (оха-23 и оха-40).
Для осуществления амплификации используют набор специфических олигонуклеотидных праймеров, представленных в Таблице 1.


В 29 мкл ПЦР-смеси вносят 1 мкл образца, полученного в результате Этапа 1. Состав ПЦР-смеси включает: ПЦР-буфер: 10 мМ KCl, 10 мМ Трис-HCl (рН 8,3) (Силекс, Россия); 2,0 мМ MgCl2; 200 мкМ каждого dATP, dCTP, dGTP, dUTP (Силекс, Россия); смесь праймеров (Таблица 1) в концентрации 100 нМ каждого; 5 ед. термостабильной Taq ДНК-полимеразы (Силекс, Россия). Амплификацию проводят на термоциклере «Терцик» (ДНК-технология, Россия) со следующим режимом: 95°С - 30 с, 65°С - 30 с, 72°С - 30 с; 35 циклов (в первом цикле время денатурации увеличивают до 5 мин, в последнем - время достройки до 5 мин). 10 мкл реакционной смеси, полученной после проведения ПЦР, используют для электрофоретического разделения.
Этап 3. Проведение электрофоретического разделения продуктов амплификации фрагментов генов β-лактамаз в агарозном геле.
Готовят 1х ТАЕ-буфер путем пятидесятикратного разведения 50х ТАЕ буфера (2 М Трис, 1 М уксусная кислота, 50 мМ ЭДТА, рН 8,4) в объеме, достаточном для заполнения электрофорезной камеры и приготовления геля (1000 мл). Добавляют к 1х ТАЕ буферу агарозу в количестве, необходимом для получения 2% раствора, и нагревают в микроволновой печи до полного расплавления агарозы. Охлаждают смесь до 60°С. Добавляют к раствору агарозы бромистый этидий до конечной концентрации 0,5 мкг/мл и осторожно перемешивают. Полученный раствор выливают в кювету для геля и равномерно распределяют по объему кюветы. В кювету вставляют гребенку в вертикальном положении так, чтобы ее зубцы не доставали до дна примерно 1,0 мм. Оставляют кювету с агарозным гелем на 30 мин при комнатной температуре для застывания геля. Далее аккуратно удаляют гребенку и помещают кювету с гелем в электрофорезную камеру, содержащую необходимое количество 1х ТАЕ буфера.
По 10 мкл образов, полученных на Этапе 2, смешивают с 2 мкл буфера для нанесения (10 мМ Трис-HCl, рН 7.8, 40% глицерин, 40 мМ ЭДТА, 0,01% бромфеноловый синий, 0,01% ксиленцианол) и аккуратно вносят в лунки геля. Проводят электрофорез при градиенте напряженности 0,7 В на 1 см геля в течение 10 мин, затем 1,5 В на 1 см геля в течение 20 мин. Извлекают гель из электрофорезной камеры и просматривают в УФ-свете на транс-иллюминаторе. Результаты документируют фотографированием геля.
Этап 4. Интерпретация результатов электрофоретического разделения продуктов амплификации фрагментов видо- родоспецифичных генов в агарозном геле.
Полученные изображения интерпретируют следующим образом. По расположению специфических полос для продуктов амплификации проводят интерпретацию электрофореграммы и делают вывод о наличии у анализируемых образцов идентифицируемых родо-/видоспецифичных генов и генов, кодирующих карбапенемазы ОХА-типа. По совокупному анализу длин двух полос оптической плотности делают вывод о видовой принадлежности исследуемого штамма. Так, совокупность двух полос длиной 85 п.н. (rpoB) и 268 п.н. (оха-51) соответствует A. baumannii, совокупность двух полос длиной 85 п.н. (rpoB) и 173 п.н. (оха-51) соответствует A. calcoaceticus, совокупность двух полос длиной 119 п.н. (rpoB) и 268 п.н. (оха-51) соответствует A. lwoffii.
Наличие генов карбапенемаз ОХА-типа определяли по наличию соответствующих полос при электрофоретическом разделении продуктов амплификации клинических образцов. Оптическая полоса, соответствующая длине 362 п.н, свидетельствовала о наличии гена оха-23. Оптическая полоса, соответствующая длине 498 п.н, свидетельствовала о наличии гена оха-40. Наличие сразу двух полос при анализе одного клинического образца, соответствующих длинам ПЦР-продуктов 362 п.н и 498 п.н, свидетельствовала об одновременном наличии генов оха-23 и оха-40, кодирующих карбапенемазы ОХА-типа и обусловливающих резистентность штамма к бета-лактамным противомикробным препаратам. Надежность видовой идентификации обеспечивается одновременным молекулярно-генетическим анализом генов rpoB и оха-51, выявление устойчивости к бета-лактамным препаратам (карбапенемам) обеспечивается способом молекулярно-генетического анализа генов, экспрессирующих карпапенемазы ОХА-23 и ОХА-40.
В результате сравнительного анализа полученных электрофоретических изображений, полученных по методике предлагаемого способа, было установлено, что биоматериал содержит бактерии Acinetobacter baumannii, которые несут ген устойчивости к карбапенемам ОХА-40. Общепринятый микробиологический способ не позволил установить точную видовую принадлежность бактерий рода Acinetobacter, находящихся в биоматриале, и показал, что биоматериал содержит бактерии, относящиеся к Acinetobacter baumannii-комплексу, которые устойчивы к меропенему, дорипенему и имипенему. Результаты сравнительного анализа биоматериала (мазок из зева), полученные предлагаемым способом и известным микробиологическим способом, представлены в Таблице 2.
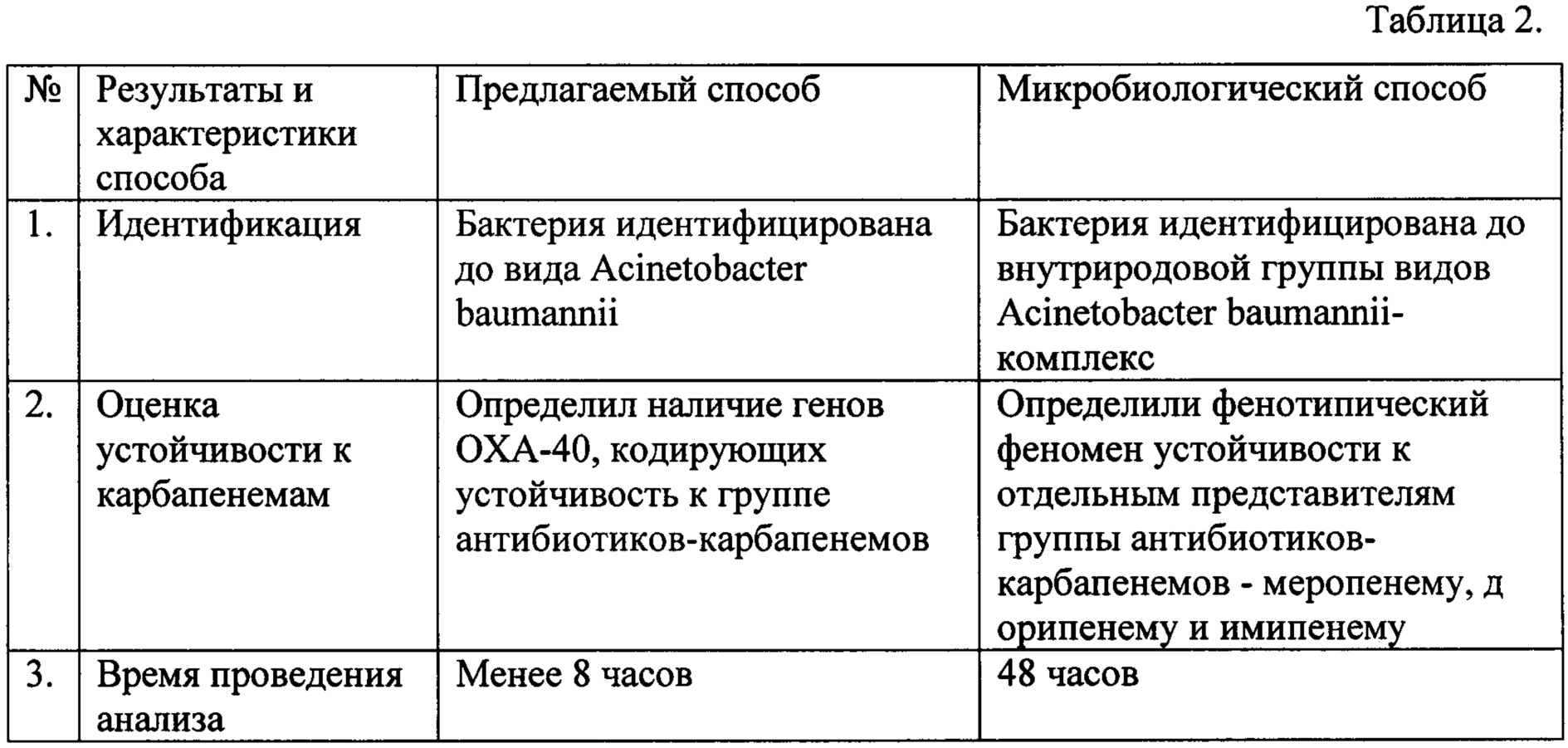
Из таблицы видно, что предлагаемый способ обеспечивает качественное, более быстрое и информативное определение видовой принадлежности присутствующего в биопробе микроорганизма и определяет его устойчивость к группе антибиотиков-карбапенемов.
Способ выгодно отличается от известных из уровня техники методов возможностью идентификации непосредственно в клиническом материале с одновременным определением устойчивости к карбапенемам и другим бета-лактамам (продуценты карбапенемаз так называемого ОХА-типа); возможностью установления индивидуальных генов, ответственных за резистентность (оха-23 и оха-40), а также низкой себестоимостью, малым временем, необходимым для получения результата.
Способ не требует дорогостоящего оборудования и высококвалифицированного персонала. Данные, полученные с помощью способа, могут быть использованы при выборе лекарственного препарата, режима лечения и эпидемиологического контроля.
Список использованной литературы
1. Горбич Ю.Л. Инфекции, вызываемые Acinetobacter baumannii, и их рациональная антибактериальная терапия. Диссертация на соискание ученой степени кандидата медицинских наук. Минск, 2012.
2. Juni Е. Bergey's manual of systematic bacteriology / Eds. N.R. Krieg, J.G. Holt. - Baltimore: Willam& Willcins Co., 1984; 9th ed. V. 1: P. 303-7.
3. Fyhrquist N., Ruokolainen L., Suomalainen A.,  S., Veckman V., Vendelin J., et al. Acinetobacter species in the skin microbiota protect against allergic sensitization and inflammation. Journal of Allergy and Clinical Immunology, 2014. - 134 (6), 1301-1309.
S., Veckman V., Vendelin J., et al. Acinetobacter species in the skin microbiota protect against allergic sensitization and inflammation. Journal of Allergy and Clinical Immunology, 2014. - 134 (6), 1301-1309.
4. Bogaerts P., Cuzon G., Evrard S., Hoebeke M., Naas T., Glupczynski Y. Evaluation of a DNA microarray for rapid detection of the most prevalent extended-spectrum β-lactamases, plasmid-mediated cephalosporinases and carbapenemases in Enterobacteriaceae, Pseudomonas and Acinetobacter. Int J Antimicrob Agents. 2016 Aug; 48 (2): 189-93. doi:
10.1016/j.ijantimicag.2016.05.006.
5. Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» (2015 г.). Режим доступа:
http://www.antibiotic.ru/minzdrav/clinical-recornmendations.

