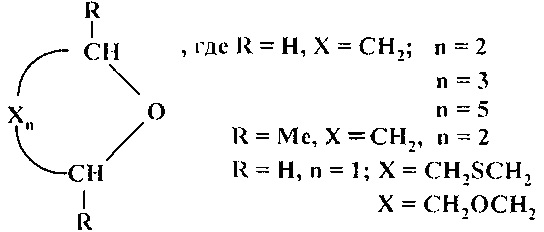Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЦИКЛИЧЕСКИХ ЭФИРОВ ИЗ ДИОЛОВ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения циклических эфиров.
Наиболее практически важными циклическими эфирами являются тетрагидрофуран и 1,4-диоксан. Тетрагидрофуран как универсальный растворитель широко используется в синтезе, в производстве натуральных и синтетических смол.
1,4-Диоксан [1. Y.-M. Park, H. Pyo, S.-J. Park, S.-K. Park / Anal. Chim. Acta. 2005, 548(1-2), 109-115], который синтезируется циклодегидратацией диэтиленгликоля, используется для обезжиривания деталей в электронике, обработке металлов, очистке тканей, фармацевтике, производстве бумаги и в органическом синтезе.
Основными промышленно важными методами синтеза тетрагидрофурана и 1,4-диоксана является циклодегидратация 1,4-бутандиола и диэтиленгликоля под действием минеральных кислот (серная или фосфорная кислота), гетерополикислот, оксида алюминия и цеолитов [2. Y. Kitayama, М. Kamimura, K. Wakui, М. Kanamori, Т. Kodama, J. Abe / J. Mol. Catal. A: Chem. 1999, 142 (2), 237-245; 3. A. Wali, S.M. Pillai, S. Unnikrishnan, S. Satish / J. Mol. Catal. A: Chem. 1996, 109 (2), 149-155; 4. A.J. Heuvelsland. US Patent №4764626 (1988); 5. T. Richter, H. Vogel / Chem. Eng. Technol. 2001, 24 (4), 340-343; 6.  Encyclopedia of Industrial Chemistry. Wiley-VCH. 6-th ed. 10, 545, 35, 672 (2003); 7. L.F. Schmoyer, L.C. Case / Nature. 1960, 187, 592-593. 8. A. Faworski / Chem. Zbl. 1907, 78, 15-17; 9. E. Dziwinski, J. Czerny, L. Kubiczek, A. Szocik, G. Herzog / Przem. Chem. 1979, 58 (12), 667-668; 10. Y. Inoue, S. Deguchi, T. Hakushi / Bull. Chem. Soc. Jpn. 1980, 53 (10), 3031-3032; 11. E.L. Wittbecker, H.K. Hall Jr., T.W. Campbell / J. Am. Chem. Soc. 1960, 82 (5), 1218-1222], PPh3-CCl4 [12. C.N. Barry, S.A. Evans / J. Org. Chem. 1981, 46 (16), 3361-3364; 13. E. Palomino, A.P. Schaap, M.J. Heeg / Tetrahedron Lett. 1989, 30 (49), 6797-6800; 14. S.-T. Chen, S.-H Chiou, K.-T. Wang / J. Chem. Soc., Chem. Commun. 1990, 11, 807-809].
Encyclopedia of Industrial Chemistry. Wiley-VCH. 6-th ed. 10, 545, 35, 672 (2003); 7. L.F. Schmoyer, L.C. Case / Nature. 1960, 187, 592-593. 8. A. Faworski / Chem. Zbl. 1907, 78, 15-17; 9. E. Dziwinski, J. Czerny, L. Kubiczek, A. Szocik, G. Herzog / Przem. Chem. 1979, 58 (12), 667-668; 10. Y. Inoue, S. Deguchi, T. Hakushi / Bull. Chem. Soc. Jpn. 1980, 53 (10), 3031-3032; 11. E.L. Wittbecker, H.K. Hall Jr., T.W. Campbell / J. Am. Chem. Soc. 1960, 82 (5), 1218-1222], PPh3-CCl4 [12. C.N. Barry, S.A. Evans / J. Org. Chem. 1981, 46 (16), 3361-3364; 13. E. Palomino, A.P. Schaap, M.J. Heeg / Tetrahedron Lett. 1989, 30 (49), 6797-6800; 14. S.-T. Chen, S.-H Chiou, K.-T. Wang / J. Chem. Soc., Chem. Commun. 1990, 11, 807-809].
В работе [15. Т. Richter, H. Vogel / Chem. Eng. Technol. 2001, 24 (4), 340-343] описан способ получения ТГФ дегидратацией 1,4-бутандиола в воде в сверхкритических условиях, которая достигается при давлении 25-50 атм. и температуре 300-450°С. Реакция проходит с высокой скоростью и завершается за 10-500 сек. Селективность процесса ~100%. По предположению авторов циклодегидратация 1,4-бутандиола проходит по ионному механизму.
Межмолекулярную циклодегидратацию 1,2-этандиола катализируют кислотные ионные жидкости. Основным продуктом реакции является 1,4-диоксан. В качестве побочного продукта образуется 2-метил-1,3-диоксолан. Выход и чистота 1,4-диоксана зависят от природы кислотной ионной жидкости. При использовании кислотных ионных жидкостей с противоионами на основе пиридиния и имидазолия ([BuImPS][HSO4], [PyPS][HSO4], [MeImPS][HSO4]) выходы 1,4-диоксана выше, чем для жидкостей, содержащих противоионы [TsO]- и [H2РO4]- [16. Е. Ausekle, А. Priksane, A. Zicmanis / Lat. J. Chem. 2011, 50 (1/2), 139-144].

Кислотная ионная жидкость [PyPS][HSO4] катализирует циклодегидратацию 1,4-бутандиола с образованием ТГФ с количественным выходом [16. Е. Ausekle, A. Priksane, A. Zicmanis / Lat. J. Chem. 2011, 50 (1/2), 139-144].
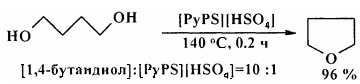
Аналогичная реакция циклодегидратации диэтиленгликоля [17. Y.-Y. Wang, W. Li, L.-Y. Dai / Chem. Papers. 2008, 62 (3), 313-317] в присутствии гидросульфата 1-бутил-3-метилимидазолия ([PSmim]HSO4) приводит к образованию 1,4-диоксана с селективностью 89,3%.
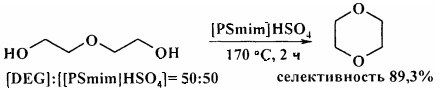
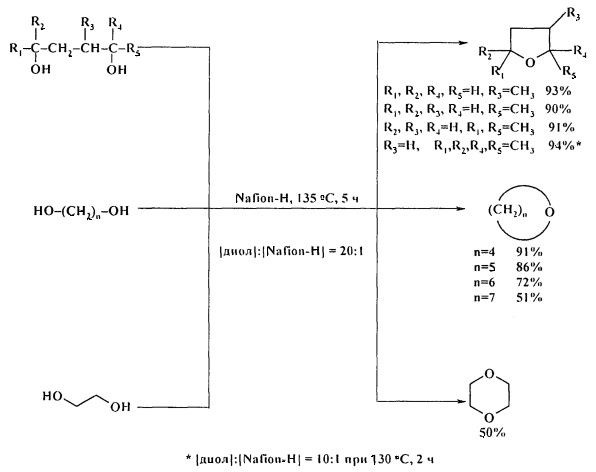
1,4-Бутандиол и его производные, а также 1,5-пентандиол, 1,6-гександиол, 1,7-гептандиол и диэтиленгликоль при нагревании в присутствии фторированной ионообменной смолы Nafion-H при 130-135°С за 5 ч превращаются в ТГФ и моно- и диметилтетрагидрофураны, тетрагидропирам, оксепан, оксокан и 1,4-диоксан соответственно с выходами 50-94%. [18. G.A. Olah, А.Р. Fung, R. Malhorla / Synthesis. 1981, 6, 474-476].
Ионная жидкость на основе хлорметилдиметилиминийхлорида (реагент Вильсмайера) используется при получении циклических эфиров из диолов [19. A.A. Hullio, G.M. Mastoi / Int. J. Chem. 2013, 5 (3), 57-69]

Дегидратация диолов катализируется бутилтрихлорстанном BuSnCl3 [20. G. Tagliavini, D. Marton, D. Furlani / Tetrahedron. 1989, 45 (4), 1187-1196].
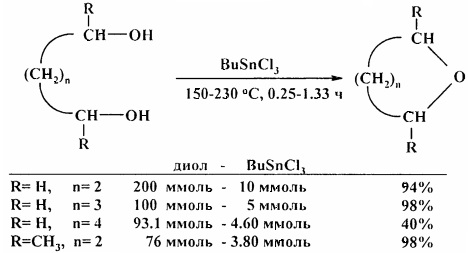
В аналогичных условиях тиодиэтиленгликоль превращается в 1,4-тиоксан [20. G. Tagliavini, D. Marton, D. Furlani / Tetrahedron. 1989, 45 (4), 1187-1196].
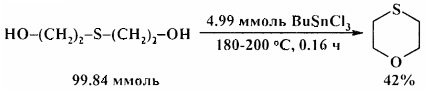
Для превращения диэтиленгликоля в 1,4-диоксан требуются более жесткие условия: 225°С, 4 ч [21. D. Marton, P. Slaviero, G. Tagliavini / Tetrahedron. 1989, 45 (22), 7099-7108].
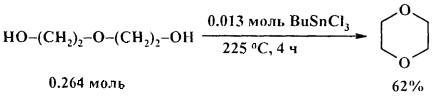
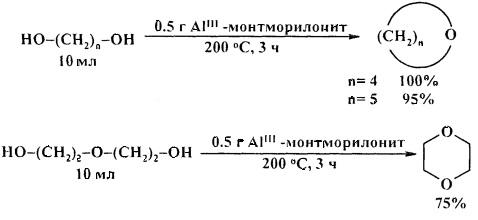
В работе [22. D. Kotkar, P.K. Ghosh / J. Chem. Soc., Chem. Commun. 1986, 9, 650-6511] осуществлен синтез циклических эфиров из 1,4-бутандиола, 1,5-пентандиола, диэтиленгликоля под действием цеолита Al-монтмориллонита. Выходы эфиров составили 75-100%. Диэтаноламин и 1,6-гександиол в реакцию в аналогичных условиях не вступают.
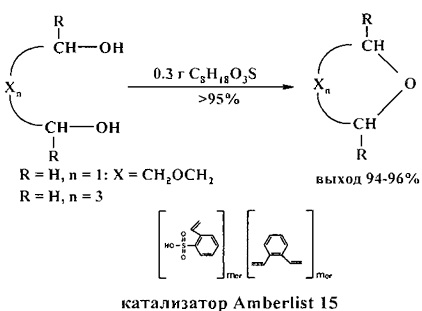
1,4-Диоксан можно получить циклодегидратацией диэтиленгликоля с использованием сульфокатионитной ионной смолы Amberlist-15 [23. L.T. Scott, J.O. Naples / Synthesis. 1973, 4, 209].
Реакция 1,4-диолов с диметилкарбонатом (ДМК) в присутствии основания в мягких условиях приводит к соответствующим циклическим простым эфирам с количественным выходом [24. F. Arico, P. Tundo, А. Maranzana, G. Tonachini / ChemSusChem. 2012, 5 (8), 1578-1586].
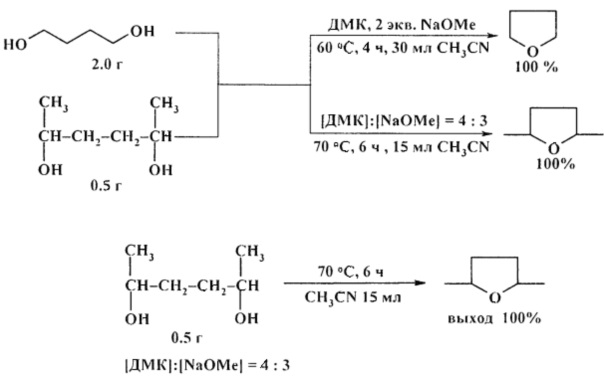
Удобным способом получения циклических эфиров из 1,4-, 1,5- и 1,6-диолов является перегонка над твердым катализатором AlPO4-Al2O3 [25. А. Costa, J.М. Riego/Synth. Commun. 2011, 17 (11), 1373-1376].
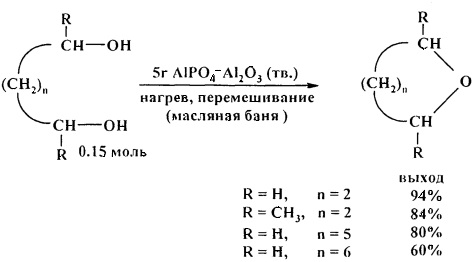
В аналогичных условиях 2-метил-2,4-пентандиол даст смесь продуктов. Этиленгликоль с низким выходом (2%) превращается в 1,4-диоксан, основными продуктами реакции являются смолистые соединения.
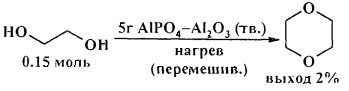
Эффективными катализаторами циклодегидратации диолов являются фосфиды олова, циркония и титана [26. S.M. Patel, U.V. Chudasama, P.А. Ganeshpure / Green Chem. 2001, 3, 143-145]. Наиболее высокую активность показал фосфид олова (IV), который был использован в качестве катализатора для циклодегидратации бутан-1,4-диола, пентан-1,5-диола, гексан-1,6-диола и диэтаноламина с получением тетрагидрофурана, тетрагидропирана, оксепана и морфолина соответственно
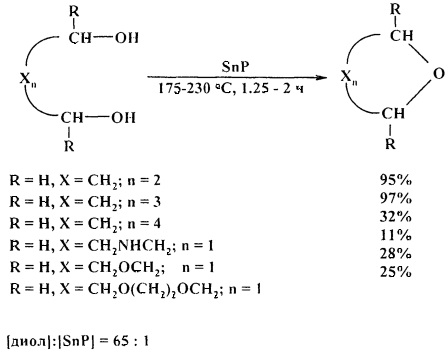
Циклодегидратация диэтиленгликоля, триэтиленгликоля, полиэтиленгликолей 200 и 300 в присутствии фосфида олова (IV) (SnP) приводит к 1,4-диоксану с низким выходом. [26. S.M. Patel, U.V. Chudasama, Р.А. Ganeshpure / Green Chem. 2001, 3, 143-145].
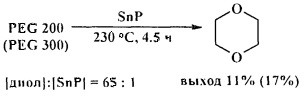
В присутствии SnP монометиловый эфир диэтиленгликоля превращается в 1,4-диоксан с выходом 97% [26. S.M. Patel, U.V. Chudasama, Р.А. Ganeshpure / Green Chem. 2001, 3, 143-145].
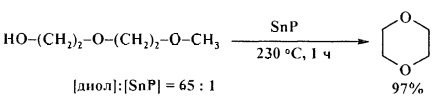
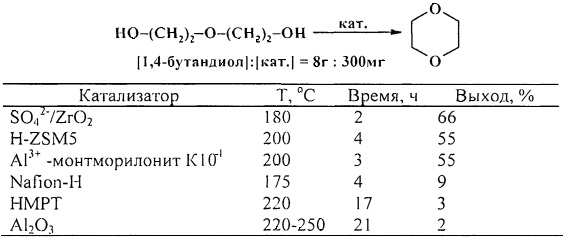
В работе [27. A. Wali, S.M. Pillai / J. Chem. Res. (S). 1999, 5, 326-327] 1,4-диоксан был получен циклодегидратацией диэтиленгликоля в присутствии следующих катализаторов: SO42-/ZrO2, H-ZSM5, Al3+-монтмориллонит K104, Nafion-H, НМРТ, Al2O3, лучшим из которых оказался сульфатированный оксид циркония.
Сульфатированный оксид циркония ZrO2/SO42- активно катализирует циклодегидратацию l,n-диолов [27. A. Wali, S.M. Pillai / J. Chem. Res. (S). 1999, 5, 326-327].
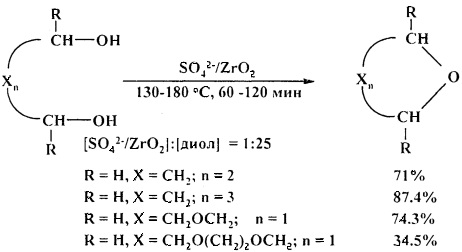
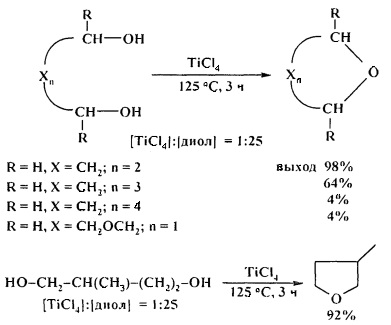
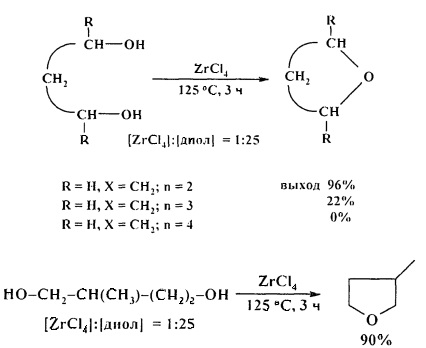
Эффективными катализаторами циклодегидратации диолов с образованием циклических простых эфиров являются комплексы титана, циркония и гафния CpxMCl4-x (х=0-2, М=Ti, Zr, Hf). Лучшие результаты были получены при использовании TiCl4, ZrCl4, в присутствии которых выход ТГФ (из 1,4-бутандиола) составил 98% и 96%) соответственно. С увеличением длины метиленовой цепи диола выходы соответствующих эфиров снижаются [28. A. Wali, Р.А. Ganeshpure, S.M. Pillai, S. Satish / Ind. Eng. Chem. Res. 1994, 33 (2), 444-447].
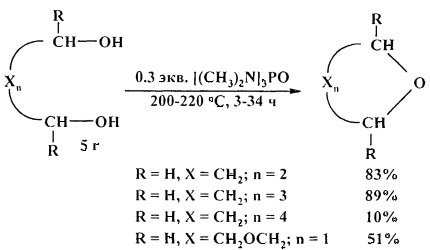
Весьма эффективным катализатором циклодегидратации 1,4- и 1,5-диолов является гексаметилфосфотриамид (ГМФТА).
Реакцию обычно проводят с 0,3 эквивалентами ГМФТА при повышенной температуре (200-220°С) с отгоном выделяющейся воды [29. J. Diab, М. Abou-Assali, С. Gervais, D. Anker / Tetrahedron Lett. 1985, 26 (12), 1501-1502].
Недостатки методов.
1. Применение дорогостоящих катализаторов: перфторированной сульфатированной смолы Nafion-H, ионных жидкостей и гексаметилфосфотриамида.
2. Большой расход катализаторов.
3. Реагент BuSnCl3 входит в список веществ, запрещенных к применению (Европейское законодательство в области химических веществ).
Гексаметилфосфотриамид - токсичный и канцерогенный реагент.
4. Высокая температура реакции до 230°С.
5. Необходимость использования безводных растворителей при проведении реакции диолов с диметилкарбонатом в присутствии NaOMe.
В качестве прототипа настоящего изобретения выбран способ получения циклических эфиров циклодегидратацией α,ω-диолов под действием безводного хлорида железа (III) FeCl3 [28. A. Wali, Р.А. Ganeshpure, S.M. Pillai, S. Satish / Ind. Eng. Chem. Res. 1994, 33 (2), 444-447].
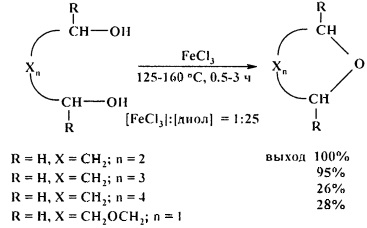
Прототип имеет следующие недостатки.
1. Большой расход катализатора.
2. Низкий выход 1,4-диоксана и оксенана.
Авторами предлагается способ получения циклических эфиров, не имеющий вышеперечисленных недостатков.
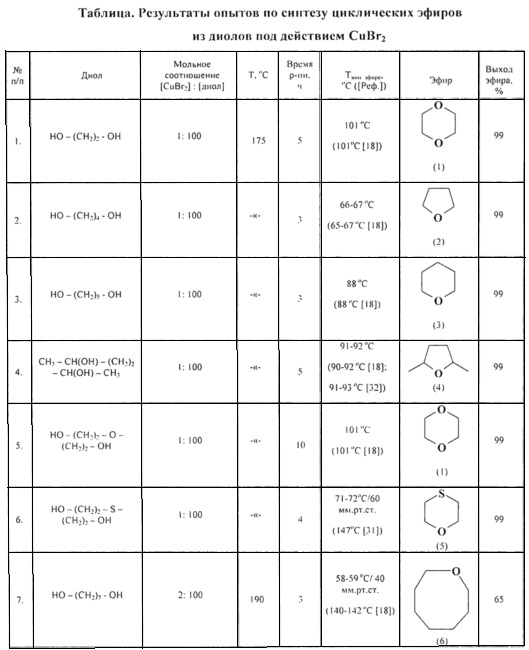
Сущность способа заключается в циклодегидратации l,n-диолов в присутствии катализатора CuBr2 при 175-190°С в течение 3-10 ч при мольном соотношении [CuBr2]:[диол]=1-2:100. Выход циклических эфиров (1-6) достигает ~99%. Синтез проводят в атмосфере инертного газа (аргон).
В отсутствие катализатора реакция не проходит.
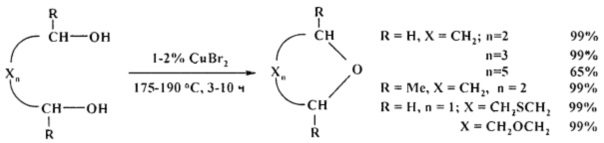
1,2-Этандиол в аналогичных условиях (175°С, 5 ч) претерпевает межмолекулярную дегидратацию и селективно превращается в 1,4-диоксан с количественным выходом.
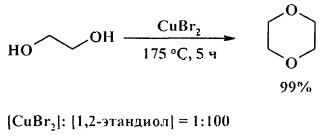
Существенные отличия предлагаемого способа от прототипа.
Для получения циклических эфиров из диолов используют новый катализатор CuBr2.
Преимущества предлагаемого метода.
1. Высокий выход целевых продуктов.
2. Селективность процесса.
3. Доступность и дешевизна катализатора.
4. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Синтез циклических простых эфиров (1).
Реакции проводили в стеклянной ампуле (V=12 мл), помещенной в микроавтоклав из нержавеющей стали (V=17 мл). В ампулу в токе аргона загружали 50 мг CuBr2 (0.2 ммоля) и 1.24 г этиленгликоля (20 ммолей). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 175°С в течение 3-10 ч с постоянным перемешиванием, затем автоклав охлаждали до ~20°С, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2СО3, органический слой экстрагировали хлористым метиленом и отфильтровывали. Хлористый метилен отгоняли, остаток перегоняли.
ПРИМЕР 2-6. Синтез циклических простых эфиров (1-5).
Аналогично примеру 1, но в качестве диола использованы: 1.8 г 1,4-бутандиола; 2.08 г 1,5-пентандиола; 2.36 г 2,5-гександиола; 2.12 г диэтиленгликоля, 2.44 г тиодиэтиленгликоля.
ПРИМЕР 7. Синтез циклического эфира (6).
Реакции проводили в стеклянной ампуле (V=12 мл), помещенной в микроавтоклав из нержавеющей стали (V=17 мл). В ампулу в токе аргона загружали 100 мг CuBr2 (0.4 ммоль) и 2.64 г 1,7-гептандиола (20 ммоль). Запаянную ампулу помешали в автоклав, автоклав герметично закрывали и нагревали при 190°С в течение 3 ч с постоянным перемешиванием, затем автоклав охлаждали до ~20°С, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3, органический слой экстрагировали хлористым метиленом и отфильтровывали. Хлористый метилен отгоняли, остаток перегоняли под вакуумом.
Строение полученных циклических эфиров (1-6) доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными [18. G.A. Olah, А.P. Fung, R. Malhorta / Synthesis. 1981, 6, 474-476; 30. W.A. Szarek, D.M. Vyas / Can. J. Chem. 1974, 52 (11), 2041-2047; 31. И. Хэйльброн, Г.М. Бэнбери. Словарь органических соединений. 1949, том III; 32. В.Т. Gillis, Р.Е. Beck / J. Org. Chem. 1963, 28 (5), 1388-1390].
Примеры, подтверждающие способ, приведены в таблице.