Результат интеллектуальной деятельности: Способ получения рекомбинантного пептидогликан-ассоциированного липопротеина (PAL) Legionella pneumophila
Вид РИД
Изобретение
Изобретение относится к биотехнологии, конкретно к биофармакологии, к областям получения и производства диагностических тест-систем, технологий выделения и очистки рекомбинантных белков и касается способа получения рекомбинантного пептидогликан-ассоциированного липопротеина (PAL) Legionella pneumophila, который может быть использован в качестве мишени при разработке диагностических препаратов для определения легионеллезов.
Основными сферами применения предлагаемого способа получения рекомбинантного белка PAL являются лабораторные биологические и медицинские исследования, диагностика легионеллезов, разработка средств специфической детекции бактерий Legionella pneumophila, санитарно-гигиенический контроль за распространением данного микробиального патогена.
Различные варианты белка PAL широко распространены в составе клеточной мембраны грамотрицательных бактерий, однако его структура у бактерий Legionella pneumophila высококонсервативна и специфична для бактерий данного вида. Белок PAL задействован в энергозависимом взаимодействии с белком TolА, обеспечивая существование комплекса, сформированного на внутренней мембране тремя белками (TolA, TolQ и TolR), а на внешней мембране белками TolB и PAL. Этот комплекс играет важную роль в обеспечении выживания бактерии и поддержании ее вирулентности, однако механизм его функционирования четко не установлен (Lazzaroni J.C., Dubuisson J.F., Vianney A. The Tol proteins of Escherichia coli and their involvement in the translocation of group A colicins. // Biochimie. – 2002. – V.84. -№5-6. – P.391-397; Michel L.V., Shaw J., MacPherson V., Barnard D., Bettinger J., D'Arcy B., Surendran N., Hellman J., Pichichero M.E. Dual orientation of the outer membrane lipoprotein Pal in Escherichia coli. // Microbiology. – 2015. – V.161. - №6. – P.1251-1259).
Некоторые грамотрицательные микроорганизмы, в частности Legionella pneumophila, обладают способностью секретировать липопротеины во внеклеточную среду, что является весьма удобным диагностическим признаком. Среди них PAL, который высвобождается в кровоток во время инфекции, и этот процесс способствует развитию септического шока (Godlewska R., Wis´niewska K., Pietras Z., Jagusztyn-Krynicka E.K. Peptidoglycan-associated lipoprotein (Pal) of Gram-negative bacteria: function, structure, role in pathogenesis and potential application in immunoprophylaxis. // FEMS Microbiology Letters. – 2009. – V. 298. - №1. – P 1-11). На сегодняшний день известны достаточно эффективные клинические диагностические тесты, основанные на определении видоспецифического белка PAL в моче больного легионеллезом (Legionella urinary antigen), позволяющие выявить подавляющее большинство изолятов патогенной Legionella pneumophila. Детекция белка PAL в моче позволяет существенно сократить время, требуемое для идентификации возбудителя, по сравнению с его выделением из образов мокроты классическими микробиологическими методами.
Легионеллез, особенно протекающий в форме «болезни легионеров», - тяжелое инфекционное заболевание, характеризующееся высокой (до 40%) смертностью, повышенной в случае несвоевременного начала терапии. «Золотой стандарт» микробиологической детекции легионелл, базирующийся на фактическом определении культуры с использованием селективных сред и являющийся основным гарантом в определении зараженности легионеллами, в последнее время признан малоэффективным в силу сложной техники избирательного культивирования, длительности роста, а иногда и технической невозможности забора образца, содержащего возбудитель. В клинической практике в настоящий момент наиболее распространена детекция легионелл с помощью тест-систем на основе ПЦР, которые при всей их эффективности обладают недостатками, присущими всем ПЦР-системам, такими как невозможность определять антигены напрямую при отсутствии в образце ДНК возбудителя, ингибирование реакции амплификации компонентами реакционной смеси и др. Известны экспрессные тест-системы для определения легионелл на основе иммуноферментного анализа (ИФА), чувствительность которых составляет около 70%. В целом, несмотря на достаточно высокую специфичность различных тест-систем детекции легионелл, существует проблема недостаточной их чувствительности. Существенно повысить чувствительность детекции легионеллезов можно за счет разработки тест-систем, основанных на современных технологических платформах, таких как, в частности, иммуно-ПЦР (Reller L. B., Weinstein M. P., Murdoch D. R. Diagnosis of Legionella infection // Clinical Infectious Diseases. – 2003. – V. 36. – №1. – P. 64-69; Gholipour A., Moosavian M., Makvandi M., Galehdari H., Alvandi A., Mard S. A. Development of an indirect sandwich ELISA for detection of urinary antigen, using Legionella pneumophila PAL protein // World Journal of Microbiology and Biotechnology. – 2014. – V. 30. – №5. – P. 1463-1471).
В Российской Федерации проводились разработки тест-систем для детекции легионеллы на основе ПЦР (в ЦНИИ эпидемиологии Роспотребнадзора, в компании ИнтерЛабСервис и др.), однако тест-системы на основе ИФА в России к настоящему моменту не производятся. Предложенный способ получения рекомбинантного белка PAL L.pneumophila является основой для создания тест-систем с целью эффективной детекции L.pneumophila на основе ИФА и иммуно-ПЦР.
Известен способ получения рекомбинантного белка PAL в клетках грамм-отрицательных бактерий под контролем сильного промотора, разработанный на примере PAL H. influenza (Патент WO 2001000790). Процесс предуматривает экстракцию модифицированного липидами белка, находящегося в нерастворимом состоянии в мембранной фракции бактерий, что неизбежно снижает чистоту конечного белкового препарата.
Известен способ получения белка PAL L. pneumophila, содержащего на С-конце последовательность шести гистидинов для очистки металл-хелатной хроматографией. Продукция белка осуществлялась под управлением лидерной последовательности pelB в периплазму бактерий, чистота белка после хроматографической очистки не превышала 80% (Gholipour A., Moosavian M., Galehdari H., Makvandi M., Mard S., RajabiMemari H., Imani R., Soleimani N., Alvandi A. Optimization of gene expression and purification of Legionella pneumophila peptidoglycan associated lipoprotein recombinant protein. // J. Shahrekord Univ. Med. Sci. – 2012. – V.14. - №3. – P.1-11). Данный подход позволяет получить корректно сложенный белок, обладающий нативной N-концевой первичной последовательностью, однако уровень продукции белка в периплазму в работе не обсуждается. На основе приведенных данных о существенном количестве рекомбинантного белка, сохраняющемся после экспрессии в растворимой фракции клеточного лизата, можно предположить, что лишь незначительная часть синтезированного внутриклеточного белка подвергается мембранному переносу и процессингу.
Известен способ продукции белка PAL L. pneumophila в эукариотических клетках линии NIH3T3 в векторе pcDNA3.1(+) методом липофекции, при этом способ дальнейшей очистки белка, его уровень продукции и степень чистоты белка не известны (Tian Y., Chen J. P., Yang C. L., Liu M. J. Cloning and expression of PAL gene of Legionella pneumophila // Journal of Sichuan University. Medical science edition. – 2007. – V. 38. – №4. – P. 583-6, 598). В целом, неоптимальная для эукариотической системы продукции утилизация кодонов в бактериальном белке, которая может повлиять на уровень синтеза белка, а также сложность и дороговизна проведения масштабной продукции белка в эукариотических системах сильно снижают перспективность такого подхода к получению PAL для диагностических целей.
Известен способ получения белка PAL L. pneumophila в составе единого полипептида с фрагментом глутатион-S-трансферазы (GST) в E. сoli в векторе pGEX-KG, предусматривающий дальнейшую очистку рекомбинантного белка методом аффинной хроматографии на глутатион-сефарозной смоле. По данному способу полипептид GST удаляют расщеплением тромбином c образованием белка PAL. В разработанной системе продукции полипептид GST-PAL накапливается в нерастворимой форме в бактериальной клетке, что требует последующего рефолдинга, снижающего количество и структурную гомогенность конечного белкового препарата PAL (Yoon W. S., Park S. H., Park Y. K., Park S. C., Sin J. I., Kim M. J. Comparison of responses elicited by immunization with a Legionella species common lipoprotein delivered as naked DNA or recombinant protein. // DNA and cell biology. – 2002. – V. 21. – №2. – P. 99-107; Kim M. J., Sohn J. W., Park D. W., Park S. C., Chun B. C. Characterization of a lipoprotein common to Legionella species as a urinary broad-spectrum antigen for diagnosis of Legionnaires' disease. // Journal of Сlinical Microbiology. – 2003. – V. 41. – №7. – P. 2974-2979).
Известен технически наиболее близкий к заявленному способ получения белка PAL L. pneumophila в E. сoli с целью создания диагностической системы на основе электрохимических иммуносенсоров для детекции легионеллезов. Белок получали в виде химеры с мальтозосвязывающим белком (MBP) с использованием вектора pMAL(C2X). Очистка белка MPB-PAL из бактериального лизата осуществлялась методом аффинной хроматографии на мальтозных колонках. Последующее удаление MBP проводилось на диэтиламиноэтил-сефарозных колонках (Lee J. Y., Jin J. H., Kim J. H., Kim M. J., Lee C. J., Min N. K. Plasma-activated carbon nanotube-based high sensitivity immunosensors for monitoring Legionella pneumophila by direct detection of maltose binding protein peptidoglycan-associated lipoprotein (MBP-PAL). // Biotechnology and bioengineering. – 2012. – V. 109. – №6. – P. 1471-1478). Несмотря на то что целевой белок удается получить в растворимом состоянии, процедура отщепления и удаления пептила MBP, по всей вероятности, проходит с низкой эффективностью, что, по мнению авторов, может ограничить применимость данного метода для создания тест-систем с использованием разработанного продуцента.
Настоящее изобретение решает задачу создания способа получения рекомбинантного пептидогликан-ассоциированного липопротеина (PAL) L. pneumophila в растворимом состоянии с нативной структурой и с высоким выходом для его дальнейшего использования в качестве белка-мишени при разработке диагностических тест-систем, направленных на обнаружение возбудителя легионеллеза.
Поставленная задача решается путем создания способа получения рекомбинантного белка PAL, включающего конструирование рекомбинантной плазмиды pET22b(+)-PAL длиной 6184 п.н., несущей экспрессионную конструкцию для продукции химерного полипептида, содержащего последовательность, кодирующую белок PAL L. pneumophila, слитую на 5’-конце с синтетической последовательностью, кодирующей шесть гистидинов и пептид SUMO.
Также поставленная задача решается за счет трансформации клеток E.coli BL21(DE3) экспрессионной плазмидной ДНК pET22b(+)-PAL, кодирующей рекомбинантный белок PAL, культивирования полученного штамма BL21(DE3)-PAL при температуре 37°С, продукции белка PAL в E.coli в течение 3 часов при температуре 37°С и получения бактериального лизата, содержащего рекомбинантный полипептид HIS-SUMO-PAL.
Также поставленная задача решается за счет очистки белка HIS-SUMO-PAL из растворимой фракции бактериального лизата металл-хелатной хроматографией, отщепления пептида HIS-SUMO обработкой SUMO-протеазой с формированием нативной первичной структуры белка PAL и удаления отщепленного пептида ионообменной и гель-фильтрационной хроматографией с получением гомогенного конечного препарата белка PAL с выходом не менее 300 мг белка с литра бактериальной культуры без ферментации, обладающего 98% чистоты по данным электрофореза и денситометрии.
Техническим результатом изобретения является создание эффективного способа конструирования продуцента, наработки и очистки рекомбинантного белка PAL L.pneumophila, применимого для нужд клинической диагностики и мониторинга распространенности возбудителя в окружающей природной и антропогенной среде.
Отличиями предлагаемого способа являются продукция белка PAL в составе единого полипептида с пептидом SUMO, способствующим растворимости синтезируемого полипептида, и применение высокоэффективной SUMO-протеазы для удаления пептида SUMO из состава очищенного химерного белка с образованием растворимого белка PAL, обладающего нативной N-концевой структурой. С использованием разработанного способа можно получить гомогенный препарат белка PAL с выходом не менее 300 мг белка с литра бактериальной культуры, характеризующийся 98% чистоты по данным электрофореза и денситометрии.
Предлагаемое техническое решение предусматривает проведение нескольких этапов хроматографической очистки, включая металл-хелатную хроматографию, а также ионообменную и гель-фильтрационную хроматографии, обеспечивающих получение белка высокой чистоты (до 98% по данным денситометрии).
Существенным достоинством предлагаемого способа получения белка PAL L. pneumophila является высокий выход рекомбинантного PAL (300 мг с литра бактериальной культуры без ферментации) в растворимой форме.
К преимуществам заявленного способа получения белка PAL относятся: 1) высокий уровень продукции рекомбинантного белка-предшественника SUMO-PAL в растворимой форме в экспрессионной системе в E.coli; 2) быстрая одноэтапная очистка белка-предшественника SUMO-PAL с помощью металл-хелатной хроматографии; 3) высокоспецифичное и эффективное расщепление белка-предшественника SUMO-PAL протеазой SUMO, не приводящее к неспецифическому протеолизу целевого белка при высоком выходе белка PAL, обладающего нативной N-концевой первичной структурой; 4) двухэтапная процедура хроматографической очистки целевого белка для удаления SUMO-пептида, приводящая к получению белка 98% чистоты; 5) высокий выход очищенного гомогенного растворимого рекомбинантного белка PAL, пригодного для использования в качестве мишени при разработке диагностических тест-систем для детекции L.pneumophila; 6) возможность экстраполяции разработанного способа для получения рекомбинантного белка PAL других патогенных и непатогенных бактерий.
Изобретение осуществляют следующим образом.
Конструируют рекомбинантную плазмидную ДНК pET22b(+)-PAL на основе коммерчески доступной плазмиды pET22b(+).
Фрагмент ДНК, кодирующий последовательность шести гистидинов и пептида SUMO синтезируют с помощью двух последовательных амплификаций с использованием праймеров SmF1, SmR1, SmF1_Nde и SmR1_Sac, представленных на Фиг.2. Синтезированный фрагмент ДНК содержит на концах сайты эндонуклеаз рестрикции NdeI и SacI, по которым его расщепляют и клонируют в расщепленную по тем же сайтам векторную плазмиду pET22b(+). Полученные бактериальные клоны pET22HIS-SUMO идентифицируют при помощи ПЦР с праймеров SmF1_Nde и SmR1_Sac, выделяют плазмидную ДНК клонов, содержащих по данным ПЦР встроенный инсерт HIS-SUMO, и верифицируют корректность встроенных последовательностей ДНК методом капиллярного секвенирования.
Фрагмент ДНК, кодирующий белок PAL, получают прямым ПЦР с генома L. pneumophila с использованием праймеров PAL_FSm, PALR_Sal и HgNSmBgl, представленных на Фиг.2. В состав праймеров входят сайты эндонуклеаз рестрикции Sal I и Bgl II. Полученный фрагмент ДНК расщепляют по сайтам указанных эндонуклеаз рестрикции Sal I и Bgl II и клонируют в расщепленную по тем же сайтам плазмиду pET22HIS-SUMO. Получают единичные клоны, которые затем идентифицируют по встраиванию последовательности, кодирующей PAL, при помощи ПЦР со стандартных праймеров T7forward и T7reverse на основе расчетных данных о длине ПЦР-фрагмента, содержащего последовательность PAL. Выделяют плазмидную ДНК клонов, образующих при ПЦР-амплификации продукт ожидаемой длины (pET22b(+)-PAL), и верифицируют корректность встроенной последовательности ДНК, кодирующей PAL, методом капиллярного секвенирования.
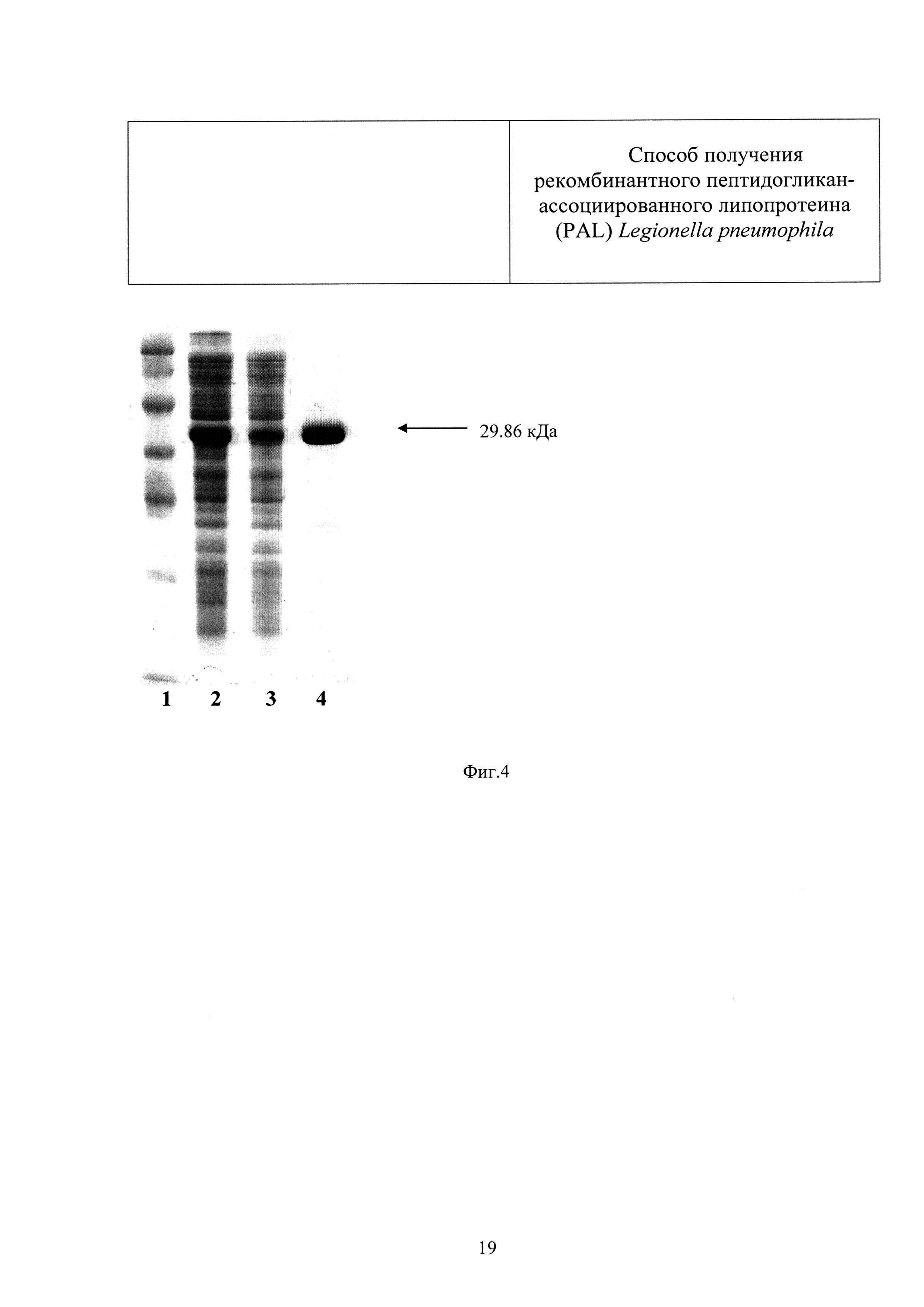
Плазмидой pET22b(+)-PAL трансформируют клетки штамма E.coli BL21(DE3) и получают единичные колонии продуцента белка PAL (BL21(DE3)-PAL). На основании результатов аналитической экспрессии выделяют клоны-суперпродуценты белка. Проводят препаративную экспрессию белка клонов-суперпродуцентов. Для этого бактериальные клоны выращивают в течение ночи в среде 2xYT, содержащей ампициллин и 1% глюкозы. 10 мл ночной культуры помещают в 1 литр свежей среды, содержащей 0,1% глюкозы и ампициллин, и наращивают культуру до достижения 1 единицы оптической плотности. Культуру инкубируют при 37°С и индуцируют синтез белка добавлением 0,2 мМ ИПТГ. Экспрессию белка проводят при 37°С в течение 3 часов. Бактериальную биомассу собирают центрифугированием и хранят при -70°С. Уровень продукции белка анализируют при помощи электрофореза в денатурирующем геле по методу Лэммли (Фиг.4).
Выделение белка PAL из бактериальной биомассы проводят при температуре 4°C. Лизис бактериальных клеток проводят 0,5% раствором Triton X-100 после обработки лизоцимом и отделяют растворимую фракцию клеточного лизата центрифугированием. Очистку полипептида SUMO-PAL из клеточного лизата осуществляют методом металл-хелатной хроматографии.
Белок обрабатывают протеазой SUMO для отщепления N-концевого пептида, содержащего последовательности шести гистидинов и пептида SUMO. Продукты протеолиза разделяют ионообменной хроматографией с последующей гель-фильтрацией. На каждом этапе контроль чистоты белка проводят методом электрофореза в денатурирующих условиях в полиакриламидном геле (ПААГ). Очищенный препарат белка PAL хранят при температуре -70 °С.
Измерение концентрации белка в полученном препарате проводят по методу Брэдфорда. Выход рекомбинантного белка PAL составляет 300 мг с литра бактериальной культуры. Чистоту полученного белкового препарата анализируют электрофорезом в 12% ПААГ с денситометрией (Фиг.5). Чистота полученного препарата PAL по данным денситометрии составляет 98%.
Изобретение иллюстрируют следующие графические материалы.
Фиг.1 - Нуклеотидная последовательность, кодирующая белок PAL, и его аминокислотная последовательность. А – нуклеотидная последовательность, кодирующая белок PAL; B - аминокислотная последовательность белка PAL; C – полная последовательность экспрессионной плазмиды pET22b(+)-PAL.
Фиг.2 - Последовательности праймеров, использованных при получении экспрессионной конструкции для продукции белка PAL в клетках E.coli.
Фиг.3 - Продукция белка PAL в клетках E.coli. Дорожка 1 – маркер молекулярной массы SM0441 (Thermo Scientific), дорожка 2 – растворимая фракция лизата клеток BL21(DE3)-PAL до индукции синтеза белка ИПТГ при 37 0С, дорожка 3 – нерастворимая фракция клеток BL21(DE3)-PAL до индукции синтеза белка ИПТГ при 370С, дорожка 4 – растворимая фракция клеток BL21(DE3)-PAL через 3 часа после индукции при 37°С, дорожка 5 – нерастворимая фракция клеток BL21(DE3)-PAL через 3 часа после начала продукции белка при 37°С.
Фиг.4 - Результаты выделения и очистки химерного белка SUMO-PAL металл-хелатной хроматографией. Дорожка 1 – маркер молекулярной массы SM0441 (Thermo Scientific), дорожка 2 – суммарный бактериальный лизат, дорожка 3 - растворимая фракция бактериального лизата до проведения очистки белка, дорожка 4 – химерный белок SUMO-PAL, очищенный методом металл-хелатной хроматографии.
Фиг.5 - Результаты отщепления пептида SUMO и очистки белка PAL ионнообменной и гель-фильтрационной хроматографией. Дорожка 1 - маркер молекулярной массы SM0671 (Thermo Scientific), дорожка 2 – белок SUMO-PAL, очищенный методом металл-хелатной хроматографии, дорожка 3 - белок SUMO-PAL, обработанный протеазой SUMO, дорожка 4 – белок PAL, очищенный методом ионнообменной хроматографии, дорожка 5 - белок PAL, очищенный методами ионнообменной и гель-фильтрационной хроматографии.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Создание экспрессионной конструкции для продукции белка PAL L. pneumophila в E.coli
Для получения геномной ДНК бактерии L. pneumophila культивируют в течение 5 суток на легионеллбакагаре при 37°С и смывают с чашек буфером, содержащим 200 мМ трис-HCl, 25 мМ хлорида натрия, 10 мМ SDS, 10 мМ ЭДТА. Бактериальную суспензию прогревают на водяной бане 20 минут при 65°С и центрифугируют 5 минут при 13000 g. Отбирают надосадочную жидкость, приливают к ней равный объем изопропанола, перемешивают, выдерживают 5 минут при 4°С и центрифугируют 5 минут при 13000g. Полученный осадок промывают 70% этанолом и центрифугируют 5 минут при 13000 g, затем осадок просушивают и растворяют в 50 мкл деионизованной воды.
Фрагмент ДНК, кодирующий последовательность шести гистидинов и пептида SUMO синтезируют с помощью двух последовательных амплификаций с использованием пар праймеров SmF1/SmR1 и SmF1_Nde/SmR1_Sac. ПЦР-амплификацию проводят при температуре отжига праймеров в 58°С в течение 25 циклов. Синтезированный фрагмент ДНК содержит на концах сайты эндонуклеаз рестрикции NdeI и SacI, по которым его расщепляют обработкой соответствующими эндонуклеазами и клонируют в расщепленную по тем же сайтам векторную плазмиду pET22b(+). Полученные бактериальные клоны pET22HIS-SUMO идентифицируют при помощи ПЦР с праймеров SmF1_Nde и SmR1_Sac, выделяют плазмидную ДНК клонов, содержащих по данным ПЦР встроенный инсерт HIS-SUMO, и верифицируют корректность встроенных последовательностей ДНК методом капиллярного секвенирования.
Фрагмент ДНК, кодирующий белок PAL, получают последовательной ПЦР-амплификацией с геномной ДНК L. pneumophila с использованием пар праймеров PAL_FSm/PALR_Sal и PAL_FSm/HgNSmBgl. В состав праймеров введены сайты эндонуклеаз рестрикции SalI (PALR_Sal) и BglII (HgNSmBgl). ПЦР-амплификацию проводят при температуре отжига праймеров в 58 °С в течение 25 циклов. В ПЦР-реакции содержится 10 pM каждого праймера и 1 мкг геномной ДНК. Полученные продукты реакции анализируют электрофоретически в агарозном геле на наличие фрагментов ДНК длиной 500 п.н.
Полученные с помощью ПЦР фрагменты ДНК обрабатывают эндонуклеазами рестрикции SalI и BglII и удаляют белок экстракцией водной смесью фенол/хлороформ с последующим спиртовым переосаждением. Проводят клонирование фрагмента PAL в вектор pET22HIS-SUMO, расщепленный по сайтам эндонуклеаз рестрикции XhoI и SalI. Единичные клоны, содержащие плазмиду pET22b(+) cо встроенной последовательностью, кодирующей белок PAL, получают электротрансформацией клеток штамма E.coli DH12S. Клоны, содержашие вставку длиной 500 п.н., идентифицируют при помощи ПЦР с праймеров T7 forward и T7 reverse. Выделяют плазмидную ДНК pET22b(+)-PAL и верифицируют корректность встроенной последовательности ДНК методом капиллярного секвенирования.
Пример 2. Получение продуцентов и продукция белка PAL в E.coli
Для получения продуцента в бактериальные клетки E.coli BL21(DE3) методом электротрансформации вставляют плазмиду pET22b(+)-PAL. Проводят аналитическую экспрессию единичных клонов BL21(DE3)-PAL, несущих плазмиду pET22b(+)-PAL. Для этого единичные колонии полученного штамма выращивают в течение ночи при 37°С в 5 мл среды 2xYT c добавлением 1% глюкозы и 50 мкг/мл ампициллина, засевают 100 мкл ночной культуры в 10 мл среды 2xYT, содержащей 0.1% глюкозы и 50 мкг/мл ампициллина, и выращивают при 37 °С в течение 3 часов. К выросшей культуре добавляют ИПТГ до 0,2 мМ и проводят экспрессию 3 часа при температуре 37 °С. Бактериальную биомассу продуцента собирают центрифугированием при 5000 об/мин 10 минут. Анализируют уровень экспрессии белка PAL денатурирующим электрофорезом в 12% полиакриламидном геле. После окончания электрофореза гель окрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Typhoon FLA9500. Клоны, обнаруживающие наибольший выход белка (образование на геле яркой полосы с молекулярной массой 30 кДа), являются суперпродуцентами, их выращивают на богатой среде (2xYT) в течение ночи, добавляют глицерин до 15% и замораживают при -70°С для хранения.
Для препаративной экспрессии штаммы-суперпродуценты E.coli BL21(DE3)-PAL с плазмидой pET22b(+)-PAL выращивают в течение ночи при 37°С c добавлением 1% глюкозы и 50 мкг/мл ампициллина на среде 2xYT, помещают 10 мл ночной культуры в 1000 мл среды 2xYT, содержащей 0.1% глюкозы и 50 мкг/мл ампициллина, и выращивают при 37°С до достижения 1 единицы оптической плотности. Выросшую культуру охлаждают, добавляют ИПТГ до 0,2 мМ и проводят экспрессию 3 часа при 37°С. Далее клетки собирают центрифугированием при 5000 об/мин 10 минут и хранят в виде замороженных осадков при температуре -70°С.
Пример 3. Выделение и очистка белка PAL из бактериальной биомассы.
Все этапы выделения белка PAL проводят при температуре 4°C. 50 г биомассы суспендируют в 200 мл раствора, cодержащего 20 мМ трис-HCl pH 7,5, 200 мМ хлорида натрия, обрабатывают лизоцимом в концентрации 20 мкг/мл в течение 20 минут, а затем добавляют к суспензии Triton X-100 до концентрации 0,5%. Проводят обработку полученного лизата ДНКазой и РНКазой в концентрации каждого из ферментов 10 мкг/мл. Полученный клеточный лизат центрифугируют в течение 30 минут при 14000 об/мин.
Отобранную растворимую фракцию лизата очищают методом металл-хелатной хроматографии на колонке cOmplete™ His-Tag Purification Resin (Roche Life Sciences) в буфере, содержащем 20 мМ трис-HCl pH 8, 100 мМ хлорида натрия. Элюцию белка PAL с колонки проводят буфером, содержащим 20 мМ трис-HCl pH 8, 100 мМ хлорида натрия, 50 мМ имидазола.
Для обработки белка протеазой SUMO в белковый раствор добавляют дитиотрейтол (DTT) до концентрации 0,1 мМ и протеазу SUMO (Thermo Fisher Scientific) в массовом соотношении протеазы к белку 1:1000. Обработку проводят при 30°С в течение 2 часов. Результаты расщепления белка протеазой анализируют электрофоретически.
Анионообменную хроматографию проводят на колонке Q-Sepharose (GE Healthcare). Белок наносят на колонку в буфере, содержащем 20 мМ трис-HCl pH 8, 20 мМ хлорида натрия и элюируют градиентом хлорида натрия на том же буфере от 20 до 500 мМ в течение 40 минут. Фракции, содержащие белок фосфатазы, идентифицируют электрофорезом в 12% ПААГ, концентрируют при помощи центрифужных концентраторов Amicon Ultra-15 (Millipore, США) и наносят на гель-фильтрационную колонку Superdex 200 10/300 GL, уравновешенную буфером, содержащим 20 мM MES pH 8, 100 мМ хлорида натрия. Фракции, содержащие целевой белок, определяют электрофоретически, объединяют, концентрируют и измеряют концентрацию белка. Белок PAL хранят в аликвотах при температуре -70°С в присутствии 30% глицерина. Выход белка составляет 300 мг с литра культуры.
Способ получения рекомбинантного пептидогликан-ассоциированного липопротеина (PAL) Legionella pneumophila, включающий конструирование рекомбинантной плазмиды pET22b(+)-PAL длиной 6184 п.н., несущей экспрессионную конструкцию для продукции химерного полипептида, содержащего последовательность, кодирующую белок PAL L. pneumophila, слитую на 5'-конце с синтетической последовательностью, кодирующей шесть гистидинов и пептид SUMO, трансформацию клеток Е. coli BL21(DE3) экспрессионной плазмидной ДНК pET22b(+)-PAL, культивирование полученного штамма BL21(DE3)-PAL при температуре 37°С, продукцию белка PAL в Е. coli в течение 3 часов при температуре 37°С, получение бактериального лизата, содержащего рекомбинантный полипептид HIS-SUMO-PAL, очистку белка HIS-SUMO-PAL из растворимой фракции бактериального лизата металл-хелатной хроматографией, отщепление пептида HIS-SUMO обработкой SUMO-протеазой с восстановлением нативной первичной структуры белка PAL и удаление отщепленного пептида ионообменной и гель-фильтрационной хроматографией с получением гомогенного конечного препарата белка PAL.