Результат интеллектуальной деятельности: Способ производства сухих очищенных солей желчных кислот для бактериологии
Вид РИД
Изобретение
Изобретение относится к клинической и санитарной микробиологии и может быть использовано в составе селективных питательных сред для обнаружения и количественного учета энтеробактерий при исследовании различного биологического материала, а также объектов окружающей среды.
Питательные среды подразделяют на селективные, избирательные, накопления, обогащения. Принцип создания элективных питательных сред основан на удовлетворении основных биохимических и энергетических потребностей того вида микроба, для культивирования которого они предназначены. Определенный состав и концентрация питательных веществ, микроэлементов, ростовых факторов при строго определенном значении рН обеспечивают оптимальные условия для выращивания микроорганизмов. При исследовании на наличие патогенных бактерий необходимо подавить рост сопутствующей микрофлоры. С этой целью используют различные ингибиторы.
Желчь и соли желчных кислот входят в состав селективных сред для выращивания патогенных энтеробактерий. Смесь желчных кислот, получаемая в результате щелочного гидролиза желчи, входит в состав среды Плоскирева. За рубежом в составе селективных сред используют соли отдельных желчных кислот, в основном дезоксихолат натрия.
Желчь представляет собой водный раствор различных ингредиентов, обладающих свойствами коллоидного раствора. Основными компонентами желчи являются желчные кислоты (холевая и в небольшом количестве дезоксихолевая), фосфолипиды, желчные пигменты, холестерин, в ее состав входят так же жирные кислоты, белок, бикарбонаты, натрий, калий, кальций, хлор, магний, йод, незначительное количество марганца, а также витамины, гормоны, мочевина, мочевая кислота, ряд ферментов и др.
Наибольшим ингибирующим эффектом, для придания селективных свойств питательным средам, обладают соли основных желчных кислот - холевой и дезоксихолевой.
В России нет коммерческого производства сухой смеси солей желчных кислот для бактериологических целей.
Наиболее близким способом получения очищенных солей желчных кислот является лабораторный способ получения желчных кислот по И.С. Олькеницкому (1957). (МУК 4.2.1884-04 «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов» Приготовление желчной соли по Олькеницкому. п. 2.4.18.)
Согласно этой методике к 1000 мл желчи крупного рогатого скота прибавляют 40 г натрия гидрата окиси, гидролизуют смесь в автоклаве при 120°С в течение 3 ч. После охлаждения в гидролизат прибавляют 100 мл 20%-го водного раствора бария хлористого и прогревают в автоклаве при 100°С в течение 1 ч. Через 18-24 ч отстаивания надосадочную жидкость сливают и фильтруют. К профильтрованному гидролизату прибавляют при постоянном помешивании 20%-й раствор соляной кислоты до кислой реакции (рН 6,4-6,6) и оставляют на 18-24 ч. Надосадочную жидкость сливают, осадок промывают водой, прибавляют при нагревании 40%-ный раствор натрия гидрата окиси до слабо щелочной реакции (рН 7,2-7,4) и выливают на противень для подсушивания в сушильном шкафу при 115°С до порошкообразного состояния. Из 1000 мл желчи можно получить 36 г смеси желчных солей. Следует остерегаться перещелачивания при последней операции. Хранят соли в темной банке с притертой пробкой.
Недостатками способа получения желчных солей по И.С. Олькеницкому являются:
- отсутствие промышленного производства сухого препарата;
- темно-зеленый цвет раствора желчных солей по И.С. Олькеницкому негативно сказывается на качестве питательных сред;
- невозможность использования в прозрачных питательных средах, ввиду мутности получаемого препарата;
- наличие примесей, не являющихся желчными кислотами;
- слабая ингибирующая способность.
Техническим результатом изобретения является создание отечественного коммерческого сухого препарата солей желчных кислот для бактериологии полностью растворяющегося в воде, не содержащего примесей, прозрачного, и придающего выраженный ингибирующий эффект селективным дифференциально-диагностическим питательным средам в отношении некоторых грамположительных и грамотрицательных микроорганизмов ассоциантов.
Технический результат достигается тем, что предложен способ производства сухих солей желчных кислот (СЖК) из нативной желчи крупного рогатого скота, включающий щелочной гидролиз, обработку гидролизата 20%-ным хлористым барием, охлаждение и отстаивание осажденных примесей с последующей фильтрацией, осаждение желчных кислот в изоэлектрической точке с рН 6,4-6,6 20%-ным раствором соляной кислоты, растворение осадка 20%-ным натрия гидроокиси при рН 7,2-7,4, причем предварительно к нативной желчи добавляют активированный уголь, смесь нагревают до температуры (95±2)°С в течение 25-30 мин, фильтруют, затем щелочной гидролиз осветленной желчи проводят 50%-ным раствором натра едкого при при температуре 130°С в течение 12 ч при непрерывном перемешивании, освобождение от непрогидролизованных белков и высокомолекулярных пептидов проводят методом фильтрации, удаляют надосадочную жидкость, растворяют осадок в дистиллированной воде, а примеси из раствора СЖК адсорбируют активированным углем при нагревании смеси до температуры (90±2)°С в течение 0,5 ч., фильтруют и высушивают в виброкипящем слое.
Отличием предлагаемого способа получения сухого препарата смеси желчных кислот от прототипа (лабораторной методики приготовление желчных солей по И.С. Олькеницкому) является создание промышленной технологии отечественного производства очищенных СЖК, содержащих не менее 50% солей желчных кислот, полностью растворяющихся в воде и образующих прозрачный или слегка опалесцирующий раствор для использования в бактериологических целях.
Технологический процесс состоит из нескольких стадий:
1. Осветление нативной желчи. Размороженную желчь крупного рогатого скота, с содержанием сухих веществ 9-11% в количестве 75 литров загружают в реактор, добавляют 1,9 кг угля активированного, смесь нагревают до температуры (95±2)°С путем подачи пара в рубашку реактора и выдерживают 25-30 мин при работающей мешалке, затем смесь охлаждают до температуры (40-20)°С. Охлажденную смесь фильтруют через картон на фильтр-прессе, измеряя объем фильтрата.
2. Гидролиз осветленной желчи. 60 литров осветленной желчи загружают в реактор, добавляют 6 литров 50%-ного раствора натра едкого, нагревают до температуры (130±2)°С путем подачи пара в рубашку реактора и выдерживают в течение 12 ч при работающей мешалке. Гидролизат очищенной желчи охлаждают до комнатной температуры и фильтруют через картон на фильтр-прессе.
3. Осаждение примесей. Готовят 20%-ный раствор бария хлористого растворением при перемешивании 1,2 кг бария хлористого вносят в 6,0 л воды дистиллированной. Фильтрат гидролизата очищенной желчи загружают в реактор и добавляют раствор бария хлористого из расчета 0,1 л на 1,0 л фильтрата. Смесь нагревают до температуры (100±2)°С путем подачи пара в рубашку реактора и выдерживают в течение 1 ч. Смесь охлаждают до температуры (40-20)°С и отстаивают в течение 24 ч для осаждения примесей, затем фильтруют через картон на фильтр-прессе. Фильтрат загружают в пищеварочный котел, предварительно замерив рН, и при постоянном перемешивании осторожно добавляют 20%-ный раствор кислоты соляной для снижения рН до значения 6,4-6,6. При этом в темно-коричневом фильтрате образуется визуально видимый хлопьевидный осадок свободных желчных кислот, который агрегируется в липкую, тягучую массу серо-зеленого цвета.
4. Получение и осветление СЖК. Сливают надосадочную жидкость, а осадок свободных желчных кислот, заливают дистиллированной водой (из расчета 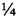 часть первоначального объема желчи). Нагревают смесь до температуры (50±2)°С путем подачи пара в рубашку котла. Добавляют 20%-ный раствор натра едкого до достижения рН значения 7,2-7,4. В пищеварочный котел добавляют уголь активированный из расчета 25 г/л, нагревают смесь до температуры (90±2)°С и выдерживают в течение 0,5 ч. Смесь СЖК с углем охлаждают до температуры около 50°С и фильтруют через картон под вакуумом. Измеряют содержание сухих веществ в растворе СЖК, которое должно быть не более 12%. Проводят биохимический контроль качества по следующим параметрам:
часть первоначального объема желчи). Нагревают смесь до температуры (50±2)°С путем подачи пара в рубашку котла. Добавляют 20%-ный раствор натра едкого до достижения рН значения 7,2-7,4. В пищеварочный котел добавляют уголь активированный из расчета 25 г/л, нагревают смесь до температуры (90±2)°С и выдерживают в течение 0,5 ч. Смесь СЖК с углем охлаждают до температуры около 50°С и фильтруют через картон под вакуумом. Измеряют содержание сухих веществ в растворе СЖК, которое должно быть не более 12%. Проводят биохимический контроль качества по следующим параметрам:
- прозрачность и цветность (прозрачная, слегка опалесцирующая жидкость желто-зеленого цвета);
- рН раствора (рН 8,0±2,0);
- сухой остаток (не более 12%, при необходимости разбавить дистиллированной водой).
4. Сушка СЖК. Сушку СЖК производят на сушильной установке ФМУ-П при следующих параметрах рабочего режима: температура воздуха на входе в сушильную камеру tвх °С - 124-132; температура воздуха на выходе из сушильной камеры tвых °C - 102-108; Потоком восходящего воздуха сухие СЖК собирают в накопительные емкости и вручную выгружают порциями, массой 8-10 кг.
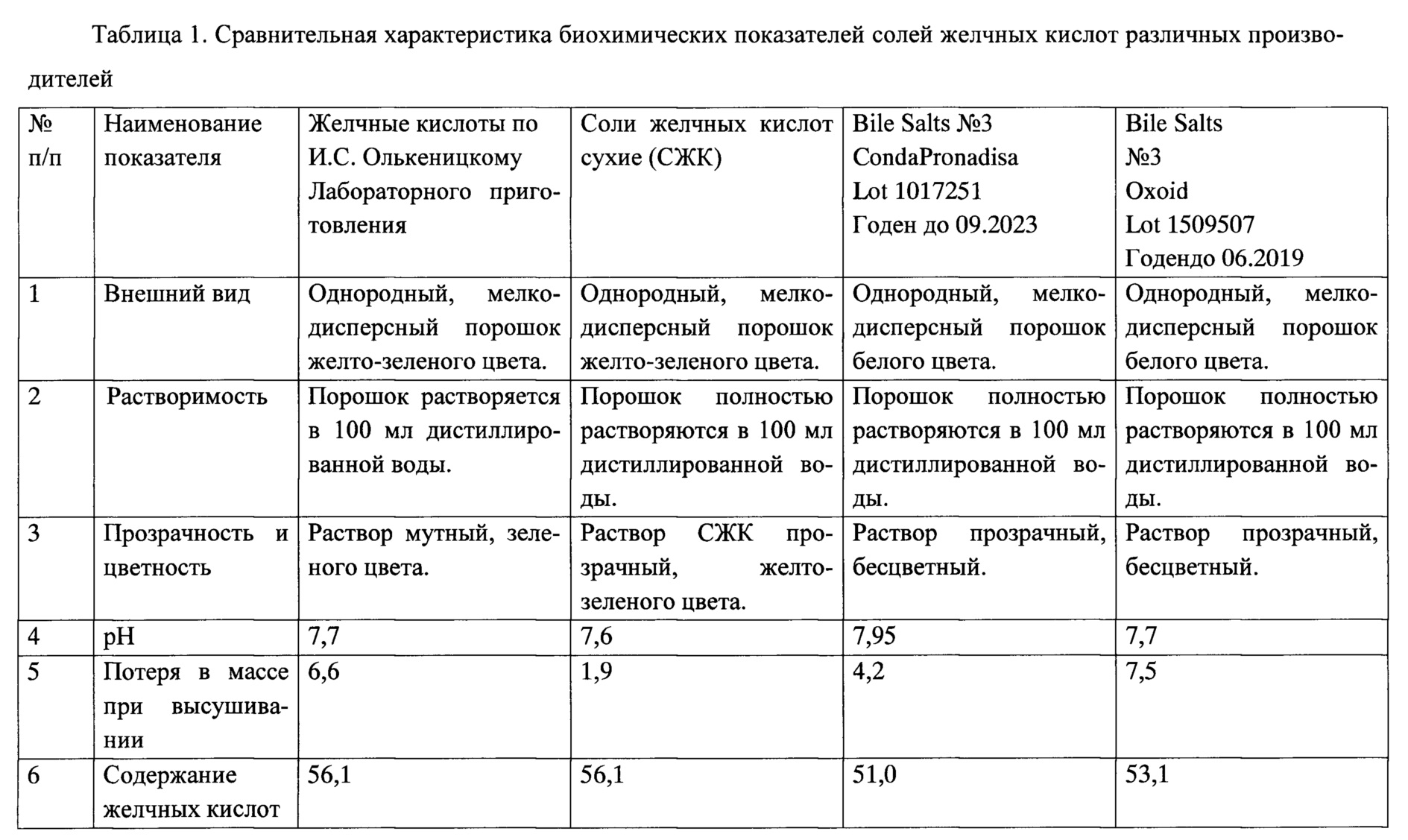
5. Контроль качества сухого препарата СЖК. Внешний вид - однородный, мелкодисперсный порошок желто-зеленого цвета. 2,0 г порошка должны полностью растворяются в 100 мл дистиллированной воды, 2%-ный раствор СЖК должен быть прозрачным, желто-зеленого цвета. Допускается легкая опалесценция, рН. 6,0-10,0. Потеря в массе при высушивании не более 7,0%. Содержание солей желчных кислот не менее 50%.
Исходя из того, что содержание сухих веществ в нативной желчи составляет 7-8%, выход солей желчных кислот по предложенному способу производства составит не менее 20% от исходного.
Сравнительная характеристика биохимических показателей солей желчных кислот различных производителей представлена в таблице 1.
Проведена качественная и количественная оценка СЖК в сравнении с желчью очищенной сухой производства ФБУН ГНЦ ПМБ методом газожидкостной хроматографии на хроматографе НР5890 с кварцевой колонкой, 15 м × 0,25 мм × 0,25 мкм (фаза SPB-1). Метод ввода пробы - с делением потока, 25:1. Объем вводимой пробы - 2 мкл. Температурная программа - от 200°С (0,5 мин) со скоростью 10°С/мин до 305°С (10 мин). Температуры испарителя/детектора -290/320°С. Регистрация сигнала - НР3396А.
Метод количественной обработки результатов - внутренний стандарт (искусственно введенная литохолевая кислота для количественных вычислений). Калибровочные коэффициенты (независимое определение):
Е хол/литохол 0,96
К дезоксихол/литохол 1 >06
К навескам отобранной в две пробирки пробы исследуемого препарата (75,1 мг) добавили навески чистой литохолевой кислоты (18,0 мг), растворили смесь при нагревании в 6,0 мл ~90%-ного этилового спирта. Высушили в пузырьках по 50 мкл раствором, силанизировали смесью 100 мкл сухого пиридина и 150 мкл БСТФА (+3% ТМХС) в течение 1 ч при 90С.
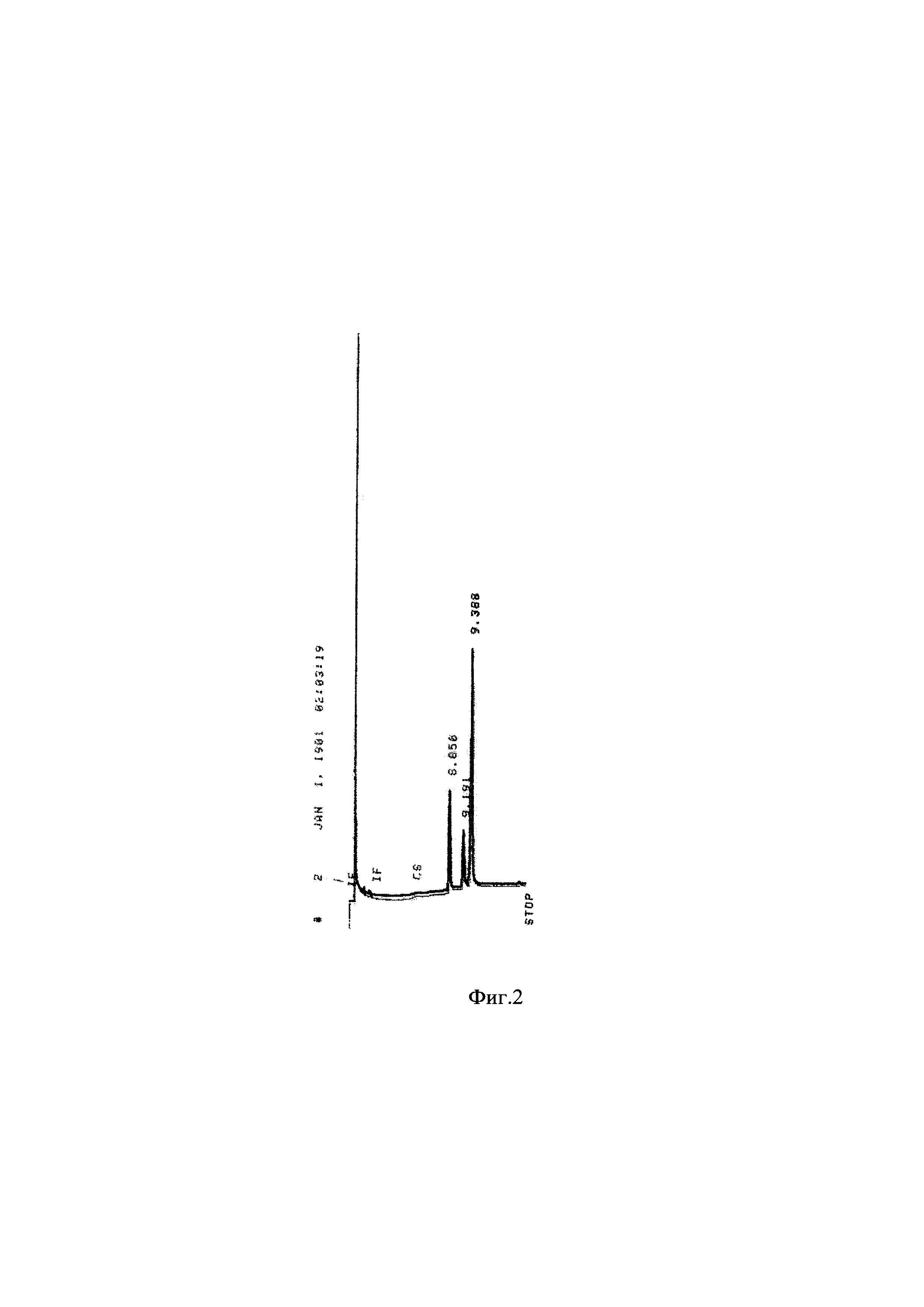
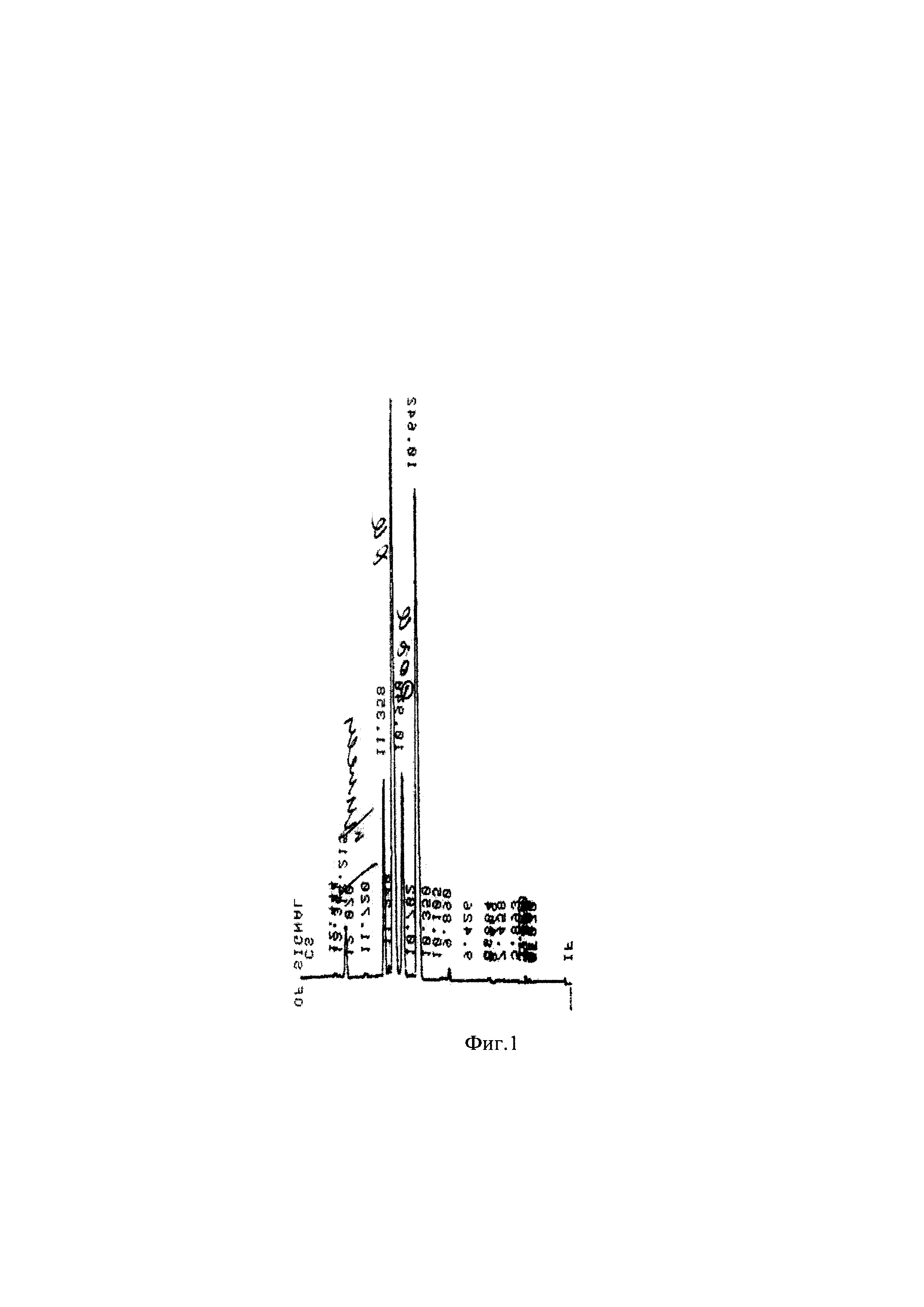
Результаты представлены в таблице 2 и на фиг. 1 и 2.
Фиг. 1 Хроматограмма желчи очищенной сухой (ЖОГ) ФБУН ГНЦ ПМБ
Фиг. 2 Хроматограмма солей желчных кислот (СЖГ) ФБУН ГНЦ ПМБ
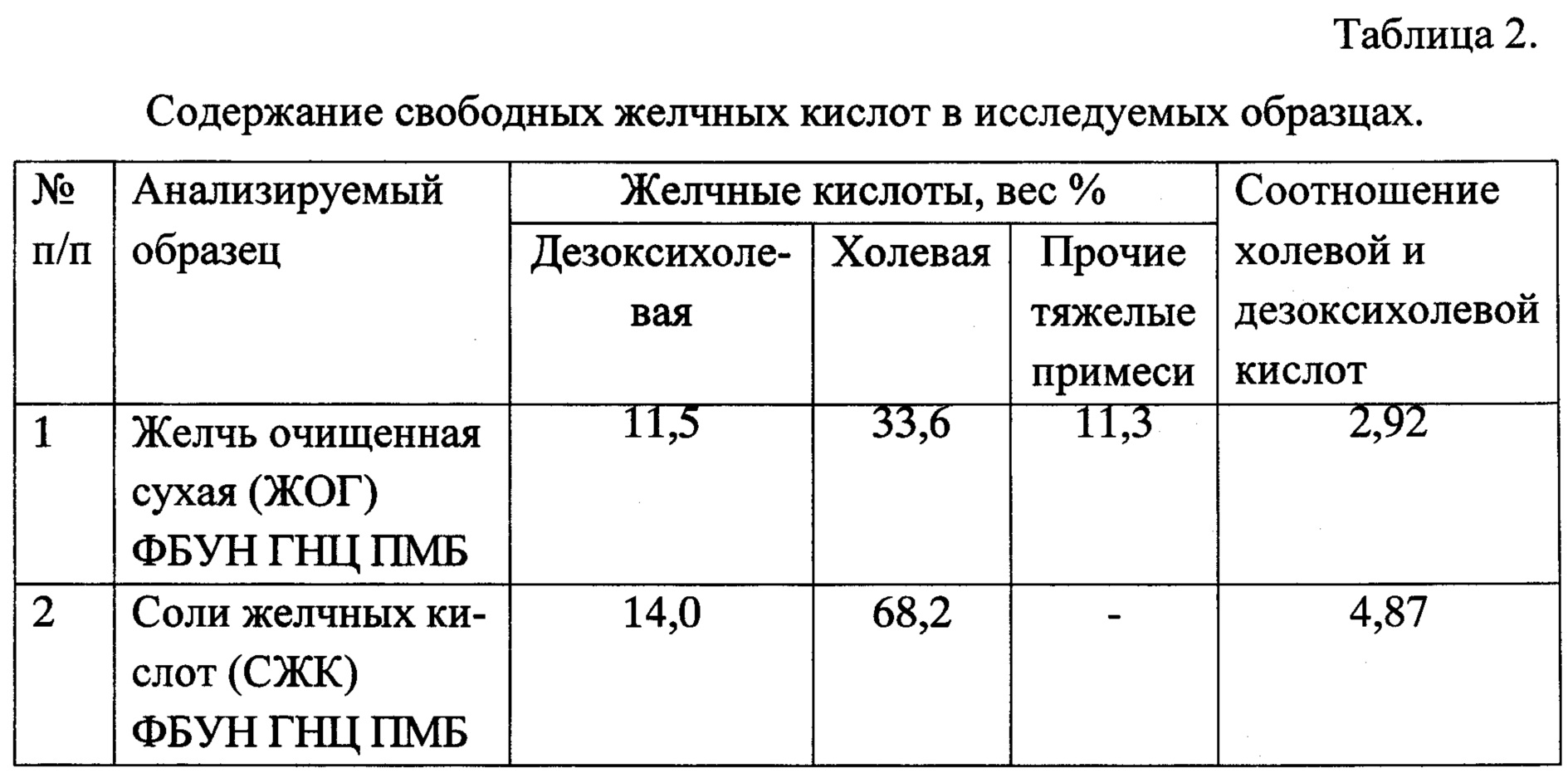
Следует отметить, что проба солей желчных кислот (СЖК) очень чистая, практически нет жирных кислот и холестерина, а из желчных кислот в аналитических количествах присутствуют только холевая и дезоксихолевая кислоты. Хенодезоксихолат, как и другие минорные компоненты не обнаружены.
ЖОГ содержит суммарное содержание желчных кислот на уровне 45 вес.% при соотношении ХК : ДОХК около 3%. Кроме того, ЖОГ содержит достаточно много примесей.
СЖК характеризуется суммарным содержанием желчных кислот, близким к 82-83 вес.%, а отношение ХК : ДОХК для образца равно приблизительно 4,8-4,9.
Изучена возможность использования полученного препарата СЖК в составе питательных сред для выявления возбудителей инфекционных заболеваний микробиологическим методом. Исследована ингибирующая способность СЖК в составе дифференциально-элективной питательной среды для выделения клебсиелл. В качестве контрольной питательной среды, наиболее близкой по составу, является Агар МакКонки (модифицированный) по ААЗ MacConkeyAgar, Modified (asperAPHA) фирмы HIMEDIA следующего состава:

Испытуемые СЖК были использованы в той же концентрации, то есть 1,5 г/л.
Для контроля качества питательных сред были использованы тест-штаммы микроорганизмов, полученные из отдела коллекционных культур ФБУН ГНЦ ПМБ. Готовили стандартную взвесь культуры каждого тест-штамма, соответствующую 10 единицам по стандартному образцу мутностиОСО 42-28-85 П, с использованием стерильного 0,9% раствора натрия хлористого. Полученные взвеси культур десятикратными разведениями (4,5 мл 0,9% раствора натрия хлорида с 0,5 мл микробной взвеси) доводили до необходимых разведений: 10-6, 10-4 и 10-1 использовали для контроля среды.
Посевы инкубировали при температуре (37±1)°С в течение 20-24 ч.
Результаты биологического контроля представлены в таблице 4.
Таким образом, сравнительный анализ результатов позволяет сделать вывод, что разработана промышленная технология производства солей желчных кислот ФБУН ГНЦ ПМБ согласно которой получен препарат для бактериологии обладающий рядом преимуществ:
- разработан отечественный конкурентоспособный препарат сухих солей желчных кислот;
- разработанные соли желчных кислот в отличие от солей лабораторного приготовления прозрачные, желто-зеленого цвета;
- не содержат примесей;
- имеют оптимальное соотношение холевой и дезоксихолевой кислот, не менее 4, что благоприятно сказывается на ингибирующей способности СЖК в составе элективных дифференциально-диагностических питательных сред;
- не уступают импортным аналогам по суммарному содержанию солей желчных кислот и отсутствию примесей;
- обеспечивают придание питательным средам селективных свойств;
- плановая калькуляция себестоимости производства 1 кг СЖК составляет 12700 руб, что в 2,0-3,0 раза ниже стоимости импортных аналогов.
- использование СЖК в составе отечественных питательных сред для бактериологических исследований снижает их стоимость.