Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 1Н-БЕНЗО[F]ХРОМЕН-2-ИЛ(АРИЛ)КЕТОНОВ
Вид РИД
Изобретение
Изобретение относится к способу получения 1H-бензо[ƒ]хроменов, содержащих во втором положении ароильную группу. Подобные соединения представляют практический интерес, поскольку хроменовый фрагмент входит в состав ряда природных соединений и фармакологически активных веществ, и это стимулирует создание новых методов их синтеза.
Данным изобретением решена задача разработки нового высокоэффективного способа получения замещенных 1H-бензо[ƒ]хроменов, содержащих ароильный заместитель в положении 2.
Формула изобретения - способ получения 1H-бензо[ƒ]хромен-2-ил(арил)кетонов конденсацией 1-[(диметиламино)метил]-2-нафтолов и 3-(диметиламино)-1-арил-проп-2-ен-1-онов в мольном соотношении 1:1 в среде кипящей уксусной кислоты.
В литературе представлено ограниченное число способов получение хроменил- и бензохромениларилкетонов: сочетание бензиловых спиртов с дитиоацеталями кетенов [1], циклоприсоединение енаминов к предшественникам о-метиленхинонов [2, 3], присоединение С-нуклеофилов по Михаэлю к тозилалкилфенолам с последующей циклизацией [4], реакции 2-галогенбензилбромидов или гидроксифенилметилфенолов с 1,3-дикарбонильными соединениями [5-8], взаимодействие фенольных и нафтольных оснований Манниха с арил(этинил)кетонами [9], трехкомпонентная конденсация 1,3-дикетонов, 2-нафтола и ароматических альдегидов [10, 11], а также ацилирование мостиковых бензопиранов в присутствии трифлата алюминия (III) [12]. 4-Замещенные 3-ацетилхромены были получены из салициловых альдегидов или салицил-N-тозилиминов и кетонов ацетиленового ряда в присутствии DABCO [13, 14]. Следует отметить, что большинство из указанных методов не имеют общего характера, а синтез исходных соединений в ряде случаев представляет самостоятельную синтетическую задачу. Кроме того, большинство описанных методов предполагают использование 1,3-дикарбонильных соединений или их синтетических эквивалентов, вследствие чего полученные хромениларилкетоны имеют заместители во 2-м и (или) 4-м положении в пирановом цикле, что ограничивает круг дальнейших возможных превращений. В то же время ряд ацилхроменов обладает противораковой [13] и антибактериальной активностью [10], что свидетельствует об актуальности поиска новых методов их получения.
Наиболее близким по конечному результату к заявляемому способу является трехкомпонентный синтез 1,3-диарил-1H-бензо[ƒ]хромен-2-ил(арил)кетонов из 1,3-дифенилпропан-1,3-диона, ароматических альдегидов и 2-нафтола при катализе бис(имино)пиридиновым комплексом железа (II) в отсутствии растворителя [11]. Однако использование дорогостоящего металл-содержащего катализатора и ограниченный круг исходных субстратов снижают ценность данного метода, особенно при получении мультиграммовых количеств бензохроменов.
Способ заключается в том, что эквимолярную смесь 2-нафтола, ароматического альдегида и 1,3-дифенилпропан-1,3-диона в присутствии 10 моль. % комплекса хлорида железа (II) с (1E, 1'E)-1,1'-(4-нитропиридин-2,6-диил)бис(N-мезитилэтан-1-имином) облучают ультразвуком при 60°C в течение 1 ч. Смесь охлаждают до комнатной температуры, экстрагируют дихлорметаном, катализатор удаляют фильтрованием. Органический слой промывают водой, сушат над Na2SO4, растворитель отгоняют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле и получают 1,3-диарил-1H-бензо[ƒ]хромен-2-ил)(фенил)метаноны с выходами около 80%.
Указанный способ обладает целым рядом существенных недостатков.
1. Метод позволяет получать только производные, содержащие в положениях 1 и 3 арильные заместители.
2. Для достижения высоких выходов необходимо использование ультразвука, что требует применения специального дорогостоящего оборудования.
3. В качестве катализатора используется труднодоступный комплекс Fe(II). Хотя необходимое количество катализатора составляет 10 моль. %, его высокая молекулярная масса приводит к тому, что по массе катализатора требуется лишь в 2.5 раза меньше, чем исходного 2-нафтола.
4. Проведение реакции без растворителя затрудняет контроль за ходом процесса при больших загрузках реагентов.
5. Обработка реакционной смеси достаточно трудоемка, необходима очистка колоночной хроматографией на силикагеле.
Более приемлемым с точки зрения доступности реагентов и простоты выглядит получение хромениларилкетонов из 2-нафтольных оснований Манниха через промежуточное образование о-метиленхинонов. Полученный нами технический результат - более универсальный и менее трудоемкий способ синтеза 1H-бензо[ƒ]хромен-2-ил(арил)кетонов, в том числе незамещенных по первому положению, общей формулы I
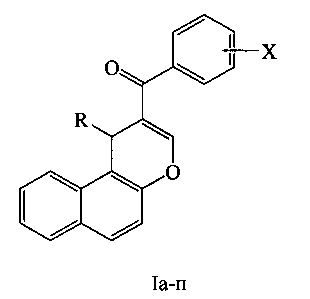
где R, X: Н, Н (Ia); Ph, Н (Iб); 4-СН3ОС6Н4, Н (Iв); 3-NO2C6H4, Н (Iг); Ph, 4-СН3 (Iд); 4-СН3ОС6Н4, 4-СН3 (Ie); 3-NO2С6H4, 4-СН3 (Iж); Н, 4-Cl (Iз); Ph, 4-Cl (Iи); 4-СН3ОС6Н4, 4-Cl (Ik); 3-NO2C6H4, 4-Cl (1л); Ph, 4-CH3O (Iм); 4-СН3ОС6Н4, 4-CH3O (Iн); Н, 2-НО (Iо).
Технический результат достигается тем, что в способе получения 1H-бензо[ƒ]хромен-2-ил(арил)кетонов используются основания Манниха нафталинового ряда в качестве исходных соединений общей формулы II
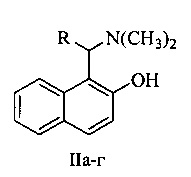
где R=Н (IIа), Ph (IIб), 4-МеОС6Н4 (IIв), 3-NO2C6H4 (IIг)
и 3-(диметиламино)-1-арил-проп-2-ен-1-оны общей формулы III
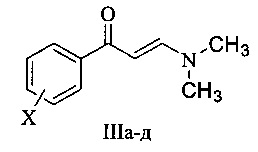
где X=Н (IIIа), 4-Cl (IIIб), 4-CH3O (IIIв), 4-СН3 (IIIг), 2-ОН (IIIд).
Отличительные признаки:
1. Использование легко доступных оснований Манниха и 3-(диметиламино)-1-арил-проп-2-ен-1-онов, содержащих как донорные, так и акцепторные группы в ароматических заместителях.
2. Применение эквимолярных количеств реагентов в отсутствие катализатора.
3. Использование в качестве растворителя уксусной кислоты.
4. Длительность протекания реакции обычно составляет 1-2 ч.
Заявляемое изобретение имеет следующие преимущества:
1. Распространение метода на синтез 1-незамещенных 1H-бензо[ƒ]хромен-2-ил (арил)кетонов.
2. Не требуется использование дорогостоящих металл-содержащих катализаторов.
3. Для очистки конечного продукта обычно достаточно однократной перекристаллизации из этанола.
4. Синтез легко масштабируется.
5. Предлагаемый метод не предполагает использование ультразвука, что существенно упрощает схему реактора и не требует применения сложного и дорогостоящего оборудования.
Исходные основания Манниха нафталиновой серии IIа-г и 3-(диметиламино)-1-арил-проп-2-ен-1-оны IIIа-д получены по описанным в литературе методикам [15, 16].
Примеры выполнения способа
ИК спектры записаны на спектрометре Shimadzu FTIR-8400S в таблетках КВr. Спектры ЯМР 1Н и 13С (400 и 100 МГц соответственно), а также DEPT зарегистрированы на спектрометре JEOL JNM-ECX400 в CDCl3. Измерения проводили без использования дополнительных эталонов с привязкой частоты к сигналу дейтерированного растворителя. Элементный анализ выполнен на автоматическом CHNS-анализаторе Euro Vector ЕА-3000. Температуры плавления определены капиллярным методом на приборе ПТП-М.
Пример 1
1H-Бензо[ƒ]хромен-2-ил(фенил)метанон (Iа). Смесь 0.34 г (1.7 ммоль) 1-[(диметиламино)метил]-2-нафтола (IIа) и 0.30 г (1.7 ммоль) 3-(диметиламино)-1-фенил-проп-2-ен-1-она (IIIа) нагревали при кипении 1 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.34 г (70%). Бесцветные кристаллы, т. пл. 158-160°C. ИК спектр, v, см-1: 1655, 1628 (С=O), 1593, 1512, 1466, 1439, 1389, 1323, 1281, 1223, 1180, 972, 910, 849, 814, 716. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 4.01 (2Н, с, СН2), 7.17 (1H, д, J=8.7, HAr), 7.46-7.57 (5Н, м, Н-3, HAr), 7.61 (1Н, т, J=7.6, HAr), 7.69 (2Н, д, J=7.1, HAr), 7.72 (1H, д, J=8.9, HAr), 7.84 (1Н, д, J=8.0, HAr), 7.95 (1Н, д, J=8.4, HAr). Спектр ЯМР 13С, δ, м. д.: 20.6 (СН2), 112.9 (С), 115.2 (С), 117.1 (CH), 123.1 (СН), 125.2 (СН), 127.2 (СН), 128.4 (СН), 128.5 (2СН), 128.6 (СН), 128.9 (2СН), 131.1 (С), 131.5 (СН), 132.1 (С), 138.8 (С), 146.8 (С), 155.2 (СН-3), 195.7 (С=O). Вычислено для С20Н14О2, %: С 83.90; Н 4.93. Найдено, %: С 83.80; Н 4.88.
Пример 2
1-Фенил-1H-бензо[ƒ]хромен-2-ил(фенил)метанон (Iб). Смесь 0.47 г (1.7 ммоль) 1-[(диметиламино)(фенил)метил]-2-нафтола (IIб) и 0.30 г (1.7 ммоль) 3-(диметиламино)-1-фенил-проп-2-ен-1-она (IIIа) нагревали при кипении 1 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.46 г (75%). Бесцветные кристаллы, т. пл. 209-211°C. ИК спектр, v, см-1: 1639 (С=O), 1616, 1593, 1454, 1381, 1319, 1231, 1192, 991, 814, 729, 698. Спектр ЯМР 1H, δ, м. д. (J, Гц): 6.02 (1Н, с, Н-1), 7.08 (1H, т, J=7.3, HAr), 7.20 (2Н, t, J=7.5, HAr), 7.32 (1H, д, J=8.9, HAr), 7.37-7.51 (8Н, м, Н-3, HAr), 7.54 (2Н, д, J=7.3, HAr), 7.79 (2Н, т, J=7.7, HAr), 7.99 (1H, д, J=8.2, HAr). Спектр ЯМР 13С, δ, м. д.: 36.5 (СН-1), 116.5 (С), 117.1 (СН), 120.6 (С), 123.8 (СН), 125.0 (СН), 126.6 (СН), 127.1 (СН), 128.4 (2СН), 128.5 (3СН), 128.6 (2СН), 128.9 (2СН), 129.2 (СН), 131.6 (С), 131.70 (СН), 131.74 (С), 138.8 (С), 144.8 (С), 148.7 (С), 152.6 (СН-3), 194.9 (С=O). Вычислено для C26H18O2, %: С 86.16; Н 5.01. Найдено, %: С 86.21; Н 4.96.
Пример 3
1-(4-Метоксифенил)-1H-бензо[ƒ]хромен-2-ил(фенил)метанон (Iв). Смесь 0.52 г (1.7 ммоль) 1-[(диметиламино)(4-метоксифенил)метил]-2-нафтола (IIб) и 0.30 г (1.7 ммоль) 3-(диметиламино)-1-фенил-проп-2-ен-1-она (IIIа) нагревали при кипении 1.5 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.53 г (80%). Бесцветные кристаллы, т. пл. 212-214°C. ИК спектр, v, см-1: 2928, 1639 (С=O), 1593, 1508, 1462, 1381, 1319, 1312, 1258, 1227, 1177, 1038, 988, 833, 810, 698. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.69 (3Н, с, СН3), 5.97 (1Н, с, Н-1), 6.73 (2Н, д, J=8.7, HAr), 7.28-7.32 (3Н, м, HAr), 7.36-7.51 (6Н, м, HAr), 7.54-7.56 (2Н, м, HAr), 7.75-7.80 (2Н, м, HAr), 7.99 (1Н, д, J=8.5, HAr). Спектр ЯМР 13С, δ, м. д.: 35.7 (СН-1), 55.2 (СН3), 113.9 (2СН), 116.7 (С), 117.1 (СН), 120.7 (С), 123.9 (СН), 125.0 (СН), 127.1 (СН), 128.4 (2СН), 128.5 (СН), 128.9 (2СН), 129.1 (СН), 129.5 (2СН), 131.6 (С), 131.7 (СН), 131.8 (С), 138.0 (С), 139.2 (С), 147.7 (С), 152.5 (СН-3), 158.1 (С-О), 195.0 (С=O). Вычислено для С27Н20О3, %: С 82.63; Н 5.14. Найдено, %: С 82.57; Н 5.20.
Пример 4
1-(3-Нитрофенил)-1H-бензо[ƒ]хромен-2-ил(фенил)метанон (I г). Смесь 0.55 г (1.7 ммоль) 1-[(диметиламино)(3-нитрофенил)метил]-2-нафтола (IIг) и 0.30 г (1.7 ммоль) 3-(диметиламино)-1-фенил-проп-2-ен-1-она (IIIа) нагревали при кипении 1.5 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.43 г (62%). Бесцветные кристаллы, т. пл. 175-177°C. ИК спектр, v, см-1: 3067, 2924, 1636 (С=O), 1593, 1531 (NO2), 1350 (NO2), 1319, 1277, 1227, 1180, 1080, 988, 922, 849, 810, 729, 694, 683. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 6.12 (1Н, с, Н-1), 7.36-7.57 (10Н, м, HAr), 7.81-7.89 (4Н, м, HAr), 7.96 (1Н, д, J=8.0, HAr), 8.18 (1Н, с, HAr). Спектр ЯМР 13С, δ, м. д.: 36.4 (СН-1), 115.0 (С), 117.3 (СН), 119.3 (С), 122.0 (СН), 123.2 (СН), 123.4 (СН), 125.4 (СН), 127.5 (СН), 128.6 (2СН), 128.8 (2СН), 128.9 (СН), 129.4 (С), 130.0 (СН), 131.1 (С), 131.88 (С), 131.93 (СН), 134.9 (СН), 138.3 (С), 146.8 (С), 147.8 (С), 148.7 (С), 153.8 (СН-3), 194.4 (С=O). Вычислено для C26H17NO4, %: С 76.65; Н 4.21; N 3.44. Найдено, %: С 76.60; Н 4.19; N 3.37.
Пример 5
1-Фенил-1H-бензо[ƒ]хромен-2-ил(4-метилфенил)метанон (Iд). Смесь 0.47 г (1.7 ммоль) 1-[(диметиламино)(фенил)метил]-2-нафтола (IIб) и 0.32 г (1.7 ммоль) 3-(диметиламино)-1-(n-толил)-проп-2-ен-1-она (IIIг) нагревали при кипении 1 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.45 г (70%). Бесцветные кристаллы, т. пл. 205-206°C. ИК спектр, v, см-1: 1639 (С=O), 1601, 1508, 1454, 1416, 1400, 1377, 1319, 1304, 1254, 1227, 1177, 1026, 988, 930, 837, 810, 760, 698. Спектр ЯМР 1H, δ, м. д. (J, Гц): 2.38 (3Н, с, СН3), 6.02 (1Н, с, Н-1), 7.08 (1Н, тт, J=7.3, 1.2, HAr), 7.17-7.21 (4Н, м, HAr), 7.31 (1Н, д, J=8.9, HAr), 7.36-7.48 (7Н, м, Н-3, HAr), 7.78 (2Н, д, J=8.0, HAr), 7.98 (1H, д, J=8.5, HAr). Спектр ЯМР 13С, δ, м. д.: 21.6 (СН3), 36.6 (СН-1), 116.4 (С), 117.1 (СН), 120.5 (С), 123.9 (СН), 125.0 (СН), 126.6 (СН), 127.1 (СН), 128.4 (2СН), 128.5 (2СН), 128.6 (СН), 129.1 (4СН), 129.2 (СН), 131.6 (С), 131.7 (С), 136.0 (С), 142.4 (С), 144.8 (С), 147.8 (С), 152.0 (СН-3), 194.7 (С=O). Вычислено для С27Н20О2, %: С 86.14; Н 5.36. Найдено, %: С 86.21; Н 5.29.
Пример 6
1-(4-Метоксифенил)-1H-бензо[ƒ]хромен-2-ил(4-метилфенил)метанон (Iе). Смесь 0.52 г (1.7 ммоль) 1-[(диметиламино)(4-метоксифенил)метил]-2-нафтола (IIв) и 0.32 г (1.7 ммоль) 3-(диметиламино)-1-(n-толил)-проп-2-ен-1-она (IIIг) нагревали при кипении 1 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.45 г (65%). Бесцветные кристаллы, т. пл. 209-212°C. ИК спектр, v, см-1: 1639 (С=O), 1609, 1589, 1508, 1462, 1439, 1400, 1373, 1315, 1303, 1227, 1184, 1107, 1026, 988, 922, 829, 810, 745, 702. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.38 (3Н, с, СН3), 3.68 (3Н, с, СН3О), 5.97 (1Н, с, Н-1), 6.72 (2Н, д, J=7.8, HAr), 7.19 (2Н, д, J=7.4, HAr), 7.26-7.32 (3Н, м, HAr), 7.36-7.48 (5Н, м, Н-3, HAr), 7.77 (2Н, т, J=7.2, HAr), 7.98 (1Н, д, J=8.2, HAr). Спектр ЯМР 13С, δ, м. д.: 21.6 (СН3), 35.8 (СН-1), 55.2 (ОСН3), 113.9 (2СН), 116.7 (С), 117.1 (СН), 120.6 (С), 123.9 (СН), 125.0 (СН), 127.1 (СН), 128.5 (СН), 129.07 (3СН), 129.10 (2СН), 129.4 (2СН), 131.6 (С), 131.7 (С), 136.1 (С), 137.3 (С), 142.4 (С), 147.8 (С), 151.8 (СН-3), 158.1 (С-О), 194.8 (С=O). Вычислено для C28H22O3, %: С 82.74; Н 5.46. Найдено, %: С 82.71; Н 5.41.
Пример 7
1-(3-Нитрофенил)-1H-бензо[ƒ]хромен-2-ил(4-метилфенил)метанон (Iж). Смесь 0.55 г (1.7 ммоль) 1-[(диметиламино)(3-нитрофенил)метил]-2-нафтола (IIг) и 0.32 г (1.7 ммоль) 3-(диметиламино)-1-(n-толил)-проп-2-ен-1-она (IIIг) нагревали при кипении 1 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.39 г (55%). Бесцветные кристаллы, т. пл. 188-190°C. ИК спектр, v, см-1: 1636 (С=O), 1609, 1593, 1528 (NO2), 1462, 1350 (NO2), 1315, 1303, 1277, 1227, 1180, 991, 922, 853, 826, 810, 756. Спектр ЯМР 'Н, δ, м. д. (J, Гц): 2.39 (3Н, с, СН3), 6.11 (1Н, с, Н-1), 7.21 (2Н, д, J=7.3, HAr), 7.35-7.46 (6Н, м, HAr), 7.56 (1Н, с, Н-3), 7.81-7.88 (4Н, м, HAr), 7.96 (1Н, д, J=8.0, HAr), 8.15 (1H, с, HAr). Спектр ЯМР 13С, δ, м. д.: 21.6 (СН3), 36.5 (СН-1), 115.0 (С), 117.3 (СН), 119.2 (С), 121.9 (СН), 123.3 (СН), 123.4 (СН), 125.3 (СН), 127.5 (СН), 128.8 (СН), 129.0 (2СН), 129.2 (2СН), 129.4 (СН), 130.0 (СН), 131.1 (С), 131.8 (С), 134.9 (СН), 135.6 (С), 142.7 (С), 146.9 (С), 147.8 (С), 148.6 (С), 153.2 (СН-3), 194.2 (С=O). Вычислено для C27H19NO4, %: С 76.95; Н 4.54; N 3.32. Найдено, %: С 77.01; Н 4.49; N 3.28.
Пример 8
1H-Бензо[ƒ]хромен-2-ил(4-хлорфенил)метанон (Iз). Смесь 0.47 г (1.7 ммоль) 1-[(диметиламино)метил]-2-нафтола (IIа) и 0.36 г (1.7 ммоль) 3-(диметиламино)-1-(4-хлорфенил)-проп-2-ен-1-она (IIIб) нагревали при кипении 2 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.38 г (69%). Бесцветные кристаллы, т. пл. 210-212°C. ИК спектр, v, см-1: 3059, 2912, 1632 (С=O), 1593, 1520, 1466, 1393, 1319, 1281, 1231, 1180, 1088, 972, 911, 833, 810, 741, 687. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 4.01 (2Н, с, СН2), 7.18 (1Н, д, J=8.9, HAr), 7.45-7.52 (4Н, м, HAr), 7.60-7.66 (3Н, м, HAr), 7.74 (1H, д, J=9.0, HAr), 7.85 (1H, д, J=8.0, HAr), 7.95 (1H, д, J=8.2, HAr). Спектр ЯМР 13С, δ, м. д.: 20.5 (СН2), 112.8 (С), 115.2 (С), 117.1 (СН), 123.1 (СН), 125.3 (СН), 127.2 (СН), 128.4 (СН), 128.6 (СН), 128.8 (2СН), 130.3 (2СН), 131.1 (С), 132.1 (С), 137.0 (С), 137.9 (С), 146.8 (С), 155.1 (1-СН), 194.3 (С=O). Вычислено для C20H13ClO2, %: С 74.89; Н 4.09. Найдено, %: С 74.94; Н 4.01.
Пример 9
1-Фенил-1H-бензо[ƒ]хромен-2-ил(4-хлорфенил)метанон (Iи). Смесь 0.47 г (1.7 ммоль) 1-[(диметиламино)(фенил)метил]-2-нафтола (IIб) и 0.36 г (1.7 ммоль) 3-(диметиламино)-1-(4-хлорфенил)-проп-2-ен-1-она (IIIб) нагревали при кипении 2 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.46 г (68%). Бесцветные кристаллы, т. пл. 163-165°C. ИК спектр, v, см-1: 3028, 1643 (С=O), 1620, 1593, 1485, 1450, 1396, 1373, 1312, 1269, 1223, 1188, 1153, 1088, 1015, 988, 926, 856, 837, 810, 752, 698. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 6.00 (1Н, с, Н-1), 7.09 (1Н, т, J=7.3, HAr), 7.21 (2Н, т, J=7.8, HAr), 7.32 (1Н, д, J=8.9, HAr), 7.36-7.45 (7Н, м, НAr, Н-3), 7.49 (2Н, д, J=8.5, НА), 7.79 (2Н, т, J=6.8, HAr), 7.98 (1H, д,.J=8.5, HAr). Спектр ЯМР 13С, δ, м. д.: 36.6 (СН-1), 116.3 (С), 117.1 (СН), 120.5 (С), 123.8 (СН), 125.1 (СН), 126.7 (СН), 127.2 (СН), 128.5 (2СН), 128.6 (СН), 128.7 (2СН), 128.8 (2СН), 129.3 (СН), 130.3 (2СН), 131.5 (С), 131.8 (С), 137.0 (С), 138.1 (С), 144.7 (С), 147.7 (С), 152.5 (СН-3), 193.6 (С=O). Вычислено для C26H17ClO2, %: С 78.69; Н 4.32. Найдено, %: С 78.61; Н 4.36.
Пример 10
1-(4-Метоксифенил)-1H-бензо[ƒ]хромен-2-ил(4-хлорфенил)метанон (Iк). Смесь 0.52 г (1.7 ммоль) 1-[(диметиламино)(4-метоксифенил)метил]-2-нафтола (IIв) и 0.36 г (1.7 ммоль) 3-(диметиламино)-1-(4-хлорфенил)-проп-2-ен-1-она (IIIб) нагревали при кипении 2 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.46 г (64%). Бесцветные кристаллы, т. пл. 156-158°C. ИК спектр, v, см-1: 1639 (С=O), 1589, 1508, 1462, 1439, 1396, 1377, 1315, 1227, 1184, 1096, 1026, 988, 922, 837, 826, 806, 775, 745. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.68 (3Н, с, CH3O), 5.94 (1H, с, Н-1), 6.73 (2Н, д, J=8.7, HAr), 7.27 (2Н, д, J=8.7, HAr), 7.31 (1H, д, J=8.9, HAr), 7.35-7.46 (5Н, м, НАг, Н-3), 7.49 (2Н, д, J=8.2, HAr), 7.76 (2Н, т, J=8.9, HAr), 7.97 (1Н, д, J=8.5, HAr). Спектр ЯМР 13С, δ, м. д.: 35.7 (СН-1), 55.2 (ОСН3), 114.0 (2СН), 116.6 (С), 117.1 (СН), 120.6 (С), 123.8 (СН), 125.1 (СН), 127.2 (СН), 128.6 (СН), 128.7 (2СН), 129.2 (СН), 129.4 (2СН), 130.3 (2СН), 131.5 (С), 131.8 (С), 137.1 (2С), 138.0 (С), 147.6 (С), 152.3 (СН-3), 158.2 (С-О), 193.8 (С=O). Вычислено для C27H19ClO3, %: С 75.97; Н 4.49. Найдено, %: С 76.05; Н 4.43.
Пример 11
1-(3-Нитрофенил)-1H-бензо[ƒ]хромен-2-ил(4-хлорфенил)метанон (Iл). Смесь 0.55 г (1.7 ммоль) 1-[(диметиламино)(3-нитрофенил)метил]-2-нафтола (IIг) и 0.36 г (1.7 ммоль) 3-(диметиламино)-1-(4-хлорфенил)-проп-2-ен-1-она (IIIб) нагревали при кипении 2 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.45 г (60%). Бесцветные кристаллы, т. пл. 237-239°C. ИК спектр, v, см-1: 1632 (С=O), 1589, 1524 (NO2), 1346 (NO2), 1315, 1227, 1192, 1088, 991, 849, 822, 806, 760, 741, 683. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 6.08 (1Н, с, Н-1), 7.36-7.45 (5Н, м, HAr), 7.47-7.50 (3Н, м, HAr), 7.54 (1Н, с, Н-3), 7.81-7.87 (4Н, м, HAr), 7.96 (1Н, ддд, J=8.2, 2.0, 0.9, HAr), 8.15 (1Н, т, J=2.0, HAr). Спектр ЯМР 13С, δ, м. д.: 36.4 (СН-1), 114.9 (С), 117.2 (СН), 119.2 (С), 122.0 (СН), 123.2 (СН), 123.3 (СН), 125.4 (СН), 127.6 (СН), 128.9 (3 СН), 129.4 (СН), 130.1 (СН), 130.2 (2СН), 131.0 (С), 131.9 (С), 134.8 (СН), 136.6 (С), 138.3 (С), 146.7 (С), 147.7 (С), 148.6 (С), 153.7 (СН-3), 193.1 (С=O). Вычислено для C26H16ClNO4, %: С 70.67; Н 3.65; N 3.17. Найдено, %: С 70.71; Н 3.60; N3.10.
Пример 12
1-Фенил-1H-бензо[ƒ]хромен-2-ил(4-метоксифенил)метанон (Iм). Смесь 0.47 г (1.7 ммоль) 1-[(диметиламино)(фенил)метил]-2-нафтола (IIб) и 0.35 г (1.7 ммоль) 3-(диметиламино)-1-(4-метоксифенил)-проп-2-ен-1-она (IIIа) нагревали при кипении 1.5 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.42 г (63%). Бесцветные кристаллы, т. пл. 175-177°C. ИК спектр, v, см-1: 2924, 1639 (С=O), 1601, 1512, 1458, 1319, 1304, 1258,1227, 1177, 1026, 988, 837,810, 760, 702. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.82 (3Н, с, ОСН3), 6.03 (1Н, с, Н-1), 6.88 (2Н, д, J=8.7, HAr), 7.07 (1H, т, J=7.3, HAr), 7.19 (2Н, т, J=7.6, HAr), 7.31-7.44 (6Н, м, Н-3, HAr), 7.57 (2Н, д, J=8.7, HAr), 7.78 (2Н, т, J=7.6, HAr), 7.97 (1Н, д, J=8.2, HAr). Спектр ЯМР 13С, δ, м. д.: 36.9 (СН-1), 55.5 (ОСН3), 113.7 (2СН), 116.4 (С), 117.1 (СН), 120.4 (С), 123.9 (СН), 125.0 (СН), 126.6 (СН), 127.1 (СН), 128.4 (2СН), 128.5 (СН), 128.6 (2СН), 129.2 (СН), 131.2 (2СН), 131.3 (С), 131.6 (С), 131.7 (С), 144.9 (С), 147.9 (С), 151.0 (СН-3), 162.7 (С-О), 193.7 (С=O). Вычислено для С27Н20О3, %: С 82.63; Н 5.14. Найдено, %: С 82.57; Н 5.08.
Пример 13
1-(4-Метоксифенил)-1H-бензо[ƒ]хромен-2-ил(4-метоксифенил)метанон (Iн). Смесь 0.52 г (1.7 ммоль) 1-[(диметиламино)(4-метоксифенил)метил]-2-нафтола (IIв) и 0.35 г (1.7 ммоль) 3-(диметиламино)-1-(4-метоксифенил)-проп-2-ен-1-она (IIIв) нагревали при кипении 1.5 ч в 4 мл уксусной кислоты. Смесь охлаждали до комнатной температуры. Выпавший осадок отфильтровывали и очищали перекристаллизацией из этанола. Выход 0.45 г (63%). Бесцветные кристаллы, т. пл. 173-175°C. ИК спектр, v, см-1: 1639 (С=O), 1601, 1508, 1462, 1319, 1265, 1227, 1180, 1107, 1026, 988, 918, 841, 826, 810, 752. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.68 (3Н, с, ОСН3), 3.83 (3Н, с, ОСН3), 5.97 (1Н, с, Н-1), 6.71 (2Н, д, J=7.3, HAr), 6.88 (2Н, д, J=7.4, HAr), 7.25-7.31 (3Н, м) и 7.35-7.45 (3Н, м) (Н-3, HAr), 7.58 (2Н, д, J=7.4, HAr), 7.77 (2Н, т, J=9.3, HAr), 7.96 (1Н, д, J=8.5, HAr). Спектр ЯМР 13С, δ, м. д.: 36.0 (СН-1), 55.2 (ОСН3), 55.5 (ОСН3), 113.7 (2СН), 113.9 (2СН), 116.6 (С), 117.1 (СН), 120.5 (С), 123.9 (СН), 124.9 (СН), 127.0 (СН), 128.5 (СН), 129.0 (СН), 129.4 (2СН), 131.2 (2СН), 131.4 (С), 131.6 (С), 131.7 (С), 137.3 (С), 147.8 (С), 150.8 (СН-3), 158.1 (С-О), 162.7 (С-О), 193.9 (С=O). Вычислено для C28H22O4, %: С 79.60; Н 5.25. Найдено, %: С 79.70; Н 5.21.
Пример 14
1H-Бензо[ƒ]хромен-2-ил(2-гидроксифенил)метанон (Iо). Смесь 0.34 г (1.7 ммоль) 1-[(диметиламино)метил]-2-нафтола (IIа) и 0.32 г (1.7 ммоль) 3-(диметиламино)-1-(2-гидроксифенил)-проп-2-ен-1-она (IIIд) нагревали при кипении 1.5 ч в 4 мл уксусной кислоты. Растворитель отгоняли в вакууме, остаток очищали колоночной хроматографией на силикагеле, элюент - CHCl3. После перекристаллизации из этанола получили 0.32 г (63%) продукта в виде бесцветных кристаллов, т. пл. 163-165°C. ИК спектр, v, см-1: 3300-2600 (ОН), 3063, 2924, 2855, 1628 (С=O), 1601, 1570, 1466, 1443, 1400, 1354, 1308, 1265, 1231, 1142, 991, 822, 760, 687. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 4.19 (2Н, с, СН2), 7.27 (1H, д, J=9.2, HAr), 7.32 (1H, т, J=7.8, HAr), 7.39 (1H, т, J=7.6, HAr), 7.43 (1Н, д, J=8.3, HAr), 7.53 (1H, ддд, J=8.3, 6.9, 1.2, HAr), 7.64-7.69 (2Н, м, HAr), 7.78 (1H, д, J=8.0, HAr), 7.97 (1Н, д, J=8.5, HAr), 8.23 (1H, дд, J=8.0, 1.4, HAr), 8.38 (1H, с, Н-3), 10.15 (1Н, уш,. с, ОН). Спектр ЯМР 13С, δ, м. д.: 22.2 (СН2), 116.5 (С), 118.1 (СН), 121.0 (СН), 121.6 (СН), 122.9 (СН), 123.0 (С), 123.5 (С), 125.6 (СН), 126.1 (СН), 126.6 (СН), 129.1 (СН), 129.3 (СН), 129.6 (С), 133.1 (С), 134.4 (СН), 153.5 (С-О), 154.2 (СН-3), 156.6 (С-О), 180.2 (С=O). Вычислено для С20Н14О3, %: С 79.46; Н 4.67. Найдено, %: С 79.54; Н 4.61.
Литература
[1] Liang D., Wang М., Bekturhun В., Xiong В., Liu Q. One-pot synthesis of polyfunctionalized 4H-chromene and dihydrocoumarins based on copper(II) bromide-catalyzed C-C coupling of benzylic alcohols with ketene dithioacetals // Adv. Synth. Catal, 2010, V. 352, pp. 1593-1599. [2] René L. A new general approach to the synthesis of functionalized 4H-chromenes // Synthesis, 1989, pp. 69-70.
[3] Jones R.M., Selenski C, Pettus T. R. R. Rapid syntheses of benzopyrans from o-OBOC salicylaldehydes and salicyl alcohols: a three-component reaction // J. Org. Chem., 2002, V. 67, pp. 6911-6915.
[4] Wu В., Gao X., Yan Z., Huang W.-X., Zhou Y.-G. Enantioselective synthesis of functionalized 2-amino-4H-chromenes via the o-quinone methides generated from 2-(l-tosylalkyl)phenols // Tetrahedron Lett., 2015, V. 56, pp. 4334-4338.
[5] Zhang X. Y., Fang L. L., Liu N., Wu H. Y., Fan X. S. Copper-catalyzed tandem reaction of 2-bromobenzyl bromides with 1,3-dicarbonyl compounds leading to 4H-chromenes // Chinese Chem. Lett., 2012, V. 23, pp. 1129-1132.
[6] Funabiki K., Komeda Т., Kubota Y., Matsui M.  acid ionic liquid-catalyzed direct benzylation, allylation and propargylation of 1,3-dicarbonyl compounds with alcohols as well as one-pot synthesis of 4H-chromenes // Tetrahedron, 2009, V. 65, pp 7457-7463.
acid ionic liquid-catalyzed direct benzylation, allylation and propargylation of 1,3-dicarbonyl compounds with alcohols as well as one-pot synthesis of 4H-chromenes // Tetrahedron, 2009, V. 65, pp 7457-7463.
[7] Bunce R.A., Rogers D., Nago Т., Bryant S. А. 4Я-1-Benzopyrans by a tandem SN2-SNAt reaction // J. Heterocyclic Chem., 2008, V. 45, pp. 547-550.
[8] Aoyama Т., Yamamoto Т., Miyota S., Hayakawa M., Takido Т., Kodomari M. One-pot synthesis of 4H-chromenes by tandem benzylation and cyclization in the presence of sodium bisulfate on silica gel // Synlett, 2014, V. 25, pp. 1571-1576.
[9] Balasubramanian К.K., Selvaraj S. Studies in phenolic Mannich bases -reaction with acetylenes // Tetrahedron Lett., 1980, V. 21, pp. 851-852.
[10] Akondi A.M., Kantam M.L., Trivedi R., Sreedhar В., Buddana S.K., Prakasham R.S., Bhargava S. Formation of benzoxanthenones and benzochromenones via cerium-impregnated-MCM-41 catalyzed, solvent-free, three-component reaction and their biological evaluation as anti-microbial agents // J. Mol. Catal. A: Chem., 2014, V. 386, pp. 49-60.
[11] Sandaroos R., Damavandi S. Ultrasound-assisted one-pot synthesis of disubstituted and trisubstituted 1H-benzo[ƒ]chromene derivatives catalyzed by 4-nitro-2,6-diacetylpyridinebis(2,4,6-trimethylaniline)FeCl2 // Res. Chem. Intermed., 2013, V. 39, pp. 4167-4174.
[12] Simelane S.В., Kinfe H.H., Muller A., Williams D.B.G. Aluminum triflate catalyzed tandem reactions of D-galactal: toward chiral benzopyrans, chromenes, and chromans // Org. Lett., 2014, V. 16, pp. 4543-4545.
[13] Singh S.N., Bopanni R., Jayaprakash S., Reddy К.V., Ashfaq M.A., Kumar K.S., Pal M. Reactions of salicylaldehydes with activated terminal alkynes in aqueous media: synthesis of 3-substituted 4-hydroxy chromenes as potential cytotoxic agents // RSC Adv., 2014, V. 4, pp. 24870-24873.
[14] Shi Y.-L., Shi M. Synthesis of substituted chromenes through the DABCO-catalyzed reaction of but-3-yn-2-one and methyl propiolate with salicyl N-tosylimines (DABCO=1,4-diazabicyclo[2.2.2]octane // Chem. Eur. J., 2006, V. 12, pp. 3374-3378.
[15] Lienhard U., Fahrni H.-P., Neuenschwander M. "Push-pull"-acetylene for die peptid-synthese // Helv. Chim. Acta, 1978, V. 61, pp. 1609-1621.
[16] Осипов Д.В., Осянин В.А., Климочкин Ю.Н. Новый метод синтеза 3-амино-1H-бензо[ƒ]хромен-2-карбонитрилов // Журн. органич. химии, 2013, Т. 49. С. 412-415.
Способ получения 1-бензо[ƒ]хромен-2-ил(арил)кетонов реакцией замещенных 1-[(диметиламино)метил]-2-нафтолов с 3-(диметиламино)-1-арил-проп-2-ен-1-онами.
