Результат интеллектуальной деятельности: Макропористые сорбенты для удаления цианобактерий из водной среды
Вид РИД
Изобретение
Область техники
Предлагаемое изобретение относится к области химии и может быть использовано для утилизации и сбора биомассы цианобактерий в открытых и закрытых природных водоемах, в искусственных водоемах и в биореакторах.
Важность проблемы
По всему миру зарегистрировано более 300 вспышек массового размножения различных видов цианобактерий за период со второй половины XX века до 2012 года. В последние годы «цветение» приобрело глобальный характер, регистрируются вспышки даже и в водоемах Северной Европы, Северной России.
Цианобактерии представляют собой источник метаболитов, которые являются прямыми токсинами для человека. Такая особенность метаболизма многих видов цианобактерий в чрезвычайной ситуации массового «цветения» приводит к сильной токсификации водоемов, ежегодно фиксируется около 150000 случаев отравления людей рыбой или другими продуктами, содержащими цианотоксины. При этом цианобактерии распространены повсеместно - в термальных источниках (температура достигает 70°С), аридных зонах, пресных, соленых водоемах, содовых озерах и т.д. В случае ухудшения условий окружающей среды цианобактерии способны менять пути метаболизма, например, способны переходить от оксигенной фототрофии к аноксигенной фототрофии, к фотогетеро- и хемогетеротрофии. В связи с вышеперечисленными фактами в случае чрезвычайной ситуации необходимо максимально быстро уменьшить численность цианобактерий в водоеме, чтобы снизить уровень токсификации.
Цианобактерии, которые продуцируют в течение метаболизма цианотоксины, принадлежат в многим родам, а именно: Anabaena, Anabaenopsis, Hapalosiphon, Nostoc, Microcystis, Oscillatoria, Planktothrix, Nodularia, Aphanizomenon, Cylindrospermopsis, Umerzakia, Phormidium, Lyngbya, Planktothrix.
Уровень техники
На сегодняшний день из уровня техники известен композиционный состав для очистки и обеззараживания воды на основе алюмосодержащего коагулянта и катионного флокулянта по патенту WO 2013066210 А1, опубл. 10 мая 2013. Данный состав обладает обеззараживающим эффектом и используется преимущественно для очищения и дальнейшего использования вод для хозяйственно-питьевых целей. Данный композиционный состав позволял адсорбировать на свою поверхность бактерии и вирусы, однако испытания в отношении цианобактерий не проводились.
Недостатком данного состава является то, что в процессе использования формируются хлопья, которые в дальнейшем выпадают в осадок. Для очистки природного или искусственного водоема данный состав не может быть использован, поскольку процесс сбора хлопьев с донных и придонных слоев затруднен.
Композиционный мембранный материал на основе полимерных материалов, запатентованный и опубликованный 7 сентября 2012, номер публикации WO 2012118408 А2, представляет из себя фибриллярно-пористую матрицу, содержащую гидрофильный полимер и металлический антибактериальный агент. Данный материал используется для фильтрационной очистки воды, что препятствует росту и развитию микроорганизмов. Кластеры металлического антибактериального агента представляют из себя, например, кластеры серебра, меди или золота, что значительно влияет на стоимость итогового материала. Кроме этого получаемые мембранные материалы используются при фильтрации, что труднодоступно в условиях природного водоема. Влияние гидрофильного материала на клетки цианобактерий не оценивалось.
Задача
Макропористые сорбенты для удаления цианобактерий из водной среды должны:
1) сорбировать на поверхность макропористого сорбента клетки цианобактерий;
2) снижать количество клеток цианобактерий в растворе при помощи макропористых сорбентов;
3) уменьшать оптическую плотность и мутность раствора;
4) уменьшать вероятность возникновения «цветения водоема», синтеза вторичных метаболитов - токсинов.
Раскрытие изобретения
Макропористые сорбенты для удаления цианобактерий из водной среды на основе гранул из новых сополимеров глицидил метакрилата, аллил глицидилового эфира, метил метакрилата, стирола, диметакрилата триэтиленгликоля, диметакрилата этиленгликоля, дивинилбензола с ковалентно иммобилизованными на них аммиаком, диметиламином, триэтиламином, этилендиамином, диэтилентриамином, полиэтиленимином для удаления цианобактерий из водной среды.
Изобретение представляет новый полимерный материал - высокоэффективный гранулированный сорбент для удаления цианобактерий из водной среды.
Техническая сущность изобретения.
Полимерный материал представляет собой сферы диаметром 200-1000 мкм из полистирола или акрилатного полимера, к которым методом химического синтеза привит гидрофильный амин. При сборе биомассы на полимерном материале адгезируют отдельные клетки цианобактерий, которые остаются на материале иммобилизованными в течение всего времени. При инкубировании на полимерном материале плотной суспензии цианобактерий наблюдается уменьшение плотности суспензии, что показано методом спектрофотометрии, при этом на поверхности макропористого сорбента методом сканирующей электронной микроскопии выявлены клетки цианобактерий.
Общая и структурная формула (сополимеров глицидил метакрилата, аллил глицидилового эфира, метил метакрилата, стирола, диметакрилата триэтиленгликоля, диметакрилата этиленгликоля, дивинилбензола с ковалентно иммобилизованными на них аммиаком, диметиламином, триэтиламином, этилендиамином, диэтилентриамином, полиэтиленимином) представлена на рисунке 1.
Осуществление изобретения.
Пример 1
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), 1-гексадеканол (19 г), поливинилпирролидон-8000 (12,5 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 750 об/мин в течение 10 мин. Суспензионную полимеризацию проводят при перемешивании со скоростью 400 об/мин при 70°С в течение 2 час и 80°С в течение 4 час. Полученные гранулы отфильтровывают, промывают водой и этиловым спиртом. После рассева для работы отбирают фракцию с диаметром частиц 300-1000 мкм.
Полученные микросферы (10 г) смачивают небольшим количеством этилового спирта и помещают в 10 мл раствора диметиламина полученного разбавлением 20 мл 40% раствора диметиламина в воде 80 мл этилового спирта. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта.
Пример 2
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), 1-гексадеканол (9,5 г), поливинилпирролидон-8000 (12,5 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию ведут аналогично процессу, описанному в примере 1.
Пример 3
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), 1-додеканол (19 г), поливинилпирролидон-8000 (12 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 4
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), 1-октанол (23 мл), поливинилпирролидон-8000 (12 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 5
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), поливинилпирролидон-8000 (12 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 6
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат триэтиленгликоля (70 мл). Затем прибавляют циклогексанол (200 мл), 1-гексадеканол (20 г), поливиниловый спирт ВР-05 (12,5 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 7
Смешивают мономеры: глицидил метакрилат (150 мл), диметакрилат триэтиленгликоля (35 мл). Затем прибавляют циклогексанол (200 мл), 1-гексадеканол (19 г), поливинилпирролидон-8000 (12,5 г) и азобисизобутиронитрил (1,9 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 8
Смешивают мономеры: глицидил метакрилат (65 мл), метил метакрилат (55 мл), диметакрилат триэтиленгликоля (86 мл). Затем прибавляют циклогексанол (225 мл), 1-гексадеканол (21 г), поливинилпирролидон-8000 (13,8 г) и азобисизобутиронитрил (2,1 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 9
Смешивают мономеры: глицидил метакрилат (110 мл), диметакрилат этиленгликоля (50 мл). Затем прибавляют циклогексанол (175 мл), 1-гексадеканол (17 г), поливинилпирролидон-8000 (11,0 г) и азобисизобутиронитрил (1,7 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 10
Смешивают мономеры: глицидил метакрилат (110 мл), дивинилбензол (14 мл). Затем прибавляют циклогексанол (170 мл), 1-гексадеканол (16 г), поливинилпирролидон-8000 (10,3 г) и азобисизобутиронитрил (1,6 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 11
Смешивают мономеры: аллил глицидиловый эфир (50 мл), стирол (80 мл), дивинилбензол (16 мл). Затем прибавляют циклогексанол (120 мл), поливинилпирролидон-8000 (7,2 г) и азобисизобутиронитрил (1,1 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 12
Смешивают мономеры: аллил глицидиловый эфир (50 мл), метил метакрилат (55 мл), диметакрилат этиленгликоля (55 мл). Затем прибавляют циклогексанол (170 мл), 1-гексадеканол (16 г), поливинилпирролидон-8000 (10,5 г) и азобисизобутиронитрил (1,6 г) суспендируют в воде при перемешивании механической мешалкой со скоростью 500 об/мин в течение 10 мин. Реакцию вели аналогично процессу, описанному в примере 1.
Пример 13
Сополимер стирола и дивинилбензола получают следующим образом. Поливиниловый спирт (8,0 г) с молекулярной массой 100-125 кДа и хлорид натрия (32,0 г) растворяют в 1,0 л дистиллированной воды при 60°С. Затем при той же температуре вносят мономеры: 220 мл стирола и 18 мл дивинилбензола. Затем вносят инициатор полимеризации перекись бензоила (4,5 г) в 350 мл толуола. Реакцию ведут в течение 10 ч при 80°С и интенсивном перемешивании. Продукт отфильтровывают, промывают горячей водой и этиловым спиртом, сушат при 70°С в сушильном шкафу. Затем гранулы рассеивают, отбирая фракцию с диаметром 0,3-0,8 мм.
Полученный сополимер стирола и дивинилбензола (100 г), хлорид цинка (100 г) и хлорметил метиловый эфир (1 л) нагревают до 35-40°С и интенсивно перемешивают в течение 24 час. Полученные микросферы (10 г) смачивают небольшим количеством этилового спирта и добавляют 10 мл раствора диметиламина, полученного разбавлением 20 мл 40% раствора диметиламина в воде 80 мл этилового спирта. Иммобилизацию ведут кипячением раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Пример 14
Микросферы, полученные по методике, описанной в примере 1 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл раствора аммиака, полученного разбавлением 30 мл 28% раствора аммиака в воде 70 мл этилового спирта. Иммобилизацию ведут кипячением раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта.
Пример 15
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл раствора аммиака, полученного разбавлением 30 мл 28% раствора аммиака в воде 70 мл этилового спирта. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Пример 16
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора триэтиламина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 ч. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Пример 17
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора этилендиамина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 ч. Микросферы отделяют фильтрованием и промывают избытком этилового спирта.
Пример 18
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора этилендиамина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Пример 19
Микросферы, полученные по методике, описанной в примере 1 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора диэтилентриамина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта.
Пример 20
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора диэтилентриамина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Пример 21
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора полиэтиленимина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта.
Пример 22
Микросферы, полученные по методике, описанной в примере 13 (10 г), смачивают небольшим количеством этилового спирта и добавляют 10 мл 10% раствора полиэтиленимина в этиловом спирте. Иммобилизацию ведут при кипячении раствора в течение 12 час. Микросферы отделяют фильтрованием и промывают избытком этилового спирта, 10% раствором гидроксида натрия и водой.
Определение насыпной плотности макропористых сорбентов для удаления цианобактерий из водной среды.
Сорбент тщательно высушивают до постоянной массы в сушильном шкафу при 70°С. Затем проводят взвешивание трех порций сорбента объемом 10,0 мл с точностью до 0,01 г. Значение насыпной плотности рассчитывают исходя из среднего значения трех измерений. Данные измерений приведены в таблице 1.
Анализ поверхности макропористых сорбентов для удаления цианобактерий из водной среды.
Для определения удельной поверхности и распределения пор по размерам использовали метод адсорбционной порометрии на приборе Beckman Coulter SA 3100, используя азот высокой чистоты в качестве адсорбируемого газа. Для расчета распределения пор по размерам использовался метод Баррета-Джойнера-Халенды (BJH), для оценки удельной поверхности - метод Брюнера-Эммета-Теллера (BET), формулы для расчета приведены в работе G Leofanti et al. Surface area and pore texture of catalysts // Catalysis Today. 1998. V. 41. P. 207-219. Данные измерений приведены в таблице 1.
Определение степени удаления цианобактерий из водной среды
Полученные макропористые сорбенты предназначены для сбора биомассы цианобактерий разных видов. Для этого в суспензию цианобактерий помещают сорбент из расчета от 1 до 50 г сорбента на 1 л бактериальной суспензии, после проведения очистки сорбент собирают с поверхности или раствор декантируют для тонущих в воде сорбентов. Для упрощения отделения сорбента рекомендуется его использовать в виде картриджей, изготовленных из инертного пластика, заполненных сорбентом. В таблице 1 приведены данные по эффективности сорбентов при использовании в соотношении 10 г сорбента на 1 л бактериальной суспензии, инкубирование проводили при комнатной температуре в течение 24 ч. Подсчет количества цианобактерий проводили спектрофотометрически до и после инкубирования с сорбентом.
Макропористые сорбенты для удаления цианобактерий из водной среды
Перечень иллюстративных материалов:
Рисунок 1. Общая и структурная формула сополимеров глицидил метакрилата, аллил глицидилового эфира, метил метакрилата, стирола, диметакрилата триэтиленгликоля, диметакрилата этиленгликоля, дивинилбензола с ковалентно иммобилизованными на них аммиаком, диметиламином, триэтиламином, этилендиамином, диэтилентриамином, полиэтиленимином.
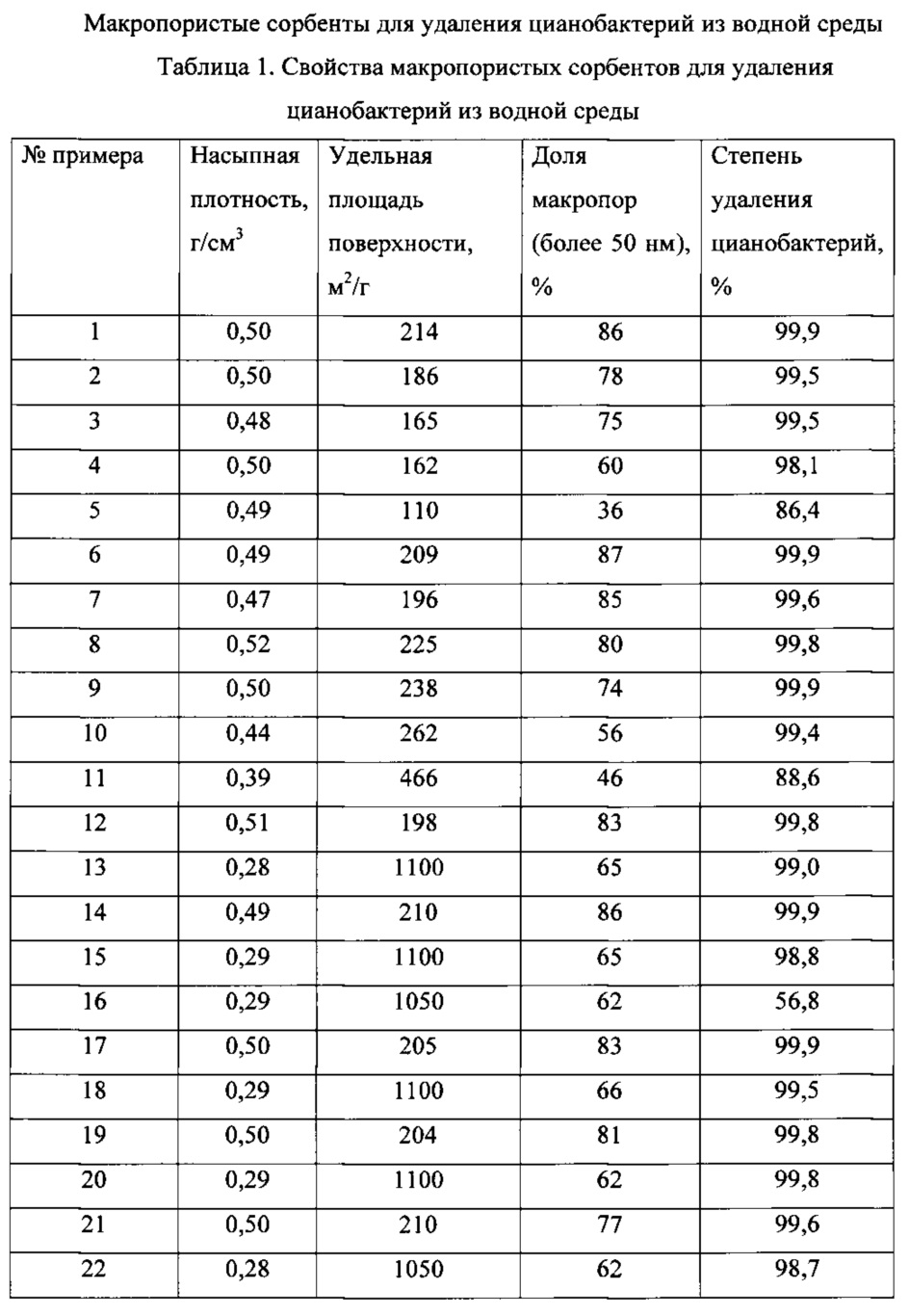
Рисунок 2 - рисунок 5. Поверхности различных макропористых сорбентов для удаления цианобактерий из водной среды с адгезировавшими к ним нитчатыми цианобактериями спустя сутки инкубирования.
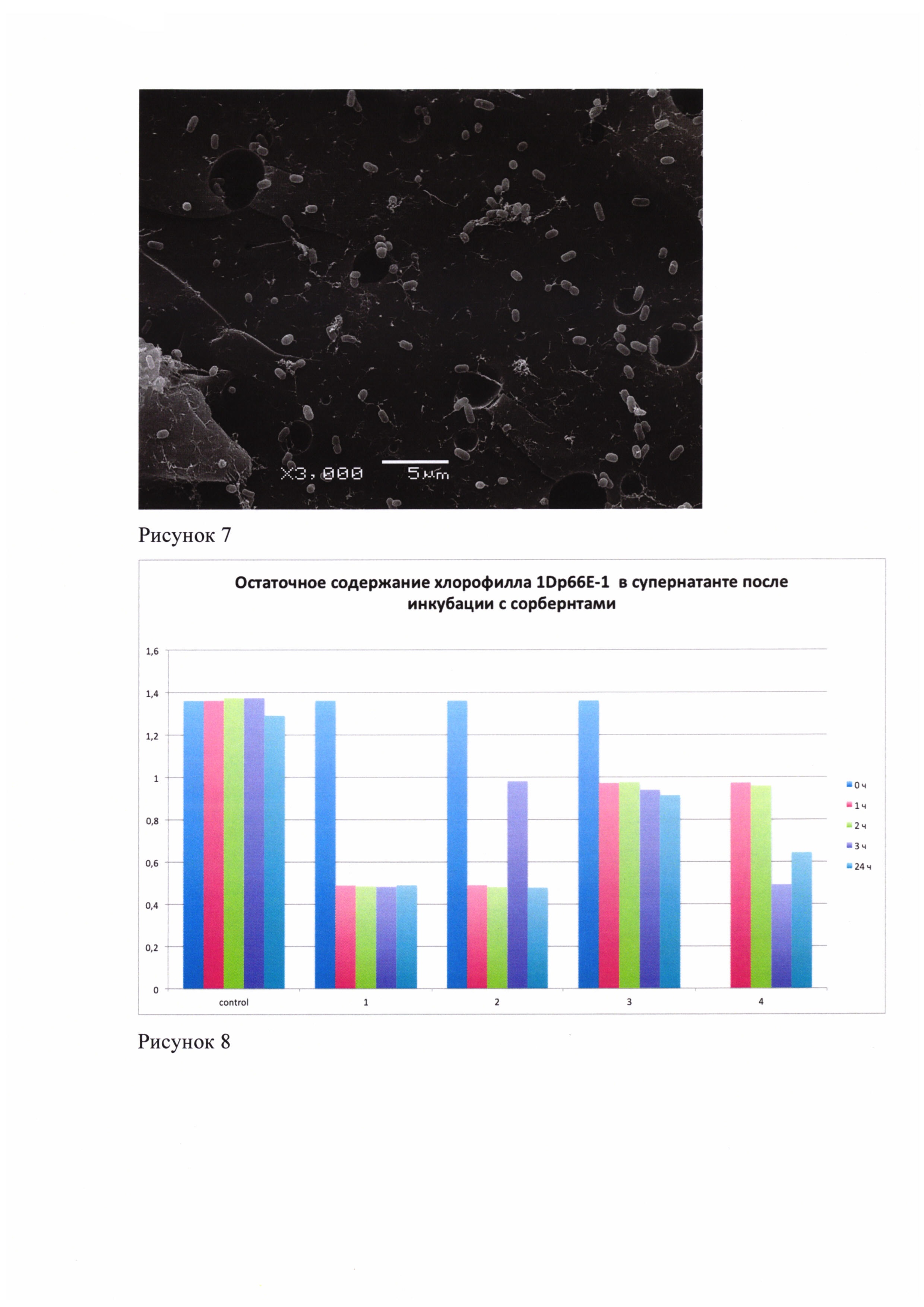
Рисунок 6 - рисунок 8. Поверхности различных макропористых сорбентов для удаления цианобактерий из водной среды с адгезировавшими к ним одноклеточными цианобактериями спустя сутки инкубирования.
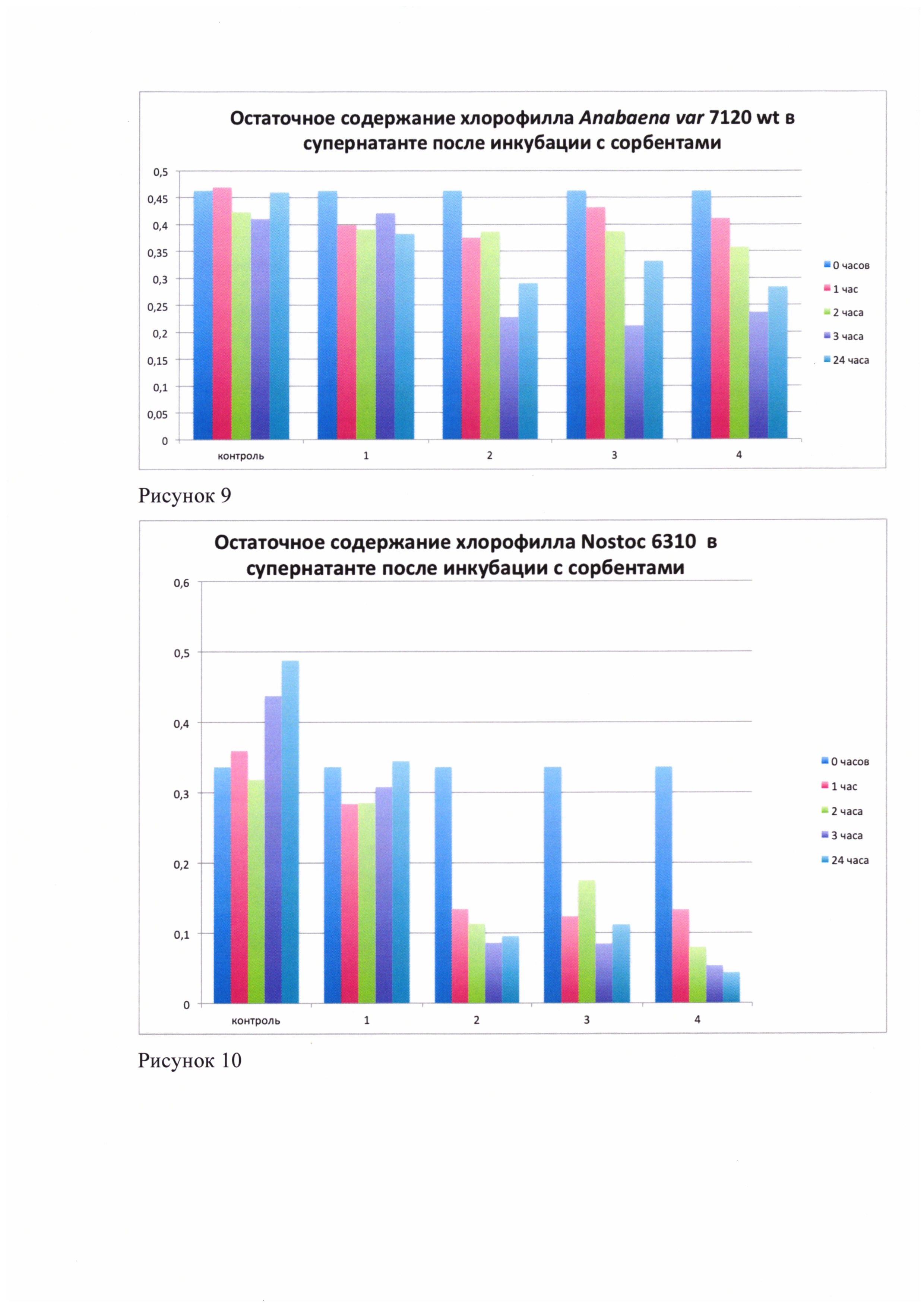
Рисунок 9. Остаточное содержание хлорофилла одноклеточных цианобактерий 1Dp66E-1 в супернатанте после инкубации с макропористыми сорбентами для удаления цианобактерий из водной среды.
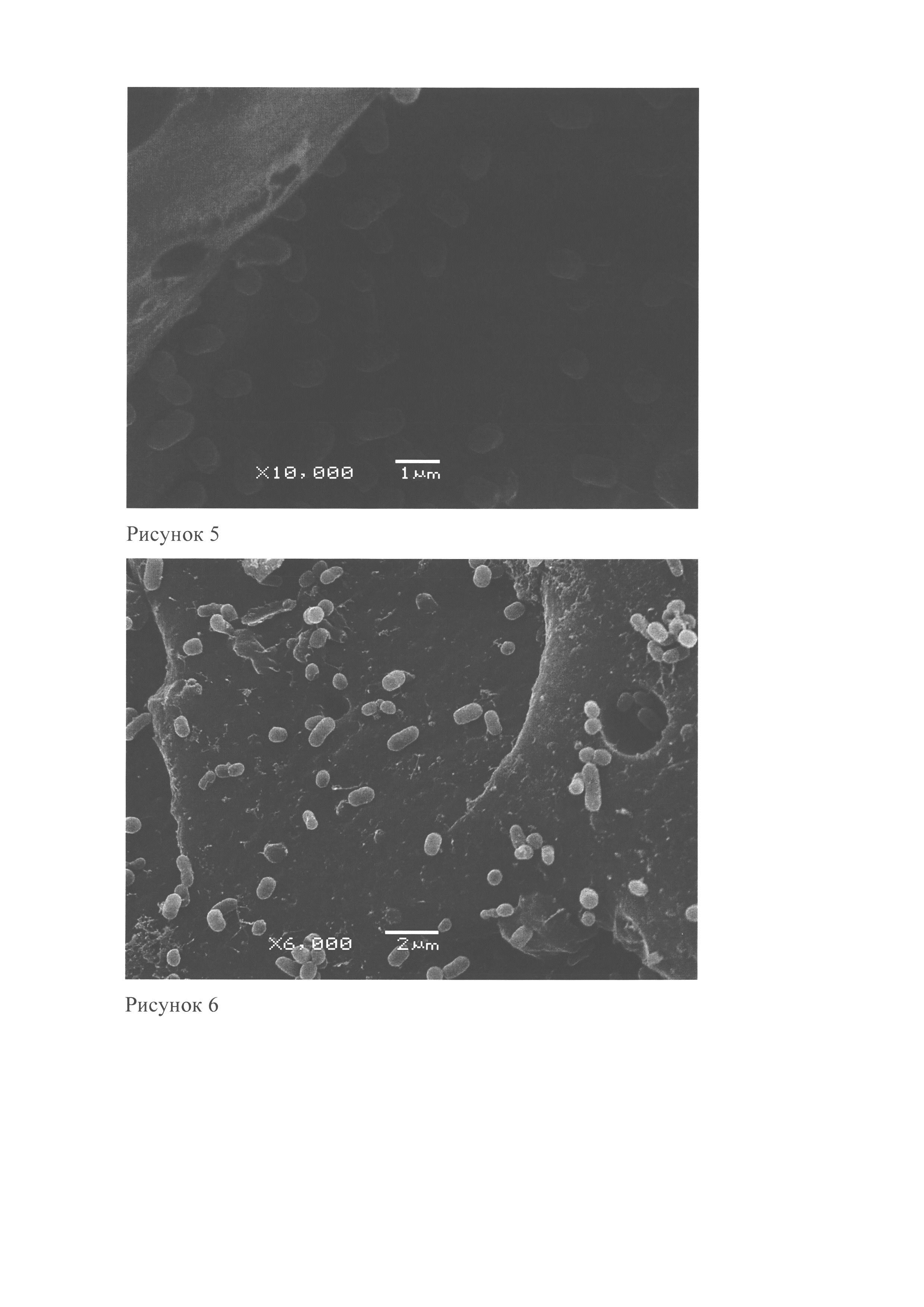
Рисунок 10. Остаточное содержание хлорофилла нитчатых цианобактерий Anabaena var 7120 wt в супернатанте после инкубации с макропористыми сорбентами для удаления цианобактерий из водной среды.
Рисунок 11. Остаточное содержание хлорофилла нитчатых цианобактерий Nostoc 6310 в супернатанте после инкубации с макропористыми сорбентами для удаления цианобактерий из водной среды.
Результаты
1) На поверхность макропористых сорбентов для удаления цианобактерий из водной среды эффективно сорбируются клетки цианобактерий, это подтверждено методом сканирующей электронной микроскопии. Спустя сутки инкубации сорбентов с клеточной суспензией цианобактерий препарат фиксировали 2% раствором глутарового альдегида на 0,1М какодилатном буфере с рН 7,2 в течение 1,5 часов, затем обезводили в спирте возрастающей концентрации (10-100% в течение 10 минут в каждом растворе) и поместили на ночь в ацетон. Образцы высушивали при критической точке на установке «DryerHCP-2» (Hitachi, Япония), напыляли золотом с палладием на ионно-напылительной установке «IB-3 IonCoater» (Eiko, Япония), после чего получили серию изображений на сканирующем электронном микроскопе JSM-6380LA (JEOL, Япония) при ускоряющем напряжении 15 кВ и инструментальном увеличении 60-20000 х.
На рисунках 2-5 представлены поверхности различных макропористых сорбентов с адгезировавшими к ним нитчатыми цианобактериями спустя сутки инкубирования.
На рисунках 6-8 представлены поверхности различных макропористых сорбентов с адгезировавшими к ним одноклеточными цианобактериями спустя сутки инкубирования.
2) В результате инкубации макропористых сорбентов для удаления цианобактерий из водной среды с клеточной цианобактериальной суспензией количество клеток в супернатанте снижалось, что подтверждено данными, полученными с помощью спектрофотометра с интегрирующей сферой Agilent-VarianCary 300, Hitachi 150-20. Данные получены в отношении одноклеточных цианобактерий 1Dp66E-1, нитчатых Anabaena var 7120 wt, Nostoc 6310 (рис. 8-10). В результате инкубации остаточное содержание хлорофилла в супернатанте снижалось, что свидетельствует об уменьшении количества клеток цианобактерий в супернатанте, содержащих хлорофилл, при этом снижались так же оптическая плотность и мутность раствора, что так же подтверждено рисунками 8-10. При этом на макропористых сорбентах обнаружены адгезировавшие клетки цианобактерий (рис. 2-8).
3) Поскольку при инкубации макропористых сорбентов для удаления цианобактерий из водной среды с оптически плотными суспензиями цианобактериальных клеток спустя сутки супернатанты суспензий теряли оптическую плотность, количество клеток уменьшалось, мутность раствора падала (рис 9-11), а клетки адгезировали к сорбентам (рис. 2-8), можно заявлять, что вероятность возникновения «цветения водоема» и синтеза вторичных метаболитов - токсинов при использовании сорбентов снижается, так как снижается численность свободных цианобактерий, способных к продуцированию токсинов.
Макропористый сорбент для удаления цианобактерий из водной среды на основе гранул из сополимеров, содержащих от двух до трех фрагментов из следующих: глицидил метакрилат, аллил глицидиловый эфир, метил метакрилат, стирол, диметакрилат триэтиленгликоля, диметакрилат этиленгликоля, дивинилбензол с ковалентно иммобилизованными на них диметиламином, или аммиаком, или триэтиламином, или этилендиамином, или диэтилентриамином, или полиэтиленимином для удаления цианобактерий из воды.