Результат интеллектуальной деятельности: Борированные производные фторированных бактериохлоринов и их металлокомплексов, обладающие противоопухолевой активностью
Вид РИД
Изобретение
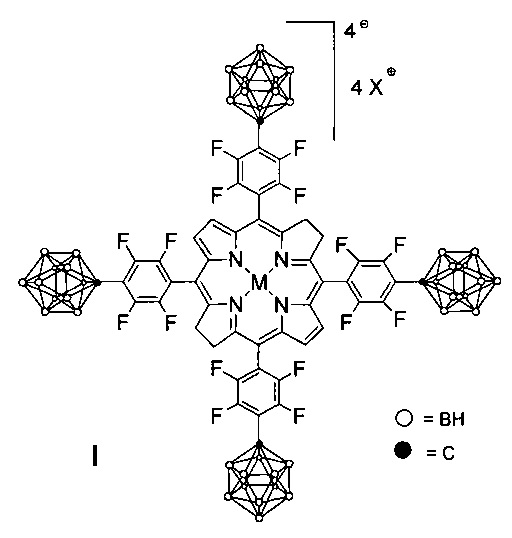
Изобретение относится к новым соединениям, а именно к борированным производным фторированных бактериохлоринов и их металлокомплексов, конкретно к борированным производным 5,10,15,20-тетракис(пентафторфенил)бактериохлорина общей формулы I

где
Ia М=2Н, X=Cs
Iб M=Cu, X=Cs
Iв М=Zn, X=Cs
Iг M=Ni, X=Cs
Iд M=Pd, X=Cs
Ie M=2H, X=Na
Iж M=Cu, X=Na
Iз М=Zn, X=Na
Iи М=Ni, X=Na
Iк М=Pd, X=Na
Указанные соединения наиболее эффективно могут быть использованы в качестве противоопухолевых агентов в борнейтронозахватной терапии (БНЗТ) и фотодинамической терапии (ФДТ) онкологических заболеваний.
Указанные соединения и их свойства в литературе не описаны.
Известны соединения формулы II, структура которых близка структуре заявляемого соединения (В.А. Ольшевская, А.В. Зайцев, В.Н. Калинин, Н.Д. Чкаников, А.Л. Сиган, А.А. Штиль. Карборанильные производные фторированных порфиринов и их металлокомплексы, проявляющие свойства фотосенсибилизатора, и способ их получения. Патент на изобретение №2402554, зарегистрировано в Государственном реестре изобретений Российской Федерации 27 октября 2010 года)
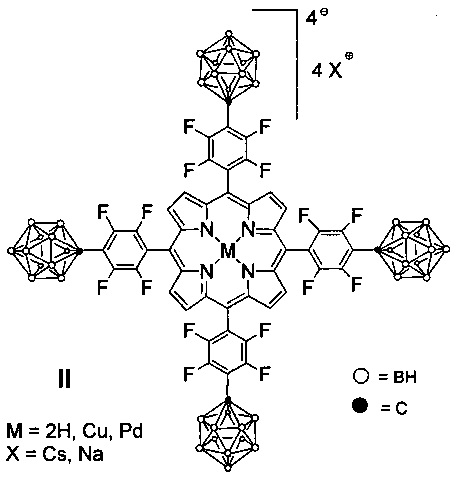
Указанные соединения общей формулы II получают путем взаимодействия 5,10,15,20-тетракис-пентафторфенилпорфирина и его металлокомплексов с литиевой солью 1-карба-клозо-додекаборанил цезия. Натровые соли получают путем ионообменной колоночной хроматографии
Известны борированные фторсодержащие хлорины формулы III, в которых полоса поглощения сдвинута в область 650 нм, что является необходимым условием для эффективного проведения ФДТ злокачественных новообразований (Ольшевская В.А., Зайцев А.В., Сиган А.Л., Кононова Е.Г., Петровский П.В., Чкаников Н.Д., Калинин В.Н. / Синтез борированных порфиринов и хлоринов через региоселективное замещение атома фтора в пентафторфенилпорфиринах при действии литийкарборанов // ДАН, 2010, том 435, №6, с. 755-759)

Успешное применение метода ФДТ для лечения злокачественных новообразований стимулирует поиск новых фотосенсибилизаторов с улучшенными свойствами. Наиболее перспективны для ФДТ фотосенсибилизаторы с максимумом поглощения в красном и ближнем инфракрасном диапазоне (700-800 нм), так называемом «терапевтическом окне», где собственное поглощение биологической ткани минимально, что обеспечивает возможность более глубокого проникновения излучения в ткань и, как следствие, высокую эффективность терапии (Bonnett R. / Progress with Heterocyclic Photosensitizers for the Photodynamic Therapy (PDT) of Tumours // J. Heterocyclic Chem., 39, 455 (2002)).
Перспективными фотосенсибилизаторами для ФДТ, поглощающими в ближнем инфракрасном диапазоне спектра, являются бактериохлорины (тетрагидропорфирины). Гидрирование еще одной двойной связи в молекуле хлорина приводит к дальнейшему батохромному смещению длинноволновой полосы поглощения. Для использования в БНЗТ соединения должны создавать терапевтически эффективную концентрацию бора в опухоли, но при этом они должны быть минимально токсичны для нормальных живых клеток и органов.
Задачей настоящего изобретения является создание борированных производных фторированных бактериохлоринов и их металлокомплексов, которые являются более эффективными противоопухолевыми агентами, потенциально применимыми для БНЗТ и ФДТ.
Поставленная задача достигается производными 5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина и его металлокомплексов, обладающими противоопухолевой активностью.
Синтез целевых соединений может быть осуществлен следующим способом.
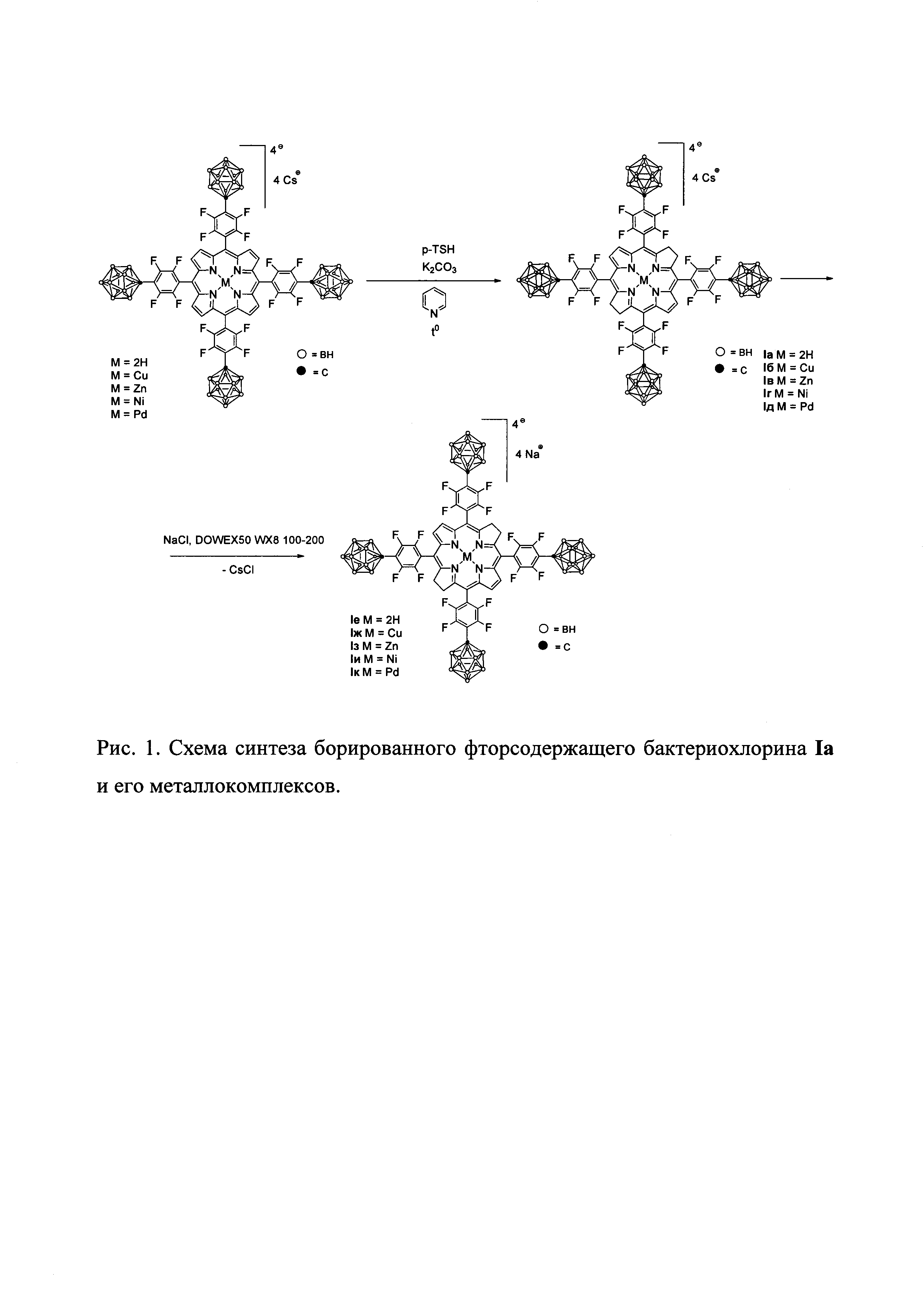
Борированный фторсодержащий бактериохлорин Iа и его металлокомплексы Iб-д получают восстановлением {5,10,15,20-тетракис[4-(1-карба-клоозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия и его металлокомплексов диимидом, генерируемым в условиях реакции из п-толуолсульфонилгидразина в присутствии сухого поташа в сухом пиридине.
Выделенные и очищенные борированные фторсодержащие бактериохлорины Ia-д растворяют в ацетоне, затем пропускают дважды через ионообменную смолу и выделяют готовые продукты (Ie-к) путем отгонки растворителя в вакууме (рисунок 1).
Исходные борированные фторсодержащие порфирины и их металлокомплексы получают как описано в статье (Ольшевская В.А., Зайцев А.В., Сиган А.Л., Кононова Е.Г., Петровский П.В., Чкаников Н.Д., Калинин В.Н. / Синтез борированных порфиринов и хлоринов через региоселективное замещение атома фтора в пентафторфенилпорфиринах при действии литийкарборанов // Доклады РАН, 2010, т. 435, №6, с. 755-759).
Примеры синтеза
Пример 1. Получение {5,10,15,20-Тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетрацезия (Iа)
Растворяют 500 мг (0,25 ммоль) {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия в 400 мл абсолютного пиридина, прибавляют 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия и кипятят при перемешивании в атмосфере аргона 2 часа. Затем каждые 2 часа добавляют в кипящую реакционную массу 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия в течение 30 часов. Далее раствор охлаждают до 80°С, приливают 200 мл этилацетата и 150 см3 воды и перемешивают 1 час при 80°С.
Раствор охлаждают, выливают в 450 мл 20% соляной кислоты. Органический слой отделяют на делительной воронке, промывают 3 раза по 250 мл 20% раствора соляной кислоты, затем промывают 4 раза 300 мл воды. Растворитель отгоняют в вакууме. Выход 495 мг (99%).
ИК-спектр (KBr), ν, см-1: 3447 (NH порфирина), 2948 (СН порфирина), 2525 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 346 (100,2); 374 (107,0); 407 (48,4); 505 (38,7); 655 (12,6); 750 (58,1).
1Н ЯМР - спектр ((CD3)2CO), δ, м.д.: 8,37 (с, 4Н, β-пиррол); 4,20 (с., 8Н, β-пиррол); -1.30 (с., 2Н, NH). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,34 (д., 44 В, J=132,1 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -133,54 (м., 8 F); -142,78 (м., 8 F).
Масс-спектр (m/z): 2002 [М]+.
Пример 2. Получение медного комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетрацезия (Iб)
Растворяют 516 мг (0,25 ммоль) медного комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия в 400 мл абсолютного пиридина, прибавляют 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия и кипятят при перемешивании в атмосфере аргона 2 часа. Затем каждые 2 часа добавляют в кипящую реакционную массу 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия в течение 30 часов. Далее раствор охлаждают до 80°С, приливают 200 мл этилацетата и 150 см3 воды и перемешивают 1 час при 80°С.
Раствор охлаждают, выливают в 450 мл 20% соляной кислоты. Органический слой отделяют на делительной воронке, промывают 3 раза по 250 мл 20% раствора соляной кислоты, затем промывают 4 раза 300 мл воды. Растворитель отгоняют в вакууме. Выход 510 мг (99%).
ИК-спектр (KBr), ν, см-1: 2958 (СН порфирина), 2530 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 410 (179,3), 619 (34,4).
Масс-спектр (m/z): 2063 [М]+.
Пример 3. Получение цинкового комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетрацезия (Iв)
Растворяют 516 мг (0,25 ммоль) цинкового комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия в 400 мл абсолютного пиридина, прибавляют 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия и кипятят при перемешивании в атмосфере аргона 2 часа. Затем каждые 2 часа добавляют в кипящую реакционную массу 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия в течение 30 часов. Далее раствор охлаждают до 80°С, приливают 200 мл этилацетата и 150 см3 воды и перемешивают 1 час при 80°С.
Раствор охлаждают, выливают в 450 мл 20% соляной кислоты. Органический слой отделяют на делительной воронке, промывают 3 раза по 250 мл 20% раствора соляной кислоты, затем промывают 4 раза 300 мл воды. Растворитель отгоняют в вакууме. Выход 510 мг (99%).
ИК-спектр (KBr), ν, см-1: 2952 (СН порфирина), 2525 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 373 (92,4), 415 (147,6), 504 (30,3), 622 (23,4), 749 (51,0).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,50 (с., 4Н, β-пиррол); 4,30 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,80 (д., 44 В, J=132,8 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -130,8 (м., 8 F); -142,0 (м., 8 F). Масс-спектр (m/z): 2065 [М]+.
Пример 4. Получение никелевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетрацезия (Iг)
Растворяют 515 мг (0,25 ммоль) никелевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия в 400 мл абсолютного пиридина, прибавляют 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия и кипятят при перемешивании в атмосфере аргона 2 часа. Затем каждые 2 часа добавляют в кипящую реакционную массу 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия в течение 30 часов. Далее раствор охлаждают до 80°С, приливают 200 мл этилацетата и 150 см3 воды и перемешивают 1 час при 80°С.
Раствор охлаждают, выливают в 450 мл 20% соляной кислоты. Органический слой отделяют на делительной воронке, промывают 3 раза по 250 мл 20% раствора соляной кислоты, затем промывают 4 раза 300 мл воды. Растворитель отгоняют в вакууме. Выход 509 мг (99%).
ИК-спектр (KBr), ν, см-1: 2938 (СН порфирина), 2525 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 412 (98,6); 506 (16,3); 583 (8,6); 647 (5,4); 749 (25,7).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,51 (с., 4Н, β-пиррол); 4,48 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,22 (д., 44 В, J=131,9 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -131,3 (м., 8 F); -142,1 (м., 8 F). Масс-спектр (m/z): 2059 [М]+.
Пример 5. Получение палладиевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетрацезия (Iд)
Растворяют 527 мг (0,25 ммоль) палладиевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирина)}тетрацезия в 400 мл абсолютного пиридина, прибавляют 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия и кипятят при перемешивании в атмосфере аргона 2 часа. Затем каждые 2 часа добавляют в кипящую реакционную массу 186 мг (1 ммоль) п-толуолсульфонилгидразида и 345 мг (2,5 ммоль) карбоната калия в течение 30 часов. Далее раствор охлаждают до 80°С, приливают 200 мл этилацетата и 150 см3 воды и перемешивают 1 час при 80°С.
Раствор охлаждают, выливают в 450 мл 20% соляной кислоты. Органический слой отделяют на делительной воронке, промывают 3 раза по 250 мл 20% раствора соляной кислоты, затем промывают 4 раза 300 мл воды. Растворитель отгоняют в вакууме. Выход 521 мг (99%).
ИК-спектр (KBr), ν, см-1: 2940 (СН порфирина), 2524 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 405 (102,0); 517 (25,9); 552 (14,9); 604 (1,8); 748 (23,6).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,45 (с., 4Н, β-пиррол); 4,41 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,36 (д., 44 В, J=130, 1 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -132,5 (м., 8 F) -142,4 (м., 8 F). Масс-спектр (m/z): 2107 [М]+.
Пример 6. Получение {5,10,15,20-Тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетранатрия (Iе)
Растворяют 40 мг (0,02 ммоль) соединения (Iа) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 31 мг (99,0%).
ИК-спектр (KBr), ν, см-1: 3446 (NH порфирина), 2949 (СН порфирина), 2526 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 345 (128,0); 373 (135,6); 406 (61,5); 504 (49,5); 654 (16,2); 749 (74,4).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,36 (с., 4Н, β-пиррол); 4,21 (с., 8Н, β-пиррол); -1.32 (с., 2Н, NH). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,33 (д., 44 В, J=132,0 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -131,5 (м., 8 F); -142,2 (м., 8 F).
Масс-спектр (m/z): 1562 [М]+.
Пример 7. Получение медного комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетранатрия (Iж)
Растворяют 41 мг (0,02 ммоль) соединения (Iб) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 32 мг (99,0%).
ИК-спектр (KBr), ν, см-1: 2960 (СН порфирина), 2532 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 411 (229,5), 620 (44,0). Масс-спектр (m/z): 1624 [М]+.
Пример 8. Получение цинкового комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина)тетранатрия (Iз)
Растворяют 41 мг (0,02 ммоль) соединения (Iв) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 32 мг (99,0%).
ИК-спектр (KBr), ν, см-1: 2956 (СН порфирина), 2526 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 374 (119,0), 416 (189,0), 505 (38,8), 623 (30,0), 750 (65,3).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,52 (с., 4Н, β-пиррол); 4,35 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,84 (д., 44 В, J=133,1 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -131,5 (м., 8 F); -142,2 (м., 8 F). Масс-спектр (m/z): 1626 [М]+.
Пример 9. Получение никелевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетранатрия (Iи)
Растворяют 41 мг (0,02 ммоль) соединения (Iг) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 32 мг (99,0%).
ИК-спектр (KBr), ν, см-1: 2940 (СН порфирина), 2529 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 411 (126,2); 507 (20,8); 582 (11,0); 648 (6,9); 748 (32,9).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,46 (с., 4Н, β-пиррол); 4,40 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,43 (д., 44 В, J=132,4 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -130,8 (м., 8 F); -141,9 (м., 8 F). Масс-спектр (m/z): 1619 [М]+.
Пример 10. Получение палладиевого комплекса {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]бактериохлорина}тетранатрия (Iк)
Растворяют 42 мг (0,02 ммоль) соединения (Iд) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 33 мг (99,0%).
ИК-спектр (KBr), ν, см-1: 2943 (СН порфирина), 2524 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε⋅10-3): 406 (130,5); 518 (33,1); 553 (19,0); 605 (2,3); 749 (30,2).
1Н ЯМР-спектр ((CD3)2CO), δ, м.д.: 8,35 (с., 4Н, β-пиррол); 4,27 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2CO), δ, м.д.: -12,42 (д., 44 В, J=130,2 Гц). 19F ЯМР-спектр ((CD3)2CO), δ, м.д.: -132,7 (м., 8 F) -142,6 (м., 8 F). Масс-спектр (m/z): 1667 [М]+.
Все полученные борированные производные представляют собой микрокристаллы темно-коричневого цвета, хорошо растворимые в ацетоне, этилацетате, ацетонитриле, воде.
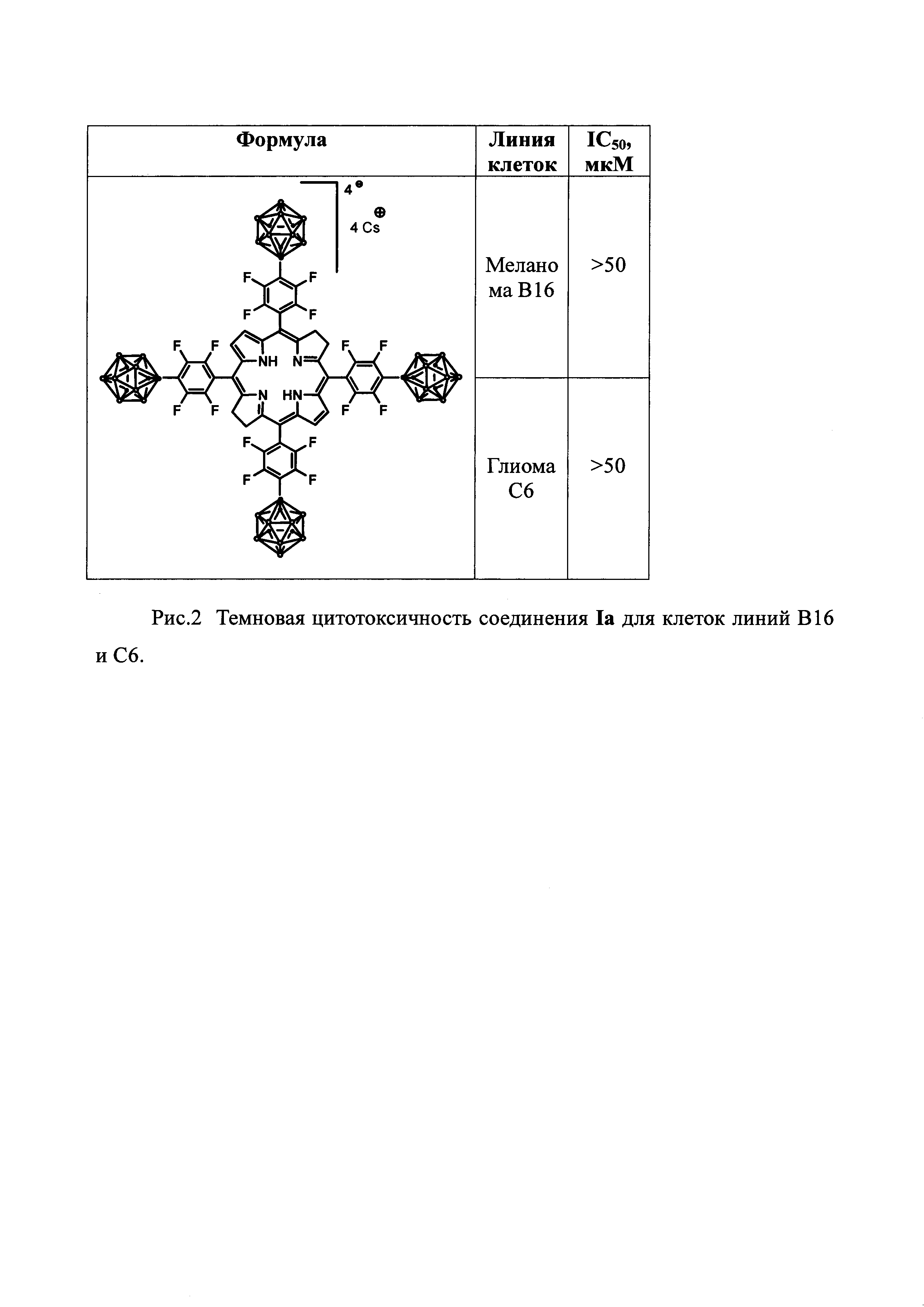
Ниже представлены результаты испытаний противоопухолевой активности основных представителей заявляемых соединений на примере Iа.
Соединение Iа растворяли в воде до концентрации 10 мМ.
Изучение темновой токсичности соединения Iа.
Клетки линий В16 (меланома мыши) или С6 (глиома крысы) рассевали на 96-луночные планшеты (Costar, США) в концентрации 5-10×103 клеток в 190 мкл культуральной среды (состав: модифицированная Дульбекко среда Игла, 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина). В лунки вносили исследуемое соединение до конечных концентраций 0,1-50 мкМ. Объем вносимого соединения Iа не превышал 5% объема среды в лунках. Клетки инкубировали при 37°С в атмосфере с 5%-м содержанием CO2 в течение 72 ч.
По окончании инкубации в лунки вносили 20 мкл водного раствора МТТ (Sigma, США) и планшеты помещали в CO2-инкубатор на 2 часа. О жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении МТТ в формазан дегидрогеназами митохондрий (МТТ-тест). Окраску регистрировали на спектрофотометре при длине волны возбуждения 540 нм. При вычислении процента выживших клеток при той или иной концентрации исследуемых вещества оптическую плотность в лунках, где клетки инкубировались только с растворителем (контроль), принимали за 100%.
На рис. 2 представлены результаты темновой цитотоксичности Iа для линий В16 и С6. Гибель не отмечена даже в концентрациях Iа, превышающих 50 мкМ.
Изучение фототоксичности соединения Iа.
Клетки линий В16 и С6 рассевали в 60-мм чашки Петри (12,5×104 клеток в 5 мл культуральной среды). Через 16 ч в чашки вносили соединение Iа до конечной концентрации 5 мкМ и инкубировали при 37°С, 5% CO2 24 ч. Среду удаляли, добавляли 1 мл фосфатно-солевого буфера pH 7,2 и освещали монослой клеток белым светом 20 мин. В каждую чашку добавляли пропидия иодид до конечной концентрации 10 мкг/мл. Погибшие клетки (включившие пропидия иодид) идентифицировали в флуоресцентном микроскопе (Carl Zeiss, Германия), используя 10- или 40-кратный объектив.
Фазово-контрастные изображения (рис. 3 и рис. 4) показывают форму клеток, характер монослоя (его целостность и плотность). Флуоресценция пропидия иодида (красная) присутствует только в клетках, освещенных в присутствии Iа. Пропидий окрашивает ядра, входя в клетки только с поврежденной плазматической мембраной
Таким образом, соединение Iа не вызывает темновую токсичность (на двух испытанных линиях). Фототоксичность Iа обусловлена первичным некрозом клеток.