Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ
Вид РИД
Изобретение
Область техники
Настоящая группа изобретений относится к медицине и фармацевтике, а более конкретно к лекарственным средствам для фотодинамической терапии (ФДТ) новообразований.
Уровень техники
ФДТ - метод лечения злокачественных опухолей, основанный на способности фотосенсибилизатора (ФС) селективно накапливаться в ткани опухолей вследствие особенностей биохимии злокачественной клетки и при локальном воздействии лазерного облучения определенной длины волны генерировать образование синглетного кислорода и других активных радикалов, оказывающих цитотоксический эффект на опухолевые клетки. Механизм действия ФДТ включает целый комплекс прямых и непрямых реакций взаимодействия различных компонентов, в конечном итоге приводящих к цитотоксическим эффектам. При ФДТ в клетках происходит очень сложный комплекс изменений [Гельфонд М.Л. Возможности ФДТ в онкологической практике // Физическая медицина. 2005. Т. 15, №2, с.33-37; А.Ф. Миронов. Фотодинамическая терапия рака - новый эффективный метод диагностики и лечения злокачественных заболеваний // Соросовский образовательный журнал. 1996. Т. 8, с. 32-40; Трещалина Е.М. Противоопухолевая активность веществ природного происхождения // Практическая медицина. Москва. 2005. 270 с.; Цыб А.Ф., Каплан М.А. Экспериментальные аспекты фотодинамической терапии // Издательство Н.Ф. Бочкаревой, Калуга. 2010. 208 с.; Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. Фотодинамическая терапия // ООО «Медицинское информационное агентство», Москва. 2009 г. 192С; Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. Клинические аспекты фотодинамической терапии // Издательство научной литературы Н.Ф. Бочкаревой, Калуга. 2009. 204 с.; Чан Тхи Хай Иен, Г.В. Раменская, Н.А. Оборотова. Фотосенсибилизаторы хлоринового ряда в фотодинамической терапии опухолей // Российский биотерапевтический журнал. 2009. Т.4, №8, с. 99-105; Чисов В.И., Давыдов М.И. Онкология: национальное руководство // ГЭОТАР Медиа, Москва. 2013. 1072 с.]. Мишенями фотохимических воздействий являются многие клеточные структуры: клеточные мембраны, митохондрии, ДНК и микротрубочки. По мере прогрессирования повреждения мембран могут наблюдаться и другие электролитные нарушения. Сублетальное повреждение клеток посредством вовлечения многих сигнальных систем может вызывать апоптоз. Тем не менее, in vivo важными могут быть и непрямые эффекты, такие как ишемический некроз вследствие повреждения сосудов. Эффекты ФДТ можно модулировать, меняя дозу, конъюгируя ФС с липопротеинами или липосомами и добавляя химиопрепараты. Основными преимуществами ФДТ перед общепринятыми методами лечения злокачественных опухолей являются избирательность поражения, отсутствие риска хирургического вмешательства и тяжелых системных осложнений, низкая стоимость лечения. В настоящее время в ФДТ злокачественных новообразований большой интерес в качестве ФС вызывают производные ряда хлорофилла [Панченков Д.Н., Леонов С.Д., Родин А.В. Разработка алгоритма биоимпедансного анализа новообразований на модели перевиваемой опухоли РС-1 в эксперименте // Вестник экспериментальной и клинической хирургии. 2013. Т. 6, №3, с. 287-291; Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Ред совет: Фисенко В.П. (председ.) и др. // ИИА «Ремедиум», Москва. 2000. 832 с.; Романко Ю.С., Цыб А.Ф., Каплан М.А., Попучиев В.В. Зависимость противоопухолевой эффективности фотодинамической терапии от плотности световой энергии // Бюллетень экспериментальной биологии и медицины. 2005. Т. 139, №4, с. 456-461], а также ведутся активные работы по созданию липосомальных форм ФС, которые увеличивают эффективность ФДТ [Зорина Т.Е., Янковский И.В., Кравченко И.Е. Липосомальные формы фотосенсибилизаторов для фотодинамической терапии и характеристики их накопления в клетках // Медико-социальная экология личности: состояние и перспективы: Материалы X Междунар. конф., 6-7 апр. 2012 г., Минск / редкол.: В.А. Прокашева (отв. ред.) [и др.]. Изд. центр БГУ, Минск. С. 155-158; Меерович И.Г., Оборотова Н.А. Применение липосом в фотохимиотерапии: 1. Липосомы в фото динамической терапии // Российский биотерапевтический журнал. 2003. Т. 2, №4, с. 3-8; М.В. Дмитриева, Н.А. Оборотова, О.Л. Орлова, А.П. Полозкова, И.И. Агапов, М.П. Кирпичников. Липосомальная лекарственная форма борхлорина.// Российский биотерапевтический журнал. 2014. Т. 1, №13, с. 31-35; Могирев С.В. Каталитическая терапия экспериментальных опухолей печени // Диссертация. Москва. 2005]. Поэтому создание препарата борированного хлорина и разработка новой лекарственной формы липосомального борированного хлорина является актуальной задачей [Романко Ю.С., Цыб А.Ф., Каплан М.А., Попучиев В.В. Зависимость противоопухолевой эффективности фотодинамической терапии от плотности световой энергии // Бюллетень экспериментальной биологии и медицины. 2005. Т. 139, №4, с. 456-461; Каплан М.А. Фотодинамическая терапия с использованием борированного хлорина. Материал доложен в Москве на научно-практической конференции "Лазерная медицина XXI века", 2009; Каплан М.А., Никитина Р.Г., Ольшевская В.А. и др. Изучение биологического действия многофункциональных комплексов конъюгатов борированных хлоринов // Труды регионального конкурса научных проектов в области естественных наук. 2010 г. Выпуск 15, С. 138-142; Каплан М.А., Никитина Р.Г., Ольшевская В.А., Зайцев А.В., Кучин А.В., Дрожжина В.В., Морозова Т.Г., Малыпакова М.В., Белых Д.В., Калинин В.Н., Штиль А.А. Новые отечественные борсодержащие фотосенсибилизаторы для противоопухолевой терапии // Российский биотерапевтический журнал. 2007. Т. 6, №1, с. 16-17; Экспериментальные аспекты фотодинамической терапии. Под редакцией А.Ф. Цыба и М.А.Каплана // Издательство научной литературы Н.Ф. Бочкаревой. Калуга. 2010. 112 с.; M.A. Kaplan, R.G. Nikitina, V.A. Olshevskaya, V.V. Drozhzhina, V.P. Mardynskaja. T.G. Morozova, A.N. Savchenko, M.M. Moisenovich, V.N. Kalinin, A.A. Shtil - Applicationofboronatedchlorinas a photosensityzerfor PDT // Programme and book of abstracts 13th congress European society for photobiology and the 2nd conference of the European platform for photodynamic therapy. Wroclaw, Poland, September 5-10, 2009; Kaplan M.A, Nikitina R.G., Olshevskaya V.A., Drozhzhina V.V., Mardynskaja V.P., Morozova T.G., Savchenko A.N., Moisenovich M.M., Kalinin V.N., Shtil A.A. Application of boronatedchlorin as a photosensityzer for PDT // Book of abstracts of International Congress of Dermatology, Prague, 2009, P.262; Valentina A. Olshevskaya, Arina N. Savchenko, Andrei V. Zaitsev, Vladimir A. Kuzmin, Mikhail A. Kaplan, Roza G. Nikitina, Valery N. Kalinin, Alexander A. Shtil. Synthesis and evaluation of novel boronated derivatives of chlorine e6 as efficient anticancer photosensitizers // Program and Abstracts International Conferens on Boron Chemistry, August 2008, Platjad"Aro, Spain, KL BO4].
В настоящее время существует несколько официальных препаратов для ФДТ опухолей. Отдельную группу представляют препараты "Фотофрин I" и "Фотофрин II" (США), "Фотосан" (Германия), "Фотогем" (Россия), созданные на основе соединений порфиринового ряда и являющиеся близкими аналогами. Поиск новых ФС продолжается. В связи с этим большое внимание уделяется различным производным хлорофилла. Производные хлорофилла широко используются в клинической практике наряду с такими препаратами, как "Фотофрин-II" [V.A. Olshevskaya, A.V. Zaisev, A.N. Savchenko, R.G. Nikitina, M.A. Kaplan, D.V. Belykh, A.V. Kuchin, A.A. Shtil, V.N. Kalinin. Supramolecularcarborane-containing tetrapyrrols for therapy of cancer // Program, abstracts of vth International Symposium Supramolecular Systems in Chemistry and Biology, May 12-16, 2009, Kyiv, Ukraine]. Эти же вещества используются как диагностические препараты в онкологии.
Борсодержащие соединения являются перспективными агентами для применения в разных областях медицины, в частности, в борнейтронзахватной терапии. Наиболее эффективные борсодержащие структуры, которые можно использовать для оптимизации ФС - карбораны, борорганические каркасные икосаэдрические структуры. Карбораны весьма устойчивы, т.к. электронная система карборанов представляет собой замкнутую структуру с полностью заполненными связывающими орбиталями. Этот факт обусловливает важность использования борных полиэдров для оптимизации ФС (Приняты за базовый объект.) В Институте элементоорганических соединений им. А.Н.Несмеянова РАН был синтезирован препарат борированный хлорин (13(l)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2), 17(3)-диметилового эфира хлорина е6, патент №2406726 от 20 декабря 2010 года) - принят за базовый объект [Оборотова Н.А. Липосомальные лекарственные формы противоопухолевых препаратов (обзор) // Хим. фарм. журнал. 2001. Т. 35, №4, С. 32-38].
Несмотря на высокую эффективность ряда синтезированных потенциальных противораковых соединений, остается открытым вопрос о снижении их токсичности, поскольку большинство разработанных веществ при введении в организм проявляли нежелательные эффекты - тромбообразование, органную токсичность [Цыб А.Ф., Каплан М.А., Романко Ю.С., Попучиев В.В. Клинические аспекты фотодинамической терапии // Издательство научной литературы Н.Ф. Бочкаревой, Калуга. 2009. 204С; T.D. Mody. Pharmaceutical development and medical applications of porphyrin-type macrocycles // J. Porph. Phthalocyan. 2000. V. 4, P. 362-367]. Кроме того, современные лекарственные средства должны соответствовать ряду важных требований, одним из которых является высокое сродство к внутриклеточной мишени. Именно это требование позволяет повысить эффективность лекарства и ограничить тяжесть побочных явлений. В свою очередь, сродство к мишени определяется размером молекулы лекарственного препарата. Оптимальным является нанометровый диапазон размеров (порядка 100-200 нм), поскольку это позволяет добиться отсутствия образования комплексов в растворах, повысить доставку в орган-мишень и обеспечить наилучшее взаимодействие с биомолекулами и их комплексами (в частности, органеллами) внутри клетки. Дизайн препаратов требует достижения таких соотношений между фармакологически активными частями сложной молекулы лекарства, при которых сохраняется наноразмерность, невзирая на присоединения к фармакофорам объемных заместителей. Таким образом, вопрос о синтезе высокоэффективных ФС остается открытым. Требуется разработка способов химической модификации структуры фотосенсибилизаторов для сохранения их высокой противоопухолевой активности и снижении побочного действия (оптимизация).
Выдвижение концепции о существовании специфического белка, связывающего фолиевую кислоту (FBP) [Johns DG, Sperti S, Burgen AS. The metabolism of tritiated folic acid in man // J Clin Invest. 1961. V. 40, P. 1684-1695] повлекло за собой ряд исследований по изучению свойств данного белка, в том числе Rothenberg с сотр. впервые обнаружили FBP в клетках человеческого организма [Rothenberg SP. A macromolecular factor in some leukemic cells which binds folic acid // Proc. Soc. Expl. Biol, Med. 1970, V. 133, P. 428], a Lesli с сотр. выделили FBP из клеточных мембран [Leslie GI, Rowe PB. Folate binding by the brush border membrane proteins of small intestinal epithelial cells // Biochem. 1972. V.11, P. 1696-1703]. После проведения многочисленных исследований на клетках плаценты Antony с сотр. высказали предположение о том, что FBP на поверхности клеточной мембраны выполняет функции рецептора фолиевой кислоты (FR), и успешно проиллюстрировали его биохимические свойства [Antony AC, Utley С, Van Horne KC, Kolhouse JF. Isolation and characterization of a folate receptor from human placenta // J. Biol. Chem. 1981. V. 256, №18, P. 9684-9692]. FR - якорно-закрепленный на глицерофосфатидинозите (GPI) клеточных мембран тип FBP, который может отщепляться от клеточной мембраны под воздействием GPI-специфических фосфатидаз С или D [Lee НС, Shoda R, Krall JA, Foster JD, Selhub J, Rosenberry TL. Folate binding protein from kidney brush border membranes contains components characteristic of a glycoinositol phospholipid anchor // Biochem. 1992. V. 31, P. 3236-3243]. FR относительно равномерно распределен на поверхности клеточной мембраны и, после связывания фолиевой кислотой, под воздействием инициатора может сдвигаться в область покрытых углублений или ковеол и, как следствие этого, образовывать кластеры [Verma RS, Gullapalli S, Antony AC. Evidence that the hydrophobicity of isolated, in situ, and de novo-synthesized native human placental folate receptors is a function of glycosyl-phosphatidylinositol anchoring to membranes // J. Biol. Chem. 1992. V. 267, №(6), P. 4119-4127]. Далее в результате эндоцитоза фолиевая кислота переносится непосредственно в клетки [Mayor S, Romberg KG, Maxfield FR. Sequestration of GPI-anchored proteins in caveolae triggered by cross-linking // Science. 1994. V. 264, P. 1948-1951; Anderson RG, Kamen BA, Romberg KG, Lacey SW. Potocytosis: sequestration and transport of small molecules by caveolae // Science. 1992. V.255, Р.410]. В некоторой степени фолиевая кислота оказывает влияние на сродство и плотность клеток, но после определенных максимальных дозировок фолиевой кислоты сродство FR- к фолиевой кислоте понижается и при этом на опухолевых клетках плотность FR- увеличивается [Gates SB, Mendelsohn LG, Shackelford KA, Habeck LL, Kursar JD, Gossett LS, Worzalla JF, Shih C, Grindey GB. Characterization of folate receptor from normal and neoplastic murine tissue: influence of dietary folate on folate receptor expression // Clin. Cancer Res. 1996. V. 2, Р. 1135-1141].
Результаты исследований, иллюстрирующих, что величина экспрессии и/или активности FR на большинстве типов опухолевых клеток заметно выше соответствующих значений для нормальных клеток, спровоцировали рост числа исследований по использованию фолиевой кислоты в качестве агента адресной доставки противоопухолевых препаратов, нацеленного на опухолевые клетки-мишени [Campbell IG, Jones ТА, Foulkes WD, Trowsdale J. Folate-binding protein is a marker for ovarian cancer // Cancer Res. 1991. V. 51, P. 5329-5336; Coney LR, Tomassetti A, Carayannopoulos L, Frasca V, Kamen BA, Colnaghi MI, Zurawski VR Jr. Cloning of a tumor-associated antigen: MOv18 and MOv19 antibodies recognize a folate-binding protein // Cancer Res. 1991. V. 51, P. 6125-6132; Weitman SD, Lark RH, Coney LR, Fort DW, Frasca V, Zurawski VR Jr, Kamen BA. Distribution of the folate receptor GP38 in normal and malignant cell lines and tissues // Cancer Res. 1992. V. 52, P. 3396-3401]. Результаты экспериментов по элиминации опухолей у животных показали, что комплексы фолиевой кислоты в виде RF лигандов, непосредственно или косвенно связывающие радионуклеиды, оказывают существенное влияние на динамику и особенности развития опухоли [Патент US 5688488 A «Composition and method for tumor imaging»].
Исследования воздействия на культуру опухолевых клеток комплекса «фолиевая кислота-ПЭГ-липосома», полученного в результате непрямого связывания фолиевой кислоты с поверхностью липосомы, показали, что указанный комплекс оказывает большее воздействие на опухолевые клетки-мишени, чем неполная комбинация ПЭГ-липосома или обычная липосома [Заявка Low et al. WO 96/36367, 21 ноября 1996; Патент WO 1997031624 А1 «Liposomal delivery system»].
Известно средство, включающее производное 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2), 17(3)-диметилового эфира хлорина е6, фосфатидилхолин (лецитин), холестерин, DSPE-PEG-2000, и сахарозу, при этом фосфолипид входит в состав, в виде конъюгата с DSPE-PEG-2000, а соотношение лецитин: сахароза составляет 1:5 [Дмитриева М.В. и др. Липосомальная лекарственная форма борхлорина. Российский биотерапевтический журнал, №1, т. 13, 2014, стр. 31-36], принятое за прототип. Средство вводится в организм животного внутривенно в виде липосомальной дисперсии.
Выбранный прототип имеет следующие недостатки:
1. средство-прототип имеет недостаточную селективность доставки к месту проведения ФДТ, что в свою очередь приводит к недостаточной фотодинамической активности препарата.
2. низкое содержание активного агента (производного хлорина) в единице лекарственной формы. Т.е. больному при проведении ФДТ придется вводить очень большие объемы лекарства.
Раскрытие изобретения
Задачей предлагаемого технического решения является создание высокоселективного средства для ФДТ со сниженной пороговой концентрацией, приводящей к 50% гибели опухолевых клеток по сравнению с прототипом.
Техническим результатом изобретения является создание средства для ФДТ, включающего 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2),17(3)-диметилового эфир хлорина е6, обладающего более высокой фотодинамической активностью за счет более высокой селективности накопления в опухолевых клетках и сниженной пороговой концентрацией, приводящей к 50% гибели опухолевых клеток по сравнению с прототипом.
Предлагаемый технический результат достигается использованием средства для фотодинамической терапии, включающего следующие компоненты в масс. %: 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2),17(3)-диметилового эфир хлорина е6 (БХ) - 0.047; фосфатидилхолин (ФХ) - 7.808; холестерин (X) - 1.401; DSPE-PEG-2000 (ПГ) - 0.129; сахарозу (С) - 11.4; DSPE-PEG(5000) Folate - 0.59; с допустимый отклонением от указанных значений на ±5%, деионизированная вода до 100 и его лиофилизированной формы.
Краткое описание чертежей
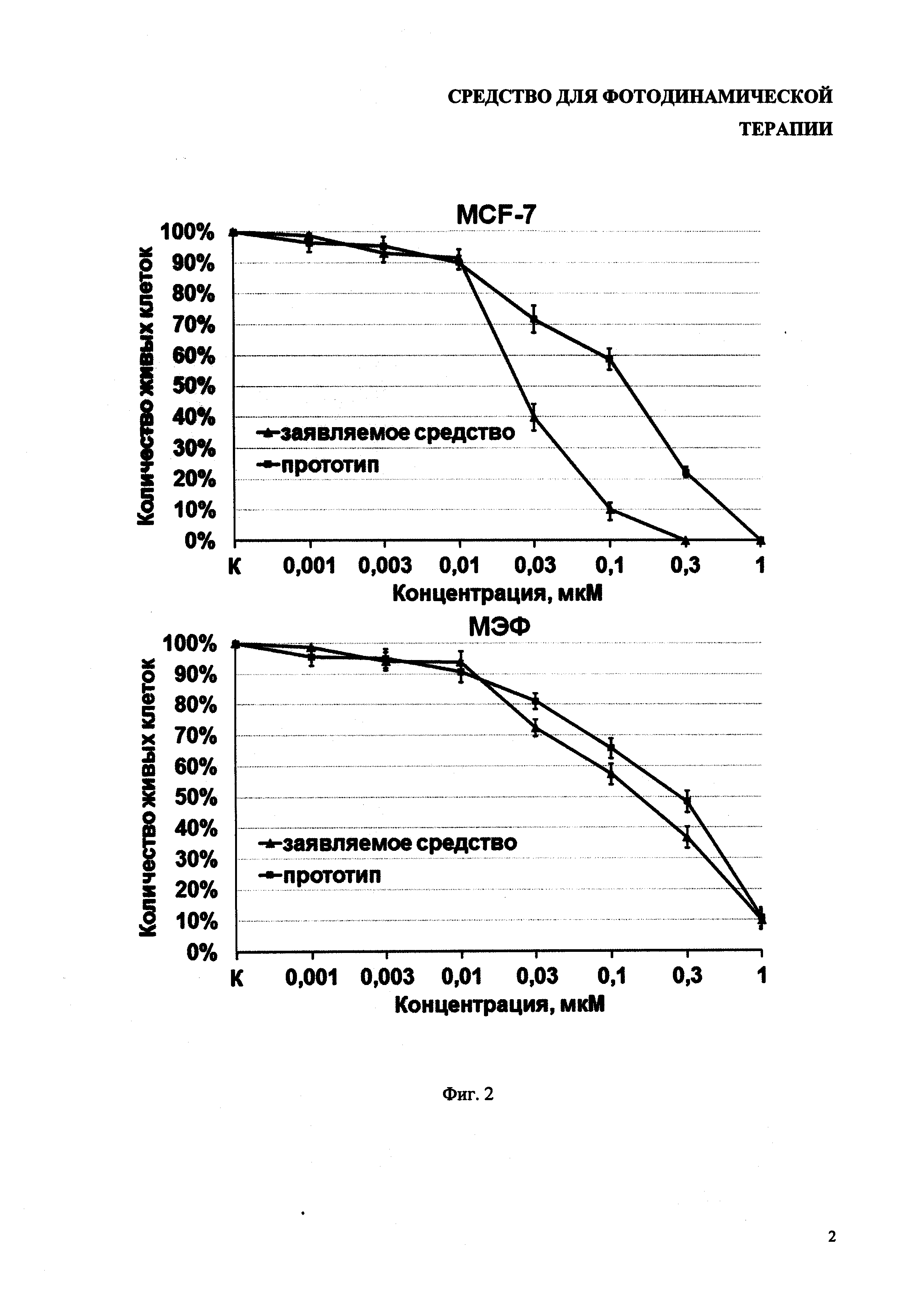
На фиг. 1 показана темновая токсичность заявляемого средства по сравнению с прототипом.
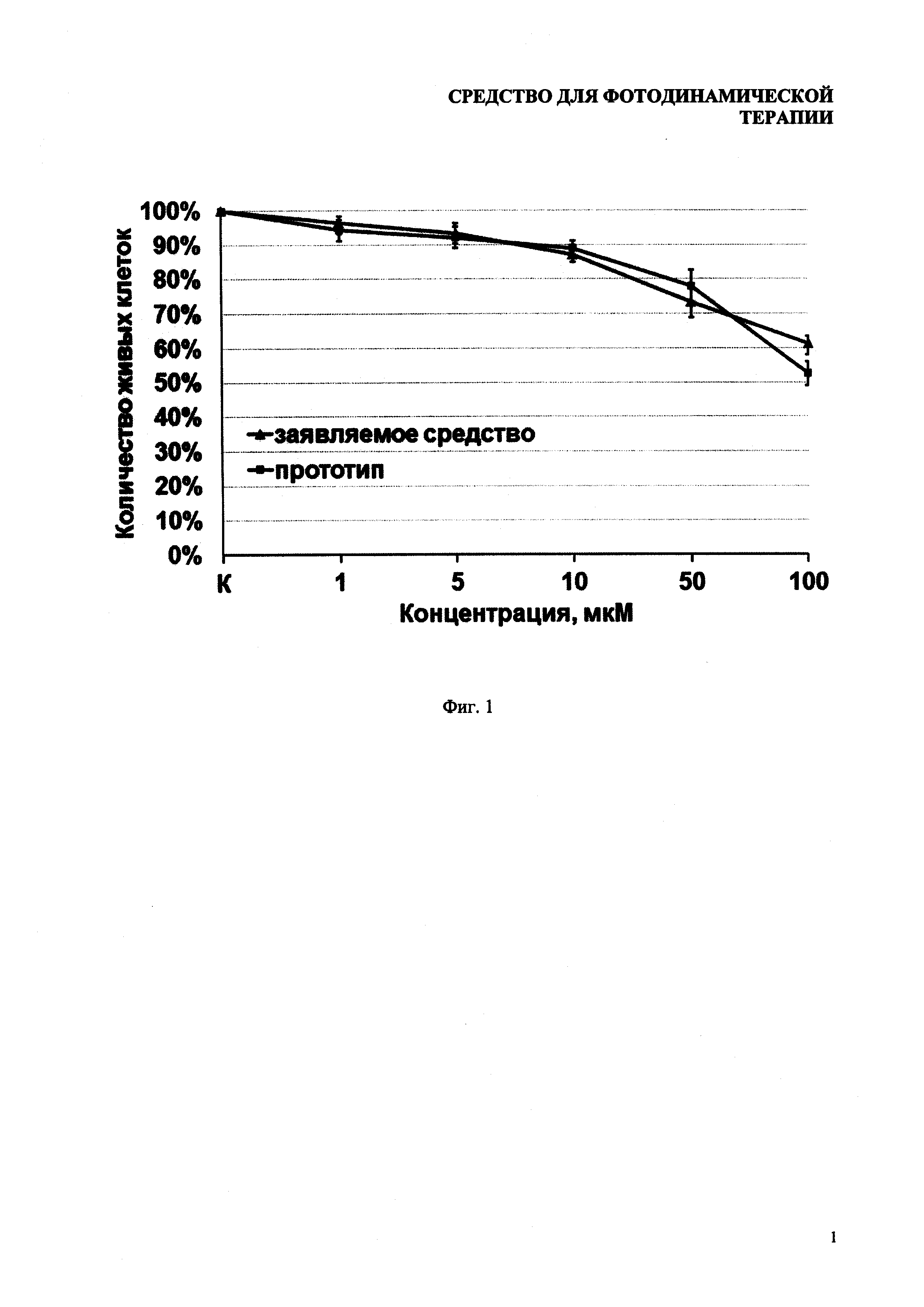
На фиг. 2 показана фотодинамическая активность заявляемого средства по сравнению с прототипом.
Осуществление изобретения
Предлагаемое средство для ФДТ получалось методом Бенгема (Bangham), адаптированным для нерастворимых субстанций.
Способ получения средства для ФДТ, заключается в растворении 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил] аминоэтил}амид-15(2), фосфатидилхолина, холестерина, DSPE-PEG-2000 и DSPE-PEG(5000) Folate в хлороформе, упаривании образовавшегося хлороформного раствора на роторном испарителе под вакуумом до полного удаления хлороформа и диспергирование образованной при упаривании пленки водой для инъекций путем встряхивания. Далее проводят фильтрацию и экструзию полученной липосомальной дисперсии. После экструзии в липосомальную дисперсию дополнительно добавляют раствор сахарозы, после чего дисперсию стерилизуют фильтрацией и дозируют.
Средний размер липосом после экструзии, измеренный на приборе Submicron Particle Sizer NICOMP-380, составлял 100-200 нм. После экструзии в дисперсию был добавлен раствор сахарозы. Добавление раствора сахарозы после экструзии не мешает измельчению липосом и не нарушает высокого (более 90%) включения 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2), 17(3)-диметилового эфира хлорина е6 в липосомы.
Полученная липосомальная дисперсия при условии хранения при температуре +2…+8°С стабильна непродолжительный период времени - в течение 5-6 суток. При более длительном хранении наблюдается постепенное слияние и образование везикул более крупных размеров и снижение уровня рН липосомальной дисперсии, что обусловлено процессами перекисного окисления липидов, входящих в состав ЛФ. Данный недостаток препятствует осуществлению серийного производства липосомальной лекарственной формы. Для повышения устойчивости липосомальной дисперсии в процессе хранения и продления срока годности предложена ее стабилизация посредством сублимационной сушки. Лиофилизация липосомальной дисперсии позволила увеличить срок годности заявляемого средства до 2 лет.
Ниже приведены конкретные примеры предлагаемого средства для ФДТ.
Пример 1. 0,048 г 13(1)-N-{2-[N-(клозо-монокарбадодекаборан-1-ил)-метил]аминоэтил}амид-15(2), 8,2 г фосфатидилхолина, 1,471 г холестерина, 0,135 г DSPE-PEG-2000 и 0,62 г DSPE-PEG(5000) Folate растворили 120 мл хлороформа. Затем образовавшийся хлороформный раствор упарили на роторном испарителе под вакуумом до полного удаления хлороформа и диспергировали образованную при упаривании пленку 134 мл воды для инъекций путем встряхивания. Далее провели фильтрацию и экструзию полученной липосомальной дисперсии, последовательно пропуская через нейлоновые мембранные фильтры «Pall» с диаметром пор 1,2 мкм (1 раз), 0,45 мкм (1 раз) и 0,22 мкм (5 раз) на экструдере Lipex Thermobarrel Extruder (Northern Lipids Inc., Канада) под давлением 0,9-1,0 МПа. После экструзии в липосомальную дисперсию дополнительно добавили 30 мл 50% водного раствора сахарозы, после чего полученную дисперсию стерилизовали фильтрацией через нейлоновый мембранный фильтр «Ра11» с диаметром пор 0,22 мкм с использованием экструдера и дозировали во флаконы с помощью ручного дозатора «Oxford». Затем полученную дисперсию лиофилизировали в сублимационной установке «Edwards Minifast D0.2».
Таким образом было получено средство следующего состава, масс. %:
|
Пример 2. Проведен аналогично примеру 1, но было получено средство следующего состава, мас. %:
|
Пример 3. Проведен аналогично примеру 1, но было получено средство следующего состава, мас. %:
|
Для прототипа и заявляемого средства проведены сравнительные исследования темновой токсичности и цитотоксичности при облучении.
Методика
Исследование темновой токсичности
Клетки глиомы крысы С6, находящихся в логарифмической фазе роста, равномерно распределяли по лункам 96-луночного плейта из расчета 1*104 клеток в 100 мкл на лунку и инкубировали в темноте в атмосфере, содержащей 6.1% углекислого газа, при +37°С в течение 24 часов. Затем в лунки того же плейта помещали вещества (прототип и заявляемое средство) в разных концентрациях в среде DMEM с 10% ЭТС по 100 мкл в лунку.
Для исследования темновой токсичности клетки инкубировали с анализируемыми веществами при 37°С, 5% СО2 в течение 72 часов. Каждую концентрацию препарата изучали в 3 повторностях. Контролем служили лунки с растворителем (ДМСО). Объем испытуемого соединения не превышал 5% объема культуральной среды в лунках. По окончании инкубации в лунки вносили 20 мкл (50 мкг) тетразолиевой соли (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Р-тетразолий, внутренняя соль), и планшеты помещали в СО2-инкубатор на 2 часа. О жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении тетразолия в формазан дегидрогеназами митохондрий. Окраску регистрировали на спектрофотометре при длине волны возбуждения 540 нм. Оптическую плотность в лунках, где клетки инкубировались только с растворителем (контроль), принимали за 100%. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняли и вычисляли процент выживших клеток при той или иной концентрации исследуемых препаратов.
Исследование фотодинамической активности
Клетки мышиных эмбриональных фибробластов МЭФ, находящихся в логарифмической фазе роста, равномерно распределяли по лункам 96-луночного плейта из расчета 1,4*104 клеток в 100 мкл на лунку и инкубировали в темноте в атмосфере, содержащей 6.1% углекислого газа, при +37°С в течение 24 часов. Затем в лунки того же плейта помещали вещества в разных концентрациях в среде DMEM с 10% ЭТС по 100 мкл в лунку.
Клетки аденокарциномы молочной железы MCF-7, находящихся в логарифмической фазе роста, равномерно распределяли по лункам 96-луночного плейта из расчета 1*104 клеток в 100 мкл на лунку и инкубировали в темноте в атмосфере, содержащей 6.1% углекислого газа, при +37°С в течение 24 часов. Затем в лунки того же плейта помещали вещества в разных концентрациях в среде ЕМЕМ с 10% ЭТС по 100 мкл в лунку.
Для исследования фотодинамической активности прототипа и заявляемого средства по окончании инкубации плейты облучали, используя монохромный источник света с длиной волны 633 нм, в течение 30 минут. Затем инкубировали в темноте в атмосфере, содержащей 6.1% углекислого газа, при +37°С в течение 48 часов. После чего среду с веществами удаляли и вносили по 100 мкл МТТ в среде в концентрации 0.5 мг/мл и инкубировали при +37°С в течение 24 часов. Осадок растворяли в 200 мкл ДМСО. Колориметрические измерения проводили на ридере Labsystem Multiscan plus при 540 нм. Величина оптической плотности прямо пропорциональна числу живых клеток.
Результаты исследования темновой токсичности представлены на фиг. 1. Темновая токсичность для субстанции и для лекарственной формы совпадают, ЛД50 больше 50 мкМ.
Результаты исследования фото динамической активности представлены на фиг. 2.
Концентрация, приводящая к 50%-й (ЛД50) гибели клеток первичных клеток МЭФ через 48 часов, для прототипа и для заявляемого средства составила 0.2 мкМ. К 100%-й гибели (ЛД100) клеток МЭФ через 48 часов приводит действие анализируемых фотодинамических веществ в концентрациях более 1 мкМ.
На культуре опухолевых клеток фотодинамическая активность была более выражена. Концентрация, приводящая к 50%-й гибели (ЛД50) клеток MCF-7 через 48 часов, для прототипа составила 0.2 мкМ, в то же время, действующая концентрация заявляемого средства была на порядок меньше. К 100%-й гибели (ЛД100) клеток MCF-7 через 48 часов приводит действие более чем 1 мкМ прототипа, а заявляемого средства требуется в 3 раза меньше.
Более высокая фотодинамическая активность заявляемого средства по сравнению с прототипом в культуре аденокарциномы молочной железы MCF-7 является последствием большей селективности заявляемого средства и достигается заявленной в формуле изобретения совокупностью признаков, включающих липосомальную форму липида с фолиевой кислотой. Доказанным фактом является то, что на поверхности клеточных мембран различных типов опухолевых клеток высоко экспрессированны рецепторы фолиевой кислоты [Müller C1, Schubiger PA, Schibli R. In vitro and in vivo targeting of different folate receptor-positive cancer cell lines with a novel 99mTc-radiofolate tracer // Eur J Nucl Med Mol Imaging. 2006. V. 33, №10, P. 1162-1170]. Это дает возможность использовать фолиевую кислоту в качестве вектора направленного транспорта фотодинамических веществ, способного селективно связываться с мембранами опухолевых клеток-мишеней с последующим проникновением внутрь путем рецептор-опосредованного эндоцитоза.
Изучение противоопухолевой активности заявляемого средства
Исследования проведены на 42 беспородных крысах. Штамм (культура клеток опухоли) получен из Банка опухолевых штаммов лаборатории комбинированной терапии опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» МЗ РФ. Крысам вводили подкожно в область бедра по 0,7-1,0 мл взвеси клеток. Затем 3 раза на крысах делали перепассаж опухолевым материалом. Для этого у крысы-донора удаляли опухолевую ткань, которую механически размельчали, смешивали с раствором Хенкса в соотношении 1:5. Полученный гомогенат в количестве 0,5 мл вводили крысе-реципиенту подкожно в область бедра. Опухоль с каждым перепассажем изменялась, приобретая более плотную консистенцию с выраженной капсулой и более развитую кровеносную сеть. Перевиваемость опухоли в 100% случаев. В опыт животных брали на 11-13 сутки, когда диаметр опухоли составлял 1,2-1,6 см.
Противоопухолевую активность ЗС изучали на 2-х дозах: 2,5 и 5,0 мг/кг при одинаковых параметрах лазерного излучения.
В группе с дозой 2,5 мг/кг до 10 суток исследования наблюдалась полная регрессия (ПР) опухоли у 100% животных. На 14 сутки после ФДТ наблюдался боковой рост у 2-х животных (14,3%). На конец наблюдения (21 сутки после ФДТ) процент ПР опухоли составлял 78,4%, рост отмечался у 21,4%. У животных с ростом опухоли коэффициент абсолютного прироста опухоли был значительно ниже по сравнению с контролем. На 14 сутки достоверно ниже (р<0.035), на 21 сутки также значительно ниже чем в контроле - К=9,57, в контроле К=23,25.
В группе с дозой 5,0 мг/кг на все сроки наблюдения отмечалась ПР опухоли у всех животных в группе.
Таким образом, несмотря на значительный первоначальный размер опухоли и ее агрессивность, невысокие параметры лазерного излучения при проведении ФДТ (Е=150 Дж/см2, Ps=0,25 Вт/см2), даже доза 2,5 мг/кг ЗС оказалась эффективной для проведения ФДТ. Максимальный ингибирующий эффект получен с дозой ЗС 5,0 мг/кг. Данные представлены в таблице 1.
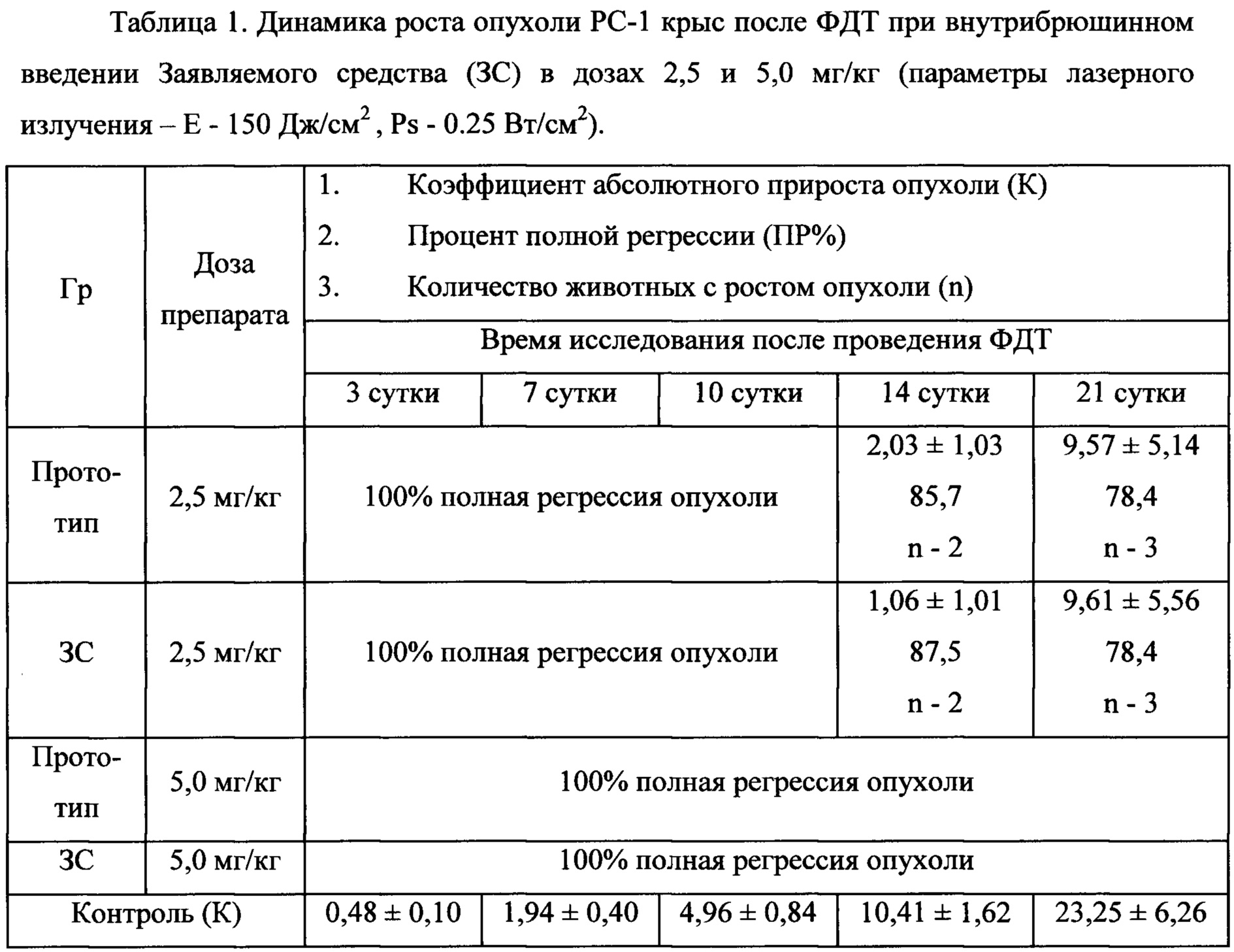
Примечание: в контрольных группах полной регрессии опухоли не наблюдалось.
Таким образом, предложенные средства согласно группе изобретений обладают селективностью накопления в опухолевых клетках и обеспечивают высокую эффективность при проведении ФДТ.