Результат интеллектуальной деятельности: Фармацевтические композиции на основе соли микофеноловой кислоты с энтеросолюбильным покрытием
Вид РИД
Изобретение
Настоящее изобретение относится к микофеноловой кислоте.
Микофеноловая кислота, также называемая в данном описании МФК, впервые была выделена в 1896 г. и ее интенсивно исследовали в качестве лекарственного средства, представляющего потенциальный коммерческий интерес. Известно, что она обладает противоопухолевой, противовирусной, иммунодепрессантной, противопсориазной и противовоспалительной активностью [см., например, W.A. Lee и др. Pharmaceutical Research (1990), 7, стр. 161-166 и ссылки, указанные в этой публикации]. Известны публикации о МФК в качестве противоракового агента специалистов фирмы Lilly, см., например, M.J. Sweeney и др., Cancer Research (1972), 32, 1795-1802 и специалистов фирмы ICI, см., например, GB 1157099 и GB 1203328, и в качестве иммунодепрессантного агента, см., например, A. Mitsui и др. J. Antibiotics (1969) 22, стр. 358-363. В вышеуказанной статье W.A. Lee и др. имеются сведения о том, что были предприняты попытки увеличить биологическую доступность или специфичность МФК путем синтеза производных. Считалось, что недостаточная биологическая доступность кислоты вызывается неопределенными факторами, такими как комплексообразование лекарства в желудочно-кишечном тракте, узкое окно абсорбции, метаболизм до абсорбции и т. д. Было описано, что препарат на основе морфолиноэтилового эфира, также известного как мофетил микофенолята (иногда называемого в настоящем описании МФМ), обладает значительно более высокой биологической доступностью, чем МФК (100% для МФМ и 43% для МФК). Это производное недавно начало поступать в продажу в качестве иммунодепрессанта для лечения или предупреждения отторжения трансплантата органа или ткани, применяемого в суточных дозах от приблизительно 200 мг до приблизительно 3 г перорально, например приблизительно 2 г перорально. Соблюдение пациентом режима и схемы лечения МФМ не является идеальным, в том числе из-за побочных действий, например побочных действий в отношении желудочно-кишечного тракта, происхождение которых неизвестно.
После обширных испытаний авторами настоящего изобретения было установлено, что соли микофеноловой кислоты с энтеросолюбильным покрытием или приспособленные для высвобождения в верхней части кишечника, например в двенадцатиперстной кишке, тощей кишке и/или подвздошной кишке, являются эффективными, хорошо переносимыми лекарственными средствами, в частности, для показаний, связанных с иммунодепрессией, особенно для лечения или предупреждения отторжения аллотрансплантата или ксенотрансплантата органа, ткани или клетки, например, после трансплантации или для лечения или предупреждения заболеваний, обусловленных иммунной системой (аутоиммунные заболевания), и обладают представляющими интерес характеристиками биологической доступности и стабильности. Кроме того, требуется вводить меньшие стандартные дозируемые формы, чем для МФМ, что облегчает введение.
Один из объектов настоящего изобретения относится к фармацевтической композиции, содержащей соль микофеноловой кислоты, причем эта композиция приспособлена для высвобождения микофенолята в верхней части кишечного тракта (в настоящем описании она называется композицией по изобретению).
Указанная способность композиции к такому высвобождению может быть достигнута любым общепринятым способом, предпочтительно с помощью средств, предотвращающих высвобождение микофенолята в желудке и обеспечивающих высвобождение в верхней части кишечного тракта. Еще один объект изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемую соль микофеноловой кислоты с нанесенным покрытием.
Такие соли представляют собой катионные соли, например соли щелочных металлов, предпочтительно соли натрия. Натриевые соли микофенолята известны, например, из патента ЮАР 68/4959. Согласно изобретению предпочтительно использовать мононатриевую соль. Она может быть получена в кристаллической форме путем перекристаллизации из ацетона/этанола при необходимости с водой; tпл 189-191oС.
В частности, объектом изобретения является твердая композиция с энтеросолюбильным покрытием в виде стандартной дозируемой формы, предназначенная для орального введения, причем ядро композиции содержит микофенолят натрия в твердой или жидкой форме.
Под термином "ядро" понимается микофенолят натрия (или другая катионная соль) при необходимости в смеси с другим физиологически приемлемым материалом, которое может быть окружено энтеросолюбильной оболочкой. Понятие "ядро" в широком смысле включает не только таблетки, пилюли или гранулы, но также капсулы, например капсулы из желатина или крахмала с мягким или твердым покрытием. Такие ядра могут быть изготовлены общепринятым способом. Согласно изобретению было установлено, что соли микофеноловой кислоты, в частности натриевая соль, представляют особый интерес для изготовления таблеток. Если используют ядра в виде таблеток, они предпочтительно должны иметь твердость приблизительно от 10 до 70 Н.
Пилюли или гранулы после нанесения энтеросолюбильного покрытия, как описано ниже, могут использоваться как сами по себе, так и для наполнения капсул, например желатиновых капсул с твердым покрытием. В альтернативном варианте при необходимости энтеросолюбильное покрытие может быть нанесено на капсулы, например, общепринятым способом.
В ядре могут присутствовать другие фармацевтически приемлемые ингредиенты, например, такие, которые обычно применяют при изготовлении фармацевтических композиций, например наполнители, такие как лактоза, скользящие вещества, такие как двуокись кремния, и смазывающие вещества, такие как стеарат магния.
Под понятием "энтеросолюбильное покрытие" понимается любое фармацевтически приемлемое покрытие, предотвращающее высвобождение действующего вещества в желудке и в достаточной степени разлагающееся в кишечном тракте (при контакте с приблизительно нейтральными или щелочными кишечными соками) для обеспечения резорбции действующего вещества стенками кишечного тракта. В фармакопеях различных стран опубликованы различные тесты для определения in vitro, может ли покрытие быть классифицировано как энтеросолюбильное или нет.
Более конкретно понятие "энтеросолюбильное покрытие", как оно используется в настоящем описании, относится к покрытию, которое остается неповрежденным в течение по крайней мере 2 ч при контакте с искусственными желудочными соками, такими как НС1 с рН 1 при 36-38oС, и после этого предпочтительно разлагается в течение 30 мин в искусственных кишечных соках, таких как забуференный КН2РО4 раствор с рН 6,8.
Толщина покрытия может варьироваться и зависит среди прочего от его проницаемости для воды и кислот. Обычное покрытие может иметь массу приблизительно 16-30, например 16-20 или до 25 мг на желатиновую капсулу размера 1. Аналогичные толщины могут использоваться и в других препаративных формах.
В целом удовлетворительные результаты получают при использовании покрытия, имеющего толщину 5-100 мкм, предпочтительно 20-80 мкм. Материал для покрытия выбирают из пригодных макромолекулярных полимеров. Пригодные для этой цели полимеры указаны, например, у L. Lachman и др. The Theory and Practice of Industrial Pharmacy, 3-е изд., 1986, стр. 365-367, у Н. Sucker и др. , Pharmazeutische Technologie, Thieme, 1991, стр. 355-359, Hagers Handbuch der pharmazeutischen Praxis, 4-е изд., том. 7, стр. 739-742 и 766-778 (изд-во Springer Verlag, 1971) и в Remington's Pharmaceutical Sciences, 13-е изд. , стр. 1689-1691 (изд-во Mack Publ., Co., 1970) и включают, например, производные сложных эфиров целлюлозы, простые эфиры целлюлозы, акриловые смолы, такие как сополимеры метакрилата и сополимеры производных малеиновой кислоты и производных фталевой кислоты.
Предпочтительно пленки изготавливают из ацетатфталата и ацетаттримеллитата целлюлозы, сополимеров метакриловой кислоты, например сополимеров, образованных из метакриловой кислоты и ее сложных эфиров, содержащих по крайней мере 49% метакриловой кислоты; и предпочтительно из гидроксипропилфталата метилцеллюлозы.
Метакрилаты включают таковые, имеющие молекулярную массу свыше 100000 Да и состоящие, например, из метилакрилата и метил- или этилметакрилата в соотношении приблизительно 1: 1. В число обычных продуктов входит Endragit L, например L 100-50, выпускаемый фирмой Rohm GmbH, Дармштадт, Германия.
В обычных ацетатфталатах целлюлозы содержание ацетила составляет 17-26%, а содержание фталата составляет 30-40% и они имеют вязкость приблизительно 45-90 сП.
В обычных ацетаттримеллитатах целлюлозы содержание ацетила составляет 17-26%, а содержание тримеллитила составляет 25-35% и они имеют вязкость приблизительно 15-20 сСт. Примером пригодного ацетаттримеллитата целлюлозы является коммерческий продукт CAT (Eastman Kodak Company, США).
Гидроксипропилфталаты метилцеллюлозы обычно имеют молекулярную массу от 20000 до 100000 Да, например от 80000 до 130000 Да, и содержат гидроксипропил в количестве, например, от 5 до 10%, метоксигруппы в количестве от 18 до 24% и фталил в количестве от 21 до 35%.
Примером пригодного ацетатфталатата целлюлозы является коммерческий продукт CAT (Eastman Kodak Company, США).
Примерами пригодных гидроксипропилфталатов метилцеллюлозы являются коммерческие продукты, которые известны под торговой маркой НР50 и поставляются фирмой Shin-Etsu Chemical Co. Ltd., Токио, Япония и в которых содержание гидроксипропила составляет 6-10%, содержание метоксигрупп составляет 20-24%, содержание фталила составляет 21-27%, молекулярная масса равна приблизительно 84000 Да, а также продукты, известные под торговой маркой НР55 и поставляемые той же самой фирмой и в которых содержание гидроксипролила, метоксигрупп и фталила составляет соответственно 5-9%, 18-22% и 27-35%, а молекулярная масса равна 78000 Да.
Предпочтительным покрытием является НР50.
Энтеросолюбильное покрытие может быть нанесено общепринятым способом, например путем нанесения на ядра раствора энтеросолюбильного покрытия распылением.
Пригодными растворителями для энтеросолюбильного покрытия являются, например, органические растворители, например спирт, такой как этанол, кетон, такой как ацетон, галогенированные углеводороды, такие как CH2Cl2, или смеси этих растворителей, например этанол/ацетон, например, в соотношениях от 1:1 до 10:1.
Обычно к такому раствору добавляют пластификатор, такой как ди-н-бутилфталат или триацетин, например, в соотношении материала покрытия к пластификатору от приблизительно 1:0,05 до приблизительно 1:0,3.
При необходимости к фталатам целлюлозы и другим кислотным материалам покрытия может быть добавлена соль аммония и может применяться водный раствор.
Для нанесения покрытия может быть использована машина для нанесения покрытий в псевдоожиженном слое.
Обычно ядра обрабатывают при комнатной температуре или нагревают перед распылением до 40oС с помощью теплого воздуха с температурой приблизительно 40-70oС. С целью избежать слипания ядер предпочтительно процесс распыления прерывают через определенные промежутки времени и затем ядра нагревают снова. Однако также возможно осуществлять обработку без прерывания процесса распыления, например, с помощью автоматического регулирования количества распыляемого материала с учетом температуры откачиваемого воздуха и/или ядер.
Давление распыляемого материала может варьироваться в широких пределах и в целом удовлетворительные результаты получают при давлении распыляемого материала от приблизительно 1 до приблизительно 1,5 бар.
Композиции по изобретению пригодны в качестве иммунодепрессантов, что подтверждено в ходе проведения стандартных тестов.
Активность и характеристики композиций по изобретению могут быть определены стандартными методами, указанными ниже.
а) С помощью клинических испытаний, например путем наблюдения первых случаев острого отторжения или неудачного лечения через шесть месяцев после трансплантации почек или поддержания состояния с отсутствием отторжения в течение 6 месяцев после начала лечения в соответствии с изобретением. Композиции по изобретению вводят в дозе от 0,5 до 2,0 г/день, например приблизительно 1,5 г/день, и они уменьшают степень острого отторжения при введении в течение определенного периода времени после операции по трансплантации и поддерживают состояние с отсутствием отторжения у пациентов через 3 месяца или более после трансплантации. Так, композиции по изобретению могут вводиться в течение первых 72 ч после трансплантации в дозе приблизительно 0,5 г, вводимой дважды в день в комбинации с обычным стероидом и циклоспорином, например, в виде NEORAL, в котором доза циклоспорина представляет собой общепринятую дозу, например, приблизительно 8±3 мг/кг в случае трансплантации почки. Доза стероида, которую требуется вводить, в случае применения преднизона составляет приблизительно 2,5 мг/кг в течение 4 дней после трансплантации, затем 1 мг/кг в течение 1 недели, затем 0,6 мг/кг в течение 2 недель, затем 0,3 мг/кг в течение 1 месяца.
б) С помощью опытов на животных, например, путем наблюдения реакции на аллотрансплантат почки у крысы. В этом опыте одну почку самки крысы линии Fisher 344 трансплантируют в почечный сосуд крысы-реципиента линии WF с одной удаленной (с левой стороны) почкой, используя анастомоз "конец в конец". Анастомоз мочеточников также осуществляют по типу "конец в конец". Лечение начинают в день трансплантации и продолжают в течение 14 дней. Удаление почки с противоположной стороны осуществляют через семь дней после трансплантации, после чего жизнь реципиента зависит только от работоспособности почки донора. Выживание реципиента с трансплантатом принимают в качестве параметра функционирования трансплантата. Обычные дозы композиций по изобретению составляют приблизительно от 1 до 30 мг/кг перорально.
Композиции по изобретению наиболее пригодны в следующих случаях:
а) Для лечения и предупреждения отторжения трансплантата, представляющего собой аллотрансплантат или ксенотрансплантат нативного или трансгенного органа, ткани или клеток, например, для лечения реципиентов, например, с трансплантатом сердца, легкого, комбинации сердце-легкое, печени, почки, панкреатической железы, кожи, островковой клетки панкреатической железы, нервной клетки или роговицы; в том числе для лечения и предупреждения острого отторжения; лечения и предупреждения сверхострого отторжения; например, связанного с отторжением ксенотрансплантата; и для лечения и предупреждения хронического отторжения, например, связанного с заболеванием, обусловленным трансплантацией сосудов. Композиции по изобретению также пригодны для лечения и предупреждения болезни "трансплантат против хозяина", такой как болезнь, возникающая после трансплантации костного мозга.
б) Для лечения и предупреждения аутоиммунных заболеваний, например заболеваний, опосредованных иммунной системой, и воспалительных состояний, в частности воспалительных состояний, этиология которых включает иммунологический компонент, таких как артрит (например, ревматоидный артрит, прогрессирующий хронический артрит и деформирующий артрит) и ревматические заболевания. Конкретные болезни, опосредованные иммунной системой, для которых могут применяться композиции по изобретению, включают аутоиммунные гематологические заболевания (в том числе гемолитическую анемию, гипопластическую анемию, анемию эритроцитов и идиопатическую тромбоцитопению, но не ограничены ими), системную красную волчанку, полихондрит, склеродому, гранулематоз Вегенера, дерматомиозит, полимиозит, хронический активный гепатит, первичный биллиарный цирроз печени, тяжелую псевдопаралитическую миастению, псориаз, синдром Стивенса-Джонса, пузырьчатку, идиопатическую спру, воспалительные заболевания кишечника (включая, например, неспецифический язвенный колит и болезнь Крона), эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, рассеянный склероз, юношеский диабет (сахарный диабет типа I), неинфекционный увеит (передний и задний), сухой кератоконъюнктивит и вернальный конъюнктивит, интерстициальный фиброз легкого, псориатический артрит, васкулит, гломерулонефрит (с нефропатическим синдромом и без него, например, включая идиопатический нефротический синдром или минимальное изменение нефропатии) и юношеский дерматоз.
Очевидно, что соответствующие дозы композиций по изобретению должны варьироваться, например, в зависимости от состояния, подлежащего лечению (например, от типа болезни или от причины, обуславливающей устойчивость), используемой соли МФК, желаемого результата и способа введения.
В целом, однако, удовлетворительные результаты получают при введении, например, орально доз, составляющих от приблизительно 1 до приблизительно 30 мг соли на 1 кг веса тела животного в день при применении в виде однократной дозы или в виде разделенных доз до 4 раз в день. Таким образом, пригодные дозы для пациента составляют приблизительно от 200 мг до 3 г вводимой перорально соли, например, содержащей приблизительно от 50 до 100% мофетила микофенолята. При использовании предпочтительной однонатриевой соли доза соли составляет приблизительно две трети от дозы мофетила микофенолята.
Репрезентативные стандартные дозируемые формы содержат от приблизительно 50 мг, например 100 мг, до приблизительно 1,5 г фармацевтически приемлемой соли микофеноловой кислоты.
Характеристики биологической доступности композиций по изобретению могут быть определены общепринятым методом, например путем орального введения, гончим собакам. Дозы обычно составляют приблизительно 50 мг соли на животное, например приблизительно 3-5 мг соли/кг веса животного. В качестве подопытных животных используют голодных взрослых собак (весом приблизительно 10 кг, например 6-14 кг). Через три часа после введения композиции вводят приблизительно 200 г пищи. Образцы крови отбирают из латеральной подкожной вены лапы перед введением и через 10, 30 и 45 мин, 1, 1,5, 2, 3, 4, 6, 8, 12 и 24 ч после введения. Уровни свободной МФК в плазме определяют с помощью ЖХВД-анализа (с использованием ультрафиолетовых лучей).
В опыте по исследованию биологической доступности самцам гончих собак вводили на 1 кг веса животного перорально по 3,8 мг соли композиции, описанной ниже в примере 1, и препаративной формы МФК или МФМ, соответствующей примеру 1, но содержащей такое же количество МФК или поступающего в продажу МФМ.
Были получены следующие результаты (см. таблицу).
INCLUDEPICTURE "http://www.fips.ru/Archive/PAT/2003/DOC/DOCURUC2/DOC022V1/D02203D2/02203659/00000001-m.gif" \* MERGEFORMATINET 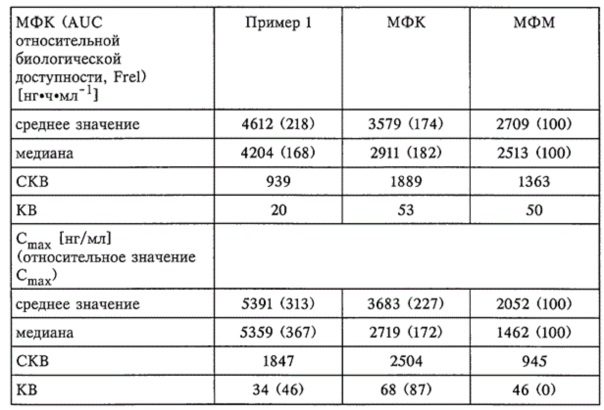
Коэффициенты вариации (KB) для AUC (20%) и Сmax (34%) для композиции из примера 1 существенно меньше, чем соответствующие величины для сравнительных композиций, что свидетельствует о меньшей вариабельности композиции из примера 1 между особями и для каждой особи.
Площадь под кривой (AUC) и Сmax композиции из примера 1 больше, чем соответствующие величины для сравнительных композиций.
Очевидно, что преимущества биологической доступности композиций по настоящему изобретению могут быть оценены с помощью стандартных клинических опытов по изучению биологической доступности. Например, дозы от 200 мг до 1,5 г композиций из примера 1 и МФК и МФМ могут быть введены 12 здоровым добровольцам в виде однократных доз в опытах с "перевернутым" планом эксперимента. Для композиций из примера 1 можно наблюдать увеличенные значения AUC и Сmax.
Неожиданно было установлено, что композиции по настоящему изобретению переносятся лучше, чем МФМ, вызывая менее выраженные побочные действия в отношении желудочно-кишечного тракта, такие как диарея и изжога. Они характеризуются менее продолжительными побочными действиями, например, в толстой кишке.
Композиции по изобретению могут вводиться в качестве единственного действующего вещества или вместе с другим иммунодепрессантом, например, наряду с одновременным или раздельным введением других иммунодепрессантов, например, для таких случаев применения иммунодепрессантов, как предупреждение и лечение болезни "трансплантат против хозяина", отторжение трансплантата или опосредованное иммунной системой заболевание, композиции по изобретению могут быть использованы в комбинации с циклоспоринами или аскомицинами либо их иммунносупрессантными аналогами, например, циклоспорином A, FK-506 (такролимус) и т.д., рапамицином; кортикостероидами; циклофосфамидом; азатиоприном; метотрексатом; бреквинаром; лефлуномидом; мизорибином; дезоксиспергуалином; их аналогами и моноклональными антителами, обладающими иммунодепрессантной активностью, например моноклональными антителами к рецепторам лейкоцитов, например МНС, CD2, CD3, CD4, CD7, CD25, CD28, CTLA4, В7, CD45 или CS58 либо их лигандами; или другими соединениями, обладающими иммуномодулирующей активностью.
Если соединения по изобретению вводятся совместно с другими иммунодепрессантами, то дозы других иммунодепрессантов могут быть уменьшены, например, до половины или одной трети их доз, когда они используются по отдельности.
Характерные дозы циклоспорина, предназначенные для применения, составляют, например, от 1 до 10, например, от 1 до 2 мг/кг/день.
Другими объектами настоящего изобретения являются применение, способ и композиции, как они описаны ниже в формуле изобретения.
Хотя эксципиенты не были подробно описаны в настоящем описании, они являются известными или описаны, например, в Handbook of Pharmaceutical Excipients, 2-е изд., под ред. Ainley Wade и Paul J. Weller, American Pharmaceutical Association, Вашингтон, США и Pharmaceutical Press, Лондон, в Lexicon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete, под ред. Н. Р. Fiedler, 4-е изд., Edito Cantor, Аулендорф и в более ранних изданиях.
Ниже приведено описание композиций по изобретению, которое дается только с целью иллюстрации.
Пример 1
Композиция
Состав капсул
мононатриевая соль МФК - 53,43 мг (=50 мг МФК)
лактоза (смесь 1:1 100/200 меш) - 256,57 мг
двуокись кремния (аэросил) - 3,1 мг
стеарат магния - 1,55 мг
всего - 314,65 мг
Капсула размера 1
Энтеросолюбильное покрытие (приблизительно 17 мг)
гидроксипропилфталат метилцеллюлозы (НР50) - 9 частей
триацетин - 1 часть
Способ приготовления
Ингредиенты смешивают и наполняют ими капсулы размера 1. Капсулы покрывают в машине для нанесения покрытий с псевдоожиженным слоем раствором ингредиентов энтеросолюбильного покрытия в этаноле (содержащем 10% ацетона). Масса покрытия каждой капсулы составляет приблизительно 17 мг. Капсулы выдерживают описанный ранее тест в отношении энтеросолюбильного покрытия и не разлагаются в течение 2 ч в искусственных желудочных соках (рН 1, HCl). Композиции сохраняют стабильность, например, в течение 2 лет при комнатной температуре.
При необходимости аналогичным способом могут быть изготовлены капсулы большего размера, содержащие 534,3 мг мононатриевой соли МФК, при уменьшенном количестве лактозы. Они обладают хорошей переносимостью в клинических испытаниях.
Пример 2
Капсулы размера 1 изготавливают аналогично примеру 1. Раствор для энтеросолюбильного покрытия готовят следующим образом:
гидроксипропилфталат метилцеллюлозы (НР50) - 270 г
триацетин - 30 г
ацетон - 900 г
этанол - 1800 г
На 1 кг капсул (приблизительно 2400 штук) используют 600 г этого раствора энтеросолюбильного покрытия. Масса покрытия, нанесенного на каждую капсулу, составляет приблизительно 25 мг, что дает пленку толщиной 5-6 мг/см2.

