Результат интеллектуальной деятельности: ПРЕПАРАТИВНАЯ ФОРМА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩАЯ ОКТРЕОТИД И ТРИ ЛИНЕЙНЫХ ПОЛИМЕРА ПОЛИ(ЛАКТИД-СО-ГЛИКОЛИДА)
Вид РИД
Изобретение
Настоящее изобретение относится к препаративным формам с замедленным высвобождением, содержащим в качестве действующего вещества октреотид или его фармацевтически приемлемую соль и три различных линейных сополимера лактида и гликолида (поли(лактид-со-гликолид)) (PLGA).
Эти фармацевтические композиции, предлагаемые в настоящем изобретении, предназначены, в том числе для пролонгированной поддерживающей терапии страдающих акромегалией пациентов и для лечения серьезной диареи и приливов крови, ассоциированных со злокачественными карциноидными опухолями и опухолями, продуцирующими вазоактивные кишечные пептиды (опухоли типа випом).
Пептидные лекарственные средства, как правило, вводят системно, например, парентерально. Однако парентеральное введение может быть болезненным и вызывать дискомфорт, прежде всего при повторных ежедневных введениях. Для минимизации количества инъекций, вводимых пациенту, лекарственную субстанцию можно вводить с помощью препаративной формы типа депо. Общим недостаткам инъецируемых препаративных форм типа депо является колебание уровней в плазме, что приводит к тому, что в течение полного периода высвобождения уровни в плазме колеблются от высоких пиковых уровней до уровней, близких к нулю.
Препаративные формы с замедленным высвобождением, которые содержат в качестве действующего вещества октреотид или его фармацевтически приемлемую соль и два или более различных полимеров полилактид-ко-гликолида (PLGA), описаны, например, в WO 2007/071395.
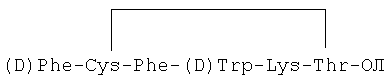
В настоящем изобретении описана препаративная форма с замедленным высвобождением, которая содержит в качестве действующего вещества (лекарственная субстанция) октреотид или его фармацевтически приемлемую соль. Октреотид представляет собой аналог соматостатина, который имеет следующую формулу:
Действующее вещество может находиться в форме фармацевтически приемлемой соли октреотида, такой как кислотно-аддитивная соль, например, неорганической кислоты, полимерной кислоты или органической кислоты, например, соляной кислоты, уксусной кислоты, молочной кислоты, лимонной кислоты, фумаровой кислоты, малоновой кислоты, малеиновой кислоты, винной кислоты, аспарагиновой кислоты, бензойной кислоты, янтарной кислоты или памовой (эмбоновой) кислоты. Кислотно-аддитивные соли могут представлять собой одно- или двухвалентные соли, например, в зависимости от того, добавлены 1 или 2 кислотных эквивалента. Предпочтительной солью является октреотида монопамоат.
Распределение размеров частиц лекарственной субстанции влияет на профиль высвобождения лекарственного средства из депо-формы. Лекарственная субстанция, которую применяют для приготовления препаративной формы типа депо, является кристаллической или находится в виде аморфного порошка. Предпочтительным является аморфный порошок, который имеет размер частиц от примерно 0,1 до примерно 15 мкм (99%>0,1 мкм, 99%<15 мкм), предпочтительно от 1 до менее чем примерно 10 мкм (90%>1 мкм, 90%<10 мкм). Предпочтительно лекарственную субстанцию подвергают процессу микронизации для получения требуемого распределения размера частиц.
Настоящее изобретение относится также к фармацевтической композиции с замедленным высвобождением (депо), которая содержит в качестве действующего вещества октреотид или его фармацевтически приемлемую соль, включенный/включенную в многокомпонентные композиции или смеси полимеров поли(лактид-со-гликолида) (PLGA), например, в форме микрочастиц, имплантатов или полутвердых препаративых форм.
Другой объект настоящего изобретения относится к фармацевтической композиции, которая является альтернативой многокомпонентным композициям PLGA и содержит смесь PLGA-полимеров, включающую действующее вещество; т.е. действующее вещества может быть включено в один или несколько PLGA в форме микрочастиц, имплантатов или полутвердых препаративных форм, и затем смешано с другой препаративной формой в виде микрочастиц или имплантата или полутвердой препаративной формы, которая также содержит действующее вещество или один или несколько PLGA.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, обеспечивает замедленное высвобождение действующего вещества в течение периода времени, превышающего 3 месяца, предпочтительно периода времени, составляющего от 3 до 6 месяцев. В течение периода времени высвобождения действующего вещества уровни октреотида в плазме находятся в пределах терапевтического диапазона. Следует понимать, что точная доза октреотида должна зависеть от нескольких факторов, таких как состояние, подлежащее лечению, серьезность состояния, подлежащего лечению, вес индивидуума и продолжительность терапии.
При создании изобретения неожиданно было установлено, что колебания уровней в плазме можно существенно снижать путем применения приемлемой комбинации трех различных линейных PLGA в фармацевтической композиции, предлагаемой в настоящем изобретении.
Лекарственную субстанцию включают в биоразлагаемый полимерный матрикс, состоящий из трех различных линейных полимеров поли(лактид-со-гликолида) (PLGA). PLGA имеют соотношение мономеров лактида: гликолида от 100:0 до 40:60, предпочтительно от 90:10 до 40:60, более предпочтительно от 85:15 до 65:35.
PLGA, предлагаемые в настоящем изобретении, имеют молекулярную массу (Mw) от 1000 до 500000 Да, предпочтительно от 5000 до 100000 Да. Полимеры имеют линейную структуру.
Характеристическая вязкость (ХВ) PLGA, предлагаемых в настоящем изобретении, составляет менее 0,9 дл/г в СНСl3, предпочтительно менее 0,8 дл/г в СНСl3. Характеристическую вязкость можно измерять общепринятыми методами, описанными, например в «Pharmacopoee Ewopeenne», 1997, сс.17-18 (метод, основанный на применении капиллярных трубок). Если не указано иное, вязкость оценивали в хлороформе, имеющем концентрацию 0,5%, при 25°С или в гексаизофторпропаноле, имеющем концентрацию 0,5%, при 30°С.
Концевые группы PLGA, предлагаемых в настоящем изобретении, могут представлять собой (но, не ограничиваясь только ими) гидроксигруппу, карбоксигруппу, сложный эфир и т.п.
Содержание лекарственной субстанции в препаративной форме типа депо (загрузка) составляет от 1 до 30%, предпочтительно от 10 до 25%, более предпочтительно от 15 до 20%. Загрузку определяют как массовое соотношение лекарственной субстанции в виде свободного основания и общей массы композиции PLGA.
Приемлемыми полимерами являются хорошо известные полимеры, включая (но, не ограничиваясь только ими) имеющие на рынке полимеры, выпускаемые под товарным знаком RESOMER® фирмы Boehringer Ingelheim Pharma GmbH & Co. KG, Ингельхайм, Германия, LACTEL® фирмы Absorbable Polymers International (API), Пелхейм, шт.Алабама, США, MEDISORB® фирмы Alkermes, Inc., Кембридж, шт.Массачусетс, США, PURASORB® фирмы PURAC biochem BV, Горинхем, Нидерланды. Примеры приемлемых полимеров перечислены в таблице 1.
|
|
1) ХВ определяли в хлороформе, взятом в концентрации 0,1%, при 25°С
2) ХВ определяли в хлороформе, взятом в концентрации 0,5 г/дл, при 30°С
3) ХВ определяли в гексафторизопропаноле, взятом в концентрации 0,5 г/дл, при 30°С.
Характеризующиеся низкой вариабельностью уровни в плазме в течение периода времени, составляющего более 3 месяцев, предпочтительно от 3 до 6 месяцев, можно обеспечивать только с использованием фармацевтических композиций, предлагаемых в настоящем изобретении, но не препаративных форм, содержащих только один из представленных выше в таблице полимеров.
Кроме того, фармацевтическую композицию, предлагаемую в настоящем изобретении, можно изготавливать в асептических или неасептических условиях и стерилизовать окончательно с помощью гамма-излучения. Предпочтительной является окончательная стерилизация гамма-излучением, приводящая к получению продукта, который имеет максимально возможную гарантированную стерильность.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, может содержать также один или несколько фармацевтических эксципиентов, модифицирующих характеристики высвобождения, в количестве от 0,1 до 50%. Примерами таких агентов являются: поли(винилпирролидон), натриевая соль карбоксиметилцеллюлозы (КМЦ-Na), декстрин, поли(этиленгликоль), приемлемые поверхностно-активные вещества, такие как полоксамеры, известные также как блок-сополимеры полиоксиэтилена и полиоксипропилена, эфиры жирных кислот и поли(оксиэтилен)сорбитана, которые известны и поступают в продажу под товарным знаком TWEEN® (например, Твин 20, Твин 40, Твин 60, Твин 80, Твин 65, Твин 85, Твин 21, Твин 61, Твин 81), эфиры жирных кислот и сорбитана, например, типа тех, которые известны и поступают в продажу под товарным знаком SPAN, лецитины, неорганические соли, такие как карбонат цинка, гидроксид магния, карбонат магния, или протамин, например, человеческий протамин или протамин лосося, или природные или синтетические полимеры, несущие аминовые остатки, такие как полилизин.
Фармацевтическая композиция, предлагаемая в изобретении, может представлять собой с точки зрения составов, молекулярной массы и/или структуры полимеров смесь депо или многокомпонентную композицию различных полимеров. Понятие «многокомпонентная полимерная композиция» в контексте настоящего описания относится к твердому раствору или суспензии трех различных линейных полимеров в одном/одной имплантате или микрочастице. В противоположность этому понятие «смесь депо» в контексте настоящего описания означает смесь двух или большего количества депо типа имплантатов или микрочастиц или полутвердых препаративных форм различного состава с одним или несколькими PLGA в каждом депо. Предпочтительной является фармацевтическая композиция, в которой три PLGA присутствуют в виде многокомпонентной полимерной композиции.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, может иметь форму имплантатов, полутвердых форм (гелей), жидких растворов или суспензий, которые отверждаются in situ после инъекции, или микрочастиц. Предпочтительными являются микрочастицы. Препарат микрочастиц, содержащих октреотид или его фармацевтически приемлемую соль, является известным и описан, например, в US 5445832 или US 5538739.
Приведенный ниже раздел описания сфокусирован на полимерных микрочастицах, хотя описание применимо также к имплантатам, полутвердым формам и жидкостям.
Микрочастицы, предлагаемые в настоящем изобретении, имеют диаметр от нескольких долей микрона до нескольких миллиметров, например, от примерно 0,01 мкм до примерно 2 мм, например, от примерно 0,1 мкм до примерно 500 мкм. Диаметры фармацевтических микрочастиц составляют, как правило, примерно 250 мкм, например, от 10 до 200 мкм, предпочтительно от 10 до 130 мкм, наиболее предпочтительно от 10 до 90 мкм.
Микрочастицы, предлагаемые в настоящем изобретении, можно смешивать с препятствующим агломерации агентом (антиагломерирующим агентом) или наносить на них покрытие с помощью указанного агента, или наносить слой покрытия из антиагломерирующего агента, например, с использованием предварительно заполненного шприца или флакона. Приемлемыми антиагломерирующими агентами являются, например, маннит, глюкоза, декстроза, сахароза, хлорид натрия или водорастворимые полимеры, такие как поливинилпирролидон или полиэтиленгликоль, например, имеющие описанные выше свойства.
В микрочастицах, предлагаемых в настоящем изобретении, в сухом состоянии предпочтительно антиагломерирующий агент присутствует в количестве от примерно 0,1 до примерно 10%, предпочтительно примерно от 3 до 5%, например, примерно 4% в пересчете на массу микрочастиц. В этом плане предпочтительным антиагломерирующим агентом является маннит.
В альтернативном варианте антиагломерирующий агент можно вносить в микрочастицы во время процесса приготовления. Например, на стадии фильтрации/промывки микрочастиц их можно дополнительно промывать водным раствором антиагломерирующего агента. В результате на поверхности микрочастиц образуется слой антиагломерирующего агента. Предпочтительно антиагломерирующий агент присутствует в микрочастицах в количестве менее 10%, более предпочтительно менее 2%, наиболее предпочтительно менее 0,5% в пересчете на массу микрочастиц. В этом плане предпочтительным антиагломерирующим агентом является маннит.
Процесс приготовления препаративной формы типа депо, предлагаемой в настоящем изобретении, подробно описан применительно к микрочастицам:
Микрочастицы можно приготавливать несколькими методами, известными в данной области, например, путем коацервации или разделения фаз, сушки распылением, методами на основе эмульсий/суспензий типа вода-в-масле (W/O) или вода-в-масле-в воде (W/O/W) или твердые вещества-в-масле-в-воде (S/O/W) с последующей экстракцией растворителя или выпаривания растворителя. Метод на основе эмульсии/суспензии является предпочтительным, и он включает следующие стадии, на которых:
(I) приготавливают внутреннюю органическую фазу, для чего
(Iа) растворяют полимер или полимеры в приемлемом органическом растворителе или смеси растворителей;
необязательно растворяют/диспергируют приемлемые добавки;
(Iб) растворяют/суспендируют/эмульгируют лекарственную субстанцию в полимерном растворе, полученном на стадии (Iа);
(II) приготавливают внешнюю водную фазу, содержащую стабилизаторы и необязательно, но предпочтительно, применяемые в качестве буфера соли;
(III) смешивают внутреннюю органическую фазу и внешнюю водную фазу, например, с помощью устройства, создающего высокие сдвиговые усилия, например, с помощью турбинной или статической мешалки, с получением эмульсии; и
(IV) отверждают микрочастицы путем выпаривания растворителя или экстракции растворителя, промывают микрочастицы, например, водой, собирают и сушат микрочастицы, например, сушкой вымораживанием или сушкой под вакуумом, и просеивают микрочастицы через сито с размером отверстий 140 мкм.
Приемлемыми органическими растворителями для полимеров являются, например, этилацетат, ацетон, ТГФ, ацетонитрил или галогенированные углеводороды, например, метиленхлорид, хлороформ или гексафторизопропанол.
Примерами пригодных стабилизаторов, которые применяют на стадии (116), являются поли(виниловый спирт) (ПВС), используемый в количестве 0,1-5%, гидроксиэтилцеллюлоза (ГЭЦ) и/или гидроксипропилцеллюлоза (ГПЦ), используемая в общем количестве 0,01-5%, поли(винилпирролидон), желатин, предпочтительно свиной или рыбий желатин.
Композицию сухих частиц можно окончательно стерилизовать с помощью гамма-излучения (убивающая все микроорганизмы стерилизация) необязательно в виде нерасфасованного продукта или после заполнения им конечного контейнера, что приводит к достижению максимально возможной гарантированной стерильности. В альтернативном варианте нерасфасованные стерилизованные микрочастицы можно ресуспендировать в приемлемом наполнителе и заполнять ими в виде суспензии приемлемое устройство, такое как шприц с двумя камерами, с последующей сушкой вымораживанием.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, содержащая микрочастицы, может включать также наполнитель, облегчающий восстановление.
Перед применением микрочастицы суспендируют в приемлемом наполнителе для инъекции. Предпочтительно указанный наполнитель представляет собой имеющие водную основу фармацевтические эксципиенты, такие как маннит, хлорид натрия, глюкоза, декстроза, сахароза или глицерины, неионные поверхностно-активные вещества (например, полоксамеры, эфиры поли(оксиэтилен)сорбитана и жирных кислот), натриевая соль карбоксиметилцеллюлозы (КМЦ-Na), сорбит, поли(винилпирролидон) или моностеарат алюминия, предназначенные для гарантии изотоничности и для улучшения смачивающих свойств и седиментации микрочастиц. Смачивающие и повышающие вязкость агенты могут присутствовать в количестве от 0,01 до 1%; придающие изотоничность агенты добавляют в соответствующем количестве для гарантии изотоничности инъецируемой суспензии.
Изобретение относится также к применению фармацевтической композиции, предлагаемой в настоящем изобретении, среди прочего для пролонгированной поддерживающей терапии страдающих акромегалией пациентов и для лечения серьезной диареи и приливов крови, ассоциированных со злокачественными карциноидными опухолями и опухолями, продуцирующими вазоактивные кишечные пептиды (опухоли типа випом).
Применимость фармацевтических композиций, предлагаемых в настоящем изобретении, можно продемонстрировать с помощью стандартных клинических испытаний или опытов на животных.
Изобретение относится также к набору, включающему препаративную форму типа депо в пузырьке, необязательно снабженном устройством для введения, в сочетании с имеющим водную основу наполнителем в ампуле, флаконе или предварительно заполненном шприце, или в виде микрочастиц и наполнителя, находящихся раздельно в шприце с двумя камерами.
Экспериментальный раздел
Приведенные ниже примеры даны с целью иллюстрации и не предназначены для ограничения объема изобретения, представленного в настоящем описании. В примерах описан только один из возможных вариантов воплощения на практике настоящего изобретения.
Пример 1: Получение микрочастиц
Соответствующее количество PLGA-полимеров растворяют в соответствующем количестве дихлорметана с получением соответствующей концентрации полимера, которая указана в колонке, обозначенной как «конц. PLGA» в таблице 2. Соответствующее количество лекарственной субстанции взвешивают в стеклянном стакане и раствор полимеров сливают на лекарственную субстанцию так, чтобы образовавшиеся микрочастицы имели лекарственную нагрузку, указанную в колонке «лекарственная нагрузка».
Например, в случае микрочастиц с лекарственной нагрузкой 20% и концентрацией полимеров 20% используют следующие количества: 3,547 г PLGA-полимеров растворяют в 17,7 мл дихлорметана, получая раствор полимеров с концентрацией 20% (мас./об.). 1,453 г октреотида памоата (следует понимать, что 1,00 г=20% октреотида в виде свободного основания) взвешивают в стеклянном стакане и раствор полимеров сливают на лекарственную субстанцию.
Суспензию гомогенизируют с помощью роторно-статорной мешалки типа Ultra-Turrax с 20000 об/мин в течение 1 мин при охлаждении с помощью смеси лед/вода. Это суспензию обозначают как S/O-суспензия.
1000 г поливинилового спирта (ПВС) 18-88, 3,62 г KH2PO4 и 15,14 г Na2HPO4 растворяют в 2,00 л деионизированной воды, получая 0,5%-ный раствор ПВС 18-88, забуференный до рН 7,4.
S/O-суспензию смешивают с 0,5%-ным раствором ПВС 18-88 путем накачки S/O-суспензии с помощью гибкого трубного насоса (фирма Регрех, тип трубы Viton) со скоростью 10 мл/мин в турбинный смеситель и путем накачки водного раствора с помощью шестеренчатого насоса (типа Ismatec MV-Z/B с накачивающей головкой Р140) со скоростью 200 мл/мин в этот же турбинный смеситель. Два раствора смешивают в турбинном смесителе со скоростью 4500 об/мин. Гомогенизированную эмульсию типа S/O/W собирают в 2-литровый стеклянный стакан, предварительно заполненный 200 мл забуференного раствора ПВС.
Затем S/O/W-эмульсию нагревают до 52°С в течение 5 ч. Поддерживают температуру 52°С в течение еще 30 мин, затем партию вновь охлаждают до комнатной температуры. Во время этого процесса выделяющийся дихлорметан удаляют под вакуумом и партию перемешивают с помощью 4-лопастной пропеллерной мешалки при 250 об/мин.
В результате из S/O/W-эмульсии образуются микрочастицы. Микрочастицы собирают фильтрацией (5 мкм). Их промывают 5 раз 200 мл воды и сушат в течение 36 ч при 20°С и давлении 0,030 мбар. Высушенные микрочастицы просеивают через сито с размером отверстий 140 мкм и заполняют ими в атмосфере азота стеклянные пузырьки. Полученные таким образом микрочастицы стерилизуют гамма-излучением, используя дозу 30 кГр.
Размер микрочастиц определяют на основе дифракции лазерного луча. Микрочастицы ресуспендируют в уайт-спирите с помощью ультразвука. В таблице 2 представлены данные о Х90-диаметре микрочастиц (90% всех частиц имеют диаметр, более низкий, чем указанная величина) после обработки в течение 120 с ультразвуком.
Анализ микрочастиц проводили с помощью ЖХВР после растворения микрочастиц при облучении ультразвуком в смеси 3:2 ацетонитрила и метанола и дополнительного разведения в соотношении 1:1 с помощью натрий-ацетатного буфера (рН 4). Раствор очищали от оставшегося вещества, имеющего размер, характерный для макрочастиц, путем центрифугирования.
|
А: PLGA 65:35, эфир, 0,6 дл/г (%)
Б: PLGA 75:25, эфир, 0,4 дл/г (%)
В: PLGA 85:15, эфир, 0,б дл/г (%)
Информация о процессе обозначает дополнительную информацию о процессе:
7: 66 мМ ЗФР, рН 7,4
38: Скорость турбины 3800 об/мин вместо 4500 об/мин
Пример 2: Состав наполнителя А-Ж
Растворяют КМЦ-Na, маннит и Pluronic F68 в количествах, указанных в таблице 3, примерно в 15 мл горячей деионизированной воды при температуре примерно 90°С при интенсивном перемешивании с помощью магнитной мешалки. Образовавшийся прозрачный раствор охлаждают до 20°С и добавляют к нему деионизированную воду до 20,0 мл.
|
Пример 3: Суспензия микрочастиц
180 мг микрочастиц, полученных согласно методу, описанному в примере 1-1, суспендируют в 1,0 мл наполнителя, имеющего состав, представленный в Г (таблица 3), в пузырьки типа 6 R. Суспензии гомогенизируют путем встряхивания вручную в течение примерно 30 с. Восстановленную суспензию можно инъецировать без каких-либо потерь с помощью иглы, имеющей размер 20.
Пример 4: Лиофилизация микрочастиц
180 мг микрочастиц, полученных согласно методу, описанному в примере 1-1, восстанавливают в 1 мл наполнителя, имеющего состав, представленный в Е (таблица 3), гомогенизируют перемешиванием в течение 1-12 ч и затем сушат вымораживанием в лиофилизаторе. Восстановление лиофилизированных микрочастиц с помощью 1 мл чистой воды (вода для инъекций, aqua ad injectabilia) приводит к быстрому и хорошему смачиванию микрочастиц, которые можно инъецировать без каких-либо потерь с помощью иглы, имеющей воды 20.
Пример 5: Профиль высвобождения in vivo (кролики)
Микрочастицы, содержащие октреотид, суспендируют в 1 мл приемлемого водного наполнителя и образовавшуюся суспензию инъецируют внутримышечно (i.m.) самцам кроликов-гибридов породы новозеландский белый в дозе 12 мг/кг. Для каждой лекарственной формы (тест-группа) используют по 4 животных. Через определенные периоды времени (указанные в таблице 4) отбирают образцы плазмы и определяют концентрацию октреотида.
|

